Производные ациклических нуклеозидов.
Номер патента: 1404
Опубликовано: 26.02.2001
Авторы: Энгельхардт Пер, Хегберг Марита, Жоу Ксиао-Ксионг, Йоханссон Нильс Гуннар, Линдборг Бьерн
Формула / Реферат
1. Соединение формулы I
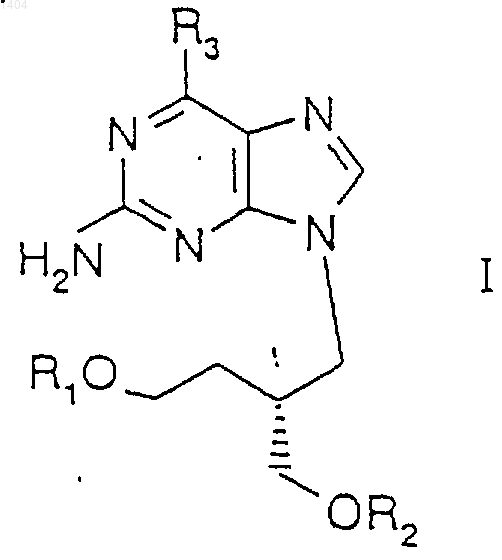
в которой
a) R1 представляет собой -С(О)СН(СН(СН3)2NH2 или -С(O)СН(СН(СН3)СH2СН3)NН2, a R2 представляет собой -С(O)С3-С21 насыщенный или мононенасыщенный, необязательно замещенный гидроксигруппой, С1-6алкилом, С1-6алкокси-, С1-6алкоксиС1-6алкилом, С1-6алканоилом, амино-, галоид-, циано-, азидо-, меркапто- и нитрогруппой алкил;
b) R1 представляет собой -С(O)С3-С21 насыщенный или мононенасыщенный, необязательно замещенный гидроксигруппой, С1-6алкилом, С1-6алкокси-, С1-6алкоксиС1-6алкилом.С1-6алканоилом, амино-, галоид-, циано-,азидо-, меркапто- и нитро группой алкил; a R2 представляет собой
-С(O)СН(СН(СН3)2)NН2 или
-С(O)СН(СН(СН3)СН2СН3)NН2; и
R3 представляет собой ОН или Н;
а также его фармацевтически приемлемые соли.
2. Соединение по п.1, в котором R1 представляет собой -С(O)СН(СН(СН3)2)NН2 или -С(О)СН(СН(СН3)СН2СН3)NН2, а R2 представляет собой -С(О)С3-С21 насыщенный или мононенасыщенный, необязательно замещенный гидроксигруппой, С1-6алкилом, С1-6алкокси-, С1-6алкоксиС1-6алкилом, С1-6алканоилом, амино-, галоид-, циано-, азидо-, меркапто- и нитрогруппой алкил;
3. Соединение по п.1, в котором -С(=O)алкил включает С9-С17 насыщенный или n:9 мононенасыщенный алкил.
4. Соединение по п.1, в котором R3 представляет собой гидрокси.
5. Соединение по п.1, выбранное из группы, состоящей из
(R)-9-[2-(стеароилоксиметил)-4-(L-валилокси)бутил]гуанина,
(R)-9-[2-(миристоилоксиметил)-4-(L-валилокси)бутил]гуанина,
(R)-9-[2-(олеоилоксиметил)-4-(L-валилокси)бутил]гуанина,
(R)-9-[2-(бутирилоксиметил)-4-(L-валилокси)бутил]гуанина,
(R)-9-[2-(деканоилоксиметил)-4-(L-валилокси)бутил]гуанина,
(R)-9-[2-(докозаноилоксиметил)-4-(L-валилокси)бутил]гуанина,
(R)-9-[4-(L-изолейцилокси)-2-(стеароилоксиметил)бутил]гуанина,
(R)-9-[2-(деканоилоксиметил)-4-(L-изолейцилокси)бутил]гуанина,
(R)-9-[4-(L-изолейцилокси)-2-(миристоилоксиметил)бутил]гуанина,
(R)-9-[2-(4-ацетилбутирилоксиметил-4-(L-валилокси)бутила,
(R)-9-[2-додеканоилоксиметил-4-(L-валилокси)бутил]гуанина,
(R)-9-[2-пальмитоилоксиметил-4-(L-валилокси)бутил]гуанина,
(R)-2-амино-9-(2-стеароилоксиметил-4-(L-залилокси)бутил]пурина,
(R)-9-[2-(L-валилоксиметил)-4-(стеароилокси)бутил]гуанина
или фармацевтически приемлемой соли.
6. (R)-9-[2-(Стеароилоксиметил)-4-(L-валилокси)бутил]гуанин.
7. (R)-9-[2-(Стеароилоксиметил)-4-(L-валилокси)бутил]гуанин или его фармацевтически приемлемая соль.
8. Фармацевтическая композиция, содержащая соединение по п.1 совместно с фармацевтически приемлемым носителем или разбавителем.
9. Фармацевтическая композиция, содержащая соединение по п.5, совместно с фармацевтически приемлемым носителем или разбавителем.
10. Фармацевтическая композиция, содержащая соединение по п.6, совместно с фармацевтически приемлемым носителем или разбавителем.
11. Способ лечения или профилактики вирусных инфекции, отличающийся тем, что он включает введение человеку или животному эффективного количества соединения по п.1.
12. Способ по п.11 для лечения или профилактики герпесных инфекций, включающих вирус Varicella zoster, вирус герпеса обыкновеного типа 1 и 2, вирус Epstein-Barr или герпес типа 6 (HHV-6) и типа 8 (HHV-8).
13. Способ по п.11 для лечения или профилактики ретровирусных инфекций, включающих SIV, HIV-1 и HIV-2.
14. Способ получения соединения по п.1, включающий
a) необязательную N-защиту 2 и/или 6 положений пурина в соединении формулы I, в которой каждый из R1 и R2 представляет собой водород;
b) региоселективное ацилирование соединения формулы I по 4-гидроксигруппе боковой цепи, с помощью
i) необязательно N-защищенной валиновой или изолейциновой группы,
ii) необязательно замещенного, насыщенного или мононенасыщенного С3-C21COOH производного, или
iii) региоселективной защитной группы;
c) ацилирование по 2-гидроксиметильной группе боковой цепи с помощью
i) необязательно N-защищенной валиновой или изолейциновой группы, или
ii) необязательно замещенного, насыщенного или мононенасыщенного С3-С21СООН производного;
d) замещение региоселективной защитной группы в R1, в случае ее присутствия, с помощью
i) необязательно N-защищенной валиновой или изолейциновой группы; или
ii) необязательно замещенного, насыщенного или мононенасыщенного C3-C21COOH производного; и
е) если это необходимо, снятие защитной группы с полученного соединения.
Текст
1 Настоящее изобретение относится к антивирусным препаратам и, главным образом, к производным ациклических нуклеозидов, находящим применение в борьбе с герпесом и ретровирусными инфекциями. Настоящее изобретение предусматривает новые соединения, фармацевтические композиции, содержащие такие соединения, способы лечения или профилактики вирусных инфекций с их использованием,способы их получения, а также способы получения новых промежуточных соединений. Практическое использование ациклических нуклеозидов ограничено их относительно умеренным фармакокинетическими свойствами. В общем плане, для решения такой проблемы был применен ряд подходов с использованием пролекарств, целью которых являлось улучшение биоприменимости ациклических нуклеозидов. Один из таких подходов заключается в получении сложноэфирных производных, особенно алифатических сложных эфиров, одной или более гидроксигрупп ациклической боковой цепи. В Европейском патенте ЕР 165 289 описывается перспективный антигерпесный агент 9[4-гидрокси-(2-гидроксиметил)бутил]гуанин,известный под названием H2G. В Европейском патенте ЕР 186 640 описывается 6-деокси H2G. В Европейском патенте ЕР 343 133 указывается,что такие соединения, особенно R-(-)энантиомер, также обладают активностью против таких ретровирусных инфекций, как HIV. Различные производные H2G, такие как фосфонаты, алифатические сложные эфиры (например, диацетат и дипропионат), а также простые эфиры по гидрокси группам ациклической боковой цепи раскрыты в ЕР 343 133. В указанном патенте также описываются способы получения таких производных, заключающиеся в конденсации ациклической боковой цепи по N-9 положению типичного 6-галогенированного пуринового фрагмента, или, в альтернативном случае, в замыкании имидазольного цикла пиримидина или фуразано-[3,4-d]-приримидинового фрагмента, или замыкании пиримидинового кольца имидазольного фрагмента, в том случае, когда ациклическая боковая цепь уже присутствует в предшествующем пиримидиновом или имидазольном фрагментах, соответственно. В соответствии с наиболее широкими аспектами каждого из таких способов, ациклическая боковая цепь является предварительно замещенной, однако, в специальных примерах показано одностадийное диацилирование H2G с помощью уксусного или пропионового ангидрида и ДМФ.(1989) сообщают об исследовании ряда низших алифатических сложных эфиров ациклического нуклеозида,9-[4-гидрокси-(3-гидроксиметил) бутил]гуанина, известного также под названием пенцикловир, и его 6-деокси аналога. Фамцик 001404 2 ловир, торговый антивирусный агент, представляет собой диацетильное производное 6-деокси пенцикловира.(1987) описывает низшие алифатические сложные эфиры 9-[(1,3-дигидрокси-2-пропокси)метил]гуанина, известного также под названием ганцикловир. Отмечается, что предпочтительным сложным эфиром является дипропионат.H2G обеспечивают лишь незначительное улучшение биоприменимости по сравнению с H2G. В международной патентной заявке WO 94/24134, опубликованной 27 октября 1994 г.,раскрываются алифатические сложноэфирные пролекарства 6-деокси-N-7 аналога ганцикловира, включающие ди-пивалоил, ди-валероил, моновалероил, моноолеоил и моностеароильные сложные эфиры. В обеих международных заявках на патенты WO 93/07163, опубликованной 15 апреля 1993 г., и WO 94/22887, опубликованной 13 октября 1994 г., описываются моносложноэфирные производные нуклеозидных аналогов - производных мононенасыщенных С 18 или С 20 жирных кислот. В патенте США 5,216,142, от 1 июня 1993 г. также описываются моносложноэфирные производные жирных кислот нуклеозидных аналогов. Второй подход, используемый для получения пролекарств ациклических нуклеозидов,включает получение аминокислотных сложных эфиров по одной или более гидроксигруппам ациклической боковой цепи. В Европейском патенте ЕР 99 493 описываются аминокислотные сложные эфиры ацикловира, а в заявке на Европейский патент ЕР 308 065, опубликованной 22 марта 1989 г., раскрываются валиновый и изолейциновый эфиры ацикловира. В заявке на Европейский патент ЕР 375 329, опубликованной 27 июня 1990 г., раскрываются аминокислотные сложноэфирные производные ганцикловира, включающие ди-валин,ди-изолейцин, ди-глицин и ди-аланин сложноэфирные производные. В международной заявке на патент WO 95/09855, опубликованной 13 апреля 1995 г., описываются сложноэфирные производные пенцикловира, включающие моновалин и ди-валин сложноэфирные производные. В ДЕ 19526163 , опубликованной 1 февраля 1996 г., а также в патенте США 5,543,414 от 6 августа 1996 г., описываются ахиральные аминокислотные сложные эфиры ганцикловира. В заявке на Европейский патент ЕР 694 547, опубликованной 31 января 1996 г., раскрывается моно-L-валиновый сложный эфир ган 3 цикловира и его получение из ди-валилганцикловира. В заявке на Европейский патент ЕР 654 473, опубликованной 24 мая 1995 г., описываются различные бис аминокислотные сложноэфирные производные 9-[1',2'-бисгидроксиметил)циклопропан-1'-ил]метилгуанина. В международной патентной заявке WO 95/22330, опубликованной 24 августа 1995 г.,описываются алифатические сложные эфиры,аминокислотные сложные эфиры, а также сложные ацетат/валинатные сложные эфиры ациклического нуклеозида, 9-[3,3-дигидроксиметил-4 гидроксибут-1-ил]гуанина. В этой работе указывается, что биоприменимость понижается в том случае, когда один из валиновых эфиров тривалинового производного заменяют на ацетатную сложноэфирную группу. Установлено, что ди-сложноэфирные производные H2G со специальной комбинацией аминокислотного сложного эфира и сложного эфира жирной кислоты, позволяют значительно улучшить оральную биодоступность в сравнении с родственным соединением (H2G). Задачей настоящего изобретения является создание новых соединений формулы I(СН(СН 3)СН 2 СН 3)NН 2; и R3 представляет собой ОН или Н; а также их фармацевтически приемлемые соли. Благоприятное влияние при оральном применении смешанных сложных эфиров жирных кислот и аминокислот настоящего изобретения является особенно неожиданным в сравнении с соответствующим применением сложных эфиров жирных кислот. На основании результатов анализа мочевой регенерации (таблица 1 А) или плазма-лекарственного анализа (таблица 1 В)H2G крыс, можно сделать вывод, что ни моно-,или ди- сложные эфиры жирных кислот H2G не обеспечивают какого-либо улучшения оральной биодоступности в сравнении с родственными соединениямиH2G. Действительно,дистеаратное производное обеспечивает значи 001404 4 тельно более низкую биодоступность, чем родственное соединение, что может быть следствием нежелательного влияния стеаратного сложного эфира на улучшение оральной биоприменимости H2G. Имеются сообщения о том, что превращение одного или обоих гидроксилов в некоторых других ациклических нуклеозидных аналогах в соответствующий валиновый или дивалиновый сложный эфир улучшают биодоступность. Превращение H2G в соответствующие моно- или ди-валил сложноэфирные производные обеспечивает аналогичное улучшение биодоступности по сравнению с родственным соединением. Учитывая тот факт, что жирнокислотные производные H2G оказывают отрицательное воздействие на улучшение биодоступности, неожиданным оказалось то, что смешанные сложноэфирные производные H2G на основе аминокислоты/жирной кислоты обеспечивают улучшенную или сравнимую оральную биодоступность в сравнении с такой характеристикой валинового дисложноэфирного производного H2G, о чем свидетельствуют данные мочевинно-регенерационного или плазмалекарственного анализов, соответственно. Таблица 1 А Группа R1 Группа R2 Биодоступность водород водород 8% водород стеароил 12% стеароил стеароил 1% валил водород 29% валил валил 36% валил стеароил 56%См. приведенный ниже подробный биологический пример 1. Таблица 1 В Группа R1 Группа R2 Биодоступностьводород водород 3,8% водород стеароил 1,9% стеароил стеароил 0% валил водород 31,3% валил валил 35% валил стеароил 29%Подробности см. в приведенном ниже биологическом примере 2. Настоящее изобретение также предусматривает фармацевтические композиции, содержащие соединения формулы I и их фармацевтические приемлемые соли, в комбинации с фармацевтически приемлемыми носителем или разбавителем. Другие аспекты настоящего изобретения включают соединения формулы I и их фармацевтически приемлемые соли, предназначенные для использования в терапии, а также применение таких соединений и солей для получения лекарственного средства, предназначенного для лечения или профилактики вирусной инфекции людей или животных. 5 Соединения настоящего изобретения являются сильными антивирусными агентами,особенно в отношении таких герпесных инфекций, которые вызываются вирусом Varicellazoster, вирусом герпеса обыкновенного типа 1 и 2, вирусом Epstein-Barr, Неrреs типа 6 (HHV-6) и типа 8 (HHV-8). Такие соединения особенно применимы против инфецирования вирусомVaricella zoster, такого как опоясывающий лишай у пожилых людей, включая пост-герпесную невралгию, или куриный сифилис у молодых особей, когда длительность и тяжесть заболевания могут быть снижены за несколько дней.Epstein-Barr вирусные инфекции, поддающиеся лечению соединениями согласно изобретению включают инфекционную мононуклеоз/железистую лихорадку, которая ранее не поддавалась лечению и которая может вызывать в течение многих месяцев неспособность к обучению у подростков. Соединения настоящего изобретения также обладают активностью против некоторых ретровирусных инфекций, особенно таких, какSIV, HIV-1 и HIV-2, а также против инфекций,для которых указан трансактивирующий вирус. Еще одной задачей изобретения является создание способа профилактики или лечения вирусной инфекции у людей или животных,заключающийся во введении эффективного количества соединения формулы I или его фармацевтически приемлемой соли людям или животным. Преимущественно группа R3 представляет собой гидрокси группу или ее таутомерную форму =O так, что основная часть соединений изобретения представляет собой встречающийся в природе гуанин, например, в том случае,когда боковая цепь расщепляется in vivo. С другой стороны, R3 может представлять собой водород, и в этом случае имеют дело с, как правило, более растворимым 6-деокси производным,которое может окисляться in vivo (например, с помощью ксантин оксидазы) в гуаниновую форму. Соединения формулы I могут присутствовать в рацемической форме, т.е. представлять собой смесь 2R и 2S изомеров. Однако, предпочтительно, чтобы соединения формулы I содержали, по крайней мере, 70%, предпочтительно, по крайней мере, 90% R-формы, например,более 95% такой формы. Наиболее предпочтительно, когда соединение формулы I представляет собой энантиомерно чистую R-форму. Предпочтительно, аминокислота группыR1/R2 содержит четное число атомов углерода, и главным образом, представляет собой деканоил(C16), стеароил (C18), или эйкозанил (С 20). Другие подходящие R1/R2 группы включают бутирил, гексаноил, октаноил или бегеноил (С 22). 6 Другие подходящие R1/R2 группы включают производные миристолеиновой, миристэлаидиновой, пальмитолеиновой, пальмэлаидиновой,н-6-октадеценовой, олеиновой, элаидиновой,гандоиновой, эруковой или брассидиновой кислот. Мононенасыщенные сложные эфиры жирных кислот, как правило, имеют двойную связь в транс-конфигурации, предпочтительно в -6,-9 или -11 положении, в зависимости от их длины. Предпочтительно, R1/R2 группа является производной жирной кислоты, содержащей C9C17 насыщенный или n:9 мононенасыщенный алкил. Насыщенная или ненасыщенная жирная кислота, или R1/R2 могут быть необязательно замещены одинаковыми или различными заместителями, в количестве до пяти, выбранными из группы, состоящей из таких заместителей, как гидрокси, C1-C6 алкил, C1-C6 алкокси, C1-C6 алкокси C1-C6 алкил, C1-C6 алканоил, амино, гало,циано, азидо, оксо, меркапто и нитро, и др. Наиболее предпочтительными соединениями формулы I являются те, в которых R1 представляет собой -С(О)СН(CH3)2NH2 или-С(O)СН(СН(СН 3)СН 2 СН 3)NН 2, a R2 представляет собой -С(О)C9-C17 насыщенный алкил. Используемый в тексте термин "низший алкил" относится к алкильным радикалам нормального или разветвленного строения, содержащим 1-7 углеродных атомов, включающим,но не ограничивающимся ими, метил, этил, нпропил, изо-пропил, н-бутил, изо-бутил, втор.бутил, трет.-бутил, н-пентил, 1-метилбутил, 2,2 диметилбутил, 2-метилпентил, 2,2-диметилпропил, н-гексил и т.п. Используемый в тексте термин "Nзащитная группа" или "N-защищенная" относится к тем группам, которые предназначены для защиты концевых N- аминокислоты или пептида, или для защиты аминогруппы от нежелательных реакций в ходе операций синтеза. Традиционно используемые N-защитные группы описаны в книге Greene "ProtectiveGroups in Organic Synthesis" (John WileySons,New York, 1981), и на эту работу ссылаются в настоящем описании. N-защитные группы включают такие ацильные группы, как формил,ацетил, пропионил, пивалоил, трет.-бутилацетил, 2-хлор-ацетил, 2-бромацетил, трифторацетил, трихлорацетил, фталил, о-нитрофеноксиацетил, -хлорбутирил, бензоил, 4 хлорбензоил, 4-бром-бензоил, 4-нитробензоил и т.п.; такие сульфонильные группы, как бензолсульфонил, п-толуолсульфонил, и т.п.; такие карбамат-образующие группы, как бензилоксикарбонил,п-хлорбензилоксикарбонил,пметоксибензилоксикарбонил, п-нитробензилоксикарбонил, 2-нитробензилоксикарбонил, пбромбензилоксикарбонил,3,4-диметоксибензилоксикарбонил, 4-метоксибензилоксикарбонил,2-нитро-4,5-диметоксибензилоксикарбо 7 нил, 3,4,5-триметоксибензилоксикарбонил, 1-(пбифенилил)-1-метилэтоксикарбонил-диметил-3,5-диметоксибензилоксикарбонил, бензгидрилоксикарбонил,трет.-бутоксикарбонил,диизопропилметоксикарбонил,изопропилоксикарбонил, этоксикарбонил, метоксикарбонил,аллилоксикарбонил, 2,2,2-трихлорэтоксикарбонил, феноксикарбонил, 4-нитрофеноксикарбонил, флуоренил-9-метоксикарбонил, циклопентилоксикарбонил, адамантилоксикарбонил,циклогексилоксикарбонил, фенилтиокарбонил,и т.п.; такие алкильные группы, как бензил,трифенилметил, бензилоксиметил и т.п.; такие силильные группы, как триметилсилил и т.п. Предпочтительными N-защитными группами являются формил, ацетил, бензоил, пивалоил,трет.-бутилацетил, фенилсульфонил, бензил,трет.-бутоксикарбонил (ВОС) и бензилоксикарбонил (Cbz). Используемый в тексте термин "активированное сложноэфирное производное" относится к таким галоидоангидридам, как хлорангидриды, а активированные сложные эфиры включают, но не ограничиваются ими, ангидриды производные муравьиновой и уксусной кислоты, ангидриды - производные таких алкоксикарбонилгалогенидов, как изобутилоксикарбонилхлорид и т.п., N-гидрокси-сукцинимид, производные сложных эфиров, N-гидроксифталимидпроизводные сложных эфиров, Nгидроксибензотриазолпроизводные сложных эфиров, N-гидрокси-5-норборнен-2,3-дикарбоксамидпроизводные сложных эфиров, 2,4,5 трихлорфенилпроизводные сложных эфиров и т.п. Предпочтительные соединения формулы I включают(R)-2-амино-9-[2-13-докозaноил)оксиметил)-4-(L-изолейцилокси)бутил]пурин,а также их фармацевтически приемлемые соли. Другие предпочтительные соединения включают(R)-2-амино-9-[2-13-докозaноил)oксиметил)-4-(L-валилокси)бутил]пурин; а также их фармацевтически приемлемые соли. Другие предпочтительные соединения формулы I включают(R)-2-амино-9-[4-9-октадеценоил)окси)2-(L-валилоксиметил)бутил]пурин,(R)-2-амино-9-[4-11-эйкозaноил)окси)-2(L-валилокси)бутил]пурин,(R)-2-амино-9-[4-13-докозаноил)оксиметил)-2-(L-валилокси)бутил]пурин или фармацевтически приемлемые соли указанных соединений. Соединения формулы I могут образовывать соли, которые являются также предметом настоящего изобретения. Подходящие фармацевтически приемлемые соли соединений формулы I включают соли органических кислот,главным образом карбоновых кислот, включающих, но не ограничивающихся ими, ацетат,трифторацетат, лактат, глюконат, цитрат, тартрат, малеат, малат, пантотенат, изоэтионат,адипат, альгинат, аспартат, бензоат, бутират,диглюконат, циклопентанат, глюкогептанат,глицерофосфат, оксалат, гептаноат, гексаноат,фумарат, никотинат, пальмоат, пектинат, 3 фенилпропионат, пикрат, пивалат, пропионат,тартрат, лактобионат, пиволат, камфорат, ундеканоат и сукцинат, такие соли органических сульфокислот, как метансульфонат, этансульфонат, 2-гидроксиэтансульфонат, камфорсульфонат, 2-нафталинсульфонат, бензолсульфонат,п-хлор-бензолсульфонат, и п-толуолсульфонат; а также соли неорганических кислот, такие как гидрохлорид, гидробромид, гидроиодид, сульфат, бисульфат, полусульфат, тиоцианат, персульфат, а также соли фосфорных и сульфокислот. Удобнее всего использовать соли хлористоводородных кислот. Соединения формулы I могут быть выделены в виде гидратов. Соединения настоящего изобретения могут быть выделены в кристаллической форме, предпочтительно, в виде гомогенных кристаллов, и, в этом случае, дополнительный аспект настоящего изобретения предусматривает соединения формулы I в практически чистой кристаллической форме, содержащей 70%, предпочтительно, 90% гомогенного кристаллического материала, например, 95% гомогенного кристаллического материала. Соединения настоящего изобретения особенно подходят для орального применения, однако, они могут применяться ректально, вагинально, назально, местно, трансдермально или парентерально, например, внутримышечно,внутривенно или эпидурально. Соединения изобретения могут применяться, как таковые, например, в виде капсул, или, как правило, совместно с фармацевтически приемлемым носителем или разбавителем. Настоящее изобретение касается также способов получения фармацевтических композиций, включающих эффективное количество соединения формулы I, или его фармацевтически приемлемой соли, в комбинации, или совместно c фармацевтически приемлемым носителем или разбавителем. 12 Оральные рецептуры удобнее всего получать в виде таких форм разовой дозировки, как капсулы или таблетки, с использованием таких традиционных носителей или связующих веществ, как стеарат магния, мел, крахмал, лактоза, воск, камедь или желатин. Для создания рецептур пролонгированного действия могут использоваться липосомы, или такие синтетические или природные полимеры, как НРМС илиPVP. С другой стороны, такие рецептуры могут быть изготовлены в виде назальных или глазных капель, сиропа, геля или крема, содержащих раствор, суспензию, эмульсию, препарат типа масло в воде или вода в масле, в таких традиционных наполнителях, как вода, физиологический раствор, этанол, растительное масло или глицерин, необязательно, в присутствии отдушки и/или предохранительного агента и/или эмульгатора. Соединения настоящего изобретения могут применяться с дневной дозировкой в интервале 0,1-200 мг/кг/день, преимущественно 0,5100 мг/кг/день, более предпочтительно 10-50 мг/кг/день, например 10-25 мг/кг/день. Типичная дозировка для нормального взрослого может составлять 50-500 мг, например 300 мг, которую применяют один или два раза в день в случае герпеса и 2-10 раз - в случае HIV инфицирований. В соответствии с обычными правилами антивирусной терапии, соединения настоящего изобретения могут применяться в комбинации с такими другими антивирусными агентами, как ацикловир, валцикловир, пенцикловир, фамцикловир, ганцикловир и их пролекарства, цидофовир, фоскарнет и аналогичные препараты, предписанные для лечения герпеса, а также AZT,ddI, ddC, d4T, ЗТС, фоскарнет, ритонавир, индинавир, саквинавир, делавиридин, Vertex VX 478, Agouron AG1343 и другими препаратами,предписанными для лечения ретровирусных инфекций. Соединения настоящего изобретения могут быть получены de novo или путем этерификации H2G родственного соединения, которое получают, например, по методике синтеза, раскрытой в Европейском патенте ЕР 343 133, на который ссылаются в тексте настоящего описания. Ниже приведена типичная реакционная схема получения H2G. Стадию конденсации 1 обычно проводят в присутствии такого основного катализатора, какNaOH или Na2CO3 в среде такого растворителя,как ДМФ. Стадия 2 представляет собой восстановление, которое может быть осуществлено в присутствии системы LiBH4/тетрагидрофуран в таком растворителе, как трет.-ВuОН. Реакцию замещения хлора на аминогруппу на стадии 3 можно проводить аммиаком при повышенном давлении. На стадии 4 используют аденозин деаминазу, которая может быть стандартно иммобилизована на твердом носителе. Охлаждение реакционной смеси позволяет сохранять непрореагировавший изомерный предшественник в растворе, что повышает чистоту конечного продукта. Исходные соединения для получения соединений изобретения, в которых R3 представляет собой водород, могут быть получены в соответствии со способом, раскрытым в Европейском патенте ЕР 186 640, на который ссылаются в настоящем описании. Такие исходные материалы могут быть ацилированы, как описано ниже для H2G, необязательно, после защиты 2 аминогруппы пурина указанными ниже традиционными N-защитными группами, особенно такими, как ВОС (трет.-ВuО-СО-), Z (ВnО-СО-) или Рh3 С-. Соединения настоящего изобретения могут быть получены из H2G как это показано ниже в схемах А и В. А. Способ прямого ацилирования. Схема А В схеме А показано получение соединений, в которых R1 является производным аминокислоты, a R2 - производным жирной кислоты, вместе с тем такая схема превращений применима к соединениям, в которых R1 является 14 производным жирной кислоты, a R2 - производным сложного эфира аминокислоты. В варианте специально представленном в приведенной выше схеме A: G представляет собой гуанин или 6 деоксигуанин, PG представляет собой необязательную N-защитную группу или водород, R1 представляет собой валин или изолейциновую боковую цепочку, a R2 представляет собой цепочку жирной кислоты. В приведенной схемеH2G показан, как исходный материал, однако,следует иметь в виду, что это соединение может быть необязательно защищено по группе R3 или 2-положению пурина с помощью традиционныхN-защитных групп (на рисунке не показано). На первой стадии H2G (производное) реагирует с активированным R1 -аминокислотным производным, как дополнительно описано ниже, в таком растворителе, как диметилформамид или пиридин, с получением моноацилированного продукта. R1 -аминокислота может быть Nзащищена с помощью N-BOC или N-CBz или аналогичных групп. В контролируемых условиях, первое ацилирование может быть осуществлено так, что будет доминировать реакция с участием 4-гидроксигруппы боковой цепи H2G. Такие контролируемые условия могут быть созданы на практике, например, в результате манипулирования с концентрациями реагентов или скоростью добавления, главным образом ацилирующего агента, в результате снижения температуры или путем выбора подходящего растворителя. За ходом реакции можно следить методом ТСХ с целью контролирования условий ее проведения. После очистки, R1 моноацилированные соединения дополнительно ацилируют по 2 СН 2 ОН группе боковой цепи, с помощью подходящего активированного жирнокислотного производного, с получением ди-ацилированного продукта, используя при этом методику, аналогичную описанной для первой стадии этерификации. Дисложноэфирные продукты далее подвергают традиционной обработке для снятия защитной группы; с использованием, например,трифторуксусной кислоты, системы НСl (водной)/диоксан, или в результате осуществления гидрирования в присутствии катализатора, с получением желаемого соединения формулы I. Это соединение может быть получено в виде соли в зависимости от условий осуществления реакции по снятию защитной группы. Активированные R1/R2 кислотные производные, используемые в различных реакциях ацилирования, могут включать, например, галоидангидрид, ангидрид кислоты, активированный сложный эфир или кислоту в присутствии сшивающего агента, например, дициклогеккарбодиимида, причем термин "кислота" в каждом случае относится к соответствующей R1/R2 аминокислоте или R1/R2 жирной кислоте. Представителями активированных кислотных произ 15 водных могут служить хлорангидрид, смешанные ангидриды муравьиной и уксусной кислот,такие ангидриды -производные алкоксикарбонилгалогенидов, как изобутилоксикарбонилхлорид и т.п., N-гидроксисукцинимидные сложные эфиры, N-гидроксифталимидные сложные эфиры,N-гидрокси-5-норборнен-2,3-дикарбоксамидные сложные эфиры, 2,4,5-трихлорфенольные сложные эфиры и т.п. В. Путь через защиту 4-гидроксигруппы боковой цепи: где G, PG, R1 и R2 имеют значения, указанные для схемы А. Схема В является примером получения соединения, в котором R1 является производным аминокислоты, a R2 - производным сложного эфира жирной кислоты, однако, эта схема превращений применима к соединениям, в которыхR2 является производным аминокислоты, а R1 производным жирной кислоты. Эта схема предусматривает региоселективную защиту 4 гидроксигруппы боковой цепи H2G массивной защитной группой. В представленной выше схеме В такой защитной группой является трет.бутилдифенилсилил, однако в такой реакции могут использоваться и другие защитные группы, такие как тритил, 9-(9-фенил)ксантенил, 1,1 бис(4-метилфенил)-1'-пиренилметил. Полученный в результате продукт ацилируют по 2 гидроксиметильной группе боковой цепи с использованием реагентов и методик, аналогичных тем, что указаны для приведенной выше схемы А, при отличии, состоящем в том, что активированное кислотное производное представляет собой, например, хлорангидрид R2 жирной кислоты, например, такой как миристиновая кислота, стеариновая, олеиновая; эладиновая и т.п. Такие моноацилированные соединения подвергают соответствующей обработке по снятию защитной группы с целью удаления 4-гидрокси защитной группы боковой цепи, что может быть сделано очень селективно с использованием таких реагентов, в зависимости от природы региоселективной защитной группы как HF/пиридин и, путем аналогичных, описанных выше, изменений условий реакций, вклю 001404 16 чающих использование различных концентраций реагентов, скоростей добавления, температуры, растворителя и т.д. После этого, свободную 4-гидроксигруппу боковой цепи ацилируют с помощью активированной -аминокислоты по методике, аналогичной описанной выше для схемы А. Другие методики введения аминокислотного сложного эфира R1/R2, например, в том,что касается схем А, В, С или D, включают 2 окса-4-азациклоалкан-1,3-дионовый способ,описанный в Международной патентной заявкеWO 94/29311. Другие методики введения жирнокислотного сложного эфира R1/R2, например, в том,что касается схем А, В, С или D, включают энзимный путь введения, описанный в PreparativeWiley and Son, Нью-Йорк, 1995), с использованием липазы, такой как SP 435 иммобилизованная Candida antarcticus (Novo Nordisk), свиная панкреатитная липаза или Candida ругозалипаза. Энзимное ацилирование особенно удобно в том случае, когда желательно избежать стадии защиты и снятия защитной группы по другим ацильным группам пурин-2-амина. Альтернативный подход к соединениям формулы I, в которых R3 представляет собой водород, состоит в активации положения 6 соответствующего соединения формулы I (в котором аминокислотный сложноэфирный фрагментR1/R2 необязательно защищен такой традиционной N-защитной группой, как ВОС) с помощью такой активирующей группы, как галоген. Активированный таким образом 6-пурин далее восстанавливают в пурин, например, с использованием палладиевого катализатора и подвергают реакции снятия защитной группы с получением желаемого 6-деокси H2G диэфира. Таким образом, еще одной задачей настоящего изобретения является создание способа получения соединений формулы I, включающегоa) необязательную N-защиту 2 и/или 6 положений пурина в соединении формулы I, в которой каждый из R1 и R2 представляют собой водород;b) региоселективное ацилирование соединения формулы I по 4-гидроксигруппе боковой цепи, с помощьюi) необязательной N-защищенной валиновой или изолейциновой группы,ii) необязательно замещенного, насыщенного или мононенасыщенного С 3-С 21 СООН производного илиc) ацилирование 2-гидроксиметильной группы боковой цепи с помощьюi) необязательно N-защищенного валинового или изолейцинового производного илиii) необязательно замещенного, насыщенного или мононенасыщенного C3-C21COOH производного;d) замену региоселективной защитной группы при R1, если она имеется, наii) необязательно замещенное, насыщенное или мононенасыщенное C3-C21COOH производное и е) если это необходимо, снятие защитной группы с полученного в результате соединения. В представленных выше схемах А и В используется селективное ацилирование с целью постадийного добавления сложных эфиров аминокислоты и жирной кислоты. Альтернативный процесс получения соединений формулы I включает начальное использование диацилированного H2G производного, в котором обе ацильные группы имеют одинаковые значения,и селективное удаление одной из таких ацильных групп, с получением моноацильного промежуточного соединения, которое далее подвергают ацилированию с помощью второй, другой, ацильной группы, используя методику,приведенную для схем А и В. В соответствии с этим, еще один аспект настоящего изобретения предусматривает способ получения соединения формулы I, приведенной выше, включающийA) монодеацилирование диацилированного соединения, соответствующего формуле I, в которой оба радикала R1 и R2 представляют собой валиловый или изолейциловый эфир (причем такие группы могут быть необязательно Nзащищенными), или оба радикала R1 и R2 представляют собой -С(=O)С 3-С 21 насыщенный или мононенасыщенный, необязательно замещенный алкил; иB) ацилирование освобожденной таким образом 4-гидрокси- или 2-гидроксиметильной группы боковой цепи с помощью валила, изолейцила или -С(=O)С 3-С 21 насыщенного или мононенасыщенного, необязательно замещенного алкила; иC) если это необходимо, снятие защитной группы. Этот альтернативный способ обладает тем преимуществом, что облегчается получение диацилированного H2G производного и оно требует лишь незначительной очистки, или стадии очистки исключаются. Селективное удаление только одной ацильной группы диацилированного H2G производного может достигаться путем изменения реакционных условий, особенно, температуры, скорости добавления реагентов и подбора подходящего основания. Соединения, используемые в таком альтернативном синтезе, имеют формулу в которой R1 и R2 представляют собой валил или изолейцил (которые могут быть, необязательно, N-защищенными) или -С(=О)С 3-С 21 насыщенный или мононeнасыщенный, необязательно замещенный алкил; а R3 представляет собой ОН или Н. В целях облегчения синтеза по такой альтернативной схеме, предпочтительно, чтобы R1 и R2 вначале были одинаковыми и, наиболее предпочтительно, чтобы они являлись производными одного сложного эфира аминокислоты. Такой диэфир аминокислоты обычно является N-защищенным в ходе его получения и может непосредственно использоваться в таком виде на стадии селективного деацилирования. С другой стороны, такое N-защищенное диаминоацилированное производное H2G производного может быть подвергнуто снятию защитной группы и, необязательно, вновь защищено, как это будет описано ниже. Таким образом, незащищенное диаминоацил H2G производное представляет собой одно из следующих соединений:(R)-2-амино-9-[4-(L-валилокси)-2-(Lвалилоксиметил)бутил]пурин. Незащищенные H2G диацилированные производные могут быть подвергнуты селективному деацилированию по одной из ацильных групп (обычно по ацилу в 4-положении боковой цепи) с последующим энзимным ацилированием открытой 4-гидроксигруппы, как описано выше. С другой стороны, незащищенное H2G диацилированное производное может быть подвергнуто повторной защите и затем селективному деацилированию, после чего проводят традиционное ацилирование сложным эфиром жирной кислоты в соответствии со схемами А и В. Такую стадию повторной защиты лучше всего проводить с использованием другой Nзащитной группы, обладающей свойствами,подходящими для последующего ацилирования. Так например, удобно использовать такую липофильную N-защитную группу, как Fmос при получении диаминокислотного H2G производного, поскольку липофильная природа такой защитной группы способствует отделению ацилированных продуктов. С другой стороны, липофильный характер Fmос менее подходит при 19 проведении ацилирования жирной кислотой и, в этом случае, повторную защиту диацилированного H2G лучше осуществлять с помощью такой другой N-защищающей группы, как ВОС. Следует отметить, что получение соединений формулы I может быть связано с новыми моноацилированными промежуточными соединениями по стадиям в i), ii), или iii), приведенным выше, которые описывают указанный выше первый аспект настоящего изобретения, касающийся способа получения. Такие соединения имеют следующую формулу: в которой один из R1 и R2 имеет значениеiii) региоселективная защитная группа; при этом другой из R1 и R2 представляет собой водород; а R3 представляет собой ОН или Н; Таким образом, полезные соединения включают(R)-9-[4-гидрокси-2-(октадеканоилоксиметил)бутил]гуанин,(R)-9-[4-гидрокси-2-(эйкозаноилоксиметил)бутил]гуанин,(R)-9-[4-гидрокси-2-(докозаноилоксиметил)бутил]гуанин,(R)-9-(2-гидроксиметил-4-(L-валилокси) бутил]гуанин,(R)-9-[2-гидроксиметил-4-(L-изолейцилокси)бутил]гуанин,(R)-9-[4-гидрокси-2-(L-изолейцилоксиметил)бутил]гуанин,(R)-9-[4-гидрокси-2-(L-валилоксиметил) бутил]гуанин,(R)-2-амино-9-[2-гидроксиметил-4-(L-валилокси)бутил]пурин,(R)-2-амино-9-[2-гидроксиметил-4-(L-изолейцилокси)бутил]пурин,(R)-2-амино-9-[4-гидрокси-2-(L-изолейцилоксиметил)бутил]пурин,(R)-2-амино-9-[4-гидрокси-2-(L-валилоксиметил)бутил]пурин. Региоселективно защищенные по 4-гидроксигруппе боковой цепи промежуточные соединения со стадии (с), приведенной выше и относящейся к первому аспекту настоящего изобретения, также являются новыми соединениями. Полезные соединения этого типа включают:(R)-9-[2-деканоилоксиметил-4-(трет.бутилдифенилсилил)бутил]гуанин,(R)-9-[2-додеканоилоксиметил-4-(трет.бутилдифенилсилил)бутил]гуанин,(R)-9-[2-тетрадеканоилоксиметил-4-(трет.бутилдифенилсилил)бутил]гуанин,(R)-9-[2-гексадеканоилоксиметил-4-(трет.бутилдифенилхлорсилан)бутил]гуанин,(R)-9-[2-октадеканоилоксиметил-4-(трет.бутилдифенилсилил)бутил]гуанин,(R)-9-[2-эйкозаноилоксиметил-4-(трет.бутилдифенилсилил)бутил]гуанин,(R)-9-[2-докозаноилоксиметил-4-(трет.бутилдифенилсилил)бутил]гуанин. Альтернативный способ получения соединений изобретения, отвечающих формуле I, в которой R3 представляет собой -ОН, показан на схеме С. Схема С Формула I В соответствии со схемой С, малонат 1 (R4 и R5 представляют собой низший алкил, бензил или т.п.) алкилируют по реакции с примерно 0,5-2,0 молярными эквивалентами ацеталя 2 (R6 и R7 представляют собой низший алкил, бензил и т.п., или R6 и R7 совместно представляют собой -СН 2 СН 2- или -СН 2 СН 2 СН 2- или -СH2 СH2 СН 2 СН 2-, a X1 представляет собой уходящую группу (например, Сl, Вr или I, либо такой сульфонат, как метансульфонат, трифлат, птолуолсульфонат, бензолсульфонат и т.п.) в присутствии 0,5-2,0 молярных эквивалентов основания (например, трет.-бутилата калия, или этилата натрия, либо NaH или КН и т.п.) в среде инертного растворителя (например такого, как ДМФ,ТГФ,диоксан,диоксолан,Nметилпирролидон и т.п.) при температуре в интервале -40 - 190 С с получением алкилированного малоната 3. В результате восстановления 3 , при соотношении 0,5-4,0 молярных эквивалентов сложного эфира к спиртовому восстанавливающему агенту (например, такому как LiBH4, Ca(BH4)2 или NaBH4, LiAlH4 и т.п.) в среде инертного растворителя (например, ТГФ, метил трет.бутилового эфира или трет.-ВuОН, или т.п.) при температуре в интервале от -20 С до примерно 100 С, получали диол 4. В результате энзимной этерификации 4 по реакции с 1,0-20,0 молярными эквивалентами в винилового эфира 5 (R8 представляет собой С 3-С 21 насыщенный или мононенасыщенный, необязательно замещенный алкил) в присутствии липазы (например,Липазы PS-30, Липазы PPL, липазы CCL и т.п.) или фосфолипазы (например, фосфолипазы D и т.п.), получали желаемый стереоизомер сложного эфира 6. Такую реакцию можно проводить в 22 отсутствии растворителя или в присутствии инертного растворителя (например, метил трет.бутилового эфира, толуола или гексана, и т.п.). Реакцию проводили при температуре в интервалe от -20 С до примерно 80 С. Спиртовый заместитель соединения 6 превращают в удаляемую группу (например, такую как галоген или сульфонат) по реакции с галогенирующим агентом (например, таким какNCS/P(Ph)3/NaI в среде ацетона или аналогичного растворителя) в среде инертного растворителя (например, такого как хлористый метилен,толуол, этилацетат и т.п.) или по реакции с 0,82,0 молярными эквивалентами сульфонил галогенида (например, такого как бензолсульфонилхлорид, толуолсульфонилхлорид или метан сульфонилхлорид и т.п.) в присутствии 1,0-4,0 молярных эквивалентов основания (например,такого как триэтиламин, карбонат калия, пиридин, диметиламинопиридин или этилдиизопропиламин и т.п.) в среде инертного растворителя-25 С до, примерно, 100 С с получением сложного эфира 7. (Х 2 представляет собой галоген или сульфонатную уходящую группу). По реакции соединения 7 с 0,9-2,0 молярными эквивалентами 2-амино-4-хлорпурина 8 в присутствии 1,0-6,0 молярных эквивалентов основания (например, такого как карбонат калия, NaH, КН, NaOH, КОН, диизопропиламид лития и т.п.) в среде инертного растворителяMitsunobu сочетания (например, с использованием системы Р(Ph)3/диэтилазидокарбоксилат) спирта 6 с 2-амино-4-хлорпурином 8 получали соединение 9. В результате реакции 9 с 2,0-20 молярными эквивалентами спирта R9OH (R9 представляет собой такую спиртозащитную группу, как бензил и т.п.) в присутствии 1,0-6,0 молярных эквивалентов основания (например, такого как трет.-бутилат калия, карбонат калия, NaH, KH,диизопропиламид лития и т.п.) в среде инертного растворителя (например, такого как ТГФ,ДМФ и т.п.), при температуре от -25 С до, примерно, 150 С получали спирт 10. В результате удаления спиртозащитной группы R9 соединения 10 (например, в результате каталитического гидрирования в среде такого инертного растворителя, как этанол, бензиловый спирт, метанол, ТГФ и т.п. в присутствии такого гидрирующего катализатора, какPd/C или Pd(OH)2 и т.п.), получали замещенный гуанин 11. 23 В результате этерификации соединения 11 по реакции с а) 0,8-2,0 молярными эквивалентами R10COOH и сшивающим агентом (например,ДСС/ДМАР) и т.п. в среде инертного растворителя (например, ТГФ, ДМФ и т.п.) или b/ с 0,82,0 молярными эквивалентами активированного производного R10COOH (например, такого как хлорангидрид, или N-гидроксисукцинимидный сложный эфир, или R10C(O)OC(O)R10 и т.п.) в присутствии 0-3,0 молярных эквивалентов основания (например такого, как пиридин, триэтиламин, этилдиизопропиламин, ДВУ, карбонат калия и т.п.), в среде инертного растворителя (например такого, как метиленхлорид, ТГФ,пиридин, ацетонитрил, ДМФ и т.п.) при температуре от -25 С до, примерно, 100 С, получали сложный эфир 12. Ацетальный заместитель соединения 12 удаляли и полученный в результате альдегид восстанавливали путем реакции соединения 12 с 0,1-10,0 молярными эквивалентами кислоты(например, такой как трифликовая, НСl, уксусная, серная кислоты и т.п.) в среде инертного растворителя (например, такого как ТГФ/Н 2 О,метиленхлорид/Н 2O,этилацетат/Н 2 О,этанол/Н 2 О, метанол/Н 2O и т.п.) при температуре в интервале от -25 С до, примерно, 100 С. К сырой смеси добавляли 0,1-10,0 молярных эквивалентов основания (например, такого как бикарбонат натрия, карбонат калия, триэтиламин,пиридин, КОН и т.п.), дополнительное количество инертного растворителя (например, такого как ТГФ, хлористый метилен, этилацетат, метил трет.-бутиловый эфир, изопропанол и т.п.), а также от 0,3 до 5,0 молярных эквивалентов агента восстанавливающего альдегид (например, такого как боргидрид натрия, RaNi/Н 2 и т.п.), при температуре в интервале от -25 С до 100 С, с получением спирта 13. В результате реакции 13 с 0,8-3,0 молярными эквивалентами N-защищенной аминокислоты P1NHCH (R11)СООН или ее активированного производного (P1 представляет собой Nзащитную группу, а R11 представляет собой изопропил или изобутил) в среде инертного растворителя (например, такого как ТГФ, диоксан,диоксолан, ДМФ, хлористый метилен и т.п.) при температуре 25-100 С, получали спирт 14. В результате снятия N-защитной группы соединения 14 получали соединение настоящего изобретения формулы I, в которой R3 представляет собой -ОН. В альтернативном случае, соединение 13 может реагировать с симметричным ангидридом, производным от P1NHCH (R11)COOH (например, P1NHCH(R11)C(O)O-C(O)CH(R11)NHP1) с получением соединения 1, в котором R3 представляет собой ОН. Другой альтернативный способ получения соединений, в которых R3 представляет собой ОН, представлен на схеме D. Формула I Малонат 1 (R4 и R5 представляют собой низший алкил, бензил и т.п.) алкилировали 0,52,0 молярными эквивалентами простого эфира 15, в котором X1 представляет собой уходящую группу (например, такую, как Сl, Вr или I, или такой сульфонат, как метансульфо-нат, трифлат,п-толуолсульфонат, бензолсульфонат и т.п.), a-Si(трет.-Bu)(Me)2 и т.п., где Ph = фенил) в присутствии 0,5-2,0 молярных эквивалентов основания (например такого, как трет.-бутилат калия, этилат натрия, NaH, KH и т.п.) в среде инертного растворителя (например, такого, как ДМФ,ТГФ,диоксан,диоксолан,Nметилпирролидон и т.п.) при температуре от-40 С до, примерно, 190 С, с получением алкилированного малоната 16. В результате восстановления соединения 16 0,5-4,0 молярными эквивалентами эфира относительно спиртового восстанавливающего агента (например, такого как LiBH4 или Са(ВН 4)2, NaBH4 или LiAlH4, либо т.п.) в среде инертного растворителя (например, такого как ТГФ, метил трет.-бутиловый эфир, этанол,трет.-бутанол и т.п.) при температуре от -20 С до, примерно, 100 С, получали диол 17. В результате энзимной этерификации соединения 17 по реакции с 1,0-20,0 молярными эквивалентами винильного эфира 5 (R8 представляет собой C3C21 насыщенный или мононенасыщенный, необязательно замещенный алкил) в присутствии липазы (например, Липазы PS-30, Липазы PPL,липазы CCL и т.п.) или фосфолипазы (например, такой, как фосфолипаза D и т.п.), получали желаемый сте-реоизомер сложного эфира 18. Эту реакцию можно проводить в отсутствии 25 растворителя или в присутствии инертного растворителя (например, метил трет.-бутилового эфира, толуола, гексана или т.п.). Реакцию проводят при температуре в интервале от -20 С до,примерно, 80 С. Спиртовый заместитель соединения 18 превращают в уходящую группу (например,такую как галоген или сульфонат) по реакции с галоидирующим агентом (например, таким какNaI в среде ацетона или другого растворителя),в среде инертного растворителя (например, такого как хлористый метилен, толуол, этилацетат и т.п.), или по реакции с 0,8-2,0 молярными эквивалентами сульфонил галогенида (например,такого как бензолсульфонилхлорид, толуолсульфонилхлорид, или метан сульфонилхлорид и т.п.), в присутствии 1,0-4,0 молярных эквивалентов основания (например такого, как триэтиламин, карбонат калия, пиридин или метил трет.-бутиловый эфир и т.п.), при температуре от -25 С до, примерно, 100 С, с получением сложного эфира 19. (Х 2 представляет собой галоген или сульфонатную уходящую группу). По реакции соединения 19 с 0,9-2,0 молярными эквивалентами 2-амино-4-хлорпурина 8 в присутствии 1,0-6,0 молярных эквивалентов основания (например, такого как карбонат калия, NaH, КН, NaOH, КОН, диизопропиламид лития и т.п.), в среде инертного растворителя(например такого, как ДМФ, ТГФ, ацетонитрил,N-метилпирролидон, этанол и т.п.) при температуре в интервале от -25 С до, примерно,140 С, получали замещенный пурин 20. В альтернативном случае, в результатеMitsunobu сочетания (например, с помощью Р(Рh)3/диэтилазидокарбоксилата) спирта 18, с 2 амино-4-хлорпурином 8, получали соединение 20. В результате реакции соединения 20 с 2,020,0 молярными эквивалентами спирта R9OH(R9 представляет собой такую спиртозащитную группу, как бензил и т.п.), в присутствии 1,0-6,0 молярных эквивалентов основания (например,такого как трет.-бутилат калия, карбонат калия,NaH, KH, диизопропиламид лития и т.п. в среде инертного растворителя (например, такого как ТГФ, ДМФ и т.п.), при температуре в интервале от -25 С до примерно 150 С, получали спирт 21. В результате удаления спиртозащитной группы R9 в соединении 21 (например, путем каталитического гидрирования в среде такого инертного растворителя, как этанол, бензиловый спирт, метанол, ТГФ, и т.п. в присутствии такого катализатора гидрирования, как Pd/C илиPd(OH)2 и т.п.) получали замещенный гуанин 22. Проводят снятие защитной группы - эфирного заместителя соединения 23 реакцией с а) восстанавливающим агентом (например, таким как НСО 2 Н и Pd/C и т.п.), где R12 представляет собой -СН(Рh)2 или -С(Рh)3, или b) десилили 001404 26 рующим агентом (например, таким как Bu4NF и т.п.), где R12 представляет собой -Si(трет.Bu)(Me)2 и т.п., с получением соединения 13. Спирт 13 может быть превращен в соединение 1, как это показано в схеме С. Дополнительное альтернативное решение включает энзиматическую этерификацию спирта 4 или 17 с помощью винилового эфира СН 2=СН-ОС(О)R10 (т.е. тот случай, когда в схемах С и D R8 = R10) с целью непосредственного внедрения в соединения 6 или 18 желаемой сложноэфирной группы карбоновой кислоты конечного продукта 1. Такой путь позволяет устранить стадии гидролиза сложного эфира и переэтерификации, в соответствии с 9-12, или 20-23. Способы, показанные на схемах С и D, характеризуются тем, что каждая из гидроксильных групп ациклической боковой цепи дифференцируется в результате использования различных гидроксизащитных групп или предшествующих групп. Такой подход позволяет осуществлять селективное ацилирование каждой из гидроксигрупп аминокислотной или жирнокислотной группой. Примеры, проиллюстрированные в схемах С и D, относятся к воплощениям изобретения, в которых R1 является производным аминокислоты, a R2 - производным жирной кислоты. Однако, должно быть понятно, что схемы могут быть применимы к соединениям, в которых RI является производным жирной кислоты, а R2 - аминокислоты. Подробное описание изобретения Далее настоящее изобретение будет проиллюстрировано примером, касающимся исключительно следующих, не ограничивающих сферу изобретения примеров, сравнительных примеров и прилагаемых рисунков, где на фиг. 1 изображена функциональная временная зависимость уровней содержания H2G в плазме для обезьян cynomolgus, на которых применяли соединение изобретения, или альтернативное пролекарственное производное H2G, как это дополнительно объяснено в биологическом примере 3; и на фиг. 2 изображена функциональная зависимость выживания от времени для инфицированных Неrреs simplex мышей, на которых применяли различные дозировки соединения изобретения или известные антивирусные агенты, как это дополнительно объяснено в биологическом примере 4. Пример 1. (R)-9-[2-(Стеароилоксиметил)4-(L-валилокси)бутил]гуанин. Этот пример иллюстрирует применимость препаративной схемы А.(300 мл) при нагревании и охлаждали до комнатной температуры перед добавлением Nтрет.-Вос-L-валина (5,58 г, 25,7 ммоля), ДМАР(0,314 г 2,57 ммоля) и ДСС (6,52 г 31,6 ммоля). Полученную смесь перемешивали при комнатной температуре в течение 24 ч и затем фильтровали. Продукт реакции подвергали хроматографической очистке на силикагеле, при элюировании смесью CH2Cl2/MeOH с получением 2,4 г желаемого промежуточного продукта. Спектр 1H ЯМР (250 МГц, DMSO-d6):0,95 (д, 6 Н), 1,47 (с, 9 Н), 1,5-1,8 (м, 2 Н), 1,962,20 (м, 2 Н), 3,40 (м, 2 Н), 3,91 (т, 1 Н), 4,05 (м,2 Н), 4,21 (т, 2 Н), 4,89 (т, 1 Н), 6,6 (широкий с,2 Н), 7,27 (д, 1 Н), 7,75 (с, 1 Н), 10,7 (широкий с,1 Н).(R)-9-[4-(N-трет.-Бутоксикарбонил-Lвалилокси)-2-(cтеароилоксиметил)бутил]гуанин. Продукт со стадии а) (185 мг, 0,41 ммоля) растворяли в пиридине (5 мл), полученный раствор охлаждали на бане со льдом и добавляли хлористый стеароил (179 мкл, 0,531 ммоля). Полученный раствор выдерживали на бане со льдом в течение 2 ч и затем 1 ч при комнатной температуре. Затем его выпаривали и подвергали хроматографической очистке на силикагеле. Затем проводили элюирование смесью дихлорметан/метанол с получением 143 мг желаемого промежуточного продукта. с)(R)-9-[2-(Стеароилоксиметил)-4-(Lвалилокси)бутил]гуанин. Продукт со стадии b) (138 мг, 0,192 ммоля) охлаждали на бане со льдом и добавляли трифторуксусную кислоту (5 мл). Полученный раствор выдерживали на бане со льдом в течение 45 мин и затем выпаривали с получением масла. Добавляли воду (0,5-1 мл) и полученную смесь выпаривали дважды. Остаток еще раз растворяли в воде (5 мл), фильтровали и сушили вымораживанием с получением 148 мг желаемого продукта в виде бистрифторацетатной соли. Спектр 1H ЯМР (250 МГц, DMSO-d6): 0,97(широкий с, 3 Н), 10,9 (широкий с, 1 Н). Пример 2. (R)-9-[2-(Миристоилоксиметил)-4-(L-валилокси)бутил]гуанин. Целевое соединение получали в виде бистрифторацетатной соли по способу аналогичному описанному в примере 1, с использованием миристоил хлорида вместо стеароил хлорида на стадии b). Спектр 1H ЯМР (250 МГц, DMSO-d6):0,97 (т, 3 Н), 1,05 (дд, 6 Н), 1,34 (широкий с,20 Н), 1,57 (м, 2 Н), 1,78 (м, 2 Н), 2,24 (м, 1 Н), 2,35 28 Целевое соединение получали в виде бистрифторацетильной соли по способу, аналогичному описанному в примере 1, с использованием олеоил хлорида вместо стеароил хлорида на стадии b). 1(R)-9-[4-(N-трет.-Бутоксикарбонил-Lвалилокси)-2-(бутирилоксиметил)бутил]гуанин. ДСС (110 мг, 0,53 ммоля) растворяли в дихлорметане (10 мл) и добавляли масляную кислоту (82 мг, 0,93 ммоля). Через 4 ч реакции при комнатной температуре смесь фильтровали и фильтрат выпаривали. Остаток растворяли в пиридине (5 мл) и добавляли (R)-9-[4-(N-трет.бутоксикарбонил-L-валилокси)-2-гидроксиметилбутил]гуанин (200 мг, 0,44 ммоля) (пример 1, стадия а. Полученную смесь перемешивали в течение 120 ч при комнатной температуре. В соответствии с данными ТСХ реакция протекает не полностью и с использованием описанной выше методики образуется большее количество ангидрида. Такой ангидрид добавляли в систему и полученную смесь перемешивали еще в течение 20 ч. Реакционную смесь выпаривали и подвергали хроматографической очистке сначала на силикагеле и затем на оксиде алюминия, в обоих случаях проводили элюирование смесью дихлорметан/метанол с получением 79 мг промежуточного продукта.b) (R)-9-[2-(Бутирилоксиметил)-4-(L-валилокси)бутил]гуанин. Промежуточный продукт со стадии а) подвергали реакции снятия защитной группы, осуществляемой по способу, аналогичному примеру 1, стадия 3, с получением 84 мг желаемого продукта в виде бистрифторацетатной соли. Спектр 1H ЯМР (250 МГц, D2O):0,88 (т,3 Н), 1,06 (дд, 6 Н), 1,53 (м, 2 Н), 1,93 (кв., 2 Н),2,25 (т, 2 Н), 2,36 (м, 1 Н), 2,60 (м, 1 Н), 4,06 (д,1 Н), 4,14-4,30 (м, 2 Н), 4,43 (м, 4 Н), 8,99 (широкий с, 1 Н). Пример 5. (R)-9-[2-(Деканоилоксиметил)4-(L-валилокси)бутил]гуанин. Целевое соединение получали в виде бистрифторацетатной соли по способу, аналогичному описанному в примере 1, с использованием деканоил хлорида вместо стеароил хлорида на стадии b. Спектр 1H ЯМР (250 МГц, D2O):0,90 (м,3 Н), 1,01 (д, 6 Н), 1,28 (широкий с, 12 Н), 1,5 (м,2 Н), 1,8 (м, 2 Н), 2,3 (м, 3 Н), 2,5 (м, 1 Н), 4,0-4,4 29 Пример 6. (R)-9-[2-Докозаноилоксиметил 4-(L-валилокси)бутил]гуанин. Полученное соединение получали в виде бистрифторацетатной соли по способу, аналогичному описанному в примере 1, но с использованием на стадии b) ДМAР/ДСС условий стадии а) примера 1, совместно с докозановой кислотой, вместо N-t-Boc-L-валина, и смеси ДМФ и дихлорметана в качестве растворителя. Спектр 1H ЯМР (250 МГц, DMCO-d6):0,97 (т, 3 Н), 1,05 (дд, 6 Н), 1,34 (широкий с,36 Н), 1,58 (м, 2 Н), 1,77 (м, 2 Н), 2,24 (м, 1 Н), 2,35(т, 2 Н), 2,50 (м, 1 Н), 3,97-4,17 (м, 5 Н), 4,35 (т,2 Н), 6,7 (широкий с, 2 Н), 8,1 (широкий с, 1 Н),8,4 (широкий с, 3 Н), 11,0 (широкий с, 1 Н). Пример 7. R-9-[4-(L-изолейцилокси)-2(стеароилоксиметил)бутил]гуанин. Этот пример иллюстрирует использование препаративной схемы В. а) (R)-9-[2-гидроксиметил-4-(трет.-бутилдифенилсилилокси)бутил]гуанин H2G (2 г, 8 ммоля) дважды совместно выпаривали с сухим ДМФ и затем суспендировали в сухом ДМФ(120 мл) и пиридине (1 мл). К полученной суспензии прикапывали при 0 С в течение 30 мин раствор трет.-бутилдифенилхлорсилана (2,1 мл,8,2 ммоля) в дихлорметане (20 мл). После завершения прикапывания реакционный раствор становился прозрачным. Реакцию проводили при 0 С в течение двух часов и затем выдерживали при 4 С в течение ночи. В реакционную смесь добавляли метанол (5 мл). Через 20 мин при комнатной температуре реакционную смесь выпаривали до небольшого объема, переливали в водный раствор бикарбоната натрия и экстрагировали дважды дихлорметаном. Органическую фазу сушили над сульфатом натрия и выпаривали в вакууме. Продукт выделяли методом колоночной хроматографии на силикагеле, с использованием системы метанол/дихлорметан с постепенно увеличивающими концентрациями МеОН. Продукт элюировали в количестве 1,89 г с помощью системы 7% МеОН в CH2Cl2.(R)-9-[2-Гидроксиметил-4-(трет.-бутилдифенилсилилокси)бутил]гуанин (2,31 г, 5 ммолей) дважды совместно выпаривали с сухим пиридином и растворяли в пиридине (20 мл). К полученному раствору медленно прикапывали стеароил хлорид (1,86 мл, 5,5 ммоля, технический сорт) в дихлорметане (2 мл) при -5 С. Реакционную смесь выдерживали при такой же температуре в течение 1 ч и затем при 5 С в течение 2 ч. За ходом реакции следили с помощью ТСХ. В результате незавершения реакции при -5 С, в систему добавляли дополнительное количество стеароил хлорида (0,29 мл). Через 30 мин при 5 С, добавляли метанол (3 мл) и реакционный раствор перемешивали в течение 20 мин. Затем его переливали в водный раствор бикарбоната натрия и экстрагировали дихлорметаном. Орга 001404 30 ническую фазу сушили и продукт очищали методом колоночной хроматографии на силикагеле с использованием ступенчато увеличивающихся количеств МеОН, проводя элюирование смесью 3,5% МеОН с СН 2 Сl2 (Выход 2,7 г).(R)-9-[2-(Стеароилоксиметил)-4-(трет.бутилдифенилсилилокси)бутил]гуанин (2,7 г,3,56 ммоля) растворяли в сухом ТГФ (30 мл) и в раствор добавляли систему фтористый водородпиридин (1,5 мл). Реакционную смесь выдерживали при 4 С в течение ночи и за ходом реакции следили методом ТСХ. В ходе реакции достигалась конверсия 80%. Вводили дополнительное количество HF-пиридин (0,75 мл). Через 4 ч методом ТСХ было установлено израсходование исходного материала. Реакционную смесь концентрировали в вакууме без повышения температуры, добавляли пиридин (5 мл) и вновь проводили выпаривание. Продукт реакции выделяли методом колоночной хроматографии на силикагеле (Выход 1,26 г).(R)-9-[4-Гидрокси-2-стеароилоксиметил) бутил]гуанин (135 мг, 0,26 ммоля) и N-BOC-Lизолейцин (180 мг, 0,78 ммоля) дважды совместно выпаривали с сухим ДМФ и растворяли в этом же растворителе (3,5 мл). К раствору добавляли 1,3-дициклогексилкарбодиимид (160 мг, 0,78 ммоля) и 4-диметиламинопиридин (4,8 мг, 0,039 ммоля). Через 18 ч, реакционную смесь фильтровали через целит и обрабатывали традиционным способом. Целевой продукт выделяли методом колоночной хроматографии на силикагеле, проводя элюирование смесью 5% МеОН в СН 2 Сl2 (Выход 160 мг).(150 мг,0,205 ммоля) со стадии d) обрабатывали трифторуксусной кислотой (3 мл) при 0 С в течение 20 мин. Раствор выпаривали в вакууме. Полученный остаток дважды совместно выпаривали с толуолом и в течение нескольких часов выдерживали в вакууме. Полученный остаток растворяли в МеОН (2 мл) и выпаривали с получением трифторацетатной соли в виде стеклоподобного продукта (выход 191 мг). Спектр 1H ЯМР (DMCO-d6 + D2O)8,35(с, 1 Н, основание), 4,21 (т, 2 Н, Н-4), 4,10 (д, 2 Н),3,96 (д, 2 Н), 3,90 (д, 1 Н, изолейцин), 2,48 (м, 1 Н,Н-2), 2,15 (2 Н, стеароил), 1,85 (м, 1 Н, изолейцин), 1,68 (м, 4 Н), 1,48 (м, 4 Н), 1,68 (м, 28 Н),0,81 (м, 9 Н). Пример 8. (R)-9-[2-(Деканоилоксиметил)4-(L-изолейцилокси)бутил]гуанин. Целевое соединение получали в виде бистрифторацетильной соли по способу, аналогичному описанному в примере 7, используя дека 31 ноилхлорид вместо стеароилхлорида на стадии(с, 12 Н), 0,84 (м, 9 Н). Пример 9. (R)-9-[4-(L-Изолейцилокси)-2(миристоилоксиметил)бутил]гуанин. Целевое соединение получали в виде бистрифторацетильной соли по способу, аналогичному описанному для примера 1, с использованием N-BOC-L-изолейцина вместо N-BOCвалина на стадии а) и миристоилхлорида на стадии b). Спектр 1H ЯМР (DMCO-d6):10,99 (с,1 Н), 8,34 (широкий с, 3 Н), 8,15 (с, 1 Н), 6,67(м, 3 Н), 2,48 (м, 1 Н), 2,20 (т, 2 Н), 1,85 (м, 1 Н),1,65 (м, 2 Н), 1,41 (м, 4 Н), 1,23 (с, 20 Н), 0,85 (м,9 Н). Пример 10. (R)-9-[2-(4-Ацетилбутирилоксиметил-4-(L-валилокси)бутил]гуанин. Целевое соединение получали в виде бистрифторацетатной соли по способу, аналогичному способу примера 1, но с использованием на стадии b) ДСС/ДМАР условий примера 1, стадия а) совместно с 4-ацетилмасляной кислотой вместо N-трет.-Вос-L-валина. Спектр 1H ЯМР (250 МГц, DMCO-d6):1,05 (дд, 6 Н), 1,77 (м, 4 Н), 2,19 (с, 3 Н), 2,24 (м,1 Н), 2,36 (т, 2 Н), 2,44-2,60 (м, 3 Н), 3,96-4,20 (м,5 Н), 4,36 (м, 2 Н), 6,8 (широкий с, 2 Н), 8,3 (широкий с, 1 Н), 8,5 (широкий с, 3 Н), 11,1 (широкий с, 1 Н). Пример 11. (R)-9-[2-Додеканоилоксиметил-4-(L-валилокси)бутил]гуанин. Целевое соединение получали в виде бистрифторацетатной соли по способу, аналогичному способу примера 1, с использованием на стадии b) додеканоилхлорида вместо стеароилхлорида. Пример 12. (R)-9-[2-Пальмитоилоксиметил-4-(L-валилокси)бутил]гуанин. Целевое соединение получали в виде бистрифторацетатной соли по способу, аналогичному способу примера 1, с использованием пальмитоилхлорида вместо стеароилхлорида на стадии b). Спектр 1H ЯМР (250 МГц, DMCO-d6):0,97 (т, 3 Н), 1,05 (м, 6 Н), 1,35 (широкий с, 24 Н),1,58 (м, 2 Н), 1,78 (м, 2 Н), 2,25 (м, 1 Н), 2,35 (т,2 Н), 2,51 (м, 1 Н), 3,97-4,18 (м, 5 Н), 4,35 (т, 2 Н),6,7 (широкий с, 2 Н), 8,1 (широкий с, 1 Н), 8,5(R)-2-Амино-9-[2-стеароилоксиметил-4-(L-валилокси)бутил]пурин. Этот пример иллюстрирует деоксигенирование группы R1. 32 а) (R)-2-Амино-9-[2-стеароилоксиметил-4(N-трет.-бутоксикарбонил-L-валилокси)бутил]6-хлорпурин. К раствору (R)-9-[2-стеароилоксиметил-4(N-трет.-бутоксикарбонил-L-валилокси)бутил] гуанина со стадии 2 примера 1 (646 мг, 0,9 ммоля) в ацетонитриле добавляли тетраметиламмонийхлорид (427 мг, 2,7 ммоля), N,Nдиэтиланилин (0,716 мл, 4,5 ммоля) и оксихлорид фосфора (0,417 мл, 4,5 ммоля). Реакцию проводили в условиях дефлегмации и за ее ходом следили методом ТСХ. Через 3 ч реакционную смесь выпаривали в вакууме и остаток растворяли в дихлорметане, затем переливали в холодный водный раствор бикарбоната натрия. Органическую фазу выпаривали и очищали методом колоночной хроматографии на силикагеле. Выход: 251 мг. Спектр 1H ЯМР (CDCl3):7,76 (1H, H-8),5,43 (широкий, 2 Н, NH2), 4,45-4,00 (м, 7 Н), 2,53b) (R)-2-Амино-9-[2-стеароилоксиметил-4(N-трет.-бутоксикарбонил-L-валилокси)бутил] пурин. К раствору (R)-2-амино-9-[2-стеароилоксиметил-4-[N-трет.-бутоксикарбонил-L-валилокси)бутил]-6-хлорпурина (240 мг, 0,33 ммоля) в смеси метанол/этилацетат (6 мл, 3:1 об./об.) добавляли формиат аммония (105 мг, 1,65 ммоля) и 10% палладия на угле (15 мг). Реакционную смесь выдерживали в условиях дефлегмации в течение 1 ч, снова загружали формиат аммония(70 мг). Еще через час, в соответствии с данными ТСХ было установлено, что реакция завершена и полученную смесь фильтровали через целит и интенсивно промывали этанолом. Фильтрат выпаривали и очищали на колонке с силикагелем. Выход: 193 мг. Спектр 1H ЯМР (СDСl3):8,69 (синглет,1 Н, Н-6), 7,74 (с, 1 Н, Н-8), 5,18 (широкий с, 2 Н,NН 2), 4,45-4,01 (м, 7 Н), 2,55 (м, 1 Н), 2,28 (т, 2 Н),2,10 (м, 1 Н), 1,75 (м, 2 Н), 1,60 (м, 2 Н), 1,43 (с,9 Н), 1,25 (с, 28 Н), 0,96 (д, 3 Н), 0,87 (м, 6 Н).(R)-2-Амино-9-[2-Стеароилоксиметил-4(N-трет.-бутоксикарбонил-L-валилокси)бутил] пурин (180 мг, 0,26 ммоля) обрабатывали трифторуксусной кислотой (5 мл) при 0 С в течение 40 мин. Затем смесь выпаривали в вакууме и последовательно совместно выпаривали с толуолом и метанолом. Остаток сушили вымораживанием в течение ночи с получением 195 мг желаемого продукта. Спектр 1H ЯМР (DMCO-d6):8,78 (с, 1 Н,Н-6), 8,32 (широкая, 3 Н), 8,29 (с, 1 Н, Н-8), 4,27 Трет.-бутилат калия (141,8 г, 1,11 экв.) растворяли в сухом ДМФ (1 л). В течение 5 минут добавляли диэтилмалонат (266 мл, 1,54 экв.). В течение 5 мин добавляли диэтилацеталь бромацетальдегида (172 мл, 1,14 моля). Смесь нагревали до 120 С (внутренняя температура) и перемешивали при 120 С в течение 5 ч. Полученной смеси давали охлаждаться до комнатной температуры, переливали в воду (5 л) и экстрагировали метил-трет.-бутиловым эфиром(МТВЕ, 3 х 600 мл). Органический раствор сушили над MgSO4, фильтровали, концентрировали и перегоняли (0,5 мм, 95-140 С) с получением желаемого диэфира (244 г, 78%) в виде бесцветного масла. Спектр 1H ЯМР (СDСl3):1,19 (т, 6 Н),1,28 (т, 6 Н), 2,22 (дд, 2 Н), 3,49 (м, 2 Н), 3,51 (т,1 Н), 3,65 (м, 2 Н), 4,20 (квадруплет, 4 Н), 4,54 (т,1 Н).LiBH4 (торговый раствор, 2 М в ТГФ, 22,5 мл) и продукт со стадии а) примера 14 (5 г в 15 мл ТГФ, 18,1 ммоля) объединяли друг с другом,нагревали до 60 С и перемешивали при 60 С в течение 4 ч. Реакционной смеси давали охлаждаться до комнатной температуры и реакционный сосуд помещали в баню с холодной водой. Затем триэтаноламин (5,97 мл, 1 экв.) добавляли с такой скоростью, чтобы температура реакционной смеси поддерживалась в интервале 2025 С. Рассол (17,5 мл) добавляли с такой скоростью, которая позволяла регулировать газовыделение и полученную смесь перемешивали в течение 45 мин при комнатной температуре. Происходило расслаивание системы, и органический слой промывали рассолом (2 х 15 мл). Объединенные промывки рассолом экстрагировали МТВЕ (метил-трет.-бутиловым эфиром, 3 х 20 мл). Объединенные органические экстракты выпаривали и остаток растворяли в МТВЕ (50 мл) и промывали рассолом (25 мл). Слой рассола подвергали обратной экстракции МТВЕ (3 х 25 мл). Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали с получением желаемого диола (3,36 г,15,5 ммоля, 97%) в виде бесцветного масла. Спектр 1H ЯМР (СDСl3)1,22 (т, 6 Н), 1,73 В 1-горлую круглодонную колбу объемом 10 мл загружали продукт со стадии b) примера 14 (3,84 г, 20 ммолей), после чего добавляли винил ацетат (2,6 г, 30 ммолей) и наконец Липазу PS 30 (69 мг, полученную от Amano,Lombard, Illinois). Смесь перемешивали при температуре окружающего воздуха в течение 16 ч. За ходом реакции внимательно следили методом ТСХ (2/1 гексан -EtOAc; окрашивание Се 2(SO4)3 и обугливание на горячей пластинке;r.f. диола - 0,1, моноацетата - 0,3, бис ацетата 0,75). Реакционную смесь разбавляли CH2Cl2 и фильтровали через 5-микронный фильтр. Фильтр промывали дополнительным количеством CH2Cl2. Затем фильтрат концентрировали в вакууме с получением желаемого продукта. В 1-горлую круглодонную колбу емкостью 100 мл, снабженную магнитной мешалкой и мембраной, в атмосфере азота загружали сырой продукт со стадии с) примера 14 (4,62 г, 19 ммолей), сухой CH2Cl2 (20 мл) и Et3N (5,62 мл,40 ммолей). К полученному раствору добавляли хлористый тозил (4,76 г, 25 ммолей). Полученную в результате смесь перемешивали при температуре окружающего воздуха в течение 4 ч. Загружали Н 2 О (0,27 г, 15 ммолей) и смесь интенсивно перемешивали в течение 4 ч. Реакционную смесь разбавляли 80 мл EtOAc и 50 мл Н 2 О и водный слой отделяли. К органическому слою добавляли 75 мл 5% водного раствора КН 2 РO4. После перемешивания и разделения слоев, водный слой отбрасывали. Органический слой промывали 50 мл насыщенного раствораNаНСО 3, сушили над Na2SO4, фильтровали и концентрировали в вакууме до постоянного веса, в результате чего получали 7,40 г желаемого продукта. Спектр 1H ЯМР (СDСl3)1,17 (т, 6 Н), 1,62 В 1-горлую круглодонную колбу емкостью 50 мл загружали продукт со стадии d) примера 35 14 (3,88 г, 10 ммолей), безводный ДМФ (20 мл),2-амино-4-хлорпурин (2,125 г 12,5 ммоля) и К 2 СО 3 (4,83 г). Полученную в результате суспензию перемешивали при 40 С в атмосфере N2 в течение 20 ч. Смесь концентрировали для удаления большей части ДМФ на роторном испарителе. Остаток разбавляли EtOAc (50 мл) и Н 2O (50 мл). Реакционную смесь переносили в делительную воронку, встряхивали и отделяли водный слой. Водный слой экстрагировалиEtOAc (25 мл). Органические слои объединяли и промывали 5% КН 2 РO4 (75 мл). Органический слой отделяли и промывали Н 2 О (75 мл), рассолом (75 мл), сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением 3,95 г сырого продукта. Этот сырой продукт суспендировали с 40 мл метил-трет.-бутилового эфира. Полученную смесь перемешивали в течение ночи при 4 С и фильтровали. Фильтрат концентрировали с получением 3,35 г продукта в виде масла (содержащего 2,6 г целевого продукта в соответствии с данными HPLC анализа). 300 МГц 1H ЯМР (СDСl3)1,19 (м, 6 Н),1,69 (2 Н), 1,79 (с, 1 Н), 2,03 (с, 3 Н), 2,52 (м, 1 Н),3,48 (м, 2 Н), 3,62 (м, 2 Н), 4,04 (м, 2 Н), 4,16 (м,2 Н), 4,61 (т, 1 Н), 5,12 (широкий с, 2 Н), 7,81 (с,1 Н).(Bn = бензил). В 1-горлую круглодонную колбу емкостью 500 мл загружали бензиловый спирт (136 мл) смесь охлаждали до 0 С после чего порциями добавляли КО-трет.-Вu (36 г, 321 ммоль). Смеси давали нагреваться до 40 С и в течение 20 мин смесь перемешивали. К полученной смеси при 0 С добавляли сырой продукт со стадии е) примера 14 (24,7 г, 64,2 ммоля),растворенный в 25 мл безводного ТГФ и бензиловый спирт (30 мл). Температуре давали медленно повышаться до 8 С за два часа. Реакционную смесь переливали в 500 мл льда и экстрагировали 500 мл МТВЕ. Органический слой промывали 250 мл рассола, сушили над Na2SО 4,фильтровали и концентрировали в вакууме с получением 193 г раствора целевого продукта в бензиловом спирте. В соответствии с даннымиHPLC анализа, было установлено, что раствор содержал 25,96 г целевого продукта. 300 МГц 1H ЯМР (CDCl3)1,22 (м, 6 Н),1,55 (2 Н), 2,18 (м, 1 Н), 3,15 (м, 1 Н), 3,40 (м, 1 Н),3,51 (м, 2 Н), 3,70 (м, 2 Н), 4,25 (м, 2 Н), 4,63 (т,1 Н), 4,90 (широкий с, 2 Н), 5,25 (м, 1 Н), 5,58 (с,2 Н), 7,35 (м, 3 Н), 7,51 (м, 2 Н), 7,72 (с, 1 Н). MS = В 1-горлую круглодонную колбу емкостью 100 мл загружали сырой продукт со стадии f) Примера 14 (9,65 г раствора в бензиловом спирте содержащего 1,30 г, 3,13 ммоля продукта стадии f) примера 14 (растворенного в абсолютированном EtOH (20 мл). К раствору добавляли 0,45 г 10% Pd/C, суспендированного в 5 мл абсолютированного EtOH. Реакционную колбу откачивали и, из баллона с водородом, трижды заполняли H2. В реакционной колбе создавали давление Н 2, равное 1 атм., и реакционную смесь перемешивали в течение ночи. Реакционную смесь фильтровали через слой диатомовой земли для удаления Pd/C. Летучие продукты удаляли в вакууме. Остаток смешивали с 25 мл изопропилацетата и затем концентрировали в вакууме. Остаток разбавляли EtOAc (10 мл),вводили затравку целевого продукта, нагревали до дефлегмации и затем добавляли СН 3 СN (2 мл) и МТВЕ (35 мл). Затем полученную смесь перемешивали в течение 30 мин. Осадок отфильтровывали и сушили до постоянного веса, с получением 600 мг целевого продукта. 300 МГц 1H ЯМР (d6-DMSO)1,16 (м,6 Н), 1,45 (м, 1 Н), 1,61 (м, 1 Н), 2,16 (м, 1 Н), 3,45 В 1-горлую круглодонную колбу емкостью 25 мл загружали продукт со стадии g) примера 14 (0,650 г, 2,0 ммоля), пиридин (4 мл) и CH2Cl2(2 мл), ДМАР (10 мг). Полученную смесь охлаждали до -5 С и в течение 5 мин добавляли стеароилхлорид (790 мг, 2,6 ммоля), растворенный в CH2Cl2 (0,5 мл). Полученную в результате смесь перемешивали в течение 16 ч при -5 С. Добавляли абсолютированный этанол (0,138 г,3,0 ммоля) и смесь перемешивали еще в течение 1 ч. Затем реакционную смесь концентрировали в вакууме. К остатку добавляли толуол (30 мл) и затем смесь концентрировали в вакууме. К полученному остатку снова добавляли толуол (30 мл) и смесь концентрировали в вакууме. К полученному остатку добавляли 1% КН 2 РO4 (25 мл) и эту смесь экстрагировали CH2Cl2 (60 мл). Органический слой отделяли и сушили надNa2SO4, фильтровали и концентрировали в вакууме до постоянного веса 1,65 г. Сырой про 37 дукт подвергали хроматографической очистке на 40 г SiO2, проводя элюирование смесьюCH2Cl2-EtOH в соотношении 95/5, в результате чего получали 367 мг целевого продукта. 300 МГц 1H ЯМР (CDCl3)0,89 (т, 3 Н),1,26 (м, 30 Н), 1,65 (м, 3 Н), 2,32 (м, 1 Н), 3,45 (м,1 Н), 3,60 (м, 2 Н), 4,08 (м, 2 Н), 4,60 (м, 1 Н), 6,0 В 1-горлую круглодонную колбу емкостью 25 мл загружали продукт со стадии h) примера 14 (0,234 г, 0,394 ммоля), растворенный в ТГФ(1,7 мл). В этот раствор добавляли трифликовую кислоту (0,108 г) в 180 мг Н 2 О. Полученную смесь перемешивали в течение ночи при комнатной температуре. К реакционной смеси добавляли насыщенный раствор NаНСО 3 (10 мл),ТГФ (5 мл), СН 2 Сl2 (2 мл) и NaBH4 (0,10 г). Смесь перемешивали в течение 30 мин. К реакционной смеси добавляли 5% раствор КН 2 РO4(30 мл). Полученную смесь экстрагировали 2 х 15 мл СН 2 Сl2. Органические слои объединяли и сушили над Na2SO4, фильтровали и концентрировали в вакууме до постоянного веса 207 мг. Полученный материал перекристаллизовывали из EtOAc (8 мл) и СН 3 СN (0,5 мл) с получением 173 мг целевого продукта. 300 МГц 1H ЯМР (d6-DMSO)0,82 (т, 3 Н),1,19 (м, 30 Н), 1,41 (м, 4 Н), 2,19 (т, 2 Н), 2,32 (м,1 Н), 3,40 (м, 2 Н), 3,9 (м, 4 Н), 4,49 (м, 1 Н), 6,4(R)-9-[2-(Стеароилоксиметил)-4-(трет.бутилдифенилсилилокси)бутил]гуанин (45 г) и ТГФ (950 мл) смешивали в 2 л колбе. Затем добавляли Boc-L-валин (3,22 г, 0,25 экв.), после чего в течение 10 мин добавляли фтористый тетрабутиламмоний (1 М в ТГФ, 89,05 мл). Прозрачную реакционную смесь перемешивали при комнатной температуре в течение 2 ч 50 мин,следя за ходом реакции с помощью ТСХ (90/10CH2Cl2/MeOH). В реакционную смесь добавляли Boc-Lвалин (35,43 г, 2,75 экв.), ДСС (36,67 г. 2,75 экв.) и диметиламинопиридин (1,1 г, 0,15 экв.) в ТГФ(25 мл). Реакционную смесь перемешивали при комнатной температуре в течение 24 ч. ДСУ отфильтровывали и промывали СН 2 Сl2. Фильтрат концентрировали и остаток переносили в 2 лCH2Cl2 и промывали 2 л насыщенного раствора бикарбоната натрия и рассола, взятыми в соотношении 1:2. В результате сушки и выпаривания получали примерно 100 г сырого продукта. 38 Этот материал очищали методом хроматографии на оксиде кремния (6000 мл оксида кремния) с использованием от 3% MeOH/CH2Cl2 до 5% MeOH/CH2Cl2 с получением 38,22 мг целевого продукта. Пример 16. Альтернативное получение(6,4 кг) загружали в выпарной аппарат Bucchi и смесь нагревали для растворения твердого вещества. Раствор концентрировали досуха в вакууме при температуре не выше 90 С. Полученный в результате порошок переносили в 22 литровую колбу, снабженную мешалкой, капельной воронкой и датчиком температуры. Последовательно добавлялиN,Nдиметилформамид (1,7 кг) и пиридин (3,53 кг). Полученную в результате суспензию охлаждали до -10 С в атмосфере азота и перемешивали при-55 С, прикапывая при этом трет.-бутилхлордифенилсилан (684 г, 2,49 моля). Полученную в результате смесь перемешивали при -55 С до завершения реакции (о чем судили по данным ТСХ (метиленхлорид/метанол, 10:1) и HPLC(колонка 4,6 х 250 мм Zorbax RxC8 (5 микрон); 60:40 ацетонитрил -водн.NН 4OАс (0,05 М) при скорости 1,5 мл/мин; УФ-детекция при 254 нм). Добавляли воду (16 кг) и смесь перемешивали в течение 30 мин для осаждения продукта, после чего смесь охлаждали до 0 С в течение 30 мин. Твердое вещество выделяли фильтрацией и продукт на фильтре промывали холодной водой и сушили с отсосом воздуха с получением сырого продукта в виде белого твердого вещества. Сырое твердое вещество переносили в пиридин(3 кг) и концентрировали в вакууме при 60 С для удаления воды. Сухой твердый остаток суспендировали с метанолом (10 кг) при 60 С в течение 1-2 ч и фильтровали в горячем состоянии. Фильтрат концентрировали в вакууме и твердый остаток подвергали дефлегмации с изопропилацетатом (7 кг) в течение 30 мин. Полученную смесь охлаждали до 20 С и фильтровали. Осадок на фильтре сушили в вакууме при 50 С с получением целевого соединения в виде белого твердого вещества (555 г).b) (R)-9-[2-(Стеароилоксиметил)-4-(трет.бутилдифенилсилилокси)бутил]гуанин. Продукт со стадии а) примера 16 (555 г,1,113 моля) загружали в 50-литровый выпарной аппарат Buchi. Прикапывали пиридин (2,7 кг) для растворения твердого вещества и полученную смесь перегоняли досуха в вакууме при 60 С. Остаток переносили в свежий пиридин(2,7 кг) и смесь переносили в 22-литровую колбу, снабженную мешалкой, капельной воронкой и датчиком температуры. Полученный раствор охлаждали до -5 С в атмосфере азота. Раствор стеароилхлорида (440 г, 1,45 моля) в хлористом 39 метилене (1,5 кг) добавляли таким образом,чтобы поддерживать температуру ниже 0 С. Добавляли 4-(N,N-диметиламино)пиридин (15 г,0,12 моля) и полученную смесь перемешивали при -5-0 С в течение 2-4 ч до завершения конверсии (о чем судили по данным ТСХ (10:1 метиленхлорид/метанол) и HPLC (колонка 4,6 х 250 мм Zorbax RxC8 (5 микрон); 60:40 ацетонитрил - водн. NH4OAс (0,05 М) при скорости 1,5 мл/мин; УФ-детекция при 254 нм. К концу реакции добавляли ацетонитрил (8,7 кг) и смесь перемешивали в течение не менее 15 мин с целью осаждения продукта. Суспензию охлаждали до 0 С в течение 2 ч и твердое вещество выделяли фильтрацией, а осадок на фильтре промывали ацетонитрилом (2 кг). Целевой продукт получали в виде белого твердого вещества (775 г). с)(R)-9-[4-Гидрокси-2-(стеароилоксиметил)бутил]гуанин. Раствор продукта со стадии b) примера 16(765 г, 0,29 моля) в тетрагидрофуране (10 кг) готовили в реакторе. Добавляли раствор тетра(н-бутил)аммонийфторида в тетрагидрофуране (1,7 кг 1 М раствора, 1,7 моля) и полученный в результате прозрачный раствор перемешивали при 205 С в течение 4 ч. Добавляли воду (32 кг) и полученную в результате суспензию перемешивали в течение 1 ч и затем охлаждали до 0 С в течение 30 мин. Осадок выделяли фильтрацией и осадок на фильтре последовательно промывали водой (10 кг) и ацетонитрилом (5 кг). После сушки в вакууме при 25 С получали 702 г сырого продукта. Сырой продукт растворяли в ТГФ (4,2 кг) и воде (160 г), в условиях дефлегмации, затем охлаждали до 40 С и обрабатывали хлористым метиленом (14,5 кг). Смеси давали охлаждаться до 225 С в течение 1 ч,затем ее охлаждали до 55 С в течение 1 ч с целью завершения осаждения. Слегка окрашенный порошок выделяли фильтрацией и сушили в вакууме при 40 С с получением целевого продукта (416 г).d) (R)-9-[4-(N-Cbz-L-валилокси)-2-(стеароилоксиметил)бутил]гуанин. Раствор N-Cbz-L-валина (169 г, 0,67 моля) в сухом ТГФ (750 мл) готовили в 2-х литровой колбе, снабженной механической мешалкой,термометром и капельной воронкой. В течение 5 мин добавляли раствор дициклогексилкарбодиимида (69,3 г, 0,34 моля) в ТГФ (250 мл) и полученную в результате суспензию перемешивали при 205 С в течение 2 ч. Суспензию фильтровали и осадок на фильтре промывали ТГФ (300 мл). Фильтрат и промывные жидкости загружали в 3-литровую колбу, снабженную мешалкой и термометром. Продукт стадии с) примера 16 (116 г, 0,22 моля) добавляли в виде твердого вещества, споласкивая реактор ТГФ(250 мл). Добавляли 4-(N,N-диметиламино) пиридин (2,73 г, 0,022 моля) и белый шламм перемешивали при 205 С. За 15 мин твердые веще 001404 40 ства полностью растворялись и реакция завершалась за 1 ч (о чем судили по данным HPLC: колонка 4,6 х 250 мм Zorbax RxC8; 85:15 ацетонитрил - 0,2% вод. НСlO4, добавление со скоростью 1 мл/мин; УФ детекция при 254 нм; исходный материал элюирует через 4,1 мин, а продукт реакции - через 5,9 мин). Реакцию гасили добавлением воды (5 мл) и полученный раствор концентрировали в вакууме, в результате чего оставалось светло-желтое полутвердое вещество. Это вещество переносили в метанол (1,5 л) и нагревали до начала дефлегмации в течение 30 мин. Полученный раствор охлаждали до 25 С и осадок удаляли фильтрацией. Фильтрат концентрировали в вакууме, в результате чего оставалось вязкое, бледно-желтое масло. Добавляли ацетонитрил (1 л) и полученную в результате белую суспензию перемешивали при 205 С в течение 90 мин. Сырой твердый продукт выделяли фильтрацией, промывали ацетонитрилом(2 х 100 мл) и сушили на воздухе в течение ночи с получением желаемого продукта в виде воскообразного липкого твердого вещества (122 г). Это вещество очищали перекристаллизацией из этилацетата (500 мл) и сушили в вакууме при 30 С с получением целевого продукта в виде белого, воскообразного твердого вещества (104 г). е) (R)-9-[4-(L-валилокси)-2-(стеароилоксиметил)бутил]гуанин. Раствор со стадии примера 16 (77 г) в теплом (40 С) этаноле (2,3 л) загружали в реактор гидрирования совместно с 5% Pd-C (15,4 г). Полученную смесь перемешивали при 40 С при давлении водорода 40 фунтов/дюйм 2 (2,8 кг/см 2) в течение 4 ч, откачивали и гидрировали еще в течение 4-10 ч. Катализатор удаляли фильтрацией и фильтрат концентрировали в вакууме с целью удаления белого твердого вещества. Это вещество перемешивали с этанолом (385 мл) при 45 С в течение 1 ч, затем охлаждали до 0 С и фильтровали. Осадок на фильтре сушили воздухом, затем в вакууме при 35 С с получением целевого соединения в виде белого порошка (46 г). Пример 17.H2G (506 мг; 2,0 ммоля) растворяли в сухом N,N-диметилформамиде (40 мл) в присутствии пиридина (400 мг; 5,06 ммоля) и 4 диметиламинопиридина (60 мг; 0,49 ммоля). Добавляли стеароилхлорид (1500 мг; 4,95 ммоля) и смесь выдерживали в течение ночи при комнатной температуре. Большую часть растворителя выпаривали в вакууме, остаток перемешивали с 70 мл этилацетата и 70 мл воды, и твердое вещество отфильтровывали, промывали этилацетатом и водой и сушили с получением 680 мг сырого продукта. В результате хромато 41 графической очистки методом колоночной хроматографии на силикагеле (хлороформ:метанол 15:1) получали чистое целевое соединение в виде белого твердого вещества. Спектр 1H ЯМР (DMSO-d6) : 0,86 (т, 3 Н),1,25 (с, 28 Н), 1,51 (квинтет, 2 Н), 1,62 (м, 2 Н),2,06 (м, 1 Н), 2,23 (т, 2 Н), 3,34 (д, 2 Н), 3,96b) (R)-9-[2-(N-Boc-L-валилоксиметил)-4(стеароилокси)бутил]гуанин. Смесь N-Boc-L-валина (528 мг; 2,1 ммоля) и N,N'-дициклогексилкарбодиимида (250 мг; 1,21 мг) в дихлорметане (20 мл) перемешивали в течение ночи при комнатной температуре, дициклогексилмочевину отфильтровывали и экстрагировали небольшим объемом дихлорметана,и фильтрат выпаривали в вакууме до небольшого объема. Добавляли (R)-9-[2-гидроксиметил-4(стеароилокси)бутил]гуанин (340 мг; 0,654 ммоля), 4-диметиламинопиридин (25 мг; 0,205 ммоля) и сухой N,N-диметилформамид (15 мл) и полученную смесь перемешивали в течение 4 ч при 50 С в атмосфере азота. Растворитель выпаривали в вакууме до небольшого объема. В результате колоночной хроматографии на силикагеле, и затем на оксиде алюминия (элюент этилацетат : метанол : вода в соотношении 15:2:1) получали 185 мг (39%) чистого целевого соединения в виде белого твердого вещества. Спектр 1H ЯМР (СНСl3) : 0,85-1,0 (м, 9 Н) 18-СН 3, СН(СН 3)2; 1,25 (с, 28 Н) 4-17-СН 2; 1,44(180 мг; 0,25 ммоля) и полученный раствор выдерживали при комнатной температуре в течение 1 ч, выпаривали до небольшого объема и дважды лиофилизировали с диоксаном до полу 001404 42 чения белого аморфного порошка. Выход целевого соединения, полученного в трифторацетатной соли, был количественным. Спектр 1H ЯМР (DMSO-d6) : 0,87 (т, 3 Н) 18-СН 3, 0,98 (дд, 6 Н) СН(СН 3)2; 1,25 (с, 28 Н) 417-CH2; 1,50 (квинтет, 2 Н) 3-СН 2; 1,68 (кв, 2 Н) 3'-СН 2; 2,19 (м, 1 Н) 2'-СН; 2,26 (т, 2 Н) 2-СН 2; 2,40 (м, 1 Н) СН(СН 3)2; 3,9-4,25 (м, 7 Н) Cl'-CH2,C2"-CH2, C4-CH2, СН; 6,5 (широкий с, 2 Н) гyaNH2; 7,79 (с, 1 Н) гуаН 8; 8,37 (широкий с, 3 Н)H2G (7,60 г, 30 ммоля) нагревали в растворе сухого ДМФ (200 мл). Раствор фильтровали с целью удаления твердых примесей, охлаждали до 20 С (H2G кристаллизовался) и перемешивали при той же температуре при добавлении пиридина (9,0 г, 114 ммоля), 4-диметиламинопиридина (0,46 г, 3,75 ммоля) и последующего, медленного, добавления стеароилхлорида (20,0 г, 66 ммоля). Перемешивание продолжали при комнатной температуре в течение ночи. Затем большую часть растворителя выпаривали в вакууме, остаток перемешивали с 200 мл этилацетата и 200 мл воды, и твердое вещество отфильтровывали, промывали этил ацетатом и водой и сушили с получением сырого продукта. В качестве альтернативы перекристаллизации, сырой продукт кратковременно нагревали почти до кипения со 100 мл смеси этилацетат:метанол:вода (15:2:1) и суспензию медленно охлаждали до 30 С и отфильтровывали в результате чего в растворе оставалось основное количество 2"-изомера (2"-изомер кристаллизуется при более низкой температуре). Процедуру экстракции повторяли еще раз с получением, после сушки в вакууме, 6,57 г (42%) почти не содержащего изомеров продукта. Пример 19. Получение кристаллического(R)-9-[2-стеароилоксиметил)-4-(L-валилокси) бутил]гуанина. Продукт со стадии с) примера 16 (20,07 г,32,5 ммоля) растворяли в абсолютированном этаноле (400 мл) при нагревании, затем фильтровали, и дополнительно разбавляли этанолом(117,5 мл). К такому раствор добавляли воду(HPLC сорт, 103,5 мл) и смеси давали охлаждаться до 35-40 С. После охлаждения смеси,при эффективном перемешивании, с постоянной скоростью в течение 16 ч, добавляли воду(HPLC сорт, 931,5 мл). После добавления всей воды, перемешивание продолжали в течение 4 ч при комнатной температуре. Полученный в результате осадок фильтровали через бумагу и сушили в вакууме при комнатной температуре,с получением целевого соединения в виде белого, свободно-текучего кристаллического порошка (19,43 г, 97%), т.пл. 169-170 С. Пример 20. 9-R-(4-Гидрокси-2-(L-валилоксиметил)бутил)гуанин. а) К раствору 9-R-(4-трет.-бутилдифенилсилилокси)-2-(гидроксиметил)бутил)гуанина (695 мг, 1,5 ммоля) в ДМФ (30 мл) добавляли N-Boc-L-Валин (488 мг, 2,25 ммоля), 4 диметиламинопиридин (30 мг, 0,25 ммоля) и ДСС (556 мг, 2,7 ммоля). Через 16 ч в реакционную смесь снова загружали N-Boc-L-валин (244 мг) и ДСС (278 мг) и полученную смесь выдерживали еще в течение 5 ч. Реакционную смесь фильтровали через целит и переливали в водный раствор бикарбоната натрия, после чего раствор экстрагировали дихлорметаном. Органическую фазу выпаривали и очищали методом колоночной хроматографии на силикагеле, в результате чего получали 950 мг Nзащищенного моноаминоацильного интермедиата.b) Указанный выше интермедиат (520 мг,0,78 ммоля) растворяли в ТГФ (15 мл). К раствору добавляли фтористый водород в пиридине (70%/30%, 0,34 мл). Через два дня раствор выпаривали и совыпаривали с толуолом. В результате очистки методом колоночной хроматографии на силикагеле получали 311 мг защищенного моноаминоацильного соединения. Спектр 1H ЯМР (DMSO-d6):10,41 (с, 1 Н),7,59 (1 Н), 6,26 (широкий с, 2 Н) , 4,32 (т, 1 Н),3,95 (м, 5 Н), 3,46 (м, 2 Н), 2,41 (м, 1 Н), 2,06 (м,1 Н), 1,45 (м, 2 Н), 1,39 (с, 9 Н), 0,90 (д, 6 Н).c) Продукт со стадии b) (95 мг, 0,21 ммоля) обрабатывали смесью трифторуксусной кислоты (4 мл) и дихлорметана (6 мл) в течение 1 ч. Полученный раствор выпаривали и сушили вымораживанием, получая 125 мг незащищенного моноаминоацильного продукта. Спектр 1H ЯМР (D2O):8,88 (с, 1 Н), 4,32(61 мг, 0,6 ммоля) и ДСС (3,7 г, 18 ммолей). После проведения реакции в течение 16 ч при 0 С,снова загружали N-Boc-L-изолейцин (1,3 г) и ДСС (1,8 г) и реакцию продолжали в течение ночи при комнатной температуре. Реакционную смесь отфильтровывали через целит и фильтрат выпаривали и очищали методом колоночнойb) Интермедиат со стадии а) (100 мг, 0,21 ммоля) обрабатывали трифторуксусной кислотой (3 мл) и смесь выдерживали в течение 30 мин при 0 С. Полученный раствор выпаривали и сушили вымораживанием, в результате чего получали с количественным выходом целевой незащищенный моноаминоацильный продукт. Спектр 1H ЯМР (DMSO-d6 + D2O):8,72(с, 1 Н), 4,15 (м, 4 Н), 3,90 (д, 1 Н), 3,42 (м, 2 Н),2,09 (м, 1 Н), 1,83 (м, 1 Н), 1,61 (м, 2 Н), 1,15 (м,Н), 0,77 (д, 3 Н), 0,71 (т, 3 Н). Пример 22. (R)-9-[2-Гидроксиметил-4-(Lвалилокси)бутил]гуанидин. Продукт со стадии а) примера 1 подвергали реакции снятия защитной группы, с помощью трифторуксусной кислоты, следуя той же методике, что описана для стадии с) примера 1. Спектр 1H ЯМР (250 МГц, DMSO-d6):1,04 (дд, 6 Н), 1,55-1,88 (м, 2 Н), 2,21 (м, 2 Н), 3,48a) (R)-9-[4-(N-Boc-L-валилокси)-2-(N-BocL-валилоксиметил)бутил]гуанин. Следуя методике, описанной для стадии а) примера 1, но используя 2,7 эквивалентов, 0,28 эквивалента и 3,2 эквивалента N-Boc-L-валина,ДМАР и ДСС, соответственно, получали целевое соединение. Спектр 1H ЯМР (250 МГц, СНСl3) : 0,95b) (R)-9-[4-(L-Валилокси)-2-(L-валилоксиметил)бутил]гуанин. Целевое соединения получали в виде тристрифторацетатной соли из интермедиата со стадии а) примера 20, по реакции снятия защитной группы, которую проводили по методике, аналогичной описанной для стадии с) примера 1. Спектр 1H ЯМР (250 МГц, D2O) : 1,0 (м,12 Н), 1,89 (м, 2 Н), 2,29 (м, 2 Н), 2,62 (м, 1 Н), 4,02(дд, 2 Н), 4,38 (м, 6 Н), 4,89 (широкий с, около 10 Н), 8,98 (с, 1 Н). Пример 24. (R)-9-[4-гидрокси-2-(стеараоилоксиметил)бутил]гуанин. Целевой продукт получали в соответствии со стадиями а) - с) примера 7. Спектр 1H ЯМР (250 МГц, DMSO-d6),10,52 (с, 1 Н), 7,62 (с, 1 Н), 6,39 (с, 2 Н), 4,50 (т,1 Н), 3,93 (м, 4 Н), 3,42 (м, 2 Н), 2,45 (м, 1 Н), 2,23 45 Пример 25. (R)-9-[2-Гидроксиметил-4(стеароилокси)бутил]гуанин. Целевое соединение получали по методике стадии а) примера 17. Спектр 1H ЯМР (DMSO-d6) : 0,86 (т, 3 Н); 1,25 (с, 28 Н); 1,51 (квин., 2 Н); 1,62 (м, 2 Н); 2,06a) (R)-9-[4-N-бензилоксикарбонил-L-валилокси)-2-(гидроксиметил)бутил]гуанин. Сухой H2G (252 мг, 1 ммоль), 4 диметиламинопиридин (122 мг, 1 ммоль) и NCbz-L-валин п-нитрофениловый эфир (408 мг,1,1 ммоля) растворяли в сухом диметилформамиде (16 мл). После перемешивания при 23 С в течение 30 ч, органический растворитель удаляли и остаток тщательно очищали методом хроматографии (оксид кремния, 2%-7% метанол/метиленхлорид) с получением целевого продукта в виде белого твердого вещества (151 мг, 31%).b) (R)-9-[4-N-бензилоксикарбонил-L-валилокси)-2-(стеароилоксиметил)бутил]гуанин. Раствор стеароилхлорида (394 мг, 1,3 ммоля) в сухом метиленхлориде (2 мл) медленно прикапывали в атмосфере азота к раствору продукта со стадии а) (243 мг, 1 ммоль) и 4 диметиламинопиридина (20 мг) в сухом пиридине (5 мл) при -5 С. При этой температуре,реакционную смесь перемешивали в течение 12 ч. Добавляли метанол (5 мл) и реакционный раствор перемешивали в течение 1 ч. После удаления растворителя, остаток обрабатывали ацетонитрилом и подвергали хроматографической очистке (оксид кремния, 0-5% метанол/метиленхлорид) с получением целевого соединения (542 мг, 72%).c) (R)-9-[2-стеароилоксиметил)-4-(L-валилокси)бутил]гуанин. Продукт со стадии b) (490 мг, 1 ммоль) растворяли в метаноле (30 мл) и добавляли 5%Pd/C (100 мг). Баллон, заполненный водородом,помещали сверху реакционного сосуда. Через 6 ч при 23 С, методом ТСХ было установлено отсутствие исходного материала. Реакционную смесь фильтровали через 0,45 микроновую мембрану с целью удаления катализатора, а растворитель удаляли с получением целевого продукта в виде белого твердого вещества (350 мг, 99%),которое было идентично (по спектральным и аналитическим характеристикам) соединению примера 16. Пример 27. Альтернативное получение 46 творе NaOH (6,3 мл, 0,63 ммоля) при комнатной температуре. Через определенные интервалы времени отбирали аликвоты и их нейтрализовали 0,5N трифторуксусной кислотой. Аликвоты выпаривали и анализировали методом HPLC с целью слежения за ходом реакции. Через 4 ч 0,5N раствор трифторуксусной кислоты (1,26 мл,0,63 ммоля) добавляли к раствору и реакционную смесь выпаривали. Целевой продукт очищали методом HPLC (YMC, колонка 50 х 4,6 мм, градиент 0,1% ТФК + 0-50% 0,1% ТФК в ацетонитриле, анализ в течение 20 мин, УФ детекция при 254 нм. Выход: 13,6%. Спектр 1H ЯМР (D2O):8,81 (с, 1 Н), 4,36(R)-9-(2-гидроксиметил-4-(L-валилокси)бутил] гуанина. В результате разделения методом HPLC реакционного раствора из примера 27 получали целевое соединение с выходом 29,29%. Спектр 1H ЯМР (DMSO-d6):8,38 (с, 3 Н),8,26 (с, 1H), 6,83 (широкий с, 2 Н), 4,23 (м, 2 Н),4,06 (м, 2 Н), 3,91 (м, 1H), 3,40 (м, 2 Н), 2,19 (м,2 Н), 1,8-1,40 (м, 2 Н), 0,95 (дд, 6 Н). Пример 29. (R)-9-[(2-стеароилоксиметил)4-(L-валилокси)]-4-бутилгуанин моногидрохлорид. Продукт со стадии d) примера 16 (360 мг,0,479 ммоля) растворяли в смеси метанола (10 мл) и этилацетата (10 мл). К раствору добавляли 10% Pd/C (100 мг) и 1N HCl (520 мкл). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч при 1 атм. H2. Реакционную смесь фильтровали и растворитель выпаривали из фильтрата с получением целевого продукта в виде кристаллического твердого вещества (300 мг). Рецептурный пример А. Препарат в виде таблетки. Следующие ингредиенты просеивали через сито с размером отверстий 0,15 мм и перемешивали в сухом состоянии:(R)-9-[2-(Стеароилоксиметил)-4(L-валилокси)бутил]гуанин 10 г Лактоза 40 г Кристаллическая целлюлоза 49 г Стеарат магния 1 г Таблетировочную машину использовали для прессования смеси в таблетки, содержащие 250 мг активного ингредиента. Рецептурный пример В. Покрытая энтеросолюбильной оболочкой таблетка. Таблетки рецептурного примера А покрывали распылением в машине для нанесения покрытий раствором, содержащим: Этилцеллюлоза 120 г Пропиленгликоль 30 г Моноолеатасорбит 10 г в 1000 мл дистиллированной воды.(Methocell K15) 12 г Глактоза 4,5 г перемешивали в сухом состоянии и гранулировали с водной пастой повидона. Добавляли стеарат магния (0,5 г) и смесь прессовали в таблетировочной машине в таблетки диаметром 13 мм, содержащие 500 мг активного агента. Рецептурный пример D. Мягкие капсулы.(R)-9-[2-(стеароилоксиметил)-4(L-валилокси)бутил]гуанин 250 г Лецитин 100 г Арахисовое масло 100 г Соединение настоящего изобретения диспергировали в лецитине и арахисовом масле и заполняли полученной смесью мягкие желатиновые капсулы. Биологический пример 1. Тестирование на биодоступность на крысах. Биодоступность соединения настоящего изобретения сравнивали с родственным соединением H2G и производными H2G на крысиной модели. Соединения изобретения и родственные соединения применяли перорально (с помощью катетера вставленного в желудок) на группах из трех индивидуально взвешенных животных,получавших по 0,1 ммол/кг растворенного пролекарства в водном растворе (пример 4, 5, сравнительные примеры 1-3, 5, 8), на основе арахисового масла (сравнительные примеры 4, 9, 10) или пропиленгликолевом (примеры 1-3, 6-12,17, сравнительные примеры 6,7) носителе, в зависимости от растворимости активного ингредиента испытуемого соединения. Животных лишали питания в период от 5 ч до применения до, примерно, 17 ч после применения и держали в метаболических клетках. Мочу собирали в течение 24 ч после введения препарата и замораживали до анализа. H2G анализировали в моче с использованием HPLC/УФ анализа по методу Sthle, berg, Antimicrob Agents Chemother,362, 339-342 (1992), модифицированного следующим образом: образцы после оттаивания разбавляли в соотношении 1:100 дистиллированной Н 2 О и фильтровали через фильтр Амикон при центрифугировании со скоростью 3000 об./мин. в течение 10 мин. Дублированные 30 мкл образцы подвергали хроматографическому разделению на HPLколонке; Zorbax SB-C18; 754,6 мм; 3,5 микронов; подвижная фаза 0,05 МNH4PO4, 3-4% метанола, рН 3,3-3,5; 0,5 мл/мин; 254 нм, время удерживания H2G при концентрации МеОН 4% и рН 3,33-12,5 мин. Биодоступность рассчитывали, как измеренное H2G выделение из каждого животного, усредненное,по крайней мере, от трех животных и выражали как процент усредненного 24 часового выделения H2G из мочи от группы из 4 индивидуально 48 взвешенных крыс, соответственно, получавших внутривенные инъекции по 0,1 ммоль/кг H2G в буферном растворе Рингера, проводя анализ,как описано выше. Сравнительный пример 1 (H2G) относился к той же партии что использовалась для препаратов примеров 1-12. Препарат сравнительного примера 2 (моно Val-H2G) и 3 (ди Val-H2G) описаны в примерах 21 и 23. Вещество сравнительного примера 4 (дистеароил H2G) готовили диэтерификацией незащищенного H2G в условиях этерификации, сравнимых с условиями стадии 2 примера 1. Вещества сравнительных примеров 5 и 8 (Val/Ac H2G) получали аналогично описанному в примере 4, с использованием уксусного ангидрида в присутствии релевантного моновалинового H2G. Вещество сравнительного примера 6 (Ala/стеароил H2G) получали аналогично описанному для примера 6, с использованием N-трет.-Вос-L-аланина на стадии 4. Вещество сравнительного примера 7(Gly/деканоил) получали аналогично описанному в примере 5, но с использованием промежуточного соединения стадии 1, полученного в присутствии N-трет.-Boc-L-глицина. Получение соединения сравнительных примеров 9 и 10 продемонстрировано в примерах 24 и 25, соответственно. Полученные результаты приведены в следующей таблице 2. Соединение Сравнительный пример 1 Сравнительный пример 2 Сравнительный пример 3 Пример 1 Сравнительный пример 4 Пример 2 Пример 3 Пример 4 Сравнительный пример 5 Пример 5 Пример 6 Пример 7 Пример 8 Пример 9 Пример 10 Пример 11 Пример 12 Пример 17 Сравнительный пример 6 Сравнительный пример 7 Сравнительный пример 8 Сравнительный пример 9 Сравнительный пример 10 валил деканоил валил докозаноил изолейцил стеароил изолейцил деканоил изолейцил миристоил валил 4-ацетилбутирил валил додеканоил валил пальмитоил стеароил валил Сравнение биодоступности соединений изобретения со сравнительными примерами 49 показывает, что специфическая комбинация жирных кислот по R1/R2 с аминокислотами поR1/R2 обеспечивает значительно более высокие значения биодоступности, чем соответствующие диаминокислотный сложный эфир или сложный эфир двуосновной жирной кислоты. Так, например, в рамках такой модели, соединение примера 1 демонстрирует на 55% лучшую биодоступность, чем соответствующий дивалиновый сложный эфир сравнительного примера 3. Соединение примера 4 демонстрирует на 25% лучшую биодоступность, чем соответствующий дивалиновый эфир. Также совершенно очевидно, например, из Сравнительных примеров 5, 6 и 7, что только специальные жирные кислоты настоящего изобретения в комбинации с конкретными аминокислотами обеспечивают такое неожиданное увеличение фармакокинетических параметров. Биологический пример 2. Концентрации плазмы у крыс. Анализ концентрации плазмы проводили на самцах Sprague Dawley крыс. Животных лишали пищи в течение ночи перед введением препарата, но обеспечивали свободный доступ к воде. Каждое из испытуемых соединений готовили в виде раствора/суспензии в пропиленгликоле с концентрацией, соответствующей 10 мг Н 2G/мл и встряхивали при комнатной температуре в течение восьми часов. Группы крыс (по крайней мере, по 4 крысы в каждой группе) получали оральную дозу в 10 мг/кг (1 мл/кг) каждого из соединений; каждую дозировку применяли через желудочный зонд. Через определенные промежутки времени после приема дозы (через 0,25, 0,5, 1, 1,5, 2, 4, 6, 9, 12,15 и 24 ч после дозирования) из хвостовой вены каждого животного получали гепаринизированные образцы крови (0,4 мл/образец). Эти образцы крови немедленно охлаждали на бане со льдом. В течение двух часов сбора, плазму отделяли от эритроцитов центрифугированием и замораживали до последующего анализа. Интересущие компоненты отделяли от белков плазмы осаждением в ацетонитриле. После лиофилизации и реконструкции, концентрации плазмы определяли обратимо-фазной HPLC с флуоресцентной детекцией. Оральное поглощениеH2G и других испытуемых соединений определяли путем сравнения площади H2G под кривой для оральной дозировки с соответствующим значением, полученным при введении внутривенной дозы H2G в 10 мг/кг, которую применяли на отдельной группе крыс. Полученные результаты представлены в приведенной выше таблице 1 В. Биологический пример 3. Биоприменимость на обезьянах. Соединения примера 1 и сравнительного примера 3 (см. биологический пример 1, приведенный выше) применяли р.о. через желудоч 001404 50 ный зонд на обезьянах cynomolgus. Применяемые растворы содержали: пример 1- 150 мг растворенные в 6,0 пропиленгликоля, что соответствует 25 мг/кг или 0,0295 ммоль/кг; сравнительный пример 3 - 164 мг растворяли в 7,0 мл воды, что соответствует 23,4 мг/кг или 0,0295 ммоль/кг. Образцы крови отбирали через 30 мин, 1,2, 3, 4, 6, 10 и 24 ч. Плазму отделяли центрифугированием со скоростью 2500 об./мин. и образцы инактивировали при 54 С в течение 20 мин перед тем, как их замораживали до последующих анализов. Уровни содержания H2G в плазме регистрировали с помощью HPLC/УФ анализа, как описано выше в примере 30. На фиг. 1 изображено выделение H2G плазмы, как функция времени. Хотя невозможно сделать статистически значимые выводы из единичных опытов на животных, можно предположить, что животные, получившие соединение настоящего изобретения, испытывают, в некоторой степени, более быстрое и более сильное воздействие H2G, чем животные, на которых применяли альтернативное пролекарствоH2G. Биологический пример 4. Антивирусная активность. Мыши, зараженные вирусом-1 простого герпеса (HSV-1) служили моделью для определения эффективности антивирусных агентов invivo. На мышах внутрибрюшинно инокулированных HSV-1, при 1000-кратном значенииLD50, применяли рецептуру, содержащую выпускаемый в настоящее время антигерпесный агент ацикловир (21 и 83 мг/кг в 2% пропиленгликоля в носителе, представляющем собой стерильную воду трижды в день, перорально), или соединение примера 29 (21 и 83 мг/кг в 2% пропиленгликоля, в носителе, представляющем собой стерильную воду, трижды в день, перорально), в течение 5 последовательных дней, начиная применение через 5 дней после инокулирования. Ежедневно оценивали смертность животных. Полученные результаты изображены на фиг. 2, где представлена зависимость степени выживания от времени. В надписи к рисунку,соединение изобретения обозначено, как Ex.29,а ацикловир обозначен, как ACV. Процентное количество мышей, переживших заражениеHSV-1, оказалось значительно большим в случае применения на них данной дозировки соединения изобретения, по сравнению с применением эквивалентной дозы ацикловира. Представленный выше материал приведен только в целях иллюстрации и настоящее изобретение не ограничивается содержанием этого материала. Подразумевается, что различные варианты и изменения, которые очевидны для специалиста в данной области, охватываются объемом притязаний изобретения, как это отражено в прилагаемой формуле изобретения.R3 представляет собой ОН или Н; а также его фармацевтически приемлемые соли. 2. Соединение по п.1, в котором R1 представляет собой -С(O)СН(СН(СН 3)2)NН 2 или(R)-9-[2-(деканоилоксиметил)-4-(Lизолейцилокси)бутил]гуанина,(R)-9-[4-(L-изолейцилокси)-2(миристоилоксиметил)бутил]гуанина,(R)-9-[2-(4-ацетилбутирилоксиметил-4-(Lвалилокси)бутила,(R)-9-[2-додеканоилоксиметил-4-(Lвалилокси)бутил]гуанина,(R)-9-[2-пальмитоилоксиметил-4-(Lвалилокси)бутил]гуанина,(R)-2-амино-9-(2-стеароилоксиметил-4-(Lвалилокси)бутил]пурина,(R)-9-[2-(L-валилоксиметил)-4(стеароилокси)бутил]гуанина или фармацевтически приемлемой соли. 6.(R)-9-[2-(Стеароилоксиметил)-4-(Lвалилокси)бутил]гуанин или его фармацевтически приемлемая соль. 8. Фармацевтическая композиция, содержащая соединение по п.1 совместно с фармацевтически приемлемым носителем или разбавителем. 9. Фармацевтическая композиция, содержащая соединение по п.5, совместно с фармацевтически приемлемым носителем или разбавителем. 10. Фармацевтическая композиция, содержащая соединение по п.6, совместно с фармацевтически приемлемым носителем или разбавителем. 11. Способ лечения или профилактики вирусных инфекции, отличающийся тем, что он включает введение человеку или животному эффективного количества соединения по п.1. 12. Способ по п.11 для лечения или профилактики герпесных инфекций, включающих вирус Varicella zoster, вирус герпеса обыкновеного типа 1 и 2, вирус Epstein-Barr или герпес типа 6 (HHV-6) и типа 8 (HHV-8). 13. Способ по п.11 для лечения или профилактики ретровирусных инфекций, включающих SIV, HIV-1 и HIV-2. 14. Способ получения соединения по п.1,включающийa) необязательную N-защиту 2 и/или 6 положений пурина в соединении формулы I, в которой каждый из R1 и R2 представляет собой водород;b) региоселективное ацилирование соединения формулы I по 4-гидроксигруппе боковой цепи, с помощьюi) необязательно N-защищенной валиновой или изолейциновой группы,ii) необязательно замещенного, насыщенного или мононенасыщенного С 3-C21COOH производного, илиc) ацилирование по 2-гидроксиметильной группе боковой цепи с помощьюi) необязательно N-защищенной валиновой или изолейциновой группы, илиii) необязательно замещенного, насыщенного или мононенасыщенного С 3-С 21 СООН производного;d) замещение региоселективной защитной группы в R1, в случае ее присутствия, с помощьюi) необязательно N-защищенной валиновой или изолейциновой группы; илиii) необязательно замещенного, насыщенного или мононенасыщенного C3-C21COOH производного; и е) если это необходимо, снятие защитной группы с полученного соединения.
МПК / Метки
МПК: A61K 31/52, C07D 473/18, A61P 31/12
Метки: ациклических, производные, нуклеозидов
Код ссылки
<a href="https://eas.patents.su/28-1404-proizvodnye-aciklicheskih-nukleozidov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные ациклических нуклеозидов.</a>
Предыдущий патент: Замещенные производные 4-гидрокси-фенилалкановой кислоты с агонистической активностью по отношению к ppar-гамма
Следующий патент: Способ получения доцетаксела
Случайный патент: Способ получения соединений ряда пиперазина и их солянокислых солей












