Модуляторы рецептора св1
Номер патента: 17170
Опубликовано: 30.10.2012
Авторы: Хёгберг Томас, Нильсен Петер Одаль, Ресевёр Жан-Мари, Линже Жан-Мишель, Купер Мартин, Бьюэрлинг Эмели, Мюррей Энтони, Ноэрегор Пиа Карина
Формула / Реферат
1. Соединение формулы (I) или его соль, гидрат, сольват или индивидуальный энантиомер
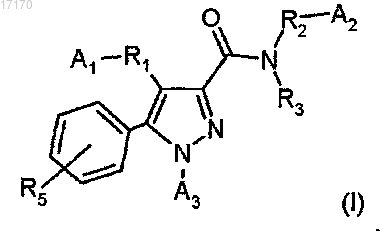
где A1 обозначает -СООН или тетразолил;
А2 обозначает водород;
А3 обозначает фенил, необязательно замещенный R5;
R3 обозначает водород или C1-C4-алкил;
R5 обозначает водород, -F или -Cl;
R7 и R8 независимо обозначают водород, С1-С4-алкил или С3-C8-циклоалкил;
R9 обозначает водород, С1-С4-алкил, С3-C8-циклоалкил или полностью или частично фторированный С1-С4-алкил;
R1 обозначает:
(i) -CH2-, -СНОН- или
(ii) C(R10)(R11)-*, -C(R10)(R11)-O-*, где связь, помеченная звездочкой, является связью с пиразольным циклом;
R2 обозначает двухвалентный радикал формулы -Q1-[A4]v;
А4 обозначает фенильное или пиридинильное кольцо, необязательно, имеющее один или более заместителей, выбранных из -F, -Cl, -Br, -CN, -CF3, C1-C4-алкила, С3-C8-циклоалкила, -OR9, оксо или -NR7R8;
v обозначает 1;
Q1 обозначает -C(R10)(R11)-, C(R10)(R11)CH2-;
R10 обозначает водород;
R11 обозначает C1-С3-алкил, или
R10 и R11, оба, обозначают C1-С3-алкил, или R10 и R11 вместе с атомом углерода, с которым они связаны, образуют циклопропильное кольцо.
2. Соединение по п.1, отличающееся тем, что в фенильном кольце, содержащем R5, R5 находится в пара-положении к связи, соединяющей указанное фенильное кольцо с пиразольным кольцом; и в цикле A3 R5 находится в орто-положении к связи, соединяющей А3 с пиразольным кольцом.
3. Соединение по п.2, отличающееся тем, что радикал -R1- обозначает -C(R10)(R11)-*, -C(R10)(R11)-O-*, a R10 обозначает водород и R11 обозначает метил; или R10 и R11, оба, обозначают метил; или R10 и R11, вместе с атомом углерода, с которым они связаны, образуют циклопропильное кольцо; или -R1- обозначает -СН2-,
-СН(ОН), где связь, помеченная звездочкой, является связью с пиразольным циклом.
4. Соединение по п.2 или 3, отличающееся тем, что в радикале -R2 R10 обозначает водород и R11 обозначает метил, или R10 и R11, оба, обозначают метил, или R10 и R11 вместе с атомом углерода, с которым они связаны, образуют циклопропильное кольцо.
5. Соединение по п.4, отличающееся тем, что в радикале R2 A4 обозначает двухвалентный фениленовый радикал или пиридинильное кольцо, необязательно замещенное -F или -Cl.
6. Соединение по п.4 или 5, отличающееся тем, что радикал -R2- выбирают из
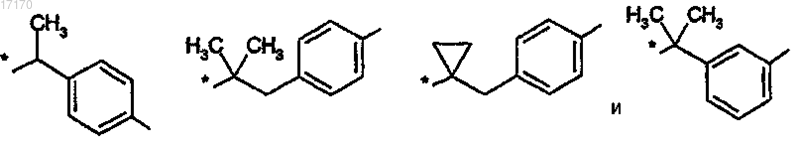
где связь с азотом амидной группы показана звездочкой, а фенильное кольцо, необязательно, может иметь в качестве заместителя -F, -Cl, -Br, -CN, -CF3, C1-C4-алкил, циклопропил, -OR9, оксо или -NR7R8, где R9 обозначает водород, С1-С4-алкил или -CF3, a R7 и R8, независимо, обозначают водород или С1-С4-алкил.
7. Соединение по любому из пп.2-6, отличающееся тем, что R3 обозначает водород.
8. Соединение по любому из пп.2-4, отличающееся тем, что радикал -С(=О)-N(R3)-R2-A2 имеет формулу (Е)
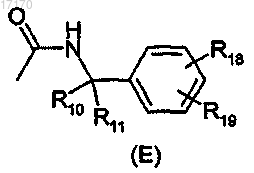
где R10 и R11 имеют значение по п.1, a R18 и R19, независимо, выбирают из водорода, (C1-С4)алкила,
-F, -CF3, -OCF3, -Br, -Cl, -ОСН3 и -CN.
9. Соединение по п.8, отличающееся тем, что R10 обозначает водород или метил, R11 обозначает метил или этил, a R18 и R19, независимо, выбирают из водорода, -F, -Cl, -Br, -CN, -CF3 и -OCF3.
10. Соединение по любому из пп.2-9, отличающееся тем, что A1 обозначает тетразолил.
11. Соединение по п.1, имеющее формулу (IA), или его соль, гидрат, сольват, индивидуальный энантиомер
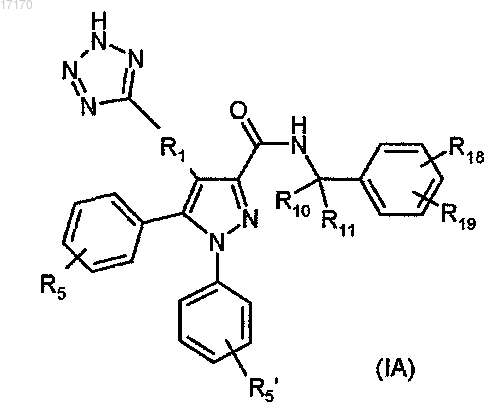
где -R1- обозначает -СН2-, -СН(ОН)-, -СН(СН3)-;
R10 обозначает водород;
R11 обозначает метил;
или R10 и R11, оба, обозначают метил, или R10 и R11, вместе с атомом углерода, с которым они связаны, образуют циклопропильное кольцо;
R5 и R5', независимо, выбирают из водорода, -F и -Cl;
R18 и R19, независимо, выбирают из водорода, -F, -Cl, -Br, -CN, -CF3 и -OCF3.
12. Соединение по п.11, отличающееся тем, что R10 обозначает водород и R11 обозначает метил, а стереохимическая конфигурация при атоме углерода, с которым связаны R10 и R11, представляет собой R-конфигурацию.
13. Соединение по п.1, выбранное из группы, включающей
[3-[(R)-1-(4-бромфенил)этилкарбамоил]-1-(2-хлорфенил)-5-(4-хлорфенил)-1H-пиразол-4-ил]уксусную кислоту;
(1-(2-хлорфенил)-5-(4-хлорфенил)-3-{метил-[(R)-1-(4-трифторметилфенил)этил]карбамоил}-1H-пиразол-4-ил)уксусную кислоту;
[(R)-1-(3-фтор-4-хлорфенил)этил]амид 1-(2-хлорфенил)-5-(4-хлорфенил)-4-(2Н-тетразол-5-илметил)-1Н-пиразол-3-карбоновой кислоты;
[(R)-1-(4-трифторметоксифенил)этил]амид 1-(2-фторфенил)-5-(4-хлорфенил)-4-(1H-тетразол-5-илметил)-1H-пиразол-3-карбоновой кислоты;
{1-(2-хлорфенил)-5-(4-хлорфенил)-3-[(R)-1-(4-трифторметилфенил)этилкарбамоил]-1Н-пиразол-4-ил}уксусная кислота;
метил-[(R)-1-(4-трифторметоксифенил)этил]амид 1-(2-хлорфенил)-5-(4-хлорфенил)-4-(1H-тетразол-5-илметил)-1H-пиразол-3-карбоновой кислоты;
[(R)-1-(4-трифторметилфенил)этил]амид 5-(4-хлорфенил)-1-(2-хлорфенил)-4-(2Н-тетразол-5-илметил)-1Н-пиразол-3-карбоновой кислоты;
[(R)-1-(3-трифторметилфенил)этил]амид 1-(2-хлорфенил)-5-(4-хлорфенил)-4-(1H-тетразол-5-илметил)-1Н-пиразол-3-карбоновой кислоты;
[(R)-1-(4-трифторметилфенил)этил]амид 1-(2-фторфенил)-5-(4-хлорфенил)-4-(1Н-тетразол-5-илметил)-1H-пиразол-3-карбоновой кислоты;
[(R)-1-(4-трифторметоксифенил)этил]амид 1-(2-хлорфенил)-5-(4-хлорфенил)-4-(2Н-тетразол-5-илметил)-1H-пиразол-3-карбоновой кислоты;
метил-[(R)-1-(3-хлор-4-фторфенил)этил]амид 1-(2-хлорфенил)-5-(4-хлорфенил)-4-(1H-тетразол-5-илметил)-1H-пиразол-3-карбоновой кислоты;
[(R)-1-(3-фторфенил)этил]амид 1-(2-хлорфенил)-5-(4-хлорфенил)-4-(1H-тетразол-5-илметил)-1H-пиразол-3-карбоновой кислоты;
[(R)-1-(3,4-дихлорфенил)этил]амид 1-(2-хлорфенил)-5-(4-хлорфенил)-4-(2Н-тетразол-5-илметил)-1Н-пиразол-3-карбоновой кислоты,
и их соли, гидраты и сольваты.
14. Фармацевтическая композиция, содержащая соединение по любому из предшествующих пунктов и один или более фармацевтически приемлемых носителей или эксципиентов.
15. Применение соединения по любому из пп.1-13 для лечения заболеваний или состояний, прямо или косвенно связанных с ожирением и избыточным весом, которые представляют собой метаболический синдром, диабет типа 2, сердечно-сосудистое заболевание, метаболическую дисфункцию, метаболическое заболевание или расстройство или заболевание печени; или для лечения расстройства пищевого поведения, аддиктивного расстройства, психического расстройства, неврологического расстройства, нарушения половых функций, дисфункции репродуктивной системы, болезни печени или заболевания, связанного с фиброзом.
Текст
МОДУЛЯТОРЫ РЕЦЕПТОРА СВ 1 где A1 обозначает -СООН или тетразолил; А 2 обозначает водород; А 3 обозначает фенил,необязательно замещнный R5; R3 обозначает водород или С 1-С 4-алкил; R5 обозначает водород,-F или -Cl; R7 и R8 независимо обозначают водород, С 1-С 4-алкил или С 3-С 8-циклоалкил; R9 обозначает водород, С 1-С 4-алкил, С 3-C8-циклоалкил или полностью или частично фторированный С 1-С 4-алкил; R1 обозначает (i) -СН 2-, -СНОН- или (ii) C(R10)(R11)-, -C(R10)(R11)-O-, где связь,помеченная звздочкой, является связью с пиразольным циклом; R2 обозначает двухвалентный радикал формулы -Q1-[A4]v; A4 обозначает фенильное или пиридинильное кольцо, необязательно,имеющее один или более заместитель, выбранный из -F, -Cl, -Br, -CN, -CF3, C1-C4-алкила, С 3-C8 циклоалкила, -OR9, оксо или -NR7R8; v обозначает 1; Q1 обозначает -C(R10)(R11)-, C(R10)(R11)CH2-;R10 обозначает водород и R11 обозначает C1-С 3-алкил; или R10 и R11, оба, обозначают C1-С 3-алкил; или R10 и R11 вместе с атомом углерода, с которым они связаны, образуют циклопропильное кольцо; подавляют нормальную активность передачи сигнала СВ 1 рецепторов и, следовательно, они применимы для лечения заболеваний или состояний, опосредуемых активностью передачи сигнала СВ 1 рецепторов, например для лечения ожирения и избыточного веса, предупреждения увеличения веса, лечения заболеваний и состояний, непосредственно или опосредованно связанных с ожирением и избыточным весом. 017170 Настоящее изобретение относится к соединениям, которые являются модуляторами каннабиоидного рецептора СВ 1 и подавляют нормальную активность передачи сигнала через такие рецепторы. Кроме того, изобретение относится к композициям и способам, использующим указанные соединения для лечения заболеваний или состояний, опосредуемых активностью СВ 1 рецепторной передачи сигнала, например, для лечения ожирения и избыточного веса, предупреждения увеличения веса, лечения заболеваний и состояний, непосредственно или опосредованно связанных с ожирением и избыточным весом, таких как метаболический синдром, диабет типа 2, сердечно-сосудистое заболевание, метаболическая дисфункция у людей с ожирением, избыточным весом или нормальным весом, метаболические заболевания или расстройства, рак, заболевания печени и другие вторичные заболевания, указанные ниже, а также для лечения некоторых расстройств, необязательно связанных с ожирением и избыточным весом, таких как расстройства пищевого поведения, аддиктивные расстройства, психические расстройства, неврологические расстройства, нарушения половых функций, дисфункции репродуктивной системы, болезни печени, заболевания, связанные с фиброзом, и другие клинические показания, указанные ниже. Изобретение относится также к фармацевтическим композициям, содержащим соединения по изобретению, и к применению этих соединений в комбинации с другими методами лечения таких расстройств. Предпосылки создания изобретения Уровень распространения ожирения в Северной Америке и в большинстве стран Европы более чем удвоился за последние 20 лет, и более половины взрослого населения в настоящее время либо имеет избыточный вес, либо страдает ожирением. В настоящее время признают, что ожирение является хроническим заболеванием и важной глобальной проблемой для систем здравоохранения (Fiegal et al., 1998, Int.J. Obesity 22: 39-47, Mokdad et al., 1999, JAMA 282: 1519-1522; Halford, 2006, Appetite, 46, 6-10). "Идентифицируемые признаки и симптомы" ожирения включают избыточное накопление жира или жировой ткани, увеличение размера или числа липоцитов (адипоцитная дифференцировка), резистентность к инсулину, повышенные уровни глюкозы (гипергликемия), повышенное кровяное давление, повышенные уровни холестерина и триглицеридов и пониженные уровни липопротеина высокой плотности. Ожирение ассоциируется со значительно повышенным риском развития диабета типа 2, ишемической болезни,удара, гипертензии, различных типов рака и различных других серьезных заболеваний и общей смертности в результате всех этих причин (Must et al., 1999, JAMA 282: 1523-1529, Calle et al., 1999, N. Engl. J.Med. 341: 1097-105). Группу метаболических факторов риска развития сердечно-сосудистого заболевания и диабета типа 2 часто называют метаболическим синдромом, синдромом X и синдромом резистентности к инсулину (инсулинорезистентности). Основные составляющие метаболического синдрома X включают избыточный абдоминальный (брюшной) жир (известный также как висцеральное ожирение,ожирение мужского типа или ожирение яблокообразного типа), атерогенную дислипидемию (пониженное содержание холестерина липопротеинов высокой плотности (ЛПВП, HDL-С, повышенное содержание триглицеридов, гипертензию, гипергликемию (сахарный диабет типа 2 или нарушенную гликемию натощак, нарушенную толерантность к глюкозе и инсулинорезистентность), провоспалительное состояние и протромботическое состояние (ср. AHA/NHLBI/ADA Conference Proceedings, Circulation 2004; 109: 551-556). Другие патологии, часто ассоциирующиеся с метаболическим синдромом, включают повышенные концентрации аполипопротеина В, низкие уровни адипонектина в плазме, мелкие частицы липопротеинов низкой плотности (ЛПНП, LDL), гиперурикемию, неалкогольную жировую болезнь печени/гепатостеатоз, повышенное содержание печеночных трансаминаз, гамма-глутамилтрансфераз и микроальбуминурию. Подобно ожирению распространенность заболеваний, связанных с ожирением, таких как диабет,также продолжает расти. Снижение веса является очень важным для пациента, страдающего ожирением,так как это может улучшить сердечно-сосудистые и метаболические показатели, что позволит снизить заболеваемость и смертность, связанные с ожирением (Blackburn, 1999, Am. J. Clin. Nutr. 69: 347-349,Galuska et al., 1999, JAMA 282: 1576). Было показано, что снижение веса на 5-10% может значительно улучшить метаболические показатели, такие как уровни глюкозы в крови натощак и после приема пищи(постпрандиальный), HbA1c (гликозилированного гемоглобина), инсулина, уровень общего холестерина в плазме, липопротеинов низкой плотности (ЛПНП, LDN), триглицеридов, мочевой кислоты и кровяное давление, и снизить риск развития диабета, рака и сердечно-сосудистых заболеваний (Goldstein, 1992, J.Obesity, 6, 397-415). Таким образом, главной целью лечения ожирения и связанных с ожирением расстройств является снижение веса. В начальной стадии лечение основывается на диете и изменениях в образе жизни, подкрепленных терапией лекарственными средствами. Однако хотя физические упражнения и уменьшение калорий в пище могут улучшить состояние, приверженность этому лечению невысокая вследствие сидячего образа жизни и избыточного потребления пищи, особенно пищи с высоким содержанием жиров. Кроме того, с помощью лечения соответствующими лекарственными средствами, способствующими снижению массы тела, не удается достичь адекватных положительных результатов у многих пациентов,страдающих ожирением, вследствие побочных эффектов, противопоказаний или недостаточной позитивной реакции. Следовательно, существует импульс к разработке новых и альтернативных лекарств для лечения ожирения.-1 017170 В настоящее время исследуется несколько агентов против ожирения (см. обзор Bays, 2004, Obesityi) агенты для центральной нервной системы, которые влияют на нейротрансмиттеры или невральные ионные каналы (например, антидепрессанты (бупропион), ингибиторы обратного захвата норадреналина (GW320659), селективные агонисты 5 НТ 2 с рецептора, противосудорожные агенты (топирамат,зонисамид), некоторые антагонисты дофамина (допамина), антагонисты каннабиоидного СВ-1 рецептораii) агенты метаболического пути лептин/инсулин/центральная нервная система (например, аналоги лептина, промоторы гена транспортного белка и/или рецептора лептина, CNTF (аксокин), NPY антагонисты, AgRP антагонисты, РОМС промоторы, CART промоторы, MSH аналоги, МС 4 рецепторные агонисты, агенты, которые влияют на метаболизм/активность инсулина [ингибиторы РТР-1B, PPAR рецепторные агонисты, краткодействующий D2-агонист (эргосет), агонисты соматостатина (октреотид) адипонектин/Acrp30 (фамоксин (Famoxin) или индуктор метаболического окисления жирных кислот (Fatty Acidiii) агенты пути желудочно-кишечный тракт - нервная система (например, агенты, которые повышают активность CCK и PYY, агенты, которые повышают активность GLP-1 (эксендин 4, лираглутид,ингибитор дипептидилпептидазы IV), агенты которые понижают активность грелина, амилин (прамлинитид), агонисты нейропептида Y);iv) агенты, которые могут повысить скорость обмена веществ в состоянии покоя (бета-3 агонисты,гомологи UCP, агонисты тиреоидного рецептора);v) другие более разнообразные агенты, например, такие как антагонисты меланинконцентрирующего гормона (МСН), аналоги фитостанолов, функциональные масла, Р 57, ингибиторы амилаз, фрагменты гормона роста, синтетические аналоги DHEAS (флуастерон), антагонисты активности 11-бета-гидроксистероид дегидрогеназы типа 1 в отношении адипоцитов, агонисты CRH, ингибиторы карбоксипептидазы, ингибиторы синтеза жирных кислот (церуленин и С 75), инданоны/инданолы, аминостеролы (тродусквемин) и другие ингибиторы липаз желудочно-кишечного тракта (ATL962). Механизмы действия лекарства для эффективного лечения ожирения могут быть различными, такими как снижение потребления пищи (например, за счет индукции насыщения или сигналов насыщения), изменение метаболизма (например, за счет модификации абсорбции питательных веществ, например, с помощью ингибирования абсорбции жиров), увеличение расхода энергии (например, повышение термогенеза), ингибирование липогенеза или стимуляция апоптоза адипоцитов. Однако лишь немного лекарств пригодны для лечения ожирения (см. обзоры Gadde and Allison, 2006, Circulation, 114, 974-984;Weigle, 2003, J. Clin Endocrinol Metab., 88, 2462-2469; Schioth, 2006, CNS Neurol. Disorders Drug Targets, 5,241-249). Сибутрамин представляет собой смешанный ингибитор пресинаптического обратного захвата серотонина и норэпинефрина центрального действия. Орлистат является ингибитором липаз желудочнокишечного тракта, который снижает абсорбцию жиров в кишечнике. Римонабант (SR141716, Acomplia) представляет собой модулятор каннабиоидных рецепторов СВ 1 (антагонист и обратный агонист), который был недавно одобрен для лечения ожирения (см. обзор Pagotto et al., 2006, Endocrine Reviews, 27, 73100; см. сообщения о фазе III клинических испытаний Despres et al., 2005, N. Engl. J. Med. 353, 212; vanGaal et al., 2005, Lancet, 16, 1389; Pi-Sunyer et al., 2006, JAMA, 295, 761). К настоящему времени охарактеризованы два каннабиоидных рецептора: СВ 1, рецептор, обнаруженный в мозговой ткани млекопитающих, и СВ 2, периферический рецептор, находящийся, главным образом, в клетках, связанных с иммунной системой. См. обзоры в модуляторах каннабиоидных СВ 1 и СВ 2 рецепторов Pertwee, 2000, Ехр. Opin. Invest. Drags, 9, 1553-1571 и Muccioli, 2005, Cur. Med. Chem.,12, 1361-1394. Множество данных указывает на то, что антагонисты СВ 1 (например, римонабат) способны модулировать энергетический гомеостаз и что антагонисты СВ 1 способны модулировать потребление пищи, а также периферически блокировать процессы липогенеза (Pagotto et al., 2006, Endocrine Reviews,27, 73-100; Tucci et al., 2006, Curr. Med. Chem. 13, 2669-2680; Lange and Kruse, 2004, Current Opinion inDrag DiscoveryDev., 7, 498-506). Периферические эффекты антагонистов СВ 1 могут опосредоваться различными целевыми органами и механизмами, например i) печень: блокирование липогенеза (синтезаde novo), ii) мышцы: увеличение поглощения глюкозы, iii) жировая ткань: стимуляция экспрессии и/или секреции адипонектина, ингибирование липогенных ферментов, стимуляция GLUT4, генерирование футильных циклов, iv) поджелудочная железа: регуляция инсулина и v) желудочно-кишечный тракт: стимуляция сигналов насыщения. Римонабат (Acomplia) одобрен в качестве дополнения к диете и упражнениям для лечения ожирения. Хотя влияние на массу тела и метаболические показатели (уровни триглицеридов, уровни ЛПВП(HDL)-холестерина, уровни инсулина в плазме, уровни HbA1c [гликозилированного гемоглобина], резистентность к инсулину и уровни адипонектина) являются очень обнадеживающими, имеются также нежелательные побочные эффекты, возможно, центрально опосредуемые (психические расстройства и расстройства центральной нервной системы), такие как чувство страха, депрессивные расстройства, нарушения сна, тошнота и рвота (ср. http://emc.medicines.ora.uk;http://www.emea.europa.eu/humandocs/PDFs/EPAR/acomplia/AcompliaEparScientificD-en.pdf). Поэтому все еще существует потребность в альтернативных антагонистах СВ 1 рецептора, ассоциированных с другими (отличными) фармакокинетическим, фармакологическим профилями и профилем побочных эффектов. Рецептор СВ 1 участвует во многих болезненных состояниях (ср. обзор Pacher et al., 2006, Pharmacol.Rev, 58, 389-462). Модуляторы СВ 1 рецепторной активности могут применяться при лечении заболеваний и состояний, ассоциированных с регуляцией рецептора СВ 1, таких как ожирение и избыточный вес,предупреждение увеличения веса (например, вызванного лекарственной терапией или прекращением курения), и при лечении заболеваний и состояний, непосредственно или опосредованно ассоциированных с ожирением (ср. Bray, 2004, J. Clin. Endocrinol. Metab. 89, 2583-9; Manson et al., 1995, N. Engl. J.Med. 333, 677-85; Grundy, 2004, J. Clin. Endocrinol. Metab. 89, 2595-600; Esposito et al., 2004, JAMA 291: 2978-84; Ejerblud et al., 2006; J. Am. Soc. Nephrol. 17, 695-702; Whitmer et al., 2005, BMJ 330 (7504), 1360),таких как метаболический синдром, также называемый синдромом X или синдромом инсулинорезистентности; диабет типа 2; сердечно-сосудистые заболевания (например, аневризма, стенокардия, аритмия, атеросклероз, кардиомиопатия, инсульт (удар), цереброваскулярная болезнь, врожденный порок сердца, застойная сердечная недостаточность, миокардит, аномалия клапанов сердца, ишемическая болезнь сердца, дилатационная кардиомиопатия, диастолическая дисфункция, эндокардит, повышенное кровяное давление (гипертензия), гипертрофическая кардиомиопатия и ею обусловленные аритмии и головокружение, пролабирование створок митрального клапана, инфаркт миокарда (сердечный приступ), венозная тромбоэмболия,варикозное расширение вен и легочная эмболия, провоспалительное состояние, повышенная склонность к тромбозу (протромбическое состояние) и внутричерепная гипертензия; метаболические дисфункции у людей, страдающих ожирением, людей с избыточным весом или с нормальным весом (например, дислипидемия, гиперлипидемия, низкие уровни холестерина ЛПВП(HDL) и/или высокие уровни холестерина ЛПНП (LDL), гиперглицеридемия, низкие уровни адипонектина, нарушенная толерантность к глюкозе, инсулинорезистентность, повышение уровней HbA1c [гликозилированного гемоглобина], сахарный диабет, диабет типа 2, пониженная метаболическая активность); метаболические заболевания или расстройства (состояния, при которых наблюдается отклонение от метаболического процесса или которые вызваны патологическим процессом обмена веществ (метаболическим); могут быть врожденными вследствие наследственной ферментативной патологии или приобретенными в результате заболевания органа эндокринной системы или недостаточности важного для обмена веществ органа, такого как печень); раковые заболевания (например, колоректальный рак (рак толстой кишки), рак молочной железы,рак матки, рак ободочной кишки); болезни печени (например, неалкогольная жировая болезнь печени, гепатостеатоз, жировая дегенерация, фиброз печени, цирроз печени); другие вторичные заболевания, связанные с ожирением и избыточным весом, такие как нарушения менструального цикла, гастроэзофагеальная рефлюксная болезнь, холелитиаз (камни в желчном пузыре),грыжа, недержание мочи, хроническая почечная недостаточность, гипогонадизм (мужской), мертворождение, стрии, акантогератодермия, лимфедема, целлюлит, карбункулы, интертриго, гиперурикемия, неподвижность, остеоартрит, поясничная боль, болезнь Рота-Бернгардта, головная боль, карпальный туннельный синдром (туннельный синдром запястья), деменция, одышка неясного происхождения, синдром обструктивного апноэ сна, синдром с проявлением гиповентиляции, синдром Пиквика, астма, депрессия,низкая самооценка, дисморфные нарушения, общественное осуждение. Рецептор СВ 1 участвует во многих болезненных состояниях, необязательно связанных с ожирением и избыточным весом, таких как расстройство пищевого поведения; аддиктивные расстройства (например, привыкание к марихуане, психостимуляторам, никотину, алкоголю, кокаину и опиатам); психическое расстройство (например, шизофрения, шизоаффективное расстройство, биполярные расстройства, страх, паническое расстройство); неврологические расстройства; половые дисфункции (например, эректильные дисфункции); репродуктивные дисфункции (например, синдром поликистозных яичников, бесплодие); заболевания печени (например, вирусный гепатит, дисфункция печени при других заболеваниях печени, воспалительные заболевания печени (например, аутоиммунный гепатит), заболевание печени алкогольной этиологии, токсическое заболевание печени, опухоли печени (такие как почечно-клеточная карцинома, гепатоклеточная карцинома, гепатома, холангиокарцинома, гепатобластома, ангиосаркома печени, саркома клетки Купфера, другие саркомы печени), стеатогепатит, неалкогольная жировая болезнь печени, фиброз печени, цирроз печени, портальная гипертензия цирротического генеза, метаболические-3 017170 заболевания печени (такие как гемохроматоз, болезнь Уилсона, синдром Жильбера, синдром КриглераНайяра, синдром Дубина-Джонсона, синдром Ротора; заболевания, связанные с фиброзом (такие как муковисцидоз поджелудочной железы и легких, эндомиокардиальный фиброз, идиопатическая миокардиопатия; идиопатический легочный фиброз, диффузное поражение легочной паренхимы, фиброз средостения, миелофиброз, болевой синдром после вазэктомии, ретроперитонеальный фиброз, прогрессирующий массивный фиброз, пролиферативный фиброз, неопластический фиброз, серповидноклеточная анемия может вызвать гипертрофию и в конечном счете фиброз селезенки); другие клинические показания, такие как эпилепсия, остеопороз, ревматоидный артрит, воспалительное заболевание кишечника (язвенный колит (UC) и болезнь Крона (CD), хроническая обструктивная болезнь легкого (COPD), воспаление, воспалительная боль, атеросклероз, диарея, астма, констипация, кожные заболевания, глаукома и выпадение волос). Так как ожирение приводит к риску, или значительно повышает риск сопутствующих патологий,включающих различные системы организма (см. Bays, 2004, Obesity research, 12, 1197-1211), в том числе:i) сердечно-сосудистая (гипертензия, застойная кардиомиопатия, варикозное расширение вен, легочная эмболия, ишемическая болезнь сердца [ИБС, CHD]), нервная (удар, идиопатическая внутричерепная гипертензия, болезнь Рота-Бернгардта);iii) скелетно-мышечная (опорно-двигательный аппарат) (неподвижность, дегенеративный остеоартрит, боль в нижней части спины (поясничная боль;iv) кожа (полосы растяжения кожи или стрии (растяжки), веностаз нижних конечностей, лимфедема, целлюлит, интертриго, карбункулы, акантогератодермия, папилломы);v) желудочно-кишечная (гастроэзофагеальная рефлюксная болезнь, неалкогольная жировая болезнь печени/стеатогепатит, холелитиаз (камни в желчном пузыре), грыжа, рак толстой кишки);viii) эндокринная (метаболический синдром, диабет типа 2, дислипидемия, гиперандрогенемия у женщин, синдром поликистозного яичника, дисменорея, бесплодие, осложнения при беременности, мужской гипогонадизм),целесообразно также комбинировать модулятор СВ 1 с лекарственной терапией, применяемой для лечения таких заболеваний. Также полезно комбинировать модулятор СВ 1 с лекарственной терапией,применяемой для лечения заболеваний, которые могут быть не связаны с ожирением, такими как нарушение питания, аддиктивные расстройства, психические расстройства, неврологические расстройства,нарушения половых функций, дисфункции репродуктивной системы, болезни печени, заболевания, связанные с фиброзом, и другие клинические показания, которые могут быть не связаны с ожирением. Сущность изобретения Настоящее изобретение предоставляет (делает доступным) класс пиразолов, которые модулируют активность каннабиоидного рецептора СВ 1. Нижеприведенные публикации относятся к другим пиразолам, обладающим СВ 1 модулирующей активностью: Международные заявки WO 199021682,WO 1997019063, WO 2000046209, WO 2001058869, WO 2001129007, WO 2003088968, WO 2003020217,WO 2004052864, WO 2005080343, WO 2006067443, WO 2006087480, WO 2006133926, Европейские патенты ЕР 00576357, ЕР 00658546, патенты США US 20030199536, US 20040119972, US 20040192667,US 20050261281, US 20050624941, US 2006028084, US 20060509367, J. Med. Chem. 1999 42, 769-776,Biochem. Pharmacol., 2000, 60, 1315-1323, J. Med. Chem. 2003, 46, 642-645, BioorgMed. Chem. Lett. 2004, 14, 2393-2395, Current Med. Chem. 2005, 12, 1361-1394. Как указано в данном описании, соединения по изобретению применимы для лечения ожирения и избыточного веса, предупреждения увеличения веса, лечения заболеваний и состояний, обсуждавшихся выше, на которые благотворно действует подавление нормальной активности передачи сигнала СВ 1 рецепторов. Как указывалось, такие заболевания и состояния включают ожирение и избыточный вес и заболевания, которые прямо или косвенно связаны с ожирением и избыточным весом (например, метаболический синдром, диабет типа 2, сердечно-сосудистые заболевания; метаболические расстройства, раковые заболевания, заболевания печени и другие вторичные заболевания), а также некоторые заболевания и состояния, которые могут быть не связаны с ожирением (например, расстройства пищевого поведения, аддиктивные расстройства, психические расстройства, неврологические расстройства, нарушения половых функций, дисфункции репродуктивной системы, болезни печени, заболевания, связанные с фиброзом, и другие клинические показания). Они применимы для модуляции массы тела и расхода энергии у млекопитающих и для модуляции плазматических показателей, связанных с метаболическим синдромом, таких как низкие уровни холестерина ЛПВП (HDL) и/или высокие уровни холестерина ЛПНП(LDL) и/или мелких плотных частиц ЛПНП, высокие уровни триглицеридов, низкие уровни адипонектина и высокие уровни HbA1c [гликозилированного гемоглобина], и для модуляции других характеристик-4 017170 метаболического синдрома, таких как нарушенная толерантность к глюкозе, резистентность к инсулину,избыточная жировая ткань живота и вокруг него, неалкогольная жировая болезнь печени, стеатогепатит,стеатоз, фиброз печени, цирроз печени, опухоли печени, метаболические заболевания печени и повышенное кровяное давление. Соединения по изобретению проявляют различные физико-химические свойства и применимы для модуляции периферических СВ 1 рецепторов и, до некоторой степени, центральных СВ 1 рецепторов. Эти соединения по изобретению, ассоциированные с пониженным центральным действием на СВ 1 рецепторы, могут обладать пониженной склонностью оказывать побочное действие на психику и нервную систему. Известная Международная заявкаPCT/EP 2006/005726 относится к обладающим активностью,модулирующей СВ 1 рецептор, соединениям формулы где A1 обозначает водород, -СООН или тетразолил, а А 2 обозначает водород, -СООН, тетразолил,-CN, -CF3, -COR6, -SO2R6, -OR7, -NR7R8, -NHCOR6 или -NR7SO2R6 при условии, что один из А 1 и А 2 обозначает либо -СООН, либо тетразолил; р обозначает 0 или 1;A3 обозначает фенил или циклоалкил, один из которых, необязательно, замещен R4 и/или R5;R1 обозначает связь или -(CH2)aB1(CH2)b-, где а и b, независимо, обозначают 0, 1, 2 или 3 при условии, что а+b не выше 4, и B1 обозначает -СО-, -О-, -S-, -SO-, -SO2-, -СН 2-, -СНОН- или -NR7-;R2 обозначает связь, -(CH2)aB1(CH2)b- или -[(CH2)aB1(CH2)b]n-А 4-[(CH2)cB2(CH2)d]m-, где a, b и B1 имеют значение по определению для R1; B2 имеет значение по определению для B1; с и d, независимо,обозначают 0, 1, 2 или 3; при условии, что а+b+с+d не выше 6, n и m, независимо, обозначают 0 или 1, и А 4 обозначает монорабоциклическое или моногетероциклическое кольцо, содержащее 3-8 атомов в цикле, необязательно, имеющее один или более заместитель из -F, -Cl, -Br, -CN, -CF3, C1-C4-алкила, циклоалкила, -OR9, оксо или -NR7R8;R9 обозначает водород, C1-С 4-алкил, циклоалкил, полностью или частично фторированный C1-С 4 алкил. Соединения, к которым относится изобретение, принципиально отличаются по структуре от соединений в Международной заявке РСТ/ЕР 2006/005726 природой радикала -R1- и/или группы -N(R3)-R2-A2. Подробное описание изобретения Согласно первому аспекту изобретения предусматривается соединение формулы (I) или его соль,гидрат, сольват или индивидуальный энантиомерR3 обозначает водород или С 1-С 4-алкил;R9 обозначает водород, С 1-С 4-алкил, С 3-C8-циклоалкил или полностью или частично фторированный С 1-С 4-алкил;R2 обозначает двухвалентный радикал формулы -Q1-[A4]v; А 4 обозначает фенильное или пиридинильное кольцо, необязательно, имеющее один или более заместителей, выбранных из -F, -Cl, -Br, -CN, -CF3, C1-C4-алкила, С 3-C8-циклоалкила, -OR9, оксо илиR11 обозначает (C1-С 3)алкил; или R10 и R11, оба, обозначают (C1-С 3)алкил, или R10 и R11 вместе с атомом углерода, с которым они связаны, образуют циклопропильное кольцо. Другой аспект изобретения представляет собой фармацевтическую композицию, содержащую соединение формулы (I) или его соль, гидрат, сольват или N-оксид вместе с одним или более фармацевтически приемлемых носителей или эксципиентов. Согласно известным положениям медицинской химии предпочтительно, чтобы максимальная молекулярная масса вводимых перорально соединений, к которым относится изобретение, составляла 750 или еще более предпочтительно 650. Соединения, к которым относится изобретение, подавляют нормальную активность передачи сигнала каннабиоидного рецептора СВ 1. Следовательно, следующими аспектами изобретения являются:(i) применение соединения формулы (I) или его соли, гидрата, сольвата или N-оксида для приготовления композиции для лечения заболеваний или состояний, которые опосредуются активностью передачи сигнала СВ 1 рецептора; примеры таких заболеваний перечислены выше;(ii) способ лечения заболеваний или состояний, которые опосредуются активностью передачи сигнала СВ 1 рецептора, причем этот способ заключается во введении субъекту, страдающему таким заболеванием или состоянием, эффективного количества соединения формулы (I) или его соли, гидрата, сольвата или N-оксида; примеры таких лекарственных средств также перечислены выше. Терминология. Термин "Ca-Cb-алкил" по данному описанию, где а и b обозначают целые числа, относится к линейному или разветвленному алкильному радикалу, содержащему от а до b углеродных атомов. Так, например, когда а обозначает 1, a b обозначает 6, термин включает метил, этил, н-пропил, изопропил, н-бутил,изобутил, втор-бутил, трет-бутил, н-пентил и н-гексил. Применяемый в данном описании не имеющий точного определения термин "карбоциклический" относится к моно-, би- или трициклическому радикалу, содержащему до 16 циклических атомов, все они являются атомами углерода, и включает арил и циклоалкил. Применяемый в данном описании не имеющий точного определения термин "циклоалкил" относится к моноциклическому насыщенному карбоциклическому радикалу, содержащему 3-8 углеродных атомов, и включает, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. Применяемый в данном описании не имеющий точного определения термин "арил" относится к моно-, би- или трициклическому ароматическому радикалу и включает радикалы, имеющие два моноциклических карбоциклических ароматических кольца, которые непосредственно связаны ковалентной связью. Применяемый в данном описании не имеющий точного определения термин "гетероарил" относится к моно-, би- или трициклическому ароматическому радикалу, содержащему один или более гетероатомов, выбранных из S, N и О, и включает радикалы, имеющие два таких моноциклических кольца, или одно такое моноциклическое кольцо и одно моноциклическое арильное кольцо, которые непосредственно связаны ковалентной связью. Примерами таких радикалов являются тиенил, бензотиенил, фурил, бензофурил, пирролил, имидазолил, бензимидазолил, тиазолил, бензотиазолил, изотиазолил, бензизотиазолил, пиразолил, оксазолил, бензоксазолил, изоксазолил, бензизоксазолил, изотиазолил, триазолил, бензотриазолил, тиадиазолил, оксадиазолил, пиридинил, пиридазинил, пиримидинил, триазинил, индолил и индазолил. Применяемый в данном описании не имеющий точного определения термин "гетероциклил" или"гетероциклический" включает "гетероарил" по определению выше и, помимо этого, обозначает моно-,ди- или трициклический неароматический радикал, содержащий один или более гетероатомов, выбранных из S, N и О, и к группам, состоящим из моноциклического неароматического радикала, содержащего один или более таких гетероатомов, которые ковалентно связаны с другим таким радикалом или с моноциклическим карбоциклическим радикалом. Примерами таких радикалов являются пирролил, фуранил,тиенил, пиперидинил, имидазолил, оксазолил, изоксазолил, тиазолил, тиадиазолил, пиразолил, пиридинил, пирролидинил, пиримидинил, морфолинил, пиперазинил, индолил, морфолинил, бензофуранил,пиранил, изоксазолил, бензимидазолил, метилендиоксифенил, этилендиоксифенил, малеимидо (малеи-6 017170 нимидо) и сукцинимидо группы. Если не указано иначе в контексте, где встречается термин "замещенный", этот термин в применении к любому фрагменту (любой частице) по данному описанию означает имеющий до четырех совместимых заместителей (замещенный одним-четырьмя заместителями), каждый из которых, независимо,может представлять собой, например, C1-С 6-алкил, C1-С 6-алкокси, гидрокси, гидрокси-С 1-С 6-алкил, меркапто, меркапто-С 1-С 6-алкил, C1-С 6-алкилтио, галоид (включая фтор, бром и хлор), полностью или частично фторированный C1-С 3-алкил, C1-С 3-алкокси или C1-С 3-алкилтио, такой как трифторметил, трифторметокси и трифторметилтио, нитро, нитрил (-CN), оксо, фенил, фенокси, моноциклический гетероарил или гетероарилокси с 5 или 6 атомами в цикле, тетразолил, -COORA, -CORA, -OCORA, -SO2RA,-CONRARB, -SO2NRARB, -NRARB, OCONRARB, -NRBCORA, -NRBCOORA, -NRBSO2ORA или-NRACONRARB, где RA и RB, независимо, обозначают водород или C1-С 6-алкильную группу, или, в случае, когда RA и RB связаны с одним и тем же атомом N, RA и RB вместе с этим атомом азота могут образовывать группы циклического амина, такие как морфолинильная, пиперидинильная или пиперазинильная группа. Если заместителем является фенил, фенокси или моноциклический гетероарил или гетероарилокси, содержащий 5 или 6 атомов в цикле, его фенильный или гетероарильный цикл может сам быть замещен любым из вышеприведенных заместителей, за исключением фенила, фенокси, гетероарила или гетероарилокси. "Необязательным заместителем" может быть одна из вышеприведенных замещающих групп. Термин "соль" по данному описанию включает соли присоединения основания, соли присоединения кислоты и четвертичные соли. Соединения по изобретению, которые являются кислыми, могут образовывать соли, включая фармацевтически приемлемые соли, с основаниями, такими как гидроксиды щелочных металлов, например гидроксиды натрия и калия; гидроксиды щелочно-земельных металлов, например гидроксиды кальция, бария и магния; с органическими основаниями, например N-метил-Dглюкамином, холин трис(гидроксиметил)аминометаном, L-аргинином, L-лизином, N-этилпиперидином,дибензиламином и т.п. Те же соединения (I), которые являются основными, могут образовывать соли,включая фармацевтически приемлемые соли, с неорганическими кислотами, например с галоидоводородными кислотами, такими как хлористо-водородная (соляная) или бромисто-водородная кислоты, серная кислота, азотная кислота или фосфорная кислота и т.п., и с органическими кислотами, например с уксусной, винной, янтарной, фумаровой, малеиновой, яблочной, салициловой, лимонной, метансульфоновой, п-толуолсульфоновой, бензойной, бензолсульфоновой, глутаминовой, молочной и миндальной кислотами и т.п. Обзор, посвященный применимым солям, см. в Handbook of Pharmaceutical Salts: Properties, Selection, and Use by Stahl and Wermuth (Wiley-VCH, Weinheim, Germany, 2002). Термин "сольват" по данному описанию относится к молекулярному комплексу, содержащему соединение по изобретению и стехиометрическое количество одной или более молекул фармацевтически приемлемого растворителя. Термин "гидрат" применяется, когда указанным растворителем является вода. Соединения, к которым относится изобретение, которые могут находиться в одной или более стереоизомерных форм вследствие присутствия асимметрических атомов или из-за затруднения (ограничения) свободного вращения (пространственного ограничения), могут существовать в виде нескольких стереоизомеров с R или S стереохимией при каждом хиральном центре или в виде атропоизомеров R или S стереохимией при каждой хиральной оси. Изобретение включает все такие энантиомеры и диастереомеры и их смеси. Соединения по изобретению охватывают соединения формулы (I) по определению выше в данном описании, включая все их полиморфные и кристаллические формы, их пролекарства и изомеры (включая оптические, геометрические изомеры и таутомерные формы) по определению выше в данном описании и меченные изотопами соединения формулы (I). Так называемые "пролекарства" соединений формулы (I) также входят в объем изобретения. Эти конкретные производные соединений формулы (I), которые сами по себе могут проявлять малую фармакологическую активность или не проявлять никакой фармакологической активности, при введении в организм, превращаются в соединения формулы (I), обладающее нужной активностью, например, по реакции гидролитического расщепления. Более подробные сведения о применении пролекарств можно найти в Prodrugs as Novel Delivery Systems, vol. 14, ACS Symposium Series (T. Higuchi and V.J. Stella) и Biorevesible Carriers in Drug Design, Pergamon Press, 1987 (ed. E.B. Roche, American Pharmaceutical Association;C.S. Larsen and J. stergaard, Design and application of prodrugs, In Textbook of Drug Design and Discovery,3rd Edition, 2002, Taylor and Francis). Пролекарства по изобретению можно получать, например, заменяя соответствующие функциональные группы в соединениях формулы (I) на конкретные группы, известные специалистам в данной области техники как "прогруппы" (promoieties), описанные, например, в Design of Prodrugs by H. Bundgaard(Elsevier, 1985). Их примерами могут являться "прогруппа" (пролекарство) карбоксильной группы (такой как -СО-О-СН 2-О-СО-трет-Bu, применяемая в пивампициллине, пролекарстве ампициллина), амид (-CONH-CH2-NAlk2) или амидин (-C(=N-O-CH3)-NH2).-7 017170 В объем изобретения также входят метаболиты соединений формулы (I), т.е. соединения, образующиеся in vivo после введения лекарства. Некоторые примеры метаболитов включают:(i) если соединение формулы (I) содержит метильную группу, его гидроксиметильное производное(ii) если соединение формулы (I) содержит алкоксигруппу, его гидроксипроизводное (-OR-ОН);(iii) если соединение формулы (I) содержит третичную аминогруппу, его производное, содержащее вторичную аминогруппу (-NR1R2-NHR1 или -NHR2);(iv) если соединение формулы (I) содержит вторичную аминогруппу, его производное, содержащее первичную аминогруппу (-NHR1-NH2);(v) если соединение формулы (I) содержит фенильную группу, его фенольное производное(vi) если соединение формулы (I) содержит амидную группу, его карбоксильное производное(-CONH2-СООН). Для применения по изобретению в соединениях (I) в настоящем изобретении рассматриваются следующие характеристики в любых совместимых комбинациях (I). В фенильном кольце, содержащем R5, R5 находится в пара-положении к связи, соединяющей указанное фенильное кольцо с пиразольным кольцом; и в цикле A3 R5 находится в орто-положении к связи,соединяющей А 3 с пиразольным кольцом. Радикал -R1- обозначает -C(R10)(R11)-, -C(R10)(R11)-O-, a R10 обозначает водород и R11 обозначает метил; или R10 и R11, оба, обозначают метил; или R10 и R11 вместе с атомом углерода, с которым они связаны, образуют циклопропильное кольцо; или -R1- обозначает -СН 2-, -СН(ОН), где связь, помеченная звездочкой, является связью с пиразольным циклом. В радикале -R2 R10 обозначает водород и R11 обозначает метил, или R10 и R11, оба, обозначают метил, или R10 и R11, вместе с атомом углерода, с которым они связаны, образуют циклопропильное кольцо. В радикале R2 A4 обозначает двухвалентный фениленовый радикал или пиридинильное кольцо, необязательно замещенное -F или -Cl. Радикал -R2- выбирают из где связь с азотом амидной группы показана звездочкой, а фенильное кольцо, необязательно, может иметь в качестве заместителя -F, -Cl, -Br, -CN, -CF3, C1-C4-алкил, циклопропил, -OR9, оксо, или -NR7R8,где R9 обозначает водород, С 1-С 4-алкил или -CF3, a R7 и R8, независимо, обозначают водород или С 1-С 4 алкил. где R10 и R11 имеют значение по п.1, a R18 и R19, независимо, выбирают из водорода, (C1-С 4)алкила,-F, -CF3, -OCF3, -Br, -Cl, -ОСН 3 и -CN.R10 обозначает водород или метил, R11 обозначает метил или этил, a R18 и R19, независимо, выбирают из водорода, -F, -С 1, -Br, -CN, -CF3 и -OCF3.A1 обозначает тетразолил. Одним из вариантов осуществления изобретения является соединение, имеющее формулу (IA), или его соль, гидрат, сольват, индивидуальный энантиомерR18 и R19, независимо, выбирают из водорода, -F, -Cl, -Br, -CN, -CF3 и -OCF3. Предпочтительным вариантом является вариант, когда R10 обозначает водород и R11 обозначает метил, а стереохимическая конфигурация при атоме углерода, с которым связаны R10 и R11, представляет собой R-конфигурацию. Конкретные соединения по изобретению включают соединения в примерах по данному описанию. Соединения по настоящему изобретению действуют на центральный и периферический каннабиоидный рецептор СВ 1. Некоторые соединения в меньшей степени переносятся в центральную нервную систему, т.е. соединение не так легко проходит через гематоэнцефалический барьер и вызывает меньше побочных эффектов, опосредуемых центральной нервной системой. Соединения по изобретению модулируют каннабиоидный рецептор СВ 1, подавляя его природную функцию передачи сигнала. Следовательно, эти соединения являются антагонистами, обратными агонистами или частичными агонистами СВ 1 рецептора. Термин "СВ 1 антагонист", "антагонист СВ 1" или "антагонист каннабиоидного рецептора СВ 1" относится к соединению, которое связывается с рецептором, или вблизи него, и не обладает какой-либо заметной способностью активировать сам рецептор. Тем самым СВ 1 антагонист может предупреждать или снижать функциональную активацию или "захват" рецептора СВ 1 агонистом, таким, например, как эндогенный агонист этаноламид арахидоновой кислоты (АЕА, анандамид). Этот термин общеизвестен в уровне техники. Термин "обратный агонист СВ 1" или "агонист каннабиоидного рецептора СВ 1" относится к соединению, которое связывается с рецептором и проявляет фармакологическое действие, противоположное действию агониста СВ 1 рецептора. Обратные агонисты эффективно действуют против некоторых типов рецепторов, которые обладают собственной (характерной) активностью, на которую не действует лиганд(также называемой "конститутивной активностью"). Этот термин общеизвестен в уровне техники. Также в уровне техники хорошо известно, что такой обратный агонист СВ 1 можно также называть антагонистом СВ 1, так как общие свойства обоих типов эквивалентны. Соответственно в контексте настоящего изобретения подразумевается, что термин "антагонист СВ 1" в целом включает как "антагонист СВ 1" по определению выше, так и "обратный агонист СВ 1". Термин "частичный агонист СВ 1 или частичный агонист каннабиоидного рецептора СВ 1" относится к соединению, которое действует на тот же самый рецептор как полный агонист, но вызывает слабый максимальный фармакологический ответ и обладает слабой имманентной активностью. Этот термин общеизвестен в уровне техники. Согласно предпочтительному варианту настоящего изобретения "модулятор СВ 1" или " модулятор каннабиоидного рецептора СВ 1" обозначает антагонист СВ 1 или обратный агонист СВ 1. Соединения по изобретению применимы для лечения заболеваний или состояний, которые опосредуются активностью передачи сигнала СВ 1 рецептора. Примеры таких заболеваний и состояний и терапевтических средств для их лечения перечислены выше. Без ограничения, они включают ожирение и избыточный вес, предупреждение увеличения веса, лечение заболеваний и состояний, непосредственно или опосредованно связанных с ожирением (например, таких как метаболический синдром, диабет типа 2, сердечно-сосудистые заболевания, метаболические дисфункции у людей с ожирением, избыточным весом или нормальным весом, метаболические заболевания или расстройства, раковые заболевания, заболевания печени и другие вторичные заболевания, указанные выше), а также лечение заболеваний и состояний, необязательно связанных с ожирением и избыточным весом (например, таких как расстройства пищевого поведения, аддиктивные расстройства, психические расстройства, неврологические расстройства, нарушения половых функций, дисфункции репродуктивной системы, болезни печени, заболевания, связанные с фиброзом, и другие клинические показания, указанные выше). Они применимы для модуляции веса тела и потребления энергии у млекопитающих и для модуляции основных компонентов,связанных с метаболическим синдромом, таких как избыточный абдоминальный (брюшной) жир, атерогенную дислипидемию (абнормальные уровни ЛПВП (HDL)-C, триглицеридов, ЛПНП (LDL), аполипопротеина В, адипонектина), гипертензию, гипергликемию, гиперурикемию, неалкогольную жировую болезнь печени/гепатостеатоз, повышенное содержание печеночных трансаминаз, гаммаглутамилтрансферазы и микроальбуминурию. Соединения по изобретению проявляют различные физико-химические свойства и применимы для модуляции периферических СВ 1 рецепторов и в различной степени для модуляции центральных СВ 1 рецепторов. Эти соединения по изобретению, ассоциированные с пониженным центральным действием на СВ 1 рецепторы, могут обладать пониженной склонностью оказывать побочное действие на психику и нервную систему. Соединения по изобретению можно комбинировать с другим терапевтическим агентом, применяемым при лечении ожирения, способ действия которого отличен, например центральное действие на сигналы насыщения или голода, механизмы желания (тяги), регуляция аппетита, метаболические пути лептин/инсулин/центральная нервная система, метаболические пути желудочно-кишечный тракт - нервная система, скорость обмена веществ, расход энергии, накопление жира, экскреция жира, моторика желу-9 017170 дочно-кишечного тракта, липогенез, транспорт глюкозы, глюкогенолиз, гликолиз, липолиз и т.д., включая модуляторы (ингибиторы, агонисты, антагонисты, аналоги) моноаминергических рецепторов или транспортеров (переносчиков) (NA (норадреналина), 5 НТ (серотонина), DA (дофамина), невральные ионные каналы, лептин или рецептор лептина, нейропептидные Y рецепторы, ПП (РР, панкреатический полипептид), PYY, пептид YY3-36, грелин или рецептор грелина, мотилин или рецептор мотилина, орексины или рецепторы орексинов, бомбезин или рецепторы бомбезиноподобных пептидов, соматостатин или рецепторы соматостатина, МСН 1 (MCHR1, рецептор меланинконцентрирующего гормона-1), ЦНТФ(CNTF) (цилиарный нейротрофический фактор), AgRP (агути-родственный пептид), РОМС (проопиомеланокортин), CART (регулируемый кокаин-/амфетамин-транскрипт), альфа-МСГ (MSH) (альфамеланоцит-стимулирующий гормон), рецептор МС 4 (меланокортина-4) или МС 3 (меланокортина-3), рецепторы галанина, рецептор релаксина-3, рецептор GPR7, рецептор GPR9, рецептор GPR10, рецепторы нейромедина U, рецепторы свободных жирных кислот (СЖК), гормон роста, несфатин-1, опиоидные рецепторы, рецепторы к нейропептиду FF, PTP-1B (протеин тирозин фосфатаза), PPAR (рецепторы, активируемые пролифераторами пероксисом), гетеродимеры ретиноидного X рецептора, адипонектин, также известный как Acrp30 (белок, родственный адипоцитарному белку комплемента, 30 кДа), метаболизм жирных кислот, рецепторы Н (гистамина), холецистокинин-А (CCK-A) или рецептор CCK-A, ГПП-1(дипептидилпептидаза IV), амилин, бета-3-адренергический рецептор, UCP (разобщающий белок, uncoupling protein), тиреоидный рецептор, рецептор тиреоид-стимулирующего гормона, 11-бетагидроксистероид-дегидрогеназу типа 1, амилазу, ДАЭ-С (DHEAS) (дегидроэпиандростерона сульфат),CRH (кортикотропин-высвобождающий гормон) или рецепторы CRH, карбоксипептидазу, синтез жирных кислот, HMG-CoA редуктазу, кишечно-печеночную циркуляцию желчных кислот, липазу желудочно-кишечного тракта, Р 57, АМР-активированную протеинкиназу (АМРК). Соединения по изобретению можно комбинировать другим терапевтическим агентом, применяемым при лечении метаболического синдрома или заболеваний, связанных с ожирением, таких как сердечно-сосудистые (гипертензия, застойная кардиомиопатия, варикозное расширение вен, легочная эмболия, ишемическая болезнь сердца [ИБС, CHD], цирроз печени), неврологические (удар, идиопатическая внутричерепная гипертензия, болезнь Рота-Бернгардта), респираторные (одышка, обструктивное апноэ сна, синдром гиповентиляции, синдром Пиквика, астма), скелетно-мышечные (опорно-двигательный аппарат) (неподвижность, дегенеративный остеоартрит, боль в нижней части спины (поясничная боль),остеопороз), кожные (полосы растяжения кожи или стрии (растяжки), веностаз нижних конечностей,лимфедема, целлюлит, интертриго, карбункулы, акантогератодермия, папилломы), желудочно-кишечные(гастроэзофагеальная рефлюксная болезнь, неалкогольная жировая болезнь печени/стеатогепатит, холелитиаз (камни в желчном пузыре), грыжа, рак толстой кишки), мочеполовые (недержание мочи при напряжении, обусловленная ожирением гломерулопатия, рак молочной железы и матки), психологические(депрессия и низкая самооценка, ухудшение качества жизни) и эндокринные (метаболический синдром,диабет типа 2, дислипидемия, гиперандрогенемия у женщин, синдром поликистозного яичника, дисменорея, бесплодие, осложнения при беременности, мужской гипогонадизм) заболевания. Применение соединений по изобретению можно комбинировать с соответствующим снижением потребления калорий с пищей и физическими упражнениями. Понятно, что конкретный уровень дозы для каждого конкретного пациента зависит от различных факторов, общего состояния здоровья, пола, диеты, времени введения, пути введения, скорости экскреции, комбинации лекарств и конкретного заболевания, подлежащего лечению. Оптимальные уровни доз и частоту введения доз можно определить с помощью клинического испытания, необходимого в фармацевтике. Однако для введения человеку общая суточная доза соединений по изобретению может, как правило, быть в пределах от 1 до 1000 мг, что, естественно, зависит от способа введения. Например, для перорального введения может потребоваться доза от 10 до 1000 мг, тогда как для внутривенной дозы может потребоваться лишь 1-500 мг. Общую суточную дозу можно вводить в виде однократной дозы или в виде раздельных доз и эта доза может, по предписанию врача, выходить за рамки типичных интервалов по данному описанию. Эти дозировки рассчитывают с учетом среднего веса тела человека, примерно от 60 до 100 кг. Врач легко может определить дозы для людей, вес которых выходит за пределы этого интервала, таких как дети и престарелые пациенты, и, в особенности, пациенты, страдающие ожирением. Соединения, к которым относится изобретение, можно приготовить для введения любым путем, соответствующим их фармакокинетическим свойствам. Композиции для перорального введения могут быть в виде таблеток, капсул, порошков, гранул, пастилок, жидких и гель-препаратов, таких как пероральные, топические или стерильные растворы или суспензии. Таблетки и капсулы для перорального введения могут быть представлены в виде стандартной (унифицированной) дозы и могут содержать подходящие эксципиенты, такие как связующие, например сироп, аравийская камедь, желатин, сорбит, трагакант или поливинилпирролидон; наполнители, например лактозу, сахар, маисовый крахмал, фосфат кальция, сорбит или глицин; смазку для таблетирования, например стеарат магния, тальк, полиэтиленгликоль или диоксид кремния; дезинтегранты, например картофельный крахмал, или приемлемые смачи- 10017170 вающие агенты, такие как лаурилсульфат натрия. Таблетки могут быть покрыты оболочкой в соответствии с обычной фармацевтической практикой. Пероральные жидкие препараты могут быть, например, в виде водных или масляных суспензий, растворов, эмульсий, сиропов или эликсиров или могут быть представлены в виде сухого продукта для восстановления перед применением водой или другим подходящим растворителем. Такие жидкие препараты могут содержать обычные добавки, такие как суспендирующие агенты, например сорбит, сироп, метилцеллюлоза, сироп глюкозы, желатин, гидрогенизированные пищевые жиры; эмульгирующие агенты, например лецитин, сорбитан моноолеат или аравийская камедь; неводные носители (которые могут включать пищевые масла), например миндальное масло,фракционированное кокосовое масло, маслообразные сложные эфиры, такие как эфиры глицерина, пропиленгликоль или этиловый спирт; консерванты, например метил или пропил п-гидроксибензоат или сорбиновая кислота, и, при желании, вещества, придающие вкус и запах, или красители. Активный ингредиент можно также вводить парентерально в стерильной среде. В зависимости от используемых носителя и концентрации лекарство может либо суспендироваться, либо растворяться в носителе. Предпочтительно, чтобы адъюванты, такие как местный анестетик, консервант и буферизующие агенты, можно было растворять в носителе. Синтез. Существует множество методов синтеза соединений (I), к которым относится настоящее изобретение, но в основе их всех лежат химические реакции, известные специалисту в области синтетической органической химии. Так, соединения формулы (I) можно синтезировать методами, описанными в классической литературе и общеизвестной специалисту в области синтетической органической химии. Типичные литературные источники включают "Advanced organic chemistry", 4th Edition (Wiley), J. March,"Comprehensive Organic Transformation", 2nd Edition (Wiley), R.C. Larock, "Handbook of Heterocyclic Chemistry", 2nd Edition (Pergamon), A.R. Katritzky, P.G.M. Wuts and T.W. Greene "Greene's Protective Groups inOrganic Chemistry" 4th Edition (Wiley), обзорные статьи, такие как печатаемые в "Synthesis", "Асе. Chem.Res.", "Chem. Rev", или первичные литературные источники, определяемые в результате обычного литературного поиска он-лайн или из вторичных источников, таких как "Chemical Abstracts" или "Beilstein". Общие методы синтеза. Способы, представленные ниже, не являются исчерпывающими. Экспериментальные условия являются общими, и их можно найти в обычных литературных источниках, таких как приведенные выше. Конкретные ссылки даются для сведения и условия могут применяться к данному субстрату с модификацией/оптимизацией или без модификации/оптимизации. Соединения формулы (I) можно получать введением фрагмента -N(R3)R2-A2 в соответствующую карбоновую кислоту или в защищенную форму изображенной карбоновой кислоты, показанной на следующей схеме. Схема 1 Так, группа HN(R3)R2-A2 содержит нуклеофильный азотный центр и остающаяся часть может включать конечный заместитель, защищенный вариант заместителя (например, сложный эфир) или группу, которую можно превратить в конечный заместитель стандартными методами, известными специалистам в данной области техники (например, в области превращения нитрила в тетразол). Итак, соединения формулы (I) можно получать либо непосредственно в результате реакции на схеме 1, либо после стандартных превращений, таких как снятие защитной группы. Карбоновые кислоты могут быть в активированной форме (например, в виде хлорангидридов кислот или в виде активных сложных эфиров) или же можно осуществлять непосредственное превращение кислоты, используя подходящие конденсирующие агенты, такие как дициклогексилкарбодиимид(ДЦКД), и промоторы, такие как 1-гидроксибензотриазол (НОВТ). Соединения формулы (I) можно также получать в результате реакции, близкой описанной выше, в ходе которой производное карбоновой кислоты (например, нитрил, сложный эфир или амид) или другой подходящий предшественник после образования амида превращается в группу А 1, например, как показано на следующей схеме. Схема 2- 11017170 Такой метод может включать, например, превращение нитрильной группы в тетразольную в стандартных условиях (например, под действием азида натрия и слабой кислоты, такой как диметиламина гидрохлорид, в полярном растворителе, таком как ДМФА (DMF или превращение нитрильной группы в карбоновую кислоту. Последнее превращение можно осуществить либо непосредственно (например,гидролизом в кислой или основной среде), либо в две стадии, включающие сначала образование сложного эфира или имидата (например, по реакции со спиртом и безводным хлористым водородом) с последующим гидролизом в стандартных условиях (например, водным раствором гидроксида натрия). Альтернативной стратегией получения соединений формулы (I) может быть введение фрагмента A1 алкилированием подходящего нуклеофильного центра. Так, возможные методы могут включать реакции,представленные на следующей схеме. Схема 3 Поэтому фрагмент R1 содержит нуклеофильный кислород, серу, азот или углерод, X представляет собой уходящую группу (например, бром), а группа A1 может представлять собой либо конечный заместитель, либо предшественник конечного заместителя, такой как нитрильная или сложноэфирная группа. Вышеприведенные методы применимы для синтеза соединений формулы (I), при этом R1, R2 и R3 включают разветвленную цепь или в которых R2 и R3 вместе образуют цикл. Или же эти соединения можно получать из родственного неразветвленного производного формулы (I) или его предшественника,например реакция одной или более групп R1, R2 или R3 в соответствующих активированных положениях с алкилирующим агентом (например, с йодистым метилом). Например, соединения формулы (I) можно получать алкилированием в альфа-положение к нитрильной группе, как показано на следующей схеме. Схема 4 Это превращение можно осуществлять, например, используя сильное основание, такое как диизопропиламид лития (LDA) в апротонном растворителе (например, в ТГФ (THF и в присутствии соответствующих веществ, способствующих реакции (кофакторов) (например, ТМЭДА (TMEDA, методами,хорошо известными специалистам в данной области техники. Следовательно, соединения формулы (I) можно получать превращением нитрильной группы в тетразол или в карбоновую кислоту в соответствии с описанными выше процедурами. Или же соединения формулы (I) можно получать из других соединений формулы (I) взаимопревращением функциональных групп на конечной стадии. Например, заместитель R5 можно ввести в фенильное кольцо или фрагмент А 3 на конечной стадии. Такое превращение можно осуществлять также с интермедиатом, который можно превратить в соединения формулы (I), или с защищенным вариантом интермедиатов. Аналогично, заместители можно также ввести во фрагмент R2 на конечной стадии реакции. Реагенты, применяемые в вышеприведенных схемах, либо могут быть описаны в литературе, либо их можно получить методами, аналогичными тем, которые описаны в литературе, в некоторых случаях после простых превращений функциональных групп, известных специалистам в данной области техники. Экспериментальный раздел включает примеры различных синтетических методов, и специалист в данной области техники может применить аналогичные методы с помощью процедур, описанных в литературе, для получения соединений, представленных формулой (I). Анализ. Спектры 1H ЯМР регистрируют на спектрометре Bruker Avance AMX 300 МГц и химические сдвиги указаны для выбранных соединений в миллионных долях (м.д., ppm) в слабое поле относительно тетраметилсилана в качестве внутреннего стандарта. Анализ ВЭЖХ проводят в следующих стандартных условиях. Колонка: Gemini С 18, 5 мкм, 2,050 мм. Скорость потока: 1,2 мл/мин.- 12017170 Градиент: ацетонитрил в 0,1% водной трифторуксусной кислоте; 10-95% ацетонитрила 3,5 мин, затем 95% ацетонитрила 1,0 мин. Прибор: система Agilent 1100 HPLS/MSD, УФ-детекция при 254 нм. Метод MS-ионизации: API-ES (положит. или отриц.). Данные для всех соединений выражают в виде времени удерживания (RT) и молекулярного иона(М+Н)+ или (М-Н)-. Сверхпроизводительную UPLC/MS проводят на приборе Waters Acquity в следующих стандартных условиях. Колонка: ACQUITY UPLC ВЕН С 18, 1,7 мкм, 2,150 мм. Скорость потока: 0,5 мл/мин. Градиент: 0,1-1,0 мин: 24-94% ацетонитрила в воде, 1-1,8 мин: 94% ацетонитрила. Модификатор: 0,1% НСООН. Метод MS-ионизации: API-ES (положит. или отриц. ионизация). Препаративная ВЭЖХ. Препаративную ВЭЖХ проводят, отбирая фракции по молекулярной массе в следующих стандартных условиях. Колонка: YMC 19100 мм. Скорость потока: 20 мл/мин. Градиент: 0-8 мин: 10-70% MeCN в воде, 8-9 мин: 70-95% MeCN в воде, 9-12 мин: MeCN. Модификатор: 0,1% ТФК (TFA). Метод MS-ионизации: API-ES (положит.) Синтез интермедиатов. Интермедиаты формулы [А], [В] и [С] получают по следующей схеме. Схема 5 Пиразольные производные формулы [А] можно получать общеизвестными методами (J. Med.Chem., 1999, 42, 769-776). Интермедиаты формулы [В] получают из соединений формулы [А] бромированием Nбромсукцинимидом (NBS) в присутствии катализатора 2,2-азо-бис-изобутиронитрила (AIBN) в четыреххлористом углероде с последующей реакцией с цианистым калием в водном этаноле и гидролизом водным раствором гидроксида натрия. Интермедиаты формулы [С] получают из соответствующих интермедиатов формулы [В] и аминовR2A2R3NH конденсацией, используя либо гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида(EDAC) и 1-гидроксибензотриазол (НОВТ), либо предварительно получая хлорангидрид кислоты по реакции с оксалилхлоридом в присутствии катализатора N,N-диметилформамида (ДМФА, DMF). Интермедиаты формулы [D] и [Е] получают по следующей схеме. Схема 6 4-Ацетоксипиразольные производные формулы [D] можно получать общеизвестными методами(Международная патентная заявка WO 2006035310). Конденсация с аминами R2A2R3NH, описанная выше, с последующим гидролизом в стандартных условиях дает интермедиаты формулы [Е]. Раствор 4'-хлорпропиофенона (33,7 г, 200 ммоль) в гептане (340 мл) при перемешивании под азотом прибавляют к раствору литий бис-(триметилсилил)амида (1 М в смеси гексанов, 240 мл, 240 ммоль) с такой скоростью, чтобы температура внутри колбы не превышала 25 С. Через 2 ч прибавляют диэтилоксалат (29,9 мл, 220 ммоль) и смесь перемешивают еще в течение 16 ч при 25 С. Полученный раствор фильтруют, промывают гептаном и частично высушивают в вакууме, получают литиевую соль этилового эфира (Z)-4-(4-хлорфенил)-2-гидрокси-3-метил-4-оксобут-2-еновой кислоты(76 г) в виде твердого вещества. Это твердое вещество (38 г) растворяют в уксусной кислоте (350 мл) и прибавляют 2 хлорфенилгидразина гидрохлорид (16,11 г, 90 ммоль). Смесь перемешивают при комнатной температуре в течение 3 ч, затем выливают в воду (680 мл), перемешивают 2 ч, полученный осадок отфильтровывают и частично высушивают в вакууме. Твердое вещество растворяют в уксусной кислоте (230 мл) и раствор кипятят 18 ч, охлаждают до комнатной температуры и выливают в воду (600 мл). Перемешивают 24 ч,выпавший осадок отфильтровывают, промывают водой, очищают перекристаллизацией из смеси 2 пропанол/вода. Полученное твердое вещество сушат в вакууме при 50 С, получают титульное соединение [А 1] (16,1 г, 48%). 1 2,2'-Азо-бис-изобутиронитрил (0,35 г, 2,13 ммоль) при перемешивании прибавляют к раствору [А 1](16 г, 42,6 ммоль) и N-бромсукцинимида (8,35 г, 46,9 ммоль) в четыреххлористом углероде (160 мл) и смесь кипятят 2 ч, затем охлаждают до комнатной температуры. Прибавляют насыщенный водный раствор метабисульфита натрия (30 мл) и смесь перемешивают 24 ч, прибавляют воду (160 мл) и рассол(40 мл) и экстрагируют этилацетатом (240 мл). Органические вытяжки экстрагируют 1 М раствором гидроксида натрия (100 мл), сушат безводным сульфатом магния и упаривают в вакууме. Остаток растворяют в этаноле (100 мл) и прибавляют раствор цианистого калия (8,33 г,127,8 ммоль) в воде (25 мл). Смесь кипятят 16 ч. Прибавляют 2 М раствор гидроксида натрия (20 мл) и кипятят еще 30 мин. К смеси прибавляют воду (300 мл), подкисляют 2 М соляной кислотой и экстрагируют этилацетатом (2300 мл). Объединенные органические вытяжки сушат сульфатом магния и фильтруют через слой силикагеля, промывают сначала этилацетатом, затем 1% раствором уксусной кислоты в этилацетате. Фильтрат упаривают в вакууме, остаток упаривают совместно с толуолом для удаления уксусной кислоты, получают титульное соединение [В 1] (14,7 г, 93%) в виде пены. 1 К раствору [В 1] (500 мг, 1,34 ммоль) и НОВТ (236 мг, 1.75 ммоль) в хлористом метилене (80 мл) при перемешивании при комнатной температуре под аргоном прибавляют EDAC (386 мг, 2,00 ммоль). Перемешивают 15 мин и прибавляют 1-(4-бромфенил)этиламин (322 мг, 1,61 ммоль) и продолжают пе- 14017170 ремешивать в течение 16 ч. Смесь промывают насыщенным водным раствором бикарбоната натрия (3),затем рассолом, сушат сульфатом магния, фильтруют и упаривают в вакууме, получают титульное соединение [С 1] (655 мг, 1,18 ммоль, 88%) в виде пены.LCMS: RT=3,450 мин. (М+Н)+=555,0. Методом, аналогичным описанному выше, из [B1] и соответствующих аминов получают также нижеприведенные интермедиаты формулы [С] Получают по описанной методике (Международная заявка WO 2006035310). Конденсацию кислоты [D1] и (R)-1-[4-(трифторметилфенил)]этиламина проводят по методике, описанной выше для получения [С 1], получают сложный эфир 1-(2-хлорфенил)-5-(4-хлорфенил)-3-[(R)-1(4-трифторметилфенил)этилкарбамоил]-1H-пиразол-4-илоксиуксусной кислоты.LCMS: tfa20p5.m Rt=3,49 мин. [М+Н]+=562,0. Этот сложный эфир (156 мг, 0,28 ммоль) растворяют в горячем метаноле. Одной порцией прибавляют карбонат калия (42 мг, 0,3 ммоль), получают бледно-желтый раствор, который перемешивают 1 ч при комнатной температуре. Реакционную смесь подкисляют 1 М соляной кислотой, прибавляют воду и дважды экстрагируют хлористым метиленом. Органические вытяжки объединяют, сушат безводным сульфатом магния, фильтруют и упаривают в вакууме, получают титульное соединение [Е 1] (115 мг,80%) в виде твердого вещества белого цвета. Соединения общей формулы [1]- 17017170 Синтез. Соединение [1.1]. Получают по методике, представленной на следующей схеме. Схема 7 К суспензии [С 1] (0,10 г, 0,197 ммоль) в этаноле (1,5 мл) при перемешивании под аргоном при комнатной температуре прибавляют хлортриметилсилан (0,5 мл, 3,94 ммоль). Смесь нагревают при 60 С в течение 3 ч, охлаждают до комнатной температуры и растворитель упаривают в вакууме. Остаток растворяют в хлористом метилене, промывают насыщенным водным раствором бикарбоната натрия, затем рассолом, сушат безводным сульфатом магния, фильтруют и упаривают в вакууме. Остаток очищают хроматографией на колонке с силикагелем градиентной элюцией смесью этилацетат/гептан, получают этиловый эфир [1-(2-хлорфенил)-5-(4-хлорфенил)-3-(4-фенил-3,6-дигидро-2 Н-пиридин-1-карбонил)-1Hпиразол-4-ил]уксусной кислоты (8,4 мг, 8%) в виде пены.LCMS: RT=3,448 мин. [М+Н]+=554,1. Раствор этого эфира (8,4 мг, 0,015 ммоль) и гидрата гидроксида лития (2,5 мг, 0,06 ммоль) в смеси тетрагидрофуран/вода (1:1, 6 мл) перемешивают при комнатной температуре в течение 16 ч, затем подкисляют, добавляя 1 М соляную кислоту. Прибавляют рассол и смесь экстрагируют хлористым метиленом. Органические вытяжки пропускают через фильтр для разделения фаз и раствор упаривают в вакууме, получая титульное соединение [1.1] (6,4 мг, 80%). Соединение [1.3]. К раствору [Е 1] (156 мг, 0,28 ммоль) в ацетоне прибавляют карбонат калия (26 мг) и этиловый эфир 2-бромпропионовой кислоты (этил 2-бромпропионат) (11 мкл, 0,10 ммоль). Полученную суспензию перемешивают при комнатной температуре в течение ночи, затем распределяют между хлористым метиленом и рассолом. Органический слой сушат безводным сульфатом магния, фильтруют и упаривают в вакууме. Остаток очищают хроматографией на колонке с силикагелем, элюируют сначала хлористым метиленом, затем смесью этилацетат/гептан (1/1), получают 142 мг этилового эфира 1-(2-хлорфенил)-5-(4 хлорфенил)-3-[(R)-1-(4-трифторметилфенил)этилкарбамоил]-1H-пиразол-4-илоксиуксусной кислоты.LCMS: RT=3,71 мин. [М+Н]+=532. К этому эфиру прибавляют гидроксид лития (12 мг) в 1,4 мл смеси ТГФ/вода (1:1) и смесь перемешивают 24 ч; затем смесь упаривают в вакууме, получают 117 мг [1.3] в виде твердого вещества белого цвета.LCMS: RT=3,74 мин. [М+Н]+=532. Соединения [1.2] и [1.4] получают аналогично [1.3], используя [Е 2] и [Е 3] соответственно и заменяя на стадии О-алкилирования этил 2-бромпропионат на этил К нитрилу (35 мг) в этаноле (300 мл) прибавляют гидроксид натрия (23 мг) и смесь кипятят в течение ночи. По охлаждении белый осадок динатриевой соли отфильтровывают и дважды промывают этанолом (50 мл) и сушат в течение ночи в вакуум-эксикаторе. Это твердое вещество растворяют в 500 мл воды, раствор подкисляют 4 N HCl и твердый продукт отфильтровывают и сушат 72 ч в вакуумэксикаторе, получают 36 г дикислоты [F1]. К этому продукту в толуоле (300 мл) прибавляют пиридин(2,2 мл) и уксусный ангидрид (15,6 мл) и реакционную смесь перемешивают при комнатной температуре в течение ночи. Прибавляют дополнительное количество пиридина (1 мл) и уксусного ангидрида (10 мл) и реакционную смесь перемешивают 2 ч сначала при комнатной температуре, а затем 45 мин при 50 С. Прибавляют этанол (150 мл) и реакционную смесь перемешивают 48 ч при комнатной температуре, упаривают в вакууме и остаток очищают перекристаллизацией из этанола, получают моноэфир [F2] (15,6 г). К моноэфиру [F2] (0,3 г) в хлористом метилене (2 мл), помещенному в баню со льдом, прибавляют оксалилхлорид (0,13 мл) и ДМФА (1 каплю) и реакционную смесь перемешивают 30 мин при этой температуре и 2 ч при комнатной температуре. Упаривают в вакууме, к остатку прибавляют хлористый метилен (2 мл) и реакционную смесь охлаждают в бане со льдом. Прибавляют DIPEA (0,46 мл) и (R)-Nметил-1-[4-(трифторметил)фенил]этиламин (0,17 г) и реакционную смесь перемешивают в течение ночи,упаривают и очищают хроматографией, получают амид (0,4 г). Этот продукт гидролизуют, используя раствор гидроксида лития (0,1 г) в воде (1,5 мл) и ТГФ (2 мл), упаривают в вакууме, очищают перекристаллизацией из смеси этилацетата и гептана, получают [1.7] в виде твердого вещества белого цвета(0,13 г). Соединения [1.5], [1.6] и [1.8] получают из [F2] из релевантного первичного или вторичного амина по методике, аналогичной методике, описанной для [1.7]. Соединение [1.11]. Схема 9 К раствору LDA (0,58 ммоль) в 5 мл ТГФ при -40 С прибавляют этиловый эфир (1-(2-хлорфенил)-5(4-хлорфенил)-3-метил-[(R)-1-(4-трифторметилфенил)этил]карбамоил-1 Н-пиразол-4-ил)уксусной кислоты (0,69 ммоль), полученного, как описано для [1.7] на стадии 4, схема 8, в 1 мл ТГФ и реакционную смесь перемешивают 30 мин при -40 С. Прибавляют чистый йодистый метил и смесь перемешивают еще в течение 1,5 ч при этой температуре. Реакционную смесь упаривают в слабом вакууме и очищают флэшхроматографией, получают 100 мг сырого эфира. Прибавляют гидроксид лития (100 мг) в смеси ТГФ:вода (1:1) и реакционную смесь перемешивают 72 ч, затем частично упаривают в слабом вакууме. Смесь подкисляют, добавляя 1 N HCl, экстрагируют хлористым метиленом, сушат и очищают флэшхроматографией (элюент 2 части этилацетата:1 часть гептана), получают титульное соединение (20 мг) в виде твердого вещества белого цвета. К раствору LDA (0,69 ммоль) в 5 мл ТГФ при -78 С прибавляют этиловый эфир (1-(2-хлорфенил)-5(4-хлорфенил)-3-метил-[(R)-1-(4-трифторметилфенил)этил]карбамоил-1H-пиразол-4-ил)уксусной кислоты (0,58 ммоль), полученного, как описано для [1.7] на стадии 4, схема 8, в 1 мл ТГФ и реакционную смесь перемешивают 30 мин при этой температуре. Прибавляют раствор 2-бензолсульфонил-3 оксазиридина (0,19 г, 0,69 ммоль) в 1 мл ТГФ и реакционную смесь перемешивают еще в течение 2 ч при этой температуре, затем прибавляют 0,3 мл воды. Реакционную смесь упаривают в слабом вакууме, прибавляют этилацетат (20 мл) и органическую фазу промывают водой (4 мл) и упаривают, получают сырой эфир (UPLCMS RT=1,02 мин. [М+Н]+=604,1). Прибавляют гидроксид лития (100 мг) в смеси ТГФ:вода(1:1) и реакционную смесь перемешивают 2 ч, затем частично упаривают в слабом вакууме. Смесь подкисляют, добавляя 1 N HCl, экстрагируют хлористым метиленом, сушат и очищают флэшхроматографией (элюент 2 части этилацетата:1 часть гептана), получают титульное соединение. Соединения общей формулы [2]- 23017170 Синтез. Соединение [2.1]. Получают по методике, представленной на следующей схеме. Схема 10(50 мг, 0,77 ммоль) и гидрохлорид диметиламмония (100 мг, 1,22 ммоль) и смесь перемешивают при 100 С в течение 16 ч. Смесь охлаждают до комнатной температуры и прибавляют 3% соляную кислоту(10 мл). Образовавшийся осадок отфильтровывают, промывают водой и сушат в вакууме. Сырой продукт очищают перекристаллизацией из смеси этилацетат/гептан, а затем хроматографируют на колонке с силикагелем, элюируя смесью этилацетат/гептан (1:2), получают титульное соединение [2.1] (19 мг,0,032 ммоль, 35%). Интермедиаты формулы [С] получают из соответствующих интермедиатов формулы [В] и аминовR3R4NH конденсацией, либо используя гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида(EDAC) и 1-гидроксипропилбензотриазол (НОВТ), либо сначала получая хлорангидрид кислоты с оксалилхлоридом и N,N-диметилформамидом (ДМФА, DMF) в качестве катализатора. Соединения [2.2]-[2.28] получают также из интермедиатов формулы [С] (полученных из [В 1]), используя соответствующие продажные амины R3R4NH, конденсацией амидов, показанной на схеме 5. Окончательное превращение интермедиатов [С] в соответствующий тетразол проводят по методике, аналогичной методике получения [2.1] на схеме 10. Для соединений из примеров [2.10], [2.19], [2.20] соответствующие непродажные амины синтезируют из соответствующих кетонов по следующей схеме. Синтез 1-(3-фтор-4-трифторметилфенил)этиламина. Колбу, содержащую 3-фтор-4-трифторметилацетофенон (1 г, 4,6 ммоль) и метанол (10 мл), охлаждают до 0 С, затем при перемешивании порциями прибавляют натрийборогидрид (175 мг, 4,6 ммоль). Реакционную смесь доводят до комнатной температуры и перемешивают 1 ч. Прибавляют воду и реакционную смесь экстрагируют этилацетатом. Объединенные органические вытяжки сушат Na2SO4,фильтруют и упаривают, получают 1-(3-фтор-4-трифторметилфенил)этанол. 1H ЯМР (CDCl3):1,52 (3 Н, д), 4,94 (1H, кв), 7,22-7,27 (2 Н, м), 7,59 (1H, т). К этому продукту прибавляют хлористый метилен (7 мл) и триэтиламин (0,7 мл) и колбу охлаждают в бане со льдом. Прибавляют метилсульфонилхлорид (0,32 мл) и реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Растворитель удаляют и прибавляют диметилформамид (6 мл) и азид натрия (0,50 г, 7,38 ммоль). Реакционную смесь перемешивают 2 ч при комнатной температуре,прибавляют воду и экстрагируют EtOAc. Объединенные органические вытяжки сушат Na2SO4, фильтруют и упаривают, получают сырой продукт. Очистка хроматографией (диоксид кремния, EtOAc/гептан,1:1) дает 0,4 г (общий выход 37%) С-азидо-С-(3-фтор-4-трифторметилфенил)метиламина. 1 Н ЯМР (CDCl3):1,47 (3 Н, д), 4,60 (1H, кв), 7,09-7,15 (м, 2 Н), 7,54 (1H, т). Аналогичную методику используют для синтеза С-азидо-С-(3-фтор-4-хлорфенил)метиламина 1H ЯМР (CDCl3):1,42 (3 Н, д), 4,82 (1H, кв), 7,16-7,28 (м, 3 Н). С-Азидо-С-(3-фтор-4-трифторметилфенил)метиламин (0,4 г) растворяют в метаноле (6 мл). Колбу откачивают и заполняют азотом, а затем в колбу помещают каталитическое количество Pd/C. Реакционную смесь помещают в атмосферу водорода и перемешивают при комнатной температуре в течение ночи. Колбу откачивают и заполняют азотом, затем реакционную смесь фильтруют через целит. Растворитель отгоняют и сырой продукт очищают на колонке (силикагель, CH2Cl2, а затем CH2Cl2/MeOH, 9:1),получают 120 мг (34%) 1-(3-фтор-4-трифторметилфенил)этиламина. 1(0,45 г, 1,72 ммоль), 2 N HCl (2 мл) и ТГФ (2 мл). Реакционную смесь перемешивают при комнатной тем- 24017170 пературе в течение 2 ч, прибавляют NaHCO3 (10 мл) и доводят рН до 8, экстрагируют хлористым метиленом (230 мл) и промывают рассолом. Объединенные органические вытяжки сушат Na2SO4, фильтруют и упаривают, получают сырой продукт. Очисткой хроматографией (силикагель (диоксид кремния),EtOAc/гептан, 1:1, затем CH2Cl2/МеОН 9:1 и с добавлением SCX колонки) дает 93 мг (30%) 1-(2-фтор-4 бромфенил)этиламина. 1H ЯМР (CDCl3):1,44 (3 Н, д), 2,48 (2 Н, уш с), 4,41 (1H, кв), 7,19-7,40 (3 Н, м). Ту же методику применяют для синтеза 1-(3-фтор-4-хлорфенил)этиламина. 1 К соединению [G1] (2,83 г, полученному, как описано в Международной заявке WO 2006/035310) в хлористом метилене (40 мл), прибавляют DIPEA (2,8 мл) и уксусный ангидрид (1,45 мл) и реакционную смесь перемешивают при комнатной температуре в течение ночи, промывают лимонной кислотой, рассолом, сушат и упаривают в вакууме до объема 10 мл. Прибавляют гептан (40 мл) и продукт осаждают. Осадок отфильтровывают и сушат в вакууме, получают 2,8 г соединения [G2]. К соединению [G2](200 мг) и HOBt (102 мг) в хлористом метилене (8 мл) прибавляют EDAC (147 мг), перемешивают 40 мин и прибавляют (R)-1-[4-(трифторметил)фенил]этиламин (110 мг) и реакционную смесь перемешивают в течение ночи при комнатной температуре, упаривают в вакууме и очищают хроматографией, получают 156 мг амида, который обрабатывают карбонатом калия (42 мг) в метаноле (5 мл) в течение 2 ч при комнатной температуре, частично упаривают, подкисляют разбавленной HCl и экстрагируют хлористым метиленом. Органические вытяжки сушат и упаривают, получают 115 мг [G3]. К раствору [G3] (65 мг) в ацетоне прибавляют бромацетонитрил (9,6 мкл) и карбонат калия (35 мг) и смесь перемешивают при комнатной температуре в течение ночи, затем распределяют между хлористым метиленом и рассолом. Органический слой отделяют, сушат и упаривают, получают 60 мг [G4], к которому затем прибавляют трибутилоловооксид (30 мг), триметилсилилазид (23 мкл) и нагревают при 160 С в течение 10 мин в микроволновой печи. Аликвоту остатка очищают хроматографией, получают 2,5 мг титульного соединения.LCMS RT=3,2 мин. [M+H]+=602,1. Соединения общей формулы [4]. Получают из интермедиата [А 2] по методу, представленному на схеме 5 и на схеме 9 и описанному для соединения [2.1].[А 2] получают аналогично интермедиату [А 1], но вместо 2-хлорфенилгидразина берут 2 фторфенилгидразин. Соединения общей формулы [6]. Получают из интермедиата [A3] по методике, аналогичной методике, представленной на схеме 8 и описанной для соединения [1.7].[A3] получают аналогично интермедиату [В], но вместо 2-хлорфенилгидразина берут 2 фторфенилгидразин. Биологические данные. Соединения тестируют в анализе функциональной активности в отношении каннабиоидного рецептора-1, описанном ниже, и определяют величины IC50 их антагонизма (противодействия) против СВ 1 рецепторного агониста. Величина IC50 соединений [1.1], [1.3], [1.4], [1.5], [1.6], [1.7], [1.9], [1.10], [1.11], [1.12], [2.1], [2.2],[2.3], [2.5], [2.6], [2.8], [2.9], [2.10], [2.11], [2.12], [2.13], [2.14], [2.15], [2.16], [2.17], [2.18], [2.19], [2.20],[2.21], [2.22], [2.23], [2.24], [2.25], [2.26], [2.27], [2.28], [3.1], [4.1], [4.2], [4.3], [5.1], [6.1], [6.2] ниже 0,30 мкМ. Величина IC50 соединений [1.2], [1.8], [2.4], [2.7] находится между 0,3 и 3,0 мкМ. Биологический анализ. Трансфекция и культура клеток - кДНК, кодирующую человеческий СВ 1 (каннабиоидный рецептор-1) рецептор (GenBank регистрационный номер NM016083), клонируют при использовании кДНК библиотеки жировой ткани человека и клонируют в эукариотический вектор экспрессии рсДНК 3.1(Invitrogen). Клетки яичников китайского хомячка (CHO-K1), стабильно экспрессирующие рекомбинантный человеческий СВ 1, получают, трансфецируя плазмиду, содержащую последовательность, кодирующую человеческий рецептор СВ 1, в клетки CHO-K1, при использовании липофектамина, в соответствии с инструкциями производителя. Резистентные клоны отбирают в присутствии G418 (Life technology)(600 мкг/мл). Стабильно трансфецированные клетки CHO-K1 сохраняют в культуральной среде Хэма F12 (Invitrogen), дополненной фетальной телячьей сывороткой (10%, Invitrogen), пенициллином(100 Ед/мл), стрептомицином (100 мкг/мл) (Life Technology) и G418 (600 мкг/мл). Функциональный анализ в отношении каннабиоидного рецептора-1. Функциональную активность вышеприведенных примеров соединений по изобретению оцениваютin vitro, определяя их способность ингибировать индуцированное СР 55940 [35S]GTPS связывание с мембранами, полученными из CHO-K1 клеток, экспрессирующих человеческий СВ 1 рецептор (описанных в разделе "Трансфекция и культура клеток"). СР 55940 представляет собой хорошо известный неселективный агонист СВ 1 и СВ 2 рецепторов (см., например, Felder et al., 1995, Molecular Pharmacology, (48) 44350). Мембраны получают по стандартной методике. Коротко говоря, клетки получают, используя 10 мМEDTA, и собирают центрифугированием. Пеллетированные клетки гомогенизируют в охлажденной льдом смеси 20 мМ Hepes (pH 7,4), 10 мМ EDTA и ингибиторов протеаз (таблетка полного коктейля ингибиторов протеаз, Roche) в гомогенизаторе Ultra Turrax. Гомогенат центрифугируют при 14000 об/мин в течение 45 мин при 4 С. Полученный осадок ресуспендируют в том же самом буфере, но только с 0,1 мМEDTA, и снова центрифугируют при 14000 об/мин в течение 45 мин при 4 С. Полученный осадок (мембраны) ресуспендируют в смеси 20 мМ Hepes (рН 7,4), 0,1 мМ EDTA, 2 мМ MgCl2 и ингибиторов протеаз и концентрацию белка определяют с помощью набора реагентов для микроанализа белка Micro BCA Protein Assay Reagent Kit (Pierce Biotechnology) в соответствии с инструкциями производителя. Анализ связывания [35S]GTPS SPA (анализ сцинтилляционной близости) осуществляют, инкубируя hCB1 мембраны (5 мкг/лунка) с 1 нМ [35S]GTPS (Perkin Elmer-NEG 030 Н) в присутствии 3 нМ СР 55940 и тестируемых соединений в различных концентрациях при комнатной температуре в течение 1 ч в 96 луночных микротитрационных планшетах. Затем добавляют бусины (гранулы) SPA (0,4 мг/лунка) (PVTWGA; RPNQ0001 Amersham Pharmacia Biotech) и инкубацию продолжают еще в течение 30 мин на орбитальном шейкере. Аналитический буфер содержит 50 мМ HEPES (рН 7.5), 50 мМ NaCl, 2,5 мМ MgCl2,0,1% BSA, 1 мкМ GDP и 100 мкг/мл сапонина. Микротитрационные планшеты центрифугируют при 1500 об/мин в течение 5 мин и сразу же читают радиоактивность с помощью счетчика Topcounter (PerkinElmer Life Sciences). Данные анализируют и величины IC50 определяют нелинейной регрессией с помощью программы Prism (GraphPad Software, San Diego).In vivo модель измерения действия на желудочно-кишечный транзит.In vivo эффективность тестируемых соединений определяют, проверяя их на антагонизм к действию агониста СВ 1 (каннабиоидного рецептора 1) R-(+)-WIN 55212 на желудочно-кишечный транзит у мышей NMRI (весом 20-30 г при входе, максимальный интервал в эксперименте 5 г). Метод аналогичен методу, описанному Lacroix and Guillaume (Current Protocols in Pharmacology, Wiley, New York, 5.3.1.5.3.8., 1998). Рецептор СВ 1 участвует в регуляции желудочно-кишечного транзита у грызунов. Стимуляция СВ 1 агонистом, таким как R-(+)-WIN 55212, снижает время транзита через желудочно-кишечный тракт, который (транзит) может быть блокирован антагонистом СВ 1 (например, римонабантом). Время транзита после введения R-(+)-WIN 55212 у мышей с генетической делецией СВ 1 рецептора не изменяется. Показано также, что введение одного антагониста СВ 1 может вызвать противоположный эффект агониста СВ 1: увеличить время транзита (например, Izzo et al., European Journal of Pharmacology, 384 (1999): 37-42 и Carai et al., British Journal of Pharmacology (2006): 1-8). В научной литературе высказывается мнение,что действие СВ 1 агонистов и антагонистов опосредуется главным образом периферическими СВ 1 рецепторами в кишечнике (например, Casu et al., European Journal of Pharmacology, 459 (2003): 97-105). Описанная модель широко применяется для получения in vivo характеристик СВ 1 антагонистов. Римонабант, проявивший в клинике активность при лечении ожирения, показывает четкую зависимость доза-эффект на модели, дополнительно подтверждая релевантность этой модели для измерения СВ 1 рецепторной in vivo активности. Животных выдерживают при нормальном 12-часовом световом дне. Если не указано иначе, еду(стандартная пища) и воду дают неограниченно (ad libitum). Тестируемые соединения растворяют в носителе 1: 5% N-метилпирролидона (Sigma) и 10% солютола (Solutol) (HS-15 от BASF) в воде и дозу вводят перорально (п.о., р.о.) через зонд в количестве 5 мл/кг. R-(+)-WIN 55212 (Sigma) диспергируют в растворе, содержащем 1% DMSO (ДМСО) и 49,5% 2-гидроксипропил-бета-циклодекстрина в дистиллированной воде (носитель 2), и дозу вводят интраперитонеально (и.п., i.p.) из расчета 10 мл/кг. В каждую экспериментальную группу входит 7 мышей. Эксперимент по желудочно-кишечному транзиту начинают после пищевой депривации в течение ночи. Мышам вводят 10% суспензию активированного угля (0,4 мл/мышь перорально с помощью зонда). В качестве растворителя для активированного угля используют 2,5% аравийскую камедь. Через 20 мин мышей умерщвляют цервикальной дислокацией и тонкий кишечник извлекают от кардии до слепой кишки. Измеряют расстояние, отмеченное головкой маркера, и выражают в процентах от общей длины тонкого кишечника. Действие тестируемых соединений оценивают после введения одной или более доз, вводимых п.о. за 45 мин до R-(+)-WIN 55212 (2,5 мг/кг), который вводят и.п. за 30 мин до введения активированного угля. На чертеже показано действие на желудочно-кишечный транзит после и.п. введения СВ 1 агонистаR-(+)-WIN 55212 (2.5 мг/кг) с предварительным введением (за 45 мин) или без предварительного введения соединения из примера 1.7 (3 и 10 мг/кг п.о.) или римонабанта (3 мг/кг п.о.). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) или его соль, гидрат, сольват или индивидуальный энантиомерR3 обозначает водород или C1-C4-алкил;R9 обозначает водород, С 1-С 4-алкил, С 3-C8-циклоалкил или полностью или частично фторированный С 1-С 4-алкил;R2 обозначает двухвалентный радикал формулы -Q1-[A4]v; А 4 обозначает фенильное или пиридинильное кольцо, необязательно, имеющее один или более за- 28017170 местителей, выбранных из -F, -Cl, -Br, -CN, -CF3, C1-C4-алкила, С 3-C8-циклоалкила, -OR9, оксо илиR10 и R11, оба, обозначают C1-С 3-алкил, или R10 и R11 вместе с атомом углерода, с которым они связаны, образуют циклопропильное кольцо. 2. Соединение по п.1, отличающееся тем, что в фенильном кольце, содержащем R5, R5 находится в пара-положении к связи, соединяющей указанное фенильное кольцо с пиразольным кольцом; и в циклеA3 R5 находится в орто-положении к связи, соединяющей А 3 с пиразольным кольцом. 3. Соединение по п.2, отличающееся тем, что радикал -R1- обозначает -C(R10)(R11)-, -C(R10)(R11)-O-,a R10 обозначает водород и R11 обозначает метил; или R10 и R11, оба, обозначают метил; или R10 и R11,вместе с атомом углерода, с которым они связаны, образуют циклопропильное кольцо; или -R1- обозначает -СН 2-, -СН(ОН), где связь, помеченная звездочкой, является связью с пиразольным циклом. 4. Соединение по п.2 или 3, отличающееся тем, что в радикале -R2 R10 обозначает водород и R11 обозначает метил, или R10 и R11, оба, обозначают метил, или R10 и R11 вместе с атомом углерода, с которым они связаны, образуют циклопропильное кольцо. 5. Соединение по п.4, отличающееся тем, что в радикале R2 A4 обозначает двухвалентный фениленовый радикал или пиридинильное кольцо, необязательно замещенное -F или -Cl. 6. Соединение по п.4 или 5, отличающееся тем, что радикал -R2- выбирают из где связь с азотом амидной группы показана звездочкой, а фенильное кольцо, необязательно, может иметь в качестве заместителя -F, -Cl, -Br, -CN, -CF3, C1-C4-алкил, циклопропил, -OR9, оксо или -NR7R8,где R9 обозначает водород, С 1-С 4-алкил или -CF3, a R7 и R8, независимо, обозначают водород или С 1-С 4 алкил. 7. Соединение по любому из пп.2-6, отличающееся тем, что R3 обозначает водород. 8. Соединение по любому из пп.2-4, отличающееся тем, что радикал -С(=О)-N(R3)-R2-A2 имеет формулу (Е) где R10 и R11 имеют значение по п.1, a R18 и R19, независимо, выбирают из водорода, (C1-С 4)алкила,-F, -CF3, -OCF3, -Br, -Cl, -ОСН 3 и -CN. 9. Соединение по п.8, отличающееся тем, что R10 обозначает водород или метил, R11 обозначает метил или этил, a R18 и R19, независимо, выбирают из водорода, -F, -Cl, -Br, -CN, -CF3 и -OCF3. 10. Соединение по любому из пп.2-9, отличающееся тем, что A1 обозначает тетразолил. 11. Соединение по п.1, имеющее формулу (IA), или его соль, гидрат, сольват, индивидуальный энантиомер
МПК / Метки
МПК: A61K 31/415, C07D 231/12, A61K 31/4155, C07D 403/06, C07D 401/12, A61P 3/00, C07D 231/18
Метки: св1, рецептора, модуляторы
Код ссылки
<a href="https://eas.patents.su/30-17170-modulyatory-receptora-sv1.html" rel="bookmark" title="База патентов Евразийского Союза">Модуляторы рецептора св1</a>
Предыдущий патент: Сельскохозяйственная рабочая машина, имеющая систему выгрузки для выгрузки сельскохозяйственного продукта
Следующий патент: Комбинированная терапия заболеваний нижних мочевыводящих путей с использованием лигандов α2δ и нестероидных противовоспалительных препаратов (нпвп)
Случайный патент: Строительный элемент для сборки несущего изолирующего перекрытия и способ сборки перекрытия












