Тиазолидинкарбоксамидные производные как модуляторы рецептора простагландина f
Номер патента: 7328
Опубликовано: 25.08.2006
Авторы: Паж Патрик, Жоран-Лебрэн Катрин, Шварц Маттиас, Амелен Эстелль, Томас Расселл Дж., Помель Венсан, Кваттропани Анна
Формула / Реферат
1. Применение соединения формулы II
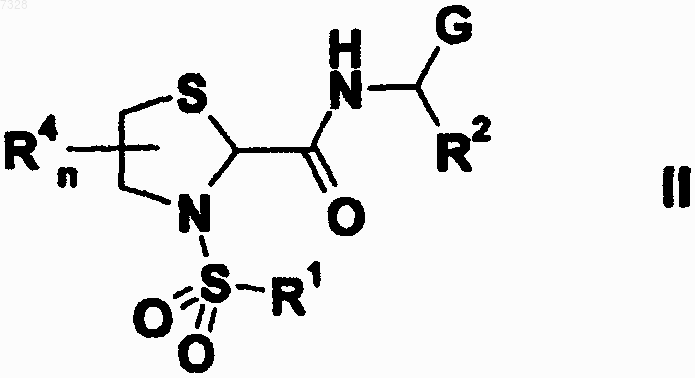
а также его геометрических изомеров, его оптически активных форм, таких как энантиомеры, диастереомеры, и его рацемических форм, а также их фармацевтически приемлемых солей и их фармацевтически активных производных, где
G выбирают из группы, состоящей из (C1-С6)алкиларила, (C1-С6)алкилгетероарила, (C1-С6)алкилциклоалкила, арила, гетероарила, (С3-С8)циклоалкила или -гетероциклоалкила, где указанные циклоалкильные, или арильные, или гетероарильные группы могут быть конденсированы с циклоалкильными, или арильными, или гетероарильными группами;
R1 выбирают из группы, состоящей из арила, гетероарила, (С3-С8)циклоалкила или 3-8-членного гетероциклоалкила, где указанные (гетеро)циклоалкильные, или арильные, или гетероарильные группы могут быть конденсированы с (гетеро)циклоалкильными, или арильными, или гетероарильными группами;
R2 выбирают из группы, состоящей из Н, карбокси, ацила, алкоксикарбонила, аминокарбонила, (C1-С5)алкилкарбокси, (C1-С5)алкилацила, (C1-С5)алкилалкоксикарбонила, (C1-С5)алкиламинокарбонила, (C1-С5)алкилацилокси, (C1-С5)алкилациламино, (C1-С5)алкилуреидо, (C1-С5)алкиламино, (C1-С5)алкилалкокси, (C1-С5)алкилсульфанила, (C1-С5)алкилсульфинила, (C1-С5)алкилсульфонила, (C1-С5)алкилсульфониламино, (C1-С5)алкилсульфонилокси, (C1-С6)алкила, (С2-С6)алкенила, (С2-С6)алкинила, арила, гетероарила, (С3-С8)циклоалкила, 3-8-членного гетероциклоалкила, (C1-С6)алкиларила, (С2-С6)алкилгетероарила, (C1-С6)алкилциклоалкила, (C1-С6)алкилгетероциклоалкила, (С2-С6)алкениларила, (С2-С6) алкенилгетероарила, (С2-С6)алкиниларила или (С2-С6)алкинилгетероарила; или
R2 и G могут образовывать (С3-С8)циклоалкильное кольцо;
R4 выбирают из группы, состоящей из (C1-С6)алкила, (С2-С6)алкенила, (C2-С6)алкинила;
n равно целому числу от 0 до 2;
для получения лекарственного средства для профилактики и/или лечения дисменореи, преждевременных родов, преждевременного родового акта и для задержки родов перед родоразрешением путем кесарева сечения.
2. Применение по п.1, где G представляет собой арильную группу.
3. Применение соединений по п.1 или 2 для ингибирования простагландинового рецептора.
4. Применение по п.3, где указанный простагландиновый рецептор представляет собой рецептор простагландина F2a .
5. Тиазолидинкарбоксамидные производные формулы (I)
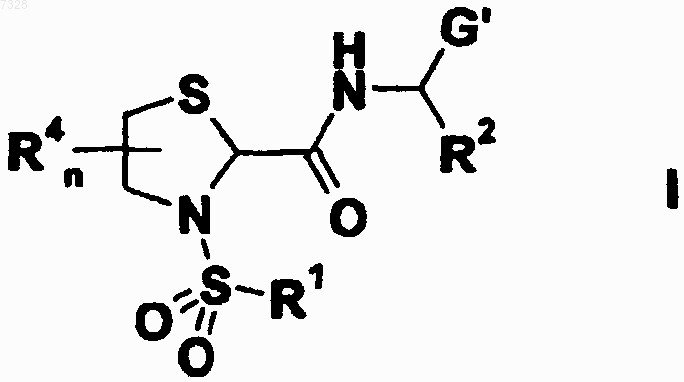
а также их геометрические изомеры, их оптически активные формы, такие как энантиомеры, диастереомеры, и их рацемические формы, а также их фармацевтически приемлемые соли и их фармацевтически активные производные, где
G' выбирают из группы, состоящей из арила, гетероарила, (С3-C8)циклоалкила или 3-8-членного гетероциклоалкила, где указанные циклоалкильные или арильные или гетероарильные группы могут быть конденсированы с циклоалкильными или арильными или гетероарильными группами;
R1, R2, R4 и n имеют значения, указанные в п.1.
6. Тиазолидинкарбоксамидные производные по п.5 формулы (Iа)
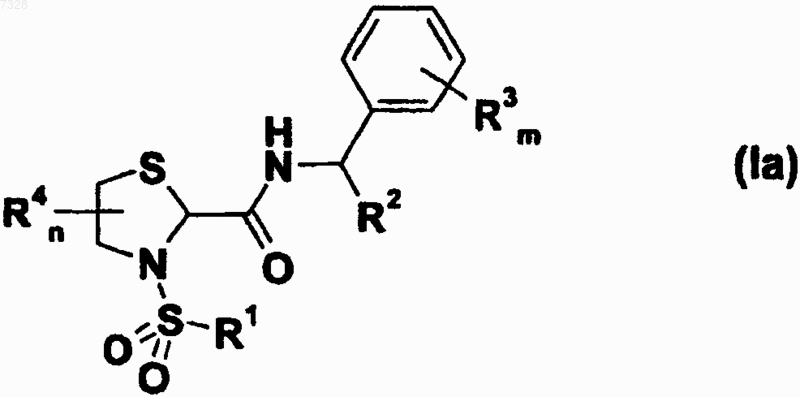
а также их геометрические изомеры, их оптически активные формы, такие как энантиомеры, диастереомеры, и их рацемические формы, а также их фармацевтически приемлемые соли и их фармацевтически активные производные, где
R1, R2, R4 и n имеют значения, указанные в п.1;
R3 выбирают из группы, состоящей из (C1-С6)алкила, (С2-С6)алкенила, (С2-С6)-алкинила, арила, гетероарила, (С3-C8)циклоалкила или гетероциклоалкила, (C1-С6)алкиларила, (C1-С6)алкилгетероарила, (C1-С3)алкилциклоалкила, (C1-С3)алкилгетероциклоалкила, (C2-С6)алкениларила или -гетероарила, (С2-С6)алкиниларила или -гетероарила, карбокси, циано, галогена, гидрокси, (C1-С6)алкокси, нитро, ациламино, уреидо, сульфониламино, сульфанила или сульфонила;
m равно целому числу от 0 до 3.
7. Тиазолидинкарбоксамидное производное по п.5 или 6, где R1 выбирают из группы, состоящей из арильной или гетероарильной группы, необязательно замещенной по меньшей мере одной группой, выбранной из группы, состоящей из арила, гетероарила, галогена, алкокси, сульфанила, линейного или разветвленного (C1-С6)алкила.
8. Тиазолидинкарбоксамидное производное по любому из пп.5-7, где R2 представляет собой группу (C1-С3)алкил-A-R5, где
А представляет собой О или группу формулы N-B-R6, где
В выбирают из группы, состоящей из связи, аминокислотного остатка, (С=O), (С=O)-O, (С=O)-NR7 или SO2;
R5, R6 и R7 независимо один от другого выбирают из группы, состоящей из Н, (C1-С6)алкила, (С2-С6)алкенила, (С2-С6)алкинила, арила, гетероарила, (С3-С8)циклоалкила или гетероциклоалкила, (C1-С6)алкиларила, (C1-С6)алкилгетероарила, (C1-С6)алкилциклоалкила, (C1-С6)алкилгетероциклоалкила, (С2-С6)алкениларила или -гетероарила, (С2-С6)алкиниларила или -гетероарила, или
R6 и R7 или R5 и B-R6 вместе с соответствующими атомами азота, к которым они присоединены, могут необязательно образовывать замещенное или незамещенное гетероциклоалкильное кольцо.
9. Тиазолидинкарбоксамидное производное по п.8, где R2 представляет собой (C1-С3)алкил-A-R5, где А представляет собой О и R5 представляет собой Н, или А представляет собой N-B-R6, причем В представляет собой связь, а R5 и R6, каждый независимо один от другого, выбирают из группы, состоящей из (C1-С3)алкила, включая (C1-С3)алкилгидрокси, (C1-С3)алкилкарбокси, (C1-С3)алкиламинокарбонил, (C1-С3)алкилалкоксикарбонил, (C1-С3)алкиларил, (C1-С3)алкилгетероарил, (C1-С3)алкилциклоалкил, (C1-С3)алкилгетероциклоалкил.
10. Тиазолидинкарбоксамидное производное по п.7, где R2 выбирают из группы, состоящей из фенила, пирид-2-ила, пирид-3-ила или пирид-4-ила.
11. Тиазолидинкарбоксамидное производное по любому из пп.5-9, где R1 представляет собой фенил, замещенный группой, выбранной из группы, состоящей из линейного или разветвленного (C1-С5) алкила или арила, R2 выбирают из группы, состоящей из (C1-С3)алкил-A-R5, где А представляет собой О и R5 представляет собой Н, или А представляет сосющ N-B-R6, причем В представляет собой связь и R5 и R6, каждый независимо, выбирают из группы, состоящей из (C1-С3)алкила, (C1-С3)алкиларила, (C1-С3)алкилгетероарила, (C1-С3)алкилгидрокси.
12. Тиазолидинкарбоксамидное производное по п.11, где R1 представляет собой бифенильную или трет-бутилфенильную группу, R2 представляет собой (C1-С3)алкил-A-R5, где А представляет собой О и R5 представляет собой Н, или А представляет собой N-B-R6, и R5 и R6 представляют собой, независимо один от другого, (C1-С3)алкил, (C1-С3)алкиларил, (C1-С3)алкилгетероарил или (C1-С3)алкилгидрокси, В представляет собой связь, R3 представляет собой фтор, m равно 0, 1 или 2, и n равно 0.
13. Тиазолидинкарбоксамидное производное по любому из предшествующих пунктов, выбранное из группы, включающей
(2R)-3-([1,1'-бифенил]-4-илсульфонил)-N-[(1S)-3-гидрокси-1-фенилпропил]-1,3-тиазолидин-2-карбоксамид,
(2R)-3-([1,1'-бифенил]-4-илсульфонил)-N-[(R)-фенил(2-пиридинил)метил]-1,3-тиазолидин-2-карбоксамид,
(2R)-3-[(4-трет-бутилфенил)сульфонил]-N-[(1S)-3-гидрокси-1-фенилпропил]-1,3-тиазолидин-2-карбоксамид,
(2R)-N-[(1S)-3-гидрокси-1-фенилпропил]-3-[(4-трет-пентилфенил)сульфонил]-1,3-тиазолидин-2-карбоксамид,
(2S)-2-({[3-([1,1'-бифенил]-4-илсульфонил)-1,3-тиазолидин-2-ил]карбонил}амино)-3-фенилпропановая кислота,
(2S)-2-[({3-[(5-хлор-3-метил-1-бензотиен-2-ил)сульфонил]-1,3-тиазолидин-2-ил}карбонил)амино]-3-фенилпропановая кислота,
(2S)-3-([1,1'-бифенил]-4-илсульфонил)-N-((1S)-3-{метил[2-(2-пиридинил)этил]амино}-1-фенилпропил)-1,3-тиазолидин-2-карбоксамид,
(2S)-3-([1,1'-бифенил]-4-илсульфонил)-N-[(1S)-1-фенил-2-пропенил]-1,3-тиазолидин-2-карбоксамид,
(2S)-3-([1,1'-бифенил]-4-илсульфонил)-N-[(1S)-3-(диэтиламино)-1-фенилпропил]-1,3-тиазолидин-2-карбоксамид,
(2S)-3-([1,1'-бифенил]-4-илсульфонил)-N-[(1S)-3-гидрокси-1-фенилпропил]-1,3-тиазолидин-2-карбоксамид,
(2S)-3-([1,1'-бифенил]-4-илсульфонил)-N-[(R)-фенил(2-пиридинил)метил]-1,3-тиазолидин-2-карбоксамид,
(2S)-3-([1,1'-бифенил]-4-илсульфонил)-N-{(1S)-3-[(2-фурилметил)(метил)амино]-1-фенилпропил}-1,3-тиазолидин-2-карбоксамид,
(2S)-3-([1,1'-бифенил]-4-илсульфонил)-N-{(1S)-3-[(2-гидроксиэтил)(метил)амино]-1-фенилпропил}-1,3-тиазолидин-2-карбоксамид,
(2S)-3-([1,1'-бифенил]-4-илсульфонил)-N-{(1S)-3-[2-(2-гидроксиэтил)-1-пиперидинил]-1-фенилпропил}-1,3-тиазолидин-2-карбоксамид,
(2S)-3-([1,1'-бифенил]-4-илсульфонил)-N-{(1S)-3-[4-(2-метоксифенил)-1-пиперазинил]-1-фенилпропил}-1,3-тиазолидин-2-карбоксамид,
(2S)-3-[(4-трет-бутилфенил)сульфонил]-N-[(1S)-3-гидрокси-1-фенилпропил]-1,3-тиазолидин-2-карбоксамид,
(2S)-3-фенил-2-{[(3-{[5-(2-пиридинил)-2-тиенил]сульфонил}-1,3-тиазолидин-2-ил)карбонил]амино} пропановая кислота,
(2S)-N-[(1S)-3-гидрокси-1-фенилпропил]-3-[(4-трет-пентилфенил)сульфонил]-1,3-тиазолидин-2-карбоксамид,
(2S)-N-{(1S)-3-[бензил(метил)амино]-1-фенилпропил}-3-([1,1'-бифенил]-4-илсульфонил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-(1-фенил-3-{[(2S)-тетрагидро-2-фуранилметил]амино}пропил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-(1-фенил-3-{[2-(1-пиперидинил)этил]амино}пропил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-(1-фенил-3-{[2-(2-пиридинил)этил]амино}пропил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-(1-фенил-3-{[2-(3-пиридинил)этил]амино}пропил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-(1-фенилпропил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-(2,3-дифторбензил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-(2,4-дифторбензил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-(2,5-дифторбензил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-(2,6-дифторбензил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-(2-хлор-4-фторбензил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-(2-фторбензил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-(2-фурилметил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-(2-метоксибензил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-(2-метилбензил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-(2-фенилпропил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-(2-тиенилметил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-(3,4-дифторбензил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-(3-{[(2R)-2-гидрокси-2-фенилэтил]амино}-1-фенилпропил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-(3-{[(2S)-2-гидроксипропил]амино}-1-фенилпропил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-(3-{[(5-метил-2-фурил)метил]амино}-1-фенилпропил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-(3-{[2-(1H-индол-3-ил)этил]амино}-1-фенилпропил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-(3-{[2-(1-метил-2-пирролидинил)этил]амино}-1-фенилпропил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-(3-{[2-(4-морфолинил)этил]амино}-1-фенилпропил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-(3-{[2-(диметиламино)этил]амино}-1-фенилпропил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-(3-{[3-(2-оксо-1-пирролидинил)пропил]амино}-1-фенилпропил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-(3-{[3-(4-морфолинил)пропил]амино}-1-фенилпропил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-(3-{метил[(1R)-1-фенилэтил]амино}-1-фенилпропил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-(3-{метил[(1S)-1-фенилэтил]амино}-1-фенилпропил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-(3-{метил[2-(2-пиридинил)этил]амино}-1-фенилпропил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-(3-хлор-4-фторбензил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-(3-фторбензил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-(3-гидрокси-1-фенилпропил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-(3-метилбензил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-(3-фенокси-1-фенилпропил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-(3-пиридинилметил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-(4-фторбензил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-(4-феноксибензил)-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[(1,5-диметил-1Н-пиррол-2-ил)метил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[(1-оксидо-2-пиридинил)метил]-1,3-тиазолидин-2-карбоксамида 1-оксид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[(1R)-2-гидрокси-1-фенилэтил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[(1R)-3-гидрокси-1-фенилпропил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[(1S)-1-фенилэтил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[(1S)-3-гидрокси-1-фенилпропил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[(R)-{6-[2-(диметиламино)этокси]-2-пиридинил}(фенил)метил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[(R)-фенил(2-пиридинил)метил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[(S)-фенил(2-пиридинил)метил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[1-(2,6-дифторфенил)-3-гидроксипропил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[1-(2-хлорфенил)-3-гидроксипропил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[1-(2-фурил)-3-гидроксипропил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[1-(3,4-дихлорфенил)-3-гидроксипропил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[1-(3-хлорфенил)-3-гидроксипропил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[1-(3-фурил)-3-гидроксипропил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[1-(4-хлорфенил)-3-гидроксипропил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[1-(4-хлорфенил)этил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[1-(4-фторфенил)-3-гидроксипропил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[1-(4-фторфенил)этил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[1-фенил-2-(1-пирролидинил)этил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[1-фенил-3-({[(1S,2R,3R,5S)-2,6,6-триметилбицикло[3,1,1]гепт-3-ил]метил}амино)пропил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[1-фенил-3-(1-пиперазинил)пропил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[1-фенил-3-(1-пиперидинил)пропил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[1-фенил-3-(1-пирролидинил)пропил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[2-(4-морфолинил)-1-фенилэтил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[2-(диметиламино)-1-фенилэтил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[3-((3R)-3-(гидроксиметил)-3,4-дигидро-2(1Н)-изохинолинил)-1-фенилпропил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[3-((3S)-3-(гидроксиметил)-3,4-дигидро-2(1Н)-изохинолинил)-1-фенилпропил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[3-(1,3-диоксо-1,3-дигидро-2Н-изоиндол-2-ил)-1-фенилпропил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[3-(2,5-дигидро-1H-пиррол-1-ил)-1-фенилпропил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[3-(3,5-диметил-1-пиперидинил)-1-фенилпропил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[3-(3,6-дигидро-1(2Н)-пиридинил)-1-фенилпропил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[3-(3-гидрокси-1-пиперидинил)-1-фенилпропил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[3-(3-гидрокси-1-пирролидинил)-1-фенилпропил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[3-(3-метил-1-пиперидинил)-1-фенилпропил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[3-(4-гидрокси-1-пиперидинил)-1-фенилпропил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[3-(4-гидрокси-4-фенил-1-пиперидинил)-1-фенилпропил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[3-(4-метил-1-пиперазинил)-1-фенилпропил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[3-(4-морфолинил)-1-фенилпропил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[3-(диэтиламино)-1-фенилпропил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[3-(диметиламино)-1-фенилпропил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[3-гидрокси-1-(2-метоксифенил)пропил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[3-гидрокси-1-(2-метилфенил)пропил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[3-гидрокси-1-(3-метоксифенил)пропил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[3-гидрокси-1-(3-пиридинил)пропил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[3-гидрокси-1-(4-метоксифенил)пропил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[3-гидрокси-1-(4-метилфенил)пропил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-[фенил(2-пиридинил)метил]-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-{1-фенил-3-[(2-фенилэтил)амино]пропил}-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-{1-фенил-3-[(2-фенилпропил)амино]пропил}-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-{1-фенил-3-[(2-пиридинилметил)амино]пропил}-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-{1-фенил-3-[(3-пиридинилметил)амино]пропил}-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-{1-фенил-3-[(тетрагидро-2-фуранилметил)амино]пропил}-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-{1-фенил-3-[4-(1-пирролидинил)-1-пиперидинил]пропил}-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-{3-[(2-фурилметил)(метил)амино]-1-фенилпропил}-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-{3-[(2-фурилметил)амино]-1-фенилпропил}-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-{3-[(2-гидрокси-2-фенилэтил)(метил)амино]-1-фенилпропил}-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-{3-[(2-гидрокси-2-фенилэтил)амино]-1-фенилпропил}-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-{3-[(2-гидроксициклогексил)амино]-1-фенилпропил}-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-{3-[(2-гидроксиэтил)(метил)амино]-1-фенилпропил}-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-{3-[(2-гидроксиэтил)амино]-1-фенилпропил}-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-{3-[(2-гидроксипропил)амино]-1-фенилпропил}-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-{3-[(2R)-2-(гидроксиметил)пирролидинил]-1-фенилпропил}-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-{3-[(2R)-2-(метоксиметил)пирролидинил]-1-фенилпропил}-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-{3-[(2S)-2-(метоксиметил)пирролидинил]-1-фенилпропил}-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-{3-[(3,5-дифторбензил)амино]-1-фенилпропил}-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-{3-[(3-гидрокси-3-фенилпропил)(метил)амино]-1-фенилпропил}-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-{3-[(3-гидроксипропил)амино]-1-фенилпропил}-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-{3-[(3R)-3-гидроксипирролидинил]-1-фенилпропил}-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-{3-[(4-фторбензил)амино]-1-фенилпропил}-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-{3-[[3-(диметиламино)пропил](метил)амино]-1-фенилпропил}-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-{3-[2-(гидроксиметил)-1-пиперидинил]-1-фенилпропил}-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-{3-[3-(гидроксиметил)-1-пиперидинил]-1-фенилпропил}-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-{3-[4-(2-гидроксиэтил)-1-пиперидинил]-1-фенилпропил}-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-{3-[4-(гидроксиметил)-1-пиперидинил]-1-фенилпропил}-1,3-тиазолидин-2-карбоксамид,
3-([1,1'-бифенил]-4-илсульфонил)-N-{3-[метил(2-фенилэтил)амино]-1-фенилпропил}-1,3-тиазолидин-2-карбоксамид,
3-[(3',4'-дихлор[1,1'-бифенил]-4-ил)сульфонил]-N-[1-(2-фурил)-3-гидроксипропил]-1,3-тиазолидин-2-карбоксамид,
3-[(4'-хлор[1,1'-бифенил]-4-ил)сульфонил]-N-[1-(2-фурил)-3-гидроксипропил]-1,3-тиазолидин-2-карбоксамид,
3-[(4-хлорфенил)сульфонил]-N-(2-пиридинилметил)-1,3-тиазолидин-2-карбоксамид,
3-[(4-хлорфенил)сульфонил]-N-{4-[({[(2-этилгексил)амино]карбонил}амино)метил]бензил}-1,3-тиазолидин-2-карбоксамид,
3-[(4-хлорфенил)сульфонил]-N-{4-[({[(2-фенилэтил)амино]карбонил}амино)метил]бензил}-1,3-тиазолидин-2-карбоксамид,
3-[(4-хлорфенил)сульфонил]-N-{4-[({[(4-метилбензил)амино]карбонил}амино)метил]бензил}-1,3-тиазолидин-2-карбоксамид,
3-[(4'-фтор[1,1'-бифенил]-4-ил)сульфонил]-N-[1-(2-фурил)-3-гидроксипропил]-1,3-тиазолидин-2-карбоксамид,
3-[(4-йодфенил)сульфонил]-N-{4-[({[(4-метилбензил)амино]карбонил}амино)метил]бензил}-1,3-тиазолидин-2-карбоксамид,
3-[(4-трет-бутилфенил)сульфонил]-N-(1,2-дифенилэтил)-1,3-тиазолидин-2-карбоксамид,
3-[(4-трет-бутилфенил)сульфонил]-N-(1-фенилэтил)-1,3-тиазолидин-2-карбоксамид,
3-[(4-трет-бутилфенил)сульфонил]-N-(2,3-дигидро-1Н-инден-1-ил)-1,3-тиазолидин-2-карбоксамид,
3-[(4-трет-бутилфенил)сульфонил]-N-(2-фурилметил)-1,3-тиазолидин-2-карбоксамид,
3-[(4-трет-бутилфенил)сульфонил]-N-(2-фенилпропил)-1,3-тиазолидин-2-карбоксамид,
3-[(4-трет-бутилфенил)сульфонил]-N-(3-гидрокси-1-фенилпропил)-1,3-тиазолидин-2-карбоксамид,
3-[(4-трет-бутилфенил)сульфонил]-N-(3-пиридинилметил)-1,3-тиазолидин-2-карбоксамид,
3-[(4-трет-бутилфенил)сульфонил]-N-[2-(1H-индол-3-ил)-1-метилэтил]-1,3-тиазолидин-2-карбоксамид,
3-[(4-трет-бутилфенил)сульфонил]-N-{[1-(4-хлорфенил)циклопропил]метил}-1,3-тиазолидин-2-карбоксамид,
3-[(4-трет-бутилфенил)сульфонил]-N-{4-[3-(диметиламино)пропокси]бензил}-1,3-тиазолидин-2-карбоксамид,
3-{[5-(3-изоксазолил)-2-тиенил]сульфонил}-N-{4-[({[(2-фенилэтил)амино]карбонил}амино)метил]бензил}-1,3-тиазолидин-2-карбоксамид,
этил {4-[(3S)-3-({[(2S)-3-([1,1'-бифенил]-4-илсульфонил)-1,3-тиазолидин-2-ил]карбонил}амино)-3-фенилпропил]-1-пиперазинил}ацетат,
метил [[(3S)-3-({[(2S)-3-([1,1'-бифенил]-4-илсульфонил)-1,3-тиазолидин-2-ил]карбонил}амино)-3-фенилпропил](метил)амино]ацетат,
N-(2,2-дифенилэтил)-3-(8-хинолинилсульфонил)-1,3-тиазолидин-2-карбоксамид,
N-(2-аминобензил)-3-([1,1'-бифенил]-4-илсульфонил)-1,3-тиазолидин-2-карбоксамид,
N-(3-{[2-(ацетиламино)этил]амино}-1-фенилпропил)-3-([1,1'-бифенил]-4-илсульфонил)-1,3-тиазолидин-2-карбоксамид,
N-(3-амино-1-фенилпропил)-3-([1,1'-бифенил]-4-илсульфонил)-1,3-тиазолидин-2-карбоксамид,
N-(3-аминобензил)-3-[(4-трет-бутилфенил)сульфонил]-1,3-тиазолидин-2-карбоксамид,
N-(3-гидрокси-1-фенилпропил)-3-[(4-феноксифенил)сульфонил]-1,3-тиазолидин-2-карбоксамид,
N-(4-аминобензил)-3-[(4-трет-бутилфенил)сульфонил]-1,3-тиазолидин-2-карбоксамид,
N-[(1R)-1-бензил-2-гидроксиэтил]-3-([1,1'-бифенил]-4-илсульфонил)-1,3-тиазолидин-2-карбоксамид,
N-[(6-амино-3-пиридинил)метил]-3-[(4-трет-бутилфенил)сульфонил]-1,3-тиазолидин-2-карбоксамид,
N-[1-(1,3-бензодиоксол-5-ил)-3-гидроксипропил]-3-([1,1'-бифенил]-4-илсульфонил)-1,3-тиазолидин-2-карбоксамид,
N-[1-(1-бензофуран-2-ил)-3-гидроксипропил]-3-([1,1'-бифенил]-4-илсульфонил)-1,3-тиазолидин-2-карбоксамид,
N-[1-(2-фурил)-3-гидроксипропил]-3-[{2'-метил[1,1'-бифенил]-4-ил}сульфонил]-1,3-тиазолидин-2-карбоксамид,
N-[1-(2-фурил)-3-гидроксипропил]-3-[(4'-метокси[1,1'-бифенил]-4-ил)сульфонил]-1,3-тиазолидин-2-карбоксамид,
N-[1-(2-фурил)-3-гидроксипропил]-3-[(4'-метил[1,1'-бифенил]-4-ил)сульфонил]-1,3-тиазолидин-2-карбоксамид,
N-[3-(1-азепанил)-1-фенилпропил]-3-([1,1'-бифенил]-4-илсульфонил)-1,3-тиазолидин-2-карбоксамид,
N-[3-(4-ацетил-1-пиперазинил)-1-фенилпропил]-3-([1,1'-бифенил]-4-илсульфонил)-1,3-тиазолидин-2-карбоксамид,
N-[3-(4-бензил-4-гидрокси-1-пиперидинил)-1-фенилпропил]-3-([1,1'-бифенил]-4-илсульфонил)-1,3-тиазолидин-2-карбоксамид,
N-[3-(ацетиламино)-1-фенилпропил]-3-([1,1'-бифенил]-4-илсульфонил)-1,3-тиазолидин-2-карбоксамид,
N-[3-(бензиламино)-1-фенилпропил]-3-([1,1'-бифенил]-4-илсульфонил)-1,3-тиазолидин-2-карбоксамид,
N-[4-({[(гексиламино)карбонил]амино}метил)бензил]-3-(фенилсульфонил)-1,3-тиазолидин-2-карбоксамид,
N-[4-({[(гексиламино)карбонил]амино}метил)бензил]-3-{[5-(3-изоксазолил)-2-тиенил]сульфонил}-1,3-тиазолидин-2-карбоксамид,
N-{3-[(1-адамантилметил)амино]-1-фенилпропил}-3-([1,1'-бифенил]-4-илсульфонил)-1,3-тиазолидин-2-карбоксамид,
N-{3-[(2R)-2-(анилинометил)пирролидинил]-1-фенилпропил}-3-([1,1'-бифенил]-4-илсульфонил)-1,3-тиазолидин-2-карбоксамид,
N-{3-[(2S)-2-(анилинометил)пирролидинил]-1-фенилпропил}-3-([1,1'-бифенил]-4-илсульфонил)-1,3-тиазолидин-2-карбоксамид,
N-{3-[бензил(2-гидроксиэтил)амино]-1-фенилпропил}-3-([1,1'-бифенил]-4-илсульфонил)-1,3-тиазолидин-2-карбоксамид,
N-{3-[бензил(метил)амино]-1-фенилпропил}-3-([1,1'-бифенил]-4-илсульфонил)-1,3-тиазолидин-2-карбоксамид,
N-{4-[({[(2-этилгексил)амино]карбонил}амино)метил]бензил}-3-[(4-йодфенил)сульфонил]-1,3-тиазолидин-2-карбоксамид,
N-бензгидрил-3-([1,1'-бифенил]-4-илсульфонил)-1,3-тиазолидин-2-карбоксамид,
N-бензгидрил-3-(8-хинолинилсульфонил)-1,3-тиазолидин-2-карбоксамид,
N-бензил{3-[(4-трет-бутилфенил)сульфонил]-1,3-тиазолидин-2-ил}метанамин,
N-бензил-3-([1,1'-бифенил]-4-илсульфонил)-1,3-тиазолидин-2-карбоксамид,
N-бензил-3-[(4-трет-бутилфенил)сульфонил]-1,3-тиазолидин-2-карбоксамид,
трет-бутил 3-{[({3-[(4-трет-бутилфенил)сульфонил]-1,3-тиазолидин-2-ил}карбонил)амино]метил}фенилкарбамат,
трет-бутил 5-{2-[({3-[(4-трет-бутилфенил)сульфонил]-1,3-тиазолидин-2-ил}карбонил)амино]этил}-2-пиридинилкарбамат,
(3S)-3-({[(2S)-3-(бифенил-4-илсульфонил)-1,3-тиазолидин-2-ил]карбонил}амино)-3-(2,6-дифторфенил)пропил L-валинат,
(3S)-3-(2,6-дифторфенил)-3-[({(2S)-3-[(2'-фторбифенил-4-ил)сульфонил]-1,3-тиазолидин-2-ил}карбонил)амино]пропил L-валинат,
(3S)-3-({[(2S)-3-(бифенил-4-илсульфонил)-1,3-тиазолидин-2-ил]карбонил}амино)-3-фенилпропил L-валинат,
(3S)-3-[({(2S)-3-[[2'-фторбифенил-4-ил]сульфонил]-1,3-тиазолидин-2-ил}карбонил)амино]-3-фенилпропил L-валинат,
(2S)-3-(бифенил-4-илсульфонил)-N-[(1S)-1-(4-фторфенил)-3-гидроксипропил]-1,3-тиазолидин-2-карбоксамид,
3-({[(3S)-3-({[3-(бифенил-4-илсульфонил)-1,3-тиазолидин-2-ил]карбонил}амино)-3-фенилпропил]амино}сульфонил)бензойная кислота,
(2S)-N-[(1S)-1-(2,6-дифторфенил)-3-гидроксипропил]-3-[(2'-фторбифенил-4-ил)сульфонил]-1,3-тиазолидин-2-карбоксамид,
(2S)-3-[(2'-фторбифенил-4-ил)сульфонил]-N-[(R)-фенил(пиридин-2-ил)метил]-1,3-тиазолидин-2-карбоксамид,
(2S)-3-[(2'-фторбифенил-4-ил)сульфонил]-N-[(S)-(1-метилпиперидин-4-ил)(фенил)метил]-1,3-тиазолидин-2-карбоксамид,
3-(бифенил-4-илсульфонил)-N-[(2-хлорпиридин-4-ил)(фенил)метил]-1,3-тиазолидин-2-карбоксамид,
3-(бифенил-4-илсульфонил)-N-[(6-гидроксипиридин-3-ил)(фенил)метил]-1,3-тиазолидин-2-карбоксамид,
(2S)-3-[(2'-фторбифенил-4-ил)сульфонил]-N-[(R)-фенил(пиридин-4-ил)метил]-1,3-тиазолидин-2-карбоксамид,
(2S)-3-[(4-йодфенил)сульфонил]-N-[(R)-фенил(пиридин-2-ил)метил]-1,3-тиазолидин-2-карбоксамид,
3-(бифенил-4-илсульфонил)-N-[[5-(2-гидроксиэтил)-1,2,4-оксадиазол-3-ил](фенил)метил]-1,3-тиазолидин-2-карбоксамид,
метил 2-метил-2-(4-{[2-({[(R)-фенил(пиридин-2-ил)метил]амино}карбонил)-1,3-тиазолидин-3-ил]сульфонил}фенил)пропаноат,
3-(бифенил-4-илсульфонил)-N-[(6-хлорпиридин-3-ил)(фенил)метил]-1,3-тиазолидин-2-карбоксамид,
(2S)-3-(бифенил-4-илсульфонил)-N-{(1S)-3-[метил(метилсульфонил)амино]-1-фенилпропил}-1,3-тиазолидин-2-карбоксамид,
3-{[4-(2-фтор-1,1-диметилэтил)фенил]сульфонил}-N-[(R)-фенил(пиридин-2-ил)метил]-1,3-тиазолидин-2-карбоксамид,
(2S)-3-[(4-бромфенил)сульфонил]-N-[(R)-фенил(пиридин-2-ил)метил]-1,3-тиазолидин-2-карбоксамид,
(3S)-3-фенил-3-[({(2S)-3-[(4-винилфенил)сульфонил]-1,3-тиазолидин-2-ил}карбонил)амино]пропил L-валинат,
3-(бифенил-4-илсульфонил)-N-[{5-[2-(диметиламино)этокси]пиридин-2-ил}(фенил)метил]-1,3-тиазолидин-2-карбоксамид,
3-(бифенил-4-илсульфонил)-N-[[6-(диметиламино)пиридин-3-ил](фенил)метил]-1,3-тиазолидин-2-карбоксамид,
3-(бифенил-4-илсульфонил)-N-[фенил-(1-L-валилпиперидин-4-ил)метил]-1,3-тиазолидин-2-карбоксамид.
14. Тиазолидинкарбоксамидное производное по любому из пп.5-13 для применения в качестве лекарственного средства.
15. Фармацевтичесъря композиция, содержащая по меньшей мере одно тиазолидинкарбоксамидное производное по любому из пп.5-13 и фармацевтически приемлемый носитель, разбавитель или эксципиент для него.
16. Способ получения тиазолидинкарбоксамидного производного формулы (Iа) по любому из пп.6-13, включающий
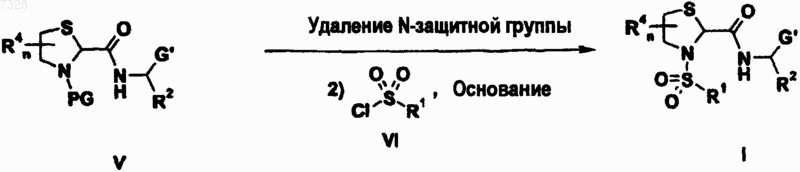
где PG, G', R1, R2, R4, m и n имеют значения, указанные выше.
17. Способ получения тиазолидинкарбоксамидного производного формулы (Iа) по любому из пп.6-13, включающий
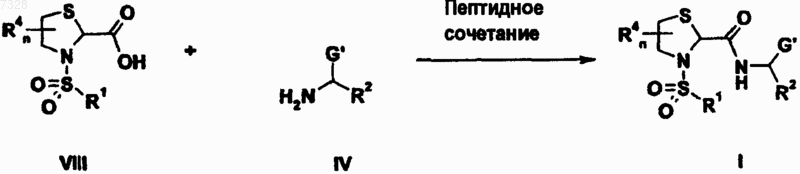
где G', R1, R2, R4, m и n имеют значения, указанные выше.
18. Промежуточное соединение формулы Va
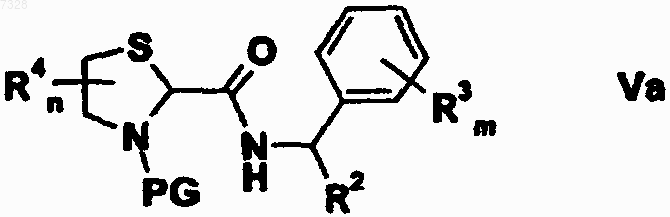
где PG представляет собой Н, R2, R4, n и m имеют значения, указанные в любом из пп.6-13, при условии, что R2 не является водородом.
19. Промежуточное соединение формулы VIII
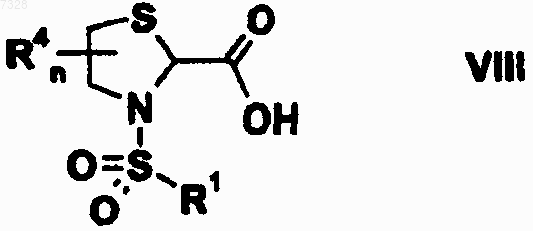
где R1 представляет собой 1,1'-бифенильную или трет-бутилфенильную группу и R4 и n имеют значения, указанные в любом из пп.6-13.
Текст
007328 Данное изобретение относится к тиазолидинкарбоксамидным производным формулы (II) для лечения и/или профилактики преждевременных родов, преждевременного родового акта, дисменореи и для задержки родов перед родоразрешением путем кесарева сечения. Конкретно, настоящее изобретение относится к замещенным тиазолидинкарбоксамидным производным для модуляции, особенно ингибирования активности или функции простагландиновых рецепторов, в частности, рецептора простагландина F2. Также настоящее изобретение относится к новым тиазолидинкарбоксамидным производным формул (I) и (Ia). В области акушерства одной из самых важных проблем является предотвращение преждевременных родов и преждевременных родовых актов, так как они представляют основную причину перинатальной заболеваемости и смертности. В последние годы накопились убедительные доказательства, показывающие, что гормон окситоцин играет главную роль в инициировании родов у млекопитающих, особенно у людей. Также предполагается, что окситоцин проявляет указанное действие прямым, а также косвенным путем, сокращая миометрий и усиливая синтез и высвобождение контрактильных простагландинов из эндометрия/децидуальной оболочки. Указанные простагландины также могут играть роль в процессе цервикального созревания. При родах высокие концентрации циркулирующего прогестерона вызывают неактивность матки, в то время как матка приобретает сократительную способность. Незадолго до срока концентрация прогестерона в плазме падает, экспрессия окситоциновых рецепторов в матке заметно возрастает, и повышается сократительная активность матки. В срок концентрации возрастают до пиковых, приводя к родам как результату взаимодействий двух положительных петель обратной связи. Первой является локальная маточная петля: в самой матке продуцируются и высвобождаются простагландины и другие маточные факторы в ответ на сокращения матки. Вторая петля вовлекает гипоталамус: в ответ на сокращения матки и вагинальное и цервикальное растяжение крупноклеточные окситоциновые нейроны в гипоталамусе повышают свою активность, что приводит к высвобождению окситоцина из терминалей их аксонов в задней доле гипофиза; высвобожденный окситоцин действует на матку, как стимулируя дальнейшее продуцирование простагландинов, так и внося вклад в дальнейшие сокращения матки. (Journal ofEndocrinology, 157, р.343-359 (1998), J.A. Russell and al.). Для лечения преждевременных родов рассматриваются несколько подходов, таких как применение сульфата магния, этанола или лечебных средств, действующих как 2-адренергические агонисты или антагонисты окситоцина. При применении сульфата магния отмечалось, что концентрации в плазме выше лечебного интервала 4-8 мг/дл могут вызвать подавление проводимости сердечного импульса и нервно-мышечной передачи, угнетение дыхания и остановку сердца, что, таким образом, делает данное средство непригодным,особенно когда ослаблена функция почек. Этанол эффективен при предупреждении преждевременных родов, но он не вызывает соответствующего снижения частоты фетального респираторного дистресса. Также предполагается, что этанол оказывает отрицательное воздействие на плод. 2-Адренергический рецептор, как правило, вызывает ингибирующее действие в тех клетках, где он экспрессируется (мышцы, сердце, матка и т.д.). 2-Адренергические агонисты используют для активирования указанного ингибирующего действия рецептора. Следовательно, 2-адренергические агонисты являются симпатомиметиками, которые, среди прочего, ингибируют сократимость матки. Известными 2-адренергическими агонистами для лечения преждевременных родов являются ритодрин, тербуталин и альбутерол. Антагонисты окситоцина Окситоцин (ОТ) представляет собой пептидный гормон, вызывающий сокращение матки у млекопитающих во время родов. Окситоциновые (ОТ) рецепторы существенно возрастают в числе в ходе беременности. Показано, что концентрация ОТ-рецепторов коррелирует со спонтанной активностью матки. В последние несколько лет в ряде статей сделаны предположения о том, что гормон окситоцин может быть физиологическим инициатором родов у некоторых видов млекопитающих, включая человека. Кроме того, полагают, что окситоцин проявляет такое действие с двух разных сторон, или непосредственно сокращая миометрий, или усиливая синтез и высвобождение контрактильных простагландинов из эндометрия/децидуальной оболочки. Поэтому путем блокирования окситоцина можно добиться прямого(контрактильного) и косвенного (усиление синтеза простагландинов) действия окситоцина на матку. Простагландины (PG), более конкретно, простагландин F2 (PGF2), играют ключевую роль в нормальной физиологии некоторых тканей, включая яичник, яйцевод, матку, семенник, легкое и, возможно,глаз и сердце, и вовлекаются в репродуктивные функции, такие как овуляция, лютеолиз и роды. Хорошо известно, что роды инициируются, когда простагландин F2 взаимодействует с FP (рецептор простагландина F) в лютеиновых клетках яичника беременной мыши, инициируя лютеолиз (Science, vol.277, р.681687 (1997), Yuhihiko Sugimoto et аl.). Действия PGF2 опосредуются рецептором PGF (FP), который является гетеротримерным рецептором типа родопсина, соединенного связывающим белком (белком G) с гуанозинтрифосфатом, специфическим для данного PG (Science, vol.277, p.681-83 (1998), YuhihikoSugimoto et аl.). Такие простагландины принадлежат к группе эйкозаноидов, продуцируемых за счет-1 007328 ферментативной активности циклооксигеназы. Вместе с тромбоксанами простагландины составляют простаноидную подгруппу эйкозаноидов. Простагландины (PG) опосредуют различные физиологические процессы, такие как зарождение лихорадки и воспаление. Аспирин и родственные лекарственные средства действуют через ингибирование биосинтеза PG.PGF2 синтезируется, в разной степени, почти каждой тканью организма и является стимулятором нескольких разных типов физиологических функций, включая гибель зернистых лютеиновых клеток,сокращение гладких мышц миометрия, регуляцию синтеза тестостерона клетками Лейдига, регуляцию мерцания ресничек яйцевода, бронхостеноз и метаболизм в костной ткани. Он синтезируется в зародышевых и материнских оболочках и действует на созревание шейки матки и сокращение миометрия.PGF2 является основным простагландином для усиления маточной сократимости. Специфические простагландиновые рецепторы (EP1, EP2, ЕP4 и FP) экспрессируются в миометрии человека. Активация рецепторов EP2 и ЕP4 приводит к релаксации гладких мышц, в то время как активация РGF2-селективного рецептора (рецептора FP) приводит к сокращению. Действительно, рецептор простагландина F2 действует через рецептор, соединенный с белком G, в сочетании с активацией фосфолипазы С, и возрастает в IР 3, что высвобождает Са 2+ из внутриклеточных пулов. Увеличение количества внутриклеточного кальция приводит к усиленному сокращению гладкой мышцы через активацию киназы легкой цепи миозина. Также известно, что мышь, утратившая FP-рецептор, имеет нормальную плодовитость, но не рожает в срок. Однако здоровые детеныши рождаются путем кесарева сечения. Одной из наиболее важных ролей PGF2 является роль лютеолитического агента в репродуктивной биологии. В отсутствие беременности, по окончании лютеиновой фазы, повышенные пульсирующие сывороточные уровни PGF2 (маточного происхождения) вызывают апоптозную клеточную гибель зернистых лютеиновых клеток (Res. Reprod., 16:1-2 (1984), McCracken). Имеются полученные в последнее время данные об активации контрактильного FP-рецептора с началом и в ходе родов. Также в недавних сообщениях указывается, что окситоцин индуцирует продуцирование PG в клетках миометрия человека через активацию СОХ-2. Такой механизм может объяснить отсроченное высвобождение PG в ткани матки, промотирующее роды. Следовательно, имеются убедительные доказательства того, что вмешательство в метаболизм простагландина путем селективного блокирования контрактильного FP-рецептора будет задерживать продвижение родов. Поэтому предполагают, что соединение, способное блокировать взаимодействие между PGF2 и его рецептором, т.е. антагонист рецептора PGF2, является более эффективным для лечения преждевременных родов, чем имеющиеся в настоящее время схемы лекарственного лечения. В силу вовлечения PGF2 в инициацию родов уже осуществлено несколько подходов к испытанию новых ингибиторов PGF2. Индометацин является хорошо известным ингибитором простагландина и уже испытан для изучения возможного способа воздействия на простагландины (Prostaglandins, 12(6),р.1053-9 (1976), Chatterjee А.). В J. Reprod. Fertil., 116(1), р.103-111 (1999), Williams B.J. et al. сообщают о том, что наблюдали, как меглюмин флуниксин разрушал нормальный профиль 13,14-дигидро-15-кетопростагландина F2, но не устранял полностью синтез простагландина или не задерживал начало родов у обработанных животных. Mattos R. et al. (Rev. Reprod., 5(1), р.38-45 (2000 используют полиненасыщенные жирные кислоты, такие как линолевая, линоленовая, эйкозапентаеновая и докозагексаеновая кислоты, которые могут ингибировать простагландин F2. В последнее время осуществлены испытания производного фенола, известного как ингибитор р 38(4-[5-(4-фторфенил)-4-(4-пиридил)имидазол-2-ил]фенола), и отмечается, что указанное соединение ингибирует как продуцирование простагландина F2, так и экспрессию СОХ-2, вызванную стимуляцией IL-1TsumuraCo. предложили ингибитор простагландина F2, активный для релаксации гладкой мышцы матки и эффективный для лечения абдоминальной боли, вызванной абортом, преждевременными родами и дисфункцией, за счет использования в качестве активного компонента фталидного производного(JP-01050818). В патенте (US 6271201), Board of Regents, the University of Texas System, раскрывается способ регуляции продуцирования плацентарными клетками тромбоксана и PGF2, включающий обработку плацентарных клеток фармакологически эффективным количеством инсулиноподобного фактора роста I, достаточным для ингибирования продуцирования тромбоксана и простагландина PGF2, без воздействия на продуцирование простациклина или простагландина Е 2. Настоящее изобретение относится к применению тиазолидинкарбоксамидных производных формулы (II),-2 007328 а также их фармацевтически приемлемых солей для получения фармацевтических композиций для лечения и/или предупреждения преждевременных родов, преждевременного родового акта, дисменореи и для задержки родов перед родоразрешением путем кесарева сечения. Соединения данного изобретения являются ингибиторами простагландиновых рецепторов, в частности рецептора простагландина F2 (FP). Настоящее изобретение также относится к новым тиазолидинкарбоксамидным производным формулы (I), где G' представляет собой арильную, гетероарильную или циклоалкильную или гетероциклоалкильную группу. В частности, настоящее изобретение относится к новым тиазолидинкарбоксамидным производным формулы (Iа): В настоящее время обнаружено, что соединения настоящего изобретения являются модуляторами простагландиновых рецепторов, в частности, функции рецептора простагландина F2 (FP). Когда рецептор простагландина F2 (FP) связан соединениями настоящего изобретения, PGF2 испытывает противодействие, будучи блокированным от своего рецептора, и, таким образом, становится неспособным проявлять свои биологические или фармакологические действия. Следовательно, соединения настоящего изобретения полезны при лечении и предупреждении преждевременных родов, преждевременного родового акта и для задержки родов перед родоразрешением путем кесарева сечения. Соединения настоящего изобретения также полезны при лечении дисменореи, которую можно определить как периодическую боль, связанную с менструацией во время овуляторного цикла. Полагают,что боль является результатом сокращений и ишемии матки, опосредуемых, вероятно, действием простагландинов, продуцируемых в секреторном эндометрии. За счет блокирования обоих действий простагландина F2 на матку, FP-антагонист более эффективен для лечения дисменореи, чем имеющиеся в настоящее время схемы лекарственного лечения. В частности, соединения настоящего изобретения также полезны при лечении и предупреждении связанных с простагландином расстройств у млекопитающих, и особенно у людей. Целью данного изобретения является обеспечение способа противодействия функциям простагландинов, в частности, простагландина F2, при болезненных состояниях у млекопитающих. Другой целью данного изобретения является обеспечение способа для предупреждения или лечения расстройств, связанных с простагландином F2, путем противодействия связыванию указанного простагландина с его рецептором. В следующем разделе даются определения различных химических групп, которые входят в состав соединений по изобретению и предназначаются для равнозначного применения во всем данном описании и формуле изобретения, если для более широкого определения не установлено специальное определение. Термин (C1-С 6)алкил относится к одновалентным алкильным группам с 1-6 атомами углерода. Примерами данного термина являются такие группы, как метил, этил, н-пропил, изопропил, н-бутил,изобутил, трет-бутил, н-гексил и т.п. Термин арил относится к ненасыщенной ароматической карбоциклической группе с 6-14 атомами углерода, содержащей одно кольцо (например, фенил) или несколько конденсированных колец (например, нафтил). Предпочтительные арилы включают фенил, нафтил, фенантренил и подобные группы. Термин (C1-С 6)алкиларил относится к (C1-С 6)алкильным группам с арильным заместителем,включая бензил, фенетил и подобные группы. Термин гетероарил относится к моноциклической гетероароматической или бициклической или трициклической с конденсированными кольцами гетероароматической группе. Конкретные примеры гетероароматических групп включают необязательно замещенные пиридил, пирролил, фурил, тиенил,имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразолил, 1,2,3-триазолил, 1,2,4-триазолил,1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, 1,3,4-триазинил, 1,2,3 триазинил, бензофурил, [2,3-дигидро]бензофурил, изобензофурил, бензотиенил, бензотриазолил, изобензотиенил, индолил, изоиндолил, 3 Н-индолил, бензимидазолил, имидазо[1,2-а]пиридил, бензотиазолил,-3 007328 бензоксазолил, хинолизинил, хиназолинил, фталазинил, хиноксалинил, циннолинил, нафтиридинил, пиридо[3,4-b]пиридил, пиридо[3,2-b]пиридил, пиридо[4,3-b]пиридил, хинолил, изохинолил, тетразолил,5,6,7,8-тетрагидрохинолил, 5,6,7,8-тетрагидроизохинолил, пуринил, птеридинил, карбазолил, ксантенил или бензохинолил. Термин (C1-С 6)алкилгетероарил относится к (C1-С 6)алкильным группам с гетероарильным заместителем, включая 2-фурилметил, 2-тиенилметил, 2-(1H-индол-3-ил)этил и подобные группы. Термин (С 2-С 6)алкенил относится к алкенильным группам, предпочтительно, с 2-6 атомами углерода и имеющим по меньшей мере 1 или 2 сайта алкенильного ненасыщения. Предпочтительные алкенильные группы включают этенил (-СН=СН 2), н-2-пропенил (аллил, -СН 2 СН=СН 2) и подобные группы. Термин (С 2-С 6)алкениларил относится к (С 2-С 6)алкенильным группам с арильным заместителем,включая 2-фенилвинил и подобные группы. Термин (С 2-С 6)алкенилгетероарил относится к (С 2-С 6)алкенильным группам с гетероарильным заместителем, включая 2-(3-пиридинил)винил и подобные группы. Термин (С 2-С 6)алкинил относится к алкинильным группам, предпочтительно, с 2-6 атомами углерода и имеющим по меньшей мере 1-2 сайта алкинильного ненасыщения, предпочтительные алкинильные группы включают этинил (-ССН), пропаргил (-СН 2 ССН) и подобные группы. Термин (С 2-С 6)алкиниларил относится к (С 2-С 6)алкинильным группам с арильным заместителем,включая фенилэтинил и подобные группы. Термин (С 2-С 6)алкинилгетероарил относится к (С 2-С 6)алкинильным группам с гетероарильным заместителем, включая 2-тиенилэтинил и подобные группы. Термин (С 3-С 8)циклоалкил относится к насыщенной карбоциклической группе с 3-8 атомами углерода, содержащей одно кольцо (например, циклогексил) или несколько конденсированных колец (например, норборнил). Предпочтительные циклоалкилы включают циклопентил, циклогексил, норборнил и подобные группы. Термин гетероциклоалкил относится к (С 3-С 8)циклоалкильной группе, имеющей значения, указанные выше, в которой вплоть до 3 атомов углерода заменено гетероатомами, выбранными из группы,состоящей из О, S, NR, причем R представляет собой водород или метил. Предпочтительные гетероциклоалкилы включают пирролидин, пиперидин, пиперазин, 1-метилпиперазин, морфолин и подобные группы. Термин (С 1-С 6)алкилциклоалкил относится к (С 1-С 6)алкильным группам с циклоалкильным заместителем, включая циклогексилметил, циклопентилпропил и подобные группы. Термин (С 1-С 6)алкилгетероциклоалкил относится к (С 1-С 6)алкильным группам с гетероциклоалкильным заместителем, включая 2-(1-пирролидинил)этил, 4-морфолинилметил, (1-метил-4 пиперидинил)метил и подобные группы. Термин карбокси относится к группе -С(О)ОН. Термин (С 1-С 5)алкилкарбокси относится к (С 1-С 5)алкильным группам с карбоксизаместителем,включая 2-карбоксиэтил и подобные группы. Термин ацил относится к группе -C(O)R, где R включает (С 1-С 6)-алкил, арил, гетероарил,(С 1-С 6)алкиларил или (С 1-С 6)алкилгетероарил. Термин (С 1-С 5)алкилацил относится к (С 1-С 5)алкильным группам с ацильным заместителем,включая 2-ацетилэтил и подобные группы. Термин ацилокси относится к группе -OC(O)R, где R включает (С 1-С 6)алкил, арил, гетероарил, (С 1-С 6)алкиларил или (С 1-С 6)алкилгетероарил. Термин (С 1-С 5)алкилацилокси относится к (С 1-С 5)алкильным группам с ацилоксизаместителем,включая 2-(ацетилокси)этил и подобные группы. Термин алкокси относится к группе -O-R, где R включает (С 1-С 6)алкил или арил или гетероарил или (С 1-С 6)алкиларил или (С 1-С 6)алкилгетероарил. Предпочтительные алкоксигруппы включают, например, метокси, этокси, фенокси и подобные группы. Термин (С 1-С 5)алкилалкокси относится к (С 1-С 5)алкильным группам с алкоксизаместителем,включая 2-этоксиэтил и подобные группы. Термин алкоксикарбонил относится к группе -С(О)OR, где R включает Н, (С 1-С 6)алкил или арил или гетероарил или (С 1-С 6)алкиларил или (С 1-С 6)алкилгетероарил. Термин (С 1-С 5)алкилалкоксикарбонил относится к (С 1-С 5)алкильным группам с алкоксикарбонильным заместителем, включая 2-(бензилоксикарбонил)этил и подобные группы. Термин аминокарбонил относится к группе -C(O)NRR', где каждый R и R' независимо включает водород или (С 1-С 6)алкил или арил или гетероарил или (С 1-С 6)алкиларил или (С 1 С 6)алкилгетероарил. Термин (С 1-С 5)алкиламинокарбонил относится к (С 1-С 5)алкильным группам с аминокарбонильным заместителем, включая 2-(диметиламинокарбонил)этил и подобные группы. Термин ациламино относится к группе -NRC(O)R', где каждый R и R' независимо представляет собой водород или (С 1-С 6)алкил или арил или гетероарил или (С 1-С 6)алкиларил или (С 1 С 6)алкилгетероарил.-4 007328 Термин (С 1-С 5)алкилациламино относится к (С 1-С 5)алкильным группам с ациламинозаместителем, включая 2-(пропиониламино)этил и подобные группы. Термин уреидо относится к группе -NRC(O)NR'R", где каждый R, R' и R" независимо представляет собой водород или (С 1-С 6)алкил или арил или гетероарил или (С 1-С 6)алкиларил или (С 1-С 6)алкилгетероарил, циклоалкил или гетероциклоалкил, и где R' и R" вместе с атомом азота, к которому они присоединены, могут необязательно образовывать 3-8-членное гетероциклоалкильное кольцо. Термин (С 1-С 5)алкилуреидо относится к (С 1-С 5)алкильным группам с уреидозаместителем, включая 2-(N'-метилуреидо)этил и подобные группы. Термин амино относится к группе -NRR', где каждый R и R' независимо представляет собой водород или (С 1-С 6)алкил или арил или гетероарил или (С 1-С 6)алкиларил или (С 1 С 6)алкилгетероарил, или циклоалкил или гетероциклоалкил, и где R и R' вместе с атомом азота, к которому они присоединены, могут необязательно образовывать 3-8-членное гетероциклоалкильное кольцо. Термин (С 1-С 5)алкиламино относится к (С 1-С 5)алкильным группам с аминозаместителем, включая 2-(1-пирролидинил)этил и подобные группы. Термин аммоний относится к положительно заряженной группе -N+RR'R", где каждый R, R' и R" независимо представляет собой (С 1-С 6)алкил или (С 1-С 6)алкиларил или (С 1-С 6)алкилгетероарил,или циклоалкил или гетероциклоалкил, и где R и R' вместе с атомом азота, к которому они присоединены, могут необязательно образовывать 3-8-членное гетероциклоалкильное кольцо. Термин галоген относится к атомам фтора, хлора, брома и йода. Термин сульфонилокси относится к группе -OSO2-R, где R выбирают из Н, (С 1-С 6)алкила, (С 1-С 6)алкила, замещенного галогеном, например, группы -ОSO2-СF3, арила, гетероарила, (С 1-С 6)алкиларила или (С 1-С 6)алкилгетероарила. Термин (С 1-С 5)алкилсульфонилокси относится к (С 1-С 5)алкильным группам с сульфонилоксизаместителем, включая 2-(метилсульфонилокси)этил и подобные группы. Термин сульфонил относится к группе -SO2-R, где R выбирают из Н, арила, гетероарила,(С 1-С 6)алкила, (С 1-С 6)алкила, замещенного галогеном, например, группы -SO2-СF3, (С 1-С 6)алкиларила или (С 1-С 6)алкилгетероарила. Термин (С 1-С 5)алкилсульфонил относится к (С 1-С 5)алкильным группам с сульфонильным заместителем, включая 2-(метилсульфонил)этил и подобные группы. Термин сульфинил относится к группе -S(O)-R, где R выбирают из Н, (С 1-С 6)алкила, (С 1-С 6) алкила, замещенного галогеном, например, группы -SO-CF3, арила, гетероарила, (С 1-С 6)алкиларила или (С 1-С 6)алкилгетероарила. Термин (С 1-С 5)алкилсульфинил относится к (С 1-С 5)алкильным группам с сульфинильным заместителем, включая 2-(метилсульфинил)этил и подобные группы. Термин сульфанил относится к группам -S-R, где R включает (С 1-С 6)алкил или арил или гетероарил или (С 1-С 6)алкиларил или (С 1-С 6)алкилгетероарил. Предпочтительные сульфанильные группы включают метилсульфанил, этилсульфанил и подобные группы. Термин (С 1-С 5)алкилсульфанил относится к (С 1-С 5)алкильным группам с сульфанильным заместителем, включая 2-(этилсульфанил)этил и подобные группы. Термин сульфониламино относится к группе -NRSO2-R', где каждый R и R' независимо представляет собой водород или (С 1-С 6)алкил или арил или гетероарил или (С 1-С 6)алкиларил или(С 1-С 6)алкилгетероарил. Термин (С 1-С 5)алкилсульфониламино относится к (С 1-С 5)алкильным группам с сульфониламинозаместителем, включая 2-(этилсульфониламино)этил и подобные группы. Термины замещенный или незамещенный. Если определение отдельного заместителя не вносит иных ограничений, вышеуказанные группы, такие как алкил, алкенил, алкинил, арил и гетероарил и т.п., могут быть необязательно замещены 1-5 заместителями, выбранными из группы, состоящей из (С 1-С 6)алкила, (С 2-С 6)алкенила, (С 2-С 6)алкинила, циклоалкила, гетероциклоалкила, (С 1-С 6)алкиларила, (С 1-С 6)алкилгетероарила, (С 1-С 6)алкилциклоалкила, (С 1-С 6)алкилгетероциклоалкила, амино, аммония, ацила, ацилокси, ациламино, аминокарбонила, алкоксикарбонила, уреидо, арила, гетероарила, сульфинила, сульфонила, алкокси, сульфанила, галогена, карбокси, тригалогенметила, циано, гидрокси, меркапто, нитро и т.п. Альтернативно,указанное замещение может также включать ситуации, когда соседние заместители претерпевают замыкание кольца, особенно, когда вовлекаются соседние функциональные заместители, таким образом, образуются, например, лактамы, лактоны, циклические ангидриды, но также ацетали, тиоацетали, аминали,образованные замыканием кольца, например, при попытке получить защитную группу. Термин фармацевтически приемлемые соли или комплексы относится к солям или комплексам соединений формул (I) и (II), определенным ниже, которые сохраняют нужную биологическую активность. Примеры таких солей включают, но не ограничиваются ими, соли присоединения кислот, образованные с неорганическими кислотами (например, хлористо-водородной кислотой, бромисто-водородной кислотой, серной кислотой, фосфорной кислотой, азотной кислотой и т.п.), и соли, образованные с орга-5 007328 ническими кислотами, такими как уксусная кислота, щавелевая кислота, винная кислота, янтарная кислота, яблочная кислота, фумаровая кислота, малеиновая кислота, аскорбиновая кислота, бензойная кислота, дубильная кислота, памовая кислота, альгиновая кислота, полиглутаминовая кислота, нафталинсульфоновая кислота, нафталиндисульфоновая кислота и полигалактуроновая кислота. Указанные соединения также можно вводить в виде фармацевтически приемлемых четвертичных солей, известных специалистам в данной области, которые конкретно включают соль четвертичного аммониевого основания формулы -NR,R'R+Z-, где R, R' и R" независимо представляют собой водород, алкил или бензил, (С 1 С 6)алкил, (С 2-С 6)алкенил, (С 2-С 6)алкинил, (С 1-С 6)алкиларил, (С 1-С 6)алкилгетероарил, циклоалкил, гетероциклоалкил, и Z представляет собой противоион, включающий ион хлора, брома, йода, -O-алкил, толуолсульфонат, метилсульфонат, сульфонат, фосфат или карбоксилат (такой как бензоат, сукцинат, ацетат, гликолят, малеат, малат, фумарат, цитрат, тартрат, аскорбат, циннамоат, манделоат и дифенилацетат). Термин фармацевтически активное производное относится к любому соединению, которое после введения реципиенту способно обеспечить, прямо или косвенно, активность, о которой идет речь в данном описании. Термин энантиомерный избыток (ее) относится к продуктам, которые получают асимметричным синтезом, т.е. синтезом с участием нерацемических исходных веществ и/или реагентов, или синтезом,включающим по меньшей мере одну энантиоселективную стадию, посредством чего получают избыток одного энантиомера порядка по меньшей мере примерно 52%. Указанная формула соединения также включает его таутомеры, его геометрические изомеры, его оптически активные формы, такие как энантиомеры, диастереомеры, и его рацемические формы, а также их фармацевтически приемлемые соли. Предпочтительными фармацевтически приемлемыми солями соединений формулы (I) являются соли присоединения кислот, образованные с фармацевтически приемлемыми кислотами, такие как гидрохлориды, гидробромиды, сульфаты или бисульфаты, фосфаты или гидрофосфаты, ацетаты, бензоаты, сукцинаты, фумараты, малеаты, лактаты, цитраты, тартраты, глюконаты, метансульфонаты, бензолсульфонаты и паратолуолсульфонаты. Первый аспект настоящего изобретения заключается в применении соединений формулы (II) а также их геометрических изомеров, их оптически активных форм, таких как энантиомеры, диастереомеры, и их рацемических форм, а также их фармацевтически приемлемых солей и их фармацевтически активных производных для получения лекарственного средства для лечения и/или предупреждения преждевременных родов, преждевременного родового акта, дисменореи и для задержки родов перед родоразрешением путем кесарева сечения. Заместители в формуле (II) определены ниже.G выбирают из группы, состоящей из замещенного или незамещенного (С 1-С 6)алкиларила, замещенного или незамещенного (С 1-С 6)алкилгетероарила, замещенного или незамещенного (С 1 С 6)алкилциклоалкила, замещенного или незамещенного арила, замещенного или незамещенного гетероарила, замещенного или незамещенного (С 3-С 8)циклоалкила или -гетероциклоалкила, где указанные циклоалкильные или арильные или гетероарильные группы могут быть конденсированы с циклоалкильными или арильными или гетероарильными группами.R1 выбирают из группы, состоящей из замещенного или незамещенного арила, замещенного или незамещенного гетероарила, замещенного или незамещенного (С 3-С 8)циклоалкила или -гетероциклоалкила, где указанные (гетеро)циклоалкильные или арильные или гетероарильные группы могут быть конденсированы с (гетеро)циклоалкильными или арильными или гетероарильными группами.R2 представляет собой Н, карбокси, ацил, алкоксикарбонил, аминокарбонил, замещенный или незамещенный (С 1-С 5)алкилкарбокси, замещенный или незамещенный (С 1-С 5)алкилацил, замещенный или незамещенный (С 1-С 5)алкилалкоксикарбонил, замещенный или незамещенный (С 1-С 5)алкиламинокарбонил, замещенный или незамещенный (С 1-С 5)алкилацилокси, замещенный или незамещенный (С 1 С 5)алкилациламино, замещенный или незамещенный (С 1-С 5)алкилуреидо, замещенный или незамещенный (С 1-С 5)алкиламино, замещенный или незамещенный (С 1-С 5)алкилалкокси, замещенный или незамещенный (С 1-С 5)алкилсульфанил, замещенный или незамещенный (С 1-С 5)алкилсульфинил замещенный или незамещенный (С 1-С 5)алкилсульфонил, замещенный или незамещенный (С 1-С 5)алкилсульфониламино, замещенный или незамещенный (С 1-С 5)алкилсульфонилокси, замещенный или незамещенный (С 1-С 6)алкил, замещенный или незамещенный (С 2-С 6)алкенил, замещенный или незамещенный (С 2 С 6)алкинил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный (С 3-С 8)циклоалкил, замещенный или незамещенный гетероциклоалкил, за-6 007328 мещенный или незамещенный (С 1-С 6)алкиларил, замещенный или незамещенный (С 2-С 6)алкилгетероарил, замещенный или незамещенный (С 1-С 6)алкилциклоалкил замещенный или незамещенный (С 1 С 6)алкилгетероциклоалкил, замещенный или незамещенный (С 2-С 6)алкениларил, замещенный или незамещенный (С 2-С 6)алкенилгетероарил, замещенный или незамещенный (С 2-С 6)алкиниларил или замещенный или незамещенный (С 2-С 6)алкинилгетероарил. Альтернативно, R2 и G могут образовывать (С 3-С 8)циклоалкильное кольцо.R4 выбирают из группы, состоящей из замещенного или незамещенного (С 1-С 6)алкила, замещенного или незамещенного (С 2-С 6)алкенила, замещенного или незамещенного (С 2-С 6)алкинила.n равно целому числу от 0 до 2. Согласно одному варианту воплощения изобретения G представляет собой арильную группу, например, замещенный или незамещенный фенил, такой как бифенил. Соединения формулы (II) особенно полезны для лечения при преждевременных родах, включая неотложную помощь и профилактику. В одном варианте воплощения настоящего изобретения соединения формулы (II) являются подходящими для модуляции, особенно ингибирования активности простагландинов, и в частности, простагландина F2. Поэтому полагают, что соединения настоящего изобретения также особенного полезны для лечения и/или предупреждения расстройств, опосредуемых простагландином F2. Указанное лечение включает модуляцию, особенно ингибирование или прекращение регуляции, функции простагландина. Другой аспект настоящего изобретения составляют новые тиазолидинкарбоксамидные производные формулы (I), где G' представляет собой замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенный или незамещенный (С 3-С 8)циклоалкил или -гетероциклоалкил, где указанные циклоалкильные или арильные или гетероарильные группы могут быть конденсированы с циклоалкильными или арильными или гетероарильными группами. Более предпочтительные соединения имеют формулу (Iа) Формулы (I), (Ia) и (II) также охватывают геометрические изомеры, оптически активные формы,включая энантиомеры, диастереомеры, и их рацемические формы, а также их фармацевтически приемлемые соли и фармацевтически активные производные. Заместители в формулах (I) и/или (Iа) имеют значения, определенные ниже.R1 выбирают из группы, состоящей из замещенного или незамещенного арила, замещенного или незамещенного гетероарила, замещенного или незамещенного (С 3-С 8)циклоалкила или -гетероциклоалкила, где указанные (гетеро)циклоалкильные или арильные или гетероарильные группы могут быть конденсированы с (гетеро)циклоалкильными или арильными или гетероарильными группами. В более предпочтительном варианте воплощения изобретения R1 выбирают из группы, состоящей из арильной или гетероарильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из арила, гетероарила, галогена, алкокси, сульфанила, линейного или разветвленного (C1-C6)алкила.R2 выбирают из группы, состоящей из Н, карбокси, ацила, замещенного или незамещенного алкоксикарбонила, замещенного или незамещенного аминокарбонила, замещенного или незамещенного (C1C5)алкилкарбокси, замещенного или незамещенного (C1-C5)алкилацила, замещенного или незамещенного (C1-C5)алкилалкоксикарбонила, замещенного или незамещенного (C1-C5)алкиламинокарбонила, замещенного или незамещенного (C1-C5)алкилацилокси, замещенного или незамещенного (C1-C5)алкилациламино, замещенного или незамещенного (C1-C5)алкилуреидо, замещенного или незамещенного (C1-C5) алкиламино, замещенного или незамещенного (C1-C5)алкилалкокси, замещенного или незамещенного(C1-C5)алкилсульфанила, замещенного или незамещенного (C1-C5)алкилсульфинила, замещенного или незамещенного (C1-C5)алкилсульфонила, замещенного или незамещенного (C1-C5)алкилсульфониламино,замещенного или незамещенного (C1-C5)алкилсульфонилокси, замещенного или незамещенного (C1C6)алкила, замещенного или незамещенного (С 2-С 6)алкенила, замещенного или незамещенного (С 2-С 6)-7 007328 алкинила, замещенного или незамещенного арила, замещенного или незамещенного гетероарила, замещенного или незамещенного (С 3-С 8)циклоалкила, замещенного или незамещенного гетероциклоалкила,замещенного или незамещенного (C1-C6)алкиларила, замещенного или незамещенного (С 2-С 6)алкилгетероарила, замещенного или незамещенного (C1-C6)алкилциклоалкила, замещенного или незамещенного (C1-C6)алкилгетероциклоалкила, замещенного или незамещенного (C2-C6)алкениларила, замещенного или незамещенного (C2-C6)алкенилгетероарила, замещенного или незамещенного (C2-C6)алкиниларила или замещенного или незамещенного (C2-C6)алкинилгетероарила. В предпочтительном варианте воплощения изобретения R2 выбирают из группы, состоящей из карбокси, ацила, замещенного или незамещенного алкоксикарбонила, аминокарбонила, замещенного или незамещенного (C1-C5)алкилкарбокси, замещенного или незамещенного (C1-C5)алкилацила, замещенного или незамещенного (C1-C5)алкилалкоксикарбонила, замещенного или незамещенного (C1-C5)алкиламинокарбонила, замещенного или незамещенного (C1-C5)алкилацилокси, замещенного или незамещенного(C1-C5)алкилациламино, замещенного или незамещенного (C1-C5)алкилуреидо, замещенного или незамещенного (C1-C5)алкиламино, замещенного или незамещенного (C1-C5)алкилалкокси, замещенного или незамещенного (C1-C5)алкилсульфанила, замещенного или незамещенного (C1-C5)алкилсульфинила, замещенного или незамещенного (C1-C5)алкилсульфонила, замещенного или незамещенного (C1-C5)алкилсульфониламино, замещенного или незамещенного (C1-C5)алкилсульфонилокси, замещенного или незамещенного арила, замещенного или незамещенного гетероарила. Более конкретно, R2 может представлять собой группу (C1-C3)алкил-A-R5, где А представляет собой О или N-B-R6. В представляет собой связь, аминокислотный остаток (например, аланин, фенилаланин, валин, лейцин, изолейцин, пролин, глицин, метионин, триптофан, треонин, серин и т.д.), (С=O), (С=O)-O, (C=O)NR7 или SO2.R5, R6 и R7, независимо один от другого, выбирают из группы, состоящей из Н, замещенного или незамещенного (C1-C6)алкила, замещенного или незамещенного (C2-C6)алкенила, замещенного или незамещенного (С 2-С 6)алкинила, замещенного или незамещенного арила, замещенного или незамещенного гетероарила, замещенного или незамещенного (С 3-С 8)циклоалкила или -гетероциклоалкила, замещенного или незамещенного (C1-C6)алкиларила, замещенного или незамещенного (C1-C6)алкилгетероарила, замещенного или незамещенного (C1-C6)алкилциклоалкила, замещенного или незамещенного (C1C6)алкилгетероциклоалкила, замещенного или незамещенного (C2-C6)алкениларила или -гетероарила,замещенного или незамещенного (С 2-С 6)-алкиниларила или -гетероарила.R5 и B-R6 (в частности, если В представляет собой связь), и аналогично, R6 и R7 (если В представляет собой (C=O)-NR7), вместе с соответствующими атомами азота, к которым они присоединены, могут необязательно образовывать замещенные или незамещенные гетероциклоалкильные кольца. В еще более предпочтительном варианте воплощения изобретения R2 представляет собой (C1C3)алкил-A-R5, где А представляет собой О и R5 представляет собой Н, или А представляет собой N-BR6, причем В представляет собой связь, а R5 и R6, каждый независимо один от другого, выбирают из группы, состоящей из замещенного или незамещенного (C1-C3)алкила, например, (C1-C3)алкилгидрокси,(C1-C3)алкилкарбокси, (C1-C3)алкиламинокарбонила, (C1-C3)алкилалкоксикарбонила, замещенного или незамещенного (C1-C3)алкиларила, замещенного или незамещенного (C1-C3)алкилгетероарила, замещенного или незамещенного (C1-C3)алкилциклоалкила, замещенного или незамещенного (C1-C3)алкилгетероциклоалкила, замещенного или незамещенного (C1-C3)алкилгидрокси, замещенного или незамещенного (C1-C3)алкилкарбокси, замещенного или незамещенного (C1-C3)алкиламинокарбонила, замещенного или незамещенного (C1-C3)алкилалкоксикарбонила. Согласно другому предпочтительному варианту воплощения изобретения R2 представляет собой замещенный или незамещенный фенил, пирид-2-ил, пирид-3-ил или пирид-4-ил. Указанные группы фенил, пирид-2-ил, пирид-3-ил или пирид-4-ил могут быть необязательно замещены по меньшей мере одним заместителем, выбранным из группы, включающей Н, гидрокси, галоген,карбокси, ацил, аминокарбонил, ациламино, (C1-C3)алкиламино, (C1-C3)алкилалкокси, (C1-C3)алкилкарбокси, (C1-C3)алкилацил, (C1-C3)алкиламинокарбонил, (C1-C3)алкилациламино, (C1-C3)алкилуреидо,(C1-C3)алкилсульфанил, (C1-C3)алкилсульфинил, (C1-C3)алкилсульфонил, (C1-C3)алкилсульфониламино. Наиболее предпочтительными заместителями являются метокси, карбоксиметокси, гидроксиметил, карбоксиметил, сульфонилоксиметил, диметиламинометил, 4-морфолинилметил, 1-пиперидинилметил, 1 пирролидинилметил, (4-метил-1-пиперазинил)метил, этокси, 2-метоксиэтокси, 2-гидроксиэтокси, 2 карбоксиэтокси, 2-сульфонилоксиэтокси, 2-(диметиламино)этокси, 2-(4-морфолинил)этокси, 2-(1 пирролидинил)этокси, 2-(1-пиперидинил)этокси, 2-(4-метил-1-пиперазинил)этокси, 2-гидроксиэтил, 2 метоксиэтил, 2-карбоксиэтил, 2-сульфонилоксиэтил, 2-(диметиламино)этил, 2-(4-морфолинил)этил, 2-(1 пирролидинил)этил, 2-(1-пиперидинил)этил, 2-(4-метил-1-пиперазинил)этил, пропокси, 3-метоксипропокси, 3-гидроксипропокси, 3-карбоксипропокси, 3-сульфонилоксипропокси, 3-(диметиламино)пропокси, 3-(4-морфолинил)пропокси, 3-(1-пирролидинил)пропокси, 3-(1-пиперидинил)пропокси, 3-(4 метил-1-пиперазинил)пропокси, 3-гидроксипропил, 3-метоксипропил, 3-карбоксипропил, 3-сульфонил-8 007328 оксипропил, 3-(диметиламино)пропил, 3-(4-морфолинил)пропил, 3-(1-пирролидинил)пропил, 3-(1-пиперидинил)пропил, 3-(4-метил-1-пиперазинил)пропил.R3 выбирают из группы, включающей замещенный или незамещенный (C1-C6)алкил, замещенный или незамещенный (С 2-С 6)алкенил, замещенный или незамещенный (С 2-С 6)алкинил, замещенный или незамещенный арил, гетероарил, замещенный или незамещенный (C3-C8)циклоалкил или замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный (C1-C6)алкиларил, замещенный или незамещенный (C1-C6)алкилгетероарил, замещенный или незамещенный (C1-C3)алкилциклоалкил,замещенный или незамещенный (C1-C3)алкилгетероциклоалкил, замещенный или незамещенный (С 2 С 6)алкениларил или -гетероарил, замещенный или незамещенный (С 2-С 6)алкиниларил или -гетероарил,карбокси, циано, галоген, гидрокси, алкокси, нитро, ациламино, уреидо, сульфониламино, сульфанил или сульфонил.m равно целому числу от 0 до 3, и n равно целому числу от 0 до 2.R4 выбирают из группы, состоящей из замещенного или незамещенного (C1-C6)алкила, замещенного или незамещенного (С 2-С 6)алкенила, замещенного или незамещенного (С 2-С 6)алкинила. В особенно предпочтительном варианте воплощения изобретения R1 представляет собой фенил, замещенный группой, выбранной из линейного или разветвленного (C1-C5)алкила или арила, R2 выбирают из группы, состоящей из (C1-C3)алкил-A-R5, где А представляет собой О и R5 представляет собой Н, или А представляет собой N-B-R6, причем В представляет собой связь и R5 и R6, каждый независимо, выбирают из группы, состоящей из (C1-C3)алкила, (C1-C3)алкиларила, (C1-C3)алкилгетероарила, (C1C3)алкилгидрокси. В еще более предпочтительном варианте воплощения изобретения R1 представляет собой бифенильную или трет-бутилфенильную группу, R2 представляет собой (C1-C3)алкил-A-R5, где А представляет собой О и R5 представляет собой Н, или А представляет собой N-B-R6, R5 и R6 представляют собой, каждый независимо один от другого, (C1-C3)алкил, (C1-C3)алкиларил, (C1-C3)алкилгетероарил или (C1-C3)алкилгидрокси, В представляет собой связь, R3 представляет собой фтор, m равно 0, 1 или 2, и n равно 0. В еще более предпочтительном варианте воплощения изобретения R1 представляет собой бифенильную или трет-бутилфенильную группу, R2 представляет собой пирид-2-ил, имеющий один или несколько заместителей, выбранных из группы, состоящей из Н, ОН, алкокси, (C1-C3)алкиламино, (C1C3)алкилгидрокси, (C1-C3)алкилкарбокси, (C1-C3)алкилсульфонилокси, R3 представляет собой фтор, m равно 0, 1 или 2, и n равно 0. Соединения настоящего изобретения представляют собой, в частности, соединения из группы,включающейL-валинат,3-(бифенил-4-илсульфонил)-N-[5-[2-(диметиламино)этокси]пиридин-2-ил(фенил)метил]-1,3 тиазолидин-2-карбоксамид,3-(бифенил-4-илсульфонил)-N-6-(диметиламино)пиридин-3-ил](фенил)метил]-1,3-тиазолидин-2 карбоксамид,3-(бифенил-4-илсульфонил)-N-[фенил-(1-L-валилпиперидин-4-ил)метил]-1,3-тиазолидин-2 карбоксамид. Еще одним аспектом настоящего изобретения является применение новых соединений формулы (I) в качестве лекарственных средств. Еще одной целью настоящего изобретения является способ получения 1,3-тиазолидин-2 карбоксамидных производных формулы (I). 1,3-Тиазолидин-2-карбоксамидные производные, приведенные в данном изобретении в качестве примеров, можно получить из легко доступных исходных веществ с использованием общих способов и методик, описанных далее. Следует иметь в виду, что приводятся типичные или предпочтительные экспериментальные условия (т.е. температуры реакций, время, моли реагентов, растворители и т.д.), также можно использовать другие экспериментальные условия, если не указано иное. Оптимальные условия реакций могут изменяться с изменением используемых определенных реагентов и растворителей, но такие условия специалист в данной области может определить, используя обычные методики оптимизации. Как правило, 1,3-тиазолидин-2-карбоксамидные производные настоящего изобретения можно получить с использованием нескольких подходов к синтезу, применяя методики как химии в растворе, так и твердофазной химии. Согласно одному способу, показанному на схеме 1 ниже, 1,3-тиазолидин-2-карбоксамидные производные общей формулы (I), где R1, R2, R4, G' и n имеют значения, указанные выше, можно получить из соответствующих карбоновых кислот (III), аминов (IV) и сульфонилхлоридов (VI), используя стандартные методики химии в растворе, хорошо известные специалистам в данной области. Промежуточные соединения формулы (V), где PG представляет собой подходящую N-защитную группу (такую как Воc,Fmoc, Cbz и другие), можно получить из соответствующих карбоновых кислот (III) и аминов (IV), используя стандартные условия амидосочетания, хорошо известные специалистам в данной области. Удаление N-защитной группы (например, в случае, когда PG представляет собой Вос, с использованием разбавленной ТФУК в DCM или НСl в смесях диоксан/DCM), с последующей обработкой сульфонилхлоридами (VI) в сочетании с подходящим основанием (таким как TEA, DIEA, пиридин и другие) дает продукты общей формулы (I). Схема 1 Согласно другому способу, показанному ниже на схеме 2, производные 1,3-тиазолидин-2 карбоновой кислоты (VII) подвергают взаимодействию с сульфонилхлоридами (VI), используя хорошо известные стандартные методики химии в растворе, такие как, например, условия реакции по СкоттенБауману, с получением промежуточных соединений общей формулы (VIII). Затем последние подвергают взаимодействию с аминами (IV), используя стандартные условия пептидного сочетания, хорошо известные специалистам в данной области, с получением продуктов общей формулы (I). Согласно еще одному способу, показанному на схеме 3, эфиры 1,3-тиазолидин-2-карбоновых кислот (IX) подвергают взаимодействию с сульфонилхлоридами (VI), с последующим омылением сложноэфирной группы, используя стандартные реагенты, такие как NaOH, HCl, трибромид бора, КOSi(СН 3)3,или другие, с выделением соответствующих промежуточных карбоновых кислот (VIII). Затем последние подвергают взаимодействию с аминами (IV), используя стандартные условия амидного сочетания, хорошо известные специалистам в данной области, с получением продуктов общей формулы (I). Схема 3 Рацемические производные 1,3-тиазолидин-2-карбоновой кислоты (III), (VII) и (IX), представленные на схемах 1-3, получают либо из коммерческих источников, либо из коммерчески доступных исходных веществ стандартными способами, подробно описанными в литературе. Сульфонилхлориды (VI), представленные на схемах 1-3, где R1 имеет значения, указанные выше,или являются коммерчески доступными, или их получают стандартными способами, хорошо известными специалистам в данной области, например, обработкой соответствующих сульфоновых кислот (X) хлорирующими агентами, такими как, например, SO2Cl2, SOCl2, хлорид диметилфосгения, и другими, или обработкой подходящего предшественника (XI) реагентом хлорсульфонилирования, таким как, например, СlSO3 Н (см. схему 4). Схема 4 Сульфоновые кислоты (X) и предшественники (XI) или получают из коммерческих источников, или синтезируют из коммерческих исходных веществ, используя стандартные способы, хорошо известные специалистам в данной области, некоторые примеры которых приведены на схеме 5 и описаны далее в примерах. Так, например, бромбензолсульфонаты (XII) можно подвергнуть взаимодействию с бороновыми кислотами (XIII) в присутствии палладиевого катализатора с получением сульфоновых кислот (X). Альтернативно, бромбензолсульфонаты (XII) можно превратить в соответствующие сложные эфиры сульфоновых кислот (XIV) обработкой, например, тионилхлоридом и затем 2-метил-1-пропанолом. Затем сложные эфиры сульфоновых кислот (XIV) можно превратить в соответствующие производные бороновых кислот (XV), используя, например, триизопропилборат в присутствии н-бутиллития. Катализируемое палладием(0) образование поперечных связей между производными бороновых кислот (XV) и- 16007328 подходящими замещенными или незамещенными арил- или гетероарилгалогенидами дает нужные сульфоновые кислоты (X). Схема 5 Амины (IV) , представленные на схемах 1-3, где R2 и G' имеют указанные выше значения, или получают из коммерческих источников, или синтезируют из коммерческих исходных веществ, используя стандартные методики, хорошо известные специалистам в данной области, как показано на схемах ниже и иллюстрируется далее в примерах. В тех случаях, когда R2 и G' представляют собой замещенные или незамещенные арильные или гетероарильные группы, амины (IV) можно получить, используя, например, способ, показанный на схеме 6. По этой схеме замещенные или незамещенные ароматические или гетероароматические альдегиды(XVI) подвергают взаимодействию с коммерчески доступными аминоспиртами (XVII) с образованием соответствующих иминов (XVIII), с последующим присоединением карбанионсодержащих веществ(XIX), таких как, например, реактив Гриньяра, медь органические или литийорганические реагенты, или других веществ, используя стандартные условия реакций, хорошо известные специалистам в данной области. Затем полученные вторичные амины (XX) можно превратить в соответствующие аналоги первичных аминов (IV) окислительным расщеплением с использованием, например, периодной кислоты, как описано далее в примерах. Такой способ также позволяет получить оптически чистые амины (IV) с использованием оптически активных аминоспиртов (XVII), как описано далее на схеме 6. Схема 6 Замещенные или незамещенные арил- и гетероарилальдегиды (XVI или XVI) или получают из коммерческих источников, или синтезируют одним из многочисленных подходящих способов, подробно описанных в литературе и хорошо известных специалистам в данной области. В качестве примера один такой способ показан на схеме 7 и описан далее в примерах. Другие замещенные или незамещенные арил- и гетероарилальдегиды (XVI) или получают из коммерческих источников, или синтезируют одним из многочисленных подходящих способов, подробно описанных в литературе и хорошо известных специалистам в данной области. В качестве другого примера один такой способ показан на схеме 8 и описан далее в примерах. Схема 8 В тех случаях, когда R2 и G' представляют собой замещенные или незамещенные арильные или гетероарильные или гетероциклические группы, амины (IV) можно получить, используя, например, способ, показанный на схеме 9. По этой схеме замещенные или незамещенные ароматические соединения(XVII) подвергают взаимодействию с ацилхлоридами (XVIII) с образованием соответствующих кетонов (XIX), или замещенные или незамещенные литированные ароматические соединения (XXXXI) подвергают взаимодействию с нитрильными производными (XXXXII). Затем кетоны (XIX) обрабатывают гидроксиламином, получая соответствующие оксимы (ХХХХIII'). Последующее восстановление оксима (XXXXIII') подходящим восстановителем с использованием стандартных условий, хорошо известных специалистам в данной области, позволяет получить амины (IV), как описано далее в примерах. Схема 9- 18007328 Амины (IV) , где R2 и G' представляют собой замещенные или незамещенные арильные или гетероарильные или гетероциклические группы, можно получить из кетона XIX, как показано ниже на схеме 10, обработкой соответствующим амином (XXXXV), с получением соединения XXXXVI после нуклеофильного замещения. После дальнейших обработок, как показано выше на схеме 9, соответствующие амины IV выделяют в виде чистых соединений. Схема 10 Амины (IV) , представленные на схемах 1-3, где R2 представляет группу общей формулы (C1 С 6)алкил-A-R5, где заместители А и R5 имеют значения, указанные выше, или являются коммерчески доступными, или их можно получить, используя, например, один из способов, примеры которых показаны на схемах 7-9 и описаны далее в примерах. Особенно предпочтительный способ заключается в превращении одной функциональной группы (R2) в другую функциональную группу (R2') с использованием известных описаний взаимопревращений функциональных групп. Как показано на схеме 11 и описано далее в примерах, такие взаимопревращения функциональных групп можно осуществить на уровне или свободных аминов (IV, IV'), или подходящим образом защищенных аминов (XXIV, XXIV'), или 1,3 тиазолидин-2-карбоксамидов (V, V') или (I, I'). Выбор наилучшей стратегии синтеза будет определяться природой взаимопревращаемых функциональных групп и совместимостью требуемых условий реакций с другими функциональными группами, имеющимися в соответствующих соединениях, что будет оценивать специалист в данной области. Самыми предпочтительными исходными веществами (IV) и соответствующими производными (XXIV), (V) и (I) являются соединения, где R2 представляет собой -СООН и/или -СН 2 СООН, т.е. альфа- и/или бета-аминокислоты, которые или получают из коммерческих источников, или синтезируют одним из многочисленных способов, описанных в литературе. Из промежуточных соединений (XXV), полученных из тех, в которых R имеет значения, указанные на схеме 11, можно получить широкий интервал производных, таких как, например, (XXVI)-(XXXVI), в которых R4, R5, R6,R7, n, G' и В имеют значения, указанные выше, последовательностью реакций, включающих окисление,восстановление, О- и N-алкилирование, восстановительное алкилирование и аминирование, наращивание цепи, реакции Мицунобу, ацилирование, удаление Вос-группы, реакции Виттига, сульфонилирование и любые другие подходящие трансформации, приводящие к взаимопревращениям функциональных групп, из которых некоторые указаны как примеры на схеме 11. Примеры синтеза, указанные на схеме 11, предназначены для иллюстрации концепции взаимопревращения функциональных групп, применяемой к соединениям общих формул (IV), (XXIV), (V) и (I), где R, R2 и G' имеют значения, указанные выше в описании и на схеме 11, и не должны рассматриваться как ограничивающие объем указанного подхода к синтезу. Схема 11 Способы, описанные на приведенных выше схемах, в частности, схемах 1-3, как правило, дают смеси стереоизомеров, таких как диастереомеры и/или энантиомеры, когда используют рацемические исходные вещества (III), (IV), (VII) и/или (IX), из-за наличия по меньшей мере одного, чаще всего двух, и в некоторых случаях трех или большего числа асимметричных атомов углерода в соединениях общей формулы (I). Чистые стереоизомеры можно получить из смесей современными способами разделения,включая, например, флэш-хроматографию, ВЭЖХ, кристаллизацию и другие способы. Согласно другому способу можно получить менее сложные смеси стереоизомеров вплоть до чистых стереоизомеров, используя для синтезов, очерченных приведенными выше схемами, в частности,схемами 1-3, соответствующие оптически чистые исходные вещества (III), (IV), (VII) и/или (IX). Оптически чистые амины (IV) или получают из коммерческих источников, или синтезируют современными способами, известными специалистам в данной области, включая стереоселективный химический синтез, химическое расщепление, ферментативное расщепление или их сочетание, как показано, например, на схеме 12 и в примерах, приведенных далее. Так, оптически чистые амины (IV) можно получить,например, адаптируя способ, описанный выше на схеме 6, путем использования хирального вспомогательного вещества (XVII), такого как, например, валинол, или других веществ, которые получают в оптически чистой форме или из коммерческих источников, или стандартными способами, описанными в литературе (схема 7-9, пример А). Альтернативно, как показано на схеме 12 (пример В), хиральные амины (IV) можно получить ферментативным расщеплением соответствующих рацемических предшественников (IV) и последующим превращением в другие хиральные амины (IV') стандартными способами взаимопревращения функциональных групп, такими как описано выше на схеме 11. Аналогично получению энантиомерно чистых аминов (IV), можно получить оптически чистые производные 1,3 тиазолидин-2-карбоновой кислоты (III), (VII) и/или (IX) стереоселективным химическим синтезом,химическим расщеплением, ферментативным расщеплением или их сочетанием. Примеры, цитированные выше и показанные на схеме 11, предназначены для иллюстрации получения оптически чистых ис- 20007328 ходных веществ и не должны рассматриваться как ограничивающие объем указанного синтетического подхода. Схема 12 Пример А. Стереоселективный синтез с хиральным вспомогательным веществом. Пример В. Ферментативное расщепление рацемических исходных веществ. Согласно еще одному способу, проиллюстрированному на схеме 13, промежуточные соединения карбоновой кислоты (VIII) подвергают взаимодействию с аминами (IV), получая соответствующую промежуточную карбоновую кислоту (Ia). Первичный амид (Ib) выделяют после образования смешанного ангидрида карбоновой кислоты (Iа) и обработки избытком аммиака. Дегидратация первичного амида (Ib) хлорангидридом циануровой кислоты позволяет получить нитрильное производное (Iс), которое затем обрабатывают гидроксиламином, получая амидоксим (Id). Затем промежуточный амидоксим (Id) подвергают взаимодействию с подходящей карбоновой кислотой, используя стандартные условия амидного сочетания, и нагревают до осуществления циклизации и образования конечного оксадиазола, используя условия, хорошо известные специалистам в данной области, с получением продуктов общей формулы (I). Схема 13 Процессы, изложенные до сих пор, описывают синтез 1,3-тиазолидин-2-карбоксамидных производных общей формулы (I) способами в растворе. Согласно еще одному подходу, 1,3-тиазолидин-2 карбоксамидные производные формулы (I), где заместители R1, R2, R4, G' и n имеют значения, указанные выше, получают твердофазными способами, такими как, например, описано на схемах 1-12 и описано далее в примерах. На схеме 14 заштрихованные кружочки символизируют гранулы смолы, к которой присоединяют соответствующие соединения во время твердофазного синтеза. Так, соответствующим образом N-защищенные 1,3-тиазолидин-2-карбоновые кислоты (III) подвергают взаимодействию, например, с оксимовой смолой Kaiser, используя, например, стандартные условия опосредованного карбодиимидами сочетания, хорошо известные специалистам в данной области, с последующим удалением за- 21007328 щитной группы. Полученные промежуточные соединения обрабатывают сульфонилхлоридами (VI) в присутствии основания, получая связанные со смолой промежуточные соединения общей формулы(XXXIX). Для того, чтобы получить конечные соединения общей формулы (I), связь со смолой расщепляют длительной обработкой аминами (IV) и, в некоторых случаях, несколькими процентами слабой кислоты, такой как НОАс. Другие производные формулы (I) получают с использованием известных модификаций или вариантов реакционной последовательности, показанной на схеме 14. Кроме вышеуказанной оксимовой смолы Kaiser, для твердофазного синтеза соединений общей формулы (I) можно использовать другие подходящие реагенты, известные специалистам в данной области, особенно смолы. Схема 14 Если приведенный выше набор синтетических способов не приемлем для получения соединений формулы (I) и/или необходимых промежуточных соединений для синтеза соединений формулы (I), следует использовать подходящие способы получения, известные специалистам в данной области. Вообще,пути синтеза для отдельного соединения формулы (I) будут зависеть от конкретных заместителей каждой молекулы и наличия готовых необходимых промежуточных соединений; причем такие факторы вновь оцениваются специалистами в данной области. Относительно всех способов введения и удаления защитных групп см. Philip J. Kocienski, в "Protecting Groups", Georg Thieme Verlag Stuttgart, New York,1994, и Theodora W. Greene and Peter G.M. Wuts, в "Protective Groups in Organic Synthesis", WileyInterscience, 1991. Соединения данного изобретения можно выделить в сочетании с молекулами растворителя кристаллизацией при выпаривании подходящего растворителя. Фармацевтически приемлемые соли присоединения кислот соединений формулы II, содержащие основной центр, можно получить обычным способом. Например, раствор свободного основания можно обработать подходящей кислотой, или чистой или в подходящем растворе, и выделить полученную соль или фильтрованием, или выпариванием в вакууме реакционного раствора. Фармацевтически приемлемые соли присоединения оснований можно получить аналогично, обрабатывая раствор соединения формулы I подходящим основанием. Оба типа солей могут быть образованы или подвергнуты взаимопревращению методами с использованием ионообменных смол. Последним аспектом настоящего изобретения являются промежуточные соединения формулы (Va),где G' представляет собой фенил, используемые в способе, показанном на схеме 1, в частности, для получения соединений формулы (Ia). В указанной формуле (Va) PG представляет собой Н; R2, R3, R4, m и n имеют значения, указанные выше, при условии, что R2 не может быть водородом. Настоящее изобретение также охватывает промежуточное соединение формулы (VIII) где R1 представляет собой 1,1'-бифенильную или трет-бутилфенильную группу и R4 и n имеют значения, указанные выше. Когда тиазолидинкарбоксамидные производные настоящего изобретения используют в качестве фармацевтических средств, их, как правило, вводят в форме фармацевтической композиции. Следовательно, фармацевтические композиции, содержащие соединение формулы (II) и фармацевтически приемлемый носитель, разбавитель или эксципиент для него, также входят в объем настоящего изобретения. Специалистам в данной области известно все разнообразие таких носителей, разбавителей или эксципиентов, подходящих для составления фармацевтической композиции. Соединения изобретения вместе с обычно используемым адъювантом, носителем, разбавителем или эксципиентом можно поместить в форму фармацевтических композиций и их стандартных лекарственных форм, и в такой форме их можно использовать в виде твердых форм, таких как таблетки или заполненные капсулы, или жидкостей, таких как растворы, суспензии, эмульсии, эликсиры или капсулы, заполненные указанными жидкостями, все для перорального применения, или в форме стерильных инъецируемых растворов для парентерального применения (включая подкожное). Такие фармацевтические композиции и их стандартные лекарственные формы могут содержать ингредиенты в обычных пропорциях, без добавления или с добавлением других активных соединений или составляющих, и такие стандартные лекарственные формы могут содержать любое подходящее эффективное количество активного ингредиента, соизмеримое с предполагаемым для использования суточным дозировочным интервалом. Фармацевтические композиции, содержащие тиазолидинкарбоксамидные производные данного изобретения, можно получить способом, хорошо известным в фармации, с содержанием по меньшей мере одного активного соединения. Как правило, соединения данного изобретения вводят в фармацевтически эффективном количестве. Количество соединения, вводимое фактически, будет обычно определяться лечащим врачом в соответствии с сопутствующими обстоятельствами, включая состояние, от которого лечат, выбранный способ введения, фактическое вводимое соединение, возраст, вес и реакцию отдельного пациента, тяжесть симптомов у пациента и тому подобное. Фармацевтические композиции настоящего изобретения можно вводить различными путями, включая пероральное, ректальное, трансдермальное, подкожное, внутривенное, внутримышечное и интраназальное введение. Композиции для перорального введения могут принимать форму нерасфасованных жидких растворов или суспензий, или нерасфасованных порошков. Однако чаще, композиции представляют в стандартных лекарственных формах для облегчения точного дозирования. Термин стандартные лекарственные формы относится к физически дискретным единицам, пригодным в качестве единичных дозировок для людей и других млекопитающих, причем каждая единица содержит заранее определенное количество активного вещества, рассчитанное на получение нужного лечебного эффекта, в сочетании с подходящим фармацевтическим эксципиентом. Обычные стандартные лекарственные формы включают предварительно заполненные, известного объема ампулы или шприцы с жидкими композициями, или пилюли, таблетки, капсулы или подобные формы в случае твердых композиций. В таких композициях тиазолидинкарбоксамидное производное, как правило, является меньшим по количеству компонентом(от примерно 0,1 до примерно 50 мас.% или, предпочтительно, от примерно 1 до примерно 40 мас.%),причем остальное составляют различные наполнители или носители и вещества, способствующие переработке в нужную лекарственную форму. Жидкие формы, подходящие для перорального введения, могут включать подходящий водный или неводный наполнитель с буферными, суспендирующими и диспергирующими веществами, красителями,корригентами и подобными веществами. Твердые формы могут включать, например, любой из следующих ингредиентов или соединений подобной природы: связующее вещество, такое как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; эксципиент, такой как крахмал или лактоза; дезинтегрирующее вещество, такое как альгиновая кислота, примогель или кукурузный крахмал; смазывающее вещество, такое как стеарат магния; вещество, способствующее скольжению, такое как коллоидный диоксид кремния; подслащивающее вещество, такое как сахароза или сахарин; или корригент, такой как мятное масло, метилсалицилат или апельсиновая отдушка. Композиции для инъекций обычно основаны на стерильном физиологическом растворе или забуференном фосфатом физиологическом растворе для инъекций или других носителях для инъекций, известных в данной области. Как указано выше, тиазолидинкарбоксамидные производные формулы (I) в таких композициях обычно составляют меньший по количеству компонент, часто в интервале от 0,05 до 10 мас.%, причем остальное составляет носитель для инъекций и подобные вещества. Вышеописанные компоненты композиций для перорального введения или для инъекций являются только характерными представителями. Другие вещества, а также методы переработки и т.п. описаны в- 23007328 части 8 издания Remington's Pharmaceutical Sciences, 17th Edition, 1985, Marck Publishing Company,Easton, Pennsylvania, включенном в данное описание в качестве ссылки. Соединения изобретения также можно вводить в формах с отсроченным высвобождением лекарственного средства или с помощью систем для доставки лекарственного средства с отсроченным высвобождением. Описание характерных веществ для отсроченного высвобождения также можно найти в материалах в Remingtons Pharmaceutical Sciences. Далее настоящее изобретение будет поясняться рядом примеров, которые не следует рассматривать как ограничение объема изобретения. Далее в описании в предлагаемых примерах используются следующие аббревиатуры: мин (минута), ч (часы), г (грамм), ммоль (миллимоль), т.пл. (температура плавления), экв. (эквиваленты), мл (миллилитр), мкл (микролитры), ACN (ацетонитрил), Воc (бутоксикарбонил), Cbz (карбоксибензил), CDCl3 (дейтерированный хлороформ), сНех (циклогексаны), dba (дибензилиденацетон), DCM (дихлорметан), DEAD (диэтилазодикарбоксилат), DIC (диизопропилкарбодиимид),DIEA (диизопропилэтиламин), DMAP (4-диметиламинопиридин), ДМФА (диметилформамид), ДМСО(N,N,N',N'тетраметилазодикарбоксамид), TosCl (толуолсульфонилхлорид). Примеры Промежуточные соединения 1. Получение аминов общей формулы (IV)/(IV), например (R)фенил(2-пиридинил)метанамина. Способ А. а) Методика получения промежуточных иминов (XVIII)/(XVIII), например (2R)-3-метил-2-[(Е)-2 пиридинилметилиден]амино-1-бутанола. Безводный MgSO4 (50 г, 415 ммоль, 4,15 экв.) и замещенный арил- или гетероарилкарбоксальдегид,например, 2-пиридинкарбоксальдегид (9,5 мл, 100 ммоль, 1 экв.) при 0 С добавляют к раствору (R)-(-)-2 амино-3-метил-1-бутанола (10,32 г, 100 ммоль) в сухом DCM (150 мл). Реакцию отслеживают методом ЖХ/МС. Смесь перемешивают при указанной температуре в течение 2 ч 25 мин. ОтфильтровываютMgSO4 и DCM удаляют выпариванием, получая нужный продукт (XVIII), например, (2R)-3-метил-2[(Е)-2-пиридинилметилиден]амино-1-бутанол, в виде желтоватого масла (19,23 г, выход количественный). 1b) Методика силилирования промежуточных соединений (XVIII)/(XVIII), например получение Имин (XVIII), полученный на предыдущей стадии, например, (2R)-3-метил-2-[(Е)-2 пиридинилметилиден]амино-1-бутанол (100 ммоль), растворяют в сухом DCM (100 мл). К перемешиваемому раствору добавляют TEA (15,3 мл, 110 ммоль, 1,1 экв.) и хлортриметилсилан (13,9 мл, 110 ммоль, 1,1 экв.). Реакцию отслеживают методом ЖХ/МС. Через 2 ч 30 мин реакция завершается. Раство- 24007328 ритель удаляют в вакууме, остаток растворяют в 500 мл смеси Et2O-циклогексан (1:1) и твердую фазу отфильтровывают. Органический раствор концентрируют в вакууме, получая нужный продукт, например, (2R)-3-метил-N-[(Е)-2-пиридинилметилиден]-1-[(триметилсилил)окси]-2-бутанамин, в виде желтоватого масла (25,5 г, 96%). 1(ESI+): 265. с) Асимметричное присоединение реактивов Гриньяра; например, получение (2R)-3-метил-2-[(R)фенил(2-пиридинил)метил]амино-1-бутанола (XX)/(XX). Силилированный имин с предыдущей стадии,например,(2R)-3-метил-N-[(Е)-2 пиридинилметилиден]-1-[(триметилсилил)окси]-2-бутанамин, растворяют в сухом ТГФ (500 мл) и раствор охлаждают до -78 С. При перемешивании смеси магнитным стержнем добавляют по каплям 1 М раствор фенилмагнийбромида в ТГФ (200 мл, 200 ммоль, 2 экв.). Смесь перемешивают еще в течение 2 ч при -78 С. Затем температуру постепенно, в течение ночи, повышают до комнатной температуры. Образец реакционной смеси гасят водным раствором NaHCO3 и анализируют методом ЖХ/МС для обнаружения O-силилированных продуктов. На другое утро смесь гасят 1 М НСl (250 мл) и смесь перемешивают при комнатной температуре до тех пор, пока не завершится десилилирование (через 1 ч, анализ ЖХ/МС). Затем водную фазу подкисляют добавлением 5 М раствора НСl (20 мл). Водную фазу промывают 300 мл смеси циклогексан/Еt2O (2:1), затем при 0 С подщелачивают 60 мл 5 М раствора NaOH и органические продукты экстрагируют Et2O, сушат (MgSO4) и концентрируют, получая нужный продукт (XX), например, (2R)-3-метил-2-[(R)-фенил(2-пиридинил)метил]амино-1-бутанол, в виде желтоватого масла (22,9 г, выход 85%, d.e.=99%, определено 1H-ЯМР). 1d) Методика удаления защитных групп из аминов (XX)/(XX); например, получение (R)-фенил(2 пиридинил)метанамина. К раствору вторичных аминов (XX)/(XX), полученных на предыдущей стадии, например, (2R)-3 метил-2-[(R)-фенил(2-пиридинил)метил]амино-1-бутанола (2,9 г, 10,73 ммоль), в 25 мл смеси МеОН/ТГФ (9/1) добавляют 40% раствор метиламина в воде (10,2 мл, 118 ммоль, 11 экв.). К перемешиваемому раствору при 0 С постепенно добавляют водную периодную кислоту (8,3 г в 25 мл воды). Полученный густой раствор перемешивают при комнатной температуре в течение ночи. Реакцию отслеживают методом ЖХ/МС. Утром добавляют воду (25 мл), смесь фильтруют и амин 3 раза экстрагируют Et2O. Органическую фазу затем сушат МgSO4 и выпаривают, получая нужные продукты (IV)/(IV), например,(R)-фенил(2-пиридинил)метанамин, в виде желтоватого масла (2,1 г, выход 95%). Полученный неочищенный первичный амин используют без дополнительной очистки. 1H-ЯМР (300 МГц, СDСl3); 2,19 (шир.с, 2 Н, NH2); 5,26 (м, 1 Н, NСHАr2); 7,15-7,44 (м, 7 Н, Н аром.); 7,62 (м, 1 Н, Н аром.); 8,58 (с, 1 Н, Н аром.). M+ (ESI+): 185. Способ В. а) Методика получения промежуточных альдегидов (XVI), например 5-[2-(диметиламино)этокси]пиридин-2-карбоксальдегида (схема 8).(100 мл) в сухом ДМФА (400 мл) нагревают при 110 С в атмосфере N2 в течение 16 ч. Реакционную смесь охлаждают до к.т. и разбавляют водой (3 л). Образовавшийся осадок отфильтровывают, промывают и сушат, получая неочищенный [3-(4-тозилокси)]-6-метилпиридин (102 г, 75%) в виде белого твердого вещества. Неочищенный продукт используют в следующей реакции без какой-либо очистки. К раствору [3-(4-тозилокси)]-6-метилпиридина (100 г, 0,38 моль) в сухом СНСl3 (2 л) одной порцией добавляют МСРВА (50%, маc./маc., 200 г, 0,57 моль). Реакционную смесь кипятят с обратным холодильником в течение 4 ч, охлаждают до к.т. и отфильтровывают твердое вещество. Фильтрат промывают 20% раствором Na2CO3 (3 х 1 л), сушат над Na2SO4 и концентрируют, получая 6-метил-3-(4 тозилокси)пиридин-N-оксид (85 г, 80%) в виде твердого вещества. Полученный неочищенный продукт используют на следующей стадии без дополнительной очистки. К раствору уксусного ангидрида (500 мл), нагретого до 90 С, небольшими порциями в течение 2 ч добавляют 6-метил-3-(4-тозилокси)пиридин-N-оксид (80 г). Реакционную смесь кипятят с обратным холодильником в течение 16 ч в атмосфере N2. Уксусный ангидрид отгоняют. Полученный неочищенный продукт очищают колоночной хроматографией на силикагеле (градиент петролейный эфир/СН 2 Сl2 от 7:3 до 3:7), получая 3-тозилокси-6-ацетоксиметилпиридин (55 г, 57%) в виде жидкости. Смесь 3-тозилокси-6-ацетоксиметилпиридина (50 г, 0,148 моль) и NaOH (25 г, 0,62 моль) в 150 мл воды кипятят с обратным холодильником в течение 15 ч. Реакционную смесь охлаждают до к.т. и нейтрализуют концентрированной НСl. Растворитель выпаривают в вакууме, получая в остатке твердое вещество, которое суспендируют в этилацетате (750 мл) и нагревают при 60 С в течение 30 мин при перемешивании. Суспендированное вещество отфильтровывают и фильтрат концентрируют, получая 5 гидрокси-2-гидроксиметилпиридин (15 г, 80%) в виде бледно-желтого твердого вещества. Его используют на следующей стадии без дополнительной очистки. Смесь 5-гидрокси-2-гидроксиметилпиридина (14 г) и МnO2 (100 г) в изопропиловом спирте (600 мл) перемешивают в атмосфере N2 в течение 20 ч. Реакционную смесь фильтруют и фильтрат концентрируют в вакууме, получая неочищенный продукт в виде твердого вещества (12 г). Его суспендируют в смеси ацетон/ацетонитрил (по 25 мл каждого) и оставшееся твердое вещество отфильтровывают. Его промывают холодной смесью ацетон/ацетонитрил, 1:1, получая 5-гидроксипиридин-2-карбоксальдегид (3 г) в виде твердого вещества. Смесь полученного выше 5-гидроксипиридин-2-карбоксальдегида (4 г, 0,032 моль) и К 2 СО 3 (14 г,0,097 моль) в ТГФ (100 мл) нагревают при 60 С в течение 2 ч в атмосфере N2. Получают свежий 2 диметиламиноэтилхлорид из соответствующей соли НСl (9,4 г, 0,06 моль), к которой при 0 С по каплям добавляют 20% раствор NaOH (2 эквивалента). Затем его по каплям добавляют при 60 С к полученной выше реакционной смеси. Реакционную смесь перемешивают 6 ч при той же температуре. По окончании указанного времени реакционную смесь охлаждают до к.т., твердое вещество отфильтровывают и фильтрат концентрируют в вакууме, получая ожидаемый неочищенный продукт. Затем его очищают колоночной хроматографией на силикагеле (градиент метанола в хлороформе от 0,1 до 2%), получая нужный альдегид (XVI), например, 5-[2-(диметиламино)этокси]пиридин-2-карбоксальдегид (3,25 г, 51%) в виде бесцветной жидкости.b) Методика получения аминов (IV и IV), например [2-(6-[(R)-амино(фенил)метил]пиридин-3 илокси)этил]диметиламина- 26007328 К альдегиду (XVI) с предыдущей стадии, например, 5-[2-(диметиламино)этокси]пиридин-2 карбоксальдегиду, применяют стадии а)-d), описанные в способе А, получая нужный амин (IV, IV), например, [2-(6-[(R)-амино(фенил)метил]пиридин-3-илокси)этил]диметиламин (165 мг, выход 96%). Полученный неочищенный первичный амин используют без дополнительной очистки.M+ (ESI+): 271. Промежуточное соединение 2. Получение рацемических аминов общей формулы (IV), например,[(6-хлорпиридин-3-ил)(фенил)метил]амина; [(2-хлорпиридин-4-ил)(фенил)метил]амина; 5-[амино(фенил) метил]пиридин-2-ола; 5-[амино(фенил)метил]-N,N-диметилпиридин-2-амина; [(1-метилпиперидин-4 ил)(фенил)метил]амина. Способ А. а) Методика получения промежуточных кетонов (XIX), например (6-хлорпиридин-3 ил)(фенил)метанона. Карбоновую кислоту, например, 6-хлорникотиновую кислоту (3,151 г, 20 ммоль), растворяют в сухом DCM. Смесь охлаждают до 0 С. Добавляют оксалилхлорид (2,58 мл, 30 ммоль), затем ДМФА (77 мкл). Смесь перемешивают при 0 С в течение 1 ч 30 мин, затем в течение ночи при к.т. Растворители выпаривают. Неочищенный продукт растворяют в толуоле и снова выпаривают растворители, получая соответствующий хлорангидрид (XVIII), например, 6-хлорникотиноилхлорид (2,886 г, выход 82%). Его растворяют в бензоле (50 мл) и добавляют АlСl3 (5,248 г, 39,4 ммоль). Смесь перемешивают в течение ночи при 80 С. После охлаждения до к.т. добавляют воду. Две фазы разделяют и водный слой экстрагируют двумя порциями этилацетата. Объединенные органические слои промывают насыщенным раствором соли и сушат над МgSO4, фильтруют и концентрируют, получая нужный продукт (XIX), например,(6-хлорпиридин-3-ил)(фенил)метанон, в виде желтоватого масла (3,884 г, выход 67%). Его используют на следующей стадии без дополнительной очистки. 1b) Методика получения промежуточных оксимов (XXXXIII), например (6-хлорпиридин-3 ил)(фенил)метаноноксима. Кетон (XIX), полученный на предыдущей стадии, например, (6-хлорпиридин-3-ил)(фенил)метанон(435 мг, 2 ммоль), растворяют в EtOH (40 мл). Добавляют DIEA (1,027 мл, 6 ммоль) и гидрохлорид гидроксиламина (417 мг; 6 ммоль). Смесь кипятят с обратным холодильником в течение ночи. Растворители удаляют. Полученную неочищенную смесь растворяют в этилацетате (40 мл) и промывают тремя порциями воды. Органический слой сушат над сульфатом магния, фильтруют и выпаривают, получая нужный продукт (XXXXIII), например, (6-хлорпиридин-3-ил)(фенил)метаноноксим (413 мг, выход 89%). Его используют на следующей стадии без дополнительной очистки. 1H-ЯМР (300 МГц, CDCl3); 7,22-7,52 (м, 6 Н, Н аром.); 7,75 (м, 1 Н, Н аром.); 8,45 (д, J=3,0 Гц, 1 Н, Н пиридина). M+ (ESI+): 233. M- (ESI-): 231. с) Методика восстановления оксимов до промежуточных первичных аминов (IV), например, [(6 хлорпиридин-3-ил)(фенил)метил]амина.- 27007328 Оксим (XIX), полученный на предыдущей стадии, например, (6-хлорпиридин-3-ил)(фенил)метаноноксим (368 мг, 1,58 ммоль), растворяют в ледяной уксусной кислоте (20 мл). Добавляют при к.т. порциями металлический цинк (1,034 г, 15,8 ммоль). Реакцию отслеживают методом ЖХ/МС. По завершении восстановления функциональной группы оксима реакционную смесь фильтруют и выпаривают растворители. Неочищенный остаток растворяют в DCM и промывают тремя порциями насыщенного раствора NaHCO3. Затем его сушат над МgSO4, фильтруют и выпаривают. Остаток очищают колоночной хроматографией на силикагеле (DCM/MeOH, 20:1, с 2% NH4OH), получая нужный продукт (IV), например, [(6-хлорпиридин-3-ил)(фенил)метил]амин (188 мг, выход 54%). 1H-ЯМР (300 МГц, CDCl3); 5,18 (с, 1 Н, СHNН 2); 7,14-7,32 (м, 6 Н, Н аром.); 7,61 (дд, J=3,0, 6,0 Гц,1 Н, Н пиридина); 8,37 (д, J=3,0 Гц, 1 Н, Н пиридина). M+ (ESI+): 219. Способ В. а) Методика ароматического замещения промежуточных соединений (XIX), например, (6 хлорпиридин-3-ил)(фенил)метанона, алкоголятом натрия, с получением промежуточных кетонов (XIX),например, (6-трет-бутоксипиридин-3-ил)(фенил)метанона.b) В 5-мл колбу для реакции под действием микроволнового излучения добавляют 55-65% NaH в масле (192 мг, 4,4 ммоль) и сухой ТГФ (2 мл), затем спирт, например, трет-бутанол. Смесь нагревают 30 мин при 60 С. Промежуточное соединение (XIX), например, (6-хлорпиридин-3-ил)(фенил)метанон (435 мг, 2 ммоль), растворяют в сухом ТГФ (2 мл) и добавляют к полученному ранее раствору алкоголята. Полученную смесь нагревают 40 мин в микроволновой печи при 100 С. После завершения реакции добавляют воду и этилацетат. Фазы разделяют и водную фазу экстрагируют двумя порциями этилацетата. Объединенные органические слои сушат над MgSO4, фильтруют и выпаривают, получая ожидаемый продукт (XIX), например, (6-трет-бутоксипиридин-3-ил)(фенил)метанон (191 мг, выход 37%). 1c) Методика получения промежуточных первичных аминов (IV), например 5-[амино(фенил)метил]пиридин-2-ола. К промежуточному соединению (XIX), например, (6-трет-бутоксипиридин-3-ил)(фенил)метанону,применяют методику, описанную в способе А, стадии b) и с), получая нужный амин (IV), например, 5[амино(фенил)метил]пиридин-2-ол (160 мг, выход количественный). На стадии восстановления Zn в АсОН трет-бутильная группа отщепляется, с получением непосредственно соответствующего пиридин 2-ола. Неочищенный первичный амин используют без дополнительной очистки.d) Методика ароматического замещения промежуточных соединений (XIX), например, (6 хлорпиридин-3-ил)(фенил)метанона, амином, с получением промежуточных кетонов (XIX), например,(6-N,N-диметиламинопиридин-3-ил)(фенил)метанона.- 28007328 В 5-мл колбу для реакции под действием микроволнового излучения добавляют промежуточное соединение (XIX), например, (6-хлорпиридин-3-ил)(фенил)метанон (217 мг, 1 ммоль) вместе с сухим ТГФ(1,5 мл) и 2 М раствором диметиламина в ТГФ (3 мл, 6 экв.). Полученную смесь нагревают 120 мин в микроволновой печи при 180 С. После завершения реакции добавляют воду. Водный раствор подщелачивают 5 М раствором NaOH до рН 8. Затем его экстрагируют тремя порциями этилацетата. Объединенные органические фазы сушат над МgSO4, фильтруют и выпаривают, получая ожидаемый продуктH-ЯМР (300 МГц, СDСl3); 3,19 (с, 6 Н, NMe2); 6,56 (д, J=9,0 Гц, 1 Н, Н аром.); 7,40-7,49 (м, 2 Н, Н аром.); 7,53 (м, 1 Н, Н аром.); 7,68-7,76 (м, 2 Н, Н аром.); 8,04 (дд, J=3,0, 9,0 Гц, 1 Н, Н пиридина); 8,60 (д,J=3,0 Гц, 1 Н, Н пиридина). M+ (ESI+): 227. е) Методика получения промежуточных первичных аминов (IV), например, 5-[амино(фенил)метил]N,N-диметилпиридин-2-амина.(IV), например, 5-[амино(фенил)метил]-N,N-диметилпиридин-2-амин (136 мг, выход 83%). Полученный неочищенный первичный амин используют без дополнительной очистки. 1H-ЯМР (300 МГц, CDCl3); 2,13 (шир.с, 2 Н, NH2); 2,99 (с, 6 Н, NMe2); 5,06 (с, 1 Н, CHNH2), 6,41 (д,J=9,0 Гц, 1 Н, Н аром.); 7,10-7,41 (м, 6 Н, Н аром.); 8,09 (д, J=3,0 Гц, 1 Н, Н пиридина). M+ (ESI+): 228. Способ D. а) Методика введения защитной Вос-группы в промежуточные аминокетоны (XIX), например, в фенил (пиперидин-4-ил )метанон.(1,129 г, 5 ммоль), суспендируют в DCM (25 мл). Добавляют DIEA (0,94 мл, 5,5 ммоль) и полученную неоднородную смесь охлаждают до 0 С. Добавляют ди-трет-бутилдикарбонат (1,20 г, 5,5 ммоль) в виде твердого вещества. Смесь перемешивают 5 мин при 0 С и 1 ч при к.т. После завершения реакции реакционную смесь промывают 1N HCl, затем насыщенным водным раствором NaHCO3, насыщенным раствором соли и сушат над МgSO4. После фильтрования и выпаривания получают ожидаемый продукт(XIX), например, трет-бутил 4-бензоилпиперидин-1-карбоксилат (1,333 г, выход 92%) в виде белого твердого вещества. 1(м, 1 Н); 4,14 (м, 2 Н); 7,41-7,49 (м, 2 Н, Н аром.); 7,55 (м, 1 Н, Н аром.); 7,88-7,95 (м, 2 Н, Н аром.). [М-третВu+Н]+ (ESI+): 234. М- (ЕSI-): 288. с) Методика получения промежуточного оксима (XXXXIII), например, трет-бутил 4-[(Z)(гидроксиимино)(фенил)метил]пиперидин-1-карбоксилата. Следуя методике, описанной в способе А, стадия b), исходя из промежуточного соединения XVIII,например, трет-бутил 4-бензоилпиперидин-1-карбоксилата (1,0 г, 3,46 ммоль), получают нужный продукт XXXXIII, например, трет-бутил 4-[(Z)-(гидроксиимино)(фенил)метил]пиперидин-1-карбоксилат, с выходом 94% и чистотой по ВЭЖХ 97%. Его используют на следующей стадии без дополнительной очистки.d) Методика восстановления промежуточного оксима XXXXIII до первичного амина (IV), например, трет-бутил 4-[амино(фенил)метил]пиперидин-1-карбоксилата Промежуточный оксим XXXXIII, например, трет-бутил 4-[(Z)-(гидроксиимино)(фенил) метил]пиперидин-1-карбоксилат, растворяют в МеОН, добавляют Pd/C (10%) и смесь помещают на ночь в атмосферу Н 2 при давлении 30 бар. Когда восстановление завершится, раствор фильтруют через целит и выпаривают растворители, получая неочищенный первичный амин. Его растворяют в Et2O и экстрагируют 3 порциями 1N HCl. Объединенные кислые фракции промывают одной порцией Et2O. Затем их подщелачивают 5N раствором NaOH. Щелочную водную фазу экстрагируют 3 порциями эфира. Объединенные органические фазы сушат над МgSO4, фильтруют и выпаривают, получая первичный амин IV, например,трет-бутил 4-[амино(фенил)метил]пиперидин-1-карбоксилат (729 мг, выход 68%), который используют на следующей стадии без дополнительной очистки. 1(м, 2 Н), 3,61 (д, J=9,0 Гц, 1 Н); 4,10 (м, 2 Н); 7,19-7,35 (м, 5 Н, Н аром.). M+ (ESI+): 291. е) Методика восстановления Вос-группы до третичного амина (XXXII), например, 1-(1-метилпиперидин-4-ил)-1-фенилметанамина. Промежуточное соединение XXXI, например, трет-бутил 4-[амино(фенил)метил]пиперидин-1 карбоксилат (1,0 г, 3,44 ммоль), растворяют в сухом ТГФ (50 мл). Добавляют порциями LiAlH4 (261 мг,6,89 ммоль). Реакционную смесь кипятят с обратным холодильником в течение ночи. После завершения реакции ее гасят, добавляя по каплям воду (5 мл), затем 1N NaOH (5 мл) и Н 2O (5 мл). Полученную таким образом суспензию экстрагируют этилацетатом, экстракт сушат над MgSO4 и выпаривают, получая неочищенный продукт. Затем его очищают флэш-хроматографией (DCM/MeOH, 20:1, с 2% NH4OH), получая третичный амин XXXII, например, 1-(1-метилпиперидин-4-ил)-1-фенилметанамин (444,6 мг, выход 63%). 1 Н-ЯМР (300 МГц, СDСl3); 1,12-1,53 (м, 4 Н); 1,62 (шир.с, 2 Н, NH2); 1,77 (м, 1 Н); 1,83-2,03 (м, 2 Н); 2,22 (с, 3 Н, СН 3); 2,75 (м, 1 Н), 2,91 (м, 1 Н), 3,60 (д, J=6,0 Гц, 1 Н); 7,18-7,35 (м, 5 Н, Н аром.). M+ (ESI+): 204.f) Разделение энантиомеров промежуточного соединения (XXXII), например 1-(1-метилпиперидин 4-ил)-1-фенилметанамина, хроматографией на хиральном носителе. Два энантиомера промежуточного соединения XXXII, например, 1-(1-метилпиперидин-4-ил)-1 фенилметанамина (5,00 г), разделяют на хиральной колонке (Chiralcell OD-H, 250 мм х 20 мм; размер гранул 5 мкм, Chiral Technologies Europe). Разделенные на 35 впрыскиваний, энантиомер (R) (2,344 г,r.t.=5,897 мин) и энантиомер (S) (2,552 г, r.t.=7,898 мин) выделяют с е.е. 99,8% (определяют на аналитической колонке Chiralcell OD-H, 250 х 4,6 мм, размер гранул 5 мкм, Chiral Technologies Europe) и выходом 98%. Абсолютную конфигурацию каждого энантиомера устанавливают путем корреляции с биологической активностью конечных продуктов, когда известно, что продукты XXXII, содержащие (S)-2 замещенный бензиламин, являются более активными, чем продукты, содержащие (R)-2-замещенный бензиламин. 1-(2-Хлорпиридин-4-ил)-1-фенилметанамин. Следуя общему способу А, исходя из 2-хлоризоникотиновой кислоты, получают указанное в заголовке соединение с выходом 62%.
МПК / Метки
МПК: A61K 31/427, C07D 417/14, C07D 417/12, C07D 277/06, A61P 15/06, A61K 31/426
Метки: рецептора, производные, модуляторы, простагландина, тиазолидинкарбоксамидные
Код ссылки
<a href="https://eas.patents.su/30-7328-tiazolidinkarboksamidnye-proizvodnye-kak-modulyatory-receptora-prostaglandina-f.html" rel="bookmark" title="База патентов Евразийского Союза">Тиазолидинкарбоксамидные производные как модуляторы рецептора простагландина f</a>
Предыдущий патент: Способ получения модафинила
Следующий патент: Гербицидные композиции с особыми сульфонилмочевинами
Случайный патент: Ингибиторы ассоциированной с иммунитетом протеинкиназы












