N-замещенные производные глицина: ингибиторы гидроксилаз
Номер патента: 17112
Опубликовано: 28.09.2012
Авторы: Даффи Кевин Дж., Майерс Андреа К., Миллер Уилльям Генри, Циммерман Майкл Н., Шо Энтони Н.
Формула / Реферат
1. Соединение формулы (I)
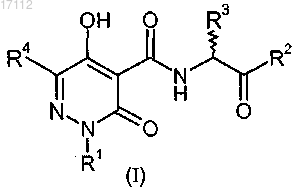
где R1 выбирают из группы, состоящей из водорода, C1-C10-алкила, C3-C8-циклоалкила, C1-C10-алкил-C3-C8-циклоалкила, C1-C10-алкилфенила и C1-C10-алкилбензотиазолила;
R2 означает -OR9;
R3 означает Н;
R4 выбирают из группы, состоящей из CONR7R8, C1-C10-алкила, C3-C8-циклоалкила, фенила, индолила, тиофенила;
R7 и R8, каждый независимо, выбирают из группы, состоящей из водорода, C1-C10-алкила;
R9 означает Н;
любой атом углерода или гетероатом групп R1, R4, R7, R8 является незамещенным или, где возможно, замещен одним или более заместителями, независимо выбранными из группы, состоящей из C1-C6-алкила, фенила, галогена, -OR10, -циано, нитро, -С(О)OR10, пиридинила; R10 означает водород, C1-C10-алкил;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, в котором
R1 означает C1-C10-алкилфенил, где любой атом углерода фенильного кольца может быть замещен одним или более заместителями, независимо выбранными из группы, состоящей из C1-C6-алкила, галогена или CF3;
R2 означает -ОН;
R3 означает Н;
R4 означает C1-C10-алкил.
3. Соединение по п.1, которым является
N-{[5-гидрокси-6-метил-3-оксо-2-(фенилметил)-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[5-гидрокси-3-оксо-6-фенил-2-(фенилметил)-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[5-гидрокси-6-(1-метилэтил)-3-оксо-2-(фенилметил)-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-[(5-гидрокси-3-оксо-6-фенил-2,3-дигидро-4-пиридазинил)карбонил]глицин;
N-[(2-{[4-(1,1-диметилэтил)фенил]метил}-5-гидрокси-3-оксо-6-фенил-2,3-дигидро-4-пиридазинил)карбонил]глицин;
N-{[5-гидрокси-3-оксо-6-фенил-2-(2-фенилэтил)-2,3-дигидропиридазин-4-ил]карбонил}глицин;
N-{[2-(2-циклопропилэтил)-5-гидрокси-3-оксо-6-фенил-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[2-(2-хлорбензил)-5-гидрокси-3-оксо-6-фенил-2,3-дигидропиридазин-4-ил]карбонил}глицин;
N-{[5-гидрокси-3-оксо-2-(фенилметил)-6-(трифторметил)-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[6-циклогексил-5-гидрокси-3-оксо-2-(фенилметил)-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-[(6-циклогексил-2-{[4-(1,1-диметилэтил)фенил]метил}-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинил)карбонил]глицин;
N-({2-[(2-хлорфенил)метил]-6-циклогексил-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинил}карбонил)глицин;
N-[(2,6-дициклогексил-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинил)карбонил]глицин;
N-{[2-{[4-(1,1-диметилэтил)фенил]метил}-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[2-[(2-хлорфенил)метил]-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[2-[(3,5-дифторфенил)метил]-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[2-(4-бифенилилметил)-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[2-(2-циклогексилэтил)-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[2-(4-бифенилилметил)-6-(4-фторфенил)-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-[(6-(4-хлорфенил)-2-{[4-(1,1-диметилэтил)фенил]метил}-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинил)карбонил]глицин;
N-{[2-(4-бифенилилметил)-6-(4-хлорфенил)-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[2-[(2-хлорфенил)метил]-6-(4-фторфенил)-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-({6-(4-хлорфенил)-2-[(2-хлорфенил)метил]-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинил}карбонил)глицин;
N-{[6-(4-хлорфенил)-2-(2-циклогексилэтил)-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[2-(2-циклопропилэтил)-6-(4-фторфенил)-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-[(6-[4-(1,1-диметилэтил)фенил]-2-{[4-(1,1-диметилэтил)фенил]метил}-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинил)карбонил]глицин;
N-({2-[(2-хлорфенил)метил]-6-[4-(1,1-диметилэтил)фенил]-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинил}карбонил)глицин;
N-({5-гидрокси-6-метил-2-[(2-нитрофенил)метил]-3-оксо-2,3-дигидро-4-пиридазинил}карбонил)глицин;
N-[(6-(4-фторфенил)-5-гидрокси-3-оксо-2-{[2-(трифторметил)фенил]метил}-2,3-дигидро-4-пиридазинил)карбонил]глицин;
N-{[2-[(2-хлорфенил)метил]-6-(3,5-дифторфенил)-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-({2-[(2-хлорфенил)метил]-5-гидрокси-6-[4-(метилокси)фенил]-3-оксо-2,3-дигидро-4-пиридазинил}карбонил)глицин;
N-({2-[(3,5-дифторфенил)метил]-5-гидрокси-6-[4-(метилокси)фенил]-3-оксо-2,3-дигидро-4-пиридазинил}карбонил)глицин;
N-{[2-[(2-хлорфенил)метил]-5-гидрокси-6-(4-гидроксифенил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[2-[(3,5-дифторфенил)метил]-5-гидрокси-6-(4-гидроксифенил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-[(5-гидрокси-6-[3-(метилокси)фенил]-3-оксо-2-{[2-(трифторметил)фенил]метил}-2,3-дигидро-4-пиридазинил)карбонил]глицин;
N-({2-[(2-хлорфенил)метил]-5-гидрокси-6-[3-(метилокси)фенил]-3-оксо-2,3-дигидро-4-пиридазинил}карбонил)глицин;
N-({2-[(2-хлорфенил)метил]-5-гидрокси-6-[2-(метилокси)фенил]-3-оксо-2,3-дигидро-4-пиридазинил}карбонил)глицин;
N-{[2-[(2,6-дихлорфенил)метил]-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[2-[(4-фторфенил)метил]-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-[(5-гидрокси-6-(1-метилэтил)-3-оксо-2-{[2-(трифторметил)фенил]метил}-2,3-дигидро-4-пиридазинил)карбонил]глицин;
N-{[2-[(3-цианофенил)метил]-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-({5-гидрокси-6-(1-метилэтил)-2-[(2-нитрофенил)метил]-3-оксо-2,3-дигидро-4-пиридазинил}карбонил)глицин;
N-{[2-[(2-фторфенил)метил]-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[2-[(2,5-дифторфенил)метил]-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[2-[(2-хлорфенил)метил]-6-(1,1-диметилэтил)-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[2-[(4-бром-2-фторфенил)метил]-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[2-[(3,4'-дифтор-4-бифенилил)метил]-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[2-{[2-фтор-4-(4-пиридинил)фенил]метил}-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-[(6-(1,1-диметилэтил)-2-{[4-(1,1-диметилэтил)фенил]метил}-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинил)карбонил]глицин;
N-{[2-[(3-фтор-4-бифенилил)метил]-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[2-[(3-фтор-4'-нитро-4-бифенилил)метил]-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[2-{[3-фтор-4'-(трифторметил)-4-бифенилил]метил}-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-({6-циклогексил-5-гидрокси-2-[(2-метилфенил)метил]-3-оксо-2,3-дигидро-4-пиридазинил}карбонил)глицин;
N-({6-циклогексил-2-[(2-фторфенил)метил]-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинил}карбонил)глицин;
N-[(6-циклогексил-5-гидрокси-3-оксо-2-{[4-(трифторметил)фенил]метил}-2,3-дигидро-4-пиридазинил)карбонил]глицин;
N-({6-циклогексил-2-[(3,4-дихлорфенил)метил]-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинил}карбонил)глицин;
N-{[2-{[3-фтор-4'-(метилтио)-4-бифенилил]метил}-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[2-{[3-фтор-2'-(метилокси)-4-бифенилил]метил}-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
4'-{[5-{[(карбоксиметил)амино]карбонил}-4-гидрокси-3-(1-метилэтил)-6-оксо-1(6Н)-пиридазинил]метил}-3'-фтор-4-бифенилкарбоновая кислота;
N-{[2-[(2-бромфенил)метил]-6-(1,1-диметилэтил)-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[2-[(4-бромфенил)метил]-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[2-[(4'-фтор-4-бифенилил)метил]-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-({5-гидрокси-6-(1-метилэтил)-2-[(4'-нитро-4-бифенилил)метил]-3-оксо-2,3-дигидро-4-пиридазинил}карбонил)глицин;
N-[(5-гидрокси-6-(1-метилэтил)-3-оксо-2-{[4'-(трифторметил)-4-бифенилил]метил}-2,3-дигидро-4-пиридазинил)карбонил]глицин;
N-[(5-гидрокси-6-(1-метилэтил)-3-оксо-2-{[4-(4-пиридинил)фенил]метил}-2,3-дигидро-4-пиридазинил)карбонил]глицин;
N-[(5-гидрокси-6-(1-метилэтил)-2-{[2'-(метилокси)-4-бифенилил]метил}-3-оксо-2,3-дигидро-4-пиридазинил)карбонил]глицин;
4'-{[5-{[(карбоксиметил)амино]карбонил}-4-гидрокси-3-(1-метилэтил)-6-оксо-1(6Н)-пиридазинил]метил}-4-бифенилкарбоновая кислота;
N-{[2-(4-бифенилилметил)-6-(1,1-диметилэтил)-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-({2-[(2-хлорфенил)метил]-6-[3-(этилокси)-5-фторфенил]-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинил}карбонил)глицин;
N-{[2-(2-бифенилилметил)-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[2-(3-бифенилилметил)-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-({6-(1,1-диметилэтил)-5-гидрокси-2-[(2-метилфенил)метил]-3-оксо-2,3-дигидро-4-пиридазинил}карбонил)глицин;
N-[(6-(3,5-дифторфенил)-5-гидрокси-3-оксо-2-{[2-(трифторметил)фенил]метил}-2,3-дигидро-4-пиридазинил)карбонил]глицин;
N-({6-(3,5-дифторфенил)-2-[(3,5-дифторфенил)метил]-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинил}карбонил)глицин;
N-[(6-(1,1-диметилэтил)-5-гидрокси-3-оксо-2-{[2-(трифторметил)фенил]метил}-2,3-дигидро-4-пиридазинил)карбонил]глицин;
N-{[2-(1,3-бензотиазол-2-илметил)-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-[(6-(1,1-диметилэтил)-2-{[4-фтор-2-(трифторметил)фенил]метил}-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинил)карбонил]глицин;
N-{[2-[(2-бромфенил)метил]-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[2-[(3-бромфенил)метил]-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-[(6-[3-(этилокси)-5-фторфенил]-5-гидрокси-3-оксо-2-{[2-(трифторметил)фенил]метил}-2,3-дигидро-4-пиридазинил)карбонил]глицин;
N-{[5-гидрокси-6-(1-метилэтил)-2-({4-[6-(4-метил-1-пиперазинил)-3-пиридинил]фенил}метил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-({2-[(3,5-дифторфенил)метил]-6-[3-(этилокси)-5-фторфенил]-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинил}карбонил)глицин;
N-{[5-гидрокси-6-(1-метилэтил)-3-оксо-2-({4-[2-(1-пиперазинил)-4-пиридинил]фенил}метил)-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[2-{[4-(2,6-дифтор-4-пиридинил)фенил]метил}-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[5-гидрокси-6-(1-метилэтил)-2-({4-[2-(метилокси)-4-пиридинил]фенил}метил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[2-[(4'-фтор-2-бифенилил)метил]-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[2-[(2,4-дифторфенил)метил]-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[2-[(3,4-дихлорфенил)метил]-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-({5-гидрокси-6-(1-метилэтил)-2-[(4'-нитро-2-бифенилил)метил]-3-оксо-2,3-дигидро-4-пиридазинил}карбонил)глицин;
N-[(5-гидрокси-6-(1-метилэтил)-3-оксо-2-{[4'-(трифторметил)-2-бифенилил]метил}-2,3-дигидро-4-пиридазинил)карбонил]глицин;
N-{[2-[(2,3-дихлорфенил)метил]-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
2'-{[5-{[(карбоксиметил)амино]карбонил}-4-гидрокси-3-(1-метилэтил)-6-оксо-1(6Н)-пиридазинил]метил}-4-бифенилкарбоновая кислота;
N-[(5-гидрокси-6-(1-метилэтил)-2-{[2'-(метилокси)-2-бифенилил]метил}-3-оксо-2,3-дигидро-4-пиридазинил)карбонил]глицин;
N-{[2-[(4-хлор-2-фторфенил)метил]-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[2-[(2,5-дихлорфенил)метил]-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[2-[(2,4-дихлорфенил)метил]-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[2-[(4'-амино-2-бифенилил)метил]-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[2-циклогексил-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[2-циклогексил-6-(1,1-диметилэтил)-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[5-гидрокси-6-(1-метилэтил)-2-({3-[6-(4-метил-1-пиперазинил)-3-пиридинил]фенил}метил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[5-гидрокси-6-(1-метилэтил)-3-оксо-2-({3-[2-(1-пиперазинил)-4-пиридинил]фенил}метил)-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[5-гидрокси-6-(1-метилэтил)-3-оксо-2-({2-[2-(1-пиперазинил)-4-пиридинил]фенил}метил)-2,3-дигидро-4-пиридазинил]карбонил}глицин;
2,2'-{{1-[(2-хлорфенил)метил]-4-гидрокси-6-оксо-1,6-дигидропиридазин-3,5-диил}-бис-[(оксометандиил)имино]}диуксусная кислота;
N-{[5-гидрокси-6-(1-метилэтил)-3-оксо-2-(2,2,2-трифторэтил)-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-({2-[(2-хлорфенил)метил]-6-[(этилокси)карбонил]-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинил}карбонил)глицин;
N-{[2-{[2-фтор-4-(трифторметил)фенил]метил}-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[5-гидрокси-6-(1Н-индол-3-ил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонил}глицин;
N-{[5-гидрокси-3-оксо-6-(2-тиенил)-2,3-дигидро-4-пиридазинил]карбонил}глицин;
или его фармацевтически приемлемая соль.
Текст
Изобретение относится к некоторым пиридазиндионовым N-замещенным производным глицина формулы (I) где R1-R4 имеют указанные в формуле изобретения значения, которые являются антагонистами пролилгидроксилаз HIF и пригодны для лечения заболеваний, на которые благоприятное воздействие оказывает ингибирование указанных ферментов, одним из примеров таких заболеваний является анемия.(71)(73) Заявитель и патентовладелец: СМИТКЛАЙН БИЧАМ КОРПОРЕЙШН (US) 017112 Область изобретения Настоящее изобретение относится к некоторым гетероароматическим N-замещенным производным глицина, которые являются ингибиторами пролилгидроксилаз HIF, и поэтому применяются в лечении заболеваний, на которые благоприятное воздействие оказывает ингибирование указанных ферментов,одним из примеров таких заболеваний является анемия. Предшествующий уровень техники Анемия наблюдается в тех случаях, когда возникает заболевание или нарушение в эритроцитах, которое приводит к снижению уровней кислорода в крови. Анемия встречается часто у онкологических больных, особенно у больных, подвергаемых химиотерапии. Анемия часто наблюдается у населения пожилого и старческого возраста, у больных с почечным заболеванием и при широком ряде состояний, связанных с хроническим заболеванием. Часто причиной анемии является снижение продукции эритропоэтина (Epo), приводящее к предотвращению эритропоэза (созревание эритроцитов). Продукцию Epo можно повысить путем ингибирования пролилгидроксилаз, ферментов, регулирующих индуцируемый гипоксией фактор (HIF). Одной из стратегий повышения продукции эритропоэтина является стабилизация и следующее из этого увеличение транскрипционной активности HIF. Субъединицы HIF- (HIF-1 альфа, HIF-2 альфа иHIF-3 альфа) быстро деградируют под действием протеасомы в нормоксических условиях при гидроксилировании остатков пролина, которое катализируется пролилгидроксилазами (EGLN1, 2, 3). Гидроксилирование пролина делает возможным взаимодействие с белком фон Хиппеля-Линдау (VHL), компонентом убиквитин лигазы Е 3. Этот процесс приводит к убиквитинилированию HIF-альфа и последующей деградации. В условиях гипоксии ингибирующая активность пролилгидроксилаз подавляется, вследствие чего субъединицы HIF-альфа стабилизируются, и HIF-чувствительные гены, включая Epo, транскрибируются. Таким образом, ингибирование пролилгидроксилаз приводит к повышению уровней HIFальфа и, вследствие этого, к увеличению продукции Epo. Соединения настоящего изобретения относятся к средствам для ингибирования таких гидроксилаз,увеличения продукции Epo и, тем самым, для лечения анемии. Введение указанных выше соединений также может оказывать благоприятное воздействие на ишемию, удар и цитопротекцию. Сущность изобретения Во-первых, данное изобретение относится к соединению формулы (I)R5 и R6, взятые вместе с атомом азота, к которому они присоединены, образуют 5-, или 6-, или 7-членное насыщенное кольцо, необязательно содержащее один другой гетероатом, выбранный из группы, состоящей из кислорода, азота и серы;R9 означает Н, или катион, или C1-C10-алкил, незамещенный или замещенный одним или более заместителями, независимо выбранными из группы, состоящей из C3-C6-циклоалкила, гетероциклоалкила,арила и гетероарила; и где любой атом углерода или гетероатом групп R1, R2, R3, R4, R5, R6, R7, R8, R9 является незамещенным или, где возможно, замещен одним или более заместителями, независимо выбранными из группы,состоящей из C1-C6-алкила, арила, гетероарила, галогена, -OR10, -NR5R6, циано, нитро, -C(O)R10,-С(О)OR10, -SR10, -S(O)R10, -S(O)2R10, -CONR5R6, -N(R5)C(O)R10, -N(R5)С(O)OR10, -OC(O)NR5R6,-1 017112-N(R5)C(O)NR5R6, -SO2NR5R6, -N(R5)SO2R10, C1-C10-алкенильной, C1-C10-алкинильной, C3-C6 циклоалкильной, C3-C6-гетероциклоалкильной, арильной и гетероарильной группы; где R5 и R6 являются такими, как определено выше, и R10 означает водород, C1-C10-алкил, C2-C10-алкенил, C2-C10-алкинил,-СО(C1-C4-алкил), -СО(арил), -СО(гетероарил), -СО(C3-C6-циклоалкил), -СО(C3-C6-гетероциклоалкил),-SO2(C1-C4-алкил), C3-C8-циклоалкил, C3-C8-гетероциклоалкил, C6-C14-арил, C1-C10-алкиларил, гетероарил или C1-C10-алкилгетероарил; или его фармацевтически приемлемой соли или сольвату. Во втором аспекте настоящего изобретения предоставлено соединение формулы (I) или его соль или сольват для применения в терапии млекопитающих, например в лечении анемии. Примером такого терапевтического подхода является способ лечения анемии, заключающийся в повышении продукции эритропоэтина посредством ингибирования пролилгидроксилаз HIF, включающий введение соединения формулы (I) пациенту, нуждающемуся в этом, одного или смешанного с фармацевтически приемлемым эксципиентом, в количестве, достаточном для увеличения продукции Epo. В третьем аспекте настоящего изобретения предоставлена фармацевтическая композиция, содержащая соединение формулы (I) или его соль, сольват или т.п. и один или более фармацевтически приемлемых носителей, разбавителей или эксципиентов. В четвертом аспекте предложено применение соединения формулы (I) или его соли или сольвата для получения лекарственного средства для применения в лечении нарушения, опосредованного ингибированием пролилгидроксилаз HIF, такого как анемия, которое можно лечить посредством ингибирования пролилгидроксилаз HIF. Подробное описание изобретения Во избежание неоднозначности толкования, если не указано иное, термин "замещенный" означает замещенный одной или несколькими определенными группами. В случае, где группы могут быть выбраны из ряда альтернативных групп, выбранные группы могут быть одинаковыми или различными. Термин "независимо" означает, что в случае, при котором более чем один заместитель выбирают из ряда возможных заместителей, такие заместители могут быть одинаковыми или различными."Эффективное количество" означает такое количество лекарственного средства или фармацевтического средства, которое будет вызывать биологический или медицинский ответ ткани, системы, животного или человека, определяемый, например, исследователем или клиницистом. Кроме того, термин "терапевтически эффективное количество" означает любое количество, которое, при сравнении с соответствующим субъектом, не получающим такое количество, приводит к улучшению лечения, излечиванию,предотвращению или уменьшению интенсивности заболевания, нарушения или побочного эффекта или уменьшению скорости протекания заболевания или нарушения. Термин также включает в свой объем количества, эффективные для усиления нормальной физиологической функции. Используемый в описании термин "алкил" относится к углеводородному радикалу с прямой или разветвленной цепью, имеющей определенное число атомов углерода, так, например, как используют в описании, термины "C1-C4-алкил" и "C1-C10-алкил" относятся к алкильной группе, имеющей по меньшей мере 1 и вплоть до 4 или 10 атомов углерода соответственно. Примеры таких алкильных групп с разветвленной или прямой цепью, используемые в настоящем изобретении, включают, но не ограничиваются ими, метил, этил, н-пропил, изопропил, изобутил, н-бутил, трет-бутил, н-пентил, изопентил, н-гексил,н-гептил, н-октил, н-нонил и н-децил и разветвленные аналоги последних пяти нормальных алканов. В случае, когда используют термин "алкенил" (или "алкенилен"), он относится к прямым или разветвленным углеводородным цепям, содержащим определенное число атомов углерода и по меньшей мере 1 и вплоть до 5 углерод-углеродных двойных связей. Примеры включают этенил (или этенилен) и пропенил (или пропенилен). В случае, когда используют термин "алкинил" (или "алкинилен"), он относится к прямым или разветвленным углеводородным цепям, содержащим определенное число атомов углерода и по меньшей мере 1 и вплоть до 5 углеводородных тройных связей. Примеры включают этинил (или этинилен) и пропинил (или пропинилен). В случае, когда используют термин "циклоалкил", он относится к неароматическому насыщенному циклическому углеводородному кольцу, содержащему определенное число атомов углерода. Так, например, термин "C3-C8-циклоалкил" относится к неароматическому циклическому углеводородному кольцу,имеющему от 3 до 8 атомов углерода. Конкретные "C3-C8-циклоалкильные" группы, используемые в настоящем изобретении, включают, но не ограничиваются ими, циклопропил, циклобутил, циклопентил,циклогексил, циклогептил и циклооктил. Термин "C3-C8-циклоалкенил" относится к неароматическому моноциклическому карбоциклическому кольцу, имеющему определенное число атомов углерода и вплоть до 3 углерод-углеродных двойных связей. Термин "циклоалкенил" включает в качестве примера циклопентенил и циклогексенил. В случае, когда используют термин "C3-C8-гетероциклоалкил", он означает неароматическое гетероциклическое кольцо, содержащее определенное число атомов, насыщенное или имеющее одну или более степеней ненасыщенности и содержащее один или более гетероатомов, выбранных из О, S и/илиN. Такое кольцо может быть необязательно конденсированным с одним или несколькими другими "гете-2 017112 роциклическими" кольцами или циклоалкильными кольцами. Примеры "гетероциклических" фрагментов включают, но не ограничиваются ими, азиридин, тииран, оксиран, азетидин, оксетан, тиетан, тетрагидрофуран, пиран, 1,4-диоксан, 1,3-диоксан, пиперидин, пиперазин, 2,4-пиперазиндион, пирролидин, имидазолидин, пиразолидин, морфолин, тиоморфолин, тетрагидротиопиран, тетрагидротиофен и т.п."Арил" относится к необязательно замещенным моноциклическим и поликарбоциклическим неконденсированным или конденсированным группам, имеющим 6-14 атомов углерода и имеющим по меньшей мере одно ароматическое кольцо, которое подчиняется правилу Хюккеля. Примерами арильных групп являются фенил, бифенил, нафтил, антраценил, фенантренил и т.п."Гетероарил" означает необязательно замещенное ароматическое моноциклическое кольцо или поликарбоциклическую конденсированную кольцевую систему, где по меньшей мере одно кольцо подчиняется правилу Хюккеля, имеет определенное число атомов в кольце, и такое кольцо содержит по меньшей мере один гетероатом, выбранный из N, O и/или S. Примеры "гетероарильных" групп включают фуранил, тиофенил, пирролил, имидазолил, пиразолил, триазолил, тетразолил, тиазолил, оксазолил, изоксазолил, оксадиазолил, оксопиридил, тиадиазолил, изотиазолил, пиридинил, пиридазинил, пиразинил, пиримидинил, хинолинил, изохинолинил, бензофуранил, бензотиофенил, индолил и индазолил. Термин "необязательно" означает, что последовательно описанное событие(я) может иметь место или не может иметь место, и включает как событие(я), которое происходит, и события, которые не происходят. Термин "сольват" относится к комплексу изменяющейся стехиометрии, образованному растворенным веществом и растворителем. Такие растворители в контексте изобретения не могут препятствовать биологической активности растворенного вещества. Примеры подходящих растворителей включают, но не ограничиваются ими, воду, метанол, этанол и уксусную кислоту. Предпочтительно используемый растворитель является фармацевтически приемлемым растворителем. Примеры подходящих фармацевтически приемлемых растворителей включают, но без ограничения, воду, этанол и уксусную кислоту. Наиболее предпочтительным используемым растворителем является вода. Употребляемый в описании термин "фармацевтически приемлемые соли" относится к солям, которые сохраняют желаемую биологическую активность соединения настоящего изобретения и проявляют минимальные нежелательные токсикологические эффекты. Приведенные выше фармацевтически приемлемые соли могут быть получены in situ на конечной стадии выделения и очистки соединения или могут быть получены отдельно путем взаимодействия очищенного соединения в его свободной кислотной или основной форме с соответствующим основанием или кислотой соответственно. В некоторых вариантах осуществления соединения формулы (I) могут содержать кислотную функциональную группу, одной кислотной группы достаточно для образования солей. Характерные соли включают фармацевтически приемлемые соли металлов, такие как натриевые, калиевые, литиевые, кальциевые, магниевые, алюминиевые и цинковые соли; карбонаты и бикарбонаты фармацевтически приемлемого катиона металла, такого как натрий, калий, литий, кальций, магний, алюминий и цинк; фармацевтически приемлемые органические первичные, вторичные и третичные амины, включая алифатические амины, ароматические амины, алифатические диамины и гидроксиалкиламины, такие как метиламин,этиламин, 2-гидроксиэтиламин, диэтиламин, триэтиламин, этилендиамин, этаноламин, диэтаноламин и циклогексиламин. В некоторых вариантах осуществления соединения формулы (I) могут содержать основную функциональную группу и вследствие этого способны образовывать фармацевтически приемлемые аддитивные соли кислоты при обработке подходящей кислотой. Подходящие кислоты включают фармацевтически приемлемые неорганические кислоты и фармацевтически приемлемые органические кислоты. Характерные фармацевтически приемлемые аддитивные соли кислоты включают гидрохлорид, гидробромид, нитрат, метилнитрат, сульфат, бисульфат, сульфамат, фосфат, ацетат, гидроксиацетат, фенилацетат,пропионат, бутират, изобутират, валерат, малеат, гидроксималеат, акрилат, фумарат, малат, тартрат, цитрат, салицилат, п-аминосалицилат, гликолят, лактат, гептаноат, фталат, оксалат, сукцинат, бензоат,о-ацетоксибензоат, хлорбензоат, метилбензоат, динитробензоат, гидроксибензоат, метоксибензоат, манделат, таннат, формиат, стеарат, аскорбат, пальмитат, олеат, пируват, памоат, малонат, лаурат, глутарат,глутамат, эстолат, метансульфонат (мезилат), этансульфонат (эзилат), 2-гидроксиэтансульфонат, бензолсульфонат (безилат), п-аминобензолсульфонат, п-толуолсульфонат (тозилат) и нафталин-2-сульфонат. Группой соединений, представляющих особый интерес, является группа, гдеR9 означает Н, или катион, или C1-C10-алкил, незамещенный или замещенный одним или более заместителями, независимо выбранными из группы, состоящей из C3-C6-циклоалкила, гетероциклоалкила,арила и гетероарила; и где любой атом углерода или гетероатом групп R1, R2, R3, R4, R9 является незамещенным или, где возможно, замещен одним или более заместителями, независимо выбранными из группы, состоящей изC1-C10-алкилгетероарил; или их фармацевтически приемлемая соль или сольват. Другой группой соединений, представляющих особый интерес, является группа, гдеR9 означает Н или катион; где любой атом углерода или гетероатом групп R1, R2, R3, R4 является незамещенным или, где возможно, замещен одним или более заместителями, независимо выбранными из группы, состоящей изC1-C6-алкила, арила, гетероарила, галогена, -OR10, -NR5R6, циано, нитро, -C(O)R10, -С(О)OR10, -SR10,-S(O)R10, -S(O)2R10, -CONR5R6, -N(R5)C(O)R10, -N(R5)С(О)OR10, -OC(O)NR5R6, N(R5)C(O)NR5R6,-SO2NR5R6,-N(R5)SO2R10,C1-C10-алкенильной,C1-C10-алкинильной,C3-C6-циклоалкильной,C3-C6-гетероциклоалкильной, арильной или гетероарильной группы; где R5 и R6 являются такими, как определено выше, и R10 означает водород, C1-C10-алкил, C2-C10-алкенил, C2-C10-алкинил,-СО(C1-C4-алкил), -СО(арил), -СО(гетероарил), -СО(C3-C6-циклоалкил), -СО(C3-С 6-гетероциклоалкил),-SO2(C1-C4-алкил), C3-C8-циклоалкил, C3-C8-гетероциклоалкил, C6-C14-арил, C1-C10-алкиларил,гетероарил и C1-C10-алкилгетероарил; или их фармацевтически приемлемая соль. Другой группой соединений, представляющих особый интерес, является группа, гдеR9 означает Н или катион; где любой атом углерода или гетероатом групп R1, R2, R3, R4 является незамещенным или, где возможно, замещен одним или более заместителями, независимо выбранными из группы, состоящей изC1-C6-алкила, арила, гетероарила, галогена, -OR10, -NR5R6, циано, нитро, -C(O)R10, -С(О)OR10, -SR10,-S(O)R10, -S(O)2R10, -CONR5R6, -N(R5)C(O)R10, -N(R5)С(О)OR10, -OC(O)NR5R6, -N(R5)C(O)NR5R6,-SO2NR5R6,-N(R5)SO2R10,C1-C10-алкенильной,C1-C10-алкинильной,C3-C6-циклоалкильной,C3-C6-гетероциклоалкильной, арильной или гетероарильной группы; где R5 и R6 являются такими, как определено выше, и R10 означает водород, C1-C10-алкил, C2-C10-алкенил, C2-C10-алкинил, -СО(C1-C4 алкил), -СО(арил), -СО(гетероарил), -СО(C3-C6-циклоалкил), -СО(С 3-С 6-гетероциклоалкил), -SO2(C1-C4 алкил), C3-C8-циклоалкил, C3-C8-гетероциклоалкил, C6-C14-арил, C1-C10-алкиларил, гетероарил иC1-C10-алкилгетероарил; или их фармацевтически приемлемая соль.R4 означает изопропил, трет-бутил или циклогексил; или или их фармацевтически приемлемая соль. Способы получения соединения формулы (I) также входят в объем данного изобретения. С целью иллюстрации представлен способ получения соединения формулы (I) где R1, R2, R3 и R4 являются такими, как определено выше для формулы (I),включающий обработку соединения формулы А где R1 и R4 являются такими, как определено для данных групп в формуле (I),натриевой солью -аминокислоты в соответствующем растворителе, таком как 2-метоксиэтанол, либо в обычном тепловом режиме, либо при микроволновом облучении с образованием соединения формулы(I), где R2 означает -ОН. Специалистам в данной области будет очевидно, что соединения формулы (I) могут существовать в одной или более таутомерных формах, таких как: Все таутомерные формы соединений, представленных в описании, включая их смеси, предназначены быть включенными в объем изобретения. Как правило, соединениям, представленным в качестве примеров в описании, присвоены названия на основе структуры таутомера формулы (IA). Понятно, что любая ссылка на названные соединения настоящего изобретения предназначена для охвата всех таутомеров названных соединений и любых смесей таутомеров названных соединений. Соединения формулы (I) могут быть получены в кристаллическом или некристаллическом виде и,если в кристаллическом, могут быть необязательно сольватированными, например в виде гидрата. Данное изобретение включает в свой объем стехиометрические сольваты (например, гидраты), а также соединения, содержащие различные количества растворителя (например, воду). Некоторые из представленных в описании соединений могут содержать один или более хиральных атомов или, иначе, могут существовать в виде двух энантиомеров. Представленные в формуле изобретения соединения включают смеси энантиомеров, а также очищенные энантиомеры или обогащенные энантиомером смеси. Также в объем изобретения включены индивидуальные изомеры соединений, представленных формулой (I), или соединений, представленных в формуле изобретения ниже, а также любые их полностью или частично уравновешенные смеси. Настоящее изобретение также охватывает индивидуальные изомеры заявленных соединений в виде смесей с их изомерами, в которых один или более хиральных центров являются инвертированными. Также понятно, что любые таутомеры или смеси таутомеров заявленных соединений включены в объем соединений формулы (I), как представлено в описании выше или ниже. В случае существования различных изомерных форм соединений они могут быть разделены или отделены одна от другой обычными способами или любой данный изомер может быть получен обычными способами синтеза или стереоспецифическими или асимметрическими синтезами.-5 017112 Хотя и представляется возможным для применения в терапии, что соединение формулы (I), а также соли, сольваты и т.п. могут быть введены в виде чистого препарата, т.е. без дополнительного носителя,обычной практикой является предоставление активного ингредиента вместе с носителем или разбавителем. Соответственно, изобретение также относится к фармацевтическим композициям, содержащим соединение формулы (I) и соли, сольваты и т.п., и один или более фармацевтически приемлемых носителей, разбавителей или эксципиентов. Соединения формулы (I) и соли, сольваты и т.д. описаны выше. Носитель(и), разбавитель(и) или эксципиент(ы) должны быть приемлемыми, в смысле быть совместимыми с другими ингредиентами композиции и не оказывать вредного воздействия на реципиента. В соответствии с другим аспектом изобретения предлагается способ получения фармацевтической композиции, включающий смешивание соединения формулы (I) или солей, сольватов и т.д. с одним или более фармацевтически приемлемыми носителями, разбавителями или эксципиентами. Специалистам в данной области будет очевидно, что некоторые защищенные производные соединений формулы (I), которые могут быть получены до осуществления конечной стадии синтеза, на которой удаляется защитная группа, могут не обладать фармакологической активностью как таковой, но могут быть в некоторых случаях введены перорально или парентерально, после чего они могут метаболизировать в организме с образованием соединений настоящего изобретения, являющихся фармакологически активными. Поэтому такие производные соединений могут быть описаны как "пролекарства". Кроме того, некоторые соединения настоящего изобретения могут действовать в качестве пролекарства других соединений настоящего изобретения. Все защищенные производные и пролекарства соединений настоящего изобретения включены в объем изобретения. Примеры подходящих пролекарств для соединений настоящего изобретения описаны в публикациях Drugs of Today, Vol. 19, Number 9, 1983, p. 499-538 и в(описания которых включены в настоящее описание посредством ссылки). Специалистам в данной области будет очевидно, что некоторые фрагменты, известные специалистам в данной области как"профрагменты", например, как описано Н. Bundgaard в "Design of Prodrugs" (описание которого включено в настоящее описание посредством ссылки), могут быть расположены на соответствующих функциональных группах, когда такие функциональные группы присутствуют в соединениях настоящего изобретения. Предпочтительные пролекарства соединений настоящего изобретения включают сложные эфиры, сложные карбонатные эфиры, сложные полуэфиры, сложные фосфатные эфиры, сложные нитроэфиры, сложные сульфатные эфиры, сульфоксиды, амиды, карбаматы, азосоединения, фосфамиды, гликозиды, простые эфиры, ацетали и кетали. Фармацевтические композиции могут быть представлены в единичных дозированных формах, содержащих предопределенное количество активного ингредиента на единичную дозу. Такая единичная доза может содержать, например, от 0,5 мг до 1 г, предпочтительно от 1 до 700 мг, более предпочтительно от 5 до 100 мг соединения формулы (I), в зависимости от состояния, которое подвергается лечению,способа введения и возраста, массы и состояния пациента. Предпочтительными единичными дозированными композициями являются такие, которые содержат суточную дозу или субдозу, как описано выше,или ее соответствующую фракцию активного ингредиента. Кроме того, такие фармацевтические композиции могут быть получены любым из способов, хорошо известных в фармацевтической области. Фармацевтические композиции могут быть приспособлены для введения любым соответствующим способом, например пероральным (включая буккальный или подъязычный способ), ректальным, назальным, местным (включая буккальный, подъязычный или чрескожный способ), вагинальным или парентеральным (включая подкожный, внутримышечный, внутривенный или внутрикожный способ) способом. Такие композиции могут быть получены любым из способов, известных в фармацевтической области,например путем смешивания соединения формулы (I) с носителем(ями) или эксципиентом(ами). Фармацевтические композиции, приспособленные для перорального введения, могут быть получены в виде дискретных единиц, таких как капсулы или таблетки; порошки или гранулы; растворы или суспензии в водных или неводных жидкостях; съедобные пленки или взбитая масса либо жидкие эмульсии масло-в-воде или жидкие эмульсии вода-в-масле. Капсулы изготавливают путем получения порошкообразной смеси, как описано выше, и наполнения формованных желатиновых капсул. Способствующие скольжению вещества и лубриканты, такие как коллоидная двуокись кремния, тальк, стеарат магния, стеарат кальция или твердый полиэтиленгликоль,могут быть добавлены к порошкообразной смеси до стадии наполнения. Дезинтегрирующее или солюбилизирующее средство, такое как агар-агар, карбонат кальция или карбонат натрия, также могут быть добавлены для улучшения доступности лекарственного средства при приеме капсулы внутрь. Кроме того, если желательно или необходимо, подходящие связующие средства, лубриканты, дезинтегрирующие средства и красители могут быть включены в смесь. Подходящие связующие средства включают крахмал, желатин, природные сахара, такие как глюкоза или бета-лактоза, сахаристые вещества из кукурузы, природные и синтетические смолы, такие как аравийская камедь, трагакант или альгинат натрия, карбоксиметилцеллюлоза, полиэтиленгликоль, воски и т.п. Лубриканты, используемые в указанных дозированных формах, включают олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и т.п. Дезинтегранты включают, но без ограничения, крахмал, метилцеллюло-6 017112 зу, агар, бентонит, ксантановую камедь и т.п. Таблетки изготавливают, например, путем получения порошкообразной смеси, грануляции или комкования зерен сыпучего материала, добавления лубриканта или дезинтегрирующего средства и прессования в таблетки. Порошкообразную смесь получают смешиванием соединения, измельченного подходящим образом, с разбавителем или основанием, как описано выше, и необязательно со связывающим средством, таким как карбоксиметилцеллюлоза, альгинат, желатин или поливинилпирролидон, с замедляющим растворение средством, таким как парафин, с ускоряющим всасывание средством, таким как четвертичная соль, и/или со способствующим поглощению средством, таким как бентонит, каолин или дикальцийфосфат. Порошкообразная смесь может быть подвергнута гранулированию с помощью формирующих таблетку головок при добавлении стеариновой кислоты, соли стеариновой кислоты, талька или минерального масла. Смесь с лубрикантом затем прессуют в таблетки. Соединения настоящего изобретения также могут быть комбинированы с сыпучим инертным носителем и прессованы в таблетки непосредственно, без осуществления стадий гранулирования или комкования. Может быть использовано прозрачное или непрозрачное защитное покрытие, состоящее из уплотняющего слоя шеллака, покрытие из сахара или полимерного материала и глянцевое покрытие из воска. Красящие средства могут быть добавлены к указанным покрытиям, чтобы отличать различные единичные дозированные формы. Пероральные жидкости, такие как раствор, сиропы и эликсиры, могут быть изготовлены в единичной дозированной форме таким образом, чтобы заданное количество включало предопределенное количество соединения формулы (I). Сиропы могут быть получены путем растворения соединения в подходящем ароматизированном водном растворе, в то время как эликсиры получают, используя нетоксичный спиртовой носитель. Солюбилизаторы и эмульгаторы, такие как этоксилированные изостеариловые спирты и полиэтиленгликолевые простые эфиры сорбита, консерванты, вкусовые добавки, такие как масло мяты перечной, или природные подсластители или другие искусственные подсластители и т.п.,также могут быть добавлены. По необходимости, дозированные единичные фармацевтические композиции для перорального введения могут быть микроинкапсулированными. Композиция также может быть получена для пролонгированного или замедленного высвобождения, например, с помощью покрытия или внесения особого материала в полимеры, воск или т.п. Фармацевтические композиции, приспособленные для ректального введения, могут быть получены в виде суппозиториев или клизм. Фармацевтические композиции, приспособленные для вагинального введения, могут быть представлены в виде пессариев, тампонов, кремов, гелей, паст, пен или распыляемых препаратов. Фармацевтические композиции, приспособленные для парентерального введения, включают водные и неводные стерильные инъецируемые растворы, которые могут содержать антиоксиданты, буферы,антимикробные добавки и растворимые вещества, делающие композицию изотоничной с кровью данного реципиента; и водные и неводные стерильные суспензии, которые могут включать суспендирующие средства и загустители. Фармацевтические композиции могут быть представлены в контейнерах с одной дозой или множеством доз, например в герметично закрытых ампулах и пузырьках, и могут храниться в высушенном замораживанием (лиофилизированный препарат) состоянии, для которого только требуется добавление стерильного жидкого носителя, например воды для инъекций, непосредственно перед применением. Растворы и суспензии для немедленного введения могут быть получены из стерильных порошков, гранул и таблеток. Следует понимать, что, кроме ингредиентов, в частности, приведенных выше, фармацевтические композиции могут содержать другие обычные в данной области средства с учетом типа рассматриваемой композиции, например композиции для перорального введения могут включать ароматизаторы. Терапевтически эффективное количество соединения настоящего изобретения будет зависеть от ряда факторов, включающих, например, возраст и массу тела данного реципиента, определенное состояние, требующее лечения, и его тяжесть, природу композиции и способ введения, и, наконец, будет выбрано медицинским работником, предписывающим лекарственный препарат. Однако эффективное количество соединения формулы (I) для лечения анемии в основном будет составлять от 0,1 до 100 мг/кг массы тела реципиента в день и обычно от 1 до 10 мг/кг массы тела в день. Таким образом, для взрослого млекопитающего массой 70 кг фактическое количество соединения в день должно составлять от 70 до 700 мг, и указанное количество может быть введено одной дозой в день или, как правило, в ряде (такие как две, три, четыре, пять или шесть доз) поддоз в день, так что общая суточная доза будет составлять одинаковое количество. Эффективное количество соли или сольвата и т.д. может быть определено как пропорция эффективного количества соединения формулы (I) как такового. Предусматривается, что подобные дозировки будут подходящими для лечения других состояний, приведенных выше.-7 017112 Сокращения и условные обозначения кт - комнатная температура;PTFE - политетрафторэтилен; ОФ-ВЭЖХ - высокоэффективная жидкостная хроматография с обращенной фазой; ТФУК - трифторуксусная кислота; ТГФ - тетрагидрофуран. Предшествующий уровень в данной области химии Соединения настоящего изобретения могут быть получены рядом способов, включающих стандартные химические способы. У любой предварительно определенной переменной величины будет оставаться предварительно определенное значение, если не указано иное. Иллюстративные общие способы синтеза представлены ниже, и отдельные полученные соединения настоящего изобретения представлены в примерах. Соединения общей формулы (I) могут быть получены способами, известными в области органического синтеза, как показано в данной части с помощью следующих схем синтеза. На всех описанных ниже схемах показано, что защитные группы для чувствительных или активных групп используют, если необходимо, в соответствии с общими принципами химии. Манипуляции, связанные с защитными группами, производят согласно обычным способам органического синтеза (T.W. Green и P.G.M. Wuts (1991),Protecting Groups in Organic Synthesis. John WileySons). Указанные группы удаляют на подходящей стадии синтеза соединения способами, которые очевидны специалистам в данной области. Выбор способов, а также условий реакций и порядка их выполнения будут согласованы с получением соединения формулы (I). Специалистам в данной области известно, существует ли стереоцентр в соединениях формулы (I). Соответственно, настоящее изобретение включает как возможные стереоизомеры, так и не только рацемические соединения, но также и индивидуальные энантиомеры. Если соединение желательно иметь в виде единственного энантиомера, то его можно получить стереоспецифическим синтезом или путем разделения конечного продукта или любого подходящего промежуточного соединения. Разделение конечного продукта, промежуточного соединения или исходного соединения может быть осуществлено любым подходящим способом, известным в данной области. См., например, Stereochemistry ofOrganic Compoundsby E.L. Eliel, S.H. Wilen и L.N. Mander (Wiley-Interscience, 1994). Иллюстрированные способы получения Схема 1b) ClOCCH2CO2Et, NaH или DBU, ТГФ, кт или 60 С; с) DBU, ТГФ или диоксан, кипячение с обратным холодильником или микроволновое облучение,130 С;a) EtO2CCH2CONHNH2, AcOH, CH2Cl2 или EtO2CCH2CONHNH2, TsOH, PhMe, кипячение с обратным холодильником, или EtO2CCH2CONHNH2, AcOH, EtOH (с MgSO4 или без), кипячение с обратным холодильником или микроволновое облучение, 150 С;b) KHMDS, KOBut или DBU, PhMe, ButOH или диоксан, кипячение с обратным холодильником или микроволновое облучение, 150 С или KOBut, ButOH, микроволновое облучение, 150 С; с) NaH, R1Br, ДМФ, от 0 С до кт;d) NaO2CCH2NH2, MeOCH2CH2OH или EtOH, кипячение с обратным холодильником или микроволновое облучение, 150 С. Схема 3b) NaH, R1Br, ДМФ, от 0 С до кт; с) NaO2CCH2NH2, МеОСН 2 СН 2 ОН, кипячение с обратным холодильником или микроволновое облучение, 150 С.-9 017112 Экспериментальная часть Пример 1. N-[5-Гидрокси-6-метил-3-оксо-2-(фенилметил)-2,3-дигидро-4-пиридазинил]карбонилглицин. 1 а) Этил 3-[2-[2-(этилокси)-1-метил-2-оксоэтилиден-1-(фенилметил)гидразино-3-оксопропаноат. Этилпируват (0,324 г, 2,79 ммоль) добавляли к перемешиваемой смеси дигидрохлорида бензилгидразина (0,551 г, 2,82 ммоль), диизопропилэтиламина (1,00 мл, 5,74 ммоль) и дихлорметана (10 мл). Добавляли сульфат магния (избыток) и смесь перемешивали 0,5 ч, затем загружали на короткую колонку с силикагелем и продукт элюировали (смесь 50% этилацетат/гексан). После выпаривания растворителя неочищенный гидразон (0,339 г) растворяли в тетрагидрофуране (20 мл) и добавляли гидрид натрия(0,075 г 60%-ной масляной суспензии, 1,88 ммоль) при перемешивании. Смесь перемешивали в течение 20 мин, затем к смеси добавляли по каплям этил 3-хлор-3-оксопропионат (0,235 мл, 1,84 ммоль) и перемешивание продолжали при комнатной температуре в течение 10 мин и при 60 С в течение 0,5 ч. К смеси дополнительно добавляли гидрид натрия (0,075 г 60%-ной масляной суспензии, 1,88 ммоль) и перемешивание продолжали при 65 С в течение 0,5 ч. Смесь охлаждали, выливали в 0,1 М водный раствор хлористо-водородной кислоты (100 мл) и экстрагировали этилацетатом. Экстракты сушили (MgSO4) и упаривали при пониженном давлении. Этилпируват (0,324 г, 2,79 ммоль) добавляли к перемешиваемой смеси остатка в дихлорметане (10 мл) и сульфата магния. Через 2 ч смесь подвергали хроматографии(силикагель, 20-50% смесь этилацетат/гексан) с получением соединения (0,205 г, 22%) в виде смолы. ЖХМС (ES+) m/z 335 (МН+). 1b) Этил 5-гидрокси-6-метил-3-оксо-2-(фенилметил)-2,3-дигидро-4-пиридазинкарбоксилат. 1,8-Диазабицикло[5.4.0]ундец-7-ен (0,180 мл, 1,20 ммоль) добавляли к перемешиваемому раствору соединения примера 1a) (0,203 г, 0,607 ммоль) в тетрагидрофуране (5 мл) двумя порциями при нагревании с обратным холодильником в атмосфере азота в течение 2 ч. Смесь охлаждали, выливали в 0,1 М водный раствор хлористо-водородной кислоты (50 мл) и экстрагировали этилацетатом. Экстракты сушили (MgSO4), упаривали при пониженном давлении и остаток подвергали хроматографии (силикагель,1-5% смесь метанол/дихлорметан) с получением указанного в заголовке соединения (0,128 г, 73%) в. виде твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 1,26 (т, J=7,20 Гц, 3H), 2,21 (с, 3H), 4,26 (кв, J=7,16 Гц, 2 Н) 5,14(с, 2 Н), 7,24-7,36 (м, 5 Н) 12,13 (с, 1 Н). 1c) N-[5-Гидрокси-6-метил-3-оксо-2-(фенилметил)-2,3-дигидро-4-пиридазинил]карбонилглицин. Перемешиваемую смесь соединения примера 1b) (0,126 г, 0,437 ммоль), безводной натриевой соли глицина (0,090 г, 0,927 ммоль) и 2-метоксиэтанола (4 мл) нагревали с обратным холодильником в атмосфере азота в течение 2 ч, охлаждали и разбавляли водой (30 мл). Медленно добавляли 1 М водный раствор хлористо-водородной кислоты (1 мл) и смесь перемешивали в течение 2 ч, затем твердое вещество отфильтровывали, промывали водой и сушили с получением указанного в заголовке соединения (0,104 г,75%) в виде желтовато-коричневого порошка. 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 2,25 (с, 3H), 4,10 (д, J=5,56 Гц, 2 Н), 5,25 (с, 2 Н), 7,27-7,37 (м,5 Н), 10,17 (т, J=5,05 Гц, 1 Н), 12,97 (с, 1 Н), 15,65 (с, 1 Н). Пример 2. N-[5-Гидрокси-3-оксо-6-фенил-2-(фенилметил)-2,3-дигидро-4-пиридазинил]карбонилглицин. 2 а) Этил 3-[2-[2-(этилокси)-2-оксо-1-фенилэтилиден]-1-(фенилметил)гидразино]-3-оксопропаноат. Смесь этилоксо(фенил)ацетата (0,315 г, 1,77 ммоль), дигидрохлорида бензилгидразина (0,334 г,1,71 ммоль), диизопропилэтиламина (0,596 мл, 3,42 ммоль), дихлорметана (10 мл) и избыток сульфата магния перемешивали в течение 18 ч, затем смесь фильтровали через слой силикагеля и осадок на фильтре промывали 50%-ной смесью этилацетат/гексан. Растворитель удаляли при пониженном давлении, неочищенный гидразон растворяли в тетрагидрофуране (5 мл) и выдерживали при стоянии в атмосфере азота. Добавляли 1,8-диазабицикло[5.4.0]ундец-7-ен (0,212 мл, 1,42 ммоль) с последующим добавлением по каплям этил 3-хлор-3-оксопропионата (0,182 мл, 1,42 ммоль). Смесь перемешивали при комнатной температуре в течение 2 ч, затем выливали в воду (50 мл) и экстрагировали этилацетатом. Экс- 10017112 тракты сушили (MgSO4), упаривали при пониженном давлении и остаток подвергали хроматографии(силикагель, 10-50% смесь этилацетат/гексан) с получением указанного в заголовке соединения (0,117 г) в виде смолы, достаточно чистой для использования в следующей реакции. ЖХМС (ES+) m/z 397 (МН+). 2b) Этил 5-гидрокси-3-оксо-6-фенил-2-(фенилметил)-2,3-дигидро-4-пиридазинкарбоксилат. 1,8-Диазабицикло[5.4.0]ундец-7-ен (0,100 мл, 0,670 ммоль) добавляли к перемешиваемому раствору соединения примера 2a) (0,115 г, 0,290 ммоль) в тетрагидрофуране (5 мл) в атмосфере азота и смесь перемешивали при кипячении с обратным холодильником в течение 2 ч, затем охлаждали, выливали в 0,1 М водный раствор хлористо-водородной кислоты (50 мл) и экстрагировали этилацетатом. Экстракты сушили (MgSO4), упаривали при пониженном давлении и остаток подвергали хроматографии (силикагель, 1-5% смесь метанол/дихлорметан). Полученное вещество снова подвергали хроматографии (силикагель, 20-30% смесь этилацетат/гексан, затем 1-4% смесь метанол/дихлорметан) с получением указанного в заголовке соединения (0,037 г, 6% за 3 стадии) в виде твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 1,28 (т, J=7,08 Гц, 3H), 4,29 (кв, J=7,16 Гц, 2 Н) 5,25 (с, 2 Н), 7,277,38 (м, 5 Н), 7,44-7,49 (м, 3H), 7,66-7,71 (м, 2 Н). 2 с) N-[5-Гидрокси-3-оксо-6-фенил-2-(фенилметил)-2,3-дигидро-4-пиридазинил]карбонилглицин. Перемешиваемую смесь соединения примера 2b) (0,036 г, 0,103 ммоль), безводной натриевой соли глицина (0,050 г, 0,515 ммоль) и 2-метоксиэтанола (2 мл) нагревали с обратным холодильником в атмосфере азота в течение 2 ч, охлаждали и разбавляли водой (20 мл). Медленно добавляли водный 1 М раствор хлористо-водородной кислоты (0,5 мл) и смесь выдерживали при стоянии в течение 18 ч, затем твердое вещество отфильтровывали, промывали водой и сушили с получением указанного в заголовке соединения (0,030 г, 77%) в виде твердого вещества бледно-розового цвета. 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 4,13 (д, J=5,56 Гц, 2 Н), 5,37 (с, 2 Н), 7,29-7,39 (м, 5 Н), 7,46-7,54 3a) Этил 3-оксо-3-[1-(фенилметил)гидразино]пропаноат. Смесь дигидрохлорида бензилгидразина (2,50 г, 12,8 ммоль), карбоната калия (1,77 г, 12,8 ммоль),ацетона (6,0 мл, 82 ммоль) и этилацетата (30 мл) перемешивали при комнатной температуре при добавлении 1 М водного раствора гидроксида натрия (6,0 мл, 6,0 ммоль). После добавления смесь перемешивали 0,5 ч, затем добавляли избыток сульфата магния и смесь фильтровали. Фильтрат упаривали при пониженном давлении и остаток обрабатывали три раза с образованием азеотропной смеси с толуолом,затем растворяли в тетрагидрофуране (50 мл). 1,8-Диазабицикло[5.4.0]ундец-7-ен (1,84 мл, 12,3 ммоль) добавляли к перемешиваемому раствору в атмосфере азота при 0 С с последующим добавлением по каплям этил 3-хлор-3-оксопропионата (1,57 мл, 12,3 ммоль). Смесь перемешивали при 0 С в течение 5 мин и при комнатной температуре в течение 3 ч, затем добавляли 1 М водный раствор хлористо-водородной кислоты (50 мл). После перемешивания еще в течение 0,5 ч добавляли воду (100 мл) и смесь экстрагировали этилацетатом. Экстракты промывали насыщенным раствором соли, сушили (MgSO4), упаривали при пониженном давлении и остаток подвергали хроматографии (силикагель, 1-5% смесь метанол/дихлорметан) с получением указанного в заголовке соединения (1,60 г) в виде масла. 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 1,18 (т, J=7,08 Гц, 3H), 3,56 (с, 2 Н) 4,08 (кв, J=7,16 Гц, 2 Н), 4,58(с, 2 Н), 4,65 (с, 2 Н) 7,25-7,36 (м, 5 Н). 3b) Этил 5-гидрокси-6-(1-метилэтил)-3-оксо-2-(фенилметил)-2,3-дигидро-4-пиридазинкарбоксилат. Раствор соединения примера 3a) (0,120 г, 0,508 ммоль), этил 3-метил-2-оксобутаноата (0,066 г,0,458 ммоль) и уксусной кислоты (0,030 г, 0,500 ммоль) в дихлорметане (2 мл) перемешивали при 50 С в течение 18 ч, затем охлаждали, разбавляли этилацетатом (2 мл) и фильтровали. Растворитель удаляли из фильтрата при пониженном давлении и остаток обрабатывали три раза с образованием азеотропа с толуолом, затем поглощали тетрагидрофураном (10 мл). Добавляли диазабицикло[5.4.0]ундец-7-ен(0,200 мл, 1,34 ммоль), раствор кипятили с обратным холодильником в атмосфере азота в течение 1,5 ч,затем охлаждали и выливали в 1 М водный раствор хлористо-водородной кислоты (10 мл). Смесь экстрагировали эфиром и органические экстракты промывали 1 М водным раствором гидроксида натрия. Водные экстракты промывали эфиром, затем подкисляли 1 М водным раствором хлористо-водородной кислоты и экстрагировали эфиром. Экстракты сушили (MgSO4), упаривали при пониженном давлении и остаток подвергали хроматографии (силикагель, 1-5% смесь метанол/дихлорметан) с получением указанного в заголовке соединения (0,029 г, 20%) в виде твердого вещества. ЖХМС (ES+) m/z 317 (МН+).- 11017112 3c) N-[5-Гидрокси-6-(1-метилэтил)-3-оксо-2-(фенилметил)-2,3-дигидро-4-пиридазинил]карбонилглицин. Перемешиваемую смесь соединения примера 3b) (0,029 г, 0,092 ммоль), безводной натриевой соли глицина (0,050 г, 0,515 ммоль) и 2-метоксиэтанола (2 мл) нагревали с обратным холодильником в атмосфере азота в течение 2 ч, охлаждали и разбавляли водой (20 мл). Медленно добавляли водный 1 М раствор хлористо-водородной кислоты (0,5 мл), смесь перемешивали в течение 0,5 ч, затем твердое вещество отфильтровывали, промывали водой и сушили с получением указанного в заголовке соединения 4 а) Этил 3-2-[2-(этилокси)-2-оксо-1-фенилэтилиден]гидразино-3-оксопропаноат. Смесь этил 3-гидразино-3-оксопропионата (1,46 г, 10,0 ммоль), этилбензоилформиата (2,14 г,12,0 ммоль), уксусной кислоты (0,5 мл, 8,3 ммоль) и дихлорметана (10 мл) перемешивали при комнатной температуре с избытком безводного сульфата магния в течение 20 ч, затем фильтровали и остаток на фильтре промывали этилацетатом. Фильтрат упаривали при пониженном давлении, обрабатывали 3 раза с образованием азеотропа с толуолом и подвергали хроматографии (силикагель, 10-3% смесь этилацетат/гексан) с получением указанного в заголовке соединения (0,773 г, 25%). 1(кв, J=7,07 Гц, 2 Н), 4,40 (кв, J=7,18 Гц, 2 Н), 7,42-7,49 (м, 3H), 7,55-7,59 (м, 2 Н), 11,57 (с, 1 Н). 4b) Этил 5-гидрокси-3-оксо-6-фенил-2,3-дигидро-4-пиридазинкарбоксилат. Раствор пиперидинийацетата 1 М в 5% смеси этанол/толуол (1,10 мл, 1,10 ммоль) добавляли к раствору соединения примера 4a) (0,350 г, 1,14 ммоль) в толуоле (10 мл) и смесь перемешивали при кипячении с обратным холодильником в течение 1 ч. Добавляли диазабицикло[5.4.0]ундец-7-ен (0,30 мл,2,00 ммоль) и кипячение с обратным холодильником продолжали в течение 2 ч. После охлаждения смесь распределяли между 1 М водным раствором хлористо-водородной кислоты и этилацетатом. Экстракты сушили (MgSO4), упаривали при пониженном давлении и остаток подвергали хроматографии (силикагель, 2-8% смесь метанол/дихлорметан). Частично очищенный продукт растирали в эфире с получением указанного в заголовке соединения (0,115 г, 39%) в виде твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 1,30 (т, J=7,20 Гц, 3H), 4,32 (кв, J=1,16 Гц, 2 Н), 7,43-7,49 (м,3H), 7,64-7,67 (м, 2 Н), 13,05 (с, 1 Н). 4 с) N-[(5-Гидрокси-3-оксо-6-фенил-2,3-дигидро-4-пиридазинил)карбонил]глицин. Перемешиваемую смесь соединения примера 4b) (0,060 г, 0,251 ммоль), безводной натриевой соли глицина (0,045 г, 0,462 ммоль) и 2-метоксиэтанола (3 мл) нагревали с обратным холодильником в атмосфере азота в течение 2 ч, охлаждали и разбавляли водой (20 мл). После фильтрования 1 М водный раствор хлористо-водородной кислоты (0,5 мл) медленно добавляли к фильтрату, затем твердое вещество отфильтровывали, промывали водой и сушили с получением указанного в заголовке соединения (0,025 г,78%) в виде белого порошка. 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 4,02 (д, J=5,56 Гц, 2 Н), 7,40-7,47 (м, 3H), 7,74-7,80 (м, 2 Н), 10,45 5 а) Этил 2-[4-(1,1-диметилэтил)фенил]метил-5-гидрокси-3-оксо-6-фенил-2,3-дигидро-4 пиридазинкарбоксилат. Гидрид натрия (0,020 г 60%-ной масляной суспензии, 0,500 ммоль) добавляли к перемешиваемому раствору соединения примера 4b) (0,052 г, 0,200 ммоль) в диметилформамиде (1 мл) в атмосфере азота. После 15 мин перемешивания при комнатной температуре вносили 4-трет-бутилбензилбромид(0,037 мл, 0,200 ммоль) и смесь перемешивали в течение 2 ч, затем распределяли между 1 М водным раствором хлористо-водородной кислоты и этилацетатом. Экстракты промывали водой и насыщенным раствором соли, затем сушили (MgSO4), упаривали при пониженном давлении и остаток подвергали хроматографии (силикагель, 0-5% смесь метанол/дихлорметан) с получением указанного в заголовке соедине- 12017112 ния (0,053 г, 65%) в виде смолы. 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 1,25 (с, 9 Н), 1,28 (т, J=7,20 Гц, 3H), 4,29 (кв, J=7,07 Гц, 2 Н), 5,20N-[(2-[4-(1,1-Диметилэтил)фенил]метил-5-гидрокси-3-оксо-6-фенил-2,3-дигидро-4 пиридазинил)карбонил]глицин Перемешиваемую смесь соединения примера 5a) (0,052 г, 0,128 ммоль), безводной натриевой соли глицина (0,050 г, 0,515 ммоль) и 2-метоксиэтанола (3 мл) нагревали с обратным холодильником в атмосфере азота в течение 2 ч, охлаждали и разбавляли водой (20 мл). После фильтрования к фильтрату медленно добавляли 1 М водный раствор хлористо-водородной кислоты до тех пор, пока pH раствора не снижался до 2, затем полученное твердое вещество отфильтровывали, промывали водой и сушили с получением указанного в заголовке соединения (0,047 г, 84%) в виде бледно-розового порошка. 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 1,25 (с, 9 Н), 4,13 (д, J=5,56 Гц, 2 Н), 5,32 (с, 2 Н), 7,28-7,34 (м,2 Н), 7,34-7,40 (м, 2 Н), 7,48-7,51 (м, 3H), 7,76-7,82 (м, 2 Н), 10,27 (т, J=5,18 Гц, 1 Н), 12,99 (с, 1 Н), 16,32 (с,1 Н). Пример 6. N-[5-Гидрокси-3-оксо-6-фенил-2-(2-фенилэтил)-2,3-дигидропиридазин-4-ил]карбонилглицин. 6a) Этил 5-гидрокси-3-оксо-6-фенил-2-(2-фенилэтил)-2,3-дигидро-4-пиридазинкарбоксилат. Гидрид натрия (0,040 г 60%-ной масляной суспензии, 1,00 ммоль) добавляли к перемешиваемому раствору этил 5-гидрокси-3-оксо-6-фенил-2,3-дигидро-4-пиридазинкарбоксилата (пример 4b), 0,100 г,0,384 ммоль) в диметилформамиде (1,5 мл) в атмосфере азота. После перемешивания в течение 15 мин при комнатной температуре смесь охлаждали на бане со льдом и вносили (2-йодэтил)бензол (0,056 мл,0,384 ммоль). Смесь перемешивали в течение 18 ч при нагревании до комнатной температуры, затем выливали в 0,1 М водный раствор хлористо-водородной кислоты (50 мл) и экстрагировали этилацетатом. Экстракты промывали водой и насыщенным раствором соли, затем сушили (MgSO4), упаривали при пониженном давлении и остаток подвергали хроматографии (силикагель, 1-5% смесь метанол/дихлорметан) с получением указанного в заголовке соединения (0,077 г, 55%) в виде бесцветной смолы. 1(ушир.с, 1 Н). 6b) N-[5-Гидрокси-3-оксо-6-фенил-2-(2-фенилэтил)-2,3-дигидропиридазин-4-ил]карбонилглицин. Перемешиваемую смесь этил 5-гидрокси-3-оксо-6-фенил-2-(2-фенилэтил)-2,3-дигидро-4 пиридазинкарбоксилата (0,075 г, 0,206 ммоль), безводной натриевой соли глицина (0,050 г, 0,515 ммоль) и 2-метоксиэтанола (3 мл) нагревали с обратным холодильником в атмосфере азота в течение 2 ч, затем охлаждали и разбавляли водой (30 мл). После фильтрования к фильтрату медленно добавляли 1 М водный раствор хлористо-водородной кислоты до тех пор, пока pH раствора не снижался до 2, затем полученное твердое вещество отфильтровывали, промывали водой и сушили с получением указанного в заголовке соединения (0,073 г, 90%) в виде не совсем белого порошка. 1N-Бромсукцинимид (1,60 г, 8,99 ммоль) добавляли порциями к охлажденному льдом перемешиваемому раствору 2-циклопропилэтанола (0,760 г, 8,82 ммоль) и трифенилфосфина (2,36 г, 9,00 ммоль) в дихлорметане (10 мл) в атмосфере азота. Смесь перемешивали в течение 2 ч при нагревании до комнатной температуры, затем разбавляли гексаном (90 мл) и фильтровали через короткую колонку с силикагелем. Колонку промывали 10% смесью этилацетат/гексан и объединенные фильтраты упаривали при пониженном давлении при комнатной температуре с получением указанного в заголовке соединения(кв, J=6,91 Гц, 2 Н), 3,47 (т, J=7,07 Гц, 2 Н). 7b) Этил 2-(2-циклопропилэтил)-5-гидрокси-3-оксо-6-фенил-2,3-дигидро-4-пиридазинкарбоксилат. Гидрид натрия (0,040 г 60%-ной масляной суспензии, 1,00 ммоль) добавляли к перемешиваемому раствору этил 5-гидрокси-3-оксо-6-фенил-2,3-дигидро-4-пиридазинкарбоксилата (пример 4b), 0,100 г,0,384 ммоль) в диметилфомамиде (1,5 мл) в атмосфере азота. После перемешивания в течение 15 мин при комнатной температуре смесь охлаждали на бане со льдом и добавляли (2-бромэтил)циклопропан(0,057 г, 0,384 ммоль). Смесь перемешивали в течение 18 ч при нагревании до комнатной температуры,затем выливали в 0,1 М водный раствор хлористо-водородной кислоты (50 мл) и экстрагировали этилацетатом. Экстракты промывали водой и насыщенным раствором соли, затем сушили (MgSO4), упаривали при пониженном давлении и остаток подвергали хроматографии (силикагель, 1-5% смесь метанол/дихлорметан) с получением указанного в заголовке соединения (0,067 г, 53%) в виде бесцветной смолы. 1H ЯМР (400 МГц, ДМСО-d6)м.д. -0,05-0,06 (м, 2 Н), 0,34-0,45 (м, 2 Н), 0,64-0,78 (м, 1 Н), 1,29 (т,J=7,07 Гц, 3H), 1,62 (кв, J=7,07 Гц, 2 Н), 4,14 (т, J=7,20 Гц, 2 Н), 4,31 (кв, J=7,07 Гц, 2 Н), 7,41-7,52 (м, 3H),7,63-7,71 (м, 2 Н), 12,42 (ушир.с, 1 Н). 7 с) N-[2-(2-Циклопропилэтил)-5-гидрокси-3-оксо-6-фенил-2,3-дигидро-4-пиридазинил]карбонилглицин. Перемешиваемую смесь этил 2-(2-циклопропилэтил)-5-гидрокси-3-оксо-6-фенил-2,3-дигидро-4 пиридазинкарбоксилата (0,065 г, 0,198 ммоль), безводной натриевой соли глицина (0,050 г, 0,515 ммоль) и 2-метоксиэтанола (3 мл) нагревали с обратным холодильником в атмосфере азота в течение 2 ч, затем охлаждали и разбавляли водой (30 мл). После фильтрования к фильтрату медленно добавляли 1 М водный раствор хлористо-водородной кислоты до тех пор, пока pH раствора не снижался до 2, затем полученное твердое вещество отфильтровывали, промывали водой и сушили с получением указанного в заголовке соединения (0,062 г, 87%) в виде не совсем белого порошка. 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. -0,05-0,09 (м, 2 Н), 0,35-0,47 (м, 2 Н), 0,66-0,79 (м, 1 Н), 1,68 (кв,J=7,07 Гц, 2 Н), 4,15 (д, J=5,56 Гц, 2 Н), 4,26 (т, J=7,07 Гц, 2 Н), 7,41-7,56 (м, 3H), 7,69-7,84 (м, 2 Н), 10,35 8 а) Этил 2-[(2-хлорфенил)метил]-5-гидрокси-3-оксо-6-фенил-2,3-дигидро-4-пиридазинкарбоксилат. Гидрид натрия (0,040 г 60%-ной масляной суспензии, 1,00 ммоль) добавляли к перемешиваемому раствору этил 5-гидрокси-3-оксо-6-фенил-2,3-дигидро-4-пиридазинкарбоксилата (пример 4b), 0,100 г,0,384 ммоль) в диметилформамиде (1,5 мл) в атмосфере азота. После перемешивания в течение 15 мин при комнатной температуре смесь охлаждали на бане со льдом и добавляли 2-хлорбензилбромид(0,051 мл, 0,384 ммоль). Смесь перемешивали в течение 18 ч при нагревании до комнатной температуры,затем выливали в 0,1 М водный раствор хлористо-водородной кислоты (50 мл) и экстрагировали этилацетатом. Экстракты промывали водой и насыщенным раствором соли, затем сушили (MgSO4), упаривали при пониженном давлении и остаток подвергали хроматографии (силикагель, 1-5% смесь метанол/дихлорметан) с получением указанного в заголовке соединения (0,098 г, 66%) в виде бесцветной смолы. 1 Н ЯМР (400 МГц, хлороформ-d)м.д. 1,50 (т, J=7,20 Гц, 3H), 4,55 (кв, J=7,07 Гц, 2 Н), 5,54 (с, 2 Н),7,20-7,28 (м, 3H), 7,35-7,52 (м, 4 Н), 7,75-7,84 (м, 2 Н), 13,83 (с, 1 Н). 8b)N-[2-(2-Хлорбензил)-5-гидрокси-3-оксо-6-фенил-2,3-дигидропиридазин-4 ил]карбонилглицин. Перемешиваемую смесь этил 2-[(2-хлорфенил)метил]-5-гидрокси-3-оксо-6-фенил-2,3-дигидро-4 пиридазинкарбоксилата (0,098 г, 0,255 ммоль), безводной натриевой соли глицина (0,050 г, 0,515 ммоль) и 2-метоксиэтанола (3 мл) нагревали с обратным холодильником в атмосфере азота в течение 2 ч, затем охлаждали и разбавляли водой (30 мл). После фильтрования к фильтрату медленно добавляли 1 М водный раствор хлористо-водородной кислоты до тех пор, пока pH раствора не снижался до 2, затем полученное твердое вещество отфильтровывали, промывали водой и сушили с получением указанного в заголовке соединения (0,099 г, 93%) в виде не совсем белого порошка. 9a) Этил 5-гидрокси-3-оксо-6-(трифторметил)-2,3-дигидро-4-пиридазинкарбоксилат. Смесь этил 3-гидразино-3-оксопропионата (0,438 г, 3,00 ммоль), этил 3,3,3-трифтор-2 оксопропионата (0,510 г, 3,00 ммоль), моногидрата п-толуолсульфокислоты (0,057 г, 0,300 ммоль) и толуола (10 мл) кипятили с обратным холодильником с использованием ловушки Дина-Старка для удаления воды в течение 3 ч, затем охлаждали. Добавляли сульфат магния и смесь фильтровали через короткую колонку с силикагелем. Колонку промывали 5% смесью этилацетат/гексан и объединенные экстракты упаривали при пониженном давлении. Остаток подвергали хроматографии (силикагель, 10-40% смесь этилацетат/гексан) с получением промежуточного соединения, гидразона. Диазабицикло[5.4.0]ундец-7 ен (0,083 мл, 0,558 ммоль) добавляли к раствору гидразона в диоксане (5 мл) и смесь кипятили с обратным холодильником в атмосфере азота в течение 1 ч. После охлаждения добавляли 0,1 М водный раствор хлористо-водородной кислоты (50 мл) и смесь экстрагировали этилацетатом. Экстракты сушили (MgSO4) и упаривали при пониженном давлении с получением указанного в заголовке соединения (0,085 г, 12%) в виде светло-коричневого порошка. 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 1,26 (т, J=7,07 Гц, 3H), 4,25 (кв, J=7,07 Гц, 2 Н), 13,30 (с, 1 Н). 9b) Этил 5-гидрокси-3-оксо-2-(фенилметил)-6-(трифторметил)-2,3-дигидро-4-пиридазинкарбоксилат. Гидрид натрия (0,040 г 60%-ной масляной суспензии, 1,00 ммоль) добавляли к перемешиваемому раствору этил 5-гидрокси-3-оксо-6-(трифторметил)-2,3-дигидро-4-пиридазинкарбоксилата (0,083 г,0,329 ммоль) в диметилформамиде (1,5 мл) в атмосфере азота. После перемешивания в течение 10 мин при комнатной температуре смесь охлаждали на бане со льдом и добавляли бензилбромид (0,043 мл,0,362 ммоль). Смесь перемешивали в течение 3 ч при 0 С. Затем добавляли 0,1 М водный раствор хлористо-водородной кислоты (50 мл) и смесь экстрагировали зтилацетатом. Экстракты промывали водой и насыщенным раствором соли, затем сушили (MgSO4), упаривали при пониженном давлении и остаток подвергали хроматографии (силикагель, 5-10% смесь метанол/дихлорметан) с получением указанного в заголовке соединения (0,050 г, 44%). 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 1,23 (т, J=6,95 Гц, 3H), 4,17 (кв, J=7,07 Гц, 2 Н), 5,14 (с, 2 Н),7,12-7,44 (м, 5 Н). 9 с)N-[5-Гидрокси-3-оксо-2-(фенилметил)-6-(трифторметил)-2,3-дигидро-4-пиридазинил]карбонилглицин. Перемешиваемую смесь этил 5-гидрокси-3-оксо-2-(фенилметил)-6-(трифторметил)-2,3-дигидро-4 пиридазинкарбоксилата (0,048 г, 0,140 ммоль), безводной натриевой соли глицина (0,050 г, 0,515 ммоль) и 2-метоксиэтанола (3 мл) нагревали с обратным холодильником в атмосфере азота в течение 2 ч, затем охлаждали и разбавляли водой (30 мл). После фильтрования к фильтрату медленно добавляли 1 М водный раствор хлористо-водородной кислоты до тех пор, пока pH раствора не снижался до 2. Смесь экстрагировали этилацетатом и экстракты сушили (MgSO4), затем упаривали при пониженном давлении. Остаток очищали ВЭЖХ (ODS, 10-90% смесь ацетонитрил/вода+0,1% трифторуксусная кислота). Продукт переосаждали из 1 М водного раствора гидроксида натрия 1 М водным раствором хлористо-водородной кислоты, твердое вещество отфильтровывали, промывали водой и сушили с получением указанного в заголовке соединения (0,014 г, 27%) в виде белого твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 4,12 (д, J=5,81 Гц, 2 Н), 5,34 (с, 2 Н), 7,27-7,41 (м, 5 Н), 9,96 (т,J=5,43 Гц, 1 Н), 13,02 (ушир.с, 1 Н). Пример 10. N-[6-Циклогексил-5-гидрокси-3-оксо-2-(фенилметил)-2,3-дигидро-4-пиридазинил]карбонилглицин.(0,600 г, 3,26 ммоль), моногидрата п-толуолсульфокислоты (0,060 г, 0,315 ммоль) и толуола (15 мл) кипятили с обратным холодильником с использованием ловушки Дина-Старка для удаления воды в течение 1 ч, затем охлаждали и подвергали хроматографии (силикагель, 10-40% смесь этилацетат/гексан) с получением промежуточного гидразона. Диазабицикло[5.4.0]ундец-7-ен (0,540 мл, 3,61 ммоль) добавляли к раствору гидразона, предварительного высушенного посредством образования азеотропа с толуолом в диоксане (10 мл) и смесь кипятили с обратным холодильником в атмосфере азота в течение 19 ч. После охлаждения, добавляли 0,1 М водный раствор хлористо-водородной кислоты (50 мл) и смесь экстрагировали этилацетатом. Экстракты промывали насыщенным раствором соли, сушили (MgSO4) и упаривали при пониженном давлении. Остаток подвергали хроматографии (силикагель, 1-5% смесь метанол/дихлорметан) с получением указанного в заголовке соединения (0,404 г, 52%) в виде твердого вещества кремового цвета. 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 1,12-1,23 (м, 1 Н), 1,27 (т, J=7,07 Гц, 3H), 1,29-1,38 (м, 4 Н), 1,641,71 (м, 1 Н), 1,72-1,90 (м, 4 Н), 2,74-2,86 (м, 1 Н), 4,28 (кв, J=7,16 Гц, 2 Н), 12,30 (ушир.с, 1 Н), 12,62 (с, 1 Н). 10b) Этил 6-циклогексил-5-гидрокси-3-оксо-2-(фенилметил)-2,3-дигидро-4-пиридазинкарбоксилат. Гидрид натрия (0,040 г 60%-ной масляной суспензии, 1,00 ммоль) добавляли к перемешиваемому раствору этил 6-циклогексил-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинкарбоксилата (0,100 г,0,376 ммоль) в диметилформамиде (1,5 мл) в атмосфере азота. После перемешивания в течение 10 мин при комнатной температуре смесь охлаждали на бане со льдом и добавляли бензилбромид (0,045 мл,0,378 ммоль). Смесь перемешивали в течение 0,5 ч при 0 С и 0,5 ч при комнатной температуре. Затем добавляли 0,1 М водный раствор хлористо-водородной кислоты (50 мл) и смесь экстрагировали этилацетатом. Экстракты промывали водой и насыщенным раствором соли, затем сушили (MgSO4), упаривали при пониженном давлении и остаток подвергали хроматографии (силикагель, 0-4% смесь метанол/дихлорметан) с получением указанного в заголовке соединения (0,095 г, 71%) в виде бесцветного масла. ЖХМС (ES+) m/z 357 (МН+). 10 с)N-[6-Циклогексил-5-гидрокси-3-оксо-2-(фенилметил)-2,3-дигидро-4-пиридазинил]карбонилглицин. Перемешиваемую смесь этил 6-циклогексил-5-гидрокси-3-оксо-2-(фенилметил)-2,3-дигидро-4 пиридазинкарбоксилата (0,095 г, 0,267 ммоль), безводной натриевой соли глицина (0,053 г, 0,544 ммоль) и 2-метоксиэтанола (3 мл) нагревали с обратным холодильником в атмосфере азота в течение 2 ч, затем охлаждали и разбавляли водой (30 мл). Затем медленно добавляли 1 М водный раствор хлористоводородной кислоты до тех пор, пока pH раствора не снижался до 2. Через 60 ч твердое вещество отфильтровывали, промывали водой и сушили с получением указанного в заголовке соединения (0,095 г,92%) в виде белого твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 1,12-1,28 (м, 1 Н), 1,28-1,49 (м, 4 Н), 1,63-1,72 (м, 1 Н), 1,74-1,81 11 а) Этил 6-циклогексил-2-[4-(1,1-диметилэтил)фенил]метил-5-гидрокси-3-оксо-2,3-дигидро-4 пиридазинкарбоксилат. Гидрид натрия (0,040 г 60%-ной масляной суспензии, 1,00 ммоль) добавляли к перемешиваемому раствору этил 6-циклогексил-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинкарбоксилата (пример 10a),0,100 г, 0,376 ммоль) в диметилформамиде (2,0 мл) в атмосфере азота. После перемешивания в течение 15 мин при комнатной температуре смесь охлаждали на бане со льдом и добавляли 4-третбутилбензилбромид (0,071 мл, 0,384 ммоль). Смесь перемешивали в течение 0,5 ч при 0 С и 3 ч при комнатной температуре. Затем добавляли 0,1 М водный раствор хлористо-водородной кислоты (50 мл) и смесь экстрагировали этилацетатом. Экстракты промывали разбавленным водным раствором хлорида натрия, затем сушили (MgSO4), упаривали при пониженном давлении и остаток подвергали хроматографии (силикагель, 0-6% смесь метанол/дихлорметан) с получением указанного в заголовке соединенияN-[(6-Циклогексил-2-[4-(1,1-диметилэтил)фенил]метил-5-гидрокси-3-оксо-2,3-дигидро-4 пиридазинил)карбонил]глицин. Перемешиваемую смесь этил 6-циклогексил-2-[4-(1,1-диметилэтил)фенил]метил-5-гидрокси-3 оксо-2,3-дигидро-4-пиридазинкарбоксилата (0,087 г, 0,211 ммоль), безводной натриевой соли глицина(0,050 г, 0,515 ммоль) и 2-метоксиэтанола (3 мл) нагревали с обратным холодильником в атмосфере азота в течение 2 ч, затем охлаждали и разбавляли водой (30 мл). Смесь фильтровали и медленно добавляли 1 М водный раствор хлористо-водородной кислоты до тех пор, пока pH раствора не снижался до 2. Через 18 ч твердое вещество отфильтровывали, промывали водой, сушили и подвергали хроматографии (силикагель, 10% метанол/дихлорметан). Продукт осаждали из метанола водой и твердое вещество собирали,промывали водой, затем сушили с получением указанного в заголовке соединения (0,057 г, 61%) в виде твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 1,18-1,24 (м, 1 Н), 1,25 (с, 9 Н), 1,29-1,50 (м, 4 Н), 1,64-1,73 (м,1 Н), 1,76-1,81 (м, 2 Н), 1,83-1,92 (м, 2 Н), 2,79-2,97 (м, 1 Н), 4,09 (д, J=5,81 Гц, 2 Н), 5,20 (с, 2 Н), 7,23 (д,J=8,34 Гц, 2 Н), 7,36 (д, J=8,34 Гц, 2 Н), 10,19 (т, J=5,56 Гц, 1 Н), 12,94 (ушир.с, 1 Н), 15,83 (с, 1 Н). Пример 12. 12 а) Этил 2-[(2-хлорфенил)метил-6-циклогексил-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинкарбоксилат. Гидрид натрия (0,040 г 60%-ной масляной суспензии, 1,00 ммоль) добавляли к перемешиваемому раствору этил 6-циклогексил-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинкарбоксилата (пример 10a),0,100 г, 0,376 ммоль) в диметилформамиде (2,0 мл) в атмосфере азота. После перемешивания в течение 15 мин при комнатной температуре смесь охлаждали на бане со льдом и добавляли 2-хлорбензилбромид(0,051 мл, 0,384 ммоль). Смесь перемешивали в течение 0,5 ч при 0 С и 3 ч при комнатной температуре. Затем добавляли 0,1 М водный раствор хлористо-водородной кислоты (50 мл) и смесь экстрагировали этилацетатом. Экстракты промывали разбавленным водным раствором хлорида натрия, затем сушили(MgSO4), упаривали при пониженном давлении и остаток подвергали хроматографии (силикагель, 0-6% смесь метанол/дихлорметан) с получением указанного в заголовке соединения (0,093 г, 63%) в виде смолы. ЖХМС (ES+) m/z 391 (МН+). 12b) N-(2-[(2-Хлорфенил)метил]-6-циклогексил-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинилкарбонил)глицин. Перемешиваемую смесь этил 2-[(2-хлорфенил)метил-6-циклогексил-5-гидрокси-3-оксо-2,3 дигидро-4-пиридазинкарбоксилата (0,093 г, 0,238 ммоль), безводной натриевой соли глицина (0,050 г,0,515 ммоль) и 2-метоксиэтанола (3 мл) нагревали с обратным холодильником в атмосфере азота в течение 2 ч, затем охлаждали и разбавляли водой (30 мл). Смесь фильтровали и медленно добавляли 1 М водный раствор хлористо-водородной кислоты до тех пор, пока pH раствора не снижался до 2. Через 18 ч твердое вещество отфильтровывали, промывали водой, сушили и подвергали хроматографии (силикагель, 10% метанол/дихлорметан). Продукт осаждали из метанола водой и твердое вещество собирали,промывали водой, затем сушили с получением указанного в заголовке соединения (0,041 г, 41%) в виде твердого вещества. ЖХМС (ES+) m/z 420 (МН+). Пример 13. 1a) Этил 2,6-дициклогексил-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинкарбоксилат. Смесь гидрохлорида циклогексилгидразина (0,451 г, 3,00 ммоль), этилциклогексил(оксо)ацетата(0,500 г, 2,71 ммоль), безводного ацетата натрия (0,246 г, 0,300 ммоль) и дихлорметана (5 мл) перемешивали при комнатной температуре в течение 18 ч, затем разбавляли водой и экстрагировали дихлорметаном. Экстракты сушили (MgSO4), упаривали при пониженном давлении и остаток подвергали хроматографии (силикагель, 5-30% смесь этилацетат/гексан) с получением промежуточного соединения, гидразона. Диазабицикло[5.4.0]ундец-7-ен (0,260 мл, 1,74 ммоль) добавляли к раствору гидразона в тетрагидрофуране (10 мл) в атмосфере азота. Смесь охлаждали на льду и по каплям добавляли этил 3-хлор-3- 17017112 оксопропионат (0,223 мл, 1,74 ммоль). Смесь перемешивали при комнатной температуре в течение 2 ч,затем добавляли дополнительно диазабицикло[5.4.0]ундец-7-ен (0,520 мл, 3,48 ммоль) и смесь кипятили с обратным холодильником в атмосфере азота в течение 2 ч. После охлаждения добавляли 0,1 М водный раствор хлористо-водородной кислоты (100 мл) и смесь экстрагировали этилацетатом. Экстракты сушили (MgSO4), упаривали при пониженном давлении и остаток подвергали хроматографии (силикагель, 25%, затем 50% смесь этилацетат/гексан) с получением указанного в заголовке соединения (0,184 г, 19%) в виде белого твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 1,13-1,21 (м, 2 Н), 1,26 (т, J=7,07 Гц, 3H), 1,31-1,45 (м, 6 Н), 1,531,91 (м, 12 Н), 2,74-2,90 (м, 1 Н), 4,26 (кв, J=7,07 Гц, 2 Н), 4,58-4,72 (м, 1 Н), 12,02 (ушир.с, 1 Н). 13b) N-[(2,6-Дициклогексил-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинил)карбонил]глицин. Перемешиваемую смесь этил 2,6-дициклогексил-5-гидрокси-3-оксо-2,3-дигидро-4 пиридазинкарбоксилата (0,182 г, 0,522 ммоль), безводной натриевой соли глицина (0,102 г, 1,05 ммоль) и 2-метоксиэтанола (5 мл) нагревали с обратным холодильником в атмосфере азота в течение 2 ч, затем охлаждали и разбавляли водой (50 мл). Затем медленно добавляли 1 М водный раствор хлористоводородной кислоты до тех пор, пока pH раствора не снижался до 2. Твердое вещество отфильтровывали,промывали водой и сушили с получением указанного в заголовке соединения (0,156 г, 79%) в виде порошка кремового цвета. 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 1,12-1,28 (м, 2 Н), 1,29-1,49 (м, 6 Н), 1,55-1,97 (м, 12 Н), 2,80-2,91 14 а) Этил 5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинкарбоксилат. В три отдельные пробирки для микроволнового нагрева добавляли этил-3-метил-2-оксобутират (5 г,34,7 ммоль) и этилмалонилгидразид (6,08 г, 41,6 ммоль) в этаноле (10 мл) и уксусной кислоте (0,5 мл). Реакционные смеси подвергали воздействию микроволнового облучения при 150 С в течение 20 мин. Неочищенную реакционную смесь упаривали с получением масла желтого цвета. Три неочищенных продукта в виде масла ресуспендировали в 1,4-диоксане (12 мл) и добавляли DBU (7,84 мл, 52,0 ммоль). Раствор разделяли на 2 пробирки для микроволнового нагрева и реакционные смеси подвергали воздействию микроволнового облучения при 150 С в течение 20 мин. Фракции объединяли, разбавляли водой(80 мл) и медленно подкисляли (в течение 15 мин) 6 н. HCl до образования осадка. Осадок отделяли фильтрованием и сушили с получением продукта в виде не совсем белого твердого вещества (11,12 г,46,7 ммоль, 44,9% выход). 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 12,64 (с, 1 Н), 12,31 (с, 1 Н), 4,28 (кв, J=7,16 Гц, 2 Н), 3,13 (септ,J=6,82 Гц, 1 Н), 1,27 (т, J=7,07 Гц, 3H), 1,14 (д, J=6,82 Гц, 6 Н). МС (ES+) m/z 227 [М+Н]+. 14b) Этил 2-[4-(1,1-диметилэтил)фенил]метил-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4 пиридазинкарбоксилат. Гидрид натрия (49 мг, 1,22 ммоль) добавляли к раствору соединения примера 14a) (110 мг,0,49 ммоль) в N,N-диметилформамиде (ДМФА) при 0 С. Температуру реакции доводили до комнатной температуры и реакционную смесь перемешивали в течение 40 мин. Затем температуру снижали до 0 С и добавляли 4-трет-бутилбензилбромид (0,09 мл, 0,49 ммоль). Температуру реакции доводили до комнатной температуры и реакционную смесь перемешивали в течение 3 ч. Раствор разбавляли EtOAc и H2O и слои разделяли. К водному слою добавляли 1 н. HCl и его экстрагировали EtOAc несколько раз. Объединенные органические слои промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали. Продукт очищали колоночной хроматографией (SiO2, 25-40% смесь EtOAc/гексаны) с получением указанного в заголовке соединения (111 мг, 61%). 1 Н ЯМР (400 МГц, хлороформ-d)м.д. 13,29 (с, 1 Н), 7,31-7,43 (м, 4 Н), 5,24 (с, 2 Н), 4,49 (кв,J=7,07 Гц, 2 Н), 3,25 (септ, J=6,82 Гц, 1 Н), 1,46 (т, J=7,20 Гц, 3H), 1,31 (с, 9 Н), 1,27 (д, J=6,82 Гц, 6 Н). 14 с) N-[2-[4-(1,1-Диметилэтил)фенил]метил-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4 пиридазинил]карбонилглицин. Натриевую соль глицина (38 мг, 0,39 ммоль) добавляли к раствору соединения примера 14b) (73 мг,0,20 ммоль) в 2-метоксиэтаноле при комнатной температуре. Реакционную смесь нагревали до кипения с обратным холодильником и перемешивали в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли Н 2 О. Раствор фильтровали и к осажденному продукту добавляли 1 н. HCl. Твердое вещество отфильтровывали и промывали H2O и гексанами с получением указанного в заголовке 15 а) Этил 2-[(2-хлорфенил)метил]-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинкарбоксилат. Гидрид натрия (37 мг, 0,93 ммоль) добавляли к раствору соединения примера 14a) (84 мг,0,37 ммоль) в N,N-диметилформамиде (ДМФА) (1,5 мл) при 0 С. Температуру реакции доводили до комнатной температуры и реакционную смесь перемешивали в течение 40 мин. Затем температуру снижали до 0 С и добавляли 2-хлорбензилбромид (48 мкл, 0,37 ммоль). Температуру реакции доводили до комнатной температуры и реакционную смесь перемешивали в течение 3 ч с последующим добавлением 1 н. HCl. Раствор разбавляли EtOAc и H2O и слои разделяли. Водный слой снова экстрагировали EtOAc несколько раз. Объединенные органические слои промывали насыщенным раствором соли, сушили(MgSO4), фильтровали и концентрировали. Продукт очищали колоночной хроматографией (SiO2, 30-45% смесь EtOAc/гексаны) с получением указанного в заголовке соединения (71 мг, 55%). 1H ЯМР (400 МГц, хлороформ-d)м.д. 13,38 (с, 1 Н), 7,35-7,42 (м, 1 Н), 7,13-7,26 (м, 3H), 5,42 (с,2 Н), 4,50 (кв, J=7,07 Гц, 2 Н), 3,24 (септ, J=6,82 Гц, 1 Н), 1,47 (т, J=7,07 Гц, 3H), 1,21 (д, J=6,82 Гц, 6 Н). 15b) N-[2-[(2-Хлорфенил)метил]-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонилглицин. Натриевую соль глицина (35 мг, 0,36 ммоль) добавляли к раствору соединения примера 15a) (64 мг,0,18 ммоль) в 2-метоксиэтаноле при комнатной температуре. Реакционную смесь нагревали до кипения с обратным холодильником и перемешивали в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли Н 2 О. Раствор фильтровали и добавляли 1 н. HCl для осаждения продукта. Твердое вещество отфильтровывали и промывали H2O и гексанами. Продукт очищали переосаждением из смеси CH2Cl2/гексаны с получением указанного в заголовке соединения (39 мг, 57%). 1 Н ЯМР (400 МГц, хлороформ-d)м.д. 15,22 (с, 1 Н), 10,42 (т, J=5,43 Гц, 1 Н), 7,38-7,45 (м, 1 Н), 7,197,27 (м, 2 Н), 7,08-7,13 (м, 1 Н), 5,45 (с, 2 Н), 4,25 (д, J=5,81 Гц, 2 Н), 3,27 (септ, J=6,82 Гц, 1 Н), 1,22 (д,J=6,82 Гц, 6 Н). Пример 16. N-[2-[(3,5-Дифторфенил)метил]-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4 пиридазинил]карбонилглицин. 16 а) Этил-2-[(3,5-дифторфенил)метил]-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4 пиридазинкарбоксилат. Гидрид натрия (32 мг, 0,80 ммоль) добавляли к раствору соединения примера 14a) (72 мг,0,32 ммоль) в N,N-диметилформамиде (ДМФА) (1,5 мл) при 0 С. Температуру реакции доводили до комнатной температуры и реакционную смесь перемешивали в течение 40 мин. Затем температуру снижали до 0 С и добавляли 3,5-дифторбензилбромид (0,04 мл, 0,32 ммоль). Температуру реакции доводили до комнатной температуры и реакционную смесь перемешивали в течение ночи. Наблюдали незначительное превращение в продукт, поэтому реакционную смесь снова охлаждали до 0 С и добавляли дополнительное количество NaH (10 мг, 0,25 ммоль) и 3,5-дифторбензилбромида (0,01 мл, 0,08 ммоль). После нескольких часов реакцию гасили 1 н. HCl. Раствор разбавляли EtOAc и H2O и слои разделяли. Водный слой снова экстрагировали EtOAc несколько раз. Объединенные органические слои промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали. Продукт очищали колоночной хроматографией (SiO2, 30-45% смесь EtOAc/гексаны) с получением указанного в заголовке соединения (34 мг, 30%). 1 Н ЯМР (400 МГц, хлороформ-d)м.д. 13,40 (с, 1 Н), 6,94 (ддд, J=14,46, 6,63, 2,15 Гц, 2 Н), 6,73 (тт,J=8,97, 2,27 Гц, 1 Н), 5,22 (с, 2 Н), 4,51 (кв, J=7,16 Гц, 2 Н), 3,27 (септ, J=6,86 Гц, 1 Н), 1,47 (т, J=7,20 Гц,3H), 1,27 (д, J=6,82 Гц, 6 Н).N-[2-[(3,5-Дифторфенил)метил]-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4 пиридазинил]карбонилглицин. Натриевую соль глицина (18 мг, 0,18 ммоль) добавляли к раствору соединения примера 16a) (32 мг,0,09 ммоль) в 2-метоксиэтаноле (0,9 мл) при комнатной температуре. Реакционную смесь нагревали до кипения с обратным холодильником и перемешивали в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли H2O. Раствор фильтровали и добавляли 1 н. HCl для осаждения продукта. Твердое вещество отфильтровывали и промывали H2O и гексанами. Твердое вещество растворяли в горячем MeOH и фильтровали. Растворитель удаляли при пониженном давлении с получением указанного в заголовке соединения (26 мг, 75%) в виде белого твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 15,92 (с, 1 Н), 12,96 (с, 1 Н), 10,13 (т, J=5,31 Гц, 1 Н), 7,17 (м, 1 Н),6,95-7,05 (м, 2 Н), 5,27 (с, 2 Н), 4,09 (д, J=5,56 Гц, 2 Н), 3,19 (септ, J=6,78 Гц, 1 Н), 1,19 (д, J=6,82 Гц, 6 Н). Пример 17. 17a) Этил-(4-бифенилилметил)-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4 пиридазинкарбоксилат. Гидрид натрия (40 мг, 0,99 ммоль) добавляли к раствору соединения примера 14a) (90 мг,0,40 ммоль) в N,N-диметилформамиде (ДМФА) (2,2 мл) при 0 С. Температуру реакции доводили до комнатной температуры и реакционную смесь перемешивали в течение 45 мин. Затем температуру снижали до 0 С и добавляли 4-(бромметил)бифенил (98 мг, 0,40 ммоль). Температуру реакции доводили до комнатной температуры и реакционную смесь перемешивали в течение 3 ч. Реакцию гасили 1 н. HCl. Раствор разбавляли EtOAc и H2O и слои разделяли. Водный слой снова экстрагировали EtOAc несколько раз. Объединенные органические слои промывали насыщенным раствором соли, сушили (MgSO4),фильтровали и концентрировали. Продукт очищали колоночной хроматографией (SiO2, 25-45% смесьN-[2-(4-Бифенилилметил)-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонилглицин. Натриевую соль глицина (18 мг, 0,18 ммоль) добавляли к раствору соединения примера 17a) (32 мг,0,09 ммоль) в 2-метоксиэтаноле (0,9 мл) при комнатной температуре. Реакционную смесь нагревали до кипения с обратным холодильником и перемешивали в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли H2O. Раствор фильтровали и добавляли 1 н. HCl для осаждения продукта. Твердое вещество отфильтровывали и промывали H2O и гексанами. Твердое вещество растворяли в горячем MeOH и фильтровали. Растворитель удаляли при пониженном давлении с получением указанного в заголовке соединения (26 мг, 75%) в виде белого твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 15,89 (с, 1 Н), 12,98 (с, 1 Н), 10,20 (т, J=4,93 Гц, 1 Н), 7,64 (д,J=7,83 Гц, 4 Н), 7,30-7,51 (м, 5 Н), 5,30 (с, 2 Н), 4,10 (д, J=5,56 Гц, 2 Н), 3,13-3,27 (м, 1 Н), 1,22 (д, J=7,07 Гц,6 Н). Пример 18. 18 а) Этил 2-(2-циклогексилэтил)-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинкарбоксилат. Гидрид натрия (40 мг, 0,99 ммоль) добавляли к раствору соединения примера 14a) (90 мг,0,40 ммоль) в N,N-диметилформамиде (ДМФА) (2,2 мл) при 0 С. Температуру реакции доводили до комнатной температуры и реакционную смесь перемешивали в течение 45 мин. Затем температуру снижали до 0 С и добавляли 2-циклогексилэтилбромид (0,09 мл, 0,40 ммоль). Температуру реакции доводили до комнатной температуры и реакционную смесь перемешивали в течение 4 ч с последующим добавлением 1 н. HCl. Раствор разбавляли EtOAc и H2O и слои разделяли. Водный слой снова экстрагировалиEtOAc несколько раз. Объединенные органические слои промывали насыщенным раствором соли, суши- 20017112 ли (MgSO4), фильтровали и концентрировали. Продукт очищали колоночной хроматографией (SiO2, 2545% смесь EtOAc/гексаны) с получением указанного в заголовке соединения (82 мг, 61%). ЖХМС (ES+) m/z 337,0 (МН+). 18b)N-[2-(Циклогексилэтил)-5-гидрокси-6-(1-метилэтил)-3-оксо-2,3-дигидро-4-пиридазинил]карбонилглицин. Натриевую соль глицина (47 мг, 0,49 ммоль) добавляли к раствору соединения примера 18a) (82 мг,0,24 ммоль) в 2-метоксиэтаноле (1,2 мл) при комнатной температуре. Реакционную смесь нагревали до кипения с обратным холодильником и перемешивали в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли Н 2 О. Раствор фильтровали и добавляли 1 н. HCl для осаждения продукта. Твердое вещество отфильтровывали и промывали H2O и гексанами. Продукт очищали осаждением из смеси Et2O/гексаны с получением указанного в заголовке соединения (40 мг, 45%) в виде белого твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 15,77 (с, 1 Н), 12,98 (с, 1 Н), 10,28 (т, J=5,31 Гц, 1 Н), 4,04-4,16 (м,4 Н), 3,18 (септ, J=6,78 Гц, 1 Н), 1,47-1,82 (м, 7 Н), 1,20-1,29 (м, 1 Н), 1,19 (д, J=6,82 Гц, 6 Н), 1,06-1,17 (м,3H), 0,82-0,99 (м, 2 Н). Пример 19. 19 а) Этил(4-фторфенил)(оксо)ацетат. Раствор диэтилоксилата (диэтилоксалата) (1,4 мл, 10,3 ммоль) в ТГФ (40 мл) и Et2O (40 ммоль) охлаждали до -78 С. Добавляли по каплям 4-фторфенилмагнийбромид (2,0 М раствор в Et2O, 6,2 мл,12,40 ммоль) и раствор перемешивали в атмосфере азота в течение 1,5 ч при -78 С. Температуру реакции доводили до 0 С и реакцию гасили 6 н. HCl. Дополнительные Et2O и H2O добавляли и слои разделяли. Водную фазу экстрагировали Et2O несколько раз. Объединенные органические слои промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали. Продукт очищали колоночной хроматографией (SiO2, 5-10% смесь EtOAc/гексаны) с получением указанного в заголовке соединения в виде бледно-желтого масла (1,74 г, 86%). 1 Н ЯМР (400 МГц, хлороформ-d)м.д. 8,05-8,15 (м, 2 Н), 7,16-7,25 (м, 2 Н), 4,47 (кв, J=7,16 Гц, 2 Н),1,45 (т, J=7,07 Гц, 3H). 19b) Этил 3-(2Z)-2- [2-(этилокси)-1-(4-фторфенил)-2-оксоэтилиден]гидразино-3-оксопропаноат. Этил-3-гидразино-3-оксопропионат (1,31 г, 8,99 ммоль) и каталитическую AcOH (0,09 мл,1,50 ммоль) добавляли к раствору соединения примера 19a) в EtOH (15 мл). Реакционную смесь нагревали до кипения с обратным холодильником и перемешивали в течение ночи. Несколько раз добавляли взятое на кончике шпателя количество MgSO4 и реакцию продолжали при перемешивании в течение 3 ч. Затем реакционную смесь охлаждали до комнатной температуры и фильтровали. Фильтрат концентрировали и подвергали обработке несколько раз с образованием азеотропа с толуолом. Продукт очищали колоночной хроматографией (SiO2, 15-45% смесь EtOAc/гексаны) с получением указанного в заголовке соединения (1,77 г 73%). 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 10,63-11,68 (м, 1 Н), 7,22-7,74 (м, 4 Н), 4,00-4,49 (м, 4 Н), 3,403,80 (м, 2 Н), 1,04-1,38 (м, 6 Н). 19c) Этил 6-(4-фторфенил)-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинкарбоксилат.KHMDS (1,60 г, 8,02 ммоль) добавляли несколькими порциями к раствору соединения примера 19b)(1,75 г, 5,35 ммоль) в 1,4-диоксане (13 мл) при комнатной температуре. Реакционную смесь нагревали до кипения с обратным холодильником и перемешивали в течение 2,5 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли 1 н. HCl для осаждения продукта. Твердое вещество отфильтровывали и промывали H2O и гексанами с получением указанного в заголовке соединенияH ЯМР (400 МГц, ДМСО-d6)м.д. 13,03 (с, 1 Н), 7,72 (дд, J=8,59, 5,81 Гц, 2 Н), 7,29 (т, J=8,84 Гц,2 Н), 4,31 (кв, J=7,07 Гц, 2 Н), 1,29 (т, J=7,07 Гц, 3H). 19d) Этил 2-(4-бифенилилметил)-6-(4-фторфенил)-5-гидрокси-3-оксо-2,3-дигидро-4 пиридазинкарбоксилат. Гидрид натрия (50 мг, 1,25 ммоль) добавляли к раствору соединения примера 19c) (139 мг,0,50 ммоль) в N,N-диметилформамиде (ДМФА) (2,5 мл) при 0 С. Температуру реакции доводили до комнатной температуры и реакционную смесь перемешивали в течение 45 мин. Затем температуру снижали до 0 С и добавляли 4-(бромметил)бифенил (124 мг, 0,50 ммоль). Температуру реакции доводили до комнатной температуры и реакционную смесь перемешивали в течение 3 ч с последующим добавлением- 21017112 1 н. HCl. Раствор разбавляли EtOAc и H2O и слои разделяли. Водный слой снова экстрагировали EtOAc несколько раз. Объединенные органические слои промывали насыщенным раствором соли, сушили(MgSO4), фильтровали и концентрировали. Продукт очищали колоночной хроматографией (SiO2, 25-45% смесь EtOAc/гексаны) с получением указанного в заголовке соединения (69 мг, 31%). ЖХМС (ES+) m/z 445 (МН+). 19 е) N-[2-(4-Бифенилилметил)-6-(4-фторфенил)-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинил]карбонилглицин. Натриевую соль глицина (28 мг, 0,29 ммоль) добавляли к раствору соединения примера 19d) (65 мг,0,15 ммоль) в 2-метоксиэтаноле (1,5 мл) при комнатной температуре. Реакционную смесь нагревали до кипения с обратным холодильником и перемешивали в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли Н 2 О. Раствор фильтровали и добавляли 1 н. HCl для осаждения продукта. Твердое вещество отфильтровывали и промывали H2O и гексанами с получением указанного в заголовке соединения (19 мг, 28%) в виде белого твердого вещества. 1 20 а) Этил 3-2-[1-(4-хлорфенил)-2-(этилокси)-2-оксоэтилиден]гидразино-3-оксопропаноат. Раствор диэтилоксилата (диэтилоксалата) (3,4 мл, 25,0 ммоль) в ТГФ (50 мл) и Et2O (50 ммоль) охлаждали до -78 С. Добавляли по каплям 4-хлорфенилмагнийбромид (1,0 М раствор в Et2O, 30 мл,30,0 ммоль) и раствор перемешивали в атмосфере азота в течение 2 ч при -78 С. Температуру реакции доводили до 0 С и реакцию гасили 6 н. HCl. Дополнительные Et2O и H2O добавляли и слои разделяли. Водную фазу экстрагировали Et2O несколько раз. Объединенные органические слои промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали. Образовавшееся масло растворяли в EtOH. Этил-3-гидразино-3-оксопропионат (4,27 г, 29,2 ммоль) и каталитическую AcOH(0,3 мл, 4,87 ммоль) добавляли наряду с несколькими взятыми на кончике шпателя порциями MgSO4. Реакционную смесь нагревали с обратным холодильником и перемешивали в течение ночи. Реакционную смесь охлаждали и растворитель удаляли при пониженном давлении. Остаток обрабатывали с образованием азеотропа с толуолом несколько раз. Продукт очищали колоночной хроматографией (SiO2,15-45% смесь EtOAc/гексаны) с получением указанного в заголовке соединения (6,29 г, 76% за 2 стадии). 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 10,60-11,75 (м, 1 Н), 7,21-7,72 (м, 4 Н), 3,96-4,50 (м, 4 Н), 3,403,82 (м, 2 Н), 1,02-1,38 (м, 6 Н). 20b) Этил 6-(4-хлорфенил)-5-гидрокси 3-оксо-2,3-дигидро-4-пиридазинкарбоксилат.KHMDS (1,80 г, 9,0 ммоль) добавляли несколькими порциями к раствору соединения примера 20 а)(2,04 г, 6,00 ммоль) в 1,4-диоксане при комнатной температуре. Реакционную смесь нагревали до кипения с обратным холодильником и перемешивали в течение 5 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли 1 н. HCl для осаждения продукта. Затем добавляли CH2Cl2 и H2O и слои разделяли. Водную фазу экстрагировали CH2Cl2 несколько раз. Объединенные органические слои промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали с получением бледно-желтого твердого вещества. Колбу охлаждали и добавляли Et2O. Продукт фильтровали с получением указанного в заголовке соединения в виде белого твердого вещества (1,07 г, 60%). ЖХМС (ES+) m/z 294,8 (МН+). 20 с) Этил 6-(4-хлорфенил)-2-[4-(1,1-диметилэтил)фенил]метил-5-гидрокси-3-оксо-2,3-дигидро-4 пиридазинкарбоксилат. Гидрид натрия (50 мг, 1,25 ммоль) добавляли к раствору соединения примера 20b) (147 мг,0,50 ммоль) в N,N-диметилформамиде (ДМФА) при 0 С. Температуру реакции доводили до комнатной температуры и реакционную смесь перемешивали в течение 45 мин. Затем температуру снижали до 0 С и добавляли 4-трет-бутилбензилбромид (0,09 мл, 0,50 ммоль). Температуру реакции доводили до комнатной температуры и реакционную смесь перемешивали в течение 3 ч с последующим добавлением 1 н.HCl. Раствор разбавляли EtOAc и H2O и слои разделяли. Водный слой снова экстрагировали EtOAc несколько раз. Объединенные органические слои промывали насыщенным раствором соли, сушили(MgSO4), фильтровали и концентрировали. Продукт очищали колоночной хроматографией (SiO2, 1-5% смесь MeOH/CH2Cl2), затем растирали в холодном Et2O с получением указанного в заголовке соединения в виде белой пены (132 мг, 60%). ЖХМС (ES+) m/z 441, 1 (МН+). 20d) N-[(6-(4-Хлорфенил)-2-[4-(1,1-диметилэтил)фенил]метил-5-гидрокси-3-оксо-2,3-дигидро-4- 22017112 пиридазинил)карбонил]глицин. Натриевую соль глицина (55 мг, 0,57 ммоль) добавляли к раствору соединения примера 20c)(125 мг, 0,28 ммоль) в 2-метоксиэтаноле при комнатной температуре. Реакционную смесь нагревали до кипения с обратным холодильником и перемешивали в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли H2O. Раствор фильтровали и добавляли 1 н. HCl для осаждения продукта. Твердое вещество отфильтровывали и промывали H2O и гексанами. Продукт очищали осаждением из смеси CH2Cl2/гексаны с получением указанного в заголовке соединения (69 мг, 52%) в виде белого твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 10,24 (т, J=6,06 Гц, 1 Н), 7,84 (д, J=8,59 Гц, 2 Н), 7,57 (д,J=8,59 Гц, 2 Н), 7,33-7,41 (м, 2 Н), 7,26-7,33 (м, 2 Н), 5,32 (с, 2 Н), 4,12 (д, J=5,81 Гц, 2 Н), 1,25 (с, 9 Н). Пример 21. 21 а) Этил 2-(4-бифенилилметил)-6-(4-хлорфенил)-5-гидрокси-3-оксо-2,3-дигидро-4 пиридазинкарбоксилат. Гидрид натрия (50 мг, 1,25 ммоль) добавляли к раствору соединения примера 20b) (147 мг,0,50 ммоль) в N,N-диметилформамиде (ДМФА) (2,5 мл) при 0 С. Температуру реакции доводили до комнатной температуры и реакционную смесь перемешивали в течение 45 мин. Затем температуру снижали до 0 С и добавляли 4-(бромметил)бифенил (124 мг, 0,50 ммоль). Температуру реакции доводили до комнатной температуры и реакционную смесь перемешивали в течение 3 ч с последующим добавлением 1 н. HCl. Раствор разбавляли EtOAc и H2O и слои разделяли. Водный слой снова экстрагировали EtOAc несколько раз. Объединенные органические слои промывали насыщенным раствором соли, сушили(MgSO4), фильтровали и концентрировали. Продукт очищали колоночной хроматографией (SiO2, 1-5% смесь MeOH/CH2Cl2) с получением указанного в заголовке соединения (135 мг, 59%). 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 7,74 (ддд, J=8,91, 2,53, 2,21 Гц, 2 Н), 7,60-7,67 (м, 4 Н), 7,55 (ддд,J=9,09, 2,53, 2,27 Гц, 2 Н), 7,40-7,50 (м, 4 Н), 7,36 (тт, J=7,33, 1,26 Гц, 1 Н), 5,30 (с, 2 Н), 4,30 (кв, J=7,07 Гц,2 Н), 1,28 (т, J=7,20 Гц, 3H). 21b) N-[2-(4-Бифенилилметил)-6-(4-хлорфенил)-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинил]карбонилглицин. Натриевую соль глицина (53 мг, 0,55 ммоль) добавляли к раствору соединения примера 21a)(126 мг, 0,27 ммоль) в 2-метоксиэтаноле (1,5 мл) при комнатной температуре. Реакционную смесь нагревали до кипения с обратным холодильником и перемешивали в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли H2O. Раствор фильтровали и добавляли 1 н. HCl для осаждения продукта. Твердое вещество отфильтровывали и промывали H2O и гексанами. Продукт очищали осаждением из смеси CH2Cl2/гексаны с получением указанного в заголовке соединения (90 мг, 67%). 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 13,03 (с, 1 Н), 10,25 (т, J=5,43 Гц, 1 Н), 7,80-7,89 (м, 2 Н), 7,65 22 а) Этил 2-[(2-хлорфенил)метил]-6-(4-фторфенил)-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинкарбоксилат. Гидрид натрия (83 мг, 2,08 ммоль) добавляли к раствору соединения примера 19c) (232 мг,0,83 ммоль) в N,N-диметилформамиде (ДМФА) (4 мл) при 0 С. Температуру реакции доводили до комнатной температуры и реакционную смесь перемешивали в течение 45 мин. Затем температуру снижали до 0 С и добавляли 2-хлорбензилбромид (0,11 мл, 0,83 ммоль). Температуру реакции доводили до комнатной температуры и реакционную смесь перемешивали в течение 3 ч с последующим добавлением 1 н.HCl. Раствор разбавляли EtOAc и H2O и слои разделяли. Водный слой снова экстрагировали EtOAc несколько раз. Объединенные органические слои промывали насыщенным раствором соли, сушили(MgSO4), фильтровали и концентрировали. Продукт очищали колоночной хроматографией (SiO2, 1-5%(м, 4 Н), 7,18 (дд, J=6,82, 2,27 Гц, 1 Н), 5,34 (с, 2 Н), 4,31 (кв, J=7,07 Гц, 2 Н), 1,28 (т, J=7,07 Гц, 3H). 22b) N-[2-[(2-Хлорфенил)метил]-6-(4-фторфенил)-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинил]карбонилглицин. Натриевую соль глицина (71 мг, 0,73 ммоль) добавляли к раствору соединения примера 22a)(147 мг, 0,37 ммоль) в 2-метоксиэтаноле (2 мл) при комнатной температуре. Реакционную смесь нагревали до кипения с обратным холодильником и перемешивали в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли Н 2 О. Раствор фильтровали и добавляли 1 н. HCl для осаждения продукта. Твердое вещество отфильтровывали и промывали H2O и гексанами. Продукт растворяли в горячем CH2Cl2, сушили (MgSO4) и фильтровали. Раствор охлаждали до 0 С и гексаны добавляли для осаждения продукта. Продукт фильтровали с получением указанного в заголовке соединения в виде бледнорозового твердого вещества (107 мг, 68%). 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 13,03 (с, 1 Н), 10,20 (т, J=4,29 Гц, 1 Н), 7,76-7,86 (м, 2 Н), 7,52 (дд,J=7,58, 1,52 Гц, 1 Н), 7,27-7,41 (м, 4 Н), 7,20-7,27 (м, 1 Н), 5,45 (с, 2 Н), 4,14 (д, J=5,56 Гц, 2 Н). Пример 23. 23 а) Этил 6-(4-хлорфенил)-2-[(2-хлорфенил)метил]-5-гидрокси-3-оксо-2,3-дигидро-4 пиридазинкарбоксилат. Гидрид натрия (85 мг, 2,14 ммоль) добавляли к раствору соединения примера 20b) (250 мг,0,85 ммоль) в N,N-диметилформамиде (ДМФА) (4 мл) при 0 С. Температуру реакции доводили до комнатной температуры и реакционную смесь перемешивали в течение 45 мин. Затем температуру снижали до 0 С и добавляли 2-хлорбензилбромид (0,11 мл, 0,85 ммоль). Температуру реакции доводили до комнатной температуры и реакционную смесь перемешивали в течение 3 ч с последующим добавлением 1 н.HCl. Раствор разбавляли EtOAc и H2O и слои разделяли. Водный слой снова экстрагировали EtOAc несколько раз. Объединенные органические слои промывали насыщенным раствором соли, сушили(MgSO4), фильтровали и концентрировали. Продукт очищали колоночной хроматографией (SiO2, 1-5% смесь MeOH/CH2Cl2), затем растирали в холодном Et2O с получением указанного в заголовке соединения в виде белого твердого вещества (187 мг, 53%). 1N-(6-(4-Хлорфенил)-2-[(2-хлорфенил)метил]-5-гидрокси-3-оксо-2,3-дигидро-4 пиридазинилкарбонил)глицин. Натриевую соль глицина (83 мг, 0,85 ммоль) добавляли к раствору соединения примера 23a)(179 мг, 0,43 ммоль) в 2-метоксиэтаноле при комнатной температуре. Реакционную смесь нагревали до кипения с обратным холодильником и перемешивали в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли H2O. Раствор фильтровали и добавляли 1 н. HCl для осаждения продукта. Твердое вещество отфильтровывали и промывали H2O и гексанами с получением указанного в заголовке соединения (153 мг, 80%). 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 13,03 (с, 1 Н), 10,19 (т, J=4,80 Гц, 1 Н), 7,74-7,83 (м, 2 Н), 7,55- 24017112 24a) Этил 6-(4-хлорфенил)-2-(2-циклогексилэтил)-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинкарбоксилат. Гидрид натрия (85 мг, 2,14 ммоль) добавляли к раствору соединения примера 20b) (250 мг,0,85 ммоль) в N,N-диметилформамиде (ДМФА) (4 мл) при 0 С. Температуру реакции доводили до комнатной температуры и реакционную смесь перемешивали в течение 45 мин. Затем температуру снижали до 0 С и добавляли 2-циклогексилэтилбромид (0,13 мл, 0,85 ммоль). Температуру реакции доводили до комнатной температуры и реакционную смесь перемешивали в течение 3 ч с последующим добавлением 1 н. HCl. Раствор разбавляли EtOAc и H2O и слои разделяли. Водный слой снова экстрагировали EtOAc несколько раз. Объединенные органические слои промывали насыщенным раствором соли, сушили(MgSO4), фильтровали и концентрировали. Продукт очищали колоночной хроматографией (SiO2, 1-5% смесь MeOH/CH2Cl2), затем сушили в высоком вакууме с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества (187 мг, 54%). ЖХМС (ES+) m/z 405,0 (МН+). 24b) N-[6-(4-Хлорфенил)-2-(2-циклогексилэтил)-5-гидрокси-3-оксо-2,3-дигидро-4-пиридазинил]карбонилглицин. Натриевую соль глицина (85 мг, 0,87 ммоль) добавляли к раствору соединения примера 24a)(177 мг, 0,44 ммоль) в 2-метоксиэтаноле (2 мл) при комнатной температуре. Реакционную смесь нагревали до кипения с обратным холодильником и перемешивали в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли H2O. Раствор фильтровали и добавляли 1 н. HCl для осаждения продукта. Твердое вещество отфильтровывали и промывали H2O и гексанами с получением указанного в заголовке соединения (117 мг, 62%). 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 13,02 (с, 1 Н), 10,32 (т, J=4,93 Гц, 1 Н), 7,82 (д, J=8,59 Гц, 2 Н),7,57 (ддд, J=8,84, 2,53, 2,27 Гц, 2 Н), 4,16-4,23 (м, 2 Н), 4,15 (д, J=5,81 Гц, 2 Н), 1,55-1,81 (м, 7 Н), 1,10-1,41 25a) Этил 2-(2-циклопропилэтил)-6-(4-фторфенил)-5-гидрокси-3-оксо-2,3-дигидро-4 пиридазинкарбоксилат. Гидрид натрия (40 мг, 1,00 ммоль) добавляли к раствору соединения примера 19c) (139 мг,0,50 ммоль) в N,N-диметилформамиде (ДМФА) (2,5 мл) при 0 С. Температуру реакции доводили до комнатной температуры и реакционную смесь перемешивали в течение 45 мин. Затем температуру снижали до 0 С и добавляли 2-циклопропилэтилиодид (119 мг, 0,50 ммоль). Температуру реакции доводили до комнатной температуры и реакционную смесь перемешивали в течение 3 ч с последующим добавлением 1 н. HCl. Раствор разбавляли EtOAc и H2O и слои разделяли. Водный слой снова экстрагировалиEtOAc несколько раз. Объединенные органические слои промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали. Продукт очищали колоночной хроматографией (SiO2, 15% смесь MeOH/CH2Cl2) с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества (47 мг, 27%). ЖХМС (ES+) m/z 346,8 (МН+). 25b)N-[2-(2-Циклопропилэтил)-6-(4-фторфенил)-5-гидрокси-3-оксо-2,3-дигидро-4 пиридазинил]карбонилглицин. Натриевую соль глицина (26 мг, 0,27 ммоль) добавляли к раствору соединения примера 25a) (47 мг,0,14 ммоль) в 2-метоксиэтаноле (0,8 мл) при комнатной температуре. Реакционную смесь нагревали до кипения с обратным холодильником и перемешивали в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли Н 2 О. Раствор фильтровали и добавляли 1 н. HCl для осаждения продукта. Твердое вещество отфильтровывали и промывали гексанами и Et2O с получением указанного в заголовке соединения в виде бледно-розового твердого вещества (21 мг, 40%). 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 13,02 (с, 1 Н), 10,28-10,39 (м, 1 Н), 7,79-7,88 (м, 2 Н), 7,29-7,38 (м,2 Н), 4,25 (т, J=7,07 Гц, 2 Н), 4,15 (д, J=5,56 Гц, 2 Н), 1,68 (кв, J=7,07 Гц, 2 Н), 0,65-0,79 (м, 1 Н), 0,40 (ддд,J=7,89, 5,75, 4,04 Гц, 2 Н), 0,02 (тд, J=5,24, 4,17 Гц, 2 Н). 26 а) Этил[4-(1,1-диметилэтил)фенил](оксо)ацетат. К раствору 4-бром-трет-бутилбензола (0,70 мл, 5,0 ммоль) в ТГФ (20 мл) добавляли по каплям н-BuLi (2,87 М раствор в гексанах, 1,74 мл, 5,0 ммоль) при -78 С в атмосфере азота. После перемешивания в течение 1 ч добавляли диэтилоксилат (0,68 мл, 5,0 ммоль). Реакционную смесь перемешивали в течение 1 ч при -78 С и затем добавляли 1 н. HCl. Раствор разбавляли H2O и EtOAc и слои разделяли. Водную фазу снова экстрагировали EtOAc несколько раз. Объединенные органические слои промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали. Продукт очищали колоночной хроматографией (SiO2, 5-10% смесь EtOAc/гексаны) с получением указанного в заголовке соединения (334 мг, 29%). 1 Н ЯМР (400 МГц, хлороформ-d)м.д. 7,97 (дт, J=8,65, 2,12 Гц, 2 Н), 7,55 (дт, J=8,84, 2,02 Гц, 2 Н),4,47 (кв, J=7,07 Гц, 2 Н), 1,45 (т, J=7,20 Гц, 3H), 1,37 (с, 9 Н). 26b) Этил 3-2-[1-[4-(1,1-диметилэтил)фенил]-2-(этилокси)-2-оксоэтилиден]гидразино-3 оксопропаноат. Этил-3-гидразино-3-оксопропионат (419 мг, 2,87 ммоль) и каталитическую AcOH (0,03 мл,0,48 ммоль) добавляли к раствору соединения примера 26a) (560 мг, 2,39 ммоль) в EtOH (10 мл). Несколько раз добавляли взятые на кончике шпателя порции MgSO4 и реакционную смесь перемешивали при кипячении с обратным холодильником в течение ночи. Затем реакционную смесь охлаждали до комнатной температуры и фильтровали. Фильтрат концентрировали и остаток обрабатывали несколько раз с образованием азеотропа с толуолом. Продукт очищали колоночной хроматографией (SiO2, 10-45%KHMDS (466 мг, 2,33 ммоль) добавляли несколькими порциями к раствору соединения примера 26b) (564 мг, 1,56 ммоль) в 1,4-диоксане (4 мл) при комнатной температуре. Реакционную смесь нагревали до кипения с обратным холодильником и перемешивали в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры и растворитель удаляли при пониженном давлении. К осажденному продукту добавляли 1 н. HCl. Твердое вещество отфильтровывали и промывали H2O, гексанами и Et2O с получением указанного в заголовке соединения (220 мг, 45%). 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 13,03 (с, 1 Н), 12,59 (ушир.с, 1 Н), 7,57-7,62 (м, 2 Н), 7,47 (дт,J=8,59, 2,02 Гц, 2 Н), 4,32 (кв, J=7,07 Гц, 2 Н), 1,31 (с, 9 Н), 1,26-1,34 (м, 3H). 26d) Этил 6-[4-(1,1-диметилэтил)фенил]-2-[4-(1,1-диметилэтил)фенил]метил-5-гидрокси-3-оксо 2,3-дигидро-4-пиридазинкарбоксилат. Гидрид натрия (32 мг, 0,79 ммоль) добавляли к раствору соединения примера 26c) (100 мг,0,32 ммоль) в N,N-диметилформамиде (ДМФА) при 0 С. Температуру реакции доводили до комнатной температуры и реакционную смесь перемешивали в течение 45 мин. Затем температуру снижали до 0 С и добавляли 4-трет-бутилбензилбромид (0,06 мл, 0,32 ммоль). Температуру реакции доводили до комнатной температуры и реакционную смесь перемешивали в течение 3 ч с последующим добавлением 1 н.HCl. Раствор разбавляли EtOAc и H2O и слои разделяли. Водный слой снова экстрагировали EtOAc несколько раз. Объединенные органические слои промывали насыщенным раствором соли, сушили(MgSO4), фильтровали и концентрировали. Продукт очищали колоночной хроматографией (SiO2, 20-45% смесь EtOAc/гексаны) с получением указанного в заголовке соединения в виде белой пены (110 мг, 75%). ЖХМС (ES+) m/z 463,2 (МН+). 26e)N-[(6-[4-(1,1-Диметилэтил)фенил]-2-[4-(1,1-диметилэтил)фенил]метил-5-гидрокси-3-оксо 2,3-дигидро-4-пиридазинил)карбонил]глицин. Натриевую соль глицина (43 мг, 0,44 ммоль) добавляли к раствору соединения примера 26d)(102 мг, 0,22 ммоль) в 2-метоксиэтаноле (1,4 мл) при комнатной температуре. Реакционную смесь нагревали до кипения с обратным холодильником и перемешивали в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли H2O. Раствор фильтровали и добавляли 1 н. HCl для осаждения продукта. Твердое вещество отфильтровывали и промывали H2O и гексанами, в которых частично растворялся продукт. Затем EtOAc добавляли и слои разделяли. Водный слой экстрагировали EtOAc несколько раз. Объединенные органические слои промывали насыщенным раствором соли, сушили 27 а) Этил 2-[(2-хлорфенил)метил]-6-[4-(1,1-диметилэтил)фенил]-5-гидрокси-3-оксо-2,3-дигидро-4 пиридазинкарбоксилат. Гидрид натрия (37 мг, 0,92 ммоль) добавляли к раствору соединения примера 26c) (117 мг,0,37 ммоль) в N,N-диметилформамиде (ДМФА) (1,5 мл) при 0 С. Температуру реакции доводили до комнатной температуры и реакционную смесь перемешивали в течение 45 мин. Затем температуру снижали до 0 С и добавляли 2-хлорбензилбромид (0,05 мл, 0,37 ммоль). Температуру реакции доводили до комнатной температуры и реакционную смесь перемешивали в течение 3 ч с последующим добавлением 1 н. HCl. Раствор разбавляли EtOAc и H2O и слои разделяли. Водный слой снова экстрагировали EtOAc несколько раз. Объединенные органические слои промывали насыщенным раствором соли, сушили(MgSO4), фильтровали и концентрировали. Продукт очищали колоночной хроматографией (SiO2, 0-4% смесь MeOH/CH2Cl2), затем сушили в высоком вакууме с получением указанного в заголовке соединения в виде белой пены (125 мг, 77%). 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 12,64 (ушир.с, 1 Н), 7,59 (ддд, J=8,72, 2,15, 2,02 Гц, 2 Н), 7,437,52 (м, 3H), 7,28-7,38 (м, 2 Н), 7,13-7,21 (м, 1 Н), 5,34 (с, 2 Н), 4,31 (кв, J=7,07 Гц, 2 Н), 1,30 (с, 9 Н), 1,241,32 (м, 3H). 27b) N-(2-[(2-Хлорфенил)метил]-6-[4-(1,1-диметилэтил)фенил]-5-гидрокси-3-оксо-2,3-дигидро-4 пиридазинилкарбонил)глицин. Натриевую соль глицина (52 мг, 0,54 ммоль) добавляли к раствору соединения примера 27a)(118 мг, 0,27 ммоль) в 2-метоксиэтаноле при комнатной температуре. Реакционную смесь нагревали до кипения с обратным холодильником и перемешивали в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли H2O. Раствор фильтровали и добавляли 1 н. HCl для осаждения продукта. Твердое вещество отфильтровывали и промывали H2O и гексанами. Продукт очищали осаждением из смеси СН 2 С 12/гексаны с получением указанного в заголовке соединения в виде белого твердого вещества (100 мг, 79%). 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 13,01 (с, 1 Н), 10,22 (т, J=5,18 Гц, 1 Н), 7,64-7,71 (м, 2 Н), 7,467,54 (м, 3H), 7,28-7,40 (м, 2 Н), 7,20-7,26 (м, 1 Н), 5,45 (с, 2 Н), 4,14 (д, J=5,56 Гц, 2 Н), 1,30 (с, 9 Н). Пример 28. N-(5-Гидрокси-6-метил-2-[(2-нитрофенил)метил]-3-оксо-2,3-дигидро-4-пиридазинилкарбонил)глицин. 28 а) Этил 3-(2Z)-2-[2-(этилокси)-1-метил-2-оксоэтилиден]гидразино-3-оксопропаноат. Этил-3-гидразино-3-оксопропионат (0,73 г, 5,00 ммоль) и каталитическую AcOH (0,06 мл,1,05 ммоль) добавляли к раствору этилпирувата (0,55 мл, 5,00 ммоль) в CH2Cl2 (20 мл). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Растворитель удаляли при пониженном давлении и полученное твердое вещество обрабатывали несколько раз с образованием азеотропа с толуолом. Продукт очищали колоночной хроматографией (SiO2, 1-5% MeOH/CH2Cl2) с получением указанного в заголовке соединения в виде белого твердого вещества (1,29 г, 63%). 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 10,64-11,20 (м, 1 Н), 4,03-4,28 (м, 4 Н), 3,47-3,68 (м, 2 Н), 1,962,11 (м, 3H), 1,12-1,32 (м, 6 Н). 28b) Этил 5-гидрокси-6-метил-3-оксо-2,3-дигидро-4-пиридазинкарбоксилат.DBU (1,6 мл, 10,73 ммоль) добавляли по каплям к раствору соединения примера 28 а) (1,31 г,5,36 ммоль) в 1,4-диоксане (12 мл) при комнатной температуре. Реакционную смесь нагревали до кипения с обратным холодильником и перемешивали в течение ночи. Реакционную смесь охлаждали до комнатной температуры и растворитель удаляли при пониженном давлении. Продукт очищали путем пропускания через слой силикагеля и промывания MeOH с получением указанного в заголовке соединенияH ЯМР (400 МГц, ДМСО-d6)м.д. 1,27 (т, J=7,20 Гц, 3H), 2,17 (с, 3H), 4,27 (кв, J=7,24 Гц, 2 Н),12,13 (ушир.с, 1 Н), 12,59 (с, 1 Н). 28 с) Этил 5-гидрокси-6-метил-2-[(2-нитрофенил)метил]-3-оксо-2,3-дигидро-4 пиридазинкарбоксилат. Гидрид натрия (50 мг, 1,26 ммоль) добавляли к раствору соединения примера 28b) (100 мг,0,50 ммоль) в N,N-диметилформамиде (ДМФА) (2 мл) при 0 С. Температуру реакции доводили до комнатной температуры и реакционную смесь перемешивали в течение 45 мин. Затем температуру снижали до 0 С и добавляли 2-нитробензилбромид (109 мг, 0,50 ммоль). Температуру реакции доводили до комнатной температуры и реакционную смесь перемешивали в течение 3 ч с последующим добавлением 1 н.HCl. Раствор разбавляли EtOAc и H2O и слои разделяли. Водный слой снова экстрагировали EtOAc несколько раз. Объединенные органические слои промывали насыщенным раствором соли, сушили(MgSO4), фильтровали и концентрировали. Продукт очищали колоночной хроматографией (SiO2, 0-6% смесь MeOH/CH2Cl2) с получением указанного в заголовке соединения в виде оранжевого масла (83 мг,50%). 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 12,28 (с, 1 Н), 8,08 (дд, J=8,08, 1,26 Гц, 1 Н), 7,70 (тд, J=7,64,1,39 Гц, 1 Н), 7,53-7,61 (м, 1 Н), 7,18 (дд, J=7,71, 0,88 Гц, 1 Н), 5,45 (с, 2 Н), 4,26 (кв, J=7,24 Гц, 2 Н), 2,20 (с,3H), 1,25 (т, J=7,07 Гц, 3H). 28d)N-(5-Гидрокси-6-метил-2-[(2-нитрофенил)метил]-3-оксо-2,3-дигидро-4 пиридазинилкарбонил)глицин. Натриевую соль глицина (43 мг, 0,45 ммоль) добавляли к раствору соединения примера 28 c) (75 мг,0,23 ммоль) в 2-метоксиэтаноле при комнатной температуре. Реакционную смесь нагревали до кипения с обратным холодильником и перемешивали в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли H2O. Раствор фильтровали и добавляли 1 н. HCl для осаждения продукта. Твердое вещество отфильтровывали и промывали H2O и гексанами. Продукт очищали осаждением из смесиCH2Cl2/гексаны с получением указанного в заголовке соединения в виде коричневого твердого вещества 29 а) Этил 6-(4-фторфенил)-5-гидрокси-3-оксо-2-[2-(трифторметил)фенил]метил-2,3-дигидро-4 пиридазинкарбоксилат. Гидрид натрия (40 мг, 1,01 ммоль) добавляли к раствору соединения примера 19c) (112 мг,0,40 ммоль) в N,N-диметилформамиде (ДМФА) при 0 С. Температуру реакции доводили до комнатной температуры и реакционную смесь перемешивали в течение 45 мин. Затем температуру снижали до 0 С и добавляли 2-(трифторметил)бензилбромид (96 мг, 0,40 ммоль). Температуру реакции доводили до комнатной температуры и реакционную смесь перемешивали в течение 3 ч с последующим добавлением 1 н.HCl. Раствор разбавляли EtOAc и H2O и слои разделяли. Водный слой экстрагировали EtOAc несколько раз. Объединенные органические слои промывали насыщенным раствором соли, сушили (MgSO4),фильтровали и концентрировали. Продукт очищали колоночной хроматографией (SiO2, 1-5% смесьN-[(6-(4-Фторфенил)-5-гидрокси-3-оксо-2-[2-(трифторметил)фенил]метил-2,3-дигидро-4 пиридазинил)карбонил]глицин. Натриевую соль глицина (68 мг, 0,70 ммоль) добавляли к раствору соединения примера 29a)(153 мг, 0,35 ммоль) в 2-метоксиэтаноле (1,5 мл) при комнатной температуре. Реакционную смесь нагревали до кипения с обратным холодильником и перемешивали в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли H2O. Раствор фильтровали и добавляли 1 н. HCl для осаждения продукта. Твердое вещество отфильтровывали и промывали H2O, гексанами и Et2O с получением указанного в заголовке соединения в виде бледно-розового твердого вещества (71 мг, 44%). 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 15,75 (с, 1 Н), 12,99 (с, 1 Н), 10,03 (т, J=5,18 Гц, 1 Н), 8,11 (дд,J=8,08, 1,26 Гц, 1 Н), 7,69 (тд, J=7,64, 1,39 Гц, 1 Н), 7,59 (тд, J=7,71, 1,26 Гц, 1 Н), 7,23 (дд, J=7,83, 1,01 Гц,1 Н), 5,56 (с, 2 Н), 4,09 (д, J=5,81 Гц, 2 Н), 2,24 (с, 3H). 30 а) Этил 3-2-[1-(3,5-дифторфенил)-2-(этилокси)-2-оксоэтилиден]гидразино-3-оксопропаноат. Раствор диэтилоксилата (2,0 мл, 15,0 ммоль) в ТГФ (30 мл) и Et2O (30 ммоль) охлаждали до -78 С. Добавляли по каплям 3,5-дифторфенилмагнийбромид (0,5 М раствор в ТГФ, 36 мл, 18,0 ммоль) и раствор перемешивали в атмосфере азота в течение 1,5 ч при -78 С. Температуру реакции доводили до 0 С и реакцию гасили 6 н. HCl. Дополнительно добавляли Et2O и H2O и слои разделяли. Водную фазу экстрагировали Et2O несколько раз. Объединенные органические слои промывали насыщенным раствором соли,сушили (MgSO4), фильтровали и концентрировали. Продукт очищали колоночной хроматографией (SiO2,15-45% смесь EtOAc/гексаны). Неочищенное масло растворяли в EtOH (40 мл). Этил-3-гидразино-3 оксопропионат (2,63 г, 18,0 ммоль) и каталитическую AcOH (0,2 мл, 3,00 ммоль) добавляли вместе с несколькими взятыми на кончике шпателя порциями MgSO4. Реакционную смесь нагревали с обратным холодильником и перемешивали в течение ночи. Затем реакционную смесь охлаждали до комнатной температуры и фильтровали. Фильтрат концентрировали и остаток обрабатывали несколько раз с образованием азеотропа с толуолом. Продукт очищали колоночной (SiO2, 10-40% смесь EtOAc/гексаны) с получением указанного в заголовке соединения (1,01 г, 20% за 2 стадии). 1KHMDS (0,80 г, 4,01 ммоль) добавляли несколькими порциями к раствору соединения примера 30 а)(0,915 г, 2,67 ммоль) в 1,4-диоксане (15 мл) при комнатной температуре. Реакционную смесь нагревали до кипения с обратным холодильником и перемешивали в течение 1,5 ч. Реакционную смесь охлаждали до комнатной температуры и разбавляли EtOAc и H2O. 1 н. HCl добавляли для нейтрализации раствора. Слои разделяли и водную фазу экстрагировали EtOAc несколько раз. Объединенные органические слои промывали насыщенным раствором соли, сушили (MgSO4), фильтровали и концентрировали с получением остатка бледно-желтого цвета. Колбу с содержимым охлаждали и добавляли Et2O. Продукт фильтровали с получением указанного в заголовке соединения в виде белого твердого вещества (332 мг, 42%). 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 13,19 (с, 1 Н), 7,31-7,45 (м, 3H), 4,31 (кв, J=7,07 Гц, 2 Н), 1,29 (т,J=7,07 Гц, 3H). 30 с) Этил 2-[(2-хлорфенил)метил]-6-(3,5-дифторфенил)-5-гидрокси-3-оксо-2,3-дигидро-4 пиридазинкарбоксилат. Гидрид натрия (38 мг, 0,95 ммоль) добавляли к раствору соединения примера 30b) (113 мг,0,38 ммоль) в N,N-диметилформамиде (1,8 мл) (ДМФА) при 0 С. Температуру реакции доводили до комнатной температуры и реакционную смесь перемешивали в течение 45 мин. Затем температуру снижали до 0 С и добавляли 2-хлорбензилбромид (0,05 мл, 0,38 ммоль). Температуру реакции доводили до комнатной температуры и реакционную смесь перемешивали в течение 3 ч с последующим добавлением 1 н. HCl. Раствор разбавляли EtOAc и H2O и слои разделяли. Водный слой экстрагировали EtOAc несколько раз. Объединенные органические слои промывали насыщенным раствором соли, сушили(MgSO4), фильтровали и концентрировали. Продукт очищали колоночной хроматографией (SiO2, 40-65% смесь EtOAc/гексаны) с получением указанного в заголовке соединения (124 мг, 78%). 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 7,47-7,55 (м, 1 Н), 7,28-7,45 (м, 5 Н), 7,16-7,24 (м, 1 Н), 5,36 (с,2 Н), 4,30 (кв, J=7,24 Гц, 2 Н), 1,28 (т, J=7,07 Гц, 3H). 30d)N-[2-[(2-Хлорфенил)метил]-6-(3,5-дифторфенил)-5-гидрокси-3-оксо-2,3-дигидро-4 пиридазинил]карбонилглицин. Натриевую соль глицина (48 мг, 0,50 ммоль) добавляли к раствору соединения примера 30c)(105 мг, 0,25 ммоль) в 2-метоксиэтаноле (1,5 мл) при комнатной температуре. Реакционную смесь нагревали до кипения с обратным холодильником и перемешивали в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли H2O. Раствор фильтровали и добавляли 1 н. HCl для осаждения продукта. Твердое вещество отфильтровывали и промывали H2O и гексанами с получением указанного в заголовке соединения (81 мг, 72%). 1
МПК / Метки
МПК: C07D 237/16, A61K 31/50, A61P 7/06
Метки: глицина, n-замещенные, производные, гидроксилаз, ингибиторы
Код ссылки
<a href="https://eas.patents.su/30-17112-n-zameshhennye-proizvodnye-glicina-ingibitory-gidroksilaz.html" rel="bookmark" title="База патентов Евразийского Союза">N-замещенные производные глицина: ингибиторы гидроксилаз</a>
Предыдущий патент: Монокристаллический пластинчатый сульфат бария в косметических композициях
Следующий патент: Мутанты мср-1 антагонисты гликозаминогликана и способы их применения
Случайный патент: Способ получения растительных клеток, аккумулирующих каротиноиды, и выделенная днк, используемая для осуществления способа












