Производные 1-(аминоалкоксиарилсульфонил)индола в качестве 5-нт6 лигандов
Номер патента: 16594
Опубликовано: 30.06.2012
Авторы: Схинде Анил Карбхари, Джасти Венкатесварлу, Даулатабад Ананд Виджайкумар, Камбхампати Рама Састри, Дварампуди Ади Редди, Кандикере Нагарадж Вишвоттам, Вишвакарма Сантош, Нироджи Рамакришна
Формула / Реферат
1. Соединение формулы (I)
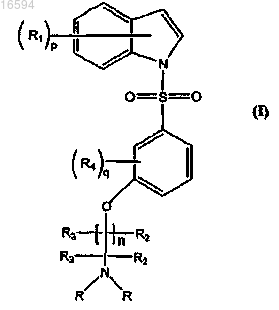
где R1 означает атом водорода, гидроксил, галоген, (С1-С3)алкил или (C1-С3)алкокси;
R означает СН3;
R2, R3 и R4 могут быть одинаковыми или различными и каждый независимо означает атом водорода или (C1-С3)алкил;
"n" равно 0-2;
"р" равно 0-6;
"q" равно 0-4.
2. Соединение по п.1, которое выбрано из группы, включающей
1-[3'-(N,N-диметиламиноэтокси)бензолсульфонил]-1Н-индол;
5-фтор-1-[3'-(N,N-диметиламиноэтокси)бензолсульфонил]-1Н-индол;
5-бром-1-(3'-[N,N-диметиламиноэтокси)бензолсульфонил]-1Н-индол;
5-фтор-1-[3'-(N,N-диметиламинопропокси)бензолсульфонил]-1H-индол;
5-бром-1-[3'-(N,N-диметиламинопропокси)бензолсульфонил]-1H-индол;
1-[3'-(N,N-диметиламинопропокси)бензолсульфонил]-5-метокси-1Н-индол;
1-[4'-метил-3'-(N,N-диметиламиноэтокси)бензолсульфонил]-1H-индол;
5-фтор-1-[4'-метил-3'-(N,N-диметиламиноэтокси)бензолсульфонил]-1Н-индол;
5-бром-1-[4'-метил-3'-(N,N-диметиламиноэтокси)бензолсульфонил]-1Н-индол;
1-[4'-метил-3'-(N,N-диметиламиноэтокси)бензолсульфонил]-5-метокси-1Н-индол;
5-этокси-1-[4'-метил-3'-(N,N-диметиламиноэтокси)бензолсульфонил]-1Н-индол;
6-хлор-1-[4'-метил-3'-(N,N-диметиламиноэтокси)бензолсульфонил]-1Н-индол;
1-[4'-метил-3'-(N,N-диметиламинопропокси)бензолсульфонил]-1H-индол;
5-фтор-1-[4'-метил-3'- (N,N-диметиламинопропокси)бензолсульфонил]-1Н-индол;
5-бром-1-[4'-метил-3'-(N,N-диметиламинопропокси)бензолсульфонил]-1Н-индол;
1-[4'-метил-3'-(N,N-диметиламинопропокси)бензолсульфонил]-5-метокси-1Н-индол;
5-этокси-1-[4'-метил-3'-(N,N-диметиламинопропокси)бензолсульфонил]-1Н-индол;
6-хлор-1-[4'-метил-3'-(N,N-диметиламинопропокси)бензолсульфонил]-1Н-индол;
1-[4'-этил-3'-(N,N-диметиламиноэтокси)бензолсульфонил]-1Н-индол;
5-бром-1-[4'-этил-3'-(N,N-диметиламиноэтокси)бензолсульфонил]-1Н-индол;
1-[4'-этил-3'-(N,N-диметиламиноэтокси)бензолсульфонил]-5-метокси-1Н-индол;
6-хлор-1-[4'-этил-3'-(N,N-диметиламиноэтокси)бензолсульфонил]-1Н-индол;
1-[4'-этил-3'-(N,N-диметиламиноэтокси)бензолсульфонил]-5-фтор-1H-индол;
1-[4'-этил-3'-(N,N-диметиламинопропокси)бензолсульфонил]-1Н-индол;
5-бром-1-[4'-этил-3'-(N,N-диметиламинопропокси)бензолсульфонил]-1Н-индол;
1-[4'-этил-3'-(N,N-диметиламинопропокси)бензолсульфонил]-6-хлор-1Н-индол;
1-[4'-этил-3'-(N,N-диметиламинопропокси)бензолсульфонил]-5-метокси-1Н-индол;
1-[4'-этил-3'-(N,N-диметиламинопропокси)бензолсульфонил]-5-фтор-1Н-индол;
1-[4'-изопропил-3'-(N,N-диметиламиноэтокси)бензолсульфонил]-1Н-индол;
1-[4'-изопропил-3'-(N,N-диметиламиноэтокси)бензолсульфонил]-5-метокси-3-метил-1Н-индол;
1-[4'-изопропил-3'-(1-диметиламино-2-пропокси)бензолсульфонил]-1Н-индол;
1-[4'-изопропил-3'-(2-диметиламино-1-пропокси)бензолсульфонил]-1Н-индол;
1-[4'-изопропил-3'-(N,N-диметиламиноэтокси)бензолсульфонил]-3-метил-1Н-индол;
1-[4'-изопропил-3'-(N,N-диметиламинопропокси)бензолсульфонил]-3-метил-1Н-индол;
1-[4'-изопропил-3'-(N,N-диметиламиноэтокси)бензолсульфонил]-5-метокси-1Н-индол;
1-[4'-изопропил-3'-(N,N-диметиламинопропокси)бензолсульфонил]-5-метокси-1Н-индол;
1-[4'-изопропил-3'-(2-диметиламинопропокси)бензолсульфонил]-5-метокси-1Н-индол;
1-[4'-изопропил-3'-(1-диметиламино-2-пропокси)бензолсульфонил]-5-метокси-1Н-индол;
1- [4'-изопропил-3'-(N,N-диметиламиноэтокси)бензолсульфонил]-5-фтор-1Н-индол;
1-[4'-изопропил-3'-(N,N-диметиламинопропокси)бензолсульфонил]-5-фтор-1Н-индол;
1-[4'-изопропил-3'-(2-диметиламинопропокси)бензолсульфонил]-5-фтор-1Н-индол;
1-[4'-изопропил-3'-(1-диметиламино-2-пропокси)бензолсульфонил]-5-фтор-1Н-индол;
1-[4'-изопропил-3'-(N,N-диметиламиноэтокси)бензолсульфонил]-5-фтор-3-метил-1Н-индол;
1-[4'-изопропил-3'-(N,N-диметиламинопропокси)бензолсульфонил]-5-фтор-3-метил-1Н-индол;
4-хлор-1-[4'-метил-3'-(N,N-диметиламинопропокси)бензолсульфонил]-1Н-индол;
5-метокси-1-[3'-(N,N-диметиламиноэтокси)бензолсульфонил]-1H-индол;
1-[3'-(N,N-диметиламинопропокси)бензолсульфонил]-1Н-индол;
1-[4'-изопропил-3'-(N,N-диметиламинопропокси)бензолсульфонил]-1Н-индол и
их фармацевтически приемлемые соли.
3. Способ получения соединения формулы (I) по п.1, который включает взаимодействие соединения формулы (а)
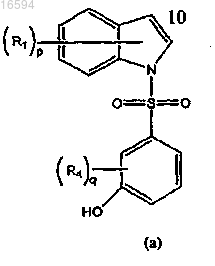
с соединениями хлоралкиламина формулы
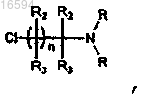
используя основание, выбранное из карбоната калия, бикарбоната натрия или гидрида натрия в присутствии растворителя, выбранного из тетрагидрофурана, толуолаэтилацетата, диметилформамида или диметилсульфоксида, с получением соединения формулы (I), где все заместители имеют значения, как определено в п.1.
4. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель, разбавитель, реципиент или сольват вместе с терапевтически эффективным количеством соединения по п.1 или 2.
5. Фармацевтическая композиция по п.4 для лечения или профилактики клинических состояний, таких как тревога, шизофрения, депрессия, болезнь Альцгеймера, болезнь Паркинсона, удар, травма головы, боль, ожирение, респираторное заболевание, абстиненция при отказе от наркотиков, алкоголя или никотина, расстройство пищевого поведения, расстройство ЦНС, когнитивное расстройство, нейродегенеративное расстройство, нарушение, связанное с дефицитом внимания, обсессивно-компульсивное расстройство, нарушение двигательной функции, желудочно-кишечное расстройство, гематологическое расстройство и генито-урологическое расстройство.
6. Применение соединения по п.1 или 2 для изготовления лекарственного средства для лечения заболеваний, связанных с рецептором 5-НТ6.
7. Применение соединения по п.6 для лечения клинических состояний, таких как тревога, шизофрения, депрессия, болезнь Альцгеймера, болезнь Паркинсона, удар, травма головы, боль, ожирение, респираторное заболевание, абстиненция при отказе от наркотиков, алкоголя или никотина, расстройство пищевого поведения, расстройство ЦНС, когнитивное расстройство, нейродегенеративное расстройство, нарушение, связанное с дефицитом внимания, обсессивно-компульсивное расстройство, нарушение двигательной функции, желудочно-кишечное расстройство, гематологическое расстройство и генито-урологическое расстройство.
Текст
Настоящее изобретение относится к новым аминоалкоксиарилсульфонамидным соединениям формулы (I), их производным, стереоизомерам, фармацевтически приемлемым солям и содержащим их фармацевтически приемлемым композициям. Настоящее изобретение также относится к способам получения указанных выше новых соединений, их производных,стереоизомеров, фармацевтически приемлемых солей и содержащих их фармацевтически приемлемых композиций. Данные соединения полезны для лечения различных расстройств,которые связаны с функцией рецептора 5-НТ 6. Конкретно, соединения настоящего изобретения также полезны для лечения различных расстройств ЦНС, гематологических расстройств,расстройств пищевого поведения, заболеваний, связанных с болью, респираторных заболеваний,генито-урологических расстройств, сердечно-сосудистых заболеваний и рака.(71)(73) Заявитель и патентовладелец: СУВЕН ЛАЙФ САЙЕНСИЗ ЛИМИТЕД (IN) 016594 Настоящее изобретение относится к новым производным 1-(аминоалкоксиарилсульфонил)индола формулы (I), фармацевтически приемлемым солям и содержащим их фармацевтически приемлемым композициям. Настоящее изобретение также относится к способу получения указанных выше новых соединений,фармацевтически приемлемых солей и содержащих их фармацевтически приемлемых композиций. Указанные соединения полезны для лечения различных нарушений, которые связаны с функциями 5-НТ 6 рецепторов. Конкретно, соединения настоящего изобретения также полезны для лечения различных нарушений ЦНС, гематологических нарушений, нарушений пищевого поведения, заболеваний, связанных с болью, респираторных заболеваний, генито-урологических расстройств, сердечно-сосудистых заболеваний и рака. Полагают, что различные нарушения центральной нервной системы, такие как тревога, депрессия,нарушения двигательной функции и т.д., включают поражение нейротрансмиттера 5 гидрокситриптамина (5-НТ) или серотонина. Серотонин находится в центральной и периферической нервной системе и, как известно, оказывает воздействие на многие типы состояний, включая, среди прочего, психиатрические расстройства, двигательную активность, пищевое поведение, сексуальную активность и нейроэндокринную регуляцию. Подтипы 5-НТ рецепторов регулируют различные эффекты серотонина. Известное семейство 5-НТ рецепторов включает семейство 5-HT1 (например, 5-НТ 1A), семейство 5-НТ 2 (например, 5-НТ 2A), подтипы 5-НТ 3, 5-НТ 4, 5-НТ 5, 5-НТ 6 и 5-НТ 7. Подтип рецептора 5-НТ 6 впервые клонировали в 1993 из ткани крыс (Monsma, F.J.; Shen, Y.; Ward,R.P.; Hamblin, M.W., Sibley, D.R., Molecular Pharmacology, 1993, 43, 320-327) и впоследствии из ткани человека (Kohen, R.; Metcalf, M.A.; KhaN, N.; Druck, Т.; Huebner, K.; Sibley, D.R., Journal of Neurochemistry, 1996, 66, 47-56). Данный рецептор представляет собой рецептор, связанный с белком G-5 (GPCR),позитивно связанный с аденилатциклазой (Ruat, М.; Traiffort, Е.; Arrang, J-M.; Tardivel-Lacombe, L.; Diaz,L.; Leurs, R.; Schwartz, J-C, Biochemical Biophysical Research Communications, 1993, 193, 268-276). У крыс и у людей данный рецептор обнаружен почти исключительно в области центральной нервной системы(ЦНС). Исследования in situ гибридизации рецептора 5-НТ 6 в головном мозге крыс с использованием мРНК показывают основную локализацию в областях предполагаемого присутствия 5-НТ, в том числе в стриатуме, прилегающем ядре, обонятельном бугорке и гиппокампальной структуре (Ward, R.P.; Hamblin,M.W.; Lachowicz, J.E.; Hoffman, B.J.; Sibley, D.R.; Dorsa, D.M., Neuroscience, 1995, 64, 1105-1111). Наивысшие уровни мРНК рецепторов 5-НТ 6 наблюдают в обонятельном бугорке, стриатуме, прилегающем ядре, зубчатой извилине головного мозга, а также CA1, СА 2 и СА 3 областях гиппокампа. Наименьшие уровни мРНК рецепторов 5-НТ 6 наблюдаются в зернистом слое мозжечка, некоторых диэнцефальных ядрах, миндалевидной железе и коре головного мозга. Нозерн-блоттинг исследование выявило, что мРНК рецептора 5-НТ 6 присутствует, по-видимому, исключительно в головном мозге при незначительных признаках ее присутствия в периферических тканях. Высокая аффинность ряда антипсихотических агентов в отношении рецептора 5-НТ 6, локализация его мРНК в стриатуме, обонятельном бугорке и прилегающем ядре предполагает, что некоторое клиническое действие указанных соединений может быть опосредовано данным рецептором. Его способность связываться с широким диапазоном применяемых в психиатрии терапевтических соединений, в сочетании с его интригующим распределением в головном мозге, имеет стимулированную значительную заинтересованность в новых соединениях, которые способны взаимодействовать с указанным рецептором(ссылка: Sleight, A.J. et al. (1997) "Рецепторы 5-НТ 6 и 5-НТ 7: молекулярная биология, функциональные корреляции и возможные терапевтические показания", Drug News Perspect. 10, 214-224). Были приложены существенные усилия, чтобы понять возможную роль рецептора 5-НТ 6 в психиатрии, когнитивной дисфункции, двигательной функции и регуляции, памяти, настроении и подобном. Предпринимаются настоятельные попытки поиска соединений, которые демонстрируют аффинность связывания в отношении рецептора 5-НТ 6, как вспомогательных агентов при изучении рецептора 5-НТ 6 и потенциальных терапевтических агентов для лечения нарушений центральной нервной системы, см., например, работуMonsma F.J. et al. (1993) и Kohen, R. et al. (2001) показали, что некоторые трициклические антидепрессантные соединения, такие как амитриптилин, и нетипичные антидепрессантные соединения, такие как миансерин, имеют высокую аффинность в отношении рецептора 5-НТ 6. Эти открытия привели к гипотезе, что рецептор 5-НТ 6 включен в патогенез и/или лечение аффективных расстройств. Модели беспокойного поведения у грызунов дают противоречивые результаты относительно роли рецептора 5-НТ 6 в состоянии беспокойства. Обработка антагонистами рецептора 5-НТ 6 повышает судорожный порог у крыс в тесте с максимальным электросудорожным шоком [Stean, Т. et al. (1999), "Anticonvulsant properties of theselective 5-НТ 6 receptor antagonist SB-271046 in the rat maximal electroshock threshold test", Br. J. Pharmacol. 127, 131P; Routledge, С. et al. (2000), "Characterization of SB-271046: a potent, selective and orally active 5HT6 receptor antagonist", Br. J. Pharmacol. 130, 1606-1612]. Хотя эти данные указывают на то, что рецепторы 5-HT6 могут регулировать порог начала приступа, эффект не является резко выраженным, как для известных противосудорожных лекарственных препаратов. Понимание авторами роли лигандов рецептора 5-НТ 6 является наиболее продвинутым для двух терапевтических симптомов, при которых данный рецептор, по-видимому, играет главную роль: обучаемость и дефицит памяти, и аномальное пищевое поведение. Пока не установлена точная роль рецептора 5-НТ 6 при других симптомах ЦНС, таких как тревога; хотя в настоящее время один 5-НТ 6 агонист дошел до клинических испытаний фазы I, точную роль рецептора еще следует установить, и она находится в центре важного исследования. Существует множество потенциальных терапевтических применений для лигандов рецептора 5-НТ 6 на людях, основанных на прямых эффектах и указаниях из доступных научных исследований. Эти исследования включают изучение локализации рецептора, аффинности лигандов при известной in vivo активности и проводимые до настоящего времени различные исследования на животных. Соединения-антагонисты рецепторов 5-НТ 6 предпочтительно пользуются спросом в качестве терапевтических агентов. Одним потенциальным терапевтическим применением модуляторов функций рецепторов 5-НТ 6 является улучшение когнитивной функции и памяти при таких заболеваниях человека, как болезнь Альцгеймера. Высокие уровни рецептора, обнаруженные в таких структурах, как передний мозг, включая хвостатое ядро/скорлупу, гиппокамп, прилегающее ядро и кору головного мозга, предполагают некую роль для рецептора в функции памяти и когнитивной функции, так как эти области, как известно, играют жизненно важную роль в функции памяти (Gerard, С.; Martres, М.Р.; Lefevre, К.; Miquel, M.C; Verge, D.;Lanfumey, R.; Doucet, E.; Hamon, M; El Mestikawy, S., Brain Research, 1997, 746, 207-219). Способность известных лигандов рецептора 5-НТ 6 усиливать холинергическую трансмиссию также содействует потенциальному когнитивному применению (Bentey, J.C.; Boursson, A.; Boess, F.G.; Kоnе, F.C.; Marsden,С.A.; Petit, N.; Sleight, A.J., British Journal of Pharmacology, 1999, 126(7), 1537-1542) . В исследованиях обнаружено, что известный селективный 5-НТ 6 антагонист значительно повышает уровни глутамата и аспартата в лобной коре, не повышая уровней норадреналина, допамина или 5-НТ. Это селективное повышение содержания некоторых нейрохимических веществ отмечается в процессе запоминания и познания и строго предполагает некоторую роль 5-НТ 6 лигандов в когнитивной функции(Dawson, L.A.; Nguyen, H.Q.; Li, P. British Journal of Pharmacology, 2000, 130 (1), 23-26). Исследования на животных памяти и обучаемости при использовании известного селективного 5-НТ 6 антагониста имеют некоторые положительные эффекты (Rogers, D.C.; Hatcher, P.D.; Hagan, J. J. Society of Neuroscience, Abstracts, 2000, 26, 680). Лиганды 5-НТ 6 находят соответствующее потенциальное терапевтическое применение при лечении расстройств, характеризующихся дефицитом внимания (ADD, также известных как расстройства, характеризующиеся гиперактивностью при дефиците внимания, или ADHD), у детей и взрослых. Так как 5 НТ 6 антагонисты, по-видимому, повышают активность нигростриатального допаминового пути, и ADHD связано с анормальностями в хвостатом ядре (Ernst, M.; Zametkin, A.J.; Matochik, J.Н.; Jons, P.A.; Cohen,R.M., Journal of Neuroscience, 1998, 18(15), 5901-5907), 5-НТ 6 антагонисты могут ослаблять расстройство,характеризующееся дефицитом внимания. В настоящее время имеется несколько вполне селективных агонистов. В настоящий момент на фазеI испытаний находится агонист WAY-181187 (Wyeth), целью воздействия которого является состояние тревоги [Cole, D.C. et al. (2005), "Discovery of a potent, selective and orally active 5-HT6 receptor agonist,WAY-181187", 230th ACS Natl. Meet. (Aug 28-Sept 1, Washington DC), Abstract MEDI 17]. В международной патентной публикации WO 03/066056 A1 сообщается, что антагонизм рецептора 5-НТ 6 может промотировать рост нейронов в центральной нервной системе млекопитающего. В другой международной патентной публикации WO 03/065046 А 2 раскрыт новый вариант человеческого рецептора 5-НТ 6 и предполагается, что рецептор 5-НТ 6 связан со многими другими расстройствами. Ранние исследования, изучающие аффинность различных лигандов ЦНС с известной терапевтической применимостью или строгим структурным сходством с известными лекарственными средствами,предполагают роль 5-НТ 6 лигандов при лечении шизофрении и депрессии. Например, клозапин (эффективный клинический антипсихотический препарат) имеет высокую аффинность в отношении 5-НТ 6 подтипа рецептора. Также некоторые клинические антидепрессанты имеют высокую аффинность в отношении данного рецептора, а также действуют как антагонисты на данном участке (Branchek, T.A.,-2 016594Blackburn, T.P., Annual Reviews in Pharmacology and Toxicology, 2000, 40, 319-334). Кроме того, последние in vivo исследования на крысах показывают, что модуляторы 5-НТ 6 могут быть полезны при лечении двигательных расстройств, в том числе эпилепсии (Stean, Т.; Routledge, С.;Brown, A.M., British Journal of Pharmacology, 2000, 30 (7), 1606-1612). Взятые вместе, приведенные выше исследования решительно предполагают, что соединения, которые являются модуляторами рецептора 5-НТ 6, т.е. лигандами, могут быть полезны при терапевтических показаниях, в том числе для лечения заболеваний, связанных с дефицитом памяти, когнитивной функции и обучаемости, таких как болезнь Альцгеймера и расстройство, характеризующееся дефицитом внимания; для лечения расстройства личности, такого как шизофрения; для лечения расстройства поведения,например тревоги, депрессии и навязчивых компульсивных расстройств; для лечения нарушений двигательной или моторной функции, такой как болезнь Паркинсона и эпилепсия; для лечения заболеваний,связанных с нейродегенерацией, таких как удар или травма головы; или абстиненции при отказе от наркотиков, в том числе никотина, алкоголя и других веществ. Ожидается также, что такие соединения пригодны при лечении некоторых желудочно-кишечных(GI) расстройств, например функционального кишечного расстройства. См., например, работы Roth, B.L.et al., Journal of Pharmacology and Experimental Therapeutics, 1994, 268, pages 1403-1412; Sibley, D.R. et al.,Molecular Pharmacology, 1993, 43, 320-327, Sleight, A.J. et al., Neurotransmission, 1995, 11, 1-5 и Sleight,A.J. et al., Serotonin ID Research Alert, 1997, 2(3), 115-118. Кроме того, сообщается об эффекте антагониста 5-НТ 6 и антисмысловых олигонуклеотидов 5-НТ 6 на снижение потребления пищи у крыс и, следовательно, потенциально на лечение ожирения. См., например, работы Bentey, J.C.; Boursson, A.; Boess, F.G.; Kоnе, F.C; Marsden, С.A.; Petit, N.; Sleight, A.J.,British Journal of Pharmacology, 1999, 126 (7), 1537-1542); Wooley et al., Neuropharmacology, 2001, 41: 210129 и WO 02/098878. В последнем обзоре Holenz, Jorg et al., Drug Discovery Today, 11, 7/8, April 2006, "Стратегии медицинской химии в отношении лигандов рецептора 5-НТ 6 как потенциальных когнитивных усилителей и агентов против ожирения" дано подробное обсуждение эволюции лигандов 5-НТ 6. В нем суммированы фармакологические инструменты и предклинические кандидаты, используемые для оценки рецептора 5 НТ 6 при таких заболеваниях как шизофрения, другие допаминсвязанные нарушения и депрессия, и для получения профиля нейрохимических и электрофизиологических эффектов блокады или активации рецепторов 5-НТ 6. Кроме того, они применяются для характеристики рецептора 5-НТ 6 и исследования его распределения. Пока лишь несколько клинических кандидатов образуют часть структур индольного типа и структурно близки эндогенному лиганду 5-НТ, например, соединения из работ Glennon, R.A. et al. "2Substituted tryptamines: agents with selectivity for 5-HT6 serotonin receptors", J. Med. Chem., 43, 1011-1018,2000; Tsai, Y. et al., "N1-(Bensenesulfonyl)triptamines as novel 5-HT6 antagonists", Bioorg. Med. Chem. Lett. 10, 2295-2299, 2000; Demchyshyn L. et al. "ALX-1161: pharmacological properties of a potent and selective 5HT6 receptor antagonist", 31-st Annu. Meet. Soc. Neurosci. (Nov 10-15), Abstract 266, 6, 2001; Slassi, A. et al.Lett. 15, 4230-4234, 2005. Зависимости от структурной функциональности описаны в разделе, касающемся структур, подобных индолу (и в рецептор-моделирующем исследовании, где Pullagurla et al. утверждают наличие различных сайтов связывания для агонистов и антагонистов [Pullagurla, M.R. et al. (2004) "Possible differences in modes of agonist and antagonist binding at human 5-HT6 receptors", Bioorg. Med. Chem. Lett. 14,4569-4573]. Большинство антагонистов, о которых сообщается, составляют часть моноциклических, бициклических и трициклических арилпиперазиновых классов [Bromidge, S.M. et al. (1999) "5-Chloro-N-(4methoxy-3-piperazin-1-ylphenyl)-3-methyl-2-benzothiophenesulfonamide (SB-271046); A potent, selective and"Ro 63-0563: Potent and selective antagonists at human and rat 5-HT6 receptors", Br. J. Pharmacol. 124,(556-562). Антагонист-кандидат, находящийся на фазе II исследований, от GlaxoSmithKIine, SB-742457,-3 016594 для терапевтических симптомов когнитивной дисфункции, связанной с болезнью Альцгеймера [Ahmed,M. et al. (2003), Novel compounds, WO патент 2003080580], и соединение LY-483518 (Lilly) [Filla, S.A. etal. (2002) "Preparation of benzenesulfonic acid indol-5-yl esters as antagonists of the 5-HT6 receptor", WO 2002060871]. Клинические испытания SB-271046, первого антагониста рецептора 5-НТ 6, поступившего на клинические исследования фазы I, были прерваны (вероятно, из-за низкой проницаемости гемоэнцефалического барьера). Кроме того, селективный антагонист 5-НТ 6 рецептора SB-271046 неактивен в исследованиях на животных в отношении позитивных или негативных симптомов шизофрении [Pouzet, В.et al. (2002) "Effects of the 5-HT6 receptor antagonist, SB-272046, in animal models for schizophrenia", Pharmacol. Biochem. Behav., 71, 635-643]. В Международных патентных публикациях WO 2004/055026 A1, WO 2004/048331 A1, WO 2004/048330 A1 и WO 2004/048328 A2 (все принадлежат Suven Life Sciences Limited) описаны относящиеся к делу прототипы. Кроме того, в WO 98/27081, WO 99/02502, WO 99/37623, WO 99/42465 и WO 01/32646 (все принадлежат Glaxo SmithKline Beecham PLC) раскрыт ряд арилсульфонамидных и сульфоксидных соединений в качестве антагонистов рецепторов 5-НТ 6 и заявлено, что они полезны для лечения различных нарушений ЦНС. Притом что раскрыты некоторые 5-НТ 6 модуляторы, сохраняется потребность в соединениях, которые пригодны для модуляции 5-НТ 6. Неожиданно обнаружено, что аминоалкоксиарилсульфонамидные соединения формулы (I) демонстрируют очень высокую аффинность в отношении рецептора 5-НТ 6. Следовательно, задачей настоящего изобретения является обеспечение соединений, которые пригодны в качестве терапевтических агентов при лечении различных расстройств центральной нервной системы или нарушений, вызванных рецепторами 5-НТ 6. Настоящее изобретение относится к новым аминоалкоксиарилсульфонамидным соединениям формулы (I), их стереоизомерам, фармацевтически приемлемым солям и содержащим их фармацевтически приемлемым композициям.R2, R3 и R4 могут быть одинаковыми или различными и каждый независимо означает атом водорода или (C1-C3)алкил; "n" равно 0-2; "р" равно 0-6; "q" равно 0-4. Настоящее изобретение относится к применению терапевтически эффективного количества соединения формулы (I) для изготовления лекарственного средства для лечения или профилактики расстройства, обладающего селективной аффинностью в отношении рецептора 5-НТ 6. Конкретно, соединения настоящего изобретения также полезны для лечения различных расстройств ЦНС, гематологических нарушений, расстройств пищевого поведения, заболеваний, связанных с болью,респираторных заболеваний, генито-урологических нарушений, сердечно-сосудистых заболеваний и рака. В другом аспекте изобретение относится к фармацевтическим композициям, содержащим терапевтически эффективное количество по меньшей мере одного соединения формулы (I) или его индивидуального стереоизомера, рацемической или нерацемической смеси стереоизомеров или фармацевтически приемлемые соли в смеси по меньшей мере с одним подходящим носителем. В другом аспекте изобретение относится к композициям, содержащим соединения формулы (I) и способам их применения. Еще в одном аспекте изобретение относится к применению терапевтически эффективного количества соединения формулы (I) для изготовления лекарственного средства для лечения или профилактики расстройства, обладающего селективной аффинностью в отношении рецептора 5-НТ 6. Еще в одном аспекте изобретение, кроме того, относится к способу получения соединений формулы (I). Далее приведен неполный список соединений, описываемых общей формулой (I): 1-[3'-[N,N-диметиламиноэтокси)бензолсульфонил]-1 Н-индол; 5-фтор-1-[3'-N,N-диметиламиноэтокси)бензолсульфонил]-1 Н-индол; 5-бром-1-(3'-[N,N-диметиламиноэтокси)бензолсульфонил]-1 Н-индол;-5 016594 гидрохлорид 5-фтор-1-[4'-этил-3'-(пиперидин-4-илокси)бензолсульфонил]-1 Н-индола; 3-бром-5-фтор-1-[4'-этил-3'-(1-метилпиперидин-4-илокси)бензолсульфонил]-1 Н-индол; 6-бром-1-[4'-этил-3'-(1-метилпиперидин-4-илокси)бензолсульфонил]-1 Н-индол; 1-[4'-этил-3'-(1-метилпиперидин-4-илокси)бензолсульфонил]-1 Н-индол; 6-хлор-1-[4'-этил-3'-(1-метилпиперидин-4-илокси)бензолсульфонил]-1 Н-индол; 5-фтор-1-[4'-этил-3'-(1-метилпиперидин-4-илокси)бензолсульфонил]-1 Н-индол; 5-фтор-3-метил-1-[4'-изопропил-3'-(1-метилпиперидин-4-илокси)бензолсульфонил]-1 Н-индол; 5-бром-1-[4'-изопропил-3'-(1-метилпиперидин-4-илокси)бензолсульфонил]-1 Н-индол; 5-бром-1-[4'-хлор-3'-(1-метилпиперидин-4-илокси)бензолсульфонил]-1 Н-индол; 6-метокси-1-[4'-хлор-3'-(1-метилпиперидин-4-илокси)бензолсульфонил]-1 Н-индол; 5-бром-1-[4'-этил-3'-(1-метилпиперидин-4-илокси)бензолсульфонил]-1 Н-индол; 6-хлор-1-[3'-(1-метилпиперидин-4-илокси)бензолсульфонил]-lH-индол; гидрохлорид 6-хлор-1-[4'-хлор-3'-(пиперидин-4-илокси)бензолсульфонил]-1 Н-индола; 4-хлор-1-[4'-метил-3'-(N,N-диметиламинопропокси)бензолсульфонил]-1 Н-индол; 5-метокси-1-[3'-(N,N-диметиламиноэтокси)бензолсульфонил]-1H-индол; 1-[3'-(N,N-диметиламинопропокси)бензолсульфонил]-1 Н-индол; 1-[4'-изопропил-3'-(N,N-диметиламинопропокси)бензолсульфонил]-1 Н-индол; 5-хлор-1-[4'-хлор-3'-(1-метилпиперидин-4-илокси)бензолсульфонил]-1 Н-индол; 1-[4'-хлор-3'-(1-метилпиперидин-4-илокси)бензолсульфонил]-5-метокси-3-метил-1H-индол; 1-[4'-этил-3'-(1-метилпиперидин-4-илокси)бензолсульфонил]-5-фтор-3-метил-1H-индол; их стереоизомеры и соли. Если не указано иное, следующие термины, используемые в данном описании и формуле изобретения, имеют приведенные ниже значения: термин "галоген" означает фтор, хлор, бром или йод; термин " (С 1-С 3)алкил" означает линейные или разветвленные алкильные радикалы, содержащие от одного до трех атомов углерода, и включает метил, этил, н-пропил и изопропил; термин " (C1-C3)алкокси" означает линейные или разветвленные алкильные радикалы, содержащие от одного до трех атомов углерода, и включает метокси, этокси, пропилокси и изопропилокси; Термин "шизофрения" означает шизофрению, шизофреноподобное расстройство, шизоаффективное расстройство и психотическое расстройство, где термин "психотическое" относится к иллюзиям, отчетливым галлюцинациям, дезорганизованной речи или дезорганизованному или бессознательному поведению. См. руководство "Diagnostic and Statistical Manual of Mental Disorder", издание четвертое, AmericanPsychiatric Association, Washington, D.C. Выражение "фармацевтически приемлемый" указывает, что вещество или композиция должна быть химически и/или токсикологически совместима с другими ингредиентами, составляющими препарат,предназначенный для лечения млекопитающего."Терапевтически эффективное количество" определяют как "количество соединения по настоящему изобретению, которое (i) лечит или предотвращает отдельное заболевание, состояние или расстройство;(ii) ослабляет, улучшает или устраняет один или более симптомов отдельного заболевания, состояния или расстройства; (iii) предотвращает или задерживает появление одного или более симптомов отдельного описанного в данном описании заболевания, состояния или расстройства". Выражения "обработка", "лечить" или "лечение" охватывают все средства, такие как предупредительные, профилактические и паллиативные. Термин "стереоизомеры" является общим обозначением для всех изомеров индивидуальных молекул, которые отличаются только ориентацией своих атомов в пространстве. Он включает зеркальные изомеры (энантиомеры), геометрические (цис-транс) изомеры и изомеры соединений, имеющих более одного хирального центра, которые не являются зеркальными изображениями друг друга (диастереомеры). Некоторые соединения формулы (I) способны существовать в виде стереоизомерных форм (например, диастереомеров и энантиомеров) и изобретение распространяется на каждую из таких стереоизомерных форм и их смеси, включая рацематы. Различные стереоизомерные формы можно отделить друг от друга обычными способами или можно получить любой заданный изомер посредством стереоспецифического или асимметрического синтеза. Изобретение также распространяется на таутомерные формы и их смеси. Стереоизомеры, как правило, получают в виде рацематов, которые можно разделить известными способами на оптически активные изомеры в чистом виде. В случае соединений общей формулы (I),имеющих асимметрический атом углерода, настоящее изобретение относится к D-формам, L-формам иD,L-смесям, в случае нескольких асимметрических атомов углерода и диастереомерных форм изобретение распространяется на каждую из таких стереоизомерных форм и их смеси, включая рацематы. Соединения общей формулы (I), которые имеют асимметрический атом углерода и, как правило, образуются в виде рацематов, можно отделить друг от друга обычными способами или можно получить любой заданный изомер посредством стереоспецифического или асимметрического синтеза. Однако можно также-6 016594 использовать оптически активное исходное соединение, тогда конечное соединение получают в виде соответствующего оптически активного энантиомерного или диастереомерного соединения. Стереоизомеры соединений общей формулы (I) можно получить одним или несколькими способами, представленными ниже:i) Можно использовать один или более реагентов в виде их оптически активных форм.ii) В процессе восстановления можно использовать оптически чистый катализатор или хиральные лиганды вместе с металлическим катализатором. Металлический катализатор может представлять собой родий, рутений, индий и подобные. Хиральные лиганды предпочтительно могут представлять собой хиральные фосфины (Principles of Assymmetric synthesis, J.E. Baldwin Ed., Tetrahedron series, 14, 311-316).iii) Смесь стереоизомеров можно разделить обычными способами, такими как получение диастереомерных солей с хиральными кислотами, или хиральными аминами, или хиральными аминоспиртами,или хиральными аминокислотами. Затем можно разделить полученную смесь диастереомеров такими методами, как фракционированная кристаллизация, хроматография и подобные, с последующей дополнительной стадией выделения оптически активного продукта посредством гидролиза производногоiv) Смесь стереоизомеров можно разделить обычными способами, такими как микробное разделение, разделение диастереомерных солей, образованных с хиральными солями или хиральными основаниями. Хиральными кислотами, которые можно использовать, могут быть винная кислота, миндальная кислота, молочная кислота, камфорсульфоновая кислота, аминокислоты и подобные. Хиральными основаниями, которые можно использовать, могут быть алкалоиды хинного дерева, бруцин или основные аминокислоты, например лизин, аргинин и подобные. В случае соединений общей формулы (I), имеющих геометрическую изомерию, настоящее изобретение относится ко всем таким геометрическим изомерам. Подходящие фармацевтически приемлемые соли очевидны для специалистов в данной области и включают соли, описанные в J. Pharm. Sci., 1977, 66, 1-19, такие как аддитивные соли кислот, образованные с неорганическими кислотами, например хлористо-водородной, бромисто-водородной, серной, азотной или фосфорной кислотой; и органическими кислотами, например янтарной, малеиновой, уксусной,фумаровой, лимонной, винной, бензойной, паратолуолсульфоновой, метансульфоновой или нафталинсульфоновой кислотой. В объем настоящего изобретения включены все возможные стехиометрические и нестехиометрические формы. Фармацевтически приемлемые соли, составляющие часть настоящего изобретения, можно получить, обрабатывая соединение формулы (I) 1-6 эквивалентами основания, такого как гидрид натрия, метилат натрия, этилат натрия, гидроксид натрия, трет-бутилат калия, гидроксид кальция, ацетат кальция,хлорид кальция, гидроксид магния, хлорид магния и подобные. Можно использовать растворители, такие как вода, ацетон, эфир, ТГФ, метанол, этанол, трет-бутанол, диоксан, изопропанол, изопропиловый эфир или их смеси. Кроме фармацевтически приемлемых солей в изобретение включены другие соли. Они могут служить промежуточными продуктами при очистке соединений, при получении других солей или для идентификации и характеристики соединений или промежуточных продуктов. Соединения формулы (I) можно получить в кристаллической или некристаллической форме, и в случае кристаллической формы соединение необязательно может представлять собой сольват, например гидрат. Настоящее изобретение также относится к способу получения соединения формулы (I) или его фармацевтически приемлемой соли, который включает взаимодействие соединения формулы (а) используя основание, выбранное из карбоната калия, бикарбоната натрия или гидрида натрия в присутствии растворителя, выбранного из тетрагидрофурана, толуолаэтилацетата, диметилформамида или диметилсульфоксида, с получением соединения формулы (I), где все заместители имеют значения,как определено в п.1. Инертную атмосферу можно поддерживать, используя инертные газы, напримерN2, Ar или Hе. На взаимодействие можно оказывать воздействие в присутствии основания, такого как карбонат калия, бикарбонат натрия, гидрид натрия или их смеси. Температура реакции может составлять от 20 до 150 С в зависимости от выбора растворителя и предпочтительно составляет диапазон от 30 до 100 С. Продолжительность взаимодействия может составлять от 1 до 24 ч, предпочтительно от 2 до 6 ч. Промежуточное соединение (а) можно получить взаимодействием индольного производного с арилсульфонилхлоридами (ArSO2Cl), используя подходящее основание, в присутствии инертного растворителя при подходящей температуре. Используемый при взаимодействии растворитель может быть выбран из ароматических углеводородов, таких как толуол, орто-, мета-, параксилол; галогенированных углеводородов, таких как метиленхлорид, хлороформ и хлорбензол; простых эфиров, таких как диэтиловый эфир, диизопропиловый эфир, трет-бутилметиловый эфир, диоксан, анизол и тетрагидрофуран; нитрилов, таких как ацетонитрил и пропионитрил; спиртов, таких как метанол, этанол, н-пропанол, нбутанол, трет-бутанол, а также ДМФА, ДМСО и воды. Предпочтительный перечень растворителей включает ДМСО, ДМФА, ацетонитрил и ТГФ. Также можно использовать смеси указанных растворителей в различных соотношениях. Используемое при взаимодействии основание может быть выбрано из неорганических соединений, таких как гидроксиды щелочных металлов и гидроксиды щелочноземельных металлов, например, гидроксид лития, гидроксид натрия, гидроксид калия и гидроксид кальция; оксиды щелочных металлов и оксиды щелочно-земельных металлов, например оксид лития, оксид натрия, оксид магния и оксид кальция; гидриды щелочных металлов и гидриды щелочно-земельных металлов, например, гидрид лития, гидрид натрия, гидрид калия и гидрид кальция; амиды щелочных металлов и амиды щелочно-земельных металлов, например амид лития, амид натрия, амид калия и амид кальция; карбонаты щелочных металлов и карбонаты щелочно-земельных металлов, например карбонат лития и карбонат кальция; а также гидрокарбонаты щелочных металлов и гидрокарбонаты щелочноземельных металлов, например гидрокарбонат натрия; металлоорганические соединения, в частности,алкилы щелочных металлов, такие как метиллитий, бутиллитий, фениллитий; алкилмагнийгалогениды,такие как метилмагнийхлорид, и алкилаты щелочных металлов и алкилаты щелочно-земельных металлов, такие как метилат натрия, этилат натрия, этилат калия, трет-бутилат калия и диметоксимагний, дополнительные органические основания, например триэтиламин, триизопропиламин, N-метилпиперидин и пиридин. Особо предпочтительными являются гидроксид натрия, метилат натрия, этилат натрия, гидроксид калия, карбонат калия и триэтиламин. Подходящим образом взаимодействие можно проводить в присутствии катализатора фазового переноса, такого как гидросульфат тетра-н-бутиламмония и подобные. Инертную атмосферу можно поддерживать, используя инертные газы, например N2, Ar или Не. Время взаимодействия можно варьировать от 1 до 24 ч, предпочтительно от 2 до 6 ч, после чего полученное соединение преобразовывают в его соль, если требуется. Соединения, полученные описанным выше способом получения настоящего изобретения, можно трансформировать в другие соединения настоящего изобретения, осуществляя дополнительные химические модификации с применением хорошо известных реакций, таких как окисление, восстановление,введение защиты, удаление защиты, перегруппировка, галогенирование, гидроксилирование, алкилирование, алкилтиолирование, деметилирование, O-алкилирование, O-ацилирование, N-алкилирование, Nалкенилирование, N-ацилирование, N-цианирование, N-сульфонилирование, реакция сочетания с использованием переходных металлов и подобные. Если необходимо, можно выполнить любую (одну или более) из следующих стадий:i) преобразование соединения формулы (I) в другое соединение формулы (1);ii) удаление защитных групп илиiii) образование его фармацевтически приемлемой соли, сольвата или пролекарства. Способ (i) можно осуществить, применяя общепринятые методики взаимного превращения, такие как эпимеризация, окисление, восстановление, алкилирование, нуклеофильное или электрофильное замещение в ароматическом ядре, гидролиз сложного эфира или образование амидной связи. Примеры защитных групп и средства их удаления для способа (ii) можно найти в T.W. Greene "Protective Groups in Organic Synthesis" (J. Wiley and Sons, 1991). Подходящее аминозащитные группы включают сульфонил (например, тозил), ацил (например, ацетил, 2',2',2'-трихлорэтоксикарбонил, бензилоксикарбонил или трет-бутоксикарбонил) и арилалкил (например, бензил), которые можно удалить гидролизом (например, используя кислоту, такую как хлористо-водородная или трифторуксусная кислота) или восстановлением (например, гидрогенолизом бензильной группы или восстановительным удалением 2',2',2'-трихлорэтоксикарбонильной группы с использованием цинка в уксусной кислоте), по обстановке. Другие подходящие аминозащитные группы включают трифторацетил, который можно удалить гидролизом, катализируемым основанием, или связанную с твердофазной смолой бензильную группу, например, связанную со смолой Меррифилда 2,6-диметоксибензильную группу (линкер Ellman), которую можно удалить гидролизом, катализируемым кислотой, например трифторуксусной кислотой. В способе (iii) галогенирование, гидроксилирование, алкилирование и/или фармацевтически приемлемые соли можно получить обычным образом путем взаимодействия с подходящей кислотой или производным кислоты, как подробно описано выше. Для применения соединений формулы (I) в терапии их обычно готовят в виде фармацевтических-8 016594 композиций согласно стандартной фармацевтической практике. Фармацевтические композиции по настоящему изобретению можно получить обычным способом,используя один или более фармацевтически приемлемых носителей. Таким образом, активные соединения настоящего изобретения можно изготовить в виде композиций для перорального, буккального, внутриносового, парентерального (например, внутривенного, внутримышечного или подкожного) или ректального введения или в виде формы, подходящей для введения путем ингаляции или инсуффляции. Для перорального введения фармацевтические композиции могут иметь, например, форму таблеток или капсул, полученных обычными способами с фармацевтически приемлемыми эксципиентами, такими как связующие (например, предварительно желатинированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или фосфат кальция); лубриканты (например, стеарат магния, тальк или диоксид кремния); разрыхлители (например, картофельный крахмал или натрийкрахмал гликолат); или смачивающие агенты (например, лаурилсульфат натрия). На таблетки можно нанести покрытие способами, хорошо известными в данной области. Жидкие препараты для перорального введения могут иметь, например, форму растворов, сиропов или суспензий, или они могут представлять собой сухой продукт для разведения водой или другим подходящим носителем непосредственно перед применением. Такие жидкие препараты можно получить обычными способами с фармацевтически приемлемыми добавками, такими как суспендирующие агенты (например, сироп сорбита, метилцеллюлоза или гидрированные пищевые жиры); эмульгаторы (например, лецитин или аравийская камедь); неводные носители (например, миндальное масло, жирные сложные эфиры или этиловый спирт) и консерванты (например, метил- или пропилпарагидроксибензоаты или сорбиновая кислота). Для буккального введения композиция может иметь форму таблеток или лепешек, полученных обычным способом. Активные соединения настоящего изобретения можно изготовить в виде препарата для парентерального введения посредством инъекции, в том числе, с применением обычных методик катетеризации или вливания. Препараты для инъекций можно представить в виде стандартной дозированной формы,например, в ампулах или многодозовых контейнерах с добавлением консерванта. Композиции могут иметь такие формы, как суспензии, растворы или эмульсии в масляных или водных носителях и могут содержать агенты, способствующие получению препарата, например суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, активный ингредиент может быть в виде порошка,предназначенного для восстановления перед применением в подходящем носителе, например стерильной воде, не содержащей пирогенов. Активные соединения настоящего изобретения также можно изготовить в виде композиций для ректального применения, таких как суппозитории или удерживающие клизмы, например, содержащие обычные основы для суппозиториев, такие как масло какао или другие глицериды. Для внутриносового применения или применения посредством ингаляции активные соединения настоящего изобретения обычно доставляют в виде аэрозольного спрея из контейнера или распылителя,находящегося под давлением, или из капсулы, применяя ингалятор или инсуффлятор. В случае аэрозоля,находящегося под давлением, можно определить подходящий пропеллент, например дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, диоксид углерода или другой подходящий газ, и стандартную дозу, снабжая контейнер клапаном для доставки отмеренного количества препарата. Лекарственный препарат для контейнера или распылителя, находящегося под давлением, может содержать раствор или суспензию активного соединения, тогда как препарат для капсулы предпочтительно должен быть в виде порошка. Для применения в ингаляторе или инсуффляторе можно изготовить капсулы и картриджи (изготовленные, например, из желатина), содержащие порошковую смесь соединения настоящего изобретения и подходящей порошковой основы, например лактозы или крахмала. Аэрозольные препараты для лечения указанных выше состояний (например, мигрени) у среднего взрослого человека предпочтительно готовят таким образом, чтобы каждая отмеренная доза или "пшик" аэрозоля содержал от 20 до 1000 мкг соединения настоящего изобретения. Общая дневная доза при использовании аэрозоля составляет от 100 мкг до 10 мг. Введения можно проводить несколько раз в день,например, 2, 3, 4 или 8 раз, вводя каждый раз, например, 1, 2 или 3 дозы. Для получения лекарственного препарата можно использовать эффективное количество соединения общей формулы (I) или его производных, которые определены выше, вместе с обычными фармацевтическими вспомогательными агентами, носителями и добавками. Такая терапия включает множество вариантов: например, одновременное введение двух совместимых соединений в виде единой дозированной формы; или введение каждого соединения индивидуально в виде отдельных доз; или, если требуется, с одинаковым временным интервалом; или отдельно для максимального увеличения благоприятного воздействия или минимизации потенциальных побочных эффектов лекарственных средств согласно известным принципам фармакологии. Дозу активного соединения можно варьировать в зависимости от таких факторов, как способ введения, возраст и масса пациента, природа и тяжесть подлежащего лечению заболевания и подобные факторы. Таким образом, любая приведенная в данном описании ссылка на фармакологически эффективное-9 016594 количество соединения общей формулы (I) относится к приведенным выше факторам. Предполагаемая доза активного соединения настоящего изобретения для перорального, парентерального, носового или буккального введения среднему взрослому человеку с целью лечения указанных выше состояний составляет от 0,1 до 200 мг активного ингредиента на единичную дозу, которую можно вводить, например, от 1 до 4 раз в день. Для иллюстративных целей на представленной в данном описании реакционной схеме показаны потенциальные способы синтеза соединений настоящего изобретения, а также ключевых промежуточных продуктов. Более подробное описание отдельных реакционных стадий см. в разделе "Примеры". Специалистам в данной области очевидно, что можно применять другие синтетические способы для синтеза соединений настоящего изобретения. Хотя на схемах изображены и обсуждаются ниже конкретные исходные соединения и реагенты, их можно легко заменить другими исходными соединениями и реагентами, обеспечивая разнообразные производные и/или условия взаимодействия. Кроме того, многие соединения, полученные описанными ниже способами, можно далее модифицировать в свете данного раскрытия, применяя обычную химию, хорошо известную специалистам в данной области. Коммерческие реагенты используют без дополнительной очистки. Комнатная температура соответствует 25-30 С. ИК-спектры снимают для твердых образцов, используя KBr. Пока не указано иное, все масс-спектры снимают, применяя условия ионизации при электрораспылении (ESI). 1 Н-ЯМР спектры регистрируют при 400 МГц на спектрометре Bruker. В качестве растворителя используют дейтерированный хлороформ (99,8% D). В качестве внутреннего стандарта сравнения используют ТМС. Значения химических сдвигов выражают в миллионных долях . Для обозначения мультиплетности ЯМР-сигналов используют следующие сокращения: с=синглет, ушир.с=широкий синглет, д=дублет, т=триплет,кв=квартет, квин.=квинтет, септ.=септет, дд=дублет дублетов, дт=дублет триплетов, тт=триплет триплетов, м=мультиплет. Термин хроматография относится к колоночной хроматографии, которую проводят с использованием силикагеля 100-200 меш и в атмосфере азота (флэш-хроматография). Примеры Новые соединения настоящего изобретения получают по следующим методикам с использованием подходящих веществ и дополнительно проиллюстрированы следующими специфическими примерами. Любое из таких соединений или все такие соединения, конкретно указанные в данных примерах, являются наиболее предпочтительными соединениями настоящего изобретения. Однако не делается вывода, что данные соединения образуют единственный класс, который считают классом, составляющим изобретение, и любая комбинация соединений или их фрагментов может сама образовать класс. Следующие примеры дополнительно иллюстрируют подробности получения соединений по настоящему изобретению. Специалистам в данной области будет легко понятно, что для получения данных соединений можно использовать известные вариации условий и способов следующих препаративных методик. Получение 1. Получение 1-(3'-гидроксибензолсульфонил)-1 Н-индола Стадия (i): Получение 3-нитробензолсулъфонилхлорида Хлорсульфоновую кислоту (4,16 ммоль, 0,475 г) помещают в трехгорлую круглодонную колбу на 1 л, снабженную защитной трубкой и воронкой для добавления жидкости. Хлорсульфоновую кислоту охлаждают на бане со льдом до 5-10 С и медленно добавляют к кислоте нитробензол (0,83 ммоль, 0,102 г) с такой скоростью, чтобы поддерживать температуру ниже 10 С. Затем доводят температуру реакционной смеси до 25 С и затем медленно нагревают на масляной бане до 80-85 С. Затем полученную выше реакционную смесь перемешивают при 80-85 С в течение 3 ч. По завершении взаимодействия реакционную смесь охлаждают до 10 С и выливают в смесь воды со льдом при перемешивании, поддерживая температуру ниже 10 С. Затем фильтруют полученную суспензию на воронке Бюхнера. Твердый осадок сушат над пентоксидом фосфора в эксикаторе, получая указанное в заголовке соединение в виде не совсем белого твердого вещества. Выход: 0,144 г. Стадия (ii): Получение 1-(3-нитробензолсульфонил)-1 Н-индола Индол (17,09 ммоль, 2,0 г) помещают в 100-мл трехгорлую круглодонную колбу с 1,2-дихлорэтаном(20 мл). Добавляют триэтиламин (34,19 ммоль, 3,45 г) при 25 С. Полученную выше смесь добавляют к раствору 3-нитробензолсульфонилхлорида (25,64 ммоль, 5,68 г) (полученного на стадии (i) ) и дихлорметана (25 мл), поддерживая температуру ниже 10 С. Затем перемешивают реакционную смесь в течение 24 ч при 25 С. По завершении взаимодействия реакционную смесь выливают в смесь воды со льдом при перемешивании и экстрагируют продукт этилацетатом (230 мл). Затем объединенные этилацетатные экстракты промывают водой, насыщенным раствором соли и сушат над безводным сульфатом магния. Летучие вещества удаляют при пониженном давлении, получая 5,4 г густой сиропообразной массы, которую очищают колоночной хроматографией, используя силикагель (100-200 меш), при этом элюентом является смесь этилацетата и н-гексана (5:95).- 10016594 Стадия (iii): Получение 1-(3-аминобензолсульфонил)-1 Н-индола 1-(3-Нитробензолсульфонил)-1H-индол (полученный на стадии (ii (6,62 ммоль, 2,0 г) помещают в трехгорлую круглодонную колбу на 50 мл с этанолом (10 мл). Добавляют туда порошок железа (33,11 ммоль, 1,85 г) при 25 С и затем добавляют воду (2 мл) и 1-2 капли хлористо-водородной кислоты. Затем реакционную смесь перемешивают в течение 4 ч при 75-80 С. По завершении взаимодействия реакционную смесь фильтруют через воронку Бюхнера и осадок на фильтре дважды промывают теплым этанолом(20 мл). Объединенный этанольный слой концентрируют в вакууме, оставшуюся массу выливают в воду со льдом (30 мл) и подщелачивают 40% раствором гидроксида натрия. Водный слой экстрагируют дихлорметаном (50 мл 3). Объединенные дихлорметановые экстракты промывают водой, насыщенным раствором соли и сушат над безводным сульфатом магния. Затем удаляют летучие вещества при пониженном давлении, получая 2,4 г густой сиропообразной массы, которую очищают колоночной хроматографией, используя нейтральный силикагель (100-200 меш), при этом элюентом является смесь этилацетата и н-гексана (2:3). Стадия (iv): Получение 1-(3-гидроксибензолсульфонил)-1 Н-индола 1-(3-Аминобензолсульфонил)-1H-индол (полученный на стадии (iii (25,7 ммоль, 7,0 г) помещают в трехгорлую круглодонную колбу на 250 мл. Добавляют воду (80 мл) и перемешивают смесь в течение 15 мин при комнатной температуре. Добавляют по каплям через капельную воронку концентрированную серную кислоту (128,5 ммоль, 7 мл) и перемешивают реакционную массу в течение 15 мин. Охлаждают массу до 0-5 С на бане со льдом. Медленно добавляют нитрит натрия (38,6 ммоль, 2,72 г), растворенный в воде (3 мл), и реакционную смесь перемешивают при 0-5 С в течение 1 ч. В другую колбу на 500 мл (50 мл) помещают воду со льдом и медленно добавляют туда концентрированную серную кислоту (50 мл) за 10 мин. Массу нагревают до 60-65 С и добавляют полученную выше диазотированную массу, поддерживая температуру при 60-65 С. Далее полученную реакционную массу перемешивают при 95-98 С еще 60 мин. По завершении взаимодействия реакционную смесь выливают в смесь воды со льдом при перемешивании и полученную смесь экстрагируют этилацетатом(3150 мл). Затем объединенные этилацетатные экстракты промывают водой, насыщенным раствором соли и сушат над безводным сульфатом магния. Летучие вещества удаляют при пониженном давлении,получая 7,33 г полутвердого соединения. Получение 2. Получение 6-хлор-1-(3-гидрокси-4-метилбензолсульфонил)-1H-индола Стадия (i): Получение N-ацетил-2-толуидина Ортотолуидин (0,75 моль, 80 г) помещают в круглодонную колбу на 1 л, снабженную воронкой для добавления жидкости и предохранительной трубкой. Добавляют туда триэтиламин (1,13 ммоль, 113,77 г) одной порцией. Полученную выше смесь охлаждают до 0-5 С и добавляют по каплям ацетилхлорид (1,13 ммоль, 88,7 г), поддерживая температуру ниже 10 С. После добавления ацетилхлорида удаляют охлаждение и реакционную массу перемешивают при 25-28 С в течение 3 ч. По завершении взаимодействия реакционную смесь выливают в 500 г смеси воды со льдом и экстрагируют дихлорметаном (2300 мл). Затем объединенные дихлорметановые экстракты промывают водой, насыщенным раствором соли и сушат над безводным сульфатом магния. Летучие вещества удаляют при пониженном давлении, получая 113,6 г твердого продукта. Стадия (ii): Получение 3-(N-ацетамидо)-4-метилбензолсульфонилхлорида Хлорсульфоновую кислоту (500 г) помещают в трехгорлую круглодонную колбу, снабженную предохранительной трубкой, и охлаждают до 10 С. Добавляют небольшими порциями N-ацетил-2-толуидин(100 г) (полученный на стадии (i, поддерживая температуру ниже 10 С. Затем охлаждение удаляют и реакционную смесь перемешивают при 25 С в течение 24 ч. По завершении взаимодействия реакционную смесь выливают в смесь воды со льдом и полученную суспензию фильтруют на воронке Бюхнера. Осадок на фильтре промывают 500 мл воды и полученное твердое вещество сушат над пентоксидом фосфора в эксикаторе, получая 113,5 г не совсем белого твердого вещества. Неочищенный продукт очищают кристаллизацией из бензола и используют в дальнейших экспериментах. Стадия (iii): Получение 6-хлор-1-[3'-(N-ацетамидо)-4'-метилбензолсульфонил]-1 Н-индола Гидрид натрия (132,0 ммоль, 6,42 г) помещают в трехгорлую круглодонную колбу на 500 мл с тетрагидрофураном (20 мл) в атмосфере азота и охлаждают до 5 С. К полученной смеси медленно добавляют 6-хлориндол (66,0 ммоль, 10 г), растворенный в тетрагидрофуране (50 мл). Затем доводят температуру реакционной смеси до комнатной и перемешивают в течение одного часа. Реакционную смесь охлаждают до 10 С и добавляют частями 3-ацетамидо-4-метилбензолсульфонилхлорид (99,0 ммоль, 24,60 г)(полученный на стадии (ii. По завершении добавления постепенно доводят температуру реакционной смеси до комнатной и поддерживают в течение ночи. По завершении взаимодействия тетрагидрофуран- 11016594 отгоняют из реакционной смеси. Затем выливают концентрированную реакционную смесь в воду при перемешивании и полученную смесь экстрагируют этилацетатом (4150 мл). Объединенные этилацетатные экстракты промывают водой, насыщенным раствором соли и сушат над безводным сульфатом натрия. Летучие вещества удаляют при пониженном давлении, получая 22 г густой сиропообразной массы. Соединение очищают колоночной хроматографией, используя силикагель (100-200 меш), при этом элюентом является смесь этилацетата и н-гексана (1:3), с получением 7,66 г продукта. Стадия (iv): Получение 6-хлор-1-(3'-амино-4'-метилбензолсульфонил)-1 Н-индола 6-Хлор-1-[(3'-(N-ацетамидо)-4'-метил)бензолсульфонил]-1 Н-индол (21,1 ммоль, 7,66 г) (полученный на стадии (iii помещают в трехгорлую круглодонную колбу на 250 мл и добавляют этанол (80 мл). Полученный раствор нагревают на водяной бане до 50-55 С и добавляют по каплям хлористо-водородную кислоту (52,8 ммоль, 6,42 г). Реакционную смесь кипятят с обратным холодильником при 80-85 С в течение 3 ч. По завершении взаимодействия этанол отгоняют из реакционной смеси и концентрированную реакционную смесь выливают в воду (150 мл). Экстрагируют продукт этилацетатом (450 мл). Затем объединенные этилацетатные экстракты промывают водой, насыщенным раствором соли и сушат над безводным сульфатом магния. Летучие вещества удаляют при пониженном давлении, получая 6,72 г густой сиропообразной массы. Соединение очищают колоночной хроматографией, используя силикагель(100-200 меш), при этом элюентом является смесь этилацетата и гексана (1:9), с получением 1,32 г чистого соединения. Стадия (v): Получение 6-хлор-1-(3'-гидрокси-4'-метилбензолсульфонил)-1 Н-индола 6-Хлор-1-(3-амино-4-метил)бензолсульфонил-1 Н-индол (8,48 ммоль, 2,72 г) (полученный на стадии(iv диазотируют, как описано выше на стадии (iv) получения 1. Соединение очищают колоночной хроматографией, используя силикагель (100-200 меш), при этом элюентом является смесь этилацетата и гексана (3:97), с получением 0,76 г чистого соединения. Получение 3. Получение 1-(3'-гидрокси-4'-этилбензолсульфонил)-1 Н-индола Стадия (i): Получение 2-этилацетанилида 2-Этиланилин (82,6 ммоль, 10 г) помещают в круглодонную колбу, снабженную воронкой для добавления жидкости и предохранительной трубкой. Добавляют туда триэтиламин (165 ммоль, 16,69 г) одной порцией. Полученную таким образом массу охлаждают до 0-5C и добавляют по каплям ацетилхлорид (123 ммоль, 9,73 г), поддерживая температуру массы ниже 10 С. После добавления ацетилхлорида охлаждение удаляют и реакционную массу перемешивают при 25-28 С в течение 3 ч. По завершении взаимодействия реакционную смесь выливают в 200 мл воды со льдом и экстрагируют водный слой дихлорметаном (2100 мл). Затем объединенные дихлорметановые экстракты промывают водой, насыщенным раствором соли и сушат над безводным сульфатом магния. Летучие вещества удаляют при пониженном давлении, получая 14,09 г соединения. Стадия (ii): Получение 3-(N-ацетамидо)-4-этилбензолсульфонилхлорида Хлорсульфоновую кислоту (426 ммоль, 49,63 г) помещают в трехгорлую круглодонную колбу на 500 мл, снабженную предохранительной трубкой, и охлаждают до 10 С. Добавляют небольшими порциями 2-этилацетанилид (85,2 ммоль, 13,89 г) (полученный на стадии (i, поддерживая температуру ниже 10 С. По завершении добавления 2-этилацетанилида охлаждение удаляют и реакционную смесь перемешивают при комнатной температуре еще в течение 24 ч. По завершении взаимодействия реакционную массу выливают в смесь воды со льдом при перемешивании и экстрагируют полученную смесь этилацетатом (3150 мл). Затем объединенные этилацетатные экстракты промывают водой, насыщенным раствором соли и сушат над безводным сульфатом магния. Летучие вещества удаляют при пониженном давлении, получая 17,51 г соединения. Стадия (iii): Получение 1-[3'-(N-ацетамидо)-4'-этилбензолсульфонил]-1 Н-индола Гидрид натрия (132,0 ммоль, 6,42 г) помещают в трехгорлую круглодонную колбу с тетрагидрофураном (20 мл) в атмосфере азота и охлаждают до 5 С. К полученной смеси медленно добавляют 6 хлориндол (66,0 ммоль, 10 г), растворенный в тетрагидрофуране (50 мл). Затем доводят температуру реакционной смеси до комнатной и перемешивают в течение одного часа. Полученную выше реакционную смесь охлаждают до 10 С и добавляют частями 3-ацетамидо-4-этилбензолсульфонилхлорид (56,5 ммоль,16,41 г) (полученный на стадии (ii. По завершении добавления постепенно доводят температуру реакционной смеси до комнатной. Тетрагидрофуран отгоняют из реакционной смеси и концентрированную реакционную массу выливают в воду при перемешивании. Полученную смесь экстрагируют этилацетатом (4150 мл). Объединенные этилацетатные экстракты последовательно промывают водой, насыщенным раствором соли и сушат над безводным сульфатом натрия. Летучие вещества удаляют при пониженном давлении, получая 22 г густой сиропообразной массы. Соединение очищают колоночной хрома- 12016594 тографией, используя силикагель (100-200 меш), при этом элюентом является смесь этилацетата и гексана (1:3), с получением 7,66 г соединения. Стадия (iv): Получение 1-(3'-амино-4'-этилбензолсульфонил)-1 Н-индола 3'-Ацетамидо-4'-этилбензолсульфонилиндол (7,16 ммоль, 2,5 г) (полученный на стадии (iii помещают трехгорлую круглодонную колбу на 250 мл с этанолом (80 мл). Полученный выше раствор нагревают на водяной бане до 50-55 С и добавляют по каплям хлористо-водородную кислоту (52,8 ммоль,6,42 г, 30% чистоты). Полученную смесь кипятят с обратным холодильником при 80-85 С в течение 3 ч. По завершении взаимодействия этанол отгоняют из реакционной смеси, концентрированную реакционную смесь выливают в воду (150 мл) и экстрагируют этилацетатом (450 мл). Затем объединенные этилацетатные экстракты промывают водой, насыщенным раствором соли и сушат над безводным сульфатом магния. Летучие вещества удаляют при пониженном давлении, получая 6,72 г густой сиропообразной массы. Соединение очищают колоночной хроматографией, используя силикагель (100-200 меш), при этом элюентом является смесь этилацетата и н-гексана (1:9), с получением 1,32 г соединения. Стадия (v): Получение 1-(3-гидрокси-4-этилбензолсульфонил)-1 Н-индола 1-(3'-Амино-4'-этилбензолсульфонил)индол (2,99 ммоль, 0,909 г) (полученный на стадии (iv помещают в трехгорлую круглодонную колбу на 250 мл. К полученному выше соединению добавляют воду(80 мл) и перемешивают смесь в течение 15 мин при комнатной температуре. При помощи капельной воронки добавляют по каплям концентрированную серную кислоту (128,5 ммоль, 7 мл) и реакционную массу перемешивают еще 15 мин. Затем реакционную массу охлаждают до 0-5C на бане со льдом. Медленно добавляют нитрит натрия (38,6 ммоль, 2,72 г), растворенный в воде (3 мл) и реакционную смесь перемешивают при 0-5 С в течение одного часа. В другую колбу на 500 мл, содержащую воду со льдом (50 мл), медленно добавляют концентрированную серную кислоту (50 мл) за 10 мин. Затем массу нагревают до 60-65 С и добавляют полученную выше диазотированную массу, поддерживая температуру массы 60-65 С. Полученную реакционную массу перемешивают при 95-98 С еще 60 мин. По завершении взаимодействия реакционную смесь выливают в воду со льдом при перемешивании и полученную смесь экстрагируют этилацетатом (3150 мл) Затем объединенные этилацетатные экстракты промывают водой, насыщенным раствором соли и сушат над безводным сульфатом магния. Летучие вещества удаляют при пониженном давлении, получая 0,221 г неочищенного полутвердого соединения. Пример 1. Получение l-[3'-(N,N-диметиламиноэтокси)бензолсульфонил]-1 Н-индола 1-(3'-Гидроксибензолсульфонил)индол (0,602 ммоль, 0,163 г) (из получения 1) помещают в двугорлую круглодонную колбу на 50 мл и добавляют тетрагидрофуран (7 мл). К полученной выше смеси добавляют карбонат калия (1,24 ммоль, 0,171 г) и перемешивают в течение 15-20 мин. Свободное основание, полученное из гидрохлорида 2-диметиламиноэтилхлорида (2,48 ммоль, 0,358 г), путем его растворения в растворе 3 мл 40% водного гидроксида натрия, разбавленного 5 мл воды, и экстракции свободного основания толуолом (3 мл), загружают непосредственно в реакционную смесь. Реакционную смесь поддерживают при температуре кипения с обратным холодильником и наблюдают за ходом процесса. По завершении взаимодействия реакционную массу охлаждают до комнатной температуры, выливают в 25 мл воды и экстрагируют продукт этилацетатом (10 мл 4). Объединенные органические экстракты сушат над сульфатом натрия и удаляют летучие вещества при пониженном давлении, получая 0,214 г неочищенного соединения. Соединение очищают колоночной хроматографией, используя силикагель (100-200 меш), при этом элюентом является смесь этилацетата и н-гексана (2:3), с получением чистого соединения. ИК (см-1): 2947, 1373, 1170. 1MС (m/z): 345 (М+Н)+. Пример 2. Получение 5-фтор-1-[3'-(N,N-диметиламинозтокси)бензолсульфонил]-1 Н-индола Используя методику, аналогично приведенной в примере 1, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2945, 1374, 1175. 1 Н-ЯМР (м.д.): 2,32 (6 Н, с), 2,70-2,72 (2 Н, т, J = 5,53 Гц), 4,00-4,03 (2 Н, т, J = 5,57 Гц), 6,62-6,63 (1 Н,д, J = 3,51 Гц), 7,01-7,04 (2 Н, м), 7,16-7,19 (1 Н, дд, J = 8,72, 2,53 Гц), 7,31-7,33 (1 Н, д, J = 7,96 Гц), 7,357,36 (1 Н, дд, J = 2,14 Гц), 7,41-7,43 (1 Н, м), 7,57-7,58 (1 Н, д, J = 3,66 Гц), 7,90-7,94 (1 Н, дд, J = 9,04, 4,4 Гц). МС (m/z): 363 (М+Н)+. Пример 3. Получение 5-бром-1-(3'-[N,N-диметиламиноэтокси)бензолсульфонил]-1 Н-индола Используя методику, аналогично приведенной в примере 1, с некоторыми некритичными измене- 13016594 ниями, получают указанное выше производное. ИК (см-1): 2947, 1373, 1170. 1H-ЯМР (м.д.): 2,32 (6 Н, с), 2,70-2,73 (2 Н, т, J = 5,6 Гц), 4,01-4,03 (2 Н, кв, J = 5,6 Гц), 6,59-6,60 (1 Н,д, J = 3,71 Гц), 7,06-7,09 (1 Н, м), 7,31-7,33 (1 Н, д, J =7,96 Гц), 7,35-7,36 (1 Н, м); 7,39-7,43 (2 Н, м), 7,547,55 (1 Н, д, J=3,65 Гц), 7,66-7,67 (1 Н, д, J = l,88 Гц), 7,84-7,87 (1 Н, д, J = 8,82 Гц). МС (m/z): 423, 425 (М+Н)+. Пример 4. Получение 5-фтор-1-[3'-(N,N-диметиламинопропокси)бензолсульфонил]-1 Н-индола 5-Фтор-1-(3-гидроксибензолсульфонил)индол обрабатывают гидрохлоридом 3-диметиламинопропилхлорида (2,48 ммоль, 0,393 г) по методике, аналогично приведенной в примере 1, с некоторыми некритичными изменениями, получая указанное выше производное. ИК (см-1): 2946, 1374, 1175. 1 Н-ЯМР (м.д.): 1,90-1,97 (2 Н, м), 2,25 (6 Н, с), 2,42-2,46 (2 Н, т, J = 7,08 Гц), 3,96-3,99 (2 Н, т, J = 6,36 Гц), 6,62-6,63 (1 Н, д, J = 3,44 Гц), 7,03-7,06 (2 Н, м), 7,18-7,28 (1 Н, дд), 7,30-7,32 (1 Н, д, J = 8 Гц), 7,33-7,39(2 Н, м), 7,58-7,59 (1 Н, д, J = 3,6 Гц), 7,90-7,94 (1 Н, дд, J = 9,0, 4,4 Гц). МС (m/z) : 377 (М+Н)+. Пример 5. Получение 5-бром-1-[3'-(N,N-диметиламинопропокси)бензолсульфонил]-1 Н-индола Используя методику, аналогично приведенной в примере 4, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2947, 1373, 1170. 1 Н-ЯМР (м.д.): 1,89-1,97 (2 Н, м), 2,25 (6H, с), 2,40-2,44 (2 Н, т, J = 7,08 Гц), 3,96-3,99 (2 Н, т, J = 6,41 Гц),6,60-6,61 (1 Н, д, J = 3,54 Гц), 7,04-7,06 (1 Н, м), 7,30-7,34 (2 Н, м), 7,38-7,42 (2 Н, м), 7,55-7,56 (1 Н, д, J = 3,7 Гц),7,66-7,67 (1 Н, д, J=1,85 Гц), 7,85-7,87 (1 Н, д, J = 8,82 Гц). МС (m/z): 437, 439 (М+Н)+. Пример 6. Получение 1-[3'-(N,N-диметиламинопропокси)бензолсульфонил]-5-метокси-1 Н-индола Используя методику, аналогично приведенной в примере 4, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2948, 1373, 1170. 1 Н-ЯМР (м.д.): 1,88-1,99 (2 Н, м), 2,24 (6 Н, с), 2,40-2,44 (2 Н, т, J = 7,09 Гц), 3,81 (3 Н, с), 3,95-3,98(2 Н, т, J = 6,37 Гц), 6,58-6,59 (1 Н, д, J = 3,70 Гц), 6,91-6,94 (1 Н, дд, J = 9,0, 2,5 Гц), 6,96-6,97 (1 Н, д, J = 2,43 Гц), 7,01-7,03 (1 Н, м), 7,27-7,40 (3 Н, м), 7,50-7,51 (1 Н, д, J = 3,60 Гц), 7,86-7,89 (1 Н, д, J = 9,01 Гц) . МС (m/z): 389 (М+Н)+. Пример 7. Получение 1-[3'-(1-метилпиперидин-4-илокси)бензолсульфонил]-1 Н-индола 1-(3'-Гидроксибензолсульфонил)индол (0,36 ммоль, 0,1 г) (из получения 1) растворяют в диметилсульфоксиде (2 мл). Добавляют карбонат калия (0,074 г) и полученную реакционную смесь перемешивают при 40-45 С в течение 1 ч. В другой круглодонной колбе растворяют 4-хлор-N-метилпиперидин (0,54 ммоль, 0,072 г) в диметилсульфоксиде (1,5 мл). Содержимое первой колбы добавляют во вторую колбу при 40-45 С. Затем полученную реакционную массу нагревают до 140-145 С и поддерживают при такой температуре в течение 5 ч, следя за взаимодействием тонкослойной хроматографией. Охлаждают реакционную массу до комнатной температуры, выливают в воду (25 мл) и экстрагируют продукт этилацетатом (30 мл 3). Объединенные органические экстракты сушат над сульфатом натрия и удаляют летучие вещества при пониженном давлении, получая 0,110 г неочищенного соединения. Соединение очищают колоночной хроматографией, используя силикагель (100-200 меш), при этом элюентами являются этилацетат и 1% триэтиламин, с получением 50 мг чистого соединения. ИК (см-1): 2933, 1595, 1445, 1372, 1173. 1 Н-ЯМР (м.д.): 1,73-1,79 (2 Н, м), 1,90-2,05 (2 Н, м), 2,17 (2 Н, м), 2,31 (3 Н, с), 2,64-2,66 (2 Н, м), 4,32(1 Н, м), 6,66-6,67 (1 Н, д, J = 3,72 Гц), 7,01-7,03 (1 Н, дд, J = 8,24, 2,36 Гц), 7,23-7,29 (1 Н, м), 7,29-7,33 (4 Н,м), 7,52-7,54 (2 Н, м), 7,99-8,01 (1 Н, д, J = 8,28 Гц). МС (m/z) : 371,2 (М+Н)+ . Пример 8. Получение 5-фтор-1-[3'-(1-метилпиперидин-4-илокси)бензолсульфонил]-1 Н-индола Используя методику, аналогично приведенной в примере 7, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2933, 1445, 1373, 1172. 1(1 Н, т, J = 2,0 Гц), 7,32-7,34 (1 Н, д, J = 8,0 Гц), 7,39-7,41 (1 Н, д, J = 3,6 Гц), 7,56-7,57 (1 Н, д, J = 3,6 Гц),7,90-7,94 (1 Н, м) . МС (m/z): 389,3 (М+Н)+. Пример 9. Получение 5-метокси-1-[3'-(1-метилпиперидин-4-илокси)бензолсульфонил]-1 Н-индола Используя методику, аналогично приведенной в примере 7, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2933, 1445, 1373, 1172. 1 Н-ЯМР (м.д.): 1,76-1,80 (2 Н, м), 1,93-1,98 (2 Н, м), 2,35 (3 Н, с), 2,38-2,42 (2 Н, м), 2,65-2,75 (2 Н, м),- 14016594 3,81 (3 Н, с), 4,29-4,30 (1 Н, м), 6,58-6,60 (1 Н, д, J = 3,60 Гц), 6,91-6,94 (1 Н, д, J = 8,96 Гц), 6,97 (1 Н, д, J = 2,44 Гц), 7,28-7,29 (2 Н, м), 7,30-7,32 (1 Н, д, J = 8,12 Гц), 7,38 (1 Н, м), 7,48-7,49 (1 Н, д, J = 3,6 Гц), 7,877,89 (1 Н, д, J=9 Гц). МС (m/z): 401,3 (М+Н)+. Пример 10. Получение 1-[4'-метил-3'-(N,N-диметиламиноэтокси)бензолсульфонил]-1 Н-индола Используя методику, аналогично приведенной в примере 1, с некоторыми некритичными изменениями и 1-(3-гидрокси-4-метил)бензолсульфонил-1 Н-индол (из получения 2), получают указанное выше производное. ИК (см-1): 2944, 1372, 1177. 1 Н-ЯМР (м.д.): 2,17 (3 Н, с), 2,33 (6 Н, с), 2,70-2,73 (2 Н, т, J = 5,68 Гц), 4,01-4,03 (2 Н, т, J = 5,72 Гц),6,64-6,65 (1 Н, д, J = 3,6 Гц), 7,14-7,16 (1 Н, д, J = 7,88 Гц), 7,21-7,30 (3 Н, м), 7,36-7,38 (1 Н, дд, J = 7,84, 1,76 Гц), 7,51-7,53 (1 Н, д, J = 7,8 Гц), 7,54-7,55 (1 Н, д, J = 3,72 Гц), 7,97-8,00 (1 Н, д, J = 8,28 Гц) . МС (m/z): 359,4 (М+Н)+. Пример 11. Получение 5-фтор-1-[4'-метил-3'-(N,N-диметиламиноэтокси)бензолсульфонил]-1 Ниндола Используя методику, аналогично приведенной в примере 10, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2944, 1372, 1172, 1138. 1 Н-ЯМР (м.д.): 2,18 (3 Н, с), 2,33 (6 Н, с), 2,72-2,74 (2 Н, т, J = 5,68 Гц), 4,01-4,03 (2 Н, т, J = 5,72 Гц),6,60-6,61 (1 Н, д, J = 3,6 Гц), 7,02-7,03 (1 Н, дт, J = 2,52), 7,15-7,18 (2 Н, м), 7,20 (1 Н, д, J = l,68 Гц), 7,34-7,36MC (m/z): 377,3 (М+Н)+. Пример 12. Получение 5-бром-1-(4'-метил-3'-(N,N-диметиламиноэтокси)бензолсульфонил)-1 Ниндола Используя методику, аналогично приведенной в примере 10, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2939, 1369, 1171. 1 Н-ЯМР (м.д.): 2,18 (3 Н, с), 2,38 (6 Н, с), 2,74-2,76 (2 Н, т, J = 5,48 Гц), 4,02-4,05 (2 Н, т, J = 5,64 Гц),6,58-6,59 (1 Н, д, J = 3,92 Гц), 7,15-7,17 (1 Н, д, J = 7,92 Гц), 7,20 (1 Н, д, J =1,72 Гц), 7,34-7,36 (1 Н, дд, J = 7,84,1,76 Гц), 7,38-7,41 (1 Н, дд, J = 8,8, 1,92 Гц), 7,54-7,55 (1 Н, д, J = 3,64 Гц), 7,65-7,66 (1 Н, д, J = l,88 Гц), 7,84-7,87 (1 Н, д, J = 8,8 Гц).MC (m/z): 437, 439 (М+Н)+. Пример 13. Получение 1-[4'-метил-3'-(N,N-диметиламиноэтокси)бензолсульфонил]-5-метокси-1 Ниндола Используя методику, аналогично приведенной в примере 10, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1) : 2944, 1373, 1170. 1 Н-ЯМР (м.д.): 2,17 (3 Н, с), 2,34 (6 Н, с), 2,72-2,75 (2 Н, т, J = 5,66 Гц), 3,80 (3 Н, с), 4,01-4,04 (2 Н, т, J = 5,68 Гц), 6,57 (1 Н, д, J = 3,57 Гц), 6,90-6,93 (1 Н, дд, J = 9,0, 2,47 Гц), 6,96 (1 Н, д, J = 2,44 Гц), 7,13-7,15 (1 Н, д, J = 7,88 Гц), 7,20 (1 Н, д, J = l,67 Гц), 7,33-7,35 (1 Н, дд, J = 7,85, 1,75 Гц), 7,49-7,50 (1 Н, д, J = 3,62 Гц), 7,86-7,88MC (m/z): 389,4 (М+Н)+. Пример 14. Получение 5-этокси-1-[4'-метил-3'-(N,N-диметиламиноэтокси)бензолсульфонил]-1 Ниндола Используя методику, аналогично приведенной в примере 10, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2947, 1373, 1170. 1MC (m/z): 403 (М+Н)+. Пример 15. Получение 6-хлор-1-[4'-метил-3'-(N,N-диметиламиноэтокси)бензолсульфонил]-1 Ниндола Используя методику, аналогично приведенной в примере 10, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1) : 1371, 1172, 1137. 1 Н-ЯМР (м.д.): 2,19 (3 Н, с), 2,38 (6 Н, с), 2,80-2,83 (2 Н, т, J = 5,56 Гц), 4,0-4,10 (2 Н, т, J = 5,56 Гц),6,61-6,62 (1 Н, д, J = 3,68 Гц), 7,17-7,21 (2 Н, м), 7,24-7,25 (1 Н, д, J = l,72 Гц), 7,36-7,38 (1 Н, дд, J = 7,88,1,76 Гц), 7,42-7,44 (1 Н, д, J = 8,4 Гц), 7,53-7,54 (1 Н, д, J = 3,64 Гц), 8,01-8,02 (1 Н, д, J = l,68 Гц).MC (m/z): 393,5 (М+Н)+. Пример 16. Получение 1-(4'-метил-3'-(N,N-диметиламинопропокси)бензолсульфонил]-1 Н-индола 1-(3-Гидрокси-4-метил)бензолсульфонил-1 Н-индол (0,622 ммоль, 0,2 г) (из получения 2) растворя- 15016594 ют в тетрагидрофуране (7 мл). К полученной выше смеси добавляют карбонат калия (1,024 ммоль, 0,171 г) и перемешивают в течение 15-20 мин. Свободное основание, полученное из гидрохлорида 3 диметиламинопропилхлорида (2,48 ммоль, 0,393 г), экстрагируют толуолом (3 мл) и загружают непосредственно в реакционную смесь. Реакционную смесь кипятят с обратным холодильником, следя за протеканием взаимодействия. По завершении взаимодействия массу охлаждают до комнатной температуры, выливают в воду (25 мл) и экстрагируют продукт этилацетатом (10 мл 4). Объединенные органические экстракты сушат над сульфатом натрия и удаляют летучие вещества при пониженном давлении,получая 0,219 г неочищенного соединения. Соединение очищают колоночной хроматографией, используя силикагель (100-200 меш), с получением 0,143 г чистого соединения. ИК (см-1): 2944, 1373, 1171. 1 Н-ЯМР (м.д.): 1,91-1,98 (2 Н, м), 2,16 (3 Н, с), 2,26 (6 Н, с), 2,43-2,46 (2 Н, т, J = 7,12 Гц), 3,96-3,99(1 Н, дд, J = 7,84, 1,76 Гц), 7,51-7,53 (1 Н, д, J = 7,8 Гц),7,55 (1 Н, д, J = 3,72 Гц), 7,98-8,00 (1 Н, д, J = 8,28 Гц) . МС (m/z): 373 (М+Н)+. Пример 17. Получение 5-фтор-1-[4'-метил-3'-(N,N-диметиламинопропокси)бензолсульфонил-1 Ниндола Используя методику, аналогично приведенной в примере 16, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2947, 2860, 1373, 1171, 1137. 1H-ЯМР (м.д.): 1,92-1,98 (2 Н, м), 2,17 (3 Н, с), 2,25 (6 Н, с), 2,42-2,46 (2 Н, т, J=7,36 Гц), 3,96-3,99 (2 Н,т, J = 6,28 Гц), 6,60-6,61 (1 Н, д, J = 3,48 Гц), 7,03-7,16 (1 Н, дт, J = 2,52 Гц), 7,18 (2 Н, м), 7,21 (1 Н, д, J = 1,76 Гц), 7,32-7,34 (1 Н, дд, J = 7,84, 1,8 Гц), 7,57-7,58 (1 Н, д, J = 3,64 Гц), 7,91-7,92 (1 Н, дд, J = 4,4 Гц). МС (m/z): 391,4 (М+Н)+ . Пример 18. Получение 5-бром-1-[4'-метил-3'-(N,N-диметиламинопропокси)бензолсульфонил]-1 Ниндола Используя методику, аналогично приведенной в примере 16, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2948, 1374, 1168. 1(2 Н, т, J = 6,24 Гц), 6,58-6,59 (1 Н, д, J = 3,84 Гц), 7,15-7,17 (1 Н, д, J = 7,92 Гц), 7,20-7,21 (1 Н, д, J = l,72 Гц), 7,32-7,34 (1 Н, дд, J = 7,88, 1,8 Гц), 7,38-7,41 (1 Н, дд, J = 8,8, 1,96 Гц), 7,55-7,56 (1 Н, д, J = 3,64 Гц),7,65-7,66 (1 Н, д, J = l,84 Гц), 7,85-7,87 (1 Н, д, J = 8,8 Гц). МС (m/z): 451, 453 (М+Н)+. Пример 19. Получение 1-[4'-метил-3'-(N,N-диметиламинопропокси)бензолсульфонил]-5-метокси 1 Н-индола Используя методику, аналогично приведенной в примере 16, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2944, 1373, 1173. 1 Н-ЯМР (м.д.): 1,90-1,94 (2 Н, м), 2,16 (3 Н, с), 2,25 (6 Н, с), 2,41-2,45 (2 Н, т, J = 7,08 Гц), 3,80 (3 Н, с), 3,953,98 (2 Н, т, J = 6,2 Гц), 6,57-6,58 (1 Н, с, J = 3,56 Гц), 6,90-6,93 (1 Н, дд, J = 9,04, 2,48 Гц), 6,96 (1 Н, д, J = 2,44 Гц), 7,12-7,14 (1 Н, д, J = 7,88 Гц), 7,21 (1 Н, д, J = l,68 Гц), 7,31-7,33 (1 Н, дд, J = 7,84, 1,76 Гц), 7,50 (1 Н, д, J= 3,6 Гц), 7,86-7,89 (1 Н, д, J = 9 Гц). МС (m/z): 403,5 (М+Н)+ . Пример 20. Получение 5-этокси-1-[-4'-метил-3'-(N,N-диметиламинопропокси)бензолсульфонил]1 Н-индола Используя методику, аналогично приведенной в примере 16, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2948, 1373, 1170. 1 Н-ЯМР (м.д.): 1,39-1,42 (3 Н, т, J = 6,92 Гц), 1,98-2,06 (2 Н, м), 2,16 (3 Н, с), 2,35 (6 Н, с), 2,57-2,61(1 Н, д, J = l,67 Гц), 7,32-7,34 (1 Н, дд, J = 7,87, 1,73 Гц), 7,49 (1 Н, д, J = 3,63 Гц), 7,85-7,87 (1 Н, д, J = 8,88 Гц) . МС (m/z): 417 (М+Н)+ . Пример 21. Получение 6-хлор-1-[4'-метил-3'-(N,N-диметиламинопропокси)бензолсульфонил]-1 Ниндола Используя методику, аналогично приведенной в примере 16, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 1371, 1172, 1137. 1H-ЯМР (м.д.): 2,0-2,10 (2 Н, м), 2,18 (3 Н, с), 2,40 (6 Н, с), 2,66-2,70 (2 Н, т, J = 7,48 Гц), 3,99-4,0 (2 Н,т, J = 6,12 Гц), 6,61-6,62 (1 Н, д, J = 3,64 Гц), 7,17-7,21 (2 Н, м), 7,22-7,23 (1 Н, д, J = l,68 Гц), 7,35-7,37 (1 Н,- 16016594 дд, J = 7,88, 1,72 Гц), 7,42-7,44 (1 Н, д, J = 8,4 Гц), 7,53-7,54 (1 Н, д, J = 3,64 Гц), 8,01 (1 Н, д, J = l,64 Гц). МС (m/z): 407,5 (М+Н)+. Пример 22. Получение 6-хлор-1-[4'-метил-3'-(1-метилпиперидин-4-илокси)бензолсульфонил]-1 Ниндола Используя методику, аналогично приведенной в примере 7, с некоторыми некритичными изменениями и 6-хлор-1-(3-гидрокси-4-метил)бензолсульфонил-1 Н-индол (из получения 2), получают указанное выше производное. ИК (см-1): 2933, 1445, 1373, 1172. 1 Н-ЯМР (м.д.): 1,78-1,81 (2 Н, м), 1,92-1,94 (2 Н, м), 2,18 (3 Н, с), 2,31 (3 Н, с), 2,60 (2 Н, м), 2,73 (2 Н, м), 4,34(1 Н, м), 6,61 (1 Н, д, J = 3,6 Гц), 7,18-7,21 (2 Н, м), 7,23-7,24 (1 Н, д, J = l,64 Гц), 7,31-7,33 (1 Н, дд, J = 7,84, 1,86 Гц), 7,42-7,44 (1 Н, д, J = 8,36 Гц), 7,51-7,52 (1 Н, д, J = 3,64 Гц), 8,02-8,03 (1 Н, д, J = 1,64 Гц). МС (m/z): 419,5, 421,5 (М+Н)+. Пример 23. Получение 1-[4'-метил-3'-(1-метилпиперидин-4-илокси)бензолсульфонил]-1 Н-индола Используя методику, аналогично приведенной в примере 7, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2933; 1445, 1372, 1170. 1(1 Н, д, J = 8,28 Гц). МС (m/z): 385,3 (М+Н)+. Пример 24. Получение гидрохлорида 5-фтор-1-(4'-метил-3'-(1-метилпиперидин-4 илокси)бензолсульфонил)-1 Н-индола Используя методику, аналогично приведенной в примере 7, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2954, 2715, 1595, 1456, 1365, 1134. 1 Н-ЯМР (м.д.): 1,83-1,93 (2 Н, м), 2,04-2,08 (2 Н, м), 2,23 (3 Н, с), 2,51 (3 Н, с), 2,75 (2 Н, м), 3,02 (2 Н,м), 4,92 (1 Н, м), 6,82 (1 Н, ушир.с), 7,18-7,20 (1 Н, д, J = 7,6 Гц), 7,39-7,40 (1 Н, д, J = 6,5 Гц), 7,42-7,44 (1 Н,д, J = 2,2 Гц), 7,47-7,50 (2 Н, м), 7,91-8,01 (2 Н, м), 10,67 (1 Н, ушир.с). МС (m/z): 403,2 (М+Н)+. Пример 25. Получение 4-хлор-1-[4'-метил-3'-(1-метилпиперидин-4-илокси)бензолсульфонил]-1 Ниндола Используя методику, аналогично приведенной в примере 7, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2933, 1445, 1373, 1172. 1 Н-ЯМР (м.д.): 1,73-1,78 (2 Н, м), 1,90-1,91 (2 Н, м), 2,18 (3 Н, с), 2,27-2,33 (2 Н, м), 2,39 (3 Н, с) 2,57(2 Н, м), 4,29-4,32 (1 Н, м), 6,77-6,78 (1 Н, д, J = 3,64 Гц), 7,17-7,19 (2 Н, м), 7,23-7,26 (2 Н, м), 7,33-7,35 (1 Н,дд, J = 7,88, 1,80 Гц), 7,57-7,58 (1 Н, д, J = 3,68 Гц), 7,90 (1 Н, м). МС (m/z): 419,5 (М+Н)+. Пример 26. Получение 1-[4'-этил-3'-(N,N-димешиламиноэтокси)бензолсульфонил]-1 Н-индола Используя методику, аналогично приведенной в примере 1, с некоторыми некритичными изменениями и промежуточное соединение 1-(3-гидрокси-4-этил)бензолсульфонилиндол (из получения 3), получают указанное выше производное. ИК (см-1): 2965, 2932, 1372, 1170, 1131. 1 Н-ЯМР (м.д.): 1,09-1,13 (3 Н, т, J = 7,56 Гц), 2,33 (6 Н, с), 2,55-2,61 (2 Н, кв, J = 7,52 Гц), 2,71-2,74(2 Н, т, J = 5,76 Гц), 4,01-4,04 (2 Н, т, J = 5,76 Гц), 6,64-6,65 (1 Н, д, J = 3,56 Гц), 7,16-7,18 (1 Н, д, J = 7,92 Гц), 7,22-7,31 (3 Н, м), 7,40-7,42 (1 Н, дд, J = 7,96, 1,8 Гц), 7,52-7,54 (1 Н, д, J = 7,84 Гц), 7,55-7,56 (1 Н, д, J = 3,64 Гц), 7,98-8,01 (1 Н, д, J = 8,28 Гц). МС (m/z): 373,3 (М+Н)+. Пример 27. Получение 5-бром-1-[4'-этил-3'-(N,N-диметиламиноэтокси)бензолсульфонил]-1 Ниндола Используя методику, аналогично приведенной в примере 26, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2948, 1373, 1175. 1 Н-ЯМР (м.д.): 1,10-1,14 (3 Н, т, J = 7,5), 2,35 (6 Н, с), 2,57-2,62 (2 Н, кв, J = 7,5 Гц), 2,74-2,76 (2 Н, т, J = 5,72 Гц), 4,03-4,06 (2 Н, т, J = 5,73 Гц), 6,58-6,59 (1 Н, д, J = 3,7 Гц), 7,17-7,19 (1 Н, д, J = 7,95 Гц), 7,21-7,22 (1 Н, д, J =l,73 Гц), 7,38-7,41 (2 Н, м), 7,55-7,56 (1 Н, д, J = 3,69 Гц), 7,66-7,67 (1 Н, д, J = 1,84 Гц), 7,85-7,88 (1 Н, д, J = 8,8 Гц). МС (m/z): 451, 453 (М+Н)+. Пример 28. Получение 1-[4'-этил-3'-(N,N-димешиламиноэтокси)бензолсульфонил]-5-метокси-1 Ниндола Используя методику, аналогично приведенной в примере 26, с некоторыми некритичными изменениями, получают указанное выше производное.(2 Н, т, J = 5,76 Гц), 3,80 (3 Н, с), 4,01-4,04 (2 Н, т, J = 5,76 Гц), 6,57-6,58 (1 Н, д, J = 3,52 Гц), 6,90-6,93 (1 Н,дд, J = 9,0, 2,48 Гц), 6,96-6,97 (1 Н, д, J = 2,4 Гц), 7,15-7,17 (1 Н, д, J = 7,96 Гц), 7,21 (1 Н, д, J = l,72 Гц),7,36-7,39 (1 Н, дд, J = 7,96, 1,76 Гц), 7,50-7,51 (1 Н, д, J = 3,6 Гц), 7,87-7,89 (1 Н, д, J = 8,96 Гц). МС (m/z): 403,3 (М+Н)+. Пример 29. Получение 6-хлор-1-[4'-этил-3'-(N,N-диметиламиноэтокси)бензолсульфонил]-1 Ниндола Используя методику, аналогично приведенной в примере 26, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2970, 2939, 1373, 1169. 1 Н-ЯМР (м.д.): 1,11-1,15 (3 Н, т, J = 7,51 Гц), 2,33 (6 Н, с), 2,58-2,63 (2 Н, кв, J = 7,51), 2,73-2,76 (2 Н, т,J = 5,69 Гц), 4,05-4,08 (2 Н, т, J = 5,70 Гц), 6,61-6,62 (1 Н, д, J = 3,69 Гц), 7,18-7,21 (2 Н, м), 7,25-7,26 (1 Н, д),7,39-7,42 (1 Н, дд, J = 7,92, 1,82 Гц), 7,42-7,44 (1 Н, д, J = 8,40 Гц), 7,53-7,54 (1 Н, д, J = 3,64 Гц), 8,02-8,03(1 Н, д, J = l,72 Гц). МС (m/z): 407 (М+Н)+. Пример 30. Получение 1-[4'-этил-3'-(N,N-диметиламиноэтокси)бензолсульфонил]-5-фтор-1 Ниндола Используя методику, аналогично приведенной в примере 26, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2934, 1374, 1171. 1 Н-ЯМР (м.д.): 1,10-1,14 (3 Н, т, J = 7,51 Гц), 2,34 (6 Н, с), 2,56-2,62 (2 Н, кв), 2,72-2,75 (2 Н, т, J = 5,76 Гц), 4,02-4,05 (2 Н, т, J = 5,76 Гц), 6,60-6,61 (1 Н, д, J = 3,44 Гц), 7,03-7,04 (1 Н, м), 7,16-7,22 (3 Н, м) , 7,387,40 (1 Н, дд, J = 7,88, 1,80 Гц), 7,58-7,59 (1 Н, д, J = 3,64 Гц), 7,91-7,93 (1 Н, кв, J = 4,64 Гц) . МС (m/z): 391 (М+Н)+. Пример 31. Получение 1-[4'-этил-3'-(N,N-диметиламинопропокси)бензолсульфонил]-1 Н-индола Используя методику, аналогично приведенной в примере 4, с некоторыми некритичными изменениями и (3-гидрокси-4-этилбензолсульфонил)индол (из получения 3), получают указанное выше производное. ИК (см-1): 2947, 1373, 1171, 1137. 1H-ЯMP (м.д.): 1,09-1,13 (3 Н, т, J = 7,48 Гц), 1,91-1,98 (2 Н, м), 2,26 (6 Н, с), 2,43-2,46 (2 Н, т, J = 7,44 Гц),2,55-2,60 (2 Н, кв, J = 7,52 Гц), 3,96-3,99 (2 Н, т, J = 6,2 Гц), 6,65 (1 Н, д, J = 3,84 Гц), 7,15-7,17 (1 Н, д, J = 7,92 Гц),7,22-7,31 (3 Н, м), 7,38-7,40 (1 Н, дд, J = 7,92, 1,76 Гц), 7,52-7,54 (1 Н, д, J = 7,8 Гц), 7,55-7,56 (1 Н, д, J = 3,68 Гц),7,99-8,01 (1 Н, д, J = 8,48 Гц) . МС (m/z): 387,4 (М+Н)+. Пример 32. Получение 5-бром-1-[4'-этил-3'-(N,N-диметиламинопропокси)бензолсульфонил]-1 Ниндола Используя методику, аналогично приведенной в примере 31, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2948, 1373, 1175. 1 Н-ЯМР (м.д.): 1,10-1,14 (3 Н, т, J = 7,52), 1,96-2,02 (2 Н, м), 2,29 (6 Н, с), 2,48-2,52 (2 Н, т, J = 7,12 Гц), 2,562,61 (2 Н, кв, J = 7,52 Гц), 3,97-4,0 (2 Н, т, J = 6,2 Гц), 6,58-6,59 (1 Н, д, J = 3,94 Гц), 7,16-7,18 (1H, д, J = 7,95 Гц),7,21-7,22 (1H, д, J = l,76 Гц), 7,36-7,41 (2H, м), 7,55-7,56 (1 Н, д, J = 3,63 Гц), 7,66-7,67 (1 Н, д, J = l,85 Гц), 7,867,88 (1 Н, д, J = 8,79 Гц). МС (m/z): 465, 467 (М+Н)+. Пример 33. Получение 1-[4'-этил-3'-(N,N-диметиламинопропокси)бензолсульфонил]-6-хлор-1 Ниндола Используя методику, аналогично приведенной в примере 31, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2939, 1374, 1169. 1(2 Н, кв), 3,99-4,02 (2 Н, т), 6,61-6,62 (1 Н, д, J = 3,59 Гц), 7,18-7,21 (2 Н, м), 7,27 (1 Н, д, J = l,78 Гц), 7,377,39 (1 Н, дд, J = l,81 Гц и 7,91 Гц), 7,42-7,44 (1 Н, д, J = 8,40 Гц), 7,53-7,54 (1 Н, д, J = 3,66 Гц), 8,03 (1 Н, д,J = l,57 Гц). МС (m/z): 421 (М+Н)+. Пример 34. Получение 1-[4'-этил-3'-(N,N-диметиламинопропокси)бензолсульфонил]-5-метокси-1 Ниндола Используя методику, аналогично приведенной в примере 31, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2940, 1370, 1172. 1 Н-ЯМР (м.д.): 1,09-1,13 (3 Н, т, J = 7,51 Гц), 1,91-1,99 (2 Н, м), 2,25 (6 Н, с); 2,42-2,45 (2 Н, т, J = 7,32 Гц), 2,55-2,60 (2 Н, кв, J = 7,48 Гц), 3,81 (3 Н, с), 3,96-3,99 (2 Н, т, J = 6,16 Гц), 6,57-6,58 (1 Н, д, J = 3,55 Гц),1l,41 Гц), 7,34-7,36 (1 Н, дд, J = 7,86, 1,54 Гц), 7,50-7,51 (1 Н, д, J = 3,57 Гц), 7,87-7,89 (1 Н, д, J = 8,95 Гц). МС (m/z) : 417,6 (М+Н)+. Пример 35. Получение 1-[4'-этил-3'-(N,N-диметиламинопропокси)бензолсульфонил)-5-фтор-1 Ниндола Используя методику, аналогично приведенной в примере 31, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2934, 1374, 1171. 1H-ЯМР (м.д.): 1,11-1,13 (6 Н, д, J = 6,91 Гц), 2,35 (6 Н, с), 2,75-2,78 (2 Н, т, J = 5,76 Гц), 3,22-3,29 (1 Н,септет), 4,03-4,06 (2 Н, т, J = 5,79 Гц), 6,64-6,65 (1 Н, д, J = 3,59 Гц), 7,21-7,25 (3 Н, м), 7,29-7,33 (1 Н, м),7,43-7,45 (1 Н, дд, J = 8,05, 1,80 Гц), 7,53-7,55 (1 Н, д, J = 7,82 Гц), 7,56 (1 Н, д, J = 3,69 Гц), 8,00-8,02 (1 Н, д,J = 8,8 Гц). МС (m/z): 387,4 (М+Н)+. Пример 37. Получение 1-[4'-изопропил-3'-(N,N-диметиламиноэтокси) бензолсульфонил]-5-метокси 3-метил-1H-индола Используя методику, аналогично приведенной в примере 1, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2960, 1365, 1172. 1 Н-ЯМР (м.д.): 1,06-1,08 (6 Н, д, J = 6,90 Гц), 2,16 (3 Н, д), 2,18 (6 Н, с), 2,57-2,60 (2 Н, т), 3,14-3,19(1 Н, септет), 3,75 (3 Н, с), 4,05-4,07 (2 Н, т), 6,91-6,94 (1 Н, дд, J = 8,97, 2,5 Гц), 7,00-7,01 (1 Н, д, J = 2,45 Гц), 7,32-7,35 (2 Н, м), 7,39-7,41 (1 Н, дд, J = 8,07, 1,74 Гц), 7,54 (1 Н, д, J = l,15 Гц), 7,82-7,84 (1 Н, д, J = 8,94 Гц). МС (m/z): 431,4 (М+Н)+. Пример 38. Получение 1-[4'-изопропил-3'-(1-диметиламино-2-пропокси)бензолсульфонил]-1 Ниндола Используя методику, аналогично приведенной в примере 1, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2966, 1371, 1172. 1 Н-ЯМР (м.д.): 1,10-1,12 (6 Н, д), 1,20-1,22 (3 Н, д, J = 6,12 Гц), 2,28 (6 Н, с), 2,41-2,46 (1 Н, дд), 2,562,61 (1 Н, дд), 3,20-3,27 (1 Н, м), 4,44-4,48 (1 Н, м), 6,65-6,66 (1 Н, д, J = 3,60 Гц), 7,20-7,24 (2 Н, м), 7,29-7,33(2 Н, м), 7,39-7,41 (1 Н, дд, J = 8,08, 1,8 Гц), 7,52-7,55 (2 Н, м), 8,01-8,03 (1 Н, м) . МС (m/z): 401,3 (М+Н)+. Пример 39. Получение 1-[4'-изопропил-3'-(2-диметиламино-1-пропокси)бензолсульфонил]-1 Ниндола Используя методику, аналогично приведенной в примере 1, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1) : 2960, 1369, 1172, 1130. 1 Н-ЯМР (м.д.): 1,12-1,16 (9 Н, м), 2,35 (6 Н, с), 2,95-2,99 (1 Н, м), 3,24-3,27 (1 Н, м), 3,77-3,81 (1 Н, м),3,99-4,02 (1 Н, м), 6,65-6,66 (1 Н, м), 7,22-7,25 (ЗН, м), 7,32 (1 Н, м), 7,42-7,44 (1 Н, м), 7,53-7,55 (1 Н, д,J=7,76 Гц), 7,56-7,57 (1 Н, д, J = 3,64 Гц), 8,00-8,02 (1 Н, дд, J = 8,2 Гц). МС (m/z): 401,3 (М+Н)+. Пример 40. Получение 1-[4'-изопропил-3'-(N,N-диметиламиноэтокси)бензолсульфонил]-3-метил 1 Н-индола Используя методику, аналогично приведенной в примере 1, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2965, 1369, 1215, 1172. 1H-ЯМР (м.д.): 1,11-1,13 (6 Н, д, J = 6,92 Гц), 2,24 (3 Н, с), 2,34 (6 Н, с), 2,74 (2 Н, т), 3,23-3,26 (1 Н, м),4,02-4,05 (2 Н, т), 7,20-7,34 (5 Н, м), 7,40-7,42 (1 Н, дд, J = 8,05, 1,84 Гц), 7,45-7,47 (1 Н, д, J = 8,18 Гц), 7,988,00 (1 Н, д, J = 8,23 Гц). МС (m/z): 401,3 (М+Н)+. Пример 41. Получение 1-[4'-изопропил-3'-(N,N-диметиламинопропокси)бензолсульфонил]-3-метил 1 Н-индола Используя методику, аналогично приведенной в примере 1, с некоторыми некритичными изменениями, получают указанное выше производное.- 19016594 ИК (см-1): 2960, 1369, 1174. Н-ЯМР (м.д.): 1,12-1,13 (6 Н, д, J = 6,92), 1,94-1,98 (2 Н, м) , 2,17-2,27 (9 Н, с), 2,44-2,48 (2 Н, т), 3,213,25 (1 Н, м), 3,96-3,99 (2 Н, т), 7,18-7,20 (1 Н, д, J = 8,08 Гц), 7,22-7,33 (4 Н, м), 7,37-7,40 (1 Н, дд, J = 8,08,1,88 Гц), 7,45-7,47 (1 Н, д, J = 7,84), 7,99-8,01 (1 Н, д, J = 8,24 Гц). МС (m/z): 415 (М+Н)+. Пример 42. Получение 1-[4'-изопропил-3'-(N,N-диметиламиноэтокси)бензолсульфонил]-5-метокси 1 Н-индола Используя методику, аналогично приведенной в примере 1, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2956, 1477, 1357, 1234. 1H-ЯМР (м.д.): 1,11-1,13 (6 Н, д), 2,34 (6 Н, с), 2,72-2,75 (2 Н, т), 3,22-3,28 (1 Н, септет), 3,81 (3 Н, с),4,01-4,04 (2 Н, т), 6,58-6,59 (1 Н, д, J = 3,60 Гц), 6,91-6,94 (1 Н, дд, J = 2,48 Гц), 6,97-6,98 (1 Н, д, J = 3,80 Гц),7,20-7,22 (2 Н, м), 7,39-7,42 (1 Н, дд, J = 8,08, 1,84 Гц), 7,51 (1 Н, д, J = 3,6 Гц), 7,88-7,90 (1 Н, д, J = 8,96 Гц). МС (m/z): 417,5 (М+Н)+. Пример 43. Получение 1-[4'-изопропил-3'-(N,N-диметиламинопропокси)бензолсульфонил]-5 метокси-1 Н-индола Используя методику, аналогично приведенной в примере 1, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2960, 1365, 1174, 1147. 1 Н-ЯМР (м.д.): 1,12-1,14 (6 Н, д), 1,92-1,99 (2 Н, м), 2,26 (6 Н, с), 2,43-2,47 (2 Н, т), 3,22-3,27 (1 Н, м),3,81 (3 Н, с), 3,96-3,99 (2 Н, т), 6,57-6,58 (1 Н, м, J = 3,65 Гц), 6,92-6,94 (1 Н, дд, J = 8,96, 2,44 Гц), 6,97-6,98(1 Н, д, J = 2,44 Гц), 7,19-7,21 (1 Н, д, J = 8,08 Гц), 7,23 (1 Н, д, 1,84 Гц), 7,37-7,39 (1 Н, дд, J = 8,08, 1,84 Гц),7,51-7,52 (1 Н, д, J = 3,60 Гц), 7,88-7,90 (1 Н, д, J = 9,0 Гц). МС (m/z): 431,3 (М+Н)+. Пример 44. Получение 1-[4'-изопропил-3'-(2-диметиламинопропокси)бензолсульфонил]-5-метокси 1 Н-индола Используя методику, аналогично приведенной в примере 1, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2960, 1365, 1143. 1 Н-ЯМР (м.д.): 1,12-1,14 (6 Н, д), 1,17-1,19 (3 Н, д), 2,38 (6 Н, с), 3,02-3,06 (1 Н, м), 3,23-3,26 (1 Н, м),3,81 (3 Н, с), 3,82-3,84 (1 Н, м), 3,99-4,03 (1 Н, м), 6,58-6,59 (1 Н, м), 6,91-6,94 (1 Н, дд, J = 9,00, 2,52 Гц), 6,98(1 Н, д, J = 2,40 Гц), 7,21-7,23 (2 Н, м, J = 7,64, 2,16 Гц), 7,39-7,42 (1 Н, дд, J = 8,04, 1,76 Гц), 7,51-7,52 (1 Н,д, J = 3,64 Гц), 7,89-7,91 (1 Н, д, J = 9,0 Гц). МС (m/z): 431,3 (М+Н)+. Пример 45. Получение 1-[4'-изопропил-3'-(1-диметиламино-2-пропокси)бензолсульфонил)-5 метокси-1 Н-индола Используя методику, аналогично приведенной в примере 1, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2950, 1369, 1172, 1145. 1 Н-ЯМР (м.д.): 1,10-1,12 (6 Н, м), 1,21-1,22 (3 Н, д, J = 6,12 Гц), 2,28 (6 Н, с), 2,40-2,45 (1 Н, м), 2,552,60 (1 Н, м), 3,20-3,25 (1 Н, м), 3,81 (3 Н, с), 4,43-4,47 (1 Н, м), 6,57-6,58 (1 Н, д, J = 3,6 Гц), 6,90-6,93 (1 Н,дд, 9,0, 2,52 Гц), 6,97-6,98 (1 Н, д, J = 2,44 Гц), 7,19-7,21 (1 Н, д, J = 8,12 Гц), 7,29 (1 Н, д, J = l,76 Гц), 7,357,37 (1 Н, дд, 8,08, 1,84 Гц), 7,49-7,50 (1 Н, д, J = 3,6 Гц), 7,89-7,91 (1 Н, д, J = 9,0 Гц). МС (m/z): 430,9 (М+Н)+. Пример 46. Получение 1-[4'-изопропил-3'-(N,N-диметиламиноэтокси)бензолсульфонил]-5-фтор-1 Ниндола Используя методику, аналогично приведенной в примере 1, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2950, 1362, 1201, 1180. 1 Н-ЯМР (м.д.): 1,12-1,14 (6 Н, д, J = 6,92 Гц), 2,35 (6 Н, с), 2,75-2,78 (2 Н, т, J = 5,76 Гц), 3,24-3,28 (1 Н,м), 4,03-4,06 (2 Н, т, J = 5,76), 6,61-6,62 (1 Н, д, J = 3,72 Гц), 6,92-7,04 (1 Н, м), 7,17-7,19 (1 Н, м), 7,22-7,25(2H, м), 7,40-7,42 (1 Н, дд, J = 8,08, 1,84 Гц), 7,58-7,59 (1 Н, д, J = 3,68 Гц), 7,92-7,93 (1 Н, м, J = 4,4 Гц). МС (m/z): 405,4 (М+Н)+. Пример 47. Получение 1-[4'-изопропил-3'-(N,N-диметиламинопропокси)бензолсульфонил]-5-фтор 1 Н-индола Используя методику, аналогично приведенной в примере 1, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2964, 1371, 1217, 1174. 1- 20016594 МС (m/z): 419,4 (М+Н)+. Пример 48. Получение 1-[4'-изопропил-3'-(2-диметиламинопропокси)бензолсульфонил]-5-фтор-1 Ниндола Используя методику, аналогично приведенной в примере 1, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2964, 1462, 1373, 1174. 1 Н-ЯМР (м.д.): 1,12-1,15 (6H, м), 1,19-1,21 (3 Н, д), 2,40 (6 Н, с), 3,11-3,15 (1 Н, м), 3,24-3,27 (1 Н, м),3,84-3,88 (1 Н, м), 4,02-4,05 (1 Н, м), 6,61-6,62 (1 Н, д, J = 3,72 Гц), 7,04-7,05 (1 Н, м), 7,17-7,20 (1 Н, м), 7,227,23 (2 Н, м), 7,41-7,43 (1 Н, дд, J = 8,08, 1,8 Гц), 7,59-7,60 (1 Н, д, J = 3,64 Гц), 7,94-8,05 (1 Н, д, J = 4,04 Гц). МС (m/z): 419,4 (М+Н)+. Пример 49. Получение 1-[4'-изопропил-3'-(1-диметиламино-2-пропокси)бензолсульфонил]-5-фтор 1 Н-индола Используя методику, аналогично приведенной в примере 1, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2968, 1373, 1247, 1182. 1H-ЯМР (м.д.): 1,10-1,13 (6 Н, м), 1,21-1,24 (3 Н, д), 2,28 (6 Н, с), 2,41-2,45 (1 Н, м), 2,56-2,61 (1 Н, м),3,22-3,26 (1 Н, м), 4,43-4,48 (1 Н, м), 6,60-6,61 (1 Н, д, J = 3,56 Гц), 7,03 (1 Н, д, J = 1,8 Гц), 7,17-7,19 (1 Н, дд,J = 8,76, 2,52 Гц), 7,21-7,23 (1 Н, д, J = 8,12 Гц), 7,30 (1 Н, д, J=l,8 Гц), 7,36-7,38 (1 Н, д, J = 8,08 Гц), 7,577,58 (1 Н, д, J = 3,68 Гц), 7,93-7,94 (1 Н, дд, J = 4,40 Гц). МС (m/z): 419,4 (М+Н)+. Пример 50. Получение 1-[4'-изопропил-3'-(N,N-диметиламиноэтокси)бензолсульфонил]-5-фтор-3 метил-1H-индола Используя методику, аналогично приведенной в примере 1, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2929, 2962, 1369, 1176. 1H-ЯМР (м.д.): 1,12-1,14 (6 Н, д, J = 6,92 Гц), 2,20 (3 Н, с), 2,34 (6 Н, с), 2,72-2,75 (2 Н, т, J = 5,8 Гц),3,22-3,29 (1 Н, м), 4,02-4,05 (2 Н, т, J = 5,84 Гц), 7,04-7,10 (2 Н, м), 7,21-7,23 (2 Н, м), 7,32 (1 Н, д, J = 0,96 Гц), 7,37-7,39 (1 Н, дд, J = 8,08, 1,8 Гц), 7,91-7,94 (1 Н, м). МС (m/z): 419,4 (М+Н)+. Пример 51. Получение 1-[4'-изопропил-3'-(N,N-диметиламинопропокси)бензолсульфонил]-5-фтор 3-метил-1 Н-индола Используя методику, аналогично приведенной в примере 1, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2962, 1367, 1247, 1178. 1(2 Н, т, J =7,6 Гц), 3,19-3,25 (1 Н, м), 3,95-3,98 (2 Н, т, J = 6,16 Гц), 7,03-7,10 (2 Н, м), 7,19-7,21 (2 Н, м), 7,327,36 (2 Н, м), 7,91-7,94 (1 Н, м). МС (m/z): 433,4 (М+Н)+. Пример 52. Получение 5-метокси-1-[4'-изопропил-3'-(1-метилпиперидин-4 илокси)бензолсульфонил]-1 Н-индола Используя методику, аналогично приведенной в примере 7, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2966, 1614, 1467, 1361, 1139. 1 Н-ЯМР (м.д.): 1,12-1,13 (6 Н, д, J = 6,84 Гц), 1,76-1,90 (2 Н, м), 1,96-2,04 (2 Н, м), 2,31 (5 Н, ушир.с), 2,60(1 Н, д, J = 3,53 Гц), 7,89-7,91 (1 Н, д, J = 8,97 Гц). МС (m/z) : 443,5 (М+Н)+. Пример 53. Получение 5-фтор-1-[4'-изопропил-3'-(1-метилпиперидин-4-илокси)бензолсульфонил]1 Н-индола Используя методику, аналогично приведенной в примере 7, с некоторыми некритичными изменениями, получают указанное выше производное. Диапазон плавления: 73,2-74,5 С ИК (см-1): 3018, 2964, 1591, 1462, 1348, 1141. 1 Н-ЯМР (м.д.): 1,13-1,15 (6 Н, д, J = 6,89 Гц), 1,77-1,80 (2 Н, м), 1,89-1,91 (2 Н, м), 2,31 (5 Н, ушир.с),2,59 (2 Н, м), 3,22-3,28 (1 Н, м), 4,30 (1 Н, м), 6,61-6,62 (1 Н, д, J = 3,60 Гц), 7,01-7,06 (1 Н, дт, J = 9,0, 2,48 Гц), 7,16 (1 Н, д, J = l,44 Гц), 7,17-7,20 (1 Н, дд, J = 8,79, 2,4 Гц), 7,23-7,25 (1 Н, д, J = 8,13 Гц), 7,36-7,38(1 Н, дд, J = 8,08, 1,5 Гц), 7,57 (1 Н, д, J = 3,64 Гц), 7,94-7,97 (1 Н, м). МС (m/z): 431,4 (М+Н)+. Пример 54. Получение 3-метил-1-[4'-метил-3'-(1-метилпиперидин-4-илокси)бензолсульфонил]-1 Ниндола Используя методику, аналогично приведенной в примере 7, с некоторыми некритичными измене- 21016594 ниями, получают указанное выше производное. ИК (см-1): 2931, 2794, 1593, 1450, 1365, 1168. 1MC (m/z): 399,2 (М+Н)+. Пример 55. Получение 5-метокси-1-[4-этил-3-(1-метилпиперидин-4-илокси)бензолсульфонил]-1 Ниндола Используя методику, аналогично приведенной в примере 7, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2958, 11467, 1369, 1143, 1037. 1 Н-ЯМР (м.д.): 1,10-1,43 (3 Н, т, J = 7,28 Гц), 1,78 (2 Н, м), 1,91-1,92 (2 Н, м), 2,33 (3 Н, с), 2,41-2,42MC (m/z): 429,3 (М+Н)+. Пример 56. Получение гидрохлорида 5-метокси-1-[4'-метокси-3'-(пиперидин-4 илокси)бензолсульфонил]-1 Н-индола Используя методику, аналогично приведенной в примере 7, с некоторыми некритичными изменениями, получают указанное выше производное. Диапазон плавления: 231,2-232,7C. ИК (см-1): 2978, 2927, 1615, 1435, 1371, 1143, 1030. 1MC (m/z) : 417,4 (М+Н)+. Пример 57. Получение 5-метокси-1-[4'-метокси-3'-(1-метилпиперидин-4-илокси)бензолсульфонил]1 Н-индола Используя методику, аналогично приведенной в примере 7, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2942, 2797, 1615, 1466, 1367, 1143, 1030. 1(1 Н, дд, J = 8,98, 2,40 Гц), 6,95-6,96 (1 Н, д, J = 2,32 Гц), 7,22-7,23 (1 Н, д, J = 2,1 Гц), 7,45-7,47 (2 Н, м),7,87-7,89 (1 Н, д, J=8,97 Гц). МС (m/z): 431,3, (М+Н)+. Пример 58. Получение 5-фтор-1-(4'-метокси-3'-(1-метилпиперидин-4-илокси)бензолсульфонил]-1 Ниндола Используя методику, аналогично приведенной в примере 7, с некоторыми некритичными изменениями 5, получают указанное выше производное. ИК (см-1): 2934, 2778, 1614, 1462, 1365, 1142, 1082. 1H-ЯМР (м.д.): 1,71-1,78 (2 Н, м), 1,85 (2 Н, м), 2,04 (2 Н, м), 2,30 (3 Н, с), 2,69 (2 Н, м), 3,83 (3 Н, с),4,14 (1 Н, м), 6,59-6,60 (1 Н, д, J = 3,45 Гц), 6,83-6,85 (1 Н, д, J = 8,62 Гц), 7,0-7,05 (1 Н, дт, J = 9,0, 2,16 Гц),7,15-7,18 (1 Н, дд, J = 86,7, 2,16 Гц), 7,23-7,24 (1 Н, д, J = 1,76 Гц), 7,46-7,49 (1 Н, дд, J = 8,56, 1,84 Гц), 7,557,56 (1 Н, д, J = 3,49 Гц), 7,91-7,95 (1 Н, кв., J = 8,96, 4,32 Гц) . МС (m/z): 419,3 (М+Н)+. Пример 59. Получение 5-фтор-1-[4'-хлор-3'-(1-метилпиперидин-4-илокси)бензолсульфонил]-1 Ниндола Используя методику, аналогично приведенной в примере 7, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2950, 1463, 1366, 1176, 1046. 1 Н-ЯМР (м.д.): 1,77-1,83 (2 Н, м), 1,88-1,93 (2 Н, м), 2,31 (3 Н, с), 2,35 (2 Н, м), 2,61 (2 Н, м), 4,14 (1 Н,м), 6,64 (1 Н, д, J = 3,55 Гц), 7,02-7,07 (1 Н, дт, J = 9,0, 2,51 Гц), 7,18-7,20 (1 Н, дд, J = 8,63, 2,49 Гц), 7,277,28 (1 Н, д, J = l,99 Гц), 7,33-7,35 (1 Н, дд, J = 8,34, 2,03 Гц), 7,40-7,42 (1 Н, д, J = 8,34 Гц), 7,52-7,54 (1 Н, д,J = 3,65 Гц), 7,91-7,94 (1 Н, кв, J = 9,04, 4,38 Гц). МС (m/z): 423,26 (М+Н)+. Пример 60. Получение 5-фтор-3-метил-1-[4'-метокси-3'-(1-метилпиперидин-4-илокси)бензолсульфонил]-1 Н-индола Используя методику, аналогично приведенной в примере 1, с некоторыми некритичными изменениями, получают указанное выше производное.(1 Н, дд, J = 8,63, 2,40 Гц), 7,21-7,22 (1 Н, д, J = 2,1 Гц), 7,29 (1 Н, с), 7,44-7,46 (1 Н, дд, J = 8,5, 2,1 Гц), 7,917,94 (1 Н, кв, J = 8,9, 4,3 Гц). МС (m/z): 433,4 (М+Н)+. Пример 61. Получение 5-метокси-3-метил-1-[4'-изопропил-3'-(1-метилпиперидин-4 илокси)бензолсульфонил]-1H-индола Используя методику, аналогично приведенной в примере 7, с некоторыми некритичными изменениями, получают указанное выше производное. Диапазон плавления: 73,2-74,5 С. ИК (см-1): 3113, 2941, 1595, 1475, 1365, 1172. 1(1 Н, д, J = 8,92 Гц). МС (m/z): 457,3 (М+Н)+. Пример 62. Получение 6-хлор-1-[4'-метокси-3'-(1-метилпиперидин-4-илокси)бензолсульфонил]-1 Ниндола Используя методику, аналогично приведенной в примере 7, с некоторыми некритичными изменениями, получают указанное выше производное. Диапазон плавления: 112-115 С. ИК (см-1): 2966, 2786, 1581, 1459, 1374, 1140, 1092. 1 Н-ЯМР (м.д.): 1,74-1,77 (2 Н, м), 1,78-1,81 (2 Н, м), 2,25 (2 Н, м), 2,31 (3 Н, с), 2,70 (2 Н, м), 3,84 (3 Н,с), 4,22 (1 Н, м), 6,60-6,61 (1 Н, д, J = 3,44 Гц), 6,85-6,87 (1 Н, д, J = 8,62 Гц), 7,19-7,21 (1 Н, дд, J = 8,25 Гц),7,30 (1 Н, д, J = l,72 Гц), 7,42-7,45 (1 Н, д, J = 8,37 Гц), 7,47-7,52 (2H, м), 8,02 (1 Н, с). МС (m/z): 435, 3 (М+Н)+ . Пример 63. Получение 5-бром-1-[4'-метокси-3'-(1-метилпиперидин-4-илокси)бензолсульфонил]-1 Ниндола Используя методику, аналогично приведенной в примере 7, с некоторыми некритичными изменениями, получают указанное выше производное. Диапазон плавления: 127,2-128 С. ИК (см-1): 2933, 2806, 1585, 1440, 1369, 1170, 1092. 1(1 Н, д, J = 1,11 Гц), 7,86-7,88 (1 Н, д, J = 8,78 Гц). МС (m/z): 479,2 (М+Н)+. Пример 64. Получение 3-бром-5-фтор-1-[4'-метокси-3'-(1-метилпиперидин-4 илокси)бензолсульфонил]-1 Н-индола Используя методику, аналогично приведенной в примере 7, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2942, 2795, 1619, 1468, 1370, 1139, 1031. 1 Н-ЯМР (м.д.): 1,88-1,97 (4 Н, м), 2,17 (2 Н, м), 2,29 (3 Н, с), 2,76-2,79 (2 Н, м), 3,90 (3 Н, с), 4,24 (1 Н, м),6,59-6,60 (1 Н, д, J = 3,65 Гц), 6,91 (1 Н, д, J = 2,46 Гц), 6,93-6,96 (1 Н, д, J = 8,96 Гц), 7,20-7,22 (1 Н, дд, J = 8,78,2,44 Гц), 7,52-7,56 (1 Н, кв, J = 9,01, 4,32 Гц), 7,77-7,78 (1 Н, д, J = 3,67 Гц), 7,92-7,95 (1 Н, д, J = 8,95 Гц). МС (m/z): 497,55 (М+Н)+. Пример 65. Получение гидрохлорида 3-бром-5-фтор-1-[4'-этил-3'-(пиперидин-4 илокси)бензолсульфонил]-1 Н-индола Используя методику, аналогично приведенной в примере 7, с некоторыми некритичными изменениями, получают указанное выше производное. Диапазон плавления: 289,9-291,5 С. ИК (см-1): 2965, 2794, 1593, 1467, 1375, 1154, 1031. 1H-ЯМР (м.д.): 1,04-1,08 (3 Н, т, J = 7,48 Гц), 1,75-1,78 (2 Н, м), 2,0-2,04 (2 Н, м), 2,53-2,58 (2 Н, кв, J = 7,43 Гц), 3,11-3,16 (4 Н, м), 4,86 (1 Н; м), 7,27-7,32 (2 Н, м), 7,38-7,40 (1 Н, д, J = 7,82 Гц), 7,53-7,55 (2 Н, д, J = 8,82 Гц),8,06-8,10 (1 Н, дд, J = 8,96, 4,32 Гц), 8,29 (1 Н, с), 8,59 (1 Н, ушир.с), 8,72 (1 Н, ушир.с). МС (m/z): 481,1, 483,1 (М+Н)+. Пример 66. Получение гидрохлорида 5-фтор-1-[4'-этил-3'-(пиперидин-4-илокси)бензолсульфонил]1 Н-индола Используя методику, аналогично приведенной в примере 7, с некоторыми некритичными изменениями, получают указанное выше производное. Диапазон плавления: 201,46-204,21 С. 1(1 Н, дд, J = 8,79 Гц), 7,31-7,35 (2 Н, м), 7,46-7,48 (1 Н, д, J = 3,5 Гц), 8,06-8,10 (1 Н, кв, J = 8,96, 4,32 Гц),8,29 (1 Н, с), 8,59 (1 Н, ушир.с), 7,99-8,03 (1 Н, дд, J = 8,95, 4,35 Гц) . МС (m/z): 403,2 (М+Н)+. Пример 67. Получение 3-бром-5-фтор-1-[4'-этил-3'-(1-метилпиперидин-4-илокси)бензолсульфонил]1 Н-индола Используя методику, аналогично приведенной в примере 7, с некоторыми некритичными изменениями, получают указанное выше производное. Диапазон плавления: 133,2-134,5 С. ИК (см-1): 3145, 2969, 2799, 1614, 1589, 1365, 1153. 1MC (m/z) : 495,2 (М+Н)+. Пример 68. Получение 6-бром-1-[4'-этил-3'-(1-метилпиперидин-4-илокси)бензолсульфонил]-1 Ниндола Используя методику, аналогично приведенной в примере 7, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 3144, 2968, 2932, 1589, 1368, 1147. 1 Н-ЯМР (м.д.): 1,11-1,15 (3 Н, т, J=7,52 Гц), 1,24-1,27 (2 Н, м), 1,78 (2 Н, м), 1,95 (2 Н, м), 2,25 (3 Н, с),2,31 (2 Н, м), 2,56-2,58 (2 Н, кв, J = 7,32 Гц), 4,35 (1 Н, м), 6,60-6,61 (1 Н, д, J = 3,49 Гц), 7,19-7,21 (1 Н, м),7,32-7,39 (4 Н, м), 7,50-7,53 (1 Н, д, J = 3,67 Гц), 8,19 (1 Н, с).MC (m/z): 477,20 (М+Н)+. Пример 69. Получение 1-[4'-этил-3'-(1-метилпиперидин-4-илокси)бензолсульфонил]-1 Н-индола Используя методику, аналогично приведенной в примере 7, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2934, 2796, 1593, 1491, 1373, 1170, 1041. 1MC (m/z): 399,3 (М+Н)+. Пример 70. Получение 6-хлор-1-[4'-этил-3'-(1-метилпиперидин-4-илокси)бензолсульфонил]-1 Ниндола Используя методику, аналогично приведенной в примере 7, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1) : 2930, 2796, 1594, 1490, 1376, 1169, 1042. 1MC (m/z): 433,3 (М+Н)+. Пример 71. Получение 5-фтор-1-[4'-этил-3'-(1-метилпиперидин-4-илокси)бензолсульфонил]-1 Ниндола Используя методику, аналогично приведенной в примере 7, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2930, 2800, 1608, 1495, 1369, 1170, 1044. 1 Н-ЯМР (м.д.): 1,11-1,14 (3 Н, т, J = 7,52 Гц), 1,76-1,77 (2 Н, м), 1,88-1,90 (2 Н, м), 2,31 (3 Н, с), 2,352,37 (2 Н, м), 2,56-2,61 (4 Н, м), 4,30 (1 Н, м), 6,61-6,62 (1 Н, д, J = 3,58 Гц), 6,99-7,06 (1 Н, дт, J = 9,04, 2,47 Гц), 7,15-7,19 (3 Н, м), 7,34-7,36 (1 Н, дд, J = 7,9, 1,58), 7,56-7,57 (1 Н, д, J = 3,6 Гц), 7,93-7,96 (1 Н, дд, J = 9,02, 4,39 Гц).MC (m/z): 417,57 (М+Н)+. Пример 72. Получение 5-фтор-3-метил-1-[4'-изопропил-3'-(1-метилпиперидин-4 илокси)бензолсульфонил]-1 Н-индола Используя методику, аналогично приведенной в примере 7, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2941, 1595, 1467, 1369, 1139. 1MC (m/z): 445,5 (М+Н)+. Пример 73. Получение 5-бром-1-[4'-изопропил-3'-(1-метилпиперидин-4-илокси)бензолсульфонил]1 Н-индола Используя методику, аналогично приведенной в примере 7, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2956, 1581, 1444, 1373, 1170.MC (m/z): 491,2 (М+Н)+. Пример 74. Получение 5-бром-1-[4'-хлор-3'-(1-метилпиперидин-4-илокси)бензолсульфонил]-1 Ниндола Используя методику, аналогично приведенной в примере 7, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2939, 1582, 1474, 1377, 1173. 1 Н-ЯМР (м.д.): 1,82-1,88 (2 Н, м), 2,0-2,02 (2 Н, м), 2,32 (3 Н, с), 2,61 (2 Н, м), 2,84 (2 Н,с), 4,34 (1 Н, м),6,61-6,62 (1 Н, д, J = 3,69 Гц), 7,26 (1 Н, с), 7,33-7,35 (1 Н, дд, J = 2,08, 8,34 Гц), 7,40-7,43 (2 Н, м), 7,49-7,50(1 Н, д, J = 3,67 Гц), 7,67-7,68 (1 Н, д, J = l,85 Гц), 7,85-7,87 (1 Н, д, J = 8,8 Гц). МС (m/z): 483,1 (М+Н)+. Пример 75. Получение 6-метокси-1-[4'-хлор-3'-(1-метилпиперидин-4-илокси)бензолсульфонил]-1 Ниндола Используя методику, аналогично приведенной в примере 7, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2940, 1582,1468, 1374, 1173. 1H-ЯМР (м.д.): 1,67-1,81 (2 Н, м), 1,86-1,91 (2 Н, м), 2,29 (5 Н, ушир.с), 2,59-2,61 (2 Н, м), 3,86 (3 Н, с),4,32 (1 Н, м), 6,58-6,59 (1 Н, д, J = 3,61 Гц), 6,85-6,88 (1 Н, дд, J = 8,6, 2,21 Гц), 7,27 (1 Н, д, J = l,82 Гц), 7,307,4 (4 Н, м), 7,51-7,52 (1 Н, д, J = 1,97 Гц). МС (m/z): 435,3 (М+Н)+. Пример 76. Получение 5-бром-1-[4'-этил-3'-(1-метилпиперидин-4-илокси)бензолсульфонил]-1 Ниндола Используя методику, аналогично приведенной в примере 7, с некоторыми некритичными изменениями, получают указанное выше производное. 1 Н-ЯМР (м.д.): 1,11-1,14 (3 Н, т, J = 7,48 Гц), 1,76-1,77 (2 Н, м), 1,88-1,90 (2 Н, м), 2,32 (4 Н, м), 2,562,61 (5 Н, м), 4,29-4,32 (1 Н, м), 6,58-6,60 (1 Н, д, J = 3,6 Гц), 7,14 (1 Н, д, J = l,8 Гц), 7,18-7,19 (1 Н, д, J = 7,96 Гц), 7,34-7,36 (1 Н, дд, J = 7,84 Гц), 7,39-7,41 (1 Н, дд, J = 8,8 Гц), 7,53-7,54 (1 Н, д, J = 3,68 Гц), 7,66-7,67MC (m/z): 477,2 (М+Н) +. Пример 77. Получение 6-хлор-1-[3'-(1-метилпиперидин-4-илокси)бензолсульфрнил]-1 Н-индола Используя методику, аналогично приведенной в примере 7, с некоторыми некритичными изменениями, получают указанное выше производное.MC (m/z): 405,3 (М+Н)+. Пример 78. Получение гидрохлорида 6-хлор-1-[4'-хлор-3'-(пиперидин-4-илокси)бензолсульфонил]1 Н-индола Используя методику, аналогично приведенной в примере 7, с некоторыми некритичными изменениями, получают указанное выше производное. Диапазон плавления: 258,3-259,5 С. ИК (см-1): 3082, 2935, 2757, 1580, 1390, 1178. 1MC (m/z): 425,2 (М+Н)+. Пример 79. Получение 4-хлор-1-[4'-метил-3'-(N,N-диметиламинопропокси)бензолсульфонил]-1 Ниндола Используя методику, аналогично приведенной в примере 16, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2927, 1376, 1252, 1167, 756, 682. 1MC (m/z): 407,4, 409,2 (М+Н)+. Пример 80. Получение 5-метокси-1-[3'-(N,N-диметиламиноэтокси)бензолсульфрнил]-1 Н-индола Используя методику, аналогично приведенной в примере 1, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2943, 1468, 1370, 1226, 1148, 1031.(1 Н, д, J = 9,08 Гц). МС (m/z): 375,3 (М+Н)+. Пример 81. Получение l-[3'-(N,N-диметиламинопропокси)бензолсульфонил]-1 Н-индола Используя методику, аналогично приведенной в примере 4, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2945, 1445, 1373, 1262, 1174. 1H-ЯMP (м.д.): 1,88-1,95 (2 Н, м, J = 7,20 Гц), 2,20 (6 Н, с), 2,39-2,42 (2 Н, т, J = 7,12 Гц), 3,95-3,98 (2 Н,т, J = 7,12 Гц), 6,66 (1 Н, д, J = 3,40 Гц), 7,01-7,04 (1 Н, м), 7,21-7,43 (5 Н, м), 7,52-7,54 (1 Н, д, J = 7,76 Гц),7,55-7,56 (1 Н, д, J = 3,7 Гц), 7,98-8,00 (1 Н, д, J = 8,30 Гц). МС (m/z): 359,7 (М+Н)+. Пример 82. Получение 1-[4'-изопропил-3'-(N,N-диметиламинопропокси)бензолсульфонил]-1 Ниндола Используя методику, аналогично приведенной в примере 1, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2960, 1371, 1172, 1130, 673. 1 Н-ЯМР (м.д.): 1,12-1,14 (6 Н, д, J = 6,96), 1,93-2,00 (2 Н, квин., 7,52 Гц), 2,27 (6 Н, с), 2,43-2,48 (2 Н, т,7,16 Гц), 3,20-3,27 (1 Н, септет, J = 6,92 Гц), 3,97-4,00 (2 Н, т, 6,16 Гц), 6,65-6,66 (1 Н, дд, J = 3,72, 0,64 Гц),7,20-7,22 (1 Н, д, J = 8,24 Гц), 7,24-7,26 (2 Н, м), 7,29-7,34 (1 Н м), 7,40-7,42 (1 Н, д, 8,08, 1,84 Гц), 7,53-7,55(1 Н, д, J = 7,72 Гц), 7,56 (1 Н, д, J = 3,68 Гц), 8,00-8,02 (1 Н, дд, J=8,32, 0,72 Гц). МС (m/z): 401,3 (М+Н)+. Пример 83. Получение 5-хлор-1-[4'-хлор-3'-(1-метилпиперидин-4-илокси)бензолсульфонил]-1 Ниндола Используя методику, аналогично приведенной в примере 7, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2961, 1442, 1378, 1258, 1173. 1 Н-ЯМР (м.д.): 1,80-1,84 (2 Н, м), 1,97-2,04 (2 Н, м), 2,36 (3 Н, с), 2,45 (2 Н, м), 2,64-2,67 (2 Н, м), 4,39(1 Н, д, J = 8,34 Гц), 7,51 (1 Н, с), 7,51-7,52 (1 Н, д, J = 3,56 Гц), 7,89-7,92 (1 Н, д, J = 8,82 Гц). МС (m/z): 439,2, 441,3, 442,3 (М+Н)+. Пример 84. Получение 1-[4'-хлор-3'-(1-метилпиперидин-4-илокси)бензолсульфонил]-5-метокси-3 метил-1 Н-индола Используя методику, аналогично приведенной в примере 7, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2949, 2362, 1535, 1353, 1258, 1174. 1 Н-ЯМР (м.д.): 1,72-1,80 (2 Н, м), 1,84-1,89 (2 Н, м), 2,19 (3 Н, с), 2,30 (5 Н, ушир.с), 2,59-2,61 (2 Н, м),3,83 (3 Н, с), 4,31 (1 Н, м), 6,86-6,87 (1 Н, д, J = 2,32 Гц), 6,90-6,93 (1 Н, дд, J = 8,96, 2,41 Гц), 7,19 (1 Н, с),7,24 (1 Н, д, J = l,76 Гц), 7,29-7,31 (1 Н, дд, J = 8,32, 1,84 Гц), 7,35-7,37 (1 Н, д, J = 8,32 Гц), 7,86-7,88 (1 Н, д,J = 8,96 Гц). МС (m/z): 449,3, 451,3 (М+Н)+. Пример 85. Получение 1-[4'-этил-3'-(1-метаилпиперидин-4-илокси) бензол сульфонил] -5-фтор-3 метил-1 Н-индола Используя методику, аналогично приведенной в примере 7, с некоторыми некритичными изменениями, получают указанное выше производное. ИК (см-1): 2964, 2783, 1592, 1362, 1252, 1172. 1 Н-ЯМР (м.д.): 1,10-1,13 (3 Н, т, J = 7,52 Гц), 1,70-1,76 (2 Н, м), 1,78 (2 Н, м), 2,19 (3 Н, с), 2,31 (5 Н,ушир.с), 2,54-2,60 (4 Н, м), 4,30 (1 Н, м), 6,99-7,04 (1 Н, дт, J = 8,98, 2,46 Гц), 7,07-7,10 (1 Н, дд, J = 8,69, 2,46 Гц), 7,13 (IB, д, J = l,38 Гц), 7,15-7,17 (1 Н, д, J = 7,96 Гц), 7,30 (1 Н, с), 7,32 (1 Н, дд, J = 1,58 Гц), 7,90-7,94(1 Н, дд, J = 8,96, 4,36 Гц). МС (m/z): 431,3 (М+Н)+. Пример 86. Определение потребления пищи Используют самцов крыс Wistar (120-140 г), полученных от N.I.N. (National Institute of Nutrition,Hyderabad, India). Затем определяют хронический эффект соединений общей формулы (I) на потребление пищи у упитанных крыс следующим образом. Крыс содержат в отдельных клетках в течение 28 дней. В течение этого периода один раз в день крысам вводят перорально или внутрибрюшинно дозу композиции, содержащей соединение формулы(1), или соответствующей композиции (носителя) без указанного соединения (контрольная группа). Крысам обеспечивают свободный доступ к пище и воде. В дни 0, 1, 7, 14, 21 и 28 крысам оставляют предварительно взвешенные количества пищи. Определяют потребление пищи и прирост массы относительно исходного значения. Способ определения приема пищи раскрыт также в литературе (Kask et al., European Journal of Pharmacology, 414, 2001, 215-224, Turn- 26016594ball et al., Diabetes, vol 51, August 2002 и некоторые частные модификации). Соответствующие части описаний включены в данное описание посредством ссылок и составляют часть раскрытия. Некоторые конкретные соединения демонстрируют статистически значимое снижение потребления пищи, если эксперимент проводят описанным выше способом при дозах 10 мг/кг, или 30 мг/кг, или обеих. Пример 87. Таблетка, содержащая соединение формулы (I) Ингредиенты объединяют и гранулируют, используя растворитель, например метанол. Затем препарат сушат и формуют в виде таблеток (содержащих примерно 20 мг активного соединения) при помощи подходящей машины для таблетирования. Пример 88. Композиция для перорального введения Ингредиенты смешивают и распределяют по капсулам, каждая из которых содержит примерно 100 мг; одна капсула должна соответствовать общей дневной дозе. Пример 89. Жидкий препарат для перорального применения Ингредиенты смешивают с получением суспензии для перорального введения. Пример 90. Препарат для парентерального применения Активный ингредиент растворяют в части воды для инъекции. Затем добавляют при перемешивании достаточное количество хлорида натрия для изотоничности раствора. Раствор доводят до определенной массы оставшейся водой для инъекций, фильтруют через 0,2 мкм мембранный фильтр и упаковывают в стерильных условиях. Пример 91. Препарат в виде суппозитория Ингредиенты плавят вместе, перемешивают на паровой бане и выливают в формы, содержащие 2,5 г общей массы.- 27016594 Пример 92. Препарат для наружного применения Все ингредиенты за исключением воды объединяют и нагревают примерно до 60 С при перемешивании. Затем добавляют достаточное количество воды при температуре примерно 60 С и энергичном перемешивании для эмульгирования ингредиентов и затем добавляют воду, сколько требуется до массы примерно 100 г. Пример 93. Модель с задачей распознавания предметов Оценивают свойства соединений настоящего изобретения усиливать когнитивную способность, используя животную модель когнитивной способности: модель с задачей распознавания предметов. В качестве экспериментальных животных используют самцов крыс Wistar (230-280 г), полученных от N.I.N. (National Institute of Nutrition, Hyderabad, India). В каждую клетку помещают четырех животных. За один день до исследования животных выдерживают при 20% пищевой депривации, во время эксперимента дают воду без ограничения и поддерживают световой режим свет/темнота с 12-часовым циклом. Также крыс приучают в течение 1 ч к индивидуальным аренам в отсутствие предметов. Животные одной группы из 12 крыс принимают носитель (1 мл/кг) перорально, и животные другой группы принимают соединение формулы (I) перорально или внутрибрюшинно за один час до ознакомительного испытания (Т 1) и испытания с выбором (Т 2). Эксперимент проводят в камере открытое поле 505050 см, изготовленной из акрила. На ознакомительной фазе (Т 1) крыс помещают индивидуально в открытое поле на 3 мин, где в двух смежных углах на расстоянии 10 см от стенок размещены два идентичных предмета (пластиковые бутылки высотой 12,5 см с диаметром 5,5 см), замотанные одной желтой маскировочной лентой (a1 и а 2). Через 24 ч. после испытания (Т 1) на проверку долгосрочной памяти, этих же крыс помещают на ту же арену, где они были в Т 1-испытании. На фазе выбора (Т 2) крысам позволяют исследовать открытое поле в течение 3 мин в присутствии одного знакомого предмета (а 3) и одного нового предмета (b) (стеклянной бутылки янтарного цвета высотой 12 см с диаметром 5 см). Знакомые предметы представляют одинаковую текстуру, цвет и размеры. Во время испытаний Т 1 и Т 2 исследование каждого предмета (определяемое как фырканье, облизывание, жевание или движение вибрисс при движении носа по направлению к предмету на расстояние менее 1 см) регистрируют отдельно при помощи секундомера. Сидение на предмете не считается исследовательской активностью, однако такое наблюдается редко. Т 1 соответствует общему времени, потраченному на исследование знакомых предметов (a1+a2). Т 2 соответствует общему времени, потраченному на исследование знакомого предмета и нового предмета (а 3+b). Тест на распознавание предметов проводят, как описано Ennaceur, A., Delacour, J., 1988, "A new onetrial test for neurobiological studies of memory in rat Behavioral data", Behav. Brain. Res., 31, 47-59. Некоторые конкретные соединения демонстрируют положительные эффекты, указывающие на повышенную способность распознавания новых предметов, то есть увеличенное время исследования при наличии нового предмета и более высокий показатель дифференциации. Пример 94. Индуцирование жевания/зевоты/потягивания антагонистами рецепторов 5-НТ 6 Используют самцов крыс Wistar массой 200-250 г. Крысам делают инъекции носителя и помещают в индивидуальные прозрачные камеры на 1 ч в день в течение 2 дней до дня тестирования для их привыкания к камерам наблюдения и процедуре тестирования. В день тестирования крыс помещают в камеры наблюдения сразу после введения лекарственного средства и непрерывно наблюдают за зевотой, потягиванием и жевательным поведением в период от 60 до 90 мин после инъекций лекарственного средства или носителя. За 60 мин до введения лекарственного средства всем животным вводят физостигмин, 0,1 мг/кг внутрибрюшинно. Регистрируют среднее количество зевков, потягиваний и бесцельных жевательных движений за 30-минутный период наблюдения. Ссылки: (A) King M. V., Sleight A., J., Woolley M.L. et al., Neuropharmacology, 2004, 47, 195-204. (В)Bentey J.C., Bourson A., Boess F.G., Fone K.C.F., Marsden C.A., Petit N., Sleight A.J., British Journal of Pharmacology, 1999, 126 (7), 1537-1542. Пример 95. Водный лабиринт Установка с водным лабиринтом состоит из кругового бассейна (диаметр 1,8 м, высота 0,6 м), изготовленного из черного оргстекла Perspex (TSE systems, Germany), заполненного водой (-242 С) и расположенного под широкоугольной видеокамерой для слежения за животным. Платформу из Perspex 10 см 2,лежащую на 1 см ниже поверхности воды, помещают в центр одной из четырех воображаемых четвер- 28016594 тей, которая остается постоянной для всех крыс. Используемый в конструкции лабиринта и платформы черный Perspex не пропускает внутрь лабиринта информацию, указывающую действия по спасению. В противоположность этому, учебная комната дает информацию в виде нескольких сильных визуальных сигналов вне бассейна в помощь образованию пространственной схемы, необходимой для обучения спасению. Используют автоматические системы слежения [Videomot 2 (5,51), TSE systems, Germany]. Эта программа анализирует видеоизображения, полученные при помощи цифровой камеры и дисплея для получения изображения, которые определяют длину пути, скорость плавания, количество подходов и продолжительность времени плавания, проводимого в каждом квадранте водного лабиринта. Ссылки: (A) Yamada N., Hattoria A., Hayashi Т., Nishikawa Т., Fukuda H. et al. , Pharmacology, Biochem. and Behaviour, 2004, 78, 787-791; (B) Under M.D., Hodges D.B., Hogan J.B., Corsa J.A. et al., TheJournal of Pharmacology and Experimental Therapeutics, 2003, 307 (2), 682-691. Пример 96. Установка для изучения пассивного избегания Животных обучают на стадии с одной попыткой в условиях света-темноты по принципу пассивного избегания. Обучающая установка состоит из камеры с длиной 300 мм, шириной 260 мм и высотой 270 мм, изготовленной по установленным чертежам. Фронтальная и верхняя поверхности являются прозрачными, давая возможность экспериментатору наблюдать поведение животного внутри установки. Камера поделена на два отсека, разделенных центральной заслонкой, которая содержит небольшое отверстие шириной 9 мм и высотой 75 мм, находящееся близко к фронтальной стороне камеры. Меньший из отсеков имеет ширину 50 мм и содержит маломощный (6V) источник освещения. Больший отсек имеет ширину 210 мм и не освещается. Пол темного отсека состоит из решетки с 16 горизонтальными брусками из нержавеющей стали, которые имеют диаметр 5 мм и расположены на расстоянии 12,5 мм друг от друга. Генератор тока подает ток 0,75 мА к решетке пола, который проходит каждые 0,5 с через 16 стержней. Для контрольной группы крыс рассчитан диапазон сопротивления 40-60 мкОм, и установку калибруют соответствующим образом. Электронная схема, детектирующая сопротивление животного, обеспечивает точную подачу тока посредством автоматического изменения вольтажа при изменении сопротивления. Экспериментальная методика Эксперимент проводят, как описано выше. Используют взрослых самцов крыс Wister массой 200230 г. Животных приносят в лабораторию за 1 ч до эксперимента. В день обучения животных помещают мордой к задней части светлого отсека установки. Таймер включают, как только животное полностью повернется к передней части камеры. Регистрируют время до входа в темную камеру (обычно 20 с) и,когда животное полностью входит в темный отсек, то неизбежно получает удар током 0,75 мА по ногам в течение 300 с. Затем животных возвращают в клетки их содержания. Между каждыми обучающими сессиями оба отсека камеры чистят, удаляя любые запутывающие обонятельные сигналы. Оценивают воспоминание данного ингибирующего раздражителя через 24, 72 ч и на 7 день после обучения, возвращая животное в светлую камеру и регистрируя время до входа в темную камеру, используют временной критерий 300 с. Ссылки: (A) Callahan P. ML, Ilch С. P., Rowe N.B., Tehim A., Abst. 776, 19, 2004, Society for neuroscience, 2004. (В) Fox G. В., Connell A.W.U., Murphy K.J., Regan С.М., Journal of Neurochemistry, 1995, 65, 6,2796-2799. Пример 97. Исследование связывания человеческого рецептора 5-НТ 6 Соединения можно исследовать согласно следующим методикам. Материалы и методы источник рецептора: человеческий рекомбинантный, экспрессированный в клетках НЕК 293; радиолиганд: [3H]LSD (60-80 кюри/ммоль); конечная концентрация лиганда: [1,5 нМ]; неспецифическая детерминанта: метиотепинмезилат [0,1 мкМ]; соединение сравнения: метиотепинмезилат; позитивный контроль: метиотепинмезилат. Условия инкубации Взаимодействия проводят в 50 мкМ TRIS-HCl (рН 7,4), содержащем 10 мкМ МgСl2 и 0,5 мМ EDTA,в течение 60 мин при 37 С. Взаимодействие прекращают посредством быстрого вакуумного фильтрования на фильтрах из стекловолокна. Определяют радиоактивность, удержанную на фильтрах, и сравнивают ее с контрольными значениями для выяснения взаимодействий исследуемого соединения(ий) с сайтами связывания клонированного серотонинового 5-НТ 6.
МПК / Метки
МПК: C07D 209/08, C07D 401/12, C07D 209/30, A61P 25/00, A61K 31/404, A61K 31/454
Метки: лигандов, качестве, производные, 5-нт6, 1-(аминоалкоксиарилсульфонил)индола
Код ссылки
<a href="https://eas.patents.su/30-16594-proizvodnye-1-aminoalkoksiarilsulfonilindola-v-kachestve-5-nt6-ligandov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 1-(аминоалкоксиарилсульфонил)индола в качестве 5-нт6 лигандов</a>
Предыдущий патент: Твердая фармацевтическая композиция, включающая производное бензимидазол-7-карбоксилата и ph регулирующий агент
Следующий патент: Способ модулирования рецептора gpr119, сопряженного с g-белком, и используемые при этом соединения
Случайный патент: Распорное устройство для защищающей от утечки облицовки бака












