2-[4-(пиразол-4-илалкил)пиперазин-1-ил]-3-фенилпиразины и -пиридины и 3-[4-(пиразол-4-илалкил)пиперазин-1-ил]-2-фенилпиридины в качестве антагонистов рецепторов 5-ht7
Номер патента: 16529
Опубликовано: 30.05.2012
Авторы: Филла Сандра Энн, Шаус Джон Менерт, Пинейро-Нуньес Марта Мария, Кэмп Энн Мари, Бадеску Валентина О., Спинадзе Патрик Джанпьетро, Ваттон Мария Энн, Коэн Майкл Филип, Мазанетц Майкл Филип, Галлахер Питер Таддеуш, Кларк Барри Питер, Хеллман Сара Линн
Формула / Реферат
1. Соединение формулы (I)
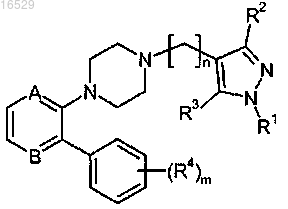
где каждый из А и В независимо представляет собой -С(Н)= или -N= при условии, что по меньшей мере один из А и В представляет собой -N=;
n имеет значение 1, 2 или 3;
m имеет значение 0, 1, 2 или 3;
R1 выбран из группы, состоящей из:
i) атома водорода,
ii) (C1-C6)алкила-, необязательно содержащего в качестве заместителей гидрокси, циано или от 1 до 5 атомов фтора или, альтернативно, необязательно содержащего в качестве заместителей гидрокси и от 1 до 3 атомов фтора,
iii) (C3-C7)циклоалкил(C0-C2)алкила-, необязательно содержащего в качестве заместителя гидрокси,
iv) (C1-C2)алкил-О-(C1-C2)алкила-,
v) Ph1-(C0-C2)алкила-,
vi) Ar1-(C0-C2)алкила-,
vii) (C1-C2)алкил-S(О)2-(C0-C3)алкила-,
ix) Ar1-S(O)2-,
x) (C1-C2)алкил-NH-(C1-C2)алкила-,
xiii) ((C1-C2)алкил)2-N-C(О)-(C0-C2)алкила-,
xiv) пирролидин-1-ил-C(O)-(C0-C2)алкила-,
xv) (C1-C2)алкил-C(O)-NH-(C1-C2)алкила- и
xvii) (C1-C2)алкил-S(О)2-NH-(C1-C2)алкила-;
R2 выбран из группы, состоящей из:
i) атома водорода,
iv) (C1-C4)алкила-, необязательно содержащего в качестве заместителей гидрокси или от 1 до 5 атомов фтора, и
v) (C1-C2)алкил-О-(C0-C2)алкила-;
R3 выбран из группы, состоящей из атома водорода, атома галогена и (C1-C4)алкила-;
каждый R4 независимо выбран из группы, состоящей из:
i) атома галогена,
ii) (C1-C2)алкила, необязательно содержащего в качестве заместителей от 1 до 5 атомов фтора,
iii) (C1-С2)алкокси, необязательно содержащего в качестве заместителей от 1 до 5 атомов фтора,
iv) циклопропил(C0-C1)алкил-О-,
v) циано,
vi) (C1-C2)алкил-S(О)2- и
vii) (C1-C4)алкил-C(O)-,
или, альтернативно, когда m имеет значение 1 или 2, один заместитель R4 выбран из группы, состоящей из:
viii) (C1-C4)алкила, дополнительно содержащего заместитель, выбранный из группы, состоящей из гидрокси, (C1-C4)алкокси, циано и амино,
ix) (C1-C2)алкил-О-C(O)-,
х) (C1-C2)алкил-S(О)2-(C1-C2)алкила-,
xi) (C1-C4)алкил-C(O)-N-(R6)-,
xii) (C1-C4)алкил-C(O)-N-(R6)метила-,
xiii) циклопропил-C(O)-NH-метила-,
xiv) (C1-C2)алкил-S(O)2-N-(R6)-(C1-C2)алкила-,
xv) (C1-C2)алкил-О-(C0-C2)алкил-C(O)-N-(R6)-,
xvi) (C1-C2)алкил-О-(C0-C2)алкил-C(O)-N-(R6)-метила-, необязательно содержащего в качестве заместителя фторгруппу,
xvii) (R6)(R7)N-C(O)-(C1-C2)алкила-,
xviii) (C1-C2)алкил-C(O)-NH-метил-C(O)-,
xix) (R6)(R7)N-C(О)-N(Н)-метила-,
хх) (R6)(R7)N-C(S)-N(Н)-метила-,
xxi) (R6)(R7)N-C(O)-О-метила-,
xxii) (R6)(R7)N-C(О)-метокси- и
xxiii) (R6)(R7)N-C(О)-метоксиметила-, и
второй заместитель R4, если присутствует, представляет собой атом фтора или атом хлора;
R6 представляет собой атом водорода или метил;
R7 представляет собой атом водорода или (C1-C3)алкил;
Ph1 представляет собой необязательно замещенный фенил, где заместитель выбран из группы, состоящей из атома галогена и (C1-C2)алкокси;
Ar1 представляет собой гетероарильную группировку, выбранную из пиридила, пиримидила, имидазолила, изоксазолила и тиазолила, каждый из которых необязательно может иметь 1 или 2 заместителя, независимо выбранных из метила и этила;
или фармацевтически приемлемая соль указанного соединения.
2. Соединение по п.1, в котором каждый R4 независимо выбран из группы, состоящей из:
i) атома галогена,
ii) (C1-C2)алкила, необязательно содержащего в качестве заместителей от 1 до 5 атомов фтора,
iii) (C1-C2)алкокси, необязательно содержащего в качестве заместителей от 1 до 5 атомов фтора,
iv) циклопропил(C0-C1)алкил-О-,
v) циано,
vi) (C1-C2)алкил-S(О)2- и
vii) (C1-C4)алкил-C(O)-,
или фармацевтически приемлемая соль указанного соединения.
3. Соединение по п.1 или 2, в котором каждый из А и В представляет собой -N=.
4. Соединение по любому из пп.1-3, в котором n имеет значение 1.
5. Соединение по любому из пп.1-4, в котором m имеет значение 1 или 2.
6. Соединение по п.1 формулы
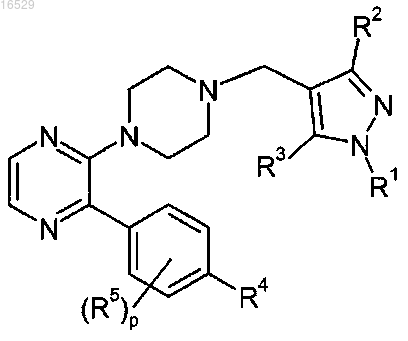
где R1 выбран из:
i) атома водорода,
ii) необязательно монозамещенного (C1-C3)алкила-, содержащего в качестве заместителя гидрокси,
iii) фенила и
v) пиридила;
R2 выбран из атома водорода и (C1-C3)алкила-;
R3 выбран из атома водорода и (C1-C3)алкила-;
R4 выбран из группы, состоящей из:
i) (C1-C4)алкила, содержащего заместитель, выбранный из группы, состоящей из гидрокси, (C1-C4)алкокси, циано и амино,
ii) (C1-C2)алкил-О-С(O)-,
iii) (C1-C2)алкил-S(О)2-(C1-C2)алкила-,
iv) (C1-C4)алкил-C(O)-N-(R6)-,
v) (C1-C4)алкил-C(O)-N-(R6)-метила-,
vi) циклопропил-C(O)-NH-метила-,
vii) (C1-C2)алкил-S(О)2-N-(R6)-(C1-С2)алкила-,
viii) (C1-C2)алкил-О-(C0-C2)алкил-C(O)-N-(R6)-,
ix) (C1-C2)алкил-О-(C0-C2)алкил-C(O)-N-(R6)-метила-, необязательно содержащего в качестве заместителя фторгруппу,
х) (R6)(R7)N-C(O)-(C1-C2)алкила-,
xi) (C1-C2)алкил-C(O)-NH-метил-C(O)-,
xii) (R6)(R7)N-C(О)-N(Н)-метила-,
xiii) (R6)(R7)N-C(S)-N(Н)-метила-,
xiv) (R6)(R7)N-C(O)-О-метила-,
xv) (R6)(R7)N-C(О)-метокси- и
xvi) (R6)(R7)N-C(О)-метоксиметила-;
R5 представляет собой атом фтора или атом хлора;
R6 представляет собой атом водорода или метил;
R7 представляет собой атом водорода или (C1-C3)алкил;
р имеет значение 0 или 1;
или фармацевтически приемлемая соль указанного соединения.
7. Соединение по п.6, где R1 представляет собой метил, этил или фенил; R2 представляет собой атом водорода или метил; R3 представляет собой атом водорода или метил; р имеет значение 0 и R4 выбран из группы, состоящей из гидроксиметила, гидроксиэтила, метоксиметила, цианометила, метил-C(O)-N(Н)-метила- и метил-S(О)2-N(Н)-метила-.
8. Соединение по п.1, которое представляет собой 2-[4-(3'-фенил-2,3,5,6-тетрагидро[1,2']бипиразинил-4-илметил)пиразол-1-ил]этанол, или фармацевтически приемлемая соль указанного соединения.
9. Соединение по п.1, которое представляет собой N-{4-[4-(1,5-диметил-1Н-пиразол-4-илметил)-3,4,5,6-тетрагидро-2Н-[1,2']бипиразинил-3'-ил]бензил}ацетамид, или фармацевтически приемлемая соль указанного соединения.
10. Фармацевтическая композиция, обладающая селективностью в отношении рецептора 5-HT7, содержащая соединение по любому из пп.1-9 в качестве активного ингредиента вместе с фармацевтически приемлемым носителем, разбавителем или наполнителем.
11. Применение соединения по любому из пп.1-9 в терапии расстройств, ассоциированных с рецептором 5-HT7.
12. Применение соединения по любому из пп.1-9 для лечения мигрени у человека.
13. Применение соединения по любому из пп.1-9 для профилактического лечения мигрени у человека.
14. Применение соединения по любому из пп.1-9 для лечения персистирующей боли у млекопитающих.
15. Применение соединения по любому из пп.1-9 для лечения тревожности у млекопитающего.
16. Применение соединения по любому из пп.14, 15, отличающееся тем, что млекопитающее представляет собой человека.
17. Применение соединения по любому из пп.1-9 в изготовлении лекарства для лечения мигрени.
18. Применение соединения по любому из пп.1-9 в изготовлении лекарства для профилактического лечения мигрени.
19. Применение соединения по любому из пп.1-9 в изготовлении лекарства для лечения персистирующей боли.
20. Применение соединения по любому из пп.1-9 в изготовлении лекарства для лечения тревожности.
Текст
2-[4-(ПИРАЗОЛ-4-ИЛАЛКИЛ)ПИПЕРАЗИН-1-ИЛ]-3-ФЕНИЛПИРАЗИНЫ И -ПИРИДИНЫ И 3-[4-(ПИРАЗОЛ-4-ИЛАЛКИЛ)ПИПЕРАЗИН-1-ИЛ]-2 ФЕНИЛПИРИДИНЫ В КАЧЕСТВЕ АНТАГОНИСТОВ РЕЦЕПТОРОВ 5-HT7 В изобретении предложены соединения формулы (I), являющиеся селективными антагонистами рецептора 5-НТ 7, и их применение в лечении мигрени, персистирующей боли и тревожности Бадеску Валентина О. (US), Кэмп Энн Мари, Кларк Барри Питер (GB), Коэн Майкл Филип, Филла Сандра Энн(US), Галлахер Питер Таддеуш (GB),Хеллман Сара Линн (US), Мазанетц Майкл Филип (GB), Пинейро-Нуньес Марта Мария, Шаус Джон Менерт,Спинадзе Патрик Джанпьетро (US),Ваттон Мария Энн (GB) Медведев В.Н. (RU) где каждый из А и В независимо представляет собой -С(Н)= или -N= при условии, что по меньшей мере один из А и В представляет собой -N=; n имеет значение 1-3; m имеет значение 0-3 и R1-4 являются такими, как определено в описании.(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) 016529 Нейромедиатор серотонин (5-гидрокситриптамин, 5-HT) обладает широким спектром фармакологического действия, которое обусловлено гетерогенной популяцией рецепторов серотонина, включающей по меньшей мере 14 различных представителей. Каждый рецептор характеризуется определенным распределением в тканях организма, хотя нередко области локализации различных рецепторов частично перекрываются, и имеет уникальный сайт связывания с серотонином, благодаря чему указанные рецепторы проявляют различную аффинность (сродство) к серотонину и опосредуют разные физиологические ответы на взаимодействие с серотонином. Показано, что рецептор 5-HT7 имеет важное функциональное значение для терморегуляции, циркадных ритмов, обучения и памяти, гиппокампальной сигнальной системы и сна. С рецептором 5-HT7 также связаны различные неврологические расстройства, включая мигрень и тревожность, а также персистирующую боль, более конкретно - боль при воспалении и невропатическую боль. Высокоаффинные антагонисты рецептора 5-HT7 могли бы стать полезными лекарственными средствами для лечения вышеупомянутых расстройств, ассоциированных с рецептором 5-HT7, включая мигрень и персистирующую боль, в частности боль при воспалении и невропатическую боль. Высокоаффинные антагонисты рецептора 5-HT7, обладающие также селективностью в отношении рецептора 5-HT7, могли бы оказывать такое терапевтическое действие без нежелательных побочных эффектов, связанных с модуляцией других подклассов серотонинергических рецепторов, таких как 5-HT1A, 5-HT1B и 5-HT1D. Разработка антагонистов 5-HT7, обладающих селективностью в отношении рецептора 5-HT7, является трудной задачей. Агонисты рецептора 5-HT1A ассоциированы с серотониновым синдромом. Агонисты рецепторов 5-HT1B и 5-HT1D ассоциированы с таким побочным эффектом, как боль в груди. В статье Leopoldo, M. (2004), Serotonin (7) receptors (5-HT(7)Rs) and their ligands. Curr. Med. Chem. 11, 629-661 описаны различные известные подходы, используемые для получения лигандов рецептора 5-HT7. В настоящем изобретении предложены новые эффективные антагонисты рецептора 5-HT7. Некоторые соединения согласно настоящему изобретению обладают селективностью в отношении рецептора 5-HT7 по сравнению с другими серотониновыми рецепторами. В настоящем изобретении предложены соединения формулы (I), являющиеся селективными антагонистами рецептора 5-HT7 где каждый из А и В независимо представляет собой -С(Н)= или -N= при условии, что по меньшей мере один из А и В представляет собой -N=;i) атома водорода,ii) (C1-C6)алкила-, необязательно содержащего в качестве заместителей гидрокси, циано или от 1 до 5 атомов фтора или, в качестве альтернативы, необязательно содержащего в качестве заместителей гидрокси и от 1 до 3 атомов фтора,iii) (C3-C7)циклоалкил(C0-C2)алкила-, необязательно содержащего в качестве заместителя гидрокси,iv) (C1-C2)алкил-О-(C1-C2)алкила-,v) Ph1-(C0-C2)алкила-,vi) Ar1-(C0-C2)алкила-,vii) (C1-C2)алкил-S(О)2-(C0-C3)алкила-,viii) Ph1-S(O)2-,ix) Ar1-S(O)2-,x) (C1-C2)алкил-NH-(C1-C2)алкила-,xi) C1-C2)алкил)2-N-(C1-C2)алкила-,xii) (C1-C2)алкил-NH-C(О)-(C0-C2)алкила-,xiii) C1-C2)алкил)2-N-C(О)-(C0-C2)алкила-,xiv) пирролидин-1-ил-C(O)-(C0-C2)алкила-,xv) (C1-C2)алкил-C(O)-NH-(C1-C2)алкила-,xvi) (C1-C2)алкил)-C(O)-N-(C1-C2-алкил)-(C1-C2)алкила-,xvii) (C1-С 2)алкил-S(О)2-NH-(C1-C2)алкила- иi) атома водорода,ii) атома галогена,iii) гидрокси,iv) (C1-C4)алкила-, необязательно содержащего в качестве заместителей гидрокси, циано или от 1 до 5 атомов фтора, иR3 выбран из группы, состоящей из атома водорода, атома галогена и (C1-C4)алкила-; каждый R4 независимо выбран из группы, состоящей из:i) атома галогена,ii) (C1-C2)алкила, необязательно дополнительно содержащего в качестве заместителей от 1 до 5 атомов фтора,iii) (C1-C2)алкокси, необязательно дополнительно содержащего в качестве заместителей от 1 до 5 атомов фтора,iv) циклопропил(C0-C2)алкил-О-,v) циано,vi) (C1-C2)алкил-S(О)2- иviii) (C1-C4)алкила, дополнительно содержащего заместитель, выбранный из группы, состоящей из гидрокси, (C1-C4)алкокси, циано и амино,ix) (C1-C2)алкил-О-C(O)-,х) (C1-C2)алкил-S(О)2-(C1-C2)алкила-,xi) (C1-C4)алкил-C(O)-N-(R6)-,xii) (C1-C4)алкил-C(O)-N-(R6)метила-,xiii) циклопропил-C(O)-NH-метила-,xiv) (C1-C2)алкил-S(О)2-N-(R6)-(C1-C2)алкила-,xv) (C1-C2)алкил-О-(C0-C2)алкил-C(O)-N-(R6)-, необязательно дополнительно содержащего в качестве заместителя фторгруппу,xvi) (C1-C2)алкил-О-(C0-C2)алкил-C(O)-N-(R6)метила-, необязательно дополнительно содержащего в качестве заместителя фторгруппу,xvii) (R6)(R7)N-C(О)-(C1-C2)алкила-,xviii) (C1-C2)алкил-C(O)-NH-метил-C(O)-,xix) (R6)(R7)N-C(О)-N(Н)метила-,хх) (R6)(R7)N-С(S)-N(Н)метила-,xxi) (R6)(R7)N-C(О)-О-метила-,xxii) (R6)(R7)N-C(О)метокси- иxxiii) (R6)(R7)N-C(О)метоксиметила-; и второй заместитель R4, если присутствует, представляет собой атом фтора или атом хлора;R6 представляет собой атом водорода или метил;R7 представляет собой атом водорода или (C1-C3)алкил;Ph1 представляет собой необязательно замещенный фенил, причем заместитель выбран из группы,состоящей из атома галогена, (C1-C2)алкила, необязательно дополнительно содержащего в качестве заместителей от 1 до 3 атомов фтора, и (C1-C2)алкокси, необязательно дополнительно содержащего в качестве заместителей от 1 до 3 атомов фтора;Ar1 представляет собой гетероарильную группировку, выбранную из пиридила, пиримидила, имидазолила, пирролила, тиенила, пиразолила, оксазолила, изоксазолила, тиазолила и изотиазолила, каждый из которых необязательно дополнительно имеет 1 или 2 заместителя, независимо выбранных из метила и этила; или их фармацевтически приемлемая соль. В настоящем изобретении также предложены фармацевтические композиции, содержащие соединение формулы (I) или фармацевтически приемлемую соль указанного соединения, вместе с фармацевтически приемлемым носителем, разбавителем или наполнителем. Согласно другому аспекту настоящего изобретения предложено одно или более соединений формулы (I) или его фармацевтически приемлемая(ые) соль(и) для применения в терапии. Данный аспект изобретения включает применение одного или более соединений формулы (I) или его фармацевтически приемлемой(ых) соли(ей) в качестве фармацевтических средств. Кроме того, согласно данному аспекту изобретения предложено одно или более соединений формулы (I) или его фармацевтически приемлемая(ые) соль(и) для лечения мигрени у млекопитающих, конкретно у человека, профилактического лечения мигрени у млекопитающих, лечения персистирующей боли, в особенности боли при воспалении или невропатической боли, у млекопитающих, конкретно у человека.-2 016529 Согласно одному варианту реализации данного аспекта изобретения предложен способ лечения мигрени у млекопитающих, включающий введение млекопитающему, нуждающемуся в таком лечении,эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Согласно другому варианту реализации данного аспекта изобретения предложен способ профилактического лечения мигрени у млекопитающих, включающий введение млекопитающему, нуждающемуся в таком лечении, а именно млекопитающему, которое подвержено мигрени, эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Согласно еще одному варианту реализации данного аспекта изобретения предложен способ лечения персистирующей боли у млекопитающих, включающий введение млекопитающему, нуждающемуся в таком лечении, эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Конкретные варианты реализации относятся к лечению боли при воспалении и/или невропатической боли. Согласно еще одному варианту реализации данного аспекта изобретения предложен способ лечения тревожности у млекопитающих, включающий введение млекопитающему, нуждающемуся в таком лечении, эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Согласно предпочтительным вариантам реализации вышеупомянутых способов лечения с использованием соединений формулы (I) или их фармацевтически приемлемых солей млекопитающее представляет собой человека. Согласно другому аспекту настоящего изобретения предложено применение соединения формулы(I) или его фармацевтически приемлемой соли в изготовлении лекарства для лечения и/или профилактического лечения мигрени. Согласно другому аспекту настоящего изобретения предложено применение соединения формулы(I) или его фармацевтически приемлемой соли в изготовлении лекарства для лечения персистирующей боли, в особенности боли при воспалении и/или невропатической боли. Согласно другому аспекту настоящего изобретения предложено применение соединения формулы(I) или его фармацевтически приемлемой соли в изготовлении лекарства для лечения тревожности. Дополнительно в настоящем изобретении предложен фармацевтический препарат, адаптированный для лечения мигрени и/или для профилактического лечения мигрени, содержащий соединение формулы(I) или фармацевтически приемлемую соль указанного соединения вместе с фармацевтически приемлемым носителем, разбавителем или наполнителем. Кроме того, в настоящем изобретении предложен фармацевтический препарат, адаптированный для лечения персистирующей боли, в особенности боли при воспалении и/или невропатической боли, содержащий соединение формулы (I) или фармацевтически приемлемую соль указанного соединения вместе с фармацевтически приемлемым носителем, разбавителем или наполнителем. Дополнительно в настоящем изобретении предложен фармацевтический препарат, адаптированный для лечения тревожности, содержащий соединение формулы (I) или фармацевтически приемлемую соль указанного соединения вместе с фармацевтически приемлемым носителем, разбавителем или наполнителем. Основные химические термины, встречающиеся в данном описании, использованы в их обычных значениях. Например, термин "алкил" относится к насыщенной углеводородной группе с разветвленной или нормальной цепью. Термин "(C1-C4)алкил" относится к метилу, этилу, н-пропилу, изопропилу,н-бутилу, изобутилу и втор-бутилу, приведенные примеры носят иллюстративный характер и не ограничивают значение данного термина. Термин "(C1-C6)алкил" относится ко всем насыщенным алкильным группам с разветвленной или нормальной цепью, содержащим от 1 до 6 атомов углерода. В контексте данного описания термин "(C0-C2)алкил" относится к простой связи или к метиленовой или этиленовой линкерной группировке. Термин "(C3-C7)циклоалкил" относится к циклопропилу, циклобутилу, циклопентилу, циклогексилу и циклогептилу. Термин "(C3-C7)циклоалкил(C0-C2)алкил" относится к циклоалкильной группировке,содержащей от 3 до 7 кольцевых атомов углерода, которая присоединена посредством простой связи (т.е.C0-алкила) или алкиленового линкера, содержащего 1 или 2 атома углерода. Каждая алкильная, циклоалкильная и циклоалкилалкильная группа необязательно может иметь заместители в соответствии с данным описанием. Термин "алкокси" относится к алкильной группе, которая присоединена через атом кислорода. Термин "галоген" относится к атому фтора, хлора, брома или йода. Предпочтительными галогеновыми группами являются атом фтора, хлора и брома. Более предпочтительными галогеновыми группами являются атом фтора и хлора. Термин "аминозащитная группа" в контексте данного описания относится к заместителю, обычно используемому для блокирования или защиты аминной функциональной группы, когда в реакции участвуют другие функциональные группы соединения. Тип используемой аминозащитной группы не имеет решающего значения при условии, что введенная аминогруппа является стабильной в условиях последующих стадий реакции с участием групп, находящихся в других позициях молекулы, и может быть удалена в подходящий момент без нарушения остальной части молекулы. Принципы выбора аминоза-3 016529 щитных групп и методики их введения и последующего снятия хорошо известны среднему специалисту в данной области техники. Другие примеры групп, относящихся к вышеупомянутым терминам, описаны в книге T.W. Greene и P.G.M. Wuts "Protective Groups in Organic Synthesis", 3rd edition John Wiley and Sons,New York, NY, 1999, chapter 7, называемой далее в описании "Greene". Термин "фармацевтический" или "фармацевтически приемлемый", используемый в данном описании в качестве прилагательного, означает, по существу, нетоксичный и, по существу, невредный для реципиента. Использование термина "фармацевтическая композиция" дополнительно означает, что носитель,растворитель, эксципиенты и/или соль должны быть совместимы с активным ингредиентом композиции(например, с соединением формулы (I. Для среднего специалиста в данной области техники должно быть понятно, что термины "фармацевтический препарат" и "фармацевтическая композиция" обычно являются взаимозаменяемыми и именно таким образом использованы для описания целей данного изобретения. Термин "эффективное количество" означает количество соединения формулы (I), которое способно оказывать антагонистическое действие на рецептор 5-HT7 и/или вызывать данный фармакологический эффект. Термин "подходящий растворитель" относится к любому растворителю (или к смеси растворителей), который в достаточной степени растворяет реагенты с получением среды для осуществления желаемой реакции и который не мешает проведению данной желаемой реакции. Подразумевается, что соединения согласно настоящему изобретению могут существовать в виде стереоизомеров. Как таковые, все энантиомеры, диастереоизомеры и их смеси включены в объем настоящего изобретения. Когда в данном изобретении установлена конкретная стереохимия соединений,для обозначения конкретных изомеров и их относительной стереохимии в названиях использованы CahnPrelog-Ingold-идентификаторы (R)- и (S)- и цис- и транс-идентификаторы относительной стереохимии. Когда известно оптическое вращение, правовращающий и левовращающий изомеры обозначены префиксами (+) и (-) соответственно. Когда изомеры хирального соединения удалось разделить, но их абсолютные конфигурации или оптическое вращение не определены, изомерам произвольно присвоены названия изомер 1, изомер 2 и т.д. Хотя все энантиомеры, диастереоизомеры и их смеси включены в объем настоящего изобретения, предпочтительные варианты реализации относятся к энантиомерам и диастереоизомерам в форме отдельных изомеров. Специалистам в данной области техники обычно понятно, что соединения, предназначенные для использования в фармацевтических композициях, принято, хотя и не обязательно, получать в форме соли с тем, чтобы оптимизировать такие характеристики, как технологические свойства, стабильность,фармакокинетика и/или биодоступность и т.д. Методики превращения соединения в заданную солевую форму хорошо известны в данной области техники (см., например, P. Stahl, et al., Handbook ofPharmaceutical Salts: Properties, Selection and Use, (VCHA/Wiley-VCH, 2002); Berge, S.M., Bighley, L.D.,and Monkhouse, D.C., J. Pharm. Sci., 66:1 (1977. Так как соединения согласно настоящему изобретению представляют собой амины и поэтому являются основными по своей природе, они легко вступают в реакцию со многими фармацевтически приемлемыми органическими и неорганическими кислотами с образованием фармацевтически приемлемых солей присоединения кислот. Варианты реализации данного изобретения также включают такие соли. Хорошо известно, что такие соединения могут образовывать соли в различных молярных отношениях с кислотой, давая, например, соли, где на одну молекулу соединения приходится 0,5, 1, 2 молекулы кислоты и т.д. Когда в соответствии с методикой получения соли кислоту добавляют в определенном стехиометрическом отношении, предполагается (но не известно), что полученная соль имеет такое же молярное отношение, если анализом не подтверждено иное. Использованные в данном описании аббревиатуры обозначают следующее:"солевой раствор" - насыщенный водный раствор хлорида натрия;"ISPA" - иммуносорбционный сцинтилляционный проксимальный анализ;"SCX-колонка" или "SCX-картридж" в контексте данного описания относится к Varian Bond Elute колонке или одноразовому картриджу на основе силикагеля с сильной катионообменной смолой или эк-4 016529 вивалентным сорбентом (например, к SCX-2-картриджу);"SPA" - сцинтилляционный проксимальный анализ, который может представлять собой анализ иммуноадсорбционного типа или может не являться таковым;"TBAS" - тетрабутиламмония бисульфит. Хотя все соединения согласно настоящему изобретению являются полезными в качестве 5-HT7 антагонистов, некоторые классы соединений являются предпочтительными, как, например, соединения,представленные формулой I(e) где каждый из А и В независимо представляет собой -С(Н)= или -N= при условии, что по меньшей мере один из А и В представляет собой -N=;i) атома водорода,ii) (C1-C6)алкила-, необязательно содержащего в качестве заместителей гидрокси, циано или от 1 до 5 атома фтора или, в качестве альтернативы, необязательно содержащего в качестве заместителей гидрокси и от 1 до 3 атомов фтора,iii) (C3-C7)циклоалкил(C0-C2)алкила-, необязательно содержащего в качестве заместителя гидрокси,iv) (C1-C2)алкил-О-(C1-C2)алкила-,v) Ph1-(C0-C2)алкила-,vi) Ar1-(C0-C2)алкила-,vii) (C1-C2)алкил-S(O)2-(C0-C3)алкила-,viii) Ph1-S(O)2-,ix) Ar1-S(О)2-,x) (C1-C2)алкил-NH-(C1-C2)алкила-,xi) C1-C2)алкил)2-N-(C1-C2)алкила-,xii) (C1-C2)алкил-NH-C(O)-(C0-C2)алкила-,xiii) C1-C2)алкил)2-N-C(O)-(C0-C2)алкила-,xiv) пирролидин-1-ил-С(O)-(C0-C2)алкила-,xv) (C1-C2)алкил-С(O)-NH-(C1-C2)алкила-,xvi) (C1-C2)алкил)-C(O)-N-(C1-C2-алкил)-(C1-C2)алкила-,xvii) (C1-C2)алкил-S(O)2-NH-(C1-C2)алкила- иi) атома водорода,ii) атома галогена,iii) гидрокси,iv) (C1-C4)алкила-, необязательно содержащего в качестве заместителей гидрокси, циано или от 1 до 5 атомов фтора, иR3 выбран из группы, состоящей из атома водорода, атома галогена и (C1-C4)алкила-; каждый R4 независимо выбран из группы, состоящей из атома галогена, (C1-C2)алкила, необязательно дополнительно содержащего в качестве заместителей от 1 до 5 атомов фтора, (C1-C2)алкокси, необязательно дополнительно содержащего в качестве заместителей от 1 до 5 атомов фтора,циклопропил(C0-C1)алкил-O-, циано, (C1-C2)алкил-S(О)2- и (C1-C4)алкил-C(O)-;Ph1 представляет собой необязательно замещенный фенил, причем заместитель выбран из группы,состоящей из атома галогена, (C1-C2)алкила, необязательно дополнительно содержащего в качестве заместителей от 1 до 3 атомов фтора, и (C1-C2)алкокси, необязательно дополнительно содержащего в качестве заместителей от 1 до 3 атомов фтора;Ar1 представляет собой гетероарильную группировку, выбранную из пиридила, пиримидила, имидазолила, пирролила, тиенила, пиразолила, оксазолила, изоксазолила, тиазолила и изотиазолила, каждый из которых необязательно дополнительно имеет 1 или 2 заместителя, независимо выбранных из метила и этила;m имеет значение 0, 1, 2 или 3; или их фармацевтически приемлемая соль.-5 016529 Другие предпочтительные варианты соединений формулы (I) и I(e) представляют собой соединения, содержащие любую из перечисленных ниже групп заместителей: 1) R1, выбранный из атома водорода, (C1-C3)алкила, необязательно содержащего в качестве заместителей гидрокси, циано или 1-3 атома фтора, (C1-C2)алкокси(C1-C2)алкила, Ph1-(C0-C2)алкила,Ar1-(C0-C2)алкила, (C1-C2)алкил-S(О)2-(C0-C3)алкила, Ph1-S(O)2-, Ar1-S(O)2-, (C1-C2)алкил-NH-(C1-C2)алкила,C1-C2)алкил)2-N-(C1-C2)алкила, (C1-C2)алкил-NH-C(О)-(C0-C2)алкила, C1-C2)алкил)2-N-C(О)-(C0-C2)алкила,(C1-C2)алкил-C(O)-NH-(C1-C2)алкила, (C1-C2)алкил-C(O)-N-(C1-C2-алкил)-(C1-C2)алкила, (C1-C2)алкил-S(О)2NH-(C1-C2)алкила или (C1-C2)алкил-S(О)2-N-(CH3)-(C1-C2)алкила; 2) R1, выбранный из атома водорода, (C1-C3)алкила, необязательно содержащего в качестве заместителей гидрокси, циано или 1-3 атома фтора, (C1-C2)алкокси(C1-C2)алкила, Ph1-(C0-C2)алкила илиAr1-(C0-C2)алкила; 3) R1, выбранный из атома водорода, (C1-C2)алкила, необязательно содержащего в качестве заместителей от 1 до 3 атома фтора, (C2-C3)алкила, необязательно содержащего в качестве заместителей гидрокси или гидроксил и 1-3 атома фтора, (C1-C2)алкокси(C1-C2)алкила, Ph1-(C0-C2)алкила илиAr1-(C0-C2)алкила; 4) R1, выбранный из (C1-C2)алкила, необязательно содержащего в качестве заместителей от 1 до 3 атомов фтора, (C2-C3)алкила, необязательно содержащего в качестве заместителей гидрокси или гидроксил и от 1 до 3 атомов фтора или (C1-C2)алкокси(C1-C2)алкила; 5) R1, выбранный из (C1-C2)алкила, необязательно содержащего в качестве заместителей от 1 до 3 атомов фтора или (C1-C2)алкокси(C1-C2)алкила; 6) R1, выбранный из Ph1-(C0-C2)алкила или Ar1-(C0-C2)алкила; 7) R1, выбранный из фенила или бензила, необязательно содержащих в качестве заместителя фтор; 8) R1, выбранный из пиридинила, имидазолила или пиразолила; 9) R1, выбранный из (C1-C5)алкил-C(O)-, Ph1-(C0-C2)алкил-C(O)- или Ar1-(C0-C2)алкил-C(O)-; 10) R1, выбранный из (C1-C2)алкил-S(О)2-(C0-C3)алкила, Ph1-S(O)2- или Ar1-S(О)2-; 11) R1, выбранный из (C1-C2)алкил-NH-(C1-C2)алкила, C1-C2)алкил)2-N-(C1-C2)алкила,(C1-C2)алкил-NH-C(О)-(C1-C2)алкила, C1-C2)алкил)2-N-C(O)-(C1-C2)алкила, (C1-C2)алкил-C(O)-NH-(C1C2)алкила или (C1-C2)алкил-C(O)-N-(C1-C2-алкил)-(C1-C2)алкила; 12) R1, выбранный из (C1-C2)алкил-S(О)2-NH-(C1-C2)алкила или (C1-C2)алкил-S(О)2-N-(CH3)-(C1C2)алкила; 13) R2, выбранный из атома водорода, атома галогена, метила, этила, -CF3, -CH2CF3, гидрокси, гидроксиметила, метоксиметила; 14) R2, выбранный из атома водорода, атома хлора, метила, этила или -CF3; 15) R2, выбранный из атома водорода или метила; 16) R3, выбранный из атома водорода, атома галогена, метила или этила; 17) R3, выбранный из атома водорода или метила; 18) R4, выбранный из атома галогена, (C1-C2)алкила, необязательно дополнительно содержащего в качестве заместителей от 1 до 3 атомов фтора, (C1-C2)алкокси, необязательно дополнительно содержащего в качестве заместителей от 1 до 3 атомов фтора, циано или CH3-C(O)-; 19) R4, выбранный из атома фтора, атома хлора, -CF3, (C1-C2)алкокси, необязательно дополнительно содержащего в качестве заместителей от 1 до 3 атомов фтора, циано или CH3-C(O)-; 20) R4, выбранный из атома фтора, атома хлора, -CF3, метокси, -O-CF3 или CH3-C(O)-; 21) R4, выбранный из атома фтора, атома хлора, -CF3, метокси или -O-CF3; 22) R4, выбранный из атома фтора или атома хлора; 23) R4, выбранный из атома фтора; 24) R4, выбранный из 4-фтора; 25) R4, выбранный из атома хлора; 26) R4, выбранный из 4-хлора. Обычно среди соединений, у которых m имеет значение 2 или 3, особенно предпочтительными соединениями являются те соединения, где каждый R4 представляет собой атом фтора, атом хлора, метил или -CF3. Среди данных предпочтительных соединений более предпочтительными являются те соединения, где каждый R4 представляет собой атом фтора или атом хлора.-6 016529 Одна предпочтительная группа соединений согласно настоящему изобретению представляет собой соединения формулы (Ia)i) атома водорода,ii) (C1-C6)алкила-, необязательно содержащего в качестве заместителей гидрокси, циано или от 1 до 5 атома фтора или, в качестве альтернативы, необязательно содержащего в качестве заместителей гидрокси и 1-3 атомов фтора,iii) (C3-C7)циклоалкил(C0-C2)алкила-, необязательно содержащего в качестве заместителя гидрокси,iv) (C1-C2)алкил-О-(C1-C2)алкила-,v) Ph1-(C0-C2)алкила-,vi) Ar1-(C0-C2)алкила-,vii) (C1-C2)алкил-S(О)2-(C0-C3)алкила-,viii) Ph1-S(O)2-,ix) Ar1-S(O)2-,x) (C1-C2)алкил-NH-(C1-C2)алкила-,xi) C1-C2)алкил)2-N-(C1-C2)алкила-,xii) (C1-C2)алкил-NH-C(O)-(C0-C2)алкила-,xiii) C1-C2)алкил)2-N-C(O)-(C0-C2)алкила-,xiv) пирролидин-1-ил-С(O)-(C0-C2)алкила-,xv) (C1-C2)алкил-С(O)-NH-(C1-C2)алкила-,xvi) (C1-C2)алкил-C(O)-N-(C1-C2)алкил(C1-C2)алкила-,xvii) (C1-C2)алкил-S(O)2-NH-(C1-C2)алкила- иi) атома водорода,ii) атома галогена,iii) гидрокси,iv) (C1-C4)алкила-, необязательно содержащего в качестве заместителей гидрокси, циано или от 1 до 5 атомов фтора, иR3 выбран из группы, состоящей из атома водорода, атома галогена и (C1-C4)алкила-; каждый R4 независимо выбран из группы, состоящей из атома галогена, (C1-C2)алкила, необязательно дополнительно содержащего в качестве заместителей от 1 до 5 атомов фтора, (C1-C2)алкокси, необязательно дополнительно содержащего в качестве заместителей от 1 до 5 атомов фтора,циклопропил(C0-C1)алкил-О-, циано, (C1-C2)алкил-S(О)2- и (C1-C4)алкил-C(O)-;Ph1 представляет собой необязательно замещенный фенил, причем заместитель выбран из группы,состоящей из атома галогена, (C1-C2)алкила, необязательно дополнительно содержащего в качестве заместителей от 1 до 3 атома фтора, и (C1-C2)алкокси, необязательно дополнительно содержащего в качестве заместителей от 1 до 3 атомов фтора;Ar1 представляет собой гетероарильную группировку, выбранную из пиридила, пиримидила, имидазолила, пирролила, тиенила, пиразолила, оксазолила, изоксазолила, тиазолила и изотиазолила, каждый из которых необязательно дополнительно имеет 1 или 2 заместителя, независимо выбранных из метила и этила;m имеет значение 0, 1, 2 или 3; или их фармацевтически приемлемую соль.-7 016529 Другая предпочтительная группа соединений согласно настоящему изобретению представляет собой соединения формулы (Ib)i) атома водорода,ii) (C1-C6)алкила-, необязательно содержащего в качестве заместителей гидрокси, циано или от 1 до 5 атомов фтора или, в качестве альтернативы, необязательно содержащего в качестве заместителей от 1 до 3 атомов фтора,iii) (C3-C7)циклоалкил(C0-C2)алкила-, необязательно содержащего в качестве заместителя гидрокси,iv) (C1-C2)алкил-О-(C1-C2)алкила-,v) Ph1-(C0-C2)алкила-,vi) Ar1-(C0-C2)алкила-,vii) (C1-C2)алкил-S(О)2-(C0-C3)алкила-,viii) Ph1-S(O)2-,ix) Ar1-S(O)2-,x) (C1-C2)алкил-NH-(C1-C2)алкила-,xi) C1-C2)алкил)2-N-(C1-C2)алкила-,xii) (C1-C2)алкил-NH-C(O)-(C0-C2)алкила-,xiii) C1-C2)алкил)2-N-C(O)-(C0-C2)алкила-,xiv) пирролидин-1-ил-С(O)-(C0-C2)алкила-,xv) (C1-C2)алкил-С(O)-NH-(C1-C2)алкила-,xvi) (C1-C2)алкил-С(O)-N-(C1-C2-алкил)-(C1-C2)алкила-,xvii) (C1-C2)алкил-S(O)2-NH-(C1-C2)алкила- иi) атома водорода,ii) атома галогена,iii) гидрокси,iv) (C1-C4)алкила-, необязательно содержащего в качестве заместителей гидрокси, циано или от 1 до 5 атомов фтора, иR3 выбран из группы, состоящей из атома водорода, атома галогена и (C1-C4)алкила-; каждый R4 независимо выбран из группы, состоящей из атома галогена, (C1-C2)алкила, необязательно дополнительно содержащего в качестве заместителей от 1 до 5 атомов фтора, (C1-C2)алкокси, необязательно дополнительно содержащего в качестве заместителей от 1 до 5 атомов фтора,циклопропил(C0-C1)алкил-O-, циано, (C1-C2)алкил-S(О)2- и (C1-C4)алкил-C(O)-;Ph1 представляет собой необязательно замещенный фенил, причем заместитель выбран из группы,состоящей из атома галогена, (C1-C2)алкила, необязательно дополнительно содержащего в качестве заместителей от 1 до 3 атома фтора, и (C1-C2)алкокси, необязательно дополнительно содержащего в качестве заместителей от 1 до 3 атомов фтора;Ar1 представляет собой гетероарильную группировку, выбранную из пиридила, пиримидила, имидазолила, пирролила, тиенила, пиразолила, оксазолила, изоксазолила, тиазолила и изотиазолила, каждый из которых необязательно дополнительно имеет 1 или 2 заместителя, независимо выбранных из метила и этила;m имеет значение 0, 1, 2 или 3; или их фармацевтически приемлемую соль.-8 016529 Еще одна предпочтительная группа соединений согласно настоящему изобретению представляет собой соединения формулы (Ic)i) атома водорода,ii) (C1-C6)алкила-, необязательно содержащего в качестве заместителей гидрокси, циано или от 1 до 5 атомов фтора или, в качестве альтернативы, необязательно содержащего в качестве заместителей гидрокси и от 1 до 3 атомов фтора,iii) (C3-C7)циклоалкил(C0-C2)алкила-, необязательно содержащего в качестве заместителя гидрокси,iv) (C1-C2)алкил-О-(C1-С 2)алкила-,v) Ph1-(C0-C2)алкила-,vi) Ar1-(C0-C2)алкила-,vii) (C1-C2)алкил-S(О)2-(C0-C3)алкила-,viii) Ph1-S(O)2-,ix) Ar1-S(O)2-,x) (C1-C2)алкил-NH-(C1-C2)алкила-,xi) C1-C2)алкил)2-N-(C1-C2)алкила-,xii) (C1-C2)алкил-NH-C(O)-(C0-C2)алкила-,xiii) C1-C2)алкил)2-N-C(O)-(C0-C2)алкила-,xiv) пирролидин-1-ил-С(O)-(C0-C2)алкила-,xv) (C1-C2)алкил-С(O)-NH-(C1-C2)алкила-,xvi) (C1-C2)алкил-С(O)-N-(C1-C2-алкил)-(C1-C2)алкила-,xvii) (C1-C2)алкил-S(O)2-NH-(C1-C2)алкила- иi) атома водорода,ii) атома галогена,iii) гидрокси,iv) (C1-C4)алкила-, необязательно содержащего в качестве заместителей гидрокси, циано или от 1 до 5 атомов фтора, иR3 выбран из группы, состоящей из атома водорода, атома галогена и (C1-C4)алкила-; каждый R4 независимо выбран из группы, состоящей из атома галогена, (C1-C2)алкила, необязательно дополнительно содержащего в качестве заместителей от 1 до 5 атомов фтора, (C1-C2)алкокси, необязательно дополнительно содержащего в качестве заместителей от 1 до 5 атомов фтора,циклопропил(C0-C1)алкил-О-, циано, (C1-C2)алкил-S(О)2- и (C1-C4)алкил-C(O)-;Ph1 представляет собой необязательно замещенный фенил, причем заместитель выбран из группы,состоящей из атома галогена, (C1-C2)алкила, необязательно дополнительно содержащего от 1 до 3 атомов фтора, и (C1-C2)алкокси, необязательно дополнительно содержащего от 1 до 3 атомов фтора;Ar1 представляет собой гетероарильную группировку, выбранную из пиридила, пиримидила, имидазолила, пирролила, тиенила, пиразолила, оксазолила, изоксазолила, тиазолила и изотиазолила, каждый из которых необязательно дополнительно имеет 1 или 2 заместителя, независимо выбранных из метила и этила;m имеет значение 0, 1, 2 или 3; или их фармацевтически приемлемую соль. В каждой группе предпочтительных соединений, представленных формулами (Ia), (Ib) и (Ic), предпочтительные группы заместителей R1-4 представляют собой заместители, принадлежащие предпочтительным группам заместителей 1-26, описанным выше для соединений общей формулы (I). Обычно соединения, представленные формулой (Ia), являются более предпочтительными, чем соединения формул (Ib) и (Ic). Кроме того, в вышеуказанных предпочтительных группах соединений более предпочтительными обычно являются те соединения, у которых n имеет значение 1.-9 016529 Предпочтительные заместители, перечисленные в пп.1-26, представляют собой предпочтительные группы заместителей R1, R2, R3 и R4, которые определены отдельно и независимо друг от друга для каждого из указанных заместителей. По существу, для любой из вышеуказанных групп предпочтительных заместителей R1-4 справедливо следующее утверждение: более предпочтительными являются те соединения, у которых наряду с первым выбранным предпочтительным заместителем еще один или более чем один другой заместитель R1-4 также выбран из предпочтительных групп заместителей. Аналогично такие комбинации предпочтительных групп заместителей R1-4 применимы и к предпочтительным соединениям формул (Ia), (Ib) и/или (Ic). Примерами таких предпочтительных комбинаций, которые, однако, не должны быть истолкованы как ограничение настоящего изобретения, являются следующие комбинации предпочтительных групп заместителей: 27) любая группа заместителей согласно пп.1-26, когда п имеет значение 1; 28) любая предпочтительная группа заместителей согласно пп.1-12 (т.е. любая предпочтительная группа заместителей R1) в комбинации с любой предпочтительной группой заместителей согласно пп.1315 (т.е. в комбинации с любой предпочтительной группой заместителей R2) и/или в комбинации с любой предпочтительной группой заместителей согласно п.16 или 17 (т.е. в комбинации с любой предпочтительной группой заместителей R3); 29) любая предпочтительная комбинация согласно п.28, когда n имеет значение 1; 30) любая предпочтительная комбинация согласно пп.27, 28 или 29 в комбинации с любой предпочтительной группой заместителей согласно пп.18-26 (т.е. в комбинации с любой предпочтительной группой заместителей R4). В данной группе предпочтительных комбинаций особенно предпочтительные комбинации включают: 31) соединения, где R1 представляет собой (C1-C2)алкил, каждый из R2 и R3 независимо представляет собой атом водорода, метил или этил, n имеет значение 1, m имеет значение 1 и R4 представляет собой атом фтора, атом хлора, -CF3, метокси, -O-CF3 или CH3-C(O)-; 32) соединения, где R1 представляет собой (C1-C2)алкил, каждый из R2 и R3 независимо представляет собой атом водорода, метил или этил, n имеет значение 1, m имеет значение 2 и каждый R4 независимо представляет собой атом фтора, атом хлора или -CF3; 33) соединения, где R1 представляет собой Ph1-(C0-C2)алкил или Ar1-(C0-C2)алкил, каждый из R2 и 3R независимо представляет собой атом водорода, метил или этил, n имеет значение 1, m имеет значение 1 и R4 представляет собой атом фтора, атом хлора, -CF3, метокси, -O-CF3 или CH3-C(O)-; 34) соединения, где R1 представляет собой Ph1-(C0-C2)алкил или Ar1-(C0-C2)алкил, каждый из R2 и 3R независимо представляет собой атом водорода, метил или этил, n имеет значение 1, m имеет значение 2 и каждый R4 независимо представляет собой атом фтора, атом хлора или -CF3,но не ограничены ими. Еще одна предпочтительная группа соединений согласно настоящему изобретению представляет собой соединения формулы (Id)R2 выбран из атома водорода и (C1-C3)алкила-;R3 выбран из атома водорода и (C1-C3)алкила-;vii) (C1-C2)алкил-S(О)2-N-(R6)-(C1-C2)алкила-,viii) (C1-C2)алкил-О-(C0-C2)алкил-С(O)-N-(R6)-, необязательно дополнительно содержащего в качестве заместителя фторгруппу,ix) (C1-C2)алкил-О-(C0-C2)алкил-C(O)-N-(R6)метила-, необязательно дополнительно содержащего в качестве заместителя фторгруппу,х) (R6)(R7)N-C(O)-(C1-C2)алкила-,xi) (C1-C2)алкил-С(O)-NH-метил-C(O)-,xii) (R6)(R7)N-C(О)-N(Н)метила-,xiii) (R6)(R7)N-C(S)-N(Н)метила-,xiv) (R6)(R7)N-C(O)-О-метила-,xv) (R6)(R7)N-C(О)метокси- иR5 представляет собой атом фтора или атом хлора;R6 представляет собой атом водорода или метил;R7 представляет собой атом водорода или (C1-C3)алкил; р имеет значение 0 или 1; и их фармацевтически приемлемые соли. Для соединений формулы (Id) являются предпочтительными перечисленные ниже группы заместителей, где 35) R1 представляет собой метил или этил; 36) R1 представляет собой фенил или бензил; 37) R2 представляет собой атом водорода или метил; 38) R3 представляет собой атом водорода или метил; 27) один из R2 или R3 представляет собой атом водорода, а другой представляет собой метил; 28) R2 представляет собой атом водорода и R3 представляет собой метил; 29) R4 выбран из группы, состоящей из:vi) метил-S(О)2-N(Н)метила-; 32) р имеет значение 0; 33) R1 представляет собой метил, этил или фенил; R2 представляет собой атом водорода или метил; 3R представляет собой атом водорода или метил; р имеет значение 0 и R4 выбран из группы, состоящей из:vi) метил-S(О)2-N(Н)метила-; 34) R1 представляет собой метил или этил, один из R2 или R3 представляет собой атом водорода, а другой представляет собой метил и R4 выбран из группы, состоящей из:vi) метил-S(О)2-N(Н)метила-; 35) R1 представляет собой метил или этил, один из R2 или R3 представляет собой атом водорода, а другой представляет собой метил и R4 выбран из группы, состоящей из:iv) метил-C(O)-N(Н)метила-; 36) R1 представляет собой фенил или бензил, один из R2 или R3 представляет собой атом водорода,а другой представляет собой метил, R4 выбран из группы, состоящей из:i) гидроксиметила,ii) гидроксиэтила,iii) метоксиметила,iv) цианометила,v) метил-C(O)-N(Н)метила-,vi) метил-S(О)2-N(Н)метила-,vii) метокси-C(O)-(C0-C1)алкила-,viii) метокси-C(O)-NH-метила-,ix) метоксиметил-C(O)-NH-метила- и х) (R6)(R7)N-C(О)метила-; 37) R1 представляет собой фенил или бензил, один из R2 или R3 представляет собой атом водорода,а другой представляет собой метил,и R4 выбран из группы, состоящей из:vi) метил-S(О)2-N(Н)метила-; 38) R5 представляет собой атом фтора. Следует понимать, что предпочтительные группы различных заместителей, перечисленные в данном описании, могут встречаться одни или в комбинации с другими предпочтительными группами других заместителей. Примерами таких предпочтительных комбинаций, которые, однако, не должны быть истолкованы как ограничение настоящего изобретения, являются следующие комбинации предпочтительных групп заместителей: 17) любая группа заместителей согласно пп.1-9, когда р имеет значение 0; 18) предпочтительная группа заместителей 1 или 2 (т.е. предпочтительная группа заместителей R1) в комбинации с любой предпочтительной группой заместителей согласно пп.3-6 (т.е. в комбинации с предпочтительными группами заместителей R2 и/или R3); 19) предпочтительная комбинация согласно п.18 в комбинации с любой предпочтительной комбинацией согласно пп.7-9 (т.е. комбинация одной из предпочтительных комбинаций заместителей, расположенных на пиразолильной группировке, с одной из предпочтительных групп заместителей R4). Конкретные предпочтительные соединения согласно настоящему изобретению представляют собой соединения, описанные в разделе "Примеры", включая их свободные основания и фармацевтически приемлемые соли. Особенно предпочтительными соединениями согласно настоящему изобретению являются два следующих соединения: 2-[4-(3'-фенил-2,3,5,6-тетрагидро[1,2']бипиразинил-4-илметил)пиразол-1-ил]этанол(соединение примера 198) и его фармацевтически приемлемые соли иN-4-[4-(1,5-диметил-1 Н-пиразол-4-илметил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиразинил-3'ил]бензилацетамид (соединение примера 32m) и его фармацевтически приемлемые соли.- 12016529 Общие схемы. Соединения согласно настоящему изобретению могут быть получены в соответствии с нижеприведенными схемами синтеза с помощью методик, известных и широко используемых в данной области техники. Подходящие условия реакций, используемые в данных схемах на различных стадиях синтеза,хорошо известны в данной области техники, специалистам в данной области техники понятно, что могут быть произведены подходящие замены растворителей и реагентов. Специалистам в данной области техники также понятно, что синтезированные промежуточные соединения могут быть выделены и/или очищены с использованием различных известных методик, если это необходимо или желательно, и что различные промежуточные соединения часто могут быть использованы на следующих стадиях синтеза без предварительной очистки или может быть выполнена их незначительная очистка. Кроме того, специалистам в данной области техники понятно, что в некоторых случаях не имеет решающего значения тот порядок, в котором вводятся группировки. Специалистам в области химии совершенно понятно, что конкретный порядок стадий синтеза, необходимый для получения соединений формулы (I), зависит от конкретного соединения, которое требуется синтезировать, соединения, используемого в качестве исходного вещества, и относительной лабильности замещенных группировок. Все заместители, если не указано иное, являются такими, как определено ранее, и все реагенты хорошо известны и широко используются в данной области техники. На схеме I показан подходящий вариант четырехстадийного синтеза пиразиновых соединений согласно настоящему изобретению. Как следует из данной схемы, путем нуклеофильного замещения в 2,3-дихлорпиразине (1) с использованием моно-N-защищенного пиперазина получают пиперазинопиразин (2). В результате реакции Сузуки с использованием подходящей замещенной или незамещенной фенилбороновой кислоты (3) в присутствии подходящего палладиевого катализатора получают соответствующий фенилпиперазинопиразин (4). Снятие защитной группы приводит к получению вторичного амина (5), который затем подвергают восстановительному аминированию подходящим замещенным или незамещенным пиразолоальдегидом (6) с получением желаемого соединения (7). Схема I Хотя в вышеописанном примере использована фенилбороновая кислота (3), следует понимать, что для получения фенилпиперазинопиразинов (4) могли бы быть использованы и другие реагенты (например, фенилстаннаны, фенилцинкаты или фенилмагнийгалогениды (реактивы Гриньяра) в присутствии подходящего катализатора). Специалистам в данной области техники совершенно понятно, что также может быть использовано множество других N-защитных групп и подходящих методик снятия этих защитных групп. Типичные защитные группы включают Boc (трет-бутоксикарбонил), ацетил, бензил, бензилоксикарбонил или этоксикарбонил, но не ограничены ими. Специалистам в области химии понятно,что вышеописанные реакции также могут быть выполнены с использованием различных растворителей и условий реакции и что оптимальные условия обычно зависят от конкретного соединения, которое требуется синтезировать. Порядок выполнения стадий синтеза на схеме I при желании может быть изменен. Соответственно,сначала может быть выполнено взаимодействие пиразолоальдегида (6) с N-защищенным пиперазином,затем снятие защитных групп и взаимодействие полученного соединения с 2,3-дихлорпиразином (1) и в заключение введение фенильной группировки с использованием реакции Сузуки. В качестве альтернативы стадии восстановительного аминирования промежуточное соединение (5) может быть подвергнуто ацилированию карбоновыми кислотами (8) в присутствии EDC и HOBt в соответствии со схемой II. Полученный амид (9) путем восстановления боран-диметилсульфидным комплексом или аналогичным реагентом превращают в соединение (7). Хотя на вышеприведенной схеме для облегчения взаимодействия с амином карбоновую кислоту активируют EDC и HOBt, следует понимать, что могут быть использованы другие ацилирующие реагенты,которые включают, например, дициклогексилкарбодиимид или 2-(1 Н-бензотриазол-1-ил)-1,1,3,3 тетраметилурония тетрафторборат в присутствии диизопропилэтиламина, но не ограничены ими. Аналогично на стадии восстановления могут быть использованы другие восстанавливающие агенты, которые включают, например, алюмогидрид лития или диизобутилалюминий гидрид, но не ограничены ими. Специалистам в области химии понятно, что также могут быть использованы альтернативные растворители и различные условия реакции, например на стадии восстановительного аминирования может быть использован триацетоксиборгидрид натрия в метиленхлориде, или аналогичные условия. Схема III представляет собой модификацию схемы II, где соединение (7) получают с использованием метилового или этилового эфира (10) карбоновой кислоты (8) (использованной на схеме II) в присутствии восстанавливающего агента, такого как алюмогидрид лития, см. схему III. Схема III Как и в случае синтеза в соответствии со схемой I, порядок реакций с использованием схем II и III также может быть изменен, соответственно сначала моно-N-защищенный пиперазин может быть подвергнут взаимодействию с 2,3-дихлорпиразином (1), затем могут быть выполнены либо стадии снятия защитной группы и восстановительного аминирования с введением соответствующей группировки пиразолоальдегида, либо реакция Сузуки с введением фенильной группировки. Затем выполняют соответственно либо реакцию Сузуки с введением фенильной группировки, либо стадии снятия защитной группы и восстановительного аминирования с введением соответствующей группировки пиразолового альдегида/сложного эфира, в зависимости от того, как завершают синтез. Другой способ синтеза соединений согласно изобретению представляет собой алкилирование промежуточного соединения (5), например, путем взаимодействия с алкилмезилатами (11) в присутствии основания, такого как карбонат калия, в ацетонитриле или аналогичном растворителе (см. схему IV). Следует понимать, что на стадии алкилирования вместо алкилмезилатов могут быть использованы альтернативные сульфонаты (например, толуолсульфонаты или трифторметансульфонаты) или алкилгалогениды (например, бензилбромиды, бензилхлориды). Схема IV- 14016529 3,5-Диметилированные пиразольные соединения согласно настоящему изобретению могут быть получены в соответствии со схемой V. Соответственно, пентан-2,4-дион подвергают взаимодействию с бензилгидразином с получением N-защищенного 3,5-диметилпиразола (12), который затем формилируют оксихлоридом фосфора в ДМФА (диметилформамиде) с получением соответствующего бензилпиразолкарбоксальдегида (13). В качестве альтернативы вместо пентан-2,4-диона может быть использован любой симметричный дион (например, гептан-3,5-дион или нонан-4,6-дион) с получением соответствующих 3,5-диалкилпиразолов (например, 2,3-диэтил- или 3,5-дипропилпиразола). Затем данные соединения подвергают восстановительному аминированию промежуточным соединением (5) с получением бензилдиметилпиразольного соединения (14). Удаление бензильной группы, например, путем гидрогенизации в присутствии формиата аммония и подходящего палладиевого катализатора приводит к получению соединения (15) и облегчает последующее введение других заместителей у атома азота пиразолильного кольца. Следует понимать, что в некоторых случаях восстановительное аминирование пиразолкарбоксальдегидом может быть выполнено без N-защиты, что, соответственно, сразу приводит к получению соединения/промежуточного соединения (15), поскольку отсутствует необходимость в стадии снятия защитных групп. Специалистам в данной области совершенно понятно, что промежуточное соединение (15) необязательно может быть подвергнуто дальнейшему превращению с получением дополнительныхN-замещенных пиразолов (16-19) с использованием ряда известных методик, например алкилирования,ацилирования, сульфонилирования или эпоксидирования, как показано на схеме V и продемонстрировано ниже в разделе "Препараты" и "Примеры". Соединения согласно изобретению, у которых n имеет значение 2 или 3, могут быть синтезированы с помощью аналогичных методик с использованием этилового эфира бромуксусной кислоты или этилового эфира бромпропионовой кислоты в подходящем растворителе, отличном от ДМФА. Схема VR7 и R8 независимо представляют собой атом водорода или (C1-C4)алкил-, необязательно содержащий в качестве заместителей от 1 до 3 атомов фтора, при условии, что R7 и R8 вместе не содержат в качестве заместителей более 4 атомов углерода или более 3 атомов фтора. Соединения, у которых R1 представляет собой сульфониламидоалкильную группировку, могут быть получены в соответствии со схемой VI. Подходящее пиразолильное промежуточное соединение (20) алкилируют с использованием желаемого аминоалкилхлорида (и хотя на схеме показанR-аминоэтилхлорид, могут быть использованы реагенты, содержащие алкильные цепи разной длины). Затем полученный свободный амин сульфонилируют подходящим замещенным сульфонилхлоридом. Хотя на схеме показан синтез метилсульфониламида, аналогичным образом могут быть введены также другие заместители. 1 Пиридильные соединения согласно настоящему изобретению могут быть синтезированы несколькими способами с использованием подходов традиционной химии, включая приведенные на схемах VIIXII. На схеме VII показано получение пиридильных соединений, содержащих пиперазинильную группировку в позиции, соседней с атомом азота пиридильного кольца, с использованием трехстадийного синтеза. Соответственно, 2-бромпиридин (23) подвергают депротонированию и взаимодействию с фенилйодидами в присутствии хлорида цинка и подходящего палладиевого катализатора с получением 3-фенил-2-бромпиридина (24). Затем промежуточное соединение (24) подвергают взаимодействию с пиперазином в условиях реакции Бухвальда с получением 3-фенил-2-пиперазинопиридина (25), который, в свою очередь, подвергают восстановительному аминированию подходящим пиразолоальдегидом (6) с получением желаемого 3-фенил-2-(4-пиразолоалкилпиперазин-1-ил)пиридинового соединения (26). Схема VII В качестве альтернативы можно использовать 3-бром-2-хлорпиридин, как показано на схеме VIII. Соответственно, 3-бром-2-хлорпиридин (27) нагревают с пиперазином с получением 1-(3-бромпиридин 2-ил)пиперазина (28), последующее введение фенильной группировки с использованием реакции Сузуки приводит к получению фенилпиперазинового промежуточного соединения (25). Схема VIII Пиридильные соединения согласно настоящему изобретению, содержащие фенильную группировку в позиции, соседней с атомом азота пиридильного кольца, могут быть синтезированы путем взаимодействия 2,3-дибромпиридина (29) с подходящей фенилбороновой кислотой (3) в условиях реакции Сузуки с получением 2-фенил-3-бромпиридина (30). Соединение (30), в свою очередь, может быть использовано в реакции замещения пиперазином в условиях реакции Бухвальда с получением соответствующего 2-фенил-3-пиперазинопиридина (31), который затем может быть подвергнут восстановительному аминированию подходящим пиразолоальдегидом (6) с получением конечного соединения (32) (см. схему IX). В качестве альтернативы промежуточное соединение (31) может быть получено в соответствии с нижеприведенной схемой X. Соответственно, 2-хлор-3-йодпиридин (33) подвергают взаимодействию с моно-N-защищенным пиперазином (34) в присутствии подходящего палладиевого катализатора с получением соответствующего N-защищенного 2-хлор-3-пиперазинопиридина (35). Затем выполняют реакцию Сузуки с использованием необязательно замещенной фенилбороновой кислоты (3) и стадию снятия защитных групп в соответствии с тем, как описано выше, с получением желаемого промежуточного соединения (31). Схема X Хотя в вышеописанном примере использована фенилбороновая кислота, следует понимать, что могут быть использованы также другие фенилирующие реагенты (например, фенилстаннаны, фенилцинкаты или фенилмагнийгалогениды (реактивы Гриньяра) в присутствии подходящего катализатора). В качестве альтернативы стадии восстановительного аминирования соединение (25) или (31) может быть подвергнуто ацилированию карбоновыми кислотами (8) в присутствии EDC и HOBt в соответствии со схемой XI. Схема XI- 17016529 Полученные амиды (37) или (38) путем восстановления боран-диметилсульфидным комплексом или аналогичным реагентом превращают соответственно в соединение (26) или (32). Хотя на вышеприведенной схеме для облегчения взаимодействия с амином карбоновую кислоту активируют EDC и HOBt, следует понимать, что могут быть использованы другие ацилирующие реагенты(например,дициклогексилкарбодиимид или 2-(1 Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония тетрафторборат в присутствии диизопропилэтиламина). Аналогично на стадии восстановления могут быть использованы другие восстанавливающие агенты (например, алюмогидрид лития или диизобутилалюминий гидрид). Следует понимать, что, как и в случае приведенных выше схем синтеза пиразинильных соединений согласно настоящему изобретению, порядок выполнения отдельных стадий синтеза для присоединения пиразола к пиперазину, для присоединения пиперазина к пиридину и для присоединения пиридина к фенилу не имеет значения и может быть, при желании, изменен и адаптирован к соединению, которое требуется синтезировать. Кроме того, в пиразолильную группировку могут быть введены дополнительные заместители до или после присоединения пиразолильной группировки к пиперазинильной группировке. Кроме того, как и в случае синтеза пиразинильных соединений, пиразолильная группировка может быть введена путем обычного алкилирования, например путем алкилирования мезилатами или аналогичными реагентами, в соответствии с нижеприведенной схемой XII. Схема XII Соответственно, соединения (26) и (32) могут быть получены путем алкилирования с использованием алкилмезилатов (11) в присутствии основания (например, карбоната калия в ацетонитриле). Следует понимать, что вместо алкилмезилатов, использованных в качестве примера, могут быть использованы альтернативные сульфонаты (например, толуолсульфонаты или трифторметансульфонаты) или алкилгалогениды (например, бензилбромиды, бензилхлориды). На схеме XIII приведена подходящая методика получения эфира бороновой кислоты (509) из соответствующего арилгалогенида (8). Следует отметить, что в данной области техники допустимы многочисленные варианты при выборе источника каталитического палладия, лиганда, основания и растворителя. Схема XIII Как показано на схеме XIV, алкилированные эфиры бороновых кислот (511) могут быть синтезированы путем депротонирования бензильного соединения (510) и взаимодействия с метилгалогенидами,такими как йодистый метил, с получением алкилированного продукта (511). Другие эфиры бороновых кислот могут быть функционализированы в соответствии со схемой XV,где функциональная группа вводится до образования эфира бороновой кислоты. Хлорангидрид (512) превращают в амид (513), который затем может быть превращен в эфир бороновой кислоты (514) с использованием описанных выше условий. Схема XV Замещенные пиразолы могут быть синтезированы в соответствии с общеизвестной методикой, приведенной на схеме XVI. Когда R2 и R3 являются разными, региоизомерные продукты (515) должны быть разделены с использованием обычных хроматографических методик. Схема XVI Функционализированные пиразолы (517) могут быть синтезированы в соответствии со схемой Следует понимать, что функционализированные соединения могут быть дополнительно модифицированы путем введения боковой реакционноспособной функциональности. Например, как показано на схеме XVIII, бензиловый спирт (528) может быть подвергнут взаимодействию с тионилхлоридом с получением бензилхлорида (529). Затем бензилхлорид (529) может быть подвергнут нуклеофильному замещению с использованием различных азотсодержащих нуклеофилов с получением соединения (530).R11 определяется используемым аминным нуклеофилом, примеры таких нуклеофилов могут включать лактамы, триазолы, пиразолы, имидазолы, мочевины, карбаматы, сультамы или амиды, но не ограничены ими. Схема XVIII Аналогично реакция замещения может быть выполнена с использованием электрофильного бензилхлорида (529) и нуклеофильной серы с получением сульфона (531), как показано на схеме XIX. R8 может представлять собой алкил или разветвленный алкил. В соответствии со схемой XX бензиловый спирт (528) может быть функционализирован путем алкилирования или с использованием реакции Мицунобу, Следует понимать, что многие из описанных реакций функционализирования бензилового спирта также могут быть использованы для соответствующего фенолового спирта. На этих схемах R9 может представлять собой метил или этил. Схема XX В соответствии со схемой XXI боковая группировка бензилового спирта (528) также может быть ацилирована с получением карбаматов. Активирование бензилового спирта карбонилдиимидазолом и последующее взаимодействие с первичным амином приводят к получению соответствующих карбаматов(534). Карбаматы (535) могут быть получены путем депротонирования спирта (528) подходящим основанием и последующего взаимодействия с карбамоилхлоридом. Схема XXI Как и в случае бензилового спирта, в боковую группировку первичного бензиламина может быть введен ряд дополнительных функциональных групп, таких как мочевины, тиомочевины, карбаматы и амиды, в соответствии со схемой XXII. Амин (536) может быть активирован карбонилдиимидазолом и подвергнут взаимодействию с первичным амином с получением мочевин (537). Кроме того, соединение(536) может быть подвергнуто взаимодействию с хлорформиатом с получением карбаматов (538). Мочевины (539) могут быть получены путем взаимодействия соединения (536) с карбамоилхлоридами. Мочевины или тиомочевины (540) могут быть получены путем взаимодействия амина (536) либо с изоцианатами, либо с тиоизоцианатами. Кроме того, соединение (536) также может быть функционализировано с получением амидов (541) в соответствии со стандартной методикой синтеза амидов из хлорангидридов- 20016529 или с помощью других стандартных методик синтеза амидов с использованием карбоновых кислот. На схеме XI R10 может представлять собой (C1-C4)алкил, циклопропил или (C1-C2)алкил-О-(C1-C2)алкил-. Схема XXII Дополнительные функциональные группы могут быть введены путем амидирования боковой карбоновой кислоты соединения (542) амином с получением амида (543). Амидирование может быть осуществлено с использованием хлорангидрида в соответствии со схемой XXIII или путем традиционной активации непосредственно карбоновой кислоты с использованием реагентов для образования амидной связи. R11 определяется используемым аминным реагентом (который может являться первичным или вторичным амином) и может представлять собой алкил или арил. Схема XXIII Кроме того, боковая реакционноспособная азотсодержащая функциональная группа, такая как сульфонамид (544), может быть функционализирована по Мицунобу с получением алкилированных продуктов, таких как соединение (545) на схеме XXIV. Схема XXIV Описанные далее препараты и примеры являются иллюстрацией методик, полезных для синтеза соединений согласно настоящему изобретению. Название многих соединений, приведенных в разделах"Препараты" и "Примеры", генерированы на основе их структурных формул программой ChemDraw, v. 7.0 или Autonom 2000 для ISIS/Draw. Препарат 1. 3'-Хлор-2,3,5,6-тетрагидро[1,2']бипиразинил-4-карбоновой кислоты трет-бутиловый эфир. В трехгорлую круглодонную колбу объемом 2 л вносили 2,3-дихлорпиразин (78,7 г, 0,532 моль),пиперазин-1-карбоновой кислоты трет-бутиловый эфир (100 г, 0,537 моль), карбонат калия (88,2 г,0,638 моль) и затем DMA (N,N-диметилацетамид) (0,780 л), полученную суспензию нагревали до 110 С в атмосфере азота при интенсивном перемешивании. Охлаждали до комнатной температуры, добавляли воду (0,390 л) и МТВЕ (0,390 л) и смесь перемешивали в течение 60 мин. Перемешивание прекращали и разделяли слои. Органический слой промывали водой (2200 мл), сушили над MgSO4, фильтровали и- 21016529 концентрировали с получением указанного в заголовке соединения в виде сиропа желтого цвета (145 г,выход 91%). Препарат 2. 3'-(4-Фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиразина дигидрохлорид. В химический реактор вносили 2,3-дихлорпиразин (73,6 г, 0,497 моль, 1,0 экв.), пиперазин-1 карбоновой кислоты трет-бутиловый эфир (101,9 г, 0,547 моль, 1,1 экв.) и порошкообразный карбонат калия (164,8 г, 1,19 моль, 2,4 экв.). Добавляли N,N-диметилацетамид (1,1 л) и нагревали до 110 С в атмосфере азота в течение 5 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли 4-фторфенилбороновую кислоту (83,4 г, 0,596 моль, 1,2 экв.), тетракис-(трифенилфосфин)палладий(0)(2,87 г, 2,5 ммоль, 0,005 экв.) и воду (442 мл). Реакционную смесь нагревали до 110 С в атмосфере азота в течение 5 ч. Реакционную смесь охлаждали до 60 С и разбавляли водой (800 мл) и третбутилметиловым эфиром (1,0 л). Охлаждали до комнатной температуры и полученные слои разделяли. Органический слой промывали 200 мл воды, слои разделяли и концентрировали с получением 3-(4-фторфенил)-2-[4-(трет-бутилоксикарбонил)пиперазин-1-ил]пиразина в виде твердого вещества светло-желтого цвета, которое использовали на следующей стадии без дополнительной очистки. В химический реактор вместе с н-бутанолом (1,67 л) и толуолом (99 мл) вносили неочищенный 3-(4-фторфенил)-2-[4-(трет-бутилоксикарбонил)пиперазин-1-ил]пиразин. Данную реакционную смесь нагревали до 60 С и in situ в реакционную смесь добавляли по каплям раствор HCl в н-бутаноле (приготовленый путем добавления 2,33 моль ацетилхлорида в 668 мл н-бутанола при 0 С; 835 мл). После завершения добавления перемешивали при 60 С в течение 2 ч и охлаждали до комнатной температуры. Перемешивали при комнатной температуре, образовавшееся твердое вещество отфильтровали, промывали н-бутанолом (200 мл) и сушили в течение ночи в вакуумной печи при 70 С с получением указанного в заголовке промежуточного соединения в виде твердого вещества желтого цвета (148,95 г; выход за четыре стадии с поправкой на содержание н-бутанола в препарате твердого вещества: 86%).(7,5 г, 54 ммоль). Нагревали в течение 17 ч при 102 С и оставляли охлаждаться до комнатной температуры приблизительно в течение 1,5 ч. Реакционную смесь распределяли между этилацетатом и водой. Слои разделяли. Органический слой промывали солевым раствором, сушили (сульфатом натрия), фильтровали, концентрировали и очищали (хроматография на силикагеле, элюирование смесью этилацетат:гексаны(3,3 г, 9,32 ммоль) растворяли в ДХМ (10 мл). Добавляли холодную (из холодильника) трифторуксусную кислоту (42,6 г, 28,8 мл). Данную смесь перемешивали в течение 2 ч при комнатной температуре. Реакционную смесь распределяли между метиленхлоридом и 5 н. NaOH (рН водного слоя 14). Слои разделяли. Водный слой экстрагировали метиленхлоридом (220 мл). Органические слои объединяли, сушили над безводным сульфатом натрия, фильтровали и концентрировали с получением указанного в заголовке соединения (2,35 г, 99%).MS (ES): масса/заряд = 255 [М+Н]+. Препарат 4. 3'-(3-Фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиразин. Указанное в заголовке соединение получали с помощью методик, аналогичных методикам, описанным для препарата 3, используя 3-фторбензолбороновую кислоту (выход 89%).MS (ES): масса/заряд = 259 [М+Н]+. Препарат 5. 3'-(2-Фторфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиразина дигидрохлорид. 3'-(2-Фторфенил)-2,3,5,6-тетрагидро[1,2']бипиразинил-4-карбоновой кислоты трет-бутиловый эфир получали в соответствии с методикой получения препарата 3, используя 2-фторбензолбороновую кислоту (выход 82%, MS (ES): масса/заряд = 359 [М+Н]+). К раствору 3'-(2-фторфенил)-2,3,5,6-тетрагидро[1,2']-бипиразинил-4-карбоновой кислоты третбутилового эфира (1,48 г, 4,13 ммоль) в 1,4-диоксане (8 мл) добавляли 4 М HCl в диоксане (8 мл) и данную смесь перемешивали при комнатной температуре в течение 3 ч, затем при 40 С в течение 16 ч. Реакционную смесь оставляли охлаждаться, выпавшее в осадок твердое вещество отфильтровывали, промывали 1,4-диоксаном и сушили при пониженном давлении при 60 С с получением указанного в заголовке соединения в виде твердого вещества желтого цвета (960 мг, 70%).(25 мл) и воде (10 мл). Добавляли тетракис-(трифенилфосфин)палладий(0) (0,49 г, 0,42 ммоль) и карбонат калия (2,80 г, 20,16 ммоль). Данную смесь нагревали в течение 4 ч при 114 С и оставляли охлаждаться до комнатной температуры приблизительно в течение 1,5 ч. Реакционную смесь распределяли между МТВЕ и водой. Слои разделяли. Органический слой сушили (сульфат натрия), фильтровали, концентрировали и очищали (хроматография на силикагеле, элюирование смесью этилацетат:гексаны (10:9030:70 с получением 3'-(фенил)-2,3,5,6-тетрагидро[1,2']бипиразинил-4-карбоновой кислоты третбутилового эфира (2,49 г, 87%).MS (ES): масса/заряд = 341 [М+Н]+. Указанное в заголовке соединение получали в результате снятия защитной группы в соответствии с методикой, использованной для препарата 3 (выход 96%).MS (ES): масса/заряд = 241 [М+Н]+. Препарат 7. 1-[4-(3,4,5,6-Тетрагидро-2 Н-[1,2']бипиразинил-3'-ил)фенил]этанон. 3'-(Фенил)-2,3,5,6-тетрагидро[1,2']бипиразинил-4-карбоновой кислоты трет-бутиловый эфир получали в соответствии с методикой получения препарата 6 с использованием 4-ацетилбензолбороновой кислоты (91% выход).MS (ES): масса/заряд = 383 [М+Н]+. Указанное в заголовке соединение получали в результате снятия защитной группы в соответствии с методикой, использованной для препарата 3 (выход 100%).MS (ES): масса/заряд = 283 [М+Н]+. Препарат 8. 3'-(4-Хлорфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиразин. 2,3-Дихлорпиразин (0,302 г, 2,03 ммоль) и 4-хлорфенилбороновую кислоту (0,320 г, 2,05 ммоль) подвергали взаимодействию с использованием тетракис-(трифенилфосфин)палладия(0) (0,124 г,0,107 ммоль) и фторида калия (0,355 г, 6,11 ммоль) в смеси толуола (19 мл) и воды (5 мл) при 100 С в течение 17,5 ч. Реакционную смесь охлаждали, слои разделяли и водный слой экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным водным раствором хлорида натрия, сушили (сульфатом магния), концентрировали и очищали (хроматография на силикагеле, элюирование смесью этилацетат:гексаны (0:100-35:65 с получением 2-хлор-3-(4-хлорфенил)пиразина (0,199 г, 44%). 2-Хлор-3-(4-хлорфенил)пиразин (0,148 г, 0,710 ммоль) и пиперазин-1-карбоновой кислоты трет-бутиловый эфир (0,216 г, 1,16 ммоль) подвергали взаимодействию с использованием 2-(дициклогексилфосфино)бифенила (0,0321 г, 0,0916 ммоль), трис-(дибензилиденацетон)дипалладия(0,0328 г, 0,0388 ммоль) и натриевой соли 2-метилпропан-2-ола (0,104 г, 1,09 ммоль) в толуоле (9 мл) при 82 С в течение 17 ч. Реакционную смесь охлаждали до комнатной температуры, разбавляли диэтиловым эфиром (50 мл), фильтровали через подушку силикагеля (1 см); подушку промывали диэтиловым эфиромMS (ES): масса/заряд = 303 [М+Н-изобутилен]+. 3'-(4-Хлорфенил)-2,3,5,6-тетрагидро[1,2']бипиразинил-4-карбоновой кислоты трет-бутиловый эфир растворяли в ДХМ (10 мл), добавляли 4 М водный раствор HCl (5 экв.) и перемешивали в течение 2 ч при температуре окружающей среды. Концентрировали при пониженном давлении, растворяли в метаноле(2 мл) и очищали на SCX, используя для элюирования продукта ионообменной смолы 2 М NH3 в метаноле с получением указанного в заголовке соединения (0,103 г, 100%).MS (ES): масса/заряд = 259 [М+Н]+. Препарат 9. 3'-(4-Трифторметилфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиразин. 2-Хлор-3-(4-трифторметилфенил)пиразин в 30% получали в соответствии с методикой, использованной для получения 2-хлор-3-(4-хлорфенил)пиразина. 2-Хлор-3-(4-трифторметилфенил)пиразин(0,570 г, 2,20 ммоль) и пиперазин (4,31 г, 50,0 ммоль) подвергали взаимодействию при 125 С в течение 111 мин. Реакционную смесь охлаждали до приблизительно 70 С, добавляли воду (50 мл), перемешивали до тех пор, пока температура реакционной смеси не стала ниже 35 С и разбавляли ДХМ (70 мл). Слои разделяли, водный слой экстрагировали ДХМ (270 мл), объединенные органические слои промывали насыщенным водным раствором хлорида натрия, сушили (сульфатом магния), концентрировали и очищали (хроматография на силикагеле, элюирование смесью этилацетат:гексаны (0:100-1:1 с получением указанного в заголовке соединения (0,384 г, 57%).- 23016529 Препарат 10. 2-Хлор-3-(3,4-дихлорфенил)пиразин. 2,3-Дихлорпиразин (2,42 г, 2,03 ммоль) и 3,4-дихлорбензолбороновую кислоту (0,406 г, 2,13 ммоль) растворяли в толуоле (6 мл). Добавляли раствор фторида калия (0,36 г; 6,2 ммоль) в деионизированной воде (5 мл). Добавляли тетракис-трифенилфосфин (0,124 г; 0,11 ммоль). Данную реакционную смесь кипятили с обратным холодильником в течение 17 ч, охлаждали до температуры окружающей среды и добавляли EtOAc (10 мл) и воду (10 мл). Органический слой отделяли, водный слой повторно экстрагировали EtOAc (240 мл) и органические слои объединяли. Полученный органический раствор промывали насыщенным водным раствором NaHCO3 и солевым раствором (2), сушили над MgSO4, фильтровали и концентрировали. Очищали путем хроматографии на силикагеле, используя для элюирования 0-40% этилацетат/гексаны, с получением указанного в заголовке соединения (0,124 г, 23% выход).MS (ES) масса/заряд = 274, 276 (М)+. Препарат 11. 3'-(3,4-Дихлорфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиразин. Смешивали 2-хлор-3-(3,4-дихлорфенил)пиразин (0,124 г, 0,477 ммоль) и пиперазин (1,40 г; 16,3 ммоль) и данную смесь нагревали в течение 2 ч при 120 С. Охлаждали до комнатной температуры и добавляли ДХМ (50 мл) и воду (50 мл). Слои разделяли и водный слой экстрагировали ДХМ (225 мл). Органические слои объединяли, промывали солевым раствором, сушили (MgSO4) и концентрировали. Очищали путем хроматографии на силикагеле, используя для элюирования 0-15% метанол в ДХМ, с получением указанного в заголовке соединения (0,118 г, 80%).N,N-диметилацетамида (90 мл) и воды (35 мл), продували азотом в течение 0,5 ч и затем добавляли тетракис-(трифенилфосфин)палладий(0) (0,170 г, 0,15 ммоль). Нагревали в течение 3 ч при 110 С, оставляли охлаждаться до комнатной температуры приблизительно в течение 1,5 ч, фильтровали и затем полученное твердое вещество сушили в сушильном шкафу в течение ночи с получением 3'-(4-цианофенил)-2,3,5,6-тетрагидро[1,2']бипиразинил-4-карбоновой кислоты трет-бутилового эфира в виде твердого вещества белого цвета (9,94 г, 88%).MS (ES): масса/заряд = 366 [М+Н]+. К 3'-(4-цианофенил)-2,3,5,6-тетрагидро[1,2']бипиразинил-4-карбоновой кислоты трет-бутиловому эфиру (3,29 г, 9,0 ммоль) добавляли 4 М HCl в 1,4-диоксане (10 мл). К данной реакционной смеси добавляли еще одну порцию 4 М HCl в 1,4-диоксане (10 мл) и нагревали при 40 С в течение 3 ч. Твердое вещество отфильтровывали и промывали смесью 1,4-диоксан/изогексан с получением дигидрохлоридной соли в виде твердого вещества желтого цвета (4,2 г).MS (ES): масса/заряд = 266 [М+Н]+. Данный дигидрохлорид растворяли в воде (20 мл), добавляли 2 н. гидроксид натрия (10 мл), экстрагировали ДХМ и ДХМ-экстракт концентрировали с получением указанного в заголовке соединения в виде твердого вещества желтого цвета (1,8 г).(35 мл) и данную смесь продували еще в течение 15 мин. Добавляли тетракис(трифенилфосфин)палладий(0) (0,130 г, 0,11 ммоль) и нагревали в течение 2 ч 10 мин при 110 С. Смесь оставляли охлаждаться до 65 С, добавляли воду (30 мл) и трет-бутилметиловый эфир (70 мл) и перемешивали в течение 0,5 ч. Твердое вещество отфильтровывали и сушили в вакуумной печи с получением 3'-(4-метансульфонилфенил)-2,3,5,6-тетрагидро[1,2']бипиразинил-4-карбоновой кислоты трет-бутилового эфира (8,3 г, 86%).MS (ES): масса/заряд = 419 [М+Н]+. Указанное в заголовке соединение получали (по существу, с количественным выходом) в результате снятия защитной группы в соответствии с методикой, использованной для препарата 12.MS (ES): масса/заряд = 319,1 [М+Н]+. Препарат 14. 3'-(4-Метоксифенил)-2,3,5,6-тетрагидро[1,2']бипиразин. 2-Хлор-3-(4-метоксифенил)пиразин синтезировали с использованием 4-метоксифенилбороновой кислоты в соответствии с методикой получения 2-хлор-3-(4-хлорфенил)пиразина (выход 54%). 2-Хлор-3-(4-метоксифенил)пиразин (0,236 г, 1,07 ммоль) и пиперазин (3,10 г, 36,0 ммоль) подвергали взаимодействию в тетрагидрофуране (5 мл) и нагревали при 120 С в течение 2 ч. Очищали путем хроматографии на силикагеле, используя для элюирования смесь метанол:ДХМ (0:100-20:80), с получением указанного в заголовке соединения (0,220 г, 76%).- 24016529 Препарат 15. Альтернативный путь получения 3'-(4-метоксифенил)-2,3,5,6-тетрагидро[1,2']бипиразинила. Указанное в заголовке соединение синтезировали с использованием 4-метоксифенилбороновой кислоты в соответствии с методикой получения препарата 3 (общий выход 70%).MS (ES): масса/заряд = 271,2 [М+Н]+. Препарат 16. 3'-(4-Этоксифенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиразин. 3'-Хлор-2,3,5,6-тетрагидро[1,2']бипиразинил-4-карбоновой кислоты трет-бутиловый эфир (0,726 г,2,43 ммоль) и 4-этоксифенилбороновую кислоту (0,95 г, 5,991 ммоль) подвергали взаимодействию в присутствии трифенилфосфина (0,202 г, 0,770 ммоль), ацетата палладия (0,056 г, 0,243 ммоль), карбоната натрия (3,8 мл 2 н. раствора в воде) в смеси ацетонитрила (42 мл) и воды (8 мл). Кипятили с обратным холодильником в течение 3 ч. Очищали путем хроматографии на силикагеле, используя для элюирования смесь этилацетат:гексаны (0:100-25:75), с получением 3'-(4-этоксифенил)-2,3,5,6-тетрагидро[1,2']бипиразинил-4-карбоновой кислоты трет-бутилового эфира (1,79 г, 96%). Снятие защитной группы у 3'-(4-этоксифенил)-2,3,5,6-тетрагидро[1,2']бипиразинил-4-карбоновой кислоты трет-бутилого эфира (1,80 г, 4,7 ммоль) проводили в ДХМ (100 мл) с использованием 4 М раствора HCl в 1,4-диоксане (38 мл). Концентрировали и остаток растворяли в смеси ДХМ и 10% водного раствора карбоната натрия. Слои разделяли и водный слой экстрагировали ДХМ (2150 мл). Органические слои объединяли, промывали насыщенным водным раствором хлорида натрия, сушили (сульфатом магния) и концентрировали с получением указанного в заголовке соединения (1,12 г, 84%).(0,135 г, 0,452 ммоль) и 4-изопропоксифенилбороновую кислоту (0,134 г, 0,743 ммоль) подвергали взаимодействию в присутствии трифенилфосфина (0,0482 г, 0,184 ммоль), ацетата палладия (0,0118 г,0,0526 ммоль), 2 н. водного раствора карбоната натрия (0,3 мл) в смеси н-пропанола (4 мл) и воды(0,3 мл). Кипятили с обратным холодильником в течение 17,5 ч, охлаждали до комнатной температуры и экстрагировали с использованием ДХМ. Очищали путем хроматографии на силикагеле, используя для элюирования смесь этилацетат:гексаны (0:100-1:1), с получением 3'-(4-изопропоксифенил)-2,3,5,6 тетрагидро[1,2']бипиразинил-4-карбоновой кислоты трет-бутилового эфира (0,144 г, 80%). Указанное в заголовке соединение получали в результате снятия защитной группы в соответствии с методикой, использованной для препарата 16 (0,158 г, 100%).(0,303 г, 1,47 ммоль), затем тетракис-(трифенилфосфин)палладий(0) (0,077 г, 0,067 ммоль). Добавляли этанол (2,68 мл), затем 2 н. водный раствор карбоната натрия (2,68 мл). Данную реакционную смесь кипятили с обратным холодильником в течение 18 ч. Реакционную смесь охлаждали до комнатной температуры и концентрировали. Добавляли этилацетат и промывали водой. Водный слой один раз экстрагировали этилацетатом. Сушили (сульфатом магния), фильтровали, концентрировали и очищали (хроматография на силикагеле, элюирование смесью этилацетат:гексаны (0:100-20:80 с получением 3'-(4-трифторметоксифенил)-2,3,5,6-тетрагидро[1,2']бипиразинил-4-карбоновой кислоты трет-бутилового эфира (534 мг, 94%).MS (ES): масса/заряд = 425 [М+Н]+. Указанное в заголовке соединение получали в результате снятия защитной группы в соответствии с методикой, использованной для препарата 16 (выход 100%).MS (ES): масса/заряд = 271,2 [М+Н]+. Препарат 19. 3'-(2-Трифторметилфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиразина дигидрохлорид. 3'-Хлор-2,3,5,6-тетрагидро[1,2']бипиразинил-4-карбоновой кислоты трет-бутиловый эфир (1,00 г,3,35 ммоль) растворяли в N,N-диметилацетамиде (12 мл) (дегазированном путем продувания азотом). Добавляли карбонат калия (1,11 г, 8,04 ммоль) и 2-трифторметилбензолбороновую кислоту (764 мг,4,02 ммоль), затем продували азотом в течение 15 мин. Добавляли обескислороженную воду (6 мл) и тетракис-(трифенилфосфин)палладий(0) (0,039 г, 0,034 ммоль) и продували азотом в течение 15 мин. Нагревали при 115 С в течение 21 ч в атмосфере азота. Охлаждали до комнатной температуры, добавляли воду (20 мл) и экстрагировали с использованием ДХМ (420 мл). ДХМ-экстракты концентрировали и очищали (хроматография на силикагеле, элюирование смесью этилацетат:изогексан (10:90-20:80 с получением 3'-(2-трифторметилфенил)-2,3,5,6-тетрагидро[1,2']бипиразинил-4-карбоновой кислоты третбутилового эфира (408 мг, 29%).- 25016529 3'-(2-Трифторметилфенил)-2,3,5,6-тетрагидро[1,2']бипиразинил-4-карбоновой кислоты третбутиловый эфир (408 мг, 1,00 ммоль) суспендировали в растворе HCl в диэтиловом эфире (1 М, 10 мл),перемешивали в течение 2 ч, затем концентрировали в вакууме. Добавляли еще одну порцию раствораHCl в диэтиловом эфире (1 М, 20 мл), перемешивали в течение ночи при комнатной температуре и концентрировали. Добавляли раствор HCl в диоксане (4 М, 10 мл) и перемешивали в течение 2 ч, затем концентрировали с получением указанного в заголовке соединения в виде твердого вещества желтого цветаMS (ES): масса/заряд = 309 [М+Н]+. Препарат 20. 3'-(2,6-Диметилфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиразина дигидрохлорид. 3'-Хлор-2,3,5,6-тетрагидро[1,2']бипиразинил-4-карбоновой кислоты трет-бутиловый эфир (1,00 г,3,35 ммоль) растворяли в N,N-диметилацетамиде (12 мл) (дегазированном путем продувания азотом). Добавляли карбонат калия (1,11 г, 8,04 ммоль), затем 2,6-диметилбензолбороновую кислоту (602 мг,4,02 ммоль) и продували азотом в течение 10 мин. Добавляли обескислороженную воду (6 мл) и тетракис-(трифенилфосфин)палладий(0) (0,039 г, 0,034 ммоль) и продували азотом в течение 10 мин. Нагревали при 115 С в течение 20 ч в атмосфере азота. Охлаждали до комнатной температуры, добавляли воду(20 мл), экстрагировали с использованием ДХМ (320 мл), пропускали через IST Phase Separator Frit и концентрировали. Растворяли в метаноле, твердое вещество отфильтровывали и фильтрат очищали путем SCX-2-хроматографии, промывая колонку метанолом и затем элюируя 2 М раствором аммиака в метаноле. Концентрировали, затем перемешивали при комнатной температуре в растворе HCl в диоксане(4 М, 50 мл) в течение 3 ч. Растворитель раскисляли, добавляли карбонат калия (2 г), фильтровали и фильтрат концентрировали. Очищали путем SCX-2-хроматографии, промывая колонку метанолом и затем элюируя 4 М раствором аммиака в метаноле, и концентрировали. Добавляли раствор HCl в диэтиловом эфире (1 М, 20 мл) и концентрировали, затем сушили под вакуумом при 40 С с получением указанного в заголовке соединения в виде кристаллов желтого цвета (650 мг, 57%).MS (ES): масса/заряд = 269 [М+Н]+. Препарат 21. 3'-(2-Фтор-3-трифторметилфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиразин. 1-Бром-2-фтор-3-трифторметилбензол (0,424 г, 1,77 ммоль), 5,5,5',5'-тетраметил[2,2']би[1,3,2]диоксаборинанил] (0,458 г, 2,03 ммоль), 1,1'-бис-(дифенилфосфино)ферроцендихлорпалладий (0,0632 г,0,0774 ммоль) и ацетат калия (0,499 г, 5,08 ммоль) смешивали в ДМФА (10 мл) и продували азотом в течение 0,5 ч. Нагревали в течение 2 ч при 80 С и охлаждали до комнатной температуры. Добавляли 3'-хлор-2,3,5,6-тетрагидро[1,2']бипиразинил-4-карбоновой кислоты трет-бутиловый эфир (0,406 г,1,36 ммоль), карбонат натрия (4,0 мл 2 М раствора в воде) и бис-(дифенилфосфино)ферроцендихлорпалладий (0,052 г, 0,0638 ммоль). Данную реакционную смесь нагревали при 80 С в течение 20 ч. Очищали путем хроматографии на силикагеле, используя для элюирования смесь этилацетат:гексаны (5:95-40:60), с получением 3'-(2-фтор-3-трифторметилфенил)-2,3,5,6 тетрагидро[1,2']бипиразинил-4-карбоновой кислоты трет-бутилового эфира (0,102 г, 18%). К раствору 3'-(2-фтор-3-трифторметилфенил)-2,3,5,6-тетрагидро[1,2']бипиразинил-4-карбоновой кислоты трет-бутилового эфира (0,101 г, 0,237 ммоль) в ДХМ (10 мл) добавляли 4 М раствор HCl в 1,4-диоксане (5 мл) и перемешивали в течение 19 ч. Концентрировали, остаток растворяли в метаноле(20 мл) и очищали путем SCX-хроматографии (перед нанесением вещества колонку предварительно промывали метанолом), элюировали 2 М раствором аммиака в метаноле и концентрировали с получением указанного в заголовке соединения в виде твердого вещества желтого цвета (0,0985 г).MS (ES): масса/заряд = 327 [М+Н]+. Препарат 22. 3'-(4-Фтор-3-трифторметилфенил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиразин. Указанное в заголовке соединение получали в соответствии с методикой получения препарата 21, с использованием 1-бром-4-фтор-3-трифторметилбензола (общий выход 71%).(0,034 г, 0,047 мл, 0,335 ммоль) и карбонат цезия (27,3 г, 83,7 ммоль). Кипятили с обратным холодильником в течение 18 ч. Концентрировали и остаток распределяли между ДХМ и насыщенным раствором бикарбоната натрия. Водную фазу дважды экстрагировали ДХМ и один раз этилацетатом. Объединенные органические экстракты сушили (сульфат натрия), фильтровали,концентрировали и очищали (хроматография на силикагеле, элюирование смесью этилацетат:гексаны- 26016529 4-(2-Хлорпиридин-3-ил)пиперазин-1-карбоновой кислоты трет-бутиловый эфир (2,7 г, 9,1 ммоль) растворяли в толуоле (30 мл). Добавляли 4-фторфенилбороновую кислоту (1,92 г, 13,70 ммоль), затем бис-(дибензилиденацетон)палладий(0) (0,42 г, 0,46 ммоль), 1,2,3,4,5-пентафенил-1'-(ди-третбутилфосфино)ферроцен (CTC-Q-PHOS) (0,65 г, 0,91 ммоль) и фосфат калия (5,8 г, 27,3 ммоль). Данную реакционную смесь нагревали при 100 С в течение 23 ч. Охлаждали до комнатной температуры, концентрировали и остаток распределяли между этилацетатом и 1 н. раствором гидроксида натрия (рН 11). Сушили (сульфатом натрия), фильтровали, концентрировали и очищали (хроматография на силикагеле,элюирование смесью этилацетат:гексаны (20:80 с получением 4-[2-(4-фторфенил)пиридин-3 ил]пиперазин-1-карбоновой кислоты трет-бутилового эфира (28%).MS (ES): масса/заряд = 358 [М+Н]. 4-[2-(4-Фторфенил)пиридин-3-ил]пиперазин-1-карбоновой кислоты трет-бутиловый эфир (0,9 г,2,52 ммоль) растворяли в ДХМ (25 мл). Добавляли трифторуксусную кислоту (8,6 г, 5,8 мл, 75,6 ммоль). Данную смесь перемешивали при комнатной температуре в течение 2 ч, очищали на ионообменной SCXколонке с получением указанного в заголовке соединения.MS (ES): масса/заряд = 258 [М+Н]. Препарат 24. 1-[2-(2-Фторфенил)пиридин-3-ил]пиперазин. 2-Хлор-3-йодпиридин (2,0 г, 8,37 ммоль) растворяли в толуоле (7 мл). Добавляли пиперазин-1 карбоновой кислоты трет-бутиловый эфир (1,2 г, 6,4 ммоль), затем добавляли трис-(дибензилиденацетон)дипалладий(0) (0,12 г, 0,13 ммоль), 4,5-бис-(дифенилфосфино)-9,9-диметилксантен (0,23 г,0,39 ммоль) и трет-бутилат натрия (0,93 г, 9,7 ммоль). Нагревали при 100 С в течение 3,5 ч. Концентрировали и остаток распределяли между EtOAc и водой. Водную фазу дважды экстрагировали этилацетатом. Объединенные органические слои промывали солевым раствором. Органические экстракты сушили(1,13 г, 8,2 ммоль). Данную реакционную смесь нагревали при 100 С в течение 22 ч. Охлаждали до комнатной температуры, концентрировали и остаток распределяли между этилацетатом и водой. Водный слой экстрагировали этилацетатом. Объединенные органические слои промывали солевым раствором. Органические экстракты сушили (сульфатом натрия), фильтровали, концентрировали и очищали (хроматография на силикагеле, элюирование смесью этилацетат:гексаны (10:90-30:70 с получением 4-[2-(2-фторфенил)пиридин-3-ил]пиперазин-1-карбоновой кислоты трет-бутилового эфира (91%).MS (ES): масса/заряд = 358 [М+Н]+. Указанное в заголовке соединение получали в результате снятия защитной группы в соответствии с методикой, использованной для препарата 21 (выход 100%).MS (ES): масса/заряд = 258 [М+Н]+. Препарат 25. 1-[3-(4-Фторфенил)пиридин-2-ил]пиперазин. 2-Бромпиридин (5 мл, 51,3 ммоль) растворяли в тетрагидрофуране (125 мл). Охлаждали до -78 С и добавляли диизопропиламид лития (28,2 мл, 56,4 ммоль, 2 М раствор в смеси гептан/тетрагидрофуран/этилбензол). Перемешивали в течение 45 мин при -78 С, добавляли хлорид цинка(102,5 мл, 51,3 ммоль, 0,5 М раствор в тетрагидрофуране) и нагревали до 25 С в течение 1 ч. Добавляли 1-фтор-4-йодбензол (5,91 мл, 51,3 ммоль) и тетракис-(трифенилфосфин)палладий(0) (2,96 г, 2,56 ммоль) и данную смесь кипятили с обратным холодильником в течение 18 ч. Смесь охлаждали до комнатной температуры, разбавляли насыщенным водным раствором бикарбоната натрия и 3 раза экстрагировали ДХМ. Органические экстракты объединяли, сушили (сульфатом натрия), фильтровали и очищали (хроматография на силикагеле, элюирование смесью этилацетат:гексаны (20:80 с получением 2-бром-3-(4 фторфенил)пиридина (4,27 г, выход 33%). 2-Бром-3-(4-фторфенил)пиридин (4,4 г, 17,5 ммоль) растворяли в толуоле (185 мл) и добавляли пиперазин (4,5 г, 52,4 ммоль), трис-(дибензилиденацетон)дипалладий(0) (0,8 г, 873 ммоль), трет-бутилат натрия (2,35 г, 24,4 ммоль) и рацемический 2,2'-бис-(дифенилфосфино)-1,1'-бинафтил (1,63 г,2,62 ммоль). Данную смесь кипятили с обратным холодильником в течение 18 ч, затем охлаждали до комнатной температуры и фильтровали через Celite. Смесь разбавляли этилацетатом и промывали насыщенным водным раствором бикарбоната натрия, насыщенным водным раствором хлорида натрия, сушили (сульфатом натрия), фильтровали, концентрировали и очищали (хроматография на силикагеле,элюирование смесью 2 М раствор аммиака в метаноле:ДХМ (15:85 с получением указанного в заголовке соединения в виде твердого вещества желтого цвета (3,9 г, 87%).MS (APCI (химическая ионизация при атмосферном давлении: масса/заряд = 258 [М+Н]+.(10,08 г, 52,4 ммоль). Смесь нагревали при перемешивании до 190 С в течение 1 ч. Смесь оставляли охлаждаться до приблизительно 80 С, затем вливали в воду и 5 раз экстрагировали ДХМ. Раствор сушили(сульфатом натрия), фильтровали и концентрировали. Очищали путем хроматографии на силикагеле,используя для элюирования смесь метанол (с 2 М аммиаком):ДХМ (15:85), с получением 1-(3-бромпиридин-2-ил)пиперазина в виде твердого вещества белого цвета (8,98 г, 71%). 1-(3-Бромпиридин-2-ил)пиперазин (0,579 г, 2,39 ммоль) растворяли в диметиловом эфире этиленгликоля (8 мл). Добавляли карбонат натрия (2 М раствор в воде, 2,6 мл), затем фенилбороновую кислоту (0,321 г, 2,63 ммоль). Добавляли тетракис-(трифенилфосфин)палладий(0) (0,138 г, 0,120 ммоль) и кипятили с обратным холодильником в течение 18 ч. Охлаждали до комнатной температуры, затем разбавляли насыщенным водным раствором бикарбоната натрия и 3 раза экстрагировали этилацетатом. Сушили (сульфатом натрия), фильтровали, концентрировали и очищали (хроматография на силикагеле,элюирование смесью метанол (с 2 М аммиаком):ДХМ (15:85 с получением указанного в заголовке соединения в виде масла желтого цвета (0,404 г, 71%).MS (ES): масса/заряд = 240 [М+Н]+. В качестве альтернативы 1-(3-фенилпиридин-2-ил)пиперазин может быть получен следующим образом. 3-Фенилпиридин 1-оксид: 3-фенилпиридин (5,0 г, 32,2 ммоль) растворяли в ледяной уксусной кислоте (20 мл). Добавляли 30% перекись водорода (3,25 мл, 28,6 ммоль, 30% раствор в воде). Данную реакционную смесь нагревали до 80 С в течение 2,25 ч. Добавляли 30% перекись водорода (4,0 мл,35,2 ммоль, 30% раствор в воде). Реакционную смесь нагревали при 80 С в течение 1,75 ч. Добавляли 30% перекись водорода (1,0 мл, 8,8 ммоль, 30% раствор в воде). Реакционную смесь нагревали при 80 С в течение 1,5 ч. Реакционную смесь охлаждали до температуры окружающей среды в течение ночи. Реакционную смесь концентрировали при пониженном давлении, но не досуха. Остаток очищали путем хроматографии на силикагеле. Для удаления примесей использовали элюент этилацетат-гексаны, затем элюировали с использованием системы метанол-дихлорметан с получением 4,4 г (80%) 3-фенилпиридина 1-оксида в виде твердого вещества белого цвета.MS (масса/заряд): 172 (М+1). 2-Хлор-3-фенилпиридин: 3-фенилпиридин 1-оксид (1,0 г, 5,84 ммоль) растворяли в оксихлориде фосфора (14 мл, 153 ммоль). Реакционную смесь нагревали до 105 С в течение 6 ч, охлаждали до температуры окружающей среды и, чтобы нейтрализовать избыток оксихлорида фосфора, реакционную смесь медленно при перемешивании выливали на лед. Подщелачивали концентрированным гидроксидом аммония и экстрагировали дихлорметаном. Органический экстракт промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле (элюент: этилацетат-гексаны) с получением 315 мг (28%) 2-хлор-3 фенилпиридина в виде жидкости желтого цвета.H-ЯМР (400 МГц, ДМСО-d6)8,42 (дд, 1 Н, J=4,6, 2,0 Гц), 7,87 (дд, 1 Н, J=7,5, 1,8 Гц), 7,54-7,41 (м,6 Н). 1-(3-Фенилпиридин-2-ил)пиперазин. Смесь 2-хлор-3-фенилпиридина (1,12 г, 5,9 ммоль) и пиперазина (5,08 г, 59,0 ммоль) нагревали в герметично закрытой пробирке при 165 С в течение 23 ч. Охлаждали до температуры окружающей среды. Реакционную смесь растворяли в воде и этилацетате. Водный слой экстрагировали этилацетатом (3). Органические экстракты промывали водой (2) и солевым раствором. Водные фазы повторно экстрагировали этилацетатом. Объединяли все этилацетатные экстракты,сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали путем хроматографии на силикагеле (элюент: 2 н. аммиак в метаноле-дихлорметан) с получением 1,36 г (96%) указанного в заголовке соединения в виде масла желтого цвета.- 28016529 Препараты 27-31 получали, по существу, в соответствии с тем, как описано для препарата 26, с использованием подходящей бороновой кислоты и 1-(3-бромпиридин-2-ил)пиперазина.N,N-диметилформамиде (20 мл). Реакционную смесь продували в течение 30 мин, затем нагревали до 85 С в течение ночи. Распределяли между водой (100 мл) и этилацетатом (100 мл), водный слой промывали этилацетатом (100 мл). Этилацетатные фазы объединяли и сушили над сульфатом магния, фильтровали и концентрировали под вакуумом. В результате очистки (хроматография на силикагеле, элюирование смесью этилацетат:изогексан (0:100-20:80 получали указанное в заголовке соединение в виде порошка белого цвета (560 мг, выход 44%).MS (ES): масса/заряд = 244 [М+Н]+. Препарат 33. 1-Бром-2-этансульфонилэтан. 2-Этансульфонилэтанол (1,06 г, 7,67 ммоль) растворяли в ДХМ (18 мл) и добавляли трибромид фосфора (0,8 мл, 8,44 ммоль). Данную смесь перемешивали при комнатной температуре в течение ночи,затем раствор отделяли от отстоявшегося масла. Раствор промывали насыщенным водным бикарбонатом натрия, затем сушили (сульфатом натрия), фильтровали и концентрировали с получением указанного в заголовке соединения в виде масла желтого цвета (0,582 г, 38%). 1 Н-ЯМР (400 МГц, CDCl3)3,67 (т, J=7,6 Гц, 2 Н), 3,46 (т, J=7,6 Гц, 2 Н), 3,06 (кв, J=7,5 Гц, 2 Н), 1,41(0,650 г, 1,961 ммоль), Перемешивали при комнатной температуре в атмосфере азота в течение 3 ч. Реакционную смесь фильтровали через бумагу, промывая ДХМ. Фильтрат концентрировали под вакуумом с получением указанного в заголовке соединения (0,362 г, выход 100%).GC-MS (газовая хроматография/масс-спектроскопия) (масса/заряд): 202/204 (М+), 95. Препарат 35. 1-Метил-3-трифторметил-1 Н-пиразол-4-карбальдегид. 3-Трифторметил-1 Н-пиразол-4-карбоновой кислоты этиловый эфир (2,0 г, 9,61 ммоль) растворяли вN,N-диметилформамиде (20 мл) и охлаждали до 0 С. Добавляли гидрид натрия (0,58 г, 14,42 ммоль, 60% дисперсия в масле) и перемешивали при 0 С в течение 20 мин. Добавляли йодметан (0,90 мл,14,42 ммоль) и оставляли нагреваться до комнатной температуры в течение 18 ч. Распределяли между этилацетатом (100 мл) и водой (50 мл). Органический слой отделяли и промывали водой (550 мл) и насыщенным водным раствором хлорида натрия (50 мл). Сушили (сульфатом натрия), фильтровали, концентрировали и очищали (хроматография на силикагеле, элюирование смесью гексаны:этилацетат(1,74 г, 81,7%). 1 Н-ЯМР (400 МГц, CDCl3)7,92 (с, 1 Н), 4,27 (кв, 2 Н), 3,95 (с, 3H), 1,33 (т, 3H). 1-Метил-3-трифторметил-1 Н-пиразол-4-карбоновой кислоты этиловый эфир (1,74 г, 7,83 ммоль) растворяли в тетрагидрофуране (100 мл) и охлаждали до 0 С. В течение 15 мин добавляли по каплям диизобутилалюминий гидрид (47,0 мл, 47,0 ммоль, 1 М раствор в толуоле). Реакционную смесь оставляли нагреваться до комнатной температуры в течение 16 ч. Распределяли между этилацетатом (100 мл) и насыщенным водным раствором тартрата калия-натрия (50 мл) и перемешивали при комнатной температуре еще в течение 16 ч. Органический слой отделяли, сушили (сульфатом натрия), фильтровали и концентрировали с получением (1-метил-3-трифторметил-1 Н-пиразол-4-ил)метанола (1,42 г, 100%). 1(25 мл) и диметилсульфоксида (2,22 мл, 31,3 ммоль) и охлаждали до -78 С. В течение 15 мин добавляли по каплям оксалилхлорид (1,91 мл, 21,9 ммоль) и дополнительно перемешивали при -78 С в течение 1 ч. Добавляли по каплям триэтиламин (6,55 мл, 47,0 ммоль) и перемешивали еще в течение 1 ч. Реакционную смесь гасили водой (20 мл), разбавляли ДХМ (50 мл) и нагревали до комнатной температуры в тече- 29
МПК / Метки
МПК: C07D 405/14, A61K 31/497, C07D 417/14, C07D 413/14, C07D 401/14, C07D 403/12, C07D 401/12, A61P 25/00
Метки: рецепторов, качестве, пиридины, 3-[4-(пиразол-4-илалкил)пиперазин-1-ил]-2-фенилпиридины, антагонистов, 5-ht7, 2-[4-(пиразол-4-илалкил)пиперазин-1-ил]-3-фенилпиразины
Код ссылки
<a href="https://eas.patents.su/30-16529-2-4-pirazol-4-ilalkilpiperazin-1-il-3-fenilpiraziny-i-piridiny-i-3-4-pirazol-4-ilalkilpiperazin-1-il-2-fenilpiridiny-v-kachestve-antagonistov-receptorov-5-ht7.html" rel="bookmark" title="База патентов Евразийского Союза">2-[4-(пиразол-4-илалкил)пиперазин-1-ил]-3-фенилпиразины и -пиридины и 3-[4-(пиразол-4-илалкил)пиперазин-1-ил]-2-фенилпиридины в качестве антагонистов рецепторов 5-ht7</a>
Предыдущий патент: Создание химических строительных блоков из растительной биомассы посредством избирательной деполимеризации
Следующий патент: Способ выявления цитогенетического и цитотоксического действия факторов окружающей среды в клетках щитовидной железы
Случайный патент: Применение димирацетама для лечения остеоартрита и связанных с ним заболеваний












