Триазолопиридазиновые модуляторы протеинкиназ
Номер патента: 16527
Опубликовано: 30.05.2012
Авторы: Торрес Эдуардо, Ли Патрик С., Смит Кристофер Рональд, Буно Пьер-Ив, Джефферсон Элизабет Энн
Формула / Реферат
1. Соединение, выбранное из группы, состоящей из
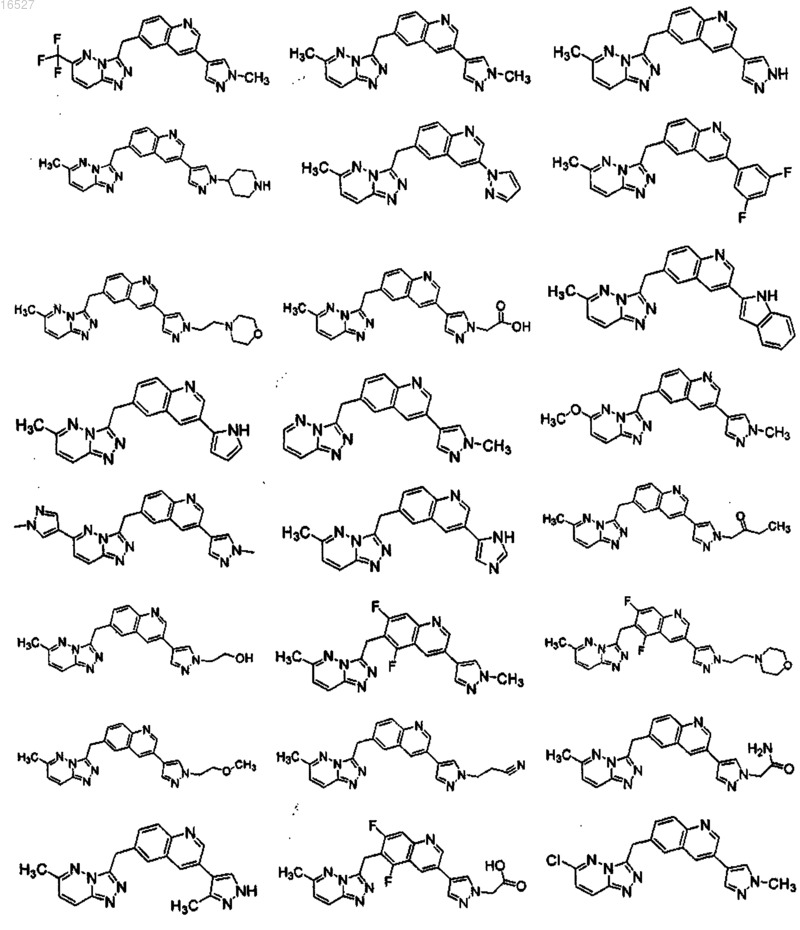

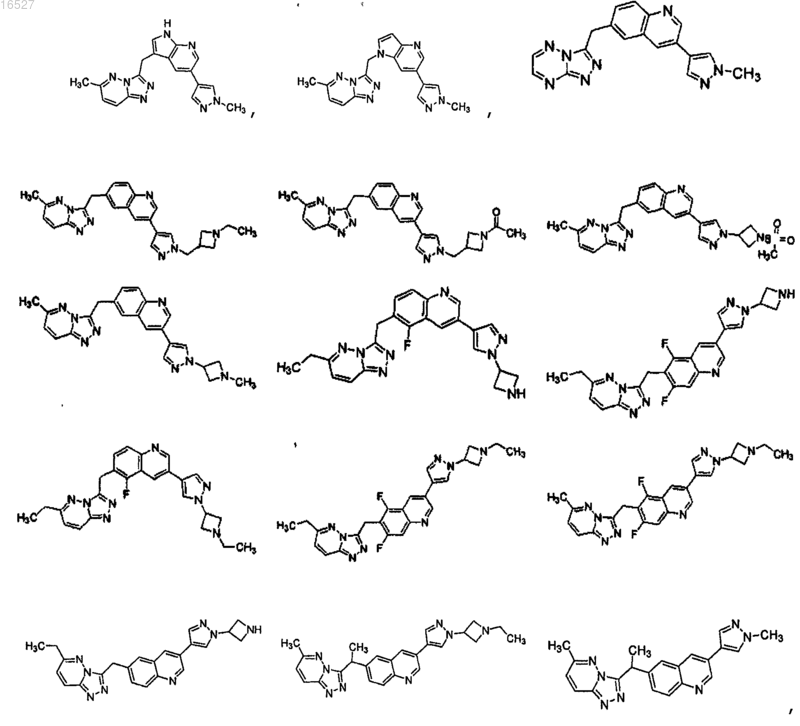
его энантиомер, диастереомер, рацемат или фармацевтически приемлемая соль.
2. Применение соединения по п.1 для получения лекарственного средства для лечения рака молочной железы, рака легкого, меланомы, рака толстой кишки, рака мочевого пузыря, рака яичников, рака предстательной железы, рака почки, плоскоклеточного рака, глиобластомы, рака поджелудочной железы, лейомиосаркомы, множественной миеломы, папиллярного почечно-клеточного рака, рака желудка, рака печени, рака головы и шеи, меланомы или лейкемии (например, миелоидной лейкемии, хронической миелоидной лейкемии, острой лимфобластной лейкемии, хронической лимфобластной лейкемии, болезни Ходжкина и других видов лейкемии и/или рака крови).
3. Применение соединения по п.1 для лечения заболевания, опосредуемого активностью киназы.
4. Фармацевтическая композиция, содержащая соединение по п.1 и фармацевтически приемлемый наполнитель.
Текст
Настоящее изобретение относится к триазолопиридазиновым модуляторам протеинкиназ,выбранным из группы, состоящей из формул, указанных в описании, их энантиомерам,диастереомерам, рацематам или фармацевтически приемлемой соли. Также изобретение относится к применению указанных соединений для лечения заболеваний, опосредуемых киназной активностью, применению их для получения лекарственного средства для лечения рака молочной железы, рака легкого, меланомы, рака толстой кишки и других видов рака. Изобретение также относится к фармацевтической композиции, содержащей заявленные соединения. 016527 Перекрестные ссылки на родственные заявки Настоящая заявка испрашивает приоритет на основании предварительных заявок на патенты США 60/862552, 60/883468 и 60/913752, озаглавленных "Триазолопиридазиновые модуляторы протеинкиназ", поданных 23 октября 2006 года, 4 января 2007 года и 24 апреля 2007 года соответственно. Таким образом, испрашивается приоритет по датам подачи указанных заявок, при этом содержание указанных заявок включено в настоящее описание во всей полноте посредством ссылки. Уровень техники Протеинкиназы млекопитающих являются важными регуляторами жизнедеятельности клеток. Поскольку нарушения активности протеинкиназ связывают с рядом заболеваний и расстройств, разрабатываются лекарственные препараты, мишенями для которых являются протеинкиназы. Семейство тирозинкиназ, в частности подтип рецепторных тирозинкиназ, включает большое количество установленных и потенциальных мишеней для лечения рака. Рецепторные тирозинкиназы (РТК), такие как EGFR (рецептор эпидермального фактора роста), HER2, KIT и KDR, представляют собой хорошо изученные белки,роль которых в развитии раковых заболеваний точно определена. Лекарственные препараты, мишенями для которых являются указанные РТК, например Гливек (Gleevec), Иресса (Iressa) и Тарцева (Tarceva),одобрены для лечения некоторых видов раковых заболеваний. Другие РТК, изученные менее хорошо,также связывают с развитием раковых заболеваний. Например, результаты проводимых исследований свидетельствуют о том, что ингибиторы TRKC, ROS, CSF1R/FMS и ALK подходят для лечения рака. Двумя особенно предпочтительными РТК-мишенями при разработке новых агентов для лечения рака являются МЕТ и RON. Фактор роста гепатоцитов (hepatocyte growth factor, HGF), также известный как рассеивающий фактор, представляет собой мультифункциональный фактор роста, способствующий протеканию трансформации и развитию опухоли за счет индуцирования митогенеза и подвижности клеток. Кроме того, HGF способствует метастазированию за счет стимулирования подвижности клеток и инвазии через различные пути передачи сигнала. Для того чтобы оказывать воздействие на клетки, HGF должен связываться со своим рецептором с-Met, представляющим собой рецепторную тирозинкиназу. с-Met представляет собой широко экспрессируемый гетеродимерный белок, содержащий -субъединицу с молекулярной массой 50 килодальтон (кДа) и -субъединицу с молекулярной массой 145 кДа (Maggiora et al., J. Cell Physiol.,173:183-186, 1997). Избыточная экспрессия c-Met наблюдается в значительном количестве случаев раковых заболеваний у людей, при этом указанная экспрессия усиливается при переходе от первичных опухолей к метастазам. Различные виды раковых заболеваний, которые связывают с избыточной экспрессией c-Met, включают, без ограничения, аденокарциному желудка, рак почки, мелкоклеточную карциному легкого, рак толстой кишки, рак предстательной железы, рак мозга, рак печени, рак поджелудочной железы и рак молочной железы. Также c-Met связывают с атеросклерозом и фиброзом легкого. МЕТ впервые был идентифицирован в ходе перестройки, трансформирующей ДНК (TPR-MET), в линии клеток остеосаркомы человека, обработанных N-метил-N'-нитронитрозогуанидином (Cooper et al. 1984). Рецепторная тирозинкиназа МЕТ (также известная как рецептор фактора роста гепатоцитов,HGFR, МЕТ или c-Met) и являющийся ее лигандом фактор роста гепатоцитов ("HGF") обладают широким спектром биологической активности, включая стимуляцию пролиферации, выживаемости, дифференцировки и морфогенеза, тубулогенеза ветвления, подвижности клеток и инвазивного роста. МЕТ связывают с патологическими процессами, такими как рост, инвазия и метастазирование, для множества различных видов рака, включая рак почки, рак желудка, рак легкого, рак яичников, рак печени и рак молочной железы. С точки зрения влияния на соматические процессы, активирующие мутации в МЕТ были обнаружены при метастазах карциномы человека и отдельных видах рака, таких как папиллярная почечно-клеточная карцинома. Также имеются доказательства того, что путь передачи сигнала МЕТ может играть важную роль в резистентности к терапии раковых заболеваний. Например, было установлено, что экспрессия гена МЕТ повышена у пациентов, страдающих раком легких, при рецидиве после первичного ответа на действие ингибиторов EGFR, таких как гефитиниб и эрлотиниб. Далее, имеются подтверждения того, что помимо раковых заболеваний ингибирование МЕТ может быть важным при лечении при различных показаниях, включая инвазию Listeria, остеолиз, связанный с множественной миеломой, малярийную инфекцию, различные виды ретинопатии при диабете, псориаз и артрит. Мутации в кодирующей последовательности МЕТ при раковых заболеваниях у человека встречаются сравнительно редко. Однако тот факт, что у пациентов с хронической миелогенной лейкемией, подвергавшихся лечению эрлотинибом и гефитинибом, были выделены мутации BCR-ABL, позволяет предположить, что именно указанные и/или, возможно, другие мутации МЕТ в дополнение к указанным могут обуславливать резистентность к лекарственным препаратам. Согласно прогнозам эти мутации будут встречаться все чаще,если ингибиторы МЕТ будут широко применяться для лечения рака. Поэтому лекарственные препараты,эффективно подавляющие некоторые из указанных мутаций МЕТ, в будущем могут быть очень важным инструментом терапии рака. МЕТ тесно связан с группой из пяти рецепторных тирозинкиназ, изученных менее хорошо по сравнению с МЕТ. Указанные тирозинкиназы включают Tyro3/Sky, MER, AXL, RYK и RON. ТирозинкиназаRON представляет собой рецептор белка, стимулирующего макрофаги, который принадлежит к семейству МЕТ и является ближайшим аналогом семейства МЕТ рецепторных тирозинкиназ. Аналогично MET,RON связывают с ростом, инвазией и метастазированием для ряда различных форм рака, включая рак толстой кишки и рак мочевого пузыря. Также имеются доказательства того, что нарушения регуляцииAXL и MER могут играть важную роль в развитии раковых заболеваний. MER обладает множеством свойств, согласующихся с его активностью в качестве онкогена. У трансгенных мышей, экспрессирующих MER в последовательности гематопоэтических клеточных поколений, развивались симптомы, сходные с симптомами Т-клеточной лимфобластной лейкемии/лимфомы. Экспрессия MER также наблюдается у большинства пациентов, страдающих острой Т-клеточной лимфобластной лейкемией (T-ALL). Исследования на мышах позволяют предположить, что AXL играет важную роль в росте опухоли при раке молочной железы, при котором, как полагают, AXL регулирует как ангиогенные, так и онкогенные процессы. Другие исследования с использованием клеточных линий рака человека позволяют предположить наличие связи AXL с метастазом при немелкоклеточном раке легкого (NSCLC) и резистентностью к лекарственным препаратам. Несмотря на то что о роли Tyro3/Sky в нормальных и патологических процессах известно очень мало, указанная рецепторная тирозинкиназа обладает некоторыми из свойств и функций, присущих родственным ей тирозинкиназам, о которых известно больше. Со временем может быть установлено, что Tyro3/Sky играет важную роль в развитии раковых заболеваний. RYK также экспрессируется при некоторых видах рака, однако представляет собой атипичную тирозинкиназу рецепторасироты, не обладающую заметной киназной активностью, вследствие чего возможность ее применения в качестве мишени для лекарственных препаратов с молекулами небольшого размера, предназначенных для лечения рака, в настоящее время не установлена. Поскольку киназы связывают с развитием целого ряда заболеваний и состояний, таких как рак, в настоящее время существует потребность в создании новых высокоактивных ингибиторов протеинкиназ,которые подходят для применения в терапевтических целях. Настоящее изобретение отвечает этой и другим потребностям, существующим в данной области техники. Несмотря на то что в настоящем описании указаны отдельные конкретные протеинкиназы, настоящее изобретение не ограничивается ингибиторами лишь этих киназ и включает, но не ограничивается ими, ингибиторы родственных протеинкиназ и ингибиторы гомологичных белков. Краткое описание изобретения Было установлено, что предложенные в настоящем изобретении соединения на основе триазолопиридазина подходят для модулирования киназной активности и лечения заболеваний, опосредуемых киназной активностью. В частности, соединения согласно настоящему изобретению могут применяться для уменьшения и/или подавления активности тирозинкиназ, включая МЕТ. Кроме того, соединения согласно настоящему изобретению подходят для уменьшения или подавления киназной активности МЕТ в клетке или у субъекта и модулирования экспрессии МЕТ в клетке или у субъекта. Предложенные соединения также подходят для предотвращения или лечения у субъекта нарушений клеточной пролиферации и/или нарушений, связанных с МЕТ. Ниже приведено подробное описание предложенных в настоящем изобретении триазолопиридазиновых модуляторов киназ. Кроме того, в настоящем описании охарактеризована ингибирующая активность отдельных соединений. Согласно одному из аспектов в настоящем изобретении предложено соединение, выбранное из его энантиомер, диастереомер, рацемат или фармацевтически приемлемая соль. Согласно другим вариантам реализации настоящее изобретение относится к применению указанных соединений для получения лекарственного средства для лечения, в частности, рака, а также применению их для лечения заболевания, опосредуемого активностью киназы. Также изобретение относится к фармацевтическим композициям, в которых применяются вышеуказанные соединения. Краткое описание чертежей Фиг. 1 иллюстрирует влияние соединения 30 на ингибирование роста опухоли GTL16 при введении указанного соединения перорально (п/о) два раза в сутки или путем внутрибрюшинной инъекции (в/б) в течение 14 дней подряд; фиг. 2 иллюстрирует влияние соединения 30 на ингибирование роста опухоли GTL16 при пероральном и внутрибрюшинном введении указанного соединения; фиг. 3 иллюстрирует влияние соединения 30 на рост опухоли GTL16 при пероральном и внутрибрюшинном введении указанного соединения; фиг. 4 иллюстрирует влияние соединения 124 на фосфорилирование МЕТ опухоли при пероральном (п/о) введении указанного соединения в виде острой дозы; фиг. 5 иллюстрирует влияние соединения 87 на фосфорилирование МЕТ опухоли при пероральном(п/о) введении указанного соединения в виде острой дозы; фиг. 6 иллюстрирует влияние соединения 124 на средний объем опухоли при пероральном (п/о) введении указанного соединения два раза в сутки (Q12H) в течение 14,5 дней подряд; фиг. 7 иллюстрирует влияние соединения 124 на ингибирование роста опухоли (ИРО) в случае опухолей GTL16 у голых мышей при пероральном введении указанного соединения. Подробное описание изобретения Соединения согласно настоящему изобретению могут существовать в виде солей, при этом такие соли также включены в объем настоящего изобретения. Примеры подходящих солевых форм включают-4 016527 гидрохлориды, гидробромиды, сульфаты, метансульфонаты, нитраты, малеаты, ацетаты, цитраты, фумараты, тартраты (например, (+)-тартраты, (-)-тартраты или их смеси, включая рацемические смеси), сукцинаты, бензоаты и соли аминокислот, таких как глутаминовая кислота. Указанные соли могут быть получены по способам, хорошо известным специалисту в данной области техники. Настоящее изобретение также включает соли присоединения оснований, такие как натриевые, калиевые, кальциевые, аммониевые соли, соли органических аминов, или магниевые соли, или другие подобные соли. В случае, когда соединения согласно настоящему изобретению содержат сравнительно основные функциональные группы, могут быть получены соли присоединения кислот путем приведения таких соединений, находящихся в нейтральной форме, в контакт с достаточным количеством требуемой кислоты, в чистом виде или в подходящем инертном растворителе. Примеры подходящих солей присоединения кислот включают соли неорганических кислот, таких как соляная, бромисто-водородная, азотная, угольная, одноосновная угольная (monohydrogencarbonic), фосфорная, одноосновная фосфорная (monohydrogenphosphoric), двухосновная фосфорная (dihydrogenphosphoric), серная, одноосновная серная (monohydrogensulfuric), йодистоводородная или фосфорная кислоты и др., а также соли органических кислот, таких как уксусная, пропионовая, изомасляная, малеиновая, малоновая, бензойная, янтарная, пробковая, фумаровая, молочная,миндальная, фталевая, бензосульфокислота, п-толилсульфокислота, лимонная, винная кислоты, метансульфокислота и др. Настоящее изобретение также включает соли аминокислот, такие как аргинаты и др. и соли органических кислот, таких как глюкуроновой или галактуроновой кислот, и др. Некоторые конкретные соединения согласно настоящему изобретению содержат как кислотные, так и основные функциональные группы, что обеспечивает возможность превращения указанных соединений либо в соли присоединения оснований, либо в соли присоединения кислот. Нейтральные формы соединений согласно изобретению предпочтительно подвергают преобразованию путем приведения указанной соли в контакт с основанием или кислотой и выделения исходного соединения с помощью традиционно применяемых способов. Исходная форма соединения отличается от различных солевых форм по некоторым физическим свойствам, таким как растворимость в полярных растворителях. Некоторые соединения согласно настоящему изобретению могут существовать как в несольватированных формах, так и в сольватированных формах, включая гидратированные формы. В общем случае,сольватированные формы эквивалентны несольватированным формам и также входят в объем настоящего изобретения. Некоторые соединения согласно настоящему изобретению могут существовать в нескольких кристаллических или аморфных формах. В общем случае, все физические формы являются эквивалентными для применения согласно настоящему изобретению, при этом настоящее изобретение включает каждую из таких форм. Некоторые соединения согласно настоящему изобретению содержат асимметричные атомы углерода (оптические центры) или двойные связи, при этом настоящее изобретение включает энантиомеры,рацематы, диастереомеры, таутомеры, геометрические изомеры, стереоизомерные формы, возможные с точки зрения абсолютной стереохимии, такие как (R)- или (S)-, или (D)- или (L)-формы в случае аминокислот, а также индивидуальные изомеры. Соединения согласно настоящему изобретению не включают соединения, которые, как известно в данной области техники, являются слишком нестабильными для их получения и/или выделения. Подразумевается, что настоящее изобретение включает соединения в рацемически и оптически чистых формах. Оптически активные (R)- и (S)- или (D)- и (L)-изомеры могут быть получены с использованием хиральных синтонов или хиральных реагентов или выделены с помощью традиционных способов. В случае, когда соединения согласно настоящему изобретению содержат олефиновые связи или другие центры геометрической асимметрии, и, если не указано иное, подразумевается, что предложенные соединения содержат как Е-, так и Z-геометрические изомеры. Используемый в настоящем описании термин "таутомер" относится к одному или нескольким структурным изомерам, находящимся в равновесии, которые легко переходят из одной изомерной формы в другую. Для специалиста в данной области техники очевидно, что некоторые соединения согласно настоящему изобретению могут существовать в виде таутомерных форм, при этом каждая из таких таутомерных форм входит в объем настоящего изобретения. Если не указано иное, представленные в настоящем описании структуры также включают все стереохимические формы указанных структур, т.е. R- и S-конфигурации для каждого центра асимметрии. Таким образом, настоящее изобретение включает отдельные стереохимические изомеры, а также смеси энантиомеров и диастереомеров соединений согласно изобретению. Если не указано иное, подразумевается, что представленные в настоящем описании структуры также включают соединения, отличающиеся лишь наличием одного или нескольких изотопных атомов. Например, настоящее изобретение включает соединения, отвечающие предложенным структурам, за исключением того, что один из атомов водорода в них заменен на дейтерий или тритий, или атом углерода заменен на 13 С- или 14 С-обогащенный углерод. Соединения согласно настоящему изобретению также могут содержать изотопы одного или нескольких атомов, входящих в состав соединения, в нехарактерных соотношениях. Например, указанные-5 016527 соединения могут быть помечены радиоактивными изотопами, такими как, например, тритий (3 Н), йод 125 (125I) или углерод-14 (14 С). Все изотопные формы соединений согласно настоящему изобретению как радиоактивные, так и не являющиеся радиоактивными входят в объем настоящего изобретения. Подразумевается, что термин "фармацевтически приемлемые соли" включает соли активных соединений, полученные с применением сравнительно нетоксичных кислот или оснований, выбор которых зависит от конкретных заместителей в составе соединения согласно изобретению. В случае, когда соединения согласно настоящему изобретению содержат функциональные группы, обладающие сравнительно кислотными свойствами, могут быть получены соли присоединения оснований путем приведения нейтральных форм указанных соединений в контакт с достаточным количеством требуемого основания, в чистом виде или в подходящем инертном растворителе. Примеры фармацевтически приемлемых солей присоединения оснований включают натриевые, калиевые, кальциевые, аммониевые соли, соли органических аминов, или магниевые соли, или другие подобные соли. В случае, когда соединения согласно настоящему изобретению содержат сравнительно основные функциональные группы, могут быть получены соли присоединения кислот путем приведения таких соединений, находящихся в нейтральной форме, в контакт с достаточным количеством требуемой кислоты, в чистом виде или в подходящем инертном растворителе. Примеры фармацевтически приемлемых солей присоединения кислот включают соли неорганических кислот, таких как соляная, бромисто-водородная, азотная, угольная, одноосновная угольная, фосфорная, одноосновная фосфорная, двухосновная фосфорная, серная, одноосновная серная, йодистоводородная или фосфорная кислоты и др., а также соли нетоксичных органических кислот, таких как уксусная, пропионовая, изомасляная, малеиновая, малоновая, бензойная, янтарная, пробковая, фумаровая, молочная, миндальная, фталевая, бензосульфокислота, п-толилсульфокислота, лимонная, винная кислоты, метансульфокислота и др. Настоящее изобретение также включает соли аминокислот, такие как аргинаты и др. и соли органических кислот, таких как глюкуроновой или галактуроновой кислот, и др.(см., например, Berge et al., "Pharmaceutical Salts", Journal of Pharmaceutical Science, 1977, 66, 1-19). Некоторые конкретные соединения согласно настоящему изобретению содержат как кислотные, так и основные функциональные группы, что обеспечивает возможность превращения указанных соединений либо в соли присоединения оснований, либо в соли присоединения кислот. Помимо солевых форм, настоящее изобретение также относится к соединениям, представляющим собой пролекарственные формы. Пролекарства соединений согласно настоящему изобретению представляют собой соединения, которые в организме легко подвергаются химическим превращениям с образованием соединений согласно настоящему изобретению. Кроме того, пролекарства могут быть подвергнуты превращению в соединения согласно настоящему изобретению с помощью химических или биохимических способов ех vivo. Например, постепенное превращение пролекарств в соединения согласно настоящему изобретению может обеспечиваться при помещении указанных пролекарств в емкость трансдермального пластыря совместно с подходящим ферментом или химическим реагентом. Формы единственного числа, используемые в настоящем описании по отношению к группам, выступающим в качестве заместителей, означают "по меньшей мере один". Например, в случае, когда соединение содержит в качестве заместителя алкил или арил, указанное соединение может содержать в качестве заместителя по меньшей мере один алкил и/или по меньшей мере один арил. Кроме того, в случае, когда фрагмент содержит заместитель R, указанная группа может быть охарактеризована как "Rзамещенная". В случае, когда фрагмент является R-замещенным, указанный фрагмент содержит в качестве заместителей по меньшей мере один заместитель R, при этом каждый из заместителей R может быть различным. Описание соединений согласно настоящему изобретению ограничено принципами образования химических связей, которые хорошо известны специалисту в данной области техники. Соответственно в случае, когда группа может содержать один или несколько заместителей, указанные заместители выбирают в соответствии с принципами образования химических связей таким образом, чтобы полученное соединение не являлось нестабильным и/или не рассматривалось специалистом в данной области техники в качестве предположительно нестабильного в условиях окружающей среды, например в водной среде, нейтральной среде или в организме. Термин "лечение", употребляемый по отношению к конкретному заболеванию, включает предотвращение указанного заболевания. Триазолопиридазиновые модуляторы протеинкиназ. Согласно настоящему изобретению предложены триазолопиридазиновые модуляторы протеинкиназ указанных выше структур. Согласно другому аспекту в настоящем изобретении предложено применение указанных соединений для получения лекарственного средства для лечения рака молочной железы, рака легкого, меланомы, рака толстой кишки, рака мочевого пузыря, рака яичников, рака предстательной железы, рака почки, плоскоклеточного рака, глиобластомы, рака поджелудочной железы, лейомиосаркомы, множественной миеломы, папиллярного почечно-клеточного рака, рака желудка, рака печени, рака головы и шеи, меланомы или лейкемии (например, миелоидной лейкемии, хронической миелоидной лейкемии, острой лимфобластной лейкемии, хронической лимфобластной лейкемии, болезни Ходжкина и других видов лейкемии и/или рака крови).-6 016527 Согласно другому аспекту в настоящем изобретении предложено соединение для лечения заболевания, опосредуемого активностью киназы. Согласно другому аспекту в настоящем изобретении предложена фармацевтическая композиция,содержащая это соединение в фармацевтически приемлемом наполнителе. Согласно настоящему изобретению указанная протеинкиназа представляет собой рецепторную тирозинкиназу Ron, рецепторную тирозинкиназу Met, рецепторную тирозинкиназу ALK, рецепторную тирозинкиназу MER, рецепторную тирозинкиназу Tyro3/Sky, рецепторную тирозинкиназу AXL, рецепторную тирозинкиназу TRKC, рецепторную тирозинкиназу ROS, рецепторную тирозинкиназу CSF1R/FMS,BRAF-киназу или Raf1-киназу. Согласно другому аспекту в настоящем изобретении предложены фармацевтические композиции,содержащие любое из предложенных соединений и фармацевтически приемлемый наполнитель. Способы ингибирования киназ. Соединения настоящего изобретения, а именно триазолопиридазиновые модуляторы киназ, способны модулировать активности протеинкиназ, т.е. активность протеинкиназы при контактировании с триазолопиридазиновым модулятором киназ согласно настоящему изобретению повышается или понижается по сравнению с активностью указанной протеинкиназы в отсутствие указанного триазолопиридазинового модулятора киназ. Таким образом, в настоящем изобретении раскрываются соединения, модулирующие активности протеинкиназы путем приведения указанной протеинкиназы в контакт с триазолопиридазиновым модулятором киназы согласно изобретению. Согласно одному из примеров реализации настоящего изобретения указанный триазолопиридазиновый модулятор киназы ингибирует киназную активность. Термин "ингибировать", используемый в настоящем описании применительно к киназной активности, означает, что указанная киназная активность снижается при контактировании с триазолопиридазиновым модулятором киназы по сравнению с указанной активностью в отсутствие указанного триазолопиридазинового модулятора киназы. Таким образом, настоящее изобретение также относится к способу ингибирования активности протеинкиназы путем приведения указанной протеинкиназы в контакт с триазолопиридазиновым модулятором киназы согласно изобретению. Согласно некоторым вариантам реализации указанная протеинкиназа представляет собой протеинтирозинкиназу. Используемый в настоящем описании термин "протеинтирозинкиназа" относится к ферменту, катализирующему фосфорилирование тирозиновых остатков в белках, содержащих фосфатные доноры (например, нуклеотидный фосфатный донор, такой как АТФ). Протеинтирозинкиназы включают,например, тирозинкиназы Абельсона ("Abl") (например, с-Abl и v-Abl), рецепторные тирозинкиназы Ron("RON"), рецепторные тирозинкиназы Met ("MET"), Fms-подобные тирозинкиназы ("FLT") (например,FLT3), тирозинкиназы семейства src (например, lyn, CSK) и р 21-активируемая киназа-4 ("PAK"), FLT3,аврора-А киназы, В-лимфоидные тирозинкиназы ("Blk"), циклинзависимые киназы ("CDK") (например,CDK1 и CDK5), протеинтирозинкиназы, родственные киназам семейства src (например, киназа Fyn),гликогенсинтазные киназы ("GSK") (например, GSK3 и GSK3), лимфоцитарные протеинтирозинкиназы ("Lck"), рибосомальные киназы S6 (например, Rsk1, Rsk2 и Rsk3), сперматогенные тирозинкиназы(например, Yes) и подтипы и гомологи указанных киназ, проявляющие тирозинкиназную активность. Согласно некоторым вариантам реализации указанная протеинкиназа представляет собой рецепторную тирозинкиназу Met. Согласно другому варианту реализации указанная киназа представляет собой мутантную киназу,такую как мутант МЕТ. Подходящие киназы, представляющие собой мутанты МЕТ, включают, например, киназы МЕТ, содержащие мутации, включая вставки и делеции во внешнеклеточных или трансмембранных доменах, или в цитоплазматическом домене, включая одну или несколько из следующих мутаций: Ser1058Pro, Val1110Ile, His1112Tyr, His1124Asp, Met1149Thr, Val1206Leu или Met1268Thr. Киназы MET включают, например, киназы MET, содержащие мутации, включая вставки и делеции во внешнеклеточных или трансмембранных доменах, или в цитоплазматическом домене, включая одну или несколько из следующих мутаций: Ser1058Pro, Val1110Ile, His1112Tyr, His1124Asp, Met1149Thr,Val1206Leu или Met1268Thr. Согласно некоторым вариантам реализации указанная киназа является гомологом известной киназы(такие киназы в настоящем описании также обозначают как "гомологичные киназы"). Соединения и композиции, подходящие для ингибирования биологической активности гомологичных киназ, первоначально могут подвергаться исследованию путем, например, исследования связывания. Гомологичные ферменты содержат последовательность аминокислот той же длины, идентичную по меньшей мере на 50%,по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80% или по меньшей мере на 90% последовательности аминокислот в известной полноразмерной киназе, или указанные ферменты на 70, 80 или 90% гомологичны активным доменам указанной известной киназы. Наличие гомологичности может быть установлено с помощью, например, исследования PSI BLAST, такого как, без ограничения,исследование, предложенное в Altschul, et al., Nuc. Acids Rec. 25:3389-3402 (1997). Согласно некоторым вариантам реализации в ходе указанных исследований по меньшей мере на 50% или по меньшей мере на 70% указанная последовательность является линейной. Другие инструменты для обеспечения указанной-7 016527 линейности включают, например, DbClustal и ESPript, которые могут применяться для создания PostScript версии указанной линейной последовательности; см., например, Thompson et al., Nucleic Acids Research, 28:2919-26, 2000; Gouet, et al., Bioinformatics, 15:305-08 (1999). Значение BLAST E-value гомологов может составлять, например, 110-6 на по меньшей мере 100 аминокислот (Altschul et al., Nucleic Acids Res., 25:3389-402 (1997) в случае FLT3, Abl или других известных киназ или любых функциональных доменов FLT3, Abl или других известных киназ. Гомологичность также может быть установлена путем сравнения кармана активного сайта связывания фермента с карманами активного сайта связывания известной киназы. Например, у гомологичных ферментов по меньшей мере 50, 60, 70, 80 или 90% аминокислот в молекуле или гомологе имеют структурные координаты домена аминокислоты, сопоставимые по размеру с доменом киназы, при этом среднеквадратичное отклонение для альфа-атомов углерода составляет примерно до 1,5 , примерно до 1,25, примерно до 1 , примерно до 0,75 , примерно до 0,5 и/или примерно до 0,25 . Соединения и композиции согласно настоящему изобретению подходят для ингибирования киназной активности, а также для ингибирования других ферментов, связывающих АТФ. Указанные соединения и композиции также подходят для лечения заболеваний и нарушений, облегчение которых может быть достигнуто путем ингибирования такой активности в отношении связывания АТФ. Способы установления таких АТФ-связывающих ферментов включают способы, известные специалисту в данной области техники, включая способы, обсуждаемые в настоящем описании в связи с выбором гомологичных ферментов. Установление указанных ферментов может также осуществляться с применением базы данных PROSITE, в которой ферменты могут быть идентифицированы по характеристическим признакам,изображениям последовательностей, мотивам или профилям семейств белков или доменов. Соединения и производные соединений согласно настоящему изобретению также могут применяться в качестве связывающих киназы агентов. Указанные соединения и их производные, выступая в роли связывающих агентов, могут быть связаны со стабильными смолами и применяться в качестве связывающих субстратов в аффинной хроматографии. Соединения и производные соединений согласно настоящему изобретению также могут подвергаться модификациям (например, могут быть меченными радиоактивным изотопом или подвергнуты аффинному мечению и т.д.) с целью их применения в исследованиях характеристик, структуры и/или функций ферментов или полипептидов. Согласно одному из вариантов реализации триазолопиридазиновые модуляторы киназ согласно изобретению представляют собой ингибиторы киназ. Согласно некоторым вариантам реализации предложенные ингибиторы киназ характеризуются константой ингибирования IC50 или Ki менее 1 мкмоль. Согласно другому варианту реализации ингибитор киназы характеризуется константой ингибированияIC50 или Ki менее 500 мкмоль. Согласно еще одному варианту реализации ингибитор киназы характеризуется константой ингибирования IC50 или Ki менее 10 мкмоль. Согласно другому варианту реализации ингибитор киназы характеризуется константой ингибирования IC50 или Ki менее 1 мкмоль. Согласно следующему варианту реализации ингибитор киназы характеризуется константой ингибирования IC50 или Ki менее 500 нмоль. Согласно другому варианту реализации ингибитор киназы характеризуется константой ингибирования IC50 или Ki менее 10 нмоль. Согласно еще одному варианту реализации ингибитор киназы характеризуется константой ингибирования IC50 или Ki менее 1 нмоль. Способы применения. Согласно другому аспекту настоящее изобретение относится к применению соединений согласно изобретению для лечения заболеваний, опосредуемых киназной активностью (опосредуемых киназами заболеваний или нарушений), в организме (например, у млекопитающих, таких как люди). Под "опосредуемыми киназами" или "связанными с киназами" заболеваниями понимают заболевания, при которых облегчение заболевания или симптомов может достигаться путем ингибирования киназной активности(например, заболеваний, при которых киназы участвуют в передаче сигнала, опосредовании, модулировании или регуляции процесса заболевания). Под "заболеваниями" подразумевают как сами заболевания,так и симптомы заболеваний. Примеры заболеваний, опосредуемых киназами, включают рак молочной железы, рак легкого, меланому, рак толстой кишки, рак мочевого пузыря, рак яичников, рак предстательной железы, рак почки,плоскоклеточный рак, глиобластому, рак поджелудочной железы, лейомиосаркому, множественную миелому, папиллярный почечно-клеточный рак, рак желудка, рак печени, рак головы и шеи, меланому или лейкемию (например, миелоидную лейкемию, хроническую миелоидную лейкемию, острую лимфобластную лейкемию, хроническую лимфобластную лейкемию, болезнь Ходжкина и другие виды лейкемии и/или рака крови). Конкретные примеры раковых заболеваний, поддающихся лечению соединениями согласно настоящему изобретению, включают рак молочной железы, рак легкого, меланому, рак толстой кишки, рак мочевого пузыря, рак яичников, рак предстательной железы, рак почки, плоскоклеточный рак, глиобластому, рак поджелудочной железы, лейомиосаркому, множественную миелому, папиллярный почечно-клеточный рак, рак желудка, рак печени, рак головы и шеи, меланому или лейкемию(например, миелоидную лейкемию, хроническую миелоидную лейкемию, острую лимфобластную лейкемию, хроническую лимфобластную лейкемию, болезнь Ходжкина и другие виды лейкемии и рака крови).-8 016527 Комбинированная терапия. Согласно настоящему изобретению предложенные триазолопиридазиновые модуляторы киназ могут использоваться в комбинированной терапии для лечения или замедления развития нарушения пролиферации клеток или нарушения, связанного с c-Met, у субъекта. Комбинированная терапия включает введение субъекту терапевтически или профилактически эффективного количества соединения формулыI и одного или нескольких других видов терапии, направленных против пролиферации клеток, включая химиотерапию, лучевую терапию, генную терапию и иммунотерапию. Согласно другому аспекту введение соединений согласно изобретению можно комбинировать с химиотерапией. Согласно настоящему описанию "химиотерапия" относится к терапии, включающей применение химиотерапевтических агентов. Предложенные в настоящем изобретении комбинированные способы лечения можно осуществлять с применением различных химиотерапевтических агентов. Примеры химиотерапевтических агентов включают, но не ограничиваются ими, соединения платины (например, цисплатин, карбоплатин, оксалиплатин); соединения таксанов (например, паклитаксел, доцетаксол); соединения камптотецинов (иринотекан, топотекан); алкалоиды барвинка (например, винкристин,винбластин, винорелбин); противоопухолевые производные нуклеозидов (например, 5-фторурацил, леуковорин, гемцитабин, капецитабин); алкилирующие агенты (например, циклофосфамид, кармустин,ломустин, тиотепа); эпиподофиллотоксины/подофиллотоксины (например, этопозид, тенипозид); ингибиторы ароматазы (например, анастрозол, летрозол, экземестан); противоэстрогенные соединения (например, тамоксифен, фулвестрант); антифолиаты (например, пеметрексед динатрия); гипометилирующие агенты (например, азацитидин); биологические препараты (например, гемтузамаб, цетуксимаб, ритуксимаб, пертузумаб, трастузумаб, бевацизумаб, эрлотиниб); антибиотики/антрациклины (например, идарубицин, актиномицин D, блеомицин, даунорубицин, доксорубицин, митомицин С, дактиномицин, карминомицин, дауномицин); антиметаболиты (например, клофарабин, аминоптерин, цитозинарабинозид, метотрексат); тубулинсвязывающие агенты (например, комбретастатин, колхицин, нокодазол); ингибиторы топоизомеразы (например, камптотецин); различные агенты (например, ретиноиды, витамин D и ретиноевая кислота); агенты, блокирующие метаболизм ретиноевой кислоты (RAMBA) (например, аккутан); ингибиторы киназ (например, флавоперидол, иматиниба мезилат, гефитиниб, эрлотиниб, сунитиниб, лапатиниб, сорафиниб, темциролимус, дазатиниб); ингибиторы фарнезилтрансферазы (например, типифарниб); ингибиторы гистондеацетилазы; ингибиторы убиквитин-протеазомных путей (например, бортезомиб, йонделиз). Другие подходящие агенты включают верапамил, представляющий собой кальциевый антагонист,который, как было установлено, подходит для применения в сочетании с противоопухолевыми агентами для обеспечения хемочувствительности клеток опухоли, резистентных к действию традиционных химиотерапевтических агентов, а также для усиления действия указанных соединений на злокачественные опухоли, поддающиеся медикаментозному лечению, см. Simpson W.G., The calcium channel blocker verapamiland cancer chemotherapy, Cell Calcium., December 1985; 6(6):449-67. Кроме того, еще не появившиеся химиотерапевтические агенты также рассматриваются в качестве подходящих для применения в комбинации с соединениями согласно изобретению. Согласно другому аспекту в настоящем изобретении предложены соединения, введение которых можно комбинировать с проведением лучевой терапии. Согласно настоящему описанию "лучевая терапия" относится к терапии, включающей воздействие на субъекта, который в этом нуждается, радиации. Указанная терапия известна специалистам в данной области техники. Подходящая схема проведения лучевой терапии очевидна для специалиста, имеющего опыт проведения такого вида терапии в клинических условиях, при этом лучевая терапия может применяться в отдельности или в сочетании с другими химиотерапевтическими препаратами. Согласно следующему аспекту в настоящем изобретении предложены соединения, введение которых можно комбинировать с проведением генной терапии, согласно настоящему описанию "генная терапия" относится к терапии, направленной на конкретные гены, участвующие в развитии опухоли. Возможные стратегии проведения генной терапии включают восстановление поврежденных генов, ответственных за подавление развития рака, трансдукцию клеток или трансфекцию с применением антисмысловой ДНК, соответствующей генам, кодирующим факторы роста и рецепторы факторов роста; стратегии на основе РНК, таких как рибозимы, РНК-ловушек, антисмысловых матричных РНК и молекул малых интерферирующих РНК (siPHK), а также так называемых "генов-убийц". Согласно другому аспекту в настоящем изобретении предложены соединения, введение которых можно комбинировать с проведением иммунотерапии. Согласно настоящему описанию "иммунотерапия" относится к терапии, предусматривающей направленное воздействие на конкретные белки, участвующие в развитии опухоли, через антитела, специфичные к указанным белкам. Например, для лечения различных видов рака использовали моноклональные антитела против эндотелиального фактора роста сосудов. При добавлении к соединению согласно изобретению второго фармацевтического агента указанные два фармацевтических агента можно вводить одновременно (например, в составе разных композиций или в составе одной композиции), последовательно в любом порядке, примерно в одно и то же время или-9 016527 в соответствии с раздельными схемами дозирования. В последнем случае указанные два соединения вводят на протяжении такого периода времени, в таком количестве и таким образом, чтобы обеспечить преимущество или наличие синергического эффекта. Очевидно, что предпочтительный способ и очередность введения, а также соответствующие дозированные количества и схемы введения для каждого из компонентов комбинации зависят от конкретного химиотерапевтического агента, вводимого совместно с соединением согласно настоящему изобретению, путей поступления указанных компонентов в организм,конкретной опухоли, подвергаемой лечению, и конкретного субъекта, подвергаемого лечению. Для специалиста в данной области техники очевидно, что подходящие дозы химиотерапевтических агентов в общем случае аналогичны или меньше доз, применяемых в настоящее время для лечения в клинических условиях, где химиотерапевтические агенты вводят по отдельности или в сочетании с другими химиотерапевтическими агентами. Оптимальный способ и очередность введения, а также дозированные количества и схема введения могут быть легко установлены специалистом в данной области техники с помощью традиционных способов с учетом информации, приведенной в настоящем описании. Только в качестве примера соединения платины преимущественно вводят в дозировке от 1 до 500 мг на квадратный метр площади поверхности тела (мг/м 2), например от 50 до 400 мг/м 2, в частности, для цисплатина в дозировке примерно 75 мг/м 2, а для карбоплатина в дозировке примерно 300 мг/м 2 на один курс лечения. Цисплатин при пероральном введении не абсорбируется, поэтому его доставка должна осуществляться путем внутривенной, подкожной, внутриопухолевой или внутрибрюшинной инъекции. Только в качестве примера соединения таксана преимущественно вводят в дозировке от 50 до 400 мг на квадратный метр площади поверхности тела (мг/м 2), например от 75 до 250 мг/м 2, в частности, для паклитакселя в дозировке примерно от 175 до 250 мг/м 2, а для доцетакселя в дозировке примерно от 75 до 150 мг/м 2 на один курс лечения. Только в качестве примера соединения камптотецина преимущественно вводят в дозировке от 0,1 до 400 мг на квадратный метр площади поверхности тела (мг/м 2), например от 1 до 300 мг/м 2, в частности, для иринотекана в дозировке примерно от 100 до 350 мг/м 2, а для топотекана в дозировке примерно от 1 до 2 мг/м 2 на один курс лечения. Только в качестве примера алкалоиды барвинка преимущественно вводят в дозировке от 2 до 30 мг на квадратный метр площади поверхности тела (мг/м 2), в частности для винбластина в дозировке примерно от 3 до 12 мг/м 2, для винкристина в дозировке примерно от 1 до 2 мг/м 2, а для винорельбина в дозировке примерно от 10 до 30 мг/м 2 на один курс лечения. Только в качестве примера противоопухолевые производные нуклеозидов можно преимущественно вводить в дозировке от 200 до 2500 мг на квадратный метр площади поверхности тела (мг/м 2), например от 700 до 1500 мг/м 2. 5-Фторурацил (5-ФУ, 5-FU) широко применяют при внутривенном введении в дозировке в пределах от 200 до 500 мг/м 2 (предпочтительно от 3 до 15 мг/кг/сутки). Гемцитабин преимущественно вводят в дозировке примерно от 800 до 1200 мг/м 2, а капецитабин в дозировке примерно от 1000 до 2500 мг/м 2 на один курс лечения. Только в качестве примера алкилирующие агенты можно преимущественно вводить в дозировке от 100 до 500 мг на квадратный метр площади поверхности тела (мг/м 2), например от 120 до 200 мг/м 2, в частности, для циклофосфамида в дозировке примерно от 100 до 500 мг/м 2, для хлорамбуцила в дозировке примерно от 0,1 до 0,2 мг/кг массы тела, для кармустина в дозировке примерно от 150 до 200 мг/м 2, а для ломустина в дозировке примерно от 100 до 150 мг/м 2 на один курс лечения. Только в качестве примера производные подофиллотоксинов преимущественно вводят в дозировке от 30 до 300 мг на квадратный метр площади поверхности тела (мг/м 2), например от 50 до 250 мг/м 2, в частности, для этопозида в дозировке примерно от 35 до 100 мг/м 2, а для тенипозида в дозировке примерно от 50 до 250 мг/м 2 на один курс лечения. Только в качестве примера производные антрациклинов преимущественно вводят в дозировке от 10 до 75 мг на квадратный метр площади поверхности тела (мг/м 2), например от 15 до 60 мг/м 2, в частности,для доксорубицина в дозировке примерно от 40 до 75 мг/м 2, для даунорубицина в дозировке примерно от 25 до 45 мг/м 2, а для идарубицина в дозировке примерно от 10 до 15 мг/м 2 на один курс лечения. Только в качестве примера соединения антиэстрогенов преимущественно можно вводить в дозировке от 1 до 100 мг в сутки в зависимости от конкретного агента и состояния, подвергаемого лечению. Тамоксифен преимущественно вводят перорально в дозировке от 5 до 50 мг, предпочтительно от 10 до 20 мг дважды в сутки, при этом лечение проводят непрерывно в течение периода времени, достаточного для достижения терапевтического эффекта. Торемифен преимущественно вводят перорально в дозировке примерно 60 мг один раз в сутки, при этом лечение проводят непрерывно в течение периода времени,достаточного для достижения терапевтического эффекта. Анастрозол преимущественно вводят перорально в дозировке примерно 1 мг один раз в сутки. Дролоксифен преимущественно вводят перорально в дозировке примерно 20-100 мг один раз в сутки. Ралоксифен преимущественно вводят перорально в дозировке примерно 60 мг один раз в сутки. Экземестан преимущественно вводят перорально в дозировке примерно 25 мг один раз в сутки. Только в качестве примера биопрепараты преимущественно вводят в дозировке от 1 до 5 мг на- 10016527 квадратный метр площади поверхности тела (мг/м 2) или в соответствии с дозировками, известными в данной области техники, если такие дозировки отличны от указанной. Например, трастузумаб преимущественно вводят в дозировке от 1 до 5 мг/м 2, в частности от 2 до 4 мг/м 2 на один курс лечения. Дозированные количества можно вводить, например, за один раз, за два или более раз в течение одного курса лечения, при этом указанные курсы лечения могут повторяться, например, каждые 7, 14, 21 или 28 дней. Соединения согласно изобретению можно вводить субъекту системно, например внутривенно, перорально, подкожно, через слизистые оболочки, внутримышечно, интрадермально или парентерально. Соединения согласно изобретению также подходят для местного введения субъекту. Неограничивающие примеры местных систем доставки включают применение внутрипросветных медицинских устройств,которые включают катетеры для внутрисосудистой доставки лекарственного препарата, провода, фармакологические стенты и внутрипросветные покрытия. Соединения согласно настоящему изобретению также можно вводить субъекту в комбинации с направляющими агентами для обеспечения высокой локальной концентрации соединения в заданном месте. Кроме того, соединения согласно настоящему изобретению могут быть введены в состав таким образом, чтобы обеспечить быстрое или замедленное высвобождение указанного соединения с целью поддержания указанных лекарственных препаратов или агентов в контакте с целевыми тканями в течение периода времени, составляющего от нескольких часов до нескольких недель. Фармацевтические составы и пути введения. Согласно другому аспекту настоящее изобретение относится к фармацевтическим композициям,содержащим триазолопиридазиновые модуляторы киназ в смеси с фармацевтически приемлемым наполнителем. Для специалиста в данной области техники очевидно, что указанные фармацевтические композиции включают фармацевтически приемлемые соли триазолопиридазиновых модуляторов киназ, определенные выше. Для применения в терапевтических и/или диагностических целях соединения согласно настоящему изобретению могут быть введены в состав, подходящий для широкого диапазона способов введения,включая системное и местное или локальное введение. В общем случае, методики и составы могут быть найдены в Remington: The Science and Practice of Pharmacy (20th ed.) Lippincott, WilliamsWilkins (2000). Согласно другому аспекту настоящее изобретение относится к фармацевтическим композициям,содержащим соединение формулы I и фармацевтически приемлемый носитель, вспомогательное вещество или наполнитель. Содержание соединения в композициях согласно изобретению является достаточным для обеспечения заметного ингибирования протеинкиназ, в частности c-Met, в пробе биологического материала или у пациента. Согласно настоящему описанию термин "c-Met" является синонимом терминов "cMet", "MET","Met" или других обозначений, известных специалисту в данной области техники. Согласно одному из аспектов состав композиции согласно изобретению выбирают таким образом, чтобы указанная композиция подходила для введения пациенту, нуждающемуся во введении такой композиции. Согласно другому аспекту состав композиции согласно изобретению выбирают таким образом, чтобы указанная композиция подходила для перорального введения пациенту. Соединения согласно изобретению эффективны в широком диапазоне дозировок. Например, для лечения взрослых людей могут применяться дозировки от 0,01 до 10000 мг, от 0,5 до 1000 мг, от 1 до 500 мг в сутки и от 5 до 100 мг в сутки. Точные дозировки зависят от пути поступления соединения в организм, формы, в которой вводят соединение согласно изобретению, подвергаемого лечению субъекта,массы тела подвергаемого лечению субъекта и предпочтений, и опыта лечащего врача. Фармацевтически приемлемые соли в целом хорошо известны специалисту в данной области техники и могут включать, например, но без ограничения, ацетаты, бензолсульфонаты, безилаты, бензоаты,бикарбонаты, битартраты, бромиды, кальцийэдетаты, камсилаты, карбонаты, цитраты, эдетаты, эдизилаты, эстолаты, эзилаты, фумараты, глюцептаты, глюконаты, глутаматы, гликолиларзанилаты, гексилрезорцинаты, гидрабамины, гидробромиды, гидрохлориды, гидроксинафтаты, йодиды, изетионаты, лактаты, лактобионаты, малаты, малеаты, манделаты, мезилаты, мукаты, напзилаты, нитраты, памоаты (эмбонаты), пантотенаты, фосфаты/дифосфаты, полигалактуронаты, салицилаты, стеараты, субацетаты, сукцинаты, сульфаты, таннаты, тартраты или теоклаты. Другие фармацевтически приемлемые соли могут быть найдены, например, в Remington: The Science and Practice of Pharmacy (20th ed.) Lippincott, WilliamsWilkins (2000). Предпочтительные фармацевтически приемлемые соли включают, например, ацетаты,бензоаты, бромиды, карбонаты, цитраты, глюконаты, гидробромиды, гидрохлориды, малеаты, мезилаты,напзилаты, памоаты (эмбонаты), фосфаты, салицилаты, сукцинаты, сульфаты или тартраты. В зависимости от конкретного состояния, подвергаемого лечению, указанные агенты могут быть получены в виде жидких или твердых дозированных форм и могут вводиться системно или местно. Доставка агентов может обеспечиваться с помощью форм, обеспечивающих ограниченное по времени или замедленное высвобождение, известных специалисту в данной области техники. Способы получения составов и способы введения могут быть найдены в Remington: The Science and Practice of Pharmacy (20th ed.) Lippincott, WilliamsWilkins (2000). Подходящие способы введения могут включать пе- 11016527 роральный, буккальный способы, применение подходящего для ингаляции спрея, сублингвальный,трансдермальный, вагинальный, трансмукозальный, назальный или внутрикишечный способы введения,парентеральную доставку, включая внутримышечный, подкожный способы доставки, внутримозговые инъекции, а также интратекальный, прямой внутрижелудочковый, внутривенный, внутрисуставной,внутригрудинный, интрасиновиальный, внутрипеченочный способы, доставку внутрь пораженных тканей, внутричерепной, внутрибрюшинный, интраназальный или внутриглазной либо другие способы доставки. Агенты согласно изобретению могут быть введены в состав, подходящий для инъекций, разбавленный водными растворами, такими как физиологически совместимые буферные растворы, например раствор Хенкса, раствор Рингера или физиологический буферный раствор. В составах, предназначенных для введения через слизистые оболочки, используют подходящие агенты, обеспечивающие прохождение агента через соответствующую границу. Такие обеспечивающие прохождение агенты (пенетранты) в целом хорошо известны в данной области техники. Настоящее изобретение также включает применение фармацевтически приемлемых носителей для получения составов на основе соединений согласно изобретению, подходящих для системного введения. При надлежащем выборе носителя и подходящем проведении процесса изготовления композиции согласно изобретению, в частности композиции, полученные в виде растворов, подходят для парентерального введения, например, путем внутривенной инъекции. Указанные соединения с применением фармацевтически приемлемых носителей, хорошо известных в данной области техники, могут быть легко введены в составы в дозировках, подходящих для перорального введения. Такие носители позволяют получать лекарственные формы на основе соединений согласно изобретению, такие как таблетки, пилюли,капсулы, жидкие лекарственные формы, гели, сиропы, суспензии и др., подходящие для перорального введения пациенту, подвергаемому лечению. Агенты согласно изобретению могут быть введены в составы, подходящие для назального или ингаляционного способов доставки, с помощью способов, известных специалисту в данной области техники, включая, например, но не ограничиваясь ими, солюбилизацию, разбавление или диспергирование веществ, таких как физиологический раствор, консервантов, таких как бензиловый спирт, веществ, способствующих абсобрции, и фторуглероды. Фармацевтические композиции, подходящие для применения согласно настоящему изобретению,включают композиции, содержащие эффективное количество активных ингредиентов, обеспечивающее достижение требуемого эффекта. Специалист в данной области техники может самостоятельно установить указанные эффективные количества, в частности, с учетом сведений, приведенных в настоящем описании. Помимо активных ингредиентов, указанные фармацевтические композиции могут содержать подходящие фармацевтически приемлемые носители, включая наполнители и вспомогательные вещества,которые облегчают получение лекарственных препаратов на основе активных соединений. Лекарственные препараты, подходящие для перорального введения, могут быть получены в форме таблеток, драже,капсул или растворов. Фармацевтические препараты для перорального применения могут быть получены путем объединения активных соединений с твердыми наполнителями, при этом полученная смесь может быть подвергнута размолу, и после добавления, когда это необходимо, дополнительных вспомогательных веществ из полученных гранул смеси получают таблетки или сердцевины драже. Подходящие наполнители включают, например, такие наполнители, как сахара, включая лактозу, сахарозу, маннит, сорбит; целлюлозу, например маисовый крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин,трагакантовую камедь,метилцеллюлозу,гидроксипропилметилцеллюлозу,натрийкарбоксиметилцеллюлозу (НКМЦ) и/или поливинилпирролидон (ПВП:повидон). В случае необходимости могут быть добавлены дезинтегрирующие агенты, такие как поперечно-сшитый поливинилпирролидон, агар, альгининовая кислота или соли указанных соединений, такие как альгинат натрия. Сердцевины драже покрывают подходящей оболочкой. Для этого можно применять, например,концентрированные растворы сахаров, которые могут содержать, например, гуммиарабик, тальк, поливинилпирролидон, гель на основе карбопола, полиэтиленгликоль (ПЭГ) и/или диоксид титана, растворы лаков и подходящие органические растворители или смеси растворителей. В таблетки или сердцевины драже можно добавлять красители и пигменты для идентификации или характеризации различных комбинаций доз активных соединений. Фармацевтические препараты, подходящие для перорального приема, включают плотные капсулы из желатина и мягкие капсулы, полученные из желатина с добавлением пластификаторов, таких как глицерин или сорбит. Плотные капсулы могут содержать активные ингредиенты в смеси с наполнителями,такими как лактоза, связующими, такими как крахмал, и/или смазывающими веществами, такими как тальк или стеарат магния, и, возможно, стабилизаторами. В составе мягких капсул активные соединения могут быть растворены или суспендированы в подходящих жидкостях, таких как жирные масла, жидкий парафин или жидкие полиэтиленгликоли (ПЭГ). Кроме того, могут быть добавлены стабилизаторы. В зависимости от конкретных условий, состояния, на устранение или предотвращение которого на- 12016527 правлено лечение, совместно с ингибиторами согласно настоящему изобретению можно вводить дополнительные терапевтические агенты, традиционно применяемые для лечения или предотвращения указанного состояния. Например, для лечения пролиферативных заболеваний и рака ингибиторы согласно изобретению можно комбинировать с химиотерапевтическими агентами или другими антипролиферативными агентами. Примеры известных химиотерапевтических агентов включают, но не ограничиваются ими, адриамицин, дексаметазон, винкристин, циклофосфамид, фторурацил, топотекан, таксол, интерфероны и производные платины. Другие примеры агентов, которые можно комбинировать с ингибиторами согласно изобретению,включают без ограничения противовоспалительные агенты, такие как кортикостероиды, блокаторы TNF,IL-1 RA, азатиоприн, циклофосфамид и сульфазалазин; иммуномодулирующие и иммуноподавляющие агенты, такие как циклоспорин, такролимус, рапамицин, микофенолят мофетила, интерфероны, кортикостероиды, циклофосфамид, азатиоприн и сульфазалазин; нейротропные факторы, такие как ингибиторы ацетилхолинэстеразы, ингибиторы МАО, интерфероны, противосудорожные агенты, блокаторы ионных каналов, рилузол и агенты для лечения болезни Паркинсона; агенты для лечения сердечно-сосудистых заболеваний, такие как бета-блокаторы, ингибиторы АСЕ, диуретики, нитраты, блокаторы кальциевых каналов и статины; агенты для лечения заболеваний печени, такие как кортикостероиды, противолейкемийные агенты и факторы роста; агенты для лечения диабета, такие как инсулин, аналоги инсулина, ингибиторы альфа-глюкозидазы, бигуаниды и агенты, повышающие чувствительность к инсулину; а также агенты для лечения нарушений, связанных с иммунодефицитом, такие как гамма-глобулин. Указанные дополнительные агенты можно вводить отдельно от композиций, содержащих ингибиторы, в качестве одного из компонентов многокомпонентной схемы введения. Альтернативным образом,указанные агенты могут входить в состав стандартной дозированной формы в смеси с указанными ингибиторами, образуя единую композицию. Представленные в качестве примеров варианты реализации изобретения не ограничивают объем настоящего изобретения и приведены для иллюстрации отдельных аспектов изобретения. Для специалиста в данной области техники очевидно, что возможны различные модификации настоящего изобретения в дополнение к указанным выше. Указанные возможные модификации также входят в объем настоящего изобретения. Кроме того, один или несколько признаков одного из вариантов реализации могут быть скомбинированы с одним или несколькими признаками другого варианта реализации, при этом результат указанного комбинирования также находится в рамках настоящего изобретения. Раздел "Триазолопиридазиновые модуляторы киназ" в равной степени применим как к способам лечения, так и к способам ингибирования киназной активности, приведенным в настоящем описании. Приведенные в настоящем описании ссылки доступны для среднего специалиста в данной области техники, при этом содержание указанных документов включено в настоящее описание во всей полноте и для любых целей посредством указанных ссылок, независимо от того, указано это отдельно или нет. Исследования. Способность соединений согласно настоящему изобретению модулировать протеинкиназы, связывать протеинкиназы и/или предотвращать рост или пролиферацию клеток может быть без труда установлена в ходе исследований. Ниже приведены некоторые из примеров подходящих исследований. Исследование ингибирования киназ и связывания. Ингибирование различных киназ может оцениваться по способам, известным специалисту в данной области техники, а также по способам, обсуждаемым в публикации Upstate KinaseProfiler Assay ProtocolsJune 2003. Например, при проведении исследований in vitro киназы обычно разбавляют до подходящей концентрации с образованием растворов киназ. К указанным растворам киназ добавляют киназный субстрат и донор фосфатов, такой как АТФ (АТР). Далее ожидают завершения переноса киназой фосфата к киназному субстрату с образованием фосфорилированного субстрата. Образование фосфорилированного субстрата может быть установлено непосредственно с помощью подходящих средств, таких как применение меченых атомов (например, [-32 Р-АТР]) или поддающихся обнаружению вторичных антител (например,ELISA). Альтернативным образом, образование фосфорилированного субстрата может быть установлено с помощью любых подходящих методов, таких как определение концентрации АТФ (например, с помощью системы для проведения исследований Kinase-Glo assay system (Promega. Идентификацию ингибиторов киназ проводят путем определения образования фосфорилированного субстрата в присутствии и в отсутствие исследуемого соединения (см. раздел "Примеры" ниже). Способность соединений согласно изобретению ингибировать киназы в клетках может также оцениваться с помощью способов, известных в данной области техники. Например, содержащие киназу клетки могут быть приведены в контакт с активирующим агентом (таким как фактор роста), который активирует указанную киназу. Количество фосфорилированного субстрата, образующегося в клетке в присутствии и в отсутствие исследуемого соединения, может быть определено путем разложения указанных клеток и установления наличия фосфорилированного субстрата с помощью подходящих спосо- 13016527 бов (например, ELISA). В случае, если количество фосфорилированного субстрата, образовавшегося в присутствии исследуемого соединения, меньше соответствующего количества субстрата, образовавшегося в отсутствие исследуемого соединения, то установлено ингибирование киназы. Более подробное обсуждение клеточных исследований киназ приведено ниже в разделе "Примеры". Для оценки связывания соединения с киназой можно применять любой из методов, известных специалисту в данной области техники. Например, можно применять набор для проведения испытаний, выпускаемый Discoverx (Fremont, CA), ED-Staurosporine NSIP Enzyme Binding Assay Kit (см. патент США 5643734). Исследование киназной активности можно также проводить согласно патенту США 6589950, выданному 8 июля 2003 года. Выбор подходящих ингибиторов киназ среди соединений согласно настоящему изобретению можно проводить с помощью исследования кристаллографических характеристик белка, как предложено,например, Antonysamy, et al. в международной публикации заявки WO 03087816 A1, содержание которой включено в настоящее описание во всей полноте посредством ссылки для любых целей. Соединения согласно настоящему изобретению могут быть подвергнуты скринингу с использованием вычислительной техники, при этом может быть наглядно продемонстрирована способность указанных соединений связывать и/или ингибировать различные киназы. Скрининг структуры с применением вычислительной техники может быть проведен для большого количества соединений согласно настоящему изобретению для определения способности указанных соединений связываться с киназами по различным сайтам. Указанные соединения можно применять в медицинских химических исследованиях в качестве мишеней для идентификации, например, потенциально важных с терапевтической точки зрения ингибиторов (Travis, Science, 262:1374, 1993). Трехмерные структуры таких соединений могут быть наложены на трехмерные структуры киназ или структуры активных сайтов или карманов связывания указанных киназ для оценки пространственной совместимости указанных структур и, таким образом, пространственной совместимости самих соединений и белка. В ходе такого скрининга о степени совместимости таких фрагментов или соединений с карманом связывания можно судить по комплементарной форме или энергии связей (Meng, et al., J. Comp. Chem., 13:505-24, 1992). Скрининг соединений согласно настоящему изобретению, связывающихся с киназами и/или модулирующих киназы (например, ингибирующих или активирующих киназы), в соответствии с настоящим изобретением в общем случае включает рассмотрение двух факторов. Прежде всего, указанные соединения должны быть способны, с точки зрения физики или пространственной структуры, образовывать ковалентные или нековалентные связи с киназами. Например, ковалентные взаимодействия могут быть важными для выявления необратимых или "суицидных" ингибиторов белков. Нековалентные молекулярные связи, важные с точки зрения связывания киназ с указанными соединениями, включают водородные связи, ионные взаимодействия, Ван-дер-Ваальсовы и гидрофобные взаимодействия. Далее, указанные соединения должны быть способны приобретать определенную конформацию и ориентацию по отношению к карману связывания, что обеспечивает возможность связывания указанных соединений с киназами. Хотя некоторые фрагменты соединений не участвуют непосредственно в образовании связей с киназами, такие части все равно оказывают влияние на общую конформацию молекулы и могут значительно влиять на активность соединения. Конформационные ограничения включают трехмерную структуру молекулы в целом и ориентацию химической группы или соединения по отношению к каждому из участков или одному из участков кармана связывания, или расстояние между функциональными группами в соединении, включая расстояние между несколькими химическими группами, непосредственно взаимодействующими с киназами. Для идентификации соединений, которые связываются с активными сайтами и/или карманами связывания, согласно настоящему изобретению можно использовать программы для расчета возможности присоединения молекул, такие как, например, DOCK или GOLD. Скрининг соединений можно проводить с точки зрения возможности связывания соединения более чем с одним карманом связывания в структуре белка или в отношении более одного набора координат для одного и того же белка с учетом различных возможных динамических конформаций молекулы белка. Определения соединений, которые наилучшим образом подходят для связывания с конкретным белком, можно затем проводить с помощью подсчета консенсусных последовательностей (Charifson, P.S. et al., J. Med. Chem., 42: 5100-9 (1999. Данные, полученные для более чем одной структуры молекулы белка, также могут быть подвергнуты обработке согласно способу, предложенному Klingler et al. в заявке на патент США, поданной 3 мая 2002 года, озаглавленной "Компьютерные системы и способы виртуального скрининга соединений". После проведения указанной компьютерной обработки данных соединения, обладающие наилучшими характеристиками, могут быть получены из библиотеки химических соединений или синтезированы и могут использоваться при проведении исследований связывания и исследований биологических свойств. Для оценки потенциального модулирующего действия химических соединений в отношении киназ или способности соединений связываться с киназами могут использоваться методы компьютерного моделирования. Если полученные с помощью компьютерного моделирования данные указывают на наличие прочной связи, то такая молекула далее может быть синтезирована и подвергнута исследованию в отношении способности указанной молекулы связываться с киназами и оказывать воздействие (ингиби- 14016527 рующее или активирующее) на активность киназ. Модулирование других соединений, способных связываться с киназами, может проводиться с применением компьютерных программ и включает последовательность этапов, на каждом из которых проводят скрининг и выбор химических групп или фрагментов с точки зрения способности указанных групп или фрагментов связываться с конкретными карманами связывания или другими участками молекул киназ. Данный процесс может начинаться с визуальной оценки, например, активного сайта, представленного на экране компьютера, на основании координат киназ. Выбранные фрагменты или химические группы далее можно помещать в различные положения молекулы в различных ориентациях внутри конкретного кармана связывания киназы (Blaney, J.M. and Dixon, J.S., Perspectives in Drug Discovery and Design, 1:301,1993). Соединение молекул или фрагментов также может проводиться в ручном режиме с использованием компьютерных программ, таких как Insight II (Accelrys, San Diego, CA) МОЕ (Chemical ComputingGroup, Inc., Montreal, Quebec, Canada) и SYBYL (Tripos, Inc., St. Louis, MO, 1992), с последующим проведением минимизации энергии молекул и/или динамики молекул под действием обычных силовых полей,известных в молекулярной механике, например, с помощью CHARMM (Brooks, et al., J. Comp. Chem. 4:187-217, 1983), AMBER (Weiner, et al., J. Am. Chem. Soc. 106: 765-84, 1984) и С 2 MMFF (Merck Molecular Force Field; Accelrys, San Diego, CA). Соединение молекул и фрагментов в более автоматизированном режиме может проводиться с помощью таких программ как DOCK (Kuntz et al., J. Mol. -Biol., 161:269-88,1982; DOCK доступен в Калифорнийском университете, Сан-Фрациско, Калифорния); AUTODOCKRarey, M., et al., J. Mol. Biol. 261: 470-89, 1996). При отборе соединений описанными выше способами эффективность, с которой эти соединения могут связывать киназы, можно исследовать и оптимизировать путем компьютерной оценки. Например,соединение, разработанное или отобранное для функционирования в качестве ингибитора киназ, возможно, занимает объем, не перекрывающийся с объемом, занятым остатками активного центра, если связан природный субстрат, однако для среднего специалиста в данной области очевидно, что существует некоторая гибкость, обеспечивающая перестройку основной цепи и боковых цепей. Кроме того, средний специалист может разработать соединения, которые могут задействовать перестройку белка после связывания, например, таким образом, что после связывания соответствие будет увеличиваться. Эффективный ингибитор киназы может демонстрировать сравнительно небольшую разницу в уровне энергии между связанным и свободным состояниями (т.е. он должен обладать низкой энергией деформации связывания и/или низким конформационным напряжением после связывания). Таким образом, наиболее эффективные ингибиторы киназ должны быть сконструированы таким образом, чтобы энергия деформации связывания не превышала 10 ккал/моль, не превышала 7 ккал/моль, не превышала 5 ккал/моль или не превышала 2 ккал/моль. Ингибиторы киназ могут взаимодействовать с белком в нескольких конформациях, близких по общей энергии связывания. В таких случаях за энергию деформации связывания принимают разницу между энергией свободного соединения и средней энергией конформаций, наблюдаемых при связывании ингибитора с ферментом. В данной области существуют специальные компьютерные программы для оценки энергии деформации соединения и электростатического взаимодействия. Примеры программ, предназначенных для этих целей, включают Gaussian 94, версия С (Frisch, Gaussian, Inc., Питтсбург, Пенсильвания, США 1995); AMBER, version 7. (Kollman, Университет Калифорнии в Сан-Франциско, США 2002);QUANTA/CHARMM (Accelrys, Inc., Сан-Диего, Калифорния, США 1995); Insight II/Discover (Accelrys,Inc., Сан-Диего, Калифорния, США 1995); Delphi (Accelrys, Inc., Сан-Диего, Калифорния, США 1995) и AMSOL (Университет Миннесоты) (Quantum Chemistry Program Exchange, Университет Индианы). Данные программы можно применять, например, на хорошо известных в данной области компьютеризированных рабочих платформах, таких как LINUX, SGI или Sun. Специалисту в данной области могут быть известны другие аппаратные системы и программные пакеты. Средний специалист в данной области сможет осуществить экспрессию белка киназы при помощи методов, известных в данной области, а также способов, раскрытых в настоящей заявке. Природные и мутантные полипептиды киназ, описанных в настоящей заявке, можно синтезировать, полностью или частично, химическими методами, хорошо известными в данной области (см., например, Creighton, Proteins: Structures and Molecular Principles, W.H. FreemanCo., NY, 1983). Для синтеза природных и мутантных полипептидов можно использовать систему экспрессии генов. Можно сконструировать векторы экспрессии, содержащие последовательность, кодирующую природный или мутантный полипептид и подходящие сигналы транскрипции/трансляции, известные специалистам в данной области. Эти методы включают in vitro технологии рекомбинантных ДНК и рекомбинацию/рекомбинацию генов. Описание таких технологий можно найти, например, в Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, NY, 2001 и Ausubel et al., Current Protocols in Molecular Biology, Greene Publishing Associates and Wiley Interscience, NY, 1989.- 15016527 Для экспрессии киназ можно использовать системы хозяин-вектор экспрессии. Такие системы включают, без ограничения, микроорганизмы, такие как бактерии, трансформированные векторами экспрессии на основе ДНК рекомбинантного бактериофага, плазмидной ДНК или космидной ДНК, содержащими кодирующую последовательность; дрожжи, трансформированные рекомбинантными дрожжевыми векторами, содержащими кодирующую последовательность; системы клеток насекомых, инфицированные рекомбинантными вирусными векторами экспрессии (например, бакуловирусными), содержащими кодирующую последовательность; системы на основе клеток насекомых, инфицированных вирусными векторами экспрессии (например, вирус мозаики цветной капусты (CaMV); вирус табачной мозаики (TMV или трансформированных рекомбинантными плазмидными векторами экспрессии (например,плазмида Ti), содержащими кодирующие последовательности или системы на основе клеток животных. Белок также можно экспрессировать в системах генной терапии человека, включая, например, экспрессирование белка для восполнения количества данного белка в организме субъекта или для экспрессии рекомбинантного терапевтического белка. Элементы экспрессии этих систем могут обладать различной эффективностью и специфичностью. Специально разработанные векторы обеспечивают перенос ДНК между хозяевами, например между клетками бактерий и дрожжей и клетками бактерий и животных. Вектор подходящей конструкции может включать ориджин репликации для автономной репликации в клетке-хозяине, один или более селективных маркеров, ограниченное число полезных сайтов рестрикции для ферментов, возможность для получения высокого числа копий и активные промоторы. Промотор по определению представляет собой последовательность ДНК, которая направляет связывание РНК полимеразы с ДНК и инициирует синтез ДНК. Сильный промотор - это промотор, который вызывает инициацию мРНК с высокой частотой. Вектор экспрессии может также содержать различные элементы, которые оказывают влияние на транскрипцию и трансляцию, включая, например, конститутивные и индуцибельные промоторы. Эти элементы часто зависят от хозяина и/или вектора. Например, при клонировании в бактериальные системы можно использовать индуцибельные промоторы, такие как промотор Т 7, pL бактериофага , plac,ptrp, ptac (гибридный промотор ptrp-lac) и т.п.; при клонировании в системы на основе клеток насекомых можно использовать промоторы, такие как полиэдриновый промотор бакуловируса; при клонировании в системы на основе клеток растений можно использовать промоторы, полученные из генома клеток растений (например, промоторы теплового шока, промотор для малой субъединицы RUBISCO; промотор белка, связывающего хлорофилл а/b) или из вирусов растений (например, РНК-промотор 35S, промоторCaMV; промотор белка оболочки TMV); при клонировании клеток в системы на основе клеток млекопитающих можно использовать промоторы млекопитающих (например, промотор металлотионеин) или промоторы вирусов млекопитающих (например, поздний промотор аденовируса; промотор вируса коровьей оспы 7,5 K; промотор SV40; промотор вируса бычьей папилломы и промотор вируса ЭпштейнБарра). Для введения вектора в клетку-хозяин можно использовать различные методы, например трансформацию, трансфекцию, инфицирование, слияние протопластов и электропорацию. Клетки, содержащие вектор экспрессии, размножают вегетативным способом и индивидуально тестируют на продукцию соответствующих полипептидов. Для идентификации трансформированных клеток можно использовать разнообразные методы, включая, например, устойчивость к антибиотикам. Идентификацию клонов клеток-хозяев, экспрессирующих полипептид, можно осуществить несколькими путями, включая, без ограничения, способность к иммунореакции с антителами к киназе и наличие активности, связанной с клеткой-хозяином. Экспрессию кДНК также можно осуществлять с использованием полученной in vitro синтетической мРНК. Синтетическую мРНК можно эффективно транслировать в различных бесклеточных системах,включая, без ограничения, экстракты зародышей пшеницы, а также эффективно трансформировать в системах на основании клеток, включая, без ограничения, микроинъекции в яйцеклетки лягушки. Для определения последовательности (последовательностей) ДНК, которые обеспечивают оптимальные уровни активности и/или белка, конструируют модифицированные молекулы кДНК. Неограничивающий пример модифицированных кДНК - это случай, когда использование кодонов ДНК оптимизируют для клетки-хозяина, в которой данную кДНК предполагают экспрессировать. Клетки-хозяев трансформируют молекулами ДНК и измеряют уровень РНК и/или белка киназы. Уровни белка-киназы в клетке-хозяине измеряют множеством методов, таких как методики, основанные на иммуноаффинности и/или аффинности к лиганду, аффинные гранулы, специфичные в отношении киназы или специфичные антитела используют для выделения белка, меченного 35S-метионином,или немеченого белка. Меченый или немеченый белок исследуют методом электрофореза в полиакриламидном геле с додецилсульфатом натрия. Немеченый белок детектируют методом вестерн-блоттинга,твердофазного иммуноферментного анализа или радиоиммунного анализа с применением специфичных антител. После экспрессии киназы в рекомбинантной клетке-хозяине полипептиды можно выделить с получением полипептида в активной форме. Существует несколько способов очистки, которые можно применять. Рекомбинантную киназу можно выделить (очистить) из лизатов клеток или из кондициониро- 16016527 ванной культуральной среды при помощи применения известных в данной области методов в комбинации или отдельно. Такие методы включают фракционирование и хроматографию, известные в данной области техники. Кроме того, рекомбинантные киназы можно отделить от других белков клетки с использование иммуноаффинной колонки с моноклональными или поликлональными антителами, специфичными к полноразмерному полученному белку или полипептидам, являющимся фрагментами такого белка. Также можно использовать другие методики очистки, основанные на аффинности, которые известны в данной области. В качестве альтернативы полипептиды можно выделять из клетки-хозяна в несвернутой, неактивной форме, например, из инклюзионных телец бактерий. Белки, полученные в такой форме, можно солюбилизировать при помощи денатурирующего агента, например гуанидиния гидрохлорида, а затем обеспечить их сворачивание с образованием активной формы, используя методы, известные специалисту в данной области, такие как диализ. Анализ роста клеток. В данной области техники известны различные тест-системы, основанные на анализе роста клеток,которые можно применять для идентификации соединений триазалопиридазина (т.е. "тестируемых соединений"), способных ингибировать (например, снижать) рост и/или пролиферацию клеток. Например, известно множество разнообразных клеток, которым для роста и/или пролиферации необходимы конкретные киназы. Можно оценивать способность таких клеток расти в присутствии тестируемого соединения и сравнивать с ростом в отсутствие тестируемого соединения, что позволяет идентифицировать антипролиферативные свойства тестируемых соединений. Один общий метод такого типа заключается в степени включения метки, такой как 3 Н-тимидин, в ДНК делящихся клеток. В качестве альтернативы ингибирование пролиферации клеток можно оценить путем определения общей метаболической активности клеток с идентифицирующим маркером, которая коррелирует с числом клеток. Клетки можно обработать индикатором метаболизма в присутствии и в отсутствие тестируемого соединения. Жизнеспособные клетки метаболизируют индикатор метаболизма и в результате выделяют детектируемый продукт метаболизма. Снижение уровня детектируемого продукта метаболизма в присутствии тестируемого соединения по сравнению с уровнем при отсутствии тестируемого соединения указывает на подавления роста и/или пролиферации клеток. Примеры индикаторов метаболизма включают, например,соли тетразолия и AlamorBlue (см. раздел "Примеры" ниже). Тестом на киназы, которые стимулируют миграцию клеток, является скретч-тест (от английскогоscratch-царапина). Этот тест используется для оценки ингибиторов киназ по имитирующим событиям,таким как заживление ран. В одном варианте данного теста, применяемом для тестирования ингибиторов МЕТ, клетки оставляют на чашке для образования непрерывного монослоя. После формирования монослоя на него наносят линейное повреждение путем механического процарапывания с образованием канавки, не содержащей клеток. В присутствии или в отсутствие тестируемого соединения добавляют фактор роста, который необходим киназе для роста клеток. Если в присутствии тестируемого соединения канавка закрывается, это указывает на отсутствие ингибирование киназы тестируемым соединением,благодаря чему клетки мигрируют и закрывают канавку. И наоборот, если в присутствии тестируемого соединения канавка сохраняется, это указывает на то, что тестируемое соединение ингибирует киназу,что препятствует росту клеток. Выбор соответствующих клеток, условий роста и факторов роста находятся в пределах компетенции специалиста в данной области (см. раздел "Примеры" ниже). Примеры Следующие примеры приведены для иллюстрации и не ограничивают настоящее изобретение. Получение конкретных соединений согласно настоящему изобретению показано в приведенных ниже примерах. Для специалиста в данной области техники очевидно, что предложенные химические реакции и способы синтеза могут быть модифицированы для получения многих других соединений согласно настоящему изобретению. В случае отсутствия примера получения для конкретного соединения согласно настоящему изобретению для специалиста в данной области техники очевидно, что указанные соединения можно получить с помощью модифицированных способов синтеза, представленных выше, и с использованием известных в данной области техники способов синтеза. Синтез промежуточных соединений. Промежуточное соединение 1. (2-Метилхинолин-6-ил)уксусная кислота Этап 1. Этиловый эфир (2-метилхинолин-6-ил)уксусной кислоты. Во флакон в атмосфере азота помещали 6-бромхинальдин (500 мг, 2,25 ммоль), бис(пинаколято)дибор (1,14 г, 4,5 ммоль), дихлорметановый аддукт дихлор[1,1'-бис-(дифенилфосфино)ферроцен]палладий(II) (92 мг, 0,112 ммоль), ацетат натрия (547 мг, 6,75 ммоль) и диметилформамид (10 мл). Реакционную смесь перемешивали при 100 С в течение 18 ч, затем разделяли между этилацетатом и водой. Органическую фазу дважды промывали солевым раствором, сушили над сульфатом натрия, фильт- 17016527 ровали и абсорбировали на силикагеле. Проводили очистку на силикагеле с 0-8% градиентом метанола в дихлорметане с получением 432 мг темного масла. Масло растворяли в тетрагидрофуране (5 мл) и добавляли в атмосфере азота в сосуд, содержащий ацетат палладия(II) (7 мг, 0,03 ммоль), три-1 нафтилфосфин (37 мг, 0,09 ммоль) и трехосновный фосфат калия (1 г, 5 ммоль). Затем добавляли этил 2 бромацетат (167 мг, 1 ммоль) и перемешивали реакционную смесь при температуре кипения с обратным холодильником в течение 18 ч. Добавляли воду и экстрагировали смесь этилацетатом (3). Объединенные органические фазы сушили над сульфатом натрия, фильтровали и абсорбировали на силикагеле. Проводили очистку на силикагеле с 0-80% градиентом этилацетата в гексане, получали 105 мг продукта в форме желтого масла. 1H-ЯМР 500 МГц (ДМСО):1,19 (т, 3 Н), 2,65 (с, 3 Н), 3,85 (с, 2 Н), 4,10 (кв., 2 Н),7,40 (д, 1 Н), 7,61 (дд, 1 Н), 7,78 (д, 1 Н), 7,86 (д, 1 Н), 8,20 (д, 1 Н); MS (m/z): 230 [М+Н+]+. Этап 2. (2-Метилхинолин-6-ил)уксусная кислота. В раствор этилового эфира (2-метилхинолин-6-ил)уксусной кислоты (100 мг, 0,436 ммоль) в метаноле (2 мл) добавили 4 М водный раствор гидроксида лития (0,55 мл, 2,18 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 14 ч, затем концентрировали в вакууме, разбавляли водой и обрабатывали 1 н. водной соляной кислотой до рН 5. Водную фазу экстрагировали этилацетатом(3) и объединенные органические фазы сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, в результате получали 19 мг продукта в форме светло-бежевого твердого вещества. 1 Н-ЯМР 500 МГц (ДМСО):2,65 (с, 3 Н), 3,76 (с, 2 Н), 7,40 (д, 1 Н), 7,60 (дд, 1 Н), 7,77 (д, 1 Н), 7,86 (д, 1 Н), 8,20 (д,1 Н); MS (m/z): 202 [М+Н+]+. Промежуточное соединение 2. 3-Хинолин-6-илпропионовая кислота Этап 1. Этиловый эфир 3-хинолин-6-илакриловой кислоты. Во флакон в атмосфере азота помещали 6-бромхинолин (1 г, 4,8 ммоль) и диметилформамид (15 мл), после чего добавляли этилакрилат (2,1 мл, 19,2 ммоль), триэтиламин (6,7 мл, 48 ммоль) и ацетат палладия(II) (32 мг, 0,142 ммоль). Реакционную смесь перемешивали при 100 С в течение 5 ч, затем горячую смесь фильтровали через целит и фильтрат концентрировали в вакууме. Остаток разделяли на части между водой и этилацетатом. Органическую фазу промывали насыщенным водным раствором хлорида аммония, насыщенным водным раствором гидрокарбоната натрия, затем солевым раствором. Органическую фазу затем абсорбировали на силикагеле. Проводили очистку на силикагеле, используя градиент этилацетата в гексане 10-80%, в результате получали 952 мг продукта в форме желтого масла. 1 НЯМР 500 МГц (ДМСО):1,28 (т, 3 Н), 4,20 (кв., 2 Н), 6,82 (д, 1 Н), 7,58 (д, 1 Н), 7,84 (д, 1 Н), 8,01 (д, 1 Н),8,16 (дд, 1 Н), 8,30 (д, 1 Н), 8,37 (дд, 1 Н), 8,93 (дд, 1 Н); MS (m/z): 228 [М+Н+]+. Этап 2. Этиловый эфир 3-хинолин-6-илпропионовой кислоты. Смесь этилового эфира 3-хинолин-6-илакриловой кислоты (200 мг, 0,881 ммоль) и 10 мас.% Pd/C(93 мг, 0,088 ммоль) в метаноле (3 мл) перемешивали при комнатной температуре в атмосфере водорода в течение 3 ч. Смесь фильтровали через слой целита, фильтрат абсорбировали на силикагеле. Проводили очистку на силикагеле с 0-65% градиентом этилацетата в гексане, в результате получали 100 мг продукта в форме прозрачного масла. 1H-ЯМР 500 МГц (ДМСО):1,13 (т, 3 Н), 2,74 (т, 2 Н), 3,05 (т, 2 Н), 4,04 (кв.,2 Н), 7,50 (дд, 1 Н), 7,67 (дд, 1 Н), 7,78 (д, 1 Н), 7,94 (д, 1 Н), 8,29 (дд, 1 Н), 8,84 (дд, 1 Н); MS (m/z): 230[М+Н+]+. Этап 3. 3-Хинолин-6-илпропионовая кислота. В раствор этилового эфира 3-хинолин-6-илпропионовой кислоты (100 мг, 0,437 ммоль) в метаноле(2 мл) добавляли 4 М водный раствор гидроксида лития (0,55 мл, 2,18 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч, затем ее концентрировали в вакууме, разбавляли водой и обрабатывали 1 н. водной соляной кислотой до рН 5. Водную фазу экстрагировали этилацетатом(3), объединенные органические фазы сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, в результате получали 18 мг продукта в форме белого твердого вещества. 1 Н-ЯМР 500 МГц Этап 1. Этиловый эфир транс-2-хинолин-6-илциклопропанкарбоновой кислоты. В суспензию гидрида натрия (71 мг, 1,76 ммоль) в ДМСО (3 мл) в атмосфере азота добавляли хлорид триметилсульфоксония (261 мг, 2,03 ммоль). После перемешивания при комнатной температуре в течение 30 мин по каплям добавляли раствор этилового эфира 3-хинолин-6-илакриловой кислоты (200 мг, 0,881 ммоль) в ДМСО (2 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2,5 ч и гасили реакцию насыщенным водным раствором хлорида аммония. Смесь экстрагировали- 18016527 этилацетатом (2), промывали объединенные органические фазы солевым раствором (3) и абсорбировали на силикагеле. Проводили очистку на силикагеле с 0-80% градиентом этилацетата в гексане, в результате получали 126 мг продукта в форме белого твердого вещества. 1 Н-ЯМР 500 МГц (ДМСО):1,22 (т,3 Н), 1,55 (м, 2 Н), 2,10 (м, 1 Н), 2,64 (м, 1 Н), 4,13 (кв., 2 Н), 7,50 (дд, 1 Н), 7,58 (дд, 1 Н), 7,80 (д, 1 Н), 7,93 (д,1 Н), 8,26 (дд, 1 Н), 8,84 (дд, 1 Н); MS (m/z): 242 [М+Н+]+. Этап 2. транс-2-Хинолин-6-илциклопропанкарбоновая кислота. В раствор этилового эфира транс-2-хинолин-6-илциклопропанкарбоновой кислоты (125 мг, 0,523 ммоль) в метаноле (2 мл) добавляли 4 М водный раствор гидроксида лития (0,65 мл, 2,62 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч, затем ее концентрировали в вакууме, разбавляли водой и обрабатывали 1 н. водной соляной кислотой до рН 4-5. Полученный осадок фильтровали, промывали водой и сушили в вакууме, в результате получали 102 мг продукта в форме белого твердого вещества. 1 Н-ЯМР 500 МГц (ДМСО):1,50 (м, 2 Н), 1,96 (м, 1 Н), 2,60 (м, 1 Н), 7,50 (дд,1 Н), 7,57 (дд, 1 Н), 7,78 (д, 1 Н), 7,93 (д, 1 Н), 8,26 (дд, 1 Н), 8,83 (дд, 1 Н); MS (m/z): 214 [М+Н+]+. Промежуточное соединение 4. Хиноксалин-6-илуксусная кислота Этап 1. Этиловый эфир хиноксалин-6-илуксусной кислоты. Во флакон в атмосфере азота помещали гидрохлорид бензопиразин-6-бороновой кислоты (500 мг,2,38 ммоль), ацетат палладия(II) (16 мг, 0,071 ммоль), три-1-нафтилфосфин (88 мг, 0,214 ммоль), трехосновной фосфат калия (2,52 г, 11,9 ммоль) и тетрагидрофуран (10 мл). Затем добавляли этил 2-бромацетат(0,315 мл, 2,85 ммоль) и перемешивали реакционную смесь при температуре кипения с обратным холодильником в течение 6 ч. Добавляли воду и экстрагировали смесь этилацетатом (3). Объединенные органические фазы абсорбировали на силикагеле. Проводили очистку на силикагеле с 0-100% градиентом этилацетата в гексане, в результате получали 96 мг продукта в форме темно-желтого масла. 1H-ЯМР 500 МГц (ДМСО):1,20 (т, 3 Н), 3,99 (с, 2 Н), 4,11 (кв., 2 Н), 7,79 (дд, 1 Н), 8,01 (д, 1 Н), 8,06 (д, 1 Н), 8,94 (д,2 Н); MS (m/z): 217 [М+Н+]+. Этап 2. Хиноксалин-6-илуксусная кислота. В раствор этилового эфира хиноксалин-6-илуксусной кислоты (95 мг, 0,44 ммоль) в метаноле (2 мл) добавили 4 М водный гидроксид лития (0,55 мл, 2,2 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 17 ч, затем концентрировали в вакууме, разбавляли водой и экстрагировали диэтиловым эфиром (3). Водную фазу обрабатывали 1 н. водной соляной кислотой до рН 2 и экстрагировали этилацетатом (3). Объединенные органические фазы сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, в результате получали 64 мг в форме бежевого твердого вещества. 1 Н-ЯМР 500 МГц (ДМСО):3,90 (с, 2 Н), 7,78 (дд, 1 Н), 7,99 (д, 1 Н), 8,06 (д, 1 Н), 8,93 (дд, 2 Н); MS (m/z): 189 [М+Н+]+. Промежуточное соединение 5. Бензотиазол-6-илуксусная кислота(4-Аминофенил)уксусную кислоту (20 г, 132,5 ммоль) и NH4SCN (20 г, 263,2 ммоль) растворяли в 300 мл уксусной кислоты и охлаждали смесь до 15 С, обрабатывали Br2 (21,2 г, 6,8 мл) в уксусной кислоте (10 мл) и удерживали температуру ниже 15 С. Затем реакцию перемешивали при комнатной температуре в течение 4 ч, смесь фильтровали и фильтрат перерастворяли в воде, устанавливали рН 5. Осадок фильтровали и сушили, в результате получали (2-аминобензотиазол-6-ил)уксусную кислоту в форме светло-желтого порошка (24 г, 87,1%). Этап 2. Бензотиазол-6-илуксусная кислота. В 1,4-диоксане (750 мл) растворяли (2-аминобензотиазол-6-ил)уксусную кислоту (20 г, 96,2 ммоль). В раствор по каплям при комнатной температуре добавляли изоамилнитрит (22,4 г, 192,4 ммоль). Смесь перемешивали при температуре кипения с обратным холодильником в атмосфере азота в течение 2 ч. После завершения реакции растворитель удаляли в вакууме и остаток использовали на следующем этапе без дальнейшей очистки. Промежуточное соединение 5 и промежуточное соединение 6. Бензотиазол-6-илуксусная кислота и В раствор дигидрохлорида (2-аминобензотиазол-6-ил)уксусной кислоты (150 мг, 0,533 ммоль) в диметилформамиде (3 мл) в атмосфере азота по каплям добавляли трет-бутилнитрит (0,076 мл, 0,64 ммоль). Реакционную смесь перемешивали при 50 С в течение 1,5 ч, ее концентрировали и сушили в вакууме в виде смеси (2:3) бензотиазол-6-илуксусной кислоты и (2-хлорбензотиазол-6-ил)уксусной ки- 19016527 слоты. Смесь использовали при процедурах соединения/циклизации, как это описано в способе Y. Промежуточное соединение 7. 4-(6-Фенил-[1,2,4]триазоло[4,3-b]пиридазин-3-ил)метиленбензол-1,2 диамин Этап 1. Метиловый эфир 4-аминофенилуксусной кислоты. В суспензию 4-аминофенилуксусной кислоты (5 г, 33 ммоль) в метаноле (20 мл) по каплям добавляли концентрированную серную кислоту (2 мл). Реакционную смесь перемешивали при температуре кипения с обратным холодильником в течение 1,5 ч, затем концентрировали в вакууме. Остаток разделяли на части между 1 М водным карбонатом калия и диэтиловым эфиром. Органическую фазу промывали 1 М водным карбонатом калия, водой, затем сушили над сульфатом натрия и фильтровали. Фильтрат концентрировали и сушили в вакууме, в результате получали 4,65 г продукт в форме темно-желтого масла. 1H-ЯМР 500 МГц (ДМСО):3,43 (с, 2 Н), 3,57 (с, 3 Н), 4,97 (с, 2 Н), 6,49 (д, 2 Н), 6,88 (д, 2 Н); MS (m/z): 166 [М+Н+]+. Этап 2. Метиловый эфир (4-ацетиламино-3-нитрофенил)уксусной кислоты. Раствор метилового эфира 4-аминофенилуксусной кислоты (3 г, 18,2 ммоль) в уксусном ангидриде(16 мл) перемешивали при комнатной температуре в течение 30 мин. Реакционную смесь охлаждали до температуры 0 С и по каплям добавляли кипящую азотную кислоту (2,3 мл). Ледяную баню убирали и реакционную смесь перемешивали в течение следующих 20 мин, затем переливали в ледяную воду. Полученный желтый осадок фильтровали, промывали водой и сушили в вакууме при 50 С, в результате получали 3,7 г продукта. 1 Н-ЯМР 500 МГц (ДМСО):2,05 (с, 3 Н), 3,63 (с, 3 Н), 3,81 (с, 2 Н), 7,54 (д, 1 Н),7,58 (дд, 1 Н), 7,87 (д, 1 Н), 10,2 (с, 1 Н). Этап 3. Гидрохлорид (4-амино-3-нитрофенил)уксусной кислоты. Раствор метилового эфира (4-ацетиламино-3-нитрофенил)уксусной кислоты (1,3 г, 5,15 ммоль) в 6 н. соляной кислоте (10 мл) перемешивали при температуре кипения с обратным холодильником в течение 1,5 ч, затем концентрировали в вакууме до осушения. Остаток растирали в диэтиловом эфире, фильтровали, промывали диэтиловым эфиром и сушили в вакууме, в результате получали 978 мг продукта в форме темно-желто-оранжевого твердого вещества. 1H-ЯМР 500 МГц (ДМСО):3,49 (с, 2 Н), 6,98 (д,1 Н), 7,30 (дд, 1 Н), 7,86 (д, 1 Н); MS (m/z): 197 [М+Н+]+. Этап 4. 2-Нитро-4-(6-фенил-[1,2,4]триазоло[4,3-b]пиридазин-3-ил)метиленфениламин. Названное соединение можно получить в соответствии с процедурой, описанной в способе D, в форме желтого твердого вещества (91 мг, 0,263 ммоль, выход 23%). 1 Н-ЯМР (ДМСО):4,50 (с, 2 Н), 6,97(М+Н). Этап 5. 4-(6-Фенил-[1,2,4]триазоло[4,3-b]пиридазин-3-ил)метиленбензол-1,2-диамин. Смесь 2-нитро-4-(6-фенил-[1,2,4]триазоло[4,3-b]пиридазин-3-ил)метиленфениламина (89 мг, 0,257 ммоль) и 10 мас.% Pd/C (27 мг, 0,026 ммоль) в метаноле (4 мл), тетрагидрофуране (2 мл) и диметилформамиде (2 мл) перемешивали при комнатной температуре в атмосфере водорода в течение 4 ч. Катализатор профильтровали через слой целита, фильтрат концентрировали и сушили в вакууме, в результате получали 81 мг продукта в форме бежевого твердого вещества. 1 Н-ЯМР (ДМСО):4,30 (с, 2 Н), 4,32 (с,2 Н), 4,43 (с, 2 Н), 6,43 (м, 2 Н), 6,50 (с, 1 Н), 7,60 (м, 3 Н), 7,93 (д, 1 Н), 8,11 (м, 2 Н), 8,39 (д, 1 Н); MS (m/z): 317 [М+Н+]+. Промежуточное соединение 8. Хинолин-6-илацетонитрил Суспензию 6-метилхинолина (21,48 г, 150 ммоль) и N-бромсукцинимида (27,6 г, 155 ммоль) в CCl4(430 мл) нагревали при температуре кипения с обратным холодильником. При температуре кипения с обратным холодильником однократно добавляли свежеполученный бензоил пероксид (1,4 г, 5,1 ммоль). Смесь перемешивали при температуре кипения с обратным холодильником в течение следующих 2 ч. После этого времени смесь оставляли остывать до температуры окружающей среды в течение более 3 ч и образовавшийся осадок удаляли путем фильтрации. Фильтрат промывали 5% водным NaOH (2150 мл),водой (200 мл), сушили (Na2SO4) и очищали путем колоночной флэш-хроматографии (SiO2, гексан/этилацетат 100:0-35/65). Фракции, содержащие искомое бромсодержащее соединение, разбавляли диметилформамидом (400 мл), смесь концентрировали в вакууме для удаления гексана и этилацетата. К этой смеси затем добавляли KHCO3 (15 г, 150 ммоль), после чего добавляли цианид натрия (7,34 г, 150 ммоль). Смесь перемешивали при комнатной температуре в течение 2 ч и при 40 С в течение еще 2 ч. После этого времени смесь концентрировали в вакууме, остаток переливали в 5% водный KHCO3 (600 мл) и экстрагировали этилацетатом (3200 мл). Объединенные органические экстракты промывали солевым раствором (100 мл), сушили (Na2SO4) и концентрировали на силикагеле. Проводили очистку путем колоночной флэш-хроматографии (SiO2, смесью гексан:этилацетат 80:20-30:70), получали названное со- 20016527 единение в форме белого твердого вещества (4,8 г, 28,6 ммоль, выход 20%). 1 Н-ЯМР 500 МГц (ДМСОd6):4,28 (2 Н, с), 7,56 (1 Н, дд), 7,11 (1 Н, дд), 7,97 (1 Н, д), 8,01 (1 Н, д), 8,40 (1 Н, дд), 8,92 (1 Н, дд); MS Этап 1. 2-Метил-2-хинолин-6-илпропионитрил. Раствор хинолин-6-илацетонитрила (промежуточное соединение 8) (200 мг, 1,2 ммоль) в тетрагидрофуране (12 мл), в который добавляли йодистый метил (2,5 ммоль, 157 мкл), охлаждали до -78 С, после чего добавляли трет-бутоксид калия (2,5 ммоль, 280 мг). Смесь оставляли нагреваться до температуры окружающей среды в течение ночи. После этого времени смесь концентрировали в вакууме, растворяли в водном NaHCO3 (30 мл) и экстрагировали дихлорметаном (330 мл). Объединенные органические экстракты сушили (Na2SO4) и концентрировали на силикагеле. Проводили очистку путем колоночной флэшхроматрграфии (SiO2, смесь гексан:этилацетат 90:10-50:50), в результате получали названное соединение в форме прозрачного бесцветного масла (214 мг, выход 91%). 1H-ЯМР 500 МГц (ДМСО-d6):1,80 (6 Н,с), 7,58 (1 Н, дд), 7,94 (1 Н, дд), 8,08 (1 Н, д), 8,11 (1 Н, д), 8,45 (1 Н, дд), 8,93 (1 Н, дд); MS (m/z): 197[М+Н+]+. Этап 2. Гидрохлорид 2-метил-2-хинолин-6-илпропионовой кислоты. К смеси 2-метил-2-хинолин-6-илпропионитрила (760 мг, 3,88 ммоль) в воде (3 мл) добавляли концентрированную соляную кислоту (7 мл) и нагревали до 160 С в микроволновой печи в течение 5 мин. После этого времени смесь концентрировали в вакууме и остаток сушили путем азеотропной дистилляции из толуола (35 мл), в результате получали названное соединение в форме белого твердого вещества Этап 1. Метиловый эфир хинолин-6-илуксусной кислоты. К перемешиваемому раствору хинолин-6-илуксусной кислоты (10 г, 53,0 ммоль) в 100 мл метанола добавляли 2,5 мл концентрированной H2SO4. Смесь нагревали при температуре кипения с обратным холодильником в течение 3 ч. Реакционную смесь концентрировали, получали коричневый остаток, который разбавляли 100 мл дихлорметана, промывали насыщенным водным NaHCO3 и солевым раствором,затем сушили органическую фазу над безводным Na2SO4 и концентрировали, в результате получали названное соединение в форме коричневого масла (7,9 г, 73,6%). Этап 2. Метиловый эфир 2-хинолин-6-илпропионовой кислоты. Раствор н-бутиллития в гексане (1,6 М, 50,9 мл) добавляли при перемешивании к раствору диизопропиламина (5,32 г, 52,6 ммоль) в безводном тетрагидрофуране (100 мл), охлажденном до -40 С в атмосфере азота, смесь перемешивали в течение 30 мин. Реакционную смесь охлаждали до -78 С, к этому раствору добавляли раствор метилового эфира хинолин-6-илуксусной кислоты (7,9 г, 39,3 ммоль) в 10 мл тетрагидрофурана и НМРА (10,0 г, 55,8 ммоль). Смесь перемешивали при -78 С в течение 1 ч и затем при -30 С в течение 30 мин. К этой реакционной смеси добавляли раствор йодистого метила (8,0 г, 56,3 ммоль) в безводном тетрагидрофуране при -78 С, смесь перемешивали при -78 С в течение 1,5 ч. Реакционную смесь медленно нагревали до комнатной температуры и разбавляли водным насыщенным раствором NH4Cl (100 мл) и водой (80 мл). Смесь экстрагировали трет-бутилметиловым эфиром, объединенные органические фазы промывали водой и солевым раствором, сушили над безводным сульфатом натрия и концентрировали, получали коричневое масло, которое очищали путем колоночной хроматографии, элюцию проводили на силикагеле смесью петролейный эфир/этилацетат (20:1), в результате получали бледно-желтое масло (7,7 г, 91,1%). 1 Н-ЯМР и LC-MS анализы показали, что названное соединение загрязнено 10% метилового эфира 2-метил-2-хинолин-6-илпропионовой кислоты. Этап 3. 2-Хинолин-6-илпропионовая кислота. Метиловый эфир 2-хинолин-6-илпропионовой кислоты, содержащий 10% метилового эфира 2 метил-2-хинолин-6-илпропионовой кислоты (7,7 г, 35,8 ммоль), и 2 н. водного NaOH (27 мл) нагревали при температуре кипения с обратным холодильником в течение 4 ч до тех пор, пока реакционная смесь не станет прозрачной. После охлаждения до комнатной температуры смесь экстрагировали дихлорметаном и водную фазу подкисляли концентрированной соляной кислотой до рН 4-5. Добавляли этилацетат(30 мл) и перемешивали в течение 10 мин, полученное вещество отфильтровывали, в результате получали продукт, который дважды перекристаллизовали из метанола, в результате получали названное соединение (5,3 г, 73,7%). 1 Н-ЯМР 300 МГц (ДМСО-d6):12,43 (с, 1 Н), 8,86 (д, 1 Н), 8,33 (д, 1 Н), 7,99-7,86 (м,- 21016527 2 Н), 7,72-7,49 (м, 2 Н), 3,92 (кв., 1 Н), 1,48 (д, 3 Н). ES-MS (m/z): 200 [М-Н+]-, 400 (димер). Промежуточное соединение 11. (5,7-Дифторхинолин-6-ил)уксусная кислота Этап 1. 6-Бром-5,7-дифторхинолин. Осторожно нагревали смесь 4-бром-3,5-дифторфениламина (6,0 г, 28,8 ммоль), сульфата железа(1,82 г), глицерина (8,6 мл), нитробензола (1,79 мл) и 5,0 мл концентрированной серной кислоты (5 мл). После первой бурной реакции смесь нагревали при температуре кипения с обратным холодильником в течение 5 ч. Нитробензол удаляли путем дистилляции в вакууме. Водный раствор подкисляли ледяной уксусной кислотой и отделяли темно-коричневый осадок, который очищали путем флэш-хроматографии(силикагель, смесь петролейный эфир/этилацетат = 12/1), в результате получали названное соединение в форме белого твердого вещества (3,5 г, 49,8%). Этап 2. Диэтиловый эфир 2-(5,7-дифторхинолин-6-ил)малоновой кислоты. В смесь гидрида натрия (60% в минеральном масле, 2,32 г, 58,0 ммоль) в 1,4-диоксане (29 мл) по каплям при 60 С добавляли этилмалонат (9,28 г, 8,8 мл, 58,0 ммоль). Затем добавляли CuBr (4,176 г, 29,0 ммоль) и 6-бром-5,7-дифторхинолин (7,07 г, 29,0 ммоль), смесь нагревали при температуре кипения с обратным холодильником в течение 16 ч. После этого времени добавляли концентрированную соляную кислоту при охлаждении льдом и затем добавляли метиловый эфир трет-бутилового спирта и воду. Отделенную органическую фазу последовательно промывали (10%) соляной кислотой и водой. Сушили над сульфатом натрия и концентрировали. Остаток очищали путем колоночной хроматографии, в результате получали названное соединение (3,13 г, 35,4%). Этап 3. (5,7-Дифторхинолин-6-ил)уксусной кислоты. В содержащую диэтиловый эфир 2-(5,7-дифторхинолин-6-ил)малоновой кислоты (2,48 г, 7,68 ммоль) круглодонную колбу добавляли этанол (77 мл) и 10% водный NaOH (103,2 мл). Раствор оставляли при температуре кипения с обратным холодильником в течение 3 ч. После этого времени этанол удаляли при пониженном давлении, получая желтую суспензию, добавляли тетрагидрофуран (50 мл), в результате получали прозрачный желтый раствор, который помещали в ледяную баню и перемешивали. В раствор медленно добавляли 6 н. соляную кислоту (50 мл), достигая рН 1. Светло-оранжевый раствор держали при температуре кипения с обратным холодильником в течение еще одного часа, за который образовывались две фазы. Собирали верхнюю тетрагидрофурановую фазу и водный раствор экстрагировали дихлорметаном. Органическую фазу промывали солевым раствором и сушили над безводным сульфатом натрия. Раствор затем фильтровали и фильтрат концентрировали, в результате получали названное соединение (1,20 г, 70,1%). 1 Н-ЯМР (300 МГц, ДМСО-d6):12,82 (с, 1 Н), 8,98-9,00 (м, 1 Н), 8,47-8,50 (д,1 Н), 7,61-7,74 (м, 2 Н), 3,86 (с, 2 Н); ES-MS (m/z): 224,2 (М 1). Промежуточное соединение 12. (7-Фторхинолин-6-ил)уксусная кислота Этап 1. 6-Бром-7-фторхинолин. Смесь 4-бром-3-фторфениламина (2,85 г, 15 ммоль), сульфата железа (0,95 г), глицерина (5,658 г,4,5 мл), нитробензола (1,125 г, 0,93 мл) и концентрированной серной кислоты (2,61 мл) мягко нагревали. После первой бурной реакции смесь нагревали при температуре кипения с обратным холодильником в течение 7 ч. Нитробензол выпаривали в вакууме. Водный раствор подкисляли ледяной уксусной кислотой и отделяли темно-коричневый осадок, который очищали путем флэш-хроматографии (силикагель,смесь петролейный эфир/этилацетат = 8/1), в результате получали названное соединение в форме белых кристаллов (1,44 г, 42,5%). Этап 2. трет-Бутиловый эфир (7-фторхинолин-6-ил)уксусной кислоты. В раствор 6-бром-7-фторхинолина (1,04 г, 4,6 ммоль) в тетрагидрофуране (1 мл) добавляли раствор ацетата трет-бутилцинкбромида (20 мл, 10,4 М в тетрагидрофуране), после чего добавляли Pd(PPh3)4(0,58 г, 0,5 ммоль). Смесь нагревали в микроволновом реакторе в течение 35 мин при 120 С. Реакционную смесь гасили насыщенным хлоридом аммония (60 мл) и экстрагировали этилацетатом. Органическую фазу сушили над безводным Na2SO4, фильтровали и концентрировали. Остаток очищали путем колоночной хроматографии, в результате получали названное соединение (0,75 г, 63%). Этап 3. (7-Фторхинолин-6-ил)уксусная кислота. Смесь трет-бутилового эфира (7-фторхинолин-6-ил)уксусной кислоты (3,67 г) и 4 н. водного гидроксида натрия (14,8 мл) нагревали при 90 С в течение 3 ч. Раствор экстрагировали этилацетатом. Водную фазу подкисляли уксусной кислотой, фильтровали и сушили, в результате получали названное соединение (2,3 г, 79,8%). 1H-ЯМР (300 МГц, ДМСО-d6):12,52 (1 Н, с), 8,88-8,90 (д, 1 Н), 8,34-8,38 (д, 1 Н), 7,977,99 (д, 1 Н), 7,73-7,76 (д, 1 Н), 7,50-7,54 (м, 1 Н), 3,85 (с, 2 Н); ES-MS (m/z): 206,2 (М+1). Промежуточное соединение 13. (7-Метилхинолин-6-ил)уксусная кислота Этап 1. 6-Бром-7-метилхинолин. Смесь 20 г 4-бром-3-метилфениламина, 6,6 г сульфата железа, 40,8 г пропан-1,2,3-триола, 8,12 г нитробензола и 23 мл концентрированной серной кислоты мягко нагревали. После первой бурной реакции смесь нагревали при температуре кипения с обратным холодильником в течение 3 ч и затем выпаривали для удаления оставшегося нитробензола. В раствор добавляли насыщенный NaHCO3 до рН 8, раствор фильтровали и экстрагировали дихлорметаном. Дихлорметановые фазы объединяли, сушили надNa2SO4 и концентрировали. Полученное твердое вещество очищали путем колоночной флэшхроматографии, получали желтое вещество, которое промывали петролейным эфиром, в результате получали названное соединение (7,5 г, 65%). 1 Н-ЯМР (CDCl3, 300 МГц):8,89 (м, 1 Н), 8,04 (м, 2 Н), 7,96 (с,1 Н), 7,36 (м, 1 Н), 2,60 (с, 3 Н). Этап 2. трет-Бутиловый эфир (7-метилхинолин-6-ил)уксусной кислоты. К 1,02 г 6-бром-7-метилхинолина добавляли 20 мл раствора трет-бутилцинкбромид ацетата и 0,58 гPd(PPh3)4. Смесь помещали в микроволновый реактор, в течение 30 мин температуру доводили до 120 С(повторяли в течение 3 раз). Проводили очистку путем колоночной флэш-хроматографии, в результате получали названное соединение (3,2 г, 68%). 1 Н-ЯМР (CDCl3, 300 МГц):8,84 (м, 1 Н), 8,07 (м, 1 Н), 7,89(с, 1 Н), 7,63 (с, 1 Н), 7,31 (м, 1 Н), 3,72 (с, 2 Н), 2,51 (с, 3 Н), 1,46 (с, 9 Н). Этап 3. (7-Метилхинолин-6-ил)уксусная кислота. 3,2 г трет-бутилового эфира (7-метилхинолин-6-ил)уксусной кислоты в 25 мл водного NaOH (4 н.) нагревали при температуре кипения с обратным холодильником в течение 4 ч. Смесь промывали этилацетатом и добавляли концентрированную соляную кислоту до рН 7. Образовавшееся белое твердое вещество фильтровали и сушили, в результате получали названное соединение (1,5 г, 71,1%). 1H-ЯМР Этап 1. Фторхинолин-6-илацетонитрил. Раствор хинолин-6-илацетонитрила (1,06 г, 6,3 ммоль) в тетрагидрофуране (40 мл) охлаждали до 78 С, в него по каплям в течение 10 мин добавляли трет-бутиллитий (0,8 М в пентане, 7,6 ммоль, 7,9 мл). По окончании добавления смесь перемешивали при -78 С в течение 30 мин. Затем добавляли раствор Nфторди(бензолсульфонил)амина (1,5 экв., 9,45 ммоль, 3,0 г) в тетрагидрофуране (10 мл). Реакционную смесь перемешивали в течение 2 ч при -78 С, затем добавляли воду, после чего добавляли водныйNaHCO3. Смесь экстрагировали дихлорметаном (380 мл), сушили (Na2SO4), концентрировали в вакууме на силикагеле и очищали путем колоночной флэш-хроматографии (SiO2, смесь гексан:этилацетат 100:050:50), в результате получали названное соединение в форме красного твердого вещества (520 мг, 2,8 ммоль, 44%). 1H-ЯМР 500 МГц (ДМСО-d6):6,05 (1 Н, д), 7,66 (1 Н, дд), 7,95 (1 Н, дд), 8,19 (1 Н, д), 8,32(1 Н, т), 8,55 (1 Н, д), 9,03 (1 Н, дд); MS (m/z): 187 [М+Н+]+. Этап 2. Гидрохлорид фторхинолин-6-илуксусной кислоты. Фторхинолин-6-илацетонитрил (370 мг, 2,0 ммоль) растворили в концентрированной соляной кислоте (4 мл) и нагревали до 145 С в течение 8 мин в микроволновой печи. После этого времени смесь концентрировали в вакууме, в результате с количественным выходом получали названное соединение в форме белого твердого вещества. 1H-ЯМР 500 МГц (D2O):6,05 (1 Н, д), 7,99-6,93 (1 Н, м), 8,14-8,05 (2 Н,м), 8,26 (1 Н, с), 9,05-8,95 (2 Н, м). MS (m/z): 204 [М-Н+]-. Промежуточное соединение 15. [6-(1-Метил-1 Н-пиразол-4-ил)пиридазин-3-ил]гидразин Этап 1. Способ 1.1. 3-Хлор-6-(1-метил-1 Н-пиразол-4-ил)пиридазин. Смесь 3,6-дихлорпиридазина (5,37 г, 33,5 ммоль), пинаколового эфира 1-метил-4-пиразолбороновой кислоты (5 г, 24,0 ммоль) и карбонат цезия (23,44 г, 72 ммоль) в 1,4-диоксане (150 мл) и воде (750 мл) в атмосфере азота дегазировали путем насыщения азотом в течение 15 мин. После чего добавляли дихлорметановый аддукт дихлор[1,1'-бис-(дифенилфосфино)ферроцен]палладия(II) (1 г, 1,37 ммоль) и насыщали смесь азотом в течение других 10 мин. Реакционную смесь перемешивали при 80 С в течение 2,5 ч, затем охлаждали до комнатной температуры и концентрировали в вакууме. Остаток разделяли на части между 1 н. водным карбонатом калия и этилацетатом. Органическую фазу промывали 1 н. водным карбонатом калия и солевым раство- 23016527 ром, сушили над сульфатом натрия, фильтровали и абсорбировали на силикагеле для очистки. Проводили очистку путем флэш-хроматографии на силикагеле, используя градиент 0-50% этилацетат/гексан, в результате получали 2,8 г названного соединения в форме белого твердого вещества (60% выход); MS (m/z): 195[М+Н+]+. Этап 1. Способ 1.2. 3-Хлор-6-(1-метил-1 Н-пиразол-4-ил)пиридазин. Смесь 3,6-дихлорпиридазина (20,1 г, 135 ммоль), пинаколового эфира 1-метил-4-пиразолбороновой кислоты (25,46 г, 122 ммоль) и карбоната калия (50,7 г, 367 ммоль) в 1,4-диоксане (500 мл) и воде (200 мл) в атмосфере азота дегазировали, насыщая азотом в течение 15 мин. После чего добавляли дихлорбис-(трифенилфосфин)палладия(II) (1,2%, 1 г, 1,4 ммоль) и насыщали смесь азотом в течение следующих 10 мин. Реакционную смесь перемешивали при 90 С в течение 3 ч, затем охлаждали до комнатной температуры и концентрировали в вакууме для удаления большей части 1,4-диоксана. Остаток разделяли на части между 1 н. водным карбонатом калия (400 мл) и этилацетатом (400 мл), фазы разделяли. Водную фазу экстрагировали этилацетатом (2300 мл) и дихлорметаном (300 мл). Объединенные органические фазы промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток перемешивали в диэтиловом эфире (150 мл), оранжевый осадок фильтровали и сушили,в результате получали названное соединение (12,76 г, 65,6 ммоль, выход 54%). Фильтрат концентрировали на силикагеле и очищали путем флэш-хроматографии на силикагеле, используя градиент смеси этилацетат/гексан 0-50%, таким образом получали исходный 3,6-дихлорпиридазин в форме белого твердого вещества (9,9 г, 66,4 ммоль, выход 49%). Этап 2. [6-(1-Метил-1 Н-пиразол-4-ил)пиридазин-3-ил]гидразин. В суспензию 3-хлор-6-(1-метил-1 Н-пиразол-4-ил)пиридазина (1,0 г, 4,81 ммоль) в этаноле (20 мл) добавляли моногидрат гидразина (2,33 мл, 48 ммоль). Реакционную смесь перемешивали при 80 С в течение 3,5 ч, охлаждали до комнатной температуры и концентрировали в вакууме. Остаток растирали в 1 н. водном карбонате калия, фильтровали, промывали водой и сушили в вакууме, в результате получали 2 г названного соединения в форме бежевого твердого вещества (670 мг, выход 73%). 1 Н-ЯМР (ДМСОd6):3,92 (с, 3 Н), 4,28 (с, 1 Н) 7,02 (д, 1 Н), 7,59 (д, 1 Н), 7,84 (с, 1 Н), 7,90 (с, 1 Н), 8,19 (д, 1 Н); MS (m/z): 191 [М+Н+]+. Промежуточное соединение 16. 2-Бензотиазол-6-илпропионовая кислота Этап 1. Метиловый эфир бензотиазол-6-илуксусной кислоты. В перемешиваемый раствор бензотиазол-6-илуксусной кислоты (20,0 г, 103,6 ммоль) в 150 мл метанола при 0 С в атмосфере N2 по каплям добавляли SOCl2 (13,5 г, 114,0 ммоль). После перемешивания при комнатной температуре в течение 2 ч растворитель выпаривали и остаток разбавляли этилацетатом (150 мл). Смесь промывали насыщенным раствором карбоната натрия (100 мл 3) и солевым раствором (100 мл), затем концентрировали в вакууме. Остаток очищали путем колоночной хроматографии, проводили элюцию смесью этилацетат/петролейный эфир (1:5), в результате получали названное соединение в форме светло-желтого масла (15,0 г, 71,5%). Этап 2. Метиловый эфир 2-бензотиазол-6-илпропионовой кислоты. Раствор н-бутиллития (2,5 М в гексане, 27,0 мл) добавляли при перемешивании в раствор диизопропиламина (7,08 г, 70,0 ммоль) в безводном тетрагидрофуране (150 мл) и охлаждали до -30 С в атмосфере азота. Смесь перемешивали в течение 30 мин, реакционную смесь охлаждали до -78 С. К этому раствору добавляли раствор метилового эфира бензотиазол-6-илуксусной кислоты (10,4 г, 50,0 ммоль) в 10 мл тетрагидрофурана и гексаметилфосфорамида (13,5 г, 75,0 ммоль). Смесь перемешивали при -78 С в течение 2 ч до добавления раствора йодистого метила (10,2 г, 72,0 ммоль) в безводном тетрагидрофуране при -78 С. Смесь далее перемешивали в течение 2 ч при -78 С. Реакционную смесь медленно нагревали до комнатной температуры и разбавляли водным насыщенным раствором NH4Cl (200 мл). Смесь экстрагировали этилацетатом (2) и объединенные органические фазы промывали водой и солевым раствором, сушили над безводным сульфатом натрия и концентрировали, получали коричневое масло. Это масло очищали путем колоночной флэш-хроматографии, проводили элюцию петролейным эфиром и этилацетатом (10:1), в результате получали названное соединение в форме светло-желтого масла (4,5 г,40,5%). Этап 5. 2-Бензотиазол-6-илпропионовая кислота. Смесь метилового эфира 2-бензотиазол-6-илпропионовой кислоты (6,6 г, 30,0 ммоль) и водного 2 н.NaOH (23,0 мл) нагревали при температуре кипения с обратным холодильником в течение 1 ч до тех пор,пока реакционная смесь не станет раствором темно-красного цвета. Смесь затем охлаждали до комнатной температуры и смесь экстрагировали дихлорметаном (2), водную фазу подкисляли концентрированной соляной кислотой до рН 4-5. Полученное твердое вещество фильтровали, получали сырой продукт, который перемешивали в этилацетате, фильтровали и сушили в вакууме, в результате получали названное соединение (4,3 г, 69,2%) в форме грязно-белого твердого вещества. (300 МГц, ДМСО-d6): Этап 1. 6-Бром-8-метилхинолин. Смесь 10 г 4-бром-2-метиланилина, 3,3 г сульфата железа, 20,4 г глицерина, 4,06 г нитробензола и 11,5 мл концентрированной серной кислоты осторожно нагревали. После первой бурной реакции смесь кипятили в течение 3 ч при температуре кипения с обратным холодильником и затем выпаривали, удаляя нитробензол. В раствор добавляли насыщенный водный NaHCO3 и экстрагировали дихлорметаном, сушили Na2SO4 и концентрировали, в результате получали твердое вещество. Вещество очищали путем колоночной флэш-хроматографии, в результате получали названное соединение (9,5 г, 80%). 1 Н-ЯМР(80 ммоль) цинкового порошка. Смесь перемешивали при комнатной температуре в течение 20 мин. По каплям добавляли раствор 5,9 мл (40 ммоль) трет-бутил 2-бромацетата в 50 мл тетрагидрофурана. Смесь перемешивали при 42-45 С в течение 20 мин. Ее оставили охлаждаться до 25 С, в результате получали 76 мл 0,52 М раствора трет-бутилового реактива Реформатского. К 1,03 9 г 6-бром-8-метилхинолина добавляли раствор 20 мл свежеполученного реактива Реформатского, после чего добавляли 0,541 гPd(PPh3)4. Смесь помещали в микроволновый реактор, в течение 30 мин поддерживали температуру 120 С. Вышеописанную процедуру повторяли еще 4 раза. Объединенные реакционные смеси соединяли и очищали путем колоночной хроматографии, в результате получали названное соединение (3,5 г, 49%). 1H-ЯМР (CDCl3, 300 МГц):8,92 (м, 1 Н), 8,11 (м, 1 Н), 7,54 (с, 1 Н), 7,50 (с, 1 Н), 7,40 (с, 1 Н), 3,67 (с, 2 Н),2,81 (с, 3 Н), 1,46 (с, 9 Н). Этап 3. (8-Метилхинолин-6-ил)уксусная кислота. В течение 3 ч при температуре кипения с обратным холодильником 3,5 г трет-бутилового эфира (8 метилхинолин-6-ил)уксусной кислоты нагревали в 18 мл раствора 4 н. водного гидроксида натрия. Смесь промывали этилацетатом и водную фазу подкисляли 1 н. соляной кислотой до рН 4-5 и экстрагировали дихлорметаном. Растворитель выпаривали и полученное вещество промывали водой и сушили в вакууме,в результате получали названное соединение в форме грязно-белого твердого вещества (1,3 г, 48%). 1HЯМР (ДМСО-d6, 300 МГц):12,42 (с, 1 Н), 8,90 (м, 1 Н), 8,30 (м, 1 Н), 7,66 (с, 1 Н), 7,54 (м, 2 Н), 3,74 (с,2 Н), 2,70 (с, 3 Н). Промежуточное соединение 18. (8-Фторхинолин-6-ил)уксусная кислота Этап 1. 6-Бром-8-фторхинолин. Смесь 4-бром-2-фторанилина (12,825 г, 67,5 ммоль), 4,275 г сульфата железа, 25,46 г (20,2 мл) глицерина, 5,067 г (4,2 мл) нитробензола и 11,79 мл концентрированной серной кислоты осторожно нагревали. После первой энергичной реакции смесь кипятили в течение 7 ч. Нитробензол удаляли в вакууме. Добавляли воду. Водный раствор подкисляли ледяной уксусной кислотой, отделяли темно-коричневый осадок, который очищали путем флэш-хроматографии (силикагель, петролейный эфир/этилацетат равно 12/1), в результате получали названное соединение в форме белого твердого вещества (9,72 г, 63,7%). Этап 2. трет-Бутиловый эфир (8-фторхинолин-6-ил)уксусной кислоты. В атмосфере N2 к 20 мл тетрагидрофурана и 0,5 мл (3,9 ммоль) хлортриметилсилана добавляли 5,2 г(80 ммоль) цинкового порошка. Смесь перемешивали при комнатной температуре в течение 20 мин. По каплям добавляли раствор 5,9 мл (40 ммоль) трет-бутил 2-бромацетата в 50 мл тетрагидрофурана. Смесь перемешивали при 42-45 С в течение 20 мин. Ее оставили охлаждаться до 25 С, в результате получали 76 мл 0,52 М раствора трет-бутилового реактива Реформатского. В раствор 6-бром-8-фторхинолина (1,04 г, 4,6 ммоль) в 1 мл тетрагидрофурана добавляли раствор вышеназванного цинкового реактива (20 мл,10,4 ммоль), после чего добавляли Pd(PPh3)4 (0,58 г, 0,5 ммоль). Смесь помещали в микроволновый реактор, в течение 35 мин поддерживали температуру 120 С. Затем реакцию гасили насыщенным воднымNH4Cl (60 мл) и экстрагировали смесь этилацетатом. Органическую фазу сушили над безводным Na2SO4,фильтровали и концентрировали. Остаток очищали путем колоночной хроматографии, в результате получали названное соединение (0,78 г, 65%). Этап 3. (8-Фторхинолин-6-ил)уксусная кислота. В течение 3 ч 0,5 г трет-бутилового эфира (8-фторхинолин-6-ил)уксусной кислоты нагревали при 90 С с 2,0 мл раствора 4 н. водного гидроксида натрия. После охлаждения реакционную смесь экстрагировали этилацетатом. Водную фазу подкисляли уксусной кислотой, фильтровали, в результате получали(21,6 г, 107 ммоль) в 150 мл четыреххлористого углерода добавляли бром (34,4 г, 215 ммоль) и нагревали при температуре кипения с обратным холодильником в течение 4 ч. Реакционную смесь затем разбавляли 17,0 г пиридина и далее перемешивали в течение 2 ч при температуре кипения с обратным холодильником. После охлаждения до температуры окружающей среды смесь разделяли на части между дихлорметаном и насыщенным водным гидрокарбонатом натрия. Органическую фазу промывали водой, затем солевым раствором, сушили над сульфатом магния, затем выпаривали при пониженном давлении, получали коричневый остаток. Остаток очищали путем колоночной хроматографии с петролейным эфиром(60-90 С) и затем смешанным растворителем из петролейного эфира и этилацетата 30/1, в результате получали названное соединение (13,6 г, 45,3%) в форме белого кристаллического вещества. (300 МГц,ДМСО-d6):8,89 (д, 1 Н), 8,27 (д, 1 Н), 8,06 (д, 1 Н), 7,67-7,64 (м, 2 Н), 3,82 (с, 2 Н), 3,72 (с, 3 Н); ES-MS Смесь метилового эфира (3-бромхинолин-6-ил)уксусной кислоты (14,8 г, 52,8 ммоль) и водного 2 н.NaOH (80 мл, 160 ммоль) нагревали при температуре кипения с обратным холодильником в течение 1,5 ч, пока реакционная смесь не станет прозрачной. После охлаждения до комнатной температуры реакционную смесь промывали дихлорметаном, затем водную фазу подкисляли концентрированной соляной кислотой до рН 4. Белый осадок фильтровали, перемешивали в метаноле при температуре кипения с обратным холодильником, фильтровали и сушили в вакууме, в результате получали названное соединение в форме белого твердого вещества (10,3 г, 73,5%). (300 МГц, ДМСО-d6):12,52 (ушир., 1 Н), 8,91 (д, 1 Н),8,69 (д, 1 Н), 7,99 (д, 1 Н), 7,82-7,70 (м, 2 Н), 3,80 (с, 2 Н); ES-MS (m/z): 266 (М+Н+). Промежуточное соединение 21. 1-Этил-4-(4,4,5,5-тетраметил-[1,3,2]диоксоборолан-2-ил)-1 Нпиразол Этап 1. 3-(6-Хлорпиридазин-3-ил)бензонитрил. Газ азот пропускали через смесь 3-цианофенил бороновой кислоты (90,0 г, 612 ммоль), 3,6 дихлорпиридазина (1,2 экв., 109,4 г, 735 ммоль), карбоната калия (3,0 экв., 253,5 г, 1,836 моль) в 1,4 диоксане (900 мл) и воды (360 мл) в течение 15 мин. После этого времени добавляли дихлорметановый- 26016527 аддукт дихлор[1,1'-бис-(дифенилфосфино)ферроцен]палладия(II) (0,06 экв., 26,8 г, 36,7 ммоль). Газ азот пропускали через смесь в течение следующих 10 мин, затем смесь нагревали до 90 С в течение 3 ч. Реакцию охлаждали и большую часть 1,4-диоксана удаляли в вакууме. Смесь растворяли в дихлорметане и промывали водой три раза. Органическую фазу концентрировали и остаток очищали путем колоночной хроматографии, в результате получали названное соединение (60 г, выход 45,5%) в форме белого твердого вещества. 1H-ЯМР (300 МГц, ДМСО-d6):8,58-8,59 (м, 1 Н), 8,44-8,52 (м, 2 Н), 8,09-8,12 (д, 1 Н), 8,028,05 (д, 1 Н), 7,76-7,81 (м, 1 Н); MS (m/z): 216,1 (M1). Этап 2. 3-(6-Гидразинопиридазин-3-ил)бензонитрил. Раствор 3-(6-хлорпиридазин-3-ил)бензонитрила (75,6 г, 350 ммоль) в 900 мл сушеного пиридина охлаждали в ледяной бане и добавляли 119,2 мл гидрата гидразина. Охлаждение продолжали, чтобы удержать температуру ниже 30 С на время, за которое разделились желтые кристаллы. Смесь затем нагревали до 65 С и перемешивали в течение ночи. Затем смесь концентрировали, остаток промывали водой и метанолом, в результате получали названное соединение (60 г, 81%) в форме желтого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6):8,38-8,39 (м, 1 Н), 8,32-8,35 (м, 1 Н), 8,24 (с, 1 Н), 7,97-8,00 (д,1 Н), 7,82-7,85 (м, 1 Н), 7,64-7,69 (м, 1 Н), 7,09-7,12 (д, 1 Н), 4,39 (с, 2 Н); MS (m/z): 212,1 [M1]. Промежуточное соединение 25. 1-2-[4-(4,4,5,5-Тетраметил-[1,3,2]диоксоборолан-2-ил)пиразол-1 ил]этилпиперидин В микроволновый флакон на 5 мл добавляли 2 мл диметилформамида, в котором растворяли 150 мг(1,546 ммоль) 1-(2-хлорэтил)пиперидина реакционную смесь нагревали при 190 С в микроволновой печи(Personel Chemistry, Emrys Optimizer) в течение одного часа. Затем в реакционную смесь добавляли воду(5 мл) и экстрагировали этилацетатом (23 мл). Органические фазы объединяли и сушили над сульфатом натрия. Растворитель удаляли в вакууме, в результате получали названное соединение, которое использовали на следующем этапе без дальнейшей очистки. Промежуточное соединение 26. 2-Фтор-4-(6-гидразинопиридазин-3-ил)-N-метилбензамид Этап 1. 4-(6-Хлорпиридазин-3-ил)-2-фтор-N-метилбензамид. Газ азот пропускали через смесь 4-борнокисло-2-фтор-N-метилбензамида (50 г, 254 ммоль), 3,6 дихлорпиридазина (1,02 экв., 38,6 г, 259 ммоль), карбоната калия (3,0 экв., 105,2 г, 761 ммоль) в 1,4 диоксане (500 мл) и воде (200 мл) в течение 15 мин. После этого времени добавляли дихлорметановый аддукт дихлор[1,1'-бис-(дифенилфосфино)ферроцен]палладия(II) (0,06 экв., 15,0 ммоль, 11,0 г). Азот пропускали через смесь в течение следующих 10 мин, затем смесь нагревали до 90 С в течение 3 ч. Охлаждали и большую часть диоксана удаляли в вакууме. Смесь растворяли в дихлорметане и промывали водой три раза. Органическую фазу концентрировали, остаток очищали путем колоночной хроматографии, в результате получали названное соединение (27,1 г, выход 40%) в форме белого твердого вещества. 1 Н-ЯМР (300 МГц, CDCl3):(ч./млн):8,24-8,30 (м, 1 Н), 7,96-8,01 (м, 1 Н), 7,83-7,87 (м, 2 Н), 7,61-7,64 (д,1 Н), 6,80-6,84 (м, 1 Н), 3,06-3,08 (м, 3 Н); MS (m/z): 266,1 [M1] Этап 2. 2-Фтор-4-(6-гидразинопиридазин-3-ил)-N-метилбензамид. Раствор 34 г 4-(6-хлорпиридазин-3-ил)-2-фтор-N-метилбензамида (128 ммоль) в 500 мл сухого пиридина охлаждали на ледяной бане и добавляли 43,5 мл гидрата гидразина. Охлаждение продолжали так,чтобы удерживать температуру ниже 30 С на время, за которое отделялись желтые игольчатые кристаллы. Смесь затем нагревали до 65 С и перемешивали в течение суток. Смесь фильтровали и твердое вещество промывали водой и метанолом, в результате получали названное соединение (28,8 г, выход 84%) в форме светло-желтого твердого вещества. 1 Н-ЯМР (300 МГц, ДМСО-d6):(ч./млн) 8,27 (с, 2 Н), 7,96-7,99 В перемешиваемый раствор хинолин-6-илуксусной кислоты (21,6 г, 107 ммоль) в 150 мл четыреххлористого углерода добавляли бром (34,4 г, 215 ммоль) и нагревали при температуре кипения с обрат- 27016527 ным холодильником в течение 4 ч. Реакционную смесь затем разбавляли 17,0 г пиридина и далее перемешивали в течение 2 ч при температуре кипения с обратным холодильником. После охлаждения до температуры окружающей среды смесь разделяли на части между дихлорметаном и насыщенным водным гидрокарбонатом натрия. Органическую фазу промывали водой, затем солевым раствором, сушили над сульфатом магния, затем выпаривали при пониженном давлении, в результате получали коричневый остаток. Остаток очищали путем колоночной хроматографии с петролейным эфиром (60-90 С) и затем смешанным растворителем из петролейного эфира и этилацетата (30/1), в результате получали названное соединение (13,6 г, 45%) в форме белого кристаллического вещества. (300 МГц, ДМСО-d6): 8,89 (д, 1 Н),8,27 (д, 1 Н), 8,06 (д, 1 Н), 7,67-7,64 (м, 2 Н), 3,82 (с, 2 Н), 3,72 (с, 3 Н); ES-MS (m/z): 280 (М+Н+). Промежуточное соединение 28. Гидразид (3-бромхинолин-6-ил)уксусной кислоты В смесь (3-бромхинолин-6-ил)уксусной кислоты (5 г, 18,9 ммоль) в метаноле (100 мл) добавляли концентрированную серную кислоту (1 мл), смесь нагревали при температуре кипения с обратным холодильником в течение 16 ч. Нагрев убирали и добавляли сульфат натрия (20 г), смесь фильтровали. В фильтрат затем добавляли моногидрат гидразина (3,2 мл) и смесь нагревали при температуре кипения с обратным холодильником в течение следующих 16 ч. Затем смесь оставляли остывать до комнатной температуры, добавляли воду (60 мл), образовавшийся осадок собирали путем фильтрации и сушили, в результате получали названное соединение в форме белого твердого вещества (4,72 г, 16,9 ммоль, выход 90%). 1 Н-ЯМР 500 МГц (ДМСО-d6): 3,57 (2 Н, с), 4,26 (2 Н, д), 7,72 (1 Н, дд), 7,80 (1 Н, д), 7,97 (1 Н, д), 8,69 Смесь метилового эфира (3-бромхинолин-6-ил)уксусной кислоты (14,8 г, 52,8 ммоль) и водного 2 н.NaOH (80 мл, 160 ммоль) нагревали при температуре кипения с обратным холодильником в течение 1,5 ч, пока реакционная смесь не становилась прозрачной. После охлаждения до комнатной температуры реакционную смесь промывали дихлорметаном, затем водную фазу подкисляли концентрированной соляной кислотой до рН 4. Белый осадок отфильтровывали, перемешивали при температуре кипения с обратным холодильником с метанолом, фильтровали и сушили в вакууме, в результате получали названное соединение в форме белого твердого вещества (10,3 г, 74%). (300 МГц, ДМСО-d6): 12,52 (ушир., 1 Н), 8,91 В микроволновый флакон на 20 мл добавляли (3-бромхинолин-6-ил)уксусную кислоту (1 г, 3,77 ммоль), пинаколовый эфир 1-метил-4-пиразолбороновой кислоты и 1,4-диоксан (10 мл). Через смесь пропускали азот в течение 10 мин. Затем добавляли карбонат калия (1,56 г, 11,3 ммоль) и воду (5 мл) и пропускали через смесь азот в течение следующих 3 мин. После этого времени добавляли дихлор-бис(трифенилфосфин)палладий (138 мг, 0,19 ммоль), флакон закрывали и нагревали в микроволновой печи в течение 1250 с при 130 С. Смесь затем фильтровали через слой целита, который промывали водой и насыщенным водным бикарбонатом натрия. Из раствора в вакууме удаляли 1,4-диоксан, оставшийся водный раствор три раза промывали дихлорметаном. Водную фазу подкисляли до рН 6, используя 4 М соляную кислоту, образовавшийся осадок собирали путем фильтрации и сушили, в результате получали названное соединение в форме грязно-белого твердого вещества. (500 МГц, ДМСО-d6); ES-MS (m/z): 268 В раствор [3-(1-метил-1 Н-пиразол-4-ил)хинолин-6-ил]уксусной кислоты (2,4 г, 8,6 ммоль) и метанола (12 мл) при 0 С по каплям добавляли тионилхлорид (2 экв., 17,2 ммоль). Реакционную смесь затем нагревали до 60 С в течение одного часа. Растворитель удаляли в вакууме и использовали на следующем этапе без дальнейшей очистки. MS (m/z): 282 (М+Н+). Промежуточное соединение 32. Гидразид [3-(1-метил-1 Н-пиразол-4-ил)хинолин-6-ил]уксусной кислоты Раствор метилового эфира [3-(1-метил-1 Н-пиразол-4-ил)хинолин-6-ил]уксусной кислоты (8,6 ммоль) и гидразина (80,6 ммоль) в метаноле (75 мл) нагревали при 55 С в течение 1 ч, затем повторно добавляли гидразин (80,6 ммоль) и реакцию нагревали до 55 С в течение следующих 16 ч. После этого времени смесь охлаждали до 0 С и полученный осадок собирали путем фильтрации, промывали холодным метанолом и сушили, в результате получали названное соединение в форме белого твердого вещества (1,74 г, 70%). 1 Н-ЯМР 500 МГц (ДМСО-d6); ES-MS (m/z): 282 (М+Н+). Промежуточное соединение 33. Метиловый эфир (3-бром-5,7-дифторхинолин-6-ил)уксусной кислоты В раствор (5,7-дифторхинолин-6-ил)уксусной кислоты (18,6 г, 83,4 ммоль) в метаноле (200 мл) добавляли концентрированную H2SO4 (4,7 мл, 87,0 ммоль). Реакционную смесь концентрировали, в результате получали коричневый остаток, который разбавляли 200 мл этилацетата, промывали насыщенным водным NaHCO3 и солевым раствором, затем органическую фазу сушили над безводным Na2SO4 и концентрировали, получали метиловый эфир (7-фторхинолин-6-ил)уксусной кислоты в форме желтого твердого вещества (17,7 г, выход: 89,8%). Промежуточное соединение 34. (5,7-Дифторхинолин-6-ил)ацетилхлорид В высушенную в муфеле круглодонную колбу добавляли (5,7-дифторхинолин-6-ил)уксусную кислоту (1 г, 4,48 ммоль) и суспендировали в дихлорметане (18 мл). Суспензию оставляли в атмосфере азота и охлаждали до 0 С. После чего медленно добавляли оксалилхлорид (470 мкл, 5,38 ммоль), затем добавляли каталитическое количество диметилформамида. Раствор оставляли нагреваться до комнатной температуры в течение 2 ч. Раствор затем концентрировали в вакууме и сушили путем азеотропной дистилляции с толуолом, в результате получали названное соединение. ES-MS (m/z): 238 (М+Н+) для метилового эфира. Промежуточное соединение 35. (3-Бром-5,7-дифторхинолин-6-ил)уксусная кислота Этап 1. Получение метилового эфира (3-бром-5,7-дифторхинолин-6-ил)уксусной кислоты. В смесь метилового эфира (5,7-дифторхинолин-6-ил)уксусной кислоты (35,3 г, 148,9 ммоль) и пиридина (24 мл, 298 ммоль) в 300 мл четыреххлористого углерода по каплям добавляли бром (15,3 мл, 298 ммоль). Смесь нагревали при температуре кипения с обратным холодильником в течение 2 ч, после чего охлаждали до температуры окружающей среды. Жидкость декантировали из колбы и промывалиNaHCO3 и водой. Темное твердое вещество на дне колбы обрабатывали NaHCO3 и дихлорметаном. Объединенные органические фазы промывали водой, сушили (Na2SO4) и выпаривали до осушения. Сырой продукт очищали путем колоночной флэш-хроматографии, проводили элюцию смесью петролейный эфир/этилацетат (40/1-3/1), в результате получали 31,5 г (выход 67%) названного соединения в форме белого кристаллического вещества. 1 Н-ЯМР (ДМСО-d6):8,92 (д, 1 Н), 8,50 (д, 1 Н), 7,57-7,61 (м, 1 Н),3,91 (с, 2 Н), 3,75 (с, 3 Н). Этап 2. Получение (3-бром-5,7-дифторхинолин-6-ил)уксусной кислоты. Суспензию метилового эфира (3-бром-5,7-дифторхинолин-6-ил)уксусной кислоты (10,0 г, 31,6 ммоль) в 48 мл водного NaOH (2 н.) нагревали при температуре кипения с обратным холодильником в течение 2 ч, затем охлаждали до комнатной температуры. Смесь промывали дихлорметаном (50 мл 2) и водную фазу подкисляли 5 н. соляной кислотой до рН 4. Белый осадок собирали путем фильтрации, промывали водой и сушили. В результате получали 9,6 г названного соединение в форме белого порошка с получением 100%. 1H-ЯМР (ДМСО-d6):12,87 (с, 1 Н), 9,05 (с, 1 Н), 8,76 (с, 1 Н), 7,75-7,79 (д, 1 Н), 3,87 (с,2 Н). LC-MS: 303 (М 1). Промежуточное соединение 36. Метиловый эфир [5,7-дифтор-3-(1-метил-1 Н-пиразол-4 ил)хинолин-6-ил]уксусной кислоты В микроволновый флакон на 20 мл добавляли метиловый эфир (3-бром-2,4-дифторхинолин-6 ил)уксусной кислоты (1 г, 3,16 ммоль), 1-метил-4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-1 Н- 29
МПК / Метки
МПК: A61K 31/5025, A61K 31/53, C07D 487/04, C07D 519/00, A61P 35/00
Метки: модуляторы, триазолопиридазиновые, протеинкиназ
Код ссылки
<a href="https://eas.patents.su/30-16527-triazolopiridazinovye-modulyatory-proteinkinaz.html" rel="bookmark" title="База патентов Евразийского Союза">Триазолопиридазиновые модуляторы протеинкиназ</a>


































