Производные пиперазинила, предназначенные для лечения заболеваний, опосредованных рецептором gpr38
Номер патента: 15820
Опубликовано: 30.12.2011
Авторы: Митчелл Даррен Джейсон, Вестауэй Сьюзан Мари, Браун Саманта Луиза, Томпсон Мервин, Сил Джонатан Томас
Формула / Реферат
1. Соединение формулы (I) или его соль
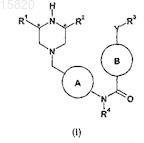
где
A означает фенил или пиридил, необязательно замещенные одним заместителем, выбранным из галогена, С(1-4)алкила и С(1-4)алкокси; и/или
R1 означает водород или метил; и/или
R2 означает водород или метил; и/или
R3 означает необязательно замещенный фенил, морфолинил или пиперидинил, оксадиазолил, пиридил, пиримидинил, имидазолил, пирролил; и/или
В означает необязательно замещенный фенил, пиперидинил, пиримидинил или пиридил; и/или
Y означает NH, О, СН2, С=O или связь; и/или
R4 означает водород, метил, этил, метоксиэтил или изопропил; и когда
R3 является замещенным, то он может быть замещен фтором, хлором, циано, CONH2, метилом, метокси или трифторметокси; и когда
В является замещенным, то он может быть замещен метилом.
2. Соединение по п.1, в котором R1 и R2означают группу, отличную от водорода, и атомы углерода пиперазина С* имеют 3R,5S-конфигурацию.
3. Соединение по п.1, которое представляет собой
6-(3-фторфенил)-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-3-пиридинкарбоксамид;
6-[(4-фторфенил)окси]-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-3-пиридинкарбоксамид;
1-(4-фторфенил)-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-4-пиперидинкарбоксамид;
6-(4-фторфенил)-N,2-диметил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-3-пиридинкарбоксамид;
6-(4-фторфенил)-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-3-пиридинкарбоксамид;
N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-6-(4-морфолинил)-3-пиридинкарбоксамид;
4'-фтор-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-4-бифенилкарбоксамид;
6-(4-фторфенил)-2-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-3-пиридинкарбоксамид;
1-[(3-фторфенил)карбонил]-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-4-пиперидинкарбоксамид;
1-[(3-фторфенил)метил]-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-4-пиперидинкарбоксамид;
1-(4-хлорфенил)-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-4-пиперидинкарбоксамид;
N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-6-(1-пиперидинил)-3-пиридинкарбоксамид;
6-(2-фторфенил)-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-3-пиридинкарбоксамид;
6-(2,4-дифторфенил)-N,2-диметил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-3-пиридинкарбоксамид;
6-(3,4-дифторфенил)-N,2-диметил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-3-пиридинкарбоксамид;
6-(3-фторфенил)-N,2-диметил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-3-пиридинкарбоксамид;
4-[(3-фторфенил)окси]-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)бензамид;
6-(3-цианофенил)-N,2-диметил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-3-пиридинкарбоксамид;
6-(4-цианофенил)-N,2-диметил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-3-пиридинкарбоксамид;
4-[(4-фторфенил)окси]-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)бензамид;
N-(4-{[(3R,5S)-3,5-диметил-1-пиперазинил]метил}фенил)-6-(4-фторфенил)-N,2-диметил-3-пиридинкарбоксамид;
2-[(4-фторфенил)окси]-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)бензамид;
N-(4-{[(3R,5S)-3,5-диметил-1-пйперазинил]метил}фенил)-6-(4-фторфенил)-N-метил-3-пиридинкарбоксамид;
4-[(2-фторфенил)окси]-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)бензамид;
3-[(4-фторфенил)окси]-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)бензамид;
3-[(3-фторфенил)окси]-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)бензамид;
6-[(4-фторфенил)амино]-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-3-пиридинкарбоксамид;
2-(4-фторфенил)-N,4-диметил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-5-пиримидинкарбоксамид;
2-(4-фторфенил)-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-5-пиримидинкарбоксамид;
6-(4-фторфенил)-N,2-диметил-N-(4-{[(3R)-3-метил-1-пиперазинил]метил}фенил)-3-пиридинкарбоксамид;
6-(4-фторфенил)-N-метил-N-(4-{[(3R)-3-метил-1-пиперазинил]метил}фенил)-3-пиридинкарбоксамид;
4'-фтор-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-3-бифенилкарбоксамид;
4'-фтор-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-2-бифенилкарбоксамид;
6-(2-цианофенил)-N,2-диметил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-3-пиридинкарбоксамид;
6-(3-фторфенил)-N-метил-N-[4-(1-пиперазинилметил)фенил]-3-пиридинкарбоксамид;
6-[(3-фторфенил)окси]-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-3-пиридинкарбоксамид;
6-[(2-фторфенил)окси]-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-3-пиридинкарбоксамид;
6-(3-фторфенил)-N,2-диметил-N-[4-(1-пиперазинилметил)фенил]-3-пиридинкарбоксамид;
6-[2-(аминокарбонил)фенил]-N,2-диметил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-3-пиридинкарбоксамид;
6-(3-фторфенил)-N-метил-N-(3-метил-4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-3-пиридинкарбоксамид;
6-(3-цианофенил)-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-3-пиридинкарбоксамид;
6-(2-цианофенил)-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-3-пиридинкарбоксамид;
6-[(3-цианофенил)окси]-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-3-пиридинкарбоксамид;
N-(2-фтор-4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-6-(3-фторфенил)-N-метил-3-пиридинкарбоксамид;
5-[(4-фторфенил)окси]-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-2-пиридинкарбоксамид;
5-[(3-фторфенил)окси]-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-2-пиридинкарбоксамид;
N-(2-фтор-4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-6-[(4-фторфенил)окси]-N-метил-3-пиридинкарбоксамид;
5-[(3-цианофенил)окси]-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-2-пиридинкарбоксамид;
5-[(4-фторфенил)амино]-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-2-пиридинкарбоксамид;
1-[(3,4-дифторфенил)метил]-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-4-пиперидинкарбоксамид;
1-[(4-фторфенил)метил]-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-4-пиперидинкарбоксамид;
N-(3-фтор-4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-6-(3-фторфенил)-N-метил-3-пиридинкарбоксамид;
N-(3-фтор-4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-6-[(4-фторфенил)окси]-N-метил-3-пиридинкарбоксамид;
1-[(3-цианофенил)метил]-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-4-пиперидинкарбоксамид;
1-[(4-цианофенил)метил]-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-4-пиперидинкарбоксамид;
6-(3-фторфенил)-N-(1-метилэтил)-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-3-пиридинкарбоксамид;
N-этил-6-(3-фторфенил)-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-3-пиридинкарбоксамид;
6-(3-фторфенил)-N-[2-(метилокси)этил]-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-3-пиридинкарбоксамид;
6-[(4-фторфенил)окси]-N-метил-N-(3-метил-4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-3-пиридинкарбоксамид;
6-(3-фторфенил)-N-метил-N-(5-{[(3S)-3-метил-1-пиперазинил]метил}-2-пиридинил)-3-пиридинкарбоксамид;
6-[(4-фторфенил)окси]-N-метил-N-(5-{[(3S)-3-метил-1-пиперазинил]метил}-2-пиридинил)-3-пиридинкарбоксамид;
6-[(4-фторфенил)окси]-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-2-пиридинкарбоксамид;
6-(4-фтор-1-пиперидинил)-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-3-пиридинкарбоксамид;
6-(3-фторфенил)-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-2-пиридинкарбоксамид;
N-метил-4-(3-метил-1,2,4-оксадиазол-5-ил)-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)бензамид;
N-этил-6-[(4-фторфенил)окси]-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-3-пиридинкарбоксамид;
N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-6-(3-пиридинилокси)-3-пиридинкарбоксамид;
6-[(3-фторфенил)окси]-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-2-пиридинкарбоксамид;
6-(4,4-дифтор-1-пиперидинил)-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-3-пиридинкарбоксамид;
6-[(4-фторфенил)окси]-N-метил-N-(6-{[(3S)-3-метил-1-пиперазинил]метил}-3-пиридинил)-3-пиридинкарбоксамид;
5-(4-фторфенил)-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-2-пиридинкарбоксамид;
5-(3-цианофенил)-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-2-пиридинкарбоксамид;
N-метил-5-[3-(метилокси)фенил]-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-2-пиридинкарбоксамид;
N-метил-5-[4-(метилокси)фенил]-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-2-пиридинкарбоксамид;
5-(3-фторфенил)-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-2-пиридинкарбоксамид;
6-[(4-фторфенил)окси]-N-метил-N-(4-метил-5-{[(3S)-3-метил-1-пиперазинил]метил}-2-пиридинил)-3-пиридинкарбоксамид;
6-(4-фторфенил)-N-метил-N-(6-{[(3S)-3-метил-1-пиперазинил]метил}-3-пиридинил)-3-пиридинкарбоксамид;
N,2'-диметил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-3,4'-бипиридин-6-карбоксамид;
6-[(4-фторфенил)окси]-N-[2-(метилокси)этил]-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-3-пиридинкарбоксамид;
N-(3-хлор-4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-6-[(4-фторфенил)окси]-N-метил-3-пиридинкарбоксамид;
N,2'-диметил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-2,4'-бипиридин-5-карбоксамид;
N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-4-(2-пиридинил)бензамид;
N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-4-(2-пиримидинил)бензамид;
N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-4-(1Н-пиразол-1-ил)бензамид;
N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-6-(1H-пиррол-1-ил)-3-пиридинкарбоксамид;
N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-4-{[4-(трифторметил)фенил]карбонил}бензамид
или его соль.
4. Соединение по п.1, которое представляет собой 6-[(4-фторфенил)окси]-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-3-пиридинкарбоксамид или его соль.
5. Соединение по п.1, которое представляет собой фумаратную соль 6-[(4-фторфенил)окси]-N-метил-N-(4-{[(3S)-3-метил-1-пиперазинил]метил}фенил)-3-пиридинкарбоксамида.
6. Соединение по п.1, которое представляет собой 6-[(4-фторфенил)окси]-N-метил-N-(4-метил-5-{[(3S)-3-метил-1-пиперазинил]метил}-2-пиридинил)-3-пиридинкарбоксамид или его соль.
7. Применение соединения по любому из пп.1-6 в качестве терапевтического вещества.
8. Применение соединения по любому из пп.1-6 или его фармацевтически приемлемой соли при лечении состояний или расстройств, опосредованных рецептором GPR38.
9. Применение соединения по любому из пп.1-6 или его фармацевтически приемлемой соли при лечении состояния или расстройства, такого как расстройства, связанные с гастроэзофагеальным рефлюксом, функциональная диспепсия, синдром раздраженного кишечника, запор, псевдонепроходимость кишечника, паралитическая кишечная непроходимость после хирургической операции или другой процедуры, рвота, желудочный стаз или гипокинезия, вызванная различными заболеваниями, такими как диабет, и/или введением других лекарственных средств или энтеральным питанием пациентов, болезнь Крона, колит, кахексия, ассоциированная с заболеваниями на поздних стадиях, такими как злокачественная опухоль и/или ее лечение, кахексия, связанная с аппетитом/метаболизмом, и другие расстройства, такие как недержание.
10. Применение соединения по любому из пп.1-6 или его фармацевтически приемлемой соли для получения лекарственного средства для лечения состояний или расстройств, опосредованных рецептором GPR38.
11. Применение по п.10, в котором состояния или расстройства представляют собой расстройства, связанные с гастроэзофагеальным рефлюксом, функциональную диспепсию, синдром раздраженного кишечника, запор, псевдонепроходимость кишечника, паралитическую кишечную непроходимость после хирургической операции или другой процедуры, рвоту, желудочный стаз или гипокинезию, вызванную различными заболеваниями, такими как диабет, и/или введением других лекарственных средств или энтеральным питанием пациентов, болезнь Крона, колит, кахексию, ассоциированную с заболеваниями на поздних стадиях, такими как злокачественная опухоль и/или ее лечение, кахексию, связанную с аппетитом/метаболизмом, и другие расстройства, такие как недержание.
12. Способ лечения состояния или расстройства, опосредованного рецептором GPR38, включающий введение пациенту терапевтически безопасного и эффективного количества соединения по любому из пп.1-6 или его фармацевтически приемлемой соли.
13. Фармацевтическая композиция, содержащая эффективное количество соединения по любому из пп.1-6 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель или эксципиент.
14. Способ получения фармацевтической композиции по п.13, включающий смешивание соединения по п.1 или его фармацевтически приемлемой соли с фармацевтически приемлемым носителем или эксципиентом.
15. Способ получения соединения формулы (I) по п.1 или его соли путем взаимодействия соединения формулы (II)
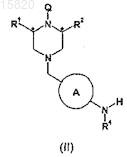
где R1, R2, А и R4имеют значения, которые определены выше, и Q означает водород или подходящую защитную группу азота, с соединением формулы R3-Y-B-C(=O)-L1, где R3, В и Y имеют значения, которые определены выше, и L1 означает удаляемую группу, в условиях, подходящих для образования амидной связи.
16. Способ получения соединения формулы (I) по п.1 или его соли путем взаимодействия соединения формулы (VIII)
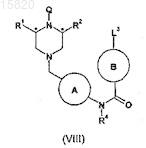
где R1, R2, R4, А, В и Q имеют значения, которые определены выше, и L3означает удаляемую группу, с соединением формулы M1-Y-R3, где R3 и Y имеют значения, которые определены в п.1, и M1 означает водород или содержащий металл остаток, необязательно в присутствии подходящего основания и необязательно с использованием подходящей системы катализаторов на основе переходного металла, и с последующим в случае необходимости осуществлением одной или нескольких следующих реакций:
a) превращение одного соединения формулы (I) в другое соединение формулы (I);
b) удаление любой из присутствующих защитных групп;
c) образование подходящей фармацевтически приемлемой соли или сольвата полученного соединения.
Текст
Дата публикации и выдачи патента Номер заявки ПРОИЗВОДНЫЕ ПИПЕРАЗИНИЛА, ПРЕДНАЗНАЧЕННЫЕ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ОПОСРЕДОВАННЫХ РЕЦЕПТОРОМ GPR38 Изобретение относится к соединениям формулы (I), способам их получения, фармацевтическим композициям, содержащим такие соединения, и к их применению для лечения состояний или расстройств, которые опосредованы рецептором GRP38. Митчелл Даррен Джейсон, Сил Джонатан Томас, Томпсон Мервин,Вестауэй Сьюзан Мари, Браун Саманта Луиза (GB) Медведев В.Н. (RU)(71)(73) Заявитель и патентовладелец: ГЛЭКСО ГРУП ЛИМИТЕД (GB) 015820 Настоящее изобретение относится к новым производным бензилпиперазина, обладающим фармакологической активностью, способам их получения, содержащим их фармацевтическим композициям и их применению для лечения различных расстройств.GPR38 является рецептором, содержащим 7 трансмембранных доменов и сопряженным с G-белком,имеющим высокую аффинность по отношению к пептиду мотилину [Feighner et al., Science 1999, 284,2184], что свидетельствует о том, что эндогенный мотилин проявляет всю или большую часть своей активности через указанный рецептор. Мотилин представляет собой пептид, состоящий из 22 аминокислот, обнаруженный в больших количествах в эндокриноподобных клетках желудочно-кишечного тракта, и особенно в области двенадцатиперстной и тощей кишки. Известно, что при голодании пептид ассоциирован с появлением фазы III активности мигрирующего комплекса в желудке [Boivin et al., Dig. Dis. Sci. 1992, 37, 1562], что свидетельствует о его роли в механизмах прокинетической активности. Мотилин также высвобождается из кишки во время приема пищи, мнимого кормления, растяжения желудка или при оральном или внутривенном потреблении питательных веществ [Christofides et al., Gut 1979, 20, 102; Bormans et al., Scand. J.Gastroenterol. 1987, 22, 781], что свидетельствует о дополнительной роли указанного пептида в модулировании картины моторики во время приема пищи. Как известно, у животных или человека мотилин усиливает моторику пищеварительного тракта и стимулирует опорожнение желудка и пропульсию в кишечнике в направлении к анальному отверстию,как во время голодания, так и в условиях приема пищи. Считают, что такая активность, главным образом, возникает благодаря, по меньшей мере, холинергической функции возбуждения кишечника [VanAssche et al. , Eur. J. Pharmacol. 1997, 337, 267], вероятно также с вовлечением активации блуждающего нерва [Mathis and Malbert, Am. J. Physiol. 1998, 274, G80]. Кроме того, более высокие концентрации мотилина непосредственно вызывают небольшое сокращение мышцы [Van Assche et al., Eur. J. Pharmacol. 1997, 337, 267]. Показано, что антибиотик эритромицин имитирует желудочно-кишечную активность мотилина в дополнение к его ранее описанным свойствам в качестве антибиотика [см. Peeters, in Problems of the Gastrointestinal Tract in Anaesthesia Ed., Herbert MK et al. Springer-Verlag, Berlin, Heidelberg 1999, pp 39-51]. Позже было показано, что эритромицин активирует рецептор GPR38, что подтверждает его способность имитировать мотилин [Carreras et al., Analyt. Biochem. 2002, 300, 146]. Кроме того, доступность такого непептидного агониста рецептора мотилина позволила предпринять, по меньшей мере, некоторые клинические исследования, чтобы исследовать клинические возможности агонистов рецептора мотилина. Такие исследования соответственно показали возможность усиливать опорожнение желудка при разных состояниях, связанных с парезом желудка, таким как функциональная диспепсия и диабетический парез желудка. Кроме того, показано, что эритромицин увеличивает давление нижнего сфинктера пищевода у человека, что наряду с усилением опорожнения желудка свидетельствует о роли в лечении расстройств,связанных с гастроэзофагеальным рефлюксом (GERD). Наконец эритромицин использовали для стимуляции пропульсивной активности кишечника, которая клинически применима при лечении псевдонепроходимости и состояний нарушения моторики ободочной кишки [Peeters, in Problems of the GastrointestinalTract in Anaesthesia Ed., Herbert MK et al. Springer-Verlag, Berlin, Heidelberg 1999, pp.39-51]. Поэтому предполагается, что агонисты рецептора GPR38 будут имитировать активность мотилина или других веществ, действующих на такой рецептор, таких как эритромицин, и найдут клиническое применение при лечении желудочно-кишечных расстройств, связанных с гипокинезией, особенно функциональных расстройств кишечника, таких как GERD, функциональная диспепсия (FD) и синдром раздраженной кишки (IBS). Соединения также будут применимы для лечения других состояний GI, когда причина известна, и в случае которых снижена моторика GI. Такие состояния включают констипацию,вызванную различными заболеваниями, такими как заболевания, ассоциированные с нейропатией, и/или введением других лекарственных средств, псевдонепроходимость кишечника, паралитическую кишечную непроходимость после операции или некоторых других процедур, желудочный стаз или гипокинезию, вызванную различными заболеваниями, такими как диабет, и/или введением других лекарственных средств или энтеральным питанием пациентов. Интересно, что способность мотилина или эритромицина активировать блуждающий нерв, ассоциация указанного нерва с изменениями в пищевом поведении [например, Furness et al., Auton. Neurosci. 2001, 92, 28] и положение GPR38 в хромосоме [на основании Ensembl: 13q21.1 (58.46-59.46 м.о.)] в маркерах (от D13S257-13ql4.11 до D13S258 в 13q21.33) локуса, ассоциированного с ожирением [Feitosa et al., Am. J. Hum. Genet. 2002, 70, 72] также свидетельствуют о том,что агонисты, активные по отношению к рецептору GPR38, кроме стимулирования моторики пищеварительного тракта будут способствовать улучшению пищевого поведения, по меньшей мере, у тех пациентов, у которых имеет место некоторая степень подавления аппетита или кахексия. Такая активность свидетельствует о том, что агонисты указанного рецептора могут найти клиническое применение при лечении симптомов, связанных, например, с лечением злокачественной опухоли или с наличием злокачественной опухоли как таковой. Кроме способности агонистов рецептора мотилина стимулировать моторику пищеварительного тракта, ассоциация полиморфизма гена мотилина с болезнью Крона [Annese et al., Dig. Dis. Sci. 1998, 43,-1 015820 715-710] и изменения плотности рецепторов мотилина во время колита [Depoortere et al., Neurogastroenterol. Motil. 2001, 13, 55] свидетельствуют о применимости агонистов рецептора мотилина для лечения воспалительных состояний кишечника, в общем. Наконец, GPR38 также обнаружен в областях вне пищеварительного тракта. Такие области включают гипофиз, жировую ткань, мочевой пузырь и некоторые области головного мозга. Первое свидетельствует о клинической применимости для стимулирования функции гипофиза, например высвобождения стимуляторов секреции гормона роста, присутствие в жировой ткани свидетельствует о роли в регуляции массы тела и присутствие в мочевом пузыре свидетельствует о роли агонистов указанного рецептора в лечении недержания. Присутствие GPR38 в головном мозге подтверждает уже указанную применимость по отношению к желудочно-кишечному тракту и питанию, но кроме того, свидетельствует об участии рецептора в более широком спектре функция блуждающего нерва - гипоталамуса. В WO9410185, ЕР 838469, WO9823629, DE19805822 и US6165985 описаны производные эритромицина, направленные к GPR38, для применения при расстройствах, связанных с моторикой желудочнокишечного тракта. В WO9921846, WO0185694, WO0168620, WO0168621 и WO0168622 раскрыта серия низкомолекулярных антагонистов рецептора GPR38. В JP07138284 и ЕР 807639 описаны пептидные агонисты. В JP09249620, WO02092592, WO05027637, US2005065156 и Li et al., (2004, Journal of MedicinalChemistry, 47(7) p.1704-1708) описана серия низкомолекулярных агонистов. В WO 05012331 и WO 05012332 описаны макроциклические соединения, которые являются агонистами или антагонистами рецепторов мотилина или грелина млекопитающих. В WO 06127252 описаны производные эритромицина. В WO 07/007018 описаны соединения формулы (А), которые обладают активностью агонистов рецептора GPR38 В WO07/012479 описаны соединения формулы (В), которые обладают активностью агонистов рецептора GPR38 В настоящее время обнаружен структурно новый класс соединений, которые представляют собой агонисты рецептора GPR38. Таким образом, настоящее изобретение относится к соединениям формулы (I) и их солям (в дальнейшем называемым соединениями согласно изобретению) где А означает фенил или пиридил, необязательно замещенные одним заместителем, выбранным из галогена, C(1-4)алкила и С(1-4)алкокси; и/илиR1 означает водород или метил; и/илиR2 означает водород или метил; и/илиR3 означает необязательно замещенный фенил, морфолинил или пиперидинил, оксадиазолил, пиридил, пиримидинил, имидазолил, пирролил; и/или В означает необязательно замещенный фенил, пиперидинил, пиримидинил или пиридил; и/илиR3 является замещенным, то он может быть замещен фтором, хлором, циано, CONH2, метилом, метокси или трифторметокси; и когда В является замещенным, то он может быть замещен метилом. В одном варианте осуществления R1 и R2 означают группу, отличную от водорода, и атомы углерода пиперазина С имеют 3R,5S-конфигурацию. Должно быть понятно, что настоящее изобретение охватывает все комбинации групп заместителей,описанных выше. В следующем варианте осуществления изобретения группа (пиперазинил)метилена и группа [N(R4)-C(=O)-B-Y-R3] находятся в пара-положении относительно друг друга и по отношению к циклу А, и в том случае, когда В представляет собой необязательно замещенный фенил или пиридил, группа [(пиперазинил)метилен-А-N(R4)-C(=O)-] и группа [-Y-R3] находятся в пара- или мета-положении относительно друг друга и по отношению к циклу В. В некоторых соединениях формулы (I) в зависимости от природы заместителя имеются хиральные атомы углерода, такие как атом углерода, отмеченный , и поэтому соединения формулы (I) могут существовать в виде стереоизомеров. Изобретение охватывает все оптические изомеры, такие как стереоизомерные формы соединений формулы (I), включая энантиомеры, диастереоизомеры и их смеси, такие как рацематы. Разные стереоизомерные формы могут быть разделены или отделены друг от друга обычными способами, или любой данный изомер может быть получен обычными способами стереоселективного или асимметричного синтеза. Предпочтительными соединениями формулы (I), в которых оба радикала R1 и R2 являются метилом, являются такие соединения, в которых атомы углерода С пиперазина имеют 3R,5S-конфигурацию. Предпочтительными соединениями формулы (I), в которых один из радикалов R1 и R2 является метилом, а другой представляет собой водород, являются такие соединения, в которых атом углерода С пиперазина имеет S-конфигурацию. Некоторые соединения, предлагаемые в изобретении, могут существовать в различных таутомерных формах, и следует понимать, что изобретение охватывает все такие таутомерные формы. Подходящими соединениями согласно изобретению являются 6-(3-фторфенил)-N-метил-N-(4-[(3S)-3-метил-1-пиперазинил]метилфенил)-3-пиридинкарбоксамид (Е 1); 6-[(4-фторфенил)окси]-N-метил-N-(4-[(3S)-3-метил-1-пиперазинил]метилфенил)-3-пиридинкарбоксамид (Е 2); 1-(4-фторфенил)-N-метил-N-(4-[(3S)-3-метил-1-пиперазинил]метилфенил)-4-пиперидинкарбоксамид (Е 3); 6-(4-фторфенил)-N,2-диметил-N-(4-[(3S)-3-метил-1-пиперазинил]метилфенил)-3-пиридинкарбоксамид (Е 4); 6-(4-фторфенил)-N-метил-N-(4-[(3S)-3-метил-1-пиперазинил]метилфенил)-3-пиридинкарбоксамид (Е 5);N-метил-N-(4-[(3S)-3-метил-1-пиперазинил]метилфенил)-4-(2-пиразинил)бензамид (Е 90); 6-(4-фторфенил)-N-метил-N-(5-[(3S)-3-метил-1-пиперазинил]метил-2-пиридинил)-2-пиридинкарбоксамид (Е 91); 6-(3-фторфенил)-K-метил-K-(5-[(3S)-3-метил-1-пиперазинил]метил-2-пиридинил)-2-пиридинкарбоксамид (Е 92); 2-[(3-фторфенил)окси]-N-метил-N-(4-[(3S)-3-метил-1-пиперазинил]метилфенил)бензамид (Е 93); и их соли. Одним вариантом осуществления изобретения является 6-[(4-фторфенил)окси]-N-метил-N-(4[(3S)-3-метил-1-пиперазинил]метилфенил)-3-пиридинкарбоксамид или его соль. Следующим вариантом осуществления изобретения является фумаратная соль 6-[(4 фторфенил)окси]-N-метил-N-(4-[(3S)-3-метил-1-пиперазинил]метилфенил)-3-пиридинкарбоксамида. Одним вариантом осуществления изобретения является 6-[(4-фторфенил)окси]-N-метил-N-(4 метил-5-[(3S)-3-метил-1-пиперазинил]метил-2-пиридинил)-3-пиридинкарбоксамид или его соль . В объем термина соединения согласно изобретению включены все соли, сольваты, гидраты, комплексы, полиморфы, пролекарства, радиоактивно меченные производные, стереоизомеры и оптические изомеры соединений формулы (I). Соединения формулы (I) могут образовывать кислотно-аддитивные соли. Будет понятно, что для применения в медицине соли соединений формулы (I) должны быть фармацевтически приемлемыми. Подходящие фармацевтически приемлемые соли будут очевидны для специалистов в данной области и включают соли, описанные в J. Pharm. Sci., 1977, 66, 1-19, такие как кислотно-аддитивные соли, образованные с неорганическими кислотами, например, хлористо-водородной, бромисто-водородной, серной,азотной или фосфорной кислотой; и органическими кислотами, например, янтарной, малеиновой, уксусной, фумаровой, лимонной, винной, бензойной, п-толуолсульфоновой, метансульфоновой или нафталинсульфоновой кислотой. Некоторые соединения формулы (I) могут образовывать кислотно-аддитивные соли с одним или несколькими эквивалентами кислоты. В объем настоящего изобретения включены все возможные стехиометрические и нестехиометрические формы. Соединения формулы (I) и их соли могут быть получены в кристаллической или некристаллической форме, и в случае кристаллической формы необязательно могут быть гидратированы или сольватированы. В объем настоящего изобретения включены стехиометрические гидраты или сольваты, а также соединения, содержащие разные количества воды и/или растворителя. Соли и сольваты, имеющие фармацевтически неприемлемые противоионы или ассоциированные растворители, входят в объем настоящего изобретения, например, для применения в качестве промежуточных продуктов при получении других соединений формулы (I) и их фармацевтически приемлемых солей. Кроме того, соединения формулы (I) могут быть введены в виде пролекарств. В используемом в настоящем изобретении смысле пролекарство соединения формулы (I) представляет собой производное соединения, которое при введении пациенту, в конечном счете высвобождает соединение формулы (I) invivo. Введение соединения формулы (I) в виде пролекарства может позволить специалистам получить один или несколько из следующих результатов: (а) модифицировать начало действия соединения in vivo;(b) модифицировать продолжительность действия соединения in vivo; (с) модифицировать транспорт или распределение соединения in vivo; (d) модифицировать растворимость соединения in vivo; и (е) преодолеть побочный эффект или другие трудности, с которыми сталкиваются при введении соединения. Типичные функциональные производные, используемые для получения пролекарств, включают модификации соединения, которые химически или ферментативно отщепляются in vivo. Такие модификации, которые включают получение фосфатов, амидов, сложных эфиров, сложных тиоэфиров, карбонатов и карбаматов, хорошо известны специалистам в данной области. В объем изобретения также включены меченные изотопами соединения, которые идентичны соединениям, описанным в настоящей публикации, но с учетом того, что один или несколько атомов заменены атомом, имеющим другую атомную массу или массовое число, отличные от атомных масс или массового числа, обычно встречающихся в природе. Примеры изотопов, которые могут быть включены соединения согласно изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора, йода и хлора, такие как 3 Н, 11C, 14 С, 18F, 123I и 125I. Соединения согласно изобретению, которые содержат указанные выше изотопы и/или другие изотопы других атомов, входят в объем настоящего изобретения. Меченые изотопами соединения согласно настоящему изобретению, например, соединения, в которые включены такие радиоактивные изотопы, как 3 Н, 14 С, применимы в анализах тканевого распределения лекарственного средства и/или субстрата. Изотопы тритий, т.е. 3 Н, и углерод-14, т.е. 14 С, являются особенно предпочтительными вследствие простоты их получения и возможности их регистрации. Изотопы 11 С и l8F особенно применимы в PET (позитронной эмиссионной томографии);, и изотопы 125I особенно применимы в SPECT (однофотонной эмиссионной компьютерной томографии), которые используют-6 015820 для визуализации головного мозга. Кроме того, замена более тяжелыми изотопами, такими как дейтерий,т.е. 2 Н, может давать некоторые терапевтические преимущества в результате более высокой метаболической стабильности, например, повышенное время полужизни in vivo или сниженные потребности в дозах, и, следовательно, в некоторых случаях могут быть предпочтительными. Меченные изотопами соединения согласно изобретению в общем могут быть получены способами, описанными на схемах и/или в примерах ниже, с последующей заменой не меченого изотопом реагента легко доступным меченным изотопом реагентом. В следующем аспекте настоящее изобретение относится к получению соединения формулы (I) которое определено выше, или его соли, и такой способ заключается в осуществлении взаимодействия соединения формулы (II) где R1, R2, А и R4 имеют значения, которые определены выше, и Q означает водород или подходящую защитную группу азота, такую как трет-бутилоксикарбонил (Boc) или бензилоксикарбонил (Cbz), и соединения формулы R3-Y-B-C(=O)-L1, где R3, В и Y имеют значения, которые определены выше, и L1 означает удаляемую группу, такую как галоген, алканоилокси или сульфонилокси, с использованием условий, подходящих для образования амидной связи. Например, в том случае, когда L1 означает галоген, реакцию можно осуществить, используя подходящее основание, такое как триэтиламин, в инертном растворителе, таком как дихлорметан. И затем необязательно осуществляют одну или несколько из следующих реакций:a) превращение одного соединения формулы (I) в другое соединение формулы (I);c) образование подходящей фармацевтически приемлемой соли или сольвата полученного таким образом соединения. Альтернативно соединение формулы (I), которое определено выше, или его соль, могут быть получены способом, который заключается в осуществлении взаимодействия соединения формулы (II), которое определено выше, с соединением формулы R3-Y-B-С(=О)-ОН, где R3, В и Y имеют значения, которые определены выше, в присутствии подходящего связывающего реагента, такого как N, N'дициклогексилкарбодиимид (DCC), N-бензил-N'-циклогексилкарбодиимидная смола или 1-(3 диметиламинопропил)-3-этилкарбодиимид(EDC); необязательно в присутствии 1 гидроксибензотриазола (HOBt); в подходящем растворителе, таком как дихлорметан, диметилформамид или их смеси. И затем необязательно осуществляют одну или несколько из следующих реакций:a) превращение одного соединения формулы (I) в другое соединение формулы (I);b) удаление любой защитной группы;c) образование подходящей фармацевтически приемлемой соли или сольвата полученного таким образом соединения. Соединения формулы (II), где А означает группу 1,4-фенилена, могут быть получены в результате взаимодействия соединения формулы (III) где R1 и R2 имеют значения, которые определены выше, R7 означает один заместитель, выбранный из галогена, С 1-4 алкила и С 1-4 алкокси, и Q означает водород или подходящую защитную группу азота,такую как трет-бутилоксикарбонил (Boc) или бензилоксикарбонил (Cbz), с соответствующим альдегидом, кетоном или еноловым эфиром, с получением R4, используя условия, подходящие для восстановительного аминирования; например в присутствии подходящего восстановителя, такого как боргидрид натрия, и в подходящем растворителе, таком как метанол, и необязательно в присутствии подходящего основания, такого как метоксид натрия. Соединения формулы (III) могут быть получены в результате взаимодействия соединения формулы где R1, R2, R7 и Q имеют значения, которые определены выше, используя условия, подходящие для восстановления; например, в том случае, когда Q означает Boc, гидрирование в присутствии подходящего катализатора, такого как палладий-на-угле или платина-на-угле, в подходящем растворителе, таком как метанол, и необязательно в присутствии подходящего основания, такого как гидроксид калия или триэтиламин. Альтернативно, когда Q означает Boc или Cbz, восстановление можно осуществлять с использованием подходящего металлического восстановителя, такого как порошок железа, в присутствии подходящего источника протонов, такого как хлорид аммония, и в подходящем растворителе, таком как водный раствор метанола. Соединения формулы (IV) могут быть получены в результате взаимодействия соединения формулы (V) где R1, R2 и Q имеют значения, которые определены выше, используя условия реакции, подходящие для восстановительного аминирования, например, в присутствии восстановителя, такого как три(ацетокси)боргидрид натрия, в подходящем растворителе, таком как дихлорметан или 1,2 дихлорэтан. Альтернативно соединения формулы (IV) могут быть получены в результате взаимодействия соединения формулы (VII) где R7 имеет значение, определенное выше, и L2 означает удаляемую группу, такую как галоген, ал-8 015820 килсульфонилокси или арилсульфонилокси, с соединением формулы (VI), которое определено выше,используя условия, подходящие для реакции алкилирования, например, используя подходящий растворитель, такой как N,N-диметилформамид, и подходящее основание, такое как основание Хенига. Соединения формулы (VII) коммерчески доступны или могут быть получены способами, сходными со способами, описанными в литературе (см., например WO 03/053972, WO 03/037898). Соединения формулы R3-Y-B-C(=O)-L1, которые определены выше, могут быть получены из соединений формулы R3-Y-B-C(=O)-ОН в результате взаимодействия с реагентом, подходящим для введения удаляемой группы, например, когда L1 является хлором, обработкой тионилхлоридом или оксалилхлоридом в присутствии каталитического количества N,N-диметилформамида. Альтернативный способ получения соединений формулы (I) заключается во взаимодействии соединения формулы (VIII) где R1, R2, R4, А, В и Q имеют значения, которые определены выше, и L3 означает удаляемую группу, такую как галоген или трифторметилсульфонилокси, и соединения формулы M1-Y-R3, где R3 и Y имеют значения, которые определены выше, и M1 означает водород, содержащий металл остаток (например, соль щелочного металла, триалкилстаннил) или бороновую кислоту, необязательно в присутствии подходящего основания, такого как карбонат калия, карбонат цезия, карбонат натрия, гидрид натрия или триэтиламин, и необязательно с использованием подходящей системы катализатора на основе переходного металла, такой как ацетат палладия/BINAP, хлорид меди (I)/2,2,6,6-тетраметил-3,5-гептандион или тетракис(трифенилфосфин)палладий(0). И затем необязательно осуществление одной или нескольких из следующих реакций:a) превращение одного соединения формулы (I) в другое соединение формулы (I);b) удаление любой защитной группы;c) образование подходящей фармацевтически приемлемой соли или сольвата полученного таким образом соединения. Соединения формулы (VIII) могут быть получены в результате взаимодействия соединений формулы (II), которые определены выше, с соединением формулы L3-B-C(=O)-L1 или L3-B-C(=O)-ОН, где L1, L3 и В имеют значения, которые определены выше, используя способы, сходные и/или аналогичные способам, описанным выше. Альтернативный способ получения соединений формулы (III) заключается во взаимодействии соединения формулы (VI), которое определено выше, с соединением формулы где R7 имеет значение, которое определено выше, и Q1 означает подходящую защитную группу, такую как ацетил, в условиях, подходящих для восстановительного аминирования, которые описаны выше,с последующей подходящей стадией удаления защиты, чтобы удалить Q1. Соединения формулы (IX) являются коммерчески доступными или могут быть получены из соответствующей карбоновой кислоты с использованием общих способов превращения карбоновой кислоты в альдегид. См., например., M. В. Smith and J. March, Advanced Organic Chemisty, 5th Edition, J. Wiley andSons, 2001, Chapter 19, p.1506-1604. Альтернативный способ получения соединений формулы (II), где А означает необязательно замещенную группу 1,4-фенилена, необязательно замещенную группу 2,5-пиридила или необязательно замещенную группу 3,6-пиридила, заключается во взаимодействии соединения формулы (VI), которое определено выше, с соединением формулы (X) где А и R4 имеют значения, которые определены выше, в условиях, подходящих для восстанови-9 015820 тельного аминирования, которые определены выше. Соединения формулы (X), где А означает необязательно замещенную группу 1,4-фенилена или необязательно замещенную группу 2,5-пиридила, и R4 имеет значение, которое определено выше, могут быть получены в результате взаимодействия соединения формулы (XI) где А означает необязательно замещенную группу 1,4-фенилена или необязательно замещенную группу 2,5-пиридила, и L3 имеет значение, которое определено выше, с соединением формулы R4NHQ1,где R4 имеет значение, которое определено выше, и Q1 означает подходящую защитную группу азота,такую как трет-бутилоксикарбонил (Boc), в присутствии подходящей системы катализатора на основе переходного, металла, такой как трис (дибензилиденацетон)дипалладий(0)/ксантофос, в присутствии подходящего основания, такого как карбонат цезия, и в подходящем растворителе, таком как диоксан; с последующей подходящей стадией удаления защиты. Соединения формулы (XI), где А означает необязательно замещенную группу 1,4-фенилена или необязательно замещенную группу 2,5-пиридила, являются коммерчески доступными или могут быть получены в результате взаимодействия соединения формулы (XII) где А означает необязательно замещенную группу 1,4-фенилена или необязательно замещенную группу 2,5-пиридила, и L3 имеет значение, которое определено выше, с подходящим восстановителем,таким как гидрид диизобутилалюминия, в подходящем растворителе, таком как толуол. Соединения формулы (X), где А означает необязательно замещенную группу 3,6-пиридила, могут быть получены в результате взаимодействия соединения формулы (XIII) где R4 имеет значение, которое определено выше, и R7 означает необязательное замещение в остатке пиридина с использованием подходящего восстановителя, такого как гидрид диизобутилалюминия, в подходящем растворителе, таком как толуол. Соединения формулы (XIII), где R4 имеет значение, которое определено выше, и R7 означает необязательное замещение остатка пиридина С(1-4)алкилом или C(1-4)алкоксигруппой, могут быть получены в результате взаимодействия соединения формулы (XIV) где R7 означает необязательное замещение остатка пиридина C(1-4)алкилом или С 1-4 алкоксигруппой,и L имеет значение, которое определено выше, с соединением формулы R4NH2 в подходящем растворителе, таком как ТГФ, и необязательно в присутствии подходящего основания. Альтернативный способ получения соединений формулы (III), где А означает необязательно замещенную группу 3,6-пиридила, заключается во взаимодействии соединения формулы (VI), которое определено выше, с соединением формулы (XV) 3 где R7 означает необязательное замещение остатка пиридина C(1-4)алкилом или C(1-4)алкокси в условиях, подходящих для восстановительного аминирования, которые определены выше. Соединения формулы (XV) могут быть получены в результате взаимодействия соединения формулы (XVI) где R7 означает необязательное замещение остатка пиридина C(1-4)алкилом или С(1-4)алкокси, и Q1 означает подходящую защитную группу, такую как трифторацетил, с подходящим восстановителем, таким как сплав никель/алюминий, в присутствии муравьиной кислоты и в подходящем растворителе, таком как вода. Соединения формулы (XVI) могут быть получены в результате взаимодействия соединения формулы (XVII) где R7 означает необязательное замещение остатка пиридина С(1-4)алкилом или С(1-4)алкокси, с цианидом меди(I) в подходящем растворителе, таком как ДМФА, с последующей подходящей защитой аминогруппы. Когда Q1 означает трифторацетил, защиту можно осуществить с использованием ангидрида трифторуксусной кислоты в присутствии подходящего основания, такого как 2,6-лутидин, и в подходящем растворителе, таком как дихлорметан. Соединения формулы (V), (VI), (XII), (XIV) и (XVII) являются коммерчески доступными, описаны в литературе или могут быть получены аналогичными или сходными способами. Соединения формулы R3-Y-B-C(=O)-ОН являются коммерческими доступными, описаны в литературе или могут быть получены аналогичными или сходными способами (например, см. WO 2003/068749,WO 2004/072069, WO 2005/016928, WO 2003/027061, WO 2005/016915, WO 1997/025309, WO 2005/047278, WO 2002/016356, WO 2007/041634 и WO 2005/073210) . Соединения формулы L3-B-C(=O)-L1 являются либо коммерчески доступными, описанными в литературе, либо могут быть получены аналогичными или сходными способами. Специалистам в данной области будет понятно, что может быть необходима защита некоторых химически активных заместителей во время некоторых описанных выше процедур. Можно применять стандартные способы защиты и удаления защиты, такие как способы. Описанные в Greene T.W. and WutsP.G.M., Protective groups in organic synthesis, 2nd Edition, New York, Wiley (1991). Например, первичные и вторичные амины могут быть защищены в виде фталимидных, трифторацетильных, бензильных, третбутилоксикарбонильных, бензилоксикарбонильных или трифенилметильных производных. Группы карбоновых кислот могут быть защищены в виде сложных эфиров. Группы альдегидов или кетонов могут быть защищены в виде ацеталей, кеталей, тиоацеталей или тиокеталей. Удаление защиты таких групп осуществляют, используя обычные способы, известные в данной области. Например, защитные группы,такие как трет-бутилоксикарбонил, могут быть удалены с использованием кислоты, такой как хлористоводородная или трифторуксусная кислота, в подходящем, растворителе, таком как дихлорметан, диэтиловый эфир, 1,4-диоксан, изопропанол или их смеси. Соли могут быть получены обычным способом при взаимодействии с подходящей кислотой или производным кислоты. В настоящем изобретении также предлагаются соединения формулы (II) и (VIII), которые показаны выше, где R1, R2, R4, А и В имеют значения, которые определены для формулы (I), Q означает водород или подходящую защитную группу, такую как трет-бутилоксикарбонил (ВОС) или бензилоксикарбонил(CBZ), и L3 означает удаляемую группу, такую как галоген или трифторметилсульфонилоксигруппа. Такие соединения применимы в качестве промежуточных продуктов при получении соединений согласно настоящему изобретению. Активности и эффективности соединений согласно настоящему изобретению по отношению кGPR38 можно определить в FLIPR-анализе, осуществляемом на клонированном рецепторе человека, как описано выше. Соединения формулы (I) проявляли частичную или полную агонистическую активность по отношению к рецептору GPR38 в функциональных анализах, проводимых с использованием FLIPR(устройство для визуализации флуориметрии в планшетах), описанных выше. Поэтому соединения формулы (I) и их фармацевтически приемлемые соли применимы для лечения состояний или расстройств, которые опосредованы рецептором GPR38. В частности, соединения формулы (I) и их фармацевтически приемлемые соли применимы для лечения некоторых желудочно-кишечных расстройств, таких как расстройства, связанные с гастроэзофагеальным рефлюксом, функциональная диспепсия, синдром раздраженного кишечника, запор, псевдонепроходимость кишечника, паралитическая кишечная непроходимость после хирургической операции или другой процедуры, рвота, желудочный стаз или гипокинезия, вызванная различными заболеваниями, такими как диабет, и/или введением других лекарственных средств или энтеральным питанием пациентов, болезнь Крона, колит, кахексия,- 11015820 ассоциированная с заболеваниями на поздних стадиях, такими как злокачественная опухоль и/или ее лечение, и другие расстройства, такие как недержание (в дальнейшем называемые расстройствами согласно изобретению). Должно быть понятно, что лечение в используемом в настоящем изобретение смысле включает профилактику, а также ослабление развившихся симптомов. Таким образом, изобретение также относится к соединениям формулы (I) и их фармацевтически приемлемым солям для применения в качестве терапевтического вещества, в частности, для лечения состояний или расстройств, опосредованных рецептором GPR38. В частности, изобретение относится к соединениям формулы (I) и их фармацевтически приемлемым солям для применения в качестве терапевтического вещества для лечения желудочно-кишечных расстройств, таких как расстройства, связанные с гастроэзофагеальным рефлюксом, функциональная диспепсия, синдром раздраженного кишечника, запор, псевдонепроходимость кишечника, паралитическая кишечная непроходимость после хирургической операции или другой процедуры, рвота, желудочный стаз или гипокинезия, вызванная различными заболеваниями, такими как диабет, и/или введением других лекарственных средств или энтеральным питанием пациентов, болезнь Крона, колит, кахексия, ассоциированная с заболеваниями на поздних стадиях,такими как злокачественная опухоль, и/или ее лечением, и другие расстройства, такие как недержание. Кроме того, изобретение относится к способу лечения состояний или расстройств у млекопитающих, включая человека, которые могут быть опосредованы рецептором GPR38, который включает введение пациенту терапевтически безопасного и эффективного количества соединений формулы (I) или их фармацевтически приемлемой соли. В другом аспекте изобретение относится к применению соединений формулы (I) и их фармацевтически приемлемых солей для получения лекарственного средства, предназначенного для лечения состояний или расстройств, опосредованных рецептором GPR38. В случае применения соединений формулы (I) и их фармацевтически приемлемых солей в терапии их, как правило, будут готовить в виде фармацевтической композиции согласно стандартной фармацевтической практике. Настоящее изобретение также относится к фармацевтической композиции, которая содержит соединение формулы (I) или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель или эксципиент. В следующем аспекте настоящее изобретение относится к способу получения фармацевтической композиции, при этом способ заключается в смешивании соединения формулы (I) или его фармацевтически приемлемой соли и фармацевтически приемлемого носителя или эксципиента. Фармацевтическая композиция согласно изобретению, которая может быть приготовлена смешиванием в подходящем случае при температуре окружающей среды и атмосферном давлении, обычно адаптирована для орального, парентерального или ректального введения, и, как таковая, может быть в форме таблеток, капсул, оральных жидких препаратов, порошков, гранул, лепешек, порошков, которые можно перерастворять, инъекционных или инфузионных растворов или суспензий или суппозиториев. Как правило, предпочтительны композиции для орального введения. Таблетки и капсулы для орального введения могут быть в стандартной лекарственной форме и могут содержать обычные эксципиенты, такие как связывающие агенты (например, пептизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например,лактоза, микрокристаллическая целлюлоза или гидрофосфат кальция); скользящие вещества для получения таблеток (например, стеарат магния, тальк или диоксид кремния); дезинтегрирующие средства (например, картофельный крахмал или крахмалгликолят натрия); и приемлемые увлажнители (например,лаурилсульфат натрия). Таблетки могут быть покрыты согласно способам, хорошо известными в обычной фармацевтической практике. Оральные жидкие препараты могут быть, например, в форме водной или масляной суспензии, растворов, эмульсий, сиропов или эликсиров, или могут быть в форме сухого продукта для перерастворения в воде или другом подходящем наполнителе перед использованием. Такие жидкие препараты могут содержать обычные добавки, такие как суспендирующие средства (например, сорбитовый сироп, производные целлюлозы или гидрогенизированные пищевые жиры), эмульгаторы (например, лецитин или аравийская камедь), неводные наполнители (которые могут включать пищевые масла, например, миндальное масло, маслянистые сложные эфиры, этиловый спирт или фракционированные растительные масла), консерванты (например, метил- или пропил-п-гидроксибензоаты или сорбиновая кислота), и при необходимости обычные корригенты или красители, соли для буферов и в подходящем случае подсластители. Препараты для орального введения в подходящем случае могут быть приготовлены так, чтобы они обеспечивали контролируемое высвобождение активного соединения или его фармацевтически приемлемой соли. Для парентерального введения жидкие стандартные лекарственные формы готовят, используя соединение формулы (I) или его фармацевтически приемлемую соль и стерильный наполнитель. Препараты для инъекции могут быть приготовлены в стандартной лекарственной форме, например, в ампулах,или в виде препарата, содержащего множество доз, используя соединение формулы (I) или его фарма- 12015820 цевтически приемлемую соль и стерильный наполнитель, необязательно с добавлением консерванта. Композиции могут быть в форме суспензий, растворов или эмульсий в масляном или водном наполнителе и могут содержать средства для приготовления композиций, такие как суспендирующие, стабилизирующие и/или диспергирующие средства. Альтернативно активный ингредиент может быть в форме порошка для перерастворения в подходящем наполнителе, например, в стерильной апирогенной воде, перед использованием. В зависимости от используемого наполнителя и концентрации соединение может быть либо суспендировано, либо растворено в наполнителе. В случае приготовления растворов соединение может быть растворено для инъекции и простерилизовано фильтрованием перед наполнением подходящего флакона или ампулы и герметично закрыто. Преимущественно в наполнителе растворяют адъюванты, такие как местный анестетик, консерванты и буферные средства. Для повышения стабильности композиция может быть заморожена после наполнения флакона, и вода может быть удалена в вакууме. Парентеральные суспензии готовят по существу таким же способом, за исключением того, что соединение суспендируют в наполнителе вместо растворения, и стерилизация не может быть осуществлена фильтрованием. Соединение можно стерилизовать, обрабатывая этиленоксидом перед суспендированием в стерильном наполнителе. Преимущественно в композицию вводят поверхностно-активное вещество или увлажнитель, чтобы облегчить равномерное распределение соединения. Могут быть приготовлены примочки на водной или масляной основе, и, в общем, они будут также содержать один или несколько эмульгаторов, стабилизаторов, диспергирующих средств, суспендирующих средств, загустителей или красителей. Капли могут быть приготовлены на водной или неводной основе, также содержащей одно или несколько диспергирующих средств, стабилизаторов, солюбилизирующих средств или суспендирующих средств. Они также могут содержать консервант. Соединения формулы (I) или их фармацевтически приемлемые соли также могут быть приготовлены в виде ректальных композиций, таких как суппозитории или удерживающие клизмы, например, содержащие обычные основы для суппозиториев, такие как масло какао или другие глицериды. Соединения формулы (I) или фармацевтически приемлемые соли также могут быть приготовлены в виде депонируемых препаратов. Такие длительно действующие препараты могут быть введены посредством имплантации (например, подкожно или внутримышечно) или путем внутримышечной инъекции. Таким образом, например, соединения формулы (I) или фармацевтически приемлемые соли могут быть приготовлены вместе с подходящими полимерными или гидрофобными веществами (например, в виде эмульсии в приемлемом масле) или ионообменными смолами, или в виде плохо растворимых производных, например, в виде плохо растворимой соли. Для интраназального введения соединения формулы (I) или их фармацевтически приемлемые соли могут быть приготовлены в виде растворов для введения с помощью подходящего дозирующего или содержащего однократную дозу устройства или альтернативно в виде порошкообразной смеси с подходящим носителем для введения с использованием подходящего устройства для доставки. Таким образом,соединения формулы (I) или их фармацевтически приемлемые соли могут быть приготовлены для орального, буккального, парентерального, местного (включая глазное и назальное), депонируемого или ректального введения или в форме, подходящей для введения путем ингаляции или инсуффляции (либо через рот, либо через нос). Соединения формулы (I) и их фармацевтически приемлемые соли могут быть приготовлены для местного введения в форме мазей, кремов, гелей, примочек, пессариев, аэрозолей или капель (например,глазных, ушных или назальных капель). Мази и кремы, например, могут быть приготовлены на водной или масляной основе с добавлением подходящих загустителей и/или гелеобразующих средств. Мази для применения на глазах могут быть изготовлены стерильным способом с использованием стерилизованных компонентов. Композиция может содержать от 0,1 до 99 мас.%, предпочтительно от 10 до 60 мас.% активного вещества, в зависимости от способа введения. Доза соединения, используемого для лечения указанных выше расстройств, будет варьировать обычным образом в зависимости от тяжести заболеваний, массы пациента и других сходных факторов. Однако в качестве общего руководства наиболее подходящие стандартные дозы могут составлять от 0,05 до 1000 мг, более предпочтительно от 1,0 до 500 мг или от 1,0 до 200 мг, и такие стандартные дозы можно вводить более одного раза в сутки, например два или три раза в сутки. Соединения формулы (I) и их фармацевтически приемлемые соли можно применять в комбинированных препаратах. Например, соединения формулы (I) и их фармацевтически приемлемые соли можно применять в комбинации с одним или несколькими соединениями, обладающими активностью, уменьшающей кислотность в желудке; одним или несколькими соединениями, обладающими активностью,уменьшающей гастроэзофагеальный рефлюкс; одним или несколькими соединениями, обладающими активностью, снижающей раздражение или воспаление в пищеводе или желудке, особенно в случае применения для ослабления эрозивного или неэрозивного эзофагита; одним или несколькими соединениями,обладающими анальгезирующей активностью; и/или одним или несколькими соединениями со смешанной активностью в отношении моторики и боли. Примеры соединений с активностью, снижающей кислотность в желудке, включают антагонисты- 13015820 рецептора H2, антагонисты кислотного насоса и ингибиторы протонного насоса. Примеры соединений с активностью, снижающей гастроэзофагеальный рефлюкс, включают агонисты ГАМК-В (GABA-B). Примеры соединений с анальгезирующей активностью включают соединения, активные по отношению к рецепторам нейрокинина (NK1, 2, 3), TRPV1 и натриевым каналам. Примеры соединений со смешанной активностью в отношении моторики и боли включают антагонисты CRF2, антагонисты 5-НТ 3 или октреотид или другие молекулы, активные по отношению к рецепторам sst2. Все публикации, включая, без ограничения, патенты и заявки на выдачу патента, цитированные в описании, включены в данное описание в виде ссылки также, как в том случае, когда специально и отдельно указано, что каждая публикация включена в настоящее описание в виде ссылки в полном объеме. Следующее описание и примеры иллюстрируют получение соединений согласно изобретению. Условия, оборудование и компьютерная программа для аналитических ЖХ-МС-систем(I) Оборудование Градиентный насос Agilent 1100 Автоматический пробоотборник Agilent 1100 Детектор Agilent 1100 DAD Дегазатор Agilent 1100 Термостат Agilent 1100 Регулятор Agilent 1100 Масс-спектрометр Waters ZQWaters MassLynx, версия 4.0 SP2 Колонка Использовали колонку Waters Atlantis с размерами 4,6 мм 50 мм. Размер частиц неподвижной фазы составляет 3 мкм. Растворители А: водный растворитель = вода + 0,05% муравьиная кислота В: органический растворитель = ацетонитрил + 0,05% муравьиная кислота Способ В общем применяемом способе время выполнения программы составляет 5 мин. Расход В описанном выше способе расход составлял 3 мл/мин Оборудование Устройство управления системой двух растворителей Waters Acquity Устройство управления вводом образца Waters AcquityWaters MassLynx, версия 4.1 Колонка Использовали колонку Waters Acquity ВЕН UPLC C18, размеры которой составляют 2,1 мм 50 мм. Размер частиц неподвижной фазы составляет 1,7 мкм. Растворители А: водный растворитель = вода + 0,05% муравьиная кислота В: органический растворитель = ацетонитрил + 0,05% муравьиная кислота Мягкая промывка = 1:1 метанол:вода Жесткая промывка = вода Способ В общем применяемом способе время выполнения программы составляет 2 мин. В описанном выше способе расход составлял 1 мл/мин. Вводимый объем в случае общего способа составлял 0,5 мкл. Температура колонки составляла 40. Диапазон регистрации в УФ составлял от 220 до 330 нм. Условия для системы MDAP (Open Access Mass Directed Auto Prep) Оборудование Оборудование Open Access Mass Directed Prep состоит из следующих устройств: 1 градиентный насос Waters 600 1 инжектор/коллектор Waters 2767 1 устройство, управляющее подачей реагентов Waters 1 масс-спектрометр MicroMass ZQ 1 устройство для сбора отходов Gilson Aspec 1 УФ-детектор фракций после разделения Gilson 115 1 компьютерная система. Компьютерная программаMicroMass MassLynx v4.0. Колонка Обычно используют колонку Supelco LCABZ, размеры которой составляют: внутренний диаметр 20 мм и длина 100 мм. Размер частиц неподвижной фазы составляет 5 мкм. Растворители А: водный растворитель = вода + 0,1% муравьиная кислота В: органический растворитель=MeCN:вода 95:5+0,05% муравьиная кислота Рабочий растворитель=МеОН:вода 80:20+50 ммоль ацетата аммония Растворитель для промывания иглы=МеОН:вода:ДМСО=80:10:10 Способы Можно применять один из пяти способов в зависимости от времени удерживания представляющего интерес соединения в анализе. Во всех способах время выполнения программы составляет 15 мин, указанный период включает 10 минутный градиент с последующей 5-минутной стадией промывки колонки и повторного уравновешивания.MDP 3,8-5,5=50-90% В Расход Во всех указанных выше способах расход составляет 20 мл/мин.(II) Оборудование Модуль для двойного градиента Waters 2525 Насос подпитки Waters 515 Модуль регуляции насосов Waters Инжектор/коллектор Waters 2767 Устройство регуляции потоков через колонку Waters Матричный фотодиодный детектор Waters 2996 Масс-спектрометр Waters ZQ Коллектор фракций Gilson 202 Устройство для сбора отходов Gilson Aspec Компьютерная программаWaters MassLynx, версия 4 SP2 Колонка Использовали колонки Waters Atlantis, размеры которых составляют 19 мм 100 мм (малый масштаб) и 30 мм 100 мм (большой масштаб). Размер частиц неподвижной фазы составляет 5 мкм.- 15015820 Растворители А: водный растворитель=вода + 0,1% муравьиная кислота В: органический растворитель=ацетонитрил + 0,1% муравьиная кислота Рабочий растворитель=метанол:вода 80:20 Растворитель для промывания иглы=метанол Способы Имеется пять способов, используемых в зависимости от времени удерживания представляющего интерес соединения в анализе. Во всех способах время выполнения программы составляет 13,5 мин, указанный период включает 10-минутный градиент с последующей 3,5-минутной стадией промывки колонки и повторного уравновешивания. большой/малый масштаб 1,0-1,5=5-30% В большой/малый масштаб 1,5-2,2=15-55% В большой/малый масштаб 2,2-2,9=30-85% В большой/малый масштаб 2,9-3,6=50-99% В большой/малый масштаб 3,6-5,0=80-99% В (за 6 мин с последующей 7,5-минутной промывкой и повторным уравновешиванием) Расход Во всех указанных выше способах MDAP расход составлял либо 20 мл/мин (малый масштаб), либо 40 мл/мин (большой масштаб). Пологие градиенты большой от 1,5 до 2,3 мин = 13-29% В большой от 1,9 до 2,3 мин = 25-41% В большой от 2,3 до 2,6 мин = 37-53% В большой от 2,6 до 3,1 мин = 49-65% В большой от 3,1 до 3,6 мин = 61-77% В Условия, используемые для ЯМР Оборудование Сверхэкранированный магнит Ultrashield Bruker 400 МГц Автоматический пробоотборник Bruker B-ACS60 Пульт управления Bruker Advance 400Bruker DRX600 Компьютерная программа Пользовательский интерфейс - NMR Kiosk Программа управления - XWin NMR, версия 3.0 Хроматография Если не оговорено особо, во всех случаях хроматографию на колонке осуществляли, используя колонки с диоксидом кремния. СокращенияKOH - гидроксид калия МеОН - метанолSCX - сильный катионообменник ТФУ - трифторуксусная кислота ТГФ - тетрагидрофуран Смесь 4-нитробензальдегида (15,1 г, 0,1 моль), гидрохлорида 1,1-диметилэтил-(2S)-2-метил-1 пиперазинкарбоксилата (21,3 г, 0,09 моль), триэтиламина (15 мл, 0,108 моль) и три(ацетокси)боргидрида натрия (42,4 г, 0,2 моль) в 1,2-DCE (500 мл) перемешивали при комнатной температуре в течение ночи. Добавляли насыщенный водный NaHCO3 (200 мл) и смесь перемешивали в течение 20-30 мин. Фазы разделяли и водную фазу промывали ДХМ. Объединенные органические фазы промывали насыщенным раствором соли, сушили и концентрировали. Хроматография на колонке с элюированием смесью 0-20% EtOAc/гексан давала указанное в заголовке соединение в виде бледно-желтого масла, которое кристаллизовалось при стоянии (25,61 г). H(1 л) перемешивали при комнатной температуре в течение двух выходных дней. Реакционную смесь обрабатывали порциями раствора NaHCO3 (400 мл) в течение периода времени 2 ч. После дополнительного 30-минутного периода органический слой отделяли, промывали насыщенным раствором соли, сушили и концентрировали, получая вязкое бледно-желтое масло. Очистка хроматографией на колонке с использованием элюирования 0, 10% и затем 20% EtOAc/гексаном давала указанное в заголовке соединение в виде желтого кристаллического твердого вещества (61,1 г). Описание 2. 1,1-Диметилэтил-(2S)-4-[(4-аминофенил)метил]-2-метил-1-пиперазинкарбоксилат (D2) К 1,1-диметилэтил-(2S)-2-метил-4-[(4-нитрофенил)метил]-1-пиперазинкарбоксилату (D1) (4,62 г,13,78 ммоль) и КОН (7,79 г, 13 8,8 ммоль) в МеОН (100 мл) добавляли влажный (50% мас./мас, воды) катализатор 10% Pd/C (4 г) и смесь гидрировали при комнатной температуре и атмосферном давлении в течение 40 мин. Катализатор удаляли фильтрованием и фильтрат концентрировали в вакууме. Остаток распределяли между ДХМ и водой и водный слой дополнительно экстрагировали ДХМ (2). Объединенные органические фазы промывали насыщенным раствором соли, сушили и концентрировали, получая указанное в заголовке соединение в виде бесцветной камеди (4,14 г), которое использовали на следующей стадии без дополнительной очистки.(А). 1,1-Диметилэтил-(2S)-4-[(4-аминофенил)метил]-2-метил-1 пиперазинкарбоксилат (D2) К 1,1-диметилэтил-(2S)-2-метил-4-[(4-нитрофенил)метил]-1-пиперазинкарбоксилату (D1) (15 г, 44,8 моль) в МеОН (150 мл) и воде (150 мл) при 80 С добавляли хлорид аммония (11,9 г, 0,224 моль) и порошкообразное железо (7,5 г, 0,134 моль) при энергичном перемешивании. Реакционную смесь перемешивали при 80 С в течение 2 ч, затем фильтровали через целит (Celite), при этом смесь все еще была горячей, и осадок на фильтре затем промывали ДХМ. Соли фильтрата разделяли и водный слой промывали ДХМ (3). Слои ДХМ объединяли, сушили (Na2SO4) и концентрировали, получая сырой продукт,который очищали хроматографией на колонке. Элюирование смесью 20-70% EtOAc/петролейный эфир давало указанное в заголовке соединение в виде белого твердого вещества (9,46 г). Описание 2. Альтернативный способ(400 мл) гидрировали при комнатной температуре и атмосферном давлении в течение ночи. Катализатор удаляли фильтрованием и затем промывали МеОН. Фильтрат концентрировали, перерастворяли в ДХМ(200 мл) и промывали 2 М раствором NaOH. Промывные воды повторно экстрагировали ДХМ (2, 100 мл) и все органические фазы объединяли, промывали насыщенным раствором соли, сушили и концентрировали, получая указанное в заголовке соединение (19,53 г), которое использовали на следующей стадии без дополнительной очистки. Описание 3. 1,1-Диметилэтил-(2S)-2-метил-4-[4-(метиламино)фенил]метил-1-пиперазинкарбоксилат (D3) К 1,1-диметилэтил-(2S)-4-[(4-аминофенил)метил]-2-метил-1-пиперазинкарбоксилату (D2) (4,14 г,13,56 ммоль) в безводном МеОН (80 мл) при 50 С в атмосфере аргона добавляли параформальдегид (1,22 г, 40,67 ммоль) и метоксид натрия (3,65 г, 67,78 ммоль). Смесь перемешивали в течение 24 ч, затем порциями добавляли боргидрид натрия (1,54 г, 40,67 ммоль) и реакционную смесь перемешивали при 50 С в течение ночи. После охлаждения до комнатной температуры добавляли ацетон (10 мл) и растворитель удаляли в вакууме. Остаток распределяли между ДХМ и водой и органическую фазу промывали насыщенным раствором соли, затем сушили и концентрировали. Хроматография на колонке давала указанное в заголовке соединение в виде бесцветного кристаллического твердого вещества (3,73 г).(9 Н, с), 1,21 (3 Н, д). Описание 3. Альтернативный способ (А). 1,1-Диметилэтил-(2S)-2-метил-4-[4-(метиламино)фенил]метил-1 пиперазинкарбоксилат (D3) Смесь 1,1-диметилэтил-(2S)-4-[(4-аминофенил)метил]-2-метил-1-пиперазинкарбоксилата (D2) (7,45 г, 24,43 ммоль), параформальдегида (2,202 г, 73,28 ммоль) и метоксида натрия (6,597 г, 122,13 ммоль) в метаноле (150 мл) в атмосфере аргона нагревали при 50 С в течение двух выходных дней. После охлаждения добавляли боргидрид натрия (1,848 г, 48,85 ммоль) и реакционную смесь нагревали при 50 С в течение 1 ч, затем охлаждали до комнатной температуры. Добавляли ацетон до тех пор, пока больше не наблюдалось выделение пузырьков, затем смесь концентрировали. Остаток распределяли между ДХМ и водой и водный слой повторно экстрагировали ДХМ. Объединенные органические фазы разбавляли МеОН (примерно 20 мл) , что способствовало растворимости, сушили и концентрировали, получая указанное в заголовке соединение в виде не совсем белого твердого вещества (7,77 г). Описание 3. Альтернативный способ (В). 1,1-Диметилэтил-(2S)-2-метил-4-[4-(метиламино)фенил]метил-1 пиперазинкарбоксилат (D3) 1,1-Диметилэтил-(2S)-4-[(4-аминофенил)метил]-2-метил-1-пиперазинкарбоксилат (D2) (19,53 г,0,0639 моль) в безводном МеОН (300 мл) в атмосфере аргона при комнатной температуре обрабатывали параформальдегидом (5,76 г, 0,1918 моль) и метоксидом натрия (17,27 г, 0,3197 моль). Реакционную- 18015820 смесь нагревали при 50 С, перемешивали в течение ночи, затем охлаждали до комнатной температуры. Порциями добавляли боргидрид натрия (7,26 г, 0,1918 ммоль) и затем реакционную смесь снова нагревали до 50 С и перемешивали в течение 2 дней. Реакционную смесь охлаждали до комнатной температуры и перемешивали еще в течение 24 ч, затем концентрировали и перерастворяли в ДХМ (200 мл). Порциями при перемешивании добавляли насыщенный водный раствор NaHCO3 (200 мл) и после завершения добавления смесь перемешивали при комнатной температуре еще в течение 0,5 ч. Фазу в ДХМ отделяли, промывали насыщенным раствором соли, сушили (MgSO4) и концентрировали, получая желтое масло, которое очищали хроматографией на колонке. Элюирование 0%, 10% и затем 20% EtOAc/гексаном давало указанное в заголовке соединение в виде желтого масла, которое кристаллизовалось при стоянии (16,7 г). Описание 4. 1,1-Диметилэтил-(2R)-2-метил-4-[(4-нитрофенил)метил]-1-пиперазинкарбоксилат (D4) Указанное в заголовке соединение получали из 4-нитробензальдегида и гидрохлорида 1,1 диметилэтил-(2R)-2-метил-1-пиперазинкарбоксилата, используя способ, сходный со способом, описанным для D1 в описании 1. МС (ES+): 280,2, 236,3, молекулярный ион (МН+) не выявлен. Описание 5. 1,1-Диметилэтил-(2R)-4-[(4-аминофенил)метил]-2-метил-1-пиперазинкарбоксилат (D5) Указанное в заголовке соединение получали из 1,1-диметилэтил-(2R)-2-метил-4-[(4 нитрофенил)метил]-1-пиперазинкарбоксилата (D4), используя способ, сходный со способом, описанным для D2 в описании 2, хотя при этом использовали водный 2 M раствор КОН вместо твердого КОН и время реакции составляло 40 мин. МС (ES): МН+ 306,2, MNa+ 328,2. Описание 6. 1,1-Диметилэтил-(2R)-2-метил-4-[4-(метиламино)фенил]метил-1 пиперазинкарбоксилат (D6) Указанное в заголовке соединение получали из 1,1-диметилэтил-(2R)-4-[(4-аминофенил)метил]-2 метил-1-пиперазинкарбоксилата (D5), используя способ, сходный со способом, описанным для D3 в описании 3 А, но при этом реакционную смесь нагревали при 50 С в течение 48 ч перед добавлением боргидрида натрия. H (CDCl3, 400 МГц) 7,13 (2 Н, д), 6,57 (2 Н, д), 4,16 (1 Н, м), 3,78 (1 Н, д), 3,42 (1 Н, д), 3,29(3 Н, д). МС (ЕС+) : 342,3 (MNa+), 220,2, молекулярный ион (МН+) не выявлен. Описание 7. 1,1-Диметилэтил-(2R,6S)-2,6-диметил-4-[(4-нитрофенил)метил]-1-пиперазинкарбоксилат (D7) Указанное в заголовке соединение можно получить, используя способ, сходный со способом, описанным для D1. Описание 7. Альтернативный способ (А). 1,1-Диметилэтил-(2R,6S)-2,6-диметил-4-[(4-нитрофенил)метил]-1 пиперазинкарбоксилат (D7)NaHCO3 (60 мл). Смесь перемешивали при комнатной температуре в течение ночи; смесь фильтровали и осадок на фильтре промывали ДХМ. Фильтрат концентрировали в вакууме и остаток распределяли между ДХМ и водой. Слой ДХМ отделяли и водный слой экстрагировали ДХМ (2). Слои ДХМ объединяли и сушили, получая желтое масло (9,614 г). Смесь очищали, пропуская через картридж SCX, получая желтое масло (4,787 г), которое представляло собой смесь указанного в заголовке соединения и не прореагировавшего D82. Всю смесь растворяли в ДХМ (60 мл) и добавляли триэтиламин (2,936 мл), затем Восангидрид (4,612 г, 21,13 ммоль). Смесь перемешивали при комнатной температуре в течение ночи в атмосфере аргона. Добавляли PS-трисамин (PS-Trisamine) (6 г) и смесь перемешивали в течение 30 мин; полимер отфильтровывали и растворитель удаляли, получая желтое масло (6,5621 г). Очистка хроматографией на колонке при элюировании смесью 0-50% Et2O/петролейный эфир давала бледно-желтое твердое вещество (5,245 г). Полученное твердое вещество растворяли в МеОН и пропускали через картриджSCX (70 г), который промывали МеОН, затем 2 М NH3 в МеОН. Растворитель удаляли, получая желтое твердое вещество (3,833 г), которое затем очищали хроматографией на колонке. Элюирование смесью 050% Et2O/петролейный эфир давало указанное в заголовке соединение в виде беловато-кремового твердого вещества (2,624 г). МС (ES+) : 294,3, 250,3, молекулярный ион (МН+) не выявлен. Описание 8. 1,1-Диметилэтил-(2R,6S)-4-[(4-аминофенил)метил]-2,6-диметил-1-пиперазинкарбоксилат (D8) К раствору 1,1-диметилэтил-(2R,6S)-2,6-диметил-4-[(4-нитрофенил)метил]-1-пиперазинкарбоксилата (D7) (2,62 г, 7,53 ммоль) в МеОН (25 мл) и воде (25 мл), нагретому до 80 С, добавляли порошкообразное железо (1,26 г, 22,54 ммоль) и хлорид аммония (2,01 г, 37,58 ммоль). Реакционную смесь энергично перемешивали при 80 С в течение 1,5 ч и затем остаток железа удаляли фильтрованием через целит. Фильтрат концентрировали и остаток распределяли между ДХМ и водой. Затем водный слой экстрагировали ДХМ (2) и объединенные органические фазы сушили и концентрировали, получая сырой продукт в виде желтой пены (2,01 г). Хроматография на колонке при элюировании смесью 0-100%Et2O/петролейный эфир давала указанное в заголовке соединение (1,694 г). Указанное в заголовке соединение получали из 1,1-диметилэтил-(2R,6S)-4-[(4-аминофенил)метил]-2,6 диметил-1-пиперазинкарбоксилата (D8), используя способ, сходный со способом, описанным для D3 в описании 3 А, но при этом реакционную смесь нагревали при 50 С в течение 48 ч перед добавлением боргидрида натрия, затем еще в течение 1 ч после добавления. Затем добавляли параформальдегид (1 эквивалент) и метоксид натрия (1 эквивалент); реакционную смесь нагревали при 50 С в течение 12 ч; затем добавляли боргидрид натрия (1 эквивалент) и реакционную смесь нагревали при 50 С в течение 1 ч. Указанное в заголовке соединение получали из 4-нитробензальдегида и 1,1-диметилэтил-1 пиперазинкарбоксилата, используя способ, сходный со способом, описанным для D1 в описании 1 А, но при этом продукт очищали хроматографией на колонке с последующим пропусканием через колонку Указанное в заголовке соединение получали из D10, используя способ, сходный со способом, описанным для D8 в описании 8, но при этом не требовалось хроматографии на колонке. МС (ES): МН+ 292,1, MNa+ 314,2. Описание 12. 1,1-Диметилэтил-4-[4-(метиламино)фенил]метил-1-пиперазинкарбоксилат (D12) Указанное в заголовке соединение получали из D11, используя способ, сходный со способом, описанным для D3 в описании 3 А, но при этом реакционную смесь нагревали при 50 С в течение ночи перед добавлением боргидрида натрия, и хроматография на колонке не требовалась.H (CDCl3, 400 МГц) 7,11 (2 Н, д), 6,57 (2 Н, д), 3,69 (1 Н, ушир.с), 3,40 (6 Н, м), 2,83 (3 Н, с), 2,36 (4 Н,м), 1,45 (9 Н, с)[значенияс поправками относительно неточного значения стандарта TMS в спектре 0,58 м.д.]. МС (ES+) : 206,2, молекулярный ион (МН+) не выявлен. Описание 13. Этил-6-[(4-фторфенил)окси]-3-пиридинкарбоксилат (D13) Гидрид натрия (0,653 г, 60% в минеральном масле, 16,338 ммоль) суспендировали в ДМФА (10 мл) в атмосфере аргона и двумя порциями добавляли 4-фторфенол (0,915 г, 8,169 ммоль). Смесь перемешивали в течение 20 мин, затем добавляли этил-6-хлор-3-пиридинкарбоксилат (1,515 г, 8,169 ммоль) вместе с дополнительным количеством ДМФА (4 мл) для обеспечения растворимости. Смесь нагревали до 80 С в течение 2,5 ч. Реакционной смеси давали возможность остыть до комнатной температуры и добавляли воду (30 мл). Раствор подкисляли до рН 3, используя 2 M HCl, и экстрагировали этилацетатом (3). Объединенные этилацетатные слои сушили и концентрировали, получая коричневое масло. Сырой продукт очищали хроматографией. Элюирование градиентом 0-25% Et2O/петролейный эфир давало указанное в заголовке соединение в виде бесцветного масла (0,284 г). Этил-6-[ (4-фторфенил)окси]-3-пиридинкарбоксилат (D13) (0,275 г, 1,054 ммоль) собирали в 1,4 диоксане (5 мл), а гидроксид лития (0,050 г, 2,109 ммоль) растворяли в воде. Два раствора объединяли и перемешивали при комнатной температуре в течение 2 ч. Смесь подкисляли до рН 5, используя 2 М HCl,и концентрировали. Остаток собирали в этилацетате, сушили и концентрировали, получая указанное в заголовке соединение в виде кремового/белого твердого вещества (0,233 г).H (ДМСО-d6, 400 МГц) 13,20 (1 Н, ушир.с), 8,65 (1 Н, дд), 8,28 (1 Н, дд), 7,26 (4 Н, м), 7,12 (1 Н, д). МС (ES) : МН+ 234,2, (М-Н+) 232,1. Описание 14. Альтернативный способ (А). 6-[(4-Фторфенил)окси]-3-пиридинкарбоновая кислота (D14) Смесь 4-фторфенола (96,8 г), метил-6-хлорпиридин-3-карбоксилата (30 г) и карбоната цезия (285,3 г) в ДМСО (875 мл) перемешивали и нагревали до 130 С в течение 1,75 ч, затем охлаждали в течение ночи. Реакционную смесь повторно нагревали до 150 С в течение 1,5 ч, выдерживали при такой температуре в течение 1 ч, затем охлаждали до 40 С и вливали в воду (4 л). Водный раствор экстрагировали эфиром (1,0 л), затем доводили до рН 7-8 добавлением 2 М HCl. Затем раствор экстрагировали эфиром(21,0 л), затем доводили до рН 2 добавлением 2 M HCl, вызывая осаждение твердого вещества. Осадок собирали фильтрованием, промывали водой и сушили в течение ночи при 40 С в вакууме, получая указанное в заголовке соединение в виде бежево-розового твердого вещества (36,7 г). Описание 15. 1,1-Диметилэтил-(2R,6S)-4-(4-6-(4-фторфенил)-2-метил-3-пиридинил]карбонил(метил)амино]фенилметил)-2,6-диметил-1-пиперазинкарбоксилат (D15)(14 мл) и добавляли ДМФА (1 каплю). Смесь охлаждали на бане со льдом и порциями в течение 5 мин добавляли оксалилхлорид (0,226 мл, 2,598 ммоль). Смесь нагревали до 40 С в течение 90 мин. Смеси давали возможность остыть и растворитель удаляли в вакууме, получая 6-(4-фторфенил)-2-метил-3 пиридинкарбонилхлорид в виде желтого твердого вещества (0,270 г), которое непосредственно использовали на стадии 2. Стадия 2. Хлорангидрид со стадии 1 собирали в ДХМ (3 мл) и добавляли к раствору 1,1-диметилэтил-(2R,6S)2,6-диметил-4-[4-(метиламино)фенил]метил-1-пиперазинкарбоксилата (D9) (0,23 г, 0,693 ммоль) в ДХМ (2 мл). Добавляли триэтиламин (0,193 мл, 1,386 ммоль) и смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь разбавляли ДХМ и промывали водой. Водный слой повторно экстрагировали ДХМ (2) и объединенные органические фазы сушили и концентрировали. Сырой продукт очищали хроматографией на колонке. Элюирование градиентом 0-50% EtOAc/петролейный эфир давало указанное в заголовке соединение в виде белой пены (0,331 г).- 22015820 Стадия 1. 6-[(4-Фторфенил)окси]-3-пиридинкарбоновую кислоту (D14) (0,232 г, 0,994 ммоль) растворяли в 1,4-диоксане (6 мл) и по каплям добавляли тионилхлорид (0,363 мл, 4,972 ммоль). Смесь кипятили с обратным холодильником в течение 3,5 ч, затем охлаждали и концентрировали в вакууме. ДХМ добавляли к остатку, который затем повторно концентрировали, получая 6-[(4-фторфенил)окси]-3 пиридинкарбонилхлорид в виде желтого масла (0,252 г), которое использовали непосредственно на стадии 2. Стадия 2. Хлорангидрид со стадии 1 собирали в ДХМ (3 мл) и добавляли к 1,1-диметилэтил-(2S)-2-метил-4[4-(метиламино)фенил]метил-1-пиперазинкарбоксилату (D3) (0,288 г, 0,904 ммоль) в ДХМ (3 мл). Добавляли триэтиламин (0,251 мл, 1,808 ммоль) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли ДХМ и промывали водой. Водный слой экстрагировали ДХМ(х 2) и объединенные органические слои сушили и концентрировали. Сырой продукт очищали хроматографией на колонке. Элюирование градиентом 0-50% EtOAc/петролейный эфир давало указанное в заголовке соединение в виде бесцветного масла (0,518 г).(А). 1,1-Диметилэтил-(2S)-4-(4-[(6-[(4-фторфенил)окси]-3 пиридинилкарбонил)(метил)амино]фенилметил)-2-метил-1-пиперазинкарбоксилат (D16) 6-[(4-Фторфенил)окси]-3-пиридинкарбоновую кислоту (D14) (20,1 г, 0,0862 моль) растворяли в 1,4 диоксане (400 мл) и осторожно добавляли тионилхлорид (28,5 мл, 4,972 ммоль). Смесь медленно нагревали до температуры образования флегмы и перемешивали в течение 4,5 ч. Реакционной смеси давали возможность остыть и концентрировали. Добавляли диоксан (200 мл) и раствор повторно концентрировали (2), получая неочищенный 6-[(4-фторфенил)окси]-3-пиридинкарбонилхлорид, который перерастворяли в ДХМ (250 мл). Полученный раствор по каплям добавляли к раствору 1,1-диметилэтил-(2S)-2 метил-4-[4-(метиламино)фенил]метил-1-пиперазинкарбоксилата (D3) (25 г, 0,0783 моль, полученного в виде трех разных партий согласно способу D3B, которые объединяли) и триэтиламина (14 мл, 0,1004 моль) в ДХМ (250 мл), охлажденному на бане лед/вода, в течение 30 мин. Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 15 ч. Реакционную смесь промывали 2 М раствором NaOH (2200 мл) и насыщенным раствором соли, затем сушили над MgSO4 и концентрировали в вакууме, получая коричневую пену/камедь. Сырой продукт очищали хроматографией, получая указанное в заголовке соединение в виде бесцветной пены (32,39 г). Указанные в таблице соединения D17, D40 и D41 получали, используя способы, подобные способам, раскрытым в описании 15, используя соответствующий анилиновый предшественник и соответствующую карбоновую кислоту. Указанные в таблице соединения D18-D53 (за исключением D40 и D41) получали, используя способы, подобные способам, раскрытым в описании 16, с использованием соответствующего анилинового предшественника и соответствующей карбоновой кислоты. 1,1-Диметилэтил-(2S)-2-метил-4-[4-(метиламино)фенил]метил-1-пиперазинкарбоксилат (D3) (0,4 г, 1,254 ммоль) собирали в ДХМ (4 мл) в атмосфере аргона. Добавляли 6-хлор-3 пиридинкарбонилхлорид (0,243 г, 1,379 ммоль) в ДХМ (4 мл) и триэтиламин (0,348 мл, 2,508 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. Смесь разбавляли ДХМ и промывали водой. Водный слой экстрагировали ДХМ (2) и объединенные органические фазы сушили и концентрировали, получая бледно-желтое масло. Сырой продукт очищали хроматографией на колонке. Элюирование градиентом 0-50% EtOAc/петролейный эфир давало указанное в заголовке соединение в виде белой пены/камеди (0,601 г). 1,1-Диметилэтил-(2S)-4-(4-(6-хлор-3-пиридинил)карбонил](метил)амино]фенилметил)-2-метил 1-пиперазинкарбоксилат (D54) (0,1 г, 0,218 ммоль) и 2-фторфенол (0,025 г, 0,436 ммоль) растворяли в ДМФА (5 мл). Добавляли карбонат калия (0,06 г, 0,436 ммоль) и смесь нагревали до 80 С в течение ночи,затем при 130 С в течение 7 ч. Смесь оставляли при комнатной температуре в течение ночи и растворитель удаляли в вакууме. Остаток распределяли между EtOAc и водой. Органический слой сушили и концентрировали, получая коричневое масло. Сырой продукт очищали с использованием MDAP, получая соль муравьиной кислоты. Соль собирали в ДХМ и промывали насыщенным раствором NaHCO3. Слой ДХМ сушили и концентрировали, получая указанное в заголовке соединение в виде бесцветного масла Указанное в заголовке соединение получали из 1,1-диметилэтил-(2S)-4-(4-(6-хлор-3 пиридинил)карбонил](метил)амино]фенилметил)-2-метил-1-пиперазинкарбоксилата(D54) и 3 фторфенола способом, подобным описанному для D55 в описании 55, получая указанное в заголовке соединение в виде бледно-желтого масла (0,057 г). МС (ES) : МН+ 535,3. Описание 57. 1,1-Диметилэтил-(2S)-4-(4-[(6-[(3-цианофенил)окси]-3-пиридинилкарбонил)(метил)амино]фенилметил)-2-метил-1-пиперазинкарбоксилат (D57) Указанное в заголовке соединение получали из 1,1-диметилэтил-(2S)-4-(4-(6-хлор-3 пиридинил)карбонил](метил)амино]фенилметил)-2-метил-1-пиперазинкарбоксилата(D54) и 3 цианофенола способом, подобным способу, который описан для D55 в описании 55, но температура/время реакции составляли 130 С в течение 24 ч, и очистку осуществляли хроматографией на колонке. При этом получали указанное в заголовке соединение в виде бесцветного масла (0,184 г). МС (ES): МН+ 542,3. Описание 58. 1,1-Диметилэтил-(2S)-4-(4-[(6-[(4-фторфенил)амино]-3-пиридинилкарбонил)(метил)амино]фенилметил)-2-метил-1-пиперазинкарбоксилат (D58)BINAP (0,041 г, 0,0654 ммоль), карбонат цезия (0,213 г, 0,654 ммоль) и ацетат палладия (0,009 г,0,0436 ммоль) объединяли в диоксане (1 мл) и обрабатывали ультразвуком в течение 1 ч в атмосфере аргона. К красной смеси добавляли 4-фторанилин (0,053 г, 0,479 ммоль) и 1,1-диметилэтил-(2S)-4-(4(6-хлор-3-пиридинил)карбонил](метил)амино]фенилметил)-2-метил-1-пиперазинкарбоксилат(0,2 г, 0,436 ммоль). Смесь перемешивали при 60 С в течение 1 ч, растворитель удаляли в вакууме и остаток распределяли между EtOAc и водой. Слой EtOAc сушили и концентрировали. Сырой продукт очищали хроматографией. Элюирование градиентом 0-7 0% EtOAc/петролейный эфир давала указанное в заголовке соединение в виде бледно-желтого масла (0,110 г). Стадия 1. 1-(4-Фторфенил)-4-пиперидинкарбоновую кислоту (0,1 г, 0,45 ммоль) перемешивали в диоксане (5 мл) и по каплям добавляли тионилхлорид (0,165 мл, 2,25 ммоль). После перемешивания в течение 1 ч растворитель удаляли выпариванием, к остатку добавляли ДХМ и затем повторно концентрировали, получая 1-(4 фторфенил)-4-пиперидинкарбонилхлорид, который непосредственно использовали на стадии 2. Стадия 2. Хлорангидрид со стадии 1 собирали в ДХМ (2,5 мл) и по каплям добавляли к 1,1-диметилэтил-(2S)2-метил-4-[4-(метиламино)фенил]метил-1-пиперазинкарбоксилату (D3) (0,121 г, 0,38 ммоль) в ДХМ(2,5 мл), затем добавляли триэтиламин (0,080 мл, 0,57 ммоль). Реакционную смесь перемешивали в течение 3 ч в атмосфере аргона, затем растворитель удаляли выпариванием. Остаток распределяли между ДХМ (30 мл) и водой (30 мл). Водный слой повторно экстрагировали ДХМ (30 мл) и объединенные органические слои сушили и концентрировали, получая указанное в заголовке соединение в виде желтого масла. Стадия 1. 6-(3-Фторфенил)-3-пиридинкарбоновую кислоту (82 мг, 0,376 ммоль) перемешивали в диоксане (4 мл) и по каплям добавляли тионилхлорид (0,137 мл, 1,88 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 40 мин, затем концентрировали в вакууме, получая 6-(3-фторфенил)-3 пиридинкарбонилхлорид в виде белого твердого вещества (0,088 г), который использовали непосредственно на стадии 2. Стадия 2. Хлорангидрид со стадии 1 собирали в ДХМ и по каплям добавляли к смеси 1,1-диметилэтил-(2S)-2 метил-4-[4-(метиламино)фенил]метил-1-пиперазинкарбоксилата (D3) (0,1 г, 0,313 ммоль) и триэтиламина(0,065 мл, 0,47 ммоль) в ДХМ (5 мл). Реакционную смесь перемешивали при комнатной температуре в атмосфере аргона в течение 15 ч, затем разбавляли водой и ДХМ. Органический слой сушили и концентрировали, получая сырой продукт, который очищали хроматографией на колонке. Элюирование смесьюEtOAc/петролейный эфир давало указанное в заголовке соединение в виде желтого масла (0,127 г).
МПК / Метки
МПК: C07D 239/28, C07D 295/12, C07D 213/78, A61K 31/495, A61P 1/00
Метки: gpr38, лечения, предназначенные, рецептором, пиперазинила, заболеваний, производные, опосредованных
Код ссылки
<a href="https://eas.patents.su/30-15820-proizvodnye-piperazinila-prednaznachennye-dlya-lecheniya-zabolevanijj-oposredovannyh-receptorom-gpr38.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пиперазинила, предназначенные для лечения заболеваний, опосредованных рецептором gpr38</a>
Предыдущий патент: Композиция, содержащая рутин и полиненасыщенную жирную кислоту, имеющая ингибирующую активность в отношении 5a-редуктазы
Следующий патент: Трициклические азотсодержащие соединения в качестве антибактериальных агентов
Случайный патент: Производное аминоалкилзамещенного n-тиенилбензамида












