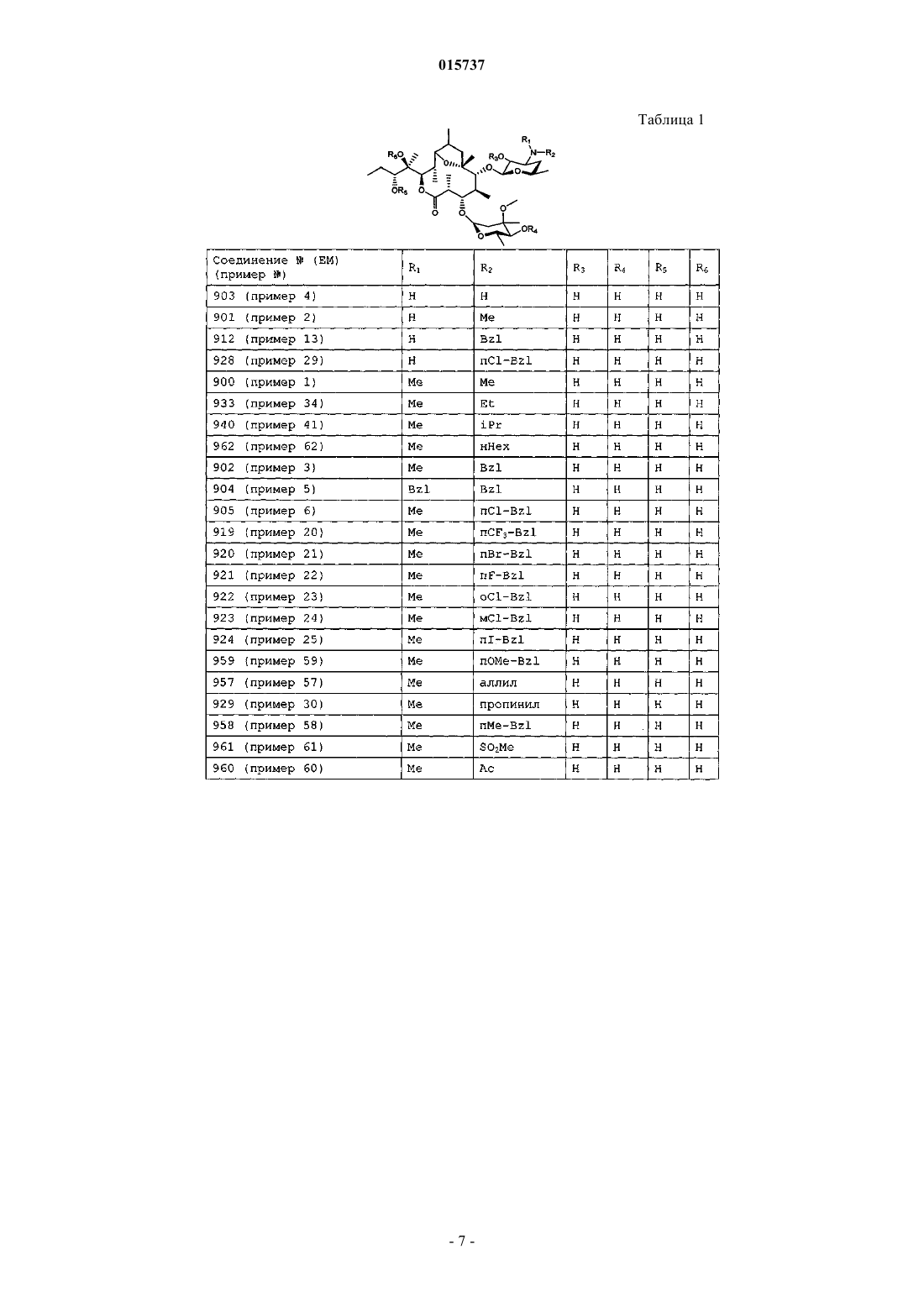
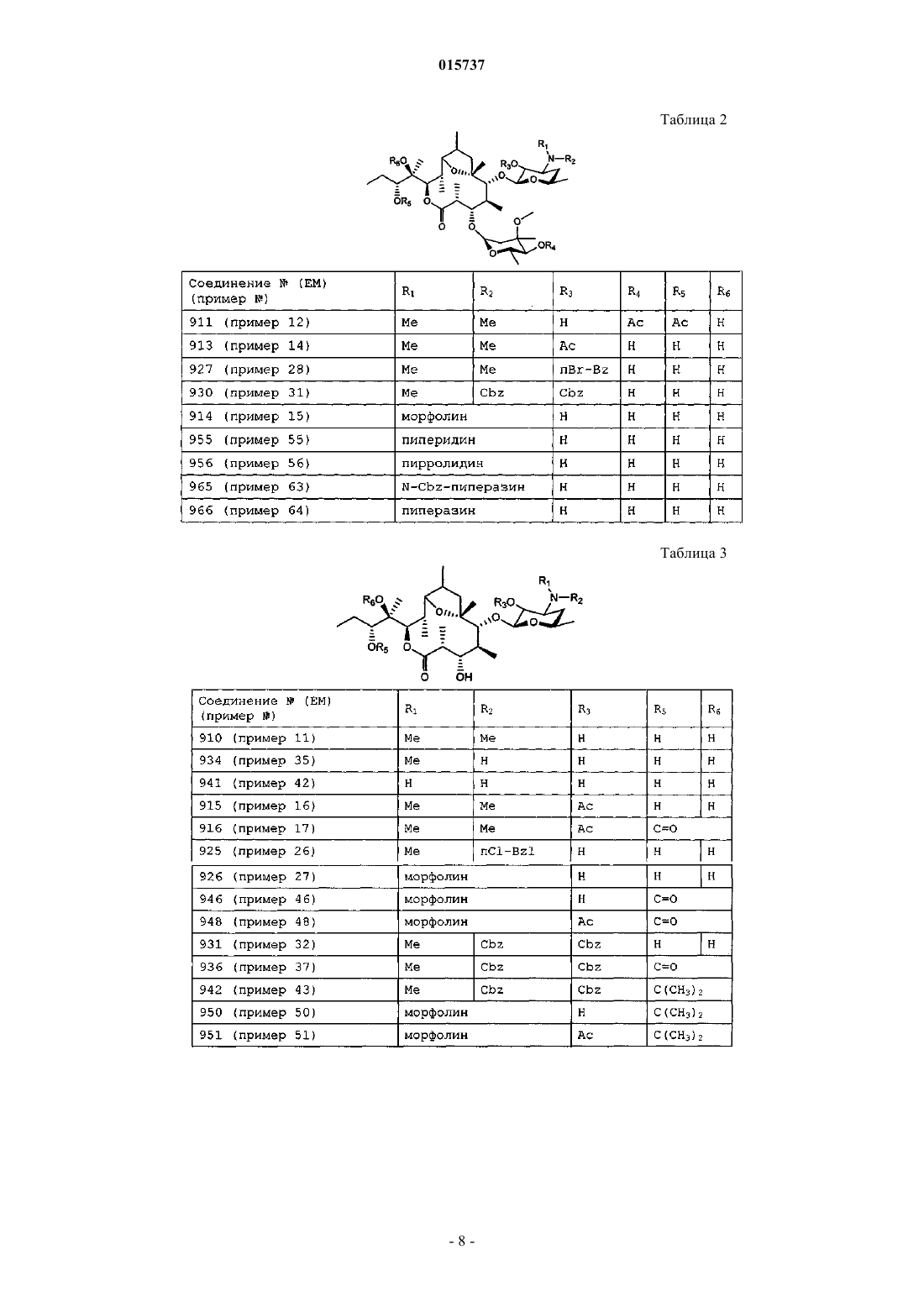
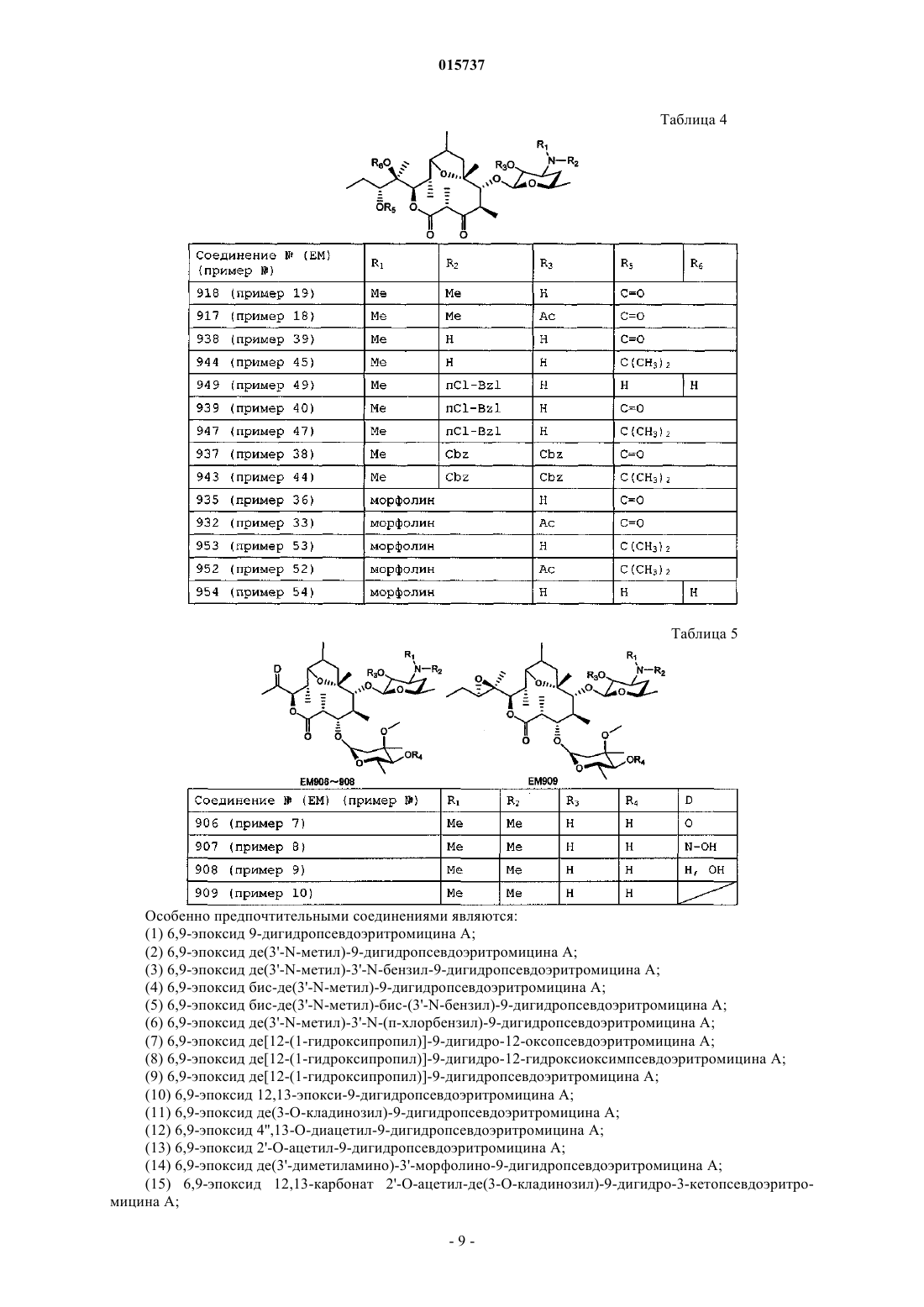
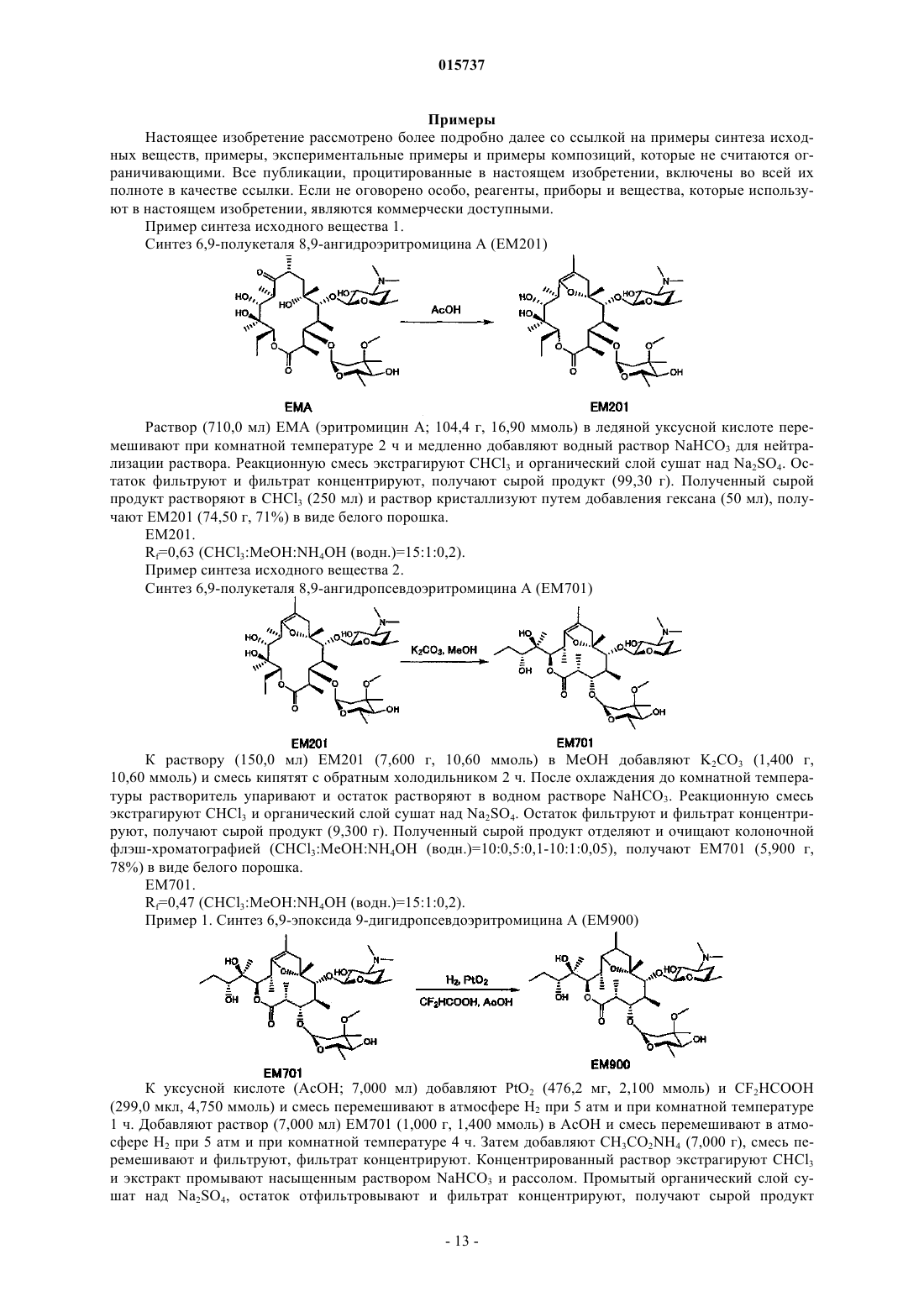
Новые производные дигидропсевдоэритромицина
Номер патента: 15737
Опубликовано: 31.10.2011
Авторы: Суназука Тосиаки, Нагаи Кенитиро, Ямабе Харуко, Омура Сатоси, Сима Хидеаки
Формула / Реферат
1. Соединение, представленное следующей формулой [I]:
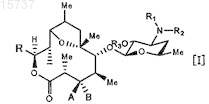
где Me представляет собой метильную группу;
R1 и R2являются одинаковыми или разными и каждый из них представляет собой атом водорода, С1-12 алкильную группу, формильную группу, ацильную группу, содержащую С1-12алкильную группу, ацильную группу, содержащую С6-14арильную группу, сульфонильную группу, С6-14арилзамещенную С1-12алкильную группу, необязательно замещенную заместителем(ями), выбранным(и) из С1-12 алкоксигруппы, галогена,
С1-12алкильной группы, гидроксильной группы, галогензамещенной С1-12 алкильной группы и галогензамещенной С1-12алкоксигруппы, С6-14арилзамещенную С1-12 алкилоксикарбонильную группу, С2-12 алкенильную группу или С2-12алкинильную группу или R1 и R2 в комбинации образуют вместе со смежным атомом азота морфолиновый цикл, пиперидиновый цикл, пиперазиновый цикл или пирролидиновый цикл, каждый из которых необязательно замещен С6-14арилзамещенной С1-12алкилоксикарбонильной группой;
R3 представляет собой атом водорода, галогензамещенную или незамещенную формильную группу, ацильную группу, содержащую С1-12алкильную группу, или ацильную группу, содержащую С6-14арильную группу, или С6-14арилзамещенную С1-12алкилоксикарбонильную группу;
А представляет собой атом водорода;
В представляет собой гидроксильную группу или группу, представленную следующей формулой [II]:
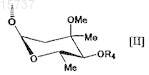
где Me представляет собой метильную группу и
R4 представляет собой атом водорода, формильную группу, ацильную группу, содержащую С1-12алкильную группу, или ацильную группу, содержащую С6-14арильную группу, или А и В в комбинации образуют =O;
R представляет собой группу, представленную следующей формулой [III]:
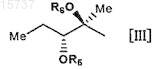
где Me представляет собой метильную группу;
R5 и R6являются одинаковыми или разными и каждый представляет собой атом водорода, формильную группу, ацильную группу, содержащую С1-12алкильную группу, или ацильную группу, содержащую С6-14 арильную группу, или R5 и R6в комбинации образуют карбонильную группу или алкиленовую группу, заместитель, представленный следующей формулой [IV]:
![]()
где Me представляет собой метильную группу;
D представляет собой O или N-OH или D представляет собой атом водорода и гидроксильную группу (-Н,
-OH),
или заместитель, представленный следующей формулой [V]:
![]()
где Me представляет собой метильную группу,
или его фармакологически приемлемая соль.
2. Соединение по п.1, где R представляет собой группу, представленную следующей формулой [III]:

где Me представляет собой метильную группу;
R5 и R6являются одинаковыми или разными и каждый представляет собой атом водорода, формильную группу, ацильную группу, содержащую С1-12алкильную группу, или ацильную группу, содержащую C6-14 арильную группу, или R5и R6 в комбинации образуют карбонильную группу или алкиленовую группу,
или его фармакологически приемлемая соль.
3. Соединение по п.1 или 2, где А и В в комбинации образуют =O, или его фармакологически приемлемая соль.
4. Соединение по п.1 или 2, где А представляет собой атом водорода и В представляет собой гидроксильную группу, или его фармакологически приемлемая соль.
5. Соединение по п.1 или 2, где А представляет собой атом водорода и В представляет собой группу, представленную следующей формулой [II]:
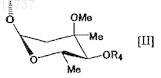
где Me представляет собой метильную группу и
R4 представляет собой атом водорода, формильную группу, ацильную группу, содержащую С1-12алкильную группу, или ацильную группу, содержащую С6-14арильную группу,
или его фармакологически приемлемая соль.
6. Соединение по п.5, где R4 представляет собой атом водорода, или его фармакологически приемлемая соль.
7. Соединение по любому из пп.1-6, где R1 и R2 являются одинаковыми или разными и каждый из них представляет собой атом водорода, С1-12алкильную группу, бензильную группу, необязательно замещенную заместителем(ями), выбранным(и) из C1-12алкоксигруппы, галогена, С1-12алкильной группы, гидроксильной группы, галогензамещенной С1-12алкильной группы и галогензамещенной С1-12алкоксигруппы, или бензилоксикарбонильную группу или R1и R2 в комбинации образуют вместе со смежным атомом азота морфолиновый цикл, пиперидиновый цикл, пиперазиновый цикл или пирролидиновый цикл, каждый из которых необязательно замещен С6-14арилзамещенной С1-12алкилоксикарбонильной группой, или его фармакологически приемлемая соль.
8. Соединение по п.7, где R1 и R2являются одинаковыми или разными и каждый из них представляет собой атом водорода, низшую алкильную группу, содержащую от 1 до 3 атомов углерода, или галогензамещенную бензильную группу, или его фармакологически приемлемая соль.
9. Соединение по любому из пп.1-8, где R3 представляет собой атом водорода, ацетильную группу, галогензамещенную или незамещенную бензоильную группу или бензилоксикарбонильную группу, или его фармакологически приемлемая соль.
10. Соединение по любому из пп.1-8, где R3 представляет собой атом водорода, галогензамещенную или незамещенную ацетильную группу или бензоильную группу, или его фармакологически приемлемая соль.
11. Соединение, представляющее собой:
(1) 6,9-эпоксид 9-дигидропсевдоэритромицина А;
(2) 6,9-эпоксид де(3'-N-метил)-9-дигидропсевдоэритромицина А;
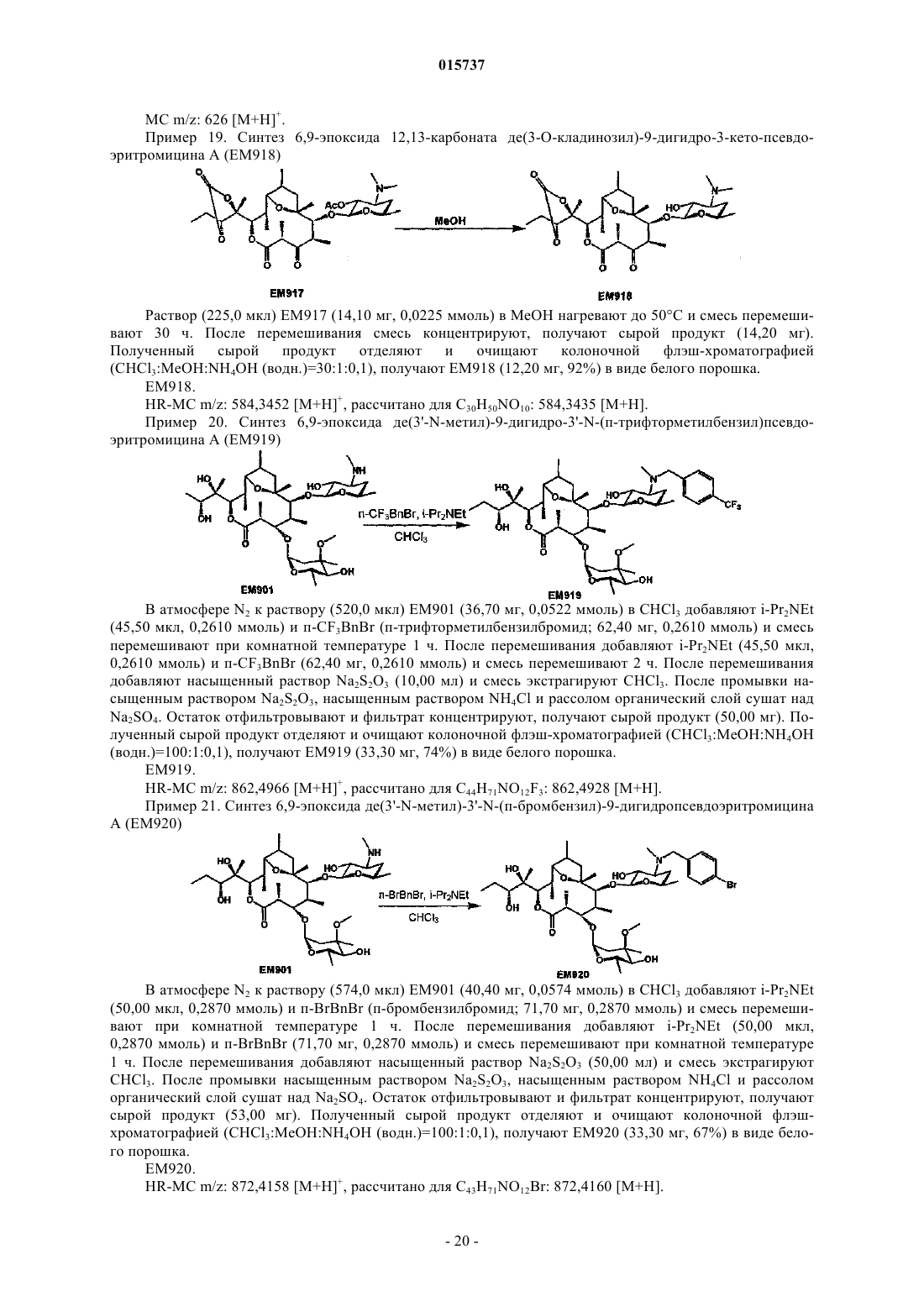
(3) 6,9-эпоксид де(3'-N-метил)-3'-N-бензил-9-дигидропсевдоэритромицина А;
(4) 6,9-эпоксид бис-де(3'-N-метил)-9-дигидропсевдоэритромицина А;
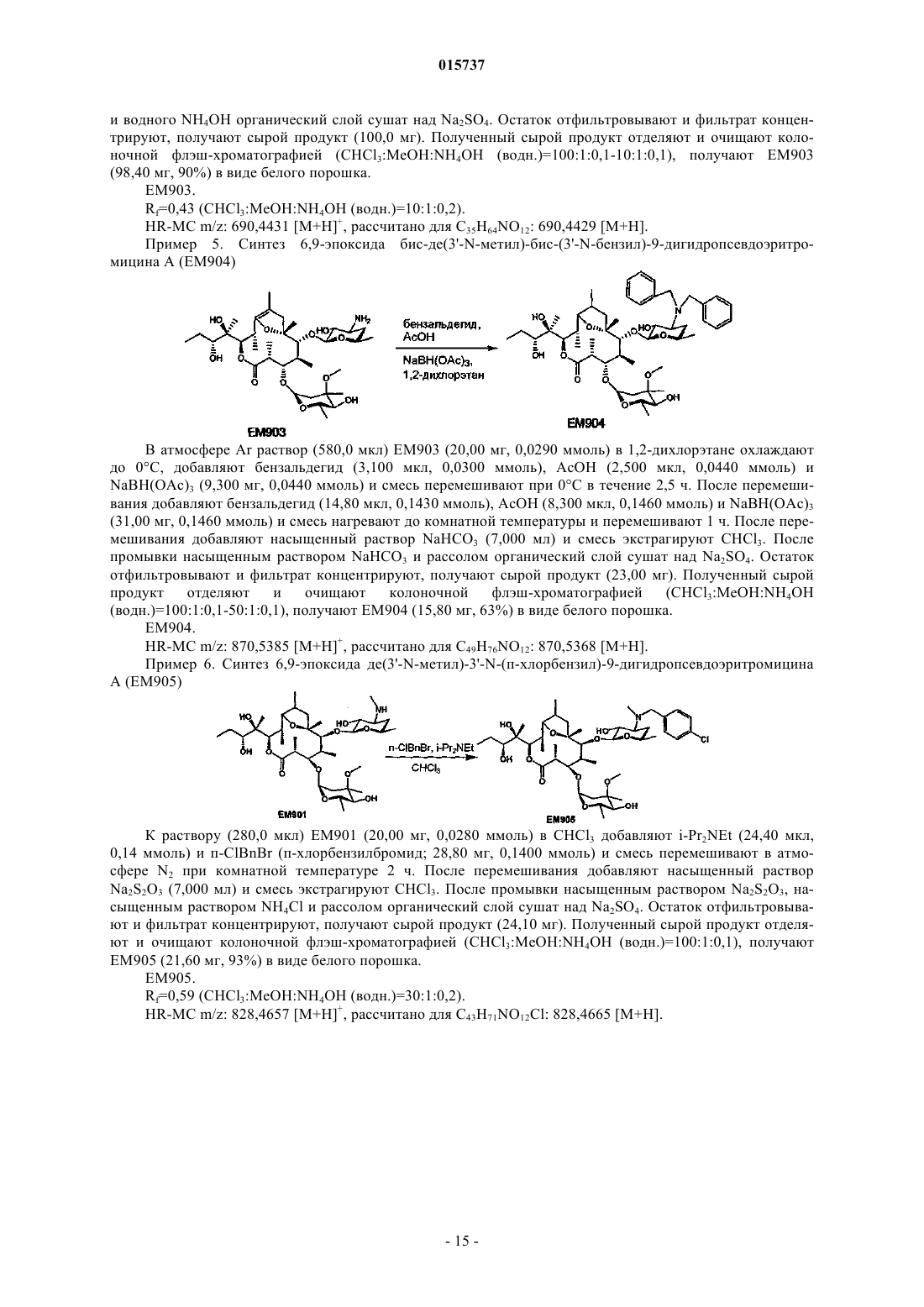
(5) 6,9-эпоксид бис-де(3'-N-метил)-бис-(3'-N-бензил)-9-дигидропсевдоэритромицина А;
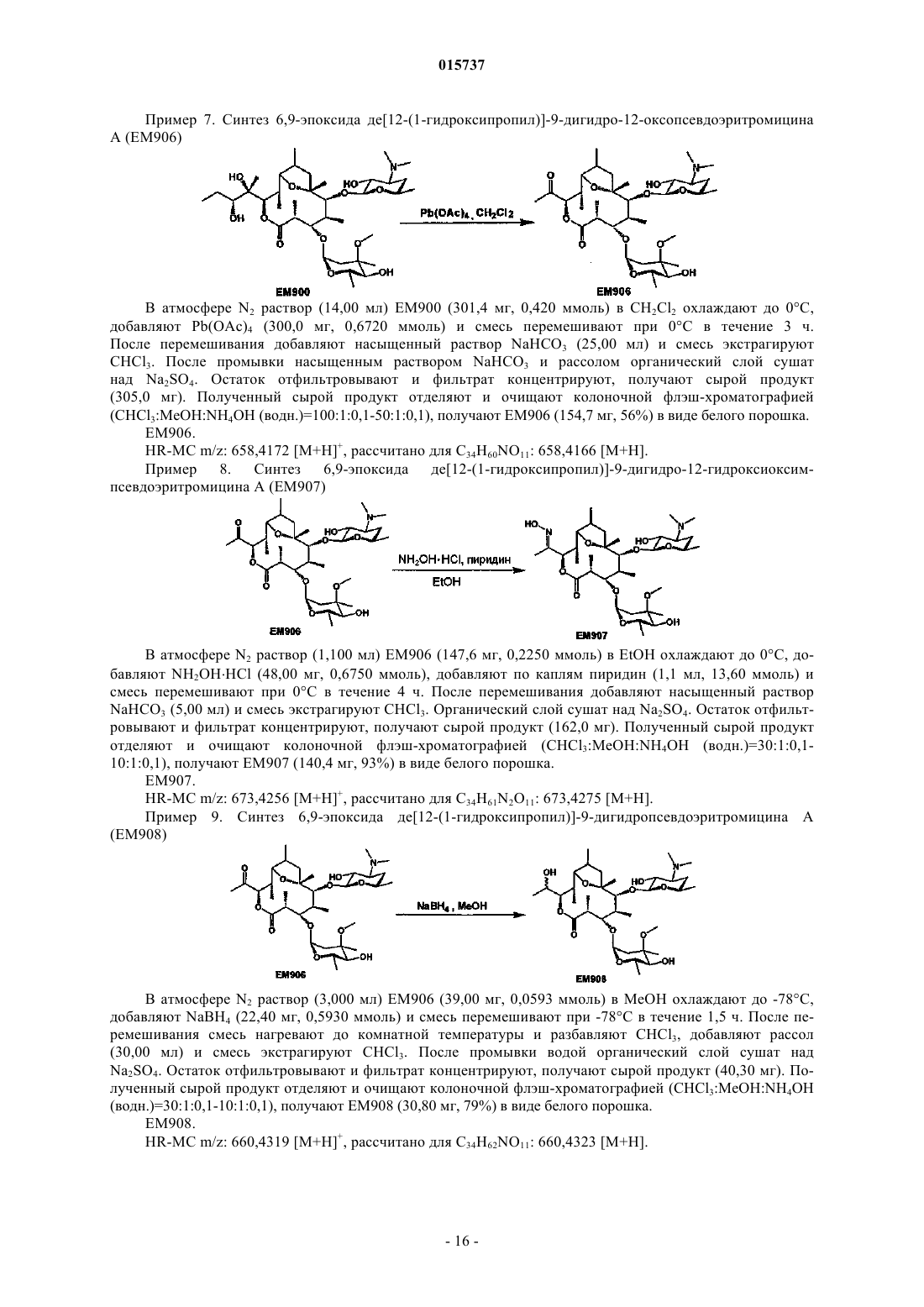
(6) 6,9-эпоксид де(3'-N-метил)-3'-N-(п-хлорбензил)-9-дигидропсевдоэритромицина А;
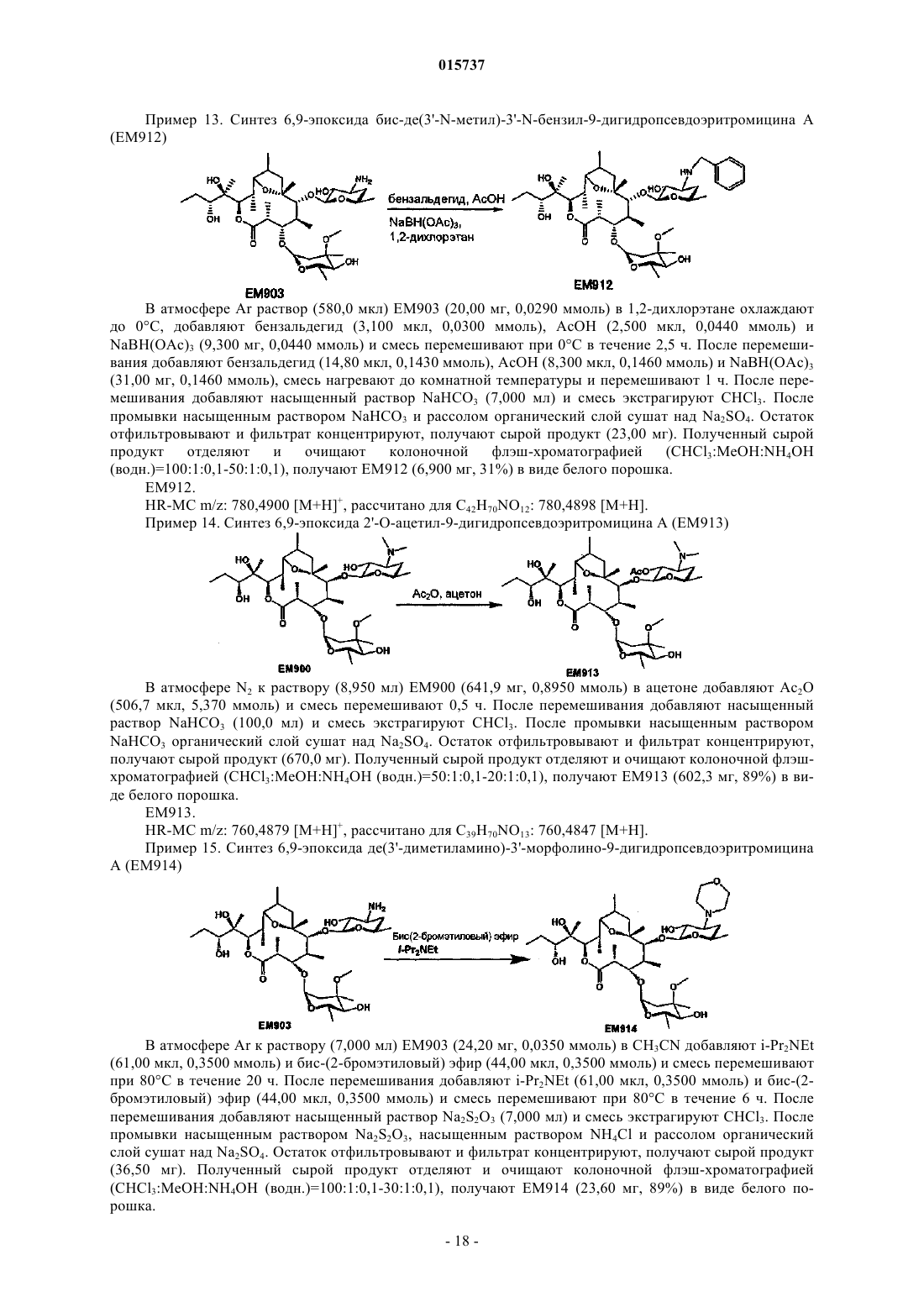
(7) 6,9-эпоксид де[12-(1-гидроксипропил)]-9-дигидро-12-оксопсевдоэритромицина А;
(8) 6,9-эпоксид де[12-(1-гидроксипропил)]-9-дигидро-12-гидроксиоксимпсевдоэритромицина А;
(9) 6,9-эпоксид де[12-(1-гидроксипропил)]-9-дигидропсевдоэритромицина А;
(10) 6,9-эпоксид 12,13-эпокси-9-дигидропсевдоэритромицина А;
(11) 6,9-эпоксид де(3-O-кладинозил)-9-дигидропсевдоэритромицина А;
(12) 6,9-эпоксид 4'',13-O-диацетил-9-дигидропсевдоэрит
Текст
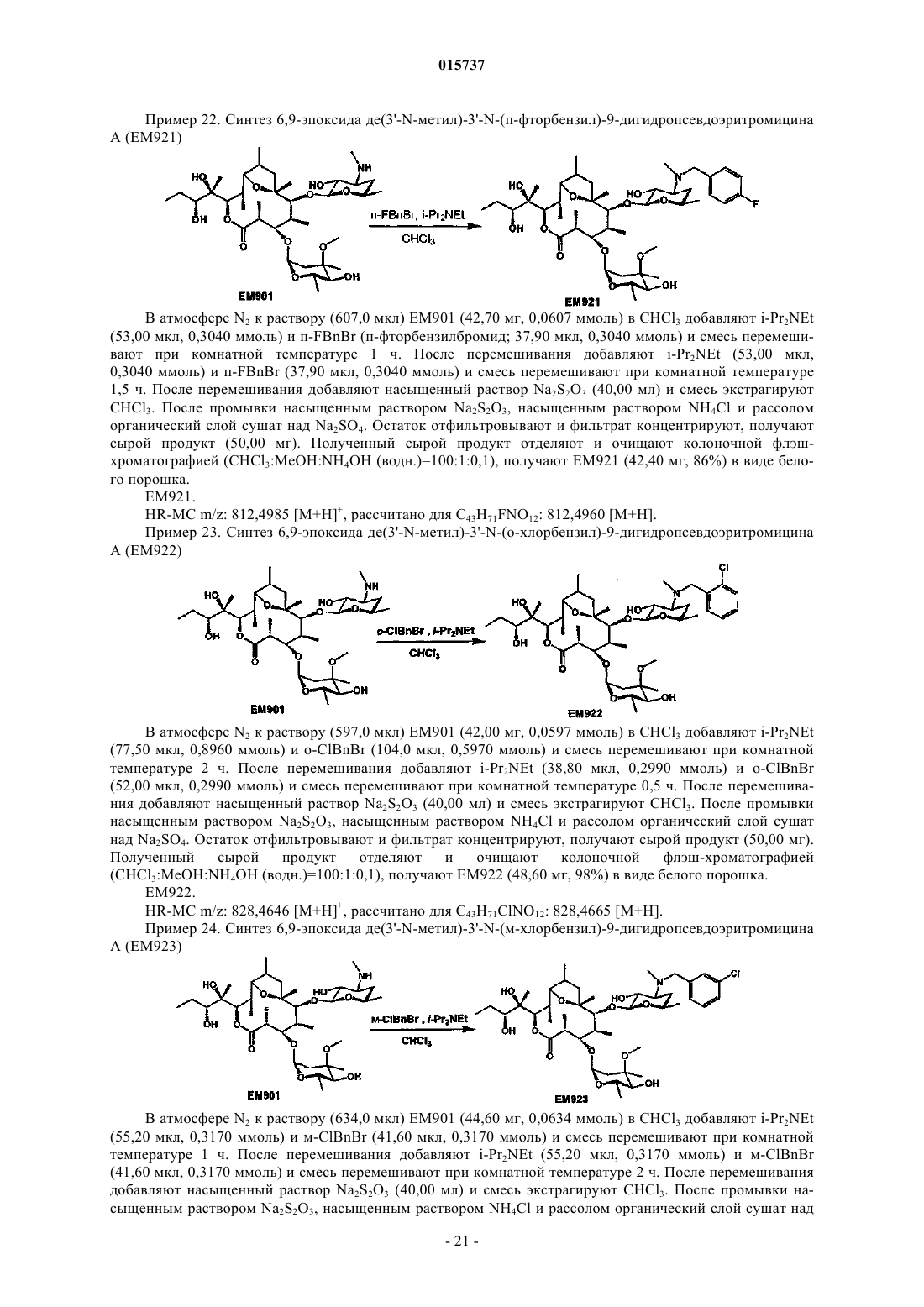
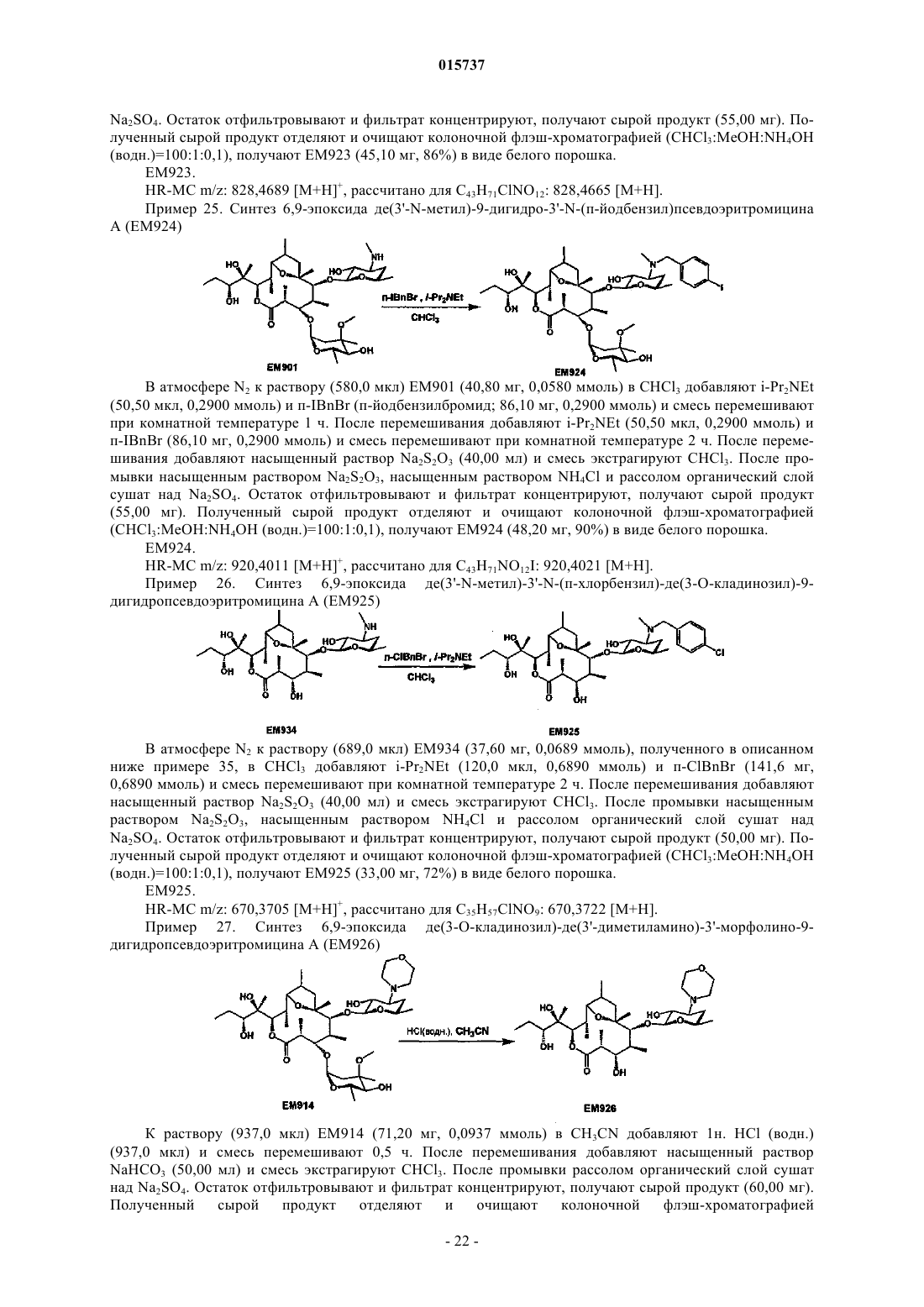
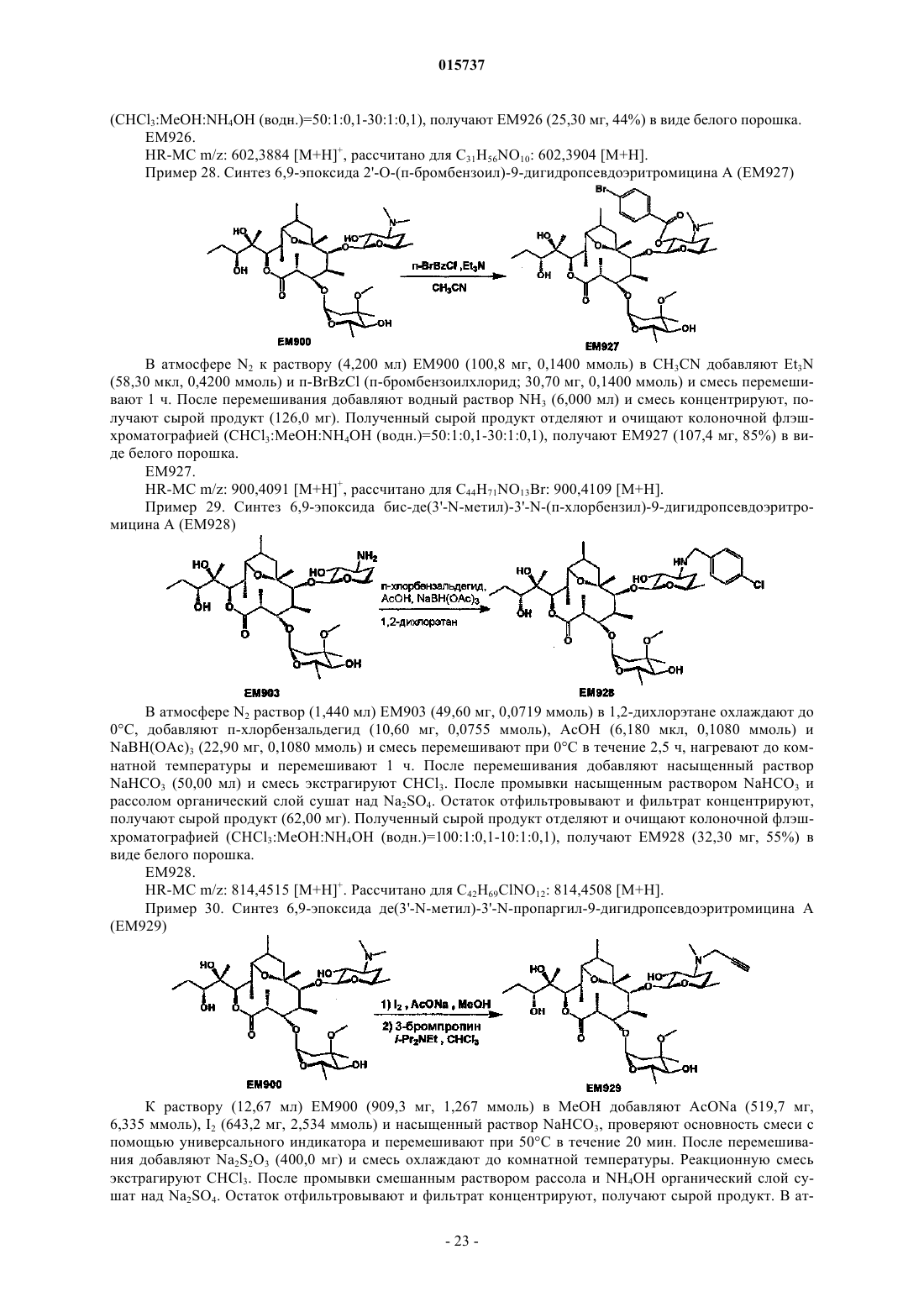
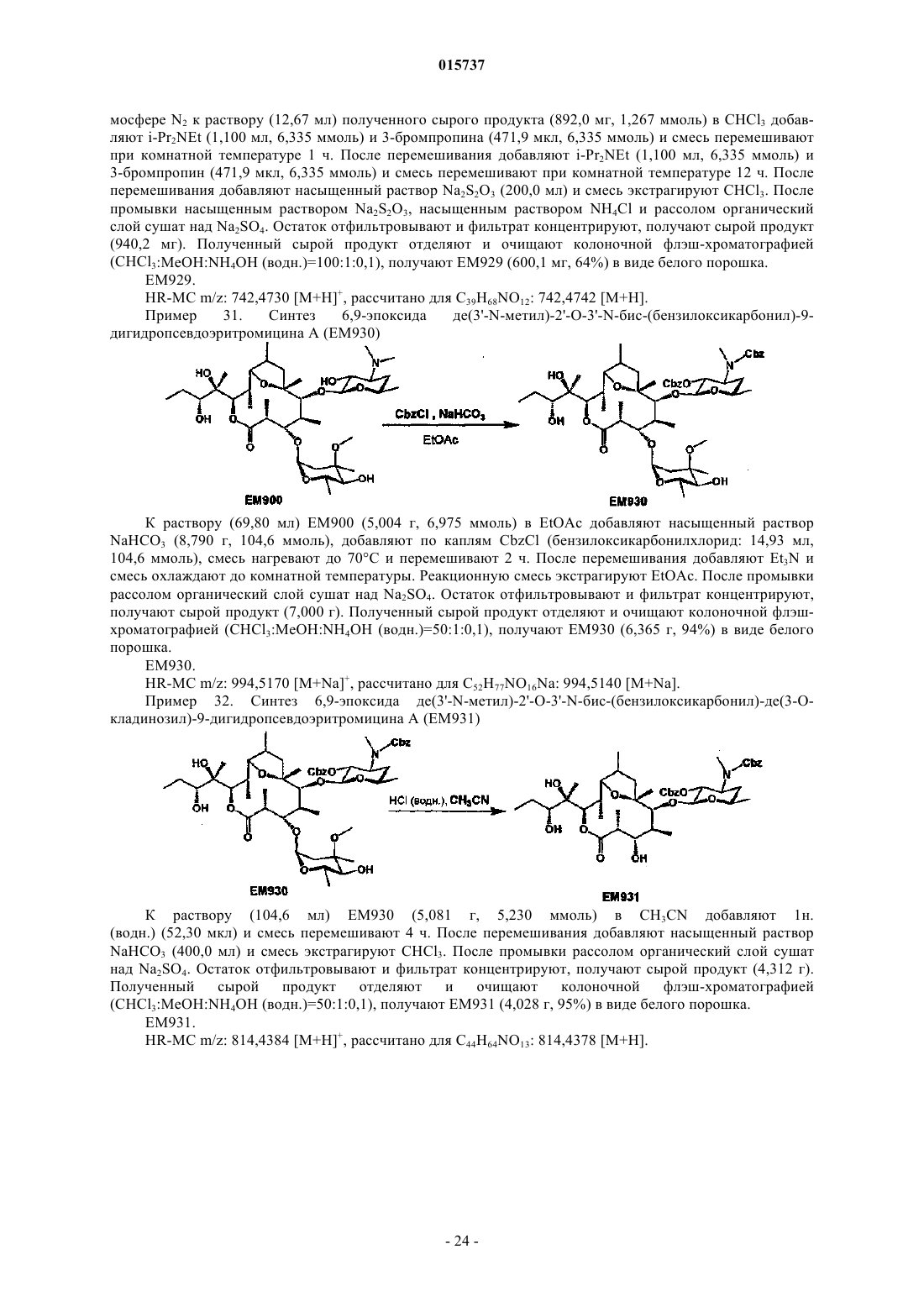
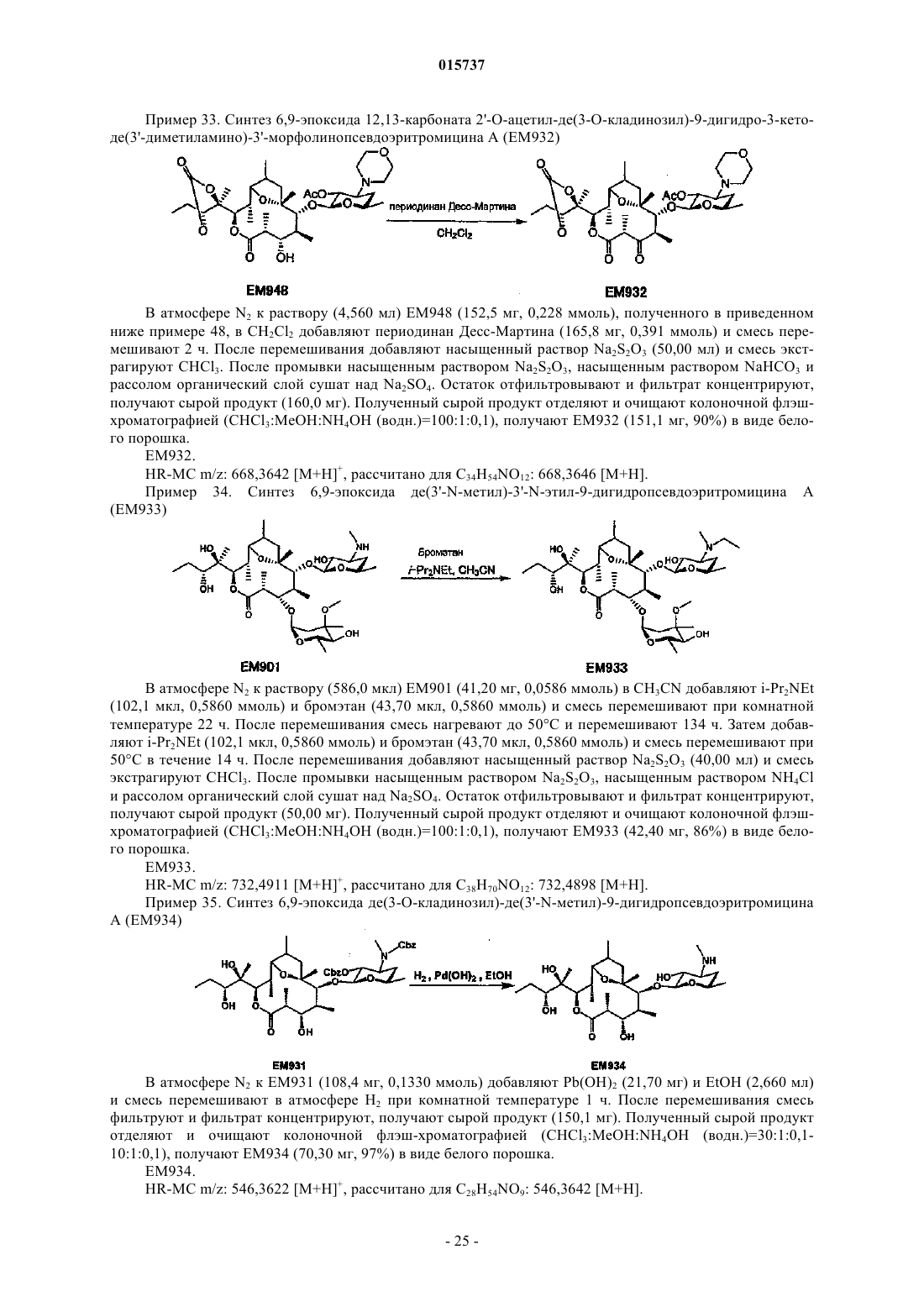
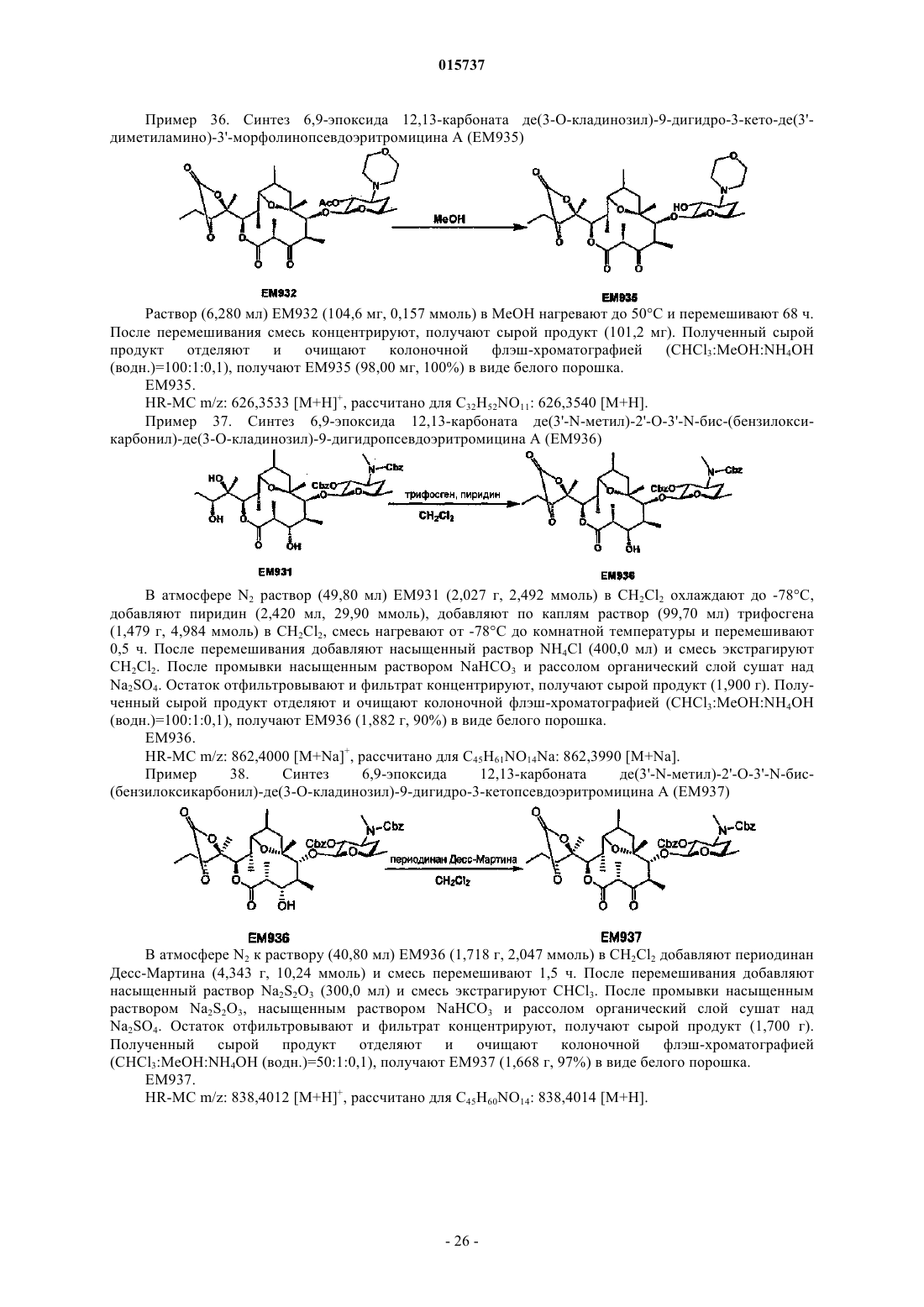
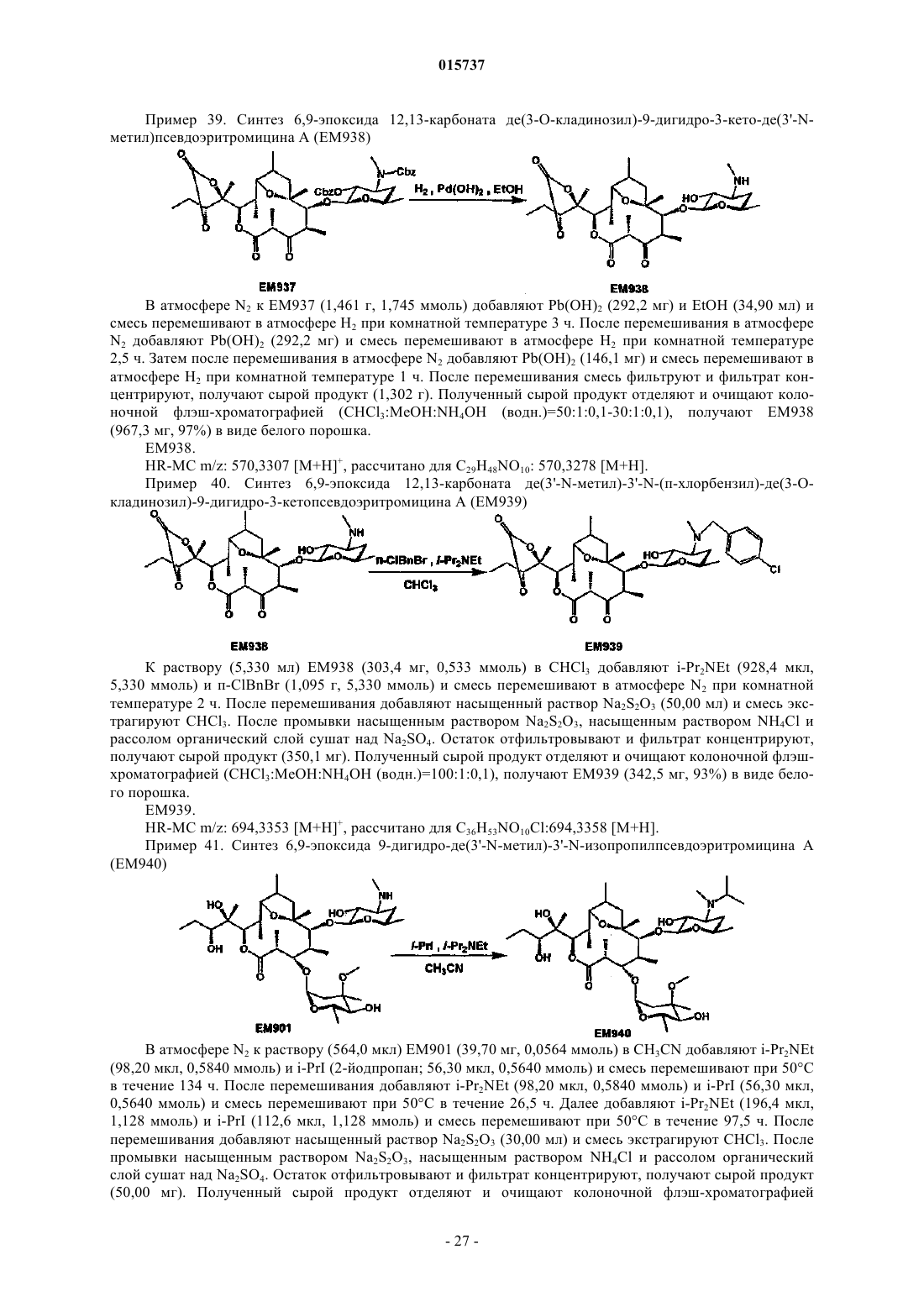
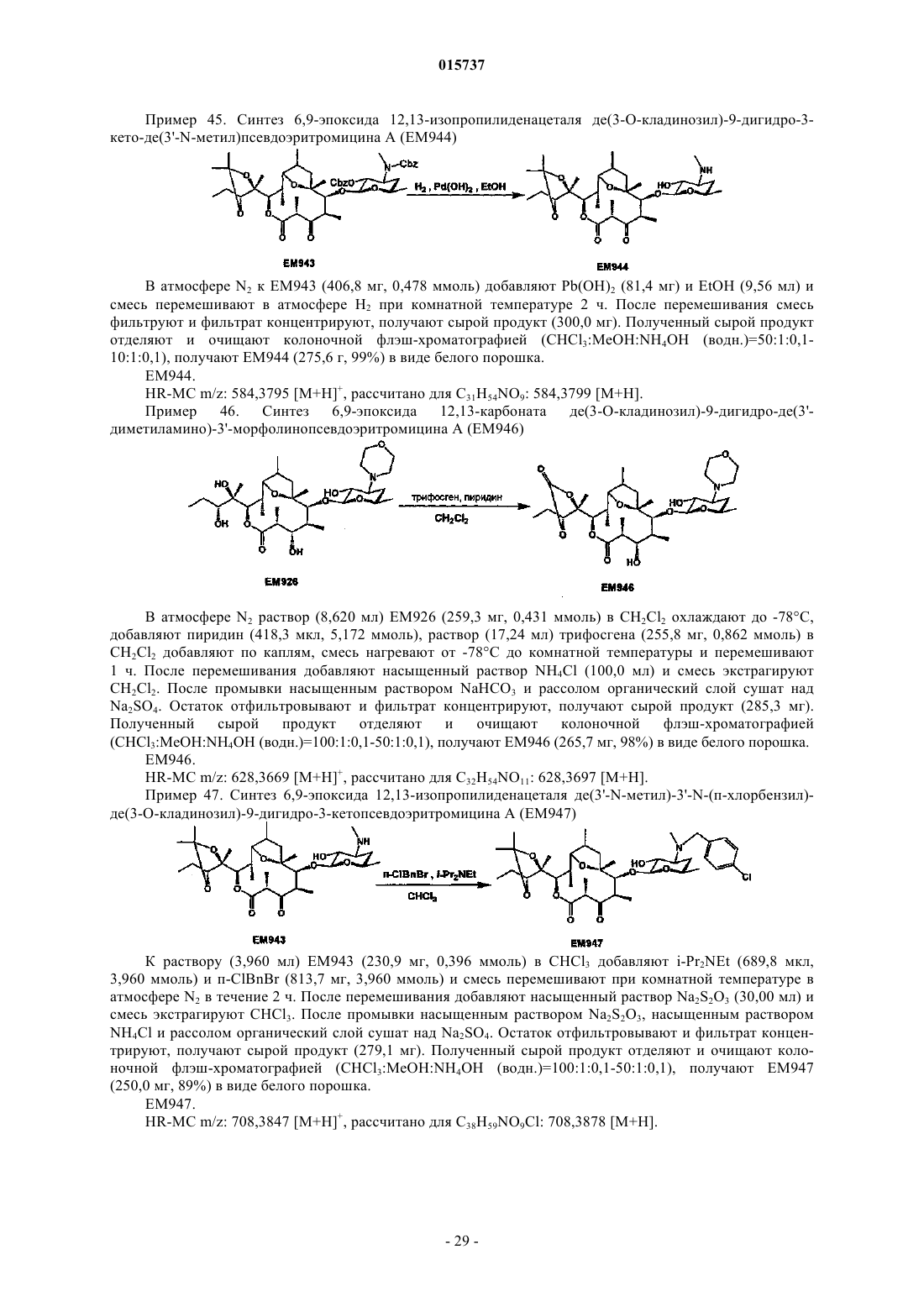
Дата публикации и выдачи патента Номер заявки Предложено соединение, представленное формулой [I], где каждый символ имеет значение,определенное в описании, или его фармакологически приемлемая соль, а также фармацевтическая композиция, содержащая данное соединение в качестве активного ингредиента. 015737 Область техники Настоящее изобретение относится к новому производному дигидропсевдоэритромицина. В частности, настоящее изобретение относится к новому производному дигидропсевдоэритромицина, которое обладает улучшенной противовоспалительной активностью и стабильностью. Уровень техники Эритромицин (14-членный циклический макролид) трудно использовать в качестве противовоспалительного агента, так как он одновременно обладает противовоспалительным действием и антибактериальным действием. Для решения этой проблемы предложено производное псевдоэритромицина(12-членный цикл, см. THE KITASATO INSTITUTE, серия ЕМ 700, WO 2002/14338 и WO 2004/39823),обладающее противовоспалительным действием, но не проявляющее антибактериального действия. Типичным соединением является ЕМ 703, которое представлено следующей формулой: Проблема упомянутого выше производного псевдоэритромицина состоит в том, что его фармакологическое действие не может быть проявлено в достаточной степени при пероральном введении, так как производное частично разлагается кислотой и становится относительно нестабильным. Дигидроформа, полученная восстановлением с целью решения этой проблемы, устойчива к кислоте и проявляет хорошее фармакологическое действие при пероральном введении. Наряду с этим Faghih R.,Nellans H.N., Lartey P.A., Petersen A., Marsh K., Bennani Y.L., Plattner J.J. в публикации "Preparation of 9-deoxo-4-deoxy-6,9-epoxyerythromycin lactams "motilactides": potent and orally active prokinetic agents"(Bioorg. Med. Chem. Lett. 1988, 8(7):805-10) описали дигидропсевдоэритромициновые производные, которые все представляют собой 4-дегидроксиформы кладинозы (сахар в 3-м положении). В документе показано, что производные дигидропсевдоэритромицина проявляют слабую активность, стимулирующую желудочно-кишечную моторику, но их противовоспалительное действие не описано. Описание изобретения Целью настоящего изобретения является исключение антибактериальной активности эритромицина и разработка соединения, имеющего только противовоспалительное действие, в частности разработка стабильного производного псевдоэритромицина. Авторы настоящего изобретения провели интенсивные исследования, пытаясь решить указанную проблему, и достигли успеха в исключении антибактериального действия за счет использования 12-членного цикла и дополнительного восстановления соединения с получением дигидроформы, в результате чего улучшается устойчивость к кислоте, что приводит к реализации настоящего изобретения. Таким образом, настоящее изобретение предлагает следующее.[1]. Соединение, представленное следующей формулой [I]: где Me представляет собой метильную группу;R1 и R2 являются одинаковыми или разными и каждый из них представляет собой атом водорода,алкильную группу, ацильную группу, сульфонильную группу, замещенную или незамещенную арилзамещенную алкильную группу, арилзамещенную алкилоксикарбонильную группу, алкенильную группу или алкинильную группу или R1 и R2 в комбинации образуют вместе со смежным атомом азота замещенную или незамещенную алициклическую гетероциклическую группу;R3 представляет собой атом водорода, замещенную или незамещенную ацильную группу или арилзамещенную алкилоксикарбонильную группу; А представляет собой атом водорода;-1 015737 В представляет собой гидроксильную группу или группу, представленную следующей формулой где Me представляет собой метильную группу;R4 представляет собой атом водорода или ацильную группу; или А и В в комбинации образуют =O;R представляет собой группу, представленную следующей формулой [III]: где Me представляет собой метильную группу;R5 и R6 являются одинаковыми или разными и каждый представляет собой атом водорода или ацильную группу или R5 и R6 в комбинации образуют карбонильную группу или замещенную или незамещенную алкиленовую группу, заместитель, представленный следующей формулой [IV]: где Me представляет собой метильную группу;D представляет собой O или N-OH или D представляет собой атом водорода и гидроксильную группу (-Н, -OH), или заместитель, представленный следующей формулой [V]: где Me представляет собой метильную группу,или его фармакологически приемлемая соль.[2]. Соединение по пункту [1], где R представляет собой группу, представленную следующей формулой [III]: где Me представляет собой метильную группу;R5 и R6 являются одинаковыми или разными и каждый представляет собой атом водорода или ацильную группу или R5 и R6 в комбинации образуют карбонильную группу или замещенную или незамещенную алкиленовую группу,или его фармакологически приемлемая соль.[3]. Соединение по пунктам [1] или [2], где А и В в комбинации образуют =O, или его фармакологически приемлемая соль.[4]. Соединение по пунктам [1] или [2], где А представляет собой атом водорода и В представляет собой гидроксильную группу, или его фармакологически приемлемая соль.[5]. Соединение по пунктам [1] или [2], где А представляет собой атом водорода и В представляет собой группу, представленную следующей формулой [II]: где Me представляет собой метильную группу;R4 представляет собой атом водорода или ацильную группу,или его фармакологически приемлемая соль.[6]. Соединение по пункту [5], где R4 представляет собой атом водорода,или его фармакологически приемлемая соль.[7]. Соединение по любому из пунктов [1]-[6], где R1 и R2 являются одинаковыми или разными и каждый из них представляет собой атом водорода, алкильную группу, замещенную или незамещенную бензильную группу или бензилоксикарбонильную группу или R1 и R2 в комбинации образуют вместе со смежным атомом азота замещенную или незамещенную алициклическую гетероциклическую группу,или его фармакологически приемлемая соль.[8]. Соединение по пункту [7], где R1 и R2 являются одинаковыми или разными и каждый из них представляет собой атом водорода, низшую алкильную группу, содержащую от 1 до 3 атомов углерода,или галогензамещенную бензильную группу, или его фармакологически приемлемая соль.[9]. Соединение по пункту [7], где замещенная или незамещенная алициклическая гетероциклическая группа, образованная R1 и R2 в комбинации со смежным атомом азота, представляет собой замещенный или незамещенный морфолиновый цикл, пиперидиновый цикл, пиперазиновый цикл или пирролидиновый цикл, или его фармакологически приемлемая соль.[10]. Соединение по любому из пунктов [1]-[9], где R3 представляет собой атом водорода, ацетильную группу, замещенную или незамещенную бензоильную группу или бензилоксикарбонильную группу,или его фармакологически приемлемая соль.[11]. Соединение по пункту [10], где R3 представляет собой атом водорода, замещенную или незамещенную ацетильную группу или бензоильную группу, или его фармакологически приемлемая соль.(24) 6,9-эпоксид де(3'-N-метил)-3'-N-(п-хлорбензил)-де(3-О-кладинозил)-9-дигидро-3-кетопсевдоэритромицина А; или его фармакологически приемлемая соль.(3) 6,9-эпоксид 12,13-карбонат де(3'-N-метил)-3'-N-(п-хлорбензил)-де(3-O-кладинозил)-9-дигидро-3 кето-псевдоэритромицина А; или его фармакологически приемлемая соль.[14]. Фармацевтическая композиция, содержащая соединение по любому из пунктов [1]-[13] или его фармакологически приемлемую соль в качестве активного ингредиента.[15]. Фармацевтическая композиция по пункту [14], которую используют для профилактики или лечения воспалительного заболевания.[16]. Фармацевтическая композиция по пункту [15], где воспалительное заболевание представляет собой воспалительное заболевание кишечника.[17]. Способ профилактики или лечения воспалительного заболевания, включающий введение эффективного количества соединения по любому из пунктов [1]-[13] или его фармакологически приемлемой соли нуждающемуся в этом пациенту.[18]. Способ по пункту [17], где воспалительное заболевание представляет собой воспалительное заболевание кишечника.[19]. Применение соединения по любому из пунктов [1]-[13] или его фармакологически приемлемой соли для производства фармацевтического агента для профилактики или лечения воспалительного заболевания.[20]. Применение по пункту [19], где воспалительное заболевание представляет собой воспалительное заболевание кишечника.[21]. Промышленная упаковка, содержащая агент для профилактики или лечения воспалительного заболевания, который включает соединение по любому из пунктов [1]-[13] или его фармакологически приемлемую соль в качестве активного ингредиента, и письменные данные, указывающие, что агент может быть или должен быть использован для профилактики или лечения воспалительного заболевания. Подробное описание изобретения В соединении, представленном с помощью приведенной выше формулы [I], пространственные структуры в 8- и 9-м положениях не имеют особенных ограничений. Соединение настоящего изобретения охватывает все стереоизомеры в 8- и 9-м положениях. В настоящем описании "алкильная группа" представляет собой линейную или разветвленную алкильную группу, содержащую от 1 до 12 атомов углерода, или циклическую алкильную группу,содержащую от 3 до 10 атомов углерода. Примерами являются метильная группа, этильная группа,н-пропильная группа, н-бутильная группа, н-пентильная группа, н-гексильная группа, н-гептильная группа, н-октильная группа, н-нонильная группа, н-децильная группа, н-ундецильная группа,н-додецильная группа, изопропильная группа, изобутильная группа, втор-бутильная группа,трет-бутильная группа, изопентильная группа, трет-пентильная группа, неопентильтная группа,2-пентильная группа, 3-пентильная группа, 2-гексильная группа, трет-октильная группа, циклопропильная группа, циклобутильная группа, циклопентильная группа, циклогексильная группа, 1-адамантильная группа и т.д., причем предпочтительная низшая алкильная группа содержит от 1 до 3 атомов углерода(метильная группа, этильная группа, н-пропильная группа и т.д.). В настоящем описании "ацильная группа" представляет собой формильную группу, ацильную группу, содержащую линейную или разветвленную алкильную группу, содержащую от 1 до 12 атомов углерода, или циклическую алкильную группу, содержащую от 3 до 10 атомов углерода, ацильную группу, содержащую линейную или разветвленную алкенильную группу, содержащую от 2 до 12 атомов углерода, или циклическую алкенильную группу, содержащую от 3 до 10 атомов углерода, или ацильную группу, включающую арильную группу, содержащую от 6 до 14 атомов углерода. Как используется в данном описании, арильная группа представляет собой моноциклическуютрициклическую ароматическую углеводородную группу, содержащую от 6 до 14 атомов углерода. Примерами являются фенильная группа, бифенильная группа, нафтильная группа, антрильная группа, фенантрильная группа и т.д. Примерами ацильной группы являются формильная группа, ацетильная группа, пропионильная группа, бутирильная группа, изобутирильная группа, валерильная группа, изовалерильная группа, пивалоильная группа, гексаноильная группа, акрилоильная группа, метакрилоильная группа, кротоноильная группа, изокротоноильная группа, бензоильная группа, нафтаноильная группа и т.д., причем предпочтение отдается ацетильной и бензоильной группам. В настоящем описании определение "замещенная или незамещенная ацильная группа" означает незамещенную ацильную группу (которая определена выше) или замещенную ацильную группу. Примерами заместителя являются атом галогена (йода, брома, хлора, фтора), алкильная группа (которая определена выше), алкоксигруппа, гидроксильная группа, галогензамещенная алкильная группа, галогензамещенная алкоксигруппа и т.д., причем предпочтение отдается атому галогена. Как используется в данном случае, алкоксигруппа представляет собой алкоксигруппу, содержащую линейную или разветвленную алкильную группу, содержащую от 1 до 12 атомов углерода, или циклическую алкильную группу, содержащую от 3 до 10 атомов углерода. Примерами являются метоксигруппа, этоксигруппа, пропоксигруппа, 1-метилэтоксигруппа, бутоксигруппа, 2-метилпропоксигруппа, 1,1-диметилэтоксигруппа, пентоксигруппа, 3-метилбутоксигруппа, гексоксигруппа, 4-метилпентоксигруппа, циклопропилоксигруппа,циклобутилоксигруппа, циклопентилоксигруппа, циклогексилоксигруппа и т.д. Галогензамещенная алкильная группа и галогензамещенная алкоксигруппа представляют собой алкильную группу (которая определена выше) и алкоксигруппу (которая определена выше), каждая из которых замещена одним или несколькими атомами галогена (который определен выше). В настоящем описании определение "замещенная или незамещенная арилзамещенная алкильная группа" означает алкильную группу, замещенную незамещенным арилом, или алкильную группу, замещенную замещенным арилом. Определение "арилзамещенная алкильная группа" представляет собой алкильную группу (которая определена выше), замещенную арильной группой (которая определена выше), например фенилметильную группу (бензильная группа), дифенилметильную группу, трифенилметильную группу (тритильная группа), фенилэтильную группу (фенэтильная группа), 3-фенилпропильную группу, 2-фенилпропильную группу, 4-фенилбутильную группу, бифенилметильную группу, нафтилметильную группу и т.д., причем-4 015737 предпочтение отдается бензильной группе. Примерами заместителей в арилзамещенной алкильной группе являются алкоксигруппа (которая определена выше), атом галогена (который определен выше), алкильная группа (которая определена выше), гидроксильная группа, галогензамещенная алкильная группа(которая определена выше), галогензамещенная алкоксигруппа (которая определена выше) и т.д., причем предпочтение отдается атому галогена. Если не оговорено особо, положения и количества таких заместителей являются необязательными и конкретно не ограничены. При наличии замещения двумя или более заместителями эти заместители могут быть одинаковыми или разными. В настоящем описании определение "арилзамещенная алкилоксикарбонильная группа" означает алкилоксикарбонильную группу, включающую линейную или разветвленную алкильную группу, содержащую от 1 до 12 атомов углерода, или циклическую алкильную группу, содержащую от 3 до 10 атомов углерода, которая замещена арильной группой (которая определена выше). Примерами являются бензилоксикарбонильная группа, тритилоксикарбонильная группа, дифенилметилоксикарбонильная группа, фенетилоксикарбонильная группа и т.д., причем предпочтение отдается бензилоксикарбонильной группе. В настоящем описании определение "алкенильная группа" означает линейную или разветвленную алкенильную группу, содержащую от 2 до 12 атомов углерода, или циклическую алкенильную группу,содержащую от 3 до 10 атомов углерода и одну ненасыщенную связь (двойную связь). Примеры включают аллильную группу, пропенильную группу, бутенильную группу, циклогексенильную группу и т.д. Предпочтительной является аллильная группа. В настоящем описании определение "алкинильная группа" означает линейную или разветвленную алкинильную группу, содержащую от 2 до 12 атомов углерода, или циклическую алкинильную группу,содержащую от 3 до 10 атомов углерода и одну ненасыщенную связь (тройную связь). Примеры включают пропаргильную группу и 1-пентинильную группу. В настоящем описании определение "замещенная или незамещенная алициклическая гетероциклическая группа" означает незамещенную алициклическую гетероциклическую группу или замещенную алициклическую гетероциклическую группу. Определение "алициклический гетероцикл" означает моноцикл, не содержащий сопряженных двойных связей в максимальном количестве, который образуется путем связывания атома углерода по меньшей мере с одним гетероатомом, таким как атом кислорода, атом азота, атом серы и т.д. Конкретными примерами являются пирролиновый цикл, пирролидиновый цикл, имидазолиновый цикл, имидазолидиновый цикл, пиразолиновый цикл, пиразолидиновый цикл, пиперидиновый цикл, пиперазиновый цикл, морфолиновый цикл и т.д. Предпочтительными являются морфолиновый цикл, пиперидиновый цикл, пиперазиновый цикл и пирролидиновый цикл и особенно предпочтительными являются морфолиновый цикл и пиперазиновый цикл. Примерами заместителя алициклической гетероциклической группы являются алкильная группа (которая определена выше), арильная группа (которая определена выше),карбонильная группа (например, упоминавшаяся выше арилзамещенная алкилоксикарбонильная группа) и т.д.R1 и R2 предпочтительно являются одинаковыми или разными и каждый из них представляет собой атом водорода, алкильную группу, замещенную или незамещенную бензильную группу или бензилоксикарбонильную группу, или R1 и R2 в комбинации образуют вместе со смежным атомом азота замещенную или незамещенную алициклическую гетероциклическую группу. Более предпочтительно R1 и R2 являются одинаковыми или разными, и каждый из них представляет собой атом водорода, низшую алкильную группу, содержащую от 1 до 3 атомов углерода, или галогензамещенную бензильную группу; или R1 и R2 в комбинации образуют вместе со смежным атомом азота замещенный или незамещенный морфолиновый цикл, пиперидиновый цикл, пиперазиновый цикл или пирролидиновый цикл (предпочтительно морфолиновый цикл или пиперазиновый цикл). Примерами заместителей алициклической гетероциклической группы являются алкильная группа (которая определена выше), арильная группа (которая определена выше), карбонильная группа (которая определена выше) и т.д. Предпочтительной является арилзамещенная алкилоксикарбонильная группа и более предпочтительной является бензилоксикарбонильная группа.R3 предпочтительно представляет собой атом водорода, ацетильную группу, замещенную или незамещенную бензоильную группу или бензилоксикарбонильную группу, более предпочтительно атом водорода или ацетильную группу.-5 015737 А представляет собой атом водорода, В представляет собой гидроксильную группу или группу,представленную следующей формулой [II]: где Me представляет собой метильную группу иR4 представляет собой атом водорода или ацильную группу, или А и В в комбинации предпочтительно образуют =O; R4 особенно предпочтительно представляет собой атом водорода.R предпочтительно представляет собой группу, представленную следующей формулой [III]: где Me представляет собой метильную группу;R5 и R6 являются одинаковыми или разными, и каждый представляет собой атом водорода или ацильную группу или R5 и R6 в комбинации образуют карбонильную группу или замещенную или незамещенную алкинильную группу. Конкретные примеры предпочтительных соединений настоящего изобретения представлены в таблицах; однако соединения настоящего изобретения не ограничены ими. Определение каждого символа в настоящем описании имеет следующее значение:Me: метильная группа; Et: этильная группа; iPr: изопропильная группа; н-Нех: н-гексильная группа; Ас: ацетильная группа; Bzl: бензильная группа; п-Cl-Bzl: бензильная группа, замещенная атомом хлора в пара-положении; п-Br-Bzl: бензильная группа, замещенная атомом брома в пара-положении; п-F-Bzl: бензильная группа, замещенная атомом фтора в пара-положении; п-I-Bzl: бензильная группа, замещенная атомом йода в пара-положении; o-Cl-Bzl: бензильная группа, замещенная атомом хлора в ортоположении; м-Cl-Bzl: бензильная группа, замещенная атомом хлора в мета-положении; п-CF3-Bzl: бензильная группа, замещенная трифторметильной группой в пара-положении; п-OMe-Bzl: бензильная группа, замещенная метоксигруппой в пара-положении; Cbz: бензилоксикарбонильная группа; п-Br-Bz: бензильная группа, замещенная атомом брома в пара-положении; п-Me-Bzl: бензоильная группа, замещенная метильной группой в пара-положении. Особенно предпочтительными соединениями являются:(24) 6,9-эпоксид де(3'-N-метил)-3'-N-(п-хлорбензил)-де(3-O-кладинозил)-9-дигидро-3-кетопсевдоэритромицина А. Более предпочтительными соединениями являются: 6,9-эпоксид де(3'-N-метил)-3'-N-(п-хлорбензил)-9-дигидропсевдоэритромицина А,6,9-эпоксид де(3'-диметиламино)-3'-морфолино-9-дигидропсевдоэритромицина А и 6,9-эпоксид 12,13-карбонат де(3'-N-метил)-3'-N-(п-хлорбензил)-де(3-O-кладинозил)-9-дигидро-3 кетопсевдоэритромицина А. Способ получения соединения настоящего изобретения особенно не ограничен, и, например, соединения могут быть получены в соответствии с приведенными ниже способами и др. Кроме того, примеры настоящего описания более конкретно представляют способы получения предпочтительных соединений. Специалист в данной области может получить любое соединение настоящего изобретения, опираясь на приведенные ниже общие разъяснения и конкретные методики примеров и соответствующим образом модифицируя или заменяя исходные вещества, реакционные условия, реакционные реагенты и т.д., если это необходимо. Например, из соединений, представленных формулой [I], соединение, где А представляет собой атом водорода и В представляет собой группу, представленную формулой [II], могут быть получены в соответствии со способом, показанным на приведенной ниже схеме. То есть, в соответствии со ссылками (а) I.O. Kibwage, R. Busson, G. Janssen, J. Hoogmartens,H. Vanderhaeghe, Translactonization of Erythromycins, J. Org. Chem., 52, 990-996, 1987; (b) H.A. Kirst, J.A.Wind, J.W. Paschal, Synthesis of Ring-Constracted Derivatives of Erythromycin, J. Org. Chem., 52, 4359-4362,1987, эритромицин А обрабатывают ледяной уксусной кислотой с получением 6,9-полукеталя 8,9-ангидроэритромицина А (ЕМ 201). Затем соединение кипятят с обратным холодильником в присутствии карбоната калия в метаноле с получением 6,9-полукеталя 8,9-ангидропсевдоэритромицина А(ЕМ 701). Затем проводят каталитическое гидрирование с использованием оксида платины и дифторуксусной кислоты в уксусной кислоте, синтезируя 6,9-эпоксид 9-дигидропсевдоэритромицина А (ЕМ 900). Затем соединение обрабатывают йодом и ацетатом натрия, получают 6,9-эпоксид де(3'-N-метил)-9 дигидропсевдоэритромицина А (ЕМ 901), который затем дополнительно обрабатывают йодом и метоксидом натрия с получением 6,9-эпоксида бис-де(3'-N-метил)-9-дигидропсевдоэритромицина А (ЕМ 903). Используя представленные выше ЕМ 901 или ЕМ 903, различные производные, которые представляют собой соединения настоящего изобретения, такие как 6,9-эпоксид де(3'-N-метил)-3'-N-бензил-9 дигидропсевдоэритромицина А (ЕМ 902), могут быть синтезированы путем различных реакций алкилирования, ацилирования и т.д. С другой стороны, из соединений, представленных формулой [I], соединения, где А и В в комбинации образуют =O или А представляет собой атом водорода и В представляет собой гидроксильную группу, могут быть получены, например, в соответствии со способом, представленным на следующей схеме. Более конкретно, описанный выше 6,9-эпоксид 9-дигидропсевдоэритромицина А (ЕМ 900) в качестве исходного вещества обрабатывают бензилоксикарбонилхлоридом с получением 6,9-эпоксида де(3'-N-метил)-2'-O-3'-N-бис-(бензилоксикарбонил)-9-дигидропсевдоэритромицина А (ЕМ 930), который затем обрабатывают соляной кислотой в ацетонитриле, получают 6,9-эпоксид де(3'-N-метил)-2'-O-3'-Nбис-(бензилоксикарбонил)-де(3-O-кладинозил)-9-дигидропсевдоэритромицина A (EM931). Описанный выше ЕМ 931 подвергают каталитическому гидрированию с использованием катализатора, гидроксида палладия, синтезируя 6,9-эпоксид де(3-O-кладинозил)-де(3'-N-метил)-9-дигидропсевдоэритромицина А(ЕМ 934). ЕМ 931 обрабатывают трифосгеном в пиридине и получают 6,9-эпоксид 12,13-карбонат де(3'-Nметил)-2'-O-3'-N-бис-(бензилоксикарбонил)-де(3-O-кладинозил)-9-дигидропсевдоэритромицина А (ЕМ 936),который затем окисляют реагентом Десса-Мартина и получают 6,9-эпоксид 12,13-карбонат де(3'-N-метил)2'-O-3'-N-бис-(бензилоксикарбонил)-де(3-O-кладинозил)-9-дигидро-3-кетопсевдоэритромицина А (ЕМ 937),который дополнительно подвергают каталитическому гидрированию с использованием катализатора, гидроксида палладия, синтезируют 6,9-эпоксид 12,13-карбонат де(3-O-кладинозил)-де(3'-N-метил)-9-дигидро 3-кетопсевдоэритромицина А (ЕМ 938). Используя представленные выше ЕМ 934, ЕМ 938 или др., проводят различные реакции алкилирования, ацилирования и т.д., чтобы синтезировать различные производные, которые представляют собой соединения настоящего изобретения, такие как 6,9-эпоксид де(3'-N-метил)-3'-N-(п-хлорбензил)-де(3-Oкладинозил)-9-дигидропсевдоэритромицина А (ЕМ 925). Примерами фармацевтически приемлемой соли, которая может быть образована соединением настоящего изобретения, являются соли неорганических кислот, такие как гидрохлорид, гидробромид, гидройодид, сульфат, нитрат, фосфат и т.д.; соли органических кислот, такие как сукцинат, фумарат, ацетат,метансульфонат, толуолсульфонат и т.д.; соли щелочных металлов, такие как соль натрия, соль калия и т.д.; соли щелочно-земельных металлов, такие как соль магния, соль кальция и т.д., аммониевые соли,такие как аммониевая соль, алкиламмониевая соль и т.д. Кроме того, сольваты описанного выше соединения или фармацевтически приемлемой соли также входят в объем настоящего изобретения. Примерами растворителя являются вода, метанол, этанол, изопропанол, ацетон, этилацетат и т.д.- 11015737 Так как соединение настоящего изобретения и его фармацевтически приемлемая соль проявляют превосходную противовоспалительную активность на млекопитающих (включая человека), таких как крупный рогатый скот, лошадь, собака, мышь, крыса и т.д., они предпочтительно могут быть использованы для профилактики или лечения воспалительных заболеваний. Примерами заболеваний, подвергающихся лечению, являются воспалительное заболевание кишечника (IBD), такое как болезнь Крона, язвенный колит и т.д., хронические обструктивные легочные заболевания (COPD), хронический бронхит,респираторное заболевание, кистозный фиброз, диффузный панбронхит (DPB), пневмония, пневмофиброз, синусит, бронхоэктаз, синобронхиальный синдром, интерстициальная пневмония (пневмонит), экссудативный средний отит, псориаз, поллакиурия, интерстициальный цистит и т.д. В качестве активного ингредиента фармацевтического агента настоящего изобретения может быть использовано одно или несколько веществ, выбранных из описанных выше соединений и их солей, а также их гидратов и сольватов. Способ введения фармацевтического агента настоящего изобретения особенно не ограничен, и агент может быть введен перорально или парентерально. В качестве фармацевтического агента настоящего изобретения описанное выше вещество может быть непосредственно введено пациентам. Однако предпочтительно его следует вводить в виде препарата в форме фармацевтической композиции, содержащей активный ингредиент и фармакологически и фармацевтически приемлемую добавку. В качестве фармакологически и фармацевтически приемлемой добавки, например, можно использовать наполнитель, диспергирующую или дезинтегрирующую добавку, связующее вещество,покрывающий агент, краситель, разбавитель, основание, солюбилизатор или солюбилизирующую добавку, изотоничный агент, рН-регулятор, стабилизатор, пропеллент, адгезив и т.д. Примерами препаратов,подходящих для перорального введения, являются таблетки, капсулы, порошок, мелкие гранулы, гранулы, жидкость, сироп и т.д., и примерами препаратов, приемлемых для парентерального введения, являются инъекции, внутривенная жидкость, мазь, крем, подкожный абсорбер, глазные капли, ушные капли,средство для ингаляции, суппозитории и т.д. Однако форма препарата не ограничена ими. Препарат, подходящий для перорального введения, может содержать в качестве добавки, например,наполнитель, такой как глюкоза, лактоза, D-маннит, крахмал, кристаллическая целлюлоза и т.д.; диспергирующую или дезинтегрирующую добавку, такую как карбоксиметилцеллюлоза, крахмал, кальцийкарбоксиметилцеллюлоза и т.д.; связывающее вещество, такое как гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, поливинилпирролидон, желатин и т.д.; смазывающее вещество, такое как стеарат магния, тальк и т.д.; основу, такую как гидроксипропилметилцеллюлоза, сахароза, полиэтиленгликоль, желатин, каолин, глицерин, очищенная вода, твердый жир и т.д. Препарат, приемлемый для инъекции или для внутривенной жидкости, может содержать добавки, такие как солюбилизатор или солюбилизирующая добавка, способные создавать водную инъекцию или инъекцию, которая растворяется при использовании (например, дистиллированная вода для инъекции, физиологический раствор, пропиленгликоль и т.д.); агент изотоничности (например, глюкоза, хлорид натрия, D-маннит, глицерин и т.д.); рН-регулятор (например, неорганическая кислота, органическая кислота, неорганическое или органическое основание и т.д.) и т.д. Хотя доза фармацевтического агента настоящего изобретения соответствующим образом будет меняться в зависимости от типа заболевания, которое подвергается лечению, объекта профилактики или лечения, состояния пациента, например, возраста, массы тела, симптомов и т.д., ежедневная доза для взрослого, как правило, составляет приблизительно 0,05-500 мг активного ингредиента для перорального введения. В общем случае указанная выше доза может быть введена в количестве от одной до нескольких порций в день или может вводиться каждые несколько дней. Когда вовлечены два или более видов активных ингредиентов, суммарное количество устанавливается так, чтобы оно попадало в пределы этого интервала.- 12015737 Примеры Настоящее изобретение рассмотрено более подробно далее со ссылкой на примеры синтеза исходных веществ, примеры, экспериментальные примеры и примеры композиций, которые не считаются ограничивающими. Все публикации, процитированные в настоящем изобретении, включены во всей их полноте в качестве ссылки. Если не оговорено особо, реагенты, приборы и вещества, которые используют в настоящем изобретении, являются коммерчески доступными. Пример синтеза исходного вещества 1. Синтез 6,9-полукеталя 8,9-ангидроэритромицина А (ЕМ 201) Раствор (710,0 мл) ЕМА (эритромицин А; 104,4 г, 16,90 ммоль) в ледяной уксусной кислоте перемешивают при комнатной температуре 2 ч и медленно добавляют водный раствор NaHCO3 для нейтрализации раствора. Реакционную смесь экстрагируют CHCl3 и органический слой сушат над Na2SO4. Остаток фильтруют и фильтрат концентрируют, получают сырой продукт (99,30 г). Полученный сырой продукт растворяют в CHCl3 (250 мл) и раствор кристаллизуют путем добавления гексана (50 мл), получают ЕМ 201 (74,50 г, 71%) в виде белого порошка. ЕМ 201.Rf=0,63 (CHCl3:MeOH:NH4OH (водн.)=15:1:0,2). Пример синтеза исходного вещества 2. Синтез 6,9-полукеталя 8,9-ангидропсевдоэритромицина А (ЕМ 701) К раствору (150,0 мл) ЕМ 201 (7,600 г, 10,60 ммоль) в MeOH добавляют K2CO3 (1,400 г,10,60 ммоль) и смесь кипятят с обратным холодильником 2 ч. После охлаждения до комнатной температуры растворитель упаривают и остаток растворяют в водном растворе NaHCO3. Реакционную смесь экстрагируют CHCl3 и органический слой сушат над Na2SO4. Остаток фильтруют и фильтрат концентрируют, получают сырой продукт (9,300 г). Полученный сырой продукт отделяют и очищают колоночной флэш-хроматографией (CHCl3:MeOH:NH4OH (водн.)=10:0,5:0,1-10:1:0,05), получают ЕМ 701 (5,900 г,78%) в виде белого порошка. ЕМ 701.(299,0 мкл, 4,750 ммоль) и смесь перемешивают в атмосфере Н 2 при 5 атм и при комнатной температуре 1 ч. Добавляют раствор (7,000 мл) ЕМ 701 (1,000 г, 1,400 ммоль) в AcOH и смесь перемешивают в атмосфере Н 2 при 5 атм и при комнатной температуре 4 ч. Затем добавляют CH3CO2NH4 (7,000 г), смесь перемешивают и фильтруют, фильтрат концентрируют. Концентрированный раствор экстрагируют CHCl3 и экстракт промывают насыщенным раствором NaHCO3 и рассолом. Промытый органический слой сушат над Na2SO4, остаток отфильтровывают и фильтрат концентрируют, получают сырой продукт(968,4 мг). Полученный сырой продукт отделяют и очищают колоночной флэш-хроматографией(AcONa; 403,6 мг, 4,920 ммоль), I2 (499,5 мг, 1,968 ммоль) и насыщенный раствор NaHCO3, проверяют основность смеси с помощью универсального индикатора и перемешивают при 50 С в течение 20 мин. После перемешивания добавляют Na2S2O3 (400,0 мг) и смесь охлаждают до комнатной температуры. Реакционную смесь экстрагируют CHCl3. После промывки смешанным раствором рассола и водногоNH4OH органический слой сушат над Na2SO4. Остаток отфильтровывают и фильтрат концентрируют,получают сырой продукт (700,0 мг). Полученный сырой продукт отделяют и очищают колоночной флэшхроматографией (CHCl3:MeOH:NH4OH (водн.)=100:1:0, 1-30:1:0,1), получают ЕМ 901 (546,5 мг, 79%) в виде белого порошка. ЕМ 901.(i-Pr2NEt; 74,00 мкл, 0,426 ммоль) и бензилбромид (BnBr, 51,00 мкл, 0,426 ммоль) и смесь перемешивают в атмосфере Ar при комнатной температуре 1 ч. После перемешивания добавляют насыщенный растворNa2S2O3 (10,00 мл) и смесь экстрагируют CHCl3. После промывки насыщенным раствором Na2S2O3,насыщенным водным раствором NH4Cl и рассолом органический слой сушат над Na2SO4. Остаток отфильтровывают и фильтрат концентрируют, получают сырой продукт (70,10 мг). Полученный сырой продукт отделяют и очищают колоночной флэш-хроматографией (CHCl3:MeOH:NH4OH(111,5 мг, 0,1580 ммоль) и I2 (200,5 мг, 0,7900 ммоль) и смесь перемешивают в атмосфере Ar при 0 С в течение 40 мин. После перемешивания добавляют Na2S2O3 (100,0 мг) и смесь нагревают до комнатной температуры. Реакционную смесь экстрагируют CHCl3. После промывки смешанным раствором рассола- 14015737 и водного NH4OH органический слой сушат над Na2SO4. Остаток отфильтровывают и фильтрат концентрируют, получают сырой продукт (100,0 мг). Полученный сырой продукт отделяют и очищают колоночной флэш-хроматографией (CHCl3:MeOH:NH4OH (водн.)=100:1:0,1-10:1:0,1), получают ЕМ 903NaBH(OAc)3 (9,300 мг, 0,0440 ммоль) и смесь перемешивают при 0 С в течение 2,5 ч. После перемешивания добавляют бензальдегид (14,80 мкл, 0,1430 ммоль), AcOH (8,300 мкл, 0,1460 ммоль) и NaBH(OAc)3(31,00 мг, 0,1460 ммоль) и смесь нагревают до комнатной температуры и перемешивают 1 ч. После перемешивания добавляют насыщенный раствор NaHCO3 (7,000 мл) и смесь экстрагируют CHCl3. После промывки насыщенным раствором NaHCO3 и рассолом органический слой сушат над Na2SO4. Остаток отфильтровывают и фильтрат концентрируют, получают сырой продукт (23,00 мг). Полученный сырой продукт отделяют и очищают колоночной флэш-хроматографией К раствору (280,0 мкл) ЕМ 901 (20,00 мг, 0,0280 ммоль) в CHCl3 добавляют i-Pr2NEt (24,40 мкл,0,14 ммоль) и п-ClBnBr (п-хлорбензилбромид; 28,80 мг, 0,1400 ммоль) и смесь перемешивают в атмосфере N2 при комнатной температуре 2 ч. После перемешивания добавляют насыщенный растворNa2S2O3 (7,000 мл) и смесь экстрагируют CHCl3. После промывки насыщенным раствором Na2S2O3, насыщенным раствором NH4Cl и рассолом органический слой сушат над Na2SO4. Остаток отфильтровывают и фильтрат концентрируют, получают сырой продукт (24,10 мг). Полученный сырой продукт отделяют и очищают колоночной флэш-хроматографией (CHCl3:MeOH:NH4OH (водн.)=100:1:0,1), получают ЕМ 905 (21,60 мг, 93%) в виде белого порошка. ЕМ 905. В атмосфере N2 раствор (14,00 мл) ЕМ 900 (301,4 мг, 0,420 ммоль) в CH2Cl2 охлаждают до 0 С,добавляют Pb(ОАс)4 (300,0 мг, 0,6720 ммоль) и смесь перемешивают при 0 С в течение 3 ч. После перемешивания добавляют насыщенный раствор NaHCO3 (25,00 мл) и смесь экстрагируютCHCl3. После промывки насыщенным раствором NaHCO3 и рассолом органический слой сушат над Na2SO4. Остаток отфильтровывают и фильтрат концентрируют, получают сырой продукт(305,0 мг). Полученный сырой продукт отделяют и очищают колоночной флэш-хроматографией В атмосфере N2 раствор (1,100 мл) ЕМ 906 (147,6 мг, 0,2250 ммоль) в EtOH охлаждают до 0 С, добавляют NH2OHHCl (48,00 мг, 0,6750 ммоль), добавляют по каплям пиридин (1,1 мл, 13,60 ммоль) и смесь перемешивают при 0 С в течение 4 ч. После перемешивания добавляют насыщенный растворNaHCO3 (5,00 мл) и смесь экстрагируют CHCl3. Органический слой сушат над Na2SO4. Остаток отфильтровывают и фильтрат концентрируют, получают сырой продукт (162,0 мг). Полученный сырой продукт отделяют и очищают колоночной флэш-хроматографией (CHCl3:MeOH:NH4OH (водн.)=30:1:0,110:1:0,1), получают ЕМ 907 (140,4 мг, 93%) в виде белого порошка. ЕМ 907. В атмосфере N2 раствор (3,000 мл) ЕМ 906 (39,00 мг, 0,0593 ммоль) в MeOH охлаждают до -78 С,добавляют NaBH4 (22,40 мг, 0,5930 ммоль) и смесь перемешивают при -78 С в течение 1,5 ч. После перемешивания смесь нагревают до комнатной температуры и разбавляют CHCl3, добавляют рассол(30,00 мл) и смесь экстрагируют CHCl3. После промывки водой органический слой сушат надNa2SO4. Остаток отфильтровывают и фильтрат концентрируют, получают сырой продукт (40,30 мг). Полученный сырой продукт отделяют и очищают колоночной флэш-хроматографией (CHCl3:MeOH:NH4OH В атмосфере N2 к раствору (1,500 мл) ЕМ 900 (106,8 мг, 0,1490 ммоль) в CH2Cl2 добавляют сульфат Мартина (250,0 мг, 0,3720 ммоль) и смесь перемешивают 1 ч. После перемешивания добавляют сульфат Мартина (50,00 мг, 0,0740 ммоль) и смесь перемешивают 0,5 ч. После перемешивания добавляют насыщенный раствор NaHCO3 (5,000 мл) и смесь экстрагируют CHCl3. После промывки рассолом органический слой сушат над Na2SO4. Остаток отфильтровывают и фильтрат концентрируют, получают сырой продукт (110,0 мг). Полученный сырой продукт отделяют и очищают колоночной флэш-хроматографией К раствору (1,390 мл) ЕМ 900 (100,0 мг, 0,1390 ммоль) в MeOH добавляют CSA (камфорсульфоновую кислоту: 48,60 мг, 0,2090 ммоль) и смесь перемешивают 3 ч. После перемешивания добавляют насыщенный раствор NaHCO3 (10,00 мл) и смесь экстрагируют CHCl3. После промывки рассолом органический слой сушат над Na2SO4. Остаток отфильтровывают и фильтрат концентрируют, получают сырой продукт (99,00 мг). Полученный сырой продукт отделяют и очищают колоночной флэш-хроматографией(4-(N,N-диметиламино)пиридин; 1,698 мг, 0,0139 ммоль) и Ас 2 О (78,69 мкл, 0,8340 ммоль) и смесь перемешивают 1 ч. После перемешивания добавляют DMAP (1,698 мг, 0,0139 ммоль) и Ас 2 О (78,69 мкл,0,8340 ммоль) и смесь перемешивают 2 ч. После перемешивания добавляют 10%-ный раствор лимонной кислоты (10,00 мл) и смесь экстрагируют AcOEt. После промывки насыщенным раствором NaHCO3 органический слой сушат над Na2SO4. Остаток отфильтровывают и фильтрат концентрируют, получают сырой продукт (120,0 мг). Полученный сырой продукт отделяют и очищают колоночной флэшхроматографией (CHCl3:MeOH:NH4OH (водн.)=50:1:0,1), получают конечный продукт (116,0 мг) в виде белого порошка. Раствор (1,390 мл) указанного конечного продукта (116,0 мг) в MeOH перемешивают при 50 С в течение 12 ч. После перемешивания раствор концентрируют, получают сырой продукт(117,1 мг). Полученный сырой продукт отделяют и очищают колоночной флэш-хроматографиейNaBH(OAc)3 (9,300 мг, 0,0440 ммоль) и смесь перемешивают при 0 С в течение 2,5 ч. После перемешивания добавляют бензальдегид (14,80 мкл, 0,1430 ммоль), AcOH (8,300 мкл, 0,1460 ммоль) и NaBH(OAc)3(31,00 мг, 0,1460 ммоль), смесь нагревают до комнатной температуры и перемешивают 1 ч. После перемешивания добавляют насыщенный раствор NaHCO3 (7,000 мл) и смесь экстрагируют CHCl3. После промывки насыщенным раствором NaHCO3 и рассолом органический слой сушат над Na2SO4. Остаток отфильтровывают и фильтрат концентрируют, получают сырой продукт (23,00 мг). Полученный сырой продукт отделяют и очищают колоночной флэш-хроматографией В атмосфере N2 к раствору (8,950 мл) ЕМ 900 (641,9 мг, 0,8950 ммоль) в ацетоне добавляют Ас 2 О(506,7 мкл, 5,370 ммоль) и смесь перемешивают 0,5 ч. После перемешивания добавляют насыщенный раствор NaHCO3 (100,0 мл) и смесь экстрагируют CHCl3. После промывки насыщенным растворомNaHCO3 органический слой сушат над Na2SO4. Остаток отфильтровывают и фильтрат концентрируют,получают сырой продукт (670,0 мг). Полученный сырой продукт отделяют и очищают колоночной флэшхроматографией (CHCl3:MeOH:NH4OH (водн.)=50:1:0,1-20:1:0,1), получают ЕМ 913 (602,3 мг, 89%) в виде белого порошка. ЕМ 913.(61,00 мкл, 0,3500 ммоль) и бис-(2-бромэтиловый) эфир (44,00 мкл, 0,3500 ммоль) и смесь перемешивают при 80 С в течение 20 ч. После перемешивания добавляют i-Pr2NEt (61,00 мкл, 0,3500 ммоль) и бис-(2 бромэтиловый) эфир (44,00 мкл, 0,3500 ммоль) и смесь перемешивают при 80 С в течение 6 ч. После перемешивания добавляют насыщенный раствор Na2S2O3 (7,000 мл) и смесь экстрагируют CHCl3. После промывки насыщенным раствором Na2S2O3, насыщенным раствором NH4Cl и рассолом органический слой сушат над Na2SO4. Остаток отфильтровывают и фильтрат концентрируют, получают сырой продукт(36,50 мг). Полученный сырой продукт отделяют и очищают колоночной флэш-хроматографией К ЕМ 913 (104,5 мг, 0,1380 ммоль) добавляют 1 н. HCl (водн.) (1,380 мл) и смесь перемешивают 5 ч. После перемешивания добавляют насыщенный раствор NaHCO3 (20,0 мл) и смесь экстрагируютCHCl3. После промывки рассолом органический слой сушат над Na2SO4. Остаток отфильтровывают и фильтрат концентрируют, получают сырой продукт (91,10 мг). Полученный сырой продукт отделяют и очищают колоночной флэш-хроматографией (CHCl3:MeOH:NH4OH (водн.)=50:1:0,1-20:1:0,1), получаютCH2Cl2 добавляют по каплям и смесь перемешивают при -78 С в течение 2 ч. После перемешивания добавляют пиридин (106,2 мкл, 1,312 ммоль) и смесь нагревают до комнатной температуры и перемешивают 0,5 ч. После перемешивания добавляют насыщенный раствор NH4Cl (15,00 мл) и смесь экстрагируютCH2Cl2. После промывки насыщенным раствором NaHCO3 и рассолом органический слой сушат надNa2SO4. Остаток отфильтровывают и фильтрат концентрируют, получают сырой продукт (35,00 мг). Полученный сырой продукт отделяют и очищают колоночной флэш-хроматографией (CHCl3:MeOH:NH4OH В атмосфере N2 к раствору (782,0 мкл) ЕМ 916 (24,50 мг, 0,0391 ммоль) в CH3Cl добавляют периодинан Десс-Мартина (165,8 мг, 0,3910 ммоль) и смесь перемешивают 2 ч. После перемешивания добавляют периодинан Десс-Мартина (165,8 мг, 0,3910 ммоль) и смесь перемешивают 41 ч. После перемешивания добавляют насыщенный раствор Na2S2O3 (15,00 мл) и смесь экстрагируют EtOAc. После промывки насыщенным раствором Na2S2O3, насыщенным раствором NaHCO3 и рассолом органический слой сушат над Na2SO4. Остаток отфильтровывают и фильтрат концентрируют, получают сырой продукт(31,00 мг). Полученный сырой продукт отделяют и очищают колоночной флэш-хроматографией Раствор (225,0 мкл) ЕМ 917 (14,10 мг, 0,0225 ммоль) в MeOH нагревают до 50 С и смесь перемешивают 30 ч. После перемешивания смесь концентрируют, получают сырой продукт (14,20 мг). Полученный сырой продукт отделяют и очищают колоночной флэш-хроматографией(45,50 мкл, 0,2610 ммоль) и п-CF3BnBr (п-трифторметилбензилбромид; 62,40 мг, 0,2610 ммоль) и смесь перемешивают при комнатной температуре 1 ч. После перемешивания добавляют i-Pr2NEt (45,50 мкл,0,2610 ммоль) и п-CF3BnBr (62,40 мг, 0,2610 ммоль) и смесь перемешивают 2 ч. После перемешивания добавляют насыщенный раствор Na2S2O3 (10,00 мл) и смесь экстрагируют CHCl3. После промывки насыщенным раствором Na2S2O3, насыщенным раствором NH4Cl и рассолом органический слой сушат надNa2SO4. Остаток отфильтровывают и фильтрат концентрируют, получают сырой продукт (50,00 мг). Полученный сырой продукт отделяют и очищают колоночной флэш-хроматографией (CHCl3:MeOH:NH4OH(50,00 мкл, 0,2870 ммоль) и п-BrBnBr (п-бромбензилбромид; 71,70 мг, 0,2870 ммоль) и смесь перемешивают при комнатной температуре 1 ч. После перемешивания добавляют i-Pr2NEt (50,00 мкл,0,2870 ммоль) и п-BrBnBr (71,70 мг, 0,2870 ммоль) и смесь перемешивают при комнатной температуре 1 ч. После перемешивания добавляют насыщенный раствор Na2S2O3 (50,00 мл) и смесь экстрагируютCHCl3. После промывки насыщенным раствором Na2S2O3, насыщенным раствором NH4Cl и рассолом органический слой сушат над Na2SO4. Остаток отфильтровывают и фильтрат концентрируют, получают сырой продукт (53,00 мг). Полученный сырой продукт отделяют и очищают колоночной флэшхроматографией (CHCl3:MeOH:NH4OH (водн.)=100:1:0,1), получают ЕМ 920 (33,30 мг, 67%) в виде белого порошка. ЕМ 920.(53,00 мкл, 0,3040 ммоль) и п-FBnBr (п-фторбензилбромид; 37,90 мкл, 0,3040 ммоль) и смесь перемешивают при комнатной температуре 1 ч. После перемешивания добавляют i-Pr2NEt (53,00 мкл,0,3040 ммоль) и п-FBnBr (37,90 мкл, 0,3040 ммоль) и смесь перемешивают при комнатной температуре 1,5 ч. После перемешивания добавляют насыщенный раствор Na2S2O3 (40,00 мл) и смесь экстрагируютCHCl3. После промывки насыщенным раствором Na2S2O3, насыщенным раствором NH4Cl и рассолом органический слой сушат над Na2SO4. Остаток отфильтровывают и фильтрат концентрируют, получают сырой продукт (50,00 мг). Полученный сырой продукт отделяют и очищают колоночной флэшхроматографией (CHCl3:MeOH:NH4OH (водн.)=100:1:0,1), получают ЕМ 921 (42,40 мг, 86%) в виде белого порошка. ЕМ 921.(77,50 мкл, 0,8960 ммоль) и о-ClBnBr (104,0 мкл, 0,5970 ммоль) и смесь перемешивают при комнатной температуре 2 ч. После перемешивания добавляют i-Pr2NEt (38,80 мкл, 0,2990 ммоль) и о-ClBnBr(52,00 мкл, 0,2990 ммоль) и смесь перемешивают при комнатной температуре 0,5 ч. После перемешивания добавляют насыщенный раствор Na2S2O3 (40,00 мл) и смесь экстрагируют CHCl3. После промывки насыщенным раствором Na2S2O3, насыщенным раствором NH4Cl и рассолом органический слой сушат над Na2SO4. Остаток отфильтровывают и фильтрат концентрируют, получают сырой продукт (50,00 мг). Полученный сырой продукт отделяют и очищают колоночной флэш-хроматографией(55,20 мкл, 0,3170 ммоль) и м-ClBnBr (41,60 мкл, 0,3170 ммоль) и смесь перемешивают при комнатной температуре 1 ч. После перемешивания добавляют i-Pr2NEt (55,20 мкл, 0,3170 ммоль) и м-ClBnBr(41,60 мкл, 0,3170 ммоль) и смесь перемешивают при комнатной температуре 2 ч. После перемешивания добавляют насыщенный раствор Na2S2O3 (40,00 мл) и смесь экстрагируют CHCl3. После промывки насыщенным раствором Na2S2O3, насыщенным раствором NH4Cl и рассолом органический слой сушат надNa2SO4. Остаток отфильтровывают и фильтрат концентрируют, получают сырой продукт (55,00 мг). Полученный сырой продукт отделяют и очищают колоночной флэш-хроматографией (CHCl3:MeOH:NH4OH(50,50 мкл, 0,2900 ммоль) и п-IBnBr (п-йодбензилбромид; 86,10 мг, 0,2900 ммоль) и смесь перемешивают при комнатной температуре 1 ч. После перемешивания добавляют i-Pr2NEt (50,50 мкл, 0,2900 ммоль) и п-IBnBr (86,10 мг, 0,2900 ммоль) и смесь перемешивают при комнатной температуре 2 ч. После перемешивания добавляют насыщенный раствор Na2S2O3 (40,00 мл) и смесь экстрагируют CHCl3. После промывки насыщенным раствором Na2S2O3, насыщенным раствором NH4Cl и рассолом органический слой сушат над Na2SO4. Остаток отфильтровывают и фильтрат концентрируют, получают сырой продукт(55,00 мг). Полученный сырой продукт отделяют и очищают колоночной флэш-хроматографией В атмосфере N2 к раствору (689,0 мкл) ЕМ 934 (37,60 мг, 0,0689 ммоль), полученного в описанном ниже примере 35, в CHCl3 добавляют i-Pr2NEt (120,0 мкл, 0,6890 ммоль) и п-ClBnBr (141,6 мг,0,6890 ммоль) и смесь перемешивают при комнатной температуре 2 ч. После перемешивания добавляют насыщенный раствор Na2S2O3 (40,00 мл) и смесь экстрагируют CHCl3. После промывки насыщенным раствором Na2S2O3, насыщенным раствором NH4Cl и рассолом органический слой сушат надNa2SO4. Остаток отфильтровывают и фильтрат концентрируют, получают сырой продукт (50,00 мг). Полученный сырой продукт отделяют и очищают колоночной флэш-хроматографией (CHCl3:MeOH:NH4OH(937,0 мкл) и смесь перемешивают 0,5 ч. После перемешивания добавляют насыщенный растворNaHCO3 (50,00 мл) и смесь экстрагируют CHCl3. После промывки рассолом органический слой сушат над Na2SO4. Остаток отфильтровывают и фильтрат концентрируют, получают сырой продукт (60,00 мг). Полученный сырой продукт отделяют и очищают колоночной флэш-хроматографией(58,30 мкл, 0,4200 ммоль) и п-BrBzCl (п-бромбензоилхлорид; 30,70 мг, 0,1400 ммоль) и смесь перемешивают 1 ч. После перемешивания добавляют водный раствор NH3 (6,000 мл) и смесь концентрируют, получают сырой продукт (126,0 мг). Полученный сырой продукт отделяют и очищают колоночной флэшхроматографией (CHCl3:MeOH:NH4OH (водн.)=50:1:0,1-30:1:0,1), получают ЕМ 927 (107,4 мг, 85%) в виде белого порошка. ЕМ 927.NaBH(OAc)3 (22,90 мг, 0,1080 ммоль) и смесь перемешивают при 0 С в течение 2,5 ч, нагревают до комнатной температуры и перемешивают 1 ч. После перемешивания добавляют насыщенный растворNaHCO3 (50,00 мл) и смесь экстрагируют CHCl3. После промывки насыщенным раствором NaHCO3 и рассолом органический слой сушат над Na2SO4. Остаток отфильтровывают и фильтрат концентрируют,получают сырой продукт (62,00 мг). Полученный сырой продукт отделяют и очищают колоночной флэшхроматографией (CHCl3:MeOH:NH4OH (водн.)=100:1:0,1-10:1:0,1), получают ЕМ 928 (32,30 мг, 55%) в виде белого порошка. ЕМ 928. К раствору (12,67 мл) ЕМ 900 (909,3 мг, 1,267 ммоль) в MeOH добавляют AcONa (519,7 мг,6,335 ммоль), I2 (643,2 мг, 2,534 ммоль) и насыщенный раствор NaHCO3, проверяют основность смеси с помощью универсального индикатора и перемешивают при 50 С в течение 20 мин. После перемешивания добавляют Na2S2O3 (400,0 мг) и смесь охлаждают до комнатной температуры. Реакционную смесь экстрагируют CHCl3. После промывки смешанным раствором рассола и NH4OH органический слой сушат над Na2SO4. Остаток отфильтровывают и фильтрат концентрируют, получают сырой продукт. В ат- 23015737 мосфере N2 к раствору (12,67 мл) полученного сырого продукта (892,0 мг, 1,267 ммоль) в CHCl3 добавляют i-Pr2NEt (1,100 мл, 6,335 ммоль) и 3-бромпропина (471,9 мкл, 6,335 ммоль) и смесь перемешивают при комнатной температуре 1 ч. После перемешивания добавляют i-Pr2NEt (1,100 мл, 6,335 ммоль) и 3-бромпропин (471,9 мкл, 6,335 ммоль) и смесь перемешивают при комнатной температуре 12 ч. После перемешивания добавляют насыщенный раствор Na2S2O3 (200,0 мл) и смесь экстрагируют CHCl3. После промывки насыщенным раствором Na2S2O3, насыщенным раствором NH4Cl и рассолом органический слой сушат над Na2SO4. Остаток отфильтровывают и фильтрат концентрируют, получают сырой продукт(940,2 мг). Полученный сырой продукт отделяют и очищают колоночной флэш-хроматографиейNaHCO3 (8,790 г, 104,6 ммоль), добавляют по каплям CbzCl (бензилоксикарбонилхлорид: 14,93 мл,104,6 ммоль), смесь нагревают до 70 С и перемешивают 2 ч. После перемешивания добавляют Et3N и смесь охлаждают до комнатной температуры. Реакционную смесь экстрагируют EtOAc. После промывки рассолом органический слой сушат над Na2SO4. Остаток отфильтровывают и фильтрат концентрируют,получают сырой продукт (7,000 г). Полученный сырой продукт отделяют и очищают колоночной флэшхроматографией (CHCl3:MeOH:NH4OH (водн.)=50:1:0,1), получают ЕМ 930 (6,365 г, 94%) в виде белого порошка. ЕМ 930.(водн.) (52,30 мкл) и смесь перемешивают 4 ч. После перемешивания добавляют насыщенный растворNaHCO3 (400,0 мл) и смесь экстрагируют CHCl3. После промывки рассолом органический слой сушат над Na2SO4. Остаток отфильтровывают и фильтрат концентрируют, получают сырой продукт (4,312 г). Полученный сырой продукт отделяют и очищают колоночной флэш-хроматографией В атмосфере N2 к раствору (4,560 мл) ЕМ 948 (152,5 мг, 0,228 ммоль), полученного в приведенном ниже примере 48, в CH2Cl2 добавляют периодинан Десс-Мартина (165,8 мг, 0,391 ммоль) и смесь перемешивают 2 ч. После перемешивания добавляют насыщенный раствор Na2S2O3 (50,00 мл) и смесь экстрагируют CHCl3. После промывки насыщенным раствором Na2S2O3, насыщенным раствором NaHCO3 и рассолом органический слой сушат над Na2SO4. Остаток отфильтровывают и фильтрат концентрируют,получают сырой продукт (160,0 мг). Полученный сырой продукт отделяют и очищают колоночной флэшхроматографией (CHCl3:MeOH:NH4OH (водн.)=100:1:0,1), получают ЕМ 932 (151,1 мг, 90%) в виде белого порошка. ЕМ 932.(102,1 мкл, 0,5860 ммоль) и бромэтан (43,70 мкл, 0,5860 ммоль) и смесь перемешивают при комнатной температуре 22 ч. После перемешивания смесь нагревают до 50 С и перемешивают 134 ч. Затем добавляют i-Pr2NEt (102,1 мкл, 0,5860 ммоль) и бромэтан (43,70 мкл, 0,5860 ммоль) и смесь перемешивают при 50 С в течение 14 ч. После перемешивания добавляют насыщенный раствор Na2S2O3 (40,00 мл) и смесь экстрагируют CHCl3. После промывки насыщенным раствором Na2S2O3, насыщенным раствором NH4Cl и рассолом органический слой сушат над Na2SO4. Остаток отфильтровывают и фильтрат концентрируют,получают сырой продукт (50,00 мг). Полученный сырой продукт отделяют и очищают колоночной флэшхроматографией (CHCl3:MeOH:NH4OH (водн.)=100:1:0,1), получают ЕМ 933 (42,40 мг, 86%) в виде белого порошка. ЕМ 933. В атмосфере N2 к EM931 (108,4 мг, 0,1330 ммоль) добавляют Pb(OH)2 (21,70 мг) и EtOH (2,660 мл) и смесь перемешивают в атмосфере Н 2 при комнатной температуре 1 ч. После перемешивания смесь фильтруют и фильтрат концентрируют, получают сырой продукт (150,1 мг). Полученный сырой продукт отделяют и очищают колоночной флэш-хроматографией (CHCl3:MeOH:NH4OH (водн.)=30:1:0,110:1:0,1), получают ЕМ 934 (70,30 мг, 97%) в виде белого порошка. ЕМ 934. Раствор (6,280 мл) ЕМ 932 (104,6 мг, 0,157 ммоль) в MeOH нагревают до 50 С и перемешивают 68 ч. После перемешивания смесь концентрируют, получают сырой продукт (101,2 мг). Полученный сырой продукт отделяют и очищают колоночной флэш-хроматографией В атмосфере N2 раствор (49,80 мл) ЕМ 931 (2,027 г, 2,492 ммоль) в CH2Cl2 охлаждают до -78 С,добавляют пиридин (2,420 мл, 29,90 ммоль), добавляют по каплям раствор (99,70 мл) трифосгена(1,479 г, 4,984 ммоль) в CH2Cl2, смесь нагревают от -78 С до комнатной температуры и перемешивают 0,5 ч. После перемешивания добавляют насыщенный раствор NH4Cl (400,0 мл) и смесь экстрагируютCH2Cl2. После промывки насыщенным раствором NaHCO3 и рассолом органический слой сушат надNa2SO4. Остаток отфильтровывают и фильтрат концентрируют, получают сырой продукт (1,900 г). Полученный сырой продукт отделяют и очищают колоночной флэш-хроматографией (CHCl3:MeOH:NH4OH В атмосфере N2 к раствору (40,80 мл) ЕМ 936 (1,718 г, 2,047 ммоль) в CH2Cl2 добавляют периодинан Десс-Мартина (4,343 г, 10,24 ммоль) и смесь перемешивают 1,5 ч. После перемешивания добавляют насыщенный раствор Na2S2O3 (300,0 мл) и смесь экстрагируют CHCl3. После промывки насыщенным раствором Na2S2O3, насыщенным раствором NaHCO3 и рассолом органический слой сушат надNa2SO4. Остаток отфильтровывают и фильтрат концентрируют, получают сырой продукт (1,700 г). Полученный сырой продукт отделяют и очищают колоночной флэш-хроматографией В атмосфере N2 к ЕМ 937 (1,461 г, 1,745 ммоль) добавляют Pb(OH)2 (292,2 мг) и EtOH (34,90 мл) и смесь перемешивают в атмосфере Н 2 при комнатной температуре 3 ч. После перемешивания в атмосфереN2 добавляют Pb(OH)2 (292,2 мг) и смесь перемешивают в атмосфере Н 2 при комнатной температуре 2,5 ч. Затем после перемешивания в атмосфере N2 добавляют Pb(OH)2 (146,1 мг) и смесь перемешивают в атмосфере Н 2 при комнатной температуре 1 ч. После перемешивания смесь фильтруют и фильтрат концентрируют, получают сырой продукт (1,302 г). Полученный сырой продукт отделяют и очищают колоночной флэш-хроматографией (CHCl3:MeOH:NH4OH (водн.)=50:1:0,1-30:1:0,1), получают EM938 К раствору (5,330 мл) EM938 (303,4 мг, 0,533 ммоль) в CHCl3 добавляют i-Pr2NEt (928,4 мкл,5,330 ммоль) и п-ClBnBr (1,095 г, 5,330 ммоль) и смесь перемешивают в атмосфере N2 при комнатной температуре 2 ч. После перемешивания добавляют насыщенный раствор Na2S2O3 (50,00 мл) и смесь экстрагируют CHCl3. После промывки насыщенным раствором Na2S2O3, насыщенным раствором NH4Cl и рассолом органический слой сушат над Na2SO4. Остаток отфильтровывают и фильтрат концентрируют,получают сырой продукт (350,1 мг). Полученный сырой продукт отделяют и очищают колоночной флэшхроматографией (CHCl3:MeOH:NH4OH (водн.)=100:1:0,1), получают ЕМ 939 (342,5 мг, 93%) в виде белого порошка. ЕМ 939.(98,20 мкл, 0,5840 ммоль) и i-PrI (2-йодпропан; 56,30 мкл, 0,5640 ммоль) и смесь перемешивают при 50 С в течение 134 ч. После перемешивания добавляют i-Pr2NEt (98,20 мкл, 0,5840 ммоль) и i-PrI (56,30 мкл,0,5640 ммоль) и смесь перемешивают при 50 С в течение 26,5 ч. Далее добавляют i-Pr2NEt (196,4 мкл,1,128 ммоль) и i-PrI (112,6 мкл, 1,128 ммоль) и смесь перемешивают при 50 С в течение 97,5 ч. После перемешивания добавляют насыщенный раствор Na2S2O3 (30,00 мл) и смесь экстрагируют CHCl3. После промывки насыщенным раствором Na2S2O3, насыщенным раствором NH4Cl и рассолом органический слой сушат над Na2SO4. Остаток отфильтровывают и фильтрат концентрируют, получают сырой продукт(50,00 мг). Полученный сырой продукт отделяют и очищают колоночной флэш-хроматографией Раствор (161,1 мл) Na (222,2 мг, 9,666 ммоль) в MeOH охлаждают до 0 С, в атмосфере N2 добавляют ЕМ 934 (878,6 мг, 1,611 ммоль) и I2 (2,044 г, 8,055 ммоль) и смесь перемешивают при 0 С в течение 1 ч. После перемешивания добавляют Na2S2O3 (6,000 г) и смесь нагревают до комнатной температуры. Реакционную смесь экстрагируют CHCl3. После промывки смешанным раствором рассола и NH4OH органический слой сушат над Na2SO4. Остаток отфильтровывают и фильтрат концентрируют, получают сырой продукт (870,2 мг). Полученный сырой продукт отделяют и очищают колоночной флэшхроматографией (CHCl3:MeOH:NH4OH (водн.)=30:1:0,1-10:1:0,1), получают ЕМ 941 (549,7 мг, 64%) в виде белого порошка. ЕМ 941.PPTS (п-толуолсульфонат пиридиния; 2,120 г, 8,434 ммоль), Ме 2 С(ОМе)2 (диметилацеталь ацетона: 5,497 мл, 44,70 ммоль) и смесь перемешивают в атмосфере N2 при комнатной температуре 21 ч. После перемешивания добавляют насыщенный раствор NaHCO3 (100,0 мл) и смесь экстрагируют CHCl3. После промывки H2O органический слой сушат над Na2SO4, остаток отфильтровывают и фильтрат концентрируют. Концентрат растворяют в смеси гексан:AcOEt=1:1 и раствор промывают Н 2 О. Органический слой сушат над Na2SO4. Остаток фильтруют и фильтрат концентрируют, получают сырой продукт (700,2 мг). Полученный сырой продукт отделяют и очищают колоночной флэш-хроматографией В атмосфере N2 к раствору (11,30 мл) ЕМ 942 (482,6 мг, 0,565 ммоль) в CH2Cl2 добавляют периодинан Десс-Мартина (479,3 мг, 1,130 ммоль) и смесь перемешивают 2 ч. После перемешивания добавляют насыщенный раствор Na2S2O3 (100,0 мл) и смесь экстрагируют CHCl3. После промывки насыщенным раствором Na2S2O3, насыщенным раствором NaHCO3 и рассолом органический слой сушат надNa2SO4. Остаток отфильтровывают и фильтрат концентрируют, получают сырой продукт (1,700 г). Полученный сырой продукт отделяют и очищают колоночной флэш-хроматографией (CHCl3:MeOH:NH4OH В атмосфере N2 к ЕМ 943 (406,8 мг, 0,478 ммоль) добавляют Pb(OH)2 (81,4 мг) и EtOH (9,56 мл) и смесь перемешивают в атмосфере Н 2 при комнатной температуре 2 ч. После перемешивания смесь фильтруют и фильтрат концентрируют, получают сырой продукт (300,0 мг). Полученный сырой продукт отделяют и очищают колоночной флэш-хроматографией (CHCl3:MeOH:NH4OH (водн.)=50:1:0,110:1:0,1), получают ЕМ 944 (275,6 г, 99%) в виде белого порошка. ЕМ 944.CH2Cl2 добавляют по каплям, смесь нагревают от -78 С до комнатной температуры и перемешивают 1 ч. После перемешивания добавляют насыщенный раствор NH4Cl (100,0 мл) и смесь экстрагируютCH2Cl2. После промывки насыщенным раствором NaHCO3 и рассолом органический слой сушат надNa2SO4. Остаток отфильтровывают и фильтрат концентрируют, получают сырой продукт (285,3 мг). Полученный сырой продукт отделяют и очищают колоночной флэш-хроматографией К раствору (3,960 мл) ЕМ 943 (230,9 мг, 0,396 ммоль) в CHCl3 добавляют i-Pr2NEt (689,8 мкл,3,960 ммоль) и п-ClBnBr (813,7 мг, 3,960 ммоль) и смесь перемешивают при комнатной температуре в атмосфере N2 в течение 2 ч. После перемешивания добавляют насыщенный раствор Na2S2O3 (30,00 мл) и смесь экстрагируют CHCl3. После промывки насыщенным раствором Na2S2O3, насыщенным растворомNH4Cl и рассолом органический слой сушат над Na2SO4. Остаток отфильтровывают и фильтрат концентрируют, получают сырой продукт (279,1 мг). Полученный сырой продукт отделяют и очищают колоночной флэш-хроматографией (CHCl3:MeOH:NH4OH (водн.)=100:1:0,1-50:1:0,1), получают ЕМ 947
МПК / Метки
МПК: C07H 17/08, A61K 31/7048, A61P 29/00, A61P 1/04
Метки: производные, дигидропсевдоэритромицина, новые
Код ссылки
<a href="https://eas.patents.su/30-15737-novye-proizvodnye-digidropsevdoeritromicina.html" rel="bookmark" title="База патентов Евразийского Союза">Новые производные дигидропсевдоэритромицина</a>
Предыдущий патент: Производные пролинамида в качестве модуляторов натриевых каналов
Следующий патент: Замещенные имидазолы и их применение в качестве пестицидов
Случайный патент: Передвижная дверь холодильной камеры