Производные пролинамида в качестве модуляторов натриевых каналов
Номер патента: 15736
Опубликовано: 31.10.2011
Авторы: Джованнини Риккардо, Альваро Джузеппе, Бергауэр Маркус, Профета Роберто
Формула / Реферат
1. 5-(4-{[(2-Фторфенил)метил]окси}фенил)пролинамид формулы (I)
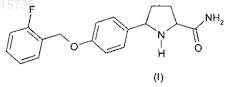
или его фармацевтически приемлемая соль или сольват.
2. Соединение по п.1, в котором соединение представляет собой
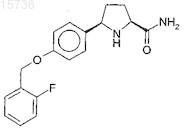
или его фармацевтически приемлемую соль или сольват.
3. Соединение по п.1 или 2, которое представляет собой (5R)-5-(4-{[(2-фторфенил)метил]окси}фенил)-L-пролинамид.
4. Соединение по п.1 или 2, которое представляет собой гидрохлорид (5R)-5-(4-{[(2-фторфенил)метил]окси}фенил)-L-пролинамида.
5. Соединение по п.4, которое находится в основном в кристаллической форме.
6. Соединение по п.5, охарактеризованное диаграммой порошковой рентгеновской дифракции (XRPD), имеющей характеристические пики в следующих положениях: 4,7+/-0,15 (°2q), 9,5+/-0,15 (°2q), 12,6+/-0,15 (°2q), 14,3+/-0,15 (°2q), 19,2+/-0,15 (°2q), 20,3+/-0,15 (°2q), 20,9+/-0,15 (°2q), 24,0+/-0,15 (°2q), 26,4+/-0,15 (°2q).
7. Фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль либо сольват по любому из пп.1-4 и его фармацевтически приемлемый носитель.
8. Применение соединения формулы (I) или его фармацевтически приемлемой соли либо сольвата по любому из пп.1-4 в терапии.
9. Применение соединения формулы (I) или его фармацевтически приемлемой соли либо сольвата по любому из пп.1-4 для получения лекарственного средства для лечения или профилактики заболевания или состояния, опосредованного модуляцией потенциалзависимых натриевых каналов.
10. Применение по п.9, в котором заболеванием или состоянием является депрессия или расстройство настроения.
11. Применение по п.10, в котором заболеванием или состоянием является биполярное расстройство.
12. Применение по п.9, в котором заболеванием или состоянием является компульсивное расстройство пищевого поведения или "вспышка переедания".
13. Применение по п.9, в котором заболеванием или состоянием является эпилепсия.
14. Применение по п.9, в котором заболеванием или состоянием является воспалительная боль или невропатическая боль.
15. Способ лечения или профилактики заболевания или состояния, опосредованного модуляцией потенциалзависимых натриевых каналов, у млекопитающего, включающий прием эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли либо сольвата по любому из пп.1-4.
16. Способ по п.15, в котором заболеванием или состоянием является депрессия или расстройство настроения.
17. Способ по п.15, в котором заболеванием или состоянием является биполярное расстройство.
18. Способ по п.15, в котором заболеванием или состоянием является расстройство, связанное с употреблением химического вещества.
19. Применение соединения формулы (I) или его фармацевтически приемлемой соли или сольвата по любому из пп.1-4 для лечения или профилактики заболевания или состояния, опосредованного модуляцией потенциалзависимых натриевых каналов.
20. Применение по п.19, в котором заболеванием или состоянием является депрессия или расстройство настроения.
21. Применение по п.19, в котором заболеванием или состоянием является биполярное расстройство.
22. Применение по п.19, в котором заболеванием или состоянием является расстройство, связанное с употреблением химического вещества.
23. Способ получения соединения формулы (I) по любому из пп.1-4, включающий взаимодействие соединения формулы (II)
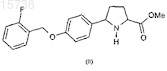
с раствором аммиака в подходящем растворителе.
Текст
ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ЕВРАЗИЙСКОМУ ПАТЕНТУ Дата публикации и выдачи патента ПРОИЗВОДНЫЕ ПРОЛИНАМИДА В КАЧЕСТВЕ МОДУЛЯТОРОВ НАТРИЕВЫХ КАНАЛОВ Изобретение относится к соединению формулы (I), его сольвату, соли, пригодному для лечения заболеваний и состояний, опосредованных модуляцией стимулзависимых потенциалзависимых натриевых каналов.(71)(73) Заявитель и патентовладелец: ГЛЭКСО ГРУП ЛИМИТЕД (GB) 015736 Настоящее изобретение относится к -аминокарбоксиамидному производному или его солям и к применению этого производного или его солей для лечения заболеваний и состояний, опосредованных модуляцией стимулзависимых потенциалзависимых натриевых каналов. В дополнение, настоящее изобретение относится к композициям, содержащим производное или его соли, и способам их получения. Потенциалзависимые натриевые каналы ответственны за возникновение потенциала действия, который является волной электрической деполяризации, обычно возникающей в теле нейрона и распространяемой вдоль аксонов к окончаниям. В окончаниях потенциал действия вызывает приток кальция и высвобождение нейротрансмиттера. Лекарственное средство, такое как лидокаин, которое блокирует потенциалзависимые каналы, используют в качестве местного анестетика. Другие блокаторы натриевых каналов, такие как ламотригин и карбамазепин используют для лечения эпилепсии. В последнем случае в результате частичного ингибирования потенциалзависимых натриевых каналов уменьшается нервная возбудимость и подавляется распространение судорог. В случае локального анестетика местное блокирование натриевых каналов на сенсорных нейронах препятствует проведению болевого сигнала. Главной особенностью этих лекарственных средств является их стимулзависимый механизм действия. Считается,что эти лекарственные вещества стабилизируют инактивированную конфигурацию, которую канал быстро принимает после своего открытия. Это инактивированное состояние обеспечивает рефракторный период до того, как канал возвращается в свое состояние покоя (закрытое), которое готово для повторной активации. В результате блокаторы стимулзависимых натриевых каналов замедляют высокочастотное возбуждение нейронов, например, в ответ на болевой сигнал и будут помогать препятствовать многократному возбуждению в течение периодов продолжительной нейронной деполяризации, которая могла бы возникать, например, при судорогах. На потенциалы действия, стимулируемые с малой частотой, например, в сердце, эти лекарственные вещества не будут оказывать сильного воздействия, хотя предел безопасности отличается в каждом случае, поскольку при достаточно высоких концентрациях каждое из этих лекарственных средств способно блокировать состояние покоя каналов или состояние, при котором они открыты. Семейство потенциалзависимых натриевых каналов состоит из 10 подтипов, четыре из которых характерны для мозга, NaV1.1, 1.2, 1.3 и 1.4. Что касается других подтипов, то NaV1.4 находится только в скелетных мышцах, NaV1.5 характерен для сердечной мышцы и NaV1.7, 1.8 и 1.9 находятся преимущественно в сенсорных нейронах. Предполагаемый участок связывания для блокаторов стимулзависимых натриевых каналов чрезвычайно консервативен для всех подтипов. В результате лекарственные средства,такие как лидокаин, ламотригин и карбамазепин не селективны по отношению к подтипам. Однако селективность можно достигнуть благодаря отличию частот, при которых обычно функционируют каналы. Лекарственные средства, которые блокируют потенциалзависимые натриевые каналы стимулзависимым способом, также используют для лечения биполярных расстройств как для того, чтобы ослабить симптомы маниакального синдрома или депрессии, так и в качестве стабилизатора настроения для того,чтобы предотвратить появление приступов расстройства настроения. Клинические и доклинические результаты также предполагают, что блокаторы стимулзависимых натриевых каналов могут способствовать ослаблению симптомов шизофрении. Например, показано, что ламотригин ослабляет симптомы психозов, вызванных кетамином у здоровых добровольцев, и, более того, исследования на пациентах показывают, что лекарственное средство может увеличить антипсихотическую эффективность некоторых атипичных антипсихотических лекарственных средств, таких как клозапин и оланзапин. Предполагается, что эффективность при таких психических расстройствах может быть, отчасти, результатом снижение высвобождения избыточного глутамата. Считается, что снижение высвобождения глутамата является следствием ингибирования стимулзависимых натриевых каналов в важнейших областях мозга, таких как лобная кора. Однако взаимодействие с потенциалзависимыми кальциевыми каналами может также вносить свой вклад в эффективность этих лекарственных средств. В опубликованной международной патентной заявке WO 05/000309 (Ionix Pharmaceuticals Limited) описано использование соединений формулы (I), где R1 представляет собой органический заместитель,X1 и Х 2 представляют собой прямые связи или спейсерные группы, Ar представляет собой арил или гетероарил и Y представляет собой замещенную аминоалкильную группу или гетероарил, гетероциклил или группу, содержащую фенил Такие соединения являются ингибиторами специфичных натриевых каналов в сенсорных нейронах,и считается, что они пригодны для лечения хронической и острой боли, шума в ушах, расстройств кишечника, дисфункции мочевого пузыря и демиелинизирующих заболеваний.-1 015736 В опубликованной международной патентной заявке WO 04/083189 (MerckСо.) описаны диарилзамещенные триазольные соединения формулы (I), (II) и (III) в качестве блокаторов натриевых каналов Считается, что такие соединения пригодны для лечения состояний, связанных с активностью натриевых каналов, включающих, например, острую боль, хроническую боль, висцеральную боль, эпилепсию, синдром раздраженного кишечника, депрессию и другие. В опубликованной международной патентной заявке WO 04/092140 (MerckCo.) описаны диарилзамещенные пиразолы формулы (I), (II), (III) и (IV) в качестве блокаторов натриевых каналов Считается, что такие соединения пригодны для лечения состояний, включающих острую боль, хроническую боль, висцеральную боль, боль при воспалении и невропатическую боль. В опубликованной международной патентной заявке WO 04/094395 (MerckCo.) описаны диарилзамещенные триазолы, оксазолы и имидазолы формулы (I) в качестве блокаторов натриевых каналов: Считается, что такие соединения полезны для лечения состояний, включающих острую боль, хроническую боль, висцеральную боль, боль при воспалении и невропатическую боль.-2 015736 В международной патентной заявке WO 04/026826 (F. Hoffman La Roche AG) описаны 4-пирролидинофенилбензилэфирные производные формулы (I) Считается, что эти соединения являются ингибиторами моноаминоксидазы В, и считается, что они пригодны для лечения состояний, таких как болезнь Альцгеймера и сенильная деменция. Цель настоящего изобретения заключается в том, чтобы обнаружить соединение, которое модулирует потенциалзависимые натриевые каналы. В одном варианте осуществления соединение будет ингибитором стимулзависимых натриевых каналов. В другом варианте осуществления соединение будет ингибитором подтипа NaV1.3 стимулзависимых натриевых каналов. Другая цель настоящего изобретения заключается в том, чтобы обнаружить ингибитор стимулзависимых натриевых каналов, который имеет подходящую кривую проявления эффекта, например с точки зрения воздействия (Cmax) и/или биодоступности при пероральном приеме. В соответствии с первым аспектом данное изобретение относится к 5-(4-[(2 фторфенил)метил]оксифенил)пролинамиду формулы (I) или его фармацевтически приемлемым солям или сольватам. В дальнейшем соединение формулы (I), его фармацевтически приемлемые соли или сольваты, определенные в любом аспекте данного изобретения (за исключением промежуточных соединений в химических реакциях), называют "соединениями данного изобретения". Специалистам ясно, что соединение формулы (I) может существовать в виде четырех возможных диастереоизомеров. В следующем варианте осуществления соединение данного изобретения выбирают из списка, состоящего из и фармацевтически приемлемых солей или сольватов (Ia), (Ib), (Ic) или (Id). В следующем варианте осуществления соединением данного изобретения является (5R)-5-(4-[(2 фторфенил)метил]оксифенил)-L-пролинамида (Ia) или его фармацевтически приемлемая соль или сольват. Диастереоизомеры соединения формулы (I) можно получить в соответствии с хорошо известными в литературе способами, например с помощью препаративной ВЭЖХ или хроматографических очисток. Рацемическую смесь можно разделить при использовании как препаративной ВЭЖХ и колонки с хиральной неподвижной фазой, так и разделить, чтобы получить отдельные энантиомеры при использовании известных специалистам в данной области техники способов. В добавление хиральные промежуточные соединения можно разделить и использовать, чтобы приготовить хиральные соединения данного изобретения. Соединение формулы (I) может образовывать фармацевтически или ветеринарно приемлемые соли. Например, фармацевтически и ветеринарно приемлемыми солями соединения (I), которые содержат основный центр, являются нетоксические соли присоединения кислоты, образованные с неорганическими кислотами, такими как хлороводородная, бромоводородная, йодоводородная, серная и фосфорная кислоты, с карбоновыми кислотами и с органо-сульфоновыми кислотами. Примеры включают HCl, HBr, HI,сульфатные и бисульфатные, нитратные, фосфатные или гидрофосфатные, ацетатные, бензоатные, сукцинатные, сахаратные, фумаратные, малеатные, лактатные, цитратные, тартратные, глюконатные, камсилатные, метансульфонатные, этансульфонатные, бензолсульфонатные, п-толуолсульфонатные и памоатные соли. Для обзора подходящих фармацевтических солей смотри Berge et al., J. Pharm. Sci., 66, 1-19,1977; P.L. Gould, International Journal of Pharmaceutics, 33 (1986), 201-217 и Bighley et al., Encyclopedia ofPharmaceutical Technology, Marcel Dekker Inc., Ney York, 1996, vol. 13, p. 453-497. Специалистам в области органической химии ясно, что многие органические соединения могут образовывать комплексы с растворителями, в которых они реагируют или из которых они осаждаются или кристаллизуются. Эти комплексы известны как "сольваты". Например, комплекс с водой известен как"гидрат". Фармацевтически приемлемые сольваты соединения данного изобретения включены в объем данного изобретения. Фармацевтически приемлемые сольваты соединений данного изобретения включают их гидраты. Также включенными в объем соединений данного изобретения являются их полиморфные модификации. Соединения данного изобретения могут существовать в одной или более таутомерных формах. Все таутомерные формы и их смеси включены в объем настоящего изобретения. Данное изобретение также включает все подходящие изотопные модификации соединения данного изобретения. Изотопную модификацию соединения данного изобретения определяют как модификацию,в которой по меньше мере один атом замещают атомом, имеющим тот же самый атомный номер, но его атомный вес отличается от атомного веса распространенного в природе атома. Примеры изотопов, которые можно ввести в соединения данного изобретения, включают изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора и хлора, такие как 2 Н, 3 Н, 13 С, 14C, 15N, 17O, 18O, 31 Р, 32 Р, 35S, 18F и 36Cl соответственно. Определенные изотопные модификации данного изобретения, например, такие, в которых вводят радиоактивные изотопы, такой как 3 Н или 14 С, пригодны для лекарств и/или для изучения распределения субстрата в тканях. Насыщенные тритием, т.е. 3 Н и углерод-14, т.е. 14 С изотопы в особенности предпочтительны из-за легкости их приготовления и обнаружения. Кроме того, замещение изотопами,такое как замещение на дейтерий, т.е. 2 Н, может давать определенные терапевтические преимущества в-4 015736 результате большей метаболической стабильности, например, увеличенного времени полураспада in vivo или сниженной требуемой дозы и, следовательно, могут быть предпочтительны в некоторых обстоятельствах. Изотопные модификации соединений данного изобретения можно в основном приготовить с помощью общепринятых методик, таких как представленные способы или с помощью методик по приготовлению, описанных в примерах ниже при использовании подходящих изотопных модификаций подходящих реагентов. В соответствии со следующим аспектом изобретение относится к способу приготовления соединения формулы (I), включающему реакцию соединения формулы (II) с раствором аммиака в подходящем растворителе. В одном варианте осуществления растворителем является метанол. В следующем варианте осуществления раствор аммиака концентрируют в метаноле, например, до 7 н. или 11,2 M раствора. В другом варианте осуществления реакцию проводят при комнатной температуре. Как описано выше в данном изобретении, считается, что соединения данного изобретения могут быть пригодны для лечения заболеваний и состояний, опосредованных модуляцией потенциалзависимых натриевых каналов. Следовательно, в соответствии со следующим аспектом данное изобретение относится к соединениям данного изобретения для использования в качестве лекарственных средств, предпочтительно в качестве лекарственных средств для человека. В соответствии со следующим аспектом данное изобретение относится к использованию соединений данного изобретения для изготовления лекарств для лечения или предупреждения заболевания или состояния, опосредованного модуляцией потенциалзависимых натриевых каналов. Без стремления быть связанными теорией, заболевания и состояния, которые могут быть опосредованы модуляцией потенциалзависимых натриевых каналов, выбирают из списка, состоящего из [номеров в скобках после перечисленных ниже заболеваний со ссылкой на классификационный код в Diagnosticand Statistical Manual of Mental Disorders, 4th Edition, опубликованном американской ассоциацией психиатров (DSM-IV) и/или International Classification of Diseases, 10th Edition (ICD-10)]:i) депрессии и расстройств настроения, включая тяжелый депрессивный эпизод, маниакальный эпизод, смешенный эпизод и гипоманиакальный эпизод; депрессивных расстройств, включая тяжелое депрессивное расстройство, дистимическое расстройство (300.4), депрессивное расстройство без дополнительных уточнений (311); биполярных расстройств, включая биполярное расстройство I типа, биполярное расстройство II типа (периодически повторяющиеся тяжелые депрессивные эпизоды и гипоманиакальные эпизоды) (296.89), циклотимическое расстройство (301.13) и биполярное расстройство без дополнительных уточнений (296.80); других расстройств настроения, включая расстройство настроения в результате общего медицинского состояния (293.83), которое включает подтипы с депрессивным характером, с эпизодом, подобным тяжелой депрессии, с маниакальным характером и со смешенным характером, расстройство настроения, обусловленное химическим веществом (включая подтипы с депрессивным характером, маниакальным характером и со смешанным характером) и расстройство настроения без дополнительных уточнений (296.90);ii) шизофрении, включая подтипы параноидального типа (295.30), дезорганизованного типа(295.60); шизофреноформного расстройства (295.40), шизоаффективного расстройства (295.70), включая подтипы биполярного типа и депрессивного типа; бредового расстройства (297.1), включая подтипы эротоманического типа, типа величия, типа ревности, типа преследования, соматического типа, смешанного типа и неуточненного типа; кратковременного психического расстройства (298.8); индуцированного психического расстройства (297.3); психического расстройства в результате общего медицинского состояния, включая подтипы с бредом и с галлюцинациями; психического расстройства, обусловленного химическим веществом, включая подтипы с бредом (293.81) и с галлюцинациями (293.82); и психического расстройства без дополнительных уточнений (298.9);iii) тревожных расстройств, включая острое тревожное состояние с реакцией паники; панического расстройства, включая паническое расстройство без агорафобии (300.01) и паническое расстройство с агорафобией (300.21); агорафобии; агорафобии без предыстории с паническим расстройством (300.22); специфической фобии (300.29, ранее простая фобия), включая подтипы типа с боязнью животных, типа с боязнью открытых пространств, типа с боязнью открытых ран, типа ситуационной фобии и других типов; социальной фобии (социальное тревожное расстройство, 300.23); обсессивно-компульсивного расстройства (300.3); посттравматического стрессового расстройства (309.81); острого стрессового расстройства (308.3); генерализованного тревожного расстройства (300.02), тревожного расстройства в результате общего медицинского состояния (293.84); тревожного расстройства, обусловленного химиче-5 015736 ским веществом, тревожного расстройства в связи с разлукой (309.21); расстройства адаптации с тревогой (309.24) и тревожного расстройства без дополнительных уточнений (300.00);iv) расстройств, обусловленных химическим веществом, включая расстройства, связанные с употреблением химических веществ, такие как зависимость от химического вещества, желание употреблять химическое вещество, злоупотребление химическим веществом; расстройств, обусловленных химическим веществом, такие как интоксикация химическим веществом, абстинентный синдром, делирий, вызванный употреблением химического вещества, персистирующая деменция, вызванная употреблением химического вещества, персистирующее амнестическое расстройство, вызванное употреблением химического вещества, психическое расстройство, вызванное употреблением химического вещества, расстройство настроения, вызванное употреблением химического вещества, тревожное расстройство, вызванное употреблением химического вещества, половая дисфункция, вызванная употреблением химического вещества, расстройство сна, вызванное употреблением химического вещества, и персистирующее расстройство восприятия, вызванное употреблением галлюциногенов ("вспышки прошлого"); расстройств, вызванных употреблением алкоголя, таких как алкогольная зависимость (303.90), желание употреблять алкоголь (305.00), алкогольная интоксикация (303.00), абстинентный алкогольный синдром(291.81), делирий при алкогольной интоксикации, алкогольный делирий при воздержании, персистирующая деменция, вызванная употреблением алкоголя, персистирующее амнестическое расстройство,вызванное употреблением алкоголя, психическое расстройство, вызванное употреблением алкоголя, расстройство настроения, вызванное употреблением алкоголя, тревожное расстройство, вызванное употреблением алкоголя, половая дисфункция, вызванная употреблением алкоголя, расстройство сна, вызванное употреблением алкоголя, и расстройство, вызванное употреблением алкоголя, без дополнительных уточнений (291.9); расстройств, обусловленных употреблением амфетамина (или подобных химических веществ), таких как амфетаминовая зависимость (304.40), желание употреблять амфетамин (305.70), амфетаминовая интоксикация (292.89), абстинентный амфетаминовый синдром (292.00), делирий при амфетаминовой интоксикации, психическое расстройство, вызванное употреблением амфетамина, расстройство настроения, вызванное употреблением амфетамина, тревожное расстройство, вызванное употреблением амфетамина, половая дисфункция, вызванная употреблением амфетамина, расстройство сна, вызванное употреблением амфетамина, и расстройство, обусловленное употреблением амфетамина, без дополнительных уточнений (292.9); расстройств, обусловленных употреблением кофеина, таких как кофеиновая интоксикация (305.90), тревожное расстройство, вызванное употреблением кофеина, расстройство сна, вызванное употреблением кофеина, и расстройство, обусловленное употреблением кофеина,без дополнительных уточнений (292.9); расстройств, обусловленных употреблением марихуаны, таких как зависимость от марихуаны (304.30), желание употреблять марихуану (305.20), марихуановая интоксикация (292.89), делирий при марихуановой интоксикации, психическое расстройство, вызванное употреблением марихуаны, тревожное расстройство, вызванное употреблением марихуаны, и расстройство,обусловленное употреблением марихуаны, без дополнительных уточнений (292.9); расстройств, обусловленных употреблением кокаина, таких как кокаиновая зависимость (304.40), желание употреблять кокаин (305.60), кокаиновая интоксикация (292.89), абстинентный кокаиновый синдром (292.0), делирий при кокаиновой интоксикации, психическое расстройство, вызванное употреблением кокаина, расстройство настроения, вызванное употреблением кокаина, тревожное расстройство, вызванное употреблением кокаина, половая дисфункция, вызванная употреблением кокаина, расстройство сна, вызванное употреблением кокаина, и расстройство, обусловленное употребление кокаина, без дополнительных уточнений(292.9); расстройств, обусловленных употреблением галлюциногенов, таких как зависимость от галлюциногена (304.50), желание употреблять галлюциноген (305.30), галлюциногенная интоксикация(292.89), персистирующее расстройство восприятия при употреблении галлюциногена ("вспышки прошлого") (292.89), делирий при галлюциногенной интоксикации, психическое расстройство, вызванное употреблением галлюциногенов, расстройство настроения, вызванное употреблением галлюциногенов,тревожное расстройство, вызванное употреблением галлюциногенов, и расстройство, обусловленное употреблением галлюциногенов, без дополнительных уточнений (292.9); расстройств, обусловленных употреблением ингалянтов, таких как зависимость от ингалянтов (304.60), желание употреблять ингалянты (305.90), ингалянтная интоксикация (292.89), делирий при ингалянтной интоксикации, персистирующая деменция, вызванная употреблением ингалянтов, психическое расстройство, вызванное употреблением ингалянтов, расстройство настроения, вызванное употреблением ингалянтов, тревожное расстройство, вызванное употреблением ингалянтов, и расстройство, обусловленное употреблением ингалянтов, без дополнительных уточнений (292.9); расстройств, обусловленных употреблением никотина,таких как никотиновая зависимость (305.10), абстинентный никотиновый синдром (292.0) и расстройство, обусловленное употреблением никотина, без дополнительных уточнений (292.9); расстройств, обусловленных употреблением опиоидов, таких как опиоидная зависимость (304.00), желание употреблять опиоиды (305.50), опиоидная интоксикация (292.89), абстинентный опиоидный синдром (292.00), делирий при опиоидной интоксикации, психическое расстройство, вызванное употреблением опиоидов, расстройство настроения, вызванное употреблением опиоидов, половая дисфункция, вызванная употреблением опиоидов, расстройство сна, вызванное употреблением опиоидов, и расстройство, обусловленное-6 015736 употреблением опиоидов, без дополнительных уточнений (292.9); расстройств, обусловленных употреблением фенциклидина (или подобных фенциклидину), таких как фенциклидиновая зависимость (304.60),желание употреблять фенциклидин (305.90), фенциклидиновая интоксикация (292.89), делирий при фенциклидиновой интоксикации, психическое расстройство, вызванное употреблением фенциклидина, расстройство настроения, вызванное употреблением фенциклидина, тревожное расстройство, вызванное употреблением фенциклидина, и расстройство, обусловленное употреблением фенциклидина, без дополнительных уточнений (292.9); расстройств, обусловленных употреблением успокаивающего средства,снотворного или анксиолитика, таких как зависимость от успокаивающего средства, снотворного или анксиолитика (304.10), желание употреблять успокаивающее средство, снотворное или анксиолитик(305.40), интоксикация успокаивающим средством, снотворным или анксиолитиком (292.89), абстинентный синдром при злоупотреблении успокаивающим средством, снотворным или анксиолитиком (292.00),делирий при интоксикации успокаивающим средством, снотворным или анксиолитиком, делирий при воздержании от употребления успокаивающего средства, снотворного или анксиолитика, персистирующая деменция при злоупотреблении успокаивающим средством, снотворным или анксиолитиком, персистирующее амнестическое расстройство при злоупотреблении успокаивающим средством, снотворным или анксиолитиком, психическое расстройство, вызванное употреблением успокаивающего средства,снотворного или анксиолитика, расстройство настроения, вызванное употреблением успокаивающего средства, снотворного или анксиолитика, тревожное расстройство, вызванное употреблением успокаивающего средства, снотворного или анксиолитика, половая дисфункция, вызванная употреблением успокаивающего средства, снотворного или анксиолитика, расстройство сна, вызванное употреблением успокаивающего средства, снотворного или анксиолитика, и расстройство, обусловленное употреблением успокаивающего средства, снотворного или анксиолитика, без дополнительных уточнений (292.9); расстройств, обусловленных употреблением нескольких химических веществ, таких как зависимость от нескольких химических веществ (304.80); и других (или неизвестных) расстройств, обусловленных употреблением химических веществ, таких как анаболические стероиды, нитратные ингалянты и оксид азота;v) улучшения познавательных способностей, включая лечение когнитивных нарушений при других заболеваниях, таких как шизофрения, биполярное расстройство, депрессия, другие психические расстройства и психические состояния, связанные с когнитивными нарушениями, например болезнью Альцгеймера;vi) нарушений сна, включая первичные расстройства сна, такие как диссомнии, такие как первичная инсомния (307.42), первичная гиперсомния (307.44), нарколепсия (347), расстройство сна, связанное с нарушением дыхания (780.59), расстройство сна, связанное с циркадными ритмами (307.45) и диссомния без дополнительных уточнений (307.47); первичных расстройств сна, таких как парасомнии, такие как нарушение сна, связанное с ночными кошмарами (307.47), нарушение сна, связанное со страхом (307.46),лунатизм (307.46) и парасомния без дополнительных уточнений (307.47); нарушений сна, связанных с другим психическим расстройством, таких как инсомния, связанная с другим психическим расстройством (307.42), и гиперсомния, связанная с другим психическим расстройством (307.44); расстройства сна в результате общего медицинского состояния, в частности нарушения сна, связанного с такими заболеваниями, как неврологические нарушения, невропатическая боль, синдром усталых ног, заболевания сердца и легких; и расстройств сна, вызванных употреблением химического вещества, включая подтипы типа инсомнии, типа гиперсомнии, типа парасомнии и смешанного типа; апноэ во сне и синдрома смены часовых поясов;vii) расстройств пищевого поведения, таких как нервная анорексия (307.1), включая подтипы ограничительного типа и типа с эпизодами переедания/очищения; нервной булимии (307.51), включая подтипы типа с очистительным поведением и без очистительного поведения; ожирения; компульсивного расстройства пищевого поведения; "вспышки переедания"; и расстройства пищевого поведения без дополнительных уточнений (307.50);viii) расстройств аутистического спектра, таких как аутизм (299.00), синдром Аспергера (299.80),синдром Ретта (299.80), дисинтегративный детский синдром (299.10) и общее расстройство без дополнительных уточнений (299.80), включая атипичный аутизм;ix) расстройства с гиперактивностью/дефицитом внимания, включая подтипы комбинированного типа расстройства с гиперактивностью/дефицитом внимания (314.01), преимущественно невнимательного типа расстройства с гиперактивностью/дефицитом внимания (314.00), гиперактивного-импульсивного типа расстройства с гиперактивностью/дефицитом внимания (314.01) и расстройства с гиперактивностью/дефицитом внимания без дополнительных уточнений (314.9); гиперкинетического расстройства; расстройства социального поведения, такого как кондуктивное расстройство, включая подтипы типа расстройства, начинающегося в раннем детстве (321.81), начинающегося в подростковом возрасте (312.82),и типа расстройства без уточнения момента появления (312.89), оппозиционно-вызывающее расстройство (313.81) и расстройство социального поведения без дополнительных уточнений; и тикозных расстройств, таких как расстройство Туретта (307.23): х) расстройств личности, включая подтипы параноидального расстройства личности (301.0), шизоидного расстройства личности (301.20), шизотипического расстройства личности (301.22), антисоциаль-7 015736 ного расстройства личности (301.7), пограничного расстройства личности (301.83), истероидного расстройства личности (301.50), нарциссического расстройства личности (301.81), избегающего расстройства личности (301.82), зависимого расстройства личности (301.6), обсессивно-компульсивного расстройства личности (301.4) и расстройство личности без дополнительных уточнений (301.9); иxi) сексуальных дисфункций, включая расстройства полового влечения, такие как расстройство со снижением полового влечения (302.71), и расстройство, характеризующееся сексуальным отвращением(302.79); расстройства сексуального возбуждения, такие как расстройство сексуального возбуждения у женщин (302.72) и расстройство эрекции у мужчин (302.72); оргазмических расстройств, таких как оргазмическое расстройство у женщин (302.73), оргазмическое расстройство у мужчин (302.74) и преждевременная эякуляция (302.75); болевых расстройств при половом акте, таких как диспареуния (302.76) и вагинизм (306.51); сексуальной дисфункции без дополнительных уточнений (302.70); парафилий, таких как экзбиционизм (302.4), фетишизм (302.81), фроттеризм (302.89), педофилия (302.2), сексуальный мазохизм (302.83), сексуальный садизм (302.84); трансвестический фетишизм (302.3), вуайеризм (302.82) и парафилия без дополнительных уточнений (302.9); расстройств половой идентичности, таких как расстройство половой идентичности в детстве (302.6) и расстройство половой идентичности в подростковом возрасте или у взрослых (302.85); и сексуального расстройства без дополнительных уточнений (302.9);xii) расстройств контроля над побуждениями, включая периодическое взрывное расстройство(312.34), клептоманию (312.32), патологическую игроманию (312.32), пироманию (312.33), трихотилломанию (312.39), расстройства контроля над побуждениями без дополнительных уточнений (312.3), переедание, навязчивый шопинг, компульсивное сексуальное поведение и навязчивое накопление. В другом варианте осуществления заболеваниями и состояниями, которые могут быть опосредованы модуляцией потенциалзависимых натриевых каналов, являются депрессия и расстройства настроения. В другом варианте осуществления заболеваниями и состояниями, которые могут быть опосредованы модуляцией потенциалзависимых натриевых каналов, являются расстройства, связанные с употреблением химического вещества. В следующем варианте осуществления заболеваниями и состояниями, которые могут быть опосредованы модуляцией потенциалзависимых натриевых каналов, являются биполярные расстройства(включая биполярное расстройство I типа, биполярное расстройство II типа (т.е. повторяющиеся эпизоды глубокой депрессии и гипоманиакальные эпизоды) (296.89), циклотимическое расстройство (301.13) и биполярное расстройство без дополнительных уточнений (296.80. В следующем варианте осуществления заболеваниями и состояниями, которые могут быть опосредованы модуляцией потенциалзависимых натриевых каналов, являются расстройства, связанные с употреблением никотина, такие как никотиновая зависимость (305.1), абстинентный никотиновый синдром(292.0), и расстройства, связанные с употреблением никотина, без дополнительных уточнений (292.9). В одном из вариантов осуществления соединения данного изобретения могут быть пригодны в качестве анальгетиков. Например, они могут быть полезны для лечения хронической воспалительной боли(например, боли, связанной с ревматическим артритом, остеоартритом, ревматическим спонделитом,подагрическим артритом и болезнью Стилла); боли скелетных мышц; болей в шее и нижнем отделе спины; растяжений и вывихов; невропатической боли; симпатически поддерживаемой боли; миозита; боли,связанной с раком или фибромиалгией; боли, связанной с мигренью; боли, связанной с гриппом или другими вирусными инфекциями, такими как простуда; острой ревматической лихорадки; боли, связанной с функциональными расстройствами кишечника, такими как неязвенная диспепсия, боль в груди, не связанная с заболеваниями сердца, и синдром раздраженного кишечника; боли, связанной с ишемией миокарда; послеоперационной боли; головной боли; зубной боли и дисменореи. Соединения данного изобретения могут быть пригодны для лечения невропатической боли. Синдромы невропатической боли могут развиваться вслед за повреждением нервной системы и боль может продолжаться в течение месяцев или лет, даже после того, как вылечено первоначальное повреждение. Повреждение нервной системы может произойти в периферических нервах, задних корешках, спинном мозге или в определенных областях в мозге. Синдромы невропатической боли традиционно классифицируют в соответствии с заболеванием или осложнением, которое вызвали их. Синдромы невропатической боли включают диабетическую невропатию; ишиаз; неспецифическую боль в нижнем отделе спины; боль при множественном склерозе; фибромиалгию; невропатию, связанную с ВИЧ; постгерпетическую невралгию; тригеминальную невралгию; и боль, являющуюся результатом физической травмы, ампутации, рака, токсинов и хронических воспалительных состояний. Эти состояния трудно лечить и хотя известно, что несколько лекарственных средств ограничивают действие, редко достигают полный контроль боли. Симптомы невропатической боли чрезвычайно разнообразны и их часто описывают как спонтанная стреляющая и острая боль или постоянная, нестерпимая боль. В дополнение существует боль, связанная с обычными не болевыми ощущениями, такими как "пощипывание в конечностях" (парестезия и дисестезия), повышенная чувствительность к прикосновениям (гиперестезия), болевое ощущение вслед за безвредной стимуляцией (динамическая, статическая и термическая аллодиния), повышенная чувствительность к вредной стимуляции (термическая, механическая гиперальгезия и повышенная чувствитель-8 015736 ность к холоду), непрерывное болевое ощущение после прекращения стимулирования (гиперпатия) или отсутствие или нехватка сенсорных проводящих путей (гипоальгезия). Соединения данного изобретения могут также быть пригодны для улучшения воспалительных состояний, например для лечения состояний кожи (например, солнечных ожогов, ожогов, экземы, дерматита, псориаза); офтальмологических заболеваний, заболеваний легких (например, астмы, бронхита, эмфиземы, аллергического ринита, не аллергического ринита, кашля, синдрома дыхательной недостаточности,болезни любителей птиц, легких фермера, хронического обструктивного заболевания легких (COPD); расстройств желудочно-кишечного тракта (например, болезни Крона, язвенного колита, целиакия, регионарного илеита, синдрома раздраженного кишечника, воспалительной болезни кишечника, гастроэзофагельной рефлюксной болезни); других состояний с воспалительным компонентом, таких как мигрень, множественный склероз, ишемия миокарда. Соединения данного изобретения могут также быть пригодны для лечения и/или предупреждения излечимых и/или предотвращаемых нарушений с помощью противосудорожных агентов, таких как эпилепсия, включая посттравматическую эпилепсию, обсессивно-компульсивные расстройства (OCD), расстройства сна (включая расстройства циркадианного ритма, инсомнию и нарколепсию), тики (например,синдром Жиль-де-ла-Туррета), атаксия, мышечная ригидность (спастическая) и дисфункция височнонижнечелюстного сустава. Соединения данного изобретения могут также быть пригодны для лечения гиперрефлексии мочевого пузыря вслед за воспалением мочевого пузыря. Соединения данного изобретения могут также быть пригодны для лечения нейродегенеративных заболеваний и нейродегенерации, таких как деменция, в частности дегенеративная деменция (включая сенильную деменцию, болезнь Альцгеймера, болезнь Пика, хорею Хантингтона, болезнь Паркинсона и болезнь Крейцфельдта-Якоба, боковой амиотрофический склероз); соединения данного изобретения могут также быть пригодны для лечения амиотрофического латерального склероза (ALS) и воспаления нервов. Соединения данного изобретения могут также быть пригодны для нейропротекции и для лечения нейродегенерации вслед за сердечным ударом, остановкой сердца, легочным шунтированием, травматическими повреждениями мозга, повреждением позвоночника или подобных. Соединения данного изобретения могут также быть пригодны для лечения звона в ушах и в качестве местных анастетиков. Соединения данного изобретения можно также использовать в комбинации с другими терапевтическими агентами. Данное изобретение, таким образом относится в следующем аспекте, к композиции,содержащей соединение данного изобретения или его фармацевтически приемлемое производное вместе с дополнительным терапевтическим агентом. Когда соединение данного изобретения или его фармацевтически приемлемое производное используют в комбинации со вторым терапевтическим агентом, имеющим активность против того же заболевания, установленная доза каждого соединения может отличаться от дозы, когда используется одно соединение. Специалисты в данной области легко определят подходящие дозы. Ясно, что количество соединения данного изобретения, требуемое для использования при лечении, будет варьироваться в зависимости от характера состояния, на которое направлено лечение, и возраста, и состояния пациента и будет, в конечном счете, определяться по усмотрению лечащего врача или ветеринара. Соединения настоящего изобретения можно использовать в комбинации с другим [антитромботическими средствами, такими как ингибиторы тромбина, антагонисты тромбоксановых рецепторов, простациклиновые миметики, ингибиторы фосфодиэстеразы, антагонисты фибриногена, тромболитическими средствами, такими как тканевый активатор плазминогена и стрептокиназа, нестероидными противовоспалительными средствами,такими как аспирин, и подобные]. Комбинации, которые указаны выше, можно для удобства использовать в виде фармацевтической композиции, и, таким образом, фармацевтические композиции, содержащие комбинацию, как описано выше, с фармацевтически приемлемым носителем или вспомогательным веществом составляют дополнительный аспект данного изобретения. Отдельные компоненты таких комбинаций можно принимать как последовательно, так и одновременно, по отдельности, так и в виде смешанного фармацевтического состава с помощью любого подходящего способа применения. При последовательном приеме можно принимать первым как соединение данного изобретения, так и второй терапевтический агент. При одновременном приеме комбинацию можно принимать как в одной и той же, так и в другой фармацевтической композиции. При смешении в одном составе ясно, что два соединения должны быть стабильны и совместимы друг с другом и с другими компонентами состава. При составлении рецептуры по отдельности их можно включать в любой удобный состав, удобный для такого приема, как известно для таких соединений в данной области техники. Соединения данного изобретения можно использовать в комбинации со следующими агентами для лечения и предупреждения психических расстройств: i) нейролептиками; ii) лекарственными средствами для экстрапирамидальных побочных эффектов, например антихолинергическими средствами (такими(такими как такрин, донепезил, ривастигмин и галантамин). Соединения данного изобретения можно использовать в комбинации с антидепрессантами для лечения и предупреждения депрессии и расстройств настроения. Соединения данного изобретения можно использовать в комбинации со следующими агентами для лечения и предупреждения биполярного расстройства: i) стабилизаторами настроения; ii) нейролептиками и iii) антидепрессантами. Соединения данного изобретения можно использовать в комбинации со следующими агентами для лечения и предупреждения тревожных расстройств: i) анксиолитиками и ii) антидепрессантами. Соединения данного изобретения можно использовать в комбинации со следующими агентами,чтобы облегчить никотиновую абстиненцию и снизить желание употреблять никотин: i) никотин заместительной терапией, например сублингвальной композицией никотинового бета-циклодекстрина и никотиновыми пластырями; и ii) бупропионом. Соединения данного изобретения можно использовать в комбинации со следующими агентами,чтобы облегчить алкогольную абстиненцию и снизить желание употреблять алкоголь: i) антагонистамиNMDA рецепторов, например, акампрозатом; ii) агонистами GABA рецепторов, например тетрабаматом; и iii) антагонистами опиоидных рецепторов, например налтрексоном. Соединения данного изобретения можно использовать в комбинации со следующими агентами,чтобы облегчить опиоидную абстиненцию и снизить желание употреблять опиаты: i) агонистами-опиоидных рецепторов/антагонистами -опиоидных рецепторов, например бупренофрином; ii) антагонистами опиоидных рецепторов, например налтрексоном; и iii) сосудорасширяющими гипотензивными средствами, например лофексидином. Соединения данного изобретения можно использовать в комбинации со следующими агентами для лечения и предупреждения расстройств сна: i) бензодиазепинами, например темазепамом, лорметазепамом, эстазоламом и триазоламом; ii) небензодиазепиновыми снотворными средствами, например золпидемом, зопиклоном, залеплоном и индиплоном; iii) барбитуратами, например апробарбиталом, бутабарбиталом, пентобарбиталом, секобарбиталом и фенобарбиталом; iv) антидепрессантами; v) другими седативно-снотворными средствами, например хлоральгидратом и хлорметиазолом. Соединения данного изобретения можно использовать в комбинации со следующими агентами для лечения анорексии: i) стимуляторами аппетита, например ципрогептидином; ii) антидепрессантами; iii) нейролептиками; iv) цинком; v) предменструальными агентами, например пиридоксином и прогестеронами. Соединения данного изобретения можно использовать в комбинации со следующими агентами для лечения и предупреждения булимии: i) антидепрессантами; ii) антагонистами опиоидных рецепторов; iii) противорвотными средствами, например ондансетроном; iv) антагонистами тестостероновых рецепторов, например флутамидом; v) стабилизаторами настроения; vi) цинком и vii) предменструальными агентами. Соединения данного изобретения можно использовать в комбинации со следующими агентами для лечения и предупреждения аутизма: i) нейролептиками; ii) антидепрессантами; iii) анксиолитиками и iv) стимуляторами, например метилфенидатом, амфетаминовыми композициями и пемолином. Соединения данного изобретения можно использовать в комбинации со следующими агентами для лечения и предупреждения ADHD: i) стимуляторами, например метилфенидатом, амфетаминовыми композициями и пемолином; и ii) не стимуляторами, например ингибиторами обратного захвата норэпинефрина (таким как атомоксетин), агонистами альфа 2 адренорецепторов (таким как клонидин), антидепрессантами, модафинилом, ингибиторами холинэстеразы (такими как галантамин и донезепил). Соединения данного изобретения можно использовать в комбинации со следующими агентами для лечения и предупреждения расстройств личности: i) нейролептиками; ii) антидепрессантами; iii) стабилизаторами настроения и iv) анксиолитиками. Соединения данного изобретения можно использовать в комбинации со следующими агентами для лечения и предупреждения мужской сексуальной дисфункции: i) ингибиторами фосфодиэстеразы V, например варденафилом и сильденафилом; ii) агонистами допамина/ингибиторами переноса допамина,например апоморфином и бупроприоном; iii) антагонистами альфа адренорецепторов, например фентоламином; iv) агонистами простагландинов, например алпростадилом; v) агонистами тестостерона, такими как тестостерон; vi) ингибиторами переноса серотонина, например ингибиторами обратного захвата серотонина; vii) ингибиторами переноса норадреналина, например ребокситином; и viii) агонистами 5 НТ 1 А, например флибансерином. Соединения данного изобретения можно использовать в комбинации с теми же агентами, указанными для мужской сексуальной дисфункции, для лечения и предупреждения женской сексуальной дисфункции и, в добавление, с агонистами эстрогена, такими как эстрадиол. Нейролептические лекарственные средства включают обычные нейролептики (например, хлорпро- 10015736 мазин, тиоридазин, мезоридазин, флуфеназин, перфеназин, прохлорперазин, трифторперазин, тиотиксин,галоперидол, молиндон и локсапин); и не стандартные нейролептики (например, клозапин, оланзапин,рисперидон, кветиапин, арипиразол, зипразидон и амисульприд). Антидепрессанты включают ингибиторы обратного захвата серотонина (такие как циталопрам, эсциталопрам, флюокситин, парокситин и сертралин); ингибиторы двойного обратного захвата серотонина/норадреналина (такие как венлафаксин, дулокситин и милнаципран); ингибиторы обратного захвата норадреналина (такие как ребокситин); трициклические антидепрессанты (такие как амитриптилин, хломипрамин, имипрамин, мапротилин, нортриптилин и тримипрамин); ингибиторы моноаминоксидазы(такие как изокарбоксазид, моклобемид, фенелзин и транилципромин) и другие (такие как бупропион,миансерин, миртазапин, нефазодон и тразодон). Лекарственные средства для стабилизации настроения включают литий, вальпроат натрия/вальпроевую кислоту/дивалпроэкс, карбамазепин, ламотригин, габапентин, топирамат и тиагабин. Анксиолитики включают бензодиазепины, такие как алпразолам и лоразепам. Ясно, что упоминание в данном описании слова "лечение" относится также к профилактике, предупреждению рецидивов и подавлению или ослаблению симптомов (независимо от того, слабые ли они,умеренные или серьезные), также как к лечению определенных состояний. Соединение данного изобретения можно принимать в чистом виде, но активный ингредиент предпочтительно принимать в виде фармацевтической композиции. В соответствии со следующим аспектом данное изобретение относится к фармацевтической композиции, содержащей соединение данного изобретения, совместно с одним или более фармацевтически приемлемым носителем (носителями), разбавителем (разбавителями) и/или вспомогательным веществом(веществами). Носитель, разбавитель и/или вспомогательное вещество должны быть приемлемыми в том смысле, что они совместимы с другими ингредиентами композиции и не вредны для самого реципиента. Соединения данного изобретения можно принимать в общепринятой лекарственной форме, приготовленной с помощью объединения соединения данного изобретения со стандартными фармацевтическими носителями или разбавителями в соответствии с хорошо известными в данной области техники общепринятыми методиками. Эти методики могут включать смешение, гранулирование и прессование или растворение ингредиентов в зависимости от требуемого препарата. Фармацевтические композиции данного изобретения можно составить для приема любым способом, и они включают такие их формы, которые подходят для перорального, топического или парентерального приема млекопитающими, включая человека. Композиции могут быть в форме таблеток, капсул, порошков, гранул, пастилок, кремов и жидких заготовок, таких как растворы для перорального приема или стерильные растворы для парентерального введения или суспензии. Лекарственные формы для наружного применения настоящего изобретения могут быть представлены, например, мазями, кремами, лосьонами, глазными мазями и каплями для глаз и ушей, пропитанными перевязками и аэрозолями и могут содержать подходящие общепринятые добавки, такие как консерванты, растворители, чтобы способствовать проникновению лекарственного средства, и смягчители в мазях и кремах. Композиции могут также содержать совместимые общепринятые носители, такие как кремовая или мазевая основа и этанол или олеиловый спирт для лосьонов. Такие носители могут присутствовать в количествах от приблизительно 1% до вплоть приблизительно 98% композиции. Обычно они составляют до приблизительно 80% композиции. Таблетки и капсулы могут быть представлены в форме единичных доз и могут содержать общепринятые вспомогательные вещества, такие как связующие агенты, например сироп, камедь, желатин, сорбитол, трагакант или поливинилпирролидон; наполнители, такие как лактоза, сахар, кукурузный крахмал, фосфат кальция, сорбитол и глицин; смазку для изготовления таблеток, например стеарат магния,тальк, полиэтиленгликоль или кварц; дезинтеграторы, например картофельный крахмал; или подходящие смачивающие реагенты, такие как лаурилсульфат натрия. Таблетки можно покрыть оболочкой в соответствии с хорошо известными в обычной фармацевтической практике способами. Жидкие составы для перорального приема могут быть в виде, например, водных или масляных суспензий, растворов, эмульсий,сиропов или эликсиров, или могут быть в виде сухого вещества для получения перед использованием жидких составов с помощью воды или других подходящих сред. Такие жидкие составы могут содержать общепринятые добавки, такие как суспендирующие агенты, например сорбитол, метилцеллюлоза, сироп глюкозы, желатин, гидроксиэтилцеллюлоза, карбоксиметилцеллюлоза, гель стеарата алюминия или гидрированные пищевые жиры, эмульсирующие агенты, такие как лецитин, моноолеат сорбитана или камедь; неводные среды (которые могут содержать пищевые масла), например миндальное масло, жирные эфиры, такие как глицерин, пропиленгликоль или этанол; консерванты, например метил- или пропил-пгидроксибензоат или сорбиновая кислота и, при желании, общепринятые агенты, придающие запах или цвет. Суппозитории могут содержать общепринятую суппозиторную основу, например масло какао или другой глицерид.- 11015736 При парентеральном приеме жидкую форму единичной дозы приготовляют, используя соединение и стерильную среду, причем в качестве среды предпочтительна вода. Соединение в зависимости от используемой среды и концентрации можно как суспендировать, так и растворять в среде. При приготовлении растворов соединение можно растворять в воде для введения и стерилизовать на фильтре перед наполнением в подходящие пробирки, ампулы и герметичные сосуды. Преимущественно агенты, такие как местные анестетики, консерванты и буферные вещества, можно растворять в среде. Чтобы повысить стабильность, композицию можно заморозить после наполнения в пробирку, и воду можно удалить в вакууме. Сухой лиофилизированный порошок затем помещают в герметичную пробирку и можно обеспечить дополнительной пробиркой воды для введения, чтобы растворить порошок перед использованием. Суспензии для парентерального введения приготовляют в основном тем же самым способом, но вместо растворения соединение суспендируют в среде и для стерилизации не используют фильтрацию. Соединение можно стерилизовать, действуя на него этиленоксидом перед суспендированием в стерильной среде. Преимущественно в композицию включают сурфактант или увлажняющий агент, чтобы способствовать равномерному распределению соединения. Композиции могут содержать от 0,1 вес.%, например 10-60 вес.%, действующего вещества в зависимости от способа приема. В случае, если композиции содержат единичную дозу, каждая единичная доза будет, например, содержать 5-1000 мг действующего вещества. Доза, используемая для лечения взрослого человека, может изменяться от 10 до 3000 мг в день, в зависимости от способа введения и частоты приема. Для перорального приема стандартная доза составляет 50-1500 мг в день, например 120-800 мг в день. Специалистам ясно, что оптимальное количество и интервал между приемами отдельных доз соединения данного изобретения будет определяться характером и продолжительностью вылечиваемого состояния, формой, способом приема и местом приема, конкретным вылечиваемым млекопитающим, и такой оптимум можно определить с помощью общепринятых методик. Специалистам ясно, что оптимальный курс лечения, т.е. число доз соединения изобретения, даваемых в день в течение определенного числа дней, может быть определен специалистами при использовании общепринятого порядка испытаний для определения лечения. Все публикации, включая, но не ограничиваясь ими, патенты патентные заявки, упомянутые в этом описании, вводятся в данное изобретение с помощью ссылки, как если бы каждая отдельная публикация упоминалась специально и отдельно для того, чтобы ввести ее с помощью ссылки в данное изобретение,как если бы она была полностью изложена. Ясно, что данное изобретение включает следующие дополнительные аспекты. Варианты осуществления, описанные для первого аспекта, аналогично используют для этих дополнительных аспектов. Заболевания и состояния, описанные выше, распространяются, по необходимости, для этих дополнительных аспектов:i) соединение данного изобретения при использовании для лечения и предупреждения заболеваний и состояний, опосредованных модуляцией потенциалзависимых натриевых каналов;ii) способ лечения или предупреждения заболевания или состояния, опосредованного модуляцией потенциалзависимых натриевых каналов, у млекопитающих, включая прием эффективных количеств соединения данного изобретения;iii) использование соединения данного изобретения для изготовления лекарственного средства, чтобы лечить и предотвращать заболевание или состояние, опосредованное модуляцией потенциалзависимых натриевых каналов;iv) использование соединения данного изобретения, чтобы лечить и предотвращать заболевание или состояние, опосредованное модуляцией потенциалзависимых натриевых каналов. Эксперименты Данное изобретение проиллюстрировано примерами, описанными ниже. В методиках, которые следуют ниже, после каждого исходного вещества обычно ставят ссылку с номером на описание или пример. Это делается просто, чтобы помочь опытному химику. Исходное вещество не обязательно было приготовлено в опыте, на который ссылаются. Когда ссылаются на использование аналогичной методики, как ясно специалистам, такая методика может содержать небольшие изменения, например температуру реакции, количество реагента/растворителя, время реакции, условия обработки или условия хроматографической очистки. Соединения, описанные в примерах, описанные в данном изобретении, получали на первой стадии из стереохимически чистого метил-5-оксо-L-пролината или этил-5-оксо-D-пролината, например, 99% ее. Стереохимию соединений описаний и примеров определяли, допуская, что стереохимическая чистота 5-оксопролината сохраняется при любых последующих условиях реакции. Абсолютную конфигурацию аномерного центра во втором положении, как показано ниже, определяли на основании NOE 1H ЯМР экспериментов, определяя относительную стереохимию этого аномерного центра по отношению к аномерному центру в 5 положении. Соединения называли, используя программу ACD/Name Pro 6.02 для наименования веществ (Advanced Chemistry Development Inc., Toronto, Ontario, M2H5L3, Canada). Спектры протонного магнитного резонанса (ЯМР) обычно записывали или на Varian Instruments при 300, 400, 500 или 600 МГц, или на Bruker Instrument при 300 и 400 МГц. Химические сдвиги представляли в ppm , используя остаточную линию растворителя в качестве внутреннего стандарта. Мультиплетность обозначали как s, синглет; d, дуплет; t, триплет; q, квинтет; m, мультиплет; b, уширение. ЯМР спектры записывали при температуре в диапазоне от 25 до 90 С. При обнаружении более чем одного конформера приводили химические сдвиги для конформера, присутствующего в наибольшем количестве. ВЭЖХ анализ обозначен Rf (ВЭЖХ): х мин, проводили на серии приборов Agilent 1100, используя колонку Luna 3u C18(2) 100A (502,0 мм) (подвижная фаза: 100% [вода+0,05% TFA] - 95% [ацетонитрил+0,05% TFA] через 8 мин, поток=1 мл/мин, длина волны для детектирования 220 нм. Масс-спектры обычно получали на 4 II тройном квадрупольном масс-спектрометре (Micromass UK) или на масс-спектрометре Agilent MSD 1100, функционирующем в ES (+) и ES (-) режимах ионизации,или на масс-спектрометре Agilent LC/MSD, функционирующем в ES (+) и ES (-) режимах ионизации,соединенном с ВЭЖХ прибором серии Agilent 1100 [LC/MS - ES(+): анализы проводили на SupercosilABZ+Plus (334,6 мм, 3 мкм) (подвижная фаза: 100% [вода+0,1% HCO2H] в течение 1 мин, затем от 100% [вода+0,1% НСО 2 Н] до 5% [вода+0,1% НСО 2 Н] и 95% [CH3CN] через 5 мин, в конце при этих условиях в течение 2 мин; Т=40 С, поток=1 мл/мин; LC/MS - ES(-): анализы проводили на Supercosil[CH3CN] через 5 мин, в конце при этих условиях в течение 2 мин; Т=40 С, поток=1 мл/мин]. В массспектрах указывали только один пик из группы молекулярных ионов. Угол оптического вращения измеряли на цифровом поляриметре JASCO DIP-360 (=589 нм,Т=20 С, с=1 в метаноле). Флеш-хроматографию на силикагеле обычно проводили на силикагеле с диаметром частиц 230-400(предоставленной Merck AG Darmstadt, Germany) или через предварительно заполненные картриджыVarian Mega Be-Si либо через предварительно заполненные силикагелем Biotage картриджы.SPE-SCX картриджы являются колонками для твердофазной ионообменной экстракции, предоставленными Varian. Элюентом, используемым с SPE-SCX картриджами, является метанол, с последующим 2 н. раствором аммиака в метаноле. В ряде методик очистку проводили, используя или систему флеш-хроматографии Biotage с ручным управлением (Flash +), или систему автоматической флеш-хроматографии (Horizon).SPE-Si картриджи являются колонками для твердофазной ионообменной экстракции, предоставленными Varian. Ясно, что спектральные и дифракционные данные будут слегка варьироваться в соответствии с различными факторами, такими как температура, концентрация и используемый инструментарий. Специалистам ясно, что на положения XRPD пиков влияют различия в высоте образца. Положения пиков, приведенных в данном изобретении, таким образом, зависят от изменения +/-0,15 2. Порошковая рентгеновская дифракция Анализы с помощью порошковой рентгеновской дифракции (XRPD) проводили на Bruker D5005,используя детектор Sol-X. Условия получения данных были: излучение Cu-K, напряжение генератора: 40 кВ, сила тока генератора: 50 мА, начальный угол: 2,0 2, конечный угол: 45,0 2, размер шага: 0,02 2, время на один шаг: 1 мин. Образец приготовляли на нулевом уровне держателя образца. Дифференциальная сканирующая калориметрия (DSC): должно быть ясно, что измеренный эндотермический пик зависит от ряда факторов, включая используемый прибор, скорость нагрева, калибровочный стандарт, влажности и чистоты используемого образца. Температуры плавления, представленные в экспериментах, измеряли на основании возникновения эндотермических пиков, регистрируемых в процессе DSC анализа. В следующей таблице перечислены используемые сокращения: ВОС 2 О - бис-(1,1-диметилэтил)дикарбонатTFA - трифторуксусная кислота МТВЕ - метил-трет-бутиловый эфир К раствору имеющегося в продаже метил-5-оксо-L-пролината (20 г, 140 ммоль) в DCM (200 мл) добавляли триэтиламин (19,6 мл, 140 ммоль), DMAP (17,2 г, 140 ммоль) и затем добавляли по каплям раствор ВОС 2 О (61 г, 280 ммоль) в DCM (100 мл). Полученную в результате красную смесь перемешивали при комнатной температуре в течение 2 ч. Затем растворитель удаляли при пониженном давлении и сырой продукт очищали хроматографией на силикагеле, элюируя в градиенте циклогексан/этилацетат(7:3-4:6), чтобы получить (после растирания в системе гексан/диэтиловый эфир 1:1) названное в заголовке соединение в виде белого твердого остатка (32,4 г, 96%); Rf (циклогексан:этилацетат=65:35): 0,21; 1 Н ЯМР (300 МГц, CDCl3)(ppm): 4,62 (дд, 1 Н), 3,78 (с, 3 Н), 2,68-2,58 (м, 1 Н), 2,52-2,45 (м, 1 Н), 2,372,27 (м, 1 Н), 2,08-1,97 (м, 1 Н), 1,48 (с, 9 Н). Описание 2. Метил-(2S)-2-([(1,1-диметилэтил)окси]карбониламино)-5-оксо-5-4-[(фенилметил)окси]фенилпентаноат (D2). 1,6 М раствор н-бутиллития в гексане (0,88 мл, 1,4 ммоль) добавляли по каплям к раствору имеющегося в продаже 1-бром-4-[(фенилметил)окси]бензола (390 мг, 1,48 ммоль) в сухом THF (2 мл) при-78 С в атмосфере азота. Полученную в результате суспензию перемешивали при -78 С в течение 40 мин и затем ее добавляли по каплям к раствору 1-(1,1-диметилэтил)-2-метил-(2S)-5-оксо-1,2 пирролидиндикарбоксилата (D1, 300 мг, 1,23 ммоль) в сухом THF (2,4 мл), предварительно охлажденному до -78 С. Смесь перемешивали при -78 С в течение 40 мин и при -40 С в течение 1 ч, затем реакцию гасили при -40 С насыщенным водным раствором хлорида аммония. Смесь разбавляли водой и экстрагировали этилацетатом. Затем органическую фазу промывали солевым раствором, сушили над Na2SO4 и упаривали при пониженном давлении, чтобы получить сырое вещество, которое очищали хроматографией на силикагеле, элюируя в градиенте циклогексан/этилацетат (95:5), получая таким образом названное в заголовке соединение в виде белого твердого остатка (170 мг, 32%); Rf (циклогексан:этилацетат=8:2): 0,30; 1H ЯМР (300 МГц, CDCl3)(ppm): 7,95 (д, 2H), 7,50-7,33 (м, 5H), 7,03 (д, 2 Н), 5,20 (ушир.с, 1H),5,15 (с, 2 Н), 4,45-4,35 (м, 1 Н), 3,78 (с, 3 Н), 3,15-2,95 (м, 2 Н), 2,36-2,26 (м, 1 Н), 2,16-2,02 (м, 1 Н), 1,45 (с,9H). Описание 3. Метил-(2S)-5-4-[(фенилметил)окси]фенил-3,4-дигидро-2H-пиррол-2-карбоксилат К раствору метил-(2S)-2-([(1,1-диметилэтил)окси]карбониламино)-5-оксо-5-4-[(фенилметил)окси]фенилпентаноата (D2, 323 мг, 0,75 ммоль) в сухом DCM (4 мл) при 0 С в атмосфере азота добавляли по каплям трифторуксусную кислоту (1 мл). Полученный в результате бледно розовый раствор нагревали до комнатной температуры в течение 1 ч, затем упаривали при пониженном давлении, получая названное в заголовке соединение (D7, 291 мг, 0,68 ммоль, 91%) в виде зеленоватого масла, которое можно использовать на следующей стадии без дополнительной очистки; Rt (ВЭЖХ): 3,69 мин; MS: К раствору метил-(2S)-5-4-[(фенилметил)окси]фенил-3,4-дигидро-2H-пиррол-2-карбоксилата (D3,13,7 г, 32,4 ммоль) в МеОН (200 мл) добавляли PtO2 (240 мг) и смесь перемешивали в атмосфере водорода (2 атм) в течение 6 ч. Затем катализатор отфильтровывали и растворитель удаляли при пониженном давлении, чтобы получить красное масло, которое растворяли в этилацетате и промывали растворомNaHCO3. Полученное в результате сырое вещество очищали хроматографией на силикагеле, элюируя в градиенте циклогексан/этилацетат (9:1-8:2), получая названные в заголовке соединения: D4, 4,15 г,13,3 ммоль, Y=41%, MS: (ES/+) m/z: 312 [МН+], C19H21NO3 требует 311, Rt (ВЭЖХ): 3,80 мин; Rf (циклогексан:этилацетат=7:3): 0,18; 1 Н ЯМР (300 МГц, CDCl3)(ppm): 7,40 (д, 2 Н); 7,35 (т, 2 Н); 7,33 (д, 2 Н); 7,29 (т, 1 Н); 6,93 (д, 2 Н); 5,03 (с, 2 Н); 4,23 (дд, 1 Н); 4,00 (дд, 1 Н); 3,71-3,79 (м, 3 Н); 2,18-2,30 (м, 1 Н); 2,09-2,18 (м, 2 Н); 1,67-1,78 (м, 1 Н). Можно наблюдать NOE между протонами в С 2 и С 5 положениях. D5,0,6 г, 1,9 ммоль, Y=6%, MS: (ES/+) m/z: 312 [МН+], C19H21NO3 требует 311, Rt (ВЭЖХ): 3,73 мин; Rf (циклогексан:этилацетат=7:3): 0,32. 1H ЯМР (300 МГц, CDCl3)(ppm): 7,40 (д, 2 Н); 7,35 (т, 2 Н); 7,29 (д, 2 Н); 7,28 (т, 1 Н); 6,91 (д, 2 Н); 4,97-5,07 (м, 2 Н); 4,29 (дд, 1 Н); 4,09 (дд, 1 Н); 3,71-3,75 (м, 3 Н); 2,29-2,42 (м, 1 Н); 2,09-2,20 (м, 1 Н); 1,90-2,02 (м, 1 Н); 1,69-1,82 (м, 1 Н). NOE между протонами в С 2 и С 5 положениях не наблюдали. Описание 6. (5R)-5-4-[(Фенилметил)окси]фенил-L-пролин (D6). Описание 7. (5R)-1-[(1,1-Диметилэтил)окси]карбонил-5-4-[(фенилметил)окси]фенил-L-пролин(2,3 мл) добавляли растворенный в воде (1,1 мл) моногидрат LiOH (26 мг, 0,61 ммоль), с последующем добавлением метанола (1,1 м). Полученный в результате раствор перемешивали при комнатной температуре в течение 2,5 ч, затем оставляли на ночь при -18 С. Затем органический растворитель удаляли при пониженном давлении, поддерживая температуру 38 С, и водный остаток, содержащий кислое промежуточное соединение (D6, Rt (ВЭЖХ)=3,63 мин. MS: (ES/+) m/z: 298 [МН+], C18H19NO3 требует 297) обрабатывали ВОС 2 О (168 мг, 0,77 ммоль), растворенным в THF (1,1 мл). Реакционную смесь перемешивали при комнатной температуре в течение 3,5 ч. Органический растворитель выпаривали и основный водный раствор подкисляли при 0 С 1 н. водным раствором HCl до рН 3, этот кислый водный раствор экстрагировали этилацетатом (210 мл). Органическую фазу сушили над Na2SO4 и растворитель выпаривали при пониженном давлении, получая твердый остаток, который растирали в н-гексане (36 мл), получая названное в заголовке соединение в виде белого порошка (D7, 137 мг, 90% для двух стадий); Rt (ВЭЖХ) 5,81 мин; Rf (циклогексан:этилацетат=1:1): 0,34; MS: (ES/+) m/z: 420 [M+Na+], C23H27NO5 требует 397;(1,23 г, 3,98 ммоль) и после 20 мин 1,1,1,3,3,3-гексаметилдисилазан (1,15 мл, 5,43 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем обрабатывали 5% водным раство- 15015736 ром NaHCO3 (30 мл) и дополнительно перемешивали в течение 30 минут. Полученную в результате смесь разбавляли водой и экстрагировали этилацетатом. Затем органическую фазу промывали дважды смесью соляной раствор/лед, сушили над Na2SO4 и упаривали, чтобы получить бесцветное масло. Это сырое вещество очищали колоночной хроматографией на силикагеле, элюируя в градиенте циклогексан/этилацетат (7:3-5:5), чтобы получить названное в заголовке соединение (1,25 г, 87%); Rt (ВЭЖХ) 5,51 мин; Rf (циклогексан:этилацетат=1:1): 0,29; MS: (ES/+) m/z: 419 [M+Na+], C23H28N2O4 требует 396. Описание 9. 1,1-Диметилэтил-(2S,5R)-2-(аминокарбонил)-5-(4-гидроксифенил)-1-пирролидинкарбоксилат (D9). К раствору 1,1-диметилэтил-(2S,5R)-2-(аминокарбонил)-5-4-[(фенилиметил)окси]фенил-1-пирролидинкарбоксилата (D8, 1,2 г, 3,02 ммоль) в метаноле (25 мл) добавляли Pd/C 10 вес.% (210 мг) и смесь перемешивали в атмосфере водорода (1 атм) в течение 6 ч. Катализатор отфильтровывали и растворитель выпаривали при пониженном давлении, чтобы получить названное в заголовке соединение в виде белого твердого остатка (870 мг, 94%); Rt (ВЭЖХ) 3,61 мин; Rf (циклогексан:этилацетат=1:1): 0,18; MS: (ES/+) К раствору 1,1-диметилэтил-(2S,5R)-2-(аминокарбонил)-5-(4-гидроксифенил)-1-пирролидинкарбоксилата (D9, 45 мг, 0,146 ммоль) и карбоната калия (30 мг) в ацетонитриле (2 мл) добавляли 1-(бромметил)-2-фторбензол (30 мкл, 0,220 ммоль). Смесь перемешивали в течение ночи при комнатной температуре. После завершения реакции, как было определено по ТСХ, добавляли этилацетат и воду. Органическую фазу затем промывали солевым раствором, сушили (Na2SO4), фильтровали и упаривали. Сырое вещество очищали колоночной хроматографией на силикагеле, используя в качестве градиента смесь циклогексан/этилацетат (7:3-6:4), чтобы получить названное в заголовке соединение (51 мг, 85%); Rt(D11). Сырое вещество можно использовать без дополнительной очистки на следующей стадии; Rt К раствору 1,1-диметилэтил-(2S,5S)-2-(аминокарбонил)-5-(4-гидроксифенил)-1-пирролидинкарбоксилата (D14, 50 мг, 0,163 ммоль) и карбоната калия (34 мг, 0,244 ммоль) в ацетонитриле (0,5 мл) добавляли 1-(бромметил)-2-фторбензол (30 мкл, 0,244 ммоль). Смесь перемешивали в течение ночи при комнатной температуре. Затем добавляли этилацетат (20 мл) и воду (10 мл). Органическую фазу сушили надNa2SO4, фильтровали и упаривали при пониженном давлении. Сырое вещество очищали колоночной хроматографией на силикагеле, используя в качестве градиента смесь циклогексан/этилацетат (7:3-6:4),чтобы получить названное в заголовке соединение (65 мг, 97%); Rf (циклогексан:этилацетат=7:3): 0,19; Названное в заголовке соединение (14 мг, 71%) синтезировали, следуя аналогичной методике, используемой ранее в описании 1, исходя из имеющегося в продаже 5-оксо-D-пролината (12 г, 75,6 ммоль); Названное в заголовке соединение синтезировали, следуя аналогичной методике, используемой ранее в описании 3, исходя из этил-(2R)-2-([(1,1-диметилэтил)окси]карбониламино)-5-оксо-5-4[(фенилметил)окси]фенилпентаноата (D17, 2,9 г, 6,57 ммоль). Сырое вещество можно использовать без дополнительной очистки на следующей стадии; Rt (ВЭЖХ) 3,80 мин; MS: (ES/+) m/z: 324 [M+Na+] Названное в заголовке соединение (1,84 г, 86% на две стадии) синтезировали, следуя аналогичной методике, используемой ранее в описании 4, исходя из неочищенного вещества, полученного по методике, описанной в описании 18; Rt (ВЭЖХ) 4,03 мин; MS: (ES/+) m/z: 326 [МН+] C20H23NO3 требует 325; 1H ЯМР (500 МГц, CHCl3-d)(ppm): 7,30-7,47 (м, 7 Н), 6,96 (д, 2 Н), 5,06 (с, 2 Н), 4,23 (кв, 2 Н), 4,15 (дд, 1 Н),3,90 (дд, 1 Н), 2,17-2,28 (м, 1 Н), 2,07-2,17 (м, 2 Н), 1,61-1,76 (м, 1 Н), 1,31 (т, 3 Н). Описание 20. (5S)-5-4-[(Фенилметил)окси]фенил-D-пролин (D20). Названное в заголовке соединение (440 мг, количественный выход после двух стадий) синтезировали, следуя аналогичной методике, используемой ранее в описании 7, исходя из (5S)-5-4-[(фенилметил)окси]фенил-D-пролина (D20); Rt (ВЭЖХ) 5,77 мин; MS: (ES/+) m/z: 420 [M+Na+] C23H27NO5 требует 397; 1 Н-ЯМР (500 МГц, ДМСО-d6)(ppm): 12,55 (ушир.с, 1 Н); 6,65-6,78 (м, 7 Н); 6,95 (д, 2 Н); 5,10- 18015736 Названное в заголовке соединение (135 мг, количественный выход после двух стадий) синтезировали, следуя аналогичной методике, используемой ранее в описании 9, исходя из 1,1-диметилэтил-(2R,5S)-2(аминокарбонил)-5-4-[(фенилиметил)окси]фенил-1-пирролидинкарбоксилата (D22, 175 мг, 0,44 ммоль); Rt Способ 1. К раствору 4-бромфенола (502,08 г) в ацетоне (7322 мл) добавляли K2CO3 (570 г) и затем бензилбромид (523 г). Смесь кипятили с обратным холодильником в течение 2 ч. Затем реакционную смесь охлаждали до 25 С, фильтровали и остаток на фильтре промывали МТВЕ (1046 мл). Объединенные фильтраты концентрировали до 1000 мл и добавляли МТВЕ (4184 мл). Смесь промывали 1 М водным раствором NaOH (1464 мл), затем солевым раствором (1300 мл) и органическую фазу концентрировали досуха. Добавляли THF (1300 мл) и растворитель удаляли при пониженном давлении, чтобы получить названное в заголовке соединение (902,1 г); 1H ЯМР (400 МГц, ДМСО-d6)(ppm): 7,54 (тд, 1 Н); 7,46 (д, 2 Н); 7,42 (м, 1 Н); 7,23 (м, 2 Н); 7,01 (д, 2 Н); 5,13 (с, 2 Н).D25 также получали следующим способом. Способ 2. Смесь 4-бромфенола (19,22 г, 111 ммоль), ортофторбензилбромида (20 г, 105,8 ммоль) и карбоната калия (21,9 г, 158,4 ммоль) в ацетоне (280 мл) кипятили с обратным холодильником в течение 6 ч. Реакционную смесь охлаждали до комнатной температуры и фильтровали, промывали твердый остаток ТВМЕ (40 мл). Объединенные фильтраты и промывки концентрировали в вакууме до объема 40 мл. Полученный в результате раствор разбавляли ТВМЕ (160 мл) и промывали 1 М раствором гидроксида натрия и солевым раствором, затем концентрировали в вакууме до масла, которое медленно затвердевало, давая названное в заголовке соединение (28,9 г). 1H ЯМР (300 МГц, CHCl3-d),(ppm): 5,10 (с, 2 Н),6,86 (м, 2 Н), 7,10 (м, 1 Н), 7,17 (м, 1 Н), 7,29 (м, 1 Н), 7,35 (м, 2 Н), 7,38 (м, 1 Н). Описание 26. Метил-(2S)-2-([(1,1-диметилэтил)окси]карбониламино)-5-(4-[(2-фторфенил)метил]оксифенил)-5-оксопентаноат (D26). Способ 1. К перемешиваемой суспензии металлического магния (90 г) в сухом THF (600 мл) в атмосфере азота при комнатной температуре добавляли йод (0,3 г). Смесь нагревали до внутренней температуры 64+/-2 С. Раствор 1-[(4-бромфенокси)метил]-2-фторбензола (D25) (693 г) в THF (1500 мл) добавляли двумя порциями. Во-первых, добавляли 45 мл. Во-вторых, добавляли по каплям оставшийся раствор(1455 мл). После прибавления смесь кипятили с обратным холодильником в течение 1 ч. Реакционную смесь охлаждали до комнатной температуры. Затем эту реакционную смесь медленно добавляли к раствору имеющегося в продаже 1-трет-бутил-2-метил-(2S)-5-оксопирролидин-1,2-дикарбоксилата (300 г) вTHF (1500 мл), охлажденному до -60 С, поддерживая внутреннюю температуру ниже -60 С. Добавление завершали через 2 ч. Реакционную смесь дополнительно перемешивали в течение 15 мин после прибавления. Затем добавляли по каплям изопропиловый спирт (300 мл), поддерживая внутреннюю температуру ниже -60 С. Добавляли смесь водный насыщенный раствор хлорида аммония/водный насыщенный раствор хлорида натрия (2/1; 900 мл), поддерживая внутреннюю температуру ниже -60 С. Добавляли воду (600 мл), чтобы растворить желтый осадок. Органическую фазу отделяли и промывали 13% водным- 19015736 раствором NaCl (600 мл). Органическую фазу концентрировали досуха. Затем добавляли этилацетат(1500 мл) и растворитель выпаривали при пониженном давлении, чтобы удалить воду. Остаток очищали колоночной хроматографией на силикагеле, элюируя в градиенте циклогексан/этилацетат (90:10-8:2),получая названное в заголовке соединение (287 г); 1H ЯМР (600 МГц, ДМСО-d6)(ppm): 7,93 (д, 2 Н); 7,57 (тд, 1 Н); 7,44 (м, 1 Н); 7,27 (м, 3 Н); 7,14 (д, 2 Н); 5,24 (с, 2 Н); 4,04 (м, 1 Н); 3,61 (с, 3 Н); 3,03 (м, 2 Н); 1,94 (м, 2 Н); 1,38 (с, 9 Н).D26 также получали следующим способом. Способ 2. К смеси магниевой стружки (12,79 г, 533 ммоль), следовому количеству йода и 1,2-дибромэтана в THF (86 мл) при 70-75 С добавляли через 2 ч раствор 4-бромфенилового эфира(2-фторфенил)метила (D25, 100 г, 355,6 ммоль) в THF (216,25 мл). Смесь нагревали при 70-75 С в течение 2 ч, затем охлаждали до комнатной температуры, получая раствор реактива Гриньяра. Раствор 1-(1,1 диметилэтил)-2-метил-(2S)-5-оксо-1,2-пирролидинкарбоксилата (43,25 г, 177,8 ммоль) в THF (216,25 мл) охлаждали до -60 С и добавляли через 1 ч раствор реагента Гриньяра, затем смесь перемешивали в течение 3 ч при -60 С. Добавляли по каплям изопропанол (43,25 мл) с последующим добавлением насыщенного водного раствора хлорида аммония (86,5 мл) и соляного раствора (43,25 мл), затем смесь нагревали до комнатной температуры. Добавляли воду (173 мл) и 50% уксусную кислоту (50 мл) до рН 6-7 с последующим добавлением этилацетата (129,7 мл). Слои разделяли и водный слой экстрагировали этилацетатом (2129,7 мл). Объединенные органические слои промывали солевым раствором, затем концентрировали в вакууме. Остаток перемешивали с гексаном (216,2 мл), затем твердый остаток фильтровали и промывали гексаном. К полученному в результате твердому остатку добавляли изопропанол (432,5 мл) и смесь перемешивали при 45 С в течение 15 мин, затем охлаждали до 5-10 С и перемешивали в течение 2 ч. Твердый остаток фильтровали, промывали изопропанолом и сушили, чтобы получить названное в заголовке соединение в виде твердого остатка. 1H ЯМР (300 МГц, CHCl3-d):(ppm): 1,42 (с, 9 Н); 2,04 (м,1 Н); 2,28 (м, 1 Н); 3,03 (м, 2 Н); 3,74 (с, 3 Н); 4,37 (м, 1 Н); 5,19 (ушир., 1 Н); 5,20 (с, 2 Н); 7,02 (д, 2 Н); 7,11 Способ 1. К раствору метил-(2S)-2-([(1,1-диметилэтил)окси]карбониламино)-5-(4-[(2 фторфенил)метил]оксифенил)-5-оксопентаноата (D26) (243 мг) в сухом DCM (2430 мл) при 0 С добавляли по каплям TFA (461 мл). Смесь нагревали до комнатной температуры и перемешивали в течение 3 ч. Растворитель и избыток TFA удаляли в вакууме и полученное в результате черное масло перемешивали с EtOAc (21215 мл) и оставляли на ночь при высоком вакууме. Названное в заголовке соединение(392 г) получали в виде красного масла и использовали на следующей стадии без дополнительной очистки; 1H ЯМР (400 МГц, ДМСО-d6)(ppm): 8,16 (м, 2 Н); 7,60 (тд, 1 Н); 7,46 (м, 1 Н); 7,34 (м, 2 Н); 7,27 (м,2 Н); 5,32 (с, 2 Н); 5,25 (м, 1 Н); 3,77 (с, 3 Н); 3,57 (м, 2 Н); 2,60 (м, 1 Н); 2,34 (м, 1 Н).D27 получали также следующим способом. К раствору метил-(2S)-2-([(1,1-диметилэтил)окси]карбониламино)-5-(4-[(2-фторфенил)метил]оксифенил)-5-оксопентаноата (D26, 46 г, 103 ммоль) в DCM (437 мл) прибавляли по каплям трифторуксусную кислоту (87,4 мл) при 0-5 С, затем нагревали до комнатной температуры и перемешивали в течение 3 ч. Раствор охлаждали до 0-5 С, добавляли раствор гидроксида натрия до рН 7. Водный слой отделяли и экстрагировали DCM (13 мл), затем объединенные органические слои промывали водой, сушили над сульфатом натрия, затем концентрировали в вакууме, чтобы получить названное в заголовке соединение в виде твердого остатка (33,3 г). 1H ЯМР (300 МГц, CHCl3-d):(ppm): 2,35 (м, 2 Н); 2,95 (м,1 Н); 3,12 (м, 1 Н); 3,78 (с, 3 Н); 4,89 (дд, 1 Н); 5,18 (с, 2 Н); 7,00 (д, 2 Н); 7,10 (м, 1 Н); 7,16 (м, 1 Н); 7,29 (м,1 Н); 7,5 (т, 1 Н); 7,85 (д, 2 Н). Описание 28. Метил-(5R)-5-4-[(2-фторбензил)окси]фенил-L-пролинат (D28).(Engelhard code 44379, содержание влаги приблизительно 50%), в реактор закачивали водород до давления в 2 атм и реакционную смесь перемешивали в течение приблизительно 1,5 ч. Реактор разгерметизировали и отработанный катализатор отфильтровывали через целит, промывая EtOAc (2500 мл, затем дополнительно 200 мл). К фильтрату добавляли насыщенный водный раствор NaHCO3 (600 мл) с после- 20015736 дующим добавлением 13 вес.% водного раствора Na2CO3 (до рН 9, 1000 мл). Смесь перемешивали в течение 10 мин, и затем фазы разделяли. Водную фазу удаляли и затем органический слой промывали один раз солевым раствором (600 мл). Полученный в результате раствор концентрировали досуха и остаток очищали флеш-хроматографией, элюируя в градиенте циклогексан/этилацетат (1:1), получая названное в заголовке соединение (133 г); 1H ЯМР (600 МГц, ДМСО-d6)(ppm): 7,55 (дт, 1 Н); 7,41 (м, 1 Н); 7,34 (м,2 Н); 7,23 (м, 2 Н); 6,97 (м, 2 Н); 5,12 (с, 2 Н); 4,09 (дд, 1 Н); 3,83 (дд, 1 Н); 3,66 (с, 3 Н); 2,97 (ушир.с, 1 Н); 2,04 (м, 2 Н); 1,94 (м, 1 Н); 1,52 (м, 1 Н).D28 также приготовляли следующим способом. Способ 2. Раствор (2S)-5-4-[(2-фторбензил)окси]фенил-3,4-дигидро-2H-пиррол-2-карбоксилата(D27, 34 г, 103,5 ммоль) в этилацетате (272 мл) помещали в автоклав и обрабатывали трифторуксусной кислотой (7,2 мл). Добавляли платиновый катализатор на угле (1,7 г) в виде суспензии с этилацетатом(68 мл) и реакционную смесь перемешивали при комнатной температуре и давлении водорода 50 фунт/кв.дюйм в течение 5 ч. Смесь фильтровали через Hyflo, промывали этилацетатом (272 мл), затем фильтрат промывали водным раствором карбоната натрия и солевым раствором, сушили над сульфатом натрия, затем концентрировали в вакууме и остаток сушили, чтобы получить названное в заголовке соединение в виде неочищенного масла (также содержащего некоторое количество антиизомера). 1H ЯМР Способ 1. Раствор метил-(5R)-5-4-[(2-фторбензил)окси]фенил-L-пролината (D28, 32,5 г,98,6 ммоль) в метаноле (65 мл) охлаждали до 0-10 С. Добавляли раствор аммиака в метаноле (приблизительно 11,2 М) четырьмя порциями в течение 11 ч (175,4, 43,8, 43,8, 43,8 мл), затем реакционную смесь перемешивали при 15-20 С в течение 22 ч. Аммиак и метанол удаляли в вакууме, затем добавляли толуол (65 мл) и смесь нагревали до 60-65 С, чтобы получить раствор, который затем концентрировали в вакууме и остаток сушили при 60 С. К остатку добавляли толуол (130 мл) и метанол (0,32 мл) и смесь нагревали до 70-75 С. Затем полученный в результате раствор охлаждали до 15-20 С и перемешивали в течение 1 ч. Твердый остаток отфильтровывали, промывали толуолом и сушили при 45-50 С, чтобы получить названное в заголовке соединение в виде твердого остатка (21,8 г). 1H ЯМР (500 МГц, ДМСО-d6)(ppm): 1,39 (м, 1 Н); 1,84 (м, 1 Н); 2,04 (м, 2 Н); 3,54 (м, 1 Н); 4,09 (м, 1 Н); 5,12 (с, 2 Н); 6,96 (д, 2 Н); 7,15(м, 1 Н); 7,25 (м, 2 Н); 7,34 (д, 2 Н); 7,41 (м, 2 Н); 7,55 (т, 1 Н). Е 1 также приготовляли следующим способом. Способ 2. Метил-(5R)-5-4-[(2-фторбензил)окси]фенил-L-пролинат (D28) (127 г) растворяли в 7 н. растворе NH3 в метаноле (1016 мл) и смесь перемешивали при комнатной температуре в течение 24 ч. Дополнительно добавляли 7 н. раствор NH3 в МеОН (63 мл) и смесь дополнительно перемешивали в течение 15 ч. Растворитель удаляли при пониженном давлении и добавляли метанол (635 мл). Растворитель выпаривали досуха и белый твердый остаток выдерживали при высоком вакууме в течение выходных. Белый твердый остаток суспендировали в смеси МТВЕ/толуол 1:1 (254 мл) при 20 С и перемешивали в течение 1 ч. Суспензию фильтровали и твердый остаток промывали МТВЕ (254 мл). Белый твердый остаток сушили при 40 С в течение ночи в вакууме, чтобы получить 122,4 г вещества. Это вещество повторно суспендировали в смеси МТВЕ/толуол 1:1 (254 мл) при 20 С и перемешивали при комнатной температуре в течение 1 ч. Смесь фильтровали, и твердый остаток промывали МТВЕ (254 мл). Полученный белый твердый остаток сушили при 40 С в течение ночи в вакууме, чтобы получить названное в заголовке соединение (109 г). 1H ЯМР (600 МГц, ДМСО-d6)(ppm): 7,54 (тд, 1 Н); 7,41 (м, 1 Н); 7,38 (м,2 Н); 7,34 (д, 2 Н); 7,24 (м, 2 Н); 7,13 (ушир.с, 1 Н); 6,96 (д, 2H); 5,12 (с, 2 Н); 4,09 (дд, 1 Н); 3,55 (дд, 1 Н); 3,24 (ушир.с, 1 Н); 2,07 (м, 1 Н); 2,00 (м, 1 Н); 1,85 (м, 1 Н); 1,40 (м, 1 Н). Пример 2. (5R)-5-(4-[(2-Фторфенил)метил]оксифенил)-L-пролинамид гидрохлорид (Е 2). Способ 1. К раствору 1,1-диметилэтил-(2S,5R)-2-(аминокарбонил)-5-(4-[(2-фторфенил)метил]оксифенил)-1-пирролидинкарбоксилата (D10, 51 мг, 0,123 ммоль) в смеси этилацетата (0,9 мл) и метанола (1 мл), добавляли ацетилхлорид (28 мкл, 2,5 экв.) при 0 С. Смесь встряхивали в течение 1,5 ч и медленно нагревали до комнатной температуры. После выпаривания растворителя остаток растирали с- 21015736 диэтиловым эфиром, чтобы получить названное в заголовке соединение в виде белого твердого остатка(42 мг, количеств.); хиральная ВЭЖХ: колонка: chiralcel OD 10 мкм, 2504,6 мм; подвижная фаза: А: н-гексан; В: этанол; градиент: изократическая 30% В; скорость потока 0,8 м/мин; диапазон УФ длин волн: 200-400 нм; время анализа: 22 мин; время удержания: 12,0 мин; []D=-30,5. MS: (ES/+) m/z: 315(м, 1 Н). Соединение из примера 2 также приготовляли следующим способом. Способ 2. (5R)-5-(4-[(2-фторфенил)метил]оксифенил)-L-пролинамид (Е 1, 109 г) растворяли вDCM (654 мл) и добавляли при комнатной температуре Et2O (654 мл). Добавляли по каплям при комнатной температуре 1 н. HCl в Et2O (380,4 мл). Суспензию охлаждали до 0 С и перемешивали при комнатной температуре в течение 1 ч. Твердый остаток отфильтровывали, промывали Et2O (2327 мл) и сушили при 40 С в вакууме в течение ночи, чтобы получить кристаллы 1 формы названного в заголовке соединения(60 мл) с последующим добавлением раствора HCl в эфире (0,84 н., 40 мл) и затем смесь перемешивали в течение 30 мин при 20-25 С, затем охлаждали до 0-5 С и перемешивали в течение 2 ч. Твердый остаток отфильтровывали, промывали эфиром, затем сушили при комнатной температуре, чтобы получить кристаллы 1 формы названного в заголовке соединения (10,25 г). 1H ЯМР (300 МГц, ДМСО-d6)(ppm): 2,04(м, 1 Н); 2,18 (м, 1 Н); 2,32 (м, 2 Н); 4,34 (м, 1 Н); 4,64 (м, 1 Н); 5,18 (с, 2 Н); 7,10 (д, 2 Н); 7,25 (м, 2 Н); 7,407,60 (м, 4 Н); 7,77 (с, 1 Н); 8,24 (с, 1 Н); 11,03 (ушир., 1 Н). Способ 4. В круглодонной колбе раствор (5R)-5-(4-[(2-фторфенил)метил]оксифенил)-Lпролинамида (Е 1, 1,4 г, 4,45 ммоль) в этилацетате (14 мл) и МеОН (2,5 мл) при 0 С обрабатывали 1 МHCl в диэтиловом эфире (1,1 экв., 4,89 мл). Достаточно скоро наблюдали выпадение осадка и смесь перемешивали при 0 С в течение 1 ч. Затем смесь разбавляли сухим диэтиловым эфиром (10 мл) и затем фильтровали на фильтре Гуча (пористость 4, диаметр 5 см). Осадок на фильтре промывали сухим диэтиловым эфиром (220 мл) и полученный белый твердый остаток переносили в круглодонную колбу, сушили при высоком вакууме при 40 С в течение 2 ч и затем при комнатной температуре в течение 18 ч. Белый твердый остаток (1,51 г) получали в виде кристаллов 1 формы названного в заголовке соединения. Способ 5. (5R)-5-(4-[(2-фторфенил)метил]оксифенил)-L-пролинамида (Е 1, 25 г, 79,5 ммоль) растворяли в этилацетате (750 мл) и перемешивали с активированным углем (2,5 г), затем фильтровали,промывали этилацетатом (125 мл). Через 30 мин к фильтрату и промывкам добавляли при 20-25 С раствор HCl в эфире (1 н., 103 мл) и затем смесь перемешивали при 20-25 С в течение 30 мин, затем охлаждали до 0-5 С и перемешивали в течение 2 ч. Твердый остаток отфильтровывали, промывали этилацетатом (270 мл), затем сушили при комнатной температуре, чтобы получить кристаллы 1 формы названного в заголовке соединения (25,5 г). Уникальные и специфические пики формы 1 названного в заголовке соединения примера 2 были идентифицированы и представлены в таблице ниже: Названное в заголовке соединение (51 мг, 100%) синтезировали, следуя аналогичной методике, используемой ранее в примере 2, способа 1, исходя из 1,1-диметилэтил-(2S,5S)-2-(аминокарбонил)-5-(4[(2-фторфенил)метил]оксифенил)-1-пирролидинкарбоксилата (D15, 62 мг, 0,15 ммоль); Rt (ВЭЖХ): 3,54 мин; хиральная ВЭЖХ: колонка: chiralpak AD-H 5 мкм, 2504,6 мм; подвижная фаза: А: н-гексан; В: изопропанол; градиент: изократическая 30% В; скорость потока 0,8 м/мин; диапазон УФ длин волн: 200400 нм; время анализа: 15 мин; время удержания: 10,4 мин; MS: (ES/+) m/z: 315 [МН+], C18H19FN2O2 требует 314; 1H ЯМР (500 МГц, ДМСО-d6)(ppm): 9,37-9,13 (ушир. с, 2 Н), 8,01 (с, 1 Н), 7,68 (с, 1 Н), 7,55 (т,1 Н), 7,49 (д, 2 Н), 7,45-7,37 (м, 1 Н), 7,29-7,20 (м, 2 Н), 7,08 (д, 2 Н), 5,17 (с, 2 Н), 4,62 (дд, 1 Н), 4,31 (т, 1 Н),2,59-2,50 (м, 1 Н), 2,37-2,26 (м, 1 Н), 2,18- 2,03 (м, 1 Н), 2,01-1,88 (м, 1 Н). Пример 4. (5S)-5-(4-[(2-Фторфенил)метил]оксифенил)-D-пролинамид гидрохлорид (Е 4). Пример 5. (5R)-5-(4-[(2-Фторфенил)метил]оксифенил)-D-пролинамид гидрохлорид (Е 5). К раствору 1,1-диметилэтил-(2R,5S)-2-(аминокарбонил)-5-(4-[(2-фторфенил)метил]оксифенил)-1 пирролидинкарбоксилата (D24, 145 мг, 0,37 ммоль) в DCM (6 мл) добавляли по каплям при 0 С TFA(1,5 мл). Смесь перемешивали в течение 1 ч при этих условиях. После выпаривания растворителя полученное в результате неочищенное вещество очищали SCX картриджем, чтобы получить названное в заголовке соединение (100 мг, 92 %) в виде смеси диастереоизомеров. Диастереоизомеры разделяли при использовании хиральной полупрепаративной ВЭЖХ: колонка: chiralpak AD-H 5; подвижная фаза: нгексан:этанол=70/30; скорость потока 13 м/мин; диапазон УФ длин волн: 225 нм; время анализа: 25 мин. Условия аналитической хроматографии: хиральная ВЭЖХ: колонка: chiralpak AD-Hмкм, 2504,6 мм; подвижная фаза: А: н-гексан; В: этанол; градиент: изократическая 30% В; скорость потока 0,8 м/мин; диапазон УФ длин волн: 200-400 нм; время анализа: 15 мин; Rt: 14,02 (Е 4); Rt: 16,12 (Е 3); Е 4 (69,5 мг): Rt(ВЭЖХ): 3,60 мин. Хиральная ВЭЖХ: колонка: chiralcel OD 10 мкм, 2504,6 мм; подвижная фаза: А: н-гексан; В: этанол; градиент: изократическая 30% В; скорость потока 0,8 м/мин; диапазон УФ длин волн: 200-400 нм; время анализа: 22 мин; Rt: 17,6 мин. []D=+30,7. 1 Н-ЯМР (400 МГц, ДМСО-d6)(ppm): 10,19 (ушир.с, 1 Н); 8,13 (ушир.с, 1 Н); 7,94 (с, 1 Н); 7,60-7,77 (м, 1 Н); 7,51 (дт, 1 Н); 7,43 (д, 2 Н); 7,34-7,41 (м, 1 Н); 7,23 (д, 1 Н); 7,18 (дд, 1 Н); 7,05 (д, 2 Н); 5,13 (с, 2 Н); 4,49-4,60 (м, 1 Н); 4,19- 4,28 (м, 1 Н); 2,17-2,38 (м, 1 Н); 2,05-2,16 (м, 1 Н); 1,92-2,03 (м, 1 Н). Е 3 (32 мг): Rt (ВЭЖХ): 3,55 мин. Хиральная ВЭЖХ: колонка: chiralpak AD-H 5 мкм, 2504,6 мм; подвижная фаза: А: н-гексан; В: изопропанол; градиент: изократическая 30% В; скорость потока 0,8 м/мин; диапазон УФ длин волн: 200-400 нм; время анализа: 15 мин; Rt: 8,4 мин. []D=+24,3. 1 Н-ЯМР(6 мл) и эту смесь нагревали при 60 С в течение 1 ч, чтобы растворить соединение. Затем к раствору добавляли метансульфоновую кислоту (65 мкл, 1,05 экв.) и по мере того, как добавляли кислоту, раствор мутнел. Затем смесь выдерживали при температурном цикле (0-40 С) в течение 2 дней. Соединение в виде белого твердого остатка отдаляли фильтрацией, промывали EtOAc и сушили в вакууме при 40 С в течение выходных, чтобы получить 335 мг названного в заголовке соединения. Температура плавления: 192 С. Биологический анализ Способность соединений данного изобретения модулировать потенциалзависимые натриевые каналы подтипа NaV1.3 можно определить с помощью следующего анализа.- 23015736 Клеточная биология Стабильные клеточные линии, экспрессирующие hNaV1.3 каналы, были созданы с помощью трансфекции в СНО клетки вектора pCIN5-hNaV1.3, используя способ липофектаминовой (invitrogen) трансфекции. pCIN5 является бицистронным вектором для создания линии клеток млекопитающего, который провоцирует все устойчивые к неомицину клетки экспрессировать рекомбинантный белок (смотриRees S., Coote J., Stable J., Goodson S., Harris S.Lee M.G. (1996) Biotechniques, 20, 102-112) благодаря тому, что рекомбинантная цДНК связана с неомицин-селектируемым маркером цДНК ниже CMV промотора (подробности смотри в Chen Y.H., Dale T.J., Romanos M.A., Whitaker W.R., Xie X.M., Clare J.J., Cloning, distribution and functional analysis of the Type III sodiMKM channel from human brain, Eur. J. Neurosci,2000 Dec.; 12, 4281-9). Клетки выращивали в среде Дульбекко в модификации Иксова (invitrogen), содержащей 1% заменимой аминокислоты, 2% Н-Т добавки и 1% G418 (invitrogen), и выдерживали при 37 С во влажной среде, содержащей 5% СО 2 в воздухе. Клетки высвобождали из колбы для культуры для пересева и сбора, используя Versene (invitrogen). Приготовление клеток Клетки выращивали до 60-95% конфлуентности в колбе Т 75. Клетки собирали, удаляя питательную среду, и инкубировали с 1,5 мл нагретого (37 С) Versene (invitrogen, 15040-066) в течение 6 мин. Собранные клетки суспендировали в 10 мл PBS (invitrogen, 15040-133). Клеточную суспензию затем помещали в 10 мл пробирку для центрифуги и центрифугировали в течение 2 мин при 700 об/мин. После центрифугирования надосадочную жидкость удаляли и дебрис повторно суспендировали в 3 мл PBS. Электрофизиология Токи записывали при комнатной температуре (21-23), используя IonWorcksHT технологию электрофизиологии на плоской матрице (Molecular Devices Corp.). Протоколы стимуляции и сбор данных проводили, используя микрокомпьютер (Dell Pentium 4). Для того чтобы определить сопротивление щели плоского электрода (Rp), 10 мВ, 160 мс использовали разность потенциалов вдоль каждой щели. Эти измерения проводили перед добавлением клеток. После добавления клеток проводили контрольное испытание перед циркуляцией антибиотика (амфотерицина), чтобы получить доступ к внутреннему содержимому клетки. Вычитание утечки проводили во всех экспериментах, применяя 160 мс гиперполяризующий (10 мВ) опережающий импульс за 200 мс до контрольных импульсов, чтобы измерить утечку проводимости. Контрольные импульсы, изменяющиеся от исходного потенциала -90 до 0 мВ, применяли в течение 20 мс и повторяли 10 раз с частотой 10 Гц. Во всех экспериментах протокол контрольного импульса осуществляли в отсутствие (перед считыванием) и в присутствии (после считывания) соединения. Считывание перед и после разделяли добавлением соединения с последующим 3-3,5-минутной инкубацией. Растворы и лекарственные средства Внутриклеточный раствор содержал следующее (мМ): K-глюконат 100, KCl 40 мМ, MgCl2 3,2,EGTA 3, Hepes 5, регулируя рН 7,25. Амфотерицин получали в виде исходного раствора 30 мг/мл и разбавляли до конечной рабочей концентрации 0,1 мг/мл во внутреннем буферном растворе. Внешним раствором был PBS Дульбекко (invitrogen) и содержал следующее (мМ): CaCl2 0,90, KCl 2,67, K3PO4 1,47,MgCl2 0,50, NaCl 138, Na3PO4 8,10, с рН 7,4. Соединения получали в DMSO в виде 10 мМ исходного раствора и впоследствии проводили серию разбавлений 1:3. В заключение соединения разбавляли 1:100 во внешнем растворе, получая в результате конечную концентрацию в DMSO 1%. Анализ данных Показания приборов анализировали и отбирали, используя как контрольное сопротивление(40 МОм), так и максимальную амплитуду тока (200 пА) при отсутствии соединения, чтобы убрать клетки, которые не подходили для дальнейшего анализа. Использовали парное сравнение перед добавлением лекарственного средства и после добавления лекарственного средства, чтобы определить эффект ингибирования каждого соединения. Концентрации соединений, требуемые для того, чтобы подавить ток, вызванный первым деполяризующим импульсом, на 50% (тоническая pIC50) определяли, приспосабливая уравнение Хилла к данным,отвечающим за концентрации. В добавление стимулзависимые ингибиторные свойства определяли с помощью определения эффекта соединений при десятом деполяризующем импульсе по сравнению с первым. Отношение десятого к первому рассчитывали в отсутствие и в присутствии лекарственного средства и рассчитывали процент стимулзависимого ингибирования. Данные подгоняли, используя тоже уравнение, как для тонического PIC50 и рассчитывали концентрации, приводящие к 15% ингибированию (стимулзависимая pUD15). Соединения примеров 2 и 5 испытывали с помощью вышеупомянутого анализа и они показали значения pUD15 больше чем 5,0. или его фармацевтически приемлемая соль или сольват. 2. Соединение по п.1, в котором соединение представляет собой или его фармацевтически приемлемую соль или сольват. 3. Соединение по п.1 или 2,которое представляет собой(5R)-5-(4-[(2 фторфенил)метил]оксифенил)-L-пролинамид. 4. Соединение по п.1 или 2, которое представляет собой гидрохлорид (5R)-5-(4-[(2 фторфенил)метил]оксифенил)-L-пролинамида. 5. Соединение по п.4, которое находится в основном в кристаллической форме. 6. Соединение по п.5, охарактеризованное диаграммой порошковой рентгеновской дифракции(XRPD), имеющей характеристические пики в следующих положениях: 4,7+/-0,15 (2), 9,5+/-0,15 (2),12,6+/-0,15 (2), 14,3+/-0,15 (2), 19,2+/-0,15 (2), 20,3+/-0,15 (2), 20,9+/-0,15 (2), 24,0+/-0,15 (2),26,4+/-0,15 (2). 7. Фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль либо сольват по любому из пп.1-4 и его фармацевтически приемлемый носитель. 8. Применение соединения формулы (I) или его фармацевтически приемлемой соли либо сольвата по любому из пп.1-4 в терапии. 9. Применение соединения формулы (I) или его фармацевтически приемлемой соли либо сольвата по любому из пп.1-4 для получения лекарственного средства для лечения или профилактики заболевания или состояния, опосредованного модуляцией потенциалзависимых натриевых каналов. 10. Применение по п.9, в котором заболеванием или состоянием является депрессия или расстройство настроения. 11. Применение по п.10, в котором заболеванием или состоянием является биполярное расстройство. 12. Применение по п.9, в котором заболеванием или состоянием является компульсивное расстройство пищевого поведения или "вспышка переедания". 13. Применение по п.9, в котором заболеванием или состоянием является эпилепсия. 14. Применение по п.9, в котором заболеванием или состоянием является воспалительная боль или невропатическая боль. 15. Способ лечения или профилактики заболевания или состояния, опосредованного модуляцией потенциалзависимых натриевых каналов, у млекопитающего, включающий прием эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли либо сольвата по любому из пп.1-4. 16. Способ по п.15, в котором заболеванием или состоянием является депрессия или расстройство настроения. 17. Способ по п.15, в котором заболеванием или состоянием является биполярное расстройство. 18. Способ по п.15, в котором заболеванием или состоянием является расстройство, связанное с употреблением химического вещества. 19. Применение соединения формулы (I) или его фармацевтически приемлемой соли или сольвата по любому из пп.1-4 для лечения или профилактики заболевания или состояния, опосредованного модуляцией потенциалзависимых натриевых каналов. 20. Применение по п.19, в котором заболеванием или состоянием является депрессия или расстройство настроения. 21. Применение по п.19, в котором заболеванием или состоянием является биполярное расстройство.- 25015736 22. Применение по п.19, в котором заболеванием или состоянием является расстройство, связанное с употреблением химического вещества. 23. Способ получения соединения формулы (I) по любому из пп.1-4, включающий взаимодействие соединения формулы (II)
МПК / Метки
МПК: C07D 207/22, A61K 31/401, A61P 25/24
Метки: пролинамида, качестве, производные, модуляторов, каналов, натриевых
Код ссылки
<a href="https://eas.patents.su/27-15736-proizvodnye-prolinamida-v-kachestve-modulyatorov-natrievyh-kanalov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пролинамида в качестве модуляторов натриевых каналов</a>












