Ингибиторы вируса гепатита с (hcv)
Номер патента: 15415
Опубликовано: 31.08.2011
Авторы: Венкатарамани Чандрэсикар, Линк Джон О., Граупе Михаель
Формула / Реферат
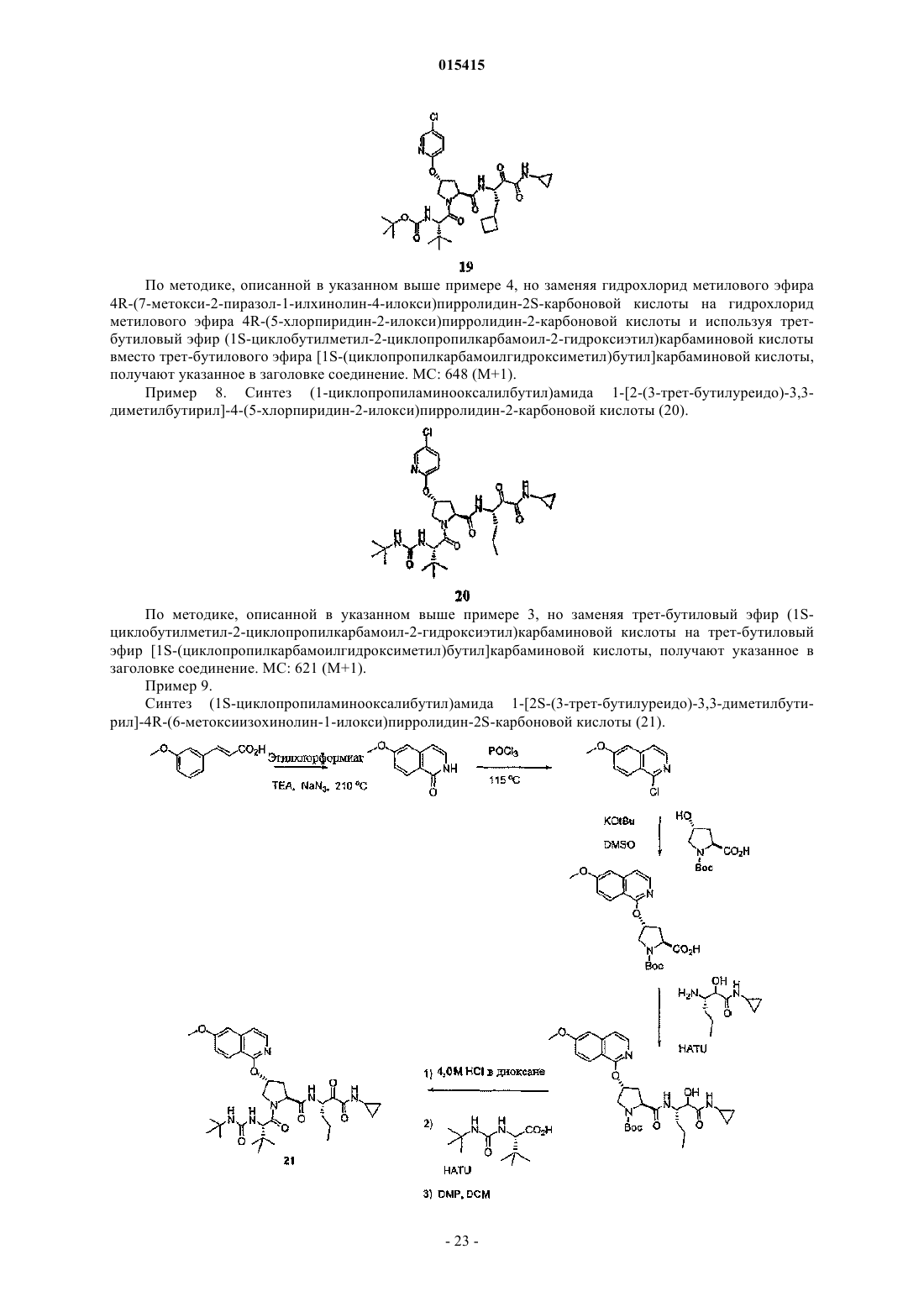
1. Соединение формулы (I)
где Е представляет собой -COCONHR6, где R6представляет собой водород, алкил, циклоалкил, аралкил или гетероаралкил, где ароматическое кольцо необязательно замещено одним или двумя галоидами;
R1 представляет собой алкил, циклоалкилалкил, где алифатические или алициклические группы в R1необязательно замещены одним или двумя радикалами Rb, которые независимо выбирают из гидрокси, алкокси, арилокси, гетероарилокси, алкилтио, арилтио, гетероарилтио, амино, монозамещенного амино, дизамещенного амино, алкилсульфонила, арилсульфонила, карбокси, алкоксикарбонила, ациламино, аминокарбонила, галоида или циано и, дополнительно, где ароматическое или алициклическое кольцо в Rbнеобязательно замещено одним, двумя или тремя заместителями, независимо выбранными из алкила, алкокси, галоида, галоидалкила, галоидалкокси, циано, карбокси или карбоксиалкила;
X представляет собой -О-;
R3 представляет собой алкил, где алифатическая группа в R3 необязательно замещена одним или двумя радикалами Rc, которые независимо выбирают из гидрокси, алкокси, галоидалкокси, арилокси, гетероарилокси, алкилтио, арилтио, гетероарилтио, амино, монозамещенного амино, дизамещенного амино, алкилсульфонила, арилсульфонила, карбокси, алкоксикарбонила, ациламино, аминокарбонила, галоида или циано и, дополнительно, где ароматическое или алициклическое кольцо в Rc необязательно замещено одним, двумя или тремя заместителями, независимо выбранными из алкила, алкокси, галоида, галоидалкила, галоидалкокси, карбокси или карбоксиалкила;
Y представляет собой -NH-C(O)NH-;
R2 представляет собой группу формулы (а)

где Rd1представляет собой водород, гидрокси, алкокси, амино, алкиламино, диалкиламино, галоидалкокси или алкилсульфонил;
Rd и Rd2 независимо представляют собой водород, алкил, галоид, алкокси, алкилтио или алкилсульфонил или
Rd1 и Rd или Rd1 и Rd2вместе с атомами углерода, к которым они присоединены, образуют 4, 5, или 6-атомное гетероциклильное кольцо, в котором один или два атома кольца замещены кислородом или -N-, причем гетероциклильное кольцо необязательно замещено одним или двумя алкилами;
Rd3 представляет собой арил, гетероарил или гетероциклил, необязательно замещенные галоидом, алкилом, циклоалкилом, циклоалкилакилом, алкокси, циклоалкокси, нитро, алкилкарбониламино, циклоалкилкарбониламино, циклоалкилалкилкарбониламино, алкилоксикарбониламино, амино, алкиламино, диалкиламино, или -NHCONRR', в котором R представляет собой водород или алкил и R' представляет собой водород, алкил, циклоалкил или циклоалкилалкил, причем циклоалкил и циклоалкилалкил необязательно замещены одним, двумя или тремя алкилами; и
R4 представляет собой алкил;
или его фармацевтически приемлемая соль или диастереоизомеры; где
в каждом случае термин "алкил" сам по себе или как часть другого заместителя содержит от 1 до 8 атомов углерода;
в каждом случае термин "циклоалкил" сам по себе или как часть другого заместителя содержит от 3 до 8 атомов углерода;
в каждом случае термин "алкилен" сам по себе или как часть другого заместителя содержит от 1 до 6 атомов углерода;
в каждом случае термин "алкенил" сам по себе или как часть другого заместителя содержит от 2 до 6 атомов углерода;
в каждом случае термин "алкинил" сам по себе или как часть другого заместителя содержит от 2 до 6 атомов углерода;
в каждом случае термин "галоидалкил" сам по себе или как часть другого заместителя относится к алкилу, как определено выше, замещенному 1-7 атомами галоида;
в каждом случае термин "арил" сам по себе или как часть другого заместителя содержит от 6 до 10 атомов углерода кольца;
в каждом случае термин "гетероарил" сам по себе или как часть другого заместителя содержит от 5 до 10 атомов углерода кольца, в котором один, два или три из атомов кольца выбраны из азота, кислорода или серы;
в каждом случае термин "гетероциклил" сам по себе или как часть другого заместителя содержит от 5 до 6 атомов углерода кольца, причем один, два или три из атомов углерода кольца замещены гетероатомом, выбранным из -N=, -N-, -О-, -S-, -SO-или -S(O)2-;
в каждом случае термин "ацил" сам по себе или как часть другого заместителя относится к -COR, где R представляет собой водород, алкил, галоидалкил, арил, аралкил, гетероарил, гетероаралкил или гетероциклил, как определено выше;
в каждом случае термин "монозамещенный амино" сам по себе или как часть другого заместителя относится к -NHR, где R представляет собой алкил, арил, аралкил, гетероарил, гетероаралкил, циклоалкил, циклоалкилалкил, гидроксиалкил, алкоксиалкил или ацил, как определено выше; и
в каждом случае термин "дизамещенный амино" сам по себе или как часть другого заместителя относится к -NRR', где R представляет собой алкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, и R' представляет собой алкил, арил, аралкил, гетероарил, гетероаралкил, циклоалкил, гетероциклил, циклоалкилалкил, гидроксиалкил, алкоксиалкил или ацил, как определено выше.
2. Соединение по п.1, в котором Rd1 представляет собой водород, гидрокси; метокси, этокси, н-пропокси, изопропокси, метиламино, этиламино, н-пропиламино, изопропиламино, диметиламино, метилэтиламино, метил(н-пропил)амино или метил(изопропил)амино; Rd и Rd2независимо представляют собой фтор, хлор, метил, этинил, метокси, этокси, тиометил или метилсульфонил.
3. Соединение по п.1, в котором Rd1 означает водород, гидрокси, метокси или этокси; Rd и Rd2 независимо представляют собой водород, фтор; хлор или метил.
4. Соединение по п.1, в котором Rd1 означает метокси или этокси и каждый Rd и Rd2 представляет собой водород.
5. Соединение по любому из пп.1-4, в котором R1 представляет собой алкил или циклоалкилалкил и R3означает 1-метилэтил, 1-метилпропил, трет-бутил.
6. Соединение по любому из пп.1-4, в котором R1 представляет собой циклобутилметил, этил или н-пропил и R3означает трет-бутил.
7. Соединение по п.1, в котором R6 представляет собой циклопропил.
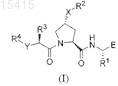
8. Соединение, имеющее структуру:
или его фармацевтически приемлемая соль.
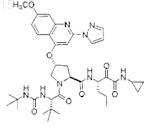
9. Соединение, имеющее структуру:
или его фармацевтически приемлемая соль.
10. Диастереомерная смесь соединений, представленных структурой:
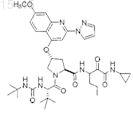
или их фармацевтически приемлемая соль.
11. Соединение по п.1, выбранное из группы, состоящей из
(1S-циклопропиламинооксалилбутил)амида 1-[2S-(3-трет-бутилуреидо)-3,3-диметилбутирил]-4R-(7-метокси-2-пиразол-1-илхинолин-4-илокси)пирролидин-2S-карбоновой кислоты и
(1S-циклобутилметил-2-циклопропилкарбамоил-2-оксоэтил)амида 1-[2S-(3-трет-бутилуреидо)-3,3-диметилбутирил]-4R-(7-метокси-2-пиразол-1-илхинолин-4-илокси)пирролидин-2S-карбоновой кислоты.
12. Соединение по п.1, которое представляет собой (1-циклопропиламиноксалилбутил)амид 1-[2S-(3-трет-бутилуреидо)-3,3-диметилбутирил]-4R-(7-метокси-2-пиразол-1-илхинолин-4-илокси)пирролидин-2S-карбоновой кислоты и его любые диастереоизомеры или смесь диастереоизомеров; или его фармацевтически приемлемая сульфатная или сульфонатная соль.
13. Соединение по п.1, которое представляет собой (1S-циклопропиламинооксалилбутил)амид 1-[2S-(3-трет-бутилуреидо)-3,3-диметилбутирил]-4R-(7-метокси-2-пиразол-1-илхинолин-4-илокси)пирролидин-2S-карбоновой кислоты; или его сульфатная или метилсульфонатная соль.
14. Соединение по п.1, которое представляет собой (1R-циклопропиламинооксалилбутил)амид 1-[2S-(3-трет-бутилуреидо)-3,3-диметилбутирил]-4R-(7-метокси-2-пиразол-1-илхинолин-4-илокси)пирролидин-2S-карбоновой кислоты; или его сульфатная или метилсульфонатная соль.
15. Фармацевтическая композиция, содержащая соединение по любому из пп.1-11 и один или несколько фармацевтически приемлемых наполнителей.
16. Фармацевтическая композиция по п.15, дополнительно содержащая второе противовирусное средство.
17. Фармацевтическая композиция по п.16, в которой указанное второе противовирусное средство представляет собой рибавирин или ингибитор полимеразы.
18. Применение соединения по любому из пп.1-11 в изготовлении медикамента для лечения инфекций гепатита С.
19. Применение соединения по любому из пп.1-11 в комбинации со вторым противовирусным средством в изготовлении медикамента для лечения инфекций гепатита С, где второе противовирусное средство выбрано из группы, состоящей из интерферона, пегилированных или непегилированных родственных представителей интерферона, рибавирина, ингибитора полимеразы HCV и агониста толл-рецептора.
Текст
Дата публикации и выдачи патента Номер заявки ИНГИБИТОРЫ ВИРУСА ГЕПАТИТА С (HCV) Изобретение относится к соединениям формулы (I), их фармацевтически приемлемым солям или диастереоизомерам, которые являются противовирусными агентами. Конкретно, соединения настоящего изобретения ингибируют репликацию HCV и поэтому являются эффективными при лечении инфекций гепатита С. Кроме того настоящее изобретение относится к фармацевтическим композициям, содержащим эти соединения, и способам их получения. 015415 Перекрестные ссылки на родственные заявки В этой заявке заявлены права на преимущества по предварительной заявке США, порядковый 60/695767, поданной 30 июня 2005, раскрытие которой включено в настоящее изобретение путем отсылки. Область техники, к которой относится изобретение Настоящее изобретение относится к соединениям, которые ингибируют репликацию HCV, и поэтому являются эффективными при лечении гепатита С. Кроме того, настоящее изобретение относится к фармацевтическим композициям, содержащим эти соединения, и способам их получения. Уровень техники Вирус гепатита С (HCV) представляет собой вирус "плюс"-смысловой одноцепочечной РНК, который представляет собой основную причину не-А, не-В гепатита во всм мире. У значительной части людей, заражнных HCV, развивается хроническое заболевание печени. В свою очередь, эта инфекция хронического гепатита С в значительной степени подвергает их риску развития серьезных заболеваний печени, таких как цирроз печени, гепатоцеллюлярная карцинома и терминальное состояние печени, приводящее к смерти. В настоящее время инфекции гепатита С лечатся или с помощью впрыскиваемого интерферона, или содержащих полиэтиленгликоль (PEG) форм интерферона, таких как PEG-Интрон иPegasys, индивидуальных, или в сочетании с рибавирином. Однако такие типы терапии стимулируют сильные побочные эффекты, такие как ретинопатия, воспаление щитовидной железы, острый панкреатит, депрессия. В документе US 2003/0216325 описаны пептидные соединения общей формулы I, обладающие активностью ингибиторов сериновой протеазы NS3 вируса гепатита С: Формула I В частности, в данном документе раскрыто соединение 338, имеющее следующую формулу: Соединение 338 Из статьи R.Ronn et al. (Exploration of acyl sulfonamides as carboxylic acid replacements in protease inhibitors of the hepatitis С virus full-length NS3. Bioorganic Medicinal Chemistry, 2006, 14, 544-559) известны ингибиторы пролноразмерной протеазы NS3 вируса гепатита С общей формулы: Следовательно, существует потребность в безопасном, оральном лекарственном препарате лечения инфекций гепатита С. В настоящем изобретении осуществляется эта и родственные потребности. Раскрытие изобретения В одном аспекте настоящее изобретение относится к соединению формулы (I) где группа Е представляет собой -COCONHR6, где R6 представляет собой водород, алкил, циклоалкил, аралкил, или гетероаралкил, где ароматическое кольцо необязательно замещено одним или двумя галоидами; радикал R1 представляет собой алкил, циклоалкилалкил, где алифатические или алициклические группы в R1 необязательно замещены одним или двумя радикалами Rb, которые независимо выбирают из гидрокси, алкокси, арилокси, гетероарилокси, алкилтио, арилтио, гетероарилтио, амино, монозамещенной амино, дизамещенной амино, алкилсульфонила, арилсульфонила, карбокси, алкоксикарбонила, ациламино, аминокарбонила, галоида или циано, и, кроме того, где ароматическое или алициклическое кольцо в Rb необязательно замещено одним, двумя, или тремя заместителями, независимо выбранными из алкила, алкокси, галоида, галоидалкила, галоидалкокси, циано, карбокси или карбоксиалкила;X представляет собой -О-; радикал R3 представляет собой алкил, где алифатическая группа в R3 необязательно замещена одним или двумя радикалами Rc, которые независимо выбирают из гидрокси, алкокси, галоидалкокси, арилокси, гетероарилокси, алкилтио, арилтио, гетероарилтио, амино, монозамещенной амино, дизамещенной амино, алкилсульфонила, арилсульфонила, карбокси, алкоксикарбонила, ациламино, аминокарбонила, галоида или циано, и, кроме того, где ароматическое или алициклическое кольцо в Rc необязательно замещено одним, двумя или тремя заместителями, независимо выбранными из алкила, алкокси, галоида,галоидалкила, галоидалкокси, карбокси, или карбоксиалкила; группа Y представляет собой -NH-C(O)NH-; радикал R2 представляет собой группу формулы (а):Rd и Rd2 независимо представляют собой водород, алкил, галоид, алкокси, алкилтио или алкилсульфонил; илиRd1 и Rd или Rd1 и Rd2 вместе с атомами углерода, к которым они присоединены, образуют 4, 5, или 6- атомное гетероциклильное кольцо, в котором один или два атома кольца замещены кислородом или N-, причем гетероциклильное кольцо необязательно замещено одним или двумя алкилами;Rd3 представляет собой арил, гетероарил или гетероциклил, необязательно замещенные галоидом,алкилом, циклоалкилом, циклоалкилакилом, алкокси, циклоалкокси, нитро, алкилкарбониламино, циклоалкилкарбониламино, циклоалкилалкилкарбониламино, алкилоксикарбониламино, амино, алкиламино,диалкиламино или -NHCONRR', в котором R представляет собой водород или алкил и R' представляет собой водород, алкил, циклоалкил или циклоалкилалкил, причем циклоалкил и циклоалкилалкил необязательно замещены одним, двумя или тремя алкилами; и радикал R4 представляет собой алкил; или его фармацевтически приемлемая соль или диастереоизомеры; где в каждом случае термин "алкил" сам по себе или как часть другого заместителя содержит от 1 до 8 атомов углерода; в каждом случае термин "циклоалкил" сам по себе или как часть другого заместителя содержит от 3 до 8 атомов углерода; в каждом случае термин "алкилен" сам по себе или как часть другого заместителя содержит от 1 до 6 атомов углерода; в каждом случае термин "алкенил" сам по себе или как часть другого заместителя содержит от 2 до 6 атомов углерода; в каждом случае термин "алкинил" сам по себе или как часть другого заместителя содержит от 2 до 6 атомов углерода; в каждом случае термин "галоидалкил" сам по себе или как часть другого заместителя относится к алкилу, как определено выше, замещенному 1-7 атомами галоида; в каждом случае термин "арил" сам по себе или как часть другого заместителя содержит от 6 до 10-2 015415 атомов углерода кольца; в каждом случае термин "гетероарил" сам по себе или как часть другого заместителя содержит от 5 до 10 атомов углерода кольца, в котором один, два или три из атомов кольца выбраны из азота, кислорода или серы; в каждом случае термин "гетероциклил" сам по себе или как часть другого заместителя содержит от 5 до 6 атомов углерода кольца, причем один, два или три из атомов углерода кольца замещены гетероатомом, выбранным из -N=, -N-, -О-, -S-, -SO- или -S(O)2-; в каждом случае термин "ацил" сам по себе или как часть другого заместителя относится к -COR,где R представляет собой водород, алкил, галоидалкил, арил, аралкил, гетероарил, гетероаралкил или гетероциклил, как определено выше; в каждом случае термин "монозамещенный амино" сам по себе или как часть другого заместителя относится к -NHR, где R представляет собой алкил, арил, аралкил, гетероарил, гетероаралкил, циклоалкил, циклоалкилалкил, гидроксиалкил, алкоксиалкил или ацил, как определено выше; и в каждом случае термин "дизамещенный амино" сам по себе или как часть другого заместителя относится к -NRR', где R представляет собой алкил, арил, аралкил, гетероарил, гетероаралкил, гетероциклил, и R представляет собой алкил, арил, аралкил, гетероарил, гетероаралкил, циклоалкил, гетероциклил,циклоалкилалкил, гидроксиалкил, алкоксиалкил или ацил, как определено выше. Ради ясности, отмечается, что место присоединения группы Y к группе R4 является таким, как указано ниже: R4NH-C(O)NH-. Во втором аспекте настоящее изобретение относится к соединению, имеющему структуру: или его фармацевтически приемлемой соли. В третьем аспекте настоящее изобретение относится к соединению, имеющему структуру: или его фармацевтически приемлемой соли. В четвертом аспекте настоящее изобретение относится к диастереомерной смеси соединений, представленных структурой: или их фармацевтически приемлемых солей. В пятом аспекте настоящее изобретение относится к фармацевтической композиции, содержащей соединение, укуазанное выше, или его фармацевтически приемлемую соль в смеси с одним или несколькими фармацевтически приемлемыми наполнителями. В шестом аспекте настоящее изобретение относится к применению соединения, указанного выше, в изготовлении медикамента для лечения инфекций гепатита С. В седьмом аспекте настоящее изобретение относится к применению соединения, указанного вьппе,в комбинации со вторым противовирусным средством в изготовлении медикамента для лечения инфекций гепатита С, где второе противовирусное средство выбрано из группы, состоящей из интерферона,пегилированных или непегилированных родственных представителей интерферона, рибавирина, ингибитора полимеразы HCV и агониста толл-рецептора.-3 015415 Осуществление изобретения Если не указано другое, следующие ниже термины, используемые в описании и формуле изобретения, определены для настоящего изобретения и имеют следующие ниже значения. Термин "алициклический" означает фрагмент, характеризующийся расположением атомов углерода в замкнутых структурах неароматических колец, например циклоалкила и гетероциклических колец, которые указаны в описании."Алифатический" означает алкильный, алкенильный или алкинильный радикалы, которые указаны в описании. Термин "алкил", представленный сам по себе, означает линейный или разветвленный, насыщенный алифатический радикал, содержащий от одного до восьми атомов углерода, если не указано другое, например, алкил включает в себя метил, этил, пропил, изопропил, бутил, втор-бутил, изобутил, трет-бутил и тому подобное. Термин "алкилкарбониламино" относится к радикалу -NHC(O)R, в котором R означает алкильную группу, которая определена выше, например метилкарбониламино, этилкарбониламино и тому подобное."Алкилен", если не указано другое, означает линейный или разветвленный, насыщенный алифатический, двухвалентный радикал, имеющий число атомов углерода от одного до шести, например метилен"Алкенил" означает линейный одновалентный углеводородный радикал, имеющий два-шесть атомов углерода, или разветвленный одновалентный углеводородный радикал, имеющий три-шесть атомов углерода, содержащий одну или две двойные связи, например этенил, пропенил (в том числе все изомерные формы), 1-метилпропенил, бутенил (в том числе все изомерные формы), или пентенил (в том числе все изомерные формы) и тому подобное."Алкениламинокарбонил" относится к радикалу -C(O)NHR, где R представляет собой алкенильную группу, как определено выше, 3-пропен-1-иламинокарбонил и тому подобное."Алкинил" означает линейный одновалентный углеводородный радикал, содержащий от двух до шести атомов углерода, или разветвленный одновалентный углеводородный радикал с тремя-шестью атомами углерода, содержащий одну или две тройные связи, например этинил, пропинил (в том числе все изомерные формы), 1-метилпропинил, бутинил (в том числе все изомерные формы) или пентинил (в том числе все изомерные формы) и тому подобное."Алкинилоксикарбонил" относится к радикалу -C(O)OR, в котором R представляет собой алкинильную группу, как определено выше, например 3-пропин-1-илоксикарбонил, и тому подобное."Алкилтио" означает -SR радикал, в котором R является алкилом, который указан в описании, например метилтио, этилтио, пропилтио или бутилтио и тому подобное."Алкоксикарбониламино" относится к радикалу -NHC(O)OR, где R представляет собой алкильную группу, как определено выше, например, метоксикарбониламино, этоксикарбониламино и тому подобное."Алкоксиалкил" означает линейный одновалентный углеводородный радикал, имеющий от одного до шести атомов углерода, или разветвленный одновалентный углеводородный радикал с тремя-шестью атомами углерода, замещенный по меньшей мере одной алкоксигруппой, предпочтительно одной или двумя алкоксигруппами, как определено выше, например 2-метоксиэтил, 1-, 2- или 3-метоксипропил, 2 этоксиэтил и тому подобное."Алкоксикарбонил" относится к радикалу -C(O)OR, в котором R представляет собой алкильную группу, как определено выше, например метоксикарбонил, этоксикарбонил и тому подобное. Термин "амино" означает радикал -NH2."Аминоалкил" означает линейный одновалентный углеводородный радикал, имеющий один-шесть атомов углерода, или разветвленный одновалентный углеводородный радикал с тремя-шестью атомами углерода, замещенными по меньшей мере одной, предпочтительно одной или двумя группами -NRR', где"Ацил" относится к радикалу -COR, где R представляет собой водород, алкил, галоидалкил, цикло-4 015415 алкил, арил, аралкил, гетероарил, гетероаралкил или гетероциклил, которые указаны в описании, формил, ацетил, трифторацетил, бензоил, пиперазин-1-илкарбонил и тому подобное. Когда R является алкилом, то такая группа называется в этом описании алкилкарбонилом. Когда R является арилом, то такая группа называется в этом описании арилкарбонилом. Когда R является гетероарилом, то такая группа называется в этом описании гетероарилкарбонилом. Когда R является гетероциклилом, то такая группа называется в этом описании гетероциклилкарбонилом."Ациламино" относится к радикалу -NRCOR', где R представляет собой водород или алкил и R' означает водород, алкил, галоидалкил, циклоалкил, арил, аралкил, гетероарил, гетероаралкил, или гетероциклил, которые указаны в описании, например формил, ацетил, трифторацетил, бензоил, пиперазин-1 илкарбонил и тому подобное."Аминокарбонил" означает радикал -CONRR', где R и R' независимо выбирают из водорода, алкила,арила, аралкила, гетероарила, гетероаралкила или гетероциклилалкила, или R и R' вместе с атомом азота,с которым они связаны, образуют гетероциклоамин-группу, которая указана в описании."Аминосульфонил" означает радикал -SO2NRR', где R и R' независимо выбирают из водорода, алкила, арила, аралкила, гетероарила, гетероаралкила или гетероциклилалкила, или R и R' вместе с атомом азота, с которым они связаны, образуют гетероциклоаминогруппу, которая указана в описании. Термин "животное" включает человека, нечеловеческих млекопитающих (например, собак, кошек,кроликов, крупный рогатый скот, лошадей, овец, коз, свиней, оленей и тому подобное) и немлекопитающих (например, птиц и тому подобное)."Ароматический" относится к фрагменту, в котором составляющие его атомы образуют систему ненасыщенного кольца, причем все атомы в системе кольца имеют гибридизацию sp2 и общее число пиэлектронов равно 4n+2."Арил" относится к моноциклической или конденсированной бициклической кольчатой системе,содержащей от 6 до 10 кольцевых атомов углерода, где каждое кольцо является ароматическим, например фенил или нафтил."Арилтио" означает радикал -SR, где R представляет собой арил, который указан в описании, например фенилтио или нафтилтио."Арилсульфонил" означает радикал -SO2R, где R представляет собой арил, который указан в описании, например фенилсульфонил или нафтилсульфонил."Карбоксиалкил" означает алкильный радикал, который указан в описании, замещенный по меньшей мере одной, предпочтительно одной или двумя группами -С(О)ОН, например карбоксиметил, карбоксиэтил, 1-,2-, или 3-карбоксипропил, и тому подобное."Циклоалкил" относится к одновалентному насыщенному моноциклическому кольцу, содержащему от трех до восьми кольцевых атомов углерода, например циклопропил, циклобутил, циклопентил, циклогексил, и тому подобное."Циклоалкилалкилоксикарбониламино" относится к радикалу -NHC(O)OR, где R означает циклоалкилалкил, как определено выше, например циклопропилметилоксикарбониламино, циклопентилметилоксикарбониламино и тому подобное. Термин "заболевание" конкретно включает в себя болезненное состояние животного или его органов и включает в себя болезненное состояние, которое может быть вызвано, или присуще, применяемой медицинской или ветеринарной терапии для этого животного, то есть является "побочным эффектом" такой терапии."Диалкиламино" означает радикал -NRR', где R и R' независимо представляют собой алкил, который указан в описании, например диметиламино, диэтиламино, N,N-метилпропиламино или N,Nметилэтиламино и тому подобное."Дизамещенная аминогруппа" означает радикал -NRR', где R и R' независимо выбирают из алкила,циклоалкила, циклоалкилалкила, гидроксиалкила, алкоксиалкила, аминоалкила, арила, аралкила, гете-5 015415 роарила или гетероаралкила, как определено в описании, например диметиламино, диэтиламино, N;Nметилпропиламино или N;N-метилэтиламино, метилфениламино и тому подобное. Диалкиламино представляет собой подгруппу дизамещенного амина."Конденсированный гетероциклил" означает гетероциклический радикал, указанный в описании,который конденсирован с арильным или гетероарильным кольцом, которое указано в описании, например 2,3-дигидроизоиндол-1-ил, 1,2,3,4-тетрагидроизохинолин-1-ил и тому подобное."Галоидалкил" относится к указанному выше алкилу, который замещен одним или несколькими,предпочтительно от одного до семи, атомами "галогена", причем эти термины определены в этой заявке. Термин галоидалкил включает в себя моногалоидалкил, дигалоидалкил, тригалоидалкил, пергалоидалкил и тому подобное, например хлорметил, дихлорметил, дифторметил, трифторметил, 2,2,2-трифторэтил,перфторэтил, 2,2,2-трифтор-1,1-дихлорэтил и тому подобное."Галоидалкокси" относится к радикалу -OR, где R представляет собой галоидалкильную группу, как определено выше, например, трифторметокси, 2,2,2-трифторэтокси, дифторметокси и тому подобное."Гетероарил" в качестве группы или части группы означает ароматический моноциклический или бициклический фрагмент, имеющий от 5 до 10 кольцевых атомов, причем один или несколько, предпочтительно один, два или три кольцевых атомов выбирают из азота, кислорода или серы, а остальные атомы кольца представляют собой углерод. Типичные примеры гетероарильных колец включают в себя (но не ограничиваются) пирролил, фуранил, тиенил, оксазолил, изоксазолил, тиазолил, имидазолил, триазолил, тетразолил, пиридинил, пиримидинил, пиразинил, пиридазинил, индолил, бензофуранил, бензотиофенил, бензимидазолил, хинолинил, изохинолинил, хиназолинил, хиноксалинил, пиразолил, и тому подобное."Гетероциклил" относится к насыщенному или частично ненасыщенному, моно- или бициклическому радикалу с 4, 5, 6 или 7 атомами углерода в кольце, в котором один или несколько, предпочтительно один, два или три кольцевых атома углерода заменены на гетероатомы, которые выбирают из-N=, -N-, -О-, -S-, -SO-, или -S(O)2, и, кроме того, где один или два кольцевых атома углерода необязательно заменены двумя группами кето(-СО)-. Это гетероциклическое кольцо необязательно конденсировано с циклоалкильным, арильным или гетероарильным кольцом, которые указаны в описании. Типичные примеры включают в себя (но не ограничиваются), имидазолидинил, морфолинил, тиоморфолинил,тиоморфолино-1-оксид, тиоморфолино-1,1-диоксид, тетрагидрофуранил, тетрагидропиранил, тетрагидротиопиранил, 1-оксо-тетрагидротиопиранил, 1,1-диоксотетратиопиранил, индолинил, пиперазинил, пиперидил, пирролидинил, пирролинил, хинуклидинил,3,4-дигидроизохинолинил, дигидроиндолил и тому подобное. Когда гетероциклическая группа содержит по меньшей мере один кольцевой атом азота, то она называется в этом описании "гетероциклоамино" и представляет собой подгруппу гетероциклильной группы, как определено выше."Гидроксиалкил" означает линейный одновалентный углеводородный радикал, содержащий одиншесть атомов углерода или разветвленный одновалентный углеводородный радикал с тремя-шестью атомами углерода, которые замещены одной или двумя гидроксильными группами, при условии, что,если присутствуют две гидроксильные группы, то они не связаны с одним и тем же атомом углерода.-6 015415 Типичные примеры включают в себя (но не ограничиваются) гидроксиметил, 2-гидроксиэтил, 2 гидроксипропил,3-гидроксипропил,1-(гидроксиметил)-2-метилпропил,2-гидроксибутил,3 гидроксибутил, 4-гидроксибутил-2,3-дигидроксипропил, 1-(гидроксиметил)-2-гидроксиэтил, 2,3 дигидроксибутил, 3,4-дигидроксибутил и 2-(гидроксиметил)-3-гидроксипропил, предпочтительно 2 гидроксиэтил, 2,3-дигидроксипропил, и 1-(гидроксиметил)-2- гидроксиэтил. Термин "изомеры" означает соединения формулы (I), имеющие одинаковые молекулярные формулы, но отличающиеся природой или последовательностью связей своих атомов или пространственным расположением своих атомов. Изомеры, которые отличаются пространственным расположением своих атомов, называются "стереоизомерами". Стереоизомеры, которые не являются зеркальными изображениями друг друга, называются "диастереомеры", и стереоизомеры, которые не накладываются в одно зеркальное изображение, называются "энантиомеры" или иногда "оптические изомеры". Атом углерода,связанный с четырьмя неодинаковыми заместителями, называется "хиральным центром". Соединение с одним хиральным центром, которое имеет две энантиомерные формы противоположной хиральности,называется "рацемической смесью". Соединение, которое имеет больше одного хирального центра, имеет 2n-1 энантиомерных пары, где n означает число хиральных центров. Соединения, имеющие больше одного хирального центра, могут существовать или в виде индивидуальных диастереомеров, или как смесь диастереомеров, называемой "диастереомерной смесью". Когда присутствует один хиральный центр, стереоизомер может быть охарактеризован по абсолютной конфигурации этого хирального центра. Термин абсолютная конфигурация относится к пространственному расположению заместителя, связанного с хиральным центром. Энантиомеры характеризуются абсолютной конфигурацией своих хиральных центров и описываются с помощью правил R- и S-последовательностей Кана, Ингольда и Прелога. Правила стереохимической номенклатуры, методы определения стереохимии и разделение стереоизомеров хорошо известны из уровня техники (см., например, книгу "Advanced Organic Chemistry", 4e издание, March, Jerry, John WileySons, New York, 1992). Предполагается, что названия и изображения,использованные в этой заявке для описания соединений формулы (1), включают в себя все возможные стереоизомеры."Монозамещенная аминогруппа" означает радикал -NHR, в котором R выбирают из алкила, циклоалкила, циклоалкилалкила, гидроксиалкила, алкоксиалкила, аминоалкила, арила, аралкила, гетероарила или гетероаралкила, которые указаны в описании, например, метиламино, этиламино, пропиламино, фениламино, бензиламино, и тому подобное. Выражения "по выбору", или "необязательно", или "может быть" означают, что в последующем описанное событие или обстоятельство может или не может произойти и что настоящее изобретение включает в себя случаи, когда событие или обстоятельство происходит, и случаи, когда оно не происходит. Например, выражение "где ароматическое кольцо в Ra необязательно замещено одним или двумя заместителями, которые независимо выбирают из алкила" означает, что ароматическое кольцо может быть замещено (или не замещено) алкилом для того, чтобы войти в объем защиты настоящего изобретения. Кроме того, настоящее изобретение включает в себя N-оксидные производные соединения формулы (1). N-Оксидное производное означает соединение формулы (I), в котором атом азота находится в окисленном состоянии (то есть, NО), например, N-оксид пиридина, и которое обладает желательной фармакологической активностью."Патология" заболевания означает основные элементы, причины и эволюцию заболевания, а также структурные и функциональные изменения, которые являются результатом процесса заболевания."Фармацевтически приемлемый" означает форму, которая является полезной при получении фармацевтической композиции, то есть, как правило, безопасная, нетоксичная и являющаяся подходящей как в биологическом, так и в другом аспекте, и включает в себя форму, приемлемую как для ветеринарного применения, так и при фармацевтическом применении для человека. Термин "фармацевтически приемлемые соли" означает соли соединений формулы (I), которые являются фармацевтически приемлемыми, как определено выше, и которые обладают желательной фармакологической активностью. Такие соли включают в себя кислые аддитивные соли, образовавшиеся с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота, и тому подобное; или с органическими кислотами, такими как уксусная кислота, пропионовая кислота, гексановая кислота, гептановая кислота, циклопентанпропионовая кислота, гликолевая кислота, пировиноградная кислота, молочная кислота, малоновая кислота, янтарная кислота, яблочная кислота, малеиновая кислота, фумаровая кислота, винная кислота,лимонная кислота, бензойная кислота, орто-(4-гидроксибензоил)бензойная кислота, коричная кислота,миндальная кислота, метилсульфоновая кислота, этансульфоновая кислота, 1,2-этандисульфоновая кислота, 2-гидроксиэтансульфоновая кислота, бензолсульфоновая кислота, пара-хлорбензолсульфоновая кислота, 2-нафталинсульфоновая кислота, пара-толуолсульфоновая кислота, камфорсульфоновая кислота, 4-метилбицикло(2.2.2)окт-2-ен-1-карбоновая кислота, глюкогептоновая кислота, 4,4'-метиленбис(3 гидрокси-2-ен-1-карбоновая кислота), 3-фенилпропионовая кислота, триметилуксусная кислота, третбутилуксусная кислота, лаурилсерная кислота, глюконовая кислота, глутаминовая кислота, гидрокси-7 015415 нафтойная кислота, салициловая кислота, стеариновая кислота, муконовая кислота и тому подобное. Фармацевтически приемлемые соли также включают в себя аддитивные соли оснований, которые могут образоваться, когда имеющиеся кислотные протоны способны взаимодействовать с неорганическими или органическими основаниями. Подходящие неорганические основания включают в себя гидроксид натрия, карбонат натрия, гидроксид калия, гидроксид алюминия и гидроксид кальция. Подходящие органические основания включают в себя этаноламин, диэтаноламин, триэтаноламин, трометамин, Nметилглюкамин и тому подобное. Кроме того, настоящее изобретение включает в себя пролекарственные препараты соединения формулы (1). Пролекарственный препарат означает соединение, которое превращается в организме путем обмена веществ (например, путем гидролиза) в соединение формулы (1). Например, сложный эфир соединения формулы (I), содержащий гидроксильную группу, может быть превращен путем гидролиза invivo- в родоначальную молекулу. В качестве альтернативы, сложный эфир соединения формулы (1), содержащий карбоксильную группу, может быть превращен путем гидролиза in vivo- в родоначальную молекулу. Подходящие сложные эфиры, соединения формулы (1), содержащие гидроксильную группу,представляют собой, например, ацетаты, цитраты, лактаты, тартраты, малонаты, оксалаты, салицилаты,пропионаты, сукцинаты, фумараты, малеаты, метилен-бис-бета-гидроксинафтоаты, эфиры гентизиновой кислоты, изэтионаты, дипаратолуилтартраты, метилсульфонаты, этансульфонаты, бензолсульфонаты,паратолуолсульфонаты, циклогексилсульфаматы и квинаты. Подходящие сложные эфиры - соединения формулы (1), содержащие карбоксильную группу, представляют собой, например те, что описаны в статье Leinweber, F.J. Drug Metab. Res., 1987, том 18, стр. 379. Особенно эффективный класс сложных эфиров, соединений формулы (1), содержащих гидроксильную группу, может образоваться из кислотных фрагментов, которые выбирают из описанных в работе Bundgaard et al, J. Med. Chem., 1989, 32, стр. 25032507, и включают замещенные (аминометил)бензоаты, например диалкиламинометилбензоаты, в которых две алкильные группы могут быть соединены вместе и/или прерваны атомом кислорода или необязательно замещены атомом азота, например, алкилированным атомом азота, более конкретно, (морфолинометил)бензоаты, например 3- или 4-(морфолинометил)бензоаты, и (4-алкилпиперазин-1-ил)бензоаты,например 3- или 4-(4-алкилпиперазин-1-ил)бензоаты. Предполагается, что названия и изображения, использованные в этой заявке для описания соединений формулы (1), включают в себя все возможные пролекарственные препараты. Термин "защищенные производные" означает производные соединений формулы (I), в которой реакционноспособный центр или центры блокированы защитными группами. Защищенные производные соединений формулы (1) применяются при получении соединений формулы (1), или они сами могут быть активными ингибиторами катепсина (фермент автолиза). Исчерпывающий перечень подходящих защитных групп можно найти в книге T.W. Greene, Защитные группы в органическом синтезе, 3 е издание, John WileySons, Inc. 1999. Предполагается, что названия и изображения, использованные в этой заявке для описания формулы (1), включают в себя все возможные защищенные производные этого соединения."Терапевтически эффективное количество" означает такое количество, которое при введении животному для лечения заболевания, является достаточным для осуществления лечения этого заболевания. Термин "обработка" или "лечение" означает любой прием внутрь соединения настоящего изобретения и включает в себя: (1) предупреждение возникновения заболевания у животного, которое может быть предрасположено к этому заболеванию, но патология или симптоматология заболевания еще не проявилась или не отобразилась, (2) ингибирование заболевания у животного, у которого проявилась или отобразилась патология или симптоматология заболевания (то есть, прекращение дальнейшего развития патологии и/или симптоматологии), или (3) улучшение заболевания у животного, у которого проявилась или отобразилась патология или симптоматология заболевания (то есть, обращение патологии и/или симптоматологии)."Уреидо" означает радикал -NHCONRR', в котором R представляет собой водород или алкил и R' означает водород, алкил, циклоалкил, или циклоалкилалкил. Предпочтительные варианты изобретения Определенные соединения формулы (I) являются предпочтительными в пределах самого широкого объема защиты, приведенного в разделе "Раскрытие изобретения". Например: А. Предпочтительной группой соединений формулы (I) являются соединения, в которых Е представляет собой -COCONHR6, где R6 означает водород, алкил, циклоалкил, аралкил или гетероаралкил, где ароматическое кольцо необязательно замещено одним или двумя атомами галогена, предпочтительно R6 представляет собой циклопропил, -CH(CH3)R, где R означает фенил, 4-хлорфенил, 2,4 дихлорфенил, 2,4-дифторфенил, 3,4-дихлорфенил, 3,4-дифторфенил или пиридин-4-ил. Предпочтительно(а) В пределах указанной выше предпочтительной группы А и содержащихся в ней более предпочтительных групп, более предпочтительной группой соединений является группа, в которой(1) Внутри групп (А) и А(а) и содержащихся в них более предпочтительных групп более предпочтительной является группа соединений, в которых R4 означает трет-бутил.(В) Еще одной предпочтительной группой соединений формулы (I) являются соединения, в которых R2 является группой формулы (а):Rd1 и Rd или Rd1 и Rd2 вместе с атомами углерода, с которыми они связаны, образуют 4-, 5- или 6 атомное гетероциклическое кольцо, в котором один или два кольцевых атома заменены на кислород или-N-, причем гетероциклическое кольцо необязательно замещено одним или двумя алкилами;Rd3 представляет собой арил, гетероарил, циклоалкил или гетероциклил, необязательно замещенный галоидом, алкилом, циклоалкилом, циклоалкилалкилом, алкокси, циклоалкокси, нитро, алкилкарбониламино, циклоалкилкарбониламино, циклоалкилалкилкарбониламино, алкилоксикарбониламино, амино, алкиламино, диалкиламино- или группой -NHCONRR', где R означает водород или алкил и R' представляет собой водород, алкил, циклоалкил, или циклоалкилалкил, причем циклоалкил и циклоалкилалкил необязательно замещены одним, двумя или тремя алкилами.Rd и Rd2 независимо представляют собой водород, алкил, галоид, алкокси, алкилтио или алкилсульфонил; и или необязательно замещенной галоидом, алкилом, циклоалкилом, циклоалкилалкилом, алкокси, циклоалкокси, нитро-, алкилкарбониламино-, циклоалкилкарбониламино-, циклоалкилалкилкарбониламино-,алкилоксикарбониламино-, амино-, алкиламино, диалкиламино-, или группой -NHCONRR', где R представляет собой водород или алкил и R' означает водород, алкил, циклоалкил, или циклоалкилалкил, причем циклоалкил и циклоалкилалкил необязательно замещены одним, двумя или тремя алкилами. Более предпочтительно Rd3 является группой формулы: или необязательно замещенной галоидом, алкилом, циклоалкилом, циклоалкилалкилом, алкокси, циклоалкокси, нитро-, алкилкарбониламино-, циклоалкилкарбониламино-, циклоалкилалкилкарбониламино-,алкилоксикарбониламино-, амино-, алкиламино-, диалкиламино-, или группой -NHCONRR', где R является водородом или алкилом и R' означает водород, алкил, циклоалкил или циклоалкилалкил, причем циклоалкил и циклоалкилалкил необязательно замещены одним, двумя или тремя алкилами. Еще более предпочтительно Rd3 представляет собой группу: или необязательно замещенную галоидом, алкилом, циклоалкилом, циклоалкилалкилом, алкокси, циклоалкокси, нитро-, алкилкарбониламино-, циклоалкилкарбониламино-, циклоалкилалкилкарбониламино-,алкилоксикарбониламино-, амино-, алкиламино-, диалкиламино-, или группой -NHCONRR', где R является водородом или алкилом и R' означает водород, алкил, циклоалкил или циклоалкилалкил, где циклоалкил и-9 015415 циклоалкилалкил необязательно замещены одним, двумя или тремя алкилами. Внутри указанных выше предпочтительных групп, более предпочтительной является группа соединений, в которойR означает водород, гидрокси, метокси, этокси, н-пропокси, изопропокси, метиламино, этиламино,н-пропиламино, изопиориламино, диметиламино, метилэтиламино, метил(н-пропил)амино и метил(изопропил)амино; более предпочтительно, водород, гидроксил; метокси или диметиламино, еще более предпочтительно метокси. В качестве альтернативы, еще более предпочтителен водород;Rd и Rd2 независимо представляют собой фтор, хлор, метил, этинил, метокси, этокси, тиометил или метилсульфонил. Более предпочтительно, R означает водород, этинил, фтор, хлор, метил, метокси, метилтио или метилсульфонил и Rd2 является водородом. Наиболее предпочтительно, Rd1 означает метокси, Rd представляет собой водород или метил, фтор,хлор или метокси и Rd2 является водородом.(ii) Предпочтительно R2 представляет собой группу формулы: или где Za и Zb независимо означают группу -О- или -NH-, где Н может быть замещен на R, предпочтительно -О-;R является алкилом, предпочтительно метилом; Rd2 означает водород или метил, предпочтительно водород; и значение Rd3 указано для подгруппы (i), непосредственно выше, (iii) предпочтительно, R2 является группой формулыZa и Zb независимо означают -О- или -NH-, где Н может быть замещен радикалом R, предпочтительно -О-;Rd представляет собой водород или метил, предпочтительно водород; и значение R определено для подгруппы (i), как указано выше. (1) В рамках указанной выше предпочтительной группы (В) и содержащихся в ней более предпочтительных групп, еще более предпочтительной является группа соединений, в которыхR1 означает алкил или циклоалкилалкил, предпочтительно метил, этил, н-пропил, н-бутил, нпентил, 1-метилэтил, 1-метилпропил, 2-метилпропил, 3-метилбутил или циклобутилметил. Более предпочтительны циклобутилметил, этил или н-пропил; и(а) В рамках этой группы В и В(1) и содержащихся в них более предпочтительных групп, предпочтительной является группа соединений, в которых Е представляет собой группу -COCONHR6, в которой R6 означает водород, алкил, циклоалкил,аралкил или гетероаралкил, где ароматическое кольцо необязательно замещено одним или двумя галоидами, предпочтительно, R6 означает циклопропил, -CH(CH3)R, R представляет собой фенил, 4 хлорфенил, 2,4-дихлорфенил, 2,4-дифторфенил, 3,4-дихлорфенил, 3,4-дифторфенил, или пиридин-4-ил. Предпочтительно R6 является циклопропилом. Необходимо отметить, что ссылка на предпочтительные варианты, указанные выше, включает в себя все комбинации конкретных и предпочтительных групп, если не указано другое. Общая схема синтеза Соединения настоящего изобретения могут быть получены с использованием способов, которые изображены в схемах реакций, приведенных ниже. Исходные материалы и реагенты, используемые при получении этих соединений, или доступны из промышленных источников, таких как Aldrich Chemical Co., (Milwaukee, Wis.), Bachem (Torrance, Calif.),или Sigma (St. Louis, Mo.), или получаются методами, которые известны специалистам в этой области техники, следуя методикам, изложенным в таких ссылках, как Fieser и Fieser's "Реагенты для органического синтеза, тома 1-17 (John Wiley и Sons, 1991); Rodd's "Химия соединений углерода, тома 1-5 и приложения (Elsevier Science Publishers, 1989); Органические реакции, тома 1-40 (John Wiley и Sons, 1991),March's "Углубленный курс органической химии", (John Wiley и Sons, 4e издание) и Larock's "Всесторонние органические превращения" (VCR Publishers Inc., 1989). Эти схемы представляют собой простую иллюстрацию некоторых методов, с использованием которых можно синтезировать соединения настоящего изобретения, причем могут быть использованы различные модификации этих схем, которые могут- 10015415 быть предложены специалистам в этой области техники со ссылкой на это описание. Исходные материалы и промежуточные соединения могут быть выделены и очищены, если это желательно, с использованием традиционных методик, в том числе (без ограничений) фильтрации, дистилляции, кристаллизации, хроматографии и тому подобного. Такие материалы могут быть охарактеризованы с использованием традиционных приемов, в том числе физические константы и спектральные данные. Если не указано другое, описанные в этом изобретении процессы протекают при атмосферном давлении, в температурном диапазоне приблизительно от -78 С до приблизительно 150 С, более предпочтительно приблизительно от 0 до 125 С и наиболее предпочтительно, приблизительно при комнатной температуре (или температуре среды), например, около 20 С. В описанных ниже реакциях может возникнуть необходимость защиты реакционноспособных функциональных групп, например гидрокси, амино, имино, тио или карбоксигрупп, которые являются желательньми в конечном продукте, для того, чтобы предотвратить их нежелательное участие в этих процессах. Традиционные защитные группы могут быть использованы в соответствии с обычной практикой, например, см. книгу T.W. Greene и P. G. M. Wuts "Защитные группы в органической химии" JohnWiley и Sons, 1999. Соединения формулы (I), в которой Y представляет собой -OC(O)NH-, E означает -COCONR5R6 и значения X, R1, R2, R3, и R4 указаны в кратком изложении изобретения, могут быть получены, с использованием следующей ниже схемы реакций 1 Схема реакций 1alkyl= алкил Удаление аминозащитной группы PG1, такой как трет-бутоксикарбонил, бензилоксикарбонил, и тому подобное, в пирролидиновом соединении формулы 1, в которой PG представляет собой подходящую карбоксизащитную группу, предпочтительно алкил, и значения X и R2 определены в кратком изложении изобретения, приводит к соединению формулы 2. Условия реакции, используемые для аминозащитной группы, зависят от природы защитной группы. Например, если группа PG1 представляет собой третбутоксикарбонил, то она удаляется путем обработки соединения 1 кислотой, такой как хлористоводородная кислота в органическом растворителе, таком как диоксан, тетрагидрофуран, и тому подобное. Другие подходящие защитные группы для азота, с условиями реакции для их введения и удаления,можно найти в книге Greene, T.W.; и Wuts, P. G. М.; Защитные группы в органической химии" John Wiley и Sons, Inc. 1999. Соединения формулы 1 могут быть получены способами, которые хорошо известны из уровня техники. Некоторые такие способы описаны в патентах US 2003191067, US 6608027, US 6268207,US 6404397, US 6268207 и заявке WO 2005/028501, раскрытие которых полностью включено в настоящее изобретение со ссылкой. Обработка соединения 2 аминокислотой формулы 3, где значение R3 определено в кратком изложении изобретения, в условиях реакции пептидного сочетания приводит к соединению формулы 4. где Y представляет собой -O-C(O)NH- и R4 является алкилом. Обычно процесс проводят в присутствии подходящего сочетающего агента, например, бензотриазол-1-илокситриспирролидинофосфоний гексафторфосфата (РуВОР), О-бензо-триазол 4-ил-N,N,N',N'-тетраметилуроний гексафторфосфата (HBTU), О-(7 азабензо-триазол-1-ил)-1,1,3,3-тетраметилуроний гексафторфосфата (HATU), гидрохлорида 1-(3 диметиламинопропил)-3-этилкарбодиимида (EDC) или 1,3-дициклогексилкарбодиимида (DCC), необязательно в присутствии 1-гидроксибензотриазола (НОВТ), и основания, такого как N,Nдиизопропилэтиламин, триэтиламин, N-метилморфолин и тому подобное. Обычно взаимодействие протекает при температуре от 20 до 30 С, предпочтительно приблизительно при 25 С. Подходящими реак- 11015415 ционными растворителями являются инертные органические растворители, такие как галоидированные органические растворители (например, хлористый метилен, хлороформ, и тому подобное), ацетонитрил,N,N-диметилформамид (ДМФ), эфирные растворители, такие как тетрагидрофуран, диоксан, и тому подобные или их смеси. Аминокислоты формулы 3 являются либо промышленно доступными, либо они могут быть получены методами, которые хорошо известны из уровня техники. При гидролизе сложноэфирной группы в соединении 4 (PG = алкил) в условиях реакции гидролиза водным основанием получается соединение формулы 5. Обычно взаимодействие проводят с добавкой карбоната цезия, гидроксида лития, гидроксида натрия, и тому подобного, в водном спирте, таком как метанол, этанол, и тому подобное. При обработке соединения 5 -гидроксиаминокарбоксамидом формулы 6 в условиях реакции пептидного сочетания, как описано выше, получается соединение формулы 7. Соединения формулы 6 могут быть получены методами, которые хорошо известны из уровня техники, и некоторые из них подробно описаны в рабочих примерах, ссылки А и В ниже. Соединение 6 также может быть получено из соединения 17 (синтез которого описан в схеме 3 ниже). Кратко, после соответствующей защиты аминогруппы(например, в виде трет-ВОС карбамата), сложноэфирная группа соединения 17 удаляется в условиях реакции основного гидролиза с образованием соответствующей -гидроксикислоты. Обработка кислоты амином формулы NHR5R6 в условиях реакции сочетания с последующим гидролизом аминной защитной группы с кислотным катализатором дает соединение формулы 6. В качестве альтернативы, указанная выше стадия сочетания может быть проведена путем первоначального превращения 5 в активную производную кислоты, такую как галогенид кислоты, эфир имида янтарной кислоты, и тому подобное, с последующим взаимодействием производной с гидроксикетоамидом формулы 6. Используемые в этой реакции условия зависят от природы активной производной кислоты. Например, если эта производная является хлорангидридом кислоты 5, то взаимодействие проводят в присутствии подходящего основания (например, триэтиламин, диизопропилэтиламин, пиридин, и тому подобное). Подходящими реакционными растворителями являются полярные органические растворители, такие как ацетонитрил, N,N-диметилформамид, дихлорэтан или их любые подходящие смеси. При окислении гидроксильной группы в соединении 8 подходящим окислителем,таким как периодинан Dess Martin, получается соединение формулы (1). Соединения формулы (1), где Y представляет собой -NHC(O)NH-, E означает -COCONR5R6 и значения X, R1, R2, R3 и R4 определены в кратком изложении изобретения, могут быть получены путем осуществления схемы реакций 2, приведенной ниже. Схема реакций 2alkyl = алкил При удалении бутоксикарбонильной (ВОС) группы в соединении 4 в условиях реакции кислотного гидролиза получается аминное соединение формулы 9, которое при взаимодействии с алкилизоцианатом дает уреидное соединение формулы 10. Это взаимодействие проводят в присутствии органического основания, такого как триэтиламин, пиридин и тому подобное, и в соответствующем органическом растворителе, таком как дихлорметан, и тому подобное. Кроме того, уреидные соединения могут быть получены с помощью других методов, хорошо известных из уровня техники, таких как взаимодействие соединения 9 с карбамоил галогенидами. Затем соединение 10 превращается в соединение формулы (I) по маршруту, который описан в схеме 1, указанной выше. Аналогично, соединения формулы (I), в которыхR4 отличается от алкила, могут быть получены путем замены алкилизоцианата на арил-, гетероарил-, или аралкилизоцианаты или карбамоилгалогениды. Аналогично, соединения формулы (I), в которых Y представляет собой -CONH- или -SO2NH-, могут- 12015415 быть получены путем взаимодействия соединения 9 с ацилирующим агентом формулы R4COL, соответственно в условиях, которые хорошо известны из уровня техники. В качестве альтернативы, соединения формулы (I) могут быть получены из соединения 4 путем удаления защитной группы кислоты для того, чтобы получить соответствующую кислоту. Кислота взаимодействует с альфа-гидроксиаминокарбоксамидом 6 с последующим удалением группы ВОС[алкилОС(О)-] в полученном продукте с образованием соединения - свободного амина. Взаимодействие аминосоединения с алкилизоцианатами или карбамоилгалогенидом дает соединение 12, которое затем превращается в соединение формулы (I) при окислении гидроксильной группы, как описано выше. Соединения формулы (I), где Е представляет собой -COCOOR10 и значения X, Y, R1, R2, R3, R4 и R10 определены в кратком изложении изобретения, могут быть получены путем осуществления превращений по следующей ниже схеме. Схема реакций 3alkyl = алкил При обработке защищенного N-BOC-аминокислотного соединения формулы 13 N,Oдиметиламином в условиях, которые хорошо известны из уровня техники, получается амидное соединение Вайнреба (Вайнреба) формулы 14. Соединения формулы 13 могут быть получены из промышленно доступных аминокислот с трет-бутоксикарбониловым ангидридом в условиях, которые хорошо известны из уровня техники. Другие подходящие амино защитные группы также могут быть использованы. Обработка соединения 14 подходящим восстановителем, таким как алюмогидрид лития в соответствующем органическом растворителе, таком как тетрагидрофуран и тому подобное, обеспечивает получение соответствующего альдегида формулы 15. Обработка соединения 15 цианогидрином ацетона дает соединение 16, которое затем взаимодействует с галогенидом кислоты в гидроксильном соединении формулы R10OH,в котором значение R10 определено в кратком изложении изобретения, чтобы получить альфагидроксильное сложноэфирное соединение формулы 17. При обработке соединения 17 соединением формулы 5, в условиях пептидного сочетания, которые описаны ранее, с последующим окислением гидроксильной группы в образовавшемся продукте получается соединение формулы (I), где Y представляет собой -OC(O)NH- и R4 является алкилом. Соединение формулы (I), где Y представляет собой -OC(O)NH- и R4 является алкилом, можно превратить в другие соединения формулы (I), в которых Y и R4 имеют значения, указанные в кратком изложении изобретения, как описано выше. Соединения формулы (I), где Е представляет собой -CONR11R12 и значения X, Y, R1, R2, R3, R4, R11 и 12R определены в кратком изложении изобретения, могут быть получены путем осуществления превращений по следующей ниже схеме. Схема реакций 4alkyl = алкил При обработке соединения 13 амином формулы NHR11R12 в условиях реакции сочетания, указанных выше, получается соединение формулы 18. Удаление ВОС-группы в условиях реакции кислотного гидролиза дает соединение 19, которое затем превращается в соединение формулы (I), как описано выше.- 13015415 Соединения формулы (1), в которой В представляет собой -COR9 и значения X, Y, R1, R2, R3, R4 и R9 определены в кратком изложении изобретения, могут быть получены путем осуществления превращений по следующей ниже схеме. Схема реакций 5alkyl = алкил При обработке соединения формулы 15 литийорганическим соединением или реактивом Гриньяра формулы R9Li или R9MgX соответственно, где значение R9 определено в кратком изложении изобретения получается соединение формулы 20. Обычно это взаимодействие осуществляют при низкой реакционной температуре, такой как -78 С, и в органическом растворителе, таком как тетрагидрофуран, и тому подобное. При удалении ВОС-группы получается соединение 21, которое при взаимодействии с соединением 5 в указанных выше условиях реакции сочетания дает соединение формулы 22. Затем при окислении гидроксильной группы получается соединение формулы (I), в которой Y представляет собой -OC(O)NH- иR4 является алкилом. Соединения формулы (I), где Y и R4 являются другими группами, которые определены в кратком изложении изобретения, могут быть получены, как описано выше. Соединения формулы (I), где Е представляет собой -СНО и значения X, Y, R1, R2, R3, R4 и R8 определены в кратком изложении изобретения, могут быть получены путем осуществления превращений по следующей ниже схеме. Схема реакций 6alkyl = алкил При удалении аминозащитной группы в соединении 23 в условиях реакции кислотного гидролиза с последующим сочетанием образовавшегося аминного соединения с соединением формулы 5 получается соединение формулы 24. Затем соединение 24 превращается в соединение формулы (1), в которой Е представляет собой -СНО путем осуществления процесса по методу А или В, указанному выше. В методе А гидролиз сложноэфирной группы в условиях реакции основного гидролиза дает соединение формулы 25, которое превращается в амид Вайнреба формулы 26. Затем при восстановлении амидной группы в 26 подходящим восстановителем, таким как алюмогидрид лития получается соедине- 14015415 ние формулы (I), где Е представляет собой -СНО и Y означает -OC(O)NH-. В качестве альтернативы, сложноэфирная группа в соединении 24 может быть восстановлена подходящим восстановителем, таким как алюмогидрид лития для того, чтобы получить соответствующий спирт формулы 27, который при обработке окислителем дает соединение формулы (1), в которой Е представляет собой -СНО и Y означает -OC(O)NH-. Соединения формулы (I), где Y представляет собой другие группы, могут быть получены как описано выше. Соединение формулы (I) может быть превращено в другие соединения формулы (I). Например, соединение формулы (I), содержащее гидроксильную группу, может быть получено путем деалкилирования/бензилирования алкокси/бензилоксизаместителя; соединения, содержащие кислотную группу, получают путем гидролиза сложноэфирной группы; и соединения, содержащие цианогруппу, путем замещения атома брома в соответствующих соединениях формулы (1). Соединение формулы (I), содержащее цианогруппу, может быть превращено в соответствующее карбоксисодержащее соединение путем гидролиза цианогруппы. В свою очередь, карбоксигруппа может быть превращена в сложноэфирную группу. Соединение формулы (I) может быть получено в виде фармацевтически приемлемой кислой аддитивной соли путем взаимодействия соединения в виде свободного основания с фармацевтически приемлемой неорганической или органической кислотой. В качестве альтернативы, фармацевтически приемлемая основная аддитивная соль соединения формулы (I) может быть получена путем взаимодействия соединения в виде свободной кислоты с фармацевтически приемлемым неорганическим или органическим основанием. Неорганические и органические кислоты и основания, подходящие для получения фармацевтически приемлемых солей соединений формулы (I), указаны в разделе определений настоящего изобретения. В качестве альтернативы, солевые формы соединений формулы (I) могут быть получены с использованием солей исходных материалов или промежуточных соединений. Соединения формулы (I) в виде свободной кислоты или свободного основания могут быть получены из соответствующих основных аддитивных солей или кислотных аддитивных солей. Например, соединение формулы (I) в виде кислотной аддитивной соли можно превратить в соответствующее свободное основание путем обработки подходящим основанием (например, раствором гидроксида аммония,гидроксида натрия, и тому подобное). Соединение формулы (I) в виде основной аддитивной соли можно превратить в соответствующую свободную кислоту путем обработки подходящей кислотой (например,хлористо-водородной кислотой, и др.).N-Оксиды соединений формулы (1) могут быть получены с помощью методов, известных специалистам в этой области техники. Например, N-оксиды могут быть получены путем обработки неокисленной формы соединения формулы (1) окислителем (например, трифторперуксусной кислотой, пермалеиновой кислотой, пербензойной кислотой, перуксусной кислотой, мета-хлорпероксибензойной кислотой,или тому подобной) в подходящем органическом растворителе (например, галоидированном углеводороде, таком как дихлорметан) приблизительно при 0 С. В качестве альтернативы, N-оксиды соединений формулы (1) могут быть получены из N-оксида соответствующего исходного материала. Соединения формулы (I) в неокисленной форме могут быть получены из N-оксидов соединений формулы (I) путем обработки восстановителем (например, серой, диоксидом серы, трифенилфосфином,боргидридом лития, боргидридом натрия, трихлоридом фосфора, трибромидом фосфора или тому подобным) в подходящем инертном органическом растворителе (например, ацетонитрил, этанол, водный диоксан, или тому подобное) при температуре от 0 до 80 С. Пролекарственные производные соединений формулы (I) могут быть получены методами, которые известны специалистам в этой области техники (дальнейшие подробности смотрите, например, в работеSaulnier и др. (1994), Bioorganic and Medicinal Chemistry Letters, том. 4, с. 1985). Например, подходящие пролекарственные препараты могут быть получены путем взаимодействия не дериватизированного соединения формулы (I) с соответствующим карбамоильным агентом (например, 1,1-ацилоксиалкилкарбонхлоридатом, пара-нитрофенилкарбонатом, или тому подобным). Защищенные производные соединений формулы (I) могут быть получены методами, которые известны специалистам в этой области техники. Подробное описание методик, применимых для создания защитных групп и их удаления, можно найти в вниге T.W. Greene, Защитные группы в органическом синтезе, 3 е издание, John WileySons, Inc. 1999. Соединения настоящего изобретения могут быть удобно получены или сформированы в процессе настоящего изобретения в виде сольватов (например, гидратов). Гидраты соединений настоящего изобретения могут быть удобно получены путем перекристаллизации из смеси воды и органического растворителя, с использованием таких органических растворителей как диоксан, тетрагидрофуран или метанол. Соединения формулы (1) могут быть получены в виде диастереомеров, которые обладают определенными физическими характеристиками (например, температура плавления, точка кипения, растворимость, реакционная способность, и др.), и могут быть легко выделены с использованием преимущества указанных различий. Диастереомеры могут быть разделены хроматографическим методом или, предпочтительно, по методике разделения/повторного растворения, основанной на различиях растворимости.- 15015415 Затем оптически чистый изомер выделяется с помощью любого практического приема, который не приводит к рацемизации хиральных центров изомера. Более подробное описание методик, применяемых для расщепления стереоизомеров соединений из их рацемической смеси можно найти в книге Jean JacquesAndre Collet, Samuel H. Wilen, Энантиомеры, рацематы и их расщепление, John WileySons, Inc. (1981). Фармакология и полезность Соединения настоящего изобретения являются ингибиторами репликации вируса гепатита С (HCV) и следовательно, являются полезными при лечении инфекций гепатита С. Ингибирующую активность соединений формулы (I) можно определить с помощью методов, которые известны специалистам в этой области техники. Подходящий метод измерения способности соединений настоящего изобретения ингибировать репликацию HCV вне организма изложен ниже, в биологическом примере 1. Введение и фармацевтические композиции Обычно соединения формулы (1) можно вводить в терапевтически эффективных количествах с использованием любых обычных и приемлемых приемов, которые известны из уровня техники, либо отдельно, либо в сочетании с одним или несколькими терапевтическими агентами. Терапевтически эффективное количество может изменяться в широких пределах в зависимости от серьзности заболевания,возраста и состояния здоровья субъекта, активности применяемого соединения и других факторов. Например, терапевтически эффективное количество соединения формулы (I) может изменяться приблизительно от 10 микрограмм на килограмм веса тела (мкг/кг) в сутки до приблизительно 100 миллиграмм на килограмм веса тела (мг/кг) в сутки, обычно приблизительно от 100 мкг/кг до 10 мг/кг в сутки. Следовательно, терапевтически эффективное количество для пациента-человека весом 80 кг может изменяться приблизительно от 1 мг/сутки до 8 г/сутки, типично приблизительно от 1 мг/сутки до 800 мг/сутки. Обычно, специалист в этой области техники, действуя на основании собственного опыта и раскрытия настоящего изобретения, будет способен установить терапевтически эффективное количество соединения формулы (I) для лечения данного заболевания. Соединения формулы (1) можно вводить в виде фармацевтических композиций одним из следующих способов: оральным, системным (например, через кожу, интраназально или с помощью свечи) или парэнтерально (например, внутримышечно, внутривенно или подкожно). Композиции могут принимать форму таблеток, пилюль, капсул, полутвердых веществ, порошков, рецептур с замедленным высвобождением, растворов, суспензий, эликсиров, аэрозолей или любой другой подходящей композиции и обычно содержат соединение формулы (1) в сочетании по меньшей мере с одним фармацевтически приемлемым наполнителем. Приемлемые наполнители представляют собой нетоксичные, вспомогательные средства для приема, и не оказывают вредного влияния на терапевтические преимущества активного компонента. Такой наполнитель может иметь любую форму твердого, жидкого, полутвердого вещества, или, в случае аэрозольной композиции, является газообразным наполнителем, который, как правило, является доступным для специалиста в этой области техники. Твердые фармацевтические наполнители включают крахмал, целлюлозу, тальк, глюкозу, лактозу,сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат магния, стеарат натрия, моностеарат глицерина, хлорид натрия, порошок снятого молока и тому подобное. Жидкие и полутвердые наполнители можно выбирать из воды, этанола, глицерина, пропиленгликоля и различных масел, в том числе масла нефтяного, животного, растительного или искусственного происхождения (например, арахисовое масло,соевое масло, минеральное масло, кунжутное масло, и тому подобное). Предпочтительные жидкие носители, в частности растворы для инъекций, включают в себя воду, физиологический раствор, водную декстрозу и гликоли. Количество соединения формулы (I) в композиции может изменяться в широком диапазоне, в зависимости от типа рецептуры, размера стандартной дозы, типа наполнителя и других факторов, которые известны специалисту в области фармацевтической техники. Как правило, композиция соединения формулы (I) для лечения данного заболевания может содержать от 0,01 до 90 мас.%, предпочтительно от 5 до 50 мас.%, активного компонента, причем остальное приходится на наполнитель или наполнители. Предпочтительно фармацевтическую композицию принимают в виде отдельной формы стандартной дозировки для непрерывного лечения или в виде отдельной формы стандартной дозировки по желанию,когда требуется конкретное облегчение симптомов заболевания. Примеры фармацевтических рецептур,содержащих соединение формулы (I), описаны ниже. В некоторых вариантах изобретения соединения формулы (I) могут вводиться пациенту, нуждающемуся в лечении, вместе со вторым противовирусным средством. Примерами подходящих противовирусных средств являются интерфероны, такие как Интрон А, Роферон А и интерфероны, содержащиеPEG, такие как PEG-интрон, Пегасиз; Рибавирин, Вирамидин, Левовирин; ингибиторы полимеразы HCV,такие как Валопицитабин, R 1626 (Roche), HCV-796 (Viropharma/Wyeth); и агонисты толл-рецепторов,такие как ANA-975 (Anadys). Соединения формулы (I) можно принимать внутрь в сочетании с указанными выше агентами или индивидуально. Кроме того, соединения формулы (I) можно принимать или до,или после приема внутрь второго противовирусного средства, в соответствии с предписанием лечащего врача.- 16015415 Примеры Настоящее изобретение дополнительно охарактеризовано примерами, но не ограничено следующими примерами, которые иллюстрируют получение соединений формулы (I) согласно изобретению. Ссылка А. Синтез трет-бутилового эфира [1S-(циклопропилкарбамоилгидроксиметил)бутил]карбаминовой кислотыNMM (34,9 г, 0,35 моль) при перемешивании в течение 30 мин. Реакционную смесь выдерживают при комнатной температуре в течение 2 ч, затем разбавляют в 2000 мл этилацетата (EtOAc), промывают раствором NaHCO3, Н 2 О, и рассолом и сушат над MgSO4. Растворитель удаляют на роторном испарителе,получая трет-бутиловый эфир [1S-(метоксиметилкарбамоил)бутил]карбаминовой кислоты (20 г) в виде бесцветного масла. Стадия 2. К раствору трет-бутилового эфира [1S-(метоксиметилкарбамоил)бутил]карбаминовой кислоты (7,2 г, 27,7 ммоль) в безводном тетрагидрофуране (THF,100 мл) в атмосфере аргона при -78 С медленно добавляют алюмогидрид лития (LAH, 1M раствор в THF, 27,7 мл). Спустя 2 ч, реакцию прерывают, медленно добавляя 1 н. HCl-кислоту (20 мл), и затем смеси дают нагреться до комнатной температуры. Реакционную смесь разбавляют этилацетатом (600 мл), промывают 1 н. HCl-кислотой, Н 2 О и рассолом и сушат над MgSO4. При удалении растворителя получают трет-бутиловый эфир (1S-формилбутил)карбаминовой кислоты (4,8 г) в виде масла. Стадия 3. К раствору циклопропилизонитрила (1,91 г, 28,5 ммоль), трет-бутилового эфира (1Sформилбутил)карбаминовой кислоты (3,8 г, 19 ммоль) в метиленхлориде (100 мл) добавляют уксусную кислоту (HOAc, 2,28 г, 38 ммоль) при 0 С. По завершении добавления реакционной смеси дают нагреться до 25 С, и смесь перемешивают в течение 6 ч. Реакционную смесь разбавляют этилацетатом (200 мл),затем промывают насыщенным раствором NaHCO3 и рассолом (30 мл) и сушат над MgSO4. Растворитель удаляют, и сырой продукт кристаллизуется из 50 мл смеси этилацетата и гексана (1/1 по объему), получая 2-трет-бутоксикарбониламино-1-циклопропилкарбамоилпентиловый эфир уксусной кислоты (4,8 г) в виде белого твердого вещества. Стадия 4. В раствор 2-трет-бутоксикарбониламино-1-циклопропилкарбамоилпентилового эфира уксусной кислоты (4,8 г, 14,6 ммоль) в метаноле (МеОН, 50 мл) добавляют водный раствор NaOH (1 н., 22 мл) при комнатной температуре. Спустя 2 ч, метанол удаляют, и концентрат экстрагируют этилацетатом (300 мл). Этилацетатный слой промывают рассолом и сушат над MgSO4. После удаления растворителя, сырой продукт кристаллизуется из 100 мл смеси этилацетата и гексана (3/1 по объему), получая указанное в заголовке соединение (3,5 г) в виде белого твердого вещества. Ссылка В. Синтез трет-бутилового эфира (1S-циклобутилметил-2-циклопропилкарбамоил-2-гидроксиэтил) карбаминовой кислоты Стадия 1. К смеси ВОС-L-циклобутилаланин DIPA (10,33 г, 30 ммоль), гидрохлорида N,O-диметил- 17015415 гидроксиламина (3,22 г, 33 ммоль), EDC (8,63 г, 45 ммоль), HOBt (5,52 г, 36 ммоль) в дихлорметане (200 мл), медленно добавляют NMM (9,11 г, 90 ммоль) при перемешивании в течение 30 мин. Спустя 2 ч, реакционную смесь разбавляют этилацетатом (1000 мл), промывают раствором NaHCO3, H2O и рассолом, и сушат над MgSO4. Удаление растворителя дает трет-бутиловый эфир [2-циклобутил-1S-(метоксиметилкарбамоил)этил]карбаминовой кислоты (7,1 г) в виде бесцветного масла. Стадия 2. К раствору трет-бутилового эфира [2-циклобутил-1S-(метоксиметилкарбамоил)этил]карбаминовой кислоты (4,3 г, 15 ммоль) в безводном THF (100 мл) в атмосфере аргона при -78 С, медленно добавляютLAH (1M раствор в THF, 15 мл, 15 ммоль). Спустя 2 ч, реакцию прерывают, медленно добавляя 1 н. HClкислоту (15 мл), и реакционную смесь нагревают до комнатной температуры по окончании добавления. Реакционную смесь разбавляют этилацетатом (500 мл), промывают 1 н. HCl-кислотой, Н 2 О и рассолом, и сушат над MgSO4. Удаление растворителей дает трет-бутиловый эфир (2-циклобутил-1S-формилэтил) карбаминовой кислоты (2,95 г) в виде масла. Стадия 3. К раствору циклопропилизонитрила (1,21 г, 18 ммоль), трет-бутилового эфира (2-циклобутил-1Sформилэтил)карбаминовой кислоты (2,95 г, 13 ммоль) в метиленхлориде (20 мл), добавляют уксусную кислоту (1,56 г, 26 ммоль) при 0 С. По окончании добавления реакционной смеси дают нагреться до 25 С и перемешивают еще в течение 4 ч. Реакционную смесь разбавляют этилацетатом (200 мл) и промывают насыщенным раствором NaHCO3 и рассолом и сушат над MgSO4. Растворитель удаляют, и сырой продукт кристаллизуется из 50 мл смеси этилацетата и гексана (1/1 по объему), давая 2S-третбутоксикарбониламино-3-циклобутил-1-циклопропилкарбамоилпропиловый эфир уксусной кислоты (3,8 г) в виде белого твердого вещества. Стадия 4. К раствору 2S-трет-бутоксикарбониламино-3-циклобутил-1-циклопропилкарбамоилпропилового эфира уксусной кислоты (3,8 г, 10,7 ммоль) в метаноле (50 мл) добавляют водный раствор NaOH (1 н., 15 мл) при комнатной температуре. Спустя 2 ч, метанол удаляют и концентрат экстрагируют этилацетатом. Этилацетатный экстракт промывают рассолом и сушат над MgSO4. Растворитель удаляют, и остаток кристаллизуется из 100 мл смеси этилацетата и гексана (3/1 по объему), чтобы получить указанное в заголовке соединение (2,9 г) в виде белого твердого вещества. Пример 1. Синтез (1S-циклопропиламинооксалилбутил)амида 1-[2S-(3-трет-бутилуреидо)-3,3 диметилбутирил]-R-(7-метокси-2-пиразол-1-ил-хинолин-4-илокси)пирролидин-2S-карбоновой кислоты- 18015415 Стадия 1. К раствору промышленно доступного метилового эфира N-трет-BOC-цис-4S-гидрокси-L-пролина(370 мг, 1,51 ммоль) и 7-метокси-2-пиразол-1-илхинолин-4-ола (опубликованная заявка РСТWO 2000059929) (400 мг, 1,66 ммоль) в осушенном THF (15 мл) при 0 С добавляют трифенилфосфин (PPh3,594 мг, 2,27 ммоль) и затем медленно добавляют DIAD (0,36 мл, 1,81 ммоль) в атмосфере N2. Реакционной смеси дают медленно нагреться до комнатной температуры и перемешивают смесь в течение 18 ч. Затем сырую реакционную смесь концентрируют и очищают методом флэш-хроматографии, чтобы получить 1-трет-бутиловый-2S-метиловьш эфир 4R-(7-метокси-2-пиразол-1-ил-хинолин-4-илокси)пирролидин-1,2-дикарбоновой кислоты (1) с выходом 69%. Стадия 2. К раствору 1-трет-бутилового-2S-метилового эфира 4R-(7-метокси-2-пиразол-1-илхинолин-4 илокси)пирролидин-1,2-дикарбоновой кислоты (200 мг, 0,43 ммоль) в дихлорметане (1 мл) добавляют 4,0 М раствор HCl в диоксане (3,0 мл). Спустя 1 ч, реакционную смесь концентрируют и сушат, получая гидрохлорид метилового эфира 4R-(7-метокси-2-пиразол-1-илхинолин-4-илокси)пирролидин-2Sкарбоновой кислоты (2) в виде белого твердого вещества. Стадия 3. К раствору гидрохлорида метилового эфира 4R-(7-метокси-2-пиразол-1-илхинолин-4 илокси)пирролидин-2S-карбоновой кислоты (67 мг, 0,165 ммоль) в смеси дихлорметан/ДМФ (2,0 мл, 1:1) добавляют BOC-L-трет-Leu-ОН (38,1 мг, 0,165 ммоль), HATU (69 мг, 0,182 ммоль) и DIPEA (0,1 мл, 0,5 ммоль) и смесь перемешивают при комнатной температуре. Спустя 16 ч, реакционную смесь разбавляют этилацетатом и промывают 1 н. HCl-кислотой, насыщенным раствором NaHCO3 и рассолом. Этилацетатный слой сушат (MgSO4), фильтруют и выпаривают досуха, получая метиловый эфир 1-(2S-третбутоксикарбониламино-3,3-диметилбутирил)-4R-(7-метокси-2-пиразол-1-илхинолин-4-илокси)пирролидин-2S-карбоновой кислоты (3) с количественным выходом. Стадия 4. К раствору сырого метилового эфира 1-(2S-трет-бутоксикарбониламино-3,3-диметилбутирил)-4R(7-метокси-2-пиразол-1-илхинолин-4-илокси)пирролидин-2S-карбоновой кислоты в дихлорметане (1 мл) добавляют 4,0 М раствор HCl в диоксане (3,0 мл). Спустя 1 ч, реакционную смесь концентрируют и сушат, получая гидрохлоридную соль метилового эфира 1-(2S-амино-3,3-диметилбушрил)-4R-(7-метокси 2-пиразол-1-илхинолин-4-илокси)пирролидин-2S-карбоновой кислоты в виде белого твердого вещества,которое используют на следующей стадии без дополнительной очистки. Стадия 5. К раствору гидрохлорида метилового эфира 1-(2S-амино-3,3-диметилбутирил)-4R-(7-метокси-2 пиразол-1-илхинолин-4-илокси)пирролидин-2S-карбоновой кислоты (0,165 ммоль) в дихлорметане (3,0 мл) добавляют триэтиламин (0,06 мл, 0,413 ммоль) и трет-бутилизоцианат (0,02 мл, 0,165 ммоль) и реакционную смесь перемешивают при комнатной температуре. Спустя 16 ч, реакционную смесь разбавляют дихлорметаном и промывают 1 н. HCl-кислотой, насыщенным раствором NaHCO3 и рассолом. Затем дихлорметановый слой выпаривают досуха, чтобы получить метиловый эфир 1-[2S-(3-трет-бутилуреидо)3,3-диметилбутирил]-4R-(7-метокси-2-пиразол-1-илхинолин-4-илокси)пирролидин-2S-карбоновой кислоты (4). Стадия 6. Метиловый эфир 1-[2S-(3-трет-бутилуреидо)-3,3-диметилбутирил]-4R-(7-метокси-2-пиразол-1 илхинолин-4-илокси)пирролидин-2S-карбоновой кислоты обрабатывают метанолом (6,0 мл), THF (3,0 мл) и 1 н. раствором NaOH (6 мл). Спустя 1 ч при комнатной температуре, реакционную смесь концентрируют, подкисляют 1 н. HCl-кислотой и экстрагируют этилацетатом. Затем объединенные этилацетатные слои промывают рассолом и сушат (MgSO4). Затем этилацетатный слой фильтруют и выпаривают досуха, чтобы получить 1-[2S-(3-трет-бутилуреидо)-3,3-диметилбутирил]-4R-(7-метокси-2-пиразол-1 илхинолин-4- илокси)пирролидин-2S-карбоновую кислоту (5). Стадия 7. трет-Бутиловый эфир [1S-(циклопропилкарбамоилгидроксиметил)бутил]-карбаминовой кислоты(48 мг, 0,165 ммоль) растворяют в дихлорметане (3,0 мл) и добавляют трифторуксусную кислоту (TFA 3,0 мл). После перемешивания в течение 1 ч при комнатной температуре, реакционную смесь выпаривают досуха, чтобы получить трифторацетат циклопропиламида 3S-амино-2-гидроксигексановой кислоты в виде белого твердого вещества. Раствор 1-[2S-(3-трет-бутилуреидо)-3,3-диметилбутирил)-4R-(7 метокси-2-пиразол-1-илхинолин-4-илокси)пирролидин-2S-карбоновой кислоты в смеси дихлорметан/ДМФ (1:1, 6,0 мл) добавляют к трифторацетату циклопропиламида 3S-амино-2-гидроксигексановой кислоты с последующим добавлением HATU (75 мг, 0,198 ммоль) и DEPEA (0,1 мл, 0,7 ммоль). Спустя 24 ч при комнатной температуре, реакционную смесь разбавляют этилацетатом и промывают 1 н. HCl,раствором NaHCO3 и рассолом. Этилацетатный слой сушат (MgSO4), фильтруют и выпаривают досуха. Затем сырой продукт растворяют в осушенном дихлорметане (10,0 мл) и добавляют периодинан ДессаМартина (Десса-Мартина; 112 мг, 0,264 ммоль). После перемешивания при комнатной температуре в течение 2 ч, реакцию прерывают, добавляя 0,26 М Na2S2O3 в насыщенном растворе NaHCO3 и экстраги- 19015415 руют этилацетатом. Затем объединенные этилацетатные слои промывают насыщенным раствором NaHCO3 и рассолом. При очистке методом препаративной ВЭЖХ получают указанное в заголовке соединение (7), чистотой 99% по данным ВЭЖХ. 1H ЯМР: (ДМСО-d6)8,76-8,70 (м, 2 Н); 8,22 (д, J = 6,8 Гц, 1 Н); 8,11 (д, J = 9,6 Гц, 1 Н); 7,87 (д, J = 1,2 Гц, 1 Н); 7,45 (с, 1 Н); 7,27 (д, J = 2,4 Гц, 1 Н); 7,00-6,97 (дд, J = 2,8 и 9,6 Гц, 1 Н); 6,64-6,62 (м, 1 Н); 5,92 (hrc, 1 Н); 5,49 (hrc, 1 Н); 5,00-4,96 (м, 1 Н); 4,55-4,49 (м, 2 Н); 4,18 (д, J = 5,6 Гц, 1 Н); 3,90 (с, 3 Н); 3,91-3,82 (м, 1 Н); 3,54 (шир. с, 1 Н); 2,75-2,72 (м, 1 Н); 2,54-2,51 (м, 1 Н); 2,17-2,14 (м, 1 Н); 1,69-1,66 (м,1 Н); 1,40-1,34 (м, 3 Н); 1,13 (м, 9 Н); 0,93 (м, 9H); 0,90-0,82 (м, 3 Н); 0,65-0,53 (м, 4 Н). МС (М 1) 733. Пример 2. Синтез (1S-циклобутилметил-2-циклопропилкарбамоил-2-оксоэтил)амида 1-[2S-(3-третбутилуреидо)-3,3-диметилбутирил]-4R-(7-метокси-2-пиразол-1-илхинолин-4-илокси)пирролидин-2 карбоновой кислоты (9). Стадия 1. трет-Бутиловый эфир (1S-циклобутилметил-2-циклопропилкарбамоил-2-гидроксиэтил)карбаминовой кислоты (51 мг, 0,165 ммоль) растворяют в дихлорметане (3,0 мл) и добавляют TFA (3,0 мл). После перемешивания в течение 1 ч при комнатной температуре, реакционную смесь выпаривают досуха, чтобы получить трифторацетат 3S-амино-4-циклобутил-N-циклопропил-2-гидроксибутирамида в виде белого твердого вещества. Раствор 1-[2S-(3-трет-бутилуреидо)-3,3-диметилбутирил]-4R-(7-метокси-2-пиразол-1-илхинолин-4 илокси)пирролидин-2S-карбоновой кислоты в смеси дихлорметан/ДМФ (1:1, 6,0 мл) добавляют к трифторацетату 3S-амино-4-циклобутил-N-циклопропил-2-гидроксибутирамида, затем добавляют HATU (75 мг, 0,198 ммоль) и DIPEA (0,1 мл, 0,7 ммоль). Спустя 24 ч при комнатной температуре, реакционную смесь разбавляют этилацетатом и промывают 1 н. HCl-кислотой, насыщенным раствором NaHCO3 и рассолом. Этилацетатный слой сушат (MgSO4), фильтруют и выпаривают досуха. Затем сырой продукт растворяют в осушенном дихлорметане (10,0 мл) и добавляют периодинан Десса-Мартина (112 мг, 0,264 ммоль). После перемешивания при комнатной температуре в течение 2 ч, реакцию прерывают, добавляя 0,26 М Na2S2O3 в насыщенном растворе NaHCO3, и экстрагируют этилацетатом. Затем объединенные этилацетатные слои промывают насыщенным раствором NaHCO3 и рассолом. При очистке методом препаративной ВЭЖХ получают указанное в заголовке соединение (9) чистотой 99% по данным ВЭЖХ. 1- 20015415 Получение HCl соли соединения 10 К раствору промышленно доступного трет-ВОС-(2S,4R)-гидроксипролина (1 ммоль) в ДМСО добавляют небольшими порциями трет-бутоксид калия (3 ммоль) в течение 15 мин при 23 С. Смесь перемешивают при 23 С в течение 30 мин, затем охлаждают до 0 С, затем добавляют 2,5-дихлорпиридин (1,1 ммоль) небольшими порциями в течение 10 мин. Реакционную смесь перемешивают при 23 С в течение 16 ч. Образовавшуюся суспензию выливают в 5% водный раствор лимонной кислоты и экстрагируют этилацетатом. Объединенные этилацетатные слои промывают рассолом и сушат (MgSO4). Органические фазы фильтруют и концентрируют, получая белое твердое вещество. Это твердое вещество растворяют в 4,0 М растворе HCl в диоксане (10 мл). Спустя 1 ч, реакционную смесь концентрируют и сушат, получая гидрохлорид метилового эфира 4R-(5-хлорпиридин-2-илокси)пирролидин-2S-карбоновой кислоты. Стадия 1. К раствору гидрохлорида метилового эфира 4R-(5-хлорпиридин-2-илокси)пирролидин-2S-карбоновой кислоты (242 мг, 0,829 ммоль) в смеси дихлорметана и ДМФ (10 мл, 1:1) добавляют ВОС-L-третLeu-OH (192 мг, 0,829 ммоль), HATU (347 мг, 0,912 ммоль) и DIPEA (0,37 мл, 2,07 ммоль), и реакционную смесь перемешивают при комнатной температуре. Спустя 16 ч, реакционную смесь разбавляют этилацетатом и промывают насыщенным раствором NaHCO3 и рассолом. Этилацетатный слой сушат(MgSO4), фильтруют и выпаривают досуха, получая метиловый эфир 1-(2S-трет-бутоксикарбониламино 3,3-диметилбутирил)-4-(5-хлорпиридин-2-илокси)пирролидин-2S-карбоновой кислоты (11) с количественным выходом. Стадия 2. Метиловый эфир 1-(2S-трет-бутоксикарбониламино-3,3-диметилбутирил)-4-(5-хлорпиридин-2 илокси)пирролидин-2S-карбоновой кислоты обрабатывают метанолом (5,0 мл), тетрагидрофураном (3,0 мл) и 1 н. раствором NaOH (5,0 мл). Спустя 2 ч при комнатной температуре, реакционную смесь концентрируют, подкисляют 1 н. HCl-кислотой и экстрагируют этилацетатом. Затем объединенные этилацетатные слои промывают рассолом и сушат (MgSO4). Затем этилацетатный слой фильтруют и выпаривают досуха, чтобы получить 1-(2S-трет-бутоксикарбониламино-3,3-диметил-бутирил)-4R-(5-хлорпиридин-2 илокси)пирролидин-2S-карбоновую кислоту (12). Стадия 3. К трет-бутиловому эфиру (1S-циклобутилметил-2-циклопропилкарбамоил-2-гидроксиэтил) карбаминовой кислоты (214 мг, 0,83 ммоль) добавляют 4,0 М раствор HCl в диоксане (11,0 мл). Спустя 1 ч,реакционную смесь концентрируют и сушат, получая гидрохлорид 3S-амино-4-циклобутил-Nциклопропил-2-гидроксибутирамида в виде белого твердого вещества. К 3S-амино-4-циклобутил-Nциклопропил-2-гидроксибутирамиду добавляют 1-(2S-трет-бутоксикарбониламино-3,3-диметилбутирил)-4R-(5-хлорпиридин-2-илокси)пирролидин-2S-карбоновую кислоту в смеси дихлорметан/ДМФ (1:1,10,0 мл), EDC (238 мг, 1,24 ммоль), HOBt (190 мг, 1,24 ммоль) и NMM (0,6 мл, 3.32 ммоль). Спустя 16 ч при комнатной температуре, реакционную смесь разбавляют этилацетатом и промывают насыщенным раствором NaHCO3, рассолом и сушат (MgSO4). Затем этилацетатный слой фильтруют, концентрируют и очищают методом флэш-хроматографии, чтобы получить трет-бутиловый эфир 1[4R-(5-хлорпиридин-2 илокси)-2S-(1S-циклобутилметил-2-циклопропилкарбамоил-2-гидроксиэтилкарбамоил)пирролидин-1 карбонил]-2,2-диметилпропилкарбаминовой кислоты (13) с выходом 58%. Стадия 4. К трет-бутиловому эфиру 1-[4R-(5-хлорпиридин-2-илокси)-2S-(1S-циклобутилметил-2-циклопропилкарбамоил-2-гидроксиэтилкарбамоил)пирролидин-1-карбонил]-2,2-диметилпропилкарбаминовой кислоты (313 мг, 0,482 ммоль) в дихлорметане (2 мл) добавляют 4,0 М раствор HCl в диоксане (3,0 мл). Спустя 1 ч, реакционную смесь концентрируют и сушат, получая гидрохлорид (1-циклобутилметил-2 циклопропилкарбамоил-2-гидроксиэтил)амида 1-(2S-амино-3,3-диметилбутирил)-4R-(5-хлорпиридин-2 илокси)пирролидин-2-карбоновой кислоты в виде белого твердого вещества. Стадия 5. К раствору гидрохлорида (1-циклобутилметил-2-циклопропилкарбамоил-2-гидроксиэтил)амида 1(2S-амино-3,3-диметилбутирил)-4R-(5-хлорпиридин-2-илокси)пирролидин-2-карбоновой кислоты (45 мг,0,077 ммоль) в дихлорметане (3,0 мл) добавляют метиламин (0,02 мл, 0,154 ммоль). Спустя 5 мин при комнатной температуре, добавляют трет-бутилизоцианат (0,01 мл,0,077 ммоль) и реакционную смесь перемешивают при комнатной температуре. Через 16 ч реакционную смесь разбавляют дихлорметаном и промывают 1 н. HCl-кислотой, насыщенным раствором NaHCO3 и рассолом. Затем выпаривают досуха дихлорметановый слой, получая (1S-циклобутилметил-2-циклопропилкарбамоил-2-гидроксиэтил)амид 1[2S-(3-трет-бутил-уреидо)-3,3-диметилбутирил]-4R-(5-хлорпиридин-2-илокси)пирролидин-2Sкарбоновой кислоты (14). Стадия 6.- 21015415 перемешивания при комнатной температуре в течение 2 ч, реакцию прерывают, добавляя 0,26 М Na2S2O3 в насыщенном растворе NaHCO3 и экстрагируют этилацетатом. Затем объединенные этилацетатные слои промывают насыщенным раствором NaHCO3 и рассолом. Очистка путем препаративной ВЭЖХ дает указанное в заголовке соединение (15) чистотой 90% по данным ВЭЖХ. 1 По методике, описанной в указанном выше примере 1, получают трет-бутиловый эфир 1S-[2R-(1Sциклопропиламино-оксалилбутикарбамоил)-4R-(7-метокси-2-пиразол-1-илхинолин-4-илокси)пирролидин-1-карбонил]-2,2-диметилпропилкарбаминовой кислоты. МС: 734 (М+1). Пример 5. Синтез трет-бутилового эфира 1S-[2S-(1S-циклопропиламинооксалилбутилкарбамоил)4R-(7-метокси-2-фенилхинолин-4-илокси)пирролидин-1-карбонил]-2,2-диметилпропилкарбаминовой кислоты (17). По методике, описанной в указанном выше примере 4, но заменяя 7-метокси-2-пиразол-1 илхинолин-4-ол на 7-метокси-2-фенилхинолин-4-ол, получают указанное в заголовке соединение. МС: 744 (М+1). Пример 6. Синтез трет-бутилового эфира 1S-[4R-(5-хлорпиридин-2-илокси)-2S-(1S-циклопропиламинооксалилбутилкарбамоил)пирролидин-1-карбонил]-2,2-диметилпропилкарбаминовой кислоты (18) По методике, описанной в указанном выше примере 4, но заменяя гидрохлорид метилового эфира 4R-(7-метокси-2-пиразол-1-илхинолин-4-илокси)пирролидин-2S-карбоновой кислоты на гидрохлорид метилового эфира 4R-(5-хлорпиридин-2-илокси)пирролидин-2-карбоновой кислоты, получают указанное в заголовке соединение. МС: 622 (М+1). Пример 7. Синтез трет-бутилового эфира 1S-[4R-(5-хлорпиридин-2-илокси)-2S-(1S-циклобутилметил-2-циклопропилкарбамоил-2-оксоэтилкарбамоил)пирролидин-1-карбонил]-2,2-диметилпропил карбаминовой кислоты (19) По методике, описанной в указанном выше примере 4, но заменяя гидрохлорид метилового эфира 4R-(7-метокси-2-пиразол-1-илхинолин-4-илокси)пирролидин-2S-карбоновой кислоты на гидрохлорид метилового эфира 4R-(5-хлорпиридин-2-илокси)пирролидин-2-карбоновой кислоты и используя третбутиловый эфир (1S-циклобутилметил-2-циклопропилкарбамоил-2-гидроксиэтил)карбаминовой кислоты вместо трет-бутилового эфира [1S-(циклопропилкарбамоилгидроксиметил)бутил]карбаминовой кислоты,получают указанное в заголовке соединение. МС: 648 (М+1). Пример 8. Синтез (1-циклопропиламинооксалилбутил)амида 1-[2-(3-трет-бутилуреидо)-3,3 диметилбутирил]-4-(5-хлорпиридин-2-илокси)пирролидин-2-карбоновой кислоты (20). По методике, описанной в указанном выше примере 3, но заменяя трет-бутиловый эфир (1Sциклобутилметил-2-циклопропилкарбамоил-2-гидроксиэтил)карбаминовой кислоты на трет-бутиловый эфир [1S-(циклопропилкарбамоилгидроксиметил)бутил]карбаминовой кислоты, получают указанное в заголовке соединение. МС: 621 (M+1). Пример 9. Синтез (1S-циклопропиламинооксалибутил)амида 1-[2S-(3-трет-бутилуреидо)-3,3-диметилбутирил]-4R-(6-метоксиизохинолин-1-илокси)пирролидин-2S-карбоновой кислоты (21).- 23015415 Стадия 1. Этилхлороформиат (4,3 мл, 44,5 ммоль) по каплям добавляют при 0 С в раствор 3-метоксикоричной кислот (5,3 г, 29,7 ммоль) и триэтиламина (8,3 мл, 59,4 ммоль) в ацетоне (35 мл). Спустя 1 ч при 0 С по каплям добавляют водный раствор азида натрия (3,1 г, 47,5 ммоль, 16 мл воды) и реакционную смесь перемешивают при 23 С в течение 16 ч. К смеси добавляют воду (50 мл) и летучие вещества удаляют в вакууме. Образовавшуюся суспензию экстрагируют толуолом (325 мл) и объединенные органические слои высушивают (MgSO4). Высушенный раствор фильтруют и по каплям добавляют при 190 С в раствор дифенилметана (25 мл) и трибутиламина (14,2 мл, 59,4 ммоль). Толуол отгоняют по мере добавления. По завершении добавления температуру реакционной смеси повышают до 210 С в течение 2 ч. После охлаждения осажденный продукт собирают путем фильтрации, промывают гексаном и сушат в вакууме, получая 6-метокси-2 Н-изохинолин-1-он (1,7 г, 9,7 ммоль, выход 33%). МС m/z 176 (MH). Стадия 2. Суспензию 6-метокси-2 Н-изохинолин-1-она (900 мг, 5,1 ммоль) в POCl3 (4 мл) нагревают при 110 С в течение 3 ч (при нагревании получается прозрачный раствор). Спустя 3 ч, реакционную смесь концентрируют при пониженном давлении. Остаток выливают в ледяную воду (10 мл), затем доводят рН смеси до 10, добавляя 3 н. раствор NaOH, и экстрагируют хлороформом (325 мл). Объединенные хлороформовые слои промывают рассолом и сушат (MgSO4). Затем органический слой фильтруют, концентрируют и очищают методом флэш-хроматографии (50% этилацетата в гексане), чтобы получить 1-хлор-6 метоксиизохинолин (720 мг, 3,7 ммоль, выход 73%) в виде белого твердого вещества. 1H-ЯМР (CD3OD): 8,23 (д, I H, J=8,8 Гц); 8,11 (д, 1 H,J= 6,0 Гц); 7,69 (д, 1 Н, J=6,0 Гц); 7,37-7,33 (м, 2 Н); 3,97 (с, 3 Н). МСm/z 194 (МН). Стадия 3. В раствор промышленно доступного N-трет-ВОС-(2S,4R)-гидроксипролина (684 мг, 2,96 ммоль) в ДМСО (20 мл) добавляют малыми порциями трет-бутоксид калия (997 мг, 8,88 ммоль) в течение 15 мин при 23 С. Смесь перемешивают при 23 С в течение 30 мин и затем охлаждают до 0 С. При 0 С добавляют небольшими порциями 1-хлор-6-метоксиизохинолин (600 мг, 3,11 ммоль) в течение 10 мин. Реакционную смесь перемешивают при 23 С в течение 16 ч. Образовавшуюся суспензию выливают в 5% водный раствор лимонной кислоты (100 мл) и экстрагируют этилацетатом (3 раза по 50 мл). Объединенные этилацетатные слои промывают рассолом и сушат (MgSO4). Затем органический слой фильтруют и концентрируют, чтобы получить 1-трет-бутиловый эфир (2S,4R)-(6-метоксиизохинолин-1-илокси)пирролидин-1,2-дикарбоновой кислоты (1,04 г, 2,68 ммоль, выход 91%) в виде белого твердого вещества. МС m/z 389 (МН). Этот материал используют на следующей стадии в сыром виде, без дополнительной очистки. Стадия 4. К трет-бутиловому эфиру (1S-(циклопропилкарбамоилгидроксиметил)бутил)-карбаминовой кислоты (100 мг, 0,35 ммоль) добавляют 4,0 М раствор HCl в диоксане (10 мл). Спустя 1 ч, реакционную смесь концентрируют и сушат, получая соответствующую соль HCl в виде белого твердого вещества. К указанному выше гидрохлориду амина в смеси дихлорметан/ДМФ (8:3, 11,0 мл) добавляют 1-третбутиловый эфир (2S,4R)-(6-метокси-изохинолин-1-илокси)пирролидин-1,2-дикарбоновой кислоты (136 мг, 0,35 ммоль), HATU (160 мг, 0,42 ммоль) и DIPEA (0,2 мл, 1,05 ммоль). Через 2 ч при комнатной температуре реакционную смесь разбавляют этилацетатом и промывают 1 н. HCl (2 раза), 1 раз растворомNaHCO3 и рассолом (1 раз). Этилацетатный слой сушат (MgSO4), фильтруют и выпаривают досуха, получая трет-бутиловый эфир 2S-[1S-(циклопропилкарбамоилгидроксиметил)бутилкарбамоил]-4R-(6 метоксиизохинолин-1-илокси)пирролидин-1-карбоновой кислоты. Стадия 5. К указанному выше сырому соединению добавляют 4,0 М раствор HCl в диоксане (10 мл). Спустя 1 ч, реакционную смесь концентрируют и сушат, получая соответствующий гидрохлорид в виде белого твердого вещества. К указанному выше гидрохлориду амина в смеси дихлорметан/ДМФ (8:3, 11,0 мл) добавляют 2S-(3-трет-бутилуреидо)-3,3-диметилмасляной кислоты (81,0 мг, 0,35 ммоль), HATU (160 мг,0,42 ммоль) и DIPEA (0,2 мл, 1,05 ммоль). Через 16 ч при комнатной температуре реакционную смесь разбавляют этилацетатом и промывают 2 раза 1 н. HCl, раствором NaHCO3 (1 раз) и рассолом (1 раз). Этилацетатный слой сушат (MgSO4), фильтруют и выпаривают досуха. Стадия 6. Затем сырой продукт растворяют в осушенном дихлорметане (10,0 мл) и добавляют периодинан Десса-Мартина (223 мг, 0,525 ммоль). После перемешивания при комнатной температуре в течение 2 ч,реакцию прерывают, добавляя 0,26 М Na2S2O3 в насыщенном растворе NaHCO3 и экстрагируют этилацетатом (3 раза). Затем объединенные этилацетатные слои промывают насыщенным раствором NaHCO3 (2 раза) и рассолом (1 раз). Очистка методом препаративной ВЭЖХ дает (1S-циклопропиламинооксалилбутил)амид 1-[2S-(3-трет-бутилуреидо)-3,3-диметилбутирил]-4R-(6-метоксиизохинолин-1-илокси)пирролидин-2S-карбоновой кислоты (21) чистотой 95% по данным ВЭЖХ. 1 Н ЯМР: (ДМСО-d6) 8,74 (д, 1 Н, J= 4,8 Гц); 8,28 (д, 1 Н, J= 7,2 Гц); 8,15 (д, 1 Н, J= 9,2 Гц); 7,97 (д, 1 Стадия 1. К гидрохлориду (S)-3-амино-4,N-дициклопропил-2-гидроксибутирамида (47 мг, 0,2 ммоль) в смеси дихлорметан/ДМФ (5:1,5, 6,5 мл) добавляют 1-трет-бутиловый эфир (2S,4R)-(6-метоксиизохинолин-1 илокси)пирролидин-1,2-дикарбоновой кислоты (78 мг, 0,2 ммоль), HATU (91 мг, 0,4 ммоль) и DIPEA (0,1 мл, 0,6 ммоль). Через 16 ч при комнатной температуре реакционную смесь разбавляют этилацетатом,промывают 1 н. HCl-кислотой (2 раза), раствором NaHCO3 (1 раз) и рассолом (1 раз). Этилацетатный слой сушат (MgSO4), фильтруют и выпаривают досуха, получая трет-бутиловый эфир 2S-(2-циклопропилкарбамоил-1S-циклопропилметил-2-гидроксиэтилкарбамоил)-4R-(6-метоксиизохинолин-1-илокси) пирролидин-1-карбоновой кислоты (22). Стадия 2. К указанному выше сырому соединению добавляют 4,0 М раствор HCl в диоксане (5,0 мл). Спустя 1 ч, реакционную смесь концентрируют и сушат, получая соответствующий гидрохлорид в виде белого твердого вещества. К указанному выше гидрохлориду амина в смеси дихлорметан/ДМФ (7:3,10,0 мл) добавляют 2S-(3-трет-бутилуреидо)-3,3-диметилмасляной кислот (46 мг, 0,2 ммоль), HATU (91 мг, 0,24 ммоль) и DIPEA (0,1 мл, 0,6 ммоль). Через 3 ч при комнатной температуре реакционную смесь разбавляют этилацетатом и промывают 1 н. HCl (2 раза), раствором NaHCO3 (1 раз) и рассолом (1 раз). Этилацетатный слой сушат (MgSO4), фильтруют и выпаривают досуха. Стадия 3. Затем неочищенный продукт растворяют в осушенном дихлорметане (8,0 мл) и добавляют периодинан Десса-Мартина (127 мг, 0,3 ммоль). После перемешивания при комнатной температуре в течение 2 ч реакцию прерывают, добавляя 0,26 М Na2S2O3 в насыщенном растворе NaHCO3, и экстрагируют этилацетатом (3 раза). Затем объединенные этилацетатные слои промывают насыщенным раствором NaHCO3(2 раза) и рассолом (1 раз). Очистка методом препаративной ВЭЖХ дает (2-циклопропилкарбамоил-1Sциклопропилметил-2-оксоэтил)амид 1-[2S-(3-трет-бутилуреидо)-3,3-диметилбутирил]-4R-(6-метоксиизохинолин-1-илокси)пирролидин-2S-карбоновой кислоты (23) чистотой 95% по данным ВЭЖХ. MC m/z 679 (МН), 701 (MNa), 677 (М+-Н). Пример 11. Синтез (2-циклопропилкарбамоил-1S-циклопропилметил-2S-оксоэтил)амида 1-[2S-(3 трет-бутилуреидо)-3,3-диметилбутарил]-4R-(6-этокси-изохинолин-1-илокси)пирролидин-2-карбоновой кислоты (26). Стадия 1. Этилхлороформиат (4,3 мл, 44,5 ммоль) по каплям добавляют при 0 С к раствору 3-этоксикоричной кислоты (5,71 г, 29,7 ммоль) и триэтиламина (8,3 мл, 59,4 ммоль) в ацетоне (35 мл). Спустя 1 ч при 0 С,по каплям добавляют водный раствор азида натрия (3,1 г, 47,5 ммоль, 16 мл воды) и реакционную смесь перемешивают при 23 С в течение 16 ч. К смеси добавляют воду (50 мл) и летучие вещества удаляют в вакууме. Образовавшуюся суспензию экстрагируют толуолом (3 раза по 25 мл) и объединенные органические слои сушат (MgSO4). Высушенный раствор фильтруют и по каплям добавляют при 190 С к раствору дифенилметана (25 мл) и трибутиламина (14,2 мл, 59,4 ммоль). Толуол отгоняют по мере добавления. По завершении добавления температуру реакционной смеси повышают до 210 С в течение 2 ч. После охлаждения осажденный продукт собирают путем фильтрации, промывают гексаном и сушат в вакууме, получая 6-этокси-2H-изохинолин-1-он (1,92 г, 10,2 ммоль, выход 34%). МС m/z 190 (МН). Стадия 2. Суспензию 6-этокси-2 Н-изохинолин-1-она (896 мг, 4,74 ммоль) в POCl3 (4 мл) нагревают при 110 С в течение 3 ч (при нагревании образуется прозрачный раствор). Спустя 3 ч, реакционную смесь концентрируют при пониженном давлении. Остаток выливают в ледяную воду (10 мл), затем устанавливают значение рН 10, добавляя 3 н. раствор NaOH, и экстрагируют хлороформом (3 раза по 25 мл). Объединенные хлороформовые слои промывают рассолом и сушат (MgSO4). Затем органический слой фильтруют и концентрируют, чтобы получить 1-хлор-6-этоксиизохинолин (866 мг, 4,18 ммоль, выход 88%, чистота 90%) в виде желтовато-коричневого твердого вещества. МС m/z 208 (МН). Стадия 3. К раствору промышленно доступного N-трет-ВОС-(2S,4R)-гидроксипролина (531 мг, 2,30 ммоль) в ДМСО (20 мл), добавляют малыми порциями трет-бутоксид калия (774 мг, 6,9 ммоль) в течение 15 мин при 23 С. Смесь перемешивают при 23 С в течение 30 мин и затем охлаждают до 0 С. При 0 С добавляют небольшими порциями 1-хлор-6-этоксиизохинолин (500 мг, 2,41 ммоль) в течение 10 мин. Реакционную смесь перемешивают при 23 С в течение 16 ч. Образовавшуюся суспензию выливают в воду и смесь промывают эфиром (2 раза) и этилацетатом (2 раза). Водный слой подкисляют 1 н. соляной кислотой до рН 4 и экстрагируют дихлорметаном (3 раза). Объединенные дихлорметановые слои промывают рассолом и сушат (MgSO4). Затем органический слой фильтруют и концентрируют, чтобы получить 1-третбутиловый эфир (2S,4R)-(6-этоксиизохинолин-1-илокси)пирролидин-1,2-дикарбоновой кислоты (24)(сырой вес = 1,18 г, чистота 90% чистый). МС m/z 403 (МН), 401 (М+-Н), 303 (М+-ВОС). Этот материал используют на следующей стадии в сыром виде, без дополнительной очистки. Стадия 4. К гидрохлориду (S)-3-амино-4,N-дициклопропил-2-гидроксибутирамида (66 мг, 0,28 ммоль) в смеси дихлорметан/ДМФ (10:3,13 мл) добавляют 1-трет-бутиловый эфир (2S,4R)-(6-этоксиизохинолин-1 илокси)пирролидин-1,2-дикарбоновой кислоты (114 мг, 0,28 ммоль), HATU (128 мг, 0,34 ммоль) иDIPEA (0,15 мл, 0,84 ммоль). Спустя 1 ч при комнатной температуре, реакционную смесь разбавляют этилацетатом и промывают 1 н. соляной кислотой (2 раза), раствором NaHCO3 (1 раз) и рассолом (1 раз). Этилацетатный слой сушат (MgSO4), фильтруют и выпаривают досуха, чтобы получить трет-бутиловый- 26015415 эфир 2S-(2-циклопропилкарбамоил-1S-циклопропилметил-2-гидроксиэтилкарбамоил)-4R-(6-этоксиизохинолин-1-илокси)пирролидин-1-карбоновой кислоты (25). Стадия 5. К указанному выше неочищенному соединению добавляют 4,0 М раствор HCl в диоксане (10 мл). Спустя 1 ч, реакционную смесь концентрируют и сушат, получая соответствующий гидрохлорид в виде белого твердого вещества. К указанному выше гидрохлориду амина в смеси дихлорметан/ДМФ (10:3, 13 мл) добавляют 2S-(3-трет-бутилуреидо)-3,3-диметилмасляную кислоту (64 мг, 0,28 ммоль), HATU (128 мг, 0,34 ммоль) и DIPEA (0,15 мл, 0,84 ммоль). Спустя 1 ч при комнатной температуре, реакционную смесь разбавляют этилацетатом и промывают 1 н. соляной кислотой (2 раза), раствором NaHCO3 (1 раз) и рассолом (1 раз). Этилацетатный слой сушат (MgSO4), фильтруют и выпаривают досуха. Стадия 6. Затем неочищенный продукт растворяют в осушенном дихлорметане (10,0 мл) и добавляют периодинан Десса-Мартина (154 мг, 0,364 ммоль). После перемешивания при комнатной температуре в течение 1 ч реакцию прерывают, добавляя 0,26 М Na2S2O3 в насыщенном растворе NaHCO3, и экстрагируют этилацетатом (3 раза). Затем объединенные этилацетатные слои промывают насыщенным раствором NaHCO3 (2 раза), рассолом (1 раз) и сушат (MgSO4). Затем органический слой фильтруют, концентрируют и очищают методом флэш-хроматографии(2 циклопропилкарбамоил-1S-циклопропилметил-2S-оксоэтил)амид 1-[2S-(3-трет-бутил-уреидо)-3,3-диметилбутирил]-4R-(6-этоксиизохинолин-1-илокси)пирролидин-2-карбоновой кислоты (26) (80,7 мг, 0,116 ммоль, выход 42%) в виде белого твердого вещества. 1H ЯМР: (ДМСО) 8,67 (д, 1 Н, J = 5,6 Гц); 8,26 (д, 1 Н, J = 6,8 Гц); 8,06 (д, 1 Н, J= 8,8 Гц); 7,89 (д, 1 Н, J= 5,6 Гц); 7,24-7,22 (м, 1 Н); 7,01-6,98 (дд, 1 Н, J = 2,4,8,8 Гц); 5,90-5,85 (м, 2 Н); 5,65-5,62 (м, 1 Н); 5,06-5,01 (м, 1 Н); 4,53 (т, 1 Н, J=8,0 Гц); 4,26-4,23 (м,1H); 4,16-4,08 (м, 3 Н); 3,84-3,80 (м, 1 Н); 2,69-2,65 (м, 1 Н); 2,11-2,04 (м, 1 Н); 1,64-1,57 (м, 1H); 1,35-1,29 Стадия 1. К трет-бутиловому эфиру [1S-(циклопропилкарбамоилгидроксиметил)бутил]-карбаминовой кислоты (75 мг, 0,26 ммоль) добавляют 4,0 М раствор HCl в диоксане (6,0 мл). Спустя 1 ч, реакционную смесь концентрируют и сушат, получая соответствующий гидрохлорид в виде белого твердого вещества. К указанному выше гидрохлориду амина в смеси дихлорметан/ДМФ (10:3, 13 мл) добавляют 1-третбутиловый эфир (2S,4R)-(6-этоксиизохинолин-1-илокси)пирролидин-1,2-дикарбоновой кислоты (106 мг,0,26 ммоль), HATU (119 мг, 0,31 ммоль) и DIPEA (0,15 мл, 0,78 ммоль). Спустя 1 ч при комнатной температуре реакционную смесь разбавляют этилацетатом и промывают 1 н. соляной кислотой (2 раза), раствором NaHCO3 (1 раз) и рассолом (1 раз). Этилацетатный слой сушат (MgSO4), фильтруют и выпаривают досуха, получая трет-бутиловый эфир 2S-[1S-(циклопропилкарбамоил-гидроксиметил)бутилкарбамоил]-4R-(6-этоксиизохинолин-1-илокси)пирролидин-1-карбоновой кислоты (27). Стадия 2. К указанному выше неочищенному соединению добавляют 4,0 М раствор HCl в диоксане (10 мл). Спустя 1 ч, реакционную смесь концентрируют и сушат, получая соответствующий гидрохлорид в виде- 27015415 белого твердого вещества. К указанному выше гидрохлориду амина в смеси дихлорметан/ДМФ (10:3, 13 мл) добавляют 2S-(3-трет-бутил-уреидо)-3,3-диметилмасляную кислоту (60 мг, 0,26 ммоль), HATU (128 мг, 0,34 ммоль) и DIPEA (0,15 мл, 0,84 ммоль). Спустя 1 ч при комнатной температуре, реакционную смесь разбавляют этилацетатом и промывают 1 н. соляной кислотой (2 раза), раствором NaHCO3 (1 раз) и рассолом (1 раз). Этилацетатный слой сушат (MgSO4), фильтруют и выпаривают досуха. Стадия 3. Затем неочищенный продукт растворяют в осушенном дихлорметане (10,0 мл) и добавляют периодинан Десса-Мартина (143 мг, 0,338 ммоль). После перемешивания при комнатной температуре в течение 1 ч реакцию прерывают, добавляя 0,26 М Na2S2O3 в насыщенном растворе NaHCO3, и экстрагируют этилацетатом (3 раза). Затем объединенные этилацетатные слои промывают насыщенным раствором NaHCO3 (2 раза), рассолом (1 раз) и сушат (MgSO4). Затем органический слой фильтруют, концентрируют и очищают методом флэш-хроматографии (65% этилацетата в гексане), чтобы получить (1Sциклопропиламинооксалилбутил)амид 1-[2S-(3-трет-бутилуреидо)-3,3-диметилбутирил)-4R-(6-этоксиизохинолин-1-илокси)пирролидин-2S-карбоновой кислоты (28) (75,7 мг, 0,11 ммоль, выход 43%) в виде белого твердого вещества. 1H-ЯМР: (ДМСО-d6) 8,75 (д, 1 Н, J = 4,8 Гц); 8,28 (д, 1 Н, J=7,2 Гц); 8,13 (д, 1 Н, J= 8,8 Гц); 7,96 (д, IH, J= 6,0 Гц); 7,31-7,29 (м, 2 Н); 7,10-7,06 (дд, 1H, J= 2,4,9,2 Гц); 5,94-5,92 (м, 2H); 5,72-5,70 (м, 1H); 5,04-5,00 (м, 1H); 4,58 (т, 1 Н, J= 7,6 Гц); 4,34-4,30 (м, 1 Н); 4,23-4,17 (м, 3 Н); 3,90-3,86 Стадия 1. К гидрохлориду циклопропиламида (S)-3-амино-2-гидроксигептановой кислоты (96 мг, 0,40 ммоль) в смеси дихлорметан/ДМФ (10:3,13 мл) добавляют 1-трет-бутиловый эфир (2S,4R)-(6-метоксиизохинолин-1-илокси)пирролидин-1,2-дикарбоновой кислоты (157 мг, 0,40 ммоль), HATU (200 мг, 0,53 ммоль) и DIPEA (0,35 мл, 2,0 ммоль). Спустя 1 ч при комнатной температуре, реакционную смесь разбавляют этилацетатом и промывают 1 н. соляной кислотой (2 раза), раствором NaHCO3 (1 раз) и рассолом(1 раз). Этилацетатный слой сушат (MgSO4), фильтруют и выпаривают досуха, чтобы получить третбутиловый эфир 2S-[1S-(циклопропилкарбамоилгидроксиметил)пентилкарбамоил]-4R-(6-метоксиизохинолин-1-илокси)пирролидин-1-карбоновой кислоты (29). МС m/z 571 (МН), 593 (MNa), 569(М+-Н), 471 (М+-ВОС). Стадия 2. К указанному выше неочищенному соединению добавляют 4,0 М раствор HCl в диоксане (10 мл). Спустя 1 ч при комнатной температуре, реакционную смесь концентрируют и сушат, получая соответствующий гидрохлорид в виде белого твердого вещества. К указанному выше гидрохлориду амина в смеси дихлорметан/ДМФ (10:3, 13 мл) добавляют 2S-(3-трет-бутилуреидо)-3,3-диметилмасляную кислоту (93 мг, 0,40 ммоль), HATU (200 мг, 0,53 ммоль) и DIPEA (0,35 мл, 2,0 ммоль). Спустя 1 ч при комнатной температуре, реакционную смесь разбавляют этилацетатом и промывают 1 н. соляной кислотой (2 раза),NaHCO3 (1 раз) и рассолом (1 раз). Этилацетатный слой сушат (MgSO4), фильтруют и выпаривают досуха. МС m/z 683 МН), 705 (МNa), 681 (М+-Н).- 28015415 Стадия 3. Затем неочищенный продукт растворяют в осушенном дихлорметане (10,0 мл) и добавляют периодинан Десса-Мартина (223 мг, 0,53 ммоль). После перемешивания при комнатной температуре в течение 2 ч реакцию прерывают, добавляя 0,26 М Na2S2O3 в насыщенном растворе NaHCO3, и экстрагируют этилацетатом (3 раза). Затем объединенные этилацетатные слои промывают насыщенным раствором NaHCO3(2 раза), рассолом (1 раз) и сушат (MgSO4). Затем органический слой фильтруют, концентрируют и очищают методом флэш-хроматографии (45% этилацетата в гексане), чтобы получить (1S-циклопропиламинооксалилпентил)амид 1-[2S-(3-трет-бутилуреидо)-3,3 диметилбутирил]-4R-(6-метоксиизохинолин-1-илокси)пирролидин-2S-карбоновой кислоты (30) (83,5 мг, 0,12 ммоль, выход 31 %) в виде белого твердого вещества. 1H ЯМР: (ДМСО) 8,74 (д, 1 Н, J= 4,8 Гц); 8,27 (д, 1 Н, J = 7,2 Гц); 8,15 (д, 1 Н, J Стадия 1. 3-Циклопропил-6-метоксиизохинолин (32). Тетраметилпиперидинлитий получают путем добавления по каплям 2,2,6,6-тетраметилпиперидина(1,0 г; 7,0 ммоль) в THF (17 мл) в 1,6 М раствор н-бутиллития (в гексане; 8,0 ммоль) при -15 С. Спустя 15 мин при -15 С, добавляют раствор циклогексил-(4-метокси-2-метилбензилиден)амина (660 мг; 2,86 ммоль) в THF (3 мл), получая раствор пурпурного цвета. Реакционной смеси дают нагреться до 0 С в течение 20 мин, затем добавляют за один прием раствор N-метил-N-метоксициклопропанкарбоксамида(630 мг: 4,4 ммоль) в THF (2 мл) при температуре 0 С. Реакционную смесь выдерживают при комнатной температуре в течение 30 мин и затем добавляют к насыщенному водному раствору NH4Cl. Раствор экстрагируют диэтиловым эфиром и органическую фазу промывают насыщенным водным раствором NaCl,сушат и концентрируют в вакууме. Остаток растворяют в концентрированном NH4OH (15 мл) и обрабатывают уксусной кислотой (1
МПК / Метки
МПК: A61K 31/74, A61K 47/00, C07K 5/08, A61K 31/00
Метки: ингибиторы, вируса, гепатита, hcv
Код ссылки
<a href="https://eas.patents.su/30-15415-ingibitory-virusa-gepatita-s-hcv.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы вируса гепатита с (hcv)</a>
Предыдущий патент: Смесь для приготовления диетического теста и способ производства мучных изделий на ее основе
Следующий патент: Удаление триоксида серы из потока топочного газа
Случайный патент: Управляемое извне нанесение компаунда на кромки консервных банок