Способ ферментативного рафинирования пищевых масел гидратацией и применение липидацилтрансферазы для осуществления способа
Формула / Реферат
1. Способ ферментативного рафинирования пищевых масел гидратацией, заключающийся в обработке пищевого масла липидацилтрансферазой для того, чтобы перенести ацильную группу с основной части фосфолипида на один или более акцепторов ацила, в котором акцептор ацила представляет собой один или более стеринов и/или станолов и в котором липидацилтрансфераза отличается следующим:
(а) липидацилтрансфераза обладает активностью ацилтрансферазы, которую определяют как активность переноса сложного эфира, причем ацильная часть исходной сложно-эфирной связи липидного донора ацила переносится на акцептор ацила с образованием нового сложного эфира; и
(б) фермент включает мотив последовательности аминокислот GDSX, в котором X представляет собой один или более из следующих остатков аминокислот: L, А, V, I, F, Y, H, Q, T, N, М или S, причем липидацилтрансфераза при сравнительном анализе первичной структуры либо с консенсусной последовательностью SEQ ID NO: 2, либо с SEQ ID NO: 37, либо с обеими указанными последовательностями включает блок GANDY.
2. Способ по п.1, в котором в масле повышается уровень сложного стеринового эфира или сложного станолового эфира.
3. Способ по п.2, в котором акцептор ацила представляет собой стерин.
4. Способ по любому из предшествующих пунктов, в котором фосфолипид представляет собой лецитин.
5. Способ по любому из предшествующих пунктов, в котором липидацилтрансфераза дополнительно переносит ацильную группу с липида по меньшей мере на один углевод, белок, субъединицу белка и глицерин.
6. Способ по любому из предшествующих пунктов, в котором липидацилтрансфераза представляет собой природную липидацилтрансферазу.
7. Способ по любому из предшествующих пунктов, в котором липидацилтрансфераза представляет модифицированный вариант природной липидацилтрансферазы.
8. Способ по любому из предшествующих пунктов, в котором указанная липидацилтрансфераза получена из организма, принадлежащего одному из следующих родов: Aeromonas, Streptomyces, Saccharomyces, Lactococcus, Mycobacterium, Streptococcus, Lactobacillus, Desulfitobacterium, Bacillus, Campylobacter, Vibrionaceae, Xylella, Sulfolobus, Aspergillus, Schizosaccharomyces, Listeria, Neisseria, Mesorhizobium, Ralstonia, Xanthomonas, Candida, Thermobifida и Corynebacterium.
9. Способ по любому из предшествующих пунктов, в котором указанная липидацилтрансфераза получена из одного или более организмов, выбранных из группы, включающей Aeromonas hydrophila, Aeromonas salmonicida, Streptomyces coelicolor, Streptomyces rimosus, Streptomyces thermosacchari, Streptomyces avermitilis, Mycobacterium, Streptococcus pyogenes, Lactococcus lactis, Streptococcus pyogenes, Streptococcus thermophilus, Lactobacillus helveticus, Desulfitobacterium dehalogenans, Bacillus sp, Campylobacter jejuni, Vibrionaceae, Xylella fastidiosa, Sulfolobus solfataricus, Saccharomyces cerevisiae, Aspergillus terreus, Schizosaccharomyces pombe, Listeria innocua, Listeria monocytogenes, Neisseria meningitidis, Mesorhizobium loti, Ralstonia solanacearum, Xanthomonas campestris, Xanthomonas axonopodis, Candida parapsilosis, Thermobifida fusca и Corynebacterium efficiens.
10. Способ по любому из предшествующих пунктов, в котором X мотива GDSX представляет собой L.
11. Способ по любому из предшествующих пунктов, в котором липидацилтрансфераза включает по меньшей мере одну из следующих последовательностей аминокислот: SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14 или SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 36, SEQ ID NO: 38, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 45, SEQ ID NO: 47, SEQ ID NO: 50 или последовательность аминокислот, которая имеет с ними идентичность75% или более.
12. Способ по п.11, в котором липидацилтрансфераза включает по меньшей мере одну последовательность из следующих последовательностей аминокислот: SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 1 или SEQ ID NO: 15 либо последовательность аминокислот, которая имеет с ними идентичность 75% или более.
13. Способ по п.11, в котором липидацилтрансфераза включает по меньшей мере одну последовательность из следующих последовательностей аминокислот: SEQ ID NO: 36, SEQ ID NO: 38, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 45, SEQ ID NO: 47, SEQ ID NO: 50 или последовательность аминокислот, которая имеет с ними идентичность 70% или более.
14. Способ по п.11, в котором липидацилтрансфераза включает по меньшей мере одну последовательность из SEQ ID NO: 17 или SEQ ID NO: 18 либо последовательность аминокислот, гомологичную указанным на 70% или более.
15. Способ по п.11, в котором липидацилтрансфераза включает последовательность аминокислот SEQ ID NO: 16 или последовательность аминокислот, гомологичную указанной на 75% или более.
16. Способ по п.11, в котором липидацилтрансфераза включает последовательность аминокислот SEQ ID NO: 16.
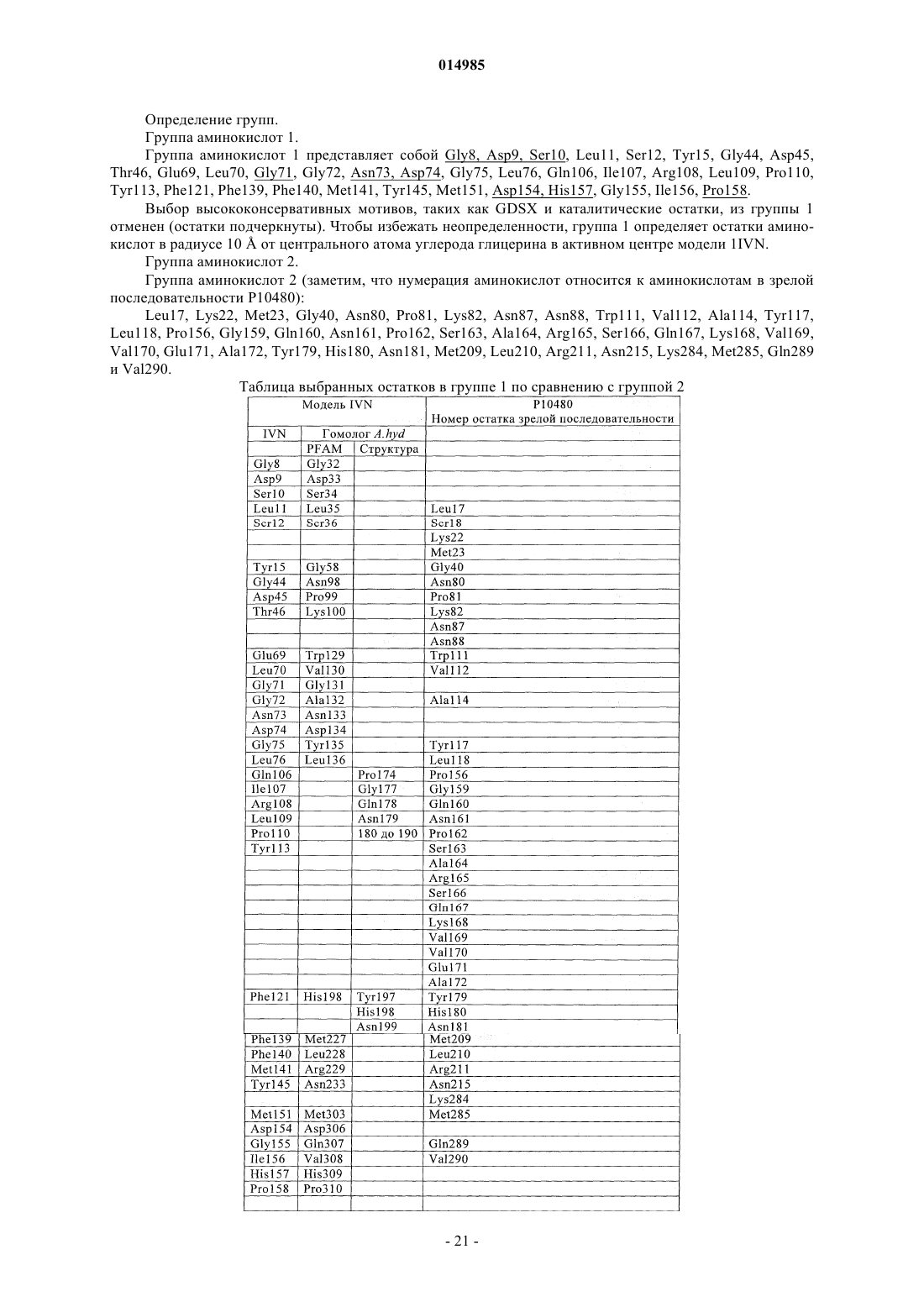
17. Способ по п.7, в котором вариант фермента включает одну или более модификаций аминокислот сравнительно с исходной последовательностью по крайней мере в одном из остатков аминокислот Ser3; Phe13Ser; Asp15Asn, Leu17; Ser18x (где х выбирают из Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Thr, Try или Tyr), Lys22, Met23, Tyr30x (где х выбирают из Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Try); Gly40; Asn80; Pro81; Lys82, Asn87; Asn88; Trp111; Val112; Ala114; Asp116Asn или Glu; Tyr117; Leu118; Pro156; Asp157Asn; Gly159; Gln160; Asn161; Pro162; Ser163; Ala164; Arg165; Ser166; Gln167; Lys168; Val169; Val170; Gln171; Ala172; Tyr179; His180; Asn181; Gln182; Met209; Leu210; Arg211; Asn215; Tyr226x (где х выбирают из Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Try); Asp228Asn; Try230x (где х выбирают из Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Try); Lys284; Met285; Gln289; Val290; Glu309; Ser310 и 318.
18. Способ по п.7 или 17, в котором липидацилтрансфераза включает последовательность аминокислот SEQ ID NO: 16 или последовательность аминокислот, гомологичную указанной на 75% или более.
19. Способ по п.7 или 17, в котором липидацилтрансфераза включает последовательность аминокислот SEQ ID NO: 16.
20. Способ по любому из предшествующих пунктов, в котором пищевое масло во время обработки включает менее чем 1% воды.
21. Способ по п.20, в котором масло включает менее чем 0,5% воды.
22. Способ по п.21, в котором масло включает менее чем 0,1% воды.
23. Способ по любому из предшествующих пунктов, который включает удаление лизофосфолипидов, образующихся под действием липидацилтрансферазы, посредством фильтрования.
24. Применение липидацилтрансферазы, отличающейся тем, что:
(а) липидацилтрансфераза обладает активностью ацилтрансферазы, которую определяют как активность переноса сложного эфира, причем ацильная часть исходной сложно-эфирной связи липидного донора ацила переносится на акцептор ацила с образованием нового сложного эфира; и
(б) фермент включает мотив последовательности аминокислот GDSX, в котором X представляет собой один или более из следующих остатков аминокислот: L, А, V, I, F, Y, H, Q, T, N, М или S, причем липидацилтрансфераза при сравнительном анализе первичной структуры либо с консенсусной последовательностью SEQ ID NO: 2, либо с SEQ ID NO: 37, либо с обеими указанными последовательностями включает блок GANDY, в рафинировании пищевых масел гидратацией для удаления фосфолипидов и повышения уровня образования сложных стериновых эфиров и/или сложных станоловых эфиров в масле.
25. Применение по п.24, при котором не происходит существенного повышения уровня свободных жирных кислот в масле после обработки.
26. Применение по п.24 или 25, в котором фосфолипид представляет собой лецитин.
27. Применение по любому из пп.24-26, в котором липидацилтрансфераза представляет собой природную липидацилтрансферазу.
28. Применение по любому из пп.24-27, в котором липидацилтрансфераза представляет модифицированный вариант природной липидацилтрансферазы.
29. Применение по любому из пп.24-28, в котором указанная липидацилтрансфераза получена из организма, принадлежащего к одному из следующих родов: Aeromonas, Streptomyces, Saccharomyces, Lactococcus, Mycobacterium, Streptococcus, Lactobacillus, Desulfitobacterium, Bacillus, Campylobacter, Vibrionaceae, Xylella, Sulfolobus, Aspergillus, Schizosaccharomyces, Listeria, Neisseria, Mesorhizobium, Ralstonia, Xanthomonas, Candida, Thermobifida и Corynebacterium.
30. Применение по любому из пп.24-29, в котором липидацилтрансфераза получена из одного или более организмов, выбранных из группы, включающей Aeromonas hydrophila, Aeromonas salmonicida, Streptomyces coelicolor, Streptomyces rimosus, Streptomyces thermosacchari, Streptomyces avermitilis, Mycobacterium, Streptococcus pyogenes, Lactococcus lactis, Streptococcus pyogenes, Streptococcus thermophilus, Lactobacillus helveticus, Desulfitobacterium dehalogenans, Bacillus sp, Campylobacter jejuni, Vibrionaceae, Xylella fastidiosa, Sulfolobus solfataricus, Saccharomyces cerevisiae, Aspergillus terreus, Schizosaccharomyces pombe, Listeria innocua, Listeria monocytogenes, Neisseria meningitidis, Mesorhizobium loti, Ralstonia solanacearum, Xanthomonas campestris, Xanthomonas axonopodis, Candida parapsilosis, Thermobifida fusca и Corynebacterium efficiens.
31. Применение по любому из пп.24-30, в котором X мотива GDSX представляет собой L.
32. Применение по любому из пп.24-31, в котором липидацилтрансфераза включает по меньшей мере одну из следующих последовательностей аминокислот: SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14 или SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 36, SEQ ID NO: 38, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 45, SEQ ID NO: 47, SEQ ID NO: 50 или последовательность аминокислот, которая имеет с ними идентичность 75% или более.
33. Применение по п.32, в котором липидацилтрансфераза включает по меньшей мере одну последовательность из следующих последовательностей аминокислот: SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 1 или SEQ ID NO: 14 либо последовательность аминокислот, которая имеет с ними идентичность 75% или более.
34. Применение по п.32, в котором липидацилтрансфераза включает по меньшей мере одну последовательность из следующих последовательностей аминокислот: SEQ ID NO: 36, SEQ ID NO: 38, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 45, SEQ ID NO: 47, SEQ ID NO: 50 или последовательность аминокислот, которая имеет с ними идентичность 75% или более.
35. Применение по п.32, в котором липидацилтрансфераза включает по меньшей мере одну последовательность из SEQ ID NO: 17 или SEQ ID NO: 18 либо последовательность аминокислот, гомологичную указанным на 75% или более.
36. Применение по п.32, в котором липидацилтрансфераза включает последовательность аминокислот SEQ ID NO: 16 или последовательность аминокислот, гомологичную указанным на 75% или более.
37. Применение по п.32, в котором липидацилтрансфераза включает последовательность аминокислот SEQ ID NO: 16.
38. Применение по п.28, в котором липидацилтрансфераза отличается тем, что фермент включает мотив последовательности аминокислот GDSX, в котором X представляет собой один или более из следующих остатков аминокислот: L, А, V, I, F, Y, H, Q, T, N, М или S и в котором вариант фермента включает одну или более модификаций аминокислот сравнительно с исходной последовательностью в любом одном или более остатков аминокислот: Ser3; Phe13Ser; Asp15Asn, Leu17; Ser18x (где х выбирают из Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Thr, Try или Tyr), Lys22, Met23, Tyr30x (где х выбирают из Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Try); Gly40; Asn80; Pro81; Lys82, Asn87; Asn88; Trp111; Val112; Ala114; Asp116Asn или Glu; Tyr117; Leu118; Pro156; Asp157Asn; Gly159; Gln160; Asn161; Pro162; Ser163; Ala164; Arg165; Ser166; Gln167; Lys168; Val169; Val170; Gln171; Ala172; Tyr179; His180; Asn181; Gln182; Met209; Leu210; Arg211; Asn215; Tyr226x (где х выбирают из Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Try); Asp228Asn; Try230x (где х выбирают из Ala, Cys, Asp, Glu, Phe, Gly, His, Ile, Lys, Leu, Met, Asn, Pro, Gln, Arg, Ser, Thr, Val или Try); Lys284; Met285; Gln289; Val290; Glu309; Ser310 и 318.
39. Применение по п.28, в котором липидацилтрансфераза включает последовательность аминокислот SEQ ID NO: 16 или последовательность аминокислот, гомологичную указанной на 75% или более.
40. Применение по п.39, в котором липидацилтрансфераза включает последовательность аминокислот SEQ ID NO: 16.
41. Применение по любому из пп.24-40, в котором пищевое масло во время обработки включает менее чем 1% воды.
42. Применение по п.41, в котором масло включает менее чем 0,5% воды.
43. Применение по п.42, в котором масло включает менее чем 0,1% воды.
Текст
СПОСОБ ФЕРМЕНТАТИВНОГО РАФИНИРОВАНИЯ ПИЩЕВЫХ МАСЕЛ ГИДРАТАЦИЕЙ И ПРИМЕНЕНИЕ ЛИПИДАЦИЛТРАНСФЕРАЗЫ ДЛЯ ОСУЩЕСТВЛЕНИЯ СПОСОБА Изобретение относится к способу ферментативного рафинирования гидратацией пищевых масел,заключающемуся в обработке пищевого масла липидацилтрансферазой для того, чтобы перенести ацильную группу с основной части фосфолипида на один или более акцепторов ацила, в котором акцептор ацила представляет собой один или более стеринов и/или станолов и в котором липидацилтрансфераза отличается следующим: (а) липидацилтрансфераза обладает активностью ацилтрансферазы, которую определяют как активность переноса сложного эфира, причем ацильная часть исходной сложно-эфирной связи липидного донора ацила переносится на акцептор ацила с образованием нового сложного эфира; и (б) фермент включает мотив последовательности аминокислот GDSX, в котором X представляет собой один или более из следующих остатков аминокислот: L, А, V, I, F, Y, H, Q, T, N, М или S, причем липидацилтрансфераза при сравнительном анализе первичной структуры либо с консенсусной последовательностью SEQ ID NO:2,либо с SEQ ID NO:37, либо с обеими указанными последовательностями включает блок GANDY. Кроме того, в изобретении раскрыто применение указанной липидацилтрансферазы для осуществления способа. 014985 Ссылка на родственные заявки Делают ссылку на следующие родственные заявки: заявка США 09/750990, поданная 20 июля 1999 г., заявка США 10/409391, WO 2004/064537, WO 2004/064987, PCT/IB 2004/004378 и РСТ/IB 2004/004374. Каждая из данных заявок и каждый из документов, приведенных в каждой из данных заявок ("документы, приведенные в заявке"), и каждый документ, на который ссылаются или приводят в документах, приведенных в заявке, как в тексте, так и во время ведения дела по данным заявкам, а также все аргументы в поддержку патентоспособности, выдвигаемые во время данного ведения дела,включены таким образом в данном контексте в виде ссылки. В данном тексте также приведены различные документы ("документы, приведенные в данном контексте"). Каждый из приведенных в данном контексте документов и каждый документ, приведенный или на который ссылаются в данном контексте,включены таким образом в данном контексте в виде ссылки. Область изобретения Настоящее изобретение относится к способу ферментативного рафинирования пищевых масел гидратацией с использованием липидацилтрансферазы. Кроме того, настоящее изобретение далее относится к применению липидацилтрансферазы для рафинирования пищевых масел гидратацией. Предшествующий уровень техники Традиционно для рафинирования масла гидратацией использовали два способа, которые представляют собой способы физического рафинирования гидратацией и химического рафинирования гидратацией. Ранее в 1990-е годы был разработан ферментативный способ рафинирования гидратацией на основе использования фосфолипазы поджелудочной железы. Поскольку данный фермент некошерный, фосфолипазу со временем заменили микробной фосфолипазой A1 (Lecitase Ultra - Novozymes, Дания). Ферментативный способ имеет некоторые преимущества относительно химического или физического способов рафинирования гидратацией, включая снижение себестоимости, повышенный выход и процесс, более благоприятный для окружающей среды. Краткое изложение аспектов настоящего изобретения Термин "липидацилтрансфераза", как используют в данном контексте, означает фермент, который обладает активностью ацилтрансферазы (как правило, классифицируемой как Е.С. 2.3.1.x), причем фермент, который способен переносить ацильную группу с липида на один или более акцепторных субстратов, таких как один или более из следующих: стерин, станол, углевод, белок, белковая субъединица, глицерин, предпочтительно стерин и/или станол. Фермент липидацилтрансфераза, представленный в настоящем изобретении или предназначенный для использования в способах и/или вариантах применения настоящего изобретения, может быть охарактеризован с помощью следующих критериев:(i) фермент обладает активностью ацилтрансферазы, которую можно определить как активность переноса сложного эфира, причем ацильная часть исходной эфирной связи липидного донора ацила переносится на акцептор ацила с образованием нового сложного эфира; и(ii) фермент включает мотив последовательности аминокислот GDSX, в котором X означает один или более следующих остатков аминокислот: L, А, V, I, F, Y, Н, Q, T, N, М или S,причем липидацилтрансфераза при сравнительном анализе первичной структуры с консенсусной последовательностью либо SEQ ID NO: 2, либо SEQ ID NO: 37, либо с обеими указанными последовательностями включает блок GANDY. Предпочтительно, когда X мотива GDSX представляет собой L или Y. Более предпочтительно, когда X мотива GDSX представляет собой L. Таким образом, предпочтительно, когда фермент, представленный в настоящем изобретении, включает мотив последовательности аминокислот GDSL. Мотив GDSX состоит из четырех консервативных аминокислот. Предпочтительно, когда серин в мотиве представляет собой каталитический серин фермента липидацилтрансферазы. Соответственно серин мотива GDSX может находиться в положении, соответствующем Ser16 в липолитическом ферменте Aeromonas hydrophila, описанном в статье BrumlikBuckley (Journal of Bacteriology Apr. 1996,v. 178, No. 7, p. 2060-2064). Для того чтобы определить, включает ли белок мотив GDSX, представленный в настоящем изобретении, последовательность сравнивают с профилями скрытой модели Маркова (профилями НММ) базы данных pfam согласно методам, описанным в заявке WO 2004/064537 или WO 2004/064987.Pfam является базой данных семейств белковых доменов и включает скорректированные элайнменты множества последовательностей для каждого семейства, а также профили скрытых моделей Маркова(профиль HMMs) для идентификации данных доменов в новых последовательностях. Введение в pfam можно найти в статье Bateman A. et al. (2002), Nucleic Acids Res. 30; 276-280. Скрытые модели Маркова используют в ряде баз данных, целью которых является классификация белков, в качестве обзора см. статью Bateman A. and Haft D.H. (2002), Brief Bioinform, 3; 236-245.-1 014985 Реферат. В плане подробного объяснения скрытых моделей Маркова и того, как их применяют в базе данныхHammer можно получить в Washington University, St. Louis, USA. Альтернативно, мотив GDSX можно идентифицировать с использованием пакета программ Hammersoftware package, инструкции представлены в монографии Durbin R., Eddy S. and Krogh A. (1998),Biological sequence analysis; probabilistic models of proteins and nucleic acids. Cambridge University Press,ISBN 0-521-62041-4 и в ссылках в данной работе, и профиль HMMER2 приведен в данном описании. К базе данных pfam можно получить доступ, например, через ряд серверов, которые в настоящее время находятся на следующих веб-сайтах:http://pfam.cgb.ki.se/. База данных обеспечивает возможность поиска, при котором можно войти в последовательность белка. Используя заданные по умолчанию параметры базы данных, затем анализируют последовательность белка на присутствие доменов pfam. Домен GDSX является широко известным доменом в базе данных, и вследствие этого его присутствие будет распознано в любой запрашиваемой последовательности. База данных даст ответ относительно сравнительного анализа консенсусной последовательностиpfam00657 с запрашиваемой последовательностью. Фермент липидацилтрансфераза, предназначенный для использования в способах и вариантах применения изобретения, может быть подвергнут сравнительному анализу с использованием консенсусной последовательности pfam00657 (в плане полного объяснения см. заявку WO 2004/064537 илиWO 2004/064987). Предпочтительно, когда положительное соответствие с профилем скрытой модели Маркова (профиль НММ) семейства домена pfam00657 указывает на присутствие домена GDSL или GDSX, соответствующего настоящему изобретению. Предпочтительно, когда остатки мотива GANDY выбраны из GANDY, GGNDA, GGNDL, наиболее предпочтительно GANDY. Предпочтительно, когда подвергнутый сравнительному анализу с консенсусной последовательностью pfam00657 фермент, предназначенный для использования в способах и вариантах применения изобретения, имеет по меньшей мере 1, предпочтительно более чем 1, предпочтительно более чем 2, предпочтительно более чем 3, предпочтительно более чем 4, предпочтительно более чем 5, предпочтительно более чем 6, предпочтительно более чем 7, предпочтительно более чем 8, предпочтительно более чем 9,предпочтительно более чем 10, предпочтительно более чем 11, предпочтительно более чем 12, предпочтительно более чем 13, предпочтительно более чем 14 следующих остатков аминокислот по сравнению с эталонной полипептидной последовательностью A.hydrophilia, а именно: SEQ ID NO: 1: Hid28, Hid29,Hid30, Hid31, Gly32, Asp33, Ser34, Hid35, Hid130, Gly131, Hid132, Asn133, Asp134, Hid135, His309. Домен pfam00657 GDSX является уникальным идентификатором, который отличает белки, имеющие данный домен, от других ферментов. Консенсусная последовательность pfam00657 представлена на фиг. 12 как SEQ ID NO: 2. Она получена при идентификации семейства pfam 00657, база данных version 6, которая также может быть обозначена в данном контексте как pfam00657.6. Консенсусную последовательность можно обновить, используя следующие выпуски базы данныхpfam (см., например, заявки WO 2004/064537 или WO 2004/064987). Присутствие блока GANDY обнаруживают в семействе 00657 pfam из обоих выпусков базы данных. Дальнейшие выпуски базы данных pfam можно использовать для идентификации семейства 00657pfam. В одном варианте осуществления фермент липидацилтрансфераза, предназначенный для использования в способах и вариантах применения изобретения, может быть охарактеризован с использованием следующих критериев:(i) фермент обладает активностью ацилтрансферазы, которую можно определить как активность переноса сложного эфира, причем ацильная часть исходной эфирной связи липидного донора ацила переносится на акцептор ацила с образованием нового эфира;(ii) фермент включает мотив последовательности аминокислот GDSX, в котором X означает один или более следующих остатков аминокислот: L, А, V, I, F, Y, H, Q, T, N, М или S;(iii) фермент включает His309 или включает остаток гистидина в положении, соответствующем-2 014985 Предпочтительно, когда остатком аминокислоты мотива GDSX является L. В SEQ ID NO: 3 или SEQ ID NO: 1 первые 18 остатков аминокислот образуют сигнальную последовательность. His309 последовательности полной длины, которая представляет собой белок, включающий сигнальную последовательность, приравнивают к His291 зрелой части белка, т.е. последовательности без сигнальной последовательности. В одном варианте осуществления фермент липидацилтрансфераза, предназначенный для использования в способах и вариантах применения настоящего изобретения, включает следующую каталитическую триаду: Ser34, Asp134 и His309 или содержит остаток серина, остаток аспарагиновой кислоты и остаток гистидина соответственно в положениях, соответствующих Ser34, Asp134 и His309 в ферменте липидацилтрансферазе Aeromonas hydrophila, представленном на фиг. 13 (SEQ ID NO: 3) или фиг. 11SEQ ID NO: 1, первые 18 остатков аминокислот образуют сигнальную последовательность. Ser34,Asp134 и His309 последовательности полной длины, которая представляет собой белок, включающий сигнальную последовательность, приравнивают к Ser16, Asp116 и His291 зрелой части белка, т.е. последовательности без сигнальной последовательности. В консенсусной последовательности pfam00657, как приводят на фиг. 12 (SEQ ID NO: 2), остатки активного центра соответствуют Ser7, Asp157 иHis348. В одном варианте осуществления фермент липидацилтрансфераза, предназначенный для использования в способах и вариантах применения настоящего изобретения, можно охарактеризовать, используя следующие критерии:(i) фермент обладает активностью ацилтрансферазы, которую можно определить как активность переноса сложного эфира, причем ацильная часть исходной эфирной связи первого липидного донора ацила переносится на акцептор ацила с образованием нового эфира;(ii) фермент включает, по меньшей мере, Gly32, Asp33, Ser34, Asp134 и His309 или содержит остатки глицина, аспарагиновой кислоты, серина, аспарагиновой кислоты и гистидина в положениях, соответствующих Gly32, Asp33, Ser34, Asp134 и His309 соответственно, в ферменте липидацилтрансферазеAeromonas hydrophila, приведенном на фиг. 13 (SEQ ID NO: 3) или фиг. 11 (SEQ ID NO: 1). Соответственно фермент липидацилтрансфераза, предназначенный для использования в способах и вариантах применения настоящего изобретения, включает одну или более следующих последовательностей аминокислот:(xiv) последовательность аминокислот, показанную как SEQ ID NO: 15 (см. фиг. 25) или последовательность аминокислот, которая имеет идентичность 75% или более с любой из последовательностей, показанных как SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5,SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11,SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14 или SEQ ID NO: 15. Соответственно фермент липидацилтрансфераза, предназначенный для использования в способах и вариантах применения настоящего изобретения, включает либо последовательность аминокислот, показанную как SEQ ID NO: 3, или SEQ ID NO: 4, или SEQ ID NO: 1, или SEQ ID NO: 15, либо включает последовательность аминокислот, которая имеет идентичность 75% или более, предпочтительно 80% или более, предпочтительно 85% или более, предпочтительно 90% или более, предпочтительно 95% или более с последовательностью аминокислот, показанной как SEQ ID NO: 3, или последовательностью аминокислот, показанной как SEQ ID NO: 4, или последовательностью аминокислот, показанной какSEQ ID NO: 1, или последовательностью аминокислот, показанной как SEQ ID NO: 15. Соответственно фермент липидацилтрансфераза, предназначенный для использования в способах и вариантах применения настоящего изобретения, включает последовательность аминокислот, которая имеет идентичность 80% или более, предпочтительно 85% или более, более предпочтительно 90% или более и еще более предпочтительно 95% или более с любой из последовательностей, показанной какSEQ ID NO: 15. Соответственно фермент липидацилтрансфераза, предназначенный для использования в способах и вариантах применения настоящего изобретения, включает одну или более следующих последовательностей аминокислот:(а) последовательность аминокислот, показанную как остатки аминокислот 1-100 SEQ ID NO: 3 или(б) последовательность аминокислот, показанную как остатки аминокислот 101-200 SEQ ID NO: 3 или SEQ ID NO: 1;(в) последовательность аминокислот, показанную как остатки аминокислот 201-300 SEQ ID NO: 3 или SEQ ID NO: 1; либо(г) последовательность аминокислот, которая имеет идентичность 75% или более, предпочтительно 85% или более, более предпочтительно 90% или более, еще более предпочтительно 95% или более с любой из последовательностей аминокислот, определенных в (а)-(с) выше. Соответственно фермент липидацилтрансфераза, предназначенный для использования в способах и вариантах применения настоящего изобретения, включает одну или более следующих последовательностей аминокислот:(а) последовательность аминокислот, показанную как остатки аминокислот 28-39 SEQ ID NO: 3 или(б) последовательность аминокислот, показанную как остатки аминокислот 77-88 SEQ ID NO: 3 или(в) последовательность аминокислот, показанную как остатки аминокислот 126-136 SEQ ID NO: 3 или SEQ ID NO: 1;(г) последовательность аминокислот, показанную как остатки аминокислот 163-175 SEQ ID NO: 3 или SEQ ID NO: 1;(д) последовательность аминокислот, показанную как остатки аминокислот 304-311 SEQ ID NO: 3 или SEQ ID NO: 1; или(е) последовательность аминокислот, которая имеет идентичность 75% или более, предпочтительно 85% или более, более предпочтительно 90% или более, еще более предпочтительно 95% или более с любой из последовательностей аминокислот, определенных в (а)-(е) выше. В одном аспекте липидацилтрансфераза, предназначенная для использования в способах и вариантах применения настоящего изобретения, может представлять собой липидацилтрансферазу из Candidaparapsilosis, как описано в заявке ЕР 1275711. Таким образом, в одном аспекте липидацилтрансфераза,предназначенная для использования в способе и вариантах применения настоящего изобретения, может представлять собой липидацилтрансферазу, включающую одну из последовательностей аминокислот,описанных в SEQ ID NO: 17 (см. фиг. 28) или SEQ ID NO: 18 (см. фиг. 29). Более предпочтительно, когда липидацилтрансфераза, предназначенная для использования в способе и вариантах применения настоящего изобретения, может представлять собой липидацилтрансферазу,включающую последовательность аминокислот, показанную как SEQ ID NO: 16 (см. фиг. 10), или последовательность аминокислот, которая имеет идентичность 75% или более, предпочтительно 85% или более, более предпочтительно 90% или более, еще более предпочтительно 95% или более, еще более предпочтительно 98% или более либо еще более предпочтительно 99% или более с SEQ ID NO: 16. Данный фермент можно рассматривать как вариант фермента. В одном аспекте липидацилтрансфераза, предназначенная для использования в способе и вариантах применения настоящего изобретения, может представлять собой лецитин: холестеринацилтрансферазу(LCAT) или ее вариант (например, вариант, полученный путем молекулярной эволюции). Подходящие LCAT известны в области техники, и их можно получить из одного или более следующих организмов, например млекопитающих, крыс, мышей, кур, Drosophila melanogaster, растений, в том числе Arabidopsis и Oryza saliva, нематод, грибов и дрожжей. В одном варианте осуществления фермент липидацилтрансфераза, предназначенный для использования в способах и вариантах применения настоящего изобретения, может представлять собой липидацилтрансферазу, получаемую и предпочтительно полученную из штаммов Е.coli ТОР 10, несущихpPet12aAhydro и pPet12aASalmo, депонированных фирмой Danisco A/S of Langebrogade 1, DK-1001, Копенгаген К, Дания, согласно Будапештскому договору о международном признании депонирования микроорганизмов для целей патентной процедуры в Национальной коллекции промышленных, морских и пищевых бактерий (NCIMB), 23 St. Machar Street, Абердин, Шотландия, GB, 22 декабря 2003 г. под регистрационными номерами NICMB 41204 и NCIMB 41205 соответственно. Весьма предпочтительные липидацилтрансферазы, предназначенные для использования в способах,предложенных в настоящем изобретении, включают выделенные из Aeromonas spp., предпочтительноAeromonas hydrophila или А.salmonicida, наиболее предпочтительно A.salmonicida. Наиболее предпочтительные липидацилтрансферазы, предназначенные для применения в настоящем изобретении, кодируются SEQ ID NO: 1, 3, 4, 15, 16. Компетентный специалист признает, что предпочтительно, чтобы сигнальные пептиды ацилтрансферазы отщеплялись в процессе экспрессии трансферазы. Сигнальный пептидSEQ ID NO: 1, 3, 4, 15 и 16 представляет собой аминокислоты 1-18. Вследствие этого наиболее предпочтительными участками являются аминокислоты 19-335 для SEQ ID NO: 1 и SEQ ID NO: 3 (A.hydrophilia) и аминокислоты 19-336 для SEQ ID NO: 4, SEQ ID NO: 15 и SEQ ID NO: 16. (A.salmonicida). При использовании для определения гомологии или идентичности последовательностей аминокислот предпочтительно, чтобы при сравнительном анализе, как описано в данном контексте, использовали зрелую последовательность. Вследствие этого наиболее предпочтительными участками для определения гомологии (идентичности) являются аминокислоты 19-335 для SEQ ID NO: 1 и 3 (A.hydrophilia) и аминокислоты 19-336 дляSEQ ID NO: 4, 15 и 16. (А.salmonicida). SEQ ID NO: 34 и 35 являются последовательностями зрелого белка весьма предпочтительных липидацилтрансфераз из A.hydrophilia и А.Salmonicida соответственно. Липидацилтрансфераза, предназначенная для использования в изобретении, может быть также выделена из Thermobifida, предпочтительно Т.fusca, наиболее предпочтительной является кодируемаяSEQ ID NO: 28. Липидацилтрансфераза, предназначенная для использования в изобретении, может быть также выделена из Streptomyces, предпочтительно S.avermitis, наиболее предпочтительной является кодируемаяSEQ ID NO: 32. Другие возможные ферменты из Streptomyces, предназначенные для использования в настоящем изобретении, включают кодируемые SEQ ID NO: 5, 6, 9, 10, 11, 12, 13, 14, 31, 33. Примеры показывают, что фермент, кодируемый SEQ ID NO: 33, высокоэффективен при ферментативном рафинировании гидратацией. Фермент, предназначенный для использования в изобретении, может быть также выделен изCorynebacterium, предпочтительно С.efficiens, наиболее предпочтительным является кодируемыйSEQ ID NO: 29. Соответственно липидацилтрансфераза, предназначенная для использования в способах и вариантах применения, соответствующих настоящему изобретению, может представлять собой липидацилтрансферазу, включающую любую из последовательностей аминокислот, показанную какSEQ ID NO: 37, 38, 40, 41, 43, 45 или 47, либо последовательность аминокислот, которая идентична указанным по меньшей мере на 70, 75, 80, 85, 90, 95, 96, 97 или 98% или кодируется любой из нуклеотидных последовательностей, показанных как SEQ ID NO: 36, 39, 42, 44, 46 или 48, либо нуклеотидными последовательностями, которые идентичны указанным по меньшей мере на 70, 75, 80, 85, 90, 95, 96, 97 или 98%. Предпочтительно, когда липидацилтрансфераза, предназначенная для использования в способах и вариантах применения, соответствующих настоящему изобретению, представляет собой липидацилтрансферазу, способную гидролизовать, по меньшей мере, галактолипиды и/или способную переносить ацильную группу, по меньшей мере, из галактолипида на один или более субстратов акцептора ацила,причем получаемый фермент предпочтительно получен из Streptomyces species. В одном варианте осуществления липидацилтрансфераза, предназначенная для использования в способах и вариантах применения, соответствующих настоящему изобретению, предпочтительно представляет собой липидацилтрансферазу, способную гидролизовать, по меньшей мере, галактолипиды и/или способную переносить ацильную группу, по меньшей мере, из галактолипида на один или более субстратов акцептора ацила, причем фермент кодируется нуклеиновой кислотой, выбранной из группы,состоящей из:(б) нуклеиновой кислоты, которая является родственной нуклеотидной последовательностиSEQ ID NO: 36 вследствие вырождения генетического кода, и(в) нуклеиновой кислоты, включающей нуклеотидную последовательность, которая идентична по меньшей мере на 70% с нуклеотидной последовательностью, показанной в SEQ ID NO: 36. В одном варианте осуществления липидацилтрансфераза, предназначенная для использования в способах и вариантах применения, соответствующих настоящему изобретению, предпочтительно представляет собой липидацилтрансферазу, включающую последовательность аминокислот, как показано вSEQ ID NO: 37, или последовательность аминокислот, которая идентична ей по меньшей мере на 60%. В другом варианте осуществления липидацилтрансфераза, предназначенная для использования в способах и вариантах применения, соответствующих настоящему изобретению, предпочтительно представляет собой липидацилтрансферазу, способную гидролизовать, по меньшей мере, галактолипид и/или способную переносить ацильную группу, по меньшей мере, с галактолипида на один или более субстратов акцептора ацила, причем фермент включает последовательность аминокислот, как показано вSEQ ID NO: 37, или последовательность аминокислот, которая идентична ей по меньшей мере на 60%. Предпочтительно, когда липидацилтрансфераза, предназначенная для использования в способах и вариантах применения, соответствующих настоящему изобретению, представляет собой липидацилтрансферазу, способную гидролизовать, по меньшей мере, галактолипиды, и/или способна переносить ацильную группу, по меньшей мере, с галактолипида на один или более субстратов акцептора ацила,причем получаемый фермент предпочтительно получен из Thermobifida species, предпочтительноThermobifida fusca. Предпочтительно, когда липидацилтрансфераза, предназначенная для использования в способах и вариантах применения, соответствующих настоящему изобретению, представляет собой липолитический фермент, способный гидролизовать, по меньшей мере, галактолипиды и/или способный переносить ацильную группу, по меньшей мере, с галактолипида на один или более субстратов акцептора ацила,причем получаемый фермент предпочтительно получен из Corynebacterium species, предпочтительноCorynebacterium efficiens. В следующем варианте осуществления липидацилтрансфераза, предназначенная для использования в способах и вариантах применения, соответствующих настоящему изобретению, может представлять собой липидацилтрансферазу, включающую любую из последовательностей аминокислот, показанных как SEQ ID NO: 37, 38, 40, 41, 43, 45 или 47, или последовательность аминокислот, которая идентична указанным по меньшей мере на 70, 75, 80, 85, 90, 95, 96, 97 или 98%, либо кодируемую любой из нуклеотидных последовательностей, показанных как SEQ ID NO: 39, 42, 44, 46 или 48, либо нуклеотидной последовательностью, которая идентична указанным по меньшей мере на 70, 75, 80, 85, 90, 95, 96, 97 или 98%. В следующем варианте осуществления липидацилтрансфераза, предназначенная для использования в способах и вариантах применения, соответствующих настоящему изобретению, может представлять собой липидацилтрансферазу, включающую любую из последовательностей аминокислот, показанную как SEQ ID NO: 38, 40, 41, 45 или 47, либо последовательность аминокислот, которая идентична указанным по меньшей мере на 70, 75, 80, 85, 90, 95, 96, 97 или 98%, предназначенную для вариантов применения, описанных в данном контексте. В следующем варианте осуществления липидацилтрансфераза, предназначенная для использования в способах и вариантах применения, соответствующих настоящему изобретению, может представлять собой липидацилтрансферазу, включающую любую из последовательностей аминокислот, показанную как SEQ ID NO: 38, 40 или 47, либо последовательность аминокислот, которая идентична указанным по меньшей мере на 70, 75, 80, 85, 90, 95, 96, 97 или 98%, предназначенную для вариантов применения, описанных в данном контексте. Более предпочтительно, когда в одном варианте осуществления липидацилтрансфераза, предназначенная для использования в способах и вариантах применения, соответствующих настоящему изобретению, может представлять собой липидацилтрансферазу, включающую последовательность аминокислот,показанную как SEQ ID NO: 47, или последовательность аминокислот, которая идентична указанной по меньшей мере на 70, 75, 80, 85, 90, 95, 96, 97 или 98%. В другом варианте осуществления липидацилтрансфераза, предназначенная для использования в способах и вариантах применения, соответствующих настоящему изобретению, может представлять собой липидацилтрансферазу, включающую последовательность аминокислот, показанную какSEQ ID NO: 43 или 44, либо последовательность аминокислот, которая идентична указанным по меньшей мере на 80, 85, 90, 95, 96, 97 или 98%. В другом варианте осуществления липидацилтрансфераза, предназначенная для использования в способах и вариантах применения, соответствующих настоящему изобретению, может представлять собой липидацилтрансферазу, включающую последовательность аминокислот, показанную какSEQ ID NO: 41, или последовательность аминокислот, которая идентична указанной по меньшей мере на 70, 75, 80, 85, 90, 95, 96, 97 или 98%. В одном варианте осуществления липидацилтрансфераза, предназначенная для использования в способах и вариантах применения, соответствующих настоящему изобретению, может представлять собой липидацилтрансферазу, способную гидролизовать, по меньшей мере, галактолипиды и/или способную переносить ацильную группу, по меньшей мере, с галактолипида на один или более субстратов акцептора ацила, причем фермент кодируется нуклеиновой кислотой, выбранной из группы, состоящей из: а) нуклеиновой кислоты, включающей нуклеотидную последовательность, показанную вSEQ ID NO: 36; б) нуклеиновой кислоты, которая является родственной нуклеотидной последовательностиSEQ ID NO: 36 вследствие вырождения генетического кода; и в) нуклеиновой кислоты, включающей нуклеотидную последовательность, которая идентична по меньшей мере на 70% с нуклеотидной последовательностью, показанной в SEQ ID NO: 36. В одном варианте осуществления липидацилтрансфераза, соответствующая настоящему изобретению, может представлять собой получаемую липидацилтрансферазу, предпочтительно полученную из штаммов Streptomyces L130 или L131, депонированных фирмой Danisco A/S of Langebrogade 1, DK-1001 Копенгаген К, Дания согласно Будапештскому договору о международном признании депонирования микроорганизмов для целей патентной процедуры в Национальной коллекции промышленных, морских и пищевых бактерий (NCIMB), 23 St. Machar Street, Абердин, Шотландия, GB, 25 июня 2004 г. под регистрационными номерами NCIMB 41226 и NCIMB 41227 соответственно.-6 014985 Подходящие липидацилтрансферазы, предназначенные для использования в соответствии с настоящим изобретением и/или в способах, представленных в настоящем изобретении, могут включать любую из следующих последовательностей аминокислот и/или кодироваться следующими нуклеотидными последовательностями: полинуклеотидом, кодирующим липидацилтрансферазу, соответствующую настоящему изобретению (SEQ ID NO: 16); последовательностью аминокислот липидацилтрансферазы, соответствующей настоящему изобретению (SEQ ID NO: 17). Подходящий фермент липидацилтрансфераза, предназначенный для использования в способах, соответствующих изобретению, можно также идентифицировать посредством элайнмента с последовательностью L131 (SEQ ID NO: 37) с помощью Align X, алгоритма попарного элайнмента Clustal WVectorNTI при использовании установок, заданных по умолчанию. Сравнительный анализ L131 и гомологов из S.avermitilis и Т.fusca иллюстрирует консервацию мотива GDSX (GDSY в L131, а также S.avermitilis и Т.fusca), бокса GANDY, который представляет собой либо GGNDA, либо GGNDL (является, как считают, консервативным каталитическим гистидином). Данные три консервативных блока выделены на фиг. 61. Соответственно, когда липидацилтрансфераза, предназначенная для использования в способах или вариантах применения настоящего изобретения, может представлять собой вариант липидацилтрансферазы, в таком случае фермент можно охарактеризовать тем, что он включает мотив последовательности аминокислот GDSX, в котором X означает один или более следующих остатков аминокислот: L, А, V, I,F, Y, H, Q, T, N, М или S, причем при сравнительном анализе первичной структуры этого фермента с консенсусной последовательностью либо SEQ ID NO: 2, либо SEQ ID NO: 37, либо с обеими указанными последовательностями включает блок GANDY. Этот вариант фермента может включать одну или более модификаций аминокислот по сравнению с исходной последовательностью в любом из одного или более остатков аминокислот, определенных в группе 2, или группе 4, или группе 6, или группе 7 (определено ниже). Например, вариант фермента липидацилтрансферазы, предназначенный для использования в способах и вариантах применения настоящего изобретения, можно охарактеризовать тем, что фермент включает мотив последовательности аминокислот GDSX, в которой X означает один или более следующих остатков аминокислот: L, А, V, I, F, Y, H, Q, T, N, М или S, причем вариант фермента включает одну или более модификаций аминокислот по сравнению с исходной последовательностью в любом из одного или более остатков аминокислот, подробно описанных в группе 2, или группе 4, или группе 6, или группе 7 (определено ниже), идентифицированных с помощью указанной исходной последовательности, подвергнутой сравнительному анализу структуры со структурной моделью Р 10480, определенной в данном контексте, которая предпочтительно получена путем структурного элайнмента координат кристаллической структуры Р 10480 с 1IVN.PDB и/или 1DEO.PDB, как представлено в данном контексте. В следующем варианте осуществления вариант фермента липидацилтрансферазы, предназначенный для использования в способах и вариантах применения настоящего изобретения, можно охарактеризовать тем, что фермент включает мотив последовательности аминокислот GDSX, в которой X означает один или более следующих остатков аминокислот: L, A, V, I, F, Y, H, Q, T, N, M или S, причем вариант фермента включает одну или более модификаций аминокислот по сравнению с исходной последовательностью в любом из одного или более остатков аминокислот, описанного в группе 2, идентифицированных при структурном анализе исходной последовательности с консенсусной последовательностью pfam(SEQ ID NO: 2 - фиг. 12) и модифицированных согласно структурной модели Р 10480, чтобы обеспечить наилучшим образом соответствующее перекрывание (см. фиг. 30), как описано в данном контексте. Соответственно вариант фермента липидацилтрансферазы может включать последовательность аминокислот, которая показана как SEQ ID NO: 34, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5,SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 19, SEQ ID NO: 10, SEQ ID NO: 11,SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 1, SEQ ID NO: 15, SEQ ID NO: 25,SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 32 илиSEQ ID NO: 33, за исключением одной или более модификаций аминокислот в любом одном или более остатков аминокислот, определенных в группе 2, или группе 4, или группе 6, или группе 7 (определенных ниже), идентифицированных с помощью элайнмента последовательности с SEQ ID NO: 34. Альтернативно, вариант фермента липидацилтрансферазы может представлять собой вариант фермента, включающий последовательность аминокислот, которая показана как SEQ ID NO: 34,SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 19,SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 1,SEQ ID NO: 15, SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29,SEQ ID NO: 30, SEQ ID NO: 32 или SEQ ID NO: 33, за исключением одной или более модификаций аминокислот в любом одном или более остатков аминокислот, определенных в группе 2, или группе 4, или группе 6, или группе 7 (определенных ниже), идентифицированных с помощью указанной исходной последовательности, подвергнутой сравнительному анализу структуры со структурной моделью Р 10480,-7 014985 определенной в данном контексте, которая предпочтительно получена путем структурного элайнмента координат кристаллической структуры P10480 с 1IVN.PDB и/или 1DEO.PDB, как представлено в данном контексте. Альтернативно, вариант фермента липидацилтрансферазы может представлять собой вариант фермента, включающий последовательность аминокислот, которая показана как SEQ ID NO: 34,SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 19,SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 1,SEQ ID NO: 15, SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29,SEQ ID NO: 30, SEQ ID NO: 32 или SEQ ID NO: 33, за исключением одной или более модификаций аминокислот в любом одном или более остатков аминокислот, определенных в группе 2, идентифицированных при структурном анализе исходной последовательности с консенсусной последовательностью pfam(SEQ ID NO: 2) и модифицированных согласно структурной модели Р 10480, чтобы обеспечить наилучшим образом соответствующее перекрывание (см. фиг. 30), как описано в данном контексте. Термин "модификация", как используют в данном контексте, означает добавление, замену и/или удаление. Предпочтительно, когда термин "модификация" означает "замена". Чтобы избежать неопределенности при замене аминокислоты в исходном ферменте, ее предпочтительно заменяют аминокислотой, которая отличается от исходно обнаруженной в данном положении в исходном ферменте, чтобы, таким образом, получить вариант фермента. Другими словами, термин "замена" не предусматривает покрытие замены аминокислоты такой же аминокислотой. Предпочтительно, когда исходный фермент представляет собой фермент, который включает последовательность аминокислот, показанную как SEQ ID NO: 34, и/или SEQ ID NO: 15, и/или SEQ ID NO: 35. Предпочтительно, когда вариант фермента представляет собой фермент, который включает последовательность аминокислот, которая показана как SEQ ID NO: 34 или SEQ ID NO: 35, за исключением одной или более модификаций аминокислот в любом из одного или более остатков аминокислот, определенных в группе 2, или группе 4, или группе 6, или группе 7. В одном варианте осуществления предпочтительно, когда вариант фермента включает одну или более модификаций аминокислот по сравнению с исходной последовательностью по меньшей мере в одном из остатков аминокислот, определенных в группе 4. Соответственно вариант фермента включает один или более следующих модификаций аминокислот по сравнению с исходным ферментом: S3E, A, G, K, M, Y, R, P, N, Т или G; E309Q, R или А, предпочтительно Q или R; -318Y, Н, S или Y, предпочтительно Y. Предпочтительно, когда X мотива GDSX представляет собой L. Таким образом, предпочтительно,когда исходный фермент включает аминокислотный мотив GDSL. Предпочтительно, когда способ получения варианта фермента липидацилтрансферазы далее включает одну или более следующих стадий: 1) картирование структурной гомологии или 2) сравнительный анализ гомологии последовательностей. Соответственно картирование структурной гомологии может включать одну или более следующих стадий:i) проведение элайнмента исходной последовательности со структурной моделью (1IVN.PDB),представленной на фиг. 46;ii) выбор одного или более остатков аминокислот в сферической области 10 , центром которой является центральный атом углерода молекулы глицерина в активном центре (см. фиг. 47) (такой как один или более остатков аминокислот, определенных в группе 1 или группе 2); иiii) модификация одной или более аминокислот, выбранных в соответствии со стадией (ii), в указанной исходной последовательности. В одном варианте осуществления выбранный остаток аминокислоты может находиться в сферической области 9, предпочтительно в сферической области 8, 7, 6, 5, 4 или 3 , центром которой является центральный атом углерода молекулы глицерина в активном центре (см. фиг. 47). Соответственно картирование структурной гомологии может включать одну или более следующих стадий:i) проведение элайнмента исходной последовательности со структурной моделью (1IVN.PDB),представленной на фиг. 46;ii) выбор одной или более аминокислот в сферической области 10 , центром которой является центральный атом углерода молекулы глицерина в активном центре (см. фиг. 47) (такой как один или более остатков аминокислот, определенных в группе 1 или группе 2);iii) определение, является ли один или более остатков аминокислот, выбранных в соответствии со стадией (ii), высококонсервативным (особенно остатки активного центра и/или часть мотива GDSXiv) модификация одной или более аминокислот, выбранных в соответствии со стадией (ii), за исключением консервативных участков, идентифицированных в соответствии со стадией (iii), в указанной исходной последовательности.-8 014985 В одном варианте осуществления выбранный остаток аминокислоты может находиться в сферической области 9, предпочтительно 8, 7, 6, 5, 4, или 3 , центром которой является центральный атом углерода молекулы глицерина в активном центре (см. фиг. 47). Альтернативно или в сочетании с вышеописанным картированием структурной гомологии может быть проведено картирование структурной гомологии путем выбора специфических участков петли(LRs) или промежуточных участков (IVRs), выделенных при сравнении первичной структуры pfam(сравнение первичной структуры 2, см. фиг. 48), перекрывающихся с моделью Р 10480 и 1IVN. Участки петли (LRs) или промежуточные участки (IVRs) определены в нижеприведенной таблице. В ряде вариантов осуществления настоящего изобретения вариант фермента ацилтрансферазы,предназначенный для использования в способах и вариантах применения настоящего изобретения, не только включает модификации аминокислоты в одной или более аминокислот, определенных в любой из групп 1-4 и 6-7, но также включает по меньшей мере одну модификацию аминокислоты в одном или более из определенных выше промежуточных участков (IVR1-6) (предпочтительно в одном или более изIVRs3, 5 и 6, более предпочтительно в IVR5 или IVR6) и/или в одном или более определенных выше участков петли (LR1-5) (предпочтительно в одном или более из LR1, LR2 или LR5, более предпочтительно вLR5). В одном варианте осуществления вариант ацилтрансферазы, предназначенный для использования в способах и вариантах применения настоящего изобретения, может включать одну или более модификаций аминокислоты, которая не только определена одной или более групп 2, 4, 6 и 7, но также находится в одном или более из IVRs1-6 (предпочтительно в IVR3, 5 или 6, более предпочтительно в IVR5 илиIVR6) или в одном или более из LRs1-5 (предпочтительно в LR1, LR2 или LR5, более предпочтительно вLR5). Соответственно, вариант ацилтрансферазы, предназначенный для использования в способах и вариантах применения настоящего изобретения, может включать одну или более модификаций аминокислоты, которая находится не только в группе 1 или 2, но также в IVR3. Соответственно, вариант ацилтрансферазы, предназначенный для использования в способах и вариантах применения настоящего изобретения, может включать одну или более модификаций аминокислоты, которая находится не только в группе 1 или 2, но также в IVR5. Соответственно, вариант ацилтрансферазы, предназначенный для использования в способах и вариантах применения настоящего изобретения, может включать одну или более модификаций аминокислоты, которая находится не только в группе 1 или 2, но также в IVR6. Соответственно, вариант ацилтрансферазы, предназначенный для использования в способах и вариантах применения настоящего изобретения, может включать одну или более модификаций аминокислоты, которая находится не только в группе 1 или 2, но также в LR1. Соответственно, вариант ацилтрансферазы, предназначенный для использования в способах и вариантах применения настоящего изобретения, может включать одну или более модификаций аминокислоты, которая находится не только в группе 1 или 2, но также в LR2. Аналогично в ряде вариантов осуществления настоящего изобретения вариант фермента ацилтрансферазы, предназначенный для использования в способах и вариантах применения настоящего изобретения, не только включает модификацию аминокислоты в одном или более остатков аминокислот,которые находятся в сферической области 10, предпочтительно в 9, 8, 7, 6, 5, 4 или 3 , центр которой находится на центральном атоме углерода молекулы глицерина в активном центре (см. фиг. 47), но также включает модификацию по меньшей мере одной аминокислоты в одном или более определенных выше промежуточных участков (IVR1-6) (предпочтительно в одном или более IVRs3, 5 и 6, более предпочтительно в IVR5 или IVR6) и/или в одном или более из вышеопределенных участков петли (LR1-5) (предпочтительно в одном или более из LR1, LR2 или LR5, более предпочтительно в LR5). В одном варианте осуществления предпочтительно, когда модификация аминокислоты представляет собой модификацию в одном или более остатков аминокислот, который находится в сферической области 10 , а также в LR5.-9 014985 Таким образом, картирование структурной гомологии может включать одну или более следующих стадий:i) проведение элайнмента исходной последовательности со структурной моделью (1IVN.PDB), показанной на фиг. 46;ii) выбор одного или более остатков аминокислот в сферической области 10 , центр которой находится на центральном атоме углерода молекулы глицерина в активном центре (см. фиг. 47) (таком как один или более остатков аминокислот, определенных в группе 1 или группе 2); и/или выбор одного или более остатков аминокислот в IVR1-6) (предпочтительно в IVR3, 5 или 6, более предпочтительно вIVR5 или IVR6); и/или выбор одного или более остатков аминокислот в LR1-5 (предпочтительно в LR1,LR2 или LR5, более предпочтительно в LR5) иiii) модификация одной или более аминокислот, выбранных в соответствии со стадией (ii) в указанной исходной последовательности. В одном варианте осуществления выбранный остаток аминокислоты может находится в сферической области 9 , предпочтительно в сферической области 8, 7, 6, 5, 4 или 3 , центр которой находится на центральном атоме углерода молекулы глицерина в активном центре (см. фиг. 47). Соответственно, картирование структурной гомологии может включать одну или более следующих стадий:i) проведение элайнмента исходной последовательности со структурной моделью (1IVN.PDB), показанной на фиг. 46;ii) выбор одного или более остатков аминокислот в сферической области 10 , центр которой находится на центральном атоме углерода молекулы глицерина в активном центре (см. фиг. 47) (таком как один или более остатков аминокислот, определенных в группе 1 или группе 2); и/или выбор одного или более остатков аминокислот в IVR1-6) (предпочтительно в IVR3, 5 или 6, более предпочтительно вIVR5 или IVR6); и/или выбор одного или более остатков аминокислот в LR1-5 (предпочтительно в LR1,LR2 или LR5, более предпочтительно в LR5);iii) определение, являются ли один или более остатков аминокислот, выбранных в соответствии со стадией (ii), высококонсервативными (особенно остатки активных центров, и/или часть мотива, и/или часть мотива GANDY); и модификацию одной или более аминокислот, выбранных в соответствии со стадией (ii), за исключением консервативных участков, идентифицированных в соответствии со стадией (iii) в указанной исходной последовательности. Соответственно, одна или более аминокислот, выбранных в способах, подробно описанных выше,находятся не только в сферической области 10 , центр которой расположен на центральном атоме углерода молекулы глицерина в активном центре (см. фиг. 47) (например, один или более остатков аминокислот, определенных в группе 1 или группе 2), но также в одном или более IVRs1-6 (предпочтительно вIVR3, 5 или 6, более предпочтительно в IVR5 или IVR6) или в одном или более LRs1-5 (предпочтительно в LR1, LR2 или LR5, более предпочтительно в LR5). В одном варианте осуществления предпочтительно, когда одна или более модификаций аминокислот находится/находятся в LR5. В случае когда модификация(и) находится в LR5, модификация не является той, которая определена в группе 5. Соответственно, одна или более модификаций аминокислот не только расположены в области, определенной LR5, но также включают аминокислоту в одной или более из группы 2, группы 4, группы 6 или группы 7. Соответственно, сравнительный анализ гомологии последовательностей может включать одну или более следующих стадий:i) выбор первой исходной липидацилтрансферазы;ii) идентификация второй родственной липидацилтрансферазы, обладающей требующейся активностью;iii) проведение элайнмента указанной первой исходной липидацилтрансферазы и второй родственной липидацилтрансферазы;v) модификация одного или более остатков аминокислот, идентифицированных в соответствии со стадией (iv) в указанной исходной липидацилтрансферазе. Соответственно, структурный анализ гомологии последовательностей может включать одну или более следующих стадий:i) выбор первой исходной липидацилтрансферазы;ii) идентификация второй родственной липидацилтрансферазы, обладающей требующейся активностью;iii) проведение элайнмента указанной первой исходной липидацилтрансферазы и второй родственной липидацилтрансферазы;v) определение, является ли один или более остатков аминокислот, выбранных в соответствии со стадией (iv), высококонсервативными (особенно остатки активного центра, и/или часть мотива GDSX,- 10014985 и/или часть мотива GANDY); иvi) модификация одного или более остатков аминокислот, идентифицированных в соответствии со стадией (iv), за исключением консервативных участков, идентифицированных в соответствии со стадией(v) в указанной исходной последовательности. Соответственно, указанная первая исходная липидацилтрансфераза может включать любую из следующих последовательностей аминокислот: SEQ ID NO: 34, SEQ ID NO: 3, SEQ ID NO: 4,SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 19, SEQ ID NO: 10,SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 1, SEQ ID NO: 15,SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30,SEQ ID NO: 32 или SEQ ID NO: 33. Соответственно, указанная вторая родственная липидацилтрансфераза может включать любую из следующих последовательностей аминокислот: SEQ ID NO: 3, SEQ ID NO: 34, SEQ ID NO: 4,SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 19, SEQ ID NO: 10,SEQ ID NO: 11, SEQ ID NO: 12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 1, SEQ ID NO: 15,SEQ ID NO: 25, SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28, SEQ ID NO: 29, SEQ ID NO: 30,SEQ ID NO: 32 или SEQ ID NO: 33. Вариант фермента может включать по меньшей мере одну модификацию аминокислоты по сравнению с исходным ферментом. В ряде вариантов осуществления вариант фермента может включать по меньшей мере 2, предпочтительно по меньшей мере 3, предпочтительно по меньшей мере 4, предпочтительно по меньшей мере 5, предпочтительно по меньшей мере 6, предпочтительно по меньшей мере 7,предпочтительно по меньшей мере 8, предпочтительно по меньшей мере 9, предпочтительно по меньшей мере 10 модификаций аминокислот по сравнению с исходным ферментом. Что касается специфических остатков аминокислот, то в данном контексте нумерация такая, как получена при структурном анализе варианта последовательности с эталонной последовательностью, показанной как SEQ ID NO: 34 или SEQ ID NO: 35. В одном аспекте предпочтительно, когда вариант фермента включает одну или более следующих замен аминокислот: В дополнение или альтернативно этому может иметься одно или более С-концевых удлинений. Предпочтительно, когда дополнительное С-концевое удлинение состоит из одной или более алифатических аминокислот, предпочтительно неполярной аминокислоты, более предпочтительно из I, L, V или G. Таким образом, настоящее изобретение далее представляет вариант фермента, включающий одно или более следующих С-концевых удлинений: 318I, 318L, 318V, 318G. В случае когда остатки в исходном скелете отличаются от находящихся в Р 10480 (SEQ ID NO: 2),как определяют посредством гомологичного элайнмента и/или структурного элайнмента с Р 10480 и/или 1IVN, может потребоваться заменить остатки, которые выравниваются с любым одним или более следующим остатков аминокислот в Р 10480 (SEQ ID NO: 2): Ser3, Leu17, Lys22, Met23, Gly40, Asn80, Pro81,Lys82, Asn87, Asn88, Trp111, Val112, Ala114, Tyr117, Leu118, Pro156, Gly159, Gln160, Asn161, Pro162,Ser163, Ala164, Arg165, Ser166, Gln167, Lys168, Val169, Val170, Glu171, Ala172, Tyr179, His180, Asn181,Gln182, Met209, Leu210, Arg211, Asn215, Lys284, Met285, Gln289, Val290, Glu309 или Ser310, остатком,обнаруженным в PI0480, соответственно. Варианты фермента, которые имеют пониженную гидролитическую активность в отношении фосфолипида, такого как фосфатидилхолин (ФХ), могут также иметь повышенную активность трансферазы,переносящей группу из фосфолипида. Варианты фермента, которые обладают повышенной активностью трансферазы, переносящей группы из фосфолипида, такого как фосфатидилхолин (ФХ), могут также иметь повышенную активность в отношении фосфолипида. Соответственно, один или более следующих центров могут быть включены в связывание субстрата:Val290. Модификация одного или более следующих остатков может привести в результате к получению варианта фермента, обладающего повышенной абсолютной активностью трансферазы в отношении фосфолипида:- 12014985 Специфические модификации, которые могут дать вариант фермента, обладающий улучшенной активностью трансферазы в отношении фосфолипида, могут быть выбраны из одной или более следующих модификаций:- 13014985 Модификация одного или более следующих остатков приводит в результате к получению варианта фермента, обладающего повышенной абсолютной активностью трансферазы в отношении фосфолипида: Одной из предпочтительных модификаций является N80D. Это, в частности, тот случай, когда используют эталонную последовательность SEQ ID NO: 35. Вследствие этого в предпочтительном варианте осуществления настоящего изобретения липидацилтрансфераза, соответствующая настоящему изобретению, включает SEQ ID NO: 35. Как отмечено выше относительно специфических остатков аминокислот в данном контексте, нумерация такая, как получена при сравнительном анализе варианта последовательности с эталонной последовательностью, показанной как SEQ ID NO: 34 или SEQ ID NO: 35. Во многом предпочтительно, когда липидацилтрансфераза, предназначенная для использования в способе и вариантах применения настоящего изобретения, может представлять собой липидацилтрансферазу, включающую последовательность аминокислот, показанную как SEQ ID NO: 16 (см. фиг. 10),или последовательность аминокислот, которая идентична на 75% или более, предпочтительно 85% или более, более предпочтительно 90% или более, еще более предпочтительно 95% или более, еще более предпочтительно 98% или более либо еще более предпочтительно 99% или более SEQ ID NO: 16. Данный фермент можно считать вариантом фермента. Чтобы избежать неопределенности, когда конкретную аминокислоту описывают, например, в специфическом положении, например L118, это относится к специфической аминокислоте с номером остатка 118 в SEQ ID NO: 34, пока не указывают иначе. Однако остаток аминокислоты в положении 118 в другом исходном ферменте может быть отличным от лейцина. Таким образом, когда указывают заменить аминокислоту остатка 118, хотя ссылка может быть сделана на L118, компетентный специалист легко поймет, что, если исходный фермент отличен от приведенного в SEQ ID NO: 34, замещаемая аминокислота может не быть лейцином. Вследствие этого возможно, что при замене последовательности аминокислот в исходном ферменте, который не является ферментом, имеющим последовательность аминокислот, показанную как SEQ ID NO: 34, новая (заменяющая) аминокислота может быть такой же, как указано в SEQ ID NO: 34. Это может быть в случае,например, когда аминокислота указанного остатка 118 не является лейцином и вследствие этого отлична от аминокислоты остатка 118 в SEQ ID NO: 34. Другими словами, в остатке 118, например, если исходный фермент имеет в данном положении аминокислоту, отличную от лейцина, данная аминокислота может быть заменена лейцином в соответствии с настоящим изобретением. Для целей настоящего изобретения степень идентичности основана на числе элементов последовательности, которые являются одинаковыми. Степень идентичности в соответствии с настоящим изобретением может быть, соответственно, определена с помощью компьютерных программ, известных в области техники, таких как GAP, представленная в пакете программ GCG (Program Manual for the WisconsinPackage, Version 8, August 1994, Genetics Computer Group, 575 Science Drive, Madison, Wisconsin,US53711) (см. статью NeedlemanWunsch (1970), J. of Molecular Biology, 48, 443-45) с использованием следующих установок для сравнения последовательностей полипептидов: формирования GAP образование потерь 3.0 и дополнительные потери GAP 0,1. Соответственно, степень идентичности касательно последовательности аминокислот определяют по меньшей мере для 20 следующих друг за другом аминокислот, предпочтительно по меньшей мере для 30 следующих друг за другом аминокислот, предпочтительно по меньшей мере для 40 следующих друг за другом аминокислот, предпочтительно по меньшей мере для 50 следующих друг за другом аминокислот, предпочтительно по меньшей мере для 60 следующих друг за другом аминокислот. Соответственно, фермент липидацилтрансфераза, представленный в настоящем изобретении,можно получить и предпочтительно получают из организмов из одного или более следующих родов:Corynebacterium. Соответственно, фермент липидацилтрансферазу, представленный в настоящем изобретении,можно получить и предпочтительно получают из организмов из одного или более следующих организмов: Aeromonas hydrophila, Aeromonas salmonicida, Streptomyces coelicolor, Streptomyces rimosus,Mycobacterium, Streptococcus pyogenes, Lactococcus lactis, Streptococcus pyogenes, StreptococcusCorynebacterium efftciens. В одном аспекте предпочтительно, когда получаемый фермент липидацилтрансфераза, представленный в настоящем изобретении, предпочтительно получен из одного или более Aeromonas hydrophila или Aeromonas salmonicida. В одном варианте осуществления, соответственно, стерин и/или станол может включать один или более следующих структурных признаков:ii) циклы А:В в цис-положении или циклы А:В в транс-положении или С 5-С 6 является ненасыщенным. Подходящие стериновые акцепторы ацила включают холестерин и фитостерины, например-ситостерин, -ситостерин, стигмастерин, эрогостерин, кампестерин, 5,6-дигидростерин, брассикастерин, -спинастерин, -спинастерин, -спинастерин, -спинастерин, фукостерин, димостерин, аскостерин,себеристерин, эпистерин, анастерин, гипостерин, хондрилластерин, десмостерин, халиностерин, пориферастерин, клионастерин, стериновые гликозиды, токоферол, токотриенол и другие природные или синтетические изомерные формы и производные. Преимущественно в одном варианте осуществления стериновый акцептор ацила представляет собой токоферол. Соответственно, токоферол может являться одним или более из -, -, - илиdтокоферолов, включая, например, кислый сукцинат dтокоферола. В одном варианте осуществления предпочтительно, когда стериновый акцептор ацила представляет собой -токоферол. В одном варианте осуществления предпочтительно, когда способ, представленный в настоящем изобретении, включает стадию добавления к маслу токоферола, предпочтительно -токоферола. В одном аспекте предпочтительно, когда стериновый акцептор ацила представляет собой холестерин. В одном аспекте предпочтительно, когда стериновый и/или станоловый акцептор ацила представляет собой стерин и/или станол, отличный от холестерина. В одном аспекте настоящего изобретения, соответственно, в качестве акцептора ацила может действовать больше одного стерина и/или станола, соответственно, в качестве акцептора ацила может действовать больше двух стеринов и/или станолов. Другими словами, в одном аспекте настоящего изобретения, соответственно, может быть получено больше одного сложного стеринового эфира и/или сложного станолового эфира. Соответственно, когда холестерин является акцептором ацила, один или более других стеринов или один или более станолов также могут действовать как акцептор ацила. Таким образом,в одном аспекте настоящее изобретение представляет способ получения in situ как сложного эфира токоферола, так и по меньшей мере одного из сложных эфиров другого стерина или станола в комбинации. Другими словами, липидацилтрансфераза для некоторых аспектов настоящего изобретения может переносить ацильную группу с липида на оба, токоферол и по меньшей мере один из других стеринов и/или по меньшей мере один станол. Масло, полученное согласно настоящему изобретению, можно использовать для снижения риска развития сердечно-сосудистых заболеваний, в частности для снижения уровня холестерина сыворотки крови и/или для снижения уровня липопротеина низкой плотности. Как холестерин сыворотки крови, так и липопротеины низкой плотности ассоциированы с рядом заболеваний человека, таких как атеросклероз и/или, например, сердечное заболевание. Таким образом, предполагают, что масла, полученные согласно настоящему изобретению, можно использовать для уменьшения риска развития данных заболеваний. Стериновый акцептор ацила может представлять собой акцептор, обнаруженный в естественных условиях в пищевом или растительном маслах. Альтернативно или дополнительно стериновый акцептор ацила может представлять собой акцептор, добавленный к пищевому или растительному маслу. В случае когда стерин и/или станол добавляют к пищевому маслу, стерин и/или станол могут быть добавлены перед, одновременно и/или после добавления липидацилтрансферазы, представленной в настоящем изобретении. Соответственно, настоящее изобретение может охватывать добавление экзогенных стеринов/станолов, особенно фитостеринов/фитостанолов, к пищевому или растительному маслу перед или одновременно с добавлением фермента, представленного в настоящем изобретении. Для некоторых аспектов один или более стеринов, присутствующих в пищевом масле, можно превратить в один или более станолов перед тем или в то же самое время, когда добавляют липидацилтрансферазу в соответствии с настоящим изобретением. Можно использовать любой подходящий способ превращения стеринов в станолы. Например, превращение может быть осуществлено, в частности, путем химического гидрирования. Превращение можно провести перед добавлением липидацилтрансферазы в соответствии с настоящим изобретением или одновременно с добавлением липидацилтрансферазы в со- 15014985 ответствии с настоящим изобретением. Соответственно, ферменты для превращения стеринов в станолы описаны в заявке WO 00/061771. Соответственно, настоящее изобретение можно использовать для получения сложных фитостаноловых эфиров in situ в пищевом масле. Фитостаноловые эфиры обладают повышенной растворимостью в липидных мембранах, биодоступностью и повышенным благоприятным эффектом на состояние здоровья(см., например, заявку WO 92/99640). Преимущество настоящего изобретения состоит в том, что сложные стериновые или станоловые эфиры получают в пищевом масле в процессе его рафинирования гидратацией. Следующее преимущество состоит в том, что фермент обеспечивает рафинирование гидратацией без повышения или существенного повышения содержания свободных жирных кислот в пищевом масле. Образование свободных жирных кислот в пищевом масле может быть вредным. Предпочтительно, когда способ, представленный в настоящем изобретении, в результате приводит к рафинированию пищевого масла гидратацией, при котором накопление свободных жирных кислот понижено и/или исключено. Не намереваясь связывать себя теорией, в соответствии с настоящим изобретением жирная кислота, которая удаляется из липида,переносится липидацилтрансферазой на акцептор ацила, например стерин и/или станол. Таким образом,общий уровень свободных жирных кислот в пищевом продукте не повышается или повышается только до несущественного уровня. Это прямо противоположно ситуации, когда при ферментативном рафинировании пищевых масел гидратацией используют фосфолипазы, такие как Lecitase Ultra. В частности,применение данных фосфолипаз может привести к образованию повышенного количества свободных жирных кислот в пищевом масле, что может быть вредным. Согласно настоящему изобретению накопление свободных жирных кислот понижено и/или исключено по сравнению с количеством свободных жирных кислот, которое накапливалось бы при использовании фермента фосфолипазы, такой какLecitase Ultra, вместо липидацилтрансферазы, представленной в настоящем изобретении. Липидацилтрансфераза, представленная в настоящем изобретении, может подходить для использования в ферментативном рафинировании растительных или пищевых масел гидратацией. При переработке растительного или пищевого масла данное пищевое или растительное масло обрабатывают липидацилтрансферазой, представленной в настоящем изобретении, чтобы гидролизовать большую часть фосфолипида. Предпочтительно, когда жирные ацильные группы переносятся из полярных липидов на акцептор ацила. Способ рафинирования, как правило, приводит в результате к уменьшению содержания полярных липидов, особенно фосфолипидов, в пищевом масле вследствие гидролиза основной части (т.е. больше 50%) фосфолипида. Как правило, водную фазу, включающую гидролизованный фосфолипид, отделяют от масла. Соответственно, пищевое или растительное масло может изначально (предварительная обработка ферментом, представленным в настоящем изобретении) иметь содержание фосфора 50-250 промиль. Как известно компетентному специалисту, термин "рафинирование гидратацией", как используют в данном контексте, означает рафинирование масла путем превращения фосфатидов (таких как лецитин,фосфолипиды и сорбированное масло) в гидратируемые фосфатиды. Масло, которое рафинировано гидратацией, является более текучим и, таким образом, имеет улучшенные технологические свойства по сравнению с маслом, не подвергнутым рафинированию гидратацией. Термин "трансферазы", как используют в данном контексте, является взаимозаменяемым с термином "липидацилтрансфераза". Соответственно, липидацилтрансфераза, как определено в данном контексте, катализирует одну или более из следующих реакций: интерэстерификация, трансэстерификация, алкоголиз, гидролиз. Термин "интерэстерификация" относится к ферментативно катализируемому переносу ацильных групп между липидным донором и липидным акцептором, причем липидный донор не является свободной ацильной группой. Термин "трансэстерификация", как используют в данном контексте, означает ферментативно катализируемый перенос ацильной группы от липидного донора (отличного от свободной жирной кислоты) на акцептор ацила (отличный от воды). Как используют в данном контексте, термин "алкоголиз" относится к ферментативному расщеплению ковалентной связи кислотного производного путем реакции со спиртом ROH, так что один из продуктов связывается с Н спирта, а другой продукт связывается с группой OR спирта. Как используют в данном контексте, термин "спирт" относится к алкильному соединению, включающему гироксильную группу. Как используют в данном контексте, термин "гидролиз" относится к ферментативно катализируемому переносу ацильной группы с липида на группу ОН молекулы воды. Термин "без повышения или без существенного повышения уровня свободных жирных кислот", как используют в данном контексте, означает, что предпочтительно, когда липидацилтрансфераза, представленная в настоящем изобретении, имеет 100% активность трансферазы (т.е. переносит 100% ацильных групп с донора ацила на акцептор ацила при отсутствии гидролитической активности); однако фермент может переносить менее чем 100% ацильных групп, присутствующих в липидном доноре ацила, на ак- 16014985 цептор ацила. В таком случае предпочтительно, когда ацилтрансферазная активность составляет по меньшей мере 5%, более предпочтительно по меньшей мере 10%, более предпочтительно по меньшей мере 20%, более предпочтительно по меньшей мере 30%, более предпочтительно по меньшей мере 40%,более предпочтительно 50%, более предпочтительно по меньшей мере 60%, более предпочтительно по меньшей мере 70%, более предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 90% и более предпочтительно по меньшей мере 98% общей активности фермента. Процент трансферазной активности (т.е. трансферазная активность как доля общей ферментативной активности) можно определить с помощью следующего протокола. Фермент, подходящий для использования в способах, представленных в изобретении, предпочтительно обладает активностью фосфолипазы в стандартном анализе активности фосфолипазы, описанном ниже. Определение активности фосфолипазы (анализ активности фосфолипазы (PLU-7. Субстрат. 0,6% L- фосфатидилхолина растительного 95% (фирмы Avanti 441601), 0,4% Тритон-Х 100 (фирмы Sigma Х-100) и 5 мМ CaCl2 диспергируют в 0,05 М буфере HEPES рН 7. Методика анализа. 400 мкл субстрата вносят в эппендорфовскую пробирку объемом 1,5 мл и помещают в термосмеситель Eppendorf при 37 С на 5 мин. В точке времени t=0 мин добавляют 50 мкл раствора фермента. Кроме того, анализируют контроль с водой вместо фермента. Образец перемешивают при 10100 об/мин в термосмесителе Eppendorf при 37 С в течение 10 мин. В точке времени t=10 мин эппендорфовскую пробирку помещают в другой термосмеситель при 99 С на 10 мин, чтобы остановить реакцию. Свободную жирную кислоту в образцах анализируют с использованием набора NEFA С фирмыWAKO GmbH. Активность фермента PLU-7 при рН 7 рассчитывают как количество микромолей жирной кислоты,образующееся в минуту в условиях анализа. Более предпочтительно, когда липидацилтрансфераза будет также обладать активностью трансферазы, как определено нижеприведенной методикой. Протокол определения активности ацилтрансферазы, %. Пищевое масло, к которому добавлена липидацилтрансфераза, представленная в настоящем изобретении, можно экстрагировать после ферментативной реакции с CHCl3:CH3OH, 2:1 и органическую фазу,включающую липидный материал, выделяют и анализируют посредством ГЖХ (газожидкостной хроматографии) и ВЭЖХ (высокоэффективной жидкостной хроматографии) согласно методике, подробно описанной ниже. На основании анализов ГЖХ и ВЭЖХ определяют количество свободных жирных кислот и одного или более сложных стериновых/станоловых эфиров. Контрольное пищевое масло, к которому не добавляют фермент, представленный в настоящем изобретении, анализируют аналогичным методом. Расчет. На основании результатов анализов ГЖХ и ВЭЖХ можно рассчитать повышение уровня свободных жирных кислот и сложных стериновых/станоловых эфиров:% жирной кислоты = % жирной кислоты(фермент) - % жирной кислоты(контроль); Мв жирной кислоты = среднемассовая молекулярная масса жирных кислот; А = % стеринового эфира/Мв стеринового эфира (где % стеринового эфира = % стеринового/станолового эфира(фермент) - % стеринового/станолового эфира(контроль) и Мв стеринового эфира = среднемассовая молекулярная масса стериновых/станоловых эфиров); Трансферазную активность рассчитывают как процент общей ферментативной активности Если в пищевом масле повышено содержание свободных жирных кислот, предпочтительно, чтобы оно не было повышено в существенной степени, т.е. до значительного уровня. Под этим имеют в виду,что повышение содержания свободной жирной кислоты не влияет неблагоприятным образом на качество пищевого масла. Пищевое масло, используемое для анализа активности ацилтрансферазы, предпочтительно является соевым маслом, в которое добавлены растительный стерин (1%) и фосфатидилхолин (2%), используемым в способе, представленном в примере 3. Для анализа доза используемого фермента предпочтительно составляет 0,2 PLU-7/г масла, более предпочтительно 0,08 PLU-7/г масла. Уровень фосфолипида, присутствующего в масле, и/или % превращения стерина предпочтительно определяют через 4 ч, более предпочтительно через 20 ч. В ряде аспектов настоящего изобретения термин "без существенного повышения содержания свободных жирных кислот", как используют в данном контексте, означает, что количество свободной жирной кислоты в пищевом масле, обработанном липидацилтрансферазой, представленной в настоящем изобретении, меньше, чем количество свободной жирной кислоты, образованной в пищевом масле, когда используют фермент, отличный от липидацилтрансферазы, представленной в настоящем изобретении,- 17014985 как, например, по сравнению с количеством свободной жирной кислоты, образованной, когда используют принятый фермент фосфолипазу, например Lecitase Ultra (фирмы Novozymes A/S, Дания). Дополнительно или вместо оценки % трансферазной активности в масле (см. выше) для идентификации ферментов липидацилтрансфераз, наиболее предпочтительных для использования в способах,представленных в изобретении, можно использовать следующий анализ, названный "Протокол идентификации липидацилтрансфераз, предназначенных для использования в настоящем изобретении". Протокол идентификации липидацилтрансфераз. Липидацилтрансфераза, соответствующая настоящему изобретению, представляет собой приводящую к следующему результату:ii) превращение (% превращения) добавленного стерина в сложный стериновый эфир при использовании способа, описанного в примере 3. Можно использовать способ ГЖХ для определения уровня стерина и сложных стериновых эфиров,как описано в примере 5. Для анализа доза используемого фермента может составлять 0,2 PLU-7/г масла, предпочтительно 0,08 PLU-7/г масла. Уровень фосфолипида, присутствующего в масле, и/или превращения (% превращения) стерина предпочтительно определяют через 4 ч, более предпочтительно через 20 ч. В протоколе идентификации липидацилтрансфераз после обработки ферментом предпочтительно добавляют 5% воды и тщательно перемешивают с маслом. Затем масло разделяют на масляную и водную фазу при использовании центрифугирования (см. монографию "Enzyme-catalyzed degumming of vegetableoils". Buchold H. и Laurgi A.-G., Fett Wissenschaft Technologie (1993), 95(8), 300-4, ISSN: 0931-5985) и затем масляную фазу можно проанализировать на содержание фосфора, используя следующий протокол("Анализ на содержание фосфора"). Анализ на содержание фосфора. Уровень фосфолипида, имеющийся в масле после рафинирования гидратацией, определяют, получая сначала образец масла в соответствии с получением образца, описанного в АОАС официальном методе 999.10 (свинца, кадмия, цинка, меди и железа в атомно-абсорбционной спектрофотометрии пищевых продуктов после микроволнового разложения, метод NMKL-AOAC первое действие 1999). Затем количество фосфолипидов в масле измеряют посредством анализа содержания фосфора в образце масла после рафинирования гидратацией согласно АОАС официальному методу 985.01 (металлов и других элементов в растениях и кормах для домашних животных, способ спектроскопии с индуктивносвязанной плазмой первое действие 1985, окончательное действие 1988). Количество фосфора, присутствующее в масле после рафинирования гидратацией, составляет предпочтительно менее чем 50 промиль, предпочтительно менее чем 40 промиль, предпочтительно менее чем 30 промиль, предпочтительно менее чем 20 промиль, предпочтительно менее чем 10 промиль, предпочтительно менее чем 5 промиль. Масло после рафинирования гидратацией, как проиллюстрировано в примерах, может быть в существенной степени свободным от фосфолипида, т.е. содержать менее чем 1 промиль фосфолипида. Процент превращения стерина, присутствующего в масле, составляет по меньшей мере 1%,предпочтительно по меньшей мере 5%, предпочтительно по меньшей мере 10%,предпочтительно по меньшей мере 20%, предпочтительно по меньшей мере 30%,предпочтительно по меньшей мере 40%, предпочтительно по меньшей мере 50%,предпочтительно по меньшей мере 60%, предпочтительно по меньшей мере 70%,предпочтительно по меньшей мере 80%, предпочтительно по меньшей мере 90%,предпочтительно по меньшей мере 95%. В одном варианте осуществления % превращения стерина, присутствующего в масле, составляет по меньшей мере 5%, предпочтительно по меньшей мере 20%. Рафинирование при низком содержании воды. Неожиданно обнаружено, что при использовании липидацилтрансферазы в способе ферментативного рафинирования гидратацией пищевого масла ферментативное рафинирование гидратацией можно осуществить в среде с очень низким содержанием воды. Может потребоваться еще немного воды, например при добавлении фермента к маслу фермент может быть добавлен в небольшом количестве воды,таком как менее чем 1%, предпочтительно 0,5%, более предпочтительно менее чем 0,2%, более предпочтительно менее чем 0,1%. Предпочтительно, когда содержание воды в пищевом масле в способах и вариантах применения,представленных в настоящем изобретении, составляет менее чем 1%, предпочтительно менее чем 0,5%,более предпочтительно менее чем 0,2%, более предпочтительно менее чем 0,1%. Таким образом, одно из преимуществ настоящего изобретения состоит в том, что, когда при ферментативном рафинировании гидратацией используют только небольшое количество воды (т.е. 5%,предпочтительно 1%, предпочтительно 0,5%, предпочтительно 0,2%), клейкие вещества (т.е. фосфорсодержащая часть) выделяются из масла, например, в форме твердого осадка. Твердый осадок легко- 18014985 можно удалить из рафинированного гидратацией масла такими способами, как, например, простая декантация масла или удаление клейких веществ фильтрацией. Это прямо противоположно принятым способам ферментативного рафинирования гидратацией, в которых к маслу добавляют значительное количество воды. Это обусловлено тем, что в принятых способах ферментативного рафинирования гидратацией после рафинирования получают водный слой, который включает фосфорсодержащую часть (например, ту часть, которая включает лизофосфолипиды). Данный водный слой можно удалить, например, центрифугированием. Однако удаление водного слоя значительно сложнее, чем удаление твердого осадка, полученного при использовании способа, представленного в настоящем изобретении. Вследствие этого способ ферментативного рафинирования гидратацией, представленный в настоящем изобретении, мог рассматриваться как "способ рафинирования гидратацией при низком содержании воды". В одном варианте осуществления настоящего изобретения клейкое вещество можно удалить доведением содержания воды в масле до 5% с последующим центрифугированием масла, (см. статью(1993), 95(8), 300-4). Вследствие этого изобретение представляет способ рафинирования гидратацией пищевого масла,такого как неочищенное пищевое масло (например, неочищенное соевое масло), без необходимости включения либо стадии предварительного промывания перед рафинированием гидратацией и/либо стадии удаления воды, добавленной в процессе рафинирования гидратацией, которое требуется при использовании принятых фосфолипаз, таких как фосфолипаза поджелудочной железы и Lecitase Ultra. Предпочтительно, когда пищевое масло имеет содержание воды менее чем 4,5%, более предпочтительно менее чем 4%, менее чем 3%, менее чем 2%, менее чем 1%, менее чем 0,5%. Соответственно, пищевое масло может включать по меньшей мере 0,1% воды, например по меньшей мере 0,3, 0,4 или 0,5%. Предпочтительные липидацилтрансферазы, предназначенные для использования в настоящем изобретении, идентифицированы как обладающие высокой активностью, такой как высокая гидролитическая активность в отношении фосфолипидов или высокая активность фосфолипидтрансферазы в отношении фосфолипидов в масляной среде, наиболее предпочтительно, когда липидацилтрансферазы, предназначенные для использования в ферментативном рафинировании гидратацией, обладают высокой активностью фосфолипид-стерин-трансферазы. Как подробно описано выше, другие ацилтрансферазы, подходящие для использования в способах,представленных в изобретении, можно определить путем идентификации присутствия блоковGDSX, GANDY и НРТ либо посредством элайнмента с консенсусной последовательностью pfam00657(SEQ ID NO: 1) и/или элайнмента с ацилтрансферазой GDSX, например SEQ ID NO: 28. Для того чтобы оценить их пригодность для рафинирования гидратацией, т.е. идентифицировать те ферменты, которые обладают трансферазной активностью по меньшей мере 5%, более предпочтительно по меньшей мере 10%, более предпочтительно по меньшей мере 20%, более предпочтительно по меньшей мере 30%, более предпочтительно по меньшей мере 40%, более предпочтительно 50%, более предпочтительно по меньшей мере 60%, более предпочтительно по меньшей мере 70%, более предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 90% и более предпочтительно по меньшей мере 98% от общей активности фермента, данные ацилтрансферазы тестируют с использованием анализа "Протокол определения процента ацилтрансферазной активности", подробно описанного выше. Настоящее изобретение относится к применению липидацилтрансферазы, представленной в настоящем изобретении, в рафинировании гидратацией пищевых растительных масел и/или пищевых масел и к способам рафинирования пищевых или растительных масел. В одном аспекте настоящее изобретение может представлять способ, включающий применение липидацилтрансферазы для удаления доли негидратируемого фосфора (NHP) в масле, включающем относительно высокое количество NHP. Термин "пищевое масло", как используют в данном контексте, может охватывать растительные масла. Предпочтительно, когда пищевое масло перед обработкой в соответствии с настоящим изобретением включает долю негидратируемого фосфора 50-250 промиль, предпочтительно по меньшей мере 60 промиль, более предпочтительно по меньшей мере 100 промиль и еще более предпочтительно по меньшей мере 200 промиль, еще более предпочтительно выше 250 промиль. Более предпочтительно, когда пищевое масло перед обработкой в соответствии с настоящим изобретением включает долю негидратируемого фосфора в интервале 60-500 промиль, более предпочтительно в интервале 100-500 промиль и еще более предпочтительно в интервале 200-500 промиль. Пищевое масло, как называют в данном контексте, может представлять собой любое масло, содержащее относительно высокое количество негидратируемого фосфора, оно может включать рафинированное водой масло или более предпочтительно оно представляет собой неочищенное масло или полуочищенное масло.- 19014985 В одном аспекте неочищенное пищевое масло имеет перед осуществлением способа, представленного в изобретении, содержание фосфора выше 350 промиль, более предпочтительно выше 400 промиль,еще более предпочтительно выше 500 промиль и наиболее предпочтительно выше 600 промиль. Масла, охватываемые способом, представленным в настоящем изобретении, включают, но без ограничения перечисленным, одно или более из соевого масла, масла канолы, кукурузного масла, хлопкового масла, пальмового масла, кокосового масла, арахисового масла, оливкового масла, масла сафлора,косточкового пальмового масла, рапсового масла и подсолнечного масла. Предпочтительно, когда масло представляет собой одно или более из соевого масла, подсолнечного масла и рапсового масла (иногда называемого маслом канолы). Более предпочтительно, когда масло представляет собой одно или более из соевого масла, подсолнечного масла и рапсового масла. Наиболее предпочтительно, когда масло представляет собой соевое масло. Данные масла могут находиться в форме неочищенного масла, полуочищенного масла или масла,рафинированного водой. Как используют в данном контексте, "неочищенное масло" (называемое в данном контексте также масло, нерафинированное гидратацией) может представлять собой масло, полученное отжимом, или экстрагированное масло либо их смесь, например из рапса, сои или подсолнечника. Содержание фосфатидов в неочищенном масле может варьировать от 0,5 до 3% мас./мас., соответствуя содержанию фосфора в интервале 200-1200 промиль, более предпочтительно в интервале 250-1200 промиль. Кроме фосфатидов, неочищенное масло содержит также маленькие концентрации углеводов, соединений сахаров и комплексы металл/фосфатидная кислота Са, Mg и Fe. Как используют в данном контексте, термин "полуочищенное масло" относится к любому маслу,которое не является неочищенным маслом, но содержание фосфатидов в котором составляет выше 250 промиль, более предпочтительно выше 500 промиль. Такое масло можно было бы получить, например, обработкой неочищенного масла способом, аналогичным нижеописанному способу "рафинирования водой". Как используют в данном контексте, "масло, рафинированное водой", как правило, можно получить(60-90 С) неочищенным маслом. Обычно периоды обработки составляют 30-60 мин. На стадии рафинирования водой удаляют фосфатиды и вязкие клейкие вещества, которые становятся нерастворимыми в масле при гидратации. Гидратированные фосфатиды и клейкие вещества можно отделить от масла посредством отстаивания, фильтрации или центрифугирования - центрифугирование является более распространенным способом. Основной целью в данном способе рафинирования водой является отделение гидратированных фосфатидов от масла. Вышеописанное вмешивание горячей воды в масло следует в данном контексте понимать в широком смысле как вмешивание водного раствора в масло в соответствии со стандартными способами рафинирования водой в области техники. Преимущественно способ и варианты применения настоящего изобретения обеспечивают возможность рафинирования пищевых масел гидратацией в среде с низким содержанием воды (5%, предпочтительно менее чем 2%, более предпочтительно менее чем 1%). Вследствие этого рафинирование гидратацией можно осуществить при добавлении меньшего количества воды, чем при использовании принятых ферментов. Следующим преимуществом настоящего изобретения является образование сложных стериновых эфиров (в частности, сложных эфиров токоферола) в масле. Еще одно преимущество настоящего изобретения состоит в удалении (предпочтительно полном удалении) фосфолипидов. Следующим преимуществом настоящего изобретения является удаление (предпочтительно полное удаление) фосфолипидов без удаления фитостерина и, в частности, токоферола. Предпочтительно, чтобы вследствие эстерификации фитостерина не происходило существенного удаления фитостеринов, таких как токоферол, из масла и вместо этого они бы просто эстерифицировались. Однако в одном варианте осуществления количество фитостерина, такого как токоферол, может быть уменьшено. В данных вариантах осуществления абсолютные уровни фитостерина, такого как токоферол, могут понизиться предпочтительно не более чем на 10%, альтернативно не более чем на 25%, альтернативно не более чем на 50%,альтернативно не более чем на 75%. Еще одно преимущество настоящего изобретения состоит в удалении (предпочтительно полном удалении) фосфолипидов без гидролиза триглицеридов. Для простоты ссылки данные и последующие аспекты настоящего изобретения теперь обсуждают под соответствующими названиями разделов. Однако описания в каждом из разделов не являются обязательно ограниченными каждым конкретным разделом.- 20014985 Определение групп. Группа аминокислот 1. Группа аминокислот 1 представляет собой Gly8, Asp9, Ser10, Leu11, Ser12, Tyr15, Gly44, Asp45,Thr46, Glu69, Leu70, Gly71, Gly72, Asn73, Asp74, Gly75, Leu76, Gln106, Ile107, Arg108, Leu109, Pro110,Tyr113, Phe121, Phe139, Phe140, Met141, Tyr145, Met151, Asp154, His157, Gly155, Ile156, Pro158. Выбор высококонсервативных мотивов, таких как GDSX и каталитические остатки, из группы 1 отменен (остатки подчеркнуты). Чтобы избежать неопределенности, группа 1 определяет остатки аминокислот в радиусе 10 от центрального атома углерода глицерина в активном центре модели 1IVN. Группа аминокислот 2. Группа аминокислот 2 (заметим, что нумерация аминокислот относится к аминокислотам в зрелой последовательности Р 10480):Leu17, Lys22, Met23, Gly40, Asn80, Pro81, Lys82, Asn87, Asn88, Trp111, Val112, Ala114, Tyr117,Leu118, Pro156, Gly159, Gln160, Asn161, Pro162, Ser163, Ala164, Arg165, Ser166, Gln167, Lys168, Val169,Val170, Glu171, Ala172, Tyr179, His180, Asn181, Met209, Leu210, Arg211, Asn215, Lys284, Met285, Gln289 и Val290. Таблица выбранных остатков в группе 1 по сравнению с группой 2Aeromonas salmonicida (SEQ ID NO: 28), т.е. номера остатков аминокислот в группе 3 на 18 больше, поскольку это отражает разницу между нумерацией аминокислот в зрелом белке (SEQ ID NO: 2) по сравнению с белком, включающим сигнальную последовательность (SEQ ID NO: 28). Зрелые белки GDSX Aeromonas salmonicida (SEQ ID NO: 28) и GDSX Aeromonas hydrophila(SEQ ID NO: 26) различаются по пяти аминокислотам. Они представляют собой Thr3Ser, Gln182Lys,Glu309Ala, Ser310Asn, Gly318-, когда остаток salmonicida приведен в перечислении первым и остатокhydrophila приведен последним (см. фиг. 59). Белок hydrophila имеет длину всего 317 аминокислот и у него отсутствует остаток в положении 318. GDSX Aeromonas salmonicidae обладает значительно более высокой активностью в отношении полярных липидов, таких как галактолипидные субстраты, чем белокAeromonas hydrophila. Проводят сканирование центра по всем пяти положениям аминокислот. Группа аминокислот 4. Группа аминокислот 4 представляет собой S3, Q182, Е 309, S310 и -318. Группа аминокислот 5. Группа аминокислот 5 представляет собой F13S, D15N, S18G, S18V, Y30F, D116N, D116E, D157N,Y226F, D228N, Y230F. Группа аминокислот 6. Группа аминокислот 6 представляет собой Ser3, Leu17, Lys22, Met23, Gly40, Asn80, Pro81, Lys82,Asn87, Asn88, Trp111, Val112, Ala114, Tyr117, Leu118, Pro156, Gly159, Gln160, Asn161, Pro162, Ser163,Ala164, Arg165, Ser166, Gln167, Lys168, Val169, Val170, Glu171, Ala172, Tyr179, His180, Asn181, Gln182,Met209, Leu210, Arg211, Asn215, Lys284, Met285, Gln289, Val290, Glu309, Ser310, -318. Нумерация аминокислот в группе 6 относится к остаткам аминокислот в Р 10480 (SEQ ID NO: 2) соответствующие аминокислоты в других скелетах последовательностей можно определить с помощью элайнмента гомологии и/или структурного элайнмента с Р 10480 и/или 1IVN. Группа аминокислот 7. Группа аминокислот 7 представляет собой Ser3, Leu17, Lys22, Met23, Gly40, Asn80, Pro81, Lys82,Asn87, Asn88, Trp111, Val112, Ala114, Tyr117, Leu118, Pro156, Gly159, Gln160, Asn161, Pro162, Ser163,Ala164, Arg165, Ser166, Gln167, Lys168, Val169, Val170, Glu171, Ala172, Tyr179, His180, Asn181, Gln182,Met209, Leu210, Arg211, Asn215, Lys284, Met285, Gln289, Val290, Glu309, Ser310, -318, Y30X (где X выбрано из А, С, D, E, G, H, I, K, L, M, N, P, Q, R, S, T, V или W), Y226X (где X выбрано из А, С, D, E, G, H,I, K, L, M, N, P, Q, R, S, T, V или W), Y230X (где X выбрано из А, С, D, E, G, H, I, K, L, M, N, P, Q, R, S,T, V или W), S18X (где X выбрано из А, С, D, E, F, H, I, K, L, M, N, P, Q, R, T, W или Y), D157X (где X выбрано из А, С, E, F, G, H, I, K, L, M, P, Q, R, S, T, V, W или Y). Нумерация аминокислот в группе 7 относится к остаткам аминокислот в Р 10480 (SEQ ID NO: 2) соответствующие аминокислоты в других скелетах последовательностей можно определить с помощью элайнмента гомологии и/или структурного элайнмента с Р 10480 и/или 1IVN. Выделенный. В одном аспекте предпочтительно, когда полипептид или белок, предназначенный для использования в настоящем изобретении, находится в выделенной форме. Термин "выделенный" означает, что последовательность, по меньшей мере, в существенной степени свободна по меньшей мере от одного из других компонентов, с которыми последовательность по природе связана в естественных условиях или как она обнаружена в естественных условиях. Очищенный. В одном аспекте предпочтительно, когда полипептид или белок, предназначенный для использования в настоящем изобретении, находится в очищенной форме. Термин "очищенный" означает, что последовательность находится в относительно очищенном состоянии - например по меньшей мере приблизительно 51% чистоты, или по меньшей мере приблизительно 75%, или по меньшей мере приблизительно 80%, или по меньшей мере приблизительно 90% чистоты, или по меньшей мере приблизительно 95% чистоты, или по меньшей мере приблизительно 98% чистоты. Клонирование нуклеотидной последовательности, кодирующей полипептид, представленный в настоящем изобретении. Нуклеотидная последовательность, кодирующая либо полипептид, который имеет специфические свойства, как определено в данном контексте, либо полипептид, который пригоден для модификации,может быть выделена из любой клетки или организма, продуцирующего данный полипептид. В области техники хорошо известны различные методы выделения нуклеотидных последовательностей. Например, геномную ДНК и/или библиотеку кДНК можно сконструировать, используя хромосомную ДНК или информационную РНК из организма, продуцирующего полипептид. Если последовательность аминокислот полипептида известна, можно синтезировать меченые олигонуклеотидные зонды и использовать для идентификации клонов, кодирующих полипептид из геномной библиотеки, полученной из организма. Альтернативно, для идентификации клонов, кодирующих полипептид, можно было бы- 22014985 использовать меченый олигонуклеотидный зонд, включающий последовательности, гомологичные другому известному гену полипептида. В последнем случае используют условия гибридизации и промывания более низкой жесткости. Альтернативно, клоны, кодирующие полипептид, можно было бы идентифицировать путем инсерции фрагментов геномной ДНК в экспрессирующий вектор, такой как плазмида, трансформации фермент-отрицательной бактерии полученной библиотекой геномной ДНК и затем помещения трансформированной бактерии на агаризованную среду, содержащую фермент, ингибируемый полипептидом, чтобы получить возможность идентифицировать клоны, экспрессирующие полипептид. В еще одном альтернативном варианте нуклеотидную последовательность, кодирующую полипептид, можно получить синтетически с помощью разработанных стандартных методов, например фосфороамидитного метода, описанного в статье Beucage S.L. et al. (1981), Tetrahedron Letters, 22, p. 1859-1869,или метода, описанного в статье Matthes et al. (1984), EMBO J. 3, p. 801-805. В фосфороамидитном методе олигонуклеотиды синтезируют, например, в автоматическом синтезаторе ДНК, очищают, отжигают,лигируют и клонируют в подходящие векторы. Нуклеотидная последовательность может быть смешанной геномной и синтетической природы или смешанной геномной и кДНК природы, полученной лигированием фрагментов синтетической, геномной или ДНК природы (как требуется) в соответствии со стандартными методиками. Каждый лигированный фрагмент соответствует различным частям полной нуклеотидной последовательности. Последовательность ДНК можно получить также с помощью полимеразной цепной реакции (ПЦР) при использовании специфических праймеров, например, как описано в US 4683202 или в статье Saiki R.K. et al. (Science(1988), 239, p. 487-491). Нуклеотидные последовательности. Настоящее изобретение охватывает также нуклеотидные последовательности, кодирующие полипептиды, имеющие специфические свойства, как определено в данном контексте. Термин "нуклеотидная последовательность", как используют в данном контексте, относится к олигонуклеотидной последовательности или полинуклеотидной последовательности и ее вариантам, гомологам, фрагментам и производным (таким как ее части). Нуклеотидная последовательность может быть геномной или синтетической либо рекомбинантной природы, которая может быть двунитевой или однонитевой, представляя либо смысловую, либо антисмысловую нить. Термин "нуклеотидная последовательность" в контексте настоящего изобретения включает геномную ДНК, кДНК, синтетическую ДНК и РНК. Он предпочтительно означает ДНК, более предпочтительно кДНК кодирующей последовательности. В предпочтительном варианте осуществления сама по себе нуклеотидная последовательность, кодирующая полипептид, обладающий специфическими свойствами, не покрывает нативную нуклеотидную последовательность в ее естественной среде, когда она связана с естественно ассоциированной с ней последовательностью(ями), которая(ые) также находится в своей естественной среде. Для простоты ссылки данный предпочтительный вариант осуществления называют "ненативной нуклеотидной последовательностью". В связи с этим термин "нативная нуклеотидная последовательность" означает полную нуклеотидную последовательность, которая находится в своей естественной среде, и если она функционально связана с полным промотором, с которым она ассоциирована естественным образом, то данный промотор также находится в своей естественной среде. Таким образом, полипептид, представленный в настоящем изобретении, может экспрессироваться нуклеотидной последовательностью в своем нативном организме, но когда нуклеотидная последовательность не находится под контролем промотора, с которым она естественным образом ассоциирована в данном организме. Предпочтительно, когда полипептид не является нативным полипептидом. В этом плане термин"нативный полипептид" означает полный полипептид, который находится в своей нативной среде и когда он экспрессирован своей нативной нуклеотидной последовательностью. Как правило, нуклеотидную последовательность, кодирующую полипептиды, обладающие специфическими свойствами, как определено в данном контексте, получают, используя технологии рекомбинантной ДНК (т.е. рекомбинантную ДНК). Однако в альтернативном варианте осуществления изобретения нуклеотидную последовательность можно было бы синтезировать полностью или частично, используя химические методы, хорошо известные в области техники (см. статьи Caruthers M.H. et al. (1980),Nuc. Acids Res. Symp. Ser. 215-23 и Horn T. et al. (1980), Nuc. Acids Res. Symp. Ser. 225-232). Молекулярная эволюция. После выделения кодирующей фермент нуклеотидной последовательности или идентификации нуклеотидной последовательности, кодирующей данный фермент, может потребоваться модифицировать выбранную нуклеотидную последовательность, например может потребоваться подвергнуть последовательность мутации с целью получения фермента, соответствующего настоящему изобретению. Мутации можно индродуцировать, используя синтетические олигонуклеотиды. Данные олигонуклеотиды включают нуклеотидные последовательности, фланкирующие требующиеся мутационные сайты.- 23014985 Подходящий метод описан в статье Morinaga et al. (Biotechnology (1984), 2, p. 646-649). Другой метод интродукции мутаций в кодирующие фермент нуклеотидные последовательности описан в статьеNelson и Long (Analytical Biochemistry (1989), 180, p. 147-151). Вместо сайт-направленного мутагенеза, как описано выше, можно интродуцировать мутации неспецифическим образом, например используя коммерческий набор, такой как набор для ПЦР-мутагенезаGeneMorph фирмы Stratagene или набор для множественного неспецифического ПЦР-мутагенеза фирмыClontech. Заявка ЕР 0583265 относится к методам оптимизации мутагенеза на основе ПЦР, которые можно также сочетать с использованием мутагенных аналогов ДНК, таких как описаны в заявке ЕР 0866796. Способствующие ошибкам ПЦР-технологии подходят для получения вариантов липидацилтрансфераз с предпочтительными характеристиками. Заявка WO 0206457 относится к молекулярной эволюции липазы. Третий способ получения новых последовательностей представляет собой фрагментацию неидентичных нуклеотидных последовательностей либо при использовании любого числа рестрикционных ферментов, либо такого фермента, как ДНКаза I, и повторную сборку полных нуклеотидных последовательностей, кодирующих функциональные белки. Альтернативно можно использовать одну или множество неидентичных нуклеотидных последовательностей и интродуцировать мутации во время повторной сборки полной нуклеотидной последовательности. Технологии тасования ДНК и тасования семейств подходят для получения вариантов липидацилтрансфераз с предпочтительными характеристиками. Подходящие способы осуществления "тасования" можно найти в заявках ЕР 0752008, ЕР 1138763,ЕР 1103606. Тасование можно также сочетать с другими формами ДНК-мутагенеза, как описано с заявках US 6180406 и WO 01/34835. Таким образом, имеется возможность получить множество сайт-направленных или неспецифических мутацией в нуклеотидной последовательности как in vivo, так и in vitro и затем провести скрининг на повышенную функциональность кодируемого полипептида различными способами. Используя insilico и экзоопосредованные методы (см. заявки WO 00/58517, US 6344328, US 6361974), например, можно осуществить молекулярную эволюцию, при которой полученный вариант сохраняет очень низкую гомологию с известными ферментами или белками. Данные варианты, полученные таким путем, могут обладать существенной структурной аналогией с известными ферментами трансферазами, но иметь очень низкую гомологию последовательности аминокислот. В качестве неограничивающего примера, кроме того, мутации или природные варианты полинуклеотидной последовательности могут быть подвергнуты рекомбинации либо с диким типом, либо с другими мутациями с целью получения новых вариантов. Данные новые варианты также можно подвергнуть скринингу на повышенную функциональность кодируемого полипептида. Применение вышеупомянутых и аналогичных методов молекулярной эволюции дает возможность идентификации и селекции вариантов ферментов, представленных в настоящем изобретении, которые обладают предпочтительными характеристиками, без предварительного знания структуры или функции белка и обеспечивает продукцию непредсказанных, но полезных мутаций и вариантов. Имеется множество примеров применения молекулярной эволюции в области оптимизации или изменения активности фермента, данные примеры включают, но не ограничены одним или более из следующих: оптимизированная экспрессия и/или активность в клетке-хозяине или in vitro; повышенная ферментная активность; измененная специфичность в отношении субстрата и/или продукта; повышенная или пониженная ферментативная или структурная стабильность; измененная ферментативная активность/специфичность в предпочтительных условиях окружающей среды, например температуры, рН и/или субстрата. Как будет очевидно компетентному специалисту в данной области, при использовании инструментов молекулярной эволюции можно изменить фермент с целью повышения функциональности фермента. Соответственно, липидацилтрансфераза, используемая в изобретении, может представлять собой вариант, т.е. может включать по меньшей мере одну замену, делецию или добавление аминокислоты по сравнению с исходным ферментом. Варианты фермента сохраняют по меньшей мере 1, 2, 3, 5, 10, 15, 20,30, 40, 50, 60, 70, 80, 90, 95, 97, 99% гомологию с исходным ферментом. Подходящие исходные ферменты могут включать любой фермент с активностью эстеразы или липазы. Предпочтительно, когда исходный фермент выравнивают с консенсусной последовательностью pfam00657. В предпочтительном варианте осуществления вариант фермента липидацилтрансферазы сохраняет или включает по меньшей мере один или более остатков аминокислот консенсусной последовательностиpfam00657, обнаруженных в блоках GDSX, GANDY и НРТ. Ферменты, такие как липазы, с отсутствующей или с низкой активностью липидацилтрансферазы в водной среде можно подвергнуть мутированию, используя инструменты молекулярной эволюции для интродукции или усиления трансферазной активности, получая при этом фермент липидацилтрансферазу с существенной трансферазной активностью, подходящий для использования в композициях и способах, представленных в настоящем изобретении. Соответственно липидацилтрансфераза, предназначенная для использования в изобретении, может представлять собой вариант с повышенной ферментативной активностью в отношении фосфолипидов по сравнению с исходным ферментом. Предпочтительно, когда данные варианты также имеют низкую или не имеют активности в отношении лизополярных липидов. Повышенная активность в отношении фос- 24014985 фолипидов может также являться результатом гидролиза и/или трансферазной активности или комбинации обоих факторов. Вариант липидацилтрансферазы, предназначенный для использования в изобретении, может иметь пониженную активность в отношении триглицеридов, и/или моноглицеридов, и/или диглицеридов по сравнению с исходным ферментом. Соответственно вариант фермента может не обладать активностью в отношении триглицеридов,и/или моноглицеридов, и/или диглицеридов. Альтернативно, вариант фермента, предназначенный для использования в изобретении, может иметь повышенную активность в отношении триглицеридов и/или может также иметь повышенную активность в отношении одного или более из следующих соединений: полярных липидов, фосфолипидов,лецитина, фосфатидилхолина. Известны варианты липидацилтрансферазы, и один или более данных вариантов могут подходить для использования в способах и вариантах применения, соответствующих настоящему изобретению,и/или в композициях ферментов, соответствующих настоящему изобретению. Только в качестве примера варианты липидацилтрансфераз, описанные в следующих ссылках, могут быть использованы согласно настоящему изобретению: см. статьи HiltonBuckley J. Biol. Chem. 15 January, 1991; 266(2): 997-1000;Robertson et al. J. Biol. Chem. 21 January, 1994; 269(3): 2146-50; Brumlik et al. J. Bacteriol, April 1996; 178(7): 2060-4; Peelman et al. Protein Sci. March 1998; 7(3): 587-99. Последовательности аминокислот. Настоящее изобретение охватывает также последовательности аминокислот полипептидов, обладающих специфическими свойствами, как определено в данном контексте. Как используют в данном контексте, термин "последовательность аминокислот" является синонимом термина "полипептид" и/или термина "белок". В ряде случаев термин "последовательность аминокислот" является синонимом термина "пептид". Последовательность аминокислот можно получить/выделить из подходящего источника, или она может быть создана синтетическим путем, или может быть получена с использованием технологий рекомбинантной ДНК. Соответственно последовательности аминокислот можно получить из выделенных полипептидов,описанных в данном контексте, с помощью стандартных методик. Одним из подходящих методов определения последовательностей аминокислот из выделенных полипептидов является следующий. Очищенный полипептид может быть лиофилизирован и 100 мкг лиофилизированного материала растворяют в 50 мкл смеси 8 М мочевины и 0,4 М гидрокарбоната аммония, рН 8,4. Растворенный белок можно денатурировать и восстановить в течение 15 мин при 50 С после покрытия слоем азота и добавления 5 мкл 45 мМ динитротрейтола. После охлаждения до комнатной температуры можно добавить 5 мкл 100 мМ йодацетамида для того, что дериватизировать цистеиновые остатки в течение 15 мин при комнатной температуре в темноте под азотом. К вышеуказанной реакционной смеси можно добавить 135 мкл воды и 5 мкг эндопротеиназы Lys-C в 5 мкл воды и можно осуществить разложение при 37 С под азотом в течение 24 ч. Полученные в результате пептиды можно разделить обращено-фазовой ВЭЖХ (высокоэффективной жидкостной хроматографией) на колонке VYDAC С 18 (0,4615 см; 10 мкм; The Separation Group,California, USA) при использовании растворителя А: 0,1% ТФУК (трифторуксусная кислота) в воде и растворителя В: 0,1% ТФУК в ацетонитриле. Отобранные пептиды можно повторно хроматографировать на колонке Develosil С 18, используя ту же систему растворителей, перед N-концевым секвенированием. Секвенирование можно осуществить с помощью секвенатора Applied Biosystems 476A при использовании быстрых циклов с импульсным введением жидкости согласно инструкциям изготовителя (фирмаApplied Biosystems, California, USA). Идентичность последовательности или гомология последовательности. Настоящее изобретение охватывает также использование последовательностей, имеющих степень гомологии последовательности с последовательностью(ями) аминокислот полипептида, обладающего специфическими свойствами, определенными в данном контексте, или любой нуклеотидной последовательностью, кодирующей данный полипептид (далее обозначают как "гомологичная последовательность(и)"). В данном случае термин "гомолог" означает элемент, имеющий некоторую гомологию с данными последовательностями аминокислот и данными нуклеотидными последовательностями. В данном случае термин "гомология" может быть приравнен к термину "идентичность". Гомологичная последовательность аминокислот и/или нуклеотидная последовательность должна давать и/или кодировать полипептид, который сохраняет функциональную активность и/или повышает активность фермента. В настоящем контексте предусматривают, что гомологичная последовательность включает последовательность аминокислот, которая может быть по меньшей мере на 75, 85 или 90% идентичной, предпочтительно по меньшей мере на 95 или 98% идентичной заданной последовательности. Как правило,гомологи будут включать такие же активные центры и т.п., как заданная последовательность аминокис- 25014985 лот. Хотя гомологию можно также рассматривать в терминах близости (т.е. остатков аминокислот,имеющих близкие химические свойства/функции), в контексте настоящего изобретения предпочтительно, когда гомологию выражают в терминах идентичности последовательности. В настоящем контексте предусматривают, что гомологичная последовательность включает нуклеотидную последовательность, которая может быть по меньшей мере на 75, 85 или 90% идентичной, предпочтительно по меньшей мере на 95 или 98% идентичной нуклеотидной последовательности, кодирующей полипептид, представленный в изобретении (заданная последовательность). Как правило, гомологи будут включать одинаковые последовательности, которые кодируют такие же активные центры и т.п.,как заданная последовательность. Хотя гомологию можно также рассматривать в терминах близости (т.е. остатков аминокислот, имеющих близкие химические свойства/функции), в контексте настоящего изобретения предпочтительно, когда гомологию выражают в терминах идентичности последовательности. Сравнения гомологии можно проводить визуально или, более обыкновенно, с помощью легкодоступных программ сравнения последовательностей. Данные коммерчески доступные компьютерные программы могут рассчитать % гомологии между двумя или более последовательностями. Процент гомологии можно рассчитать относительно соседних последовательностей, т.е. одну последовательность выравнивают с другой последовательностью и каждую аминокислоту в одной последовательности непосредственно сравнивают с соответствующей аминокислотой в другой последовательности, по одному остатку за один раз. Это называют сравнительный анализ "без гэпов". Как правило,данные сравнительные анализы без гэпов проводят только при относительно маленьком числе остатков. Хотя это очень простой и совместимый метод, в нем не принимают во внимание, что, например, в идентичной в других отношениях паре последовательностей одна инсерция или делеция будет вызывать выпадение следующих остатков аминокислот из элайнмента, таким образом потенциально приводя в результате к большому снижению % гомологии при проведении общего элайнмента. Впоследствии разрабатывают большинство методов сравнения последовательностей, чтобы получить оптимальные элайнменты, в которых принимают во внимание возможные инсерции и делеции без неправильного определения штрафа для всего результата гомологии. Это достигается введением "гэпов" в сравниваемые последовательности для того, чтобы попытаться довести до максимума локальную гомологию. Однако в данных более сложных методах устанавливают "штрафы за гэпы" за каждый гэп, который появляется при сравнительном анализе, так что за одинаковое число идентичных аминокислот при сравнительном анализе последовательности с насколько это возможно маленьким числом гэпов (отражающим более высокое родство между двумя сравниваемыми последовательностями) будут получать более высокое значение, чем результат элайнмента с множеством гэпов. Как правило, используют выражение"аффинные цены гэпов", которое отражает относительно высокую цену наличия гэпа и меньший штраф за каждый последующий остаток в гэпе. Это представляет собой наиболее широко используемую систему подсчета гэпов. Высокие штрафы за гэпы, конечно, будут давать оптимизированные элайнменты с меньшим числом гэпов. Большинство программ элайнмента допускают модификацию штрафов за гэпы. Однако предпочтительно, когда используют значения, заданные по умолчанию, при использовании данных программ для сравнений последовательностей. Например, при использовании пакета GCG WisconsinBestfit штраф за гэп по умолчанию для последовательностей аминокислот составляет -12 за гэп и -4 за каждое удлинение. Вследствие этого для вычисления максимального % гомологии необходимо получение оптимального элайнмента, учитывающего штрафы за гэпы. Подходящей компьютерной программой для осуществления данного элайнмента является пакет программ GCG Wisconsin Bestfit (см. статью Devereux et al. 1984, Nuc. Acids Research, 12, p. 387). Примеры других программ, которые могут проводить сравнения последовательностей, включают, но без ограничения перечисленным, пакет программ BLAST (см. монографию Ausubel et al. 1999, Short Protocols in Molecular Biology, 4-е изд., глава 18), FASTA (см. статьюAltschul et al. 1990, J. Mol. Biol. 403-410) и набор инструментов для сравнения GENEWORKS. Обе программы, BLAST и FASTA, доступны для поиска в автономном и неавтономном режимах (см. Ausubel etal. 1999, p. 7-58 - 7-60). Однако для некоторых вариантов применения предпочтительно использование программы GCG. Новый инструмент, названный BLAST 2 Sequences, также доступен для сравнения белковой и нуклеотидной последовательности (см. FEMS Microbiol. Lett. 1999, 174(2): 247-50; FEMS Microbiol. Lett. 1999, 177(1): 187-8 и tatianancbi.nlm.nih.gov). Хотя конечный % гомологии можно измерить в терминах идентичности, сам процесс элайнмента,как правило, не основан на сравнении пар по принципу "все или ничего". Вместо этого в основном используют масштабную матрицу для подсчета подобия, которая устанавливает результаты для каждого попарного сравнения на основе химической близости или эволюционного расстояния. Примером такой обычно используемой матрицы является матрица BLOSUM62 - матрица, заданная по умолчанию для пакета программ BLAST. В программах GCG Wisconsin, как правило, используют либо общедоступные значения, заданные по умолчанию, либо заказную таблицу сравнения символов, если она прилагается(дальнейшие подробности см. в руководстве для пользователя). Для ряда приложений предпочтительно использовать для пакета GCG общедоступные значения, заданные по умолчанию, или в случае другой программы - заданную по умолчанию матрицу, такую как BLOSUM62.- 26014985 Альтернативно, процент гомологии можно рассчитать, используя функцию множественного элайнмента в программе DNASIS (Hitachi Software), основанной на алгоритме, аналогичном CLUSTAL (см. статью Higgins D.G.Sharp P.M. (1988), Gene 73(1), 237-244). После того как программа даст оптимальный сравнительный анализ, возможно рассчитать % гомологии, предпочтительно % идентичности последовательностей. Программа, как правило, делает это как часть сравнения последовательностей и генерирует числовой результат. В предпочтительном аспекте настоящего изобретения используют следующую программу и установки для расчета процента гомологии/идентичности. Для последовательностей аминокислот процент идентичностей (гомологии) или "положительные результаты" вычисляют с помощью AlignX VectorNTI(Vector NTI Advance 9.1 фирмы Invitrogen Corporation, Carlsbad, California, USA), причем для каждой возможной пары последовательностей аминокислот установки представляют собой параметры, заданные по умолчанию (штраф за открытие гэпа составляет 10, штраф за удлинение гэпа - 0,1). Последовательности могут также иметь делеции, инсерции или замены остатков аминокислот, которые образуют молчащее изменение и в результате приводят к образованию функционально эквивалентной субстанции. Преднамеренные замены аминокислот можно сделать на основе близости полярности, заряда, растворимости, гидрофобности, гидрофильности и/или амфипатической природы остатков,пока сохраняется вторичная связывающая активность субстанции. Например, отрицательно заряженные аминокислоты включают аспарагиновую кислоту и глутаминовую кислоту; положительно заряженные аминокислоты включают лизин и аргинин и аминокислоты с незаряженными полярными головными группами, имеющие близкие значения гидрофильности, включают лейцин, изолейцин, валин, глицин,аланин, аспарагин, глутамин, серин, треонин, фенилаланин и тирозин. Консервативные замены можно сделать, например, согласно нижеприведенной таблице. Аминокислоты из одного блока во второй колонке и предпочтительно из одной строки в третьей колонке можно заменять одна другой. Настоящее изобретение также охватывает гомологичную замену (оба термина, замена и замещение,используют в данном контексте для обозначения взаимообмена имеющихся остатков аминокислот с альтернативным остатком), которая может существовать, т.е. замена подобного на подобное, например основной на основную, кислой на кислую, полярной на полярную и т.п. Может также происходить негомологичная замена, т.е. остатка из одного класса на другой или, альтернативно, предусматривающая включение неприродных аминокислот, таких как орнитин (далее обозначают как Z), диаминомасляная кислота (далее обозначают как В), норлейцин (далее обозначают как О), пиридилаланин, тиенилаланин, нафтилаланин и фенилглицин. Могут быть также проведены замещения неприродными аминокислотами. Варианты последовательностей аминокислот могут включать подходящие спейсерные группы, которые могут быть введены между двумя остатками аминокислот последовательности, в том числе алкильные группы, такие как метильная, этильная или пропиловая группы, в дополнение к аминокислотным спейсерам, таким как остатки глицина или -аланина. Следующая форма вариации, которая включает присутствие остатков аминокислот в пептоидной форме, будет хорошо понятна компетентным специалистам в данной области. Чтобы избежать неопределенности, термин "пептоидная форма" используют для ссылки на остатки вариантов аминокислот, в которых -углеродная замещающая группа находится на атоме азота остатка, а не на -углероде. Методы получения пептидов в пептоидной форме известны в области техники, например, см. статьи Simon R.J. et al., PNAS (1992), 89(20), 9367-9371 и Horwell D.C.,Trends Biotechnol. (1995), 13(4), 132-134. Нуклеотидные последовательности, предназначенные для применения в настоящем изобретении или кодирующие полипептид, обладающий специфическими свойствами, описанными в данном контексте, могут включать в своей структуре синтетические или модифицированные нуклеотиды. В области техники известен ряд различных типов модификации олигонуклеотидов. Они включают метилфосфонатные и фосфоротиоатные скелеты и/или введение акридиновых или полилизиновых цепей в 3'- и/или 5'-концы молекулы. Для целей настоящего изобретения следует иметь в виду, что нуклеотидные последовательности, описанные в данном контексте, можно модифицировать любым из методов, имеющихся в области техники. Данные модификации могут быть проведены с целью повышения активности in vivo или продолжительности существования нуклеотидных последовательностей.- 27014985 Настоящее изобретение также охватывает использование нуклеотидных последовательностей, которые комплементарны последовательностям, представленным в данном контексте, или любое производное, фрагмент или его производное. Если последовательность комплементарна ее фрагменту, то данную последовательность можно использовать в качестве зонда для идентификации близких кодирующих последовательностей в других организмах и т.п. Полинуклеотиды, которые не являются на 100% гомологичными последовательностям, присутствующим в настоящем изобретении, но входят в объем изобретения, можно получить рядом способов. Другие варианты последовательностей, описанные в данном контексте, можно получить, например, зондированием библиотек ДНК, полученных у ряда субъектов, например субъектов из различных популяций. Кроме того, можно получить другие вирусные/бактериальные или клеточные гомологи, особенно клеточные гомологи, обнаруженные в клетках млекопитающих (например, в клетках крысы, мыши,крупного рогатого скота и приматов), и данные гомологи и их фрагменты, как правило, будут способны к селективной гибридизации с последовательностями, показанными в перечне последовательностей, приведенном в данном материале. Данные последовательности можно получить зондированием библиотек кДНК, полученных из/или библиотек геномных ДНК других видов животных, и зондированием данных библиотек зондами, включающими полностью или часть любой из последовательностей в прилагаемых перечнях последовательностей в условиях сред высокой жесткости. Аналогичные рассуждения используют для получения видовых гомологов и аллельных вариантов полипептидных или нуклеотидных последовательностей, представленных в изобретении. Варианты и штаммовые/видовые гомологи можно также получить, используя ПЦР с вырожденными праймерами, в которой будут использованы праймеры, созданные для получения направленности на последовательности в вариантах и гомологах, кодирующие консервативные последовательности аминокислот в последовательностях, представленных в настоящем изобретении. Консервативые последовательности можно предсказать, например, посредством элайнмента последовательностей аминокислот из нескольких вариантов/гомологов. Элайнменты последовательности можно провести, используя компьютерные программы, известные в области техники. Например, широко используют программу GCGWisconsin PileUp. Праймеры, используемые в вырожденной ПЦР, будут включать одно или более вырожденных положений и будут использованы в условиях жесткости ниже тех, которые используют для клонирования последовательностей с праймерами одной и той же последовательности относительно известных последовательностей. Альтернативно, данные полинуклеотиды можно получить сайт-направленным мутагенезом охарактеризованных последовательностей. Это может быть использовано, когда, например, требуются изменения последовательности молчащего кодона с целью оптимизации предпочтительности кодонов для определенной клетки-хозяина, в которой экспрессируются полинуклеотидные последовательности. Другие изменения последовательности могут потребоваться для интродукции сайтов распознавания рестрикционного полипептида или для изменения свойства или функции полипептидов, кодируемых полинуклеотидами. Полинуклеотиды (нуклеотидные последовательности), представленные в изобретении, можно использовать для получения праймера, например ПЦР-праймера, праймера для альтернативной реакции амплификации, зонда, например, меченного уходящей меткой, принятыми средствами с использованием радиоактивных или нерадиоактивных меток либо полинуклеотиды можно клонировать в векторы. Данные праймеры, зонды и другие фрагменты будут иметь длину по меньшей мере 15, предпочтительно по меньшей мере 20, например по меньшей мере 25, 30 или 40 нуклеотидов, и они также охватываются термином полинуклеотиды, представленные в изобретении, как используют в данном контексте. Полинуклеотиды, такие как ДНК-полинуклеотиды и зонды, представленные в изобретении, можно получить рекомбинантно, синтетическим или любыми средствами, доступными компетентным специалистам в данной области. Их можно также клонировать стандартными методами. Как правило, праймеры будут получать синтетическими средствами, включая постадийное получение требующейся последовательности нуклеиновой кислоты по одному нуклеотиду за один раз. Методики осуществления этой цели с использованием автоматизированных технологий легко доступны в области техники. Более длинные полинуклеотиды, как правило, будут получать с использованием рекомбинантных средств, например при использовании методик клонирования с помощью ПЦР (полимеразной цепной реакции). Данные методики будут включать получение пары праймеров (например, приблизительно из 15-30 нуклеотидов), фланкирующих направленную на липид последовательность, которую требуется клонировать, осуществление контакта праймеров с мРНК или кДНК, полученных из клетки животного или человека, проведение полимеразной цепной реакции в условиях, которые приводят к амплификации требующегося участка, выделение амплифицированного фрагмента (например, путем очистки реакционной смеси на агарозном геле) и выделение амплифицированной ДНК. Можно сконструировать праймеры, включающие подходящие сайты распознавания рестриктазами, чтобы амплифицированную ДНК можно было клонировать в подходящий клонирующий вектор.- 28014985 Гибридизация. Настоящее изобретение охватывает также последовательности, которые комплементарны последовательностям, представленным в настоящем изобретении, или последовательности, которые способны гибридизоваться либо с последовательностями, представленными в настоящем изобретении, либо с последовательностями, которые им комплементарны. Термин "гибридизация", как используют в данном контексте, будет включать "способ, посредством которого нить нуклеиновой кислоты связывается с комплементарной нитью посредством спаривания оснований", а также способ амплификации, осуществляемый в технологиях полимеразной цепной реакции (ПЦР). Настоящее изобретение охватывает также применение нуклеотидных последовательностей, которые способны гибридизоваться с последовательностями, которые комплементарны заданным последовательностям, обсуждаемым в данном контексте, или любому производному, фрагменту или его производному. Настоящее изобретение охватывает также последовательности, которые комплементарны последовательностям, которые способны гибридизоваться с нуклеотидными последовательностями, обсуждаемыми в данном контексте. Условия гибридизации основаны на температуре плавления (Тп) нуклеотид-связывающего комплекса, как описано в монографии Berger и Kimmel (1987), Guide to Molecular Cloning Techniques,Methods in Enzymology, vol. 152, Academic Press, San Diego CA), и обеспечивают определенную "жесткость", как объясняют ниже. Максимальная жесткость, как правило, имеет место приблизительно при Тп 5 С (5 С ниже Тп зонда); высокая жесткость приблизительно при 5-10 С ниже Тп; средняя жесткость приблизительно при 10-20 С ниже Тп и низкая жесткость приблизительно при 20-25 С ниже Тп. Как будут иметь в виду компетентные специалисты в области техники, гибридизацию максимальной жесткости можно использовать для идентификации или детекции нуклеотидных последовательностей, тогда как гибридизацию средней(или низкой) жесткости можно использовать для идентификации или детекции близких или родственных полинуклеотидных последовательностей. Предпочтительно, когда настоящее изобретение охватывает последовательности, которые комплементарны последовательностям, которые способны гибридизоваться в условиях высокой жесткости или условиях средней жесткости с нуклеотидными последовательностями, кодирующими полипептиды, обладающие специфическими свойствами, как определено в данном контексте. Более предпочтительно, когда настоящее изобретение охватывает последовательности, которые комплементарны последовательностям, которые способны гибридизоваться в условиях высокой жесткости (например, 65 С и 0,1SSC 1SSC=0,15 М NaCl, 0,015 М цитрат Na, pH 7,0) с нуклеотидными последовательностями, кодирующими полипептиды, обладающие специфическими свойствами, как определено в данном контексте. Настоящее изобретение относится также к нуклеотидным последовательностям, которые могут гибридизоваться с нуклеотидными последовательностями, обсуждаемыми в данном контексте (включая последовательности, комплементарные обсуждаемым в данном контексте). Настоящее изобретение относится также к нуклеотидным последовательностям, которые комплементарны последовательностям, которые могут гибридизоваться с нуклеотидными последовательностями, обсуждаемыми в данном контексте (включая последовательности, комплементарные обсуждаемым в данном контексте). В объем настоящего изобретения включены также полинуклеотидные последовательности, которые способны гибридизоваться с нуклеотидными последовательностями, обсуждаемыми в данном контексте,в условиях средней до максимальной жесткости. В предпочтительном аспекте настоящее изобретение покрывает нуклеотидные последовательности,которые могут гибридизоваться с нуклеотидными последовательностями, обсуждаемыми в данном контексте, или их комплементом в жестких условиях (например, 50 С и 0,2SSC). В более предпочтительном аспекте настоящее изобретение покрывает нуклеотидные последовательности, которые могут гибридизоваться с нуклеотидными последовательностями, обсуждаемыми в данном контексте, или их комплементом в условиях высокой жесткости (например, 65 С и 0,1SSC). Экспрессия полипептидов. Нуклеотидная последовательность, предназначенная для использования в настоящем изобретении или для кодирования полипептида, обладающего специфическими свойствами, как определено в данном контексте, может быть включена в рекомбинантный реплицирующийся вектор. Вектор можно использовать для репликации и экспрессии нуклеотидной последовательности в форме полипептида в и/или из совместимой клетки-хозяина. Экспрессию можно контролировать, используя контролирующие последовательности, которые включают промоторы/энхансеры и другие сигналы регуляции экспрессии. Могут быть использованы прокариотические промоторы и промоторы, функциональные в эукариотических клетках. Можно использовать тканеспецифические или специфические в отношении стимулов промото- 29
МПК / Метки
МПК: C11B 3/00, C07F 9/10, C11C 3/00
Метки: липидацилтрансферазы, гидратацией, масел, применение, ферментативного, осуществления, способ, пищевых, рафинирования, способа
Код ссылки
<a href="https://eas.patents.su/30-14985-sposob-fermentativnogo-rafinirovaniya-pishhevyh-masel-gidrataciejj-i-primenenie-lipidaciltransferazy-dlya-osushhestvleniya-sposoba.html" rel="bookmark" title="База патентов Евразийского Союза">Способ ферментативного рафинирования пищевых масел гидратацией и применение липидацилтрансферазы для осуществления способа</a>
Предыдущий патент: Способ замены труб в риформинговой установке
Следующий патент: Сосудистое растение с повышенной толерантностью к na + и способ его получения
Случайный патент: Коммуникационное устройство и способ блокировки элемента оборудования