Энантиомерно чистые аминогетероарильные соединения в качестве ингибиторов протеинкиназы
Номер патента: 13678
Опубликовано: 30.06.2010
Авторы: Фанк Ли Эндрю, Намбу Митчелл Дэвид, Шэнь Хун, Кунг Пэй -Пэй, Пэйриш Мейсон Алан, Мэн Джерри Цзялунь, Цуй Цзинжун Джин, Трэн -Дюбе Мишелль Бич, Цзя Лэй
Формула / Реферат
1. Энантиомерно чистое соединение формулы 1
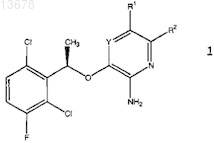
где Y представляет собой N или CR12;
R1 выбирают из водорода, галогена, С6-12арила, 5-12-членного гетероарила, С3-12циклоалкила, 3-12-членной гетероалициклической группы, -O(CR6R7)nR4, -C(O)R4, -С(О)OR4, -CN, -NO2, -S(O)mR4, -SO2NR4R5,
-C(O)NR4R5, -NR4C(O)R5, -C(=NR6)NR4R5, С1-8алкила, С2-8алкенила и С2-8алкинила; и каждый из атомов водорода в R1 необязательно замещен одной или несколькими группами R3;
R2 представляет собой водород;
каждый из R3 независимо представляет собой галоген, С1-12алкил, С2-12алкенил, С2-12алкинил, С3-12 циклоалкил, С6-12арил, 3-12-членную гетероалициклическую группу, 5-12-членный гетероарил, -S(O)mR4,
-SO2NR4R5, -S(O)2OR4, -NO2, -NR4R5, -(CR6R7)nOR4, -CN, -C(O)R4, -OC(O)R4, -O(CR6R7)nR4, -NR4C(O)R5,
-(CR6R7)nC(O)OR4, -(CR6R7)nOR4, -(CR6R7)nC(O)NR4R5, -(CR6R7)nNCR4R5, -C(=NR6)NR4R5, -NR4C(O)NR5R6,
-NR4S(O)pR5 или -C(O)NR4R5, каждый из атомов водорода в R3 необязательно замещен R8, и группы R3 на соседних атомах могут объединяться с образованием С6-12арила, 5-12-членного гетероарила, С3-12 циклоалкила или 3-12-членной гетероалициклической группы;
каждый из R4, R5, R6 и R7 независимо представляет собой водород, галоген, С1-12алкил, С2-12алкенил, С2-12 алкинил, С3-12циклоалкил, С6-12арил, 3-12-членную гетероалициклическую группу, 5-12-членный гетероарил; или любые два из R4, R5, R6 и R7, связанные с одним и тем же атомом азота, могут вместе с азотом, с которым они связаны, объединяться с образованием 3-12-членной гетероалициклической или 5-12-членной гетероарильной группы, необязательно содержащей 1-3 дополнительных гетероатома, выбранных из N, О и S; или любые два из R4, R5, R6 и R7, связанные с одним и тем же атомом углерода, могут объединяться с образованием С3-12циклоалкила, С6-12арила, 3-12-членной гетероалициклической группы или 5-12-членной гетероарильной группы; и каждый из атомов водорода в R4, R5, R6 и R7 необязательно замещен R8;
каждый из R8 независимо представляет собой галоген, С1-12алкил, С2-12алкенил, С2-12алкинил, С3-12циклоалкил, С6-12арил, 3-12-членную гетероалициклическую группу, 5-12-членный гетероарил, -NH2, -CN, -ОН, -О-С1-12алкил, -O-(CH2)nC3-12циклоалкил, -O-(CH2)nC6-12арил, -О-(СН2)n(3-12-членную гетероалициклическую группу) или -О-(СН2)n(5-12-членный гетероарил); и каждый из атомов водорода в R8 необязательно замещен R11;
каждый из R11 независимо представляет собой галоген, С1-12алкил, С1-12алкокси, С3-12циклоалкил, С6-12арил, 3-12-членную гетероалициклическую группу, 5-12-членный гетероарил, -О-С1-12алкил, -О-(CH2)nC3-12 циклоалкил, -O-(CH2)nC6-12арил, -О-(СН2)n(3-12-членную гетероалициклическую группу), -О-(СН2)n(5-12-членный гетероарил) или -CN, и каждый из атомов водорода в R11 необязательно замещен галогеном, -ОН,
-CN, -С1-12алкилом, который может быть частично или полностью галогенированным, -O-C1-12алкилом, который может быть частично или полностью галогенированным, -СО, -SO или -SO2;
R12 представляет собой водород;
каждый из m независимо представляет собой 0, 1 или 2;
каждый из n независимо представляет собой 0, 1, 2, 3 или 4;
каждый из р независимо представляет собой 1 или 2;
где указанный 5-12-членный гетероарил выбран из фурановой, тиофеновой, пиррольной, пирролиновой, пирролидиновой, диоксолановой, оксазольной, тиазольной, имидазольной, имидазолиновой, имидазолидиновой, пиразольной, пиразолиновой, пиразолидиновой, изоксазольной, изотиазольной, оксадиазольной, триазольной, тиадиазольной, пирановой, пиридиновой, пиперидиновой, диоксановой, морфолиновой, дитиановой, тиоморфолиновой, пиридазиновой, пиримидиновой, пиразиновой, пиперазиновой, триазиновой, тритиановой, азитидиновой или фенильной группы;
или его фармацевтически приемлемая соль, гидрат или сольват.
2. Соединение по п.1, в котором Y представляет собой N.
3. Соединение по п.1, в котором Y представляет собой CR12.
4. Энантиомерно чистое соединение формулы 1а
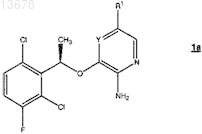
где Y представляет собой N или СН;
R1 представляет собой 5-12-членный гетероарил, необязательно замещенный R3;
каждый из R3 независимо представляет собой галоген, С1-12алкил, С2-12алкенил, С2-12алкинил, С3-12 циклоалкил, С6-12арил, 3-12-членную гетероалициклическую группу, 5-12-членный гетероарил, -S(O)mR4,
-SO2NR4R5, -S(O)2OR4, -NO2, -NR4R5, -(CR6R7)nOR4, -CN, -C(O)R4, -OC(O)R4, -O(CR6R7)nR4, -NR4C(O)R5,
-(CR6R7)nC(O)OR4, -(CR6R7)nOR4, -(CR6R7)nC(O)NR4R5, -(CR6R7)nNCR4R5, -C(=NR6)NR4R5, -NR4C(O)NR5R6,
-NR4S(O)pR5 или -C(O)NR4R5, каждый из атомов водорода в R3 необязательно замещен R8, и группы R3 на соседних атомах могут объединяться с образованием С6-12арила, 5-12-членного гетероарила, С3-12 циклоалкила или 3-12-членной гетероалициклической группы;
каждый из R4, R5, R6 и R7 независимо представляет собой водород, галоген, С1-12алкил, С2-12алкенил, С2-12 алкинил, С3-12циклоалкил, С6-12арил, 3-12-членную гетероалициклическую группу, 5-12-членный гетероарил; или любые два из R4, R5, R6 и R7, связанные с одним и тем же атомом азота, могут вместе с азотом, с которым они связаны, объединяться с образованием 3-12-членной гетероалициклической группы или 5-12-членной гетероарильной группы, необязательно содержащей 1-3 дополнительных гетероатома, выбранных из N, О и S; или любые два из R4, R5, R6 и R7, связанные с одним и тем же атомом углерода, могут объединяться с образованием С3-12циклоалкильной, С6-12арильной, 3-12-членной гетероалициклической группы или 5-12-членной гетероарильной группы; и каждый из атомов водорода в R4, R5, R6 и R7 необязательно замещен R8;
каждый из R независимо представляет собой галоген, С1-12алкил, С2-12алкенил, С2-12алкинил, С3-12 циклоалкил, С6-12арил, 3-12-членную гетероалициклическую группу, 5-12-членный гетероарил, -NH2, -CN,
-ОН, -О-С1-12алкил, -O-(CH2)nC3-12циклоалкил, -O-(CH2)nC6-12арил, -О-(СН2)n(3-12-членную гетероалициклическую группу) или -О-(СН2)n(5-12-членный гетероарил); и каждый из атомов водорода в R8необязательно замещен R11;
каждый из R11 независимо представляет собой галоген, С1-12алкил, С1-12алкокси, С3-12циклоалкил, С6-12арил, 3-12-членную гетероалициклическую группу, 5-12-членный гетероарил, -O-С1-12алкил, -О-(CH2)nC3-12 циклоалкил, -O-(CH2)nC6-12арил, -О-(СН2)n(3-12-членную гетероалициклическую группу), -О-(СН2)n(5-12-членный гетероарил) или -CN, и каждый из атомов водорода в R11 необязательно замещен галогеном, -ОН,
-CN, -С1-12алкилом, который может быть частично или полностью галогенированным, -О-С1-12алкилом, который может быть частично или полностью галогенированным, -СО, -SO или -SO2;
каждый из m независимо представляет собой 0, 1 или 2;
каждый из n независимо представляет собой 0, 1, 2, 3 или 4;
каждый из р независимо представляет собой 1 или 2;
где указанный 5-12-членный гетероарил выбран из фурановой, тиофеновой, пиррольной, пирролиновой, пирролидиновой, диоксолановой, оксазольной, тиазольной, имидазольной, имидазолиновой, имидазолидиновой, пиразольной, пиразолиновой, пиразолидиновой, изоксазольной, изотиазольной, оксадиазольной, триазольной, тиадиазольной, пирановой, пиридиновой, пиперидиновой, диоксановой, морфолиновой, дитиановой, тиоморфолиновой, пиридазиновой, пиримидиновой, пиразиновой, пиперазиновой, триазиновой, тритиановой, азитидиновой или фенильной группы;
или его фармацевтически приемлемая соль, гидрат или сольват.
5. Энантиомерно чистое соединение, выбранное из группы, состоящей из
5-бром-3-[(R)-1-(2,6-дихлор-3-фторфенил)этокси]пиразин-2-иламина;
5-йод-3-[(R)-1-(2,6-дихлор-3-фторфенил)этокси]пиридин-2-иламина;
5-бром-3-[1(R)-(2,6-дихлор-3-фторфенил)этокси]пиридин-2-иламина;
4-{5-амино-6-[(R)-1-(2,6-дихлор-3-фторфенил)этокси]пиразин-2-ил}бензойной кислоты;
(4-{5-амино-6-[(R)-1-(2,6-дихлор-3-фторфенил)этокси]пиразин-2-ил}фенил)пиперазин-1-илметанона;
трет-бутилового эфира 4-(4-{5-амино-6-[(R)-1-(2,6-дихлор-3-фторфенил)этокси]пиразин-2-ил}бензоил)пиперазин-1-карбоновой кислоты;
3-[(1R)-1-(2,6-дихлор-3-фторфенил)этокси]-5-[4-(пиперазин-1-илкарбонил)фенил]пиридин-2-амина;
4-{6-амино-5-[(1R)-1-(2,6-дихлор-3-фторфенил)этокси]пиридин-3-ил}-N-[2-(диметиламино)этил]-N-метилбензамида;
(4-{6-амино-5-[(1R)-1-(2,6-дихлор-3-фторфенил)этокси]пиридин-3-ил}фенил)метанола;
4-{6-амино-5-[(1R)-1-(2,6-дихлор-3-фторфенил)этокси]пиридин-3-ил}-N-[3-(диметиламино)пропил]-N-метилбензамида;
трет-бутил 4-(4-{6-амино-5-[(1R)-1-(2,6-дихлор-3-фторфенил)этокси]пиридин-3-ил}бензоил)пиперазин-1-карбоксилата;
3-[(R)-1-(2,6-дихлор-3-фторфенил)этокси]-5-[1-(1-метилпиперидин-4-ил)-1Н-пиразол-4-ил]пиридин-2-иламина;
1-[4-(4-{6-амино-5-[(R)-1-(2,6-дихлор-3-фторфенил)этокси]пиридин-3-ил}пиразол-1-ил)пиперидин-1-ил]-2-гидроксиэтанона;
3-[(R)-1-(2,6-дихлор-3-фторфенил)этокси]-5-(1-пиперидин-4-ил-1Н-пиразол-4-ил)пиридин-2-иламина;
3-[(R)-1-(2,6-дихлор-3-фторфенил)этокси]-5-(1-пиперидин-4-ил-1Н-пиразол-4-ил)пиридин-2-иламина;
3-[(R)-1-(2,6-дихлор-3-фторфенил)этокси]-5-(1-пиперидин-4-ил-1Н-пиразол-4-ил)пиразин-2-иламина;
3-[(R)-1-(2,6-дихлор-3-фторфенил)этокси]-5-(1Н-пиразол-4-ил)пиразин-2-иламина;
1-[4-(4-{5-амино-6-[(R)-1-(2,6-дихлор-3-фторфенил)этокси]пиразин-2-ил}пиразол-1-ил)пиперидин-1-ил]-2-гидроксиэтанона;
3-[(R)-1-(2,6-дихлор-3-фторфенил)этокси]-5-[1-(1-метилпиперидин-4-ил)-1Н-пиразол-4-ил]пиразин-2-иламина;
1-[4-(4-{5-амино-6-[(R)-1-(2,6-дихлор-3-фторфенил)этокси]пиразин-2-ил}пиразол-1-ил)пиперидин-1-ил]-2-диметиламиноэтанона;
3-[(R)-1-(2-хлор-3,6-дифторфенил)этокси]-5-(1-пиперидин-4-ил-1Н-пиразол-4-ил)пиридин-2-иламина;
или их фармацевтически приемлемой соли, сольвата или гидрата.
6. Применение соединения, соли, гидрата или сольвата по любому из пп.1-5 для получения лекарственного средства для лечения аномального роста клеток у млекопитающего.
7. Применение по п.6, в котором аномальный рост клеток представляет собой рак.
8. Фармацевтическая композиция, содержащая соединение, соль, гидрат или сольват по любому из пп.1-5 и фармацевтически приемлемый носитель.
9. Соединение по п.4, включающее 3-[(R)-1-(2,6-дихлор-3-фторфенил)этокси]-5-(1-пиперидин-4-ил-1Н-пиразол-4-ил]пиридин-2-иламин.
10. Фармацевтическая композиция по п.8, где указанное соединение представляет собой 3-[(R)-1-(2,6-дихлор-3-фторфенил)этокси]-5-(1-пиперидин-4-ил-1Н-пиразол-4-ил]пиридин-2-иламин.
Текст
013678 Область техники, к которой относится изобретение Настоящее изобретение относится, в целом, к новым химическим соединениям и способам. Более конкретно настоящее изобретение предусматривает энантиомерно чистые аминогетероарильные соединения, в частности аминопиридины и аминопиразины, обладающие активностью протеинтирозинкиназы,и способы синтеза и применение таких соединений. Предпочтительные соединения представляют собой ингибиторы c-Met, пригодные для лечения аномального роста клеток, такого как рак. Уровень техники Тирозинкиназный рецептор (RTK) фактора роста гепатоцитов (HGF) (c-Met или HGFR), как показано, при многих раковых заболеваниях человека вовлекается в онкогенез, развитие опухоли с повышенной клеточной подвижностью и инвазией, а также в метастазирование (см., например, Ма, Р.С, Maulik,G., Christensen, J.Salgia, R. (2003b). Cancer Metastasis Rev, 22, 309-25; Maulik, G., Shrikhande, A., Kijima, Т., Ma, P.C., Morrison, P.T.Salgia, R. (2002b). Cytokine Growth Factor Rev, 13, 41-59). c-MET(HGFR) может быть активирован посредством сверхэкспрессии или мутаций при различных раковых заболеваниях человека, включая мелкоклеточный рак легких (SCLC) (Ма, Р.С, Kijima, Т., Maulik, G., Fox,E.A., Sattler, M., Griffin, J.D., Johnson, B.E.Salgia, R. (2003a). Cancer Res, 63, 6272-6281).c-MET представляет собой тирозинкиназу рецептора, которая кодируется протоонкогеном Met и передает биологические воздействия фактора роста гепатоцитов (HGF), который упоминается также как рассеивающий фактор (SF). Jiang et al., Crit. Rev. Oncol. Hematol. 29: 209-248 (1999). c-MET и HGF экспрессируются в многочисленных тканях, хотя их экспрессия обычно ограничивается в основном клетками эпителиального и мезенхимального происхождения соответственно. с-МЕТ и HGF необходимы для нормального развития млекопитающих и, как показано, являются важными при клеточной миграции,клеточной пролиферации и выживании, морфогенной дифференциации и организации трехмерных трубчатых структур (например, почечных трубчатых клеток, при формировании желез и т.п.). В дополнение к их воздействиям на эпителиальные клетки, HGF/SF, как сообщается, представляют собой ангиогенный фактор, и сигнализация с помощью с-МЕТ в эндотелиальных клетках может индуцировать многие из клеточных реакций, необходимых для ангиогенеза (пролиферация, подвижность, инвазия). с-МЕТ рецептор, как показано, экспрессируется при ряде раковых заболеваний человека. c-Met и его лиганд, HGF, также, как показано, совместно экспрессируются на повышенных уровнях при многих раковых заболевания человека (в частности, при саркомах). Однако поскольку рецептор и лиганд обычно экспрессируются различными типами клеток, сигнализация с помощью с-МЕТ чаще всего регулируется посредством взаимодействий опухоль-строма (опухоль-хозяин). Кроме того, амплификация, мутация и перегруппировка гена с-МЕТ наблюдаются в подмножестве раковых заболеваний человека. Семьи с мутациями по линии одного из родителей, которые активируют с-МЕТ киназу, склонны к множеству почечных опухолей, а также к опухолям в других тканях. Многочисленные исследования коррелируют экспрессию с-МЕТ и/или HGF/SF с состоянием развития заболевания различных типов рака (включая рак легких, толстой кишки, груди, простаты, печени, поджелудочной железы, мозга, почек, яичников, желудка, кожи и костей). Кроме того, сверхэкспрессия с-МЕТ или HGF, как показано, коррелирует с плохим прогнозом и исходом заболевания при ряде основных раковых заболеваний человека, включая рак легких, печени, желудка и груди. с-МЕТ также непосредственно участвует в раковых заболеваниях без успешного режима лечения, таких как рак поджелудочной железы, глиома и гепатоцеллюлярная карцинома. Примеры ингибиторов с-МЕТ (HGFR), их синтеза и применения можно найти в заявке на патент США, серийный 10/786610, озаглавленной "Aminoheteroaryl Compounds as Protein Kinase Inhibitors",зарегистрированной 26 февраля 2004 г., и в соответствующей заявке на международный патент PCT/US 2004/005495 с таким же заглавием, зарегистрированной 26 февраля 2004 г., описания которых включены здесь в качестве ссылок во всей их полноте. Было бы желательным получение новых ингибиторов с-МЕТ (HGFR) и способов применения таких ингибиторов для лечения аномального роста клеток, такого как рак. Сущность изобретения В одном из вариантов осуществления настоящее изобретение предусматривает энантиомерно чистое соединение формулы 1R1 выбран из водорода, галогена, С 6-12 арила, 5-12-членного гетероарила, С 3-12 циклоалкила, 3-12 членной гетероалициклической группы, -O(CR6R7)nR4, -C(O)R4, -С(О)OR4, -CN, -NO2, -S(O)mR4,-SO2NR4R5, -C(O)NR4R5, -NR4C(O)R5, -C(=NR6)NR4R5, С 1-8 алкила, С 2-8 алкенила и С 2-8 алкинила; и каждый из атомов водорода в R1 необязательно замещен одной или несколькими группами R3;-S(O)2OR , -NO2, -NR R , -(CR R )nOR , -CN, -C(O)R , -OC(O)R , -O(CR R )nR , -NR C(O)R5,-(CR6R7)nC(O)OR4, -(CR6R7)nNCR4R5, -C(=NR6)NR4R5, -NR4C(O)NR5R6, -NR4S(O)PR5 или -C(O)NR4R5, и каждый из атомов водорода в R2 необязательно замещен R8; каждый из R3 независимо представляет собой галоген, С 1-12 алкил, С 2-12 алкенил, С 2-12 алкинил, С 3-12 циклоалкил, С 6-12 арил, 3-12-членную гетероалициклическую группу, 5-12-членный гетероарил,-S(O)mR4, -SO2NR4R5, -S(O)2OR4, -NO2, -NR4R5, -(CR6R7)nOR4, -CN, -C(O)R4, -OC(O)R4, -O(CR6R7)nR4,-NR4C(O)R5, -(CR6R7)nC(O)OR4, -(CR6R7)nOR4, -(CR6R7)nC(O)NR4R5, -(CR6R7)nNCR4R5, -C(=NR6)NR4R5,-NR4C(O)NR5R6, -NR4S(O)pR5 или -C(O)NR4R5, каждый из атомов водорода в R3 необязательно замещенR8, и группы R3 на соседних атомах могут объединяться с образованием С 6-12 арила, 5-12-членного гетероарила, С 3-12 циклоалкила или 3-12-членной гетероалициклической группы; каждый из R4, R5, R6 и R7 независимо представляет собой водород, галоген, С 1-12 алкил, С 2-12 алкенил,С 2-12 алкинил, С 3-12 циклоалкил, С 6-12 арил, 3-12-членную гетероалициклическую группу, 5-12-членный гетероарил; или любые два из R4, R5, R6 и R7, связанные с одним и тем же атомом азота, могут вместе с азотом, с которым они связаны, объединяться с образованием 3-12-членной гетероалициклической группы или 5-12-членной гетероарильной группы, необязательно содержащей 1-3 дополнительных гетероатома, выбранных из N, О и S; или любые два из R4, R5, R6 и R7, связанные с одним и тем же атомом углерода, могут объединяться с образованием С 3-12 циклоалкила, С 6-12 арила, 3-12-членной гетероалициклической группы или 5-12-членной гетероарильной группы; и каждый из атомов водорода в R4, R5, R6 и R7 необязательно замещен R8; каждый из R8 независимо представляет собой галоген, С 1-12 алкил, С 2-12 алкенил, С 2-12 алкинил, С 3-12 циклоалкил, С 6-12 арил, 3-12-членную гетероалициклическую группу, 5-12-членный гетероарил, -NH2,-CN, -ОН, -О-С 1-12 алкил, -O-(CH2)nC3-12 циклоалкил, -O-(CH2)nC6-12 арил, -О-(СН 2)n(3-12-членную гетероалициклическую группу) или -О-(СН 2)n(5-12-членный гетероарил); и каждый из атомов водорода в R8 необязательно замещен R11; каждый из R9 и R10 независимо представляет собой водород, галоген, С 1-12 алкил, С 3-12 циклоалкил,С 6-12 арил, 3-12-членную гетероалициклическую группу, 5-12-членный гетероарил, -S(O)mR4, -SO2NR4R5,-S(O)2OR4, -NO2, -NR4R5, -(CR6R7)nOR4, -CN, -C(O)R4, -OC(O)R4, -NR4C(O)R5, -(CR6R7)nC(O)OR4,-(CR6R7)nNCR4R5, -NR4C(O)NR5R6, -NR4S(O)nR5 или -C(O)NR4R5; R9 или R10 могут объединяться с кольцевым атомом А или заместителем А с образованием С 3-12 циклоалкильного, 3-12-членного гетероалициклического, С 6-12 арильного или 5-12-членного гетероарильного кольца, конденсированного с А; и каждый из атомов водорода в R9 и R10 необязательно замещен R3; каждый из R11 независимо представляет собой галоген, С 1-12 алкил, С 1-12 алкокси, С 3-12 циклоалкил,С 6-12 арил, 3-12-членную гетероалициклическую группу, 5-12-членный гетероарил, -O-С 1-12 алкил, -О(CH2)nC3-12 циклоалкил, -О-(СН 2)nC6-12 арил, -O-(СН 2)n(3-12-членную гетероалициклическую группу), -O(СН 2)n(5-12-членный гетероарил) или -CN, и каждый из атомов водорода в R11 необязательно замещен галогеном, -ОН, -CN, -С 1-12 алкилом, который может быть частично или полностью галогенированным,-O-С 1-12 алкилом, который может быть частично или полностью галогенированным, -СО, -SO или -SO2;R12 представляет собой водород, галоген, С 1-12 алкил, С 2-12 алкенил, С 2-12 алкинил, С 3-12 циклоалкил,С 6-12 арил, 3-12-членную гетероалициклическую группу, 5-12-членный гетероарил, -S(O)mR4, -SO2NR4R5,-S(O)2OR4, -NO2, -NR4R5, -(CR6R7)nOR4, -CN, -C(O)R4, -OC(O)R4, -O(CR6R7)nR4, -NR4C(O)R5,-(CR6R7)nC(O)OR4, -(CR6R7)nNCR4R5, -C(=NR6)NR4R5, -NR4C(O)NR5R6, -NR4S(O)pR5 или -C(O)NR4R5, и каждый из атомов водорода в R12 необязательно замещен R3; каждый из R13 независимо представляет собой галоген, С 1-12 алкил, С 2-12 алкенил, С 2-12 алкинил, С 3-12 циклоалкил, С 6-12 арил, 3-12-членную гетероалициклическую группу, 5-12-членный гетероарил, -S(O)mR4,-SO2NR4R5, -S(O)2OR4, -NO2, -NR4R5, -(CR6R7)nOR4, -CN, -C(O)R4, -OC(O)R4, -O(CR6R7)nR4, -NR4C(O)R5,-(CR6R7)nC(O)OR4,-(CR6R7)nOR4,-(CR6R7)nC(O)NR4R5,-(CR6R7)nNCR4R5,-C(=NR6)NR4R5,4 5 6 4 5 4 5 6 7-(CR R )nC(O)NR R или -(CR R )nC(O)R , группы R на соседних атомах могут объединяться с образованием С 6-12 арила, 5-12-членного гетероарила, С 3-12 циклоалкила или 3-12-членной гетероалициклической группы, и каждый из атомов водорода в R13 необязательно замещен R3; каждый из m независимо представляет собой 0, 1 или 2; каждый из n независимо представляет собой 0, 1, 2, 3 или 4; каждый из р независимо представляет собой 1 или 2; или его фармацевтически приемлемую соль, гидрат или сольват.-2 013678 В конкретном аспекте этого варианта осуществления R2 представляет собой водород. В другом конкретном аспекте этого варианта осуществления Y представляет собой N. В другом конкретном аспекте этого варианта осуществления Y представляет собой N, и R2 представляет собой водород. В другом конкретном аспекте этого варианта осуществления Y представляет собой CR12. В другом конкретном аспекте этого варианта осуществления Y представляет собой CR12, и R12 представляет собой Н. В другом конкретном аспекте этого варианта осуществления и в сочетании с любым другим конкретным аспектом, не являющимся несовместимым, R1 представляет собой фурановую, тиофеновую,пиррольную, пирролиновую, пирролидиновую, диоксолановую, оксазольную, тиазольную, имидазольную, имидазолиновую, имидазолидиновую, пиразольную, пиразолиновую, пиразолидиновую, изоксазольную, изотиазольную, оксадиазольную, триазольную, тиадиазольную, пирановую, пиридиновую, пиперидиновую, диоксановую, морфолиновую, дитиановую, тиоморфолиновую, пиридазиновую, пиримидиновую, пиразиновую, пиперазиновую, триазиновую, тритиановую или фенильную группу, и каждый из атомов водорода в R1 необязательно замещен одной или несколькими группами R3. В другом конкретном аспекте этого варианта осуществления и в сочетании с любым другим конкретным аспектом, не являющимся несовместимым, R1 представляет собой гетероарильную группу с конденсированным кольцом, и каждый из атомов водорода в R1 необязательно замещен одной или несколькими группами R3. В другом конкретном аспекте этого варианта осуществления и в сочетании с любым другим конкретным аспектом, не являющимся несовместимым, R1 представляет собой водород. В другом конкретном аспекте этого варианта осуществления и в сочетании с любым другим конкретным аспектом, не являющимся несовместимым, R1 представляет собой галоген. В другом варианте осуществления настоящее изобретение предусматривает энантиомерно чистое соединение формулы 1 аR1 представляет собой фурановую, тиофеновую, пиррольную, пирролиновую, пирролидиновую,диоксолановую, оксазольную, тиазольную, имидазольную, имидазолиновую, имидазолидиновую, пиразольную, пиразолиновую, пиразолидиновую, изоксазольную, изотиазольную, оксадиазольную, триазольную, тиадиазольную, пирановую, пиридиновую, пиперидиновую, диоксановую, морфолиновую, дитиановую, тиоморфолиновую, пиридазиновую, пиримидиновую, пиразиновую, пиперазиновую, триазиновую, тритиановую, азитидиновую или фенильную группу; и каждый из атомов водорода в R1 необязательно замещен R3; каждый из R3 независимо представляет собой галоген, С 1-12 алкил, С 2-12 алкенил, С 2-12 алкинил, С 3-12 циклоалкил, С 6-12 арил, 3-12-членную гетероалициклическую группу, 5-12-членный гетероарил, -S(O)mR4,-SO2NR4R5, -S(O)2OR4, -NO2, -NR4R5, -(CR6R7)nOR4, -CN, -C(O)R4, -OC(O)R4, -O(CR6R7)nR4, -NR4C(O)R5,-(CR6R7)nC(O)OR4,-(CR6R7)nOR4,-(CR6R7)nC(O)NR4R5,-(CR6R7)nNCR4R5,-C(=NR6)NR4R5,4 5 6 4 5 4 5 3-NR C(O)NR R , -NR S(O)pR или -C(O)NR R , каждый из атомов водорода в R необязательно замещенR8, и группы R3 на соседних атомах могут объединяться с образованием С 6-12 арила, 5-12-членного гетероарила, С 3-12 циклоалкила или 3-12-членной гетероалициклической группы; каждый из R4, R5, R6 и R7 независимо представляет собой водород, галоген, С 1-12 алкил, С 2-12 алкенил,С 2-12 алкинил, С 3-12 циклоалкил, С 6-12 арил, 3-12-членную гетероалициклическую группу, 5-12-членный гетероарил; или любые два из R4, R5, R6 и R7, связанные с одним и тем же атомом азота, могут вместе с азотом, с которым они связаны, объединяться с образованием 3-12-членной гетероалициклической группы или 5-12-членной гетероарильной группы, необязательно содержащей 1-3 дополнительных гетероатома, выбранных из N, О и S; или любые два из R4, R5, R6 и R7, связанные с одним и тем же атомом углерода, могут объединяться с образованием С 3-12 циклоалкильной, С 6-12 арильной, 3-12-членной гетероалициклической группы или 5-12-членной гетероарильной группы; и каждый из атомов водорода в R4, R5, R6 и R7 необязательно замещен R8; каждый из R8 независимо представляет собой галоген, C1-12 алкил, С 2-12 алкенил, С 2-12 алкинил, С 3-12 циклоалкил, С 6-12 арил, 3-12-членную гетероалициклическую группу, 5-12-членный гетероарил, -NH2,-CN, -ОН, -О-С 1-12 алкил, -O-(СН 2)nC3-12 циклоалкил, -О-(СН 2)nC6-12 арил, -О-(СН 2)n(3-12-членную гетероа-3 013678 лициклическую группу) или -О-(СН 2)n(5-12-членный гетероарил); и каждый из атомов водорода в R8 необязательно замещен R11; каждый из R9 и R10 независимо представляет собой водород, галоген, С 1-12 алкил, С 3-12 циклоалкил,С 6-12 арил, 3-12-членную гетероалициклическую группу, 5-12-членный гетероарил, -S(O)mR4, -SO2NR4R5,-S(O)2OR4, -NO2, -NR4R5, -(CR6R7)nOR4, -CN, -C(O)R4, -OC(O)R4, -NR4C(O)R5, -(CR6R7)nC(O)OR4,-(CR6R7)nNCR4R5, -NR4C(O)NR5R6, -NR4S(O)pR5 или -C(O)NR4R5; R9 или R10 могут объединяться с кольцевым атомом А или заместителем А с образованием С 3-12 циклоалкильного, 3-12-членного гетероалициклического, С 6-12 арильного или 5-12-членного гетероарильного кольца, конденсированного с А; и каждый из атомов водорода в R9 и R10 необязательно замещен R3; каждый из R11 независимо представляет собой галоген, С 1-12 алкил, С 1-12 алкокси, С 3-12 циклоалкил,С 6-12 арил, 3-12-членную гетероалициклическую группу, 5-12-членный гетероарил, -O-С 1-12 алкил, -О(СН 2)nC3-12 циклоалкил, -О-(СН 2)nC6-12 арил, -O-(СН 2)n(3-12-членную гетероалициклическую группу), -O(СН 2)n(5-12-членный гетероарил) или -CN, и каждый из атомов водорода в R11 необязательно замещен галогеном, -ОН, -CN, -С 1-12 алкилом, который может быть частично или полностью галогенированным,-O-C1-12 алкилом, который может быть частично или полностью галогенированным, -СО, -SO или -SO2; каждый из R13 независимо представляет собой галоген, С 1-12 алкил, С 2-12 алкенил, С 2-12 алкинил,С 3-12 циклоалкил, С 6-12 арил, 3-12-членную гетероалициклическую группу, 5-12-членный гетероарил,-S(O)mR4, -SO2NR4R5, -S(O)2OR4, -NO2, -NR4R5, -(CR6R7)nOR4, -CN, -C(O)R4, -OC(O)R4, -O(CR6R7)nR4,-NR4C(O)R5, -(CR6R7)nC(O)OR4, -(CR6R7)nOR4, -(CR6R7)nC(O)NR4R5, -(CR6R7)nNCR4R5, -C(=NR6)NR4R5,-NR4C(O)NR5R6, -NR4S(O)pR5, -C(O)NR4R5, -(CR6R7)n(3-12-членную гетероалициклическую группу),-(CR6R7)n(С 3-12 циклоалкил),-(CR6R7)n(C6-12 арил),-(CR6R7)n(5-12-членный гетероарил),6 7 4 5 6 7 4 13-(CR R )nC(O)NR R или -(CR R )nC(O)R , группы R на соседних атомах могут объединяться с образованием С 6-12 арильной, 5-12-членной гетероарильной, С 3-12 циклоалкильной или 3-12-членной гетероалициклической группы, и каждый из атомов водорода в R13 необязательно замещен R3; каждый из m независимо представляет собой 0, 1 или 2; каждый из n независимо представляет собой 0, 1, 2, 3 или 4; каждый из р независимо представляет собой 1 или 2; или его фармацевтически приемлемую соль, гидрат или сольват. В другом варианте осуществления настоящее изобретение предусматривает энантиомерно чистое соединение, выбранное из группы, состоящей из 5-бром-3-[(R)-1-(2,6-дихлор-3-фторфенил)этокси]пиразин-2-иламина; 5-йод-3-[(R)1-(2,6-дихлор-3-фторфенил)этокси]пиридин-2-иламина; 5-бром-3-[1(R)-(2,6-дихлор-3-фторфенил)этокси]пиридин-2-иламина; 4-5-амино-6-[(R)-1-(2,6-дихлор-3-фторфенил)этокси]пиразин-2-илбензойной кислоты;-4 013678 или их фармацевтически приемлемой соли, сольвата или гидрата. В другом варианте осуществления настоящее изобретение предусматривает фармацевтическую композицию, содержащую любое из соединений по настоящему изобретению и фармацевтически приемлемый носитель. Примеры таких композиций описываются ниже. Предпочтительные соединения по настоящему изобретению включают соединения, которые обладают ингибиторной активностью по отношению к с-МЕТ, как определено любым одним или несколькими параметрами из IC50, Ki или процента ингибирования (%I). Специалист в данной области легко определит, обладает ли соединение такой активностью, путем осуществления соответствующего анализа, и описания таких анализов показаны в разделе примеры. В одном из вариантов осуществления особенно предпочтительные соединения имеют Ki с-МЕТ менее чем 5 мкМ, или менее чем 2 мкМ, или менее чем 1 мкМ, или менее чем 500 нМ, или менее чем 200 нМ, или менее чем 100 нМ. В другом варианте осуществления особенно предпочтительные соединения обладают ингибированием с-МЕТ при 1 мкМ по меньшей мере 10%, или по меньшей мере 20%, или по меньшей мере 30%, или по меньшей мере 40%, или по меньшей мере 50%, или по меньшей мере 60%, или по меньшей мере 70%, или по меньшей мере 80%,или по меньшей мере 90%. Способы измерения активности c-MET/HGFR описаны в примерах. В другом варианте осуществления настоящее изобретение предусматривает способ лечения аномального роста клеток у млекопитающих, в том числе человека, включающий введение млекопитающему любой из фармацевтических композиций по настоящему изобретению. В конкретном варианте осуществления любого из способов по настоящему изобретению, описанных здесь, аномальный рост клеток представляет собой рак, включая, но не ограничиваясь ими, рак легких, рак костей, рак поджелудочной железы, рак кожи, рак головы или шеи, кожную или интраокулярную меланому, рак матки, рак яичников, рак прямой кишки, рак анальной области, рак желудка, рак толстой кишки, рак груди, рак матки, карциному фаллопиевых труб, карциному эндометрия, карциному шейки матки, карциному вагины, карциному вульвы, болезнь Ходжкина, рак пищевода, рак тонкого кишечника, рак эндокринной системы, рак щитовидной железы, рак паращитовидной железы, рак надпочечников, саркому мягких тканей, рак уретры, рак пениса, рак простаты, хроническую или острую лейкемию, лимфоцитные лимфомы, рак мочевого пузыря, рак почек или мочеточников, карциному почечных клеток, карциному почечных лоханок, новообразования центральной нервной системы (CNS), первичную лимфому CNS, опухоли спинного хребта, глиому ствола мозга, аденому слизистых или сочетание одного или нескольких из указанных выше раковых заболеваний. В другом варианте осуществления указанного способа указанный аномальный рост клеток представляет собой злокачественное пролиферативное заболевание, включая, но не ограничиваясь ими, псориаз, злокачественную гипертрофию простаты или рестеноз. В другом варианте осуществления настоящее изобретение предусматривает способ лечения расстройства, опосредуемого HGFR, у млекопитающего, в том числе человека, включающий введение млекопитающему любой из фармацевтических композиций по настоящему изобретению. В дополнительных конкретных вариантах осуществления любого из способов по настоящему изобретению, описанных здесь, способ дополнительно включает введение млекопитающему некоторого количества одного или нескольких веществ, выбранных из противоопухолевых агентов, агентов против ангиогенеза, ингибиторов передачи сигналов и антипролиферативных агентов, причем эти количества вместе являются эффективными при лечении указанного аномального роста клеток. Такие вещества включают те, которые описываются в РСТ публикациях заявок на международный патентWO 00/38715, WO 00/38716, WO 00/38717, WO 00/38718, WO 00/38719, WO 00/38730, WO 00/38665, WO 00/37107 и WO 00/38786, описания которых включены здесь в качестве ссылок во всей их полноте. Примеры противоопухолевых агентов включают ингибиторы митоза, например производные винкаалкалоидов, такие как винбластин, винорелбин, виндесцин и винкристин; колхины аллохохин, галихондрин, N-бензоилтриметилметиловый эфир колхициновой кислоты, доластатин 10, майстанзин, ризоксин, таксаны, такие как таксол (паклитаксель), доцетаксель (таксотер), 2'-N-[3-(диметиламино)пропил]глутарамат (производное таксола), тиоколхицин, тритилцистеин, тенипозид, метотрексат, азатиоприн, фторурацил, цитоцин арабинозид, 2'2'-дифтордезоксицитидин (гемцитабин), адриамицин и митамицин. Алкилирующие агенты, например цисплатин, карбоплатин, оксиплатин, ипроплатин, этиловый эфир N-ацетил-DL-саркозил-L-лейцина (азалей или азалекс), 1,4-циклогексадиен-1,4-дикарбаминовую кислоту, 2,5-бис(1-азиридинил)-3,6-диоксодиэтиловый эфир (диазиквон), 1,4-бис(метансулвфонилокси)бутан (бисульфан или лейкосульфан) хлорозотоцин, кломезон, цианоморфолинодоксорубицин,циклодизон, диангидрогалактитол, фтордопан, гепсульфам, митомицин С, гикантеонмитомицин С, митозоламид, 1-(2-хлорэтил)-4-(3-хлорпропил)пиперазина дигидрохлорид, пиперазиндион, пипоброман, порфиромицин, спирогидантоиновая горчица, тероксирон, тетраплатин, тиотепа, триэтиленмеламин, урацилазотная горчица, бис(3-мезилоксипропил)амина гидрохлорид, митомицин, нитрозомочевинные агенты,такие как циклогексилхлорэтилнитрозомочевина, метилциклогексилхлорэтилнитрозомочевина, 1-(2 хлорэтил)-3-(2,6-диоксо-3-пиперидил)-1-нитрозомочевина, бис(2-хлорэтил)нитрозомочевина, прокарбазин, дакарбазин, соединения, родственные азотной горчице, такие как мехлорэтамин, циклофосфамид,ифосамид, мелфалан, хлорамбуцил, эстрамустина фосфат натрия, стрептозоин и темозоламид. Антиме-5 013678 таболиты ДНК, например 5-фторурацил, цитозинарабинозид, гидроксимочевина, 2-[(3-гидрокси-2 пиринодинил)метилен]гидразинкарботиоамид, дезоксифторуридин, 5-гидрокси-2-формилпиридин тиосемикарбазон, альфа-2'-дезокси-6-тиогуанозин, афидиколин глицинат, 5-азадезоксицитидин, бетатиогуанин дезоксирибозид, циклоцитидин, гуаназол, инозин гликодиальдегид, макбецин II, пиразолимидазол, кладрибин, пентостатин, тиогуанин, меркаптопурин, блеомицин, 2-хлордезоксиаденозин, ингибиторы тимидилатсинтазы, такие как ралтитрексед и пеметрексед динатрий, клофарабин, флоксуридин и флударабин. Антиметаболиты ДНК/РНК, например L-аланозин, 5-азацитидин, ацивицин, аминоптерин и их производные, такие как N-[2-хлор-5-(2,4-диамино-5-метил-6-хиназолинил)метил]амино]бензоил]-Lаспарагиновая кислота, N-[4-(2,4-диамино-5-этил-6-хиназолинил)метил]амино]бензоил]-L-аспарагиновая кислота, N-[2-хлор-4-(2,4-диаминоптеридинил)метил]амино]бензоил]-L-аспарагиновая кислота,растворимый антифол Бейкера, дихлораллил лавсон, бреквинар, фтораф, дигидро-5-азацитидин, метотрексат, тетранатриевая соль N-(фосфоноацетил)-L-аспарагиновой кислоты, пиразофуран, триметрексат,пликамицин, актиномицин D, криптофицин, и аналоги, такие как криптофицин-52, или, например, один из предпочтительных антиметаболитов, описанных в заявке на европейский патент 239362, такой какN-(5-[N-(3,4-дигидро-2-метил-4-оксохиназолин-6-илметил)-N-метиламино]-2-теноил)-L-глутаминовая кислота; ингибиторы факторов роста; ингибиторы клеточного цикла; интеркалирующие антибиотики,например адриамицин и блеомицин; белки, например интерферон; и антигормоны, например антиэстрогены, такие как Nolvadex (тамоксифен) или, например, антиандрогены, такие как Casodex (4'-циано 3-(4-фторфенилсульфонил)-2-гидрокси-2-метил-3'-(трифторметил)пропионанилид). Такое совместное лечение может достигаться одновременным, последовательным или отдельным дозированием индивидуальных компонентов лечения. Агенты против ангиогенеза включают ингибиторы ММР-2 (матриксной металлопротеиназы 2), ингибиторы ММР-9 (матриксной металлопротеиназы 9) и ингибиторы COX-II (циклооксигеназы II). Примеры подходящих для использования ингибиторов СОХ-II включают CELEBREX (алекоксиб), вальдекоксиб и рофекоксиб. Примеры подходящих для использования ингибиторов матриксной металлопротеиназы описаны в заявках на международный патент WO 96/33172 (опубликованной 24 октября 1996 г.),WO 96/27583 (опубликованной 7 марта 1996 г.), в заявке на европейский патент 97304971.1 (зарегистрированной 8 июля 1997 г.), заявке на европейский патент 99308617,2 (зарегистрированной 29 октября 1999 г.), в заявках на международный патент WO 98/07697 (опубликованной 26 февраля 1998 г.), WO 98/03516 (опубликованной 29 января 1998 г.), WO 98/34918 (опубликованной 13 августа 1998 г.), WO 98/34915 (опубликованной 13 августа 1998 г.), WO 98/33768 (опубликованной 6 августа 1998 г.), WO 98/30566 (опубликованной 16 июля 1998 г.), в публикации европейского патента 606046 (опубликованного 13 июля 1994 г.), в публикации европейского патента 931788 (опубликованного 28 июля 1999 г.), в заявках на международный патент WO 90/05719 (опубликованной 31 мая 1990 г.), WO 99/52910 (опубликованной 21 октября 1999 г.), WO 99/52889 (опубликованной 21 октября 1999 г.), WO 99/29667 (опубликованной 17 июня 1999 г.), РСТ заявке на международный патентPCT/IB 98/01113 (зарегистрированной 21 июля 1998 г.), в заявке на европейский патент 99302232.1 (зарегистрированной 25 марта 1999 г.), заявке на патент Великобритании номер 9912961.1 (зарегистрированной 3 июня 1999 г.), во временной заявке на патент Соединенных Штатов 60/148464 (зарегистрированной 12 августа 1999 г.), в патенте Соединенных Штатов Америки 5863949 (выданном 26 января 1999 г.), в патенте Соединенных Штатов Америки 5861510 (выданном 19 января 1999 г.) и в публикации европейского патента 780386(опубликованного 25 июня 1997 г.), все они включены здесь в качестве ссылок во всей их полноте. Предпочтительные ингибиторы ММР-2 и ММР-9 представляют собой такие, которые не обладают активностью ингибирования ММР-1 или имеют небольшую активность. Более предпочтительными являются те, которые селективно ингибируют ММР-2 и/или ММР-9 по отношению к другим матриксным металлопротеиназам (то есть ММР-1, ММР-3, ММР-4, ММР-5, ММР-6, ММР-7, ММР-8, ММР-10, ММР 11, ММР-12 и ММР-13). Примеры ингибиторов ММР включают AG-3340, RO 32-3555, RS 13-0830 и следующие соединения: 3-4-(4-фторфенокси)бензолсульфонил]-(1-гидроксикарбамоилциклопентил)амино]пропионовую кислоту; гидроксиамид 3-экзо-3-[4-(4-фторфенокси)бензолсульфониламино]-8-оксабицикло[3.2.1]октан-3 карбоновой кислоты; гидроксиамид (2R,3R)-1-[4-(2-хлор-4-фторбензилокси)бензолсульфонил]-3-гидрокси-3-метилпиперидин-2-карбоновой кислоты; гидроксиамид 4-[4-(4-фторфенокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты; 3-4-(4-фторфенокси)бензолсульфонил]-(1-гидроксикарбамоилциклобутил)амино]пропионовую кислоту; гидроксиамид 4-[4-(4-хлорфенокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты; гидроксиамид 3-[4-(4-хлорфенокси)бензолсульфониламино]тетрагидропиран-3-карбоновой кислоты; гидроксиамид (2R,3R)-1-[4-(4-фтор-2-метилбензилокси)бензолсульфонил]-3-гидрокси-3-метилпипе-6 013678 ридин-2-карбоновой кислоты; 3-4-(4-фторфенокси)бензолсульфонил]-(1-гидроксикарбамоил-1-метилэтил)амино]пропионовую кислоту; 3-4-(4-фторфенокси)бензолсульфонил]-(4-гидроксикарбамоилтетрагидропиран-4-ил)амино]пропионовую кислоту; гидроксиамид 3-экзо-3-[4-(4-хлорфенокси)бензолсульфониламино]-8-оксабицикло[3.2.1]октан-3 карбоновой кислоты; гидроксиамид 3-эндо-3-[4-(4-фторфенокси)бензолсульфониламино]-8-оксабицикло[3.2.1]октан-3 карбоновой кислоты и гидроксиамид 3-[4-(4-фторфенокси)бензолсульфониламино]тетрагидрофуран-3-карбоновой кислоты; и их фармацевтически приемлемые соли, сольваты и гидраты. Примеры ингибиторов передачи сигналов включают агенты, которые могут ингибировать реакцииEGFR (рецептор эпидермального фактора роста), такие как антитела EGFR, антитела EGF, и молекулы,которые являются ингибиторами EGFR; ингибиторы VEGF (эндотелиального фактора роста сосудов); и ингибиторы рецептора erbB2, такие как органические молекулы или антитела, которые могут связываться с рецептором erbB2, например HERCEPTIN (Genentech, Inc. of South San Francisco, California, USA). Ингибиторы EGFR описаны, например, в заявках на международный патент WO 95/19970 (опубликованной 27 июля 1995 г.), WO 98/14451 (опубликованной 9 апреля 1998 г.), WO 98/02434 (опубликованной 22 января 1998 г.) и в патенте Соединенных Штатов Америки 5747498 (выданном 5 мая 1998 г.).EGFR-ингибирующие агенты включают, но не ограничиваются ими, моноклональные антитела С 225 и анти-EGFR 22Mab (ImClone Systems Incorporated of New York, New York, USA), соединения ZD-1839(AstraZeneca), BIBX-1382 (Boehringer Ingelheim), MDX-447 (Medarex Inc. of Annandale, New Jersey, USA) и OLX-103 (MerckCo. of Whitehouse Station, New Jersey, USA), VRCTC-310 (Ventech Research) и токсин слияния EGF (Seragen Inc. of Hopkinton, Massachusetts). Ингибиторы VEGF, например SU-5416 и SU-6668 (Sugen Inc. of South San Francisco, California,USA), также могут быть объединены или введены совместно с композицией. Ингибиторы VEGF описаны, например, в заявке на международный патент WO 99/24440 (опубликованной 20 мая 1999 г.), РСТ заявке на международный патент PCT/IB 99/00797 (зарегистрированной 3 мая 1999 г.), в заявках на международный патент WO 95/21613 (опубликованной 17 августа 1995 г.), WO 99/61422 (опубликованной 2 декабря 1999 г.), в патенте Соединенных Штатов Америки 5834504 (выданном 10 ноября 1998 г.), в заявке на международный патент WO 98/50356 (опубликованной 12 ноября 1998 г.), в патенте Соединенных Штатов Америки 5883113 (выданном 16 марта 1999 г.), в патенте Соединенных Штатов Америки 5886020 (выданном 23 марта 1999 г.), в патенте Соединенных Штатов Америки 5792783 (выданном 11 августа 1998 г.), в заявках на международный патент WO 99/10349 (опубликованной 4 марта 1999 г.),WO 97/32856 (опубликованной 12 сентября 1997 г.), WO 97/22596 (опубликованной 26 июня 1997 г.),WO 98/54093 (опубликованной 3 декабря 1998 г.), WO 98/02438 (опубликованной 22 января 1998 г.), WO 99/16755 (опубликованной 8 апреля 1999 г.) и WO 98/02437 (опубликованной 22 января 1998 г.), все они включены здесь в качестве ссылок во всей их полноте. Другие примеры некоторых специфичных ингибиторов VEGF представляют собой IM862 (Cytran Inc. of Kirkland, Washington, USA); анти-VEGF моноклональное антитело бевацизумаб (Genentech, Inc. of South San Francisco, California); и ангиозим, синтетический рибозим от Ribozyme (Boulder, Colorado) и Chiron (Emeryville, California). Ингибиторы рецептора erbB2, такие как GW-282974 (Glaxo Wellcome pic), и моноклональные антитела AR-209 (Aronex Pharmaceuticals Inc. of The Woodlands, Texas, USA) и 2 В-1 (Chiron), могут быть введены в сочетании с композицией. Такие ингибиторы erbB2 включают те, которые описаны в заявках на международный патент WO 98/02434 (опубликованной 22 января 1998 г.), WO 99/35146 (опубликованной 15 июля 1999 г.), WO 99/35132 (опубликованной 15 июля 1999 г.), WO 98/02437 (опубликованной 22 января 1998 г.), WO 97/13760 (опубликованной 17 апреля 1997 г.), WO 95/19970 (опубликованной 27 июля 1995 г.), в патенте Соединенных Штатов Америки 5587458 (выданном 24 декабря 1996 г.) и в патенте Соединенных Штатов Америки 5877305 (выданном 2 марта 1999 г.), каждый из которых включен здесь в качестве ссылки во всей ее полноте. Ингибиторы рецептора ErbB2, подходящие для использования в настоящем изобретении, также описаны во временной заявке на патент Соединенных Штатов Америки 60/117341, зарегистрированной 27 января 1999 г., и в во временной заявке на патент Соединенных Штатов Америки 60/117346, зарегистрированной 27 января 1999 г., обе они включены здесь в качестве ссылок во всей их полноте. Другие антипролиферативные агенты, которые могут быть использованы, включают ингибиторы фермента фарнезилпротеинтрансферазы и ингибиторы тирозинкиназы рецептора PDGFr, включая соединения, описанные и заявленные в следующих заявках на патент Соединенных Штатов Америки: 09/221946 (зарегистрированной 28 декабря 1998 г.); 09/454058 (зарегистрированной 2 декабря 1999 г.); 09/501163 (зарегистрированной 9 февраля 2000 г.); 09/539930 (зарегистрированной 31 марта 2000 г.); 09/202796 (зарегистрированной 22 мая 1997 г.); 09/384339 (зарегистрированной 26 августа 1999 г.) и 09/383755 (зарегистрированной 26 августа 1999 г.); и соединения, описанные и заявленные в следующих временных заявках на патент Соединенных Штатов Америки: 60/168207 (зарегистрированной 30 ноября-7 013678 1999 г.); 60/170119 (зарегистрированной 10 декабря 1999 г.); 60/177718 (зарегистрированной 21 января 2000 г.); 60/168217 (зарегистрированной 30 ноября 1999 г.) и 60/200834 (зарегистрированной 1 мая 2000 г.). Каждая из указанных выше заявок на патент и временных заявок на патент включены здесь в качестве ссылки во всей ее полноте. Композиции по настоящему изобретению также могут быть использованы вместе с другими агентами, пригодными для лечения аномального роста клеток или рака, включая, но не ограничиваясь ими,агенты, способные повышать противоопухолевые иммунные реакции, такие как антитела CTLA4 (антиген цитотоксичных лимфоцитов 4), и другие агенты, способные блокировать CTLA4; и антипролиферативные агенты, такие как другие ингибиторы фарнезилпротеинтрансферазы. Специфичные антителаCTLA4, которые могут быть использованы в настоящем изобретении, включают те, которые описаны во временной заявке на патент Соединенных Штатов Америки 60/113647 (зарегистрированной 23 декабря 1998 г.), которая включена здесь в качестве ссылки во всей ее полноте. Определения. Если не утверждается иного, следующие далее термины, используемые в описании и формуле изобретения, имеют значения, обсуждаемые ниже. Переменные, определяемые в настоящем разделе, такие как R, X, n и т.п., предназначены для упоминания только в данном разделе и не рассматриваются как имеющие такое же значение, которое может использоваться вне настоящего раздела определений. Кроме того, многие группы, определенные здесь, могут быть необязательно замещены. Перечисление в настоящем разделе определений типичных заместителей является примерным и не предназначено для ограничения заместителей, определенных где-либо еще в настоящем описании и формуле изобретения."Алкил" относится к насыщенному алифатическому углеводородному радикалу, включающему группы с прямой цепью и разветвленной цепью из 1-20 атомов углерода, предпочтительно из 1-12 атомов углерода, более предпочтительно 1-8 атомов углерода или 1-6 атомов углерода или 1-4 атомов углерода. "Низший алкил" относится конкретно к алкильной группе с 1-4 атомами углерода. Примеры алкильных групп включают метил, этил, пропил, 2-пропил, н-бутил, изобутил, трет-бутил, пентил и т.п. Алкил может быть замещенным или незамещенным. Типичные группы заместителей включают циклоалкил, арил, гетероарил, гетероалициклическую группу, гидрокси, алкокси, арилокси, меркапто, алкилтио, арилтио, циано, галоген, карбонил, тиокарбонил, О-карбамил, N-карбамил, О-тиокарбамил, Nтиокарбамил, С-амидо, N-амидо, С-карбокси, О-карбокси, нитро, силил, амино и -NRxRy, где Rx и Ry независимо выбраны из группы, состоящей из водорода, алкила, циклоалкила, арила, карбонила, ацетила,сульфонила, трифторметансульфонила и объединены в пяти- или шестичленное гетероалициклическое кольцо."Циклоалкил" относится к 3-8-членному углеродному моноциклическому кольцу, углеродному 5 членному/6-членному или 6-членному/6-членному конденсированному бициклическому кольцу или к полициклической конденсированной группе ("конденсированная" кольцевая система означает, что каждое кольцо в системе делит соседнюю пару атомов углерода с любым другим кольцом в системе), где одно или несколько колец могут содержать одну или несколько двойных связей, но ни одно из колец не имеет полностью сопряженной системы -электронов. Примерами, без ограничения, циклоалкильных групп являются циклопропан, циклобутан, циклопентан, циклопентен, циклогексан, циклогексадиен,адамантан, циклогептан, циклогептатриен и т.п. Циклоалкильная группа может быть замещенной или незамещенной. Типичные группы заместителя включают алкил, арил, гетероарил, гетероалицикл, гидрокси, алкокси, арилокси, меркапто, алкилтио, арилтио, циано, галоген, карбонил, тиокарбонил, Скарбокси, О-карбокси, О-карбамил, N-карбамил, С-амидо, N-амидо, нитро, амино и -NRxRy с Rx и Ry, определенными выше. Иллюстративные примеры циклоалкила получают, но не ограничиваются ими, из следующих групп:"Алкенил" относится к алкильной группе, как определено в данном описании, состоящей по меньшей мере из двух атомов углерода и по меньшей мере одной двойной связи углерод-углерод. Типичные примеры включают, но не ограничиваются ими, этенил, 1-пропенил, 2-пропенил, 1-, 2- или 3-бутенил и т.п."Алкинил" относится к алкильной группе, как определено в данном описании, состоящей по меньшей мере из двух атомов углерода и по меньшей мере одной тройной связи углерод-углерод. Типичные примеры включают, но не ограничиваются ими, этинил, 1-пропинил, 2-пропинил, 1-, 2- или 3-бутинил и т.п."Арил" относится к углеродным моноциклическим группам или полициклическим группам с конденсированными кольцами из 6-12 атомов углерода, имеющим полностью сопряженную систему электронов. Примерами, без ограничения, арильных групп являются фенил, нафталенил и антраценил. Арильная группа может быть замещенной или незамещенной. Типичные заместители включают галоген,тригалогенметил, алкил, гидрокси, алкокси, арилокси, меркапто, алкилтио, арилтио, циано, нитро, карбонил, тиокарбонил, С-карбокси, О-карбокси, О-карбамил, N-карбамил, O-тиокарбамил, N-тиокарбамил,С-амидо, N-амидо, сульфинил, сульфонил, амино и -NRxRy с Rx и Ry, определенными выше."Гетероарил" относится к моноциклической группе или группе с конденсированными кольцами из 5-12 кольцевых атомов, содержащей один, два, три или четыре кольцевых гетероатома, выбранных из N,О и S, остальные кольцевые атомы представляют собой С, и, в дополнение к этому, имеющей полностью сопряженную систему -электронов. Примерами, без ограничения, незамещенных гетероарильных групп являются пиррол, фуран, тиофен, имидазол, оксазол, тиазол, пиразол, пиридин, пиримидин, хинолин,изохинолин, пурин, тетразол, триазин и карбазол. Гетероарильная группа может быть замещенной или незамещенной. Типичные заместители включают алкил, циклоалкил, галоген, тригалогенметил, гидрокси, алкокси, арилокси, меркапто, алкилтио, арилтио, циано, нитро, карбонил, тиокарбонил, сульфонамидо, С-карбокси, О-карбокси, сульфинил, сульфонил, O-карбамил, N-карбамил, О-тиокарбамил, Nтиокарбамил, С-амидо, N-амидо, амино и -NRxRy с Rx и Ry, определенными выше. Фармацевтически приемлемый гетероарил представляет собой такой, который является достаточно стабильным для присоединения к соединению по настоящему изобретению, приготовления в виде фармацевтической композиции и последующего введения пациенту, нуждающемуся в нем. Примеры типичных моноциклических гетероарильных групп включают, но не ограничиваются ими Примеры подходящих конденсированных кольцевых гетероарильных групп включают, но не ограничиваются ими Термин "гетероалициклическая" или "гетероцикл" относится к моноциклической группе или группе с конденсированными кольцами, имеющей в кольце (кольцах) от 3 до 12 кольцевых атомов, в которой один или два кольцевых атома являются гетероатомами, выбранными из N, О и S(O)n (где n равно 0, 1 или 2), а остальные кольцевые атомы представляют собой С. Кольца могут также иметь одну или несколько двойных связей. Однако кольца не должны иметь полностью сопряженную систему электронов. Примеры подходящих насыщенных гетероалициклических групп включают, но не ограничиваются ими Примеры подходящих частично ненасыщенных гетероалициклических групп включают, но не ограничиваются ими Группа гетероцикла необязательно замещена одним или двумя заместителями, независимо выбранными из галогена, низшего алкила, низшего алкила, замещенного карбоксигруппой, сложноэфирной гидроксигруппой или моно- или диалкиламиногруппой."Алкокси" относится как к -О-(алкильной), так и к -O-(незамещенной циклоалкильной) группе. Типичные примеры включают, но не ограничиваются ими, метокси, этокси, пропокси, бутокси, циклопропилокси, циклобутилокси, циклопентилокси, циклогексилокси и т.п."Галогеналкокси" относится к -О-(галогеналкильной) группе. Типичные примеры включают, но не ограничиваются ими, трифторметокси, трибромметокси и т.п."Арилокси" относится к -O-арильной или -О-гетероарильной группе, как определено в данном описании. Типичные примеры включают, но не ограничиваются ими, фенокси, пиридинилокси, фуранилокси, тиенилокси, пиримидинилокси, пиразинилокси и т.п. и их производные."Алкилтио" относится к -S-(алкильной) или -S-(незамещенной циклоалкильной) группе. Типичные примеры включают, но не ограничиваются ими, метилтио, этилтио, пропилтио, бутилтио, циклопропил- 11013678 тио, циклобутилтио, циклопентилтио, циклогексилтио и т.п."Арилтио" относится к -S-арильной или -S-гетероарильной группе, как определено в данном описании. Типичные примеры включают, но не ограничиваются ими, фенилтио, пиридинилтио, фуранилтио,тиенилтио, пиримидинилтио и т.п. и их производные."Ацил" или "карбонил" относится к группе -C(O)R", где R" выбран из группы, состоящей из водорода, низшего алкила, тригалогенметила, незамещенного циклоалкила, арила, необязательно замещенного одним или несколькими, предпочтительно одним, двумя или тремя, заместителями, выбранными из группы, состоящей из низшего алкила, тригалогенметила, низшего алкокси, галогена и группы -NRxRy,гетероарила (связанного через кольцевой атом углерода), необязательно замещенного одним или несколькими, предпочтительно одним, двумя или тремя, заместителями, выбранными из группы, состоящей из низшего алкила, тригалогеналкила, низшего алкокси, галогена и группы -NRxRy, и гетероалицикла (связанного через кольцевой атом углерода), необязательно замещенного одним или несколькими,предпочтительно одним, двумя или тремя, заместителями, выбранными из группы, состоящей из низшего алкила, тригалогеналкила, низшего алкокси, галогена и группы -NRxRy. Типичные ацильные группы включают, но не ограничиваются ими, ацетил, трифторацетил, бензоил и т.п."Сложноэфирная" относится к группе -С(О)OR" с R", как определено в данном описании, за исключением того, что R" не может быть водородом."Галогеновая" группа относится к фтору, хлору, брому или йоду, предпочтительно фтору или хлору."Тригалогенметильная" группа относится к метильной группе, имеющей три галогеновых заместителя, таких как трифторметильная группа."Сульфинильная" группа относится к группе -S(O)R", где, в дополнение к определенному выше, R" может также быть гидроксигруппой."Сульфонильная" группа относится к группе -S(O)2R", где, в дополнение к определенному выше, R" может также быть гидроксигруппой."Амино" относится к группе -NRxRy, где Rx и Ry оба представляют собой водород."Галогеналкил" означает алкил, предпочтительно низший алкил, который замещен одним или несколькими одинаковыми или различными атомами галогена, например -CH2Cl, -CF3, -CH2CF3, -CH2CCl3 и т.п."Гидроксиалкил" означает алкил, предпочтительно низший алкил, который замещен одним, двумя или тремя гидроксигруппами; например гидроксиметил, 1- или 2-гидроксиэтил, 1,2-, 1,3- или 2,3 дигидроксипропил и т.п."Аралкил" означает алкил, предпочтительно низший алкил, который замещен арильной группой,как определено выше; например -СН 2 фенил, -(СН 2)2 фенил, -(СН 2)3 фенил, СН 3 СН(СН 3)СН 2 фенил и т.п. и их производные."Гетероаралкильная" группа означает алкил, предпочтительно низший алкил, который замещен гетероарильной группой; например -СН 2 пиридинил, -(СН 2)2 пиримидинил, -(СН 2)3 имидазолил и т.п. и их производные."Моноалкиламино" означает радикал -NHR, где R представляет собой алкильную или незамещенную циклоалкильную группу; например метиламино, (1-метилэтил)амино, циклогексиламино и т.п."Диалкиламино" означает радикал -NRR, где каждый из R независимо представляет собой алкильную или незамещенную циклоалкильную группу; диметиламино, диэтиламино, (1-метилэтил)этиламино,циклогексилметиламино, циклопентилметиламино и т.п."Необязательный" или "необязательно" означает, что описываемое впоследствии событие или обстоятельство может, но не должно обязательно осуществляться, и что описание включает случаи, где событие или обстоятельство осуществляется, и случаи, в которых этого не происходит. Например, "гетероциклическая группа, необязательно замещенная алкильной группой", означает, что алкил может, но не должен обязательно присутствовать, и что описание включает ситуации, когда гетероциклическая группа- 12013678 замещена алкильной группой, и ситуации, когда гетероциклическая группа не замещена алкильной группой."Фармацевтическая композиция" относится к смеси одного или нескольких соединений, описанных здесь, или их физиологически/фармацевтически приемлемых солей, сольватов, гидратов или пролекарств, с другими химическими компонентами, такими как физиологически/фармацевтически приемлемые носители и эксципиенты. Целью фармацевтической композиции является облегчение введения соединения в организм. Как здесь используется, "физиологически/фармацевтически приемлемый носитель" относится к носителю или разбавителю, который не вызывает значительного раздражения для организма и не ухудшает биологической активности и свойств введенного соединения."Фармацевтически приемлемый эксципиент" относится к инертному веществу, добавляемому к фармацевтической композиции для дополнительного облегчения введения соединения. Примеры, без ограничения, эксципиентов включают карбонат кальция, фосфат кальция, различные сахара и типы крахмала, производные целлюлозы, желатин, растительные масла и полиэтиленгликоли. Как здесь используется, термин "фармацевтически приемлемая соль" относится к таким солям, которые сохраняют биологическую эффективность и свойства исходного соединения. Такие соли включают:(i) аддитивные соли кислот, которые могут быть получены взаимодействием свободного основания исходного соединения с неорганическими кислотами, такими как хлористо-водородная кислота, бромисто-водородная кислота, азотная кислота, фосфорная кислота, серная кислота и перхлорная кислота и т.п., или с органическими кислотами, такими как уксусная кислота, щавелевая кислота, (D) или (L) яблочная кислота, малеиновая кислота, метансульфоновая кислота, этансульфоновая кислота, птолуолсульфоновая кислота, салициловая кислота, винная кислота, лимонная кислота, янтарная кислота или малоновая кислота и т.п.; или(2) соли, образованные, когда протон кислоты, присутствующий в исходном соединении, либо заменяется ионом металла, например ионом щелочного металла, ионом щелочно-земельного металла или ионом алюминия; либо координируется с органическим основанием, таким как этаноламин, диэтаноламин, триэтаноламин, трометамин, N-метилглюкамин и т.п."Модуляция" или "модулирующий" относится к изменению каталитической активности RTK, CTK и STK. В частности, модулирующий относится к активированию каталитической активности RTK, CTK и STK, предпочтительно к активированию или ингибированию каталитической активности RTK, CTK иSTK, в зависимости от концентрации соединения или соли, для которых RTK, СТК или STK экспонируются, или более предпочтительно к ингибированию каталитической активности RTK, CTK и STK."Каталитическая активность" относится к скорости фосфорилирования тирозина под воздействием,непосредственно или опосредованно, RTK и/или CTK, или фосфорилирования серина и треонина под воздействием, непосредственно или опосредованно, STK."Контактирование" относится к приведению в контакт соединения по настоящему изобретению и целевой PK таким образом, что соединение может воздействовать на каталитическую активность PK либо непосредственно, то есть путем взаимодействия с самой киназой, либо опосредованно, то есть путем взаимодействия с другой молекулой, от которой зависит каталитическая активность киназы. Такое "контактирование" может осуществляться in vitro, то есть в пробирке, чашке Петри или т.п. Контактирование в пробирке может включать в себя только соединение и PK, представляющую интерес, или может включать в себя целые клетки. Клетки можно также поддерживать или выращивать в чашках для культур клеток и приводить в контакт с соединением в этой окружающей среде. В этом контексте способность конкретного соединения воздействовать на расстройства, связанные с PK, то есть IC50 соединения, определенная ниже, можно определять до попытки использования соединений in vivo с более сложными живыми организмами. Для клеток вне организма существует множество способов, и они хорошо известны специалистам в данной области, контактирования PK с соединениями, включая, но не ограничиваясь ими, непосредственную микроинъекцию в клетку и многочисленные методики трансмембранных носителей."In vitro" относится к методикам, осуществляемым в искусственной окружающей среде, такой, например, как, без ограничения, пробирка или культуральная среда."Расстройство, связанное с PK", "расстройство, обусловленное PK" и "аномальная активность PK" все относятся к состоянию, отличающемуся неправильной, то есть меньшей или, чаще, большей каталитической активностью PK, где конкретная PK может представлять собой RTK, CTK или STK. Неправильная каталитическая активность может возникать в результате либо: (1) экспрессии PK в клетках,которые обычно не экспрессируют PK, (2) повышенной экспрессии PK, приводящей к нежелательной пролиферации, дифференциации и/или росту клеток, либо (3) уменьшения экспрессии PK, приводящей к нежелательным сокращениям пролиферации, дифференциации и/или роста клеток. Сверхактивность PK- 13013678 относится либо к амплификации кодирования гена конкретной PK, либо к продуцированию уровня активности PK, который может коррелировать с расстройством, связанным с пролиферацией, дифференциацией и/или ростом клеток (то есть когда уровень PK увеличивается, тяжесть одного или нескольких симптомов клеточного расстройства увеличивается). Недостаточная активность является, разумеется,обратной, когда тяжесть одного или нескольких симптомов клеточного расстройства увеличивается, когда уровень активности PK уменьшается."Лечить", "лечебный" и "лечение" относится к способу ослабления или устранения опосредуемогоPK клеточного расстройства и/или связанных с ним симптомов. По отношению конкретно к раку, эти термины просто означают, что вероятность выживания индивидуума, подверженного раку, увеличится,или что один или несколько симптомов заболевания уменьшатся."Организм" относится к любому живому существу, состоящему по меньшей мере из одной клетки. Живой организм может быть настолько простым, например, как отдельная эукариотическая клетка, или настолько сложным, как млекопитающее, включая человеческое существо."Терапевтически эффективное количество" относится к такому количеству вводимого соединения,которое будет облегчать до некоторой степени один или несколько симптомов расстройства, подлежащего лечению. По отношению к лечению рака терапевтически эффективное количество относится к такому количеству, которое обладает по меньшей мере одним из следующих воздействий:(2) ингибирует (то есть замедляет до некоторой степени, предпочтительно останавливает) метастазирование опухоли;(3) ингибирует до некоторой степени (то есть замедляет до некоторой степени, предпочтительно останавливает) рост опухоли и(4) облегчает до некоторой степени (или предпочтительно устраняет) один или несколько симптомов, связанных с раком."Мониторинг" означает наблюдение или детектирование эффекта контактирования соединения с клеткой, экспрессирующей конкретную PK. Наблюдаемое или детектируемое воздействие может представлять собой изменение клеточного фенотипа, каталитической активности PK или изменение взаимодействия PK с природным партнером по связыванию. Методики наблюдения или детектирования таких воздействий хорошо известны в данной области. Воздействие выбирают из изменения или отсутствия изменения клеточного фенотипа, изменения или отсутствия изменения каталитической активности указанной протеинкиназы, или изменения или отсутствия изменения взаимодействия указанной протеинкиназы с природным партнером по связыванию в конечном аспекте настоящего изобретения."Клеточный фенотип" относится к внешнему виду клетки или ткани или к биологической функции клетки или ткани. Примерами, без ограничения, клеточного фенотипа являются размер клеток, рост клеток, пролиферация клеток, дифференциация клеток, выживаемость клеток, апоптоз и потребление и использование питательных веществ. Такие фенотипические характеристики измеряют с помощью методик, хорошо известных в данной области.PK в клетке. Природные партнеры по связыванию могут играть роль в распространении сигнала, опосредуемом PK, в процессе передачи сигнала. Изменение взаимодействия природного партнера по связыванию с PK может проявляться само по себе как повышенная или пониженная концентрация комплексаPK/природный партнер по связыванию и, в результате, в наблюдаемом изменении способности PK к опосредованию передачи сигнала. Как используется в данном описании, термины "оптически чистый", "энантиомерно чистый", "чистый энантиомер" и "оптически чистый энантиомер" означают композицию, которая содержит один энантиомер соединения и, по существу, не содержит противоположный энантиомер соединения. Типичное оптически чистое соединение содержит более чем примерно 80 мас.% одного энантиомера соединения и менее чем примерно 20 мас.% противоположного энантиомера соединения, более предпочтительно более чем примерно 90 мас.% одного энантиомера соединения и менее чем примерно 10 мас.% противоположного энантиомера соединения, еще более предпочтительно более чем примерно 95 мас.% одного энантиомера соединения и менее чем примерно 5 мас.% противоположного энантиомера соединения и наиболее предпочтительно более чем примерно 97 мас.% одного энантиомера соединения и менее чем примерно 3 мас.% противоположного энантиомера соединения. Подробное описание Общие схемы синтеза соединений по настоящему изобретению можно найти в разделе "Примеры". Некоторые из общих методик показаны в связи с синтезом соединений, где остаток 1-(2,6-дихлор-3 фторфенил)этокси представляет собой чистый (R)-изомер, а некоторые показаны в связи с соединениями,где указанный остаток представляет собой рацемическую смесь. Необходимо понять, что методики могут быть использованы здесь для получения рацемических соединений или энантиомерно чистых (R)-изомеров путем выбора соответствующего рацемического или энантиомерно чистого исходного вещества. Методики, показанные здесь, могут быть использованы для получения разнообразных энантиомерно чистых соединений путем выбора соответствующего энантиомерно чистого исходного вещества. В- 14013678 дополнение к соединениям, показанным здесь, настоящее изобретение также предусматривает энантиомерно чистые соединения, соответствующие соединениям 3-[1-(2,6-дихлор-3-фторфенил)этокси]пиридин-2-иламина и 3-[1-(2,6-дихлор-3-фторфенил)этокси]пиразин-2-иламина, показанным в заявке на патент США, серийный 10/786610 (PCT/US 2004/005495); в заявке на патент США, серийныйкоторой должен быть присвоен, дело номер PC 32546, зарегистрированной 26 августа 2004 г. и озаглавленной,"Pyrazolo-Substituted Aminoheteroaryl Compounds as Protein Kinase Inhibitors"; и в заявке на патент США,серийныйкоторой должен быть присвоен, дело номер PC 32548, зарегистрированной 26 августа 2004 г. и озаглавленной "Aminoheteroaryl Compounds as Protein Kinase Inhibitors". Описания этих документов включены здесь в качестве ссылок во всей их полноте. Если не указано иного, в данном описании все ссылки на соединения по настоящему изобретению включают ссылки на их соли, сольваты, гидраты и комплексы и на их сольваты, гидраты и комплексы их солей, включая их полиморфы, стереоизомеры и изотопно-меченые версии. Фармацевтически приемлемые соли включают аддитивные соли кислот и оснований (включая дисоли). Соответствующие аддитивные соли кислоты получают из кислот, которые образуют нетоксичные соли. Примеры включают ацетатные, аспартатные, бензоатные, бесплатные, бикарбонатные/карбонатные, бисульфатные/сульфатные, боратные, камсилатные, цитратные, эдизилатные, эзилатные, формиатные, фумаратные, глюцептатные, глюконатные, глюкуронатные, гексафторфосфатные, гибензатные, гидрохлоридные/хлоридные, гидробромидные/бромидные, гидройодидные/йодидные, изетионатные, лактатные, малатные, малеатные, малонатные, мезилатные, метилсульфатные, нафтилатные,2-напсилатные, никотинатные, нитратные, оротатные, оксалатные, пальмитатные, памоатные, фосфатные/гидрофосфатные/дигидрофосфатные, сахаратные, стеаратные, сукцинатные, тартратные, тозилатные и трифторацетатные соли. Соответствующие соли оснований получают из оснований, которые образуют нетоксичные соли. Примеры включают соли алюминия, аргинина, бензатина, кальция, холина, диэтиламина, диоламина,глицина, лизина, магния, меглумина, оламина, калия, натрия, трометамина и цинка. Обзор соответствующих солей см. в "Handbook of Pharmaceutical Salts: Properties, Selection, and Use"by Stahl and Wermuth (Wiley-VCH, Weinheim, Germany, 2002), описание которой включено здесь в качестве ссылки во всей ее полноте. Фармацевтически приемлемая соль соединений по настоящему изобретению может быть легко получена смешиванием вместе растворов соединения и желаемой кислоты или основания, по желанию. Соль можно осаждать из раствора и собирать фильтрованием или можно извлекать выпариванием растворителя. Степень ионизации соли может изменяться от полной ионизации до почти неионизованной соли. Соединения по настоящему изобретению могут существовать как в несольватированных, так и в сольватированных формах. Термин "сольват" используют здесь для описания молекулярного комплекса,содержащего соединение по настоящему изобретению и одну или несколько фармацевтически приемлемых молекул растворителя, например этанола. Термин "гидрат" используется, когда растворитель представляет собой воду. Фармацевтически приемлемые сольваты в соответствии с настоящим изобретением включают гидраты и сольваты, в которых растворитель для кристаллизации может быть изотопно замещенным, например представлять собой D2O, d6-ацетон, d6-ДМСО. Также включенными в объем настоящего изобретения являются комплексы, такие как клатраты,комплексы включения лекарственное средство-хозяин, где в противоположность указанным выше сольватам лекарственное средство и хозяин присутствуют в стехиометрических или нестехиометрических количествах. Также включенными являются комплексы лекарственного средства, содержащие два или более органических и/или неорганических компонентов, которые могут находиться в стехиометрических или нестехиометрических количествах. Полученные комплексы могут быть ионизированными, частично ионизированными или неионизированными. Обзор таких комплексов см. в J Pharm Sci, 64(8), 1269-1288by Haleblian (август 1975 г.), описание которой полностью включено здесь в качестве ссылки во всей ее полноте. Также в объем настоящего изобретения входят полиморфы, пролекарства и изомеры (включая оптические, геометрические и таутомерные изомеры) соединений по настоящему изобретению. Производные соединений по настоящему изобретению, которые сами по себе могут иметь низкую фармакологическую активность или не иметь вообще никакой активности, при введении пациенту могут быть преобразованы в соединения по настоящему изобретению, например, путем гидролитического расщепления. Такие производные упоминаются как "пролекарства". Дополнительную информацию по применению пролекарств можно найти в "Pro-Drugs as Novel Delivery Systems", vol. 14, ACS Symposium Series (T. Higuchi and W Stella) и "Bioreversible Carriers in Drug Design", Pergamon Press, 1987 (ed. E В Roche,American Pharmaceutical Association), описания которых включены здесь в качестве ссылок во всей их полноте. Пролекарства в соответствии с настоящим изобретением могут, например, быть получены заменой соответствующих функциональных групп, присутствующих в соединениях по настоящему изобретению,- 15013678 определенными остатками, известными специалистам в данной области как "проостатки", как описано,например, в "Design of Prodrugs" by H. Bundgaard (Elsevier, 1985), описание которой полностью включено здесь в качестве ссылки во всей ее полноте. Некоторые примеры пролекарств в соответствии с настоящим изобретением включают такие:(i) где соединение содержит функциональную группу карбоновой кислоты (-СООН), замену ее сложным эфиром, например замену водорода (C1-C8)алкилом;(ii) где соединение содержит функциональную группу спирта (-ОН), замену ее простым эфиром,например замену водорода (C1-C6)алканоилоксиметилом; и(iii) где соединение содержит первичную или вторичную функциональную аминогруппу (-NH2 или-NHR, где RН), замену ее соответствующим амидом, например замену одного или обоих атомов водорода (C1-С 10)алканоилом. Дополнительные примеры заменяемых групп в соответствии с приведенными выше примерами и примеры других типов пролекарств можно найти в указанных выше ссылках. Наконец, определенные соединения по настоящему изобретению могут сами по себе действовать в качестве пролекарств других соединений по настоящему изобретению. Соединения по настоящему изобретению, содержащие один или несколько асимметричных атомов углерода, могут существовать в виде двух или более стереоизомеров. Когда соединение по настоящему изобретению содержит алкенильную или алкениленовую группу, возможны геометрические цис/транс(или Z/E) изомеры. Когда соединение содержит, например, кетогруппу, или оксимную группу, или ароматический остаток, может возникать таутомерная изомерия ("таутомерия"). Одно соединение может демонстрировать более одного типа изомерии. Включенными в объем настоящего изобретения являются все стереоизомеры, геометрические изомеры и таутомерные формы соединений по настоящему изобретению, включая соединения, демонстрирующие более одного типа изомерии, и смеси с одним или несколькими из них. Также включенными являются аддитивные соли кислот или оснований, где противоион является оптически активным, например D-лактат или L-лизин, или рацемическим, например DL-тартрат или DL-аргинин. цис/транс-Изомеры можно разделять с помощью обычных методик, хорошо известных специалистам в данной области, например хроматографией и фракционной кристаллизацией. Обычные методики получения/выделения индивидуальных энантиомеров включают хиральный синтез из соответствующего оптически чистого предшественника или расщепление рацемата (или рацемата соли, или производного) с использованием, например, хиральной высокоэффективной жидкостной хроматографии (ВЭЖХ). Альтернативно, рацемат (или рацемический предшественник) может взаимодействовать с соответствующим оптически активным соединением, например спиртом, или в случае, когда соединение содержит кислотный или основной остаток, с кислотой или основанием, таким как винная кислота или 1 фенилэтиламин. Полученную диастереомерную смесь можно разделять хроматографией и/или фракционной кристаллизацией, и один или оба диастереоизомера преобразовать в соответствующий чистый энантиомер (энантиомеры) средствами, хорошо известными специалисту в данной области. Хиральные соединения по настоящему изобретению (и их хиральные предшественники) могут быть получены в энантиомерно-обогащенной форме с использованием хроматографии, как правило, ВЭЖХ,на асимметричной смоле с подвижной фазой, состоящей из углеводорода, как правило, гептана или гексана, содержащей от 0 до 50% изопропанола, обычно от 2 до 20%, и от 0 до 5% алкиламина, как правило,0,1% диэтиламина. Концентрирование элюата дает обогащенную смесь. Стереоизомерные конгломераты можно разделять с помощью обычных методик, известных специалистам в данной области; см., например, "Stereochemistry of Organic Compounds" by E.L. Eliel (Wiley,New York, 1994), описание которой включено здесь в качестве ссылки во всей ее полноте. Настоящее изобретение также включает изотопно-меченные соединения по настоящему изобретению, где один или несколько атомов заменены атомом, имеющим такой же атомный номер, но атомную массу или массовое число, отличное от атомной массы или массового числа, обычно встречающегося в природе. Примеры изотопов, пригодных для включения в соединения по настоящему изобретению,включают изотопы водорода, такие как 2 Н и 3 Н, углерода, такие как 11 С, 13 С и 14 С, хлора, такие как 36Cl,фтора, такие как 18F, йода, такие как 123I и 125I, азота, такие как 13N и 15N, кислорода, такие как 15O, 17O и 18O, фосфора, такие как 32 Р, и серы, такие как 35S. Определенные изотопно-меченые соединения по настоящему изобретению, например, содержащие радиоактивный изотоп, являются полезными при исследованиях распределения лекарственного средства и/или субстрата в тканях. Радиоактивные изотопы тритий, 3 Н, и углерод-14, 14 С, являются особенно пригодными для этой цели, учитывая их простоту включения и простые средства детектирования. Замещение более тяжелыми изотопами, такими как дейтерий,2 Н, может давать определенные терапевтические преимущества, возникающие благодаря большей метаболической стабильности, например, увеличенное время полужизни in vivo или уменьшенные требования к дозировке, и, следовательно, могут быть предпочтительными в некоторых обстоятельствах. Замещение изотопами, испускающими позитроны, такими как 11 С, 18F, 15O и 13N, могут быть полезными при исследованиях Positron Emission Topography (PET) для изучения расположения рецепторов субстрата.- 16013678 Изотопно-меченные соединения по настоящему изобретению, как правило, могут быть получены с помощью обычных методик, известных специалистам в данной области, или с помощью способов, аналогичных тем, которые здесь описаны, с использованием соответствующего изотопно-меченого реагента вместо немеченного реагента, используемого в иных случаях. Фармацевтически приемлемые сольваты в соответствии с настоящим изобретением включают такие, в которых растворитель кристаллизации может быть изотопно-замещенным, например D2O, d6 ацетон, d6-ДМСО. Соединения по настоящему изобретению, предназначенные для фармацевтического применения,можно вводить в виде кристаллических или аморфных продуктов, или их смесей. Они могут быть получены, например, в виде твердых слоев, порошков или пленок такими способами, как преципитация, кристаллизация, сушка вымораживанием, сушка распылением, или сушка выпариванием. Для этой цели может использоваться микроволновая или радиочастотная сушка. Соединения можно вводить отдельно или в сочетании с одним или несколькими другими соединениями по настоящему изобретению, или в сочетании с одним или несколькими другими лекарственными средствами (или в виде любого их сочетания). Как правило, их будут вводить в виде препарата в ассоциации с одним или несколькими фармацевтически приемлемыми эксципиентами. Термин "эксципиент" используют здесь для описания любого ингредиента, отличного от соединения (соединений) по настоящему изобретению. Выбор эксципиента будет в большой степени зависеть от таких факторов, как конкретный способ введения, влияние эксципиента на растворимость и стабильность и природа лекарственной формы. Фармацевтические композиции, подходящие для доставки соединений по настоящему изобретению, и способы их получения будут легко понятны специалистам в данной области. Такие композиции и способы их получения могут быть найдены, например, в "Remington's Pharmaceutical Sciences", 19th Edition (Mack Publishing Company, 1995), описание которого включено здесь в качестве ссылки во всей его полноте. Пероральное введение. Соединения по настоящему изобретению можно вводить перорально. Пероральное введение может включать глотание, так что соединение поступает в желудочно-кишечный тракт, или же может быть использовано буккальное или сублингвальное введение, посредством которого соединение поступает в поток крови непосредственно из ротовой полости. Препараты, подходящие для перорального введения, включают твердые препараты, такие как таблетки, капсулы, содержащие частицы, жидкости или порошки, лепешки (включая наполненные жидкостью), жевательную резинку, мульти- и наночастицы, гели, твердый раствор, липосомы, пленки (включая мукоадгезивные), суппозитории, спреи и жидкие препараты. Жидкие препараты включают суспензии, растворы, сиропы и эликсиры. Такие препараты могут использоваться в качестве наполнителей в мягких или твердых капсулах и, как правило, содержат носитель, например воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу или соответствующее масло, и один или несколько эмульгирующих агентов и/или суспендирующих агентов. Жидкие препараты могут быть также получены разбавлением твердого вещества, например из саше. Соединения по настоящему изобретению могут быть также использованы в быстрорастворимых,быстродезинтегрируемых лекарственных формах, таких как те, которые описываются в Expert Opinion inTherapeutic Patents, 11 (6), 981-986, Liang and Chen (2001), описание которой включено здесь в качестве ссылки во всей ее полноте. Для таблеточных лекарственных форм, в зависимости от дозы, лекарственное средство может занимать от 1 до 80 мас.% от лекарственной формы, чаще от 5 до 60 мас.% от лекарственной формы. В дополнение к лекарственному средству таблетки обычно содержат дезинтегрант. Примеры дезинтегрантов включают натрий-крахмал гликолят, натрий-карбоксиметилцеллюлозу, кальций-карбоксиметилцеллюлозу, кроскармеллозу натрия, кросповидон, поливинилпирролидон, метилцеллюлозу, микрокристаллическую целлюлозу, низший алкилзамещенную гидроксипропилцеллюлозу, крахмал, предварительно желатинизированный крахмал и альгинат натрия. Как правило, дезинтегрант будет составлять от 1 до 25 мас.%, предпочтительно от 5 до 20 мас.% от лекарственной формы. Связующие, как правило, используются для придания когезивных качеств таблеточному препарату. Подходящие для связующих включают микрокристаллическую целлюлозу, желатин, сахара, полиэтиленгликоль, природные и синтетические смолы поливинилпирролидон, предварительно желатинизированный крахмал, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу. Таблетки могут также содержать разбавители, такие как лактоза (моногидрат, высушенный распылением моногидрат, безводная и т.п.), маннит, ксилит, декстрозу, сахарозу, сорбит, микрокристаллическую целлюлозу, крахмал и дигидрат двухосновного фосфата кальция. Таблетки также могут необязательно включать поверхностно-активные агенты, такие как лаурилсульфат натрия и полисорбат 80, и вещества, способствующие скольжению, такие как диоксид кремния и тальк. Когда они присутствуют, поверхностно-активные агенты, как правило, находятся в количествах от 0,2 до 5 мас.% таблетки, а вещества, способствующие скольжению, как правило, от 0,2 до 1 мас.% таб- 17013678 летки. Таблетки обычно содержат также лубриканты, такие как стеарат магния, стеарат кальция, стеарат цинка, стеарилфумарат натрия и смеси стеарата магния с лаурилсульфатом натрия. Лубриканты обычно присутствуют в количествах от 0,25 до 10 мас.%, предпочтительно от 0,5 до 3 мас.% таблетки. Другие обычные ингредиенты включают антиоксиданты, красящие вещества, ароматизирующие агенты, консерванты и агенты, маскирующие вкус. Типичные таблетки содержат примерно до 80 мас.% лекарственного средства, примерно от 10 до примерно 90 мас.% связующего, примерно от 0 до примерно 85 мас.% разбавителя, примерно от 2 до примерно 10 мас.% дезинтегранта и примерно от 0,25 до примерно 10 мас.% лубриканта. Таблеточные смеси можно штамповать непосредственно или посредством валков, с образованием таблеток. Таблеточные смеси или части смесей можно альтернативно гранулировать во влажном состоянии, в сухом состоянии или из расплава, отверждать из расплава или экструдировать перед таблетированием. Конечный препарат может содержать один или несколько слоев и может иметь или не иметь покрытия; или может быть инкапсулирован. Приготовление таблеток подробно обсуждается в "Pharmaceutical Dosage Forms: Tablets, Vol. 1", byH. Lieberman and L. Lachman, Marcel Dekker, N.Y., N.Y., 1980 (ISBN 0-8247-6918-X), описание которой полностью включено здесь в качестве ссылки во всей ее полноте. Твердые препараты для перорального введения могут быть составлены с возможностью непосредственного и/или модифицированного высвобождения. Препараты с модифицированным высвобождением включают замедленное, длительное, импульсное, контролируемое, целевое и программируемое высвобождение. Соответствующие препараты с модифицированным высвобождением описываются в патенте США 6106864. Подробности других подходящих методик высвобождения, таких как высокоэнергетические дисперсии и осмотические и снабженные покрытием частицы, можно найти в Verma et al., PharmaceuticalTechnology On-line, 25(2), 1-14 (2001). Использование жевательной резинки для достижения контролируемого высвобождения описывается в заявке на международный патент WO 00/35298. Описания этих рекомендаций включено здесь в качестве ссылок во всей их полноте. Парентеральное введение. Соединения по настоящему изобретению можно также вводить непосредственно в кровоток, в мышцу или во внутренний орган. Соответствующие средства для парентерального введения включают внутривенные, внутриартериальные, внутрибрюшинные, интратекальные, интравентрикулярные, внутриуретральные, надчревные, внутричерепные, внутримышечные и подкожные. Соответствующие устройства для парентерального введения включают игольные (включая микроиглы) инжекторы, инжекторы без игл и инфузионные методики. Парентеральные препараты представляют собой, как правило, водные растворы, которые могут содержать эксципиенты, такие как соли, углеводы и буферные агенты (предпочтительно для рН от 3 до 9),но для некоторых применений они могут быть более удобно приготовлены в виде стерильного неводного раствора или в виде высушенной формы, которые должны использоваться в сочетании с соответствующим носителем, таким как стерильная, не содержащая пирогенов вода. Получение парентеральных препаратов в стерильных условиях, например лиофилизацией, может быть легко осуществлено с использованием стандартных фармацевтических методик, хорошо известных специалистам в данной области. Растворимость соединений по настоящему изобретению, используемых при получении парентеральных растворов, может быть увеличена использованием соответствующих методик приготовления,таких как включение агентов, повышающих растворимость. Препараты для парентерального введения могут быть приготовлены с возможностью непосредственного и/или модифицированного высвобождения. Препараты с модифицированным высвобождением включают замедленное, длительное, импульсное, контролируемое, целевое и программируемое высвобождение. Таким образом, соединения по настоящему изобретению могут быть приготовлены в виде твердого продукта, полутвердого продукта или тиксотропной жидкости для введения в виде имплантированного депо, обеспечивающего модифицированное высвобождение активного соединения. Примеры таких препаратов включают покрытые лекарственными средствами стенты и микросферы PGLA. Местное введение. Соединения по настоящему изобретению можно также вводить местно, на/в кожу или слизистую оболочку, то есть дермально или трансдермально. Типичные препараты для этой цели включают гели,гидрогели, лосьоны, растворы, кремы, мази, пудры, перевязочные средства, пены, пленки, накожные пластыри, пластинки, импланты, губки, волокна, повязки и микроэмульсии. Также могут использоваться липосомы. Типичные носители включают спирт, воду, минеральное масло, жидкий вазелин, белый вазелин, глицерин, полиэтиленгликоль и пропиленгликоль. Могут быть включены усилители проницаемости; см., например, J Pharm Sci, 88(10), 955-958 by Finnin and Morgan (Oktober 1999). Другие средства для местного введения включают доставку путем электропорации, ионтофореза, фонофореза, сонофореза и инъекции с помощью микроигл или без игл (например, Powderject, Bioject и т.п.). Описание этих ре- 18013678 комендаций включено здесь в качестве ссылок во всей их полноте. Препараты для местного введения могут быть приготовлены с возможностью непосредственного и/или модифицированного высвобождения. Препараты с модифицированным высвобождением включают замедленное, длительное, импульсное, контролируемое, целевое и программируемое высвобождение. Ингаляционное/интраназальное введение. Соединения по настоящему изобретению могут быть также введены интраназально или путем ингаляции, как правило, в форме сухого порошка (либо самого по себе, в виде смеси, например в сухой смеси с лактозой, либо в виде частиц смешиваемого компонента, например смешиваемого с фосфолипидами, такими как фосфатидилхолин) из ингалятора для сухого порошка или в виде аэрозольного спрея,контейнера высокого давления, насоса, спрея, атомайзера (предпочтительно атомайзера, использующего электрогидродинамику для получения мелкодисперсного тумана) или небулайзера, с использованием соответствующего пропеллента, такого как 1,1,1,2-тетрафторпентан или 1,1,1,2,3,3,3-гептафторпропан,или без него. Для интраназального применения порошок может включать биоадгезивный агент, например хитозан или циклодекстрин. Контейнер высокого давления, насос, спрей, атомайзер или небулайзер содержит раствор или суспензию соединения (соединений) по настоящему изобретению, включающий, например, этанол, водный раствор этанола или соответствующий альтернативный агент для диспергирования, солюбилизации или продления высвобождения активного вещества, пропеллент (пропелленты) в качестве растворителя и необязательное поверхностно-активное вещество, такое как триолеат сорбитана, олеиновая кислота или олигомолочная кислота. Перед использованием в препарате в виде сухого порошка или суспензии продукт лекарственного средства доводят до микронных размеров, подходящих для доставки путем ингаляции (как правило, менее чем 5 мкм). Этого можно достичь любым соответствующим способом измельчения, таким как измельчение в спиральной струе, струйное измельчение в псевдоожиженном слое, обработка в сверхкритической жидкости с получением наночастиц, гомогенизация высокого давления или сушка распылением. Капсулы (изготовленные, например, из желатина или НРМС), блистеры и картриджи для применения в ингаляторе или инсуфляторе могут быть приготовлены так, чтобы они содержали порошковую смесь соединения по настоящему изобретению, подходящую порошковую основу, такую как лактоза или крахмал, и модификатор характеристик, такой как 1-лейцин, маннит или стеарат магния. Лактоза может быть безводной или находиться в форме моногидрата, последнее - предпочтительно. Другие подходящие эксципиенты включают декстран, глюкозу, мальтозу, сорбит, ксилит, фруктозу, сахарозу и трегалозу. Препарат в виде раствора для применения в атомайзере, использующем электрогидродинамику для получения тонкодисперсного тумана, может содержать от 1 до 20 мг соединения по настоящему изобретению на одно действие, и объем однократного действия может изменяться от 1 до 100 мкл. Типичный препарат содержит соединение по настоящему изобретению, пропиленгликоль, стерильную воду, этанол и хлорид натрия. Альтернативные растворители, которые могут использоваться вместо пропиленгликоля, включают глицерин и полиэтиленгликоль. Соответствующие ароматизаторы, такие как ментол и левоментол, или подсластители, такие как сахарин или сахарин натрий, могут быть добавлены к этим препаратам по настоящему изобретению, предназначенным для ингаляционного/интраназального введения. Препараты для ингаляционного/интраназального введения могут быть приготовлены с возможностью непосредственного и/или модифицированного высвобождения, с использованием, например, сополимера DL-молочной кислоты и гликолевой кислоты (PGLA). Препараты с модифицированным высвобождением включают замедленное, длительное, импульсное, контролируемое, целевое и программируемое высвобождение. В случае ингаляторов для сухого порошка и аэрозолей, единица дозы определяется посредством клапана, который доставляет отмеренное количество. Единицы в соответствии с настоящим изобретением, как правило, организуются для введения отмеренной дозы или "пшика", содержащей желаемое количество соединения по настоящему изобретению. Общую ежедневную дозу можно вводить в разовой дозе или чаще, в виде разделенных доз в течение дня. Ректальное/интравагинальное введение. Соединения по настоящему изобретению могут быть введены ректально или вагинально, например,в форме суппозитория, пессария или клизмы. Масло какао представляет собой традиционную основу для суппозиториев, но различные альтернативы могут использоваться, если это необходимо. Препараты для ректального/вагинального введения могут быть приготовлены с возможностью непосредственного и/или модифицированного высвобождения. Препараты с модифицированным высвобождением включают замедленное, длительное, импульсное, контролируемое, целевое и программируемое высвобождение. Окулярное введение. Соединения по настоящему изобретению могут быть также введены непосредственно в глаз или в ухо, как правило, в форме капель суспензии частиц микронных размеров или раствора в изотоническом,имеющем заданный рН, стерильном солевом растворе. Другие препараты, подходящие для окулярного и- 19013678 аурального введения, включают мази, биодеградируемые (например, губки из поглощаемого геля, коллаген) и недеградируемые биологически (например, силиконовые) импланты, пластинки, линзы и системы частиц или везикул, таких как ниосомы или липосомы. Полимер, такой как поперечно-сшитая полиакриловая кислота, поливиниловый спирт, гиалуроновая кислота, целлюлозный полимер, например гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза или метилцеллюлоза, или гетерополисахаридный полимер, например гелановая камедь, может быть включен вместе с консервантом, таким как бензалконийхлорид. Такие препараты могут также доставляться путем ионтофореза. Препараты для окулярного/аурального введения могут быть приготовлены с возможностью непосредственного и/или модифицированного высвобождения. Препараты с модифицированным высвобождением включают замедленное, длительное, импульсное, контролируемое, целевое или программируемое высвобождение. Другие методики. Соединения по настоящему изобретению могут быть объединены с растворимыми макромолекулярными веществами, такими как циклодекстрин и его соответствующие производные, или полимеры,содержащие полиэтиленгликоль, для улучшения их растворимости, скорости растворения, маскировки вкуса, биодоступности и/или стабильности для использования в любом из указанных выше способов введения. Комплексы лекарственное средство-циклодекстрин, например, как обнаружено, в целом пригодны для большинства лекарственных форм и способов введения. Могут использоваться комплексы, как с включением, так и без включения. В качестве альтернативы непосредственному комплексообразованию с лекарственным средством, циклодекстрин может использоваться в качестве вспомогательной добавки,то есть в виде носителя, разбавителя или солюбилизатора. Чаще всего для этих целей используют альфа-,бета- и гамма-циклодекстрины, примеры которых можно найти в РСТ публикациях заявок на международный патентWO 91/11172, WO 94/02518 и WO 98/55148, описания которых включено здесь в качестве ссылок во всей их полноте. Дозировка. Количество введенного активного соединения будет зависеть от субъекта, подлежащего лечению,тяжести расстройства или состояния, скорости введения, выведения соединения и ответственности предписывающего врача. Однако эффективная дозировка, как правило, находится в пределах примерно от 0,001 до примерно 100 мг на кг массы тела в день, предпочтительно примерно от 0,01 до примерно 35 мг/кг/день в разовой дозе или в разделенных дозах. Для 70-кг человека это составило бы количество примерно от 0,07 до примерно 7000 мг/день, предпочтительно примерно от 0,7 до примерно 2500 мг/день. В некоторых случаях уровни дозировки ниже нижнего предела указанного выше диапазона могут быть более чем адекватными, в то время как в других случаях могут использоваться еще большие дозы, не вызывая никакого вредного побочного воздействия, при этом такие большие дозы, как правило,разделяют на несколько меньших доз для введения в течение дня. Наборы. Поскольку может быть желательным введение комбинации активных соединений, например, для лечения конкретного заболевания или состояния, в объеме настоящего изобретения предусматривается,что две или более фармацевтических композиций, по меньшей мере одна из которых содержит соединение в соответствии с настоящим изобретением, могут быть удобно объединены в форме набора, пригодного для совместного введения композиций. Таким образом, набор по настоящему изобретению содержит две или более отдельных фармацевтических композиций, по меньшей мере одна из которых содержит соединение по настоящему изобретению, и средства для раздельного размещения таких композиций,такие как контейнер, бутылка с несколькими отделениями или пакет из фольги с несколькими отделениями. Примером такого набора является обычная блистерная упаковка, используемая для упаковки таблеток, капсул и т.п. Набор по настоящему изобретению особенно подходит для введения различных лекарственных форм, например, для перорального и парентерального введения, для введения отдельных композиций с различными интервалами между дозировками или для титрования отдельных композиций по отношению друг к другу. Для удобства набор, как правило, содержит инструкции для введения и может снабжаться этикеткой для памяти. Примеры В следующих далее примерах "Et" обозначает этил, "Ас" обозначает ацетил, "Ме" обозначает метил, "Ms" обозначает метансульфонил (CH3SO2), "iPr" обозначает изопропил, "HATU" обозначает гексафторфосфат 2-(7-аза-1 Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония, "Ph" обозначает фенил, "Boc" обозначает трет-бутоксикарбонил, "EtOAc" обозначает этилацетат, "HOAc" обозначает уксусную кислоту, "NEt3" или "Et3N" обозначает триэтиламин, "ТГФ" обозначает тетрагидрофуран, "DIC" обозначает диизопропилкарбодиимид, "HOBt" обозначает гидроксибензотриазол, "МеОН" обозначает метанол, "iPrOAc" обозначает изопропилацетат, "KOAc" обозначает ацетат калия, "ДМСО" обозначает диметилсульфоксид, "AcCl" обозначает ацетилхлорид, "CDCl3" обозначает дейтерированный хлороформ,"МТВЕ" обозначает метил-трет-бутиловый эфир, "ДМФА" обозначает диметилформамид, "Ас 2 О" обо- 20013678 значает уксусный ангидрид, "Me3SOI" обозначает йодид триметилсульфоксония, "DMAP" обозначает 4 диметиламинопиридин, "dppf" обозначает дифенилфосфиноферроцен, "DME" обозначает диметиловый эфир этиленгликоля, НОВТ обозначает 1-гидроксибензотриазол, EDC обозначает 1-этил-3-(3-диметиламинопропил)карбодиимид. Следующие далее примеры приводятся для иллюстрации настоящего изобретения. Необходимо понять, однако, что настоящее изобретение не должно ограничиваться конкретными условиями или деталями, описанными в этих примерах. Реагенты могут быть синтезированы, как здесь показано, или являются доступными из коммерческих источников (например, Aldrich, Milwaukee, WI; Acros, Morris Plains, NJ; Biosynth International, Naperville, IL; Frontier Scientific, Logan, UT; TCI America, Portland, OR; Combi-Blocks, San Diego, CA; MatrixScientific, Columbia, SC; Acros, Morris Plains, NJ; Alfa Aesar, Ward Hill, MA; Apollo Scientific, UK; и тому подобное), или могут быть синтезированы по методикам, известным в данной области. Синтез нескольких конкретных реагентов показан в заявке на патент США, серийный 10/786610,озаглавленной "Aminoheteroaryl Compounds as Protein Kinase Inhibitors", зарегистрированной 26 февраля 2004 г., и в соответствующей заявке на международный патент PCT/US 2004/005495 с таким же заглавием, зарегистрированной 26 февраля 2004 г. Другие реагенты могут быть синтезированы путем адаптации приведенных там методик, и специалист в данной области может легко адаптировать эти методики для получения желаемых соединений. Кроме того, эти ссылки содержат общие методики и конкретные примеры получения большого количества гетероариламиносоединений, и специалист в данной области может легко адаптировать такие методики и примеры для получения соединений по настоящему изобретению. Описания этих рекомендаций включено здесь в качестве ссылок во всей их полноте. Когда упоминается общая или примерная методика синтеза, специалист в данной области может легко определить соответствующие реагенты, если они не указаны, исходя из общих или примерных методик. Некоторые из общих методик приводятся в качестве примеров получения конкретных соединений. Специалист в данной области может легко адаптировать такие методики к синтезу других соединений. Необходимо понять, что группы R, показанные в общих методиках, как подразумевается, являются обобщенными и неограничивающими и не соответствуют определениям групп R в других местах настоящего документа. Каждая такая группа R представляет собой один или множество химических остатков, которые могут быть такими же или отличаться от других химических остатков, также представленных тем же символом R. Специалист в данной области может легко определить диапазон групп R, подходящих для примеров синтеза. Кроме того, представление незамещенного положения в структурах, показанных или упоминаемых в общих методиках, приводится для удобства и не означает замещения, как описано здесь в другом месте. Относительно конкретных групп, которые могут присутствовать либо как группы R в общих методиках, либо как необязательные непоказанные заместители, это относится к описаниям в остальных частях настоящего документа, включая формулу изобретения, сущность изобретения и подробное описание. Некоторые общие методики показаны со ссылками на синтез соединений, где остаток 1-(2,6 дихлор-3-фторфенил)этокси представляет собой чистый (R)-изомер, а некоторые показаны со ссылками на соединения, в которых указанный остаток представляет собой рацемическую смесь. Необходимо понять, что методики могут использоваться для получения рацемических соединений или энантиомерно чистых (R)-изомеров путем выбора соответствующего рацемического или энантиомерно чистого исходного вещества. Методики, показанные здесь, могут использоваться для получения большого разнообразия энантиомерно чистых соединений путем выбора соответствующего энантиомерно чистого исходного вещества. В дополнение к соединениям, показанным здесь, настоящее изобретение также предусматривает энантиомерно чистые соединения, соответствующие соединениям 3-[1-(2,6-дихлор-3-фторфенил)этокси] пиридин-2-иламина и 3-[1-(2,6-дихлор-3-фторфенил)этокси]пиразин-2-иламина, показанным в заявке на патент США, серийный 10/786610 (PCT/US 2004/005495); в заявке на патент США, серийныйдолжен быть присвоен, номер дела PC 32546, зарегистрированной 26 августа 2004 г. и озаглавленной "Pyrazolo-Substituted Arninoheteroaryl Compounds as Protein Kinase Inhibitors"; и в заявке на патент США, серийныйдолжен быть присвоен, номер дела PC 32548, зарегистрированной 26 августа 2004 г. и озаглавленной "Aminoheteroaryl Compounds as Protein Kinase Inhibitors". Описания этих документов полностью включены здесь в качестве ссылок во всей их полноте. Выбор исходных веществ. 5-Бром-3-[1-(2,6-дихлор-3-фторфенил)этокси]пиридин-2-иламин (рацемат). 1. 2,6-Дихлор-3-фторацетофенон (15 г, 0,072 моль) перемешивают в ТГФ (150 мл, 0,5 М) при 0 С на ледяной бане в течение 10 мин. Медленно добавляют алюмогидрид лития (2,75 г, 0,072 моль). Реакционную смесь перемешивают при температуре окружающей среды в течение 3 ч. Реакционную смесь охлаждают на ледяной бане и добавляют по каплям воду (3 мл) с последующим добавлением 15% NaOH (3 мл) (медленно). Смесь перемешивают при температуре окружающей среды в течение 30 мин. Добавляют 15% NaOH (9 мл), MgSO4 и смесь фильтруют для удаления твердых продуктов. Твердые продукты промывают ТГФ (50 мл) и фильтрат концентрируют с получением 1-(2,6-дихлор-3-фторфенил)этанола (14,8 г, выход 95%) в виде желтого масла. 1 Н-ЯМР (400 МГц, ДМСО-d6)1,45 (д, 3 Н), 5,42 (м, 2 Н), 7,32 (м, 1 Н), 7,42 (м, 1 Н). 2. К перемешиваемому раствору трифенилфосфина (8,2 г, 0,03 моль) и DEAD (13,65 мл 40% раствора в толуоле) в ТГФ (200 мл) при 0 С добавляют раствор 1-(2,6-дихлор-3-фторфенил)этанола (4,55 г,0,021 моль) и 3-гидроксинитропиридина (3,35 г, 0,023 моль) в ТГФ (200 мл). Полученный яркооранжевый раствор перемешивают в атмосфере азота при температуре окружающей среды в течение 4 ч,при этом все исходные вещества реагируют. Растворитель удаляют и неочищенный продукт сухим загружают на силикагель и элюируют смесью этилацетат-гексан (20:80), получая 3-(2,6-дихлор-3 фторбензилокси)-2-нитропиридин (6,21 г, 0,021 моль, 98%) в виде розового твердого продукта. 1 Н-ЯМР (CDCl3, 300 МГц)1,8-1,85 (д, 3 Н), 6,0-6,15 (кв, 1 Н), 7,0-7,1 (т, 1 Н), 7,2-7,21 (д, 1 Н), 7,257,5 (м, 2 Н), 8,0-8,05 (д, 1 Н). 3. В перемешиваемой смеси АсОН (650 мл) и EtOH (500 мл) суспендируют 3-(2,6-дихлор-3 фторбензилокси)-2-нитропиридин (9,43 г, 0,028 моль) и железную стружку (15,7 г, 0,28 моль). Реакционную смесь медленно кипятят с обратным холодильником и дают перемешиваться в течение 1 ч. Реакционную смесь охлаждают до комнатной температуры, затем добавляют диэтиловый эфир (500 мл) и воду(500 мл). Раствор осторожно нейтрализуют добавлением карбоната натрия. Объединенные органические экстракты промывают насыщенным раствором NaHCO3 (2100 мл), H2O (2100 мл) и насыщенным раствором соли (1100 мл), затем сушат (Na2SO4), фильтруют и концентрируют досуха в вакууме с получением 3-(2,6-дихлор-3-фторбензилокси)пиридин-2-иламина (9,04 г, 0,027 моль, 99%) в виде светлорозового твердого продукта. 1H-ЯМР (CDCl3, 300 МГц)1,8-1,85 (д, 3 Н), 4,9-5,2 (уш.с, 2 Н), 6,7-6,84 (кв, 1 Н), 7,0-7,1 (м, 1 Н), 7,27,3 (м, 1 Н), 7,6-7,7 (м, 1 Н). 4. Перемешиваемый раствор 3-(2,6-дихлор-3-фторбензилокси)пиридин-2-иламина (9,07 г, 0,03 моль) в ацетонитриле охлаждают до 0 С на ледяной бане. К этому раствору добавляют порциями Nбромсукцинимид (NBS) (5,33 г, 0,03 моль). Реакционную смесь перемешивают при 0 С в течение 15 мин. Реакционную смесь концентрируют досуха в вакууме. Полученное темное масло растворяют в EtOAc(500 мл) и очищают хроматографией на силикагеле. Затем растворители удаляют в вакууме с получением 5-бром-3-(2,6-дихлор-3-фторбензилокси)пиридин-2-иламина (5,8 г, 0,015 моль, 51%) в виде белого твердого продукта. 1 К раствору 3-[1-(2,6-дихлор-3-фторфенил)этокси]пиридин-2-иламина (10,0 г, 33,2 ммоль) в ацетонитриле (600 мл) и уксусной кислоте (120 мл) добавляют N-йодсукцинимид (11,2 г, 49,8 ммоль). Смесь перемешивают при комнатной температуре в течение 4 ч и реакцию гасят раствором Na2S2O5. После выпаривания остаток распределяют между этилацетатом и водой. Органический слой промывают 2N раствором NaOH, насыщенным раствором соли и сушат над Na2SO4. Неочищенный продукт очищают на колонке с силикагелем с получением 5-йод-3-[1-(2,6-дихлор-3-фторфенил)этокси]пиридин-2-иламина 1. 2,6-Дихлор-3-фторацетофенон (15 г, 0,012 моль) перемешивают в ТГФ (150 мл, 0,5 М) при 0 С на ледяной бане в течение 10 мин. Медленно добавляют алюмогидрид лития (от Aldrich, 2,75 г, 0,072 моль). Реакционную смесь перемешивают при температуре окружающей среды в течение 3 ч. Реакционную смесь охлаждают на ледяной бане и по каплям добавляют воду (3 мл) с последующим добавлением 15%NaOH (3 мл) (медленно). Смесь перемешивают при температуре окружающей среды в течение 30 мин. Добавляют 15% NaOH (9 мл), MgSO4 и смесь фильтруют для удаления твердых продуктов. Твердые продукты промывают ТГФ (50 мл) и фильтрат концентрируют с получением 1-(2,6-дихлор-3 фторфенил)этанола (14,8 г, выход 95%) в виде желтого масла. 1H-ЯМР (400 МГц, ДМСО-d6)1,74 (д, 3 Н), 6,40 (м, 1 Н), 6,52 (уш.с, 2 Н), 7,30 (м, 1 Н), 7,48 (м, 1 Н),7,56 (с, 1 Н); МС m/z 382 (М+1). Энантиомерно чистые исходные вещества.PLE представляет собой фермент, производимый Roche и продаваемый через Biocatalytics Inc. в виде неочищенного препарата эстеразы из печени свиньи, повсеместно известный как PLE-AS (покупают уBiocatalytics как ICR-123, продается в виде суспензии в сульфате аммония). Фермент классифицируется в регистре CAS как "гидролаза сложных эфиров карбоновых кислот, CAS 9016-18-6". Соответствующий номер в классификации ферментов представляет собой ЕС 3,1,1,1. Фермент, как известно, имеет широкую специфичность к субстрату, по отношению к гидролизу большого разнообразия сложных эфиров. Липазную активность определяют, используя способ на основе гидролиза этилбутирата в титраторе рН. 1LU (липазная единица) представляет собой количество фермента, которое высвобождает 1 мкмоль титруемой масляной кислоты в минуту при 22 С, рН 8,2. Препарат, о котором говорится здесь (PLE-AS, в виде суспензии), обычно доставляется в виде мутной коричнево-зеленой жидкости с заявленной активностью 45 LU/мг (содержание белка примерно 40 мг/мл).(1S)-1-(2,6-дихлор-3-фторфенил)этанол, показанный как соединение (S-1) на схемах ниже, получают сочетанием ферментативного гидролиза рацемического 1-(2,6-дихлор-3-фторфенил)этилацетата, этерификацией и химическим гидролизом с инверсией в соответствии со схемой В. Рацемический 1-(2,6 дихлор-3-фторфенил)этилацетат (соединение А 2) получают в соответствии со схемой А. Схема А 1-(2,6-Дихлор-3-фторфенил)этанол (А 1). Боргидрид натрия (90 мг, 2,4 ммоль) добавляют к раствору 2',6'-дихлор-3'-фторацетофенона (Aldrich, каталожный 52,294-5) (207 мг, 1 ммоль) в 2 мл безводного СН 3 ОН. Реакционную смесь перемешивают при комнатной температуре в течение 1 ч, затем выпаривают с получением бесцветного масляного остатка. Остаток очищают флэш-хроматографией (элюируя 010% EtOAc в гексане) с получением соединения А 1 в виде бесцветного масла (180 мг; 0,88 ммоль; выход 86,5%); МС (APCI) (М-Н)- 208; 1 Н-ЯМР (400 МГц, хлороформ-D)м.д. 1,64 (д, J=6,82 Гц, 3 Н), 3,02 (д, J=9,85 Гц, 1 Н), 6,97-7,07 (м,1 Н), 7,19-7,33 (м, 1 Н). 1-(2,6-Дихлор-3-фторфенил)этилацетат (А 2). Уксусный ангидрид (1,42 мл, 15 ммоль) и пиридин (1,7 мл, 21 ммоль) добавляют последовательно к раствору соединения А 1 (2,2 г, 10,5 ммоль) в 20 мл CH2Cl2. Реакционную смесь перемешивают при ком- 23013678 натной температуре в течение 12 ч, а затем выпаривают с получением желтоватого масляного остатка. Остаток очищают флэш-хроматографией (элюируя 79% EtOAc в гексане) с получением соединения А 2 в виде бесцветного масла (2,26 г; 9,0 ммоль; выход 85,6%); 1 Н-ЯМР (400 МГц, хлороформ-D)м.д. 1,88 (д, J=6,82 Гц, 3 Н), 2,31 (с, 3 Н), 6,62 (кв, J=6,82 Гц, 1 Н),7,25 (т, J=8,46 Гц, 1 Н), 7,49 (дд, J=8,84, 5,05 Гц, 1 Н). Схема В В 50 мл колбу с кожухом, снабженную рН электродом, верхней мешалкой и линией добавления основания (1 М NaOH), добавляют 1,2 мл 100 мМ калийфосфатного буфера, рН 7,0, и 0,13 мл суспензии PLEAS. Затем по каплям добавляют соединение А 2 (0,13 г, 0,5 ммоль, 1,00 зкв.) и полученную смесь перемешивают при комнатной температуре в течение 20 ч, поддерживая рН реакции постоянным при 7,0, с использованием 1 М NaOH. Как преобразование, так и ее (энантиомерный избыток) реакции отслеживают по ОФ-ВЭЖХ, и ее прекращают после того, как превращено 50% исходных веществ (приблизительно 17 ч при этих условиях). Затем смесь экстрагируют три раза 10 мл этилацетата для извлечения как сложного эфира, так и спирта, в виде смеси R-1 и S-2. Метансульфонилхлорид (0,06 мл, 0,6 ммоль) добавляют к раствору смеси R-1 и S-2 (0,48 ммоль) в 4 мл пиридина в атмосфере азота. Реакционную смесь перемешивают при комнатной температуре в течение 3 ч, затем выпаривают с получением масла. К смеси добавляют воду (20 мл), а затем добавляютEtOAc (20 мл 2) для экстрагирования водного раствора. Органические слои объединяют, сушат, фильтруют и выпаривают с получением смеси R-3 и S-2. Эту смесь используют на следующей стадии реакции без дополнительной очистки. 1 Н-ЯМР (400 МГц, хлороформ-D)м.д. 1,66 (д, J=7,1 Гц, 3 Н), 1,84 (д, J=7,1 Гц, 3 Н), 2,09 (с, 3 Н),2,92 (с, 3 Н), 6,39 (кв, J=7,0 Гц, 1 Н), 6,46 (кв, J=6,8 Гц, 1 Н), 6,98-7,07 (м, 1 Н), 7,07-7,17 (м, 1 Н), 7,23-7,30(м, 1 Н), 7,34 (дд, J=8,8, 4,80 Гц, 1 Н). Ацетат калия (0,027 г, 0,26 ммоль) добавляют к смеси R-3 и S-2 (0,48 ммоль) в 4 мл ДМФА в атмосфере азота. Реакционную смесь нагревают до 100 С в течение 12 ч. К реакционной смеси добавляют воду (20 мл) и добавляют EtOAc (20 мл 2) для экстрагирования водного раствора. Объединенный органический слой сушат, фильтруют и выпаривают с получением масла S-2 (72 мг, выход 61% в две стадии),ее хиральности: 97,6%. 1 Н-ЯМР (400 МГц, хлороформ-D)м.д. 1,66 (д, J=7,1 Гц, 3 Н), 2,09 (с, 3 Н), 6,39 (кв, J=6,8 Гц, 1 Н),7,02 (т, J=8,5 Гц, 1 Н), 7,22-7,30 (м, 1 Н). Метоксид натрия (19 ммоль; 0,5 М в метаноле) медленно добавляют к соединению S-2 (4,64 г, 18,8 ммоль) в атмосфере азота при 0 С. Полученную смесь перемешивают при комнатной температуре в течение 4 ч. Растворитель выпаривают и добавляют H2O (100 мл). Охлажденную реакционную смесь нейтрализуют буферным раствором ацетата натрия-уксусной кислоты до рН 7. Этилацетат (100 мл 2) добавляют для экстрагирования водного раствора. Объединенные органические слои сушат над Na2SO4,фильтруют и выпаривают с получением белого твердого продукта (4,36 г, выход 94,9%); 3-Гидрокси-2-нитропиридин (175 мг, 1,21 ммоль) и трифенилфосфин (440 мг, 1,65 ммоль) добавляют последовательно к перемешиваемому раствору (1S)-1-(2,6-дихлор-3-фторфенил)этанола (229,8 мг, 1,1 ммоль) в ТГФ (10 мл) в атмосфере азота. Реакционную смесь поддерживают при комнатной температуре в течение 1 ч, а затем добавляют диизопропил азо-дикарбоксилат (0,34 мл, 1,65 ммоль) при 0 С. Смесь перемешивают в течение дополнительных 12 ч. Реакционную смесь выпаривают в вакууме с получением масла. Остаток очищают флэш-хроматографией (элюируя 2025% EtOAc в гексане) с получением указанного в заголовке соединения в виде белого твердого продукта (321,5 мг; 0,97 ммоль; выход 88,3%); МС (APCI) (М+Н)+ 331; SFC-MC: 99,5% ее. 1 Железо (365 мг) добавляют к перемешиваемому раствору 3-[(1R)-1-(2,6-дихлор-3-фторфенил)этокси]-2-нитропиридина (321 мг, 0,97 ммоль) в смеси EtOH (2 мл) и 2 М HCl (0,2 мл) при 0 С. Полученный раствор нагревают до 85 С в течение 2 ч. К охлажденной реакционной смеси добавляют целит (0,5 г). Эту смесь фильтруют через слой целита и выпаривают с получением указанного в заголовке соединения в виде темного масла. МС (APCI) (М+Н)+ 301. 5-Бром-3-[1(R)-(2,6-дихлор-3-фторфенил)этокси]пиридин-2-иламин. Энантиомерно чистый изомер R получают, как описано выше для рацемата, но с использованием энантиомерно чистых исходных веществ, описанных выше. 1 Периодную кислоту (60 мг, 0,24 ммоль), йод (130 мг, 0,5 ммоль) и серную кислоту (0,03 мл) добавляют последовательно к перемешиваемому раствору 3-[(1R)-1-(2,6-дихлор-3-фторфенил)этокси]пиридин-2-амина (0,97 ммоль) в смеси уксусной кислоты (3 мл) и Н 2 О (0,5 мл). Полученный раствор нагревают до 80 С в течение 5 ч. Охлажденную реакционную смесь гасят Na2SO3 (80 мг) и подщелачивают насыщенным Na2SO3 (2100 мл) до рН 7. Добавляют CH2Cl2 (250 мл) для экстрагирования водного раствора. Объединенные органические слои сушат над Na2SO4, затем фильтруют и концентрируют в вакуу- 25013678 ме. Остаток очищают флэш-хроматографией (элюируя 3540% EtOAc в гексане) с получением указанного в заголовке соединения в виде желтого масла (254 мг; 0,6 ммоль; выход 61,6%); МС (APCI) (М+Н)+ 426. 1 Н-ЯМР (400 МГц, хлороформ-D)м.д. 1,81 (д, J=6,8 Гц, 3 Н), 4,86 (с, 2 Н), 5,98 (кв, J=6,57 Гц, 1 Н),6,96 (д, J=1,5 Гц, 1 Н), 7,08 (дд, J=9,0, 8,0 Гц, 1 Н), 7,31 (дд, J=8,8, 4,8 Гц, 1 Н), 7,78 (д, J=1,8 Гц, 1 Н). 5-Бром-3-[(R)-1-(2,6-дихлор-3-фторфенил)этокси]пиразин-2-иламин. Указанное в заголовке соединение получают в соответствии с методикой 2 из (1S)-1-(2,6-дихлор-3 фторфенил)этанола. 1 Н-ЯМР (400 МГц, ДМСО-d6)7,53 (с, 1 Н), 7,48 (м, 1 Н), 7,39 (т, 1 Н), 6,48 (с, 2 Н), 6,41 (кв, 1 Н), 1,74 Общая методика 1 для синтеза 5-бром-3-(замещенного-бензилокси)пиридин-2-иламина (5). 1. Получение 3-(замещенного-бензилокси)-2-нитропиридина (3). К перемешиваемому раствору Cs2CO3 (1,0 мол. экв. в ДМФА (0,2 М), в атмосфере N2, содержащему 3-гидрокси-4-нитропиридин (Aldrich, 1,0 мол. экв.), добавляют замещенный бензилбромид (1,0 мол. экв.). Смесь перемешивают в течение 6 ч при температуре окружающей среды. Реакционную смесь затем разбавляют EtOAc и распределяют при помощи Н 2 О. Водный слой дважды экстрагируют EtOAc. Затем органические слои объединяют, промывают Н 2 О и насыщенным раствором соли, сушат над Na2SO4,фильтруют и концентрируют досуха в вакууме с получением 3-(замещенного-бензилокси)-2 нитропиридина (3) в виде твердого продукта. 2. Получение 3-(замещенного-бензилокси)пиридин-2-иламина (4). В перемешиваемой смеси АсОН и EtOH (1,3:1) суспендируют 3-(замещенный-бензилокси)-2 нитропиридин (1,0 мол. экв., 1 М) и железную стружку (1,0 мол. экв.). Реакционную смесь медленно нагревают с обратным холодильником и дают перемешиваться в течение 1 ч. Реакционную смесь охлаждают до комнатной температуры, затем фильтруют через тонкий слой целита. Полученный фильтрат нейтрализуют концентрированным NH4OH, а затем три раза экстрагируют EtOAc. Объединенные органические экстракты промывают насыщенным NaHCO3, Н 2 О и насыщенным раствором соли, сушат надNa2SO4, фильтруют и концентрируют досуха в вакууме с получением 3-(замещенногобензилокси)пиридин-2-иламина (4) в виде твердого продукта. 3. Получение 5-бром-3-(замещенного-бензилокси)пиридин-2-иламина (5). Перемешиваемый раствор 3-(замещенного-бензилокси)пиридин-2-иламина (4) (1,0 мол. экв.) в ацетонитриле охлаждают до 0 С на ледяной бане. К этому раствору добавляют порциями Nбромсукцинимид (Aldrich, 1,0 мол. экв.). Реакционную смесь перемешивают при 0 С в течение 15 мин. Реакционную смесь концентрируют досуха в вакууме. Полученное темное масло растворяют в EtOAc и распределяют при помощи Н 2 О. Органический слой затем дважды промывают насыщенным NaHCO3 и один раз насыщенным раствором соли. К органическому слою добавляют активированный уголь и нагревают с обратным холодильником. Затем раствор охлаждают до комнатной температуры и фильтруют через тонкий слой целита. Затем органический слой концентрируют досуха в вакууме до одной трети исходного объема. Затем твердые продукты отфильтровывают с получением 5-бром-3-(замещенногобензилокси)пиридин-2-иламина (5) в виде твердого продукта. Общая схема II для синтеза 5-арил-3-(замещенного-бензилокси)пиразин-2-иламина К охлажденному на льду раствору замещенного бензилового спирта (1,0 мол. экв.) и безводного тетрагидрофурана (0,14 М) добавляют гидрид натрия (1,0 мол. экв.) (медленно) в атмосфере азота. После перемешивания в течение 30 мин добавляют 3,5-дибромпиразин-2-иламин (1,0 мол. экв.) в тетрагидрофуране (0,56 М) через капельную воронку при большой скорости капельного добавления. После завершения добавления ледяную баню удаляют и реакционную смесь кипятят с обратным холодильником в атмосфере азота и отслеживают по обращенно-фазовой ВЭЖХ. Через 18 ч ВЭЖХ показывает, что основная часть исходного 3,5-дибромпиразин-2-иламина прореагировала, и реакционной смеси дают охладиться до комнатной температуры. Реакционную смесь концентрируют, разбавляют этилацетатом и промывают насыщенным раствором соли. Органический слой сушат над безводным сульфатом магния и концентрируют в вакууме. Неочищенный продукт очищают с использованием силикагеля, элюируя смесью этилацетат/дихлорметан 1:1, с получением 5-бром-3-(замещенного-бензилокси)пиразин-2-иламина в виде белого твердого продукта с выходом 60-90%. Общая методика 3 для синтеза 5-арил-3-(замещенного-бензилокси)пиридин-2-иламина и 5-арил-3(замещенного-бензилокси)пиразин-2-иламина. Смесь 5-бром-3-(замещенного-бензилокси)пиридин-2-иламина или 5-бром-3-(замещенногобензилокси)пиразин-2-иламина (1 мол. экв.), арилбороновой кислоты или ее сложного эфира (1,2 мол. экв.), хлорида бис(трифенилфосфин)палладия II (0,03 мол. экв.) и карбоната натрия (3,0 мол. экв.) в диметиловом эфире этиленгликоля и воде (10:0,5, 0,03 М) дегазируют и три раза продувают азотом, а затем кипятят с обратным холодильником в атмосфере азота в течение ночи. Реакционную смесь охлаждают до температуры окружающей среды и разбавляют этилацетатом. Смесь промывают водой, насыщенным раствором соли, сушат над Na2SO4 и очищают на колонке с силикагелем, получая 5-арил-3-(замещенныйбензилокси)пиридин-2-иламин или 5-арил-3-(замещенный-бензилокси)пиразин-2-иламин. Общая методика 4 для реакции амидирования 6-амино-5-(замещенного-бензилокси)пиридин-3 ил]бензойной кислоты. К раствору 6-амино-5-(замещенной-бензилокси)пиридин-3-ил]бензойной кислоты (1 мол. экв.),гидрата 1-гидроксибензотриазола (НОВТ, 1,2 мол. экв.) и гидрохлорида 1-(3-диметиламинопропил)-3 этилкарбодиимида (EDC, 1,2 мол. экв.) в ДМФА (0,2 М) добавляют амин (1,2 мол. экв.). Реакционный раствор перемешивают при комнатной температуре в течение ночи, затем разбавляют EtOAc и распределяют при помощи Н 2 О. Органические слои отделяют и водный слой экстрагируют EtOAc. Органические слои объединяют, промывают насыщенным NaHCO3 и концентрируют досуха в вакууме. Продукт очищают, используя колоночную хроматографию (силикагель, от 99:1 до 95:5 CH2Cl2/MeOH). Фракции, содержащие продукт, концентрируют в вакууме с получением амидного продукта. Общая методика 5 для получения 3-(замещенного-бензилокси)-5-(3-диалкиламинометил-1 Н-индол 5-ил)пиридин-2-иламина. К раствору бензотриазола (1,0 мол. экв.) в дихлорметане (0,2 М) добавляют амин (1,0 мол. экв.). Реакционную смесь перемешивают в течение 5 мин при комнатной температуре, после чего добавляют формальдегид (37 мас.%, 1,0 мол. экв.) и реакционную смесь герметизируют и перемешивают при комнатной температуре в течение 3 ч. После того как ТСХ (10% этилацетат:дихлорметан) покажет, что исходный бензотриазол прореагировал, реакционную смесь сушат безводным сульфатом магния (10 г),фильтруют и концентрируют в вакууме. Неочищенный продукт очищают на колонке с силикагелем,элюируя смесью этилацетат:дихлорметан 1:1, с получением желаемого продукта в виде белого твердого вещества. К раствору промежуточного соединения аминометилбензотриазола (1,0 мол. экв.) в дихлорметане(0,43 М) добавляют хлорид алюминия (2,0 мол. экв.), а затем 3-(2,6-дихлорбензилокси)-5-(1 Н-индол-5 ил)пиридин-2-иламин (1,1 мол. экв.). Реакционную смесь герметизируют и нагревают при перемешивании при 40 С в течение 3-4 ч. Прекращают нагрев реакционной смеси, затем дают ей охладиться до комнатной температуры. Реакционную смесь разбавляют гидроксидом натрия (0,2 М) и хлороформом, повторно герметизируют в колбе и энергично перемешивают при комнатной температуре для растворения остатка. Хлороформ удаляют из водного слоя, сушат над безводным сульфатом натрия и концентрируют в вакууме. Неочищенный продукт очищают на колонке с силикагелем, сначала элюируя смесью этилацетат:дихлорметан 1:1 для элюирования менее полярных примесей, а затем элюируя продукт смесью хлороформ:метанолгидроксид аммония 90:9:1. (Выходы 10-67%). Общая методика 6 для синтеза 3-(замещенного-бензилокси)-5-фенилпиридин-2-иламина с использованием 3-(3-метоксибензилокси)-5-фенилпиридин-2-иламина.(30 мл) добавляют Pd(OH)2 (2,5 г, 2,37 ммоль). Смесь дегазируют и продувают водородом три раза, а затем перемешивают в атмосфере водорода из баллона в течение 5 ч. Реакционную смесь фильтруют через тонкий слой целита, промывают метанолом и конденсируют. После сушки в высоком вакууме получают 2-амино-5-фенилпиридин-3-ол (2,04 г, выход 93%). МС m/z 187 [M+1]. К раствору 2-амино-5-фенилпиридин-3-ола (2,04 г, 10,95 ммоль) в ТГФ (безводный, 30 мл) медленно добавляют NaH (1,31 г, 32,85 ммоль). Смесь перемешивают в атмосфере азота в течение 20 мин, а затем добавляют тритилхлорид (3,66 г, 13,14 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи в атмосфере азота. Растворитель выпаривают и остаток растворяют в дихлорметане, промывают водой и сушат над Na2SO4. После фильтрования и конденсирования сырой продукт очищают на колонке с силикагелем, элюируя EtOAc-гексаном (1:10), с получением 5-фенил-2(тритиламино)пиридин-3-ола (1,09 г, выход 23%). МС m/z 427 [М+1]. К раствору 5-фенил-2-(тритиламино)пиридин-3-ола (100 мг, 0,24 ммоль) в ТГФ (3 мл) добавляютCs2CO3 (79 мг, 0,24 ммоль). Смесь перемешивают при комнатной температуре в течение 20 мин, а затем добавляют 3-метоксибензилбромид (0,037 мл, 0,26 ммоль). Реакционную смесь перемешивают при ком- 28013678 натной температуре в течение ночи, разбавляют дихлорметаном (5 мл) и фильтруют для удаления соли. Растворители выпаривают и остаток растворяют в 10% трифторуксусной кислоте в дихлорметане (2 мл). Реакционную смесь перемешивают в течение 2 ч и выпаривают. Остаток растворяют в дихлорметане,промывают насыщенным NaHCO3 и сушат над Na2SO3. После фильтрования и концентрирования сырой продукт очищают на колонке с силикагелем, элюируя смесью метанол-дихлорметан (градиент от 3 до 15%), с получением 3-(3-метоксибензилокси)-5-фенилпиридин-2-иламина в виде белого твердого продукта (43,5 мг, выход 60%). Общая методика 7 для синтеза 3-(замещенного-бензилокси)-5-арилпиридин-2-иламина с использованием 5-[4-(2-морфолин-4-илэтокси)фенил]-3-(3-нитробензилокси)пиридин-2-иламина. К раствору 2-амино-5-[4-(2-морфолин-4-илэтокси)фенил]пиридин-3-ола (полученного в соответствии с методиками для 2-амино-5-фенилпиридин-3-ола в примерах 1-88 заявки на патент США, серийный 10/786610 (PCT/US 2004/005495), (45,5 мг, 0,14 ммоль) в ДМФА (3 мл) при 0 С добавляют NaH (60% в масле) (5,6 мг, 0,14 ммоль) и смесь перемешивают при 0 С в течение 20 мин. Затем добавляют 1 бромметил-3-нитробензол и смесь перемешивают при 0 С в течение 1 ч и при комнатной температуре в течение 2 ч. Добавляют холодный 1N водный раствор HCl (0,1 мл) и растворитель удаляют при пониженном давлении. Остаток очищают хроматографией на силикагеле (CH2Cl2:MeOH:NH4OH=100:3:0,3) с получением 5-[4-(2-морфолин-4-илэтокси)фенил]-3-(3-нитробензилокси)пиридин-2-иламина в виде желтого твердого продукта (44 мг, 68%). Общая методика 8 для синтеза 4-[6-амино-5-(замещенного-бензилокси)пиридин-3-ил]фенил[(2R)-2-пирролидин-1-илметилпирролидин-1-ил]метанона с использованием 4-[6-амино-5-(4-фтор-2 трифторметилбензилокси)пиридин-3-ил]фенил-[(2R)-2-пирролидин-1-илметилпирролидин-1 ил]метанона.[4-(6-Амино-5-бензилоксипиридин-3-ил)фенил]-[(2R)-2-пирролидин-1-илметилпирролидин-1 ил]метанон получают, следуя методике 4, с использованием 6-амино-5-бензилоксиникотиновой кислоты и (2R)-пирролидин-1-илметилпирролидина (полученного в примере 1-39 заявки на патент США, серийный 10/786610 (PCT/US 2004/005495. МС m/z 457 (М+1). 3. К раствору [4-(6-амино-5-бензилоксипиридин-3-ил)фенил]-[(2R)-пирролидин-1-илметилпирролидин-1-ил]метанона (2,28 г, 5,00 ммоль) в метаноле (25 мл) добавляют 10% Pd/C (100 мг). Смесь дегазируют и продувают водородом за три раза, а затем перемешивают в атмосфере водорода из баллона в течение ночи. Реакционную смесь фильтруют через тонкий слой целита, промывают метанолом и конденсируют. После сушки в высоком вакууме получают [4-(6-амино-5-гидроксипиридин-3-ил)фенил][(2R)-2-пирролидин-1-илметилпирролидин-1-ил]метанон (1,74 г, выход 95%). 1 Н-ЯМР (400 МГц, ДМСО-d6)7,79 (с, 1 Н), 7,54 (м, 3 Н), 7,46 (м, 2 Н), 7,14 (с, 1 Н), 5,68 (с, 2 Н), 4,22- 29013678 4. К перемешиваемому раствору [4-(6-амино-5-гидроксипиридин-3-ил)фенил]-[(2R)-2-пирролидин 1-илметилпирролидин-1-ил]метанона (100 мг, 0,27 ммоль) в безводном ДМФА (15 мл), выдерживаемом в атмосфере N2 при 0 С, добавляют гидрид натрия (60% дисперсия в минеральном масле, 11 мг, 0,49 ммоль). Смеси дают перемешиваться при 0 С в течение 30 мин. Добавляют 1-(бромметил)-4-фтор-2(трифторметил)бензол (0,046 мл, 0,27 ммоль). Смесь перемешивают при комнатной температуре в течение 2 ч. Реакционную смесь разбавляют EtOAc и распределяют при помощи H2O. Водный слой экстрагируют EtOAc (225 мл). Органические слои объединяют, промывают H2O (115 мл), насыщенным раствором соли (115 мл), сушат над MgSO4, фильтруют, концентрируют и очищают на колонке с силикагелем,получая 4-[6-амино-5-(4-фтор-2-трифторметилбензилокси)пиридин-3-ил]фенил-[(2R)-2-пирролидин-1 илметилпирролидин-1-ил]метанон в виде серо-белых кристаллов. Общая методика 9 для синтеза [6-амино-5-(замещенного-бензилокси)пиридин-3-ил]фениламида 2 диалкиламиноэтансульфоновой кислоты с использованием 4-[6-амино-5-(2-хлор-3,6-дифторбензилокси)пиридин-3-ил]фениламида 2-диэтиламиноэтансульфоновой кислоты. 1. К раствору 4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фениламина (5 г, 22,8 ммоль) в дихлорметане (120 мл) добавляют N-метилморфолин (7,5 мл, 68,4 ммоль). Эту смесь охлаждают до 0 С в атмосфере азота. Затем добавляют по каплям 2-хлорэтансульфонилхлорид (2,5 мл, 23,9 ммоль) в дихлорметане (60 мл) при перемешивании. После завершения добавления перемешивают при 0 С в течение 1 ч,а затем при комнатной температуре, в то же время отслеживая по ТСХ (1:1, этилацетат:гексан) и окрашивая нингидрином. После 4 ч перемешивания некоторое количество исходного сложного эфира бороновой кислоты по-прежнему остается, и дополнительные 0,2 экв. (0,5 мл) 2-хлорэтансульфонилхлорида в дихлорметане (25 мл) добавляют по каплям при комнатной температуре. Через 1 ч сложный эфир бороновой кислоты расходуется, как показывает ТСХ, и общий объем реакционной смеси уменьшают до половины с помощью роторного испарителя. Содержимое разбавляют этилацетатом (200 мл), промывают 50% насыщенным раствором соли (2100 мл), сушат над безводным сульфатом натрия и концентрируют в вакууме. Сырой продукт очищают с использованием силикагеля (120 г) и элюируя 10% этилацетатом,дихлорметаном, с получением [4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]амида этенсульфоновой кислоты в виде белого твердого вещества (6,2 г, 20,2 ммоль, выход 89%). 1 Н-ЯМР (CDCl3, 300 МГц)7,76 (д, J=8,4, 2H), 7,12 (д, J=8,45, 2 Н), 6,65 (с, 1 Н), 6,55 (дд, J=9,77, 6,7,1 Н), 6,31 (д, J=16,54, 1H), 5,96 (д, J=9,8, 1H), 1,33 (с, 12 Н). 2. К раствору [4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]амида этенсульфоновой кислоты (0,500 г, 1,6 ммоль) в метаноле (5 мл) добавляют диэтиламин (0,707 г, 4,0 ммоль) в метаноле (5 мл) и реакционную смесь перемешивают при комнатной температуре и отслеживают по ТСХ (1:1 этилацетат:гексан). Через 2 ч реакционную смесь концентрируют в вакууме и остаток распределяют между этилацетатом (50 мл) и водой (50 мл). Затем этилацетат промывают 50% насыщенным раствором соли (150 мл), сушат над безводным сульфатом натрия, фильтруют и концентрируют в вакууме. Сырой продукт очищают с использованием предварительно набитой 10 г силикагеля колонки, элюируя смесью этилацетат:дихлорметан 1:1, с получением [4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]амида 2 диэтиламиноэтансульфоновой кислоты в виде белого твердого вещества (0,346 г, 0,90 ммоль, 56%). 1 Н-ЯМР (CDCl3, 300 МГц)7,78 (д, J=6,65, 2H), 7,15 (д, J=6,66, 2 Н), 3,20 (м, 2 Н), 3,0 (м, 2 Н), 2,55(кв, J=7,15, 7,16 4 Н), 1,34 (с, 12 Н), 1,05 (т, J=7,19, 6H). 3. 4-[6-Амино-5-(2-хлор-3,6-дифторбензилокси)пиридин-3-ил]фениламид 2-диэтиламиноэтансульфоновой кислоты получают, следуя общей методике 3 сочетания Судзуки, из 5-бром-3-(2-хлор-3,6 дифторбензилокси)пиридин-2-иламина и [4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]амида 2-диэтиламиноэтансульфоновой кислоты, полученного в части 2, в виде белого твердого вещества с выходом 60%. Общая методика 10. 1. 4-(4,4,5,5-Тетраметил-1,3,2-диоксаборалан-2-ил)анилин (3 г, 0,013 моль) растворяют в дихлорметане (350 мл), к которому добавляют пиридин (1,02 г, 0,013 моль) и 4-нитрофенилхлорформиат. Реакционную смесь перемешивают в течение 13 ч, пока анализ ТСХ не покажет расходование всех исходных
МПК / Метки
МПК: C07D 401/14, C07D 401/12, C07D 403/04, C07D 403/14, C07D 241/20
Метки: протеинкиназы, энантиомерно, ингибиторов, качестве, аминогетероарильные, чистые, соединения
Код ссылки
<a href="https://eas.patents.su/30-13678-enantiomerno-chistye-aminogeteroarilnye-soedineniya-v-kachestve-ingibitorov-proteinkinazy.html" rel="bookmark" title="База патентов Евразийского Союза">Энантиомерно чистые аминогетероарильные соединения в качестве ингибиторов протеинкиназы</a>
Предыдущий патент: Человеческие моноклональные антитела против cd25 и их применение
Следующий патент: Способ получения ферментированного белкового продукта, ферментированный белковый продукт и его применения
Случайный патент: Антиперспирантные композиции и продукты