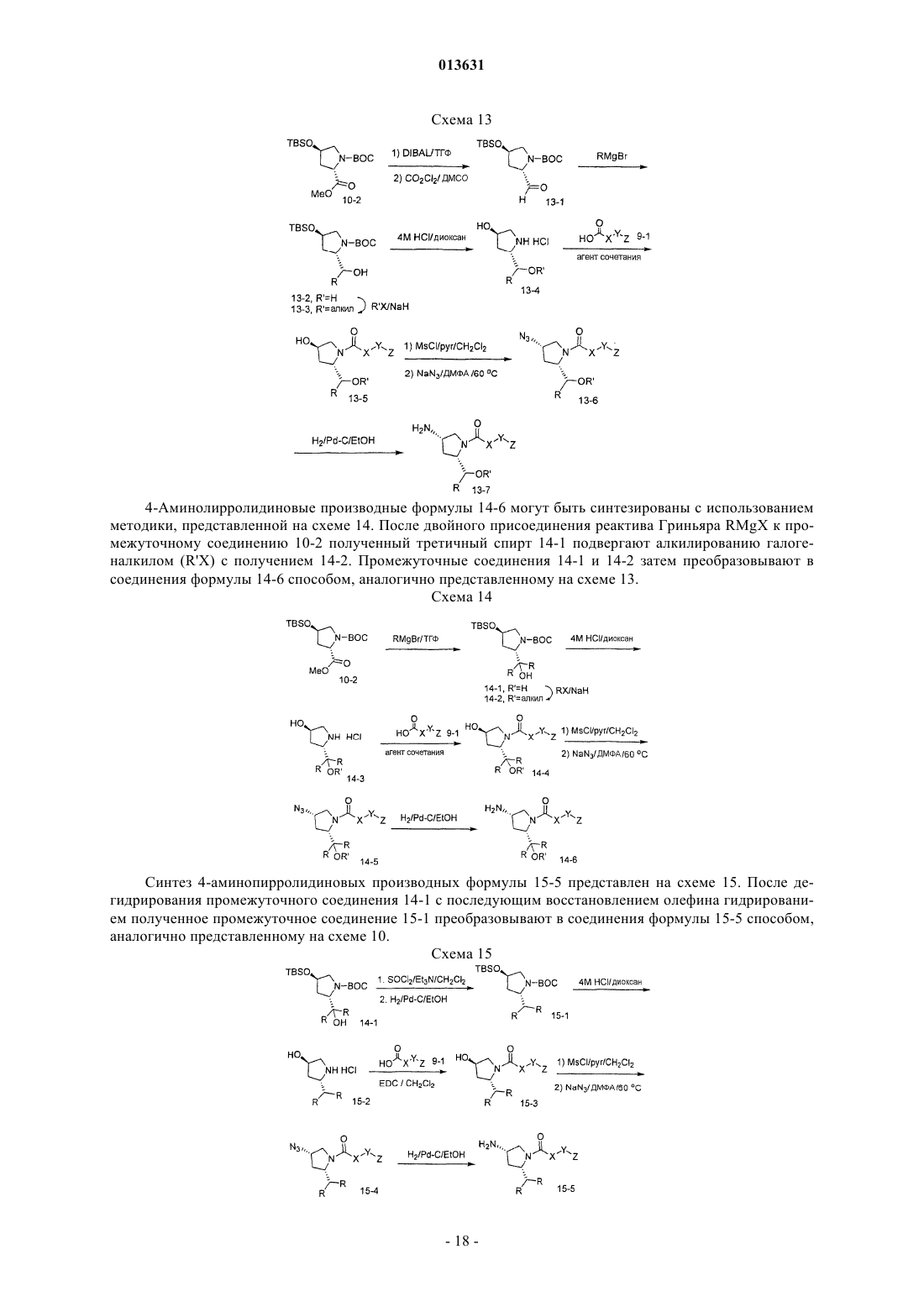
Производные 3-циклоалкиламинопирролидина в качестве модуляторов рецепторов хемокинов
Номер патента: 13631
Опубликовано: 30.06.2010
Авторы: Чжэн Чаншэн, Чжан Инсинь, Ван Аньлай, Робинсон Дариус Дж., Сюэ Чу-Бяо, Хан Ами Ци, Меткаф Брайан
Формула / Реферат
1. Соединение формулы I
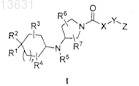
или его фармацевтически приемлемая соль, где
-X-Y- выбран из группы, состоящей из -CH2-NH-CO-, -C1-6алкил-O-С1-6алкила-, гетероцикла, содержащего 4-6 атомов в кольце, один из которых представляет гетероатом, такой как N, либо гетероарила, содержащего 5 атомов в кольце, 2 из которых представляют гетероатом, выбранный из N и О;
Z выбран из фенила и гетероарила, содержащего 6 атомов в кольце, 1 или 2 из которых представляют гетероатом, такой как N, возможно замещенного R10, где R10 - галогеналкил;
R1 выбран из фенила и гетероарила, содержащего 5-6 атомов в кольце и содержащего N в качестве гетероатома или два гетероатома, один из которых N, а другой выбран из N или S, возможно замещенного R1a, где R1a выбран из группы, состоящей из галогена, C1-6алкила, C1-6алкокси, С1-6алкоксиС1-6алкила, гидроксиC1-6алкила; аминоC1-6алкила, моно- или дизамещенного C1-6алкилом; моно- или дизамещенного C1-6 алкилом аминокарбонила; гетероалкилилкарбонила, содержащего 5-6 атомов в кольце, 1 или 2 из которых представляют гетероатом, выбранный из N и О;
либо R1представляет собой R1b-фенил или R1b-гетероарил, содержащий 5-6 атомов в кольце, 1 или 2 из которых представляют гетероатом, такой как N, О или S, где R1b выбран из группы, состоящей из Н, гидроксиC1-6алкила, карбоксамида;
R2 представляет собой ОН;
R3 и R4представляют собой Н;
R5 представляет собой Н или C1-6алкил;
R6 и R7выбраны из группы, состоящей из Н, С1-6алкила (где алкил может быть необязательно прерван О) или гидроксиС1-6алкила.
2. Соединение по п.1, где -X-Y- представляет собой гетероарил.
3. Соединение по п.1, где -X-Y- представляет собой гетероцикл.
4. Соединение по п.1, где -X-Y- представляет собой гетероарил, содержащий 5 атомов в кольце, 2 из которых представляют гетероатом, выбранный из N и О.
5. Соединение по п.1, где -X-Y- представляет собой -C1-6алкил-О-С1-6алкил-.
6. Соединение по п.1, где -X-Y- представляет собой -CH2-NH-CO-.
7. Соединение по п.1, где -X-Y- представляет собой азетидин.
8. Соединение по п.1, где-X-Y- представляет собой пирролидин или пиперидин.
9. Соединение по п.1, где -X-Y- представляет собой имидазол или 4,5-дигидроизоксазол.
10. Соединение по п.1, где -X-Y- представляет собой -СН2-O-CH2-.
11. Соединение по п.1, где Z представляет собой фенил или гетероарил, каждый замещенный R10.
12. Соединение по п.1, где Z представляет собой 6-членный гетероарил, замещенный R10.
13. Соединение по п.1, где Z представляет собой фенил, пиридил или пиримидинил, каждый замещенный R10.
14. Соединение по п.1, где Z представляет собой фенил, пиридил или пиримидинил, каждый замещенный тригалогеналкилом.
15. Соединение по п.1, где Z представляет собой
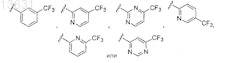
16. Соединение по п.1, где Z представляет собой
![]()
17. Соединение по п.1, где R1 представляет собой фенил или гетероарил, каждый замещенный 0-3 R1a.
18. Соединение по п.1, где R1 представляет собой фенил, пиридил, пиримидинил, пиридазинил или тиазолил, каждый замещенный 0-3 R1a.
19. Соединение по п.1, где R1 представляет собой фенил или гетероарил, каждый замещенный 0-3 R1a:
галогена, C1-6алкила, С1-6алкокси, С1-6алкоксиС1-6алкила, гидроксиC1-6алкила, аминоС1-6алкила, моно- или дизамещенного C1-6алкилом; моно- или дизамещенного C1-6алкилом аминокарбонила; гетероалкилилкарбонила, содержащего 5-6 атомов в кольце, 1 или 2 из которых представляют гетероатом, выбранный из N и О.
20. Соединение по п.1, где R1 представляет собой фенил или гетероарил, каждый замещенный 0-1 R1b-фенилом или R1b-гетероарилом.
21. Соединение по п.1, где R1 представляет собой фенил или гетероарил, каждый замещенный фенилом, пиридилом, пиримидинилом, оксазолилом, тиазолилом или имидазолилом.
22. Соединение по п.1, где R1 представляет собой гетероарил, замещенный фенилом, пиридилом, пиримидинилом, оксазолилом, тиазолилом или имидазолилом.
23. Соединение по п.1, где R1 представляет собой фенил или гетероарил, каждый замещенный 0-1 R1b-фенилом.
24. Соединение по п.1, где R1 представляет собой фенил или гетероарил, каждый замещенный 0-1 R1b-гетероарилом.
25. Соединение по п.1, где R5 представляет собой Н.
26. Соединение по п.1, где R5 представляет собой С1-6алкил.
27. Соединение по п.1, где R6 и R7выбраны из группы, состоящей из Н, C1-6алкила, где алкил может быть необязательно прерван О, или гидроксиC1-6алкила.
28. Соединение по п.1, где один из R6 и R7представляет собой Н и другой представляет собой Н, C1-6алкил, гидроксиС1-6алкил или C1-6алкоксиалкил.
29. Соединение по п.1, где R6 и R7оба Н.
30. Соединение по п.1, где -X-Y- представляет собой -СН2-NH-CO-,
Z представляет собой фенил,
R10 представляет собой CF3,
R1 представляет собой пиридил,
R1a представляет собой пиримидинил,
R5 представляет собой Н,
R6 представляет собой Н,
R7 представляет собой гидроксиС1-6алкил.
31. Соединение по п.1, где -X-Y- представляет собой -СН2-NH-CO-,
Z представляет собой фенил,
R10 представляет собой CF3,
R1 представляет собой пиридил,
R1a представляет собой пиримидинил,
R5 представляет собой Н,
R6 представляет собой Н,
R7 представляет собой С1-6алкоксиС1-6алкил.
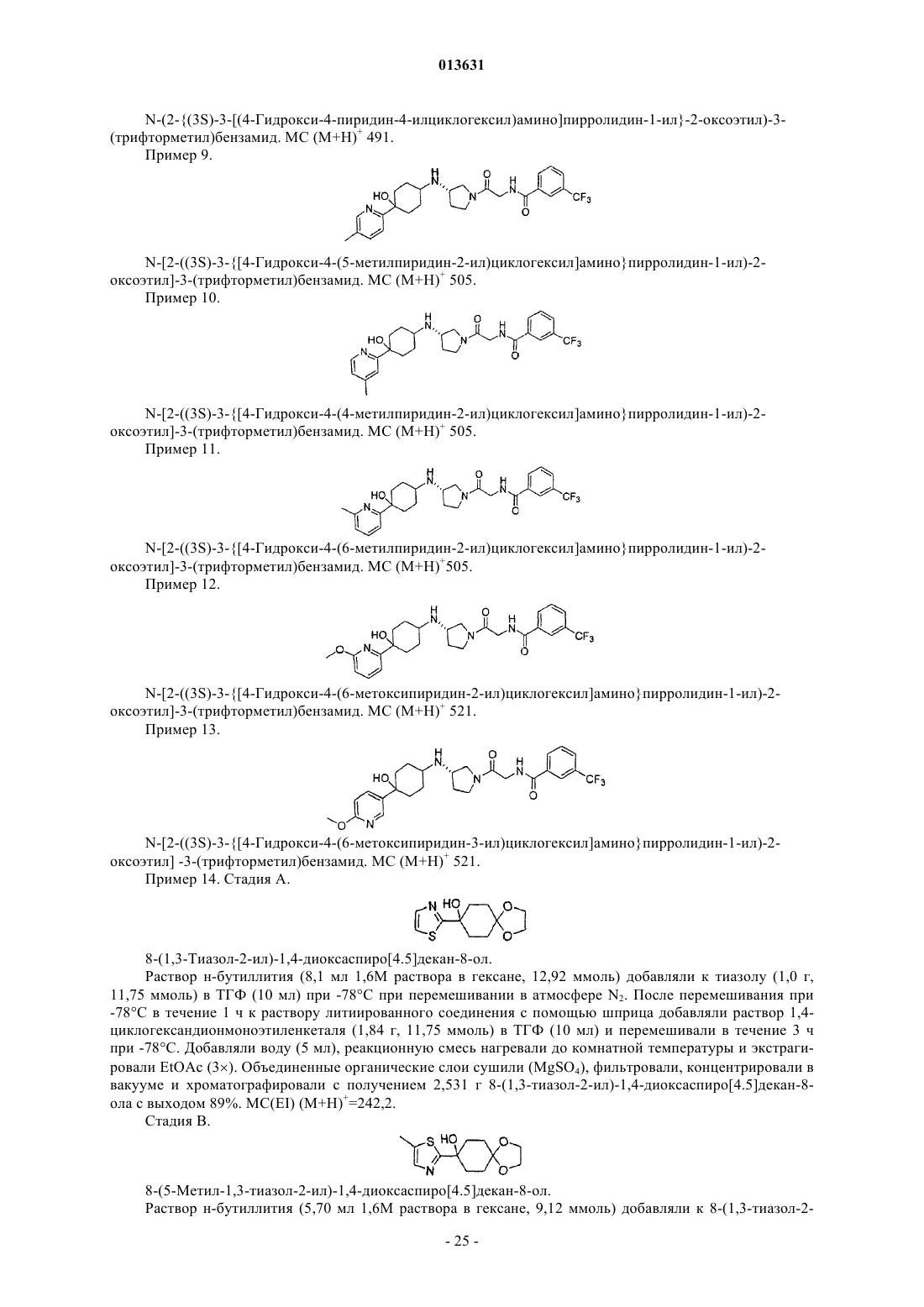
32. Соединение по п.1, которое представляет собой N-[2-((3S)-3-{[4-гидрокси-4-(5-пиримидин-2-илпиридин-2-ил)циклогексил]амино}пирролидин-1-ил)-2-оксоэтил]-3-(трифторметил)бензамид формулы

или его фармацевтически приемлемую соль.
33. Соединение по п.1, где -X-Y- представляет собой -СН2-NH-CO-, -C1-6алкил-O-С1-6алкил-, гетероцикл или гетероарил,
Z представляет собой фенил или гетероарил, замещенный R10;
R1 представляет собой арил или гетероарил, каждый замещенный R1a,
R5 представляет собой Н,
R6 и R7оба Н.
34. Соединение по п.1, где -X-Y- представляет собой -СН2-NH-CO-;
Z представляет собой фенил, пиридил, пиримидинил, каждый замещенный тригалогеналкилом;
R1 представляет собой арил или гетероарил, каждый замещенный фенилом, пиридилом, пиримидинилом, оксазолилом, тиазолилом или имидазолилом;
R5 представляет собой Н,
R6 и R7оба Н.
35. Соединение по п.1, где -X-Y- представляет собой -СН2-NH-CO-;
Z представляет собой фенил, замещенный тригалогеналкилом;
R1 представляет собой гетероарил, замещенный фенилом, пиридилом, пиримидинилом, оксазолилом, тиазолилом или имидазолилом;
R5 представляет собой Н,
R6 и R7оба Н.
36. Соединение по п.1, выбранное из группы, состоящей из
N-(2-{(3S)-3-[(4-гидрокси-4-фенилциклогексил)амино]пирролидин-1-ил}-2-оксоэтил)-3-(трифторметил)бензамида,
N-(2-{(3S)-3-[(4-гидрокси-4-пиридин-2-илциклогексил)амино]пирролидин-1-ил}-2-оксоэтил)-3-(трифторметил)бензамида,
N-(2-{(3S)-3-[(4-гидрокси-4-пиридин-2-илциклогексил)(метил)амино]пирролидин-1-ил}-2-оксоэтил)-3-(трифторметил)бензамида,
N-{2-[(3S)-3-({4-гидрокси-4-[5-(метоксиметил)пиридин-2-ил]циклогексил}амино)пирролидин-1-ил]-2-оксоэтил}-3-(трифторметил)бензамида,
N-(2-{(3S)-3-[(4-{5-[(диметиламино)метил]пиридин-2-ил}-4-гидроксициклогексил)амино]пирролидин-1-ил}-2-оксоэтил)-3-(трифторметил)бензамида,
N-[2-((3S)-3-{[4-гидрокси-4-(4-метилфенил)циклогексил]амино}пирролидин-1-ил)-2-оксоэтил]-3-(трифторметил)бензамида,
N-(2-{(3S)-3-[(4-гидрокси-4-пиридин-3-илциклогексил)амино]пирролидин-1-ил}-2-оксоэтил)-3-(трифторметил)бензамида,
N-(2-{(3S)-3-[(4-гидрокси-4-пиридин-4-илциклогексил)амино]пирролидин-1-ил}-2-оксоэтил)-3-(трифторметил)бензамида,
N-[2-((3S)-3-{[4-гидрокси-4-(5-метилпиридин-2-ил)циклогексил]амино}пирролидин-1-ил)-2-оксоэтил]-3-(трифторметил)бензамида,
N-[2-((3S)-3-{[4-гидрокси-4-(4-метилпиридин-2-ил)циклогексил]амино}пирролидин-1-ил)-2-оксоэтил]-3-(трифторметил)бензамида,
N-[2-((3S)-3-{[4-гидрокси-4-(6-метилпиридин-2-ил)циклогексил]амино}пирролидин-1-ил)-2-оксоэтил]-3-(трифторметил)бензамида,
N-[2-((3S)-3-{[4-гидрокси-4-(6-метоксипиридин-2-ил)циклогексил]амино}пирролидин-1-ил)-2-оксоэтил]-3-(трифторметил)бензамида,
N-[2-((3S)-3-{[4-гидрокси-4-(6-метоксипиридин-3-ил)циклогексил]амино}пирролидин-1-ил)-2-оксоэтил]-3-(трифторметил)бензамида,
3-(трифторметил)-N-[2-((3S)-3-{[4-гидрокси-4-(5-метил-1,3-тиазол-2-ил)циклогексил]амино}пирролидин-1-ил)-2-оксоэтил]бензамида,
3-(трифторметил)-N-{2-[(3S)-3-({4-гидрокси-4-[5-(1-гидрокси-1-метилэтил)-1,3-тиазол-2-ил]циклогексил}амино)пирролидин-1-ил]-2-оксоэтил}бензамида,
3-(трифторметил)-N-{2-[(3S)-3-({4-гидрокси-4-[5-(метоксиметил)-1,3-тиазол-2-ил]циклогексил}амино) пирролидин-1-ил]-2-оксоэтил}бензамида,
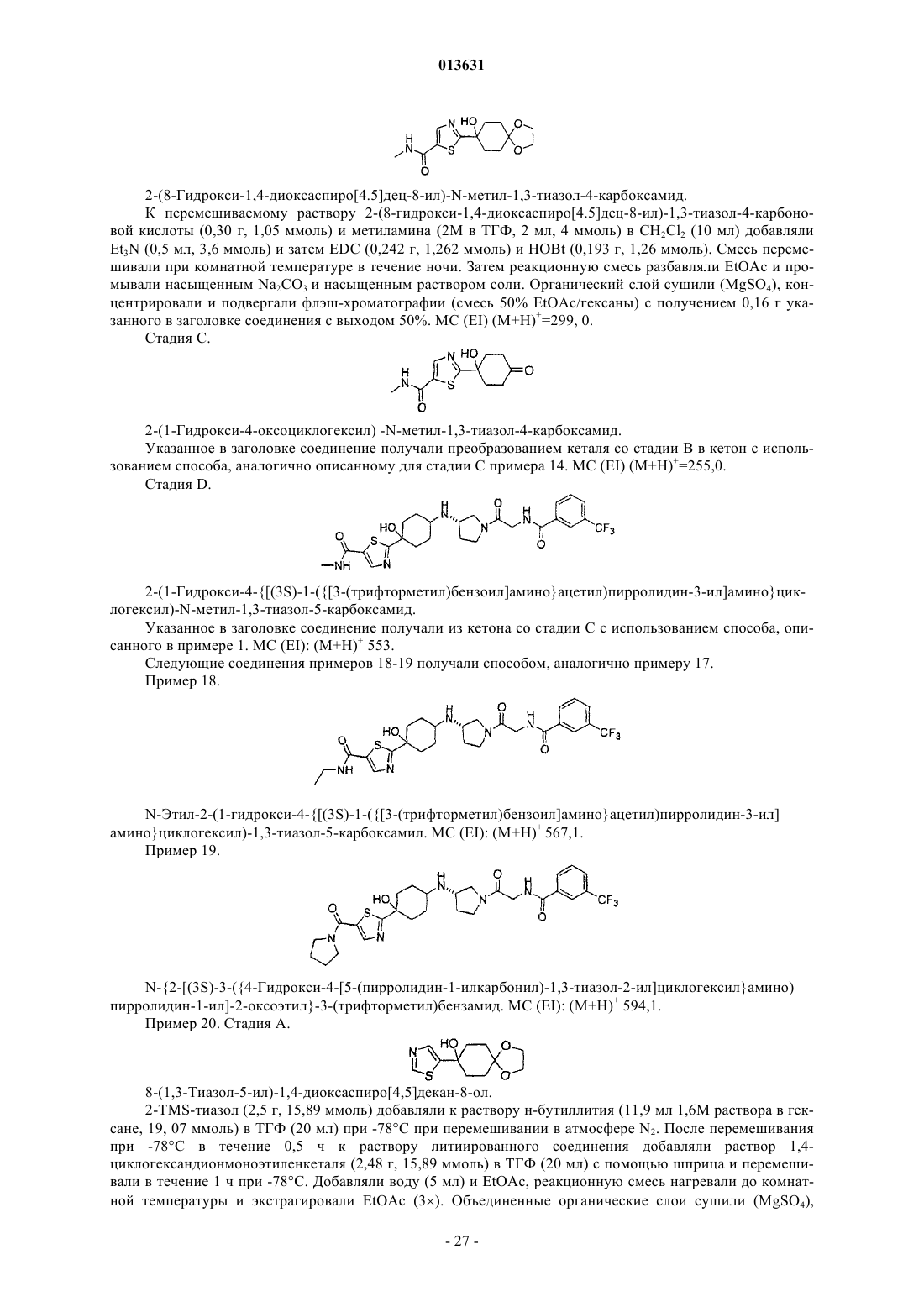
2-(1-гидрокси-4-{[(3S)-1-({[3-(трифторметил)бензоил]амино}ацетил)пирролидин-3-ил]амино}циклогексил)-N-метил-1,3-тиазол-5-карбоксамида,
N-этил-2-(1-гидрокси-4-{[(3S)-1-({[3-(трифторметил)бензоил]амино}ацетил)пирролидин-3-ил]амино}циклогексил)-1,3-тиазол-5-карбоксамида,
N-{2-[(3S)-3-({4-гидрокси-4-[5-(пирролидин-1-илкарбонил)-1,3-тиазол-2-ил]циклогексил}амино) пирролидин-1-ил]-2-оксоэтил}-3-(трифторметил)бензамида,
3-(трифторметил)-N-{2-[(3S)-3-({4-гидрокси-4-[2-(метоксиметил)-1,3-тиазол-5-ил]циклогексил}амино) пирролидин-1-ил]-2-оксоэтил}бензамида,
3-(трифторметил)-N-[2-((3S)-3-{[4-гидрокси-4-(2-метил-1,3-тиазол-5-ил)циклогексил]амино}пирролидин-1-ил)-2-оксоэтил]бензамида,
3-(трифторметил)-N-[2-((3S)-3-{[4-(2-этил-1,3-тиазол-5-ил)-4-гидроксициклогексил]амино}пирролидин-1-ил)-2-оксоэтил]бензамида,
N-[2-((3S)-3-{[4-гидрокси-4-(2-изопропил-1,3-тиазол-5-ил)циклогексил]амино}пирролидин-1-ил)-2-оксоэтил]-3-(трифторметил)бензамида,
N-[2-(3S)-(3-{[4-гидрокси-4-(5-пиридин-3-ил-1,3-тиазол-2-ил)циклогексил]метил}пирролидин-1-ил)-2-оксоэтил]-3-(трифторметил)бензамида,
N-[2-({(3S)-1-[4-гидрокси-4-(5-пиридин-2-ил-1,3-тиазол-2-ил)циклогексил]пирролидин-3-ил}амино)-2-оксоэтил]-3-(трифторметил)бензамида,
N-(2-{(3S)-3-[(4-гидрокси-4-пиридазин-3-илциклогексил)амино]пирролидин-1-ил}-2-оксоэтил)-3-(трифторметил)бензамида,
N-(2-{(3S)-3-[(4-гидрокси-4-пиразин-2-илциклогексил)амино]пирролидин-1-ил}-2-оксоэтил)-3-(трифторметил)бензамида,
N-(2-{(3S)-3-[(4-гидрокси-4-пиримидин-2-илциклогексил)амино]пирролидин-1-ил}-2-оксоэтил)-3-(трифторметил)бензамида,
6-(1-гидрокси-4-{[(3S)-1-({[3-(трифторметил)бензоил]амино}ацетил)пирролидин-3-ил]амино}циклогексил)-N-метилникотинамида,
6-(1-гидрокси-4-{[(3S)-1-({[3-(трифторметил)бензоил]амино}ацетил)пирролидин-3-ил]амино}циклогексил)-N,N-диметилникотинамида,
N-{2-[(3S)-3-({4-гидрокси-4-[5-(пирролидин-1-илкарбонил)пиридин-2-ил]циклогексил}амино)пирролидин-1-ил]-2-оксоэтил}-3-(трифторметил)бензамида,
N-[2-((3S)-3-[4-(5-бромпиридин-2-ил)-4-гидроксициклогексил]аминопирролидин-1-ил)-2-оксоэтил]-3-(трифторметил)бензамида,
N-{2-[(3S)-3-({4-[5-(2-формилфенил)пиридин-2-ил]-4-гидроксициклогексил}амино)пирролидин-1-ил]-2-оксоэтил}-3-(трифторметил)бензамида,
бис(трифторацетат) N-(2-(3S)-3-[(4-гидрокси-4-[5-(2-(гидроксиметил)фенил]пиридин-2-илциклогексил)амино]пирролидин-1-ил-2-оксоэтил)-3-(трифторметил)бензамида,
бис(трифторацетат) N-[2-((3S)-3-[4-гидрокси-4-(4-пиримидин-2-илфенил)циклогексил]аминопирролидин-1-ил)-2-оксоэтил]-3-(трифторметил)бензамида,
N-[2-((3S)-3-{[4-гидрокси-4-(5-фенилпиридин-2-ил)циклогексил]амино}пирролидин-1-ил)-2-оксоэтил]-3-(трифторметил)бензамида,
N-{2-[(3S)-3-({4-гидрокси-4-[5-(1,3-тиазол-2-ил)пиридин-2-ил]циклогексил}амино)пирролидин-1-ил]-2-оксоэтил}-3-(трифторметил)бензамида,
N-[2-((3S)-3-{[4-гидрокси-4-(5-пиримидин-2-илпиридин-2-ил)циклогексил]амино}пирролидин-1-ил)-2-оксоэтил]-3-(трифторметил)бензамида,
N-(2-{(3S)-3-[(4-{5-[3-(аминокарбонил)фенил]пиридин-2-ил}-4-гидроксициклогексил)амино]пирролидин-1-ил}-2-оксоэтил)-3-(трифторметил)бензамида,
N-(2-{(3S)-3-[(4-{5-[2-(аминокарбонил)фенил]пиридин-2-ил}-4-гидроксициклогексил)амино]пирролидин-1-ил}-2-оксоэтил)-3-(трифторметил)бензамида,
N-{2-[(3S)-3-({4-[5-(3-ацетилфенил)пиридин-2-ил]-4-гидроксициклогексил}амино)пирролидин-1-ил]-2-оксоэтил}-3-(трифторметил)бензамида,
3-[6-(1-гидрокси-4-{[(3S)-1-({[3-(трифторметил)бензоил]амино}ацетил)пирролидин-3-ил]амино}циклогексил)пиридин-3-ил]бензойной кислоты,
N-(2-{(3S)-3-[(4-гидрокси-4-{5-[3-(гидроксиметил)фенил]пиридин-2-ил}циклогексил)амино]пирролидин-1-ил}-2-оксоэтил)-3-(трифторметил)бензамида,
N-[2-((3S)-3-{[4-гидрокси-4-(5-пиримидин-5-илпиридин-2-ил)циклогексил]амино}пирролидин-1-ил)-2-оксоэтил]-3-(трифторметил)бензамида,
N-[2-((3S)-3-{[4-(3,3'-бипиридин-6-ил)-4-гидроксициклогексил]амино}пирролидин-1-ил)-2-оксоэтил]-3-(трифторметил)бензамида,
N-[2-((3S)-3-{[4-(3,4'-бипиридин-6-ил)-4-гидроксициклогексил]амино}пирролидин-1-ил)-2-оксоэтил]-3-(трифторметил)бензамида,
N-[2-((3S)-3-{[4-гидрокси-4-(5-пиразин-2-илпиридин-2-ил)циклогексил]амино}пирролидин-1-ил)-2-оксоэтил]-3-(трифторметил)бензамида,
N-[2-((3S)-3-{[4-гидрокси-4-(4-изоксазол-4-илфенил)циклогексил]амино}пирролидин-1-ил)-2-оксоэтил]-3-(трифторметил)бензамида,
N-{2-[(3S)-3-({4-гидрокси-4-[4-(1Н-имидазол-1-ил)фенил]циклогексил}амино)пирролидин-1-ил]-2-оксоэтил}-3-(трифторметил)бензамида,
4'-(1-гидрокси-4-{[(3S)-1-({[3-(трифторметил)бензоил]амино}ацетил)пирролидин-3-ил]амино}циклогексил) бифенил-2-карбоксамида,
N-[2-((3S)-3-{[4-(2'-формилбифенил-4-ил)-4-гидроксициклогексил]амино}пирролидин-1-ил)-2-оксоэтил]-3-(трифторметил)бензамида,
N-{2-[(3S)-3-({4-гидрокси-4-[2'-(гидроксиметил)бифенил-4-ил]циклогексил}амино)пирролидин-1-ил]-2-оксоэтил}-3-(трифторметил)бензамида,
N-{2-[(3S)-3-({4-[5-(3,5-диметилизоксазол-4-ил)пиридин-2-ил]-4-гидроксициклогексил}амино)пирролидин-1-ил]-2-оксоэтил}-3-(трифторметил)бензамида,
N-{2-[(3S)-3-({4-гидрокси-4-[5-(1,3-оксазол-2-ил)пиридин-2-ил]циклогексил}амино)пирролидин-1-ил]-2-оксоэтил}-3-(трифторметил)бензамида,
1-пиридин-2-ил-4-[(3S)-1-(3-[3-(трифторметил)фенил]-4,5-дигидроизоксазол-5-илкарбонил)пирролидин-3-ил]аминоциклогексанола,
1-[5-(1,3-оксазол-2-ил)пиридин-2-ил]-4-{[(3S)-1-({3-[3-(трифторметил)фенил]-4,5-дигидроизоксазол-5-ил}карбонил)пирролидин-3-ил]амино}циклогексанола,
1-{5-[(диметиламино)метил]пиридин-2-ил}-4-{[(3S)-1-({3-[3-(трифторметил)фенил]-4,5-дигидроизоксазол-5-ил}карбонил)пирролидин-3-ил]амино}циклогексанола,
1-(5-пиримидин-2-илпиридин-2-ил)-4-{[(3S)-1-({3-[3-(трифторметил)фенил]-4,5-дигидроизоксазол-5-ил}карбонил)пирролидин-3-ил]амино}циклогексанола,
N-(2-{{2R,4S)-4-[(4-гидрокси-4-пиридин-2-илциклогексил)амино]-2-метилпирролидин-1-ил}-2-оксоэтил)-3-(трифторметил)бензамида,
N-{2-[(2S,4S)-4-[(4-гидрокси-4-пиридин-2-илциклогексил)амино]-2-(метоксиметил)пирролидин-1-ил]-2-оксоэтил}-3-(трифторметил)бензамида,
N-(2-{(2S,4S)-2-(этоксиметил)-4-[(4-гидрокси-4-пиридин-2-илциклогексил)амино]пирролидин-1-ил}-2-оксоэтил)-3-(трифторметил)бензамида,
N-(2-{(2S,4S)-2-(1-гидрокси-1-метилэтил)-4-[(транс-4-гидрокси-4-пиридин-2-илциклогексил)амино]пирролидин-1-ил}-2-оксоэтил)-3-(трифторметил)бензамида,
N-(2-{(2S,4S)-2-[1-гидроксиэтил]-4-[(4-гидрокси-4-пиридин-2-илциклогексил)амино]пирролидин-1-ил}-2-оксоэтил)-3-(трифторметил)бензамида,
N-{2-[(2S,4S)-4-[(4-гидрокси-4-пиридин-2-илциклогексил)амино]-2-(1-метокси-1-метилэтил)пирролидин-1-ил]-2-оксоэтил}-3-(трифторметил)бензамида,
N-(2-{(2S,4S)-4-[(4-гидрокси-4-пиридин-2-илциклогексил)амино]-2-[(1S)-1-метоксиэтил]пирролидин-1-ил}-2-оксоэтил)-3-(трифторметил)бензамида,
N-(2-{(4S)-4-[(4-гидрокси-4-пиридин-2-илциклогексил)амино]-2,2-диметилпирролидин-1-ил}-2-оксоэтил)-3-(трифторметил)бензамида,
N-(2-{(2S,4S)-4-[(4-гидрокси-4-пиридин-2-илциклогексил)амино]-2-изопропилпирролидин-1-ил}-2-оксоэтил)-3-(трифторметил)бензамида,
N-{2-[(2S,4S)-4-({4-гидрокси-4-[5-(метоксиметил)пиридин-2-ил]циклогексил}амино)-2-(метоксиметил)пирролидин-1-ил]-2-оксоэтил}-3-(трифторметил)бензамида,
N-{2-[(2S,4S)-4-[(4-{5-[(диметиламино)метил]пиридин-2-ил}-4-гидроксициклогексил)амино]-2-(метоксиметил)пирролидин-1-ил]-2-оксоэтил}-3-(трифторметил)бензамида и
N-{2-[(2S,4S)-4-[(4-гидрокси-4-пиридин-2-илциклогексил)амино]-2-(изопропоксиметил)пирролидин-1-ил]-2-оксоэтил}-3-(трифторметил)бензамида.
37. Соединение по п.1, выбранное из
N-{2-[(2S,4S)-4-{[4-гидрокси-4-(5-пиримидин-2-илпиридин-2-ил)циклогексил]амино}-2-(метоксиметил)пирролидин-1-ил]-2-оксоэтил}-3-(трифторметил)бензамида;
N-(2-{(3S)-3-[[4-гидрокси-4-(5-пиразин-2-илпиридин-2-ил)циклогексил](метил)амино]пирролидин-1-ил}-2-оксоэтил)-3-(трифторметил)бензамида;
N-(2-{(3S)-3-[{4-гидрокси-4-[5-(1,3-оксазол-2-ил)пиридин-2-ил]циклогексил}(метил)амино]пирролидин-1-ил}-2-оксоэтил)-3-(трифторметил)бензамида;
1-пиридин-2-ил-4-{[(3S)-1-({1-[3-(трифторметил)фенил]пиперидин-4-ил}карбонил)пирролидин-3-ил]амино}циклогексанола;
1-(5-пиримидин-2-илпиридин-2-ил)-4-{[(3S)-1-({1-[3-(трифторметил)фенил]пиперидин-4-ил}карбонил)пирролидин-3-ил]амино}циклогексанола;
1-(5-пиримидин-2-илпиридин-2-ил)-4-{[(3S)-1-({1-[3-(трифторметил)фенил]пирролидин-3-ил}карбонил)пирролидин-3-ил]амино}циклогексанола;
1-(5-пиримидин-2-илпиридин-2-ил)-4-{[(3S)-1-({1-[3-(трифторметил)фенил]азетидин-3-ил}карбонил)пирролидин-3-ил]амино}циклогексанола;
1-(5-пиримидин-2-илпиридин-2-ил)-4-{[(3S)-1-({1-[6-(трифторметил)пиридин-2-ил]пиперидин-4-ил}карбонил)пирролидин-3-ил]амино}циклогексанола;
1-пиридин-2-ил-4-{[(3S)-1-({1-[6-(трифторметил)пиридин-2-ил]пиперидин-4-ил}карбонил)пирролидин-3-ил]амино}циклогексанола;
1-(6-пиримидин-2-илпиридин-3-ил)-4-{[(3S)-1-({1-[6-(трифторметил)пиримидин-4-ил]пиперидин-4-ил}карбонил)пирролидин-3-ил]амино}циклогексанола;
1-пиридин-2-ил-4-{[(3S)-1-({1-[6-(трифторметил)пиримидин-4-ил]пиперидин-4-ил}карбонил)пирролидин-3-ил]амино}циклогексанола;
1-пиридин-2-ил-4-{[(3S)-1-({1-[4-(трифторметил)пиридин-2-ил]пиперидин-4-ил}карбонил)пирролидин-3-ил]амино}циклогексанола;
1-(5-пиримидин-2-илпиридин-2-ил)-4-{[(3S)-1-({1-[4-(трифторметил)пиридин-2-ил]пиперидин-4-ил}карбонил)пирролидин-3-ил]амино}циклогексанола;
1-[5-(1,3-оксазол-2-ил)пиридин-2-ил]-4-{[(3S)-1-({1-[4-(трифторметил)пиридин-2-ил]пиперидин-4-ил}карбонил)пирролидин-3-ил]амино}циклогексанола;
1-(5-пиразин-2-илпиридин-2-ил)-4-{[(3S)-1-({1-[4-(трифторметил)пиридин-2-ил]пиперидин-4-ил}карбонил)пирролидин-3-ил]амино}циклогексанола;
1-(5-метилпиридин-2-ил)-4-{[(3S)-1-({1-[4-(трифторметил)пиридин-2-ил]пиперидин-4-ил}карбонил)пирролидин-3-ил]амино}циклогексанола;
1-(3,3'-бипиридин-6-ил)-4-{[(3S)-1-({1-[4-(трифторметил)пиридин-2-ил]пиперидин-4-ил}карбонил)пирролидин-3-ил]амино}циклогексанола;
1-(3,4'-бипиридин-6-ил)-4-{[(3S)-1-({1-[4-(трифторметил)пиридин-2-ил]пиперидин-4-ил}карбонил)пирролидин-3-ил]амино}циклогексанола;
1-(5-метоксипиридин-2-ил)-4-{[(3S)-1-({1-[4-(трифторметил)пиридин-2-ил]пиперидин-4-ил}карбонил)пирролидин-3-ил]амино}циклогексанола;
1-[5-(метоксиметил)пиридин-2-ил]-4-{[(3S)-1-({1-[4-(трифторметил)пиридин-2-ил]пиперидин-4-ил}карбонил)пирролидин-3-ил]амино}циклогексанола;
6-(1-гидрокси-4-{[(3S)-1-({1-[4-(трифторметил)пиридин-2-ил]пиперидин-4-ил}карбонил)пирролидин-3-ил]амино}циклогексил)никотинамида;
6-(1-гидрокси-4-{[(3S)-1-({1-[4-(трифторметил)пиридин-2-ил]пиперидин-4-ил}карбонил)пирролидин-3-ил]амино}циклогексил)-N-метилникотинамида;
1-(5-пиримидин-2-илпиридин-2-ил)-4-{[(3S)-1-({1-[4-(трифторметил)пиримидин-2-ил]пиперидин-4-ил}карбонил)пирролидин-3-ил]амино}циклогексанола;
1-(5-пиримидин-2-илпиридин-2-ил)-4-{[(3S)-1-({1-[6-(трифторметил)пиридин-2-ил]пирролидин-3-ил}карбонил)пирролидин-3-ил]амино}циклогексанола;
1-(5-пиримидин-2-илпиридин-2-ил)-4-{[(3S)-1-({1-[5-(трифторметил)пиридин-2-ил]пирролидин-3-ил}карбонил)пирролидин-3-ил]амино}циклогексанола;
1-(5-пиримидин-2-илпиридин-2-ил)-4-{[(3S)-1-({1-[4-(трифторметил)пиримидин-2-ил]пирролидин-3-ил}карбонил)пирролидин-3-ил]амино}циклогексанола;
1-(5-пиримидин-2-илпиридин-2-ил)-4-{[(3S)-1-({(3R)-1-[4-(трифторметил)пиридин-2-ил]пиперидин-3-ил}карбонил)пирролидин-3-ил]амино}циклогексанола;
1-(5-пиримидин-2-илпиридин-2-ил)-4-{[(3S)-1-({(3S)-1-[4-(трифторметил)пиридин-2-ил]пиперидин-3-ил}карбонил)пирролидин-3-ил]амино}циклогексанола;
1-(5-пиримидин-2-илпиридин-2-ил)-4-{[(3S)-1-({1-[4-(трифторметил)пиридин-2-ил]азетидин-3-ил}карбонил)пирролидин-3-ил]амино}циклогексанола;
1-(6-пиримидин-2-илпиридин-3-ил)-4-{[(3S)-1-({1-[4-(трифторметил)пиридин-2-ил]-1Н-имидазол-4-ил}карбонил)пирролидин-3-ил]амино}циклогексанола;
1-(5-пиримидин-2-илпиридин-2-ил)-4-{[(3S)-1-({[4-(трифторметил)пиридин-2-ил]метокси}ацетил) пирролидин-3-ил]амино}циклогексанола и
1-(5-пиримидин-2-илпиридин-2-ил)-4-{[(3S)-1-({[4-(трифторметил)-2-фенил]метокси}ацетил)пирролидин-3-иламино}циклогексанола.
38. Способ лечения заболевания, связанного с экспрессией или активностью рецептора хемокинов у больного, включающий введение указанному больному терапевтически эффективного количества соединения по п.1.
39. Способ по п.38, где указанный рецептор хемокинов представляет собой CCR2 или CCR5.
40. Способ по п.38, где указанное заболевание представляет собой воспалительное заболевание.
41. Способ по п.38, где указанное заболевание представляет собой иммунное заболевание.
42. Способ по п.38, где указанное заболевание представляет собой ревматоидный артрит, атеросклероз, волчанку, множественный склероз, невропатическую боль, отторжение трансплантата, диабет или ожирение.
43. Способ по п.38, где указанное заболевание представляет собой рак.
44. Способ по п.43, где указанный рак характеризуется макрофагами, ассоциированными с опухолью.
45. Способ по п.43, где указанный рак представляет собой рак молочной железы, рак яичников или множественную миелому.
46. Способ по п.38, где указанное заболевание представляет собой вирусную инфекцию.
47. Способ по п.46, где указанная вирусная инфекция представляет собой ВИЧ-инфекцию.
Текст
013631 Область техники, к которой относится изобретение Настоящее изобретение относится к модуляторам рецепторов хемокинов, например, к антагонистам, и их применению в качестве медицинских агентов. Настоящее изобретение дополнительно относится к новым соединениям и медицинским способам лечения воспаления и других нарушений, особенно тех, которые связаны с аккумуляцией лимфоцитов или моноцитов, таких как ревматоидный артрит,волчанка, заболевания трансплантат против хозяина и/или отторжение трансплантата. Более конкретно, настоящее изобретение относится к производным 3-циклоалкиламинопирролидина и их применению в качестве модуляторов рецепторов хемокинов. Более конкретно, настоящее изобретение относится к новым противовоспалительным и иммуномодуляторным биологически активным веществам и их фармацевтическим композициям, которые действуют как антагонисты рецептора CCR2 (также известного как рецептор МСР-1) и поэтому ведут к ингибированию хемоаттрактантного белка-1 моноцитов (МСР-1). Новые соединения представляют собой производные 3-циклоалкиламинопирролидина. Изобретение дополнительно относится к новым соединениям для применения в композициях, к способам их получения, к промежуточным продуктам, применяемым при их получении и к их применению в качестве терапевтических агентов. В настоящем изобретении предложены также иммуномодуляторные биологически активные соединения и их фармацевтические композиции, которые действуют как антагонисты рецептора CCR5. Модуляторы/антагонисты рецепторов хемокинов изобретения могут быть эффективными в качестве терапевтических агентов и/или профилактических агентов для таких заболеваний, связанных с экспрессией или активностью рецептора хемокинов, где указанный рецептор хемокинов представляет собойCCR2 или CCR5. К таким заболеваниям относятся воспалительное заболевание, иммунное заболевание, рак и вирусная инфекция. Указанное иммунное заболевание в частности представляет собой ревматоидный артрит, атеросклероз, волчанку, множественный склероз, невропатическую боль, отторжение трансплантата, диабет или ожирение. Указанный рак характеризуется макрофагами, ассоциированными с опухолью и, в частности, представляет собой рак молочной железы, рак яичников или множественную миелому. Указанное вирусное заболевание, в частности, представляет собой ВИЧ-инфекцию. Известный уровень техники Миграция и транспорт лейкоцитов из кровеносных сосудов в пораженные ткани, очевидно, являются решающим компонентом инициации нормальной борьбы с заболеванием в виде воспалительных ответов. Процесс, также известный как рекрутирование лейкоцитов, относится также к наступлению и прогрессии опасного для жизни воспаления, а также к подрывающим здоровье аутоиммунным заболеваниям. Итоговая патология при данных заболеваниях возникает из-за действия защитной иммунной системы организма на нормальные ткани. Соответственно, предотвращение или блокирование рекрутирования лейкоцитов в ткани-мишени при воспалительном и аутоиммунном заболевании должно быть высокоэффективным подходом терапевтического вмешательства. Различные классы лейкоцитарных клеток, вовлеченных в клеточные иммунные ответы, включают моноциты, лимфоциты, нейтрофилы, эозинофилы и базофилы. В большинстве случаев лимфоциты являются классом лейкоцитов, который инициирует, координирует и поддерживает хронические воспалительные ответы, и, таким образом, они обычно являются наиболее важным классом клеток для блокирования их входа в места воспаления. Лимфоциты привлекают в тканевые участки моноциты, которые совместно с лимфоцитами отвечают за большую часть тканевого повреждения, которое наступает при воспалительном заболевании. Инфильтрация лимфоцитов и/или моноцитов, как известно, ведет к широкому спектру хронических аутоиммунных заболеваний, а также к отторжению трансплантата органа. Данные заболевания включают, но не ограничиваются ими, ревматоидный артрит, хронический контактный дерматит, воспалительное заболевание кишечника, волчанку, системную красную волчанку, множественный склероз, атеросклероз, псориаз, саркоидоз, идиопатический фиброз легких, дерматомиозит, кожный пемфигоид (например, pemphigus vulgaris, p. foliacious, p. erythematosis), гломерулонефриты, васкулиты,гепатит, диабет, отторжение аллотрансплантата и реакцию трансплантата против хозяина. Способ, с помощью которого лейкоциты покидают кровоток, аккумулируются в местах воспаления и инициируют заболевание, имеет по меньшей мере три стадии, которые описаны как (1) перекатывание,(2) активация/устойчивая адгезия, (3) трансэндотелиальная миграция [Springer, T.A., Nature 346:425-433(1990); Lawrence и Springer, Cell 65:859-873 (1991); Butcher, E.C., Cell 67:1033-1036 (1991)]. Вторая стадия опосредуется на молекулярном уровне рецепторами хемоаттрактантов. Рецепторы хемоаттрактантов на поверхности лейкоцитов затем связывают хемоаттрактантные цитокины, которые секретируются клетками в месте повреждения или инфекции. Связывание с рецептором активирует лейкоциты, увеличивает адгезивность молекул адгезии, которые опосредуют трансэндотелиальную миграцию, стимулирует направленную миграцию клеток по направлению к источнику хемоаттрактантного цитокина. Цитокины, осуществляющие хемотаксис (хемоаттрактанты лейкоцитов/активирующие факторы),известные также как хемокины, известные также как интеркрины и SIS цитокины, являются группой-1 013631 воспалительных/иммуномодуляторных полипептидных факторов с молекулярной массой 6-15 кДа, которые секретируются широким спектром клеток, таких как макрофаги, моноциты, эозинофилы, нейтрофилы, фибробласты, эндотелиальные клетки сосудов, гладкомышечные клетки и тучные клетки, в местах воспаления (обзоры Luster, New Eng. J Med., 338, 436-445 (1998) и Rollins, Blood, 90, 909-928 (1997. Хемокины описаны также Oppenheim, J.J. et al., Annu. Rev. Immunol., 9:617-648 (1991); Schall и Bacon, Curr.Opin. Immunol., 6:865-873 (1994); Baggiolini, M., et al., и Adv. Immunol., 55:97-179 (1994). Хемокины обладают способностью стимулировать направленную клеточную миграцию, процесс, известный как хемотаксис. Каждый хемокин содержит четыре цистеиновых остатка (С) и два внутренних дисульфидных мостика. Хемокины могут быть сгруппированы в два подсемейства на основе либо двух непосредственно прилегающих аминоконцевых цистеиновых остатков (семейство СС), либо разделенных одной аминокислотой (семейство СХС). Эти различия коррелируют с организацией двух подсемейств в отдельные кластеры генов. В пределах каждого кластера генов хемокины обычно характеризуются сходством последовательностей от 25 до 60%. Хемокины СХС, такие как интерлейкин-8 (IL-8), белок-2, активирующий нейтрофилы (NAP-2) и белок, стимулирующий ростовую активность меланомы (MGSA), осуществляют хемотаксис в первую очередь в отношении нейтрофилов и Т-лимфоцитов, в то время как хемокины СС, такие как RANTES, MIP-1, MIP-1, белки хемотаксиса моноцитов (МСР-1, МСР-2, МСР-3, МСР-4 и МСР-5) и эотаксины (-1 и -2) осуществляют хемотаксис среди других клеточных типов в отношении макрофагов, Т-лимфоцитов, эозинофилов, дендритных клеток и базофилов. Существуют также хемокины лимфотактин-1, лимфотактин-2 (оба хемокины С) и фракталкин (хемокин СХХХС), которые не попадают в какое-либо из главных подсемейств хемокинов. МСР-1 (также известный как MCAF (аббревиатура для фактора хемотакисиса и активации макрофагов) или JE) представляет собой хемокин СС, продуцируемый моноцитами/макрофагами, гладкомышечными клетками, фибробластами и клетками эндотелия сосудов, и он вызывает клеточную миграцию и клеточную адгезию моноцитов (см., например, Valente, A.J., et al., Biochemistry, 1988, 27, 4162; Matsushima, K., et al. , J. Exp. Med., 1989, 169, 1485; Yoshimura, Т., et al., J. Immunol., 1989, 142, 1956; Rollins,B.J., et al., Proc. Natl. Acad. Sci. USA, 1988, 85, 3738; Rollins, B.J., et al., Blood, 1991, 78, 1112; Jiang, Y., etal., J. Immunol., 1992, 148, 2423; Vaddi, K., et al., J. Immunol., 1994, 153, 4721), Т-лимфоцитов памяти (см.,например, Carr, M.W., et al., Proc. Natl. Acad. Sci. USA, 1994, 91, 3652), Т-лимфоцитов (см., например,Loetscher, P., et al., FASEB J., 1994, 8, 1055) и клеток естественных киллеров (см., например, Loetscher, P.,et al., J. Immunol., 1996, 156, 322; Allavena, P., et al., Eur. J. Immunol., 1994, 24, 3233), а также опосредует секрецию гистамина базофилами (см., например, Alam, R., et al., J. Clin. Invest., 1992, 89, 723; Bischoff,S.C., et al., J. Exp. Med., 1992, 175, 1271; Kuna, P., et al., J. Exp. Med., 1992, 175, 489). Кроме того, сообщалось о высокой экспрессии МСР-1 при заболеваниях, при которых, как считается, аккумуляция моноцитов/макрофагом или Т-клеток важна для инициации или прогрессии заболеваний, таких как атеросклерозInvest. Dermatol., 1993, 101, 127), воспалительное заболевание кишечника (см., например, Grimm, M. С, etPathol., 1998, 152, 125), внутрибрюшинное рубцовое сращение (см., например, Zeyneloglu, H.B., et al.,Human Reproduction, 1998, 13, 1194), застойная сердечная недостаточность (см., например, Aurust, P., etal., Circulation, 1998, 97, 1136), хроническое заболевание печени (см., например, Marra, F., et al., Am. J.Pathol., 1998, 152, 423), вирусный менингит (см., например, Lahrtz, F., et al., Eur. J. Immunol., 1997, 27,2484), болезнь Кавасаки (см., например, Wong, M.; et al., J. Rheumatol., 1997, 24, 1179) и сепсис (см., например, Salkowski, С.A.; et al., Infect. Immun., 1998, 66, 3569). Более того, антитело против МСР-1, как сообщалось, обладает ингибиторным эффектом или терапевтическим эффектом на животных моделях ревматоидного артрита (см., например, Schimmer, R.C., et al., J. Immunol., 1998, 160, 1466; Schrier, D.J., J.Exp. Med., 1997, 185, 1371; Wada, Т., et al., FASEB J., 1996, 10, 1418), астмы (см., например, Gonzalo, J.A., et al., J. Exp. Med., 1998, 188, 157; Lukacs, N.W., J. Immunol., 1997, 158, 4398), атеросклероза (см., например, Guzman, L.A., et al., Circulation, 1993, 88 (suppl.), I-371), гиперчувствительности отставленного типа (см., например, Rand, M.L., et al., Am. J. Pathol., 1996, 148, 855), легочной гипертензии (см., напри-2 013631 мер, Kimura, H., et al., Lab. Invest., 1998, 78, 571) и внутрибрюшинного рубцового сращения (см., например, Zeyneloglu, H.B., et al., Am. J. Obstet. Gynecol., 1998, 179, 438). Пептидный антагонист МСР-1, МСР 1 (9-76), как также сообщалось, ингибирует артрит на мышиной модели (см. Gong, J.-H., J. Exp., 4ed.,1997, 186, 131), а также исследования на мышах, дефицитных по МСР-1, показали, что МСР-1 существенен для рекрутирования моноцитов in vivo (см. Lu, В., et al., J. Exp. Med., 1998, 187, 601; Gu, L., et al.,Moll. Cell, 1998, 2, 275). В опубликованной литературе указывается, что хемокины, такие как МСР-1 и MIP-1, привлекают моноциты и лимфоциты к местам заболевания и опосредуют их активацию и, таким образом, как считается, являются непосредственно вовлеченными в инициацию, прогрессию и поддержание заболеваний,тесно связанных с вовлечением моноцитов и лимфоцитов, таких как атеросклероз, рестеноз, ревматоидный артрит, псориаз, астма, язвенный колит, нефрит (нефропатия), множественный склероз, фиброз легких, миокардит, гепатит, панкреатит, саркоидоз, болезнь Крона, эндометриоз, застойная сердечная недостаточность, вирусный менингит, ишемический инсульт, нейропатия, болезнь Кавасаки и сепсис (см.,например, Rovin, В.Н., et al. , Am. J. Kidney, dis., 1998, 31, 1065; Lloyd, C, et al., Curr. Opin. Nephrol. Hypertens., 1998, 7, 281; Conti, P., et al., Allergy и Asthma Proc., 1998, 19, 121; Ransohoff, R. M., et al., TrendsNeurosci., 1998, 21, 154; MacDermott, R. P., et al., Inflammatory Bowel diseases, 1998, 4, 54). Хемокины связываются со специфическими рецепторами клеточной поверхности, принадлежащими к семейству белков, содержащих семь трансмембранных доменов, сопряженных с G-белками (рассмотренных в Horuk, Trends Pharm. Sci., 15, 159-165 (1994, которые называют рецепторами хемокинов. При связывании с узнающими их лигандами рецепторы хемокинов передают внутриклеточный сигнал через связанные с ними тримерные G-белки, что ведет среди других ответов к быстрому увеличению внутриклеточной концентрации кальция, изменениям в форме клеток, увеличенной экспрессии молекул клеточной адгезии, дегрануляции и стимуляции клеточной миграции. Гены, кодирующие рецепторы конкретных хемокинов, клонированы и в настоящее время известно,что данные рецепторы являются семидоменными трансмембранными рецепторами, сопряженными с Gбелками, которые присутствуют у различных популяций лейкоцитов. К настоящему времени идентифицировано по меньшей мере пять рецепторов СХС хемокинов (CXCR1-CXCR5) и восемь рецепторов СС хемокинов (CCR1-CCR8). Например, IL-8 является лигандом CXCR1 и CXCR2, MIP-1 является лигандом для CCR1 и CCR5, и МСР-1 является лигандом для CCR2A и CCR2B (в качестве ссылки см., например, Holmes, W.E., et al., Science 1991, 253, 1278-1280; Murphy P.M., et al., Science, 253, 1280-1283; Neote,K. et al., Cell, 1993, 72, 415-425; Charo, I. F., et al., Proc. Natl. Acad. Sci. USA, 1994, 91, 2752-2756; Yamagami, S., et al., Biochem. Biophys. Res. Commun., 1994, 202, 1156-1162; Combadier, C. et al., The Journal ofSamson, M., et al. , Biochemistry, 1996, 35, 3362-3367; Murphy, P.M., Annual Review of Immunology, 1994,12, 592-633). Сообщалось, что воспаление легких и образование гранулемы подавляется у мышей, дефицитных по CCR1 (см. Gao, J.-L., et al., J. Exp. Med., 1997, 185, 1959; Gerard, C. et al., J. Clin. Invest., 1997,100, 2022), и что рекрутирование макрофагов и образование атеросклеротического повреждения снижаются у мышей, дефицитных по CCR2 (см. Boring, L., et al., Nature, 1998, 394, 894; Kuziel, W. A., et al.,Proc. Natl. Acad. Sci., USA, 1997, 94, 12053; Kurihara, Т., et al., J. Exp. Med., 1997, 186, 1757; Boring, L., etal., J. Clin. Invest., 1997, 100, 2552). Соответственно, лекарственные средства, которые ингибируют связывание хемокинов, таких как МСР-1 и/или MIP-1, со своими рецепторами, например, антагонисты рецепторов хемокинов, могут быть полезны в качестве фармацевтических агентов, которые ингибируют действие хемокинов, таких как МСР-1 и/или MIP-1, на клетки-мишени, но в предшествующем уровне техники не сообщается о производных 3-циклоалкиламинопирролидина, обладающих таким фармакологическим действием. Идентификация соединений, которые модулируют функцию CCR2 и/или CCR5, представляет собой отличный подход к дизайну лекарственных средств для разработки фармакологических агентов для лечения воспалительных состояний и заболеваний, связанных с активацией CCR2 и/или CCR5, таких как ревматоидный артрит, волчанка и другие воспалительные заболевания. В настоящем изобретении предложены решения давно имеющейся потребности в области модуляторов и антагонистов рецепторов хемокинов. Цель изобретения Имея в виду указанное выше, целью настоящего изобретения является обеспечение антагонистов рецепторов хемокинов и модуляторов рецепторов хемокинов для лечения ревматоидного артрита. Другой главной целью изобретения является обеспечение антагонистов рецепторов хемокинов и их применение в качестве медицинских агентов. Дополнительной целью изобретения является обеспечение модуляторов рецепторов хемокинов и их применение в качестве медицинских агентов. Другой целью настоящего изобретения является обеспечение производных 3-циклоалкиламинопирролидина. Другая цель изобретения относится к новым соединениям и медицинским способам лечения воспаления.-3 013631 Еще одной целью изобретения является обеспечение новых противовоспалительных и иммуномодуляторных биологически активных соединений и их фармацевтических композиций, которые действуют как антагонисты рецептора CCR2. Дополнительной целью изобретения является обеспечение производных 3-циклоалкиламинопирролидина и их применение в качестве модуляторов рецепторов хемокинов. Еще одной целью изобретения является обеспечение производных 3-циклоалкиламинопирролидина и их применение для лечения и профилактики атеросклероза и рестеноза. Другой целью изобретения является обеспечение производных 3-циклоалкиламинопирролидина и их применение в качестве модуляторов рецептора CCR5. Другие цели и варианты осуществления настоящего изобретения будут обсуждаться ниже. Однако важно отметить, что многие дополнительные варианты осуществления настоящего изобретения, не описанные в данном описании, могут быть, тем не менее, включены в существо и объем настоящего изобретения и/или формулу изобретения. Краткое описание изобретения Настоящее изобретение направлено на соединение формулы I или его фармацевтически приемлемую соль, где-X-Y- выбран из группы, состоящей из -CH2-NH-CO-, -C1-6 алкил-О-С 1-6 алкила-, гетероцикла, содержащего 4-6 атомов в кольце, один из которых представляет гетероатом, такой как N, либо гетероарила,содержащего 5 атомов в кольце, 2 из которых представляют гетероатом, выбранный из N и О;Z выбран из фенила и гетероарила, содержащего 6 атомов в кольце, 1 или 2 из которых представляют гетероатом, такой как N, возможно замещенного R10, где R10 галогеналкил;R1 выбран из фенила и гетероарила, содержащего 5-6 атомов в кольце, и содержащего N в качестве гетероатома или два гетероатома, один из которых N а другой выбран из N или S, возможно замещенногоC1-6 алкилом аминокарбонила; гетероалкилилкарбонила, содержащего 5-6 атомов в кольце, 1 или 2 из которых представляют гетероатом, выбранный из N и О; либо R1 представляет собойR1b-фенил или R1b-гетероарил, содержащий 5-6 атомов в кольце, 1 или 2 из которых представляют гетероатом, такой как N, О или S, где R1b выбран из группы, состоящей из Н, гидроксиС 1-6 алкила, карбоксамида;R6 и R7 выбраны из группы, состоящей из Н, С 1-6 алкила (где алкил может быть необязательно прерван О) или гидроксиС 1-6 алкила,Настоящее изобретение также относится к соединениям формулы I, как показано выше, которые действуют как антагонисты рецептора CCR2, (также известного как рецептор МСР-1), следовательно,ингибируя хемоаттрактантный белок-1 моноцитов (МСР-1). Настоящее изобретение также направлено на противовоспалительные и/или иммуномодуляторные соединения формул I, как показано выше, которые действуют как антагонисты рецептора CCR5 (также известного как рецептор МСР-1), следовательно, ингибируя хемоаттрактантный белок-1 моноцитов(МСР-1). Настоящее изобретение также направлено на соединения формул I, которые являются модуляторами функции рецептора CCR2 хемокинов и полезны для профилактики или лечения воспалительных состояний и заболеваний, таких как ревматоидный артрит и волчанка. В настоящем изобретении также описаны соединения формул I, которые являются модуляторами функции рецептора CCR5 хемокинов и пригодны для профилактики или лечения воспалительных состояний и заболеваний, таких как ревматоидный артрит и волчанка. В изобретении также предложены соединения, выбранные из группы формулы I, и применение данных соединений для профилактики или лечения заболеваний, в которые вовлечены рецепторы CCR5 хемокинов. В изобретении дополнительно предложен способ лечения воспаления, ревматоидного артрита, волчанки, системной красной волчанки, атеросклероза, рестеноза, иммунных нарушений и отторжения-4 013631 трансплантата у нуждающегося в этом млекопитающего, включающий введение такому млекопитающему терапевтически эффективного количества соединения формулы I. В настоящем изобретении дополнительно предложены способы модуляции активности рецептора хемокинов, включающие контактирование указанного рецептора хемокина с соединением изобретения. В настоящем изобретении дополнительно предложены способы лечения заболевания, связанного с экспрессией или активностью рецептора хемокина у больного, включающие введение больному терапевтически эффективного количества соединения изобретения. Подробное описание Настоящее изобретение относится к соединению формулы I или его фармацевтически приемлемой соли, где-X-Y- выбран из группы, состоящей из -CH2-NH-CO-, -C1-6 алкил-O-С 1-6 алкила-, гетероцикла, содержащего 4-6 атомов в кольце, один из которых представляет гетероатом, такой как N, либо гетероарила,содержащего 5 атомов в кольце, 2 из которых представляют гетероатом, выбранный из N и О;Z выбран из фенила и гетероарила, содержащего 6 атомов в кольце, 1 или 2 из которых представляют гетероатом, такой как N, возможно замещенного R10, где R10 галогеналкил;R1 выбран из фенила и гетероарила, содержащего 5-6 атомов в кольце, и содержащего N в качестве гетероатома или два гетероатома, один из которых N, а другой выбран из N или S, возможно замещенного R1a, где R1a выбран из группы, состоящей из галогена, C1-6 алкила, C1-6 алкокси, С 1-6 алкоксиС 1-6 алкила,гидроксиС 1-6 алкила; аминоС 1-6 алкила, моно- или дизамещенного C1-6 алкилом; моно- или дизамещенногоC1-6 алкилом аминокарбонила; гетероалкилилкарбонила, содержащего 5-6 атомов в кольце, 1 или 2 из которых представляют гетероатом, выбранный из N и О; либо R1 представляет собой R1b-фенил или R1b-гетероарил содержащий 5-6 атомов в кольце, 1 или 2 из которых представляют гетероатом, такой как N, О или S, где R1b выбран из группы, состоящей из Н,гидроксиС 1-6 алкила, карбоксамида;R6 и R7 выбраны из группы, состоящей из Н, С 1-6 алкила (где алкил может быть необязательно прерван О) или гидроксиС 1-6 алкила. В некоторых вариантах осуществления -X-Y- представляет собой гетероарил. В некоторых вариантах осуществления -X-Y- представляет собой гетероцикл. В некоторых вариантах осуществления -X-Y- представляет собой гетероарил, содержащий 5 атомов в кольце, 2 из которых представляют гетероатом, выбранный из N и О. В некоторых вариантах осуществления -X-Y- представляет собой -С 1-6 алкил-O-С 1-6 алкил-. В некоторых вариантах осуществления -X-Y- представляет собой -СН 2-NH-CO-. В некоторых вариантах осуществления -X-Y- представляет собой азетидин, пирролидин, пиперидин, имидазол или 4,5-дигидроизоксазол. В некоторых вариантах осуществления -X-Y- представляет собой -СН 2-O-СН 2-. В некоторых вариантах осуществления Z представляет собой фенил или гетероарил, каждый замещенный R10. В некоторых вариантах осуществления Z представляет собой 6-членный гетероарил, замещенныйR10. В некоторых вариантах осуществления Z представляет собой фенил, пиридил или пиримидинил,каждый замещенный R10. В некоторых вариантах осуществления Z представляет собой фенил, пиридил или пиримидинил,каждый замещенный тригалогеналкилом. В некоторых вариантах осуществления Z представляет собой В некоторых вариантах осуществления Z представляет собой В некоторых вариантах осуществления R1 представляет собой фенил или гетероарил, каждый замещенный 0-3 R1a. В некоторых вариантах осуществления R1 представляет собой фенил, пиридил, пиримидинил, пиридазинил или тиазолил, каждый замещенный 0-3 R1a. В некоторых вариантах осуществления R1 представляет собой фенил или гетероарил, каждый замещенный 0-3 R1a, состоящий из галогена, С 1-6 алкила, C1-6 алкокси, С 1-6 алкоксиС 1-6 алкила, гидроксиС 1-6 алкила, аминоС 1-6 алкила, моно- или дизамещенного C1-6 алкилом; моно- или дизамещенного C1-6 алкилом аминокарбонила; гетероалкилилкарбонила, содержащего 5-6 атомов в кольце, 1 или 2 из которых представляют гетероатом, выбранный из N и О. В некоторых вариантах осуществления R1 представляет собой фенил или гетероарил, каждый замещенный 0-1 R1b-фенилом или R1b-гетероарилом. В некоторых вариантах осуществления R1 представляет собой фенил или гетероарил, каждый замещенный фенилом, пиридилом, пиримидинилом, оксазолилом, тиазолилом или имидазолилом. В некоторых вариантах осуществления R1 представляет собой гетероарил, замещенный фенилом,пиридилом, пиримидинилом, оксазолилом, тиазолилом или имидазолилом. В некоторых вариантах осуществления R1 представляет собой фенил или гетероарил, каждый замещенный 0-1 R1b-фенилом. В некоторых вариантах осуществления R1 представляет собой фенил или гетероарил, каждый замещенный 0-1 R1b-гетероарилом. В некоторых вариантах осуществления R5 представляет собой Н. В некоторых вариантах осуществления R5 представляет собой C1-6 алкил. В некоторых вариантах осуществления R6 и R7 выбраны из группы, состоящей из Н, С 1-6 алкила, где алкил может быть необязательно прерван О, или гидроксиС 1-6 алкила. В некоторых вариантах осуществления R6 и R7 представляет собой Н и другой представляет собой Н, С 1-6 алкил, гидроксиС 1-6 алкил или C1-6 алкоксиалкил. В некоторых вариантах осуществления R6 и R7 оба Н. В некоторых вариантах осуществления соединения -X-Y- представляет собой -CH2-NH-CO-, Z представляет собой фенил, R10 представляет собой CF3, R1 представляет собой пиридил, R1a представляет собой пиримидинил, R5 представляет собой Н, R6 представляет собой Н, R7 представляет собой гидрокси С 1-6 алкил. В некоторых вариантах осуществления соединения -X-Y- представляет собой -CH2-NH-CO-, Z представляет собой фенил, R10 представляет собой CF3, R1 представляет собой пиридил, R1a представляет собой пиримидинил, R5 представляет собой Н, R6 представляет собой Н, R7 представляет собой С 1-6 алкоксиС 1-6 алкил. В некоторых вариантах осуществления -X-Y- представляет собой -СН 2-NH-СО-, -С 1-6 алкил-O-С 1-6 алкил-, гетероцикл или гетероарил, Z представляет собой фенил или гетероарил, замещенный R10, R1 представляет собой арил или гетероарил, каждый замещенный R1a, R5 представляет собой Н, R6 и R7 оба Н. В некоторых вариантах осуществления -X-Y- представляет собой -CH2-NH-CO-; Z представляет собой фенил, пиридил, пиримидинил, каждый замещенный тригалогеналкилом; R1 представляет собой арил или гетероарил, каждый замещенный фенилом, пиридилом, пиримидинилом, оксазолилом, тиазолилом или имидазолилом; R5 представляет собой Н, R6 и R7 оба Н. В некоторых вариантах осуществления -X-Y- представляет собой -CH2-NH-CO-; Z представляет собой фенил замещенный тригалогеналкилом; R1 представляет собой гетероарил, замещенный фенилом,пиридилом, пиримидинилом, оксазолилом, тиазолилом или имидазолилом; R5 представляет собой Н, R6 и R7 оба Н. В предпочтительном варианте осуществления изобретение относится к соединению, которое представляет собой N-[2-3S)-3-[4-гидрокси-4-(5-пиримидин-2-илпиридин-2-ил)циклогексил]аминопирролидин-1-ил)-2-оксоэтил]-3-(трифторметил)бензамид формулы или его фармацевтически приемлемую соль. В некоторых вариантах осуществления соединения выбраны из группы, состоящей изN-2-[(2S,4S)-4-[(4-гидрокси-4-пиридин-2-илциклогексил)амино]-2-(изопропоксиметил)пирролидин-1-ил]-2-оксоэтил-3-(трифторметил)бензамида. В некоторых вариантах осуществления соединения выбраны изN-(2-(3S)-3-[4-гидрокси-4-[5-(1,3-оксазол-2-ил)пиридин-2-ил]циклогексил(метил)амино]пирролидин-1-ил-2-оксоэтил)-3-(трифторметил)бензамида; 1-пиридин-2-ил-4-[(3S)-1-(1-[3-(трифторметил)фенил]пиперидин-4-илкарбонил)пирролидин-3 ил]аминоциклогексанола; 1-(5-пиримидин-2-илпиридин-2-ил)-4-[(3S)-1-(l-[3-(трифторметил)фенил]пиперидин-4 илкарбонил)пирролидин-3-ил]аминоциклогексанола; 1-(5-пиримидин-2-илпиридин-2-ил)-4-[(3S)-1-(l-[3-(трифторметил)фенил]пирролидин-3 илкарбонил)пирролидин-3-ил]аминоциклогексанола; 1-(5-пиримидин-2-илпиридин-2-ил)-4-[(3S)-1-(1-[3-(трифторметил)фенил]азетидин-3 илкарбонил)пирролидин-3-ил]аминоциклогексанола; 1-(5-пиримидин-2-илпиридин-2-ил)-4-[(3S)-1-(1-[6-(трифторметил)пиридин-2-ил]пиперидин-4 илкарбонил)пирролидин-3-ил]аминоциклогексанола; 1-пиридин-2-ил-4-[(3S)-1-(l-[6-(трифторметил)пиридин-2-ил]пиперидин-4-илкарбонил)пирролидин-3-ил]аминоциклогексанола; 1-(6-пиримидин-2-илпиридин-3-ил)-4-[(3S)-1-(1-[6-(трифторметил)пиримидин-4-ил]пиперидин-4 илкарбонил)пирролидин-3-ил]аминоциклогексанола; 1-пиридин-2-ил-4-[(3S)-1-(1-[6-(трифторметил)пиримидин-4-ил]пиперидин-4-илкарбонил)пирролидин-3-ил]аминоциклогексанола; 1-пиридин-2-ил-4-[(3S)-1-(1-[4-(трифторметил)пиридин-2-ил]пиперидин-4-илкарбонил)пирролидин-3-ил]аминоциклогексанола; 1-(5-пиримидин-2-илпиридин-2-ил)-4-[(3S)-1-(1-[4-(трифторметил)пиридин-2-ил]пиперидин-4 илкарбонил)пирролидин-3-ил]аминоциклогексанола; 1-[5-(1,3-оксазол-2-ил)пиридин-2-ил]-4-[(3S)-1-(1-[4-(трифторметил)пиридин-2-ил]пиперидин-4 илкарбонил)пирролидин-3-ил]аминоциклогексанола; 1-(5-пиразин-2-илпиридин-2-ил)-4-[(3S)-1-(1-[4-(трифторметил)пиридин-2-ил]пиперидин-4-ил карбонил)пирролидин-3-ил]аминоциклогексанола; 1-(5-метилпиридин-2-ил)-4-[(3S)-1-(1-[4-(трифторметил)пиридин-2-ил]пиперидин-4-илкарбонил)пирролидин-3-ил]амино циклогексанола; 1-(3,3'-бипиридин-6-ил)-4-[(3S)-1-(1-[4-(трифторметил)пиридин-2-ил]пиперидин-4-илкарбонил) пирролидин-3-ил]аминоциклогексанола; 1-(3,4'-бипиридин-6-ил)-4-[(3S)-1-(1-[4-(трифторметил)пиридин-2-ил]пиперидин-4-илкарбонил) пирролидин-3-ил]аминоциклогексанола; 1-(5-метоксипиридин-2-ил)-4-[(3S)-1-(1-[4-(трифторметил)пиридин-2-ил]пиперидин-4-илкарбонил)пирролидин-3-ил]аминоциклогексанола; 1-[5-(метоксиметил)пиридин-2-ил]-4-[(3S)-1-(1-[4-(трифторметил)пиридин-2-ил]пиперидин-4-ил карбонил)пирролидин-3-ил]аминоциклогексанола; 6-(1-гидрокси-4-[(3S)-1-(1-[4-(трифторметил)пиридин-2-ил]пиперидин-4-илкарбонил)пирролидин-3-ил]аминоциклогексил)никотинамида; 6-(1-гидрокси-4-[(3S)-1-(1-[4-(трифторметил)пиридин-2-ил]пиперидин-4-илкарбонил)пирролидин-3-ил]аминоциклогексил)-N-метилникотинамида; 1-(5-пиримидин-2-илпиридин-2-ил)-4-[(3S)-1-(1-[4-(трифторметил)пиримидин-2-ил]пиперидин-4 илкарбонил)пирролидин-3-ил]аминоциклогексанола; 1-(5-пиримидин-2-илпиридин-2-ил)-4-[(3S)-1-(1-[6-(трифторметил)пиридин-2-ил]пирролидин-3-9 013631 илкарбонил)пирролидин-3-ил]аминоциклогексанола; 1-(5-пиримидин-2-илпиридин-2-ил)-4-[(3S)-1-(1-[5-(трифторметил)пиридин-2-ил]пирролидин-3 илкарбонил)пирролидин-3-ил]аминоциклогексанола; 1-(5-пиримидин-2-илпиридин-2-ил)-4-[(3S)-1-(1-[4-(трифторметил)пиримидин-2-ил]пирролидин 3-илкарбонил)пирролидин-3-ил]аминоциклогексанола; 1-(5-пиримидин-2-илпиридин-2-ил)-4-[(3S)-1-3R)-1-[4-(трифторметил)пиридин-2-ил]пиперидин-3-илкарбонил)пирролидин-3-ил]аминоциклогексанола; 1-(5-пиримидин-2-илпиридин-2-ил)-4-[(3S)-1-3S)-1-[4-(трифторметил)пиридин-2-ил]пиперидин 3-илкарбонил)пирролидин-3-ил]аминоциклогексанола; 1-(5-пиримидин-2-илпиридин-2-ил)-4-[(3S)-1-(1-[4-(трифторметил)пиридин-2-ил]азетидин-3-ил карбонил)пирролидин-3-ил]аминоциклогексанола; 1-(6-пиримидин-2-илпиридин-3-ил)-4-[(3S)-1-(1-[4-(трифторметил)пиридин-2-ил]-1 Н-имидазол-4 илкарбонил)пирролидин-3-ил]аминоциклогексанола; 1-(5-пиримидин-2-илпиридин-2-ил)-4-[(3S)-1-([4-(трифторметил)пиридин-2-ил]метоксиацетил) пирролидин-3-ил]аминоциклогексанола и 1-(5-пиримидин-2-илпиридин-2-ил)-4-[(3S)-1-([4-(трифторметил)-2-фенил]метоксиацетил)пирролидин-3-ил-аминоциклогексанола. Для соединений изобретения, в которых переменная встречается более одного раза, каждая переменная может быть различной частью, выбранной из группы Маркуша, определяющей переменную. Например, когда структура описывается как имеющая две группы R, которые одновременно присутствуют в одном и том же соединении; две группы R могут представлять собой различные части, выбранные из группы Маркуша, определяющей R. Дополнительно принимается во внимание, что определенные признаки изобретения, которые для ясности описаны в контексте отдельных вариантах осуществления, могут быть также представлены в сочетании в одном варианте осуществления. Наоборот, различные признаки изобретения, которые для краткости описаны в контексте одного варианта осуществления, могут предлагаться также отдельно или в любой подходящей подкомбинации. Термин арильные группы предназначен для включения ароматических карбоциклических групп,таких как фенил, бифенилил, инденил, нафтил, а также ароматических карбоциклов, конденсированных с гетероциклом, таких как бензотиенил, бензофуранил, индолил, хинолинил, бензотиазол, бензоксазол,бензимидазол, изохинолинил, изоиндолил, бензотриазол, индазол и акридинил. Термин гетероарил предназначен для включения моно- и полициклических ароматических колец,содержащих от 3 до 20, предпочтительно от 4 до 10 атомов в кольце, по меньшей мере один из которых представляет собой гетероатом, такой как кислород, сера, фосфор или азот. Примеры таких групп включают фурил, тиенил, пирролил, имидазолил, триазолил, тиазолил, тетразолил, оксазолил, изоксазолил,пиразолил, пиридил, пиримидинил, пиразинил, пиридазинил, триазинил, хинолинил, изохинолинил, хиноксалинил, бензотиазолил, бензоксазолил, бензотиенил или бензофурил. Гетероциклы представляют собой неароматические карбоциклические кольца (моно или полициклические), которые имеют в кольце один или более гетероатомов, таких азот, кислород или сера. В некоторых вариантах осуществления кольцо может быть трех-, четырех-, пяти-, шести-, семи- или восьмичленным. В некоторых вариантах осуществления гетероцикл содержит 1, 2 или 3 гетероатома. Гетероциклы могут быть насыщенными или ненасыщенными. В некоторых вариантах осуществления гетероциклы содержат 0, 1 или 2 двойные или тройные связи. Образующие кольцо углеродные атомы и гетероатомы могут также нести оксо или сульфидные заместители (например, СО, CS, SO, SO2, NO и т.д.). Примеры гетероциклов включают тетрагидрофуранил, тетрагидротиофенил, морфолино, тиоморфолино,азетидинил, пирролидинил, пиперазинил, пиперидинил, пиран, диоксан и тиазолидинил. Дополнительно, когда гетероарильные или гетероциклические группы представляют собой гетероциклы, содержащие азот, указанный азот может быть модифицирован, чтобы находиться в форме NO(N-оксиды) и такие оксиды предназначены для включения в объем настоящего изобретения. В случае гетероциклов, содержащих серу, оксиды серы также предназначены для включения в объем настоящего изобретения. Монозамещенный арил относится к арильной группе, имеющей один заместитель. Полизамещенный арил относится к арилу, имеющему 2 или более заместителей (таких как 2-4 заместителя). Монозамещенный гетероарил относится к гетероарильной группе, имеющей один заместитель. Полизамещенный гетероарил относится к гетероарилу, имеющему 2 или более заместителей (таких как 2-4 заместителя). Монозамещенный циклоалкил (или карбоцикл) относится к циклоалкильной группе, имеющей один заместитель. Полизамещенный циклоалкил (или карбоцикл) относится к циклоалкилу, имеющему 2 или более заместителей (таких как 2-4 заместителя). Монозамещенный гетероцикл относится к гетероциклу,имеющему один заместитель. Полизамещенный гетероцикл относится к гетероциклу, имеющему 2 или более заместителей (таких как 2-4 заместителя). Заместители в арильных группах, арилалкильных группах, гетероарильных группах, гетероарилалкильных группах, карбоциклических (циклоалкильных) группах и гетероциклических группах изобрете- 10013631 ния могут быть выбраны из группы, состоящей из галогена, алкила, алкокси, моногалогеналкокси, дигалогеналкокси, тригалогеналкокси, тиоалкила и моногалогеналкила, дигалогеналкила, тригалогеналкила,нитро, амино, карбоксила, этерифицированного карбоксила, карбоксамида, тиокарбоксамидо и циано. Более конкретно заместители могут быть также выбраны из группы, состоящей из трифторметила, С 1-4 алкила, галогена, трифторметокси, фторметокси, дифторметокси, С 1-5 алкокси, С 1-5 алканоила, С 1-5 алканоилокси, С 1-5 алкиламино, ди(С 1-5 алкил)амино, С 1-5 алканоиламино, нитро, карбокси, карбамоила, С 1-5 алкоксикарбонила, С 1-5 тиола, сульфонамидо, карбамоилС 1-5 алкила, N-(С 1-5 алкил)карбамоилС 1-5 алкила, N(С 1-5 алкил)2 карбамоилС 1-5 алкила, гидроксиС 1-5 алкила и С 1-5 алкоксиС 1-4 алкила. Термины гало или галоген сами по себе или как часть другого заместителя означают, если не указано иное, фтор, хлор, бром или йод. Аналогично, термины, такие как галогеналкил, предназначены для включения моногалогеналкила и полигалогеналкила. Например, термин галогеналкил, такой как галоген(C1-C4)алкил, предназначен для включения трифторметила, 2,2,2-трифторэтила, 4-хлорбутила, 3 бромпропила и тому подобное. Термин алкил, используемый самостоятельно, либо как часть, прибавляемая в конце слова, включает структуры с линейной и разветвленной цепями, такие как первичные алкильные группы, вторичные алкильные группы и третичные алкильные группы. Данные группы могут содержать до 15, предпочтительно до 8 и более предпочтительно до 4 углеродных атомов. В некоторых вариантах осуществления алкильная группа представляет собой C1-10, C1-8, C1-6, C1-5, C1-4 или C1-3. Примеры алкильных радикалов включают группы, такие как метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, изобутил и вторбутил. Сходно термины алкенил и алкинил относятся к ненасыщенным структурам с линейной и разветвленной цепями, содержащим, например, от 2 до 12, предпочтительно от 2 до 6 углеродных атомов. В некоторых вариантах осуществления алкенильная или алкинильная группа представляет собой С 2-10, С 2-8,С 2-6, С 2-5, С 2-4 или С 2-3. Примеры алкенильных и алкинильных групп включают винил, 2-пропенил, кротил, 2-изопентенил, 2-(бутадиенил), 2, 4-пентадиенил, 3-(1,4-пентадиенил), этинил, 1- и 3-пропинил, 3 бутинил и более высокие гомологи и изомеры. Аралкил или арилалкил предназначены для обозначения алкильной группы, замещенной арильной группой. Примером арилалкильной группы является бензил. Арилалкенил относится к алкенильной группе, замещенной арилом. Арилалкинил относится к алкинильной группе, замещенной арильной группой. Гетероарилалкенил относится к алкенильной группе, замещенной гетероарилом. Гетероарилалкинил относится к алкинильной группе, замещенной гетероарилом. Гетероциклоалкил или гетероциклический алкил предназначены для обозначения алкильной группы, замещенной гетероциклом. Циклоалкилалкил или гетероциклический алкилалкил предназначены для обозначения алкильной группы, замещенной циклоалкильной группой. Примеры циклоалкилалкильных групп включают (циклогексил)метил, циклопропилметил и тому подобное. Термины алкокси, алкиламино и алкилтио (или тиоалкокси) используются в их традиционном смысле и относятся к тем алкильным группам, которые присоединены к остатку молекулы через атом кислорода, аминогруппу или атом серы, соответственно. Следовательно, такие термины, как алкокси и тиоалкил, включают алкильные части, как указано выше, присоединенные к подходящей функциональной группе. Другие подходящие заместители, которые могут быть использованы во многих углеродных кольцах настоящего изобретения, такие как циклоалифатическое, ароматическое, неароматическое гетероциклическое кольцо или бензильная группа, включают, например, -ОН, галоген (-Br, -Cl, -I и -F), -О (алифатическая группа, замещенная алифатическая группа, бензил, замещенный бензил, фенил, замещенный фенил, ароматическая или замещенная ароматическая группа), -CN, -NO2, -СООН, -NH2, -NH (алифатическая группа, замещенная алифатическая группа, бензил, замещенный бензил, фенил, замещенный фенил,ароматическая или замещенная ароматическая группа), -N (алифатическая группа, замещенная алифатическая группа, бензил, замещенный бензил, фенил, замещенный фенил, ароматическая или замещенная ароматическая группа)2, -COO (алифатическая группа, замещенная алифатическая группа, бензил, замещенный бензил, фенил, замещенный фенил, ароматическая или замещенная ароматическая группа),-CONH2, -CONH (алифатическая группа, замещенная алифатическая группа, бензил, замещенный бензил,фенил, замещенный фенил, ароматическая или замещенная ароматическая группа), -SH,-S (алифатическая группа, замещенная алифатическая группа, бензил, замещенный бензил, фенил, замещенный фенил, ароматическая или замещенная ароматическая группа) и -NH-C=NH-NH2. Замещенное неароматическое гетероциклическое кольцо, бензильная группа или ароматическая группа могут также иметь алифатическую или замещенную алифатическую группу в качестве заместителя. Замещенная алкильная или алифатическая группа может также иметь неароматическое гетероциклическое кольцо, бензил, замещенный бензил, ароматическую или замещенную ароматическую группу в качестве заместителя. Замещенное неароматическое гетероциклическое кольцо может также иметь =O, =S, =NH или =N(алифатическая, ароматическая или замещенная ароматическая группа) в качестве заместителя. Замещенное алифатическое, замещенное ароматическое, замещенное неароматическое гетероциклическое кольцо или замещенная бензильная группа могут иметь более одного заместителя.- 11013631 Для двухвалентных частей, таких как X и Y, термин амидная связь относится к -NHCO-; термин тиамидная связь относится к -NHCS-; термин сульфонамид относится к -NHSO2-; термин кетон относится к -ОС-; термин оксим относится к -C(=N-OH)- и термин мочевина относится к -NHCONH-. Циклический алкокси относится к -О- (циклоалкилу). Гетероциклический алкокси относится к-О-(гетероциклу). Алкоксиалкил относится к алкилу, замещенному алкокси. Циклический алкоксиалкил относится к алкилу, замещенному -О-(циклоалкилом). Гетероциклический алкоксиалкил относится к алкилу, замещенному -О-(гетероциклом). Алкилтиоалкил относится к алкилу, замещенному тиоалкилом. Циклический алкилтиоалкил относится к алкилу, замещенному -S-(циклоалкилом). Гетероциклический алкилтиоалкил относится к алкилу, замещенному -S-(гетероциклом). Моноили дизамещенный амино относится к -NH2, где-либо один (например, моно), либо оба (например, ди) водорода заменены заместителем, таким как C1-8 алкил, ОН, СО-(С 1-4 алкил) и т.д. Моно- или дизамещенный аминоалкил относится к алкилу, замещенному моно или дизамещенным амино. Этерифицированный карбоксил относится к СООН, где атом водорода заменен заместителем, таким как C1-8 алкил,карбоцикл, гетероцикл, арил или гетероарил. Карбоксамидо относится к -CONH2. Моно- или дизамещенный карбоксамид относится к-CONH2, где-либо один (например, моно), либо два (например, ди) водорода заменены заместителем,таким как С 1-8 алкил, ОН, СО-(С 1-4 алкил) и т.д. Карбамат относится к -OCONH2 и моно- или дизамещенный карбамат относится к -OCONH2, где-либо один (например, моно), либо оба (например, ди) водорода заменены заместителем, таким как С 1-8 алкил, ОН, СО- (С 1-4 алкил) и т.д. Сульфонамид относится к -SO2NH2 и моно- или дизамещенный сульфонамид относится к -SO2NH2, где-либо один (например, моно), либо оба (например, ди) водорода заменены заместителем, таким как C1-8 алкил, ОН, СО-(С 14 алкил) и т.д. Алкилсульфонил относится к -SO2-(алкилу). Циклический алкилсульфонил относится к-SO2-(карбоциклу). Гетероциклический сульфонил относится к -SO2-(гетероциклу). Арилсульфонил относится к -SO2-(арилу). Гетероарилсульфонил относится к -SO2-(гетероарилу). Алкилкарбонил относится к -СО-(алкилу). Циклический алкилкарбонил относится к -СО(циклоалкилу). Гетероциклический алкилкарбонил относится к -СО-(гетероциклу). Арилкарбонил относится к -СО-(арилу). Гетероарилкарбонил относится к -CO-(гетероарилу). Тиокарбоксамидо относится к -CSNH2. Ариламинокарбонил относится к -CO-NH-(арилу). Гетероариламинокарбонил относится к -CO-NH-(гетероарилу). Арилкарбоксамидо относится к-CO-NH-(арилу). Гетероарилкарбоксамидо относится к -CO-NH-(гетероарилу). Арилуреидо относится к уреидо,замещенному арилом. Гетероарилуреидо относится к уреидо, замещенному гетероарилом. Арилокси относится к -О(арилу). Гетероарилокси относится к -О-(гетероарилу). Арилалкокси относится к алкокси, замещенному арилом. Гетероарилалкокси относится к алкокси, замещенному гетероарилом. Ариламино относится к -NH-(арилу). Гетероариламино относится к -NH-(гетероарилу). Гидроксилалкил относится к алкилу, замещенному гидроксилом (ОН). Аминокарбонилалкил относится к алкилу, замещенному аминокарбонилом. Моно- или дизамещенный аминокарбонилалкил относится к алкилу, замещенному моно- или дизамещенным аминокарбонилом. Алкилкарбонилалкил относится к алкилу, замещенному алкилкарбонилом. Циклоалкилкарбонилалкил относится к алкилу,замещенному -СО-(циклоалкилом). Гетероциклоалкилкарбонилалкил относится к алкилу, замещенному -CO-(гетероциклом). Алкилкарбониламиноалкил относится к алкилу, замещенному -NH-CO-(алкилом). Циклоалкилкарбониламиноалкил относится к алкилу, замещенному -NH-CO-(циклоалкилом). Гетероциклоалкилкарбониламиноалкил относится к алкилу, замещенному -NH-CO-(гетероциклом). Арилкарбониламиноалкил относится к алкилу, замещенному -NH-CO-(арилом). Гетероарилкарбониламиноалкил относится к алкилу, замещенному -NH-CO-(гетероарилом). Арилсульфониламиноалкил относится к алкилу, замещенному -NH-SO2-(арилом). Гетероарилсульфониламиноалкил относится к алкилу, замещенному -NH-SO2-(гетероарилом). Если специально не указано, то подразумевается, что соединения, представленные указанной выше формулой, включают фармацевтически приемлемые соли. Подразумевается, что термин фармацевтически приемлемые соли включает соли активных соединений, которые получают с относительно нетоксичными кислотами или основаниями, в зависимости от конкретных заместителей, содержащихся в описываемых в данном описании соединениях. Когда соединения настоящего изобретения содержат относительно кислые функциональные группы, аддитивные соли основания могут быть получены взаимодействием нейтральной формы таких соединений с достаточным количеством желаемого основания либо в чистом виде, либо в подходящем инертном растворителе. Примеры фармацевтически приемлемых аддитивных солей основания включают соль натрия, калия, кальция, аммония, органического амина или магния, или сходную соль. Когда соединения настоя- 12013631 щего изобретения содержат относительно основные функциональные группы, аддитивные соли кислоты могут быть получены взаимодействием нейтральной формы таких соединений с достаточным количеством желаемой кислоты либо в чистом виде, либо в подходящем инертном растворителе. Примеры фармацевтически приемлемых аддитивных солей кислоты включают соли, которые являются производными неорганических кислот, таких как хлористо-водородная, бромисто-водородная, азотная, карбоновая, фосфорная, частично нейтрализованные фосфорные кислоты, серная кислота, частично нейтрализованная серная, иодисто-водородная или фосфористая кислоты и тому подобное, а также соли, являющиеся производными относительно нетоксичных органических кислот, подобных уксусной, пропионовой, изомасляной, малеиновой, малоновой, бензойной, янтарной, пробковой, фумаровой, миндальной, фталевой,бензолсульфоновой, п-толилсульфоновой, лимонной, винной, метансульфоновой и тому подобное. Включены также соли аминокислот, такие как аргинат и тому подобное, и соли органических кислот,подобных глюкуроновой или галактуроновой кислотам и тому подобное. Некоторые конкретные соединения настоящего изобретения могут содержать как основные, так и кислые функциональные группы,что позволяет преобразовывать соединения в аддитивные соли либо основания, либо кислоты. Перечень подходящих солей содержится в Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Company,Easton, Pa., 1985, p. 1418 и Journal of Pharmaceutical Science, 66, 2 (1977), каждая из которых включена в данное описание в качестве ссылки во всей своей полноте. Нейтральные формы соединений настоящего изобретения могут быть регенерированы взаимодействием соли с основанием или кислотой и выделения исходного соединения традиционным способом. Исходная форма соединения отличается от различных солевых форм по определенным физическим свойствам, таким как растворимость в полярных растворителях, но в любом другом отношении соли эквивалентны исходной форме соединения для целей настоящего изобретения. Некоторые из соединений настоящего изобретения содержат хиральные или асимметричныеуглеродные атомы (оптические центры) или двойные связи; рацематы, диастереомеры, геометрические изомеры и индивидуальные оптические изомеры, все предназначены для включения в объем настоящего изобретения. Соединения изобретения, включая их соли, гидраты и сольваты, могут быть получены с использованием известных способов органического синтеза и могут быть синтезированы в соответствии с любыми разнообразными возможными путями синтеза. Реакции получения соединений изобретения можно проводить в подходящих растворителях, которые могут быть легко выбраны специалистом в области органического синтеза. Подходящие растворители могут быть по существу инертными к исходным веществам (реагентами), промежуточным соединениям или продуктам при температурах, при которых проводят реакции, например, температурах, которые могут варьироваться от температуры замерзания растворителя до температуры кипения растворителя. Данную реакцию можно проводить в одном растворителе или в смеси из более чем одного растворителя. В зависимости от конкретной стадии реакции могут быть выбраны подходящие растворители для конкретной стадии реакции. Получение соединений изобретения может включать защиту и снятие защиты различных химических групп. Потребность в защите и снятии защиты и выбор подходящих защитных групп могут быть легко определены специалистом в данной области. Химию защитных групп можно найти, например, в(1999), которая включена в данное описание в качестве ссылки во всей своей полноте. Реакции можно отслеживать в соответствии с любым подходящим способом, известным в данной области. Например, образование продукта можно отслеживать с использованием средств спектроскопии,таких как спектроскопия магнитного резонанса (например, 1 Н или 13 С), инфракрасная спектроскопия,спектрофотометрия (например, в УФ-видимой области) или масс-спектрометрия, или с использованием хроматографии, такой как высокоэффективная жидкостная хроматография (ВЭЖХ) или тонкослойная хроматография. Множество 4,4-дизамещенных производных циклогексанона может быть синтезировано с использованием методик, описанных на схемах 1. Соединения формулы 1-2 могут быть получены добавлением арил MgX или ArX/BuLi к 1,4-циклогександиону 1-1. Альтернативно, соединения формулы 1-2 могут быть получены обработкой моноэтиленкеталя 1,4-циклогександиона 1-3 арил MgX, ArX/BuLi или тетраметилпиперидином гетероарилН/лития с последующим преобразованием кеталя 1-4 в кетон с использованием кислоты, такой как HCl, в водном растворе. Производные 4-арилциклогексанона формулы 2-3 могут быть синтезированы в соответствии со способами, показанными на схеме 2. Промежуточные соединения 1-4 подвергают обработке дегидратирующим агентом, таким как тионилхлорид/пиридин, с последующим восстановлением полученного олефина гидрированием с использованием катализатора, такого как Pd-C или PtO2. Преобразование кеталя 2-2 обработкой кислотой дает кетоны формулы 2-3. Схема 2 Альтернативно, соединения формулы 2-3 могут быть синтезированы согласно схеме 3. Восстановление кетона 1-3 с использованием восстанавливающего агента, такого как боргидрид натрия, дает спирт 3-1, который преобразовывают в мезилат 3-2 обработкой метансульфонилхлоридом. Замещение мезилата 3-2 гетероциклом, таким как пиразол, имидазол, триазол или тетразол, дает промежуточное соединение 2-2, которое преобразовывают в соединения формулы 2-3 обработкой кислотой, такой как HCl. Схема 3Ar=замещенный пиразол, имидазол, триазол или тетразол Введение заместителя в ароматическое кольцо кетонов формулы 1-2 или 2-3 может быть осуществлено, исходя из кетального промежуточного соединения 1-4 или 2-2, с применением способов, описанных на схемах 4-8. Когда ароматическое кольцо в 1-4 или 2-2 несет цианогруппу, кеталь 4-1 подвергают гидролизу с использованием основания, такого как гидроксид натрия или калия, с получением карбоновой кислоты 4-2. Сочетание 4-2 с амином с использованием агента сочетания, такого как ВОР, дает амид 4-3. Обработка 4-3 кислотой, такой как HCl, дает кетоны формулы 4-4. Схема 4 Когда ароматическое кольцо кетального промежуточного продукта 1-4 или 2-2 несет галоген, такой как бром или йод, галоген может быть преобразован в заместителе с использованием методик, представленных на схеме 5. Обработка 5-1 бутиллитием с последующим гашением электрофилом, таким как ал- 14013631 килгалогенид, альдегид, кетон, хлорформиат или карбонат, дает R-замещенный кеталь 5-2. Сочетание Сузуки 5-1 с бороновой кислотой ArB(OH)2 (Ar=арил или гетероарил) или сочетание 5-1 с ArZnCl, который может быть получен in situ обработкой ArX (X=Br, I) бутиллитием с последующим гашением хлоридом цинка, или обработкой 5-1 iPrMgCl с последующим сочетанием с ArX (X-Br, I) в присутствии катализатора, такого как Ni(CH3COCH(ОН)СН 3)2-1,2-бис(дифенилфосфино)этан, дает Ar-замещенное кетальное промежуточное соединение 5-4. Обработка 5-2 и 5-4 кислотой дает их соответствующие кетоны 5-3 и 5-5. Схема 5 Альтернативно, кетоны формулы 5-5 могут быть получены с использованием методик, представленных на схеме 6. После преобразования соединения 5-1 в сложный эфир бороновой кислоты, полученный сложный эфир бороновой кислоты 6-1 сочетают с ArX (X=Br, I) с использованием палладиевого катализатора, такого как Pd(PPh3)4 с получением Ar-замещенного кеталя 5-4, из которого получают кетоны формулы 5-5 обработкой кислотой, такой как HCl. Схема 6 Когда группа Ar в кетонах формулы 1-2 или 2-3 представляет собой остаток 2-тиазола, введение заместителя в положение 5 тиазола может быть осуществлено с использованием последовательности, изображенной на схеме 7. Обработка тиазола 7-1 бутиллитием с последующим гашением моноэтиленкеталем 1,4-циклогександиона 1-3 дает третичный спирт 7-2. Обработка спирта 7-2 бутиллитием с последующим гашением аниона 7-3 электрофилом, таким как галогеналкил, альдегид, кетон, хлорформиат или карбонат, дает кеталь 7-4 с заместителем R в положении 5 тиазола. Альтернативно, анион 7-3 может быть погашен хлоридом цинка, и полученное промежуточное соединение сочетают с ArX (X=Br, I) с использованием палладиевого катализатора, такого как PdCl2(PPh3)2, с получением кеталя 7-6 с остатком Ar в положении 5 тиазола. Кетали 7-4 и 7-6 затем преобразовывают в соответствующие кетоны формулы 7-5 и 7-7 обработкой кислотой, такой как HCl. Схема 7 Когда группа Ar в кетонах формулы 1-2 или 2-3 представляет собой остаток 5-тиазола, введение заместителя в положение 2 тиазола может быть осуществлено с использованием последовательности, изображенной на схеме 7. Литиирование защищенного 2-триметилсилилом тиазола 8-1 с последующим га- 15013631 шением 1-3 дает промежуточное соединение 8-2. После удаления триметилсилильной группы с использованием TBAF литиирование 8-3 с последующим гашением электрофилом, таким как галогеналкил,альдегид, кетон, изоцианат, хлорформиат или карбонат, дает 5-R-замещенное производное тиазола 8-4. Обработка соединения 8-4 кислотой, такой как HCl, дает кетоны формулы 8-5. Схема 8 Множество 3-аминопирролидиновых промежуточных соединений может быть получено, как показано на схемах 6-17. Сочетание карбоновой кислоты формулы 9-1 с коммерчески доступными производным пирролидина формулы 9-2 с использованием агента сочетания, такого как ВОР, дает амид 9-3. Удаление защитной группы Р (Р=Вос, бензил или Cbz) с использованием кислоты, такой как ТФУ или HCl,или гидрироанием с использованием палладиевого катализатора дает пирролидиновые промежуточные соединения формулы 9-4. Схема 9 4-амино-2-метипирролидиновые производные формулы 10-8 могут быть получены с использованием последовательности, описанной на схеме 10. После защиты амина с использованием Boc и защиты гидроксила с использованием TBS метилового эфира транс-4-гидрокси-L-пролина 10-1 сложный эфир 10-2 восстанавливают до спирта и полученный спирт преобразовывают в тозилат. Удаление тозилатной группы в соединении 10-3 может быть достигнуто восстановлением с использованием триэтилборгидрида лития (LiEt3BH) . Полученное промежуточное соединение 10-4 подвергают снятию защиты с использованием кислоты, такой как HCl, для удаления групп Вос и TBS. После сочетания полученного амина 10-5 с карбоновой кислотой формулы 9-1 с использованием агента сочетания, такого как EDC, за преобразованием гидроксила в мезилат следует замещение азидом натрия. Полученную азидную группу затем восстанавливают до амина гидрированием с получением пирролидиновых промежуточных соединений формулы 10-8. Схема 10- 16013631 4-Аминопирролидиновые производные формулы 11-6 могут быть получены согласно схеме 11. Алкилирование промежуточного продукта 10-2 галогеналкилом (RX) с использованием LHMDS дает Rзамещенное промежуточное соединение 11-1. После восстановления сложного эфира до спирта с использованием гидрида диизобутилалюминия (DIBAL) спирт преобразовывают в тозилат и полученный тозилат восстанавливают с использованием LiEt3BH с получением соединения 11-2. Промежуточное соединение 11-2 затем преобразовывают в соединения формулы 11-6 способом, аналогично представленному на схеме 10. Схема 11 4-Аминопирролидиновые производные формулы 12-5 могут быть синтезированы с применением способа, показанного на схеме 12. Промежуточное соединение 10-2 восстанавливают до спирта с использованием восстанавливающего агента, такого как DIBAL, и полученный спирт алкилируют галогеналкилом (RX) с использованием гидрида натрия с получением промежуточного соединения 12-1. С использованием методик, аналогично представленным на схеме 10, получают соединения формулы 12-5 из промежуточного соединения 12-1. Схема 12 4-Аминопирролидиновые производные формулы 13-7 могут быть получены согласно схеме 13. Промежуточное соединение 10-2 восстанавливают до спирта с использованием восстанавливающего агента, такого как DIBAL, и полученный спирт окисляют до альдегида с использованием окисляющего агента, такого как при окислении по Сверну. Добавление реактива Гриньяра RMgX к альдегиду 13-1 сопровождается алкилированием полученного спирта галогеналкилом (RX) с использованием гидрида натрия. После удаления защитных групп Вос и TBS в соединении 13-2 или 13-3 с использованием кислоты,такой как HCl, полученный амин 13-4 конденсируют с карбоновой кислотой формулы 9-1. Мезилирование по 4-гидроксилу пирролидина с последующей заменой полученного мезилата азидом натрия и восстановлением азидогруппы гидрироанием дает соединения формулы 13-7. 4-Аминолирролидиновые производные формулы 14-6 могут быть синтезированы с использованием методики, представленной на схеме 14. После двойного присоединения реактива Гриньяра RMgX к промежуточному соединению 10-2 полученный третичный спирт 14-1 подвергают алкилированию галогеналкилом (R'X) с получением 14-2. Промежуточные соединения 14-1 и 14-2 затем преобразовывают в соединения формулы 14-6 способом, аналогично представленному на схеме 13. Схема 14 Синтез 4-аминопирролидиновых производных формулы 15-5 представлен на схеме 15. После дегидрирования промежуточного соединения 14-1 с последующим восстановлением олефина гидрированием полученное промежуточное соединение 15-1 преобразовывают в соединения формулы 15-5 способом,аналогично представленному на схеме 10. Схема 15- 18013631 Соединения формулы I могут быть получены присоединением аминопирролидиновых производных формулы 16-1 к кетону формулы 16-2 путем восстановительного аминирования с использованием восстанавливающего агента, такого как триацетоборгидрид натрия или гидрированием с последующей обработкой полученного вторичного амина 16-3 посредством восстановительного аминирования альдегидом, или путем алкилирования галогеналкилом (RX). Схема 16 Альтернативно, соединения формулы I могут быть получены с использованием последовательности, представленной на схеме 17. Восстановительное аминирование аминопирролидиновых производных формулы 17-1 кетоном формулы 16-2 дает вторичный амин 17-2. После удаления защитной группы Р(Р=Вос, бензил или Cbz) с использованием кислоты или посредством гидрирования с использованием катализатора, такого как Pd-C, полученный амин 17-3 конденсируют с карбоновой кислотой формулы 91 с получением соединений формулы 17-4. Схема 17 Альтернативно, соединения формулы I могут быть получены с использованием последовательности, описанной на схеме 18. Восстановление циклогексанона 1-2 восстанавливающим агентом, таким как алюмогидрид лития, дает цис диол 18-1. После преобразования вторичного спирта в мезилат полученный мезилат 18-2 заменяют аминопирролидиновым производным формулы 17-1 с получением транс 4-амино 1-циклогексанольного производного формулы 18-3. Удаление защитной группы с использованием кислоты или посредством гидрирования с последующим сочетанием полученного амина с карбоновой кислотой формулы 9-1 дает соединения формулы 18-5. Схема 18- 19013631 Альтернативно, соединения формулы I могут быть синтезированы согласно схеме 19. Замена мезилата 18-2 азидом натрия дает азидное промежуточное соединение 19-1, которое восстанавливают до амина гидрироанием с использованием катализатора, такого как Pd-C. Замена мезилата формулы 19-3 полученным амином 19-2 или восстановительное аминирование 19-2 кетоном формулы 19-4 дает соединения формулы 19-5. Схема 19 Соединения настоящего изобретения являются модуляторами рецептора МСР-1, например, антагонистами, и способны ингибировать связывание МСР-1 с его рецептором. Неожиданно оказалось, что соединения блокируют миграцию Т-клеток in vitro и оказывают сильное действие на рекрутирование клеток воспаления на множестве моделей воспалительных заболеваний. Следовательно, соединения формулы I являются полезными в качестве агентов для лечения воспалительных заболеваний, в особенности тех, которые ассоциированы с аккумуляцией лимфоцитов и/или моноцитов, таких как артрит, ревматоидный артрит, рассеянный склероз, невропатическая боль, атеросклероз и отторжение трансплантата. Кроме того, эти соединения могут быть полезны для лечения нарушений аллергической гиперчувствительности, таких как астма и аллергический ринит, характеризуемых активацией базофилов и рекрутированием эозинофилов, а также для лечения рестеноза и хронических или острых иммунных нарушений. Модуляция активности хемокинового рецептора, как это использовано в контексте настоящего изобретения, подразумевает включение антагонизма, агонизма, частичного антагонизма и/или частичного агонизма активности, ассоциированной с конкретным хемокиновым рецептором, предпочтительно рецептором CCR2. Используемый в данном описании термин композиция предназначен для включения продукта, включающего описанные ингредиенты в описанных количествах, а также любого продукта,который образуется прямо или косвенно из сочетания описанных ингредиентов в описанных количествах. Фармацевтически приемлемый означает, что носитель, разбавитель или эксципиент должен быть совместим с другими ингредиентами состава и не быть вредным для их реципиента. Соединения формулы I настоящего изобретения и их композиции полезны для модуляции активности хемокинового рецептора, в особенности CCR2. Соответственно, соединениями настоящего изобретения являются соединения, которые ингибируют по меньшей мере одну функцию или свойство белка млекопитающих CCR2, например, белка CCR2 человека. Способность соединения ингибировать такую функцию может быть продемонстрирована при анализе связывания (например, связывания лиганда или связывания с промотором), анализе проведения сигнала (например, активации G-белка млекопитающих,индукции быстрого и кратковременного увеличения концентрации свободного кальция в цитозоле) и/или анализе клеточного ответа (например, стимуляции хемотаксиса, экзоцитоза или секреции медиаторов воспаления лейкоцитами). Изобретение иллюстрируется следующими примерами, которые ни коим образом не предназначены для его ограничения. Примеры Используемые ниже реактивы и растворители могут быть получены из коммерческих источников,таких как Aldrich Chemical Co. (Milwaukee, Wis., USA). Результаты масс-спектрометрии представлены в виде отношения массы к заряду с последующим указанием на вид каждого иона (в скобках). В таблицах представлена единственная величина m/e для М+Н (или, если это отмечено, М-Н) иона, содержащего наиболее распространенные изотопы атомов. Во всех случаях характер распределения изотопов соответствует ожидаемой формуле. Пример 1. Стадия А.- 20013631 К быстро перемешиваемому раствору глицина (15,014 г, 0,20 моль) в MeCN (400 мл) и 2 М NaOH(250 мл) при 0 С медленно добавляли раствор 3-(трифторметил)бензоилхлорида (41,714 г, 0,20 моль) в 75 мл MeCN в течение 30 мин. Мутный желтый раствор перемешивали при 0 С в течение 30 мин. Реакционную смесь подкисляли с использованием 3 М HCl до рН=3 с последующим удалением MeCN на роторном испарителе. Полученную смесь затем экстрагировали EtOAc (400 мл х 3). Объединенные органические слои сушили, фильтровали и концентрировали с получением светло-желтого твердого вещества(48,53 г), которое растирали с толуолом (500 мл). После фильтрования твердый продукт промывали холодным толуолом до обесцвечивания фильтрата. После сушки в высоком вакууме в течение выходных дней получали белый порошковый продукт: 44,60 г (90%). МС (М+Н+)=248,1. 1 Н ЯМР (ДМСО-d6)12,70 трет-Бутил[(3S)-1-([3-(трифторметил)бензоил]аминоацетил)пирролидин-3-ил]карбамат. К раствору карбоновой кислоты (2,7 г, 11 ммоль) со стадии А и трет-бутил-(3S)пирролидин-3 илкарбамата (2,0 г, 11 ммоль) в ДМФА (30 мл), охлажденному на ледяной бане, добавляли ВОР (5 г, 11 ммоль) и затем триэтиламин (3 мл, 22 ммоль). Смеси давали нагреться до температуры и перемешивали в течение ночи. Добавляли этилацетат (150 мл). Полученный раствор промывали NaHCO3 и насыщенным раствором соли, каждым три раза, сушили над MgSO4 и концентрировали. Хроматография на силикагеле при элюировании EtOAc давала 4,4 г (96%) желаемого продукта. МС (М-Вос+Н)+ 316. Стадия С.N-2-[(3S)-3-Аминопирролидин-1-ил]-2-оксоэтил-3-(трифторметил)бензамид. Указанный выше продукт (4,2 г) растворяли в смеси 4 н. HCl/диоксан (30 мл). После перемешивания в течение 1 ч при комнатной температуре раствор концентрировали с получением 4,0 г указанного в заголовке соединения. МС(М+Н)+ 316. Стадия D. 8-Фенил-1,4-диоксаспиро[4.5]декан-8-ол. К раствору 1,4-циклогексанонмоноэтиленкеталя (8,1 г, 50 ммоль) в ТГФ (20 мл) при 10 С добавляли 1 М раствор фенилмагнийбромид а в ТГФ (70 мл, 70 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 ч перед гашением насыщенным раствором NH4Cl. Раствор экстрагировали EtOAc 3 раза. Объединенную органическую фазу промывали насыщенным раствором соли, сушили над MgSO4 и концентрировали. Хроматография на силикагеле при элюировании смесью 40% 4-Гидрокси-4-фенилциклогексанон. Указанный выше продукт растворяли в ТГФ (50 мл). К нему добавляли смесь 10% HCl/H2O (50 мл). Раствор перемешивали при комнатной температуре в течение ночи и экстрагировали EtOAc три раза. Объединенные экстракты промывали насыщенным раствором соли, сушили над MgSO4 и концентрировали с получением указанного в заголовке соединения в виде белого твердого вещества. МС (М+Н)+ 191. Стадия F.N-(2-(3S)-3-[(4-Гидрокси-4-фенилциклогексил)амино]пирролидин-1-ил-2-оксоэтил)-3(трифторметил)бензамид. К раствору пирролидинового промежуточного продукта со стадии С (0,3 г, 0,85 ммоль) и кетона со стадии Е (0,16 г, 0,85 ммоль) в ТГФ (5 мл) добавляли Na(OAc)3BH (0,35 г, 2,5 ммоль) и затем триэтила- 21013631 мин (0,2 мл, 1,5 ммоль). Реакцию проводили при комнатной температуре в течение ночи и гасили добавлением насыщенного раствора NaHCO3. Полученный раствор экстрагировали EtOAc, слой EtOAc сушили над MgSO4 и концентрировали. Разделение на силикагеле при элюировании смесью от 10 до 30% 8-Пиридин-2-ил-1,4-диоксаспиро[4.5]декан-8-ол. К раствору 2-бромпиридина (14 г, 88,6 ммоль) в безводном эфире (300 мл), охлажденному при 78 С, медленно добавляли раствор 2,5 М н-бутиллития (36 мл). После добавления перемешивание продолжали при -78 С в течение 1 ч. Затем медленно добавляли раствор 1,4-циклогександионмоноэтиленкеталя (15 г, 96 ммоль) в безводном эфире (300 мл). После завершения добавления смеси давали нагреться до 0 С и перемешивание продолжали в течение 1 ч. Реакцию гасили добавлением водного раствора (100 мл) хлорида аммония (4,5 г). Органическую фазу отделяли, и водную фазу экстрагировали метиленхлоридом 4 раза. Объединенные органические фазы сушили над MgSO4 и концентрировали. Кристаллизация из EtOAc давала 7 г желаемого продукта. Маточную жидкость очищали на силикагеле при элюировании смесью 10% MeOH/EtOAc с получением 3 г желаемого продукта. МС(М+Н)+ 236,0. Стадия В. 4-Гидрокси-4-(пиридин-2-ил)циклогексанон. Указанный выше продукт растворяли в ТГФ (30 мл) и 3 н. растворе HCl в воде (30 мл). Смесь перемешивали при 50 С в течение 3 ч. После охлаждения до комнатной температуры к раствору добавлялиNaHCO3 при перемешивании до прекращения образования пузырьков. Органическую фазу отделяли и водный слой экстрагировали EtOAc три раза. Объединенную органическую фазу сушили над MgSO4 и концентрировали. Остаток растирали с EtOAc с получением 5,5 г указанного в заголовке соединения. МС(М+Н)+ 192. Стадия С.N- (2- (3S) -3- [ (4-Гидрокси-4-пиридин-2-илциклогексил) амино]пирролидин-1-ил -2-оксоэтил) 3-(трифторметил)бензамид. Указанное в заголовке соединение получали восстановительным аминированием кетона, полученного выше, производным пирролидина, полученным на стадии С примера 1, с использованием методики, аналогично описанной для стадии F, пример 1. МС(М+Н)+ 491. Пример 3.N-(2-(3S)-3-[(4-Гидрокси-4-пиридин-2-илциклогексил)(метил)амино]пирролидин-1-ил-2 оксоэтил)-3-(трифторметил)бензамид. К раствору N-(2-(3S)-3-[(4-гидрокси-4-пиридин-2-илциклогексил)амино]пирролидин-1-ил-2 оксоэтил)-3-(трифторметил)бензамида (49 мг, 0,1 ммоль) и формальдегида (0,3 мл, 37% водный раствор) в ТГФ (2 мл) добавляли Na(OAc)3BH (64 мг, 0,3 ммоль). После перемешивания при комнатной температуре в течение ночи реакцию гасили добавлением насыщенного раствора NaHCO3. Полученный раствор экстрагировали EtOAc, слой EtOAc сушили (MgSO4) и концентрировали. Очистка препаративной ВЭЖХ давала указанное в заголовке соединение в виде соли ТФУ. МС(М+Н)+ 505. Пример 4. Стадия А. 2-Бром-5-бромметилпиридин. 2-Бром-5-метилпиридин (5,00 г, 29,1 ммоль) и N-бромсукцинимид (5,22 г, 29,3 ммоль) растворяли в четыреххлористом углероде (40 мл) в атмосфере азота. Добавляли бензоилпероксид (0,35 г, 1,4 ммоль) и смесь кипятили с обратным холодильником в течение 4 ч. Смесь охлаждали до комнатной температуры,фильтровали и промывали NaHCO3/Н 2 О. Смесь адсорбировали на силикагель и затем хроматографиро- 22013631 вали при элюировании градиентом от гексана до смеси 10% этилацетат/гексан. Очищенные фракции объединяли и концентрировали с получением желаемого монобромированного продукта в виде бледножелтого твердого вещества, 3,60 г (49%). ЖХ/МС (М+Н)+ m/z=249,8, 251,8, 253,8. Стадия В. 2-Бром-5-(метоксиметил)пиридин. 2-Бром-5-бромметилпиридин, 4 (3,58 г, 14,3 ммоль) растворяли метаноле (20 мл) в атмосфере азота. Добавляли метоксид натрия (0,89 г, 15,7 ммоль, 95%) и смесь перемешивали при комнатной температуре. Спустя 3 ч метанол удаляли на роторном испарителе и остаток растворяли в дихлорметане и промывали водой. Органический экстракт адсорбировали на силикагель и хроматографировали. Колонку элюировали градиентом от гексана до смеси 20% этилацетат/гексан. Очищенные фракции объединяли и концентрировали с получением указанного в заголовке соединения в виде бесцветного масла, 2,62 г (90%). ЖХ/МС (М+Н)+ m/z=202,0. Стадия С. 4-Гидрокси-4-[5-(метоксиметил)пиридин-2-ил]циклогексанон. Раствор 2-бром-5-(метоксиметил) пиридина (2,61 г, 12,9 ммоль) растворяли в безводном ТГФ (40 мл) в атмосфере азота и охлаждали до -78 С. По каплям добавляли н-бутиллитий (6,20 мл, 15,5 ммоль,2,5 М в гексане) в течение 10 мин с образованием черного раствора. Через 15 мин по каплям добавляли раствор 1,4-диоксаспиро[4.5]декан-8-она (2,21 г, 14,1 ммоль) в ТГФ в течение 2 мин, и смесь постепенно нагревали до комнатной температуры в течение 3 ч. ТСХ (смесь 50% этилацетат/гексан) и ЖХ/МС показали полное преобразование. Добавляли водную HCl (14 мл, 6,0 М), смесь перемешивали в течение 3 ч при комнатной температуре и затем нейтрализовали NaHCO3/H2O. Смесь экстрагировали 3 раза этилацетатом, объединенные экстракты адсорбировали на силикагеле и хроматографировали. Колонку элюировали градиентом от гексана до смеси 40% этилацетат/гексан. Очищенные фракции объединяли и концентрировали с получением указанного в заголовке соединения в виде бледно-желтого твердого вещества,1,00 г (33%). ЖХ/МС (М+Н)+ m/z=236,l. Стадия D.N-2-[(3S)-3-(4-Гидрокси-4-[5-(метоксиметил)пиридин-2-ил]циклогексиламино)пирролидин-1 ил]-2-оксоэтил-3-(трифторметил)бензамид. Указанное в заголовке соединение получали из кетона со стадии С с использованием методики,аналогично описанной в примере 1. МС(М+Н)+ 535. Пример 5. Стадия А. 6-Бром-пиридин-3-карбальдегид. 2,5-Дибромпиридин 9,48 г (40 ммоль) растворяли в 60 мл ТГФ и 150 мл безводного эфира. После охлаждения раствора до -78 С медленно по каплям добавляли 16 мл н-бутиллития (2,5 М, 40 ммоль) с помощью шприца в течение 30 мин. После перемешивания при -78 С в течение 30 мин добавляли N,Nдиметилформамид (3,5 г, 48 ммоль). Реакционную смесь нагревали до комнатной температуры в течение двух часов и затем гасили добавлением 10 мл воды. Смесь экстрагировали дважды EtOAc. Объединенные экстракты сушили и концентрировали. После колоночной флэш-хроматографии с использованием 30-40% EtOAc в гексане получали 2,80 г белого твердого вещества (выход 28%), МС: (М+Н)+ 186,0,188,0. Стадия В. 1-(6-Бромпиридин-3-ил)-N,N-диметилметанамин. К раствору тетраизопропоксида титана (6,4 г, 22 ммоль) и 2,0 М диметиламина в метаноле (22 мл, 44- 23013631 ммоль) добавляли 6-бром-пиридин-3-карбальдегид (2,10 г, 11 ммоль) в 20 мл метанола. После перемешивания при комнатной температуре в течение 5 ч добавляли боргидрид натрия (0,43 г, 11 ммоль) и смесь перемешивали в течение ночи. Реакцию гасили добавлением 10 мл воды и экстрагировали дваждыEtOAc. Объединенные экстракты сушили и концентрировали. После колоночной флэш-хроматографии с использованием 20-40% метанола в EtOAc и 0,5% NH4OH получали 1,15 г масла (выход 47%), МС: 8-5-[(Диметиламино)метил]пиридин-2-ил-1,4-диоксаспиро[4,5]декан-8-ол. 1-(6-Бромпиридин-3-ил)-N,N-диметилметанамин (1,15 г, 5,4 ммоль) растворяли в 30 мл ТГФ и 80 мл безводного эфира. После охлаждения раствора до -78 С медленно по каплям добавляли с помощью шприца 2,60 мл н-бутиллития (2,5 М, 6,40 ммоль) в течение 10 мин. После перемешивания при -78 С в течение 30 мин добавляли 1,4-циклогександионмоноэтиленкеталь (1,01 г, 6,4 ммоль). Реакционной смеси давали нагреться до комнатной температуры в течение двух часов и затем гасили добавлением 10 мл воды. Смесь экстрагировали дважды EtOAc. Объединенные экстракты сушили и концентрировали. После колоночной флэш-хроматографии с использованием 20-40% метанола в EtOAc и 0,5% NH4OH получали 0,85 г масла (выход 54%), МС: (М+Н)+ 293,2. Стадия D. 4-5-[(Диметиламино)метил]пиридин-2-ил-4-гидроксициклогексанон. 8-5-[(Диметиламино)метил]пиридин-2-ил-1,4-диоксаспиро[4,5]декан-8-ол (0,85 г, 2,9 ммоль) растворяли в 10 мл ТГФ и добавляли 10 мл 2 н раствора HCl. После перемешивания в течение 2 ч реакционную смесь нейтрализовали до рН 8-9 добавлением насыщенного водного раствора NaHCO3 и экстрагировали дважды EtOAc. Объединенные экстракты сушили и концентрировали с получением 0,37 г белого твердого вещества (выход 51%), МС: (М+Н)+ 249,2. Стадия Е.N-(2-(3S)-3-[(4-5-[(Диметиламино)метил]пиридин-2-ил-4-гидроксициклогексил)амино]пирролидин-1-ил-2-оксоэтил)-3-(трифторметил)бензамид. Указанное в заголовке соединение получали из указанного выше кетона в соответствии с методикой, описанной в примере 1. МС (М+Н)+ 548. Следующие соединения примеров 6-13 получали аналогично предшествующему примеру 5. Пример 6.-78 С в течение 1 ч к раствору литиированного соединения с помощью шприца добавляли раствор 1,4 циклогександионмоноэтиленкеталя (1,84 г, 11,75 ммоль) в ТГФ (10 мл) и перемешивали в течение 3 ч при -78 С. Добавляли воду (5 мл), реакционную смесь нагревали до комнатной температуры и экстрагировали EtOAc (3). Объединенные органические слои сушили (MgSO4), фильтровали, концентрировали в вакууме и хроматографировали с получением 2,531 г 8-(1,3-тиазол-2-ил)-1,4-диоксаспиро[4.5]декан-8 ола с выходом 89%. MC(EI) (М+Н)+=242,2. Стадия В. 8-(5-Метил-1,3-тиазол-2-ил)-1,4-диоксаспиро[4.5]декан-8-ол. Раствор н-бутиллития (5,70 мл 1,6 М раствора в гексане, 9,12 ммоль) добавляли к 8-(1,3-тиазол-2- 25013631 ил)-1,4-диоксаспиро[4.5]декан-8-олу (1,00 г, 4,14 ммоль) в ТГФ (10 мл) при -78 С при перемешивании в атмосфере N2. После перемешивания при -78 С в течение 1 ч к раствору литиированного соединения с помощью шприца при -78 С добавляли метилйодид (0,71 мл, 9,12 ммоль). Реакционной смеси давали медленно нагреться до комнатной температуры и перемешивали в течение ночи. Добавляли воду иEtOAc. Водный слой экстрагировали EtOAc (3). Объединенные органические слои промывали насыщенным NaCl, сушили (MgSO4), концентрировали и подвергали флэш-хроматографии с использованием смеси 20% EtOAc/гексан с получением 0,77 г указанного в заголовке соединения с выходом 71%. МС(EI) 4-Гидрокси-4-(5-метил-1,3-тиазол-2-ил)циклогексанон. Раствор 8-(5-Метил-1,3-тиазол-2-ил)-1,4-диоксаспиро[4.5]декан-8-ола (1,0 г, 4,14 ммоль) в 20 мл смеси ТГФ/3 н. HCl (1:1) перемешивали в течение 1 ч при 50 С. После охлаждения до комнатной температуры смесь обрабатывали Na2CO3 до рН 8 и экстрагировали EtOAc (3). Объединенные органические слои промывали насыщенным раствором NaCl, сушили (MgSO4) и концентрировали с получением 0,82 г 4-гидрокси-4-(5-метил-1,3-тиазол-2-ил)циклогексанона с выходом 99%. MC (EI) (M+H)+=212, 2. Стадия D. 3-(Трифторметил)-N-[2-3S)-3-[4-гидрокси-4-(5-метил-1,3-тиазол-2-ил)циклогексил]аминопирролидин-1-ил)-2-оксоэтил]бензамид. Указанное в заголовке соединение получали из кетона со стадии С с использованием методики, аналогично описанной в примере 1. МС(EI): (М+Н)+ 511,1. Следующие соединения примеров 15-16 получали аналогично примеру 14. Пример 15. 2-(8-Гидрокси-1,4-диоксаспиро[4.5]дец-8-ил)-1,3-тиазол-4-карбоновая кислота. Раствор н-бутиллития (17,1 мл 1, 6 М раствора в гексане, 27,35 ммоль) добавляли к 8-(1,3-тиазол-2 ил)-1,4-диоксаспиро [4.5]декан-8-олу (3,00 г, 12,43 ммоль) в ТГФ (50 мл) при -78 С при перемешивании в атмосфере N2. После перемешивания при -78 С в течение 1 ч к раствору литиированного соединения добавляли сухой лед (10 г, 227 ммоль) и перемешивали в течение 2 ч при -78 С. Добавляли воду, и раствор нагревали до комнатной температуры. Смесь затем обрабатывали 1 н. HCl до рН от 3 до 4 и экстрагировали EtOAc (3). Объединенные органические слои промывали насыщенным раствором NaCl, сушили (MgSO4), концентрировали и хроматографировали (от EtOAc до смеси 1% AcOH/EtOAc) с получением 3,23 г 2-(8-гидрокси-1,4-диоксаспиро[4.5]дец-8-ил)-1,3-тиазол-4-карбоновой кислоты. МС (EI)Et3N (0,5 мл, 3,6 ммоль) и затем EDC (0,242 г, 1,262 ммоль) и HOBt (0,193 г, 1,26 ммоль). Смесь перемешивали при комнатной температуре в течение ночи. Затем реакционную смесь разбавляли EtOAc и промывали насыщенным Na2CO3 и насыщенным раствором соли. Органический слой сушили (MgSO4), концентрировали и подвергали флэш-хроматографии (смесь 50% EtOAc/гексаны) с получением 0,16 г указанного в заголовке соединения с выходом 50%. MC (EI) (М+Н)+=299, 0. Стадия С. 2-(1-Гидрокси-4-оксоциклогексил) -N-метил-1,3-тиазол-4-карбоксамид. Указанное в заголовке соединение получали преобразованием кеталя со стадии В в кетон с использованием способа, аналогично описанному для стадии С примера 14. MC (EI) (М+Н)+=255,0. Стадия D. 2-(1-Гидрокси-4-[(3S)-1-([3-(трифторметил)бензоил]аминоацетил)пирролидин-3-ил]аминоциклогексил)-N-метил-1,3-тиазол-5-карбоксамид. Указанное в заголовке соединение получали из кетона со стадии С с использованием способа, описанного в примере 1. МС (EI): (М+Н)+ 553. Следующие соединения примеров 18-19 получали способом, аналогично примеру 17. Пример 18. 8-(1,3-Тиазол-5-ил)-1,4-диоксаспиро[4,5]декан-8-ол. 2-TMS-тиазол (2,5 г, 15,89 ммоль) добавляли к раствору н-бутиллития (11,9 мл 1,6 М раствора в гексане, 19, 07 ммоль) в ТГФ (20 мл) при -78 С при перемешивании в атмосфере N2. После перемешивания при -78 С в течение 0,5 ч к раствору литиированного соединения добавляли раствор 1,4 циклогександионмоноэтиленкеталя (2,48 г, 15,89 ммоль) в ТГФ (20 мл) с помощью шприца и перемешивали в течение 1 ч при -78 С. Добавляли воду (5 мл) и EtOAc, реакционную смесь нагревали до комнатной температуры и экстрагировали EtOAc (3). Объединенные органические слои сушили (MgSO4),- 27013631 фильтровали и кристаллизовали из EtOAc с получением 3,4 г 8-(1,3-тиазол-5-ил)-1,4-диоксаспиро 4-Гидрокси-4-[2-(морфолин-4-илкарбонил)-1,3-тиазол-5-ил]циклогексанон. Раствор н-бутиллития (2,90 мл 1, 6 М в гексане, 4,64 ммоль) добавляли к 8-(1,3-тиазол-5-ил)-1,4 диоксаспиро[4,5]декан-8-олу (1,00 г, 4,10 ммоль) в ТГФ (20 мл) при -78 С в атмосфере N2. После перемешивания при -78 С в течение 1 ч к раствору литиированного соединения добавляли 4-морфолинкарбонилхлорид (0,93 г, 6,15 ммоль) с помощью шприца и перемешивали в течение 2 ч при-78 С. Добавляли воду (5 мл) и реакционную смесь нагревали до комнатной температуры. Реакционную смесь разбавляли водой и EtOAc. Водный слой экстрагировали EtOAc (3). Объединенные органические слои промывали насыщенным раствором соли, сушили (Na2SO4) и концентрировали с получением кетального промежуточного соединения. Затем промежуточное соединение обрабатывали 20 мл смеси ТГФ/1 н. HCl (1:1) в течение ночи при комнатной температуре. Реакционный раствор доводили до рН 10 с использованием Na2CO3 и экстрагировали EtOAc (3). Объединенные органические слои промывали насыщенным раствором соли, сушили (Na2SO4), концентрировали и подвергали флэш-хроматографии с использованием смеси 2 0% EtOAc/гексаны с получением 309 мг указанного в заголовке соединения. MC 3-(Трифторметил)-N-2-[(3S)-3-(4-гидрокси-4-[2-(метоксиметил)-1,3-тиазол-5-ил]циклогексил амино)пирролидин-1-ил]-2-оксоэтилбензамид. Указанное в заголовке соединение получали из кетона со стадии В с использованием способов, аналогично описанным в примере 14. MC(EI): (M+H)+ 541,1. Следующие соединения примеров 21-23 получали способом, аналогично примеру 20. Пример 21.(1,0 г, 4,15 ммоль) в ТГФ (20 мл) при -78 С при перемешивании в атмосфере N2. После перемешивания при -78 С в течение 0,5 ч добавляли 12,5 мл 0,5 М раствора ZnCl2 (6,23 ммоль) в ТГФ. Полученную смесь перемешивали при комнатной температуре в течение 0,5 ч и добавляли смесь 3-бромпиридина (0,40 мл,4,15 ммоль) и PdCl2(PPh3)2 (0,11 г, 0,16 ммоль) в 5 мл ТГФ с помощью шприца. После кипячения с обратным холодильником в течение ночи реакцию гасили 10 мл насыщенного раствора NH4Cl. Водный слой экстрагировали EtOAc (3) . Объединенные органические слои сушили (MgSO4), фильтровали, концентрировали в вакууме и хроматографировали с получением 0,68 г указанного в заголовке соединения с выходом 52%. MC (EI) вычислено: (М+Н)+=319,1; найдено: 319,1. Стадия В.N-[2-(3S)-(3-[4-Гидрокси-4-(5-пиридин-3-ил-1,3-тиазол-2-ил)циклогексил]метилпирролидин-1 ил)-2-оксоэтил]-3-(трифторметил)бензамид. Указанное в заголовке соединение получали из кеталя со стадии А в соответствии со способами,описанными в примере 14. MC(EI): (М+Н)+ 574,2. Пример 25.N-[2-3S)-1-[4-Гидрокси-4-(5-пиридин-2-ил-1,3-тиазол-2-ил)циклогексил]пирролидин-3 иламино)-2-оксоэтил]-3-(трифторметил)бензамид. Указанное в заголовке соединение получали в соответствии со способами, описанными в примере 24. MC(EI): (М+Н)+ 574,2. Пример 26. Стадия А. 8-Пиридазин-3-ил-1,4-диоксаспиро[4.5]декан-8-ол. К раствору пиридазина (17,7 ммоль, 1,28 мл) в ТГФ (60 мл) добавляли 2,2,6,6-тетраметилпиперидин лития (71 ммоль, 10 г) при -78 С. Реакционную смесь затем перемешивали в течение 6 мин и добавляли 1,4-диоксаспиро[4.5]декан-8-он (71 ммоль, 11 г). Реакционную смесь перемешивали в течение 5 ч при -78 С и в этот момент реакцию гасили с использованием раствора этанола, хлористо-водородной кислоты и ТГФ (30 мл, 1:1:1). Полученный раствор экстрагировали EtOAc. Органические слои объединяли, сушили над MgSO4 и концентрировали. Остаток очищали флэш-хроматографией с получением желаемого спирта (44%, 1,84 г). МС(М+Н)+ 237,1. Стадия В. 4-Гидрокси-4-пиридазин-3-илциклогексанон. К продукту стадии А (7,79 ммоль, 1,84 г) в ТГФ (15 мл) добавляли HCl (45 ммоль, 15 мл). Реакционную смесь перемешивали в течение ночи и затем гасили с использованием Na2CO3. Раствор затем экстрагировали EtOAc (3100 мл). Органические слои объединяли, сушили и концентрировали в вакууме с получением желаемого кетона (780 мг, 52%). МС (М+Н)+ 193,1. Стадия С.N-(2-(3S)-3-[(4-Гидрокси-4-пиридазин-3-илциклогексил)амино]пирролидин-1-ил-2-оксоэтил)-3(трифторметил)бензамид. Указанное в заголовке соединение получали из кетона со стадии В с использованием способа, аналогично описанному в примере 1. МС (М+Н)+ 492,2. Пример 27.N-(2-(3S)-3-[(4-Гидрокси-4-пиразин-2-илциклогексил)амино]пирролидин-1-ил-2-оксоэтил)-3(трифторметил)бензамид. Указанное в заголовке соединение получали способом, аналогично описанному в примере 26. МС (М+Н)+ 492,2. Пример 28. Стадия А. 8-Пиримидин-2-ил-1,4-диоксаспиро[4.5]декан-8-ол (1 а). К раствору 2-бромпиримидина (0,20 г, 1,258 ммоль) в безводном метиленхлориде (3,0 мл) по каплям добавляли 1,6 М н-бутиллития в гексане (0,86 мл) при -78 С. Реакционную смесь перемешивали в течение 29 мин при -78 С и по каплям добавляли 1,4-диоксаспиро[4.5]декан-8-он (0,196 г, 1,26 ммоль) вCH2Cl2 (3 мл). Реакционную смесь перемешивали при -78 С в течение 50 мин и гасили водным раствором NH4Cl. После нагревания до комнатной температуры смесь экстрагировали CH2Cl2 три раза. Объединенные экстракты сушили над MgSO4, фильтровали и концентрировали в вакууме с получением 0,50 г неочищенного продукта. Очистка колоночной хроматографией на силикагеле при элюировании 050% 4-Гидрокси-4-пиримидин-2-илциклогексанон. К продукту со стадии А (190 ммоль, 44 г) в ТГФ (200 мл) добавляли раствор HCl (300 ммоль, 100 мл). Реакционную смесь перемешивали в течение 2 дней, затем реакционную смесь промывали диэтиловым эфиром. Водный слой затем гасили с использованием NaOH (50%) до получения рН 11. Водный слой экстрагировали EtOAc (6300 мл). Органические слои объединяли, сушили над MgSO4 и концентрировали в вакууме. Реакционную смесь очищали флэш-хроматографией с получением желаемого кетона (18 г, 49%). МС (М+Н)+ 193,1. Стадия С.N-(2-(3S)-3-[(4-Гидрокси-4-пиримидин-2-илциклогексил)амино]пирролидин-1-ил-2-оксоэтил)-3(трифторметил)бензамид. Указанное в заголовке соединение получали из кетона со стадии В с использованием способа, аналогично описанному в примере 1. МС(М+Н)+ 492,2. Пример 29. Стадия А 6-Бромникотинонитрил. 6-Хлорникотинонитрил (13,8 г, 100 ммоль) нагревали при 145 С в трибромиде фосфора (150 мл) в течение 32 ч. После охлаждения смесь концентрировали в вакууме. К остатку добавляли трибромид фосфора (150 мл), и смесь нагревали при 145 С в течение еще 32 ч. После охлаждения смесь концентрировали в вакууме и добавляли смесь лед-вода (500 мл). Для нейтрализации смеси добавляли бикарбонат натрия и продукт экстрагировали этилацетатом (3250 мл). Объединенные органические экстракты промывали насыщенным раствором соли и сушили над сульфатом магния. Растворитель удаляли в вакууме и остаток хроматографировали (смесь гексаны-этилацетат) с получением 14,9 г (81%) 6 бромникотинонитрила в виде белого твердого вещества: 1 Н ЯМР (400 МГц, CDCl3)7,66 (д, J=11,0 Гц,1 Н), 7,80 (дд, J=3,1, 11,0 Гц, 1 Н), 8,67 (д, J=3,1 Гц, 1 Н); МС (М+Н)+ m/z=183,0, 185,0. Стадия В.
МПК / Метки
МПК: C07D 401/14, A61K 31/44, C07D 401/12
Метки: качестве, модуляторов, рецепторов, хемокинов, 3-циклоалкиламинопирролидина, производные
Код ссылки
<a href="https://eas.patents.su/30-13631-proizvodnye-3-cikloalkilaminopirrolidina-v-kachestve-modulyatorov-receptorov-hemokinov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 3-циклоалкиламинопирролидина в качестве модуляторов рецепторов хемокинов</a>
Предыдущий патент: Лопастная машина с неподвижными и вращающимися частями цилиндра
Следующий патент: Пористые таблетки в качестве носителей для жидких композиций
Случайный патент: Устройство для освежения воздуха