Производные оксииндола в качестве агонистов 5-ht4 рецептора
Формула / Реферат
1. Соединение формулы (I)
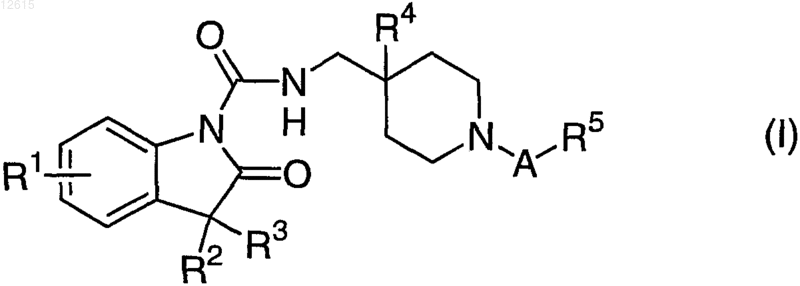
где А представляет собой C1-C2-алкиленовую группу, указанная алкиленовая группа является незамещенной или замещенной 1-4 заместителями, независимо выбираемыми из группы, состоящей из C1-C4-алкильной группы, гидроксизамещенной C1-C4-алкильной группой и C1-C2-алкоксизамещенной C1-C4-алкильной группой, где 2 из указанных заместителей могут необязательно образовывать мостиковую связь, образуя 3-6-членное кольцо;
R1 представляет собой атом водорода и атом галогена;
R2 и R3 представляют собой метильную группу или R2 и R3 могут вместе образовывать тетраметиленовую мостиковую связь с получением 5-членного кольца;
R4 представляет собой атом водорода, атом галогена или гидроксигруппу и
R5 представляет собой гидроксигруппу, карбоксигруппу и тетразолильную группу;
или его фармацевтически приемлемая соль.
2. Соединение или фармацевтически приемлемая соль по п.1, где А представляет собой C1-C2-алкиленовую группу, указанная алкиленовая группа является незамещенной или замещенной 1-2 заместителями, независимо выбираемыми из группы, состоящей из C1-C4-алкильной группы, гидроксизамещенной C1-C4-алкильной группы и C1-C2-алкоксизамещенной C1-C4-алкильной группы, где 2 из указанных заместителей могут необязательно образовывать мостиковую связь, образуя 3-6-членное кольцо;
R1 представляет собой атом водорода или атом галогена;
R2 и R3 представляют собой метильную группу или R2 и R3 могут вместе образовывать тетраметиленовую мостиковую связь с получением 5-членного кольца;
R4 представляет собой атом водорода и
R5 представляет собой карбоксигруппу или тетразолильную группу.
3. Соединение или фармацевтически приемлемая соль по п.2, где А представляет собой C1-C2-алкиленовую группу, указанная алкиленовая группа является незамещенной или замещенной 2 заместителями, независимо выбираемыми из группы, состоящей из C1-C4-алкильной группы и гидроксизамещенной C1-C4-алкильной группы, где 2 из указанных заместителей необязательно могут образовывать мостиковую связь с получением 3-6-членного кольца;
R1 представляет собой атом водорода или атом фтора;
R2 и R3 представляют собой метильную группу или R2 и R3 могут вместе образовывать тетраметиленовую мостиковую связь с получением 5-членного кольца;
R4 представляет собой атом водорода и
R5 представляет собой карбоксигруппу или тетразолильную группу.
4. Соединение или фармацевтически приемлемая соль по п.3, где А представляет собой
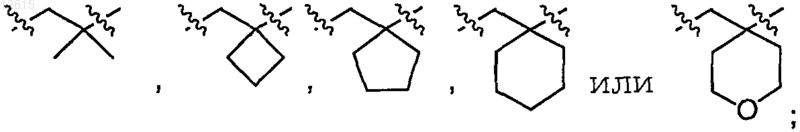
R1 представляет собой атом водорода или атом фтора;
R2 и R3 представляют собой метильную группу;
R4 представляет собой атом водорода и
R5 представляет собой карбоксигруппу или тетразолильную группу.
5. Соединение по п.1, которое выбирают из
4-{[4-({[(2'-оксоспиро[циклопентан-1,3'-индол]-1'(2'Н)-ил)карбонил]амино}метил)пиперидин-1-ил]метил}тетрагидро-2Н-пиран-4-карбоновой кислоты,
2,2-диметил-3-[4-({[(2'-оксоспиро[циклопентан-1,3'-индол]-1'(2'Н)-ил)карбонил]амино}метил)пиперидин-1-ил]пропановой кислоты,
1-{[4-({[(2'-оксоспиро[циклопентан-1,3'-индол]-1'(2'Н)-ил)карбонил]амино}метил)пиперидин-1-ил]метил}циклопропанкарбоновой кислоты,
1-{[4-({[(2'-оксоспиро[циклопентан-1,3'-индол]-1'(2'Н)-ил)карбонил]амино}метил)пиперидин-1-ил]метил}циклопентанкарбоновой кислоты,
1-{[4-({[(2'-оксоспиро[циклопентан-1,3'-индол]-1'(2'Н)-ил)карбонил]амино}метил)пиперидин-1-ил]метил}циклобутанкарбоновой кислоты,
2-этил-2-{[4-({[(2'-оксоспиро[циклопентан-1,3'-индол]-1'(2'Н)-ил)карбонил]амино}метил)пиперидин-1-ил]метил}бутановой кислоты,
1-{[4-({[(6'-фтор-2'-оксоспиро[циклопентан-1,3'-индол]-1'(2'Н)-ил)карбонил]амино}метил)пиперидин-1-ил]метил}циклобутанкарбоновой кислоты,
4-{[4-({[(6'-фтор-2'-оксоспиро[циклопентан-1,3'-индол]-1'(2'Н)-ил)карбонил]амино}метил)пиперидин-1-ил]метил}тетрагидро-2Н-пиран-4-карбоновой кислоты,
1-{[4-({[(3,3-диметил-2-оксо-2,3-дигидро-1Н-индол-1-ил)карбонил]амино}метил)пиперидин-1-ил]метил}циклобутанкарбоновой кислоты,
3-[4-({[(3,3-диметил-2-оксо-2,3-дигидро-1Н-индол-1-ил)карбонил]амино}метил)пиперидин-1-ил]пропановой кислоты,
3-[4-({[(3,3-диметил-2-оксо-2,3-дигидро-1Н-индол-1-ил)карбонил]амино}метил)пиперидин-1-ил]-2,2-диметилпропановой кислоты,
3-[4-({[(3,3-диметил-2-оксо-2,3-дигидро-1Н-индол-1-ил)карбонил]амино}метил)гидроксипиперидин-1-ил]-2,2-диметилпропановой кислоты,
1-{[4-({[(2'-оксоспиро[циклопентан-1,3'-индол]-1'(2'Н)-ил)карбонил]амино}метил)пиперидин-1-ил]метил}циклогексанкарбоновой кислоты,
2'-оксо-N-[(1-{[1-(2Н-тетразол-5-ил)циклопентил]метил}пиперидин-4-ил)метил]спиро[циклопентан-1,3'-индол]-1'(2'Н)-карбоксамида,
1-{[4-({[(6-фтор-3,3-диметил-2-оксо-2,3-дигидро-1Н-индол-1-ил)карбонил]амино}метил)пиперидин-1-ил]метил}циклобутанкарбоновой кислоты,
3-[4-({[(6-фтор-3,3-диметил-2-оксо-2,3-дигидро-1Н-индол-1-ил)карбонил]амино}метил)пиперидин-1-ил]пропановой кислоты,
3-[4-({[(6-фтор-3,3-диметил-2-оксо-2,3-дигидро-1Н-индол-1-ил)карбонил]амино}метил)пиперидин-1-ил]-2,2-диметилпропановой кислоты,
[4-({[(6-фтор-3,3-диметил-2-оксо-2,3-дигидро-1Н-индол-1-ил)карбонил]амино}метил)пиперидин-1-ил]уксусной кислоты,
2-[4-({[(6-фтор-3,3-диметил-2-оксо-2,3-дигидро-1Н-индол-1-ил)карбонил]амино}метил)пиперидин-1-ил]-2-метилпропановой кислоты,
3-[4-фтор-4-({[(6-фтор-3,3-диметил-2-оксо-2,3-дигидро-1Н-индол-1-ил)карбонил]амино}метил)пиперидин-1-ил]-2,2-диметилпропановой кислоты,
3-[4-({[(3,3-диметил-2-оксо-2,3-дигидро-1Н-индол-1-ил)карбонил]амино}метил)-4-фторпиперидин-1-ил]-2,2-диметилпропановой кислоты,
1-{[4-({[(6-фтор-3,3-диметил-2-оксо-2,3-дигидро-1Н-индол-1-ил)карбонил]амино}метил)-4-гидроксипиперидин-1-ил]метил}циклобутанкарбоновой кислоты,
1-{[4-({[(3,3-диметил-2-оксо-2,3-дигидро-1Н-индол-1-ил)карбонил]амино}метил)пиперидин-1-ил]метил}циклобутанкарбоновой кислоты гидрохлорид,
1-{[4-({[(3,3-диметил-2-оксо-2,3-дигидро-1Н-индол-1-ил)карбонил]амино}метил)пиперидин-1-ил]метил}циклобутанкарбоновой кислоты гемифумарата.
6. Соединение по п.1, которое выбирают из
1-{[4-({[(3,3-диметил-2-оксо-2,3-дигидро-1Н-индол-1-ил)карбонил]амино}метил)пиперидин-1-ил]метил}циклобутанкарбоновой кислоты,
1-{[4-({[(6-фтор-3,3-диметил-2-оксо-2,3-дигидро-1Н-индол-1-ил)карбонил]амино}метил)пиперидин-1-ил]метил}циклобутанкарбоновой кислоты,
3-[4-({[(6-фтор-3,3-диметил-2-оксо-2,3-дигидро-1Н-индол-1-ил)карбонил]амино}метил)пиперидин-1-ил]-2,2-диметилпропановой кислоты, и
его фармацевтически приемлемая соль.
7. Фармацевтическая композиция, содержащая соединение или фармацевтически приемлемую соль по любому из пп.1-6 вместе с фармацевтически приемлемым наполнителем.
8. Применение соединения или фармацевтически приемлемой соли по любому из пп.1-6 в качестве лекарственного средства.
9. Комбинация соединения или фармацевтически приемлемой соли по любому из пп.1-6 и другого фармакологически активного агента.
10. Фармацевтическая композиция, содержащая соединение или фармацевтически приемлемую соль по любому из пп.1-6 и другой фармакологически активный агент.
Текст
012615 Предпосылки создания изобретения Данное изобретение относится к производным оксииндола. Данные соединения обладают селективной агонистической активностью по отношению к 5-НТ 4 рецептору. Настоящее изобретение также относится к фармацевтической композиции, способу лечения и применению, включая указанные выше производные, для лечения болезненных состояний, опосредованных активностью 5-НТ 4 рецептора; в частности к агонистической активности по отношению к 5-НТ 4 рецептору. Вообще говоря, обнаружено,что агонисты 5-НТ 4 рецептора оказываются применимыми для лечения множества болезней, таких как рефлюксная гастроэзофагеальная болезнь, желудочно-кишечное заболевание, расстройство двигательной функции желудка, неязвенная диспепсия, функциональная диспепсия, синдром раздраженной толстой кишки (IBS), констипация, диспепсия, эзофагит, гастроэзофагеальная болезнь, тошнота, заболевание центральной нервной системы, болезнь Альцгеймера, расстройство познавательной способности, рвота,мигрень, неврологическое заболевание, боль, сердечно-сосудистые расстройства, сердечная недостаточность, сердечная аритмия, сахарный диабет и синдром удушья (см. TiPs, 1992, 13, 141; Ford A.P.D.W. etForsch./Drug Res., 1993, 43, 913). В US 5399562A описывают соединения индолона в качестве агонистов или антагонистов 5-НТ 4 и/или антагонистов 5-HT3. Главным образом, соединения, представляемые нижеследующей формулой,описаны в качестве примера 5 Существует необходимость в получении новых агонистов 5-НТ 4, которые рассматривают как предполагаемые лекарственные средства высокого качества. В частности, предпочтительные соединения должны прочно связываться с 5-НТ 4 рецептором, обнаруживая при этом низкий аффинитет по отношению к другим рецепторам, и проявлять функциональную активность в качестве агонистов. Они должны хорошо адсорбироваться из желудочно-кишечного тракта, быть метаболически устойчивыми и обладать благоприятными фармакокинетическими свойствами. Когда мишенью являются рецепторы центральной нервной системы, они должны свободно пересекать гематоэнцефалический барьер, а когда селективно выбираемой мишенью являются рецепторы периферической нервной системы, они не должны пересекать гематоэнцефалический барьер. Они должны быть нетоксичными и иметь мало побочных эффектов. Более того, идеальное предполагаемое лекарственное средство будет находиться в такой физической форме, которая является устойчивой, негигроскопичной и легко образует смеси. Сущность изобретения В данном изобретении было обнаружено, что замена хинуклидинового цикла пиперидиновым циклом значительно повышает агонистическую активность по отношению к 5-НТ 4. Поэтому, как было с удивлением обнаружено, соединения по изобретению, если сравнивать с предшествующим уровнем техники, обладают более высокой селективной агонистической активностью по отношению к 5-НТ 4. И, таким образом, они являются применимыми при лечении болезненных состояний, опосредованных 5-НТ 4 активностью, таких как рефлюксная гастроэзофагеальная болезнь, желудочно-кишечное заболевание, расстройство двигательной функции желудка, неязвенная диспепсия,функциональная диспепсия, синдром раздраженной толстой кишки (IBS), констипация, диспепсия, эзофагит, гастроэзофагеральная болезнь, тошнота, заболевание центральной нервной системы, болезнь Альцгеймера, расстройство познавательной способности, рвота, мигрень, неврологическое заболевание,боль, сердечно-сосудистые расстройства, сердечная недостаточность, сердечная аритмия, сахарный диабет и синдром удушья (в дальнейшем эти заболевания обозначают как 5-НТ 4 болезни). Настоящее изобретение предлагает соединение нижеследующей формулы (I) или его фармацевтически приемлемую соль, в которой А представляет C1-C4-алкиленовую группу, указанная алкиленовая группа является незамещенной или замещенной 1-4 заместителями, независимо выбираемыми из группы, состоящей из C1-C4-алкильной группы, гидроксизамещенной C1-C4-алкильной группы и C1-C2-алкоксизамещенной C1-C4-алкильной-1 012615 группы, где 2 из указанных заместителей могут необязательно образовывать мостиковую связь с получением 3-6-членного кольца, которое является незамещенным или замещенным гидроксигруппой или карбоксигруппой;R1 представляет атом водорода, атом галогена или C1-C4-алкильную группу;R2 и R3 независимо представляют метильную или этильную группу или R2 и R3 могут вместе образовывать C2-C4-алкиленовую мостиковую связь с получением 3-5-членного кольца;R4 представляет атом водорода, атом галогена или гидроксигруппу иR5 представляет гидроксигруппу, карбоксигруппу, тетразолильную группу, (5-оксо-1,2,4 оксадиазол-3-ил)группу или (5-оксо-1,2,4-тиадиазол-3-ил)группу. Кроме того, настоящее изобретение предлагает применение соединения формулы (I) или его фармацевтически приемлемой соли, из которых каждое соединение описано в настоящем документе, для получения лекарственного средства для лечения состояния, опосредованного модулирующей активностью 5-НТ 4; в частности агонистической активностью к 5-НТ 4. Предпочтительно, что настоящее изобретение также предлагает применение соединения формулы(I) или его фармацевтически приемлемой соли, каждое из которых описано в настоящем документе, для получения лекарственного средства для лечения болезней, выбираемых из 5-НТ 4 болезней. Кроме того, настоящее изобретение предлагает фармацевтическую композицию, содержащую соединение формулы (I) или его фармацевтически приемлемую соль, каждое из которых описано в настоящем документе, вместе с фармацевтически приемлемым носителем указанного соединения. Кроме того, настоящее изобретение предлагает фармацевтическую композицию, содержащую соединение формулы (I) или его фармацевтически приемлемую соль, каждое из которых описано в настоящем документе, вместе с фармацевтически приемлемым носителем указанного соединения и еще одним фармакологически активным агентом. Дополнительно, настоящее изобретение предлагает способ лечения состояния, опосредованного модулирующей активностью 5-НТ 4, у млекопитающих, который включает введение млекопитающему,нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, каждое из которых описано в настоящем документе. Примеры состояний, опосредованных модулирующей активностью 5-НТ 4, включают, кроме прочих, 5-НТ 4 болезни. Соединения по настоящему изобретению могут демонстрировать меньшую токсичность, хорошую всасываемость, распределение в организме, хорошую растворимость, меньшую способность к связыванию белка, отличную от кислотного насоса, меньшее взаимодействие с другими лекарственными средствами и удовлетворительную метаболическую устойчивость. Подробное описание изобретения В соединениях по настоящему изобретению, где А представляет собой C1-C4-алкиленовую группу,данная C1-C4-алкиленовая группа может быть группой с прямой цепью, имеющей от одного до четырех атомов углерода, где примеры включают, кроме прочих, метилен, этилен, триметилен и тетраметилен. Предпочтительными из них являются метилен или этилен; этилен является более предпочтительным. Там, где R2 и R3 образуют C2-C4-алкиленовую мостиковую связь с получением 3-5-членного кольца,это 3-5-членное кольцо может представлять собой циклоалкильную группу, имеющую от трех до пяти атомов углерода, где примеры включают, кроме прочих, циклопропил, циклобутил и циклопентил. Предпочтительным из них является циклопентил. Там, где R1 и R4 представляют собой атом галогена, являющийся атомом фтора, хлора, брома или йода, предпочтительными из них являются атом фтора и атом хлора, более предпочтительным является атом фтора. Там, где R1 и заместитель А представляют собой C1-C4-алкильную группу, эта C1-C4-алкильная группа может быть группой с прямой или разветвленной цепью, имеющей от одного до четырех атомов углерода, где примеры включают, кроме прочих, метил, этил, пропил, изопропил, бутил, изобутил, вторбутил и трет-бутил. Предпочтительными из них являются метил или этил; более предпочтительным дляR1 является метил. Там, где заместитель А является гидроксизамещенной C1-C4-алкильной группой, он представляет собой указанную C1-C4-алкильную группу, замещенную гидрокси, где примеры включают, кроме прочих, гидроксиметил, 2-гидроксиэтил, 1-гидроксиэтил, 3-гидроксипропил, 2-гидроксипропил, 2-гидрокси 1-метилэтил, 4-гидроксибутил, 3-гидроксибутил, 2-гидроксибутил, 3-гидрокси-2-метилпропил и 3-гидрокси-1-метилпропил. Предпочтительными из них являются гидроксиалкильные группы, имеющие от 1 до 3 атомов углерода; более предпочтительными являются гидроксиметил, 2-гидроксиэтил и 2-гидроксипропил. Там, где заместитель А является C1-C2-алкоксизамещенной C1-C4-алкильной группой, он представляет собой указанную C1-C4-алкильную группу, метокси- или этоксизамещенную, где примеры включают, кроме прочих, метоксиметил, этоксиметил, 2-метоксиэтил, 2-этоксиэтил, 1-метоксиэтил,3-метоксипропил, 3-этоксипропил, 2-метоксипропил, 2-метокси-1-метилэтил, 4-метоксибутил,4-этоксибутил, 3-метоксибутил, 2-метоксибутил, 3-метокси-2-метилпропил и 3-метокси-1-метилпропил.-2 012615 Предпочтительными из них являются алкилоксиалкильные группы, имеющие от 2 до 4 атомов углерода; более предпочтительными являются метоксиметил, 2-метоксиэтил и 3-метоксипропил. Там, где 2 из заместителей А образуют мостиковую связь с получением 3-6-членного кольца, кольцо может представлять собой циклоалкильную или гетероциклильную группу, где примеры включают циклопропил, циклопентил, циклобутил, циклогексил, метилциклопропил, этилциклопропил, метилциклобутил, метилциклопентил, метилциклогексил, этилциклогексил, гидроксициклопропил, гидроксициклобутил, гидроксициклопентил, гидроксициклогексил, метоксициклопропил, метоксициклобутил, метоксициклопентил, метоксициклогексил, тетрагидрофурил и тетрагидропиранил, предпочтительно циклопропил, циклобутил, циклопентил, циклогексил, метоксициклогексил и тетрагидропиранил, и наиболее предпочтительно циклобутил, циклопентил, циклогексил и тетрагидропиранил. Термины "терапия" и "лечение", используемые здесь, обозначают целительное, паллиативное и профилактическое лечение, включающее возвращение к прежнему состоянию, облегчение, подавление прогресса расстройства или предотвращение расстройства или состояния, к которому применим этот термин, или одного или нескольких симптомов такого расстройства или состояния. Предпочтительными соединениями по настоящему изобретения являются такие соединения формулы (I) или фармацевтически приемлемой их соли, каждое из которых описано здесь, где:(А) А представляет собой C1-C2-алкиленовую группу. Указанная алкиленовая группа является незамещенной или замещенной 1-4 заместителями,независимо выбираемыми из группы, состоящей из C1-C4-алкильной группы, гидроксизамещеннойC1-C4-алкильной группы и C1-C2-алкоксизамещенной C1-C4-алкильной группы, где 2 из указанных заместителей могут необязательно образовывать мостиковую связь с получением 36-членного кольца;R1 представляет атом водорода, атом галогена или C1-C4-алкильную группу;R2 и R3 представляют собой метильную группу или R2 и R3 могут вместе образовывать тетраметиленовую мостиковую связь с получением 5-членного кольца;R4 представляет атом водорода, атом галогена или гидроксигруппу; a(B) А представляет собой C1-C2-алкиленовую группу. Указанная алкиленовая группа является незамещенной или замещенной 1 или 2 заместителями, независимо выбираемыми из группы, состоящей из C1-C4-алкильной группы, гидроксизамещеннойC1-C4-алкильной группы и C1-C2-алкоксизамещенной C1-C4-алкильной группы, где 2 из указанных заместителей могут необязательно образовывать мостиковую связь с получением 3-6-членного кольца;R1 представляет собой атом водорода или атом галогена;R2 и R3 представляют собой метильную группу или R2 и R3 могут вместе образовывать тетраметиленовую мостиковую связь с получением 5-членного кольца;(C) А представляет собой C1-C2-алкиленовую группу. Указанная алкиленовая группа является незамещенной или замещенной 2 заместителями, независимо выбираемыми из группы, состоящей из C1-C4-алкильной группы, гидроксизамещеннойC1-C4-алкильной группы и C1-C2-алкоксизамещенной C1-C4-алкильной группы, где 2 из указанных заместителей могут необязательно образовывать мостиковую связь с получением 3-6-членного кольца;R1 представляет собой атом водорода или атом фтора;R2 и R3 представляют собой метильную группу или R2 и R3 могут вместе образовывать тетраметиленовую мостиковую связь с получением 5-членного кольца;R5 представляет собой карбоксигруппу или тетразолильную группу;R1 представляет собой атом водорода или атом фтора;R2 и R3 представляют собой метильную группу;-3 012615 Указанная алкиленовая группа является незамещенной или замещенной 2 заместителями, независимо выбираемыми из группы, состоящей из C1-C2-алкильной группы и гидроксизамещеннойC1-C2-алкильной группы, где 2 из указанных заместителей могут необязательно образовывать мостиковую связь с получением 4-6-членного кольца;R1 представляет собой атом водорода или атом фтора;R2 и R3 представляют собой метильную группу или R2 и R3 могут вместе образовывать тетраметиленовую мостиковую связь с получением 5-членного кольца;R5 представляет собой карбоксигруппу или тетразолильную группу;R1 представляет собой атом водорода или атом фтора;R2 и R3 представляют собой метильную группу;R5 представляет собой карбоксигруппу или тетразолильную группу;(G) А представляет собой C1-C4-алкиленовую группу. Указанная алкиленовая группа является незамещенной или замещенной 1-4 заместителями,независимо выбираемыми из группы, состоящей из C1-C4-алкильной группы, гидроксизамещеннойC1-C4-алкильной группы и C1-C2-алкоксизамещенной C1-C4-алкильной группы, где 2 из указанных заместителей могут необязательно образовывать мостиковую связь с получением 3-6-членного кольца, незамещенного или замещенного гидроксигруппой или карбоксигруппой;R1 представляет собой атом водорода или атом фтора, или C1-C4-алкильную группу;R2 и R3 представляют собой метильную группу или R2 и R3 могут вместе образовывать тетраметиленовую мостиковую связь с получением 5-членного кольца;R4 является атомом водорода, атомом галогена или гидроксигруппой; a(Н) А представляет собой C1-C2-алкиленовую группу. Указанная алкиленовая группа является незамещенной или замещенной 1-4 заместителями,независимо выбираемыми из группы, состоящей из C1-C4-алкильной группы, гидроксизамещеннойC1-C4-алкильной группы и C1-C2-алкоксизамещенной C1-C4-алкильной группы, где 2 из указанных заместителей могут необязательно образовывать мостиковую связь с получением 3-6-членного кольца;R1 представляет собой атом водорода или атом хлора;R2 и R3 представляют собой метильную группу или R2 и R3 могут вместе образовывать тетраметиленовую мостиковую связь с получением 5-членного кольца;R4 является атомом водорода, атомом галогена или гидроксигруппой; a(I) А представляет собой C1-C2-алкиленовую группу. Указанная алкиленовая группа является незамещенной или замещенной 1-4 заместителями,независимо выбираемыми из группы, состоящей из C1-C4-алкильной группы, гидроксизамещеннойC1-C4-алкильной группы и C1-C2-алкоксизамещенной C1-C4-алкильной группы, где 2 из указанных заместителей могут необязательно образовывать мостиковую связь с получением 3-6-членного кольца;R1 представляет собой атом водорода или атом галогена;R2 и R3 представляют собой метильную группу или R2 и R3 могут вместе образовывать тетраметиленовую мостиковую связь с получением 5-членного кольца;R4 является атомом водорода, атомом фтора или гидроксигруппой; a(J) А представляет собой C1-C2-алкиленовую группу. Указанная алкиленовая группа является незамещенной или замещенной 1 или 2 заместителями,независимо выбираемыми из группы, состоящей из C1-C4-алкильной группы, гидроксизамещеннойC1-C4-алкильной группы и C1-C2-алкоксизамещенной C1-C4-алкильной группы, где 2 из указанных заместителей могут необязательно образовывать мостиковую связь с получением 3-6-членного кольца;R1 представляет собой атом водорода или атом галогена;R2 и R3 представляют собой метильную группу;(K) А представляет собой C1-C2-алкиленовую группу. Указанная алкиленовая группа является незамещенной или замещенной 2 заместителями,независимо выбираемыми из группы, состоящей из C1-C4-алкильной группы и гидроксизамещеннойC1-C4-алкильной группы, где 2 из указанных заместителей могут необязательно образовывать мостиковую связь с получением 3-6-членного кольца;R1 является атомом водорода, или атомом фтора; каждый из R2 и R3 представляет собой метильную группу;R5 представляет собой карбоксигруппу, тетразолильную группу. Предпочтительными классами соединений по настоящему изобретению являются такие соединения формулы (I) или их фармацевттически приемлемой соли, описанные здесь, в которых:(а) А представляет собой C1-C2-алкиленовую группу. Указанная алкиленовая группа является незамещенной или замещенной 1-4 заместителями,независимо выбираемыми из группы, состоящей из C1-C4-алкильной группы, гидроксизамещеннойC1-C4-алкильной группы и C1-C2-алкоксизамещенной C1-C4-алкильной группы, где 2 из указанных заместителей могут необязательно образовывать мостиковую связь с получением 3-6-членного кольца;R1 является атомом водорода, атомом галогена или C1-C4-алкильной группой;(b) А представляет собой C1-C2-алкиленовую группу. Указанная алкиленовая группа является незамещенной или замещенной 1-2 заместителями,независимо выбираемыми из группы, состоящей из C1-C4-алкильной группы, гидроксизамещеннойC1-C4-алкильной группы и C1-C2-алкоксизамещенной C1-C4-алкильной группы, где 2 из указанных заместителей могут необязательно образовывать мостиковую связь с получением 3-6-членного кольца;(c) А представляет собой C1-C2-алкиленовую группу. Указанная алкиленовая группа является незамещенной или замещенной 2 заместителями,независимо выбираемыми из группы, состоящей из C1-C4-алкильной группы и гидроксизамещеннойC1-C4-алкильной группы, где 2 из указанных заместителей могут необязательно образовывать мостиковую связь с получением 3-6-членного кольца;(d) А представляет собой C1-C2-алкиленовую группу. Указанная алкиленовая группа является незамещенной или замещенной 2 заместителями,независимо выбираемыми из группы, состоящей из C1-C2-алкильной группы и гидроксизамещеннойC1-C2-алкильной группы, где 2 из указанных заместителей могут необязательно образовывать мостиковую связь с получением 46-членного кольца;R1 представляет собой атом водорода или атом фтора;(g) R1 представляет собой атом водорода или атом галогена;(h) R1 представляет собой атом водорода или атом фтора;(i) R2 и R3 представляют собой метильную группу или R2 и R3 могут вместе образовывать тетраметиленовую мостиковую связь с получением 5-членного кольца;(j) R2 и R3 представляют собой метильную группу;(k) R4 представляет собой атом водорода;(m) R5 представляет собой карбоксигруппу или тетразолильную группу. Из этих классов соединений любая комбинация из соединений от (а) до (m) также является предпочтительной. В одном варианте осуществления изобретения предлагают соединение, выбираемое из группы, состоящей из 1-[4-([(3,3-диметил-2-оксо-2,3-дигидро-1 Н-индол-1-ил)карбонил]аминометил)пиперидин-1 ил]метилциклобутанкарбоновой кислоты; 1-[4-([(6-фтор-3,3-диметил-2-оксо-2,3-дигидро-1 Н-индол-1-ил)карбонил]аминометил)пиперидин-1-ил]метилциклобутанкарбоновой кислоты; 3-[4-([(6-фтор-3,3-диметил-2-оксо-2,3-дигидро-1 Н-индол-1-ил)карбонил]аминометил)пиперидин 1-ил]-2,2-диметилпропановой кислоты; и его фармацевтически приемлемую соль. Фармацевтически приемлемые соли соединений формулы (I) включают кислотно-аддитивные соли и основно-аддитивные соли (включая бисоли). Пригодные кислотно-аддитивные соли образуют из кислот, которые дают нетоксичные соли. Примеры включают нижеследующие соли: ацетат, адипат, аспартат, бензоат, безилат, бикарбонат/карбонат,бисульфат/сульфат, борат, камсилат, цитрат, кольцамат, эдисилат, эзилат, формиат, фумарате, глюцептат, глюконат, глюкуронат, гексафторфосфат, гибензат, гидрохлорид/хлорид, гидробромид/бромид, гидроиодид/иодид, изетионат, лактат, малат, малеат, малонат, мезилат, метилсульфат, нафтилат, 2-напсилат,никотинат, нитрат, оротат, оксалат, пальмитат, памоат, фосфат/гидрофосфат/дигидрофосфат, пироглутамат, сахарат, стеарат, сукцинат, таннат, тартрат, тозилат, трифторацетат и ксинофоат. Пригодные основные соли образуют из оснований, которые дают нетоксичные соли. Примеры включают себя соли алюминия, аргинина, бензатина, кальция, холина, диэтиламина, диоламина, глицина, лизина, магния, меглумина, оламина, калия, натрия, трометамина и цинка. Обзор по пригодным солям можно найти в "Handbook of Pharmaceutical Salts: Properties, Selection,and Use", Stahl and Wermuth (Wiley-VCH, Weinheim, Germany, 2002). Фармацевтически приемлемая соль соединения формулы (I) может быть легко получена смешением вместе в надлежащем количестве растворов соединения формулы (I) и желаемой кислоты или основания. Соль можно осаждать из раствора и собирать фильтрованием; или можно получить выпариванием растворителя. Степень ионизации соли может меняться от полностью ионизированной до неионизированной. Соединения по изобретению могут находиться как несольватированной, так и в сольватированной формах. Термин "сольват" используют здесь для описания молекулярного комплекса, содержащего соединение по изобретению и одну или нескольких фармацевтически приемлемых молекул растворителя,например этанола. Термин "гидрат" используют, если указанным растворителем является вода. Фармацевтически приемлемые сольваты согласно изобретению включают гидраты и сольваты, в которых захваченный при кристаллизации растворитель может быть замещен изотопом, например D2O,d6-ацетон, d6-ДМСО. Включенными в объем изобретения являются и такие комплексы, как клатраты-комплексы, включения лекарственного средства-хозяин, в которых, в противоположность упомянутым выше сольватам,лекарственное средство и хозяин присутствуют в стехиометрических или нестехиометрических количествах. Также включенными в объем изобретения являются комплексы лекарственного средства, содержащего два или несколько органических и/или неорганических компонентов, которые могут быть в стехиометрических или нестехиометрических количествах. Полученные комплексы могут быть ионизированными, частично ионизированными или неионизированными. Обзор по таким комплексам можно найти в J. Pharm. Sci., 64 (8), 1269-1288, Haleblian (August 1975). В дальнейшем все ссылки на соединение формулы (I) включают ссылки на его соли и комплексы и на сольваты и комплексы его солей. Термин "соединение по изобретению" или "соединения по изобретению" обозначает, если не оговорено иначе, соединение формулы (I), определенное выше, его полиморфы, пролекарственные средства и изомеры (включая оптические, геометрические и таутомерные изомеры), определенные далее и меченые изотопами соединения формулы (I). Также в объем изобретения входят так называемые "пролекарственные средства" соединений формулы (I). Таким образом, некоторые производные соединений формулы (I), которые сами по себе могут обладать незначительной фармакологической активностью или вовсе не обладать ею, могут при введении внутрь или нанесении на тело сами превращаться в соединения формулы (I), обладающие требуемой активностью, например, посредством гидролитического расщепления. Такие производные обозначают как "пролекарственные средства". Дополнительную информацию по использованию пролекарственных средств можно найти в "Pro-drugs as Novel Delivery Systems", vol. 14, ACS Symposium Series (T. Higuchi-6 012615 Пролекарственные средства по изобретению могут, например, быть получены заменой соответствующих присутствующих в соединениях формулы (I) функциональных групп на определенные части,известные специалистам в данной области как прочасти, описанные, например, в "Design of Prodrugs"H. Bundgaard (Elsevier, 1985). Некоторые примеры пролекарственных средств по изобретению включают:(i) когда соединение формулы (I) содержит функциональную группу карбоновой кислоты (карбоксильную группу) (-COOH), ее сложный эфир, например, получается при замене атома водорода(ii) когда соединение формулы (I) содержит функциональную группу спирта (-OH), его простой эфир, например, получается при замене атома водорода (C1-C6)-алканоилоксиметилом. Дополнительные примеры заменяющих групп, в соответствии с вышеприведенными примерами и примерами других типов пролекарственных средств, могут быть найдены в указанных выше ссылках. В результате отдельные соединения формулы (I) могут сами вести себя как пролекарственные средства для других соединений формулы (I). Соединения формулы (I), содержащие один или несколько асимметричных атомов углерода, могут находиться в форме двух или более стереоизомеров. Когда соединение содержит, например, кетогруппу или оксим или ароматическую часть, то таутомерная изомерия ("таутомерия") может иметь место. Отсюда следует, что отдельное соединение может обнаруживать более одного вида изомерии. Все стереоизомеры, геометрические изомеры и таутомерные формы соединения формулы (I), включая соединения, демонстрирующие более одного вида изомерии, и смеси одного или нескольких изомеров входят в объем настоящего изобретения. Включены также кислотно-аддитивные или основноаддитивные соли, у которых противоион является оптически активным, например D-лактат или L-лизин,или рацемические, например DL-тартрат или DL-аргинин. Настоящее изобретение включает все фармацевтически приемлемые меченые изотопами соединения формулы (I), где один или несколько атомов заменены атомами, имеющими такой же атомный номер, но атомную массу или массовое число, отличное от атомной массы или массового числа, обычно,встречающегося в природе. Примеры изотопов, пригодных для включения в соединения по изобретению, включают изотопы водорода, такие как 2H и 3 Н; углерода, такие как 11 С, 13 С и 14 С; хлора, такие как 36Cl; фтора, такие как 18F,йода, такие как 123I и 125I; азота, такие как 13N и 15N; кислорода, такие как 15O, 17O и 18O; фосфора, такие как 32 Р, и серы, такие как 35S. Некоторые меченые изотопами соединения формулы (I), например соединения, включающие радиоактивный изотоп, применимы при исследованиях по распределению в лекарственном средстве и/или в ткани субстрата. Радиоактивные изотопы трития, т.е. 3 Н, и углерода-14, т.е. 14 С, являются особенно используемыми для этих целей ввиду легкости их внедрения и наличия способов их обнаружения. Замещение более тяжелыми изотопами, такими как дейтерий, т.е. 2 Н, может дать некоторые терапевтические преимущества вследствие большей метаболической устойчивости, например увеличенныйin vivo период полувыведения или сниженные требования по дозировке, и поэтому может оказаться предпочтительным в некоторых обстоятельствах. Замещение испускающими позитроны изотопами, такими как 11C, 18F, 15O и 13N, может быть использовано при анализах топографии позитронного излучения (PET) для исследования вовлечения рецепторов субстрата. Меченые изотопами соединения формулы (I) обычно могут быть получены по общепринятым методикам, известным специалистам в данной области, или используя способы, аналогичные способам,описанным в сопроводительных примерах и способах получения, использующих соответствующие меченые изотопами реагенты вместо используемых ранее не содержащих изотопных меток реагентов. Все соединения формулы (I) могут быть получены по методикам, представленным в описании основных способов, приведенном ниже; или с помощью конкретных способов, описанных в разделе, относящемся к примерам, а также в разделе, относящемся к способам получения, или путем стандартной их модификации. Настоящее изобретение также охватывает любой (один или несколько) из этих способов получения соединений формулы (I), в дополнение к любым новым интермедиатам, там используемым. Общий синтез Соединения по настоящему изобретению могут быть получены множеством хорошо известных способов получения соединений этого типа, например, показанных в нижеследующих способах от А до I. Нижеследующие способы А и В иллюстрируют получение соединений формулы (I). Способы от С до I иллюстрируют получение различных интермедиатов. До тех пор пока не оговорено иначе, R1, R2, R3, R4, R5 и А в нижеследующих способах являются такими, как определено выше. Термин "защитная группа", используемый далее, обозначает гидрокси-, карбокси- или аминозащитную группу, которую обычно выбирают из гидрокси-, карбокси- или аминозащитных групп, описанных в Protective Groups in Organic Synthesis, edited by T.W. Greene et al. (JohnWileySons, 1999). Все исходные вещества в нижеследующих основных синтезах могут быть коммерчески доступными или получены обычными способами, известными специалистам в данной области, такими как описанные в Howard, Harry R. et al., J. Med. Chem., 1996, 39, 143; Joensson, N. et al., Acta Chem.al., Synthesis, 1993, 351, описание которых включено в настоящий документ в виде ссылки. Способ А. Способ иллюстрирует получение соединения формулы (I). Реакционная схема А В реакционной схеме А заместитель R5a представляет собой R5, определенный выше, или группу формулы -COOR6, где R6 представляет собой карбоксизащитную группу. Термин "карбоксизащитная группа", используемый здесь, означает защищающую группу, способную к отщеплению в результате химического воздействия, такого как гидрогенолиз, гидролиз, электролиз или фотолиз; такие карбоксизащитные группы описаны в Protective Groups in Organic Synthesis, editedby T.W. Greene et al. (John WileySons, 1999). Стандартные карбоксизащитные группы включают, кроме прочих, метил, этил, т-бутил, метоксиметил, 2,2,2-трихлорэтил, бензил, дифенилметил, триметилсилил,т-бутилдиметилсилил и аллил. Из этих групп т-бутил, этил или метил являются предпочтительными. Стадия А 1. На этой стадии требуемое соединение формулы (I) по настоящему изобретению получают карбонилированием соединения формулы (II) соединением формулы (III). Соединение формулы (II) является коммерчески доступным или может быть получено способами С и D, предложенными ниже. Соединение формулы (III) может быть получено способами от Е до G, предложенными ниже. Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особых ограничений на природу используемого растворителя при условии, что он не оказывает вредного воздействия на течение реакции или на включенные реагенты, и он способен растворять реагенты, по крайней мере, в некоторой степени. Примеры пригодных растворителей включают, кроме прочих, галогенированные углеводороды, такие как дихлорметан, хлороформ, четыреххлористый углерод и 1,2-дихлорэтан; ароматические углеводороды, такие как бензол, толуол и нитробензол; простые эфиры,такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран и диоксан; и амиды, такие какN,N-диметилформамид и N,N-диметилацетамид. Из этих растворителей дихлорметан является предпочтительным. Не существует также особых ограничений на природу используемых карбонилирующих агентов, и здесь одинаково может быть использован любой карбонилирующий агент, обычно применяемый в реакциях такого типа. Примеры таких карбонилирующих агентов включают, кроме прочих, производное имидазола, такое как N,N'-карбонилдиимидазол (CDI); хлорформиат, такой как трихлорметилхлорформиат и 4-нитрофенилхлорформиат; мочевину и трифосген. Из этих агентов 4-нитрофенилхлорформиат является предпочтительным. Реакция может протекать в широком интервале температур, и точная температура реакции не является определяющей для изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходные вещества. Однако, вообще говоря, удобно осуществлять реакцию при температуре от приблизительно 0 до приблизительно 100 С. Время, необходимое для реакции, может также меняться в широких пределах в зависимости от многих факторов, особенно температуры реакции и природы исходных веществ и используемого растворителя. Однако при условии, что реакцию осуществляют в предпочтительных условиях, описанных выше, период от приблизительно 5 мин до приблизительно 24 ч, как правило, будет достаточным. В случае, когда R5a представляет собой группу соединений формулы -COOR6, для получения карбоксигруппы осуществляют реакцию для удаления защиты. Эта реакция подробно описана в работе Т.W. Greene et al., Protective Groups in Organic Synthesis, 369-453, (1999); которая включена здесь в виде ссылки. Нижеследующее иллюстрирует типичную реакцию с участием защитной т-бутильной группы. Реакцию удаления защиты обычно предпочтительно осуществляют в присутствии растворителя. Не существует особых ограничений на природу используемого растворителя при условии, что он не оказывает вредного воздействия на течение реакции или на используемые реагенты, и он способен растворять реагенты, по крайней мере, до некоторой степени. Примеры пригодных растворителей включают, кроме прочих, галогенированные углеводороды, такие как дихлорметан, хлороформ, четыреххлористый углерод и 1,2-дихлорэтан; и ароматические углеводороды, такие как бензол, толуол и нитробензол. Из этих растворителей галогенированные углеводороды являются предпочтительными.-8 012615 Реакцию удаления защиты осуществляют в присутствии кислоты. Не существует также особых ограничений на природу используемых кислот; и любая кислота, обычно используемая в реакциях такого типа, одинаково может быть здесь использована. Примеры таких кислот включают, кроме прочих, такие кислоты, как хлористо-водородная кислота, уксусная кислота, п-толуолсульфокислота или трифторуксусная кислота. Из них трифторуксусная кислота является предпочтительной. Реакцию удаления защиты можно осуществлять в присутствии акцептора радикалов. Не существует также особых ограничений на природу используемого акцептора радикалов, и любой акцептор радикалов, обычно используемый в реакциях такого типа, одинаково может быть здесь использован. Примеры таких акцепторов радикалов включают, кроме прочих, HBr, диметилсульфоксид или (CH3CH2)3SiH. Из них (CH3CH2)3SiH является предпочтительным. Реакция удаления защиты может протекать в широком интервале температур, и точная температура реакции не является определяющей для изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходные вещества. Однако, вообще говоря, удобно осуществлять реакцию при температуре от приблизительно 0 до приблизительно 100 С. Время, необходимое для реакции, может также меняться в широких пределах в зависимости от многих факторов,особенно температуры реакции и природы исходных веществ и используемого растворителя. Однако при условии, что реакцию осуществляют в предпочтительных условиях, описанных выше, период от приблизительно 5 мин до приблизительно 24 ч, как правило, будет достаточным. Способ В. Способ иллюстрирует получение соединений формулы (I). Реакционная схема В На реакционной схеме В заместитель R5a определен выше; R7 является аминозащитной группой; Аа представляет собой группу А, определенную выше, или C1-C3-алкиленовую группу; указанная алкиленовая группа является незамещенной или замещенной 1-4 заместителями, независимо выбираемыми из группы, состоящей из атома галогена, C1-C4-алкильной группы, гидроксизамещенной C1-C4-алкильной группы и C1-C2-алкоксизамещенной C1-C4-алкильной группы, где 2 из указанных заместителей могут,необязательно, вместе с атомами углерода образовывать 3-6-членное кольцо; а X представляет собой атом галогена, такой как атом йода, атом хлора или атом брома. Термин "аминозащитная группа", используемый здесь, обозначает защитную группу, способную к отщеплению химическими средствами, такими как гидрогенолиз, гидролиз, электролиз или фотолиз. Такие аминозащитные группы описаны в Protective Groups in Organic Synthesis, edited by T.W. Greene et al.(John WileySons, 1999). Обычные аминозащитные группы включают, кроме прочих, бензил,C2H5O(C=O)-, CH3(C=O)-, т-бутилдиметилсилил, т-бутилдифенилсилил, бензилоксикарбонил и т-бутоксикарбонил. Из этих групп т-бутоксикарбонил является предпочтительным. Стадия В 1. На этой стадии соединение формулы (V) получают посредством удаления защиты соединения формулы (IV), которое может быть получено, например, способом, аналогичным способу, описанному в способе А для получения соединения формулы (I) из соединения формулы (II). Этот способ удаления защиты подробно описан в Т.W. Greene et al. [Protective Groups in Organic Synthesis, 494-653, (1999)]; описание включено в данный документ в виде ссылки. Нижеследующее иллюстрирует типичный способ с участием т-бутоксикарбонильной защитной группы. Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особых ограничений на природу используемого растворителя при условии, что он не оказывает вредного воздействия на течение реакции или на включенные реагенты и способен растворять реагенты, по крайней мере, до некоторой степени. Примеры пригодных растворителей включают, кроме прочих, галогенированные углеводороды, такие как дихлорметан, хлороформ, четыреххлористый углерод и 1,2-дихлорэтан; и спирты, такие как метанол, этанол, пропанол, 2-пропанол и бутанол. Из этих растворителей спирты являются предпочтительными.-9 012615 Реакцию осуществляют в присутствии кислоты. Не существует также особых ограничений на природу используемых кислот; и любая кислота, обычно используемая в реакциях такого типа, одинаково может быть здесь использована. Примеры таких кислот включают, кроме прочих, такие кислоты, как хлористо-водородная или трифторуксусная кислота. Из них хлористо-водородная кислота является предпочтительной. Реакция может протекать в широком интервале температур, и точная температура реакции не является определяющей для изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходные вещества. Однако, вообще говоря, удобно осуществлять реакцию при температуре от приблизительно 0 до приблизительно 100 С. Время, необходимое для реакции, может также меняться в широких пределах в зависимости от многих факторов, особенно температуры реакции и природы исходных веществ и используемого растворителя. Однако при условии, что реакцию осуществляют в предпочтительных условиях, описанных выше, период от приблизительно 5 мин до приблизительно 24 ч, как правило, будет достаточным. Стадия В 2. На этой стадии требуемое соединение формулы (I) получают (В 2-а) сочетанием соединения формулы (V), получаемого, как описано для стадии В 1, с соединением формулы (VI) или путем восстановительного аминирования (В 2-b) соединения формулы (V) соединением формулы (VII).(В 2-а) Сочетание с соединением формулы (VI). Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особых ограничений на природу используемого растворителя при условии, что он не оказывает вредного воздействия на течение реакции или на включенные реагенты и способен растворять реагенты,по крайней мере, до некоторой степени. Примеры пригодных растворителей включают, кроме прочих,галогенированные углеводороды, такие как дихлорметан, хлороформ, четыреххлористый углерод и 1,2-дихлорэтан; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран и диоксан; амины, такие как N-метилморфолин, триэтиламин, трипропиламин, трибутиламин,диизопропилэтиламин, дициклогексиламин, N-метилпиперидин, N-метилпирролидин, пиридин,4-пирролидинопиридин, N,N-диметиланилин и N,N-диэтиланилин; и амиды, такие как N,N-диметилформамид и N,N-диметилацетамид. Из них N,N-диметилформамид или N,N-метилпирролидин являются предпочтительными. Реакцию осуществляют в присутствии основания. Не существует также особых ограничений на природу используемых оснований; и любое основание, обычно используемое в реакциях такого типа,одинаково может быть здесь использовано. Примеры таких оснований включают, кроме прочих, амины,такие как N-метилморфолин, триэтиламин, трипропиламин, трибутиламин, диизопропилэтиламин,дициклогексиламин,N-метилпиперидин,пиридин,4-пирролидинопиридин,пиколин,4-(N,N-диметиламино)пиридин, 2,6-ди(т-бутил)-4-метилпиридин, хинолин, N,N-диметиланилин иN,N-диэтиланилин, 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,4-диазабицикло[2.2.2]октан (DABCO) и 1,8-диазабицикло[5.4.0]ундек-7-ен (DBU); гидриды щелочных металлов, такие как гидрид лития, гидрид натрия и гидрид калия; и алкоксиды щелочных металлов, такие как метилат натрия, этилат натрия,т-бутилат калия. Предпочтительным из них является диизопропилэтиламин. Реакция может протекать в широком интервале температур, и точная температура реакции не является определяющей для изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходные вещества. Однако, вообще говоря, удобно осуществлять реакцию при температуре от приблизительно 0 до приблизительно 120 С. Время, необходимое для реакции, может также меняться в широких пределах в зависимости от многих факторов, особенно температуры реакции и природы исходных веществ и используемого растворителя. Однако при условии, что реакцию осуществляют в описанных выше предпочтительных условиях период от приблизительно 5 мин до приблизительно 48 ч, как правило, будет достаточным.(В 2-b) Восстановительное аминирование. Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особых ограничений на природу используемого растворителя при условии, что он не оказывает вредного воздействия на течение реакции или на включенные реагенты и способен растворять реагенты, по крайней мере, до некоторой степени. Примеры пригодных растворителей включают, кроме прочих, галогенированные углеводороды, такие как дихлорметан, хлороформ, четыреххлористый углерод и 1,2-дихлорэтан; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран и диоксан; спирты, такие как метанол, этанол, пропанол, 2-пропанол и бутанол; уксусную кислоту и воду. Из этих растворителей галогенированные углеводороды являются предпочтительными. Реакцию осуществляют в присутствии восстановителя. Не существует также особых ограничений на природу используемых восстановителей, и любой восстановитель, обычно используемый в реакциях такого типа, одинаково может быть здесь использован. Примеры такого восстановителя включают, кроме прочих, боргидрид натрия, цианоборгидрид натрия и триацетоксиборгидрид натрия. Из них триацетоксиборгидрид натрия является предпочтительным. Требуемое для реакции количество восстановителя также может меняться в широких пределах в зависимости от многих факторов, особенно температуры- 10012615 реакции и природы исходных веществ и используемого растворителя. Однако при осуществлении реакции в предпочтительных условиях соотношение химических эквивалентов восстановителя и исходного вещества, равное 1:3, будет, как правило, достаточным. Реакция может протекать в широком интервале температур, и точная температура реакции не является определяющей для изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходные вещества. Однако, вообще говоря, удобно осуществлять реакцию при температуре от приблизительно -20 до приблизительно 60 С. Время, необходимое для реакции, может также меняться в широких пределах в зависимости от многих факторов, особенно температуры реакции и природы исходных веществ и используемого растворителя. Однако при условии, что реакцию осуществляют в описанных выше предпочтительных условиях, период от приблизительно 5 мин до приблизительно 24 ч, как правило, будет достаточным. В случае, когда R5a представляет собой группу соединений, отвечающих формуле -COOR6, получение карбоксигруппы будет сопровождаться реакцией удаления защитной группы. Реакция может быть осуществлена в условиях, аналогичных условиям, описанным для стадии А 1 способа А. Способ С. Нижеследующее иллюстрирует получение соединений формулы (II). Реакционная схема С На реакционной схеме С R8 представляет собой C1-C4-алкильную группу, предпочтительно метильную или этильную; а заместитель X определен выше. Стадия С 1. На этой стадии соединение формулы (X) получают (С 1-а) сочетанием соединения формулы (VIII) и соединения формулы (IX) с последующим (C1-b) декарбоксилированием полученного соединения. Соединение формулы (VIII) и соединение формулы (IX) коммерчески доступны.(С 1-а) Сочетание с соединением формулы (VIII). Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особых ограничений на природу используемого растворителя при условии, что он не оказывает вредного воздействия на течение реакции или на включенные реагенты и способен растворять реагенты, по крайней мере, до некоторой степени. Примеры пригодных растворителей включают простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран и диоксан; амиды, такие как формамид,N,N-диметилформамид, N,N-диметилацетамид и гексаметилтриамид фосфорной кислоты; и сульфоксиды, такие как диметилсульфоксид и сульфолан. Из этих растворителей N,N-диметилсульфоксид является предпочтительным. Реакцию осуществляют в присутствии основания. Также не существует особых ограничений на природу используемых оснований, и любое основание, обычно используемое в реакциях такого типа,одинаково может быть здесь использовано. Примеры таких оснований включают гидриды щелочных металлов, такие как гидрид лития, гидрид натрия и гидрид калия; алкоксиды щелочных металлов, такие как метилат натрия, этилат натрия, т-бутилат калия; карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия и карбонат калия; и амиды щелочных металлов, такие как амид лития, амид натрия, амид калия, диизопропиламид лития, диизопропиламид калия, диизопропиламид натрия, бис(триметилсилил)амид лития и бис-(триметилсилил)амид калия. Из них предпочтительным является гидрид натрия. Реакция может протекать в широком интервале температур, и точная температура реакции не является определяющей для изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходные вещества. Однако, вообще говоря, удобно осуществлять реакцию при температуре от приблизительно 20 до приблизительно 200 С. Время, необходимое для реакции, может также меняться в широких пределах в зависимости от многих факторов, особенно температуры реакции и природы исходных веществ и используемого растворителя. Однако при условии, что реакцию осуществляют в описанных выше предпочтительных условиях, период от приблизительно 10 мин до приблизительно 24 ч, как правило, будет достаточным.(C1-b) Декарбоксилирование. Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особых ограничений на природу используемого растворителя при условии, что он не оказывает вредного воздействия на течение реакции или на включенные реагенты и способен растворять реагенты, по крайней мере, до некоторой степени. Примеры пригодных растворителей включают простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран и диоксан; амиды, такие как формамид,N,N-диметилформамид, N,N-диметилацетамид и гексаметилтриамид фосфорной кислоты; и сульфоксиды, такие как диметилсульфоксид и сульфолан. Из этих растворителей N,N-диметилсульфоксид является предпочтительным. Реакцию осуществляют в присутствии галогенида металла и воды. Не существует особых ограничений на природу используемого галогенида металла при условии, что он не оказывает вредного воздействия на течение реакции, по крайней мере, до некоторой степени. Примеры галогенида металла включают хлорид лития, хлорид калия, хлорид натрия и йодид натрия. Из них предпочтительным является хлорид лития. Реакция может протекать в широком интервале температур, и точная температура реакции не является определяющей для изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходные вещества. Однако, вообще говоря, удобно осуществлять реакцию при температуре от приблизительно 50 до приблизительно 200 С. Время, необходимое для реакции, может также меняться в широких пределах в зависимости от многих факторов, особенно температуры реакции, и природы исходных веществ и используемого растворителя. Однако при условии, что реакцию осуществляют в описанных выше предпочтительных условиях, период от приблизительно 10 мин до приблизительно 24 ч, как правило, будет достаточным. Стадия С 2. На этой стадии соединение формулы (XI) получают алкилированием соединения формулы (X) соединениями формул R2-X и R3-X. Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особых ограничений на природу используемого растворителя при условии, что он не оказывает вредного воздействия на течение реакции или на включенные реагенты и способен растворять реагенты, по крайней мере, до некоторой степени. Примеры пригодных растворителей включают простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран и диоксан; амиды, такие как формамид,N,N-диметилформамид, N,N-диметилацетамид и гексаметилтриамид фосфорной кислоты; и сульфоксиды, такие как диметилсульфоксид и сульфолан. Из этих растворителей N,N-диметилформамид является предпочтительным. Реакцию осуществляют в присутствии основания. Также не существует особых ограничений на природу используемых оснований; и любое основание, обычно используемое в реакциях такого типа,одинаково может быть здесь использовано. Примеры таких оснований включают гидриды щелочных металлов, такие как гидрид лития, гидрид натрия и гидрид калия; алкоксиды щелочных металлов, такие как метилат натрия, этилат натрия, т-бутилат калия; карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия и карбонат калия; амиды щелочных металлов, такие как амид лития, амид натрия,амид калия, диизопропиламид лития, диизопропиламид калия, диизопропиламид натрия, бис(триметилсилил)амид лития и бис-(триметилсилил)амид калия; и органические соединения лития, такие как н-бутиллитий, втор-бутиллитий, т-бутиллитий и фениллитий. Из них предпочтительным является гидрид натрия или н-бутиллитий. Реакцию могут проводить в присутствии или в отсутствие добавок, таких как 16-краун-6, N,N,N'N'тетраметилэтилендиамин (TMEDA) и гексаметилтриамид фосфорной кислоты (НМРА). Из этих добавок 16-краун-6 или TMEDA является предпочтительным. Реакция может протекать в широком интервале температур, и точная температура реакции не является определяющей для изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходные вещества. Однако, вообще говоря, удобно осуществлять реакцию при температуре от приблизительно 50 до приблизительно 200 С. Время, необходимое для реакции, может также меняться в широких пределах в зависимости от многих факторов, особенно температуры реакции, и природы исходных веществ и используемого растворителя. Однако при условии, что реакцию осуществляют в описанных выше предпочтительных условиях, период от приблизительно 10 мин до приблизительно 24 ч, как правило, будет достаточным. Стадия C3. На этой стадии соединение формулы (II) получают путем прокаливания соединения формулы (XI) в восстановительных условиях. Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особых ограничений на природу используемого растворителя при условии, что он не оказывает вредного воздействия на течение реакции или на включенные реагенты и способен растворять реагенты, по крайней мере, до некоторой степени. Примеры пригодных растворителей включают спирты, такие как метанол, этанол, пропанол, 2-пропанол и бутанол; и сложные эфиры, такие как этилацетат и пропилацетат. Из- 12012615 этих растворителей метанол является предпочтительным. Реакцию осуществляют в присутствии восстановителя. Не существует также особых ограничений на природу используемых восстановителей, и любой восстановитель, обычно используемый в реакциях такого типа, одинаково может быть здесь использован. Примеры такого восстановителя включают комбинации поставщика водорода, такого как газообразный водород и формиат аммония, и катализатора,такого как палладий/углерод, платина и никель Ренея; и комбинацию металлов, таких как цинк и железо,и кислот, таких как хлористо-водородная кислота, уксусная кислота и комплекс уксусная кислотахлорид аммония. Из них комбинация железа и уксусной кислоты является предпочтительной. Реакция может протекать в широком интервале температур, и точная температура реакции не является определяющей для изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходные вещества. Однако, вообще говоря, удобно осуществлять реакцию при температуре от приблизительно 10 до приблизительно 50 С в случае применения в качестве восстановителя комбинации поставщика водорода и катализатора или от приблизительно 50 до приблизительно 200 С в случае применения в качестве восстановителя комбинации металлов и кислот. Время,необходимое для реакции, может также меняться в широких пределах в зависимости от многих факторов, особенно температуры реакции и природы исходных веществ и используемого растворителя. Однако при условии, что реакцию осуществляют в описанных выше предпочтительных условиях, период от приблизительно 10 мин до приблизительно 24 ч, как правило, будет достаточным. Способ D. Нижеследующее иллюстрирует получение соединения формулы (II). Реакционная схема D В реакционной схеме D каждый из Ra и X определен выше. Стадия D1. На этой стадии соединение формулы (XII) получают прокаливанием соединения формулы (X), которое является коммерчески доступным, или его получают в соответствии со стадией С 1 способа С. Реакцию могут осуществлять в условиях, аналогичных условиям, описанным для стадии C3 способа С. Стадия D2. На этой стадии соединение формулы (II) получают алкилированием соединения формулы (XII) соединениями формулы R2-X и R3-X. Реакцию могут осуществлять в условиях, аналогичных условиям,описанным для стадии С 2 способа С. Способ Е. Нижеследующее иллюстрирует получение соединения формулы (III). Реакционная схема Е В реакционной схеме Е каждый из X, Аа и R3a определен выше; a R9 представляет собой аминозащитную группу. Стадия Е 1. На этой стадии соединение формулы (XIV) получают сочетанием соединения формулы (XIII) с соединением формулы (VI) или посредством восстановительного аминирования соединения формулы(XIII) соединением формулы (VII). Соединение формулы (XIII) или является коммерчески доступным,или может быть получено способами Н и I, предлагаемыми ниже. Стадия Е 2. На этой стадии соединение формулы (III) получают путем удаления защиты от соединения формулы (XIV), получаемого, как описано для стадии Е 1. Реакцию могут осуществлять в условиях, аналогичных условиям, описанным для стадии В 1 способа В.- 13012615 Способ F. Нижеследующее иллюстрирует получение соединения формулы (III), где А представляет собой Ab. Реакционная схема F На реакционной схеме F каждый из F, R5a, R6 и R9 определен выше; R10 представляет собой силильную группу, такую как т-бутилдиметилсилил, т-бутилдифенилсилил, триэтилсилил или триметилсилил,предпочтительно триметилсилил; R11 и R12 независимо представляют собой атом галогена,C1-C4-алкильную группу, гидроксизамещенную C1-C4-алкильную группу и C1-C2-алкоксизамещеннуюC1-C4-алкильную группу, где R11 и R12, необязательно, могут вместе с атомом углерода, к которому они присоединены, образовывать 3-6-членное кольцо; Ab является А, определенным выше, с той оговоркой,что метиленовая группа и замещенная метиленовая группа исключаются; a Y представляет собой алкоксигруппу, имеющую от 1 до 4 атомов углерода, имидазолильную группу или фталимидильную группу. Стадия F1. На этой стадии соединение формулы (XV) получают по реакции конденсации соединения формулы(XIII) с соединением формулы H-Y, в присутствии параформальдегида. Соединение формулы (XIII) может быть получено способами Н и I или же является коммерчески доступным. В случае, когда Y не является алкоксигруппой, реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особых ограничений на природу используемого растворителя при условии, что он не оказывает вредного воздействия на течение реакции или на включенные реагенты и способен растворять реагенты, по крайней мере, до некоторой степени. Примеры пригодных растворителей включают, кроме прочих, галогенированные углеводороды, такие как дихлорметан, хлороформ,четыреххлористый углерод и 1,2-дихлорэтан; и спирты, такие как метанол, этанол, пропанол,2-пропанол и бутанол. Из них дихлорметан или этанол являются предпочтительными. Реакция может протекать в широком интервале температур, и точная температура реакции не является определяющей для изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходные вещества. Однако, вообще говоря, удобно осуществлять реакцию при температуре от приблизительно 0 до приблизительно 120 С. Время, необходимое для реакции, может также меняться в широких пределах в зависимости от многих факторов, особенно температуры реакции, и природы исходных веществ и используемого растворителя. Однако при условии, что реакцию осуществляют в описанных выше предпочтительных условиях период от приблизительно 5 мин до приблизительно 48 ч, как правило, будет достаточным. Стадия F2. На этой стадии соединение формулы (IIIa) получают по реакции Манниха соединения формулы(XV) с соединением формулы (XVI). Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особых ограничений на природу используемого растворителя при условии, что он не оказывает вредного воздействия на течение реакции или на включенные реагенты и способен растворять реагенты, по крайней мере, до некоторой степени. Примеры пригодных растворителей включают, кроме прочих, галогенированные углеводороды, такие как дихлорметан, хлороформ, четыреххлористый углерод и 1,2-дихлорэтан; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран и диоксан; нитрилы, такие как ацетонитрил и бензонитрил; и амиды, такие как формамид,N,N-диметилформамид, N,N-диметилацетамид и гексаметилтриамид фосфорной кислоты. Из этих растворителей дихлорметан является предпочтительным. Реакцию осуществляют в присутствии кислоты Льюиса. Также не существует особых ограничений на природу используемых кислот Льюиса; и любая кислота Льюиса, обычно используемая в реакциях такого типа, может здесь одинаково быть использована. Примеры такой кислоты Льюиса включают,кроме прочих, BF3, AlCl3, FeCl3, MgCl2, AgCl, Fe(NO3)3, CF3SO3Si(CH3)3, Yb(CF3SO3)3 и SnCl4. Из нихYb(CF3SO3)3, CF3SO3Si(CH3)3 или MgCl2 являются предпочтительными. Реакция может протекать в широком интервале температур, и точная температура реакции не является определяющей для изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходные вещества. Однако, вообще говоря, удобно осуществлять реакцию при температуре от приблизительно 0 до приблизительно 100 С. Время, необходимое для реакции, может также меняться в широких пределах в зависимости от многих факторов, особенно температуры реакции, и природы исходных веществ и используемого растворителя. Однако при условии, что реакцию осуществляют в описанных выше предпочтительных условиях, период от приблизительно 5 мин до приблизительно 24 ч, как правило, будет достаточным.- 14012615 Способ G. Нижеследующее иллюстрирует получение соединения формулы (III), где R4 представляет собой атом водорода и А является Ab. Реакционная схема G На реакционной схеме G каждый из Аа, Ab и R5a определен выше; каждый из R и R' представляет собой C1-C4-алкильную группу, предпочтительно метильную группу, или аралкильную группу, такую как бензильная или фенэтильная группа, предпочтительно бензильную группу. Стадия G1. На этой стадии соединение формулы (XVI) получают путем восстановления цианогруппы соединения формулы (XV), которое является коммерчески доступным. Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особых ограничений на природу используемого растворителя при условии, что он не оказывает вредного воздействия на течение реакции или на включенные реагенты и способен растворять реагенты, по крайней мере, до некоторой степени. Примеры пригодных растворителей включают, кроме прочих, простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран и диоксан; ароматические углеводороды, такие как бензол, толуол и нитробензол; и спирты, такие как метанол, этанол, пропанол,2-пропанол и бутанол. Из них метанол является предпочтительным. Реакцию осуществляют в присутствии восстановителя. Не существует также особых ограничений на природу используемых восстановителей, и любой восстановитель, обычно используемый в реакциях такого типа, одинаково может быть здесь использован. Примеры таких восстановителей включают, кроме прочих, боргидриды металлов, таких как боргидрид натрия и цианоборгидрид натрия в комбинации газообразного водорода и катализатора, такого как палладий/углерод, платина и никель Ренея; и соединения гидридов, такие как алюмогидрид лития, диизобутилалюмогидрид. Из них никель Ренея является предпочтительным. Реакция может протекать в широком интервале температур, и точная температура реакции не является определяющей для изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходные вещества. Однако, вообще говоря, удобно осуществлять реакцию при температуре от приблизительно 0 до приблизительно 100 С. Время, необходимое для реакции, может также меняться в широких пределах в зависимости от многих факторов, особенно температуры реакции и природы исходных веществ и используемого растворителя. Однако при условии, что реакцию осуществляют в описанных выше предпочтительных условиях, период от приблизительно 5 мин до приблизительно 24 ч, как правило, будет достаточным. Стадия G2. На этой стадии соединение формулы (XVIII) получают взаимодействием соединения формулы(XVII), которое является коммерчески доступным, с соединением формулы (XVI). Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особых ограничений на природу используемого растворителя при условии, что он не оказывает вредного воздействия на течение реакции или на включенные реагенты и способен растворять реагенты, по крайней мере, до некоторой степени. Примеры пригодных растворителей включают, кроме прочих, воду и спирты, такие как метанол, этанол, пропанол, 2-пропанол и бутанол. Из них смесь воды и этанола является предпочтительной. Реакцию осуществляют в присутствии основания. Также не существует особых ограничений на природу используемого основания, и любое основание, обычно используемое в реакциях такого типа,может быть здесь одинаково использовано. Примеры таких оснований включают, кроме прочих, гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия; алкоксиды щелочных металлов, такие как метилат натрия, этилат натрия, т-бутилат калия; и карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия и карбонат калия. Из них карбонат калия является предпочтительным. Реакция может протекать в широком интервале температур, и точная температура реакции не является определяющей для изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходные вещества. Однако, вообще говоря, удобно осуществлять реакцию при температуре от приблизительно 0 до приблизительно 120 С. Время, необходимое для реак- 15012615 ции, может также меняться в широких пределах в зависимости от многих факторов, особенно температуры реакции, и природы исходных веществ и используемого растворителя. Однако при условии, что реакцию осуществляют в описанных выше предпочтительных условиях, период от приблизительно 5 мин до приблизительно 24 ч, как правило, будет достаточным. Стадия G3. На этой стадии соединение формулы (XIX) получают посредством преобразования оксогруппы соединения формулы (XVIII) в присутствии п-толуолсульфонилметилизоцианида в цианогруппу. Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особых ограничений на природу используемого растворителя при условии, что он не оказывает вредного воздействия на течение реакции или на включенные реагенты и способен растворять реагенты, по крайней мере, до некоторой степени. Примеры пригодных растворителей включают, кроме прочих, простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, диметиловый эфир этиленгликоля, тетрагидрофуран и диоксан; и спирты, такие как метанол, этанол, пропанол, 2-пропанол и бутанол. Из них смесь диметилового эфира этиленгликоля и этанола является предпочтительной. Реакцию осуществляют в присутствии основания. Также не существует особых ограничений на природу используемого основания, и любое основание, обычно используемое в реакциях этого типа, может быть здесь одинаково использовано. Примеры таких оснований включают, кроме прочих, алкоксиды щелочных металлов, такие как метилат натрия, этилат натрия и т-бутилат калия. Из них предпочтительным является т-бутилат калия. Реакция может протекать в широком интервале температур, и точная температура реакции не является определяющей для изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходные вещества. Однако, вообще говоря, удобно осуществлять реакцию при температуре от приблизительно 0 до приблизительно 100 С. Время, необходимое для реакции, может также меняться в широких пределах в зависимости от многих факторов, особенно температуры реакции, и природы исходных веществ и используемого растворителя. Однако при условии, что реакцию осуществляют в описанных выше предпочтительных условиях, период от приблизительно 5 мин до приблизительно 24 ч, как правило, будет достаточным. Стадия G4. На этой стадии соединение формулы (IIIb) получают восстановлением цианогруппы соединения формулы (XIX). Реакцию могут осуществлять в условиях, аналогичных условиям, описанным для стадииG1 способа G. Способ Н. Нижеследующее иллюстрирует получение соединения формулы (XIII), где R4 представляет собой атом галогена. Реакционная схема Н В реакционной схеме H R4a представляет собой атом галогена; R9 определен выше; a R13 представляет собой аминозащитную группу, предпочтительно бензоильную группу. Стадия H1. На этой стадии соединение формулы (XXI) получают, превращая карбонильную группу соединения формулы (XX) в эпоксидную группу. Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особых ограничений на природу используемого растворителя при условии, что он не оказывает вредного воздействия на течение реакции или на включенные реагенты и способен растворять реагенты, по крайней мере, до некоторой степени. Примеры пригодных растворителей включают, кроме прочих, амиды,такие как формамид, N,N-диметилформамид, N,N-диметилацетамид и гексаметилтриамид фосфорной кислоты; и сульфоксиды, такие как диметилсульфоксид или сульфолан. Из этих растворителей диметилсульфоксид является предпочтительным.- 16012615 Реакцию осуществляют в присутствии основания. Не существует также особых ограничений на природу используемых оснований, и любое основание, обычно используемое в реакциях этого типа, может быть здесь одинаково использовано. Примеры таких оснований включают, кроме прочих, алкоксиды щелочных металлов, такие как метилат натрия, этилат натрия, т-бутилат калия; и карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия и карбонат калия. Из них т-бутилат калия является предпочтительным. Реакция может протекать в широком интервале температур, и точная температура реакции не является определяющей для изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходные вещества. Однако, вообще говоря, удобно осуществлять реакцию при температуре от приблизительно 0 до приблизительно 100 С. Время, необходимое для реакции, может также меняться в широких пределах в зависимости от многих факторов, особенно температуры реакции, и природы исходных веществ и используемого растворителя. Однако при условии, что реакцию осуществляют в описанных выше предпочтительных условиях, период от приблизительно 5 мин до приблизительно 24 ч, как правило, будет достаточным. Стадия Н 2. На этой стадии соединение формулы (XXII) получают взаимодействием галогенида водорода с соединением формулы (XXI). Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особых ограничений на природу используемого растворителя при условии, что он не оказывает вредного воздействия на течение реакции или на включенные реагенты и способен растворять реагенты, по крайней мере, до некоторой степени. Примеры пригодных растворителей включают, кроме прочих, простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран и диоксан; амиды, такие как формамид, N,N-диметилформамид, N,N-диметилацетамид и гексаметилтриамид фосфорной кислоты. Из этих растворителей тетрагидрофуран является предпочтительным. Реакция может протекать в широком интервале температур, и точная температура реакции не является определяющей для изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходные вещества. Однако, вообще говоря, удобно осуществлять реакцию при температуре от приблизительно 0 до приблизительно 100 С. Время, необходимое для реакции, может также меняться в широких пределах в зависимости от многих факторов, особенно температуры реакции, и природы исходных веществ и используемого растворителя. Однако при условии, что реакцию осуществляют в описанных выше предпочтительных условиях, период от приблизительно 5 мин до приблизительно 24 ч, как правило, будет достаточным. Стадия H3. На этой стадии соединение формулы (XXIII) получают реакцей соединения формулы (XXII) с азидом натрия (Н 3-а) с последующим восстановлением азидной группы (Н 3-b).(Н 3-а) реакция с азидом натрия. Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особых ограничений на природу используемого растворителя при условии, что он не оказывает вредного воздействия на течение реакции или на включенные реагенты и способен растворять реагенты, по крайней мере, до некоторой степени. Примеры пригодных растворителей включают, кроме прочих, галогенированные углеводороды, такие как дихлорметан, хлороформ, четыреххлористый углерод и 1,2-дихлорэтан; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран и диоксан; амиды, такие как формамид, N,N-диметилформамид, N,N-диметилацетамид и гексаметилтриамид фосфорной кислоты; и сульфоксиды, такие как диметилсульфоксид или сульфолан. Из этих растворителей N,N-диметилформамид является предпочтительным. Перед добавлением азида натрия, гидроксигруппу добавлением таких реагентов, как трифторметансульфонилхлорид, мезилхлорид и тозилхлорид, превращают в отщепляемую группу, такую как метилсульфонильная группа, трифторметилсульфонильная группа и 4-метилфенилсульфонильная группа. Из этих реагентов мезилхлорид является предпочтительным. Реакция может протекать в широком интервале температур, и точная температура реакции не является определяющей для изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходные вещества. Однако, вообще говоря, удобно осуществлять реакцию при температуре от приблизительно 0 до приблизительно 120 С. Время, необходимое для реакции, может также меняться в широких пределах в зависимости от многих факторов, особенно температуры реакции и природы исходных веществ и используемого растворителя. Однако при условии, что реакцию осуществляют в описанных выше предпочтительных условиях, период от приблизительно 5 мин до приблизительно 24 ч, как правило, будет достаточным.(Н 3-b) Восстановление. Реакцию могут осуществлять в условиях, аналогичных условиям, описанным для стадии G1 способа G. Стадия Н 4. На этой стадии соединение формулы (XIIIa) получают путем введения аминозащитной группы R9 к первичной аминогруппе (Н 4-а), селективно удаляя аминозащитную группу R13 вторичной аминогруппы(Н 4-а) Введение аминозащитной группы. Эту реакцию подробно описывают Т.W. Greene et al. [Protective Groups in Organic Synthesis, 494-653,(1999)]; описание ее включено здесь в виде ссылки. Нижеследующее иллюстрирует типичные реакции,включающие т-бутоксикарбонильную защитную группу. Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особых ограничений на природу используемого растворителя при условии, что он не оказывает вредного воздействия на течение реакции или на включенные реагенты и способен растворять реагенты, по крайней мере, до некоторой степени. Примеры пригодных растворителей включают, кроме прочих, воду,простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран и диоксан; сульфоксид, такой как диметилсульфоксид и сульфолан. Из этих растворителей тетрагидрофуран является предпочтительным. Реакцию осуществляют в присутствии реагента. Не существует также особых ограничений на природу используемых реагентов, и любой реагент, обычно используемый в реакциях этого типа, может быть здесь одинаково использован. Примеры таких реагентов включают, кроме прочих,ди-т-бутилкарбонат и 1-(т-бутоксикарбонил)бензотриазол. Из них ди-т-бутилкарбонат является предпочтительным. Реакция может протекать в широком интервале температур, и точная температура реакции не является определяющей для изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходные вещества. Однако, вообще говоря, удобно осуществлять реакцию при температуре от приблизительно 0 до приблизительно 120 С. Время, необходимое для реакции, может также меняться в широких пределах в зависимости от многих факторов, особенно температуры реакции и природы исходных веществ и используемого растворителя. Однако при условии, что реакцию осуществляют в описанных выше предпочтительных условиях, период от приблизительно 5 мин до приблизительно 24 ч, как правило, будет достаточным.(Н 4-b) Удаление защиты. Этот способ подробно описан в Т.W. Greene et al., Protective Protective Groups in Organic Synthesis,494-653, (1999); это описание включено здесь в виде ссылки. Нижеследующее иллюстрирует типичный способ, включающий участие бензоильной защитной группы, в присутствии комбинаций газообразного водорода и катализатора, такого как палладий/углерод или платина. Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особых ограничений на природу используемого растворителя при условии, что он не оказывает вредного воздействия на течение реакции или на включенные реагенты и способен растворять реагенты, по крайней мере, до некоторой степени. Примеры пригодных растворителей включают, кроме прочих, галогенированные углеводороды, такие как дихлорметан, хлороформ, четыреххлористый углерод и 1,2-дихлорэтан; спирты, такие как метанол, этанол, пропанол, 2-пропанол и бутанол; и простые эфиры,такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран и диоксан. Из этих растворителей метанол является предпочтительным. Реакция может протекать в широком интервале температур, и точная температура реакции не является определяющей для изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходные вещества. Однако, вообще говоря, удобно осуществлять реакцию при температуре от приблизительно 0 до приблизительно 120 С. Время, необходимое для реакции, может также меняться в широких пределах в зависимости от многих факторов, особенно температуры реакции и природы исходных веществ и используемого растворителя. Однако при условии, что реакцию осуществляют в описанных выше предпочтительных условиях, период от приблизительно 5 мин до приблизительно 24 ч, как правило, будет достаточным.- 18012615 Способ I. Нижеследующее иллюстрирует получение соединения формулы (XIII), где R4 представляет собой гидроксигруппу. Реакционная схема I В реакционной схеме I каждый из R9 и R13 определен выше. Стадия I1. На этой стадии соединение формулы (XXIV) получают взаимодействием карбонильной группы коммерчески доступного соединения формулы (XX) с триметилсилилцианидом. Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует особых ограничений на природу используемого растворителя при условии, что он не оказывает вредного воздействия на течение реакции или на включенные реагенты и способен растворять реагенты, по крайней мере, до некоторой степени. Примеры пригодных растворителей включают, кроме прочих, ароматический углеводороды, такие как бензол, толуол и нитробензол; галогенированные углеводороды, такие как дихлорметан, хлороформ, четыреххлористый углерод и 1,2-дихлорэтан; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, диметиловый эфир этиленгликоля, тетрагидрофуран и диоксан; нитрилы, такие как ацетонитрил и бензонитрил; и спирты, такие как метанол, этанол, пропанол, 2 пропанол и бутанол. Из них толуол является предпочтительным. Реакцию осуществляют в присутствии реагента. Не существует также особых ограничений на природу используемых реагентов, и любой реагент, обычно используемый в реакциях этого типа, может быть здесь одинаково использован. Примеры таких реагентов включают, кроме прочих, кислоты Льюиса,такие как BF3, AlCl3, FeCl3, AgCl, ZnI2, Fe(NO3)3, CF3SO3Si(CH3)3, Yb(CF3SO3)3 и SnCl4; основания, такие как СаО; простые эфиры, такие как 18-краун-6; кислоты, такие как смола Amberlite XAD-4. Из них ZnI2 является предпочтительным. Реакция может протекать в широком интервале температур, и точная температура реакции не является определяющей для изобретения. Предпочтительная температура реакции будет зависеть от таких факторов, как природа растворителя и исходные вещества. Однако, вообще говоря, удобно осуществлять реакцию при температуре от приблизительно 0 до приблизительно 100 С. Время, необходимое для реакции, может также меняться в широких пределах в зависимости от многих факторов, особенно температуры реакции и природы исходных веществ и используемого растворителя. Однако при условии, что реакцию осуществляют в описанных выше предпочтительных условиях, период от приблизительно 5 мин до приблизительно 24 ч, как правило, будет достаточным. Стадия I2. На этой стадии соединение формулы (XXV) получают путем превращения цианогруппы соединения формулы (XXII) в аминогруппу. Реакцию можно осуществлять в условиях, аналогичных условиям,описанным для стадии G1 способа G. Стадия I3. На этой стадии соединение формулы (XIIIa) получают, защищая аминогруппы соединения формулы (XXV) и удаляя защиту. Реакцию можно осуществлять в условиях, аналогичных условиям, описанным для стадии Н 4 способа Н. Соединения формулы (I) и интермедиаты из вышеупомянутых способов получения могут быть выделены и очищены по стандартным методикам, таким как очистка путем дистилляции, перекристаллизации или хроматографии. Соединения по изобретению, предназначенные для фармацевтического применения, могут быть введены в форме кристаллических или аморфных продуктов. Они могут, например, быть получены в виде плотной массы, порошков или пленок, такими способами, как осаждение, кристаллизация, лиофильная сушка, распылительная сушка и сушка выпариванием. Для этих целей может быть использована индукционная сушка или радиочастотная сушка. Стандартные методики получения/изолирования отдельных энантиомеров включают хиральный синтез из пригодного оптически чистого предшественника или разделение на составляющие рацемической смеси (или рацемической смеси соли или производного), используя, например, хиральную жидкостную хроматографию высокого давления (HPLC).- 19012615 Альтернативно, способ оптического разделения на составляющие рацемической смеси (или рацемического предшественника) может быть надлежащим образом выбран из стандартных методик, например селективной кристаллизации, разделения диастереомерных солей между основной частью соединения формулы (I) и соответствующей оптически активной кислотой, такой как винная кислота. Соединения по изобретению, предназначенные для фармацевтического применения, могут быть введены в виде кристаллических или аморфных продуктов. Они могут быть получены, например, в виде плотной массы, порошков или пленок такими способами, как осаждение, кристаллизация, лиофильная сушка, распылительная сушка или сушка выпариванием. Для этих целей может быть использована индукционная или радиочастотная сушка. Они могут быть введены сами по себе или в комбинации с одним или несколькими другими соединениями по изобретению или в комбинации с одним или несколькими другими лекарственными средствами (или в виде любой их комбинации). Обычно их вводят в виде фармацевтической композиции или состава вместе с одним или несколькими фармацевтически приемлемыми носителями или наполнителями. Термин "носитель" или "наполнитель" используют здесь для обозначения любого ингредиента, отличного от соединения(ий) по изобретению. Выбор носителя или наполнителя будет в большой степени зависеть от таких факторов, как конкретный вид введения, воздействие наполнителя на растворимость и устойчивость и природа лекарственной формы. Фармацевтические композиции, пригодные для доставки соединений по настоящему изобретению,и способы их получения будут очевидны для специалистов в данной области. Такие композиции и способы их получения могут быть найдены, например, Remington's Pharmaceutical Sciences', 19th Edition(Mack Publishing Company, 1995). Оральное введение. Соединения по изобретению могут быть введены орально. Оральное введение может включать глотание, так что соединение поступает в желудочно-кишечный тракт, или можно использовать буккальное или сублингвальное введение, в результате которых соединение поступает в кровоток непосредственно из ротового отверстия. Препараты, пригодные для орального введения, включают твердые препараты,такие как, например, таблетки, капсулы, содержащие частицы, жидкости или порошки, лепешки (включая заполненные жидкостью), жвачки, мульти- и наночастицы, гели, твердые растворы, липосомы, пленки (включая прилипающие к слизистой оболочке), овули, аэрозоли и жидкие препараты. Жидкие препараты включают, например, суспензии, растворы, сиропы и элексиры. Такие препараты могут быть использованы в виде наполнителей мягких или твердых капсул и обычно содержат носитель, например воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу или пригодное масло и один или несколько эмульгирующих агентов и/или суспендирующих агентов. Жидкие препараты могут также быть получены путем воссоздания из твердого вещества, например из саше с сухим лекарственным средством. Соединения по изобретению можно также использовать в быстро растворяющихся, быстро расщепляющихся лекарственных формах, таких как лекарственные формы, описанные в Expert Opinion in Therapeutic Patents. 11 (6), 981-986 Liang and Chen (2001). В таблетированных лекарственных формах, в зависимости от дозы, лекарственное средство может составлять от приблизительно 1 до приблизительно 80 мас.% лекарственной формы, более обычно от приблизительно 5 до приблизительно 60 мас.% лекарственной формы. В дополнение к лекарственному средству таблетки обычно содержат расщепляющий агент. Примеры расщепляющих агентов включают натрий-крахмалгликолат, натрий-карбоксиметилцеллюлозу, кальций-карбоксиметилцеллюлозу, кроскармеллозу-натрий, кросповидон, поливинилпирролидон, метилцеллюлозу, микрокристаллическую целлюлозу, замещенную низшим алкилом гидроксипропилцеллюлозу, крахмал, предварительно клейстеризованный крахмал, и альгинат натрия. Обычно расщепляющий агент будет составлять от приблизительно 1 до приблизительно 25 мас.% предпочтительно от приблизительно 5 до приблизительно 20 мас.% от лекарственной формы. Связующие агенты обычно используют для придания когезионных свойств таблетированному препарату. Пригодные связующие агенты включают микрокристаллическую целлюлозу, желатин, сахара,полиэтиленгликоль, натуральные и синтетические смолы, поливинилпирролидон, предварительно клейстеризованный крахмал, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу. Таблетки могут также содержать разбавители, такие как лактозу (моногидрат лактозы, высушенный спрей моногидрата лактозы, безводную лактозу и т.п.), маннит, ксилит, декстрозу, сахарозу, сорбит, микрокристаллическую целлюлозу, крахмал и дигидрат двухосновного фосфата кальция. Таблетки также могут необязательно содержать поверхностно-активные агенты, такие как лаурилсульфат натрия и полисорбат 80, и агенты, облегчающие проскальзывание, такие как двуокись кремния и тальк. Поверхностно-активные агенты, в случае их присутствия, могут составлять от приблизительно 0,2 до приблизительно 5 мас.% от состава таблетки; а агенты, облегчающие скольжение, могут составлять от приблизительно 0,2 до приблизительно 1 мас.% от состава таблетки.- 20012615 Таблетки также обычно содержат смазывающие вещества, такие как стеарат магния, стеарат кальция, стеарат цинка, стеарилфумарат натрия, смеси стеарата магния с лаурилсульфатом натрия. Смазывающие вещества обычно составляют от приблизительно 0,25 до приблизительно 10 мас.%, предпочтительно от приблизительно 0,5 до приблизительно 3 мас.% от состава таблетки. Другие возможные ингредиенты включают антиоксиданты, окрашивающие агенты, ароматизирующие агенты, консерванты и маскирующие вкус агенты. Типовые таблетки содержат примерно до приблизительно 80% лекарственного средства; от приблизительно 10 до приблизительно 90 мас.% связующего агента; от приблизительно 0 до приблизительно 85 мас.% разбавителя; от приблизительно 2 до приблизительно 10 мас.% расщепляющего агента и от приблизительно 0,25 до приблизительно 10 мас.% смазывающего вещества. Для образования таблеток смеси для таблетирования могут быть непосредственно спрессованы или же спрессованы с помощью вальцевания. Смеси для таблетирования или порции смесей могут быть альтернативно подвергнуты гранулированию посредством влажного или сухого гранулирования или путем гранулирования расплава; замораживания расплава или экструдирования перед таблетированием. Конечный препарат может содержать один или несколько слоев и может быть покрыт оболочкой или не покрыт оболочкой; он даже может быть инкапсулирован. Состав таблеток обсуждают в "Pharmaceutical Dosage Forms: Tablets, vol. 1", H. Lieberman andL. Lachman, Marcel Dekker, N.Y., N.Y., 1980 (ISBN 0-8247-6918-X). Твердые препараты для орального введения могут быть сформированы для немедленного и/или дозированного высвобождения. Препараты дозированного высвобождения включают препараты с замедленным, непрерывным, импульсным, контролируемым, направленным на мишень и программируемым высвобождением. Пригодные для целей изобретения препараты с дозированным высвобождением описывают в патенте США 6106864. Подробности других пригодных способов высвобождения, таких как способы,использующие высокоэнергетические дисперсные системы, осмотические частицы и частицы, покрытые оболочкой, следует искать в Verma et al., Pharmaceutical Technology On-line, 25(2), 1-14 (2001). Применение жевательной резинки для достижения контролируемого высвобождения описывают в WO 00/35298. Парентеральное введение. Соединения по изобретению также могут быть введены прямо в кровоток, в мышцу или внутренний орган. Пригодные способы парентерального введения включают внутривенное, внутриартериальное,внутрибрюшинное, интратекальное, интравентрикулярное, интрауретральное, интрастернальное, интракарниальное, внутримышечное и подкожное введения. Пригодные устройства для парентерального введения включают иглу (включая микроиглу), шприцы, безыгольные шприцы и аппаратуру для инфузии. Парентеральные препараты обычно представляют собой водные растворы, которые могут содержать наполнители, такие как соли, карбогидраты и буферные агенты (предпочтительно для рН от приблизительно 3 до приблизительно 9). Но для некоторых применений они могут быть сформированы более приемлемым образом, в виде стерильных неводных растворов или в сухой форме для применения вместе с пригодным носителем, таким как стерильная, апирогенная вода. Получение парентеральных препаратов в стерильных условиях, например путем лиофилизации,может быть легко выполнено при использовании стандартных фармацевтических методик, хорошо известных специалистам в данной области. Растворимость соединений формулы (I), используемых при получении парентеральных растворов,может быть увеличена путем применения соответствующих методик получения препарата, таких как включение агентов, улучшающих растворимость. Препараты для парентерального введения могут быть сформированы для немедленного и/или дозированного высвобождения. Препараты дозированного высвобождения включают препараты с замедленным, непрерывным, импульсным, контролируемым, направленным на мишень и программируемым высвобождением. Таким образом, соединения по изобретению могут быть сформированы в виде твердых веществ, полутвердых веществ или тиксотропных жидкостей для введения в виде имплантированного депо, обеспечивающего дозированное высвобождение активного соединения. Примеры таких препаратов включают себя покрытые лекарственным средством стенты и PGLA микросферы. Местное введение. Соединения по изобретению могут также быть введены местно на кожу или слизистую оболочку,т.е. дермально или трансдермально. Обычные препараты для этой цели включают гели, гидрогели, лосьоны, растворы, кремы, мази, опудривающие средства, повязки, пены, пленки, пластыри на кожу, облатки,имплантанты, тампоны, волокна, перевязочные материалы и микроэмульсии. Также могут быть использованы липосомы. Обычные носители включают спирт, воду, минеральное масло, жидкий вазелин, медицинский вазелин, глицерин, полиэтиленгликоль и пропиленгликоль. Могут быть включены промоторы проникновения, см., например, J. Pharm. Sci., 88 (10), 955-958 by Finnin and Morgan (October 1999).- 21012615 Другие способы местного введения включают доставку путем электропорации, лекарственного электрофореза, фонофореза, сонофореза путем микроигольных или безыгольных (например,Powderject, Bioject и т.д.) инъекций. Препараты для местного введения могут быть сформированы для немедленного и/или дозированного высвобождения. Препараты дозированного высвобождения включают замедленное, непрерывное, импульсное, контролируемое, программируемое высвобождение и высвобождение, направленное на мишень. Введение вдыханием/интраназальное введение. Соединения по изобретению также могут быть введены интразально или ингаляцией. Обычно вводят в виде сухого порошка (или отдельного порошка в виде смеси, например сухой смеси с лактозой, или в виде частиц смешанного компонента, например, смешанного с фосфолипидами, такими как фосфатидилхолин), распыляемого из ингалятора для сухого порошка; или в виде аэрозольной жидкости, распыляемой из герметичного контейнера, пульверизатора, распылителя, (предпочтительно распылителя, для получения легкой дымки, использующего электрогидродинамику), или небулайзера, использующего или не использующего подходящий пропеллент, такой как 1,1,1,2-тетрафторэтан или 1,1,1,2,3,3,3 гептафторпропан. Порошок для интраназального применения может содержать биоадгезивный агент,например хитозан или циклодекстрин. Герметичный контейнер, пульверизатор, распылитель или небулайзер содержат раствор или суспензию соединения(ий) по изобретению, содержащую, например, этанол, водный этанол, или пригодный альтернативный агент для диспергирования, солюбилизации или пролонгированного высвобождения активного компонента, пропеллент(ы) в качестве растворителя и, необязательно, поверхностно-активное вещество, такое как сорбитантриолеат, олеиновую кислоту или олигомолочную кислоту. Перед применением в сухом порошке или в препарате в виде суспензии, лекарственный продукт очень тонко измельчают до размера, пригодного для доставки ингаляцией (обычно менее 5 мкм). Это может быть достигнуто любым подходящим способом измельчения, таким как измельчение на вихревой мельнице, измельчение на струйной мельнице с псевдоожиженным слоем, обработкой сверхкритической текучей средой с образованием наночастиц, гомогенизацией высокими давлениями или распылительной сушкой. Капсулы (выполненные, например, из желатина или гидроксипропилметилцеллюлозы (НРМС,блистеры и съемные блоки для применения в ингаляторе или инсуффляторе могут быть разработаны для содержания смеси порошков соединения по изобретению, пригодной основы порошка, такой как лактоза или крахмал и модификатора эффективности, такого как L-лейцин, маннит или стеарат магния. Лактоза может быть безводной или в виде моногидрата, что является предпочтительным. Другие пригодные наполнители включают декстран, глюкозу, мальтозу, сорбит, ксилит, фруктозу, сахарозу и трегалозу. Раствор пригодного состава для применения в распылителе, использующем электрогидродинамику для получения легкой дымки, может содержать от приблизительно 1 мкг до приблизительно 20 мг соединения по изобретению, приходящегося на один запуск; и объем одного запуска может меняться от приблизительно 1 до приблизительно 100 мкл. Типичный препарат может содержать соединение формулы (I), пропиленгликоль, стерильную воду, этанол и хлорид натрия. Альтернативные растворители, которые могут быть использованы вместо пропиленгликоля, включают глицерин и полиэтиленгликоль. Пригодные ароматизаторы, такие как ментол и левоментол или подсластители, такие как сахарин или натрийсахарин, могут быть добавлены к препаратам по изобретению, предназначенным для введения ингаляцией/интраназального введения. Препараты для введения ингаляцией/интраназального введения могут быть сформированы для немедленного и/или дозированного высвобождения, используя, например, поли(DL-молочную-согликолевую) кислоту (PGLA). Препараты дозированного высвобождения включают препараты с замедленным, непрерывным, импульсным, контролируемым, направленным на мишень и программируемым высвобождением. В случае ингаляторов для сухих порошков и аэрозолей, стандартную лекарственную дозу определяют посредством клапана, позволяющего выпускать дозированное количество. Устройства, в соответствии с изобретением, обычно приспособлены для введения отмеренной дозы или "пуффа", содержащей от приблизительно 1 до приблизительно 100 мкг соединения формулы (I). Полная суточная доза будет, как правило, находиться в диапазоне приблизительно от 50 мкг до приблизительно 20 мг; эта доза может быть введена в однократной дозе или чаще - в разделенных дозах на протяжении дня. Ректальное/интравагинальное введение. Соединения по изобретению могут быть введены ректально или вагинально, например в виде суппозитория, вагинального суппозитория или клизмы. Масло какао является обычным основанием суппозиториев, но могут быть использованы различные альтернативные варианты в качестве приемлемых. Препараты для ректального/вагинального введения могут быть сформированы для немедленного и/или дозированного высвобождения. Препараты дозированного высвобождения включают препараты с замедленным, непрерывным, импульсным, контролируемым, направленным на мишень и программируемым высвобождением.- 22012615 Глазное/ушное введение. Соединения по изобретению также могут быть введены непосредственно через глаз или ухо обычно в виде капель очень мелкодисперсной суспензии или раствора в изотоническом, откорректированном по рН, стерильном физиологическом растворе. Другие препараты, пригодные для введения через глаз или ухо, включают мази, способные к биорасщеплению (например, всасываемые гелевые губки, коллаген) и биологически нерасщепляемые (например, силикон) имплантаты, облатки, линзы и системы макрочастиц или везикулярные системы, такие как ниосомы или липосомы. Может быть включен такой полимер, как поливиниловый спирт, сшитая поперечными связями полиакриловая кислота, гиалуроновая кислота, полимер целлюлозы, например гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза или метилцеллюлоза, или полимер гетерополисахарида, например смола со свойствами геля, вместе с таким консервантом, как бензалконийхлорид. Такие препараты также могут быть доставлены посредством лекарственного электрофореза. Препараты дозированного высвобождения включают препараты с замедленным, непрерывным, импульсным, контролируемым, направленным на мишень и программируемым высвобождением. Другие технологии. Чтобы улучшить растворимость, скорость растворения, улучшить вкус, биодоступность и/или устойчивость при использовании в любом из указанных выше способов введения соединений по изобретению, они могут быть объединены с растворимыми макромолекулярными частицами, такими как циклодекстрин и его пригодные производные или содержащие полиэтиленгликоль полимеры. Обнаружено, например, что комплексы лекарственных средств с циклодекстрином обычно оказываются применимыми для большинства лекарственных форм и путей введения. Могут быть использованы как комплексы включения, так и комплексы, не относящиеся к комплексам включения. В качестве альтернативы прямому комплексообразованию с лекарственным средством, циклодекстрин может быть использован как дополнительная добавка, т.е. в качестве носителя, разбавителя или солюбилизатора. Наиболее часто для этих целей используют альфа-, бета- и гамма-циклодекстрины, примеры которых можно найти в WO 91/11172, WO 94/02518 и WO 98/55148. Набор компонентов. Ввиду того, что может оказаться желательным ввести комбинацию активных соединений, например, с целью лечения определенной болезни или состояния, объем настоящего изобретения включает две или более фармацевтических композиций, по крайней мере одна из которых содержит соединение по изобретению, которые могут быть удобно объединены в виде набора, пригодного для совместного введения композиций. Таким образом, набор по изобретению включает две или более отдельных фармацевтических композиции, по крайней мере одна из которых содержит соединение формулы (I) по изобретению, и средства для того, чтобы сохранять указанные композиции по отдельности, такие как контейнер, разделенный на части флакон или разделенный на части пакет из фольги. Пример такого набора хорошо известен: это блистерная упаковка, используемая для упаковки таблеток, капсул и т.п. Набор по изобретению, в частности, применим для введения различных лекарственных форм, например оральных и парентеральных, для введения отдельных композиций с разными интервалами дозирования, или для титрования отдельных композиций другими композициями. В помощь выполнению набор обычно содержит инструкции для введения и может быть снабжен так называемой "памяткой". Дозирование. В зависимости от способа введения полная суточная доза соединения по изобретению, предназначенная для введения человеку, обычно находится в диапазоне от приблизительно 0,05 до приблизительно 100 мг; предпочтительно в диапазоне от приблизительно 0,1 до приблизительно 50 мг и более предпочтительно в диапазоне от приблизительно 0,5 до приблизительно 20 мг. Например, для орального введения может потребоваться полная суточная доза от приблизительно 1 до приблизительно 20 мг, тогда как для внутривенной дозы может потребоваться только от приблизительно 0,5 до приблизительно 10 мг. Полная суточная доза может быть введена в однократной дозе или разделенных дозах. Эти дозировки основаны на расчетах для среднего больного, имеющего массу от приблизительно 65 до приблизительно 70 кг. Врач будет в состоянии легко подобрать дозы для субъектов, чья масса выходит за пределы диапазона, таких как дети и люди пожилого возраста. Как обсуждали выше, соединение по изобретению демонстрирует агонистическую активность по отношению к 5-НТ 4. Агониста 5-НТ 4 по настоящему изобретению удобно объединить по крайней мере еще с одним фармакологически активным агентом или соединением, в частности, при лечении рефлюксной гастроэзофагеальной болезни. Например, 5-НТ 4 агонист, в частности соединение формулы (I) или его фармацевтически приемлемые соль или сольват, определенные выше, может быть введен совместно,последовательно или отдельно, при введении в комбинации с одним или несколькими фармакологически активными агентами, выбираемыми из:(iv) оральных смесей антацидных средств, например Маалокс, Алдурокс и Гавискох;(хх) ингибиторов селективного повторного поглощения серотонина, например сертралина, эсциталопрама, флуоксэтина, нефазодона, флавоксамина, циталопрама, милнаципрана, парооксэтина, венлафаксина, трамадола, сибуторамина, дулоксэтина, десвенлафаксина и дапоксэтина;(xxviii) антагонистов тахикинина (NK), в частности антагонистов NK-3, NK-2 и NK-1, например непадутанта, саредутанта и таланетанта,(R,9R)-7-[3,5-бис-(трифторметил)бензил]-8,9,10,11-тетрагидро-9-метил-5-(4-метилфенил)-7 Н[1,4]диазоциано[2,1-g][1,7]нафтридин-6-13-диона (AK-637),5-(2R,3S)-2-[(1R)-1-[3,5-бис-(трифторметил)фенил]этокси-3-(4-фторфенил)-4-морфолинил]метил]1,2-дигидро-3H-1,2,4-триазол-3-она (MK-869), ланепитанта, дапитанта и 3-2-метокси-5-(трифторметокси)фенил]метиламино]-2-фенилпиперидина (2S,3S). Способ определения биологической активности. Аффинитет связывания соединений по изобретению с 5-НТ 4 рецептором устанавливают с помощью нижеследующих процедур. Связывание (1) человеческого 5-НТ 4 рецептора. Получали клетки HEK293, трансфецированные человеческим 5-HT4(d), и выращивали (in-house). Собранные клетки суспендировали в 50 мМ HEPES (N-2-гидроксиэтилпиперазин-N-2-этансульфоновая кислота) (рН 7,4, при 4 С), обогащенном смесью ингибиторов протеаз (Boehringer, разбавление 1:1000), и в течение 30 с гомогенизировали на льду, используя выведенный на полную мощность ручной комплект для измельчения Polytron PT 1200. Гомогенаты 30 мин центрифугировали при 40000g при 4 С. Затем- 24012615 осадки ресуспендировали в 50 мМ HEPES (рН 7,4, при 4 С) и центрифугировали еще раз аналогичным образом. Конечные осадки ресуспендировали в соответствующем объеме, содержащем 50 мМ HEPES(рН 7,4, при 25 С), гомогенизировали, разливали по аликвотам и хранили до применения при -80 С. Аликвоту мембраннных фракций использовали для определения концентрации белка, используя набор(PIERCE) для протеиновой ВСА (бычий сывороточный альбумин) пробы и ARVOsx планшетный ридер(Wallac). Для экспериментов по связыванию 25 мкл тестируемого соединения в течение 60 мин при комнатной температуре инкубировали с 25 мкл [3 Н]-GR113808 (Amersham, окончательно 0,2 нМ) и 150 мкл мембранного гомогената и растворов суспензии WGA-SPA гранул) (Amersham) (10 мкг белка и 1 мг SPA гранул/ячейка) (WGA-агглютинины пшеничного зародыша; SPA-антигенный комплекс, защищающий строму). Неспецифическое связывание определяли при конечной концентрации с помощью 1 мкМGR113808 (Tocris). Инкубирование прекращали центрифугированием при 1000 об/мин. Радиоактивность, связанную с рецептором, определяли количественно путем подсчета с помощью планшетного счетчика бета-частиц (Wallac). Все соединения примеров демонстрировали аффинитет к 5-НТ 4 рецептору. Связывание (2) человеческого 5-НТ 4 рецептора. Получали клетки HEK293, трансфецированные человеческим 5-HT4(d), и выращивали (in-house). Собранные клетки суспендировали в 50 мМ Трис-буфера (рН 7,4 при 4 С), обогащенного смесью ингибиторов протеаз (Boehringer, разбавление 1:1000), в течение 30 с гомогенизировали на льду, используя выведенный на полную мощность ручной комплект для измельчения Polytron PT 1200. Гомогенаты центрифугировали при 40000g, при 4 С в течение 10 мин. Затем осадки ресуспендировали в 50 мМ Трисбуфера) (рН 7,4, при 4 С) и центрифугировали еще раз аналогичным образом. Конечные осадки ресуспендировали в соответствующем объеме с 50 мМ Трис-буфера (рН 7,4, при 25 С), содержащем 10 мМMgCl2, гомогенизировали, разливали по аликвотам и хранили до применения при -80 С. Аликвоту мембранных фракций использовали для определения концентрации белка, используя набор (PIERCE) для протеиновой ВСА пробы и ARVOsx планшетный ридер (Wallac). Для экспериментов по связыванию 50 мкл тестируемого соединения в течение 60 мин при комнатной температуре инкубировали с [3 Н] 5-НТ (Amersham, окончательно 8,0 нМ) и 400 мкл мембранного гомогената (300 мкг белок/пробирка). Неспецифическое связывание определяли при конечной концентрации с помощью 50 мкМ GR113808 (Tocris). Инкубацию прекращали быстрым фильтрованием в вакууме через пропитанную 0,2% PEI (полиэтиленимин) фильтровальную бумагу из стекловолокна, используя коллектор клеток BRANDEL, с последующим троекратным промыванием 50 мкМ Трис-буфером(рН 7,4, при 25 С). Радиоактивность, связанную с рецептором, определяли количественно, подсчитывая сцинтилляции жидкости, с помощью счетчика Packard LS. Все соединения примеров демонстрировали аффинитет к 5-НТ 4 рецептору. Индуцируемое агонистом увеличение цАМФ (сАМР) в клетках HEK293, трансфецированных человеческим 5-HT4(d). Клетки HEK293, трансфецированные человеческим 5-HT4(d), получали (in-house). Клетки выращивали в DMEM (модифицированная по Дульбекко среда Игла) при 37 С и 5% содержании CO2, обогащенной 10% FCS (фетальная телячья сыворотка), 20 мМ HEPES (рН 7,4), 200 мкг/мл гигромицина В (Gibco),100 единиц/мл пенициллина и 100 мкл/мл стрептомицина. Клетки выращивали до 60-80% монослоя. В день, предшествующий лечению соединениями, диализованную FCS (Gibco) заменяли на нормальную и клетки инкубировали в течение ночи. Соединения получали в 96-лунковых планшетах (12,5 мкл/ячейка). Клетки собирали с помощью смеси PBS (фосфатносолевой буферный раствор)/1 мМ EDTA (этилендиаминтетрауксусная кислота), центрифугировали и промывали PBS. В начале опыта клеточный осадок повторно ресуспендировали в DMEM, обогащенной 20 мМ HEPES, 10 мкМ паргилина (Sigma) и 1 мМ 3-изобутил-1-метилксантина (Sigma) при концентрации 1,6105 клеток/мл и оставляли на 15 мин при комнатной температуре. Реакцию инициировали добавлением клеток в планшеты (12,5 мкл/ячейка). После инкубации в течение 15 мин при комнатной температуре добавляли 1% Triton X-100, для того чтобы остановить реакцию (25 мкл/ячейка); и планшеты оставляли на 30 мин при комнатной температуре. Детектирование цАМФ на основе однородной с разрешением по времени флуоресценции (HTRF) (по Шерингу) осуществляли в соответствии с инструкцией производителя. Для измерения HTRF использовали счетчик ARVOsx для мультиметок (Wallac) (возбуждение 320 нм, излучение 665 нм/620 нм, время запаздывания 50 мкс, временное окно 400 мкс). Данные анализировали на основе соотношения интенсивностей флуоресценции каждой ячейки при 620 и 665 нм с последующим количественным определением цАМФ, используя стандартную кривую по цАМФ. Увеличение продукции цАМФ, выявляемое каждым соединением, нормировали к количеству цАМФ, продуцируемому 1000 нМ серотонина (Sigma). Все соединения примеров демонстрируют агонистическую активность по отношению к 5-НТ 4 рецептору.- 25012615 Функциональная проба на ТММ. В литературе сообщали о присутствии 5-НТ 4 рецепторов в пищеводе крысы и способность препарата ТММ обнаруживать частичный агонизм (см. G.S. Baxter et al. Naunyn-Schmiedeberg's Arch Pharmacol(1991), 103: 1067-1072). Более конкретно частичная агонистическая активность может быть измерена по нижеследующим методикам. Самцов SD (с нарушением распределения хромосом) крыс (Charles River) массой 250-350 г оглушали и затем убивали путем цервикального смещения. Пищевод иссекали, начиная от желудка (включая участок желудка, чтобы маркировать дистальный конец пищевода) до уровня трахеи, и затем помещали в свежий раствор Кребса. Наружный слой скелетных мышц удаляли за один раз путем отслаивания от нижележащего слоя гладкой мышцы, используя пинцет (по направлению от желудка к трахее). Остающаяся внутренняя трубка, образованная гладкой мускулатурой, известна как ТММ. Ее отмеряли до 2 см от оставленного "желудочного конца" и остальное удаляли. Из ТММ был сделан препарат в виде полностью открытых трубок в продольной ориентации в 5 мл органной кювете, заполненной теплым (32 С) аэрированным раствором Кербса. Ткани помещали в условия исходного натяжения в 750 мг и оставляли на 60 мин для уравновешивания. Во время уравновешивания ткани дважды повторно растягивали с интервалами в 15 мин. В течение этого времени скорость течения, задаваемую насосом, устанавливали на 2 мл/мин. После установления равновесия насос выключали. Ткани подвергали воздействию 1 мкМ карбохолина и сжимали, и за 15 мин достигали плато стабильного сокращения. Ткани затем подвергали воздействию 1 мкМ 5-НТ (это должно было служить затравкой для релаксации тканей). В ответ на 5-НТ ткани резко релаксировали в течение 1 мин. Как только наступала максимальная релаксация и измерения были сняты, ткани промывали с максимальной скоростью (66 мл/мин) в течение не менее чем 1 мин, пока не восстанавливался базовый уровень, предшествующий воздействию карбохолина и 5-НТ (обычно базовый уровень опускается ниже исходного уровня, после чего поднимается до уровня первоначального уравновешивания). Скорость течения, задаваемую насосом, понижали до 2 мл/мин и ткани оставляли на 60 мин. Комулятивная кривая эффекта концентраций (СЕС) 5-НТ была построена для диапазона от 0,1 нМ до 1 мкМ с шагом 0,5 log (5-НТ кривая 1 для анализа данных). Время контакта между дозами составляло 3 мин или до момента установления плато. При возрастании концентрации 5-НТ в кювете ответная реакция тканей ускорялась. В конце кривой ткани промывали (при максимальной скорости) с максимально возможной скоростью для избежания десенсибилизации рецепторов. Скорость течения, задаваемую насосом, понижали до 2 мл/мин и оставляли ткани на 60 мин. Вторую СЕС получали или по отношению к 5-НТ (для контроля тканей во времени), по отношению к еще одному агонисту 5-НТ 4 (стандарт), или по отношению к тестируемому соединению (кривая 2 для анализа данных). Время контакта других агонистов 5-НТ 4 и тестируемого соединения варьировали и приспосабливали к индивидуальным ответным реакциям тканей на каждого конкретного агента. В ткани,подвергаемые воздействию тестируемого соединения, после получения последней концентрации тестируемого соединения, добавляли в кювету высокую концентрацию (1 мкМ) антагониста 5-НТ 4 (SB203186: 2-(1-пиперидинил)этиловый эфир 1 Н-индол-3-карбоновой кислоты, Tocris). Это было сделано, чтобы понять, может ли быть обращена любая релаксация (если она имеет место), индуцируемая агонистом. Обращение 5-НТ индуцируемой релаксации с помощью SB 203186 восстанавливает первоначальную степень тонуса ткани индуцируемого карбохолином. Агонистическую активность тестируемых соединений подтверждали посредством предварительного инкубирования тканей со 100 нМ стандартного антагониста 5 НТ 4, такого как SB203186. За 5 мин до добавления карбохолина перед построением кривой 2 в кювету добавляли SB203186. Для анализа данных ткани должны составлять пару; т.е. сравнивали тестируемое соединение при отсутствии SB203186 в одной ткани с тестируемым соединением в присутствии SB203186 в отдельной ткани. Не было возможности осуществить кривую 3, т.е. 5-НТ кривую 1, с последующим построением кривой 2 для тестируемого соединения (-SB203186), с последующим построением кривой 3 для тестируемого соединения(+SB203186). Все соединения примеров демонстрируют агонистическую активность 5-НТ 4 рецептора. Связывание человеческого дофетилида. Получали клетки HEK293S, трансфецированные человеческим HERG, и выращивали (in-house). Собранные клетки суспендировали в 50 мМ Трис-HCl (рН 7,4 при 4 С) и гомогенизировали на льду, используя ручной комплект для измельчения Polytron PT 1200, выведенный на полную мощность. Гомогенаты центрифугировали при 48000g, при 4 С в течение 20 мин. Затем осадки ресуспендировали, гомогенизировали и центрифугировали еще раз аналогичным образом. Конечные осадки ресуспендировали в соответствующем объеме 50 мМ Трис-HCl, 10 мМ KCl, 1 мМ MgCl2 (рН 7,4 при 4 С), гомогенизировали,разливали по аликвотам и хранили до применения при -80 С. Аликвоту мембранных фракций использовали для определения концентрации белка, используя набор (PIERCE) для протеиновой ВСА пробы и- 26012615 Пробы на связывание выполняли в общем объеме, составляющем 200 мкл, в 96-лунковых планшетах. 20 мкл тестируемых соединений инкубировали с 20 мкл [3 Н]-дофетилида (Amersham, окончательно,5 нМ) и 160 мкл мембранного гомогената (25 мкг белка) при комнатной температуре в течение 60 мин. Неспецифическое связывание определяли по 10 мкМ дофетилида в конечной концентрации. Инкубацию прекращали быстрым фильтрованием в вакууме над предварительно пропитанным 0,5% GF/B фильтромBetaplate, используя коллектор клеток Skatron с 50 мМ Трис-НС 1, 10 мМ KCl, 1 мМ MgCl2, (рН 7,4 при 4 С). Фильтры сушили, помещали в пакеты для образцов и заполняли составом Betaplate Scint. Радиоактивность, связанную с фильтром, считали с помощью счетчика Wallac Betaplate. Проницаемость Сасо-2. Проницаемость Сасо-2 измеряли способом, описанным в Shiyin Yee, Pharmaceutical Research, 763(1997). Сасо-2 клетки выращивали на подложках фильтра (Falcon HTS система многоячеистых вкладок) в течение 14 дней. Культуральную среду удаляли из обоих, апикального и базолатерального, отделений и в течение 0,5 ч монослои преинкубировали при 37 С на вибрирующей водяной бане при 50 циклах/мин с предварительно нагретыми 0,3 мл апикального буфера и 1,0 мл базолатерального буфера. Апикальный буфер состоял из сбалансированного соляного раствора Hanks, 25 мМ моногидрата D-глюкозы, 20 мМ биологического буфера MES, 1,25 мМ CaCl2 и 0,5 мМ MgCl2 (рН 6,5). Базолатеральный буфер состоял из сбалансированного соляного раствора Hanks, 25 мМ моногидрата D-глюкозы, 20 мМ HEPES биологического буфера, 1,25 мМ CaCl2 и 0,5 мМ MgCl2 (рН 7,4). В конце преинкубирования среду удаляли и в апикальное отделение добавляли раствор (10 мкМ) тестируемого соединения в буфере. Вкладки перемещали в ячейки, содержащие свежий базолатеральный буфер на 1 ч. Концентрацию лекарственного средства в буфере измеряли посредством ЖХ/МС анализа. Скорость магнитного потока (F, масса/время) считали по наклону комулятивного появления субстрата на приемной стороне и коэффициент истинной проницаемости (Рарр) считали по нижеследующему уравнению: где SA представляет собой площадь поверхности переноса (0,3 см 2);VD представляет собой поданный объем (0,3 мл);MD является полным количеством лекарственного средства на подающей стороне при t=0. Все данные представляют собой среднее для 2 вкладок. Целостность монослоя определяли по переносу люцеферового желтого. Период полувыведения в микросомах человеческой печени (HLM). Тестируемые соединения (1 мкМ) инкубировали с 3,3 мМ MgCl2 и 0,78 мг/мл HLM (HL101) в 100 мМ калийфосфатного буфера (рН 7,4) при 37 С в 96-лунковом планшете с глубокими лунками. Реакционную смесь разделяли на две группы: группа Р 450 и группа "не Р 450". НАДФ (NADP) добавляли только в реакционную смесь группы Р 450 группа. Аликвоту образцов группы Р 450 собирали на временных точках: 0, 10, 30 и 60 мин, где 0 мин соответствует точке, обозначающей время добавления НАДФ в реакционную смесь группы Р 450. Аликвоту образцов группы "не Р 450" собирали на временных точках:-10 и 65 мин. Собранные аликвоты экстрагировали раствором ацетонитрила, содержащим внутренний стандарт. Осажденный белок центрифугировали в центрифуге (2000 об/мин, 15 мин). Концентрацию соединения в надосадочной жидкости измеряли посредством системы ЖХ/МС/МС. Величину периода полувыведения получали путем построения графика зависимости от времени натурального логарифма отношения площади пика соединения к площади пика внутреннего стандарта. Наклон линии лучшего подбора для всех точек дает скорость метаболизма (k), которую преобразовывали в величину периода полувыведения, используя нижеследующее уравнение: Период полувыведения=ln 2/к. Примеры Изобретение иллюстрируют нижеследующими примерами, не ограничивающими рамки изобретения, в которых все операции осуществляли, если не оговорено иначе, при комнатной температуре или температуре окружающей среды, т.е. в диапазоне 18-25 С; испарение растворителя осуществляли, используя роторный испаритель при пониженном давлении с температурой бани, доходящей до 60 С; реакции контролировали с помощью тонкослойной хроматографии (TLC) и времена реакции приведены только для иллюстрации; приведенные точки плавления (т.пл.) не откорректированы (полиморфизм может привести к различающимся точкам плавления); структура и чистота всех выделенных соединений гарантированы по крайней мере одним из нижеследующих методов: ТСХ (пластинки ТСХ, предварительно покрытые Merck силикагелем 60F254, или пластинки ТСХ, предварительно покрытые Merck NH2 гелем (силикагелем с аминным покрытием) F254s), масс-спектрометрией, спектрами ядерного магнитного резонанса (ЯМР), инфракрасными спектрами поглощения (ИК) или микроанализом. Выходы приведены только с иллюстративными целями. Обработку посредством катионообменной колонки осуществляли,используя съемный блок SCX (Varian BondElute), который предварительно обрабатывали метанолом. Колоночную флэш-хроматографию осуществляли, используя Merck силикагель 60 (63-200 мкм), Wako силикагель 300HG (40-60 мкм), Fuji Silysia NH гель (силикагель с аминным покрытием) (30-50 мкм),- 27012615(электронораспылительная ионизация) (ESI) получали на ZMD или ZQ (Waters) и масс-спектрометре. Данные ЯМР получали в миллионных долях (м.д.) при 270 МГц (спектрометр JEOL JNM-LA 270),300 МГц (спектрометр JEOL JNM-LA 300) или 600 МГц (спектрометр Bruker AVANCE 600), если не оговорено иначе, используя в качестве растворителя дейтерированные хлороформ (99,8% D) или диметилсульфоксид (99,9% D) относительно тетраметилсилана (ТМС) в качестве внутреннего стандарта; использовали стандартные сокращения: с = синглет, д = дублет, т = триплет, кв = квартет, квинт = квинтет,м = мультиплет, ш = широкий и т.д. ИК-спектры получали на инфракрасном спектрометре с Фурьепреобразованием (Shimazu FTIR-8300). Порошковые рентгенограммы (PXRD) получали, используя рентгеновский порошковый дифрактометр Rigaku RINT-TTR, снабженный автоматическим устройством смены образца, гониометром для измерения углов от 2 до , щелями для расходящегося пучка, вспомогательным монохроматором и синтиляционным счетчиком. Образец готовили к анализу, упаковывая порошок в алюминиевый держатель образца. Образец вращали со скоростью 6000 об/мин и развертку производили со скоростью 4/мин при комнатной температуре при излучении Cu-K. Химические символы имеют свой обычный смысл; так как (точка кипения), т.пл. (точка плавления), л (литр(ы, мл (миллилитр(ы, г (грамм(ы, мг (миллиграмм(ы, моль (моли), мМоль (миллимоли), экв. (эквивалент(ы, колич., (количественный выход). Пример 1. 4-[4-([(2'-Оксоспиро[циклопентан-1,3'-индол]-1'(2'Н)-ил)карбонил]аминометил)пиперидин-1 ил]метилтетрагидро-2 Н-пиран-4-карбоновая кислота Стадия 1. трет-Бутил-4-цианотетрагидро-2 Н-пиран-4-карбоксилат. К перемешанной в N,N-диметилформамиде (200 мл) суспензии NaH (17,7 г, 0,443 моль) в атмосфере N2 при 0 С по каплям добавляли раствор трет-бутилцианоацетата (25,0 г, 0,177 моль) вN,N-диметилформамиде (100 мл). Смесь оставляли нагреваться до температуры окружающей среды и перемешивали в течение 1 ч. Затем к смеси добавляли бис-(2-бромэтиловый) простой эфир (49,3 г,0,177 моль) и полученную смесь перемешивали при 90 С в течение 24 ч. После охлаждения до 0 С смесь промывали водой (100 мл). Летучие компоненты удаляли выпариванием и осадок осаждали смесью этилацетат/толуол (1:2, 500 мл) и водой (500 мл). Органическую фазу промывали 3 раза водой (500 мл), сушили над Na2SO4, фильтровали и упаривали. Твердое вещество промывали гексаном, собирали фильтрованием и сушили в вакууме для получения 19,0 г (57%) указанного в заглавии соединения в виде белого кристалла. 1H-ЯМР (CDCl3) : 3,96 (2 Н, дт, J=3,9 Гц, 12,3 Гц), 3,73 (2 Н, дт, J=2,6 Гц, 12,3 Гц), 2,20-1,94 (4 Н, м),1,52 (9 Н, с). Стадия 2. трет-Бутил-4-(аминометил)тетрагидро-2 Н-пиран-4-карбоксилат. Смесь трет-бутил-4-цианотетрагидро-2 Н-пиран-4-карбоксилата (18,95 г, 0,0897 моль, стадии 1 примера 1) и Ni Ренея (1,00 г) в метаноле (200 мл) гидрировали (3 атм) при комнатной температуре в течение 12 ч. Затем смесь фильтровали через подушку целита и фильтрат концентрировали в вакууме для получения 16,01 г (83%) указанного в заглавии соединения в виде желтого сиропа. 1 Н-ЯМР (CDCl3) : 3,86 (2 Н, дт, J=4,1 Гц, 11,4 Гц), 3,48 (2 Н, дт, J=2,5 Гц, 11,5 Гц), 2,75 (2 Н, с), 2,03(2 Н, шир. д, J=10,7 Гц), 1,55-1,35 (13 Н, м, включая 9 Н, с, 1,49 м.д.). Стадия 3. трет-Бутил-4-[(4-оксопиперидин-1-ил)метил]тетрагидро-2 Н-пиран-4-карбоксилат. К кипящей с обратным холодильником смеси трет-бутил-4-(аминометил)тетрагидро-2 Н-пиран-4 карбоксилата (8,00 г, 0,0372 моль, стадии 2 примера 1) и K2CO3 (0,51 г, 0,0372 моль) в смеси этанол/H2O(2:1, 240 мл) по каплям добавляли 1-этил-1-метил-4-оксопиперидинийиодид (12,0 г, 0,0445 моль, J. Org.Chem. 1995, 60, 4324) в смеси этанол/H2O (2:1, 150 мл) и при той же температуре полученную смесь перемешивали 1 ч. После охлаждения до комнатной температуры растворитель удаляли в вакууме. Остаток вливали в насыщенный водный раствор NaHCO3 (200 мл) и смесь экстрагировали CH2Cl2 (200 мл 3). Экстракты сушили над Na2SO4, фильтровали и концентрировали. Осадок хроматографировали на колонке с силикагелем, элюируя смесью гексан/этилацетат (от 3:1 до 2:1), чтобы получить 10,77 г (98%) соединения, указанного в заглавии, в виде бесцветного сиропа.- 28012615 МС (ESI) m/z: 298 (М+Н)+. Н-ЯМР (CDCl3) : 3,84 (2 Н, шир. д, J=11,4 Гц), 3,50 (2 Н, дт, J=2,0 Гц, 11,7 Гц), 2,85 (4 Н, т,J=5,9 Гц), 2,61 (2 Н, с), 2,39 (4 Н, т, J=6,1 Гц), 2,05 (2 Н, д, J=11,5 Гц), 1,75-1,45 (11 Н, м, включая 9 Н, с, 1,49 м.д.). Стадия 4. трет-Бутил-4-[(4-цианопиперидин-1-ил)метил]тетрагидро-2 Н-пиран-4-карбоксилат. К перемешанному раствору трет-бутил-4-[(4-оксопиперидин-1-ил)метил]тетрагидро-2 Н-пиран-4 карбоксилата (8,77 г, 0,0295 моль, стадии 3 примера 3) в 1,2-диметоксиэтане (250 мл) при 0 С добавляли п-толуолсульфонилметилизоцианид (11,51 г, 0,0590 моль), этанол (3,96 мл, 0,0678 моль) и т-бутилат калия (11,58 г, 0,1032 моль). Полученную смесь перемешивали при 50 С в течение 16 ч. После охлаждения реакционную смесь выливали в насыщенный водный раствор NaHCO3 (200 мл) и смесь 3 раза экстрагировали CH2Cl2 (200 мл). Экстракты сушили над Na2SO4, фильтровали и концентрировали. Осадок хроматографировали на колонке с силикагелем, элюируя смесью гексан/этилацетат (2:1), чтобы получить 5,76 г (63%) соединения, указанного в заглавии, в виде желтого сиропа. МС (ESI) m/z: 309 (М+Н)+. 1H-ЯМР (CDCl3) : 3,81 (2 Н, дт, J=3,1 Гц, 11,0 Гц), 3,48 (2 Н, дт, J=2,1 Гц, 11,7 Гц), 2,76-2,64 (2 Н, м),2,64-2,52 (1 Н, м), 2,50-2,35 (4 Н, м, включая 2 Н, с, 2,46 м.д.), 1,98 (2 Н, шир. д, J=11,9 Гц), 1,92-1,70 (4 Н,м), 1,65-1,40 (11 Н, м, включая 9 Н, с, 1,47 м.д.). Стадия 5. трет-Бутил-4-[4-(аминометил)пиперидин-1-ил]метилтетрагидро-2 Н-пиран-4-карбоксилат. Смесь трет-бутил-4-[(4-цианопиперидин-1-ил)метил]тетрагидро-2 Н-пиран-4-карбоксилата (5,76 г,0,0187 моль, стадии 4 примера 1) и Ni Ренея (3,00 г) в метаноле (100 мл) гидрировали (3 атм) при комнатной температуре 12 ч. Затем смесь фильтровали через подушку целита и фильтрат концентрировали в вакууме для получения 5,72 г (98%) соединения, указанного в заглавии, в виде желтого сиропа. МС (ESI) m/z: 313 (М+Н)+. 1 Н-ЯМР (CDCl3) : 3,80 (2 Н, дт, J=3,1 Гц, 11,5 Гц), 3,49 (2 Н, дт, J=2,1 Гц, 12,2 Гц), 2,80 (2 Н, шир. д,J=11,5 Гц), 2,58-2,40 (4 Н, м, включая 2 Н, с, 2,43 м.д.), 2,15 (2 Н, шир. т, J=7,3 Гц), 1,98 (2 Н, шир. д,J=13,7 Гц), 1,70-1,40 (16 Н, м, включая 9 Н, с, 1,47 м.д.), 1,30-1,10 (2 Н, м). Стадия 6. трет-Бутил-4-[4-([(2'-оксоспиро[циклопентан-1,3'-индол]-1'(2'Н)-ил)карбонил]аминометил)пиперидин-1-ил]метилтетрагидро-2 Н-пиран-4-карбоксилат. К перемешанному раствору спиро[циклопентан-1,3'-индол]-2' (1'Н)-она (600 мг, 3,2 ммоль, Howard,Harry R. et al., J. Med. Chem., 1996, 39, 143) и триэтиламина (972 мг, 9,6 ммоль) в CH2Cl2 (20 мл) при комнатной температуре добавляли 4-нитрохлорформиат (677 мг, 3,4 ммоль) и перемешивали при температуре окружающей среды 3 ч. Затем при комнатной температуре добавляли раствор трет-бутил-4-[4(аминометил)пиперидин-1-ил]метилтетрагидро-2 Н-пиран-4-карбоксилата (1,0 г, 3,2 ммоль, стадии 5 примера 1) в CH2Cl2 (5 мл) и перемешивали 18 ч. Затем добавляли насыщенный водный раствор NaHCO3(20 мл), экстрагировали 3 раза CH2Cl2 (30 мл), сушили над MgSO4, фильтровали и концентрировали, получая желто-коричневое масло. Осадок хроматографировали на колонке с аминопропилсиликагелем,элюируя смесью гексан/этилацетат (11:1), чтобы получить 1,3 г (75%) соединения, указанного в заглавии, в виде прозрачного желтого масла.MC (ESI) m/z: 526 (M+H)+. 1 Н-ЯМР (CDCl3) : 8,70 (1 Н, шир. с), 8,23 (1 Н, д, J=8,1 Гц), 7,41-7,10 (3H, м), 3,83-3,75 (2 Н, м), 3,523,47 (2 Н, м), 3,29-3,20 (2 Н, м), 2,83-2,75 (2 Н, м), 2,44 (2 Н, с), 2,25-1,20 (28 Н, м). Стадия 7. 4-[4-([(2'-Оксоспиро[циклопентан-1,3'-индол]-1'(2'H)-ил)карбонил]аминометил)пиперидин-1-ил]метилтетрагидро-2 Н-пиран-4-карбоновая кислота. К раствору трет-бутил-4-[4-([(2'-оксоспиро[циклопентан-1,3'-индол]-1'(2'Н)-ил)карбонил]аминометил)пиперидин-1-ил]метилтетрагидро-2 Н-пиран-4-карбоксилата (2,3 г, 4,38 ммоль, стадии 6 примера 1) в CH2Cl2 (14 мл) при комнатной температуре добавляли трифторуксусную кислоту (18 мл) и смесь перемешивали на протяжении ночи при комнатной температуре. Смесь концентрировали, чтобы получить желтое масло; добавляли CH2Cl2 (200 мл) и промывали насыщенным водным раствором NaHCO3(80 мл), сушили над MgSO4, фильтровали и концентрировали, чтобы получить сироп, который хроматографировали на колонке с силикагелем, элюируя смесью CH2Cl2/метанол (15:1), чтобы получить 2,1 г(колич.) соединения, указанного в заглавии, в виде белого твердого вещества. Перекристаллизация из смеси этилацетат/н-гептан дала белый порошок. Стадия 1. трет-Бутил-4-([(2'-оксоспиро[циклопентан-1,3'-индол-1'(2'Н)-ил)карбонил]аминометил)пиперидин-1-карбоксилат. Указанное в названии соединение получали, в соответствии с методикой, описанной на стадии 6 примера 1, из трет-бутил-4-(аминометил)пиперидин-1-карбоксилата.Rf=0,2 (гексан/этилацетат (8/1 1 Н-ЯМР (CDCl3) : 8,78 (1 Н, шир. с), 8,23 (1 Н, д, J=9 Гц), 7,31-7,10 (3H, м), 4,20-4,05 (2 Н, м), 3,353,25 (2 Н, м), 2,80-2,60 (2 Н, м), 2,25-1,80 (9 Н, м), 1,80-1,65 (2 Н, м), 1,46 (9 Н, с), 1,30-1,10 (2 Н, м). Стадия 2. 2'-Оксо-N-(пиперидин-4-илметил)спиро[циклопентан-1,3'-индол]-1'(2'Н)-карбоксамид. трет-Бутил-4-([(2'-оксоспиро[циклопентан-1,3'-индол]-1'(2'Н)-ил)карбонил]аминометил)пиперидин-1-карбоксилат (750 мг, 1,8 ммоль, стадии 1 примера 2) растворяли в 10% HCl в метаноле (20 мл) и смесь 7 ч перемешивали при комнатной температуре. Концентрирование дало бесцветное масло, которое хроматографировали на колонке с силикагелем, элюируя смесью CH2Cl2/метанол (12/1/0,1) с получением 570 мг (колич.) указанного в заглавии соединения в виде бесцветного масла. МС (ESI) m/z: 328 (М+Н)+. 1 Н-ЯМР (CDCl3) : 8,76 (1 Н, шир. с), 8,24 (1 Н, д, J=9,0 Гц), 7,31-7,10 (3H, м), 3,32-3,25 (2 Н, м), 3,153,09 (2 Н, м), 2,67-2,60 (2 Н, м), 2,30-1,60 (12 Н, м), 1,32-1,10 (2 Н, м). Стадия 3. Метил-2,2-диметил-3-[4-([(2'-оксоспиро[циклопентан-1,3'-индол]-1'(2'Н)-ил)карбонил]аминометил)пиперидин-1-ил]пропаноат. К перемешанному раствору 2'-оксо-N-(пиперидин-4-илметил)спиро[циклопентан-1,3'-индол]1'(2'Н)-карбоксамида (480 мг, 1,5 ммоль, стадии 2 примера 2) и метил 2,2-диметил-3-оксопропаноата(248 мг, 1,7 ммоль, Kim, Hwa-Ok et al., Synth. Commun., 1997, 27, 2505) в CH2Cl2 (40 мл) при комнатной температуре одной порцией добавляли триацетоксиборогидрид натрия (623 мг, 2,9 ммоль). Смесь перемешивали 20 ч при температуре окружающей среды. К смеси добавляли насыщенный водный растворNaHCO3 (10 мл), экстрагировали CH2Cl2 (30 мл 2), сушили над MgSO4, фильтровали и концентрировали,получая желтое масло. Осадок хроматографировали на колонке с аминопропилсиликагелем, эльюируя смесью гексан/этилацетат (9:1) с получением 150 мг (23%) соединения, указанного в названии, в виде прозрачного бесцветного масла. МС (ESI) m/z: 442 (М+Н)+. 1(2 Н, м), 2,85-2,75 (2 Н, м), 2,46 (2 Н, с), 2,23-1,90 (11 Н, м), 1,70-1,60 (2 Н, м), 1,35-1,28 (2 Н, м), 1,15 (6 Н, с). Стадия 4. 2,2-Диметил-3-[4-([(2'-оксоспиро[циклопентан-1,3'-индол]-1'(2'Н)-ил)карбонил]аминометил)пиперидин-1-ил]пропановая кислота. К перемешанному раствору метил-2,2-диметил-3-[4-([(2'-оксоспиро[циклопентан-1,3'-индол]1'(2'Н)-ил)карбонил]аминометил)пиперидин-1-ил]пропаноата (170 мг, 0,38 ммоль, стадии 3 примера 2) в уксусной кислоте (2 мл) добавляли H2SO4 (113 мг) в воде (2 мл) и смесь 36 ч кипятили с обратным холодильником. Смесь охлаждали до комнатной температуры и медленно добавляли твердый NaHCO3(500 мг). Полученную смесь концентрировали, чтобы получить белое твердое вещество. К твердому веществу добавляли CH2Cl2 (40 мл) и перемешивали 10 мин, сушили над MgSO4. Раствор фильтровали и концентрировали и в результате получали желтое масло. Масло хроматографировали на колонке с силикагелем, элюируя смесью CH2Cl2/метанол (14:1), чтобы получить 130 мг (80%) указанного в названии соединения в виде белого твердого вещества. Перекристаллизация из смеси этилацетат/диэтиловый эфир давала белый порошок. МС (ESI) m/z: 427 (М+Н)+. т.пл.: 189,1 С. ИК (KBr) v: 2950, 1732, 1600, 1537, 1475, 1348, 1321, 1280, 1153, 964, 873, 758 см-1. 1
МПК / Метки
МПК: A61K 31/454, C07D 401/12, C07D 405/14, C07D 401/14, A61P 1/04
Метки: оксииндола, качестве, производные, 5-ht4, рецептора, агонистов
Код ссылки
<a href="https://eas.patents.su/30-12615-proizvodnye-oksiindola-v-kachestve-agonistov-5-ht4-receptora.html" rel="bookmark" title="База патентов Евразийского Союза">Производные оксииндола в качестве агонистов 5-ht4 рецептора</a>
Предыдущий патент: Способ получения бутадиена из н-бутана
Следующий патент: Применение соляной кислоты для изготовления лекарственного средства для лечения повышенного давления
Случайный патент: Фармацевтические композиции против кашля


































