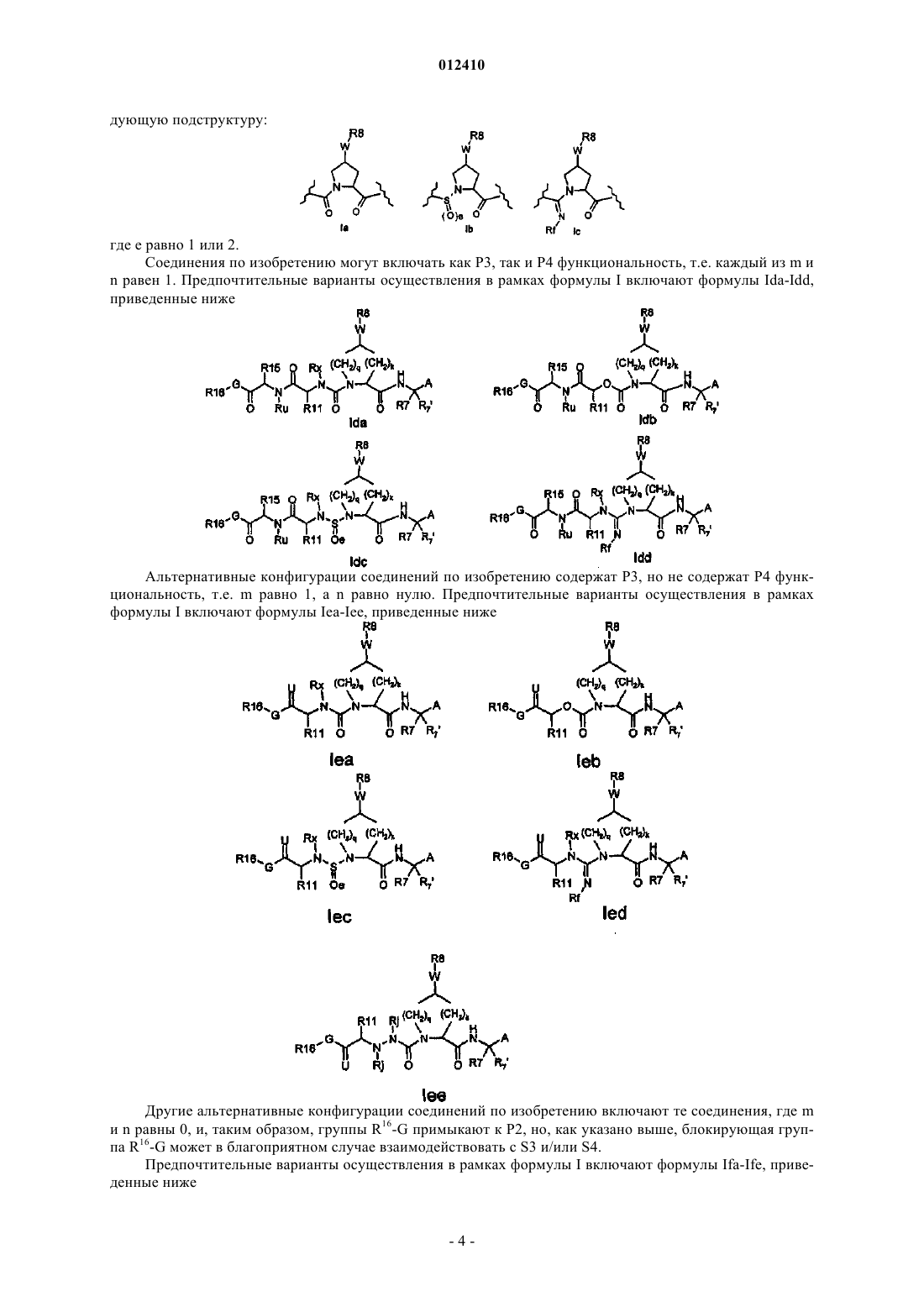
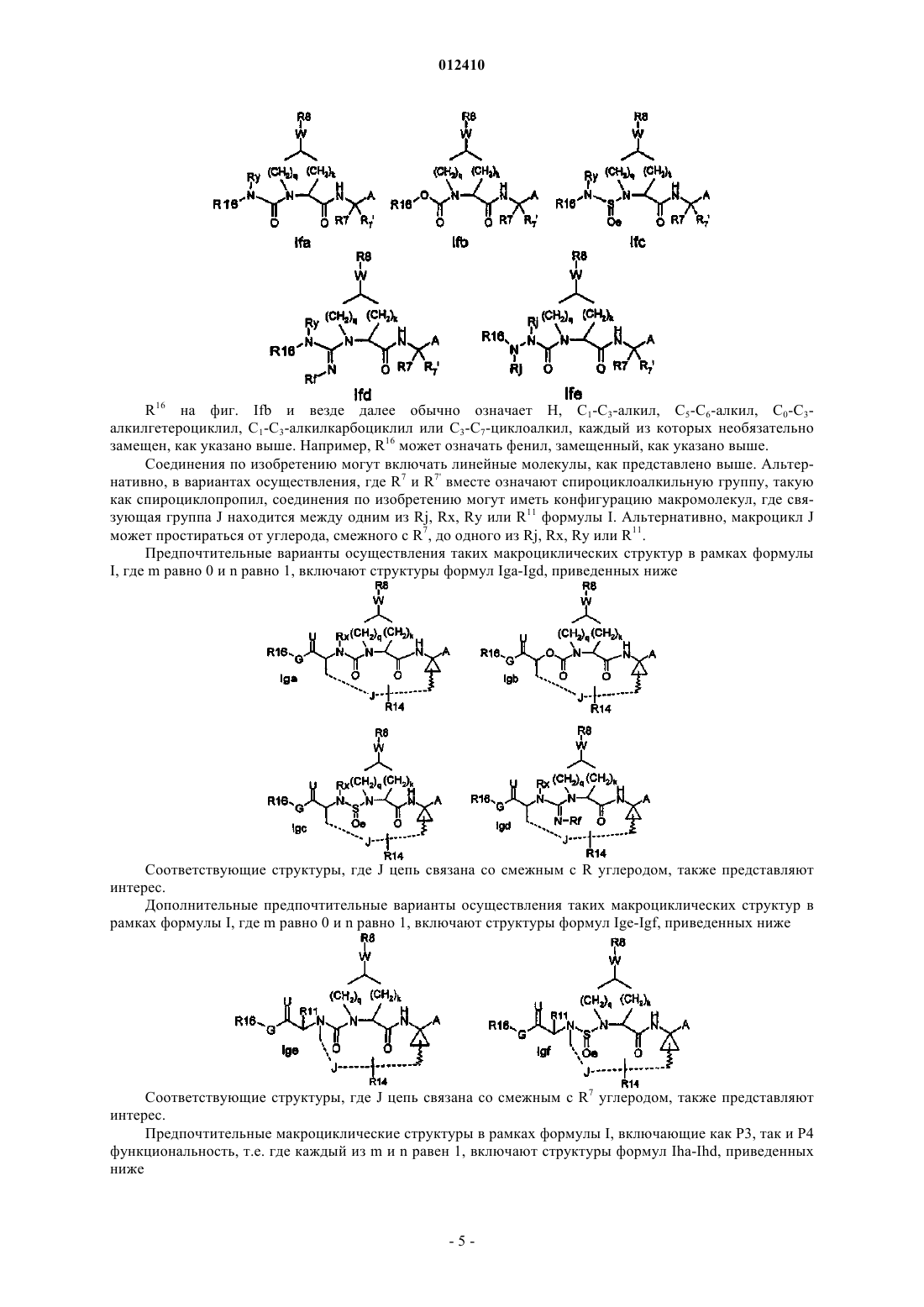
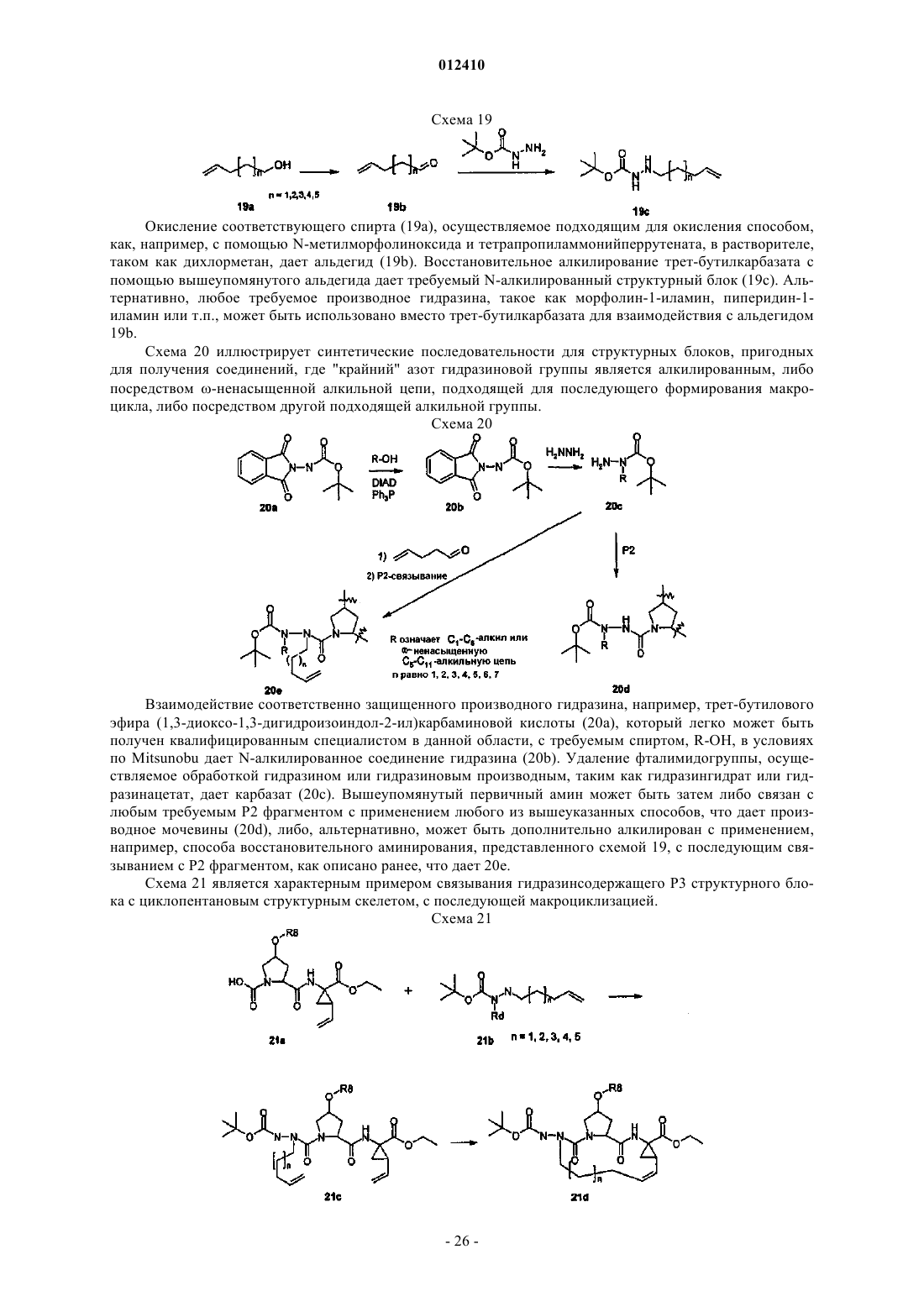
Ингибиторы серин-протеазы ns-3 hcv
Номер патента: 12410
Опубликовано: 30.10.2009
Авторы: Росенквист Оса, Ракос Ласло, Классон Бьерн, Йоханссон Пер-Ола, Торстенссон Фредрик, Кварнстрем Ингемар, Айеса Сусана, Самуэльссон Бертиль
Формула / Реферат
1. Соединение формулы I
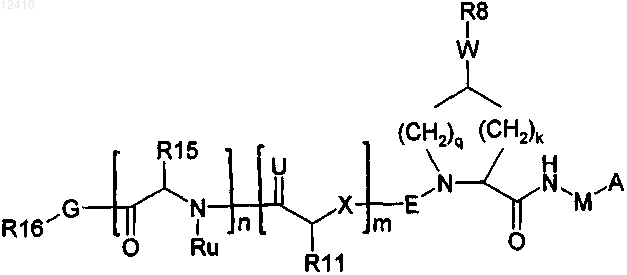
где А означает С(=O)OR1 или С(=O)NHSO2R2;
R1 означает водород, C1-C6-алкил, C0-C3-алкилкарбоциклил, C0-C3-алкилгетероциклил;
R2 означает C1-C6-алкил, C0-C3-алкилкарбоциклил, C0-C3-алкилгетероциклил; R2 замещен 1-3 заместителями, независимо выбранными из группы, включающей галоген, оксо, нитрил, азидо, нитро, C1-C6-алкил, C0-C3-алкилкарбоциклил, C0-C3-алкилгетероциклил, NH2CO-, Y-NRaRb, Y-O-Rb, Y-C(=O)Rb, Y-(C=O)NRaRb, Y-NRaC(=O)Rb, Y-NHSOpRb, Y-S(=O)pRb и Y-S(=O)pNRaRb, Y-C(=O)ORb, Y-NRaC(=O)ORb;
Y независимо означает связь или C1-C3-алкилен;
Ra независимо означает Н или C1-C3-алкил;
Rb независимо означает Н, C1-C6-алкил, C0-C3-алкилкарбоциклил или C0-C3-алкилгетероциклил;
p независимо равно 1 или 2;
М означает CR7R7';
R7 означает C1-C6-алкил, C0-C3-алкил-C3-C7-циклоалкил или C2-C6-алкенил, каждый из которых необязательно замещен 1-3 атомами галогена, либо амино, -SH или C0-C3-алкилциклоалкильной группой; или R7 означает J;
R7' означает Н или взятый вместе с R7 образует C3-C6-циклоалкильный цикл, необязательно замещенный R7'а;
R7'a означает C1-C6-алкил, C3-C5-циклоалкил, C2-C6-алкенил, каждый из которых необязательно может быть замещен галогеном; или R7'a может означать J;
q равно 0-3 и k равно 0-3; где q+k_1;
W означает -СН2-, -О-, -OC(=O)NH-, -OC(=O)-, -S-, -NH-, -NRa, -NHSO2-, -NHC(=O)NH- или
-NHC(=O)-, -NHC(=S)NH- или связь;
R8 означает кольцевую систему, содержащую 1 или 2 насыщенных, частично насыщенных или ненасыщенных кольца, каждое из которых содержит 4-7 кольцевых атомов и каждый из которых имеет 0-4 гетероатома, независимо выбранных из S, О и N, кольцевая система, необязательно, отделена от W посредством C1-C3-алкильной группы; каждая из указанных R8 групп может быть необязательно моно-, ди- или тризамещенной R9;
R9 независимо выбирают из группы, включающей галоген, оксо, нитрил, азидо, нитро, C1-C6-алкил, C0-C3-алкилкарбоциклил, C0-C3-алкилгетероциклил, NH2C(=O)-, Y-NRaRb, Y-O-Rb, Y-C(=O)Rb, Y-(C=O)NRaRb, Y-NRaC(=O)Rb, Y-NHSOpRb, Y-S(=O)pRb, Y-S(=O)pNRaRb, Y-C(=O)ORb, Y-NRaC(=O)ORb; где указанный карбоциклил или гетероциклил означает необязательно замещенный R10;
R10 означает C1-C6-алкил, C3-C7-циклоалкил, C1-C6-алкокси, амино, амидо, сульфонил, (C1-C3-алкил)сульфонил, NO2, ОН, SH, галоген, галогеналкил, карбоксил;
Е означает -С(=O)-;
X означает -NRx-, где Rx означает Н, C1-C5-алкил или J; либо в случае, когда Е означает -С(=O), X может также означать -О- или -NRjNRj-; где один из Rj означает Н, а другой означает Н, C1-C5-алкил или J;
R11 означает Н, C1-C6-алкил, C0-C3-алкилкарбоциклил, C0-C3-алкилгетероциклил, каждый из которых может быть замещен галогеном, оксо, нитрилом, азидо, нитро, C1-C6-алкилом, C0-C3-алкилкарбоциклилом, C0-C3-алкилгетероциклилом, NH2C(=O)-, Y-NRaRb, Y-O-Rb, Y-C(=O)Rb, Y-(C=O)NRaRb, Y-NRaC(=O)Rb, Y-NHSOpRb, Y-S(=O)pRb, Y-S(=O)pNRaRb, Y-C(=O)ORb, Y-NRaC(=O)ORb; либо R11 означает J;
J, если присутствует, означает отдельную 3-10-членную насыщенную или частично ненасыщенную алкиленовую цепь, простирающуюся от R7/R7'-циклоалкила или от атома углерода, к которому присоединен R7, до одного из Rj, Rx, Ry или R11 с образованием макроцикла, указанная цепь, необязательно, прерывается одним-тремя гетероатомами, независимо выбранными из -O-, -S- или -NR12-, и где 0-3 атома углерода в цепи необязательно замещены R14;
R12 означает Н, C1-C6-алкил, C3-C6-циклоалкил или C(=O)R13;
R13 означает C1-C6-алкил, C0-C3-алкилкарбоциклил, C0-C3-алкилгетероциклил;
R14 независимо выбирают из группы, включающей Н, C1-C6-алкил, C1-C6-галогеналкил, C1-C6-алкокси, гидрокси, галоген, амино, оксо, тио и C1-C6-тиоалкил;
Ru независимо означает Н или C1-C3-алкил;
m равно 0 или 1; n равно 0 или 1;
U означает =O или отсутствует;
R15 означает Н, C1-C6-алкил, C0-C3-алкилкарбоциклил, C0-C3-алкилгетероциклил, каждый из которых может быть замещен галогеном, оксо, нитрилом, азидо, нитро, C1-C6-алкилом, C0-C3-алкилгетероциклилом, C0-C3-алкилкарбоциклилом, NH2CO-, Y-NRaRb, Y-O-Rb, Y-C(=O)Rb, Y-(C=O)NRaRb, Y-NRaC(=O)Rb, Y-NHSOpRb, Y-S(=O)pRb, Y-S(=O)pNRaRb, Y-C(=O)ORb, Y-NRaC(=O)ORb;
G означает -O-, -NRy-, -NRjNRj-, где один из Rj означает Н, а другой означает Н, C1-C5-алкил или J;
Ry означает Н, C1-C3-алкил; либо Ry означает J;
R16 означает Н или C1-C6-алкил, C0-C3-алкилкарбоциклил, C0-C3-алкилгетероциклил, каждый из которых может быть замещен галогеном, оксо, нитрилом, азидо, нитро, C1-C6-алкилом, C0-C3-алкилкарбоциклилом, C0-C3-алкилгетероциклилом, NH2CO-, Y-NRaRb, Y-O-Rb, Y-C(=O)Rb, Y-(C=O)NRaRb, Y-NRaC(=O)Rb, Y-NHSOpRb, Y-S(=O)pRb, Y-S(=O)pNRaRb, Y-C(=O)ORb, Y-NRaC(=O)ORb;
при условии, что когда m=n=0 и G означает O, то R16 не может означать трет-бутил или фенил;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где R7' означает Н и R7 означает н-этил, циклопропилметил, циклопропил, циклобутилметил, циклобутил или меркаптометил, предпочтительно н-пропил или 2,2-дифторэтил.
3. Соединение по п.1, где R7 и R7' вместе означают спироциклопропиловый или спироциклобутиловый цикл, оба, необязательно, моно- или дизамещенные R7'a, где R7'a означает C1-C6-алкил, C3-C5-циклоалкил или C2-C6-алкенил, каждый из которых, необязательно, замещен галогеном; либо R7'а означает J.
4. Соединение по п.3, где цикл представляет собой спироциклопропиловый цикл, замещенный R7'a, где R7'a означает этил, винил, циклопропил, 1- или 2-бромэтил, 1- или 2-фторэтил, 2-бромвинил или 2-фторэтил.
5. Соединение по п.1, где R7 означает J и R7' означает Н.
6. Соединение по любому из пп.1-5, где q равно 1 и k равно 1.
7. Соединение по любому из пп.1-6, где m равно 0 и n равно 0.
8. Соединение по п.7, где G означает -NRy- или -NRjNRj-.
9. Соединение по п.8, где Ry или одна из Rj групп означает J, тем самым указывая на макроциклическое соединение.
10. Соединение по любому из пп.7-9, где R16 означает Н, C1-C3-алкил или C3-C6-циклоалкил.
11. Соединение по любому из пп.1-6, где m равно 1.
12. Соединение по п.11, где X означает -NRx-.
13. Соединение по любому из пп.11, 12, где U означает О.
14. Соединение по любому из пп.11-13, где R11 означает C1-C6-алкил, C0-C3-алкилкарбоциклил, C0-C3-алкиларил или C0-C3-алкилгетероарил, каждый из которых необязательно замещен галогеном, амино, C1-C6-алкокси, C1-C6-тиоалкилом, карбоксилом, (C1-C6-алкокси)карбонилом, арилом, гетероарилом или гетероциклилом, и, в особенности, где заместитель означает гидрокси или C(=O)OR14.
15. Соединение по любому из пп.11-14, где R11 означает фенилэтил, 2,2-диметилпропил, циклогексилметил, фенилметил, 2-пиридилметил, 4-гидроксифенилметил или карбоксилпропил; или, в особенности, трет-бутил, изобутил или циклогексил.
16. Соединение по любому из пп.11-15, где один из Rx или R11 означает J, тем самым указывая на макроциклическое соединение.
17. Соединение по любому из пп.1-6, где n равно 1.
18. Соединение по п.17, где R15 означает C1-C6-алкил или C0-C3-алкилкарбоциклил, каждый из которых является необязательно замещенным.
19. Соединение по любому из пп.16-18, где R15 означает циклогексил, циклогексилметил, трет-бутил, изопропил или изобутил.
20. Соединение по любому из пп.1-6, где G означает NRy или -NRjNRj-, где Ry или один из Rj означает Н или метил, а другой Rj означает Н.
21. Соединение по п.20, где R16 означает Н, C1-C6-алкил или 5- или 6-членный гетероцикл, в особенности морфолин, пиперидин или пиперазин.
22. Соединение по любому из пп.1-6, где R16 означает C1-C6-алкил, C0-C3-алкилгетероциклил, C0-C3-алкилкарбоциклил, каждый из которых необязательно замещен гидрокси, галогеном, амино или C1-C6-алкокси.
23. Соединение по п.22, где R16 означает 2-инданол, инданил, 2-гидрокси-1-фенилэтил, 2-тиофенметил, циклогексилметил, 2,3-метилендиоксибензил, циклогексил, бензил, 2-пиридилметил, циклобутил, изобутил, н-пропил или 4-метоксифенилэтил.
24. Соединение по любому из пп.1-23, где W означает -ОС(=O)-, -NRa-, -NHS(О)2- или -NHC(=O)-; или в особенности -OC(=O)NH- или -NH.
25. Соединение по любому из пп.1-23, где W означает -S-, связь или в особенности -О-.
26. Соединение по п.24 или 25, где R8 означает необязательно замещенный C0-C3-алкилкарбоциклил или необязательно замещенный C0-C3-алкилгетероциклил.
27. Соединение по п.26, где C0-C3-алкильная группа означает метилен или предпочтительно связь.
28. Соединение по п.24 или 25, где
R8 означает C0-C3-алкиларил или C0-C3-алкилгетероарил, каждый из которых необязательно моно-, ди- или тризамещен R9;
R9 означает C1-C6-алкил, C1-C6-алкокси, NO2, ОН, галоген, трифторметил, амино, амидо, необязательно моно- или дизамещенный C1-C6-алкилом, C0-C3-алкиларил, C0-C3-алкилгетероарил, карбоксил, где арил или гетероарил необязательно замещен R10;
R10 означает C1-C6-алкил, C3-C7-циклоалкил, C1-C6-алкокси, амино, необязательно моно- или дизамещенный C1-C6-алкилом, амидо, сульфонил-C1-C3-алкил, NO2, ОН, галоген, трифторметил, карбоксил или гетероарил.
29. Соединение по п.28, где
R9 означает C1-C6-алкил, C1-C6-алкокси, амино, ди(C1-C3-алкил)амино, C1-C3-алкиламид, арил или гетероарил, где арил или гетероарил необязательно замещен R10;
R10 означает C1-C6-алкил, C3-C7-циклоалкил, C1-C6-алкокси, амино, моно- или ди-C1-C3-алкиламино, амидо, галоген, трифторметил или гетероарил.
30. Соединение по п.29, где R10 означает C1-C6-алкил, C1-C6-алкокси, амино, необязательно моно- или дизамещенный C1-C3-алкилом, амидо, C1-C3-алкиламид, галоген или гетероарил.
31. Соединение по п.30, где R10 означает метил, этил, изопропил, трет-бутил, метокси, хлор, амино, необязательно моно- или дизамещенный C1-C3-алкилом, амидо или C1-C3-алкилтиазолил.
32. Соединение по п.31, где R8 означает 1-нафтилметил, 2-нафтилметил, бензил, 1-нафтил, 2-нафтил или хинолинил, каждый из которых является незамещенным, моно- или дизамещенным вышеуказанным R9.
33. Соединение по п.32, где R8 означает 1-нафтилметил или хинолинил, каждый из которых является незамещенным, моно- или дизамещенным вышеуказанным R9.
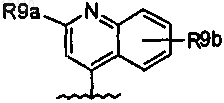
34. Соединение по п.33, где R8 означает
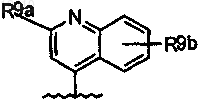
где R9a означает C1-C6-алкил, C1-C6-алкокси, тио-C1-C3-алкил, амино, необязательно замещенный C1-C6-алкилом, C0-C3-алкиларил или C0-C3-алкилгетероарил, C0-C3-алкилгетероциклил, указанный арил, гетероарил или гетероцикл, необязательно, замещен R10;
R10 означает C1-C6-алкил, C0-C3-алкил-C3-C7-циклоалкил, C1-C6-алкокси, амино, необязательно моно- или дизамещенный C1-C6-алкилом, амидо, C1-C3-алкиламид;
R9b означает C1-C6-алкил, C1-C6-алкокси, амино, ди(C1-C3-алкил)амино, (C1-C3-алкил)амид, NO2, ОН, галоген, трифторметил, карбоксил.
35. Соединение по п.34, где R9a означает арил или гетероарил, каждый из которых необязательно замещен вышеуказанным R10.
36. Соединение по п.35, где R9a выбирают из группы, включающей
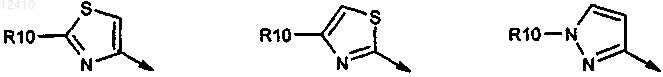
где R10 означает Н, C1-C6-алкил или C0-C3-алкилциклоалкил, амино, необязательно моно- или дизамещенный C1-C6-алкилом, амидо, (C1-C3-алкил)амид.
37. Соединение по п.35, где R9a означает необязательно замещенный фенил, предпочтительно фенил, замещенный C1-C6-алкилом; C1-C6-алкокси или галоген.
38. Соединение по п.34, где R8 означает
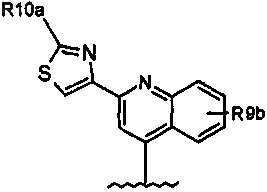
где R10a означает Н, C1-C6-алкил или C0-C3-алкилкарбоциклил, амино, необязательно моно- или дизамещенный C1-C6-алкилом, амидо, гетероарил или гетероциклил;
R9b означает C1-C6-алкил, C1-C6-алкокси, амино, ди(C1-C3-алкил)амино, амифю, NO2, ОН, галоген, трифторметил или карбоксил.
39. Соединение по п.34, где R9b означает C1-C6-алкокси, предпочтительно метокси.
40. Соединение по любому из пп.1-39, где А означает C(=O)NHSO2R2.
41. Соединение по п.40, где R2 означает необязательно замещенный C1-C6-алкил, необязательно замещенный C3-C7-циклоалкил или необязательно замещенный C0-C6-алкиларил.
42. Соединение по п.40, где R2 означает необязательно замещенный метил, необязательно замещенный циклопропил или необязательно замещенный фенил.
43. Соединение по любому из пп.1-39, где А означает C(=O)OR1.
44. Соединение по п.43, где R1 означает Н или C1-C6-алкил, предпочтительно водород, метил, этил или трет-бутил.
45. Соединение по любому из пп.1-44, где J означает 3-8-членную насыщенную или ненасыщенную алкиленовую цепь, необязательно содержащую один или два гетероатома, независимо выбранных из группы, включающей -O-, -S- или -NR12-, где R12 означает Н, C1-C6-алкил, такой как метил, или
-С(=O)C1-C6-алкил, такой как ацетил.
46. Соединение по п.45, где J означает 4-7-членную насыщенную или ненасыщенную, полностью углеродную алкиленовую цепь.
47. Соединение по п.46, где J является насыщенным или мононенасыщенным.
48. Соединение по п.45, где J является протяженным, образуя макроцикл из 14 или 15 кольцевых атомов.
49. Соединение по п.1, имеющее формулу Ihe
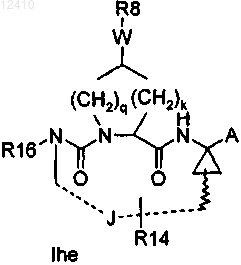
где R16 означает Н или C1-C6-алкил;
J означает отдельную 3-10-членную насыщенную или частично ненасыщенную алкиленовую цепь;
q равно 1 и k равно 1;
А означает C(=O)OR1 или С(=O)NHSO2R2;
R1 означает водород или C1-C6-алкил;
R2 означает C1-C6-алкил, C0-C3-алкилкарбоциклил, C0-C3-алкилгетероциклил;
W означает -О- или -OC(=O)NH;
R8 означает C0-C3-алкиларил или C0-C3-алкилгетероарил, каждый из которых, необязательно, моно-, ди- или тризамещенный R9;
R9 означает C1-C6-алкил, C1-C6-алкокси, NO2, ОН, галоген, трифторметил, амино или амидо, необязательно, моно- или дизамещенный C1-C6-алкилом, C0-C3-алкиларил, C0-C3-алкилгетероарил, карбоксил, где арил или гетероарил, необязательно, замещен R10;
R10 означает C1-C6-алкил, C3-C7-циклоалкил, C1-C6-алкокси, амино, необязательно моно- или дизамещенный C1-C6-алкилом, C1-C3-алкиламид, сульфонил-C1-C3-алкил, NO2, ОН, галоген, трифторметил, карбоксил или гетероарил.
50. Соединение по п.49, где J означает отдельную 5- или 6-членную насыщенную или частично ненасыщенную алкиленовую цепь.
51. Соединение по п.49 или 50, где J содержит одну ненасыщенность.
52. Соединение по любому из пп.49-51, где J содержит одну двойную связь, расположенную на расстоянии одного углеродного атома от циклоалкильной R7 функции, которая в соединениях формулы Ihe означает циклопропильную группу.
53. Соединение по любому из пп.49-52, где R8 означает
где R9a означает C0-C3-алкиларил, C0-C3-алкилгетероарил или C0-C3-алкилгетероциклил; указанный арил, гетероарил или гетероцикл необязательно замещен R10;
R10 означает C1-C6-алкил, амино, моно- или дизамещенный C1-C6-алкилом или NHC(О)C1-C6-алкилом;
R9b означает C1-C6-алкокси или
R8 означает C0-C3-алкиларил, где арильная группа необязательно замещена 1-2 заместителями, выбранными из C0-C3-алкилгетероциклила и трифтор-C1-C6-алкила; и где C0-C3-алкилгетероциклил необязательно замещен R10.
54. Соединение по п.53, где R9a означает

где R10 означает Н, C1-C6-алкил, амино, моно- или дизамещенный C1-C3-алкилом амино.
55. Соединение по любому из пп.49-54, где А означает C(=O)NHSO2R2.
56. Соединение по п.55, где R2 означает необязательно замещенный циклопропил или необязательно замещенный метил.
57. Фармацевтическая композиция, содержащая соединение по любому из пп.1-56, и фармацевтически приемлемый носитель.
58. Фармацевтическая композиция по п.57, дополнительно содержащая HCV-антивирусное средство, выбранное из группы, включающей ингибиторы нуклеозидных аналогов полимеразы, ингибиторы протеазы, рибавирин и интерферон.
59. Применение соединения по любому из пп.1-56 в терапии.
60. Применение соединения по любому из пп.1-56 для получения лекарственного средства для профилактики или лечения флавивирусных инфекций, включая HCV.
61. Способ лечения или профилактики флавивирусной инфекции, такой как HCV, включающий введение эффективного количества соединения по любому из пп.1-56 субъекту, зараженному или имеющему риск заражения такой инфекцией.
Текст
012410 Техническое обоснование Настоящее изобретение относится к новым ингибиторам серин-протеазы NS3 флавивируса HCV и способам их применения для лечения или профилактики HCV. Уровень техники Серин-протеаза NS3 HCV является многофункциональным белком, который содержит домен серинпротеазы и домен РНК-геликазы. Кофактор протеазы NS4A, являющийся сравнительно малым белком,совершенно необходим для повышенной активности серин-протеазы. Серин-протеаза NS3 незаменима для вирусного жизненного цикла. Рентгеноструктурный анализ участка связывания субстрата показывает, что участок связывания протеазы NS3 является заметно пологим и растворитель выходит на поверхность, что ставит трудную задачу создания малой молекулы ингибитора. Считается, что два ингибитора протеазы HCV поступили на клинические испытания, а именноBILN-2061 Boehringer Ingelheim, описанный в WO 0059929, и Vertex' VX-950, описанный в WO 0387092. Ряд аналогичных пептидоподобных ингибиторов протеазы HCV представлен также в академической и патентной литературе. Общим для подавляющего большинства таких известных из уровня техники пептидомиметиков является присутствие L-пролинового производного в Р 2 позиции ингибитора и взаимодействие с S2 субсайтом протеолитического фермента HCV. В случае BILN-2061, L-пролин является 4 замещенным простым хинолиновым эфиром, тогда как VX-950 содержит карбоциклическое кольцо, конденсированное с L-пролиновым циклом. Большинство пептидомиметиков, кроме того, содержит дополнительные L-аминокислотные производные, связанные с пептидом в P3 позиции, многие предложенные ингибиторы также включают дополнительные L-аминокислотные производные, удлиненные за счет Р 4,Р 5 и P6. Уже установлено, что замедленное введение BILN-2061 или VX-950 действует избирательно на мутанты HCV, устойчивые к соответствующему лекарственному средству, так называемые "ускользнувшие" от лекарств мутанты. Эти "ускользнувшие" от лекарств мутанты имеют характерные мутации в геноме протеазы HCV, а именно D168V, D168Y и/или A165S. Обработка парадигмов HCV, таким образом, схожа с терапией ВИЧ, где также легко возникают "ускользнувшие" от лекарств мутации. Следовательно, постоянно существует потребность в дополнительных лекарственных средствах с различными резистентными профилями для обеспечения пациентам, лечение которых оказалось неудачным, возможности терапевтического выбора, и комбинированная терапия с применением множества лекарственных средств, по-видимому, на будущее станет нормой, даже на первом этапе лечения. Экспериментальные данные, полученные с лекарствами против ВИЧ и ингибиторами ВИЧпротеазы, в частности, дополнительно подчеркивают, что недостаточно оптимальные фармакокинетика и комплексные схемы лекарственного лечения быстро приводят к случайным неблагоприятным исходам,связанным с комплаентностью. Это, в свою очередь, означает, что 24-часовой минимум концентрации(минимальная концентрация в плазме) для соответствующих лекарственных средств, используемых в схеме лечения ВИЧ, часто падает ниже пороговой величины IC90 или ED90 для большей части дня. Считается, что 24-часовой минимальный уровень, равный, по меньшей мере, IC50 и, точнее, IC90 или ED90,является необходимым для сдерживания развития "ускользнувших" от лекарств мутантов и достижения необходимой фармакокинетики и метаболизма лекарственных средств, что ставит условие наличия таких минимальных уровней жестким требованием к дизайну лекарственных средств. Строго пептидоподобный характер известных из уровня техники ингибиторов HCV-протеазы с множественными пептидными связями в нативных конфигурациях создает фармакокинетические препятствия для эффективных схем приема лекарственного средства. Краткое описание изобретения Согласно основному аспекту изобретения представлены соединения формулы IR2 означает C1-C6-алкил, C0-C3-алкилкарбоциклил, C0-C3-алкилгетероциклил; R2 замещен 1-3 заместителями, независимо выбранными из группы, включающей галоген, оксо, нитрил, азидо, нитро, C1-C6 алкил, C0-C3-алкилкарбоциклил, C0-C3-алкилгетероциклил, NH2CO-, Y-NRaRb, Y-O-Rb, Y-C(=O)Rb, Y(C=O)NRaRb, Y-NRaC(=O)Rb, Y-NHSOpRb, Y-S(=O)pRb и Y-S(=O)pNRaRb, Y-C(=O)ORb, YNRaC(=O)ORb;Y независимо означает связь или C1-C3-алкилен;R7 означает C1-C6-алкил, C0-C3-алкил-C3-C7-циклоалкил или C2-C6-алкенил, каждый из которых необязательно замещен 1-3 атомами галогена, либо амино, -SH или C0-C3-алкилциклоалкильной группой; или R7 означает J;R7' означает Н или взятый вместе с R7 образует C3-C6-циклоалкильный цикл, необязательно замещенный R7'a, гдеR7'a означает C1-C6-алкил, C3-C5-циклоалкил, C2-C6-алкенил, каждый из которых необязательно может быть замещен галогеном; или R7'a может означать J;R8 означает кольцевую систему, содержащую 1 или 2 насыщенных, частично насыщенных или ненасыщенных кольца, каждое из которых содержит 4-7 кольцевых атомов и каждый из которых имеет 0-4 гетероатома, независимо выбранных из S, О и N, кольцевая система, необязательно, отделена от W посредством C1-C3-алкильной группы; каждая из указанных R8 групп может быть необязательно моно-, диили тризамещенной R9, гдеR9 независимо выбирают из группы, включающей галоген, оксо, нитрил, азидо, нитро, C1-C6-алкил,C0-C3-алкилкарбоциклил, C0-C3-алкилгетероциклил, NH2C(=O)-, Y-NRaRb, Y-O-Rb, Y-C(=O)Rb, Y(C=O)NRaRb, Y-NRaC(=O)Rb, Y-NHSOpRb, Y-S(=O)pRb, Y-S(=O)pNRaRb, Y-C(=O)ORb, YNRaC(=O)ORb; где указанный карбоциклил или гетероциклил означает необязательно замещенный R10; гдеX означает -NRx-, где Rx означает Н, C1-C5-алкил или J; либо в случае, когда Е означает -С(=O), X может также означать -О- или -NRjNRj-; где один из Rj означает Н, а другой означает Н, C1-C5-алкил или J;R11 означает Н, C1-C6-алкил, C0-C3-алкилкарбоциклил, C0-C3-алкилгетероциклил, каждый из которых может быть замещен галогеном, оксо, нитрилом, азидо, нитро, C1-C6-алкилом, C0-C3 алкилкарбоциклилом, C0-C3-алкилгетероциклилом, NH2C(=O)-, Y-NRaRb, Y-O-Rb, Y-C(=O)Rb, Y(C=O)NRaRb, Y-NRaC(=O)Rb, Y-NHSOpRb, Y-S(=O)pRb, Y-S(=O)pNRaRb, Y-C(=O)ORb, YNRaC(=O)ORb; либо R11 означает J;J, если присутствует, означает отдельную 3-10-членную насыщенную или частично ненасыщенную алкиленовую цепь, простирающуюся от R7/R7'-циклоалкила или от атома углерода, к которому присоединен R7, до одного из Rj, Rx, Ry или R11 с образованием макроцикла, указанная цепь, необязательно,прерывается одним-тремя гетероатомами, независимо выбранными из -O-, -S- или -NR12-, и где 0-3 атома углерода в цепи необязательно замещены R14; гдеR14 независимо выбирают из группы, включающей Н, C1-C6-алкил, C1-C6-галогеналкил, C1-C6 алкокси, гидрокси, галоген, амино, оксо, тио и C1-C6-тиоалкил;R15 означает Н, C1-C6-алкил, C0-C3-алкилкарбоциклил, C0-C3-алкилгетероциклил, каждый из которых может быть замещен галогеном, оксо, нитрилом, азидо, нитро, C1-C6-алкилом, C0-C3 алкилгетероциклилом, C0-C3-алкилкарбоциклилом, NH2CO-, Y-NRaRb, Y-O-Rb, Y-C(=O)Rb, Y(C=O)NRaRb, Y-NRaC(=O)Rb, Y-NHSOpRb, Y-S(=O)pRb, Y-S(=O)pNRaRb, Y-C(=O)ORb, YNRaC(=O)ORb;G означает -O-, -NRy-, -NRjNRj-, где один из Rj означает H, а другой означает Н, C1-C5-алкил или J;R16 означает Н или C1-C6-алкил, C0-C3-алкилкарбоциклил, C0-C3-алкилгетероциклил, каждый из которых может быть замещен галогеном, оксо, нитрилом, азидо, нитро, C1-C6-алкилом, C0-C3 алкилкарбоциклилом, C0-C3-алкилгетероциклилом, NH2CO-, Y-NRaRb, Y-O-Rb, Y-C(=O)Rb, Y(C=O)NRaRb, Y-NRaC(=O)Rb, Y-NHSOpRb, Y-S(=O)pRb, Y-S(=O)pNRaRb, Y-C(=O)ORb, YNRaC(=O)ORb; при условии, что когда m=n=0 и G означает O, то R16 не может означать трет-бутил или фенил; или их фармацевтически приемлемая соль. Не вдаваясь в теоретические подробности или соотнесение предположительного характера связывания с конкретными переменными, используемые здесь условные понятия P1, P2, P3 и Р 4 введены ис-2 012410 ключительно для удобства и имеют, в основном, общепринятые значения, представленные в SchechterBerger (1976) Biochem. Biophys. Res. Comm. 27, 157-162, и означают те участки ингибитора, которые предположительно заполняют S1, S2, S3 и S4 субсайты фермента, соответственно, где S1 является смежным с сайтом расщепления и S4 удален от сайта расщепления. Предполагается, что независимо от характера связывания компоненты, определяемые формулой I, входят в рамки объема настоящего изобретения и приложенных пунктов. Например, предполагается, что блокирующая группа R16-G может взаимодействовать с S3 и S4 субсайтами, в частности, когда m и/или n равно 0. Различные варианты осуществления настоящего изобретения могут быть абстрактно представлены как R16-G-P4-P3-связующее звено-Р 2-Р 1, где P3 и/или Р 4 могут отсутствовать, каждый из Р 1, P3 и Р 4 означает структурный блок, состоящий из производного природной или синтетической аминокислоты, Р 2 означает гетероциклический остаток и G-R16 означает блокирующую группу. Связующим звеном служит карбонильная или другая функциональность, как указано для Е. Р 1 и Р 2 структурные блоки и P3 и Р 4 структурные блоки, таким образом, обычно связаны вместе амидными связями, тогда как Р 2 и P3 структурные блоки соединены через вышеуказанное связующее звено. Таким образом, амидные связи являются обычно обращенными относительно друг друга по обе стороны от связующего звена в соединениях по изобретению. Дополнительные аспекты изобретения включают фармацевтическую композицию, включающую вышеуказанное соединение изобретения и фармацевтически приемлемый носитель или разбавитель для указанного соединения. Соединения и композиции по изобретению находят применение в способах медицинского лечения или профилактики HCV-инфекций у человека. Следовательно, дальнейший аспект изобретения касается применения вышеуказанного соединения в терапии, а именно в целях получения лекарственного средства для профилактики или лечения флавивирусных инфекций у людей или животных. Характерные примеры флавивирусов включают BVDV, денге и, в особенности, HCV. Соединения по изобретению содержат непептидный мостик по месту связи между Р 2 и P3 структурными блоками, приводящий к тому, что ориентация P3 и Р 4 остатков является обращенной относительно нативного субстрата. Это непептидное связующее звено является также обычно более длинным,чем может быть соответствующая пептидная связь, и подразумевает, что P3 и/или Р 4 группы (включая кэп R16 в пределах взаимодействия с S3 или S4) смещены наружу относительно нативного пептидного субстрата. Предполагается, что реверсия и смещение, таким образом, должны позволять искусственнойD-стереохимии включение заполняющих групп (например, боковых цепей) P3, и/или Р 4, и/или R16. В самом деле, такие соединения обычно высоко активны и входят в рамки объема изобретения и приложенных пунктов. Однако неожиданно было обнаружено, что даже соединения по изобретению, содержащие L-аминокислотные боковые цепи на P3 и/или Р 4, обладают хорошей активностью, несмотря на то,что соответствующая структурная единица боковой цепи должна сближаться с "карманом" S3 или S4 под другим углом относительно нативного пептидного субстрата. Следовательно, L-стереохимия на R11 и/или R15 и/или соответствующая конфигурация на R16, имитирующая L-стереохимию, составляет преимущественный аспект изобретения. Другой угол сближения с "карманами" S3 и/или S4 также сказывается на способности соединений по изобретению избегать резистентных профилей, которыми обладают известные из уровня техники ингибиторы HCV-протеазы, до настоящего времени имевшие, все, обычный пептидный скелет из природных или синтетических L-аминокислотных остатков. Как и в случае обратной транскриптазы ВИЧ, хорошо известной способностью к быстрой генерации "ускользнувших" от лекарств мутантов при селективном воздействии антивирусотерапии, РНК-зависимая РНК-полимераза NS5A HCV обладает очень низким потенциалом проверочного считывания. Это, в свою очередь, означает, что HCV-полимераза в высшей степени склонна к ошибкам и наверняка характерные резистентные профили будут возникать при введении HCV-антивирусных средств в течение длительных периодов времени. Даже до запуска в производство ясно, что BILN 2061 с, по существу, пептидным скелетом (хотя и макроциклизованным) и ингибитор протеазы NS3 Vertex' VX-950 с линейным пептидным скелетом по P3 и Р 4 быстро приведут к характерным устойчивым мутациям в положениях 155, 156 или 168 протеазы NS3 (Lin et al. J. Biol. Предпочтительные значения q и k в формуле I включают 2:1, 2:2, 2:3, 3:2, 3:3, более предпочтительно 1:2 и 1:0 и наиболее предпочтительно 1:1, в этом случае предпочтительные соединения имеют сле-3 012410 дующую подструктуру: где е равно 1 или 2. Соединения по изобретению могут включать как P3, так и Р 4 функциональность, т.е. каждый из m иn равен 1. Предпочтительные варианты осуществления в рамках формулы I включают формулы Ida-Idd,приведенные ниже Альтернативные конфигурации соединений по изобретению содержат P3, но не содержат Р 4 функциональность, т.е. m равно 1, а n равно нулю. Предпочтительные варианты осуществления в рамках формулы I включают формулы Iea-Iee, приведенные ниже Другие альтернативные конфигурации соединений по изобретению включают те соединения, где m и n равны 0, и, таким образом, группы R16-G примыкают к Р 2, но, как указано выше, блокирующая группа R16-G может в благоприятном случае взаимодействовать с S3 и/или S4. Предпочтительные варианты осуществления в рамках формулы I включают формулы Ifa-Ife, приведенные нижеR16 на фиг. Ifb и везде далее обычно означает Н, C1-C3-алкил, C5-C6-алкил, C0-C3 алкилгетероциклил, C1-C3-алкилкарбоциклил или C3-C7-циклоалкил, каждый из которых необязательно замещен, как указано выше. Например, R16 может означать фенил, замещенный, как указано выше. Соединения по изобретению могут включать линейные молекулы, как представлено выше. Альтернативно, в вариантах осуществления, где R7 и R7' вместе означают спироциклоалкильную группу, такую как спироциклопропил, соединения по изобретению могут иметь конфигурацию макромолекул, где связующая группа J находится между одним из Rj, Rx, Ry или R11 формулы I. Альтернативно, макроцикл J может простираться от углерода, смежного с R7, до одного из Rj, Rx, Ry или R11. Предпочтительные варианты осуществления таких макроциклических структур в рамках формулыI, где m равно 0 и n равно 1, включают структуры формул Iga-Igd, приведенных ниже Соответствующие структуры, где J цепь связана со смежным с R углеродом, также представляют интерес. Дополнительные предпочтительные варианты осуществления таких макроциклических структур в рамках формулы I, где m равно 0 и n равно 1, включают структуры формул Ige-Igf, приведенных ниже Соответствующие структуры, где J цепь связана со смежным с R7 углеродом, также представляют интерес. Предпочтительные макроциклические структуры в рамках формулы I, включающие как P3, так и Р 4 функциональность, т.е. где каждый из m и n равен 1, включают структуры формул Iha-Ihd, приведенных ниже Соответствующие структуры, где J цепь связана со смежным с R углеродом, также представляют интерес. Предпочтительные макроциклические структуры в рамках формулы I, где обе функциональности,P3 и Р 4, отсутствуют, т.е. где каждый из m и n равен 0, включают структуры формул Ihe и Ihf. Соответствующие структуры, где J цепь связана со смежным с R7 углеродом, также представляют интерес, в особенности формулы Ihe и Ihf. В общем случае, в необязательно макроциклических структурах, таких как изображены выше, связующая группа J означает содержащую 3-10 атомов в цепи, предпочтительно 5-8 атомов в цепи, например 6 или 7 атомов в цепи, насыщенную алкиленовую цепь или частично ненасыщенную алкиленовую цепь, т.е. алкиленовую цепь, содержащую 1-3 ненасыщенных связи между смежными углеродами, как правило, одну ненасыщенность. Длина цепи зависит, конечно же, от того, простирается ли J от Rd, Rj,Rx, Ry, R11 или от углерода, смежного с R7. Подходящие цепи описаны подробно в WO 00/59929. Обычно J должен быть протяженным, чтобы обеспечивать макроцикл с 13-16 кольцевыми атомами (включая атомы в P1, P2 и, если присутствует, P3 группах, участвующие в образовании цикла). Обычно J является протяженным, образуя макроцикл с 14 или 15 кольцевыми атомами. Целесообразно, чтобы в состав J цепи входили один или два гетероатома, выбранных из О, S, NH,NC1-C6-алкила или N-С(=O)C1-C6-алкила. Более предпочтительно, в состав J цепи, необязательно, входит один гетероатом, выбранный из NH или N-С(=O)C1-C6-алкила, наиболее предпочтительно N(Ac). Наиболее предпочтительно цепь, содержащая атом азота, является насыщенной. Согласно альтернативному варианту осуществления, J содержит один гетероатом, выбранный из О или S. Цепь может быть замещена R14, таким как Н или метил. Как правило, структура J связующей группы является насыщенной. Альтернативно, J содержит 1-3,предпочтительно 1 двойную связь, обычно отделенную одним углеродом от циклоалкильной R7 функциональности, если таковая присутствует. Двойная связь может быть цис или транс. Характерные примеры J, таким образом, включают пентилен, гексилен, гептилен, каждый из которых замещен C1-C6-алкилом, C1-C6-галогеналкилом, C1-C6-алкокси, гидроксилом, галогеном, амино, оксо, тио или C1-C6-тиоалкилом; пентен-3-ил, гексен-4-ил, гептен-5-ил, где 3, 4 или 5 означает двойную связь между атомами углерода 3 и 4, 4 и 5 и т.д. Подходящие R7 и R7' группы включают те группы, в которых R означает Н и R7 означает н-этил, н-6 012410 пропил, циклопропилметил, циклопропил, циклобутилметил, циклобутил, 2,2-дифторэтил или меркаптометил. Предпочтительные варианты осуществления включают те группы, в которых R7 означает нпропил или 2,2-дифторэтил. Альтернативные предпочтительные конфигурации R7 и R7' включают те группы, в которых R7' означает Н и R7 означает C3-C7-циклоалкил или C1-C3-алкил-C3-C7-циклоалкил. Другие предпочтительные конфигурации R7 и R7' включают те группы, в которых R7' означает Н и 7R означает J. Альтернативно, R7 и R7' вместе означают спироциклоалкильную функциональность, такую как спироциклобутиловый цикл и более предпочтительно спироциклопропиловый цикл. "Спиро" в данном контексте просто означает, что циклоалкиловый цикл имеет один совместный атом углерода с основной пептидной цепью соединения. Цикл является замещенным или незамещенным. Предпочтительные заместители включают моно- или дизамещения посредством R7'a, где R7'a означает C1-C6-алкил, C3-C5 циклоалкил или C2-C6-алкенил, каждый из которых необязательно замещен галогеном. Альтернативно,заместителем может являться вышеуказанная J связующая группа. Предпочтительные для этого случая стереохимические структуры спироциклопропилового цикла приведены ниже. В особенности предпочтительные заместители включают R7'а, означающий этил, винил, циклопропил (т.е. спироциклопропиловый заместитель для "спиро"-циклоалкилового цикла, образованного R7/R7'),1- или 2-бромэтил, 1- или 2-фторэтил, 2-бромвинил или 2-фторэтил. Предпочтительной конфигурацией А является C(=O)OR1, в особенности, где R1 означает C1-C6 алкил, такой как метил, этил или трет-бутил и наиболее предпочтительно водород. В частности, предпочтительной конфигурацией А является С(=O)NHSO2R2, в особенности, когда R2 означает необязательно замещенный C1-C6-алкил, предпочтительно метил, или необязательно замещенный C3-C7-циклоалкил, предпочтительно циклопропил, или необязательно замещенный C0-C6-алкиларил,предпочтительно необязательно замещенный фенил. Подходящие заместители представлены в определениях ниже. Заместитель -W-R8 на циклической группе Р 2 может иметь разнообразные пролиновые заместители, подробно описанные в WO 00/59929, WO 00/09543, WO 00/09558, WO 99/07734, WO 99/07733,WO 02/60926, WO 03/35060, WO 03/53349, WO 03/064416, WO 03/66103, WO 03/064455, WO 03/064456,WO 03/62265, WO 03/062228, WO 03/87092, WO 03/99274, WO 03/99316, WO 03/99274, WO 04/03670,WO 04/032827, WO 04/037855, WO 04/43339, WO 04/92161, WO 04/72243, WO 04/93798, WO 04/93915,WO 04/94452, WO 04/101505, WO 04/101602, WO 04/103996, WO 04113365 и тому подобном. Предпочтительные функциональности W включают такие значения W, как -OC(=O)NH-, -OC(=O)-,-NH-, -NHS(O)2- или -NHC(=O)-, в особенности -OC(=O)NH- или -NH-. Предпочтительные R8 группы для таких функциональностей W включают необязательно замещенный C0-C3-алкилкарбоциклил или C0-C3 алкилгетероциклил, включая группы, описанные в WO 0009543, WO 0009558 и WO 00/174768. Например, сложноэфирные заместители, -W-R8, на циклической Р 2 группе включают соответствующие заместители, описанные в WO 01/74768, такие как C1-C6-алканоилокси, C0-C3-алкиларилоилокси, в частности,(необязательно замещенный)бензоилокси или, в особенности, C0-C3-алкилгетероциклоилокси В указанной публикации также описаны альтернативные возможные варианты -W-R8, например,C1-C6-алкил, такой как этил, изопропил, C0-C3-алкилкарбоциклил, такой как циклогексил, 2,2 дифторэтил, -C(=O)NRc, где Rc означает C1-C6-алкил, C0-C3-алкилциклопропил, C0-C3-алкиларил или C0C3-алкилгетероциклил. В этом случае предпочтительные W функциональности включают -S- и в особенности -О-. Подходящие значения R8 в этих вариантах осуществления включают C0-C3-алкиларил или C0-C3 алкилгетероарил, каждый из которых, необязательно, моно-, ди- или тризамещен R9, где R9 означает C1C6-алкил, C1-C6-алкокси, NO2, ОН, галоген, трифторметил, амино или амидо (например, амидо- или амино-, необязательно, моно- или дизамещенный C1-C6-алкилом), C0-C3-алкиларил, C0-C3-алкилгетероарил или карбоксил, где арильная или гетероарильная группа необязательно замещена R10; где R10 означаетC1-C6-алкил, C3-C7-циклоалкил, C1-C6-алкокси, амино, амидо, сульфонил-C1-C3-алкил, NO2, ОН, галоген,трифторметил, карбоксил или гетероарил. В основном, C0-C3-алкильный компонент R8, такой как C0-C3-алкиларил или C0-C3-алкилгетероарил,означает метил и, в особенности предпочтительно, отсутствует, т.е. C0. Арильный или гетероарильный компонент имеет значения, подробно описанные в определениях ниже. Предпочтительный R9 включает C1-C6-алкил, C1-C6-алкокси, амино (такой как ди-C1-C3 алкиламино), амидо (такой как -NHC(О)C1-C6-алкил или С(=O)NHC1-C6-алкил), арил или гетероарил; арил или гетероарил необязательно замещены R10; где R10 означает C1-C6-алкил, C3-C7-циклоалкил, C1C6-алкокси, амино (такой как моно- или ди-C1-C3-алкиламино), амидо (такой как -NHC(O)C1-C3-алкил или С(=O)NHC1-C3-алкил), галоген, трифторметил или гетероарил.-7 012410 Предпочтительный R10 включает C1-C6-алкил, C1-C6-алкокси, амино, амидо (такой как -NHC(O)C1C6-алкил или С(=O)NHC1-C6-алкил), галоген или гетероарил. В особенности предпочтительный R10 включает метил, этил, изопропил, трет-бутил, метокси, хлор,амино, амидо (такой как -NHC(O)C1-C6-алкил, например, -NC(=O)СНС(СН 3)3 или С(=O)NHC1-C3-алкил),или C1-C3-алкилтиазол. Предпочтительные варианты осуществления R8 включают 1-нафтилметил, 2-нафтилметил, бензил,1-нафтил, 2-нафтил или хинолинил, каждый из которых является незамещенным, моно- или дизамещенным R9, принимающим указанные значения, в частности, 1-нафтилметил, или хинолинил, незамещенный, моно- или дизамещенный R9, принимающим указанные значения. В данном случае предпочтительный R8 означает где R9a означает C1-C6-алкил; C1-C6-алкокси; тио-C1-C3-алкил; амино, необязательно замещенный C1-C6 алкилом; C0-C3-алкиларил или C0-C3-алкилгетероарил, C0-C3-алкилгетероциклил, указанный арил, гетероарил или гетероцикл необязательно замещен R10, гдеR10 означает C1-C6-алкил, C3-C7-циклоалкил, C1-C6-алкокси, амино, амидо, гетероарил или гетероциклил; и R9b означает C1-C6-алкил, C1-C6-алкокси, амино, амидо, NO2, ОН, галоген, трифторметил, карбоксил. Подходящие R9a включают арил или гетероарил, все, необязательно замещенные вышеуказанным 10 где R10a означает Н, C1-C6-алкил или C0-C3-алкил-C3-C6-циклоалкил, амин (такой как амин, моно- или дизамещенный C1-C6-алкилом), амидо (такой как -NHC(О)C1-C3-алкил или С(=O)NHC1-C3-алкил), гетероарил или гетероциклил и R9b означает C1-C6-алкил, C1-C6-алкокси, амино (такой как ди(C1-C3 алкил)амино), амидо (такой как -NHC(О)C1-C3-алкил или С(=O)NHC1-C3-алкил), NO2, ОН, галоген, трифторметил или карбоксил. В описанных непосредственно выше вариантах осуществления целесообразно, чтобы R9b означал где W' означает N или СН, r равно 0 или 1, Ra' означает Н, C1-C6-алкил, C0-C3-алкилциклоалкил, C1-C6 алкилокси, гидрокси или амин и Rb' означает Н, галоген, C1-C6-алкил, C0-C3-алкилциклоалкил, C1-C6 алкилокси, C1-C6-тиоалкил, циклоалкил-C0-C3-алкилокси, C1-C3-алкилокси-C1-C3-алкил, C0-C3-алкиларил или C0-C3-алкилгетероциклил. В особенности предпочтительным простым эфирным заместителем является 7-метокси-2-фенилхинолин-4-илокси. Когда W означает связь, то R8 предпочтительно означает замещенную или незамещенную систему-8 012410 гетероциклических колец, описанную в WO 2004/072243 или WO 2004/113665. Характерные примеры R8, когда W означает связь, включают следующие ароматические группы,которые необязательно могут быть замещенными: 1H-пиррол, 1H-имидазол, 1H-пиразол, фуран, тиофен,оксазол, тиазол, изоксазол, изотиазол, пиридин, пиридазин, пиримидин, пиразин, фталазин, хиноксалин,хиназолин, хинолин, циннолин, 1H-пирроло [2,3-b]пиридин, 1H-индол, 1H-бензоимидазол, 1H-индазол,7H-пурин, бензотиазол, бензооксазол, 1H-имидазо[4,5-с]пиридин, 1H-имидазо[4,5-b]пиридин, 1,3 дигидробензоимидазол-2-он, 1,3-дигидробензоимидазол-2-тион, 2,3-дигидро-1H-индол, 1,3-дигидроиндол-2-он, 1H-индол-2,3-дион, 1,3-дигидробензоимидазол-2-он, 1H,1H-пирроло[2,3-е]пиридин, бензофуран, бензо[b]тиофен, бензо[d]изоксазол, бензо[d]изотиазол, 1H-хинолин-2-он, 1H-хинолин-4-он, 1Hхиназолин-4-он, 9H-карбазол, 1H-хиназолин-2-он. Дополнительные характерные примеры R8, когда W означает связь, включают следующие неароматические группы, которые, необязательно, могут быть замещенными: азиридин, азетидин, пирролидин,4,5-дигидро-1 Н-пиразол, пиразолидин, имидазолидин-2-он, имидазолидин-2-тион, пирролидин-2-он,пирролидин-2,5-дион, пиперидин-2,6-дион, пиперидин-2-он, пиперазин-2,6-дион, пиперазин-2-он, пиперазин, морфолин, тиоморфолин-1,1-диоксид, пиразолидин-3-он, имидазолидин-2,4-дион, пиперидин,тетрагидрофуран, тетрагидропиран, [1,4]диоксан, 1,2,3,6-тетрагидропиридин. Предпочтительные значения R8, когда W означает связь, включают тетразол и производные тетразола. Тетразольная составляющая связана с циклическим структурным скелетом Р 2 и, необязательно,является замещенной, как показано ниже-(С=O)-; Q выбирают из группы, включающей группа отсутствует, -CH2- и -NH; Y выбирают из Н, C1C6-алкила, C0-C3-арила, C0-C3-гетероциклила; R1 выбирают из Н, C1-C6-алкила, карбоциклила, C0-C3 арила, C0-C3-гетероциклила. Характерные примеры замещенных тетразолов представлены в табл. 1 WO 2004/072243 и структурами, следующими непосредственно ниже, или в WO 2004/113665. Дополнительные предпочтительные значения R8, когда W означает связь, включают триазол и производные триазола. Триазольная составляющая связана с циклическим структурным скелетом Р 2 и, необязательно, является замещенной, как показано ниже где X и Y независимо выбирают из Н, галогена, C1-C6-алкила, C0-C3-карбоциклила, -СН 2-амино, -СН 2 ариламино, -СН 2-диариламино, -(С=O)-амино, -(С=O)-ариламино, -(С=O)-диариламино, C0-C3-арила, C0C3-гетероциклила или, альтернативно, X и Y вместе с атомами углерода, к которым они присоединены, образуют циклическую группу, выбранную из группы, включающей арил и гетероарил. Характерные примеры замещенных триазолов представлены в табл. 2 WO 2004/072243 и структурами, следующими непосредственно ниже, и в таблицах WO 2004/113365. Дополнительные предпочтительные значения R8, когда W означает связь, включают пиридазинон и производные пиридазинона. Группа пиридазинона связана с циклическим структурным скелетом Р 2 и,необязательно, является замещенной, как показано ниже где X, Y и Z независимо выбирают из группы, включающей Н, N3, галоген, C1-C6-алкил, карбоциклил,амино, C0-C3-арил, -S-арил, -О-арил, -NH-арил, диариламино, дигетероариламино, C0-C3-гетероциклил,-S-гетероарил, -О-гетероарил, NH-гетероарил или, альтернативно, X и Y или Y и Z вместе с атомами углерода, к которым они присоединены, образуют арильную или гетероарильную циклическую группу. Характерные примеры замещенных пиридазинонов представлены в табл. 3 WO 2004/072243 и структурами, следующими непосредственно ниже, и в таблицах WO 2004/113365. Предпочтительными P3 группами, т.е. когда m равно 1, соответствующими природным или синтетическим аминокислотам, в особенности, алифатическим аминокислотам, являются такие, как L-валил,L-лейцил, L-изолейцил или L-трет-лейцил. Дополнительные предпочтительные P3 группы, как указано вWO 02/01898, включают C0-C3-алкилциклоалкилаланин, в особенности, циклогексилаланин, необяза-9 012410 тельно замещенный с помощью CO2Rg, где Rg означает H, C1-C6-алкил, C0-C3-алкиларил, C0-C3 алкилгетероциклил, C0-C3-алкилциклоалкил или амин; либо N-ацетилпиперидин или тетрагидропиран. Предпочтительные R11 группы, таким образом, включают C1-C6-алкил, C0-C3-алкилкарбоциклил, например, C0-C3-алкил-C3-C7-циклоалкилил, C0-C3-алкиларил или C0-C3-алкилгетероарил, каждый из которых необязательно замещен гидрокси, галогеном, амино, C1-C6-алкокси, C1-C6-тиоалкилом, C(=O)OR14, карбоксилом, (C1-C6-алкокси) карбонилом, арилом, гетероарилом или гетероциклилом, в особенности, где заместитель означает гидрокси или C(=O)OR14. В особенности предпочтительный R11 включает трет-бутил, изобутил, циклогексил, фенилэтил, 2,2 диметилпропил, циклогексилметил, фенилметил, 2-пиридилметил, 4-гидроксифенилметил или карбоксилпропил. Наиболее предпочтительными значениями R11 в данном случае являются трет-бутил, изобутил или циклогексил. Вариант осуществления настоящего изобретения включает соединения, где Р 4 отсутствует (т.е. n равно 0) и где в P3 функциональности отсутствует карбонил, т.е. U отсутствует. Характерные примеры структур включают структуры формулы Ii, приведенной ниже:R11' означает C1-C6-алкил, предпочтительно C3-C5-разветвленный алкил, такой как боковые цепи Lвалила, L-лейцила, L-изолейцила, L-трет-лейцила; или C0-C2-алкил-C3-C7-циклоалкил, такой как циклогексил или циклогексилметил;Rba означает C1-C6-алкил, C0-C3-алкилгетероциклил, C0-C3-алкилкарбоциклил. Альтернативно, соединения подструктуры Ii могут образовывать макроцикл, образованный между соответствующим R7 и одним из Rx, Ry или R11'. Характерные варианты осуществления P3 групп, в которых отсутствует карбоксифункциональность(т.е. отсутствует переменная U), включают группы формул Iia-Iid, приведенных ниже где Ar означает карбоциклил или гетероциклил, в особенности арил или гетероарил, каждый из которых необязательно замещен R9. Хотя подструктуры формул Iia-Iid иллюстрируют соединение в рамках формулы I, очевидно, что в таких конфигурациях формул Ii используются также другие значения q и k. Также, хотя в подструктурах формул Iic и Iid указана R группа, соответствующая лейцину, очевидно, что эти конфигурации приемлемы для других R11 групп, в особенности, для групп, совпадающих с боковыми цепями природных или синтетических L-аминокислот, например трет-бутилаланин/трет-лейцин.R15 в тех соединениях по изобретению, где n равно 1, предпочтительно, необязательно замещен C1C6-алкилом или C0-C3-алкилкарбоциклилом, например, C0-C3-алкил-C3-C7-циклоалкилом, каждый из которых необязательно является замещенным. Предпочтительные Р 4 группы в основном являются аналогами природных или синтетических аминокислот, в особенности алифатических аминокислот, такими как L-валил, L-лейцил, L-изолейцил, L-трет-лейцил или L-циклогексилаланин, и, таким образом, предпочтительные R15 группы включают циклогексил, циклогексилметил, трет-бутил, изопропил или изобутил. Предпочтительные значения G включают -NRy-, в особенности, где Ry означает метил или предпочтительно Н или гидразин. Другим предпочтительным значением G является О, дающий сложный эфир с карбонилом группы Р 4 (если присутствует) или с карбонилом группы P3 (если присутствует), либо простой эфир в случае- 10012410 вариантов, когда группа U отсутствует. Общепринятые фармацевтически приемлемые простые эфирные или сложноэфирные блокирующие группы для R16 включают C1-C6-алкил (в особенности, метил или трет-бутил), C0-C3-алкилгетероциклил (в особенности, пиридил, бензимидазолил, пиперидил, морфолинил, пиперазинил) или C0-C3-алкилкарбоциклил (в особенности, фенил, бензил, инданил), каждый из которых необязательно замещен гидрокси, галогеном, амино или C1-C6-алкокси. Очевидно, что для соединений формулы I, когда m=n=0, то R16G- не означает ВОС или CBz защитную группу, но это ограничение не применимо к другим перестановкам значений m и n. Boc- или CBzзащищенные-4-замещенные пролиновые синтетические промежуточные соединения, описанные, например, в WO 0059929, таким образом, выходят за рамки объема изобретения. Предпочтительные соединения по изобретению могут содержать гидразиновую функциональность,например, когда X означает -NHNH- и m равно 1; при этом n равно 0 или 1. Альтернативно, в особенности, когда m равно 0, G может означать -NRjNRj-, такой как -NHNH-. Соединения обычно не содержат гидразин как в G, так и в X. Типичные гидразины в рамках формулы I, где m и n равны 0, включают соединения подструктур Ija-Ijb, приведенных нижеR16 в формулах Ija и Ijb может рассматриваться как алкил (или C1-C3-алкилгетероциклил, или C1-C3 алкилкарбоциклил), где первый алкильный углерод замещен оксогруппой, образуя кетофункциональность, и R16' является остатком алкильной, алкилгетероциклильной или алкилкарбоциклильной группы. Формула Ijb представляет вариант, где R16 означает метиленовую группу, углерод которой замещен оксозаместителем, а также -ORb, где Rb имеет вышеуказанные значения, как правило, C1C6-алкил, такой как трет-бутил, C0-C3-алкилгетероциклил, такой как пиридил, или C0-C3 алкилкарбоциклил, такой как бензил или фенил, каждый из которых необязательно замещен, как указано выше. Соединения подструктур Ija и Ijb могут иметь линейные молекулы, как изображено (оба Rj означают Н), или, предпочтительно, одна из изображенных Rj групп может образовывать макроцикл посредством J, замкнутый на соответствующую R7 группу. Альтернативные гидразины формулы I, где m равно 1, включают гидразины приведенных ниже подструктур Ijc и Ijd: где R16, G, R11, R15, Rj и Ru принимают обозначения, указанные выше для формулы I. Соединения подструктур Ijc и Ijd могут иметь линейные молекулы, как изображено (оба Rj означают Н), или предпочтительно одна из изображенных Rj групп, или R11 группа может образовывать макроцикл посредством J,замкнутый на соответствующую R7 группу. Хотя формулы Ija-Ijd изображены с пролиновым аналогом в качестве Р 2, очевидно, что этот аспект изобретения равно применим к другим вариантам компоновок q и k. Альтернативная гидразинподобная конфигурация образуется, когда G означает амино, m и n равны 0 и R16 означает N-связанный ненасыщенный гетероцикл, как показано ниже, например, пиридил или пиримидил, или насыщенный гетероцикл, как показано ниже, такой как пиперазинил, пиперидинил и, в особенности, морфолинил. Примеры таких вариантов осуществления включают соединения формулы Ije Соединения подструктур Ije могут иметь линейные молекулы, как изображено, или, предпочтительно, Rx группа может образовывать макроцикл посредством J, замкнутый на соответствующую R7 группу. Хотя эти подструктуры изображены с пятичленным циклом Р 2, совершенно очевидно, что эта конфигурация распространяется на другие значения q и k. Подобным образом эти конфигурации применимы к другим N-связанным гетероциклам, таким как R16. Возвращаясь теперь к формуле I в общем случае, предпочтительные R16 группы для соединений по- 11012410 изобретению включают 2-инданол, инданил, 2-гидрокси-1-фенилэтил, 2-тиофенметил, циклогексилметил, 2,3-метилендиоксибензил, циклогексил, фенил, бензил, 2-пиридилметил, циклобутил, изобутил, нпропил, метил или 4-метоксифенилэтил. В этом случае предпочтительные R16 группы включают 2-инданол, индан, 2-гидрокси-1-фенилэтил,2-тиофенметил, 2,3-метилендиоксибензил или циклогексилметил. Синтетические аминокислоты включают L-аминокислоты, где боковая цепь не соответствует ни одной из 20 встречающихся в природе аминокислот. Примеры синтетических аминокислот включают Lбета-метилсульфонилметилаланин, L-циклогексилаланин, L-третичный лейцин, L-норлейцин, Lнорвалин, L-орнитин, L-саркозин, L-цитурлин, L-гомофенилаланин, L-гомосерин, L-бета-(1 нафтил)аланин, L-бета-(2-нафтил)аланин и т.д. Синтетические аминокислоты также включают Dаминокислоты, соответствующие 20 природным аминокислотам и D-аминокислоты, содержащие другие боковые цепи такие, как указаны выше. Подразумевается, что C1-C6-алкил (также обозначаемый C1-C6-алк или используемый в сложных выражениях, таких как C1-C6-алкилокси и пр.), как использовано здесь, включает линейные и разветвленные алифатические углеродные цепи, такие как метил, этил, н-пропил, изопропил, н-бутил, изобутил,трет-бутил, пентил, изопентил, гексил и любые простые соответствующие изомеры. Кроме того, любой С атом в C1-C6-алкиле, необязательно, может быть замещен одним, двумя или, где валентность позволяет,тремя галогенами. Значение алкила в C1-C4-алкиле и C1-C5-алкиле соответствует его значению в C1-C6-алкиле, данному выше, с необходимой поправкой на число углеродов.C1-C3-алкил, как использовано здесь, включает метил, этил, пропил, изопропил, циклопропил, каждый из которых, необязательно, может быть замещенным или может прерываться гетероатомом, как указано в предыдущем абзаце, либо в случае С 2 или C3, содержать ненасыщенную связь, такую как CH2=СН.C1-C3-алкилен, как использовано здесь, означает двухвалентную группу C1-C3-алкилдиил, включающую пропилен, этилен и, в особенности, метилен. Обычно более длинные алкиленовые цепи для J могут содержать 1-3 ненасыщенности и/или прерываться вышеуказанными гетероатомами. Амино включает NH2, NHC1-C6-алкил или N(C1-C6-алкил)2, в особенности, C1-C3-алкильные варианты. Амидо включает C(=O)NH2 и алкиламидо, такой как C(=O)NHC1-C6-алкил, С(=O)N(C1-C6-алкил)2, в особенности С(=O)NHC1-C3-алкил, С(=O)N(C1-C3-алкил)2 или -NH(С=O)C1-C6-алкил, например-NHC(=O)CHC(CH3)3, включая -NH(С=O)C1-C3-алкил. Подразумевается, что галоген, как использовано здесь, включает F, Cl, Br, I, в особенности хлор и предпочтительно фтор. Подразумевается, что C0-C3-алкиларил, как использовано здесь, включает арильную составляющую,такую как фенил, нафтил или фенил, конденсированную с C3-C7-циклоалкилом (например, инданил),указанный арил связан непосредственно (т.е. С 0) или через промежуточную метильную, этильную или пропильную группу, как указано выше для C1-C3-алкилена. Если не оговорено особо, арильная и/или конденсированная циклоалкильная составляющая необязательно замещены 1-3 заместителями, выбранными из галогена, гидрокси, нитро, циано, карбокси, C1-C6-алкила, C1-C6-алкокси, C1-C6-алкокси-C1-C6 алкила, C1-C6-алканоила, амино, азидо, оксо, меркапто, нитро C0-C3-алкилкарбоциклила, C0-C3 алкилгетероциклила. Арил имеет соответствующее значение, т.е. случай, когда C0-C3-алкильный мостик отсутствует. Подразумевается, что C0-C3-алкил-C3-C7-циклоалкил, как использовано здесь, включает C3-C7 циклоалкильную группу, такую как циклопропил, циклобутил, циклопентил, циклогексил или циклогептил, указанный циклоалкил связан непосредственно (т.е. C0-алкил) или через промежуточную метильную, этильную, пропильную или изопропильную группу, как указано выше для C1-C3-алкилена, циклоалкильная группа может содержать ненасыщенную связь. Если не оговорено особо, циклоалкильная составляющая, необязательно, замещена 1-3 заместителями, выбранными из галогена, гидрокси, нитро,циано, карбокси, C1-C6-алкила, C1-C6-алкокси, C1-C6-алкокси-C1-C6-алкила, C1-C6-алканоила, амино, азидо, оксо, меркапто, нитро C0-C3-алкилкарбоциклила, C0-C3-алкилгетероциклила. Подразумевается, что C0-C3-алкилкарбоциклил, как использовано здесь, включает C0-C3-алкиларил и C0-C3-алкил-C3-C7-циклоалкил. Если не оговорено особо, арильная или циклоалкильная группа, необязательно, замещена 1-3 заместителями, выбранными из галогена, гидрокси, нитро, циано, карбокси, C1C6-алкила, C1-C6-алкокси, C1-C6-алкокси-C1-C6-алкила, C1-C6-алканоила, амино, азидо, оксо, меркапто,нитро C0-C3-алкилкарбоциклила и/или C0-C3-алкилгетероциклила. Карбоциклил имеет соответствующее значение, т.е. случай, когда C0-C3-алкильный мостик отсутствует. Подразумевается, что C0-C3-алкилгетероциклил, как использовано здесь, включает моноциклический, насыщенный или ненасыщенный, содержащий гетероатом цикл, такой как пиперидинил, морфолинил, пиперазинил, пиразолил, имидазолил, оксазолил, изоксазолил, тиазинолил, изотиазинолил, тиазолил, оксадиазолил, 1,2,3-триазолил, 1,2,4-триазолил, тетразолил, фуранил, тиенил, пиридил, пиримидил,пиридазинил, пиразолил, или каждую их этих групп, конденсированную с фенильным циклом, такую как хинолинил, бензимидазолил, бензоксазолил, бензизоксазолил, бензотиазинолил, бензизотиазинолил, бен- 12012410 зотиазолил, бензоксадиазолил, бензо-1,2,3-триазолил, бензо-1,2,4-триазолил, бензотетразолил, бензофуранил, бензотиенил, бензопиридил, бензопиримидил, бензопиридазинил, бензопиразолил и т.д., указанный цикл связан непосредственно, т.е. (С 0) или через промежуточную метильную, этильную, пропильную или изопропильную группу, как указано выше для C1-C3-алкилена. Любые такие ненасыщенные циклы, имеющие ароматический характер, могут носить здесь название гетероарил. Если не оговорено особо, гетероцикл и/или соответствующая конденсированная фенильная составляющая, необязательно,замещены 1-3 заместителями, выбранными из галогена, гидрокси, нитро, циано, карбокси, C1-C6-алкила,C1-C6-алкокси, C1-C6-алкокси-C1-C6-алкила, C1-C6-алканоила, амино, азидо, оксо, меркапто, нитро C0-C3 алкилкарбоциклила, C0-C3-алкилгетероциклила. Гетероциклил и гетероарил имеют соответствующее значение, т.е. случай, когда C0-C3-алкильный мостик отсутствует. Таким образом, обычно гетероциклильная и карбоциклильная составляющие в рамках объема вышеуказанных определений означают моноциклическое кольцо с 5 или, в особенности, 6 кольцевыми атомами, или бициклическую структуру колец, содержащую 6-членный цикл, конденсированный с 4-, 5 или 6-членным циклом. Типичные указанные группы включают C3-C8-циклоалкил, фенил, бензил, тетрагидронафтил, инденил, инданил, гетероциклил, такой как азепанил, азоканил, пирролидинил, пиперидинил, морфолинил,тиоморфолинил, пиперазинил, индолинил, пиранил, тетрагидропиранил, тетрагидротиопиранил, тиопиранил, фуранил, тетрагидрофуранил, тиенил, пирролил, оксазолил, изоксазолил, тиазолил, имидазолил,пиридинил, пиримидинил, пиразинил, пиридазинил, тетразолил, пиразолил, индолил, бензофуранил, бензотиенил, бензимидазолил, бензтиазолил, бензоксазолил, бензизоксазолил, хинолинил, тетрагидрохинолинил, изохинолинил, тетрагидроизохинолинил, хиназолинил, тетрагидрохиназолинил и хиноксалинил,каждый из которых необязательно замещен, как здесь указано. Насыщенная гетероциклическая составляющая, таким образом, включает радикалы, такие как пирролинил, пирролидинил, пиразолинил, пиразолидинил, пиперидинил, морфолинил, тиоморфолинил, пиранил, тиопиранил, пиперазинил, индолинил, азетидинил, тетрагидропиранил, тетрагидротиопиранил,тетрагидрофуранил, гексагидропиримидинил, гексагидропиридазинил, 1,4,5,6-тетрагидропиримидиниламин, дигидрооксазолил, 1,2-тиазинанил-1,1-диоксид, 1,2,6-тиадиазинанил-1,1-диоксид, изотиазолидинил-1,1-диоксид и имидазолидинил-2,4-дион, тогда как ненасыщенный гетероцикл включает радикалы ароматического характера, такие как фуранил, тиенил, пирролил, оксазолил, тиазолил, имидазолил, пиразолил, изоксазолил, изотиазолил, оксадиазолил, триазолил, тетразолил, тиадиазолил, пиридинил, пиридазинил, пиримидинил, пиразинил, индолизинил, индолил, изоиндолил. В каждом случае гетероцикл может быть конденсирован с фенильным циклом, образуя бициклическую систему колец. Синтез. Синтез соединений по настоящему изобретению может быть выполнен различными химическими способами, в растворе или твердой фазе, либо комбинацией указанных приемов. Сначала могут быть получены соответственно защищенные отдельные структурные блоки и впоследствии соединены вместе,т.е. Р 2+Р 1 Р 2-Р 1. Альтернативно, предшественники структурных блоков могут быть соединены вместе и модифицированы на более поздней стадии синтеза ингибиторной последовательности. Далее, структурные блоки, предшественники структурных блоков или заранее полученные более крупные фрагменты требуемой структуры могут быть соединены в растущую цепь, например, R16-G-P3+E-P2-P1R16-G-P3P2-P1 или R16-G-P4-P3+E-P2-P1R16-G-P4-P3-Е-Р 2-Р 1. Связывание двух аминокислот, аминокислоты и пептида или двух пептидных фрагментов может быть выполнено с применением стандартных методов связывания, таких как азидный метод, смешанный метод на основе углекислого газа-ангидрида карбоновой кислоты (изобутилхлорформиат), карбодиимидный метод (дициклогексилкарбодиимид, диизопропилкарбодиимид или водорастворимый карбодиимид), метод активного сложного эфира (п-нитрофениловый сложный эфир, сложный имидоэфир Nгидроксиянтарной кислоты), метод реагента Woodward K., карбонилдиимидазольный метод, методы фосфорных реагентов или окисления-восстановления. Некоторые из этих методов (в особенности, карбодиимидный метод) могут быть усилены добавлением 1-гидроксибензотриазола или 4-DMAP. Эти реакции связывания могут быть выполнены либо в растворе (жидкая фаза), либо в твердой фазе. Точнее, стадия связывания включает дегидративное связывание свободного карбоксила одного из реагентов со свободной аминогруппой другого реагента в присутствии связывающего агента с образованием сшивающей амидной связи. Описание таких связывающих агентов может быть найдено в общих руководствах по химии пептидов, например, в М. Bodanszky, "Peptide Chemistry", 2nd rev ed., SpringerVerlag, Berlin, Germany (1993), здесь далее упоминаемом как Bodanszky, содержание которого включено в качестве ссылки. Примерами подходящих связывающих агентов являютсяN,N'дициклогексилкарбодиимид, 1-гидроксибензотриазол в присутствии N,N'-дициклогексилкарбодиимида или N-этил-N'-[(3-диметиламино)пропил]карбодиимида. Практичным и полезным связывающим агентом является промышленно выпускаемый(бензотриазол-1-илокси)-трис-(диметиламино)фосфонийгексафторфосфат, либо сам по себе, либо в присутствии 1-гидроксибензотриазола или 4-DMAP. Другим целесообразным и полезным связывающим агентом является промышленно выпускаемый 2-(1 Н- 13012410 бензотриазол-1-ил)-N,N,N',N'-тетраметилуронийтетрафторборат. Еще одним целесообразным и полезным связывающим агентом является промышленно выпускаемый О-(7-азабензотриазол-1-ил)-N,N,N',N'тетраметилуронийгексафторфосфат. Реакцию связывания осуществляют в инертном растворителе, например, дихлорметане, ацетонитриле или диметилформамиде. Избыток третичного амина, например, диизопропилэтиламина, Nметилморфолина, N-метилпирролидина или 4-DMAP добавляют к реакционной смеси при pH около 8. Реакционная температура обычно изменяется в пределах от 0 до 50 С и реакционное время, как правило,составляет от 15 мин до 24 ч. Функциональные группы составляющей аминокислоты обычно должны быть защищены во время реакций связывания для предупреждения образования нежелательных химических связей. Защитные группы, которые могут быть использованы, перечислены в Greene, "Protective Groups in Organic Chemistry", John WileySons, New York (1981) и "The Peptides: Analysis, Synthesis, Biology", Vol. 3, AcademicPress, New York (1981), далее упоминаемых просто как Greene, содержание которых включено здесь в качестве ссылок. -Карбоксильную группу С-концевого остатка обычно защищают сложным эфиром,который может быть отщеплен с образованием карбоновой кислоты. Защитные группы, которые могут быть использованы, включают: 1) алкиловые сложные эфиры, такие как метиловый, триметилсилиловый и трет-бутиловый, 2) аралкиловые сложные эфиры, такие как бензиловый и замещенный бензиловый,или 3) сложные эфиры, которые могут быть отщеплены слабым основанием или слабыми восстанавливающими средствами, такими как трихлорэтиловый и фенациловый сложные эфиры.-Аминогруппу каждой связываемой аминокислоты обычно защищают. Может быть использована любая известная из уровня техники защитная группа. Примеры таких групп включают: 1) ацильные группы, такие как формил, трифторацетил, фталил и п-толуолсульфонил; 2) ароматические карбаматные группы, такие как бензилоксикарбонил (Cbz или Z) и замещенные бензилоксикарбонилы и 9 флуоренилметилоксикарбонил (Fmoc); 3) алифатические карбаматные группы, такие как третбутилоксикарбонил (Boc), этоксикарбонил, диизопропилметоксикарбонил и аллилоксикарбонил; 4) циклические алкильные карбаматные группы, такие как циклопентилоксикарбонил и адамантилоксикарбонил; 5) алкильные группы, такие как трифенилметил и бензил; 6) триалкилсилильные группы, такие как триметилсилил; и 7) тиолсодержащие группы, такие как фенилтиокарбонил и дитиасукциноил. Предпочтительной -аминозащитной группой является Boc или Fmoc. Многие производные аминокислот, соответственно защищенные для пептидного синтеза, выпускаются промышленно.-Аминозащитную группу отщепляют перед последующей стадией связывания. Когда используют Вос-группу, возможно применение на выбор трифторуксусной кислоты, чистой или в дихлорметане, илиHCl в диоксане или в этилацетате. Образующуюся аммониевую соль затем нейтрализуют перед связыванием или на месте с помощью основных растворов, таких как водные буферные растворы или третичные амины в дихлорметане или ацетонитриле, или диметилформамиде. Когда используют Fmoc-группу, реагенты выбирают из пиперидина или замещенного пиперидина в диметилформамиде, но может быть использован любой вторичный амин. Снятие защиты осуществляют при температуре от 0 С до комнатной температуры, обычно при 20-22 С. Любые природные или синтетические аминокислоты с функциональностями в боковой цепи обычно защищают путем получения пептида с использованием любой из вышеуказанных групп. Для специалиста в данной области очевидно, что выбор и применение соответствующих защитных групп для этих функциональностей боковой цепи зависит от аминокислоты и присутствия других защитных групп в пептиде. При выборе таких защитных групп желательно, чтобы группа не удалялась во время снятия защиты и связывания -аминогруппы. Например, когда Boc используют в качестве -аминозащитной группы, целесообразны следующие защитные группы для боковых цепей: п-толуолсульфонил-(тозил) группы могут быть использованы для защиты аминобоковой цепи аминокислоты, такой как Lys и Arg; ацетамидометил-, бензил- (Bn) или третбутилсульфонилгруппы могут быть использованы для защиты сульфидсодержащей боковой цепи цистеина; простые бензиловые (Bn) эфиры могут быть использованы для защиты гидроксисодержащих боковых цепей серина, треонина или гидроксипролина; и сложные бензиловые эфиры могут быть использованы для защиты карбоксисодержащих боковых цепей аспарагиновой кислоты и глутаминовой кислоты. Когда Fmoc выбирают для защиты -амина, обычно приемлемы защитные группы на основе третбутила. Так, например, Boc может быть использован для лизина и аргинина, простой трет-бутиловый эфир - для серина, треонина и гидроксипролина и сложный трет-бутиловый эфир - для аспарагиновой кислоты и глутаминовой кислоты. Трифенилметил-(тритил) группа может быть использована для защиты сульфидсодержащей боковой цепи цистеина. Как только ингибиторная последовательность завершена, все защитные группы удаляют любым способом в зависимости от выбора защитных групп. Эти методики хорошо известны специалисту в данной области. В соединениях формулы I звено Р 2 включает азотсодержащий циклический остаток, замещенныйR8 группа может быть связана с Р 2 структурным скелетом на любой подходящей стадии синтеза соединений по настоящему изобретению. Один из способов состоит в первоначальном связывании R8 группы с Р 2 структурным скелетом и последующем присоединении других требуемых структурных блоков, например, Р 1 и, необязательно, P3 и Р 4. Другой способ состоит в связывании Р 1 и, если присутствует, P3 и Р 4 с применением незамещенного Р 2 структурного скелета и последующем присоединении R8 группы. Соединения, где W означает О и R8 означает алкил, C0-C3-алкилкарбоциклил, C0-C3 алкилгетероциклил, могут быть получены по методике, описанной в Е. М. Smith et al. (J. Med. Chem.(1988), 31, 875-885), как представлено на схеме 1, иллюстрирующей способ для группы, где q и k равны 1. Схема 1 Промышленно выпускаемый Вос-4-(R)-гидроксипролин, или любой подходящий гидроксизамещенный пролиновый аналог, такой как гидроксипиперидоиновая кислота, обрабатывают основанием,таким как гидрид натрия или трет-бутилат калия, в растворителе, таком как диметилформамид, и образовавшийся алкоксид подвергают взаимодействию с алкилирующим агентом, R8-X, где X означает подходящую уходящую группу, такую как галогенид, мезилат, трифлат или тозилат или т.п., получая требуемое замещенное производное пролина. Альтернативно, когда W означает О или S и R8 означает карбоциклил, такой как фенил, или гетероциклилил, такой как гетероарил, Р 2 структурные блоки могут также быть получены по реакции Mitsunobu (Mitsunobu, 1981, Synthesis, January, 1-28; Rano et al., Tetrahedron Lett., 1995, 36, 22, 3779-3792;Krchnak et al., Tetrahedron Lett., 1995, 36, 5, 6193-6196; Richter et al., Tetrahedron Lett., 1994, 35, 27, 47054706), как показано на схеме 2, иллюстрирующей способ для группы, где q и k равны 1. Схема 2 Обработка соответственно гидроксизамещенного пролинового аналога, такого как гидроксипиперидоиновая кислота, здесь представленного промышленно выпускаемым метиловым эфиром Вос-4 гидроксипролина, требуемым спиртом или тиолом (R8-WH) в присутствии трифенилфосфина и активирующего агента, такого как диэтилазодикарбоксилат (DEAD), диизопропилазодикарбоксилат (DIAD) или т.п., дает сложноэфирное соединение (2b). Гидролизация сложного эфира до кислоты, осуществляемая по стандартным методикам, дает Р 2 структурный блок (2 с). Спирт (2 а), альтернативно, может быть обработан фосгеном, что приводит, таким образом, к получению соответствующего хлорформиата, который при взаимодействии с амином, R8NH2, в присутствии основания, такого как гидрокарбонат натрия или триэтиламин, дает карбаматы, т.е. W означает-OC(=O)NH-, тогда как взаимодействие спирта (2 а) с ацилирующим агентом, R8-CO-X, таким как ангидрид уксусной кислоты или галогенид уксусной кислоты, например, хлорангидрид, дает сложный эфир,т.е. W означает -ОС(=O)-. Различные спирты R8-OH и алкилирующие агенты R8-X описаны в WO 00/09543 и WO 00/59929. Пример синтеза, когда R8 означает замещенное хинолиновое производное, представлен на схеме 3. Ацилирование по Фриделю-Крафтсу соответственно замещенного анилина (3a), выпускаемого промышленно либо описанного в литературе, с применением ацилирующего агента, такого как ацетилхлорид или т.п., в присутствии трихлорида бора и трихлорида алюминия, в растворителе, таком как дихлорметан, дает (3b). Связывание (3b) и гетероциклической карбоновой кислоты (3c) в основных условиях,таких как в пиридине, в присутствии активирующего агента для карбоксилатной группы, например,POCl3, с последующим замыканием цикла и дегидратацией в основных условиях, таких как трет-бутилат калия в трет-бутаноле, приводит к образованию хинолинового производного (3 е). Хинолиновое производное (3 е) может быть связано по реакции Mitsunobu со спиртом, как указано выше, либо гидроксигруппа может быть замещена подходящей уходящей группой, такой как галогенид, как, например, хлорид, бромид или иодид, путем обработки хинолина (3 е) соответствующим галогенирующим агентом,например, фосфорилхлоридом или т.п. Различные карбоновые кислоты общей структуры (3c) могут быть использованы для схемы 3. Эти кислоты выпускаются промышленно или описаны в литературе. Пример получения 2-(замещенных)аминокарбоксиаминотиазолпроизводных, по методике Berdikhina et al. Chem. Heterocycl. Compd. (Engl. Тиомочевина (4 с) с различными алкильными заместителями R' может быть получена при взаимодействии соответствующего амина (4 а) с трет-бутилизотиоцианатом в присутствии основания, такого как диизопропилэтиламин, в растворителе, таком как дихлорметан, с последующим удалением третбутиловой группы в кислотных условиях. Последующая конденсация производного тиомочевины (4 с) с 3-бромпировиноградной кислотой дает кислоту (4d). Р 2 структурные блоки, где R8 заместитель присоединен через амин, амид, мочевину или сульфонамид, могут быть получены из аналогов аминопролина, полученных либо из подходящего промышленно выпускаемого аминопролинового и прочего производного, либо путем превращения гидроксигруппы соответствующего гидроксипроизводного в азидную группу, например, путем превращения гидроксигруппы в подходящую уходящую группу, такую как мезилат или галоген, например, хлорид, с последующим замещением уходящей группы азидом или путем применения азидпереносящего агента, такого как дифенилфосфорилазид (DPPA). Восстановление азида путем каталитического гидрирования или любым другим подходящим для восстановления способом дает амин. Аминопроизводное может быть подвергнуто взаимодействию по реакции замещения с алкилирующим агентом общей формулы R8-X, где R8 и X имеют указанные для схемы 1 значения, с образованием Р 2 структурных блоков, предназначенных для получения соединений общей формулы I, где W означает -NH-. Взаимодействие аминопролинового аналога с кислотой общей формулы R8-COOH в стандартных условиях амидного связывания дает соединения, где R8 заместитель связан через амидную связь, тогда как взаимодействие аминопролинового аналога с соответствующим производным сульфоновой кислоты, R8-S(O)2-X, где X означает уходящую группу, например, хлорид, в присутствии основания, дает сульфонамиды. Соединения, где связь между циклическим структурным скелетом и R8 заместителем образована группой мочевины, могут, например,быть получены обработкой аминопролинового аналога фосгеном, что дает соответствующий хлоркарбамат, и последующим осуществлением взаимодействия с требуемым амином. Альтернативно, аминопролиновый аналог может быть подвергнут взаимодействию с карбамоилхлоридом или изоцианатом требуемого R8 заместителя для образования группировки мочевины. Очевидно, что соответствующие взаимодействия приемлемы для Р 2 групп с другими размерами циклов и схемой замещения. 4-Замещенные гетероциклильные производные, такие как 4-замещенный пролин, для применения в качестве Р 2 структурных блоков, где W означает -СН 2-, могут быть получены, как показано на схеме 5,иллюстрирующей способ для группы, где q и k равны 1, согласно методикам, описанным J. Ezquerra et Обработка пирролидона или пиперидинона с соответственно защищенной кислотной группой, такого как промышленно выпускаемая Вос-пироглутаминовая кислота (5 а), с помощью сильного основания, такого как литийдиизопропиламид, в растворителе, таком как тетрагидрофуран, с последующим добавлением алкилирующего агента R8-CH2-X, где X означает соответствующую уходящую группу, такую как галогенид, такой как хлорид или бромид, последующее восстановление амида и снятие защитной сложноэфирной группы дают требуемое соединение (5d). Соединения по настоящему изобретению, где гетероциклическая R8 группа непосредственно соединена с циклическим Р 2 структурным скелетом, т.е. W означает связь в общей формуле I, могут быть получены, например, использованием реакции замещения, где соответствующая уходящая группа на Р 2 структурном скелете замещается требуемой R8 группой, такой как гетероциклическая группа. Альтернативно, R8 группа может быть введена по реакции Mitsunobu, где гидроксигруппа Р 2 структурного скелета взаимодействует с атомом азота в гетероциклической R8 группе. Соединения, где тетразольное производное присоединено через атом углерода гетероциклического кольца, целесообразно получать, наращивая тетразольную группу непосредственно на предшественник Р 2. Это может быть достигнуто, например, превращением гидроксигруппы предшественника Р 2 в цианогруппу, при последующем осуществлении взаимодействия с азидным реагентом, таким как азид натрия. Триазольные производные могут также быть созданы непосредственно на предшественнике Р 2, например, превращением гидроксигруппы предшественника Р 2 в азидную группу, с последующим осуществлением реакции циклоприсоединения 3+2 между вышеупомянутым азидом и соответствующим алкиновым производным. Структурно разнообразные тетразолы для применения в вышеописанном замещении или реакцияхMitsunobu могут быть получены при взаимодействии промышленно выпускаемых нитриловых соединений с азидом натрия. Триазольные производные могут быть получены при взаимодействии алкинового соединения и триметилсилилазида. Пригодные алкиновые соединения либо являются коммерчески доступными, либо могут быть получены, например, по реакции Sonogashira, т.е. при взаимодействии первичного алкина, арилгалогенида и триэтиламина в присутствии PdCl2(PPh)3 и CuI, как описано, например, в A. Elangovan, Y.-H. Wang, T.-I. Но, Org. Lett., 2003, 5, 1841-1844. Гетероциклический заместитель может также быть модифицирован, будучи связанным с Р 2 структурным блоком, либо до, либо после связывания Р 2 структурного блока с другими структурными блоками. Эти способы и другие альтернативные возможности получения соединений, где W означает связь иR8 означает необязательно замещенный гетероцикл, подробно описаны в WO 2004/072243. Соединения с альтернативным размером цикла и/или положением заместителя W-R8 на пролиновых производных, отвечающие схемам 1, 2 и 5, могут также быть использованы для получения соединений по настоящему изобретению. Например, алкилирование промышленно выпускаемого 3-гидроксипролина дает соединения общей формулы I, где k означает 0 и q равно 2. Соответственно, алкилирование 5 гидроксипролина, полученного, например, как описано в Hallberg et al., J. Med. Chem. (1999), 4524-4537,дает соединения общей формулы I, где k равно 2 и q равно 0. Различные способы получения гидроксилированной 2-пиперидинкарбоновой кислоты описаны в литературе, см., например, Celestini et al., Org. Lett. (2002), 1367-1370, Hoarau et al., Tetrahedron: Asymmetry (1996), 2585-2594, Zhu et al., Tetrahedron Lett., 41 (2000), 7033-7036. Например, соответствующие пиридинкарбоновые кислоты могут быть восстановлены, что дает гидроксилированные 2 пиперидинкарбоновые кислоты. Ферментативные способы также могут быть использованы для получения гидроксилированных пролиновых аналогов. Например, 3-гидроксизаместитель может быть введен в промышленно выпускаемые 4-, 5- и 6-членные гетероциклические кислоты путем применения пролин-3 гидроксилазы, как описано в Ozaki et al., Tet. Letters, 40 (1999), 5227-5230. Синтез и введение Р 1 структурных блоков. Аминокислоты, используемые для получения Р 1 фрагментов, являются либо коммерчески доступными, либо описанными в литературе, см., например, WO 00/09543 и WO 00/59929 от Boehringer- 17012410Ingelheim или US 2004/0048802 от BMS. Схема 6 приводит пример получения сульфонамидного производного, используемого в качестве Р 1 фрагмента, и последующего связывания с Boc-защищенным Р 2 структурным блоком. Схема 6 Сульфонамидная группа может быть введена в соответственно защищенную аминокислоту (6 а) путем обработки аминокислоты связывающим агентом, например, N,N'-карбонилдиимидазолом (CDI) или т.п., в растворителе, таком как ТГФ, с последующим осуществлением взаимодействия с требуемым сульфонамидом (6b) в присутствии сильного основания, такого как 1,8-диазабицикло[5.4.0]ундец-7-ен(DBU). Альтернативно, аминокислота может быть обработана требуемым сульфонамидом (6b) в присутствии основания, такого как диизопропилэтиламин, с последующей обработкой связывающим агентом,таким как РуВОР, для осуществления введения сульфонамидной группы. Удаление аминозащитной группы стандартными способами и последующее связывание с Р 2 структурным блоком, полученным,как описано выше, с применением стандартных методов образования амидной связи, таких как осуществление взаимодействия со связывающим агентом, таким как О-(7-азабензотриазол-1-ил)-N,N,N',N'тетраметилуронийгексафторфосфат (HATU), в присутствии основания, такого как диизопропиламин, в растворителе, таком как диметилформамид, дает Boc-защищенное Р 2-Р 1 соединение (6e). Альтернативно, сульфонамидная группа может быть введена на более поздней стадии синтеза, например, на последней стадии. В этом случае аминокислоту с обращенной схемой защиты, т.е. содержащую незащищенную аминофункциональность и защищенную кислотную функциональность, связывают по кислотной функциональности Р 2 структурного блока, используя стандартные условия пептидного связывания, например,описанные выше. Удаление кислотной защитной группы с применением соответствующих условий для снятия используемой защитной группы и последующее связывание сульфонамида, как описано выше,дают соединение 6e. Р 1 структурные блоки для получения соединений общей формулы I, где А означает сложный эфир или амид, могут быть получены осуществлением взаимодействия аминокислоты (6 а) с подходящим амином или спиртом, соответственно, в стандартных условиях образования амида или сложного эфира. Соединения общей формулы I, где А означает CR4R4', могут быть получены путем связывания соответствующего P1 структурного блока с Р 2 структурным блоком, как описано в Oscarsson et al. Bioorg. Med.Chem. 2003, 11 (13), 2955-2963 и РСТ/ЕР 03/10595, поданном 23.09.2003, содержание которых включено здесь в качестве ссылки. Соединения, содержащие азапептидный Р 1 остаток, т.е. где в общей формуле I Q означает NRu, могут быть получены использованием подходящего Р 1 азааминоацильного компонента для связывания с Р 2 фрагментом. Получение азааминоацильных групп описано М. D. Bailey et al. в J. Med. Chem., 47 (2004),3788-3799, и пример иллюстрируется схемой 6 А. Введение соответствующей N-связанной боковой цепи, Ru, в промышленно выпускаемый третбутилгидразин может быть выполнено, например, по реакции восстановительного аминирования с подходящим альдегидом или кетоном, как приведено на схеме 19 ниже, что дает N-алкилированный карбазат (6 Аа). Конденсация 6 Аа с требуемым хлорформиатом в присутствии основания, такого как триэтиламин или диизопропилэтиламин, в растворителе, таком как ТГФ, дает 6Ab. Группа R1' может быть затем,необязательно, удалена с применением соответствующих условий, зависящих от конкретного R1', таких как каталитическое гидрирование для R1', означающего бензил, что дает соответствующие кислоты. Последующее взаимодействие полученной кислоты с требуемым сульфонамидным производным, как представлено схемой 6, дает сульфонамид блокированные структурные блоки. Альтернативно, взаимодействие карбазата 6 Аа с изоцианатом, R3-N=C=O, дает структурные блоки для получения соединений общей формулы I, где М означает NRu и А означает CONHR3. Р 2 и P3 составляющие могут быть соединены вместе перед или после введения Р 1 структурного блока. Синтез блокированных P3 и P3-Р 4 структурных блоков. Структурные блоки R16-G-P3 и R16-G-P4-P3 могут быть получены, как в общих чертах представлено схемой 7. Схема 7 Подходящая N-защищенная аминокислота (7 а) может быть связана с аминоблокирующей группой(R16-NHRy) с использованием стандартных условий пептидного связывания, таких как применение связывающих агентов, таких как HATU, DCC, HOBt или т.п., в присутствии основания, такого как DIEA илиDMAP, в растворителе, таком как дихлорметан, хлороформ или диметилформамид или смеси указанных растворителей, и использование условий, подобных условиям образования сложных эфиров, что дает амиды, т.е. G означает NHRy (7b). Альтернативно, взаимодействие аминокислоты (7 а) с соединением общей формулы R16-X, где R16 принимает вышеуказанные значения и X означает уходящую группу, такую как галогенид, в присутствии основания, такого как карбонат цезия или оксид серебра (I), дает сложные эфиры, т.е. G означает О (7b). С другой стороны, аминокислота (7 а) может быть связана со второй, соответственно O-защищенной, аминокислотой (7d) с применением вышеуказанных стандартных условий пептидного связывания, что дает (7 е). Замещение сложноэфирной группы подходящей блокирующей группой (7b) дает фрагмент (7f), полезный для получения соединений по настоящему изобретению, где m и n равны 1. Когда G означает N-Ry, блокированный P3 или Р 2 структурный блок может также быть получен на твердом носителе, как иллюстрируется схемой 8. Соответственно N-защищенная, например, Вос-защищенная, аминокислота (8 а) может быть иммобилизована на твердом носителе, примером которого здесь является полимер PS-TFP Agronaut, взаимодействием аминокислоты с требуемым твердым носителем в присутствии реагента связывания, такого как N,N'-диизопропилкарбодиимид, и основания, такого как DMAP, в растворителе, таком как дихлорметан и диметилформамид. Иммобилизованная аминокислота может затем быть отщеплена от носителя с помощью подходящей блокирующей группы (8 с), что таким образом дает фрагменты, полезные для получения соединений по настоящему изобретению, где m или n равно 1. Необязательно, аминозащитная группа может быть удалена после связывания соответствующей аминокислоты с применением стандартных методик, что, таким образом, обеспечивает фрагменты, полезные для получения соединений по настоящему изобретению, где m и n равны 1. Связывание блокирующей группы или блокированного структурного блока с конструкцией Р 2-Р 1.R16-G, R16-G-P3 или R16-G-P4-P3 структурный блок, связанный через функциональность мочевины с Р 2-Р 1 конструкцией, может быть введен, как представлено на схеме 9, иллюстрирующей способ для случая, когда Р 2 структурный скелет означает 5-членный цикл. Схема 9 Хлоркарбаматная группа может быть создана на циклическом амине Р 2-Р 1 конструкции (9 а) путем удаления аминозащитной группы по стандартным методикам, таким как кислотная обработка с помощью, например, TFA в дихлорметане или т.п., в случае использования Вос-группы, с последующим взаимодействием свободного амина с фосгеном в толуоле в присутствии основания, такого как гидрокарбонат натрия или триэтиламин, в растворителе, таком как тетрагидрофуран. Последующее взаимодействие образовавшегося электрофильного центра с аминогруппой, принадлежащей R15-NH2, R16-NHNH2, R16-G-P3 или R16-G-P4-P3 структурному блоку (9 с), в растворителе, таком как дихлорметан, в присутствии основания, такого как гидрокарбонат натрия, дает (9d). Соединения общей формулы I, где Е означает C=S, S(=O) или S(=O)2, могут быть получены по вышеуказанной методике, но с применением реагентов, таких как тиокарбонилдиимидазол, тионилхлорид или сульфурилхлорид, соответственно,вместо фосгена. Соединения, содержащие гидразиновую группу, связанную с Р 2 конфигурационным звеном, т.е. гдеX означает -NRjNRj- в общей формуле I или где P3 и Р 4 звенья отсутствуют и G означает NRjNRj, могут быть получены, как описано ниже. Схема 10 демонстрирует введение гидразинового производного в 5- 20012410 членный Р 2 структурный блок. Схема 10 Взаимодействие трет-бутилкарбазата (10 а), необязательно алкилзамещенного по одному или обоим азотам, с п-нитрофенилхлорформиатом в присутствии основания, такого как гидрокарбонат натрия, с последующим присоединением Р 2 структурного блока (10b) дает производное мочевины 10 с. Фосгеновый метод, представленный схемой 9, альтернативно может быть использован для обеспечения соединения фрагментов 10 а и 10b. Необязательное удаление Вос-группы по стандартным методикам, таким как кислотная обработка, например, TFA в подходящем растворителе, таком как дихлорметан, дает гидразинсодержащее производное (10d). Альтернативно, любое подходящее гидразиновое производное, такое как морфолин-1-иламин, пиперидин-1-иламин или т.п., может быть связано с 9Ab вместо производного трет-бутилкарбазата. Полученное соединение может быть затем расширено присоединением P3 или Р 4-P3 структурного блока по первичному амину соединения 9Ad, например, как показано на схеме 11. Схема 11et al. J. Org. Chem. (2001), 66, 7303-7312) дает соответствующее -бромсоединение (11b), которое при взаимодействии с описанным выше производным (10d) дает гидразинсодержащее производное (11 с). Связь между Р 2 и P3 структурными блоками может также быть образована карбаматной группой, и общая схема синтеза таких соединений представлена на схеме 12, иллюстрирующей способ для случая,когда Р 2 означает пролиновое производное. Требуемую, необязательно защищенную, аминоблокирующую группу (12 а) связывают с гидроксикислотой (10b), используя стандартные методы пептидного связывания, и впоследствии осуществляют взаимодействие с электрофильным Р 2 структурным блоком (12d), описанным выше, и, необязательно,снятие защиты, что дает конструкцию (12 е). Соединения, не содержащие карбоксигруппы в P3 звене, могут быть получены, как иллюстрируется схемой 13, демонстрирующей способ, применительно к соединению формулы I. Схема 13 Хлоркарбамоилпроизводное (13 а) может быть подвергнуто взаимодействию по реакции замещения с азидным производным (13b), полученным известным из литературы способом, в присутствии основания, такого как гидрокарбонат натрия, что дает (13 с). X имеет значения, указанные для общей формулыI. Восстановление азидной функциональности, например, посредством полимерсвязанного трифенилфосфина, в растворителе, таком как метанол, или любым другим подходящим для восстановления способом, дает промежуточное соединение (13d), которое затем может быть подвергнуто взаимодействию с кислотой в условиях пептидного связывания или с амином по реакции восстановительного аминирования, что приводит к образованию амидов и вторичных аминов, соответственно. Схема 14 представляет альтернативный способ для соединений, не содержащих карбоксигруппу в Вместо применения азидного производного (13b) согласно схеме 13 соответствующее, необязательно защищенное, гидроксипроизводное (14b) может быть использовано для реакции замещения с хлоркарбаматом (14 а) и, таким образом, введения первичного спирта. Затем, после необязательного снятия защиты, спирт (14 с) может быть окислен с помощью подходящего окисляющего агента, такого как, например, периодинан Dess-Martin, для получения соответствующего альдегида. Взаимодействие альдегида с требуемым амином по реакции восстановительного аминирования с использованием реагента, такого как, например, связанный с полистиролом цианоборгидрид, в растворителе, таком как ТГФ, дает аминопроизводные (14 е). Альтернативно, спирт (14 с) может быть подвергнут взаимодействию с подходящим ацилирующим или алкилирующим агентом в соответствующих условиях, что дает сложноэфирные и простые эфирные соединения, соответственно, т.е. G означает О в общей формуле I. Последующее взаимодействие образовавшегося спирта с подходящим ацилирующим или алкилирующим агентом с применением соответствующих условий дает сложноэфирные и простые эфирные соединения, соответственно, т.е. G означает О в общей формуле I. Альтернативно, связь между Р 2 и P3 структурными блоками может быть образована гуанидиновой группой, общий способ для таких соединений представлен схемой 15. Схема 15 Обработка Р 2-структурного блока (15 а) тиокарбонилдиимидазолом или т.п. в растворителе, таком как диметилформамид, с последующей конденсацией с цианамидом натрия в растворителе, таком как этанол, дает тиолатное промежуточное соединение (15b). Взаимодействие промежуточного соединения(15b) с требуемым структурным блоком, здесь представленным блокированным P3 структурным блоком(12 с), дает цианогуанидиновое производное (15d). Другие структурные блоки, R16-G или R16-G-P4-P3,могут альтернативно быть связаны с промежуточным соединением (15b). Гидролиз цианогруппы посредством обработки (15d) разбавленной хлористо-водородной кислотой дает производное гуанилмочевины(15 е). Когда R7, R7' и А' содержат функциональные группы, эти группы удобно защищать способами, известными специалистам в данной области, см., например, вышеупомянутые Bodanzky или Greene.- 23012410 Получение макроциклических соединений. Соединения по настоящему изобретению, где алкиленовая цепь простирается от R7/R7'-циклоалкила до Rx или R11, образуя таким образом макроцикл, могут быть получены, как описано ниже. ПодходящиеP1, P2 и P3 структурные блоки либо предшественники указанных блоков соединяют вместе, используя вышеуказанные приемы, с последующим осуществлением реакции замыкания цикла (макроциклизации). Заместитель W-R8 P2 структурного блока может быть включен по реакции Mitsunobu, как описано выше,до или после формирования макроцикла, либо требуемые структурные блоки могут быть связаны вместе путем использования соответственно замещенного Р 2-структурного блока. Для макроциклических структур, простирающихся от R7/R7' циклоалкила до R11, P3 аминокислоты, содержащие соответствующую боковую цепь, могут быть получены, как описано в WO 00/59929. Типичный способ получения макроциклических соединений представлен на схеме 18, иллюстрирующей способ, применимый к соединению, имеющему 5-членный Р 2 структурный скелет и спироциклопропильную группу в Р 1 составляющей, где макроцикл простирается от P3 боковой цепи. Схема 16 Связывание пролинового производного (16 а) и аминокислоты с соответственно защищенной кислотной группой (16b) с применением, например, фосгеновых условий, описанных выше, дает (16 с). Формирование макроцикла может быть затем выполнено по реакции олефинового обмена с применением катализатора на основе Ru, такого как катализатор, описанный в Miller, S.J., Blackwell, H.E.; Grubbs,R. H. J. Am. Chera. Soc. 118 (1996), 9606-9614, Kingsbury, J.S., Harrity, J.P.A., Bonitatebus, P.J., Hoveyda,A.H., J. Am. Chem. Soc. 121 (1999), 791-799 и Huang et al., J. Am. Chem. Soc. 121 (1999), 2674-2678. Также очевидно, что для этого взаимодействия могут быть использованы катализаторы, содержащие другие переходные металлы, такие как Мо. Необязательно, двойную связь восстанавливают и/или сложный этиловый эфир гидролизуют по стандартным методикам гидрирования и/или гидролиза, соответственно,хорошо известным из уровня техники. Альтернативно, сложный метиловый эфир селективно может быть подвергнут гидролизу с последующим связыванием R16-G-P4 структурного блока в стандартных условиях пептидного связывания. Стадия макроциклизации, представленная схемой 16, может также быть применена к соответствующим карбоциклическим аналогам, описанным выше. Когда связующая группа содержит атом азота, замыкание цикла может быть выполнено восстановительным аминированием, как описано в WO 00/59929. Макроциклические соединения без циклопропильной составляющей на Р 1 участке, т.е. где макроциклическое кольцо простирается непосредственно от основной пептидной цепи, находясь при углероде,смежном с R7, могут быть получены с применением описанных здесь способов. Пример, где пролиновое производное используют в качестве циклического Р 2 структурного скелета, представлен схемой 17. Связывания соответствующего аллилглицинового производного (17 а) с кислотной функциональностью Р 2 структурного блока (17b) с применением стандартных условий пептидного связывания дает амидное производное (17 с). Удаление Boc защитной группы путем кислотной обработки с последующим получением хлоркарбамата при обработке фосгеном в присутствии гидрокарбоната натрия и дальнейшее осуществление взаимодействия с олефинзамещенной аминокислотой (17d) дает соединение мочевины(17 е). Реакцию обмена с замыканием цикла осуществляют затем, используя, например, катализатор Hoveyda-Grubbs, что дает макроциклическое соединение (17f). Несмотря на то что схема 17 изображает синтетическую последовательность с применением Р 2 структурного блока, где R8 заместитель соединен со структурным скелетом, очевидно, что может быть использован незамещенный Р 2 структурный скелет, и R8 группа может быть введена на любой удобной стадии синтеза с применением любого из описанных здесь способов. Структурные блоки, используемые для получения соединений, где макроцикл простирается от азота в мостике между Р 2 и P3 фрагментами, т.е. X означает NRx в общей формуле I, или для получения соединений, где P3 и Р 4 фрагменты отсутствуют, т.е. m и n равны 0 и G означает NRj в общей формуле I,могут обычно быть получены, как представлено на схеме 18 В. Схема 18 Карбамат 18 а, который является коммерчески доступным либо легко может быть получен, например, при взаимодействии требуемого алкиламина с ди-трет-бутилдикарбонатом, может быть подвергнут взаимодействию с соответствующим -ненасыщенным спиртом в условиях по Mitsunobu, что дает алкилированный карбамат (18b). Кислотное воздействие на 18b, как, например, обработка трифторуксусной кислотой в растворителе, таком как дихлорметан, дает свободный амин (18 с), который может быть связан с Р 2 фрагментом с применением любой из вышеуказанных схем. Макроциклические структуры, содержащие гидразиновую группу, т.е. где X означает NRjNRj илиm и n равны 0 и G означает NRjNRj, в общей формуле I, могут быть получены путем присоединения соответственно N-алкилированного производного карбазата к Р 2 фрагменту. Алкилированные производные карбазата могут быть получены, например, как представлено схемой 19. Окисление соответствующего спирта (19 а), осуществляемое подходящим для окисления способом,как, например, с помощью N-метилморфолиноксида и тетрапропиламмонийперрутената, в растворителе,таком как дихлорметан, дает альдегид (19b). Восстановительное алкилирование трет-бутилкарбазата с помощью вышеупомянутого альдегида дает требуемый N-алкилированный структурный блок (19 с). Альтернативно, любое требуемое производное гидразина, такое как морфолин-1-иламин, пиперидин-1 иламин или т.п., может быть использовано вместо трет-бутилкарбазата для взаимодействия с альдегидом 19b. Схема 20 иллюстрирует синтетические последовательности для структурных блоков, пригодных для получения соединений, где "крайний" азот гидразиновой группы является алкилированным, либо посредством -ненасыщенной алкильной цепи, подходящей для последующего формирования макроцикла, либо посредством другой подходящей алкильной группы. Схема 20 Взаимодействие соответственно защищенного производного гидразина, например, трет-бутилового эфира (1,3-диоксо-1,3-дигидроизоиндол-2-ил)карбаминовой кислоты (20 а), который легко может быть получен квалифицированным специалистом в данной области, с требуемым спиртом, R-OH, в условиях по Mitsunobu дает N-алкилированное соединение гидразина (20b). Удаление фталимидогруппы, осуществляемое обработкой гидразином или гидразиновым производным, таким как гидразингидрат или гидразинацетат, дает карбазат (20 с). Вышеупомянутый первичный амин может быть затем либо связан с любым требуемым Р 2 фрагментом с применением любого из вышеуказанных способов, что дает производное мочевины (20d), либо, альтернативно, может быть дополнительно алкилирован с применением,например, способа восстановительного аминирования, представленного схемой 19, с последующим связыванием с Р 2 фрагментом, как описано ранее, что дает 20 е. Схема 21 является характерным примером связывания гидразинсодержащего P3 структурного блока с циклопентановым структурным скелетом, с последующей макроциклизацией. Схема 21- 26012410 Связывание производного карбазата (21b) с Р 2-Р 1 структурным блоком (21 а) с применением стандартных условий пептидного связывания дает промежуточное соединение (21 с). Замыкание цикла (21 с) по реакции олефинового обмена, представленной схемой 18, дает макроциклическое соединение (21d). Термин "N-защитная группа" или "N-защищенный", как использовано здесь, означает группы,предназначенные для защиты N-концов аминокислоты или пептида, или для защиты аминогруппы от нежелательных взаимодействий в ходе синтеза. Обычно употребляемые N-защитные группы описаны вGreene, "Protective Groups in Organic Synthesis" (John WileySons, New York, 1981), включенном здесь в качестве ссылки. N-защитные группы включают ацильные группы, такие как формил, ацетил, пропионил, пивалоил, трет-бутилацетил, 2-хлорацетил, 2-бромацетил, трифторацетил, трихлорацетил, фталил,о-нитрофеноксиацетил, -хлорбутирил, бензоил, 4-хлорбензоил, 4-бромбензоил, 4-нитробензоил и т.п.; сульфонильные группы, такие как бензолсульфонил, п-толуолсульфонил и т.п., карбаматобразующие группы, такие как бензилоксикарбонил, п-хлорбензилоксикарбонил, п-метоксибензилоксикарбонил, пнитробензилоксикарбонил, 2-нитробензилоксикарбонил, п-бромбензилоксикарбонил, 3,4-диметоксибензилоксикарбонил, 4-метоксибензилоксикарбонил, 2-нитро-4,5-диметоксибензилоксикарбонил, 3,4,5 триметоксибензилоксикарбонил, 1-(п-бифенилил)-1-метилэтоксикарбонил, ,-диметил-3,5-диметоксибензилоксикарбонил, бензгидрилоксикарбонил, трет-бутоксикарбонил, диизопропилметоксикарбонил,изопропилоксикарбонил, этоксикарбонил, метоксикарбонил, аллилоксикарбонил, 2,2,2-трихлорэтоксикарбонил, феноксикарбонил, 4-нитрофеноксикарбонил, флуоренил-9-метоксикарбонил, циклопентилоксикарбонил, адамантилоксикарбонил, циклогексилоксикарбонил, фенилтиокарбонил и т.п.; алкильные группы, такие как бензил, трифенилметил, бензилоксиметил и т.п.; и силильные группы, такие как триметилсилил и т.п. Предпочтительные N-защитные группы включают формил, ацетил, бензоил,пивалоил, трет-бутилацетил, фенилсульфонил, бензил, трет-бутоксикарбонил (ВОС) и бензилоксикарбонил (Cbz). Гидроксизащитная группа, как использовано здесь, означает заместитель, который защищает гидроксильные группы от нежелательных взаимодействий в ходе синтеза, такие как O-защитные группы,описанные в Greene, "Protective Groups In Organic Synthesis," (John WileySons, New York (1981. Гидроксизащитные группы включают замещенные простые метиловые эфиры, например, метоксиметил,бензилоксиметил, 2-метоксиэтоксиметил, 2-(триметилсилил)этоксиметил, трет-бутил и другие простые эфиры низших алкилов, таких как изопропил, этил и, в особенности, метил, бензил и трифенилметил; простые тетрагидропираниловые эфиры; замещенные простые этиловые эфиры, например, 2,2,2 трихлорэтил; простые силиловые эфиры, например, триметилсилил, трет-бутилдиметилсилил и третбутилдифенилсилил; и сложные эфиры, полученные при взаимодействии гидроксильной группы с карбоновой кислотой, например, ацетат, пропионат, бензоат и т.п. В условиях терапии, обусловленных флавивирусом, таким как HCV, соединения формулы I обычно вводят в количестве, позволяющем достигнуть уровня в плазме около 100-5000 нМ, такого как 3002000 нМ. Это соответствует дозировке, в зависимости от биологической доступности состава, порядка 0,01-10 мг/кг/день, предпочтительно 0,1-2 мг/кг/день. Типичная дозировка для стандартных размеров взрослого составляет около 0,05-5 г в день, предпочтительно 0,1-2 г, такая как 500-750 мг, в однойчетырех стандартных дозах на день. Как и для всех фармацевтических средств, дозировки зависят от размеров и состояния обмена веществ пациента, а также тяжести инфекции и должны быть скорректированы применительно к сопутствующим обстоятельствам. Согласно полезному практическому предписанию антивирусотерапии, соединения формулы I обычно вводят совместно с другими HCV-терапевтическими средствами, чтобы избежать генерации "ускользнувших" от лекарств мутантов. Примеры таких дополнительных HCV-антивирусотерапий включают рибавирин, интерфероны, включая пегилированные интерфероны. Кроме того, ряд нуклеозидных аналогов и ингибиторов протеазы находится в стадии клинической или доклинической разработки и может быть пригоден для совместного введения с соединениями по изобретению. Согласно другому аспекту изобретение представляет композицию, содержащую соединение формулы I и по меньшей мере одно дополнительное HCV-антивирусное средство в стандартной лекарственной форме, такой как приведенные ниже лекарственные формы, но преимущественно в виде таблетки для перорального введения или капсулы, либо жидкой суспензии или раствора для перорального введения или инъекций. Дальнейший аспект изобретения касается способа лечения или профилактики флавивирусной инфекции, такой как HCV, включающего последовательное или одновременное введение соединения формулы I и по меньшей мере одного дополнительного HCV-антивирусного средства. Близкий аспект изобретения касается индивидуального пакета для пациента, включающего первую фармацевтическую композицию, предпочтительно в стандартной лекарственной форме, из соединения формулы I, и вторую фармацевтическую композицию, как правило, также в стандартной лекарственной форме, и обычно в отдельном контейнере внутри индивидуального пакета для пациента, из второго HCVантивирусного средства. Целесообразно также снабжать индивидуальный пакет для пациента инструкциями по одновременному или последовательному приему соответствующих фармацевтических композиций, напечатанными на упаковке или содержащимися внутри контейнера, или на внутренней упаковке.- 27012410 Многие HCV-пациенты являются соинфицированными другими инфекционными болезнями или имеют предрасположенность к суперинфекции. Следовательно, дальнейший аспект изобретения касается комбинированной терапии, включающей соединение по изобретению, совместно формулированное в одну и ту же лекарственную форму или совместно упакованное по меньшей мере с одним дополнительным антибактериальным фармацевтическим средством. Соединение по изобретению и по меньшей мере одно дополнительное антибактериальное средство вводят одновременно или последовательно, как правило, в дозах, отвечающих монотерапевтической дозе рассматриваемого средства. Однако некоторые антибактериальные средства могут оказывать синергическое действие, позволяющее вводить один или оба активных ингредиента в более низкой дозе, чем доза, соответствующая монотерапии. Например, в случае лекарств, склонных к быстрому метаболизму по Cyp3A4, вводимых дозами совместно с ингибитором ВИЧ-протеазы ритонавир, возможна схема лечения с применением меньших доз. Типичные соинфекции или суперинфекции, сопутствующие HCV, включают вирус гепатита В или ВИЧ. Следовательно, соединение по изобретению целесообразно вводить совместно (в той же самой стандартной лекарственной форме, совместно упакованной, или отдельно предписанной лекарственной форме) по меньшей мере с одним ВИЧ-антивирусным средством и/или по меньшей мере одним HBVантивирусным средством. Характерные примеры ВИЧ-антивирусных средств включают NRTI, такие как аловудин (FLT), зудовудин (AZT, ZDV), ставудин (d4T, Zerit), залцитабин (ddC), диданозин (ddI, Videx), абакавир (ABC,Ziagen), ламивудин (3TC, Epivir), эмтрицитабин (FTC, Emtriva), рацевир (рацемический FTC), адефовир(ADV), энтакавир (BMS 200475), аловудин (FLT), тенофовирдисопроксилфумарат (TNF, Viread), амдоксавир (DAPD), D-d4FC (DPC-817), -dOTC (Shire SPD754), элвуцитабин (Achillion ACH-126443), BCH 10681 (Shire) SPD-756, рацивир, D-FDOC, GS7340, INK-20 (простой тиоэфирный фосфолипид AZT,Kucera), 2'3'-дидеокси-3'-фторгуанозин (FLG) и соответствующие пролекарства, такие как MIV-210, реверсет (RVT, D-D4FC, Pharmasset DPC-817). Характерные примеры NNRTI включают делавирдин (Rescriptor), эфавиренз (DMP-266, Sustiva),невирапин (BIRG-587, Viramune), (+)каланолид А и В (Advanced Life Sciences), каправирин (AG1549f S1153; Pfizer), GW-695634 (GW-8248; GSK), MIV-150 (Medivir), MV026048 (R-1495; Medivir AB/Roche),NV-0522 (Idenix Pharm.), R-278474 (JohnsonJohnson), RS-1588 (Idenix Pharm.), TMC-120/125 (JohnsonJohnson), TMC-125 (R-165335; JohnsonJohnson), UC-781 (Biosyn Inc.) и YM215389 (Yamanoushi). Характерные примеры ингибиторов ВИЧ-протеазы включают РА-457 (Panacos), KPC-2 (Kucera(Vertex/GSK). Другие ВИЧ-антивирусные средства включают ингибиторы входа, включая фузионные ингибиторы, ингибиторы CD4-рецептора, ингибиторы CCR5-сорецептора и ингибиторы CXCR4-сорецептора, или их фармацевтически приемлемую соль или пролекарство. Примерами ингибиторов входа являютсяSchering-Plough), T-1249 (R724; Roche/Trimeris), TAK-220 (Takeda Chem. Ind.), TNX-355 (Tanox) и UK427,857 (Pfizer). Примерами ингибиторов интегразы являются L-870810 (MerckCo.), c-2507 (MerckCo.) и S(RSC)-1838 (shionogi/GSK). Примеры HBV-антивирусных средств включают адефовирдипивоксил (Hepsera) и, в особенности,ламивудин и 2'3'-дидеокси-3'-фторгуанозин (FLG) и соответствующие пролекартсва, такие как MIV-210,5'-О-валил-L-лактиловое пролекарство FLG. Эти последние HBV-антивирусные средства в особенности подходящи, поскольку являются также активными против ВИЧ. Хотя активный агент может быть введен отдельно, предпочтительно, чтобы указанный агент входил в фармацевтический состав. Такой состав включает вышеуказанный активный агент вместе с одним или более приемлемыми носителями или наполнителями и, необязательно, другими терапевтическими ингредиентами. Носитель(носители) должен быть приемлемым, в том смысле, что должен быть совместимым с другими ингредиентами состава и не оказывать вредного воздействия на реципиента. Составы включают составы, пригодные для ректального, назального, местного (включая трансбуккальное и сублингвальное), вагинального или парентерального (включая подкожное, внутримышечное,внутривенное и внутрикожное) введения, но предпочтительным формулированием является состав для перорального введения. Целесообразно, чтобы составы были представлены в стандартной лекарственной форме, например, в виде таблеток и капсул замедленного высвобождения, которые могут быть получены хорошо известными из фармации способами.- 28012410 Такие способы включают стадию объединения вышеуказанного активного агента с носителем. В общем случае, составы получают путем равномерного и однородного объединения активного агента с жидкими носителями или тонко измельченными твердыми носителями, либо с теми и другими, и затем,при необходимости, формованием продукта. Изобретение охватывает способы получения фармацевтической композиции, включающие получение конъюгированного или ассоциированного с фармацевтически приемлемым носителем или разбавителем соединения формулы I или фармацевтически приемлемой соли указанного соединения. Если получение фармацевтических составов включает однородное смешивание фармацевтических наполнителей и активного ингредиента в солевой форме, то часто предпочтительно использовать наполнители, не являющиеся основными по характеру, т.е. либо кислотные, либо нейтральные. Составы для перорального введения по настоящему изобретению могут быть представлены в виде дискретных стандартных единиц, таких как капсулы, крахмальные облатки или таблетки, каждая из которых содержит заранее рассчитанное количество активного агента; в виде порошка или гранул; в виде раствора или суспензии активного агента в водной жидкости или неводной жидкости; или в виде жидкой эмульсии типа масло-в-воде, либо жидкой эмульсии типа вода-в-масле, и в виде болюсов и пр. Что касается композиций для перорального введения (например, таблеток и капсул), термин пригодный носитель включает разбавители, такие как общепринятые наполнители, например, связующие средства, например сироп, камедь акации, желатин, сорбит, трагакантовая камедь, поливинилпирролидон(Povidone), метилцеллюлоза, этилцеллюлоза, натрий-карбоксиметилцеллюлоза, гидроксипропилметилцеллюлоза, сахароза и крахмал; наполнители и носители, например, кукурузный крахмал, желатин, лактоза, сахароза, микрокристаллическая целлюлоза, каолин, маннит, дикальцийфосфат, хлорид натрия и альгиновая кислота; и смазывающие вещества, такие как стеарат магния, стеарат натрия и другие стеараты металлов, стеариновая кислота, глицеролстеарат, силиконовая жидкость, тальк, воски, масла и коллоидный диоксид кремния. Также могут быть использованы корригенты, такие как мятное масло, винтергреневое масло, вишневый ароматизатор или т.п. Может быть также желательно включение красителя для получения легко распознаваемой лекарственной формы. Таблетки также могут быть покрыты оболочкой с применением хорошо известных из уровня техники способов. Таблетки могут быть получены прессованием или формованием, необязательно, с одним или более вспомогательными ингредиентами. Прессованные таблетки могут быть получены прессованием на подходящей машине активного агента в свободнотекучей форме, такой как порошок или гранулы, необязательно в смеси с связующим веществом, смазывающим веществом, инертным разбавителем, консервантом, поверхностно-активным или диспергирующим средством. Формованные таблетки могут быть получены путем формования на подходящей машине смеси из порошкообразного соединения, смоченного инертным жидким разбавителем. Таблетки, необязательно, могут быть покрыты оболочкой или иметь насечки, и могут быть формулированы таким образом, чтобы обеспечивать медленное или контролируемое замедленное высвобождение активного агента. Другие составы, подходящие для перорального введения, включают леденцы, содержащие активный агент в ароматизированной основе, обычно сахарозе и гуммиарабике или трагаканте; пастилки, содержащие активный агент в инертной основе, такой как желатин и глицерин, или сахароза и камедь акации; и жидкости для полоскания рта, включающие активный агент в подходящем жидком носителе. Соединения формулы I могут образовывать соли, которые составляют дополнительный аспект изобретения. Соответствующие фармацевтически приемлемые соли соединений формулы I включают соли органических кислот, в особенности, карбоновых кислот, включающие, но не в порядке ограничения,ацетат, трифторацетат, лактат, глюконат, цитрат, тартрат, малеат, малат, пантотенат, изетионат, адипат,альгинат, аспартат, бензоат, бутират, диглюконат, циклопентанат, глюкогептанат, глицерофосфат, оксалат, гептаноат, гексаноат, фумарат, никотинат, пальмоат, пектинат, 3-фенилпропионат, пикрат, пивалат,пропионат, тартрат, лактобионат, пиволат, камфорат, ундеканоат и сукцинат, органических сульфоновых кислот, такие как метансульфонат, этансульфонат, 2-гидроксиэтансульфонат, камфорсульфонат, 2 нафталинсульфонат, бензолсульфонат, п-хлорбензолсульфонат и п-толуолсульфонат; и неорганических кислот, таких как гидрохлорид, гидробромид, гидроиодид, сульфат, бисульфат, гемисульфат, тиоцианат,персульфат, фосфорной и сульфоновой кислот. Кроме того, изобретение охватывает соли соединений формулы I, которые могут являться либо не являться, фармацевтически приемлемыми, но быть полезными в качестве синтетических промежуточных соединений, солевая группа может быть замещена или возвращена на место, по необходимости. Изобретение включает пролекарства соединений формулы I. Пролекарствами соединений формулыI являются такие соединения, которые после введения пациенту высвобождают соединение формулы I invivo, обычно после гидролиза в кишечнике, печени или плазме. Типичными пролекарствами являются фармацевтически приемлемые простые эфиры и, в особенности, сложные эфиры (включая фосфатные сложные эфиры) для гидроксифункциональностей, фармацевтически приемлемые амиды или карбаматы для аминофункциональностей или фармацевтически приемлемые сложные эфиры для карбоксифункциональностей. Предпочтительные фармацевтически приемлемые сложные эфиры включают алкиловые сложные эфиры, включая ацетил, этаноил, бутирил, трет-бутирил, стеарил и пивалоил, фосфатные сложные эфиры и сульфоновые сложные эфиры (т.е. производные RSO2OH, где R означает низший алкил или- 29012410 арил). Фармацевтически приемлемые сложные эфиры включают низшие алкиловые простые эфиры и простые эфиры, описанные в WO 00/47561, в особенности, метоксиаминоацил и этоксиаминоацил. Соединения по изобретению имеют различные стерические центры, и изобретение охватывает рацематы и энантиомеры при каждом из таких стерических центров. Обычно стереохимия групп, соответствующих P3 и Р 4 боковым цепям (т.е. R15 и/или R11), отвечает конфигурации L-аминокислот, хотя изобретение также охватывает D-изомеры при одном или более таких центров. Заслуживает внимания тот факт, что L конфигурация является активной, несмотря на то,что природа Е составляющей подразумевает, что P3 и Р 4 имеют, как правило, один смещенный атом относительно обычного полипептида, и тот факт, что реверсия пептидного остатка, как представляется дляP3 и Р 4, затем устанавливает аминокислотную боковую цепь с противоположной стороны в сравнении с обычным пептидным субстратом. Стереохимия компонента основной цепи для циклической Р 2 группы (т.е. перекрывание карбонила Р 1 амидной связи и протяженность карбонила или Е в P3 обычно соответствуют L-пролину. Стереохимия Р 2 циклического атома, с которым связан W, обычно является такой, как изображено ниже: В соединениях по изобретению, где R7 и R7' вместе означают спироалкильную группу, такой спироциклоалкил обычно содержит R7a заместитель на спироциклопропиловом цикле, который ориентирован син- относительно А Целесообразно, когда спироуглерод такого спироциклопропилового цикла имеет R конфигурацию Целесообразно, когда R7'a заместитель на спироциклопропиловом цикле, смежном с А, находится в син-ориентации в следующей абсолютной конфигурации: В особенности предпочтительные варианты для R7'a включают этил, следовательно, асимметричные атомы углерода в позиции 1 и 2 имеют R,R-конфигурацию. Альтернативные предпочтительные значенияR7'а включают винил, следовательно, асимметричные атомы углерода в позиции 1 и 2 имеют R,Sконфигурацию. Когда соединение по изобретению означает макроцикл, содержащий J группу, J предпочтительно является диастереомером, представленным подструктурами (i) или (ii)
МПК / Метки
МПК: A61P 31/12, C07D 413/14, A61K 31/47, C07K 5/02, C07D 417/14, C07D 207/16, C07D 401/12, C07D 487/04, C07D 405/14, C07D 409/14
Метки: ингибиторы, серин-протеазы
Код ссылки
<a href="https://eas.patents.su/30-12410-ingibitory-serin-proteazy-ns-3-hcv.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы серин-протеазы ns-3 hcv</a>
Предыдущий патент: Способ лечения раздражения мочевого пузыря и чрезмерно активного мочевого пузыря
Следующий патент: Никелевый катализатор, способ получения катализатора и способ селективного гидрирования
Случайный патент: Способ производства гранул