Производные замещенного пропенилпиперазина в качестве новых ингибиторов гистондеацетилазы
Номер патента: 11932
Опубликовано: 30.06.2009
Авторы: Артс Янине, Анжибо Патрик Рене, Ван Брандт Свен Францискус Анна, Ван Эмелен Кристоф, Марконне-Декран Лоранс Франсуаз Бернадетт
Формула / Реферат
1. Соединение формулы (I)
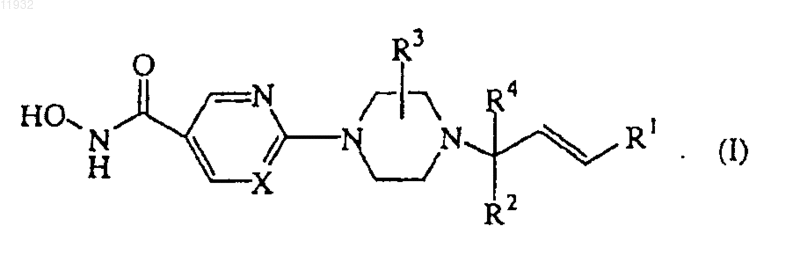
его N-оксидные формы, его фармацевтически приемлемые кислотно-аддитивные соли и стереохимически изомерные формы,
где каждый X независимо представляет собой N или CH;
R1 представляет собой фенил или фенил, необязательно замещенный галогеном, С1-6алкилом, С1-6 алкилокси, полигалогенС1-6алкилом или арилом;
R2 представляет собой CH2-R5 или -C(=O)-R6, каждый R5 независимо выбран из водорода, гидрокси, С1-6алкилокси, С1-6алкилоксиС1-6алкилокси, С1-6алкилкарбонилокси, N-метилпиперазинила, морфолинила или имидазолила; каждый R6 независимо выбран из С1-6алкиламино, C1-6циклоалкиламино, гидроксиС1-6 алкиламино, ди(С1-6алкил)аминоС1-6алкиламино или морфолинила;
R3 представляет собой водород и
R4 представляет собой водород или С1-6алкил,
вышеуказанный арил представляет собой фенил.
2. Соединение по п.1, где каждый X представляет собой N.
3. Соединение по пп.1 и 2, где каждый X представляет собой N, R1 представляет собой фенил или фенил, замещенный галогеном; R2 представляет собой -CH2-R5; каждый R5 независимо выбран из водорода, гидрокси, С1-6алкилокси или С1-6алкилкарбонилокси; R3 представляет собой водород и R4 представляет собой водород.
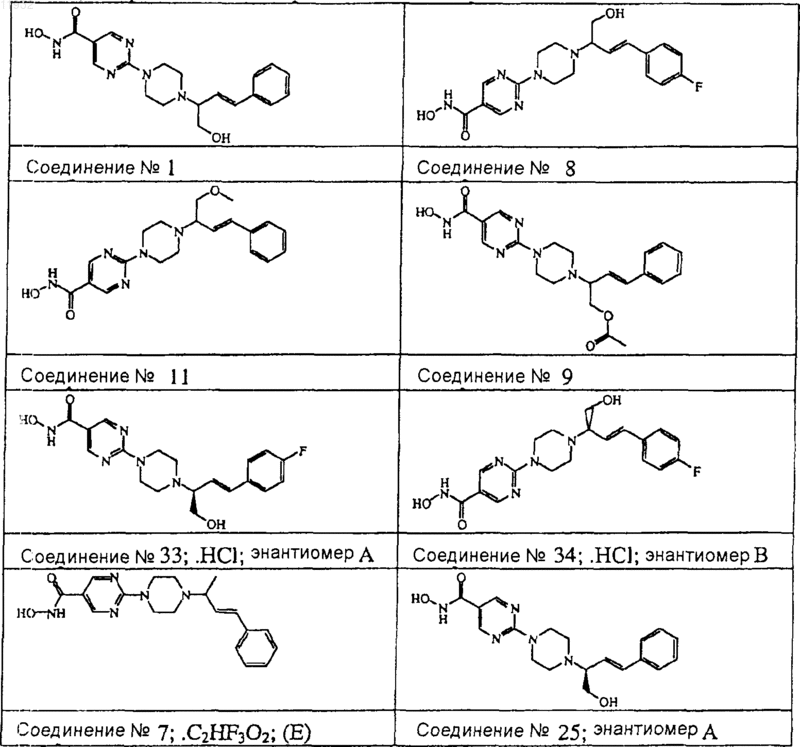
4. Соединение по пп.1-3, где указанное соединение представляет собой соединение ь 1, соединение ь 8, соединение ь 11, соединение ь 9, соединение ь 33, соединение ь 34, соединение ь 7 или соединение ь 25.
5. Фармацевтическая композиция, содержащая фармацевтически приемлемые носители и в качестве активного ингредиента терапевтически эффективное количество соединения по пп.1-4.
6. Способ получения фармацевтической композиции по п.5, в котором фармацевтически приемлемые носители и соединение по пп.1-4 тщательно смешивают.
7. Применение соединения по любому из пп.1-4 в качестве лекарственного средства.
8. Применение соединения по любому из пп.1-4 для производства лекарственного средства для лечения пролиферативных заболеваний.
9. Комбинация противоракового средства и ингибитора HDAC по любому из пп.1-4.
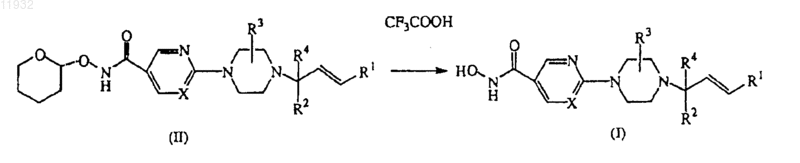
10. Способ получения соединения по п.1, отличающийся взаимодействием промежуточного соединения формулы (II) с соответствующей кислотой с образованием гидроксамовой кислоты формулы (I)
11. Соединение формулы (V)

его N-оксидные формы, его фармацевтически приемлемые кислотно-аддитивные соли и стереохимически изомерные формы,
где каждый X независимо представляет собой N или CH;
R1 представляет собой фенил или фенил, необязательно замещенный галогеном, С1-6алкилом, С1-6 алкилокси, полигалогенС1-6алкилом или арилом;
R2 представляет собой CH2-R5 или -C(=O)-R6, каждый R5 независимо выбран из водорода, гидрокси, С1-6алкилокси, С1-6алкилоксиС1-6алкилокси, С1-6алкилкарбонилокси, N-метилпиперазинила, морфолинила или имидазолила; каждый R6 независимо выбран из С1-6алкиламино, С1-6циклоалкиламино, гидроксиС1-6 алкиламино, ди(С1-6алкил)аминоС1-6алкиламино или морфолинила;
R3 представляет собой водород и
R4 представляет собой водород или С1-6алкил,
вышеуказанный арил представляет собой фенил.
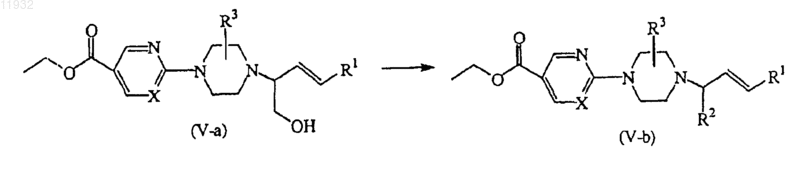
12. Способ получения соединения по п.11, отличающийся тем, что включает превращение соединений формулы (V), где R2 представляет собой -CH2OH и R4 представляет собой водород, называемых здесь соединениями формулы (V-a), в соединения формулы (V), где R2 представляет собой заместитель, отличающийся от -CH2OH, называемых здесь соединениями формулы (V-b), по реакциям, известным в данной области техники, или путем трансформаций функциональных групп
13. Способ получения соединения по п.11, отличающийся тем, что включает получение соединений формулы (V-a) в одну стадию взаимодействием промежуточного соединения формулы (VI) с 1,4-диоксан-2,5-диолом и соответствующей бороновой кислотой формулы (VII), где R1 такой, как определено выше, или
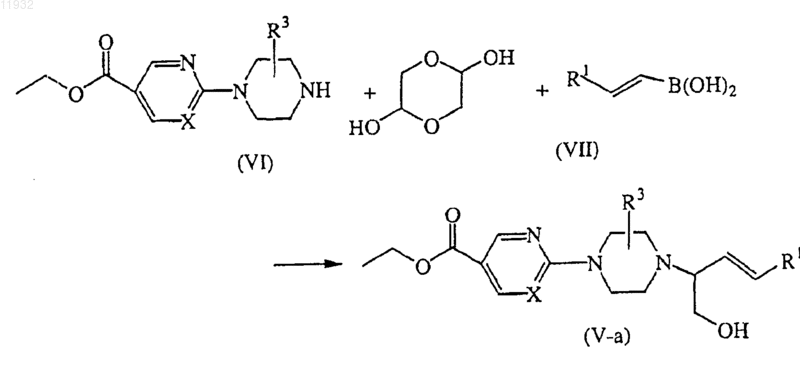
14. Способ получения соединения по п.11, отличающийся тем, что включает получение соединений формулы (V-b) взаимодействием промежуточного соединения (VI) с соответствующим кетоном формулы (VIII), где R1 и R2 такие, как определено выше
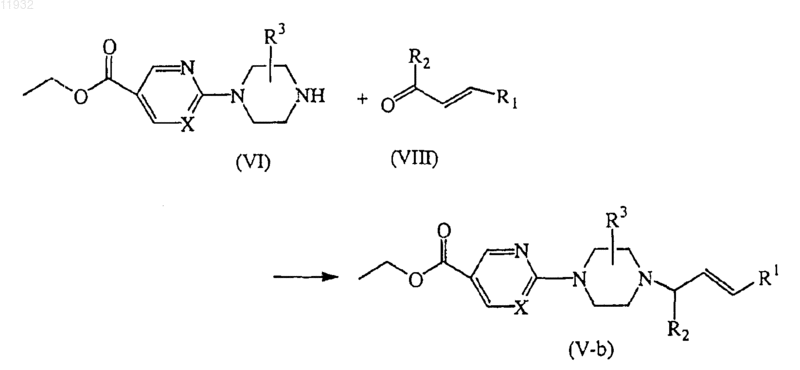
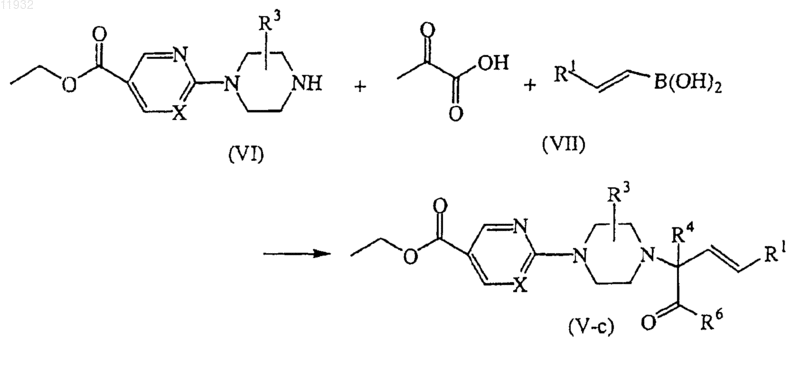
15. Способ получения соединения по п.11, отличающийся тем, что включает получение соединений формулы (V), где R2 представляет собой -COOH, называемых здесь соединениями формулы (V-с), в одну стадию взаимодействием промежуточного соединения формулы (VI) с 2-оксопропановой кислотой и соответствующей бороновой кислотой формулы (VII), где R1 такой, как определено выше, в подходящем растворителе и дальнейшим превращением в промежуточные соединения формулы (V), где R2 представляет собой -C(=O)-R6, по реакциям, известным в данной области техники, или путем трансформаций функциональных групп.
Текст
011932 Настоящее изобретение относится к соединениям, обладающим ферментативной активностью, ингибирующей гистондеацетилазу (HDAC). Кроме того, оно относится к способам получения указанных соединений, к композициям, содержащим эти соединения, а также к их применению как in vitro, так и invivo, для ингибирования HDAC и в качестве лекарственного средства, например в качестве лекарства для ингибирования пролиферативных состояний, таких как рак и псориаз. Ядерные гистоны известны как интегральные и динамические компоненты комплекса, ответственного за регуляцию транскрипции генов и другие ДНК-матричные процессы, такие как репликация, репарация, рекомбинация и сегрегация хромосом. Они являются предметом посттрансляционных модификаций, включающих ацетилирование, фосфорилирование, метилирование, убикитинирование и АДФрибозилирование. Гистондеацетилаза(ы), называемая(ые) здесь "HDAC", представляют собой ферменты, которые катализируют удаление ацетильной модификации из лизиновых остатков белков, включая коровые нуклеосомные гистоны Н 2 А, Н 2 В, Н 3 и Н 4. Вместе с гистонацетилтрансферазой(ами), называемыми здесь"HAT", HDAC регулируют степень ацетилирования гистонов. Баланс ацетилирования нуклеосомных гистонов играет важную роль в транскрипции многих генов. Гипоацетилирование гистонов связано с конденсированной хроматиновой структурой, которая в результате приводит к подавлению транскрипции генов, тогда как ацетилированные гистоны связаны с более открытой хроматиновой структурой и активацией транскрипции. Одиннадцать близких по структуре гистонов HDAC описаны и делятся на два класса. Класс IHDAC состоит из HDAC 1, 2, 3, 8 и 11, тогда как класс II HDAC состоит из HDAC 4, 5, 6, 7, 9 и 10. Члены третьего класса HDAC не являются близкими по структуре к HDAC, относящимся к классам I и IIHDAC. HDAC классов I/II действуют по цинкзависимым механизмам, тогда как HDAC класса III являются NAD-зависимыми. Другие белки, кроме гистонов, также являются субстратом для ацетилирования, конкретно, транскрипционные факторы, такие как р 53, GATA-1 и E2F; ядерные рецепторы, например, такие как глюкокортикоидный рецептор, тироидные рецепторы, эстрогеновые рецепторы; и регуляторные белки клеточного цикла, такие как pRb. Ацетилирование белков связано с их стабилизацией, например стабилизацией р 53, рекрутингом кофакторов и увеличенным связыванием ДНК. р 53 представляет собой супрессор опухолей, который может вызывать блокирование клеточного цикла и апоптоз в ответ на множество стресссигналов, таких как повреждение ДНК. Главной мишенью блокирования р 53-индуцированного клеточного цикла, по-видимому, является ген р 21. После его активации геном р 53, р 21 идентифицирован благодаря его ассоциации с циклин/циклинзависимыми комплексами киназы, приводящей к блокированию клеточного цикла как в G1, так и G2 фазах, позитивной регуляции во время старения и его взаимодействию с ядерным антигеном пролиферирующих клеток. Исследование ингибиторов HDAC указывает на их важную роль в блокировании клеточного цикла,дифференцировке клеток, апоптозе и реверсии трансформированных фенотипов. Например, ингибитор трихостатин A (TSA) вызывает блокирование клеточного цикла как в G1, так и G2 фазах, реверсирует трансформированный фенотип различных клеточных линий и индуцирует дифференцировку клеток лейкемии Фрейнда и др. Сообщают, что TSA (и субероиланилид гидроксамовой кислоты SAHA) ингибируют рост клеток, индуцируют терминальную дифференцировку и предотвращают образование опухолей у мышей (Finnin et al., Nature, 401: 188-193, 1999). Сообщают также, что трихостатин A (TSA) применим при лечении фиброза, например фиброза печени и цирроза печени. (Geerts et al., European Patent Application EP 0827742, published 11 March, 1998). Фармакофор для ингибиторов HDAC состоит из домена, связывающего металл, который взаимодействует с цинксодержащим активным сайтом HDAC, линкерным доменом и поверхностным доменом распознавания или кэпирующей областью, которая взаимодействует с остатками на краю активного сайта. Имеются также сообщения о том, что ингибиторы HDAC индуцируют экспрессию р 21 гена. Транскрипционная активация р 21 гена указанными ингибиторами ускоряется перестраиванием хроматина,затем ацетилированием гистонов Н 3 и Н 4 в области промотирования р 21 гена. Упомянутая активация р 21 происходит независимо от р 53 и, следовательно, HDAC ингибиторы работают в клетках с мутированными генами р 53, отличительным признаком многочисленных опухолей. Кроме того, HDAC ингибиторы могут обладать косвенными видами активности, такими как усиление иммунных ответов хозяина и ингибирование ангиогенеза опухолей и, следовательно, они могут подавлять рост первичных опухолей и препятствовать образованию метастаз (Mai et al., Medicinal Research Reviews, 25. 261-309). Ввиду вышеизложенного ингибиторы HDAC могут обладать большим потенциалом в лечении клеточных пролиферативных заболеваний или состояний, в том числе опухолей с мутированными генами р 53. В заявке ЕР 1472216, опубликованной 14 августа 2003 г., описаны бициклические гидроксаматы в качестве ингибиторов гистондеацетилазы. В патентных заявках ЕР 1485099, ЕР 1485348, ЕР 1485353, ЕР 1485354, ЕР 1485364, ЕР 1485365, ЕР-1 011932 1485370, ЕР 1485378, опубликованных 18 сентября 2003 г., среди других соединений описаны замещенные пиперазинилпиримидинилгидроксамовые кислоты в качестве ингибиторов гистондеацетилазы, кроме того, в заявке ЕР 1485365 описан R306465. В патентной заявке ЕР 1492534, опубликованной 9 октября 2003 г., описаны производные карбаминовой кислоты, содержащие пиперазиновый фрагмент, в качестве ингибиторов HDAC. В патентной заявке ЕР 1495002, опубликованной 23 октября 2003 г., описаны замещенные производные пиперазинилфенилбензамида в качестве ингибиторов гистондеацетилазы. В патентной заявке WO 04/009536, опубликованной 29 января 2004 г., описаны производные, содержащие алкильный линкер между арильной группой и гидроксаматом, в качестве ингибиторов гистондеацетилазы. В патентной заявке ЕР 1525199, опубликованной 12 февраля 2004 г., описаны (гетеро)арилалкенилзамещенные бициклические гидроксаматы в качестве ингибиторов гистондеацетилазы. В патентной заявке WO 04/063146, опубликованной 29 июля 2004 г., описаны производные Nгидроксибензамидов с противовоспалительной и противоопухолевой активностью. В патентной заявке WO 04/063169, опубликованной 29 июля 2004 г., описаны производные замещенных арилгидроксаматов в качестве ингибиторов гистондеацетилазы. В патентной заявке WO 04/072047, опубликованной 26 августа 2004 г., описаны индолы, бензимидазолы и нафтимидазолы в качестве ингибиторов гистондеацетилазы. В патентной заявке WO 04/082638, опубликованной 30 сентября 2004 г., описаны гидроксаматы, соединенные с неароматическими гетероциклическими кольцевыми системами, в качестве ингибиторов гистондеацетилазы. В патентной заявке WO 04/092115, опубликованной 28 октября 2004 г., описаны производные гидроксаматов в качестве ингибиторов гистондеацетилазы. В патентной заявке WO 05/028447, опубликованной 31 марта 2005 г., описаны бензимидазолы в качестве ингибиторов гистондеацетилазы. В патентных заявках WO 05/030704 и WO 05/030705, опубликованных 7 апреля 2005 г., описаны бензамиды в качестве ингибиторов гистондеацетилазы. В патентной заявке WO 05/040101, опубликованной 6 мая 2005 г., описаны гидроксаматы, связанные с ацилмочевиной и сульфонилмочевиной, в качестве ингибиторов гистондеацетилазы. В патентной заявке WO 05/040161, также опубликованной 6 мая 2005 г., описаны биарильные производные гидроксаматов в качестве ингибиторов гистондеацетилазы. Соединения по настоящему изобретению отличаются от соединений предшествующего уровня техники по своей структуре, фармакологической активности и/или фармакологической эффективности. Проблема, которая должна быть решена, состоит в создании ингибиторов гистондеацетилазы с высокой ферментативной и клеточной активностью, которые обладают повышенной биодоступностью и/или эффективностью in vivo. Новые соединения по настоящему изобретению решают вышеописанную проблему. Соединения по настоящему изобретению проявляют превосходную ферментативную и клеточную активность, ингибирующую гистондеацетилазу. Они имеют высокий потенциал для активации гена р 21 как на клеточном,так и на in vivo уровне. Они обладают требуемым фармакокинетическим профилем и низкой аффинностью в отношении Р 450 ферментов, что снижает риск нежелательного взаимодействия лекарстволекарство и позволяет также расширить пределы безопасности. Преимуществами соединений по настоящему изобретению являются метаболическая стабильность,растворимость и/или индуцирующая способность р 21. В частности, многие соединения по настоящему изобретению обладают увеличенным периодом полувыведения в гепатоцитах крыс, имеют повышенную растворимость/стабильность в водных растворах и/или обладают повышенной in vivo способностью индуцировать промотор р 21. Данное изобретение относится к соединениям формулы (I) их N-оксидным формам, их фармацевтически приемлемым кислотно-аддитивным солям и их стереохимически изомерным формам, где каждый X независимо представляет собой N или CH;R1 представляет собой фенил, нафталинил или гетероциклил; где каждый указанный фенил или нафталинил необязательно замещен одним или двумя заместителями, каждый из которых независимо выбран из галогена, С 1-6 алкила, С 1-6 алкокси, полигалогенС 1-6 алкила, арила, гидрокси, циано, амино, С 1-6 алкилкарбониламино, С 1-6 алкилсульфониламино, гидроксикарбонила, С 1-6 алкоксикарбонила, гидроксиС 1-6 алкила, С 1-6 алкилоксиметила, аминометила, С 1-6 алкиламинометила, С 1-6 алкилкарбониламинометила, С 1-6 алкилсульфониламинометила, аминосульфонила, С 1-6 алкиламиносульфонила или гетероциклила;-2 011932 независимо выбран из водорода, гидрокси, С 1-6 алкилокси, С 1-6 алкилоксиС 1-6 алкилокси, С 1-6 алкилкарбонилокси, пиперазинила, N-метилпиперазинила, морфолинила, тиоморфолинила, имидазолила или триазолила; каждый R6 независимо выбран из гидрокси, С 1-6 алкилокси, амино или моно- или ди(С 1-6 алкил)амино, C1-6 циклоалкиламино, гидроксиС 1-6 алкиламино, пиперазинила, моно- или ди(С 1-6 алкил)аминоС 1-6 алкиламино, N-метилпиперазинила, морфолинила или тиоморфолинила; каждый R7 и R8 независимо выбраны из водорода, С 1-6 алкила, С 1-6 алкилкарбонила, С 1-6 алкилсульфонила или моно- или ди(С 1-4 алкил)аминосульфонила,R3 представляет собой водород, гидроксиметил, аминометил или моно- или ди(С 1-6 алкил)аминометил;R4 представляет собой водород или С 1-6 алкил; вышеуказанный арил представляет собой фенил или нафталинил, причем каждый указанный фенил или нафталинил необязательно замещен одним или двумя заместителями, каждый из которых независимо выбран из галогена, С 1-6 алкила, С 1-6 алкокси, трифторметила, циано или гидроксикарбонила; и вышеуказанный гетероциклил представляет собой фуранил, тиенил, пирролил, пирролинил, пирролидинил, диоксолил, оксазолил, тиазолил, имидазолил, имидазолинил, имидазолидинил, пиразолил, пиразолинил, пиразолидинил, изоксазолил, изотиазолил, оксадиазолил, триазолил, тиадиазолил, пиранил,пиридинил, пиперидинил, диоксанил, морфолинил, дитианил, тиоморфолинил, пиридазинил, пиримидинил, пиразинил, пиперазинил, триазинил, тритианил, индолизинил, индолил, индолинил, бензофуранил,бензотиофенил, индазолил, бензимидазолил, бензтиазолил, пуринил, хинолизинил, хинолинил, циннолинил, фталазинил, хиназолинил, хиноксалинил или нафтиридинил, где каждый из указанных гетероциклов необязательно замещен одним или двумя заместителями, каждый из которых независимо выбран из галогена, С 1-6 алкила, С 1-6 алкокси, циано, амино, моно- или ди(С 1-4 алкил)амино. Термин "ингибитор гистондеацетилазы" используют для идентификации соединения, которое способно взаимодействовать с гистондеацетилазой и ингибировать ее активность, более конкретно, ингибировать его ферментативную активность. Ингибирование ферментативной активности гистондеацетилазы означает уменьшение способности гистондеацетилазы удалять ацетильную группу из гистона. Такое ингибирование предпочтительно является специфичным, т.е. ингибитор гистондеацетилазы уменьшает способность гистондеацетилазы удалять ацетильную группу из гистона при концентрации ниже, чем концентрация ингибитора, которая требуется для получения другого, не связанного с указанным выше,биологического эффекта. В приведенных выше и ниже определениях термин галоген является родовым термином для фтора, хлора, брома и йода; термин С 1-4 алкил обозначает насыщенные углеводородные радикалы с линейной или разветвленной цепью, содержащие от 1 до 4 атомов углерода, такие как, например, метил, этил, пропил, бутил, 1-метилэтил, 2-метилпропил и т.п.; термин С 1-6 алкил включает С 1-4 алкил и более сложные гомологи, содержащие 5-6 атомов углерода, такие как, например, пентил, 2-метилбутил, гексил, 2 метилпентил и т.п., полигалогенС 1-6 алкил обозначает С 1-6 алкил, содержащий три одинаковых или различных атомов галогена в качестве заместителей, например, трифторметил; и С 3-6 циклоалкил включает циклические углеводородные группы, содержащие от 3 до 6 атомов углерода, такие как циклопропил,циклобутил, циклопентил, циклопентенил, циклогексил и т.п. Термин фармацевтически приемлемые аддитивные соли охватывает фармацевтически приемлемые кислотно-аддитивные соли и фармацевтически приемлемые основно-аддитивные соли. Подразумевается, что фармацевтически приемлемые кислотно-аддитивные соли, как указано выше, включают терапевтически активные нетоксичные кислотно-аддитивные типы солей, которые способны образовывать соединения формулы (I). Соединения формулы (I), которые обладают основными свойствами, можно превратить в их фармацевтически приемлемые кислотно-аддитивные соли обработкой указанной основной формы соответствующей кислотой. Подходящие кислоты включают, например, неорганические кислоты, такие как галогеноводородные кислоты, например хлористо-водородная кислота или бромистоводородная кислота; серная, азотная, фосфорная и им подобные кислоты; или органические кислоты,такие как, например, уксусная, трифторуксусная, пропановая, гидроксиуксусная, молочная, пировиноградная, щавелевая, малоновая, янтарная (т.е. бутандиовая кислота), малеиновая, фумаровая, яблочная,винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, толуолсульфоновая, цикламовая, салициловая, п-аминосалициловая, памовая кислоты и им подобные. Соединения формулы (I), которые обладают кислотными свойствами, можно превратить в их фармацевтически приемлемые основно-аддитивные соли обработкой указанной кислотной формы подходящим органическим или неорганическим основанием. Подходящие типы основных солей включают, например, аммониевые соли, соли щелочных и щелочно-земельных металлов, например соли лития, натрия, калия, магния, кальция и т.п., соли, образованные с органическими основаниями, например соли бензатина, N-метил-D-глюкамина, соли гидрабамина и соли, образованные с аминокислотами, такими как, например, аргинин, лизин и им подобные. Термин "кислотно- или основно-аддитивные соли" также включает гидраты и продукты присоединения растворителя, которые способны образовывать соединения формулы (I). Примерами таких форм-3 011932 являются гидраты, алкоголяты и т.п. Термин "стереохимически изомерные формы соединения формулы (I)" используется здесь для обозначения всех возможных соединений, состоящих из одних и тех же атомов, связанных одинаковыми связями в одинаковой последовательности, но имеющих разные трехмерные структуры, не являющиеся взаимозаменяемыми, которые могут иметь соединения формулы (I). Если не упомянуто или не указано иное, химическое обозначение соединения охватывает смесь всех возможных стереохимически изомерных форм, которые может иметь указанное соединение. Упомянутая смесь может содержать все диастереомеры и/или энантиомеры основной молекулярной структуры указанного соединения. Подразумевается, что все стереохимически изомерные формы соединения формулы (I) как в чистом виде, так и виде смеси друг с другом охватываются объемом настоящего изобретения. Подразумевается, что N-оксидные формы соединения формулы (I) включают те соединения формулы (I), в которых один или несколько атомов азота окислены в так называемый N-оксид, конкретно, те Nоксиды, в которых один или несколько атомов азота в пиперидин-, пиперазин- или пиридазинильных остатках являются N-окисленными. Некоторые из соединений формулы (I) могут также существовать в таутомерных формах. Подразумевается, что такие формы, хотя на них нет точных указаний в вышеупомянутой формуле, включены в объем настоящего изобретения. Подразумевается, что везде в данной заявке, где используют термин "соединения формулы (I)", он включает также их фармацевтически приемлемые аддитивные соли и все их стереоизомерные формы. Термины "гистондеацетилаза" и "HDAC", используемые здесь, предназначены для обозначения любого семейства ферментов, которые удаляют ацетильные группы из -аминогрупп остатков лизина Nконцевой части гистона. Если в контексте не указано иное, подразумевается, что термин "гистон" относится к любому белку-гистону, включая H1, Н 2 А, Н 2 В, Н 3, Н 4 и Н 5, любых разновидностей. Человеческие белки HDAC или генные продукты включают, но не ограничены ими, HDAC-1, HDAC-2, HDAC-3,HDAC-4, HDAC-5, HDAC-6, HDAC-7, HDAC-8, HDAC-9, HDAC-10 и HDAC-11. Гистондеацетилазу можно также получить из простейших и грибов. Первая группа соединений, представляющих интерес, состоит из тех соединений формулы (I), к которым применимы одно или несколько следующих ограничений:a) R1 представляет собой фенил или нафталинил, где каждый указанный фенил или нафталинил замещен одним или двумя заместителями, каждый из которых независимо выбран из С 1-6 алкилсульфониламино, гидроксикарбонила, С 1-6 алкилоксиметила, С 1-6 алкиламинометила, С 1-6 алкилкарбониламинометила, С 1-6 алкилсульфониламинометила, аминосульфонила или С 1-6 алкиламиносульфонила; илиc) R4 представляет собой С 1-6 алкил. Вторая группа соединений, представляющих интерес, состоит из тех соединений формулы (I), к которым применимы одно или несколько следующих ограничений:a) R1 представляет собой фенил, нафталинил или гетероциклил; где каждый указанный фенил замещен одним или двумя заместителями, каждый из которых независимо выбран из арила, гидрокси,амино, С 1-6 алкилкарбониламино, С 1-6 алкилсульфониламино, С 1-6 алкоксикарбонила, гидроксиС 1-6 алкила,С 1-6 алкилоксиметила, аминометила, С 1-6 алкиламинометила, С 1-6 алкилкарбониламинометила, С 1-6 алкилсульфониламинометила, аминосульфонила, С 1-6 алкиламиносульфонила или гетероциклила; илиc) R4 представляет собой С 1-6 алкил. Третья группа соединений, представляющих интерес, состоит из тех соединений формулы (I), к которым применимы одно или несколько следующих ограничений:a) R1 представляет собой фенил, нафталинил или гетероциклил; где каждый указанный фенил или нафталинил замещен одним или двумя заместителями, каждый из которых независимо выбран из С 1-6 алкилсульфониламино, С 1-6 алкилоксиметила, аминометила, С 1-6 алкиламинометила, С 1-6 алкилкарбониламинометила, С 1-6 алкилсульфониламинометила, аминосульфонила или С 1-6 алкиламиносульфонила; илиc) R4 представляет собой С 1-6 алкил. Четвертая группа соединений, представляющих интерес, состоит из тех соединений формулы (I), к которым применимы одно или несколько следующих ограничений:a) каждый R5 независимо выбран из водорода, гидрокси, С 1-6 алкилокси, пиперазинила, Nметилпиперазинила, морфолинила, тиоморфолинила, имидазолила или триазолила;b) каждый R6 независимо выбран из гидрокси, С 1-6 алкилокси, амино или моно- или ди(С 1-6 алкил) амино, С 1-6 циклоалкиламино, пиперазинила, N-метилпиперазинила, морфолинила или тиоморфолинила;c) R4 представляет собой водород. Пятая группа соединений, представляющих интерес, состоит из тех соединений формулы (I), к которым применимы одно или несколько следующих ограничений:b) R1 представляет собой фенил или фенил, замещенный галогеном, С 1-6 алкилом, С 1-6 алкилокси, полигалогенС 1-6 алкилом или арилом;d) каждый R5 независимо выбран из водорода, гидрокси, С 1-6 алкилокси, С 1-6 алкилоксиС 1-6 алкилокси, С 1-6 алкилкарбонилокси, N-метилпиперазинила, морфолинила или имидазолила;e) каждый R6 независимо выбран из С 1-6 алкиламино, C1-6 циклоалкиламино, гидроксиС 1-6 алкиламино, ди(С 1-6 алкил)аминоС 1-6 алкиламино или морфолинила;g) R4 представляет собой водород или С 1-6 алкил. Шестая группа соединений, представляющих интерес, состоит из тех соединений формулы (I), к которым применимы одно или несколько следующих ограничений: а) каждый R6 независимо выбран из С 1-6 алкиламино, C1-6 циклоалкиламино, ди(С 1-6 алкил)аминоС 1-6 алкиламино или морфолинила. Седьмая группа соединений, представляющих интерес, состоит из тех соединений формулы (I), к которым применимы одно или несколько следующих ограничений:b) R1 представляет собой фенил или фенил, замещенный галогеном;d) каждый R5 независимо выбран из водорода, гидрокси, С 1-6 алкилокси или С 1-6 алкилкарбонилокси;g) R4 представляет собой водород. Группа предпочтительных соединений состоит из тех соединений формулы (I), в которых каждыйX представляет собой N, R1 представляет собой фенил или фенил, необязательно замещенный галогеном,С 1-6 алкилом, С 1-6 алкилокси, полигалогенС 1-6 алкилом или арилом; R2 представляет собой -CH2-R5 или-C(=O)-R6; каждый R5 независимо выбран из водорода, гидрокси, С 1-6 алкилокси, С 1-6 алкилоксиС 1-6 алкилокси, С 1-6 алкилкарбонилокси, N-метилпиперазинила, морфолинила или имидазолила; каждый R6 независимо выбран из С 1-6 алкиламино, C1-6 циклоалкиламино, гидроксиС 1-6 алкиламино, ди(С 1-6 алкил)аминоС 1-6 алкиламино или морфолинила; R3 представляет собой водород и R4 представляет собой водород или С 1-6 алкил. Еще одна группа предпочтительных соединений состоит из соединений формулы (I), в которых R2 представляет собой -CH2-R5, трифторметил, -C(=O)-R6 или -CH2-NR7R8. Еще одна группа предпочтительных соединений состоит из соединений формулы (I), в которых каждый X представляет собой N, R1 представляет собой фенил или фенил, замещенный галогеном; R2 представляет собой -CH2-R5; каждый R5 независимо выбран из водорода, гидрокси, С 1-6 алкилокси или С 1-6 алкилкарбонилокси; R3 представляет собой водород и R4 представляет собой водород. Наиболее предпочтительными соединениями являются соединение 1, соединение 8, соединение 11, соединение 9, соединение 33, соединение 34, соединение 7 и соединение 25.-5 011932 Соединения формулы (I), их фармацевтически приемлемые соли, их N-оксиды и стереохимически изомерные формы могут быть получены общепринятыми способами. Исходные вещества и некоторые промежуточные соединения представляют собой известные вещества, которые имеются в продаже или могут быть получены по традиционным методикам, обычно известным на предшествующем уровне техники. Некоторые препаративные способы будут более подробно описаны ниже. В примерах описаны другие способы для получения конечных продуктов формулы (I). а) Гидроксамовые кислоты формулы (I) могут быть получены взаимодействием промежуточного соединения формулы (II) с соответствующей кислотой, такой, например, как трифторуксусная кислота. Указанное взаимодействие осуществляют в соответствующем растворителе, таком, например, как метанол или дихлорметан.b) Промежуточные соединения формулы (II) могут быть получены взаимодействием промежуточного соединения формулы (III) с промежуточным соединением формулы (IV) в присутствии соответствующих реагентов, таких как моногидрохлорид N'-(этилкарбонимидоил)-N,N-диметил-1,3-пропандиамин(EDC) и 1-гидрокси-1 Н-бензотриазол (HOBT). Реакцию можно проводить в присутствии основания, такого как триэтиламин, в подходящем растворителе, таком как смесь дихлорметана и тетрагидрофурана. с) В альтернативном способе промежуточные соединения формулы (II), где R4 представляет собой водород, которые здесь называют промежуточные соединения формулы (II-а), могут быть получены в одну стадию взаимодействием промежуточного соединения формулы (XI) с 1,4-диоксан-2,5-диолом и соответствующей бороновой кислотой формулы (VII), где R1 такой, как определено выше, в подходящем растворителе, например спирте, таком как этанол.d) Промежуточные соединения формулы (III) могут быть получены взаимодействием промежуточного соединения формулы (V) с соответствующим кислым раствором, например раствором соляной кислоты, или основным раствором, например, бромида водорода или гидроксида натрия, в подходящем растворителе, например спирте, таком как этанол или пропанол. Настоящее изобретение также относится к соединениям формулы (V) их N-оксидным формам, их фармацевтически приемлемым кислотно-аддитивным солям, их стереохимически изомерным формам, где каждый X представляет собой независимо N или CH;R1 представляет собой фенил, нафталинил или гетероциклил; где каждый указанный фенил или нафталинил необязательно замещен одним или двумя заместителями, каждый из которых независимо выбран из галогена, С 1-6 алкила, С 1-6 алкокси, полигалогенС 1-6 алкила, арила, гидрокси, циано, амино, С 1-6 алкилкарбониламино, С 1-6 алкилсульфониламино, гидроксикарбонила, С 1-6 алкоксикарбонила, гидроксиС 1-6 алкила, С 1-6 алкилоксиметила, аминометила, С 1-6 алкиламинометила, С 1-6 алкилкарбониламинометила, С 1-6 алкилсульфониламинометила, аминосульфонила, С 1-6 алкиламиносульфонила или гетероциклила;R2 представляет собой водород, -CH2-R5, трифторметил, -C(=O)-R6 или -CH2-NR7R8; где каждый R5 независимо выбран из водорода, гидрокси, С 1-6 алкилокси, С 1-6 алкилоксиС 1-6 алкилокси, С 1-6 алкилкарбонилокси, пиперазинила, N-метилпиперазинила, морфолинила, тиоморфолинила, имидазолила или триазолила; каждый R6 независимо выбран из гидрокси, С 1-6 алкилокси, амино или моно- или ди(С 1-6 алкил)амино, C1-6 циклоалкиламино, гидроксиС 1-6 алкиламино, пиперазинила, моно- или ди(С 1-6 алкил)аминоС 1-6 алкиламино, N-метилпиперазинила, морфолинила или тиоморфолинила; каждый R7 и R8 независимо выбран из водорода, С 1-6 алкила, С 1-6 алкилкарбонила, С 1-6 алкилсульфонила или моно- или ди(С 1-4 алкил)аминосульфонила,R3 представляет собой водород, гидроксиметил, аминометил или моно- или ди(С 1-6 алкил)аминометил;R4 представляет собой водород или С 1-6 алкил; вышеуказанный арил представляет собой фенил или нафталинил, причем каждый указанный фенил или нафталинил необязательно замещен одним или двумя заместителями, каждый из которых независимо выбран из галогена, С 1-6 алкила, С 1-6 алкокси, трифторметила, циано или гидроксикарбонила; и вышеуказанный гетероциклил представляет собой фуранил, тиенил, пирролил, пирролинил, пирролидинил, диоксолил, оксазолил, тиазолил, имидазолил, имидазолинил, имидазолидинил, пиразолил, пиразолинил, пиразолидинил, изоксазолил, изотиазолил, оксадиазолил, триазолил, тиадиазолил, пиранил,пиридинил, пиперидинил, диоксанил, морфолинил, дитианил, тиоморфолинил, пиридазинил, пиримидинил, пиразинил, пиперазинил, триазинил, тритианил, индолизинил, индолил, индолинил, бензофуранил,бензотиофенил, индазолил, бензимидазолил, бензтиазолил, пуринил, хинолизинил, хинолинил, циннолинил, фталазинил, хиназолинил, хиноксалинил или нафтиридинил, где каждый из указанных гетероциклов необязательно замещен одним или двумя заместителями, каждый из которых независимо выбран из галогена, С 1-6 алкила, С 1-6 алкокси, циано, амино, моно- или ди(С 1-4 алкил)амино. Группы соединений, представляющих интерес, предпочтительных, более предпочтительных и самых предпочтительных соединений могут быть определены для соединений формулы (V) в соответствии с группами, определенными для соединений формулы (I). Новые промежуточные соединения (V) могут быть получены: а) превращением промежуточных соединений формулы (V), где R2 представляет собой -CH2OH и R4 представляет собой водород, которые здесь называют промежуточными соединениями формулы (V-a), в промежуточные соединения формулы (V), где R2 представляет собой заместитель, отличающийся от-CH2OH, которые здесь называют промежуточными соединениями формулы (V-b), по реакциям, известным в данной области техники, или путем трансформаций функциональных групп. Например, спирты формулы (V-a) можно превратить в амины, сложные и простые эфиры. Амины можно превратить в соответствующие амиды, а первичные амины можно превратить во вторичные и третичные амины.b) Новые промежуточные соединения формулы (V-a) могут быть получены в одну стадию взаимодействием промежуточного соединения формулы (VI) с 1,4-диоксан-2,5-диолом и соответствующей бороновой кислотой формулы (VII), где R1 такой, как определено выше, в подходящем растворителе, например в спирте, таком как этанол. с) Новые промежуточные соединения формулы (V-b) могут быть получены взаимодействием промежуточных соединений формулы (VI) с соответствующим кетоном формулы (VIII) в присутствии соответствующего реагента, такого как тетракис(этанолато)титан или боргидрид натрия, в подходящем растворителе, например в 1,2-дихлорэтане.d) Новые промежуточные соединения формулы (V), где R2 представляет собой -COOH, которые здесь называют соединениями формулы (V-c), могут быть получены в одну стадию взаимодействием промежуточных соединений формулы (VI) с 2-оксопропановой кислотой и соответствующей бороновой кислотой формулы (VII), где R1 такой, как определено выше, в подходящем растворителе, например 1,2 дихлорметане. Промежуточные соединения формулы (V-c), где R2 представляет собой -COOH, могут быть превращены в промежуточные соединения формулы (V), где R2 представляет собой -С(=O)-R6, используя реакции, известные в данной области техники, или путем трансформаций функциональных групп, например, превращением в амины и амиды. Промежуточные соединения формулы (XI) могут быть получены взаимодействием промежуточного Промежуточные соединения формулы (IX) могут быть получены взаимодействием промежуточного соединения формулы (X) с промежуточным соединением формулы (IV), в присутствии соответствующих реагентов, таких как моногидрохлорид N'-(этилкарбонимидоил)-N,N-диметил-1,3-пропандиамина (EDC) и 1-гидрокси-1 Н-бензотриазол (HOBT). Реакцию можно проводить в присутствии основания, такого как триэтиламин, в подходящем растворителе, таком как смесь дихлорметана и тетрагидрофурана. Промежуточные соединения формулы (X) могут быть получены взаимодействием промежуточного соединения формулы (VI) с промежуточным соединением формулы (XII) в присутствии гидроксида натрия в подходящем растворителе, таком как тетрагидрофуран, с последующей нейтрализацией соляной кислотой и прибавлением карбоната натрия. Соединения формулы (I) и некоторые промежуточные соединения могут содержать по меньшей мере один стереогенный центр в структуре. Указанный стереогенный центр может иметь R или S конфигурацию. Соединения формулы (I), полученные вышеописанными способами, обычно представляют собой рацемическую смесь энантиомеров, которые могут быть разделены с помощью следующих методик разделения, известных в данной области техники. Рацемические соединения формулы (I) могут быть превращены в соответствующие диастереомерные соли реакцией с подходящей хиральной кислотой. Указанные диастереомерные соли затем разделяют, например, селективной или фракционной кристаллизацией, а энантиомеры выделяют действием щелочей. Альтернативный способ разделения энантиомерных форм соединения формулы (I) заключается в применении жидкостной хроматографии с хиральной неподвижной фазой. Указанные стереохимически чистые изомерные формы можно также получить из соответствующих стереохимически чистых изомерных форм подходящих исходных веществ, при условии,что реакция происходит стереоспецифически. Если требуется конкретный стереоизомер, предпочтительно синтезировать указанное соединение стереоспецифическими способами. В указанных способах будет выгодно применять энантиомерно чистые исходные вещества. Соединения формулы (I), их фармацевтически приемлемые кислотно-аддитивные соли и их стереоизомерные формы обладают ценными фармакологическими свойствами, заключающимися в том, что они оказывают ингибирующее действие на гистондеацетилазу (HDAC). Рассматриваемое изобретение относится к способу ингибирования аномального роста клеток,включая рост трансформированных клеток, путем введения эффективного количества соединения по изобретению. Аномальным ростом клеток называют рост клеток, который не зависит от нормальных регуляторных механизмов (например, ингибирование из-за нарушения контакта). Изобретение включает как непосредственное ингибирование роста опухолей, которое вызывает остановку роста, терминальную-9 011932 дифференцировку и/или апоптоз раковых клеток, так и косвенное ингибирование путем неоваскуляризации опухолей. Настоящее изобретение также относится к способу ингибирования роста опухолей введением эффективного количества соединения по настоящему изобретению субъекту, например млекопитающему(и более конкретно, человеку), которому требуется такое лечение. Конкретно, изобретение относится к способу ингибирования роста опухолей введением эффективного количества соединения по настоящему изобретению. Примерами опухолей, рост которых может быть ингибирован, являются, но не ограничены ими, рак легких (например, аденокарцинома и немелкоклеточная карцинома легкого), рак поджелудочной железы (например, карцинома поджелудочной железы, такая как, например, экзокринная карцинома поджелудочной железы), разновидности рака толстой кишки (например, колоректальные карциномы,такие как, например, аденокарцинома толстой кишки и аденома толстой кишки), рак предстательной железы, включая позднюю стадию заболевания, опухоли кроветворных органов лимфоидного происхождения (например, острый лимфолейкоз, В-клеточная лимфома, лимфома Беркитта), миелоидные лейкемии(например, острый миелобластный лейкоз (AML), фолликулярный рак щитовидной железы, миелодиспластический синдром (MDS), опухоли мезенхимального происхождения (например, фибросаркомы и рабдомиосаркомы), меланомы, тератокарциномы, нейробластомы, глиомы, доброкачественные опухоли кожи (например, кератоакантома), карцинома молочной железы (например, запущенный рак молочной железы), карцинома почек, карцинома яичника, карцинома мочевого пузыря и эпидермальная карцинома. Соединение по изобретению можно применять и для других лечебных целей, например, дляa) повышения чувствительности опухолей к радиотерапии путем введения соединения по изобретению перед облучением опухоли для лечения рака, во время облучения или после него;b) лечения артропатий и остеопатологических состояний, таких как ревматоидный артрит, остеоартрит, ювенильный артрит, подагра, полиартрит, псориатический артрит, анкилозирующий спондилоартрит и системная эритематозная волчанка;c) ингибирования пролиферации клеток гладких мышц, включая сосудистые пролиферативные нарушения, атеросклероз и рестеноз;d) лечения воспалительных состояний и кожных заболеваний, таких как язвенный колит, болезнь Крона, аллергический ринит, реакция "трансплантат против хозяина", конъюктивит, астма, ARDS (синдром острой дыхательной недостаточности), болезнь Бехчета, отторжение трансплантата, инфекция мочевых путей, аллергический дерматит, очаговая алопеция, склеродермия, экзантема, экзема, дерматомиозит, акне, диабет, системная красная волчанка, синдром Кавасаки, множественный склероз, эмфизема,муковисцидоз и хронический бронхит;e) лечения эндометриоза, фиброзов матки, дисфункционального маточного кровотечения и эндометриальной гиперплазии;f) лечения глазной васкуляризации, включающей васкулопатию, влияющую на сетчатку и хориоидальные сосуды;n) ингибирования нейромышечной патологии, например бокового амиотрофического склероза; о) лечения спинальной мышечной атрофии; р) лечения других патологических состояний, подлежащих лечению путем усиления экспрессии гена;s) лечения паразитарных заболеваний, таких как малярия. Следовательно, в настоящем изобретении описаны соединения формулы (I) для применения в качестве лекарственного средства, а также применение указанных соединений формулы (I) для производства лекарственного препарата для лечения одного или нескольких вышеупомянутых заболеваний. Соединения формулы (I), их фармацевтически приемлемые кислотно-аддитивные соли и их стереоизомерные формы могут обладать ценными диагностическими свойствами, поэтому их можно применять для детектирования и идентификации HDAC в биологическом образце, включая детектирование или измерение образования комплекса между меченым соединением и HDAC. В методах детектирования или идентификации можно использовать меченые соединения, которые- 10011932 получают действием агентов для введения метки, таких как радиоизотопы, ферменты, флуоресцентные вещества, люминесцирующие вещества и т.п. Примеры радиоизотопов включают 125I, 131I, 3H и 14C. Ферменты обычно делают определимыми путем конъюгирования соответствующего субстрата, который, в свою очередь, катализирует детектируемую реакцию. Примеры ферментов включают, например, бетагалактозидазу, бета-глюкозидазу, щелочную фосфатазу, пероксидазу и малатдегидрогеназу, предпочтительно пероксидазу хрена. Люминесцирующие вещества включают, например, люминал, производные люминала, люциферин, экворин и люциферазу. Биологические образцы можно определить как ткани организма или жидкости организма. Примерами жидкостей организма являются спинно-мозговая жидкость, кровь, плазма, сыворотка, моча, мокрота, слюна и т.п. Ввиду их полезных фармакологических свойств рассматриваемые соединения могут быть включены в состав различных фармацевтических форм, предназначенных для введения. Для получения фармацевтических композиций по настоящему изобретению эффективное количество конкретного соединения в виде кислотно-аддитивной или основно-аддитивной соли в качестве активного ингредиента объединяют с фармацевтически приемлемым носителем, причем носитель может быть разнообразных видов, в зависимости от формы препарата, который требуется для введения. Указанные фармацевтические композиции желательно получать в стандартной лекарственной форме, подходящей для введения перорально, ректально, чрескожно или путем парентеральной инъекции. Например, при получении композиций в виде лекарственной формы для перорального введения можно использовать любую из обычных фармацевтических сред, например воду, гликоли, масла, спирты и т.п., в случае жидких препаратов для перорального введения, такие как суспензии, сиропы, эликсиры и растворы; или твердые носители, такие как крахмалы, сахара, каолин, вещества, способствующие скольжению, связующие, разрыхлители и т.п., в случае порошков, пилюль, капсул и таблеток. Благодаря легкости введения, таблетки и капсулы представляют собой наиболее выгодную стандартную лекарственную форму для перорального введения, в случае которой несомненно используют твердые фармацевтические носители. Носитель в композициях для парентерального введения обычно содержит стерильную воду, по меньшей мере в основном воду, хотя могут быть включены и другие ингредиенты, например, способствующие повышению растворимости. Возможно получение растворов для инъекций, в которых носитель содержит, например, физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Возможно также получение суспензий для инъекций, в случае которых могут быть использованы соответствующие жидкие носители, суспендирующие средства и т.п. В композициях, подходящих для подкожного введения, носитель необязательно содержит вещество, способствующее проникновению, и/или подходящее увлажняющее средство, необязательно объединенные с подходящими добавками любой природы в незначительной дозировке, причем добавки не оказывают вредного действия на кожу. Указанные добавки могут способствовать введению через кожу и/или могут быть полезны для приготовления нужных композиций. Указанные композиции можно вводить различными путями, например, в виде трансдермального пластыря, spot-on или мази. Особенно выгодно для удобства введения и дозировки составлять вышеупомянутые фармацевтические композиции в виде стандартной лекарственной формы. В описании и формуле изобретения настоящей заявки термин стандартная лекарственная форма относится к физически изолированным единицам,подходящим в качестве однократных доз, причем каждая единица содержит заданное количество активного ингредиента, рассчитанного для получения требуемого лечебного эффекта, вместе с необходимым фармацевтическим носителем. Примерами таких стандартных лекарственных форм являются таблетки(включая делимые таблетки и таблетки с покрытием), капсулы, пилюли, пакеты с порошком, облатки,растворы или суспензии для инъекций, формы для введения столовыми или чайными ложками и им подобные и разнообразные сложные формы. Специалисты в данной области техники могут легко определить эффективное количество по результатам испытаний, представленным ниже. Обычно считается, что терапевтически эффективное количество составляет от 0,005 до 100 мг/кг массы тела и конкретно от 0,005 до 10 мг/кг массы тела. Возможно, целесообразно вводить необходимую дозу в виде двух, трех, четырех или более субдоз через соответствующие интервалы времени в течение дня. Указанные субдозы могут быть изготовлены в виде стандартных лекарственных форм, например, содержащих 0,5-500 мг и конкретно 10-500 мг активного ингредиента на единицу лекарственной формы. В качестве еще одного объекта настоящего изобретения рассматривают комбинацию ингибитораHDAC с еще одним противораковым средством, особенно для применения в качестве лекарственного препарата, более конкретно для лечения рака или родственных заболеваний. Для лечения вышеуказанных заболеваний соединения по изобретению можно с пользой применять в сочетании с одним или несколькими лекарственными средствами, более конкретно с другими противораковыми средствами. Примерами противораковых средств являются координационные соединения платины, например цисплатин, карбоплатин или оксалиплатин; соединения таксана, например паклитаксел или доксетаксел; ингибиторы топоизомеразы I, такие как соединения камптотецина, например иринотекан или топотекан;- 11011932 ингибиторы топоизомеразы II, такие как производные противоопухолевого средства подофиллотоксина, например этопозид или тенипозид; противоопухолевые винкаалкалоиды, например винбластин, винкристин или винорелбин; противоопухолевые производные нуклеозидов, например 5-фторурацил, гемцитабин или капецитабин; алкилирующие агенты, такие как нитроиприт или нитрозомочевина, например циклофосфамид,хлорамбуцил, кармустин или ломустин; противоопухолевые производные антрациклина, например даунорубицин, доксорубицин, идарубицин или митоксантрон; антитела HER2, например трастузумаб; антагонисты эстрогеновых рецепторов или селективные модуляторы эстрогеновых рецепторов, например тамоксифен, торемифен, дролоксифен, фаслодекс или ралоксифен; ингибиторы ароматазы, такие как экземестан, анастрозол, летразол и ворозол; дифференцировочные агенты, такие как ретиноиды, витамин D и блокаторы метаболизма ретиноевой кислоты (RAMBA), например аккутан; ингибиторы ДНК метилтрансферазы, например азатидин; ингибиторы киназы, например флавоперидол, мезилат иматиниба или гефитиниб; ингибиторы фарнезилтрансферазы; другие ингибиторы HDAC; ингибиторы пути убиквитин-протеасом, например Велкад; илиYondelis. Термин "координационное соединение платины" используют здесь для обозначения любого координационного соединения платины, ингибирующего рост опухолевых клеток, которое предоставляет платину в виде иона. Термин "соединения таксана" указывает на класс соединений, содержащих циклическую систему таксана и имеющих отношение к экстрактам некоторых видов тисового дерева (Taxus) или извлеченным из них. Термин "ингибиторы топоизомеразы" применяют для обозначения ферментов, которые способны изменять топологию ДНК в эукариотических клетках. Они являются крайне необходимыми для важных клеточных функций и пролиферации клеток. В эукариотических клетках существует два типа топоизомераз, которые называются топоизомеразами типа I и типа II. Топоизомераза типа I представляет собой мономерный фермент, молекулярная масса которого составляет приблизительно 100000. Указанный фермент связывает ДНК и вводит транзиторный однониточный разрыв, развертывает двойную спираль(или позволяет ей развернуться) и затем вновь ликвидирует разрыв перед диссоциацией из нитей ДНК. Топоизомераза II имеет аналогичный механизм действия, который заключается во введении разрывов нитей ДНК или образовании свободных радикалов. Термин "соединения камптотецина" используется для обозначения соединений, родственных исходному соединению камптотецину или являющихся его производными, камптотецин представляет собой не растворимый в воде алкалоид, извлекаемый из китайского дерева Camptothecin acuminata и индийского дерева Nothapodytes foetida. Термин "соединения подофиллотоксина" используют для обозначения соединений, родственных исходному подофиллотоксину (который извлекают из растения мандрагоры), или являющихся его производными. Термин "противоопухолевые винкаалкалоиды" используют для обозначения соединений, родственных соединениям, извлекаемым из экстрактов растения барвинок (Vinca rosea), или являющихся их производными. Термин "алкилирующие агенты" относится к группе различных химикатов, общим свойством которых является способность вводить алкильные группы в биологически жизненно важные макромолекулы,такие как ДНК, в физиологических условиях. Большая часть наиболее важных алкилирующих агентов,таких как нитроиприт и нитрозомочевины, генерирует активные алкилирующие остатки in vivo после сложных реакций разложения, некоторые из которых являются ферментативными. Наиболее важными фармакологическими эффектами алкилирующих агентов являются эффекты, которые нарушают основные механизмы, связанные с пролиферацией клеток, в частности, механизмы синтеза ДНК и деления клеток. Способность алкилирующих агентов нарушать функцию ДНК и целостность в быстропролиферирующих тканях создает основу для их применения в терапии и для многих их токсических свойств. Термин "противоопухолевые производные антрациклина" включает антибиотики, полученные из гриба Strep, peuticus var. caesius и их производные, отличающиеся тем, что в их структуре содержится тетрациклиновый цикл, соединенный гликозидной связью с необычным сахаром, даунозамином. Показано, что амплификация белка 2 рецепторов человеческого эпидермального фактора роста(HER2) в первичных карциномах молочной железы коррелирует с плохим клиническим прогнозом для некоторых больных. Трастузумаб представляет собой рекомбинантное гуманизированное моноклональ- 12011932 ное ДНК-производное IgG1 каппа-антитело высокой очистки, которое связывается внеклеточным доменом рецептора HER2 с высокой аффинностью и специфичностью. Многие виды рака молочной железы обладают эстрогенными рецепторами и рост указанных опухолей может быть стимулирован эстрогеном. Термины "антагонисты эстрогеновых рецепторов" и "селективные модуляторы эстрогеновых рецепторов" используют для обозначения конкурирующих ингибиторов связывания эстродиола с эстрогеновым рецептором (ER). Селективные модуляторы эстрогеновых рецепторов при связывании с ER, вызывают изменение пространственной формы рецептора, модулируя его связывание с эстрогенчувствительным элементом (ERE) на ДНК. У женщин в постменопаузе основным источником циркулирующего эстрогена является превращение адренальных и овариальных андрогенов (андростендиона и тестостерона) в эстрогены (эстрон и эстрадиол) под действием фермента ароматазы в периферических органах. Депривация эстрогена в результате ингибирования или инактивации ароматазы представляет собой эффективное и селективное лечение гормонозависимого рака молочной железы для некоторых больных в периоде постменопаузы. Термин "антиэстрогенный агент" используют здесь для обозначения не только антагонистов эстрогеновых рецепторов и селективных модуляторов эстрогеновых рецепторов, но также и ингибиторов ароматазы, как обсуждалось выше. Термин "дифференцировочные агенты" охватывает соединения, которые могут различными путями ингибировать пролиферацию клеток и индуцировать дифференцировку. Как известно, витамин D и ретиноиды играют главную роль в регуляции роста и дифференцировке множества типов нормальных и злокачественных клеток. Блокаторы метаболизма ретиноевой кислоты (RAMBA) увеличивают уровни эндогенных ретиноевых кислот, ингибируя катаболизм ретиноевых кислот, индуцированный цитохромом Р 450. Изменения в метилировании ДНК относятся к наиболее распространенным аномалиям в неоплазме человека. Гиперметилирование в промоторах выбранных генов обычно связано с инактивацией участвующих генов. Термин "ингибиторы ДНК метилтрансферазы" используется для обозначения соединений, которые действуют через фармакологическое ингибирование ДНК метилтрансферазы и повторную активацию экспрессии гена-супрессора опухолей. Термин "ингибиторы киназы" включает сильные ингибиторы киназ, которые участвуют в прогрессии клеточного цикла и запрограммированной гибели клеток (апоптоз). Термин "ингибиторы фарнезилтрансферазы" используют для обозначения соединений, которые предназначены для того, чтобы предотвратить фарнезилирование Ras и других внутриклеточных белков. Показано, что они оказывают действие на пролиферацию злокачественных клеток и выживаемость. Термин "другие ингибиторы HDAC" включает, но не ограничивается перечисленными ниже,карбоксилаты, например бутират, коричную кислоту, 4-фенилбутират или валпроевую кислоту; гидроксамовые кислоты, например субероиланилид гидроксамовой кислоты (SAHA),аналоги SAHA, содержащие пиперазин, биарилгидроксамат A-161906 и его карбозолиловый простой эфир, тетрагидропиридиновый и тетралоновый аналоги, бициклические арил-N-гидроксикарбоксамиды, пироксамид, CG-1521, PXD-101, сульфонамид гидроксамовой кислоты, LAQ-824, LBH-589,трихостатин A (TSA), оксамфлатин, скриптаид, родственные скриптаиду трициклические молекулы, мкарбоксикоричную кислоту, бисгидроксамовую кислоту (CBHA), гидроксамовые кислоты, подобныеCBHA, трапоксиновый аналог гидроксамовой кислоты, R306465 и родственные бензоил- и гетероарилгидроксамовые кислоты, аминосубераты и малонилдиамиды; циклические тетрапептиды, например трапоксин, апидицин, депсипептид, соединения, родственные спирухостатину, RedFK-228, сульфгидрилсодержащие циклические тетрапептиды (SCOP), циклические тетрапептиды, содержащие гидроксамовую кислоту (CHAP), TAN-174s и азумамиды; бензамиды, например MS-275 или CI-994, или депудецин. Термин "ингибиторы цикла убиквитин-протеасома" используют для идентификации соединений,которые ингибируют целенаправленное разрушение клеточных белков в протеасоме, включая регуляторные белки клеточного цикла. Для лечения рака соединения по настоящему изобретению можно вводить больному, как описано выше, в сочетании с облучением. Облучение подразумевает применение ионизирующего излучения,конкретно гамма-излучения, главным образом излучения, испускаемого линейными ускорителями или радионуклидами, широко используемыми в настоящее время. Облучение опухоли радионуклидами может быть наружным или внутренним. Настоящее изобретение также относится к комбинации по изобретению противоракового средства и ингибитора HDAC по изобретению. Настоящее изобретение также относится к комбинации по изобретению для применения в лекарственной терапии, например для ингибирования роста опухолевых клеток. Настоящее изобретение также относится к комбинации по изобретению для ингибирования роста опухолевых клеток. Настоящее изобретение также относится к способу ингибирования аномального роста опухолевых- 13011932 клеток у испытуемого субъекта (человека), который включает введение субъекту эффективного количества комбинации по изобретению. Кроме того, настоящее изобретение относится к способу ингибирования аномального роста клеток,включающих трансформированные клетки, путем введения эффективного количества комбинации по изобретению. Ингибитор HDAC и еще одно лекарственное средство можно вводить одновременно (например, в виде отдельных композиций или в виде единой композиции) или последовательно в любом порядке. В последнем случае два соединения должны вводиться в течение того периода времени, в таком количестве и таким способом, при которых достигается предпочтительный или синергистический эффект. Следует понимать, что предпочтительные способ и порядок введения и соответствующие дозы и схемы лечения для каждого компонента комбинации будут зависеть от вводимых конкретных соединений - ингибитора HDAC и лекарственного средства, конкретного пути их введения, конкретной опухоли, подлежащей лечению, и конкретного хозяина, подлежащего лечению. Специалисты в данной области техники могут легко определить оптимальные способ и порядок введения, дозировку и схему лечения, используя общепринятые методы и имея в виду информацию, изложенную в данной заявке. Координационные соединения платины эффективно вводят в дозе, составляющей 1-500 мг на квадратный метр (мг/м 2) площади поверхности тела, например 50-400 мг/м 2, конкретно доза для цисплатина составляет около 75 мг/м 2, а доза для карбоплатина составляет около 300 мг/м 2 на курс лечения. Соединение таксана эффективно вводят в дозе, составляющей 50-400 мг на квадратный метр (мг/м 2) площади поверхности тела, например 75-250 мг/м 2, конкретно доза для паклитакселя составляет около 175-250 мг/м 2, а доза для доцетакселя составляет около 75-150 мг/м 2 на курс лечения. Соединение камптотецина эффективно вводят в дозе, составляющей 0,1-400 мг на квадратный метр(мг/м 2) площади поверхности тела, например 1-300 мг/м 2, конкретно доза иринотекана составляет около 100-350 мг/м 2, а доза топотекана составляет около 1-2 мг/м 2 на курс лечения. Производное подофиллотоксина с противоопухолевой активностью эффективно вводят в дозе, составляющей 30-300 мг на квадратный метр (мг/м 2) площади поверхности тела, например 50-250 мг/м 2,конкретно доза этопозида составляет около 35-100 мг/м 2, а доза тенипозида составляет около 50-250 мг/м 2 на курс лечения. Винкаалкалоиды с противоопухолевой активностью эффективно вводят в дозе, составляющей 2-30 мг на квадратный метр (мг/м 2) площади поверхности тела, конкретно доза винбластина составляет около 3-12 мг/м 2, доза винкристина составляет около 1-2 мг/м 2 и доза винорелбина составляет около 10-30 мг/м 2 на курс лечения. Производные нуклеозидов с противоопухолевой активностью эффективно вводят в дозе, составляющей 200-2500 мг на квадратный метр (мг/м 2) площади поверхности тела, например 700-1500 мг/м 2,конкретно доза 5-FU составляет около 200-500 мг/м 2, доза гемцитабина составляет около 800-1200 мг/м 2 и доза капецитабина составляет около 1000-2500 мг/м 2 на курс лечения. Алкилирующие агенты, такие как нитроиприт или нитрозомочевина, эффективно вводят в дозе, составляющей 100-500 мг на квадратный метр (мг/м 2) площади поверхности тела, например 120-200 мг/м 2,конкретно доза для циклофосфамида составляет около 100-500 мг/м 2, доза для хлорамбуцила составляет около 0,1-0,2 мг/м 2, доза для кармустина составляет около 150-200 мг/м 2 и доза для ломустина составляет около 100-150 мг/м 2 на курс лечения. Производные антрациклина с противоопухолевой активностью эффективно вводят в дозе, составляющей 10-75 мг на квадратный метр (мг/м 2) площади поверхности тела, например 15-60 мг/м 2, конкретно доза для доксорубицина составляет около 40-75 мг/м 2, доза для даунорубицина составляет около 2545 мг/м 2 и доза идарубицина составляет около 10-15 мг/м 2 на курс лечения. Трастузумаб эффективно вводят в дозе, составляющей 1-5 мг на квадратный метр (мг/м 2) площади поверхности тела, конкретно 2-4 мг/м 2 на курс лечения. Антиэстрогенный агент эффективно вводят в дозе, составляющей 1-100 мг ежедневно в зависимости от конкретного агента и заболевания, которое лечат. Тамоксифен эффективно вводят перорально в дозе, составляющей 5-50 мг, предпочтительно 10-20 мг два раза в день, продолжая лечение в течение времени, достаточного для достижения и сохранения терапевтического эффекта. Торемифен эффективно вводят перорально в дозе, составляющей около 60 мг один раз в день, продолжая лечение в течение времени, достаточного для достижения и сохранения терапевтического эффекта. Анастрозол эффективно вводят перорально в дозе, составляющей 1 мг один раз в день. Дролоксифен эффективно вводят перорально в дозе, составляющей около 20-100 мг один раз в день. Ралоксифен эффективно вводят перорально в дозе, составляющей около 60 мг один раз в день. Экземестан эффективно вводят перорально в дозе,составляющей около 25 мг один раз в день. Указанные дозы можно вводить, например, один раз, два раза или больше за курс лечения, который можно повторять, например, каждые 7, 14, 21 или 28 дней. Благодаря их полезным фармакологическим свойствам компоненты комбинаций по изобретению,т.е. ингибитор HDAC и другое лекарственное средство, могут входить в состав различных фармацевтических форм, предназначенных для введения. Указанные компоненты могут по отдельности входить в- 14011932 состав индивидуальных фармацевтических композиций или в состав единой фармацевтической композиции, содержащей оба компонента. Поэтому настоящее изобретение также относится к фармацевтической композиции, содержащей ингибитор HDAC и другое лекарственное средство вместе с одним или несколькими фармацевтическими носителями. Настоящее изобретение также относится к комбинации в форме фармацевтической композиции,включающей противораковый агент и HDAC-ингибитор в соответствии с изобретением вместе с одним или несколькими фармацевтически приемлемыми носителями. Настоящее изобретение, кроме того, также относится к применению комбинации по изобретению в производстве фармацевтической композиции для ингибирования роста опухолевых клеток. Кроме того, настоящее изобретение относится к продукту, содержащему в качестве первого активного ингредиента ингибитор HDAC по изобретению и в качестве второго активного ингредиента противораковое средство, в виде комбинированного препарата для одновременного, раздельного или последовательного применения в лечении больных, страдающих раком. Экспериментальная часть Нижеследующие примеры приведены для иллюстрации. Сокращение "EDC" обозначает моногидрохлорид N'-(этилкарбонимилоил)-N,N-диметил-1,3 пропандиамина, сокращение "DCM" обозначает дихлорметан, "DIPE" обозначает простой диизопропиловый эфир, "ДМФА" обозначает NN-диметилформамид, "EtOAc" обозначает этилацетат, "EtOH" обозначает этанол, "HOBT" обозначает 1-гидрокси-1 Н-бензотиазол, "MeOH" обозначает метанол, "ТФУ" обозначает трифторуксусную кислоту и "ТГФ" обозначает тетрагидрофуран. А. Получение промежуточных соединений. Пример A1. а) Получение промежуточного соединения 1 Смесь этилового эфира 2-(1-пиперазинил)-5-пиримидинкарбоновой кислоты (0,016 моль), (2 фенилэтенил)бороновой кислоты (0,016 моль) и 1,4-диоксан-2,5-диола (0,016 моль) в EtOH (250 мл) перемешивают в течение 2 дней при комнатной температуре и затем растворитель выпаривают в вакууме. Остаток помещают в DCM и воду, органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток очищают колоночной хроматографией на силикагеле (15-40 мкм) (элюент: смесь DCM/MeOH 97/1). Чистые фракции упаривают, получая 4 г (61%) промежуточного соединения 1,т.пл. 128 С. Сложные эфиры, соответствующие промежуточному соединению 1, могут быть разделены хиральной хроматографией.b) Получение промежуточного соединения 2 Смесь промежуточного соединения 1 (0,0007 моль) в 1 н. растворе гидроксида натрия (10 мл) и ТГФ(20 мл) перемешивают при комнатной температуре в течение 48 ч. Добавляют 1 н. соляную кислоту (10 мл). Растворитель выпаривают, осадок отфильтровывают, промывают водой, затем DIPE и сушат, получая 0,2 г (72%) промежуточного соединения 2, т.пл. 232 С. с) Получение промежуточного соединения 3(0,00593 моль) добавляют к смеси промежуточного соединения 2 (0,00395 моль) в смеси DCM (70 мл) и ТГФ (70 мл), затем реакционную смесь перемешивают в течение 3 дней при комнатной температуре. Добавляют H2O. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток очищают колоночной хроматографией (градиент элюирования: DCM/MeOH/NH4OH 97/3/0,1). Фракции продукта собирают, выпаривают органический растворитель и получают 1,5 г (84%) промежуточного соединения 3. Пример А 2. а) Получение промежуточного соединения 4 Смесь этилового эфира 2-(1-пиперазинил)-5-пиримидинкарбоновой кислоты (0,0042 моль), 1,4 диоксан-2,5-диола (0,0042 моль) и (E)-[2-(4-хлорфенил)этенил]бороновой кислоты (0,0042 моль) в EtOH(100 мл) перемешивают при комнатной температуре в течение 72 ч, выливают в воду и экстрагируют(1,8 г) очищают колоночной хроматографией на силикагеле (15-40 мкм) (элюент: смесьDCM/MeOH/NH4OH 97/3/0,1). Две фракции собирают и выпаривают растворитель, получая 0,85 г F1(масло) и 0,25 г F2 (общий выход: 63%). F1 кристаллизуют из смеси 2-пропанон/DIPE. Осадок отфильтровывают и сушат, получая 0,6 г промежуточного соединения 4, т.пл. 110C.b) Получение промежуточного соединения 5 Метансульфонилхлорид (0,0012 моль) при 5 С добавляют к раствору промежуточного соединения 4(0,0006 моль) и триэтиламина (0,0024 моль) в ТГФ (15 мл) в токе N2. Температуру смеси доводят до комнатной, затем перемешивают в течение 1 ч и выливают в ледяную воду. Смесь экстрагируют DCM. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель, получая 0,3 г промежуточного соединения 5. Полученный продукт сразу же используют на следующей стадии реакции. с) Получение промежуточного соединения 6 Смесь промежуточного соединения 5 (0,0006 моль), морфолина (0,0009 моль) и карбоната калия(0,0018 моль) в ацетонитриле (30 мл) перемешивают при 80C в течение 15 ч, выливают в воду и экстрагируют DCM. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток (0,27 г) очищают колоночной хроматографией на силикагеле (5 мкм) (элюент: смесьDCM/MeOH от 100/0 до 90/10). Чистые фракции собирают и выпаривают растворитель, получая 0,085 гd) Получение промежуточного соединения 7 Смесь промежуточного соединения 6 (0,0002 моль) в 1 н. растворе гидроксида натрия (1,5 мл) и ТГФ (3 мл) перемешивают при комнатной температуре в течение 72 ч. Добавляют 1 н. соляную кислоту(1,5 мл). Смесь упаривают досуха, получая промежуточное соединение 7. Полученный продукт сразу же используют на следующей стадии реакции. е) Получение промежуточного соединения 8 Смесь промежуточного соединения 7 (0,0002 моль), O-(тетрагидро-2 Н-пиран-2-ил)гидроксиламина(10 мл) перемешивают при комнатной температуре в течение 48 ч, выливают в воду и экстрагируют(0,095 г) очищают колоночной хроматографией на силикагеле (5 мкм) (элюент: смесь(41%) промежуточного соединения 8. Пример A3. а) Получение промежуточного соединения 11 Этилат титана (0,0085 моль) добавляют при комнатной температуре к раствору этилового эфира 2(1-пиперазинил)-5-пиримидинкарбоновой кислоты (0,0042 моль) и 4-фенил-3-бутен-2-она (0,0051 моль) в 1,2-дихлорэтане (45 мл) в токе N2. Смесь перемешивают при комнатной температуре в течение 24 ч. Добавляют NaBH(OAc)3 (0,0085 моль). Полученную смесь перемешивают в течение 5 ч, выливают в ледяную воду. Добавляют DCM. Смесь фильтруют через целит. Органический слой отделяют, сушат(MgSO4), фильтруют и растворитель выпаривают. Остаток (1,16 г) очищают колоночной хроматографией на кромасиле (5 мкм) (элюент: смесь DCM/MeOH от 100/0 до 95/5). Чистые фракции собирают и растворитель выпаривают, получая 0,12 г (8%) промежуточного соединения 11.b) Получение промежуточного соединения 12 Смесь промежуточного соединения 11 (0,0003 моль) и гидроксида натрия (0,0013 моль) в EtOH (15 мл) перемешивают и кипятят с обратным холодильником в течение 3 ч, затем охлаждают до комнатной температуры и упаривают досуха. Остаток смешивают с простым диэтиловым эфиром. Осадок отфильтровывают и сушат, получая 0,12 г (100%) промежуточного соединения 12, т.пл. 260 С. с) Получение промежуточного соединения 13EDC (0,0006 моль) и HOBT (0,0006 моль) добавляют при комнатной температуре к раствору промежуточного соединения 12 (0,0003 моль) в ТГФ (15 мл) и DCM (15 мл) в токе N2. Смесь перемешивают- 17011932 в течение 15 мин. Добавляют О-(тетрагидро-2 Н-пиран-2-ил)гидроксиламин (0,0006 моль). Смесь перемешивают при комнатной температуре в течение 48 ч, выливают в ледяную воду и экстрагируют DCM. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток (0,25 г) очищают колоночной хроматографией на кромасиле (5 мкм) (элюент: смесь DCM/MeOH от 100/0 до 95/5). Чистые фракции собирают и растворитель выпаривают, получая 0,1 г (70%) промежуточного соединения 13. Пример А 4. а) Получение промежуточного соединения 14 Смесь этилового эфира 2-(1-пиперазинил)-5-пиримидинкарбоновой кислоты (0,059 моль) в ТГФ(300 мл) и 1 н. раствора гидроксида натрия (300 мл) оставляют на ночь при комнатной температуре и затем перемешивают. Добавляют 1 н. соляную кислоту (300 мл) и смесь перемешивают в течение 10 мин. Добавляют карбонат натрия (0,178 моль) и полученную смесь перемешивают в течение 10 мин при комнатной температуре, затем небольшими порциями добавляют 1-(9H-флуорен-9-илметокси)карбонил]окси]-2,5-пирролидиндион (0,059 моль) и реакционную смесь перемешивают при комнатной температуре в течение 15 ч. Смесь подкисляют концентрированной HCl, осадок отфильтровывают и сушат (в вакууме), получая 22,5 г (90%) промежуточного соединения 14, т.пл. 218,5-221,2 С.b) Получение промежуточного соединения 15 К смеси промежуточного соединения 14 (0,0233 моль) в DCM/ТГФ (500 мл) добавляют триэтиламин (0,069 моль), затем EDC (0,0303 моль) и HOBT (0,0303 моль), затем добавляют O-(тетрагидро-2 Нпиран-2-ил)гидроксиламин (0,0303 моль) и реакционную смесь перемешивают при комнатной температуре в течение 18 ч. Смесь разбавляют DCM и промывают водой. Органический слой отделяют и промывают 10% раствором карбоната натрия. Отделенный органический слой сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток очищают флэш-хроматографией на колонке (элюент: смесьDCM/MeOH от 100/0 до 97,5/2,5 через 100 мин). Фракции продукта собирают, растворитель выпаривают,получая 8,4 г (68%) промежуточного соединения 15. с) Получение промежуточного соединения 16 Смесь промежуточного соединения 15 (0,016 моль) в пиридине (0,040 моль) и DCM (200 мл) перемешивают в течение ночи при комнатной температуре и реакционную смесь экстрагируют водой, затем водный слой концентрируют и выпаривают совместно с ацетонитрилом. Остаток (3,5 г) очищают флэшхроматографией на колонке (элюент: смесь DCM/MeOH/NH3, 95/5/0,5). Фракции продукта собирают,растворитель выпаривают, получая 2,5 г (50%) промежуточного соединения 16, т.пл. 70,8-93,9C.d) Получение промежуточного соединения 17 Смесь промежуточного соединения 16 (0,002 моль), (E)-[2-(4-фторфенил)этенил]бороновой кислоты (0,002 моль) и 1,4-диоксан-2,5-диола (0,002 моль) в EtOH (25 мл) перемешивают при комнатной температуре в течение 15 ч и выливают на лед. Добавляют NaHCO3. Смесь экстрагируют DCM. Органиче- 18011932 ский слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток (0,68 г) очищают флэш-хроматографией на колонке на кромасиле (5 мкм) (элюент: смесь DCM/MeOH от 100/0 до 90/10). Чистые фракции собирают и выпаривают растворитель, получая 0,27 г (29%) промежуточного соединения 17, т.пл. 90C. Пример А 5. а) Получение промежуточного соединения 18 К раствору [2-(4-фторфенил)этенил]бороновой кислоты (0,0169 моль) в DCM (150 мл) добавляют 2 оксопропановую кислоту (0,0169 моль), затем этиловый эфир 2-(1-пиперазинил)-5-пиримидинкарбоновой кислоты (0,0169 моль). Смесь перемешивают при комнатной температуре в течение 15 ч. Добавляют 2-оксопропановую кислоту (0,4 экв.) и [2-(4-фторфенил)этенил]бороновую кислоту (0,1 экв.). Смесь перемешивают при комнатной температуре в течение 15 ч. Органический слой промывают водой,сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток (7,7 г) очищают колоночной хроматографией на силикагеле (15-40 мкм) (элюент: смесь DCM/MeOH/NH4OH 92/8/0,1). Чистые фракции собирают и выпаривают растворитель. Полученный остаток (6 г) растворяют в 3 н. соляной кислоте. Смесь перемешивают при комнатной температуре в течение 2 ч. Осадок отфильтровывают, промывают водойb) Получение промежуточного соединения 19 К раствору промежуточного соединения 18 (0,0015 моль), N-метилметанамина (0,0022 моль) и триэтиламина (0,0075 моль) в смеси DCM/ТГФ (40 мл) добавляют HOBT (0,0022 моль), затем EDC (0,0022 моль). Смесь перемешивают при комнатной температуре в течение 24 ч, выливают в воду и экстрагируют DCM. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток смешивают с DIPE. Осадок отфильтровывают и сушат, получая 0,58 г (85%) промежуточного соединения 19, т.пл. 195 С. с) Получение промежуточного соединения 20 Смесь промежуточного соединения 19 (0,0011 моль) и гидроксида лития (0,0023 моль) в ТГФ (20 мл) и воде (10 мл) перемешивают при комнатной температуре в течение 15 ч. Добавляют 3 н. HCl. Выпаривают ТГФ. Осадок отфильтровывают, промывают водой, затем простым диэтиловым эфиром и сушат,получая 0,45 г (82%) промежуточного соединения 20.d) Получение промежуточного соединения 21 К раствору промежуточного соединения 20 (0,0009 моль), O-(тетрагидро-2 Н-пиран-2-ил)гидроксиламина (0,0014 моль) и триэтиламина (0,0043 моль) в смеси DCM/ТГФ (50/50) (75 мл) добавляют HOBT(0,0014 моль), затем EDC (0,0014 моль) при комнатной температуре. Смесь перемешивают при комнатной температуре в течение 48 ч, выливают в воду и экстрагируют DCM. Органический слой отделяют,- 19011932 сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток (0,7 г) очищают колоночной хроматографией на силикагеле (5 мкм) (элюент: смесь DCM/MeOH/NH4OH 99/1/0,1 до 94/6/0,6). Чистые фракции собирают и растворитель выпаривают, получая 0,38 г (75%) промежуточного соединения 21. Пример А 6. а) Получение промежуточного соединения 22 К раствору промежуточного соединения 1 (0,0065 моль) в ТГФ (60 мл) добавляют порциями гидрид натрия 60% (0,0085 моль) при 5 С в токе N2. Смесь перемешивают при 5 С в течение 15 мин. Затем по каплям добавляют раствор иодметана (0,0078 моль) в ТГФ (5 мл). Смесь перемешивают при 5 С в течение 1 ч и при комнатной температуре в течение 5 ч, выливают на лед и экстрагируют EtOAc. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток (1,75 г) очищают колоночной хроматографией на силикагеле (15-40 мкм) (элюент: смесь DCM/MeOH 99/1). Чистые фракции собирают и растворитель выпаривают, получая 0,87 г (34%) промежуточного соединения 22.b) Получение промежуточного соединения 23 Смесь промежуточного соединения 22 (0,0027 моль) и моногидрата гидроксида лития (0,0055 моль) в ТГФ (40 мл) и воде (20 мл) перемешивают при комнатной температуре в течение 48 ч, подкисляют 1 н.HCl. ТГФ упаривают. Осадок отфильтровывают, промывают минимальным количеством воды и сушат,получая 0,91 г (83%) промежуточного соединения 23. с) Получение промежуточного соединения 24 К раствору промежуточного соединения 23 (0,0022 моль), O-(тетрагидро-2 Н-пиран-2 ил)гидроксиламина (0,0033 моль) и триэтиламина (0,01 моль) в смеси DCM/ТГФ (90 мл) добавляют при комнатной температуре HOBT (0,0033 моль), затем EDC (0,0033 моль) в токе азота. Смесь перемешивают при комнатной температуре в течение 48 ч, выливают в воду и экстрагируют DCM. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток (1,3 г) очищают колоночной хроматографией на силикагеле (15-40 мкм) (элюент: смесь DCM/MeOH/NH4OH 97/3/0,1). Чистые фракции собирают и растворитель выпаривают, получая 0,93 г (89%) промежуточного соединения 24. Пример А 7. а) Получение промежуточного соединения 25 Смесь этилового эфира 2-(1-пиперазинил)-5-пиридилкарбоновой кислоты (0,0085 моль), 1,4 диоксан-2,5-диола (0,0093 моль) и (E)-[2-(4-фторфенил)этенил]бороновой кислоты (0,0042 моль) в EtOH(200 мл) перемешивают при комнатной температуре в течение 15 ч, затем фильтруют. Фильтрат упаривают. Остаток смешивают с EtOAc. Органический слой промывают насыщенным раствором NaCl, сушат(MgSO4), фильтруют и растворитель выпаривают. Остаток (3,3 г) растворяют в простом диэтиловом эфире и подкисляют, прибавляя по каплям 5-6 н. HCl в изопропаноле (2 мл) при 5 С. Осадок отфильтровы- 20011932 вают, промывают простым диэтиловым эфиром и сушат. Полученную фракцию смешивают с водой. Добавляют K2CO3 и смесь экстрагируют DCM. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель упаривают, получая 2,7 г (79%) промежуточного соединения 25.b) Получение промежуточного соединения 26 Смесь промежуточного соединения 25 (0,002 моль), гидроксида лития (0,004 моль) в воде (20 мл) и ТГФ (40 мл) перемешивают при комнатной температуре в течение 15 ч. Смесь концентрируют и добавляют 3 н. соляную кислоту. Осадок отфильтровывают, промывают водой, затем простым диэтиловым эфиром и сушат, получая 0,52 г (63%) промежуточного соединения 26. с) Получение промежуточного соединения 27 К смеси промежуточного соединения 26 (0,0012 моль) в смеси DCM (50 мл) и ТГФ (50 мл) добавляют триэтиламин (0,0057 моль), N'-(этилкарбонимидоил)-N,N-диметил-1,3-пропандиамин (0,0019 моль),1-гидрокси-1 Н-бензотриазол (0,0019 моль) и O-(тетрагидро-2 Н-пиран-2-ил)гидроксиламин (0,0019 моль). Реакционную смесь перемешивают в течение 24 ч при комнатной температуре, затем выливают в Н 2 О и экстрагируют DCM. Органический слой отделяют, сушат (MgSO4), фильтруют и выпаривают растворитель. Остаток очищают колоночной хроматографией на силикагеле (градиент элюирования: смесьDCM/MeOH/NH4OH 95/5/0,2). Фракции продукта собирают и органический растворитель выпаривают,получая 0,55 г (91%). Остаток смешивают с простым диэтиловым эфиром, осадок отфильтровывают и сушат, получая 0,5 г промежуточного соединения 27, т.пл. 133C. Пример А 8. Получение промежуточных соединений 28 и 29 промежуточное соединение 28: свободное основание,промежуточное соединение 29: C2H2O4 (1:1). Уксусный ангидрид (0,014 моль) добавляют по каплям при 5C к смеси промежуточного соединения 3 (0,0014 моль), 4-N-N-диметиламинопиридина (0,0095 г) и пиридина (2,5 мл) в DCM (14 мл). Смесь перемешивают при комнатной температуре в течение 24 ч, концентрируют, смешивают с водой и экстрагируют зтилацетатом. Органический слой сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (5 мкм) (градиент элюирования: смесьDCM/MeOH 95/5). Чистые фракции собирают и органический растворитель выпаривают, получая 0,48 г(58%) промежуточного соединения 28. Из фракции (0,05 г) получают оксалатную соль и кристаллизуют из смеси 2-пропанон/диэтиловый эфир. Осадок отфильтровывают и сушат, получая 0,042 г промежуточного соединения 29, т.пл. 154 С. В табл. F-1 перечислены промежуточные соединения, полученные согласно одному из вышеуказанных примеров. Смесь промежуточного соединения 3 (0,00121 моль) в ТФУ (2,5 мл) и MeOH (50 мл) перемешивают в течение 48 ч и затем выпаривают растворитель. Остаток очищают колоночной хроматографией на силикагеле LiChroprep NH2 (25-40 мкм) (элюент: смесь DCM/MeOH/Н 2 О 80/20/2). Чистые фракции соби- 23011932 рают и растворитель выпаривают. Остаток смешивают с простым диэтиловым эфиром, осадок затем отфильтровывают и сушат (в вакууме) при 50C, получая 0,26 г (64%) соединения 1, температура плавления 187 С. Пример В 2. Получение соединения 2 Смесь промежуточного соединения 8 (0,00007 моль) в трифторуксусной кислоте (0,2 мл) и MeOH(4,5 мл) перемешивают при комнатной температуре в течение 96 ч. Растворитель упаривают досуха. Остаток кристаллизуют из смеси простой диэтиловый эфир/2-пропанон. Осадок отфильтровывают и сушат,получая 0,025 г (57%) соединения 2, температура плавления 135 С. Пример В 3. Получение соединения 7 Смесь промежуточного соединения 13 (0,0002 моль) в ТФУ (0,5 мл) и MeOH (10 мл) перемешивают при комнатной температуре в течение 48 ч, затем упаривают досуха. Остаток кристаллизуют из простого диэтилового эфира. Осадок отфильтровывают и сушат, получая 0,044 г (44%) соединения 7, температура плавления 161C. Пример В 4. Получение соединения 8 Смесь промежуточного соединения 17 (0,0005 моль) в ТФУ (1,2 мл) и MeOH (24 мл) перемешивают при комнатной температуре в течение 5 дней. Растворитель упаривают досуха. Остаток (0,26 г) очищают колоночной хроматографией на силикагеле LiChroprep NH2 (25-40 мкм) (элюент: смесьDCM/MeOH/H2O 70/30/3). Чистые фракции собирают и растворитель выпаривают. Остаток (0,16 г) кристаллизуют из простого диэтилового эфира. Осадок отфильтровывают и сушат, получая 0,13 г (66%) соединения 8, температура плавления 180C. Пример В 5. Получение соединения 9 Смесь промежуточного соединения 28 (0,0004 моль) в ТФУ (1 мл) и MeOH (20 мл) перемешивают при комнатной температуре в течение 96 ч, затем упаривают. Остаток (0,23 г) очищают колоночной хроматографией на силикагеле LiChroprep NH2 (25-40 мкм) (элюент: смесь DCM/MeOH/H2O 80/20/2). Чистые фракции собирают и растворитель выпаривают. Остаток (0,106 г) кристаллизуют из простого диэтилового эфира/DIPE. Осадок отфильтровывают и сушат, получая 0,067 г (34%) соединения 9, температура плавления 161C. К раствору промежуточного соединения 21 (0,0007 моль) в MeOH (38 мл) добавляют по каплям ТФУ (1,9 мл) при 5C. Смесь перемешивают при комнатной температуре в течение 48 ч, затем упаривают досуха. Остаток кристаллизуют из смеси простой диэтиловый эфир/CH3CN. Осадок отфильтровывают, промывают простым диэтиловым эфиром и сушат, получая 0,24 г (62%) соединения 10, температура плавления 146C. Пример В 7. Получение соединения 11 Смесь промежуточного соединения 24 (0,0018 моль) в ТФУ (4,4 мл) и MeOH (87 мл) перемешивают при комнатной температуре в течение 4 дней, затем упаривают досуха. Остаток (1,05 г) очищают колоночной хроматографией на силикагеле LiChroprep NH2 (25-40 мкм) (элюент: смесь DCM/MeOH/H2O 80/20/2). Чистые фракции собирают и сушат, растворитель выпаривают. Полученную фракцию (0,634 г) помещают в простой диэтиловый эфир. Осадок отфильтровывают и сушат, получая 0,43 г соединения 11,температура плавления 212 С. Пример В 8. Получение соединения 31 Смесь промежуточного соединения 27 (0,0011 моль) в трифторуксусной кислоте (3 мл) и MeOH (60 мл) перемешивают при комнатной температуре в течение 48 ч. Растворитель выпаривают досуха. Остаток кристаллизуют из простого диэтилового эфира. Осадок отфильтровывают и сушат, получая 0,515 г(89%) соединения 31, температура плавления 145 С. В табл. F-2 перечислены соединения, полученные согласно одному из вышеуказанных примеров. В таблицах используют следующее сокращение: C2HF3O2 обозначает трифторацетатную соль. С. Фармакологический пример. В in vitro анализе ингибирования гистондеацетилазы (см. пример C.1) определяют ингибирование ферментативной активности HDAC, вызванное соединением формулы (I). Клеточную активность соединения формулы (I) определяют на опухолевых клетках А 2780 колориметрическим анализом токсичности или выживаемости клеток (Mosmann Tim, Journal of ImmunologicalMethods 65: 55-63, 1983) (см. пример С.2). Растворимость соединения определяет способность соединения находиться в растворе. В первом способе измеряют способность соединения оставаться в водном растворе при разбавлении (см. пример С.3.а). Исходные растворы в ДМСО разводят водным буферным растворителем в три последовательные стадии. Для каждого разведения нефелометром измеряют мутность. Вторым способом можно измерять растворимость соединения при различных значениях рН, используя хемилюминесцентный детектор азота (см. пример С.3.b). Проникающая способность лекарственного средства выражает его способность переходить из од- 28011932 ной среды в другую или проникать через другую. В частности, способность лекарственного средства переходить через интестинальную мембрану в кровоток и/или из кровотока в мишень. Проникающую способность (см. пример С.4) можно определить посредством образования иммобилизованной на фильтре искусственной мембраны фосфолипидного двойного слоя. В анализе с иммобилизованной на фильтре искусственной мембраной образуется "сэндвич" из 96-луночного микротитрационного планшета и 96 луночной фильтрующей пластины таким образом, что каждая составная лунка разделена на 2 камеры с раствором-донором на дне и раствором-акцептором в верхней части, которые разделены дисковым микрофильтром (125 мкм с порами 0,45 мкм), на который нанесен 2% (мас./об.) раствор диолеоилфосфатидилхолина в додекане, в условиях, где многослойные двойные слои образуют каналы внутри фильтра,когда система соприкасается с водным буферным раствором. Способность соединений проникать через упомянутую искусственную мембрану измеряют в см/с. Цель состоит в том, чтобы определить способность лекарственных средств проникать через параллельную искусственную мембрану при 2 разных значениях рН 4,0 и 7,4. Соединение детектируют УФ-спектрометрией при оптимальной длине волны от 250 до 500 нм. Метаболизм лекарственных средств означает, что растворимое в липидах ксенобиотическое или эндобиотическое соединение энзиматически трансформируется в (а) полярные, растворимые в воде и экскретируемые метаболит(ы). Главным органом для метаболизма лекарств является печень. Продукты метаболизма часто менее активны, чем исходные лекарственные средства, или вообще неактивны. Однако некоторые метаболиты, возможно, обладают повышенной активностью или повышенным токсическим действием. Следовательно, метаболизм лекарственных средств может включать как "детоксикацию", так и "интоксикацию". Одна из основных ферментных систем, которая определяет способность организма справляться с лекарственными средствами и химикатами, представлена цитохром Р 450-зависимыми монооксигеназами, которые являются ферментами, зависимыми от NADPH. Метаболическую стабильность соединений можно определить in vitro, используя субклеточные ткани человека. (см. пример С.5.а). Здесь метаболическая стабильность соединений выражается в % лекарственного средства, метаболизированного после инкубирования указанных соединений микросомами в течение 15 мин. Количественный анализ соединений осуществляют ЖХ-МС. Метаболическую стабильность соединений также можно определить, рассчитывая полупериод распада соединений в гепатоцитах крыс (см. пример C.5.b). Показано, что разнообразные противоопухолевые средства активируют белок р 21, в том числе средства, повреждающие ДНК, и ингибиторы гистондеацетилазы. Средства, повреждающие ДНК, активируют ген р 21 через опухолевый супрессор р 53, тогда как ингибиторы гистондеацетилазы транскрипционально активируют ген р 21 посредством транскрипционного фактора Sp1. Следовательно, средства,повреждающие ДНК, активируют промотор р 21 через р 53-зависимый элемент, тогда как ингибиторы гистондеацетилазы активируют промотор р 21 через сайты sp1 (расположенные в области от -60 до +40 п.н. относительно TATA бокса), причем как первые, так и вторые приводят к увеличенной экспрессии белка р 21. Когда промотор р 21 в клетках состоит из фрагмента промотора р 21 1300 п.н., который не содержит р 53-зависимых элементов, он соответственно не дает ответа на средства, повреждающие ДНК. Способность соединений индуцировать р 21 можно оценивать несколькими методами. Первый метод состоит в том, чтобы обработать опухолевые клетки соединением, представляющим интерес, и после лизиса клеток определить индукцию р 21 твердофазным иммуноферментным анализом р 21 (WAF1 ELISA ofOncogene). Анализ р 21 представляет собой "сэндвич" иммуноферментный анализ, в котором используют как моноклональные антитела мыши, так и поликлональные антитела кролика. Поликлональные антитела кролика, специфичные для человеческого белка р 21, иммобилизуются на поверхности пластмассовых лунок, имеющихся в наборе. Любой белок р 21 присутствующий в анализируемом образце, будет связываться с иммобилизованным антителом. Биотинилированное идентифицирующее моноклональное антитело также распознает человеческий белок р 21 и будет связываться любым р 21, который сохраняется иммобилизованным антителом. Идентифицирующее антитело, в свою очередь, связывается стрептавидином, конъюгированным с пероксидазой хрена. Пероксидаза хрена катализирует превращение хромогенного субстрата тетраметилбензидина из бесцветного раствора в синий раствор (или желтый после прибавления стоп-реагента), интенсивность которого пропорциональна количеству протеина р 21, связанного с планшетом. Окрашенный продукт реакции определяют количественно с помощью спектрофотометра. Количественный анализ выполняют путем построения стандартной кривой известных концентраций р 21 (при условии его лиофилизации). Указанный анализ позволяет измерять индукцию р 21 как следствие повреждения ДНК или как следствие ингибирования гистондеацетилазы (см. пример С.6.а). Способность соединений индуцировать р 21 как результат ингибирования HDAC на клеточном уровне определяют другим методом. Клетки могут быть стабильно трансфицированы вектором экспрессии, содержащим фрагмент промотора р 21 1300 п.н., который не содержит р 53-зависимых элементов и где увеличение экспрессии гена-репортера по сравнению с уровнями контроля идентифицирует соединение как способное индуцировать р 21. Ген-репортер представляет собой флуоресцирующий белок, и экспрессию гена-репортера измеряют как количество испускаемого флуоресцентного излучения (см. пример С.6.b). Последний метод представляет собой in vivo метод, где используют мышей для скрининга фармацевтической активности соединения. Вышеописанные стабильно трансформированные опухолевые- 29011932 клетки можно вводить мышам в количестве, достаточном, чтобы осуществить продуцирование опухоли. После того как опухолевые клетки имели достаточно времени для формирования опухоли, животным можно вводить потенциально активное соединение, и действие указанного соединения на опухолевые клетки оценивают, измеряя экспрессию гена-репортера. Инкубирование фармацевтически активными соединениями будет приводить к увеличению экспрессии гена-репортера по сравнению с контрольными уровнями (см. пример С.6.с). Специфические ингибиторы HDAC не должны ингибировать другие ферменты, подобно распространенным белкам CYP Р 450. Белки CYP P450 (E.coli экспрессированные) 3 А 4, 2D6 en 2C9 превращают свои специфические субстраты в флуоресцентные молекулы. Белок CYP3A4 превращает 7 бензилокситрифторметилкумарин (BFC) в 7-гидрокситрифторметилкумарин. Белок CYP2D6 превращает 3-[2-(N,N-диэтил-N-метиламино)этил]-7-метокси-4-метилкумарин (AMMC) в гидрохлорид 3-[2-(N,Nдиэтиламино)этил]-7-гидрокси-4-метилкумарина и белок CYP2C9 превращает 7-метокси-4 трифторметилкумарин (MFC) в 7-гидрокситрифторметилкумарин. Соединения, ингибирующие ферментативную реакцию будут приводить к уменьшению флуоресцентного сигнала (см. пример С.7). Пример C.1. In vitro анализ ингибирования гистондеацетилазы. Используют флуоресцентный анализ активности HDAC/Drug Discovery Kit of Biomol (номер в каталоге AK-500-0001). Флуоресцентный анализ активности HDAC базируется на комбинации субстратаFluor de Lys (Fluorogenic Histon de Acetylase Lysyl) и проявителя. Субстрат Fluor de Lys содержит боковую цепь ацетилированного лизина. Деацетилирование субстрата сенсибилизирует субстрат таким образом, что на второй стадии обработка проявителем Fluor de Lys дает флуорофор. Ядерные экстракты HeLa (поставщик - Biomol) инкубируют при 60 мкг/мл с 75 мкМ субстрата. Субстрат Fluor de Lys добавляют в буфер, содержащий 25 мМ Tris, 137 мМ NaCl, 2,7 мМ KCl и 1 мМMgCl26H2O при рН 7,4. Через 30 мин добавляют 1 об. проявителя. Флуорофор возбуждают светом 355 нм и испускаемый свет (450 нм) определяют на флуорометрическом планшет-ридере. Для каждого эксперимента параллельно проводят контрольные опыты (содержащие ядерные экстракты HeLa и буфер) и холостые опыты по инкубированию клеток (содержащие буфер без ядерного экстракта HeLa) и опыты с образцами (содержащие соединение, растворенное в ДМСО и дополнительно разведенное в буфере, и ядерный экстракт HeLa). В первом примере соединения испытывают при концентрации 10-5 M. Когда соединения проявляют активность при концентрации 10-5 M, строят кривую концентрация-ответ, для которой соединения испытывают в концентрациях от 10-5 до 10-9 M. Все образцы испытывают по 4 раза. В каждом тесте значение холостых опытов вычитают из значений, полученных в контрольных опытах и в опытах с образцом. Контрольный образец представляет собой 100% деацилированный субстрат. Для каждого образца флуоресценцию выражают в процентах от среднего значения контрольных опытов. Когда это целесообразно, рассчитывают значения IC50 (концентрация лекарственного средства, необходимая для уменьшения роста клеток на 50% по сравнению с контролем), применяя пробит-анализ для количественных данных. В настоящей заявке эффекты испытываемых соединений выражены в pIC50 (отрицательная величина логарифма значения IC50) (см. табл. F-3). Пример С.2. Определение антипролиферативной активности на клетках А 2780. Все испытываемые соединения растворяют в ДМСО и делают дальнейшие разведения в питательной среде. При определении пролиферации клеток конечные концентрации ДМСО никогда не превышали 0,1% (об./об.). Контрольные опыты содержали клетки А 2780 и ДМСО без соединения, и холостые опыты содержали ДМСО, но не содержали клеток. MTT растворяют при 5 мг/мл в PBS. Приготавливают глициновый буфер, содержащий 0,1 M глицина и 0,1 M NaCl, забуференный раствором 1 н. NaOH до рН 10,5 (все реагенты поставляются Merck). Клетки А 2780 карциномы яичника человека (любезно предоставленные в дар доктором T.С. Hamilton [Fox Chase Cancer Centre, Pennsylvania, USA]) культивируют в среде RPMI 1640, к которой добавлены 2 мМ L-глутамина, 50 мкг/мл гентамицина и 10% фетальная телячья сыворотка. По стандартной методике клетки фетальной телячьей сыворотки выдерживают как монослойные культуры при 37 С в увлажненной атмосфере с 5% СО 2. Клетки пересевают 1 раз в неделю, используя раствор трипсин/EDTA при индексе разведения 1:40. Все среды и вспомогательные средства получают от компании Life Technologies. Клетки не загрязнены микоплазмой, как определено с помощью набора Gen-Probe MycoplasmaTissue Culture kit (поставщик: BioMrieux). Клетки высевают в NUNC 96-луночные планшеты (поставщик: Life Technologies) и в течение ночи дают возможность клеткам прилипнуть к пластмассе. Плотности, используемые для культивирования, составляли 1500 клеток на лунку при общем объеме среды 200 мкл. После адгезии клеток к планшетам среду изменяют и добавляют лекарства и/или растворители к конечному объему 200 мкм. В последующие четыре дня инкубирования среду заменяют 200 мкм свежей среды и плотность и жизнеспособность клеток оценивают анализом, основанным на MTT. В каждую лунку добавляют 25 мкл раствораMTT и клетки дополнительно инкубируют в течение 2 ч при 37C. Среду затем осторожно отсасывают и синий продукт МТТ-формазан солюбилизируют прибавлением 2 мкл глицинового буфера, затем 100 мкл ДМСО. Микропланшеты для анализа встряхивают в течение 10 мин на микропланшетном шейкере и из- 30
МПК / Метки
МПК: A61P 35/00, C07D 239/42, A61K 31/505, C07D 403/12, C07D 239/54
Метки: гистондеацетилазы, качестве, замещенного, производные, пропенилпиперазина, ингибиторов, новых
Код ссылки
<a href="https://eas.patents.su/30-11932-proizvodnye-zameshhennogo-propenilpiperazina-v-kachestve-novyh-ingibitorov-gistondeacetilazy.html" rel="bookmark" title="База патентов Евразийского Союза">Производные замещенного пропенилпиперазина в качестве новых ингибиторов гистондеацетилазы</a>
Предыдущий патент: Жевательная таблетка, таблетка для рассасывания и таблетка для глотания, содержащая кальцийсодержащее соединение в качестве активного вещества
Следующий патент: Высокоактивная каталитическая композиция в виде суспензии
Случайный патент: Бензимидазолоновые соединения, обладающие агонистической активностью в отношении 5-нт4 рецепторов












