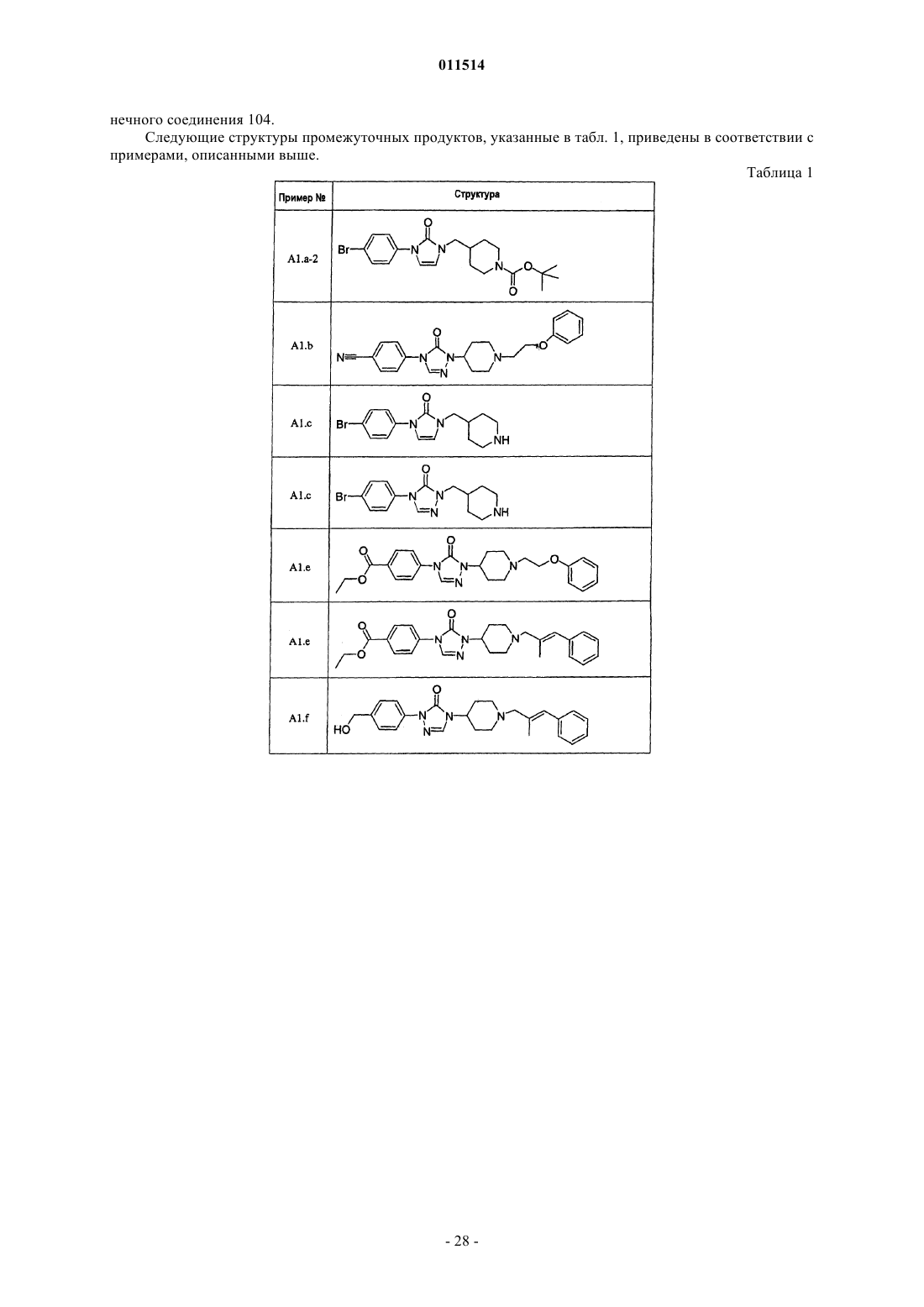
Производные триазолона, тетразолона и имидазолона для применения в качестве антагонистов альфа-2с-адренорецептора
Номер патента: 11514
Опубликовано: 28.04.2009
Авторы: Вега-Рамиро Хуан Антонио, Пастор-Фернандес Хоакин, Андрес-Хиль Хосе Игнасио, Ланглуа Ксавье Жан Мишель, Дринкенбург Вильхельмус Хелена Игнатиус Мария, Алькасар-Вака Мануэль Хесус, Ойярсабаль-Сантамарина Хулен
Формула / Реферат
1. Соединение общей формулы (I)
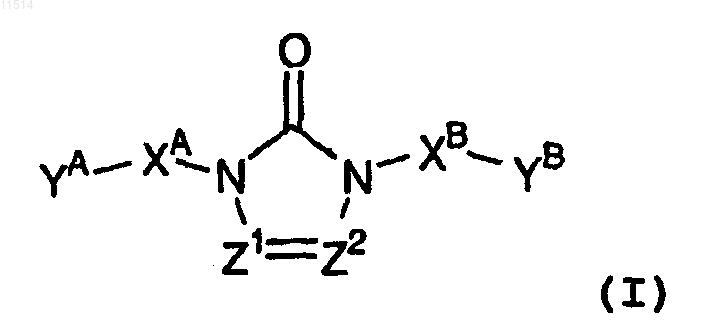
его фармацевтически приемлемая аддитивная соль кислоты или основания, его стереохимически изомерная форма, его N-оксидная форма или его четвертичная аммониевая соль,
где Z1 означает CH и Z2 означает N; или Z1 означает N и Z2 означает CH; или Z1 означает CH и Z2 означает CH;
XA и XB, каждый независимо друг от друга, означают ковалентную связь или C1-4-алкил, где одно двухвалентное звено -CH2- может быть заменено двухвалентным фенильным звеном и/или где один или более атомов водорода в каждом остатке XA и XB могут быть заменены радикалом, выбираемым из группы, состоящей из галогена, циано, гидрокси, амино и формила;
YA и YB, каждый независимо друг от друга, означают радикал, выбираемый из группы, состоящей из NR1R2 и Pir;
R1 и R2, каждый независимо друг от друга, означает радикал, выбираемый из группы, состоящей из водорода; алкила; арила; арилокси; Het; -NRaRb, где Ra и Rb, каждый независимо, означают водород, алкил, арил или арилалкил; и алкил, замещенный одним или более радикалами, выбираемыми из группы, состоящей из арила, арилокси, Het и -NRaRb, где Ra и Rb, каждый, независимо выбирают из группы, состоящей из водорода, алкила, арила и арилалкила;
Pir означает радикал, выбираемый из группы, состоящей из пирролила; пиразолила; имидазолила; пиридинила; пиримидинила; пиразинила; пиридазинила; пирролидинила; имидазолидинила; пирразолидинила; пиперидинила; диазепанила; морфолинила; тиоморфолинила; имидазолидинила; 2Н-пирролила; пирролинила; имидазолинила; пирразолинила; 1,2,3,4-тетрагидроизохинолинила; 7,9-диазабицикло [4.2.2]дец-3-енила и изоиндолила; где каждый радикал Pir может быть необязательно замещен одним или более радикалами, выбираемыми из группы, состоящей из гидрокси; оксо; алкила; алкилкарбонила; алкилсульфонила; алкилоксикарбонила; арилоксиалкила; моноариламиноалкила; арила; арилалкила; арилалкенила; пирролидинила; фурилалкила, необязательно замещенного 1 или 2 алкильными радикалами; бензофурилалкила; 2,3-дигидробензо[1,4]диоксинилалкила; хинолинилалкила; бензотиенилалкила и индолилалкила, необязательно замещенного галогеном;
Het означает моноциклический гетероциклический радикал, выбираемый из группы, состоящей из пирролила, пиразолила, имидазолила, пиридинила, пиримидинила, пиразинила, пиридазинила, пирролидинила, имидазолидинила, пирразолидинила, пиперидинила, диазепанила, морфолинила, тиоморфолинила, пиперазинила, имидазолидинила, 2Н-пирролила, пирролинила, имидазолинила, пирразолинила, фуранила, тиенила, оксазолила, изоксазолила, тиазолила, тиадиазолила, изотиазолила, диоксолила, дитианила, тетрагидрофурила, триазолила и триазинила; или бициклический гетероциклический радикал, выбираемый из группы, состоящей из хинолинила, изохинолинила, 1,2,3,4-тетрагидроизохинолинила, хиноксалинила, индолила, изоиндолила, бензимидазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, бензофуранила, бензотиенила, бензопиперидинила, хроменила и имидазо[1,2-а]пиридинила; где каждый Het необязательно замещен алкилом;
или два смежных остатка XA, XB и YA, YB могут быть конденсированы вместе с образованием двухвалентного 1,2,3,4-тетрагидроизохинолинильного радикала, необязательно замещенного водородом, алкилом, арилом, арилалкилом, алкилкарбонилом, алкилсульфонилом и пирролидинилалкилом;
арил означает нафталинил или фенил, каждый необязательно замещенный 1, 2 или 3 заместителями, каждый из которых, независимо друг от друга, выбирают из группы, состоящей из галогена, циано, гидрокси, амино, алкиламино, алкилоксиалкиламино, оксо, карбокси, нитро, тио, формила и алкилокси;
алкил означает линейный или разветвленный насыщенный углеводородный радикал, имеющий 1-6 атомов углерода; или циклический насыщенный углеводородный (циклоалкил) радикал, имеющий 3-7 атомов углерода; или циклический насыщенный углеводородный радикал, имеющий 3-7 атомов углерода, присоединенный к линейному или разветвленному насыщенному углеводородному радикалу, имеющему 1-6 атомов углерода; причем один или более атомов углерода каждого радикала может быть необязательно замещен одним или более радикалами, выбираемыми из группы, состоящей из галогена, циано, гидрокси, амино, оксо, карбокси, нитро, тио и формила; и
алкенил означает алкильный радикал, как описано выше, имеющий далее одну или более двойных связей.
2. Соединение по п.1, отличающееся тем, что Z1 означает CH и Z2 означает N.
3. Соединение по любому из пп.1-2, отличающееся тем, что каждый из XA и XB независимо друг от друга выбирают из группы, состоящей из ковалентной связи, -CH2-, -CH2CH2-, -CH2CH2CH2-,
-CH2CH2CH2CH2-, -CH(CH3)CH(CH3)-, -C6H4-, -CH2C6H5-, -CH2CH2C6H5-, -C6H5CH2-, -C6H5CH2CH2-,
-CH2C6H4CH2- и -CH2CH2C6H4CH2CH2-.
4. Соединение по п.3, отличающееся тем, что каждый из XA и XB независимо друг от друга выбирают из группы, состоящей из ковалентной связи, -CH2-, -CH2CH2-, -CH2CH2CH2-, -CH(CH3)CH(CH3)-,
-C6H4-, -CH2C6H5-, -C6H5CH2- и -CH2C6H4CH2-.
5. Соединение по п.4, отличающееся тем, что XA означает -C6H5CH2- и XB означает -CH2CH2-.
6. Соединение по любому из пп.1-5, отличающееся тем, что YA означает NR1R2 и YB означает Pir; или YA означает NR1R2 и YB означает NR1R2; или YA означает Pir и YB означает Pir; или YA означает Pir и YB означает NR1R2.
7. Соединение по п.6, отличающееся тем, что YA означает Pir и YB означает NR1R2.
8. Соединение по любому из пп.1-7, отличающееся тем, что Pir выбирают из группы, состоящей из пирролидинила; пиперидинила; диазепанила; морфолинила; 1,2,3,4-тетрагидроизохинолинила; 7,9-диазабицикло[4.2.2]дец-3-енила и изоиндолила; где каждый радикал Pir может быть необязательно замещен одним или более радикалами, выбираемыми из группы, состоящей из гидрокси; оксо; алкила; алкилоксикарбонила; арилоксиалкила; моноариламиноалкила; арила; арилалкила; арилалкенила; пирролидинила; фурилалкила, необязательно замещенного 1 или 2 алкильными радикалами; бензофурилалкила; 2,3-дигидробензо[1,4]диоксинилалкила; хинолинилалкила; бензотиенилалкила и индолилалкила, необязательно замещенного галогеном.
9. Соединение по п.8, отличающееся тем, что Pir означает морфолинил.
10. Соединение по любому из пп.1-9, отличающееся тем, что каждый из R1 и R2 независимо друг от друга выбирают из группы, состоящей из водорода, алкила, арила и алкила, замещенного радикалом, выбираемым из группы, состоящей из арила, арилокси, Het и -NRaRb, где Ra и Rb, каждый независимо, выбирают из группы, состоящей из водорода, алкила и арилалкила.
11. Соединение по п.10, отличающееся тем, что R1 и R2 независимо друг от друга выбирают из группы, состоящхщ из водорода, метила, этила, фенила, метила и этила, замещенного радикалом, выбираемым из группы, состоящей из фенила, фенилокси, диметиламино, (бензил)(метил)амино, (циклогексилметил)(метил)амино, пиридинила, пирролидинила, пиперидинила, морфолинила, пиперазинила и тетрагидрофурила.
12. Соединение по п.11, отличающееся тем, что R1 и R2 независимо друг от друга выбирают из группы, состоящей из водорода и фенилоксиэтила.
13. Соединение по любому из пп.1-12, отличающееся тем, что
Z1 означает CH и Z2 означает N; или Z1 означает N и Z2 означает CH; или Z1 означает CH и Z2 означает CH;
ХА и XB, каждый независимо друг от друга, означают ковалентную связь или C1-4-алкил, где одно двухвалентное звено -СН2- может быть заменено двухвалентным фенильным звеном;
YA и YB, каждый независимо друг от друга, означают радикал, выбираемый из группы, состоящей из NR1R2 и Pir;
R1 и R2, каждый независимо друг от друга, выбирают из группы, состоящей из водорода; алкила; арила и алкила, замещенного радикалом, выбираемым из группы, состоящей из арила, арилокси, Het и
-NRaRb, где Ra и Rb, каждый независимо, выбирают из группы, состоящей из водорода, алкила и арилалкила;
Pir означает гетероциклический радикал, выбираемый из группы, состоящей из пирролидинила; пиперидинила; диазепанила; морфолинила; 1,2,3,4-тетрагидроизохинолинила; 7,9-диазабицикло[4.2.2]дец-3-енила и изоиндолила; где каждый радикал Pir может быть необязательно замещен одним или более радикалами, выбираемыми из группы, состоящей из гидрокси; оксо; алкила; алкилоксикарбонила; арилоксиалкила; моноариламиноалкила; арила; арилалкила; арилалкенила; пирролидинила; фурилалкила, необязательно замещенного 1 или 2 алкильными радикалами; бензофурилалкила; 2,3-дигидробензо[1,4]диоксинилалкила; хинолинилалкила; бензотиенилалкила и индолилалкила, необязательно замещенного галогеном;
Het означает моноциклический гетероциклический радикал, выбираемый из группы, состоящей из пиридинила, пирролидинила, пиперидинила, морфолинила, пиперазинила и тетрагидрофурила;
или два смежных остатка XA и XB и YA и YB вместе могут образовывать двухвалентный 1,2,3,4-тетрагидроизохинолинильный радикал, необязательно замещенный водородом, алкилом, арилалкилом, алкилкарбонилом, алкилсульфонилом и пирролидинилалкилом; и
арил означает нафталинил или фенил, каждый необязательно замещен 1, 2 или 3 заместителями, каждый из которых, независимо друг от друга, выбирают из группы, состоящей из галогена, циано, гидрокси и алкилокси.
14. Соединение по любому из пп.1-13, отличающееся тем, что арилоксиалкил означает фенилоксиэтил, арилалкенил означает 2-метил-3-фенилаллил и изоиндолил замещен двумя оксоостатками с образованием изоиндол-1,3-дионильного остатка.
15. Соединение по п.1, отличающееся тем, что соединением является любое соединение, указанное в табл. 2-8.
16. Соединение по п.1, отличающееся тем, что соединением является 4-(4-морфолин-4-илметилфенил)-2-[2-(2-феноксиэтиламино)этил]-2,4-дигидро[1,2,4]триазол-3-он, его фармацевтически приемлемая аддитивная соль кислоты или основания, его стереохимически изомерная форма, его N-оксидная форма или его четвертичная аммониевая соль.
17. Соединение по любому из пп.1-16 для применения в качестве лекарственного средства.
18. Соединение по любому из пп.1-16 в комбинации с одним или более другими соединениями, выбираемыми из группы, состоящей из антидепрессантов, анксиолитиков и нейролептиков, для применения в качестве дополнительного лечения.
19. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель или разбавитель и в качестве активного ингредиента терапевтически эффективное количество соединения по любому из пп.1-16.
20. Фармацевтическая композиция по п.19, отличающаяся тем, что она дополнительно включает одно или более других соединений, выбираемых из группы, состоящей из антидепрессантов, анксиолитиков и нейролептиков.
21. Фармацевтическая композиция по любому из пп.19 и 20, отличающаяся тем, что она находится в форме, подходящей для перорального введения.
22. Способ получения фармацевтической композиции по п.19, отличающийся тем, что фармацевтически приемлемый носитель тщательно смешивают с терапевтически эффективным количеством соединения по любому из пп.1-16.
23. Способ получения фармацевтической композиции по п.19, отличающийся тем, что фармацевтически приемлемый носитель тщательно смешивают с терапевтически эффективным количеством соединения по любому из пп.1-16 и одним или более другими соединениями, выбираемыми из группы антидепрессантов, анксиолитиков и нейролептиков.
24. Применение соединения по любому из пп.1-16 для получения лекарственного средства для предупреждения и/или лечения заболеваний, где антагонизм a2-адренергического рецептора, в частности антагонизм a2C-адренергического рецептора, имеет терапевтическое применение.
25. Применение соединения по любому из пп.1-16 для получения лекарственного средства для предупреждения и/или лечения нарушений центральной нервной системы, перепадов настроения, вызывающих состояние тревоги расстройств, связанных со стрессом расстройств, ассоциированных с депрессией и/или тревогой, когнитивных расстройств, изменений личности, шизоаффективных нарушений, болезни Паркинсона, деменции типа Альцгеймера, состояний хронической боли, нейродегенеративных заболеваний, аддикционных нарушений и половой дисфункции.
26. Применение соединения по пп.24 и 25 в качестве дополнительного лечения в комбинации с одним или более другими соединениями, выбираемыми из группы, состоящей из антидепрессантов, анксиолитиков и нейролептиков.
27. Способ получения соединения по п.1, отличающийся тем, что соединение формулы (I') превращают в соединение формулы (I)
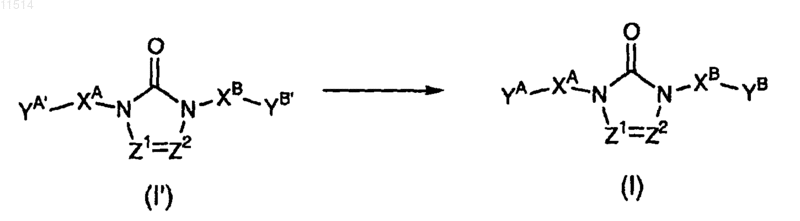
где все переменные имеют значение, указанное в п.1, и где или по меньшей мере один из YA' и YB' выбирают из группы, состоящей из галогена, в частности Br; формила; алкил-SO3-; циано; гидрокси и алкилокси, в частности метокси и этилокси; или где по меньшей мере один из YA' и YB' означает радикал NR1LB, NLAR2 или NLALB, отличающийся тем, что LA и LB, каждый независимо друг от друга, выбирают из группы, состоящей из алкилоксикарбонила, в частности трет-бутилоксикарбонила (трет-ВОС); и арилалкилоксикарбонила, в частности бензилоксикарбонила.
Текст
011514 Настоящее изобретение относится к замещенным производным триазолона, тетразолона и имидазолона, обладающим селективной антагонистической активностью по отношению к 2C-адренорецептору. Далее, оно относится к их получению, содержащим их композициям и их применению в качестве лекарственного средства. Адренергические рецепторы образуют взаимосвязь между эндогенными катехоламинами, адреналином и норадреналином и большой матрицей клеток-мишеней в организме, опосредуя биологические эффекты симпатической нервной системы. Их подразделяют на три основных подкласса: 1, 2 и . Ha сегодняшний день клонировано девять отдельных подтипов адренергического рецептора из некоторых видов: 1A, 1B, 1D, 2A, 2B, 2 С, 1, 2 и 3 (Hieble, J.P. и др., J. Med. Chem., 1995, 38, 3415-3444). Доступные 2-лиганды обладают только незначительной селективностью подтипа. Осложняющим фактором является то, что 2-адренорецепторные лиганды, представляющие собой имидазолы или имидазолины,также связываются от умеренной до высокой аффинностью с сайтами связывания неадренорецепторного имидазолина. Три подтипа 2-адренорецептора имеют множество общих свойств. Они являются Gпротеинсвязывающими рецепторами с семью трансмембранными доменами аминсвязывающего подсемейства. Все три подтипа связаны с Gi/o-сигнальной системой, ингибирующей активность аденилатциклазы, открытием потенциалзависимых Ca2+-каналов и открытием K+-каналов. Три рецептора кодированы отдельными генами (Bylund D.В. и др., Pharmacol. Rev., 1994, 46, 121-136, и Hieble J.P. и др., Pharmacol.Commun. , 1995, 6, 91-97), локализованными на различных хромосомах; у людей 2A-ген найден на хромосоме 10, 2B-ген - на хромосоме 2 и 2C-ген - на хромосоме 4. Подтипы хорошо сохранились у видов млекопитающих. У крыс и мышей, однако, имеется замена одной аминокислоты, которая снижает аффинность 2 А-адренорецептора грызуна по отношению к классическим 2-антагонистам, йохимбину и рауволсцину. Общим консенсусом является то, что этот, так называемый 2D-адренорецепторный подтип означает гомологию грызуна человеческому 2 А-подтипу. Подтипы 2-адренорецептора различным образом распределены в клетках и тканях, очевидно обеспечивая рецепторы различными физиологическими функциями и профилями фармакологической активности. Различные регуляторные области в генах рецепторов и различные белковые структуры также придают различные регуляторные свойства трем рецепторам как в отношении синтеза рецептора, так и в отношении посттрансляционных событий. 2-Адренергические рецепторы первоначально были охарактеризованы как пресинаптические рецепторы, служащие в качестве частей контура отрицательной обратной связи для регуляции высвобождения норадреналина. Вскоре было обнаружено, что 2-адренорецепторы не ограничены пресинаптическими локациями, а также имеют постсинаптические функции. 2 А-Адренорецептор является основным ингибирующим пресинаптическим рецептором (авторецептор), регулирующим высвобождение норадреналина из симпатических нейронов, в качестве части контура обратной связи. 2C-Адренорецептор выполняет функцию дополнительного пресинаптического регулятора во всех исследованных центральных и периферических нервных тканях. Однако относительные вклады 2 А- и 2C-рецепторов различны в случае центральных и периферических нервов, причем 2C-подтип более преобладает в симпатических нервных окончаниях, чем в центральных адренергических нейронах (Philipp M. и др., Am. J. Physiol. Regul. Integr. Comput. Physiol., 2002, 283, R287-R295, иKable J.W. и др., J. Pharmacol. Exp. Ther. , 2000, 293, 1-7). 2C-Адренорецептор особенно пригоден для контроля высвобождения нейромедиатора при частотах потенциала низкого действия. В противоположность, 2 А-адренорецептор первоначально действует при высоких частотах стимуляции в симпатических нервах и, таким образом, может быть ответственным за контролирование высвобождения норадреналина во время максимальной симпатической активации (Bucheler M.M. и др., Neuroscience, 2002, 109, 819826). 2B-Адренорецепторы локализованы в постсинаптических клетках, опосредуя эффекты катехоламинов, высвобождаемых из симпатических нервов, например, путем вазоконстрикции. 2 Адренергические рецепторы не только ингибируют высвобождение своих собственных нейромедиаторов, но могут также регулировать экзоцитоз множества других нейромедиаторов в центральной и периферической нервной системе. В головном мозге 2 А- и 2C-адренорецепторы могут ингибировать высвобождение допамина в базальных ядрах, а также секрецию серотонина в тонких слоях гиппокампа или коры головного мозга мыши. В противоположность, ингибирующий эффект агонистов 2 адренорецептора в отношении моторики пищеварительного тракта опосредован исключительно 2Aподтипом. Часть функциональных различий между 2 А- И 2C-рецепторами может быть объяснена их разными профилями субклеточной локализации. При экспрессии фибробластов у крысы, 2 А- и 2Bадренорецепторы нацелены на цитоплазматическую мембрану. При стимуляции агонистом только 2Bадренорецепторы обратимо проникают в эндосомы. 2C-Адренорецепторы первоначально локализованы во внутриклеточном компартменте мембраны, откуда они могут быть транслоцированы к клеточной поверхности после подвергания воздействию низкой температуры (на этот счет см. Docherty J.R. и др., Eur.-1 011514 Установление дефицита или сверхпродуцирования подтипов 2-адренорецептора у подвергнутых обработке методом генной инженерии мышей дало важную информацию для понимания специфических функций подтипа (MacDonald E. и др., Trends Pharmacol. Sci., 1997, 18, 211-219). Исследование фенотипа этих штаммов на мышах показало, что 2 А-подтип ответственен за ингибирование высвобождения нейромедиатора из центральных и периферических симпатических нервов и,больше всего, центрально опосредуемых эффектов 2-агонистов. 2B-Подтип, прежде всего, ответственен за начальные периферические гипертензивные ответы, вызываемые 2-агонистами, и принимает участие в гипертензии, индуцируемой солью (Link и др., Science, 1996, 273, 803-805, и Makaritsis К.P. и др., Hypertension, 1999, 33, 14-17). Прояснение физиологической роли 2C-подтипа оказалось более затруднительным. Несмотря на довольно широкое распространение в центральной нервной системе (CNS), его роль не является критической в опосредовании сердечно-сосудистых эффектов неселективных 2-агонистов. Предполагается его участие в гипотермии, индуцируемой дексмедетомидином, и в гиперлокомоции, индуцируемой Dамфетамином (Rohrer D.K. и др., Annu. Rev. Pharmacol. Toxicol., 1998, 38, 351-373). Другой потенциально важный ответ, опосредуемый 2C-адренорецептором, представляет собой сужение кожных артерий, приводя к уменьшению кожного кровотока (Chotani M.А. и др., Am. J. Physiol. Heart Circ. Physiol., 2004, 286,59-67). Последние исследования, проведенные на подвергнутых двойному нокаутированию мышах,показали, что 2C-адренорецептор также экспрессируется на пресинаптическом уровне, где вместе с 2Aрецептором он активно участвует в контроле высвобождения нейромедиатора. В то время как 2 Аадренорецептор является очень эффективным при высоких частотах стимуляции, 2C-адренорецептор действует скорее при низких частотах стимуляции. Кроме того, было предположено, что 2C-подтип участвует в модуляции моторики поведения и процессах запоминания (Bjorklund M. и др., Neuroscience,1999, 88, 1187-1198, и Tanila H. и др., Eur. J. Neurosci., 1999, 11, 599-603). Другие основные эффекты,инициируемые этим подтипом, также включают старт-рефлекс и агрессивный ответ на стресс и локомоцию (Sallinen J. и др., J. Neurosci., 1998, 18, 3035-3042, и Sallinen. J. и др., Neuroscience, 1998, 86, 959-965). В заключение, недавно было показано, что 2C-адренорецептор может способствовать опосредуемой 2 агонистом спинальной анальгезии и адренергически опиоидной синергии (Fairbanks C.A. и др., J. Pharm.Exp. Ther. , 2002, 300, 282-290). Вследствие их широкого распространения в центральной нервной системе 2-рецепторы затрагивают целый ряд поведенческих функций. Эффект измененной экспрессии 2C-адренергического рецептора был оценен в случае некоторых различных поведенческих парадигм (Kable J.W. и др., Journal of Pharmacology and Experimental Therapeutics, 2000, 293 (1): 1-7), подтверждая то, что 2C-адренергические антагонисты могут иметь терапевтическую ценность при лечении вызванных стрессом психиатрических расстройств. В случае каждой из поведенческих парадигм неясно, играет ли 2C-подтип какую-либо непосредственную роль в опосредуемом поведении или продуцирует ли измененная экспрессия 2Cрецептора эффекты вследствие измененного метаболизма или модуляции в прямом направлении других нейромедиаторных систем. Представляет интерес то, что мыши с дефицитом 2C-рецептора обладают усиленным старт-рефлексом, уменьшенным ингибированием форимпульса и сокращенной латентностью приступа в тесте изолированной агрессии. Таким образом, лекарственные средства, воздействующие через 2C-адренорецептор, могут иметь терапевтическую ценность при нарушениях, связанных с усиленным старт-рефлексом и сенсомоторными дефицитами, как, например, шизофрения, связанное с дефицитом внимания нарушение, посттравматический стресс и отмена лекарственного средства. В дополнение к 2C-подтипу, 2A-адренорецептор имеет важное значение. С публикацией все большего количества исследований по физиологии 2-адренорецептора в случае мышей с ген-мишенями ситуация становится более сложной, чем ожидалось первоначально. Действительно, обнаружено, что только немногие биологические функции 2-рецепторов опосредованы одним отдельным подтипом 2-адренергического рецептора. В отношении других функций, опосредуемых 2 рецептором, появились две различные стратегии для регуляции адренергической сигнальной трансдукции: некоторые биологические функции контролируются двумя противодействующими подтипами 2 рецептора, а некоторые нуждаются в двух подтипах рецептора с подобными, но комплементарными эффектами. Так как 2A-подтип опосредует наибольшее количество классических эффектов 2 адренергических агонистов, сомнительно, что 2 А-селективный агонист должен иметь лучший клинический профиль, чем доступные в настоящее время агенты. Лекарственные средства, воздействующие на 2B- или 2C-адренорецепторы, вероятно, должны обладать меньшим количеством классических 2 адренергических побочных эффектов, чем 2 А-специфические агенты. Вероятно, оказывается, что 2Cселективные агенты могут быть пригодны, по меньшей мере, при некоторых нарушениях нервной системы, в частности нарушениях центральной нервной системы. Предпосылки создания изобретения согласно известному уровню техники Анализ информационной базы данных на настоящий момент показывает, что коммерчески доступны некоторые адренергические 2-антагонисты, выпускаемые фирмами, включая Akzo Nobel (Organon),-2 011514Novartis, Pfizer и Schering AG. Ни одно из этих соединений не является селективным для любого из трех 2-адренорецепторов. Эти соединения показаны, главным образом, при депрессии, гипертензивных нарушениях и дискинезии, связанной с болезнью Паркинсона. Фирмы по клинической разработке антагонистов 2-адренорецепторов включают Britannia Pharmaceuticals, IVAX, Juvantia Pharmaceuticals, MAPPharmaceuticals, Novartis, Novo Nordisk, Organon, Pierre Fabre и Sanofi-Aventis. Относительно разработки селективных антагонистов 2C-адренорецепторов на сегодняшний день,ОРС-28326 является единственным соединением в клинической разработке (в фазе 2, фирма OtsukaPharmaceuticals, для гипертензивных нарушений и периферического сосудистого заболевания). Остальные из 2C-антагонистов находятся в состоянии доклинической разработки фирмами Oy JuvantiaPharma Ltd. (JP 1514 и JP 1302, опубликованные в WO-01/64645 и WO-04/067513) и Novartis AG (NVPABE651 и NVP-ABE697, опубликованные в WO-01/55132 и в J. Label Compd. Radio-pharm, 2002, 45,1180), показанные, главным образом, при депрессии и шизофрении. Кроме того, некоторые соединения,находящиеся на очень ранних стадиях разработки (биологическое тестирование), перечислены фирмами Juvantia и Kyowa Hakko, для применения при депрессии и болезни Паркинсона. Описание данного изобретения Задачей настоящего изобретения является создание соединений с аффинностью к связыванию с 2 адренорецепторами, в частности, с 2C-адренорецепторами, в особенности, в качестве антагонистов. Настоящая задача достигается созданием нового замещенного производного триазолона, имидазолона и тетразолона общей формулы (I) его фармацевтически приемлемой аддитивной соли кислоты или основания, его стереохимически изомерной формы, его N-оксидной формы или его четвертичной аммониевой соли, гдеZ1 означает CH и Z2 означает N; или Z1 означает N и Z2 означает CH; или Z1 означает CH и Z2 означает CH; ХА и XB, каждый независимо друг от друга, означают ковалентную связь или C1-4-алкил, где одно двухвалентное звено -CH2- может быть заменено двухвалентным фенильным звеном и/или где один или более атомов водорода в каждом остатке ХА и XB могут быть заменены радикалом, выбираемым из группы, состоящей из галогена, циано, гидрокси, амино и формила;YA и YB, каждый независимо друг от друга, означают радикал, выбираемый из группы, состоящей из NR1R2 и Pir;R1 и R2, каждый независимо друг от друга, означает радикал, выбираемый из группы, состоящей из водорода; алкила; арила; арилокси; Het; NRaRb, где Ra и Rb, каждый независимо, означают водород, алкил, арил или арилалкил; и алкил, замещенный одним или более радикалами, выбираемыми из группы,состоящей из арила, арилокси, Het и -NRaRb, где Ra и Rb, каждый независимо, выбирают из группы, состоящей из водорода, алкила, арила и арилалкила;Pir означает радикал, выбираемый из группы, состоящей из пирролила; пиразолила; имидазолила; пиридинила; пиримидинила; пиразинила; пиридазинила; пирролидинила; имидазолидинила; пирразолидинила; пиперидинила; диазепанила; морфолинила; тиоморфолинила; имидазолидинила; 2 Н-пирролила; пирролинила; имидазолинила; пирразолинила; 1,2,3,4-тетрагидроизохинолинила; 7,9-диазабицикло[4.2.2]дец-3-енила и изоиндолила; где каждый радикал Pir может быть необязательно замещен одним или более радикалами, выбираемыми из группы, состоящей из гидрокси; оксо; алкила; алкилкарбонила; алкилсульфонила; алкилоксикарбонила; арилоксиалкила; моноариламиноалкила; арила; арилалкила; арилалкенила; пирролидинила; фурилалкила, необязательно замещенного 1 или 2 алкильными радикалами; бензофурилалкила; 2,3-дигидробензоHet означает моноциклический гетероциклический радикал, выбираемый из группы, состоящей из пирролила, пиразолила, имидазолила, пиридинила, пиримидинила, пиразинила, пиридазинила, пирролидинила, имидазолидинила, пирразолидинила, пиперидинила, диазепила, морфолинила, тиоморфолинила,пиперазинила, имидазолидинила, 2 Н-пирролила, пирролинила, имидазолинила, пирразолинила, фуранила, тиенила, оксазолила, изоксазолила, тиазолила, тиадиазолила, изотиазолила, диоксолила, дитианила,тетрагидрофурила, триазолила и триазинила; или бициклический гетероциклический радикал, выбираемый из группы, состоящей из хинолинила, изохинолинила, 1,2,3, 4-тетрагидроизохинолинила, хиноксалинила, индолила, изоиндолила, бензимидазолила, бензоксазолила, бензизоксазолила, бензотиазолила,бензизотиазолила, бензофуранила, бензотиенила, бензопиперидинила, хроменила и имидазо[1,2 а]пиридинила; где каждый Het необязательно замещен алкилом; или два смежных остатка ХА, XB и YA, YB могут быть конденсированы вместе с образованием двух-3 011514 валентного 1,2,3,4-тетрагидроизохинолинильного радикала, необязательно замещенного водородом, алкилом, арилом, арилалкилом, алкилкарбонилом, алкилсульфонилом и пирролидинилалкилом; арил означает нафталинил или фенил, каждый необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо друг от друга выбирают из группы, состоящей из галогена, циано,гидрокси, амино, алкиламино, алкилоксиалкиламино, оксо, карбокси, нитро, тио, формила и алкилокси; алкил означает линейный или разветвленный насыщенный углеводородный радикал, имеющий 1-6 атомов углерода; или циклический насыщенный углеводородный радикал, имеющий 3-7 атомов углерода; или циклический насыщенный углеводородный радикал, имеющий 3-7 атомов углерода, присоединенный к линейному или разветвленному насыщенному углеводородному радикалу, имеющему 1-6 атомов углерода; причем один или более атомов углерода каждого радикала может быть необязательно замещен одним или более радикалами, выбираемыми из группы, состоящей из галогена, циано, гидрокси,амино, оксо, карбокси, нитро, тио и формила; и алкенил означает алкильный радикал, как описано выше, имеющий, далее, одну или более двойных связей. Данное изобретение также относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель или разбавитель и в качестве активного ингредиента терапевтически эффективное количество соединения согласно данному изобретению, в частности, соединения формулы (I), его фармацевтически приемлемой аддитивной соли кислоты или основания, его стереохимически изомерной формы, его N-оксидной формы или его четвертичной аммониевой соли. Данное изобретение также относится к применению соединения согласно данному изобретению для получения лекарственного средства для предупреждения и/или лечения нарушения или заболевания,чувствительного к антагонизму 2-адренергического рецептора, в частности к антагонизму 2Cадренергического рецептора. В частности, данное изобретение относится к применению соединения согласно данному изобретению для получения лекарственного средства для предупреждения и/или лечения нарушений центральной нервной системы, перепадов настроения, тревоги, стресс-зависимых расстройств, связанных с депрессией и/или тревогой, когнитивных расстройств, изменений личности, шизоаффективных расстройств, болезни Паркинсона, деменции типа Альцгеймера, состояний хронической боли, нейродегенеративных нарушений, аддикционных расстройств, расстройств эмоционального типа и половой дисфункции. Соединения согласно данному изобретению также могут быть пригодны в качестве дополнительного лечения и/или профилактики вышеперечисленных заболеваний, в комбинации с антидепрессантами,анксиолитиками и/или нейролептиками, которые доступны в настоящее время или находятся в разработке или которые станут доступными в будущем, для улучшения эффективности и/или начала действия. Это оценивалось на моделях грызунов, для которых показано, что антидепрессанты, анксиолитики и/или нейролептики являются активными. Например, соединения оценивали в комбинации с антидепрессантами, анксиолитиками и/или нейролептиками в отношении ослабления индуцируемой стрессом гипертермии. Следовательно, настоящее изобретение также относится к применению соединений согласно данному изобретению, в качестве дополнительного лечения, с одним или более другими соединениями, выбираемыми из группы, состоящей из антидепрессантов, анксиолитиков и/или нейролептиков, в фармацевтической композиции, содержащей соединения согласно данному изобретению и одно или более других соединений, выбираемых из группы, состоящей из антидепрессантов, анксиолитиков и/или нейролептиков, а также к способу получения таких фармацевтических композиций и к применению такой композиции для получения лекарственного средства, в частности, для улучшения эффективности и/или начала действия при лечении депрессии и/или тревоги. Подробное описание данного изобретения В предпочтительном воплощении данное изобретение относится к соединению согласно общей формуле (I), его фармацевтически приемлемой аддитивной соли кислоты или основания, его стереохимически изомерной форме, его N-оксидной форме или его четвертичной аммониевой соли, где Z1 означает CH и Z2 означает N; или Z1 означает N и Z2 означает N; или Z1 означает CH и Z2 означает CH, Z1 означает CH и Z2 означает CH. Еще в одном предпочтительном воплощении данное изобретение относится к соединению согласно общей формуле (I), его фармацевтически приемлемой аддитивной соли кислоты или основания, его стереохимически изомерной форме, его N-оксидной форме или его четвертичной аммониевой соли, Z1 означает CH и Z2 означает N. В другом предпочтительном воплощении данное изобретение относится к соединению согласно общей формуле (I), его фармацевтически приемлемой аддитивной соли кислоты или основания, его стереохимически изомерной форме, его N-оксидной форме или его четвертичной аммониевой соли, где каждый из ХА и XB независимо друг от друга выбирают из группы, состоящей из ковалентной связи, -CH2-,-CH2CH2-, -CH2CH2CH2-, -CH2CH2CH2CH2-, -CH(СН 3)CH(СН 3)-, -C6H4-, -СН 2 С 6 Н 5-, -СН 2 СН 2 С 6 Н 5-,-C6H5CH2-, -C6H5CH2CH2-, -CH2C6H4CH2- и -CH2CH2C6H4CH2CH2-. В дальнейшем предпочтительном воплощении данное изобретение относится к соединению соглас-4 011514 но общей формуле (I), его фармацевтически приемлемой аддитивной соли кислоты или основания, его стереохимически изомерной форме, его N-оксидной форме или его четвертичной аммониевой соли, где каждый из ХА и XB независимо друг от друга выбирают из группы, состоящей из ковалентной связи,-CH2-, -CH2CH2-, -CH2CH2CH2-, -CH(CH3)CH(CH3)-, -C6H4-, -CH2C6H5-, -C6H5CH2- и -CH2C6H4CH2-. Предпочтительно ХА и XB, каждый независимо друг от друга, представляют собой -CH2CH2- и -CH2C6H5-. Более предпочтительно ХА означает -CH2C6H5-, а XB означает -CH2CH2-. В следующем предпочтительном воплощении данное изобретение относится к соединению согласно общей формуле (I), его фармацевтически приемлемой аддитивной соли кислоты или основания, его стереохимически изомерной форме, его N-оксидной форме или его четвертичной аммониевой соли, гдеYB означает Pir; или YA означает Pir и YB означает NR1R2. Еще в одном предпочтительном воплощении данное изобретение относится к соединению согласно общей формуле (I), его фармацевтически приемлемой аддитивной соли кислоты или основания, его стереохимически изомерной форме, его N-оксидной форме или его четвертичной аммониевой соли, где YA означает Pir и YB означает NR1R2. В следующем предпочтительном воплощении данное изобретение относится к соединению согласно общей формуле (I), его фармацевтически приемлемой аддитивной соли кислоты или основания, его стереохимически изомерной форме, его N-оксидной форме или его четвертичной аммониевой соли, гдеPir выбирают из группы, состоящей из пирролидинила; пиперидинила; диазепанила; морфолинила; 1,2,3,4-тетрагидроизохинолинила; 7,9-диазабицикло[4.2.2]дец-3-енила и изоиндолила; где каждый радикал Pir может быть необязательно замещен одним или более радикалами, выбираемыми из группы, состоящей из гидрокси; оксо; алкила; алкилоксикарбонила; арилоксиалкила, в частности, фенилоксиэтила; моноариламиноалкила; арила; арилалкила; арилалкенила, в частности, 1-(2-метил-3-фенилаллил); пирролидинила; фурилалкила, необязательно замещенного 1 или 2 алкильными радикалами; бензофурилалкила; 2,3-дигидробензо[1,4]диоксинилалкила; хинолинилалкила; бензотиенилалкила и индолилалкила, необязательно замещенного галогеном. В дальнейшем предпочтительном воплощении данное изобретение относится к соединению согласно общей формуле (I), его фармацевтически приемлемой аддитивной соли кислоты или основания, его стереохимически изомерной форме, его N-оксидной форме или его четвертичной аммониевой соли, гдеPir означает морфолинил. Еще в другом предпочтительном воплощении данное изобретение относится к соединению согласно общей формуле (I), его фармацевтически приемлемой аддитивной соли кислоты или основания, его стереохимически изомерной форме, его N-оксидной форме или его четвертичной аммониевой соли, где каждый из R1 и R2, независимо друг от друга, выбирают из группы, состоящей из водорода; алкила; арила и алкила, замещенного радикалом, выбираемым из группы, состоящей из арила, арилокси, Het и-NRaRb, где Ra и Rb, каждый независимо, выбирают из группы, состоящей из водорода, алкила и арилалкила. Предпочтительно данное изобретение относится к соединению согласно общей формуле (I), его фармацевтически приемлемой аддитивной соли кислоты или основания, его стереохимически изомерной форме, его N-оксидной форме или его четвертичной аммониевой соли, где Het выбирают из группы, состоящей из пиридинила, пирролидинила, пиперидинила, морфолинила, пиперазинила и тетрагидрофурила. В дальнейшем предпочтительном воплощении данное изобретение относится к соединению согласно общей формуле (I), его фармацевтически приемлемой аддитивной соли кислоты или основания, его стереохимически изомерной форме, его N-оксидной форме или его четвертичной аммониевой соли, где каждый из R1 и R2, независимо друг от друга, выбирают из группы, состоящей из водорода; метила; этила; фенила; и метила и этила, каждый из которых замещен радикалом, выбираемым из группы, состоящей из фенила, фенилокси, диметиламино, (бензил)(метил)амино, (циклогексилметил)(метил)амино, пиридинила, пирролидинила, пиперидинила, морфолинила, пиперазинила и тетрагидрофурила. Более предпочтительно R1 и R2, независимо друг от друга, выбирают из группы, состоящей из водорода и фенилоксиэтила. Наиболее предпочтительно R1 означает водород, a R2 означает фенилоксиэтил. В следующем предпочтительном воплощении данное изобретение относится к соединению согласно общей формуле (I), его фармацевтически приемлемой аддитивной соли кислоты или основания, его стереохимически изомерной форме, его N-оксидной форме или его четвертичной аммониевой соли, гдеZ1 означает CH и Z2 означает N; или Z1 означает N и Z2 означает CH; или Z1 означает CH и Z2 означает CH; ХА и XB, каждый независимо друг от друга, означают ковалентную связь или C1-4-алкил, где одно двухвалентное звено -СН 2- может быть заменено двухвалентным фенильным звеном;YA и YB, каждый независимо друг от друга, означают радикал, выбираемый из группы, состоящей из NR1R2 и Pir;R1 и R2, каждый независимо друг от друга, выбирают из группы, состоящей из водорода; алкила; арила и алкила, замещенного радикалом, выбираемым из группы, состоящей из арила, арилокси, Het и-NRaRb, где Ra и Rb, каждый независимо выбирают из группы, состоящей из водорода, алкила и арилалкила;Pir означает гетероциклический радикал, выбираемый из группы, состоящей из пирролидинила; пиперидинила; диазепанила; морфолинила; 1,2,3,4-тетрагидроизохинолинила; 7,9-диазабицикло[4.2.2]дец 3-енила и изоиндолила; где каждый радикал Pir может быть необязательно замещен одним или более радикалами, выбираемыми из группы, состоящей из гидрокси; оксо; алкила; алкилоксикарбонила; арилоксиалкила; моноариламиноалкила; арила, арилалкила; арилалкенила; пирролидинила; фурилалкила,необязательно замещенного 1 или 2 алкильными радикалами; бензофурилалкила; 2,3 дигидробензо[1,4]диоксинилалкила; хинолинилалкила; бензотиенилалкила и индолилалкила, необязательно замещенного галогеном;Het означает моноциклический гетероциклический радикал, выбираемый из группы, состоящей из пиридинила, пирролидинила, пиперидинила, морфолинила, пиперазинила и тетрагидрофурила; или два смежных остатка ХА и XB и YA и YB вместе могут образовывать двухвалентный 1,2,3,4 тетрагидроизохинолинильный радикал, необязательно замещенный водородом, алкилом, арилалкилом,алкилкарбонилом, алкилсульфонилом и пирролидинилалкилом; и арил означает нафталинил или фенил, каждый необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо друг от друга выбирают из группы, состоящей из галогена, циано,гидрокси и алкилокси. Еще в одном предпочтительном воплощении данное изобретение относится к соединению согласно общей формуле (I), его фармацевтически приемлемой аддитивной соли кислоты или основания, его стереохимически изомерной форме, его N-оксидной форме или его четвертичной аммониевой соли, где арилоксиалкил означает фенилоксиэтил, арилалкенил означает 2-метил-3-фенилаллил и изоиндолил замещен двумя остатками оксо с образованием изоиндол-1,3-дионильного остатка. Наиболее предпочтительно данное изобретение относится к 4-(4-морфолин-4-илметилфенил)-2-[2(2-феноксиэтиламино)этил]-2,4-дигидро[1,2,4]триазол-3-ону, его фармацевтически приемлемой аддитивной соли кислоты или основания, его стереохимически изомерной форме, его N-оксидной форме или его четвертичной аммониевой соли. В рамках данной заявки алкил означает линейный или разветвленный насыщенный углеводородный радикал, имеющий 1-6 атомов углерода; или циклический насыщенный углеводородный (циклоалкильный) радикал, имеющий 3-7 атомов углерода; или циклический насыщенный углеводородный радикал, имеющий 3-7 атомов углерода, присоединенный к линейному или разветвленному насыщенному углеводородному радикалу, имеющему 1-6 атомов углерода; где каждый радикал может быть необязательно замещен в случае одного или более атомов углерода одним или более радикалами, выбираемыми из группы, состоящей из галогена, циано, гидрокси, амино, оксо, карбокси, нитро, тио и формила. Предпочтительно алкил означает метил, этил, пропил, изопропил, бутил, трет-бутил, циклопропил, циклопентил, циклогексил, циклогексилметил и циклогексилэтил. В рамках данной заявки алкенил означает алкильный радикал, как описано выше, имеющий далее одну или более двойных связей. Предпочтительно алкенил означает этенил и пропенил. В рамках данной заявки галоген является заместителем, выбираемым из группы, состоящей из фтора, хлора, брома и йода, а полигалогеналкил означает линейный или разветвленный насыщенный углеводородный радикал, имеющий 1-6 атомов углерода, или циклический насыщенный углеводородный радикал, имеющий 3-7 атомов углерода, где один или более атомов углерода замещены одним или более атомами галогена. Предпочтительно галоген означает бром, фтор или хлор, и предпочтительно полигалогеналкил означает трифторметил. В рамках данной заявки термин соединения согласно данному изобретению означает соединение согласно общей формуле (I), его фармацевтически приемлемую аддитивную соль кислоты или основания, его стереохимически изомерную форму, его N-оксидную форму или его четвертичную аммониевую соль. Поясняют, что фармацевтически приемлемые аддитивные соли кислоты включают терапевтически активные нетоксичные аддитивные солевые формы с кислотой, которые способны образовывать соединения согласно формуле (I). Указанные соли можно получать путем обработки основной формы соединений согласно формуле (I) соответствующими кислотами, например неорганическими кислотами, например галогенводородными кислотами, как, в частности, соляная кислота, бромисто-водородная кислота, серная кислота, азотная кислота и фосфорная кислота; органическими кислотами, как, например, уксусная кислота, гидроксиуксусная кислота, пропановая кислота, молочная кислота, пировиноградная кислота, щавелевая кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, яблочная кислота, винная кислота, лимонная кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, цикламиновая кислота, салициловая кислота, п-аминосалициловая кислота и памовая кислота. Наоборот, вышеуказанные аддитивные солевые формы с кислотой можно превращать в форму свободного основания путем обработки соответствующим основанием. Соединения согласно формуле (I), содержащие кислотные протоны, также можно превращать в их-6 011514 терапевтически активные нетоксичные аддитивные солевые формы с металлами или аминами (аддитивные соли основания) путем обработки соответствующими органическими и неорганическими основаниями. Соответствующие солевые формы основания включают, например, соли аммония, соли щелочных и щелочно-земельных металлов, в частности соли лития, натрия, калия, магния и кальция, соли с органическими основаниями, как, например, соли бензатина, N-метил-D-глюкамина, гибрамина, и соли с аминокислотами, как, например, аргинин и лизин. Наоборот, вышеуказанные солевые формы можно превращать в свободные формы путем обработки соответствующей кислотой. Четвертичные аммониевые соли соединений согласно формуле (I) представляют собой вышеуказанные соединения, которые способны образовываться путем реакции между основным азотом соединения согласно формуле (I) и соответствующим кватернизирующим агентом, таким как, например, необязательно замещенный алкилгалогенид, арилгалогенид или арилалкилгалогенид, в частности метилиодид и бензилиодид. Также могут быть использованы другие реагенты с пригодным образом удаляемыми группами, такие как, например, алкилтрифторметансульфонаты, алкилметансульфонаты и алкил-птолуолсульфонаты. Четвертичные аммониевые соли имеют положительно заряженный атом азота. Фармацевтически приемлемые противоионы включают ионы хлора, брома, йода, трифторацетата и ацетата. Термин аддитивная соль, как используется в рамках данной заявки, также включает сольваты, которые способны образовывать соединения согласно формуле (I), а также их соли. Такими сольватами являются, например, гидраты и алкоголяты.N-оксидные формы соединений согласно формуле (I) включают такие соединения формулы (I), где один или несколько атомов азота окислены до так называемого N-оксида, особенно таких N-оксидов, гдеN-окислены один или более третичных атомов азота (например, в случае пиперазинила или пиперидинила). Такие N-оксиды могут быть легко получены квалифицированным специалистом в данной области без каких-либо изобретательских специальных знаний, и они являются очевидными альтернативами соединениям согласно формуле (I), так как такие соединения являются метаболитами, которые образуются путем окисления в человеческом организме при поглощении. Как вообще известно, окисление обычно является первой стадией, вовлекаемой в лекарственный метаболизм (Textbook of Organic Medicinal andPharmaceutical Chemistry, 1977, стр. 70-75). Как также вообще известно, метаболитная форма соединения также может быть введена человеку вместо самого по себе соединения с почти подобными эффектами. Соединения формулы (I) можно превращать в соответствующие N-оксидные формы с помощью следующих известных в уровне техники способов превращения трехвалентного азота в его N-оксидную форму. Вышеуказанная реакция N-окисления обычно может быть осуществлена путем введения во взаимодействие исходного вещества формулы (I) с соответствующим органическим или неорганическим пероксидом. Соответствующие неорганические пероксиды включают, например, пероксид водорода, пероксиды щелочных или щелочно-земельных металлов, например, пероксид натрия, пероксид калия; соответствующие органические пероксиды могут включать надкислоты, такие как, например, бензолнадкарбоновая кислота или галогензамещенная бензолнадкарбоновая кислота, например 3 хлорбензолнадкарбоновая кислота, надалкановые кислоты, например надуксусная кислота, алкилгидропероксиды, например трет-бутилгидропероксид. Подходящими растворителями являются, например,вода, низшие алканолы, например этанол и т.п., углеводороды, например толуол, кетоны, например 2 бутанон, галогенированные углеводороды, например дихлорметан, и смеси таких растворителей. Термин стереохимически изомерные формы, как используется в данном контексте, относится ко всем возможным изомерным формам, которые могут иметь соединения формулы (I). За исключением иначе упомянутого или указанного, химическое обозначение соединений относится к смеси всех возможных стереохимически изомерных форм, причем вышеуказанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. В особенности, стереогенные центры могут иметь Rи S-конфигурацию; заместители у двухвалентных циклических (частично) насыщенных радикалов могут иметь или цис- или транс-конфигурацию. Соединения, включающие двойные связи, могут иметь E- илиZ-стереохимию по вышеуказанной двойной связи. Подразумевают, что стереохимически изомерные формы соединений формулы (I) входят в рамки данного изобретения. Следуя конвенциям по номенклатуре CAS, когда в молекуле имеются два стереогенных центра известной абсолютной конфигурации, дескриптор R или S относится (на основе правила последовательности Кана-Инголда-Прелога) к хиральному центру с наименьшей нумерацией, эталонному центру. Конфигурацию второго стереогенного центра указывают, используя относительные дескрипторы [R,R] или [R,S], где R всегда указывают в качестве эталонного центра, a [R,R] означает центры с идентичной хиральностью и [R,S] означает центры с различной хиральностью. Например, если хиральный центр с наименьшей нумерацией в молекуле имеет S-конфигурацию, а второй центр имеет Rконфигурацию, стереодескриптор должен быть указан как S-[R,S]. Если используют обозначенияи : положение высшего приоритетного заместителя у асимметрического атома углерода в циклической системе, имеющего самый низший номер цикла, является всегда произвольным в положениив-7 011514 отношении средней плоскости, определяемой циклической системой. Положение высшего приоритетного заместителя у другого асимметрического атома углерода в циклической системе (атом водорода в соединениях согласно формуле (I, соотносительно положению высшего приоритетного заместителя у эталонного атома, обозначают , если он находится на той же стороне средней плоскости, определяемой циклической системой, или , если он находится на другой стороне средней плоскости, определяемой циклической системой. Данное изобретение также включает производные соединения, (обычно называемые пролекарствами) фармакологически активных соединений согласно данному изобретению, которые распадаются invivo с образованием соединений согласно данному изобретению. Пролекарства обычно (но не всегда) обладают более низкой эффективностью по отношению к рецептору-мишени, чем соединения, на которые они распадаются. Пролекарства особенно пригодны, когда желательное соединение обладает химическими или физическими свойствами, которые делают его введение затруднительным или неэффективным. Например, желательное соединение может быть только плохо растворимым, оно может быть плохо транспортируемым сквозь эпителий слизистой оболочки или оно может иметь нежелательно короткий период полувыведения из плазмы. Дальнейшая дискуссия по пролекарствам может быть найдена у StellaV.J. и др., "Prodrugs", Drug Delivery Systems, 1985, стр.112-176, и Drugs, 1985, 29, стр.455-473. Пролекарственные формы фармакологически активных соединений согласно данному изобретению, как правило, являются соединениями согласно формуле (I), их фармацевтически приемлемыми аддитивными солями кислоты или основания, их стереохимически изомерными формами и их N-оксидной формой, имеющими кислотную группу, которая этерифицирована или амидирована. Включенными в такие этерифицированные кислотные группы являются группы формулы -COORx, где Rx означает C1-6 алкил, фенил, бензил или одну из следующих групп: Амидированные группы включают группы формулы -CONRyRz, где Ry означает H, C1-6-алкил, фенил или бензил, и Rz означает -ОН, H, C1-6-алкил, фенил или бензил. Соединения согласно данному изобретению, имеющие аминогруппу, могут быть дериватизированы с помощью кетона или альдегида, как,например, формальдегид, с образованием основания Манниха. Это основание может гидролизоваться в соответствии с кинетикой первого порядка в водном растворе. В рамках данной заявки термин соединение согласно данному изобретению означает соединение согласно общей формуле (I), его фармацевтически приемлемые аддитивные соли кислоты или основания,его стереохимически изомерные формы, его N-оксидную форму и его пролекарственную форму. В рамках данной заявки термин элемент, в частности, когда это указывается в связи с соединением согласно формуле (I), включает все изотопы и смеси изотопов этого элемента, или встречающиеся в природе или полученные синтетически, или в естественном избытке или, в обогащенной изотопами форме. В частности, когда указан водород, то подразумевают, что это относится и к 1H, 2H, 3H и их смесям; когда указан углерод, то подразумевают, что это относится к 11C, 12C, 13C, 14C и их смесям; когда указан азот, то подразумевают, что это относится к 13N, 14N, 15N и их смесям; когда указан кислород, то подразумевают, что это относится к 14O, 15O, 16O, 17O, 18O и их смесям; когда указан фтор, то подразумевают,что это относится к 18F, 19F и их смесям. Соединения согласно данному изобретению, следовательно, также включают соединения с одним или более изотопами одного или более элементов и их смесей, включая радиоактивные соединения, также называемые радиактивно меченными соединениями, где один или более нерадиоактивных атомов замещены одним из их радиоактивных изотопов. Термин радиоактивно меченное соединение означает любое соединение согласно формуле (I), его N-оксидную форму, его фармацевтически приемлемую аддитивную соль или его стереохимически изомерную форму, которая содержит по меньшей мере один радиоактивный атом. Например, соединения могут быть мечены позитрон- или гамма-эмиттирующими радиоактивными изотопами. Для методик радиолигандного связывания (тест мембранного рецептора),3 Н-атом или 125I-атом является атомом, выбираемым для замены. Например, обычно наиболее используемыми эмиттирующими позитроны (PET) радиоактивными изотопами являются 11C, 18F, 15O и 13N, которые все генерируются ускорителем и имеют периоды полураспада, равные 20, 100, 2 и 10 мин соответственно. Поскольку периоды полураспада этих радиоактивных изотопов являются такими короткими, их использование возможно только в учреждениях, которые располагают ускорителем для их генерирования, что, таким образом, ограничивает их применение. Наиболее широко используемыми из изотопов являются 18F, 99mTc, 201Tl и 123I. Обращение с этими радиоактивными изотопами, их получение, выделение и введение в молекулу известны квалифицированному специалисту в данной области. В частности, радиоактивный атом выбирают из группы, состоящей из водорода, углерода, азота, серы, кислорода и галогена. Предпочтительно радиоактивный атом выбирают из группы, состоящей из-8 011514 водорода, углерода и галогена. В частности, радиоактивный изотоп выбирают из группы, состоящей из 3H, 11C, 18F, 122I, 123I, 125I,131 75I, Br, 76Br, 77Br и 82Br. Предпочтительно радиоактивный изотоп выбирают из группы, состоящей из 3H, 11C и 18F. Получение Соединения согласно данному изобретению обычно могут быть получены путем последовательности стадий, каждая из которых известна квалифицированному специалисту в данной области. В частности, производные триазолона, тетразолона и имидазолона можно получать в соответствии со следующими способами синтеза. Синтез производных триазолона Способ А. Реакции исходных производных амина или анилина с этиловым эфиром [(диметиламино)метилен]гидразинкарбоновой кислоты могут быть проведены в полярном апротонном растворителе,таком как ацетонитрил, при подходящей температуре, или путем стандартного нагрева, или в условиях микроволнового излучения, в период времени, в течение которого обеспечивается полнота протекания реакции, обычно 20 мин, при температуре 180C, в условиях микроволнового излучения. Радикал Hal в остатке Hal-XB-YB означает атом галогена, такой как Cl, Br или I. Реакции алкилирования а) можно осуществлять в апротонном полярном растворителе, таком как, например, ацетонитрил,ДМФА или диоксан; в присутствии неорганического или органического основания, такого как K2CO3,Na2CO3, Cs2CO3, NaH, Et3N, BTPP или PS-TBD; при подходящей температуре, или в условиях микроволнового излучения, или путем стандартного нагрева. Когда XB означает арильный цикл, Hal означает атом Br или атом I или подходящую группу, такую как CF3SO3, и реакцию b) связывания с палладием проводят в апротонном растворителе, таком как толуол или диоксан; в присутствии палладиевого катализатора, такого как Pd(AcO)2 или Pd(dba)3; в присутствии основания, такого как Cs2CO3 или трет-BuONa, и лиганда, такого как BINAP или Xantphos; при подходящей температуре, или путем стандартного нагрева, или в условиях микроволнового излучения, в период времени, в течение которого обеспечивается полнота протекания реакции. В качестве альтернативы реакция связывания с медью также может быть использована для получения арильных производных. В последнем случае Hal означает атом Br, или атом I, или подходящую группу, такую как B(OH)2. Реакцию проводят в апротонных растворителях, как, например, дихлорэтан, в присутствии соединения меди, такого как Cu(AcO)2, или в каталитическом или в эквивалентном количестве; в присутствии подходящего лиганда, такого как пиридин, и при подходящей температуре, или путем стандартного нагрева,или в условиях микроволнового излучения, в период времени, в течение которого обеспечивается полнота протекания реакции. Кроме того, можно добавлять к реакционной смеси неорганическое основание,такое как K3PO4. Способ В. На вышеуказанной схеме Z означает атом галогена, как в случае способа А, или гидроксильную-9 011514 группу. Реакции алкилирования а) и реакции связывания с палладием или медью b) можно осуществлять таким же путем, как описано в случае способа А. В случае, где Z=OH, реакцию типа Митцунобу можно использовать для получения желательных соединений. Таким образом, соответствующий спирт может быть введен во взаимодействие с необходимым триазолоновым промежуточным продуктом, в присутствии или ди-трет-бутилазадикарбоксилата, DEAD или DIAD, и трифенилфосфина, необязательно нанесенного на полимер, в апротонном растворителе, таком как дихлорметан. Синтез производных тетразолона Желательный тетразолоновый промежуточный продукт, указанный выше, можно получать какимлибо одним из двух способов, описанных в литературе (Biorg. Med. Chem. Lett., 1999, 1251-1254, и J.Med. Chem., 1986, 29, 2290-2297). Последующее алкилирование или реакцию связывания с палладием/медью необходимых промежуточных продуктов можно осуществлять в тех же самых реакционных условиях, как таковые, описанные на схеме, представленной в случае способа А для получения триазолонов. Синтез производных имидазолона Желательный имидазолоновый промежуточный продукт можно получать в три стадии, используя методики, хорошо известные любому специалисту в данной области. Замещение обоих имидазолов CDI осуществляют путем нагрева реагентов в период времени, в течение которого обеспечивается полнота протекания реакции, в подходящем апротонном растворителе, таком как этилацетат или ацетонитрил. Промежуточный продукт, далее, может быть циклизован путем нагрева продукта при подходящей температуре или за счет стандартного нагрева, или под действием микроволнового излучения, в воднокислотных условиях, таких как 10% раствор соляной кислоты в воде. Последующее алкилирование или реакцию связывания с палладием или медью необходимых промежуточных продуктов можно осуществлять в тех же самых реакционных условиях, как таковые, описанных на схеме, представленной в случае способа А для получения триазолонов. Промежуточное соединение согласно формуле (I), где по меньшей мере один из YA и YB означает радикал, выбираемый из группы, состоящей из алкила; галогена; формила; амино; морфолинила; алкилSO3-; циано; гидрокси; алкилоксикарбонила, в частности этилоксикарбонила и трет-бутилоксикарбонила(трет-BOC); арилалкилоксикарбонила, в частности бензилоксикарбонила; и алкилокси, в частности метокси, также составляют часть данного изобретения. Превращения различных YA- или YB-групп, имеющихся в промежуточных соединениях, в различные YA- и YB-группы, имеющиеся в конечных соединениях согласно формуле (I), можно осуществлять синтетическими методами, хорошо известными любому специалисту в данной области. Фармакология Неожиданно оказалось, что соединения согласно данному изобретению, в частности соединения согласно формуле (I), их фармацевтически приемлемые аддитивные соли кислоты или основания, их стереохимически изомерные формы, их N-оксидная форма или их четвертичные аммониевые соли, обладают аффинностью к связыванию с 2-адренергическим рецептором, в частности с 2C-адренергическим рецептором, в особенности, в качестве антагониста. Принимая во внимание их вышеуказанную эффективность, соединения согласно данному изобретению пригодны для предупреждения и/или лечения заболеваний, где антагонизм 2-адренергического рецептора, в частности антагонизм 2C-адренергического рецептора, подходит для терапевтического применения. В частности, соединения согласно данному изобретению могут быть пригодны для лечения- 10011514 и/или профилактики следующих заболеваний: нарушения центральной нервной системы, включая перепады настроения, включая, в особенности,депрессивное расстройство основного типа, депрессию без или с психотическими признаками, кататоническими признаками, меланхолическими признаками, атипичными признаками послеродовой атаки, и,в случае рецидивов, без или с сезонным характером, дистимию, биполярное нарушение I типа, биполярное нарушение II типа, циклотимию, непродолжительный депрессивный рецидив, смешанное аффективное нарушение, биполярное нарушение, не указанное иначе, перепад настроения вследствие общего состояния здоровья, перепад настроения, вызываемый веществом, перепад настроения, не указанный иначе, сезонное аффективное нарушение и предменструальные дисфорические расстройства; вызывающие состояние тревоги расстройства, включая приступы паники, агорафобию, паническое расстройство без агорафобии, агорафобию без истории панического расстройства, специфическую фобию, социальную фобию, обсессивно-компульсивное нарушение, посттравматический стресс, острый стресс, генерализованное состояние тревоги, вызывающее состояние тревоги расстройство вследствие общего состояния здоровья, состояние тревоги, вызываемое веществами, и состояние тревоги, не указанное иначе; связанные со стрессом расстройства, ассоциированные с депрессией и/или состоянием тревоги,включая острую стресс-реакцию, нарушения приспособляемости (короткая депрессивная реакция, продолжительная депрессивная реакция, смешанная реакция в отношении состояния тревоги и депрессии,нарушение приспособляемости с доминирующим отклонением в других эмоциях, нарушение приспособляемости с доминирующим патологическим отклонением в поведении, нарушение приспособляемости со смешанными патологическими отклонениями в эмоциях и поведении, нарушения приспособляемости с другими специфическими доминирующими симптомами) и другие реакции на сильный стресс; деменция, амнестические нарушения и когнитивные расстройства, не указанные иначе, особенно деменция, вызываемая дегенеративными нарушениями, повреждениями, травмами, инфекциями, сосудистыми нарушениями, токсинами, гипоксией, дефицитом витаминов или эндокринными нарушениями,или амнестические нарушения, вызываемые алкоголем или другими причинами дефицита тиамина, билатеральным повреждением височной доли головного мозга вследствие энцефалита, вызываемого вирусом простого герпеса, и других лимбических энцефалитов, вторичной нейронной потери за счет гипоксии/гипогликемии/сильных конвульсий и хирургического вмешательства, дегенеративных нарушений,сосудистых нарушений или околожелудочковой патологии типа III; когнитивные расстройства, в частности, вследствие ухудшения познавательной способности, возникающего в результате других медицинских условий; изменения личности, включая параноидное изменение личности, шизоидное изменение личности,типичное для шизофрении изменение личности, антисоциальное изменение личности, пограничное изменение личности, мимическое изменение личности, нарциссическое изменение личности, необщительность, ортостатическое изменение личности, обсессивно-компульсивное изменение личности и изменение личности, не указанное иначе; шизоаффективные нарушения, провоцируемые вследствие различных причин, включая шизоаффективные нарушения маниакального типа, депрессивного типа, смешанного типа, параноидную, дезорганизационную, кататоническую, недифференцированную и остаточную шизофрению, шизофреноподобное расстройство, шизоаффективное нарушение, вызывающее бред расстройство, кратковременное психотическое расстройство, общее психотическое расстройство, вызываемое веществом психотическое расстройство и психотическое расстройство, не указанное иначе; акинезия, синдромы неподвижности, дискинезия и вызываемый лекарственным средством паркинсонизм, синдром Жиль де ла Туретта и его симптомы, тремор, хорея, миоклония, различные виды тиков и дистония; расстройство, вызывающее дефицит внимания/гиперактивность (ADHD); болезнь Паркинсона, вызванный лекарственными средствами паркинсонизм, постэнцефалитный паркинсонизм, прогрессирующий супрануклеарный паралич, множественная системная атрофия, кортикобазальная дегенерация, комплекс паркинсонизм-ALS-деменция и кальциноз базальных ядер головного мозга; деменция типа Альцгеймера с ранней или поздней атакой, с депрессивным настроением; поведенческие патологические отклонения и нарушения психического равновесия при деменции и замедленном умственном развитии, включая возбужденное состояние и ажитацию; нарушения экстрапирамидного движения; синдром Дауна; акатизия; расстройства при принятии пищи, включая нервную анорексию, атипичную нервную анорексию,нервную булимию, атипичную нервную булимию, переедание, связанное с другими физиологическими расстройствами, рвоту, связанную с другими физиологическими расстройствами, и не указанные расстройства при принятии пищи; деменция, связанная со СПИД;- 11011514 состояния хронической боли, включая невропатическую боль, воспалительную боль, боль при раке и послеоперационную боль вследствие хирургического вмешательства, включая хирургическую стоматологию. Эти симптомы также могут включать острую боль, скелетно-мышечную боль, поясничную боль, боль верхних конечностей, фибромиалгию и миофасциальные болевые синдромы, орофасциальную боль, абдоминальную боль, фантомную боль, невралгию тройничного нерва и атипичную лицевую боль,повреждение нервных корешков и арахноидит, гериатрическую боль, центральную боль и воспалительную боль; нейродегенеративные заболевания, включая болезнь Альцгеймера, хорею Хантингтона, болезнь Крейтцфельда-Якоба, болезнь Пика, демиелинизирующие нарушения, такие как рассеянный склероз иALS, другие невропатии и невралгию, рассеянный склероз, боковой амиотрофический склероз, апоплексический удар и травму головы; аддикционные нарушения, включая зависимость от веществ или злоупотребление с или без физиологической зависимости, особенно, когда веществом является алкоголь, амфетамины, подобные амфетаминам вещества, кофеин, марихуана, кокаин, галлюциногены, средства для ингаляции, никотин, опиоиды, фенциклидин, подобные фенциклидину соединения, седативно-гипнотические средства, бензодиазепины и/или другие вещества, особенно пригодные для лечения абстиненции от вышеуказанных веществ и алкогольного абстинентного делириозного синдрома; перепады настроения, особенно, вызываемые алкоголем, амфетаминами, кофеином, марихуаной,кокаином, галлюциногенами, средствами для ингаляции, никотином, опиоидами, фенциклидином, седативными средствами, гипнотическими средствами, анксиолитиками и другими веществами; вызывающие состояния тревоги нарушения, особенно, индуцируемые алкоголем, амфетаминами,кофеином, марихуаной, кокаином, галлюциногенами, средствами для ингаляции, никотином, опиоидами,фенциклидином, седативными средствами, гипнотическими средствами, анксиолитиками и другими веществами, и нарушения приспособляемости с состоянием тревоги; прекращение курения; контроль массы тела, включая ожирение; нарушения сна и нарушения психического равновесия, включая диссомнию и/или парадиссомнию в качестве первичных нарушений сна, нарушения сна, связанные с другим психическим расстройством,нарушение сна вследствие общего состояния здоровья и нарушение сна, вызванное веществами; нарушения циркадного ритма; повышение качества сна; половая дисфункция, включая нарушение либидо, нарушение полового возбуждения, нарушение оргазма, сексуальные расстройства, сопровождающиеся болью, половая дисфункция вследствие общего состояния здоровья, половая дисфункция, вызванная веществами, и половая дисфункция, не указанная иначе. Данное изобретение, следовательно, относится к соединению согласно общей формуле (I), его фармацевтически приемлемой аддитивной соли кислоты или основания, его стереохимически изомерной форме, его N-оксидной форме или его четвертичной аммониевой соли для применения в качестве лекарственного средства. Данное изобретение также относится к применению соединения согласно данному изобретению для получения лекарственного средства в целях предупреждения и/или лечения нарушений центральной нервной системы, перепадов настроения, вызывающих состояние тревоги расстройств, связанных со стрессом расстройств, ассоциированных с депрессией и/или состоянием тревоги, когнитивных расстройств, изменений личности, шизоаффективных нарушений, болезни Паркинсона, деменции типа Альцгеймера, состояний хронической боли, нейродегенеративных заболеваний, аддикционных нарушений, перепадов настроения и половой дисфункции. Соединения согласно данному изобретению можно вводить в качестве дополнительного лечения и/или профилактики при вышеперечисленных заболеваниях, в комбинации с антидепрессантами, анксиолитиками и/или нейролептиками, которые доступны в настоящее время или находятся в стадии разработки, или которые станут доступны в будущем, в частности, для улучшения эффективности и/или начала действия. Должно быть понятно, что соединения согласно настоящему изобретению и другие агенты могут находиться в виде комбинированного препарата для одновременного, раздельного или последовательного применения для предупреждения и/или лечения депрессии и/или состояния тревоги. Такие комбинированные препараты могут быть, например, в форме двойной упаковки. Также должно быть понятно, что соединения согласно настоящему изобретению и другие агенты можно вводить в виде раздельных фармацевтических композиций, или одновременно, или последовательно. Данное изобретение, следовательно, также относится к применению соединений согласно данному изобретению в качестве дополнительного лечения в комбинации с одним или более другими соединениями, выбираемыми из группы антидепрессантов, анксиолитиков и нейролептиков. Подходящие классы антидепрессантов включают ингибиторы повторного поглощения норадреналина, селективные ингибиторы повторного поглощения серотонина (SSRI), ингибиторы моноаминоксидазы (MAOI), обратимые ингибиторы моноаминоксидазы (RIMA), ингибиторы повторного поглощения- 12011514 серотонина и норадреналина (SNRI), норадренергические и специфические серотонинергические антидепрессанты (NaSSA), антагонисты фактора высвобождения кортикотропина (CRF), антагонисты адренорецептора и атипичные антидепрессанты. Подходящие примеры ингибиторов повторного поглощения норадреналина включают амитриптилин, кломипрамин, доксепин, имипрамин, тримипрамин, амоксапин, дезипрамин, мапротилин, нортриптилин, протриптилин, ребоксетин и их фармацевтически приемлемые соли. Подходящие примеры селективных ингибиторов повторного поглощения серотонина включают флуоксетин, флувоксамин, пароксетин, сертралин и их фармацевтически приемлемые соли. Подходящие примеры ингибиторов моноаминоксидазы включают изокарбоксазид, фенелзин, транилципромин, селегилин и их фармацевтически приемлемые соли. Подходящие примеры обратимых ингибиторов моноаминоксидазы включают моклобемид и его фармацевтически приемлемые соли. Подходящие примеры ингибиторов повторного поглощения серотонина и норадреналина включают венлафаксин и его фармацевтически приемлемые соли. Подходящие атипичные антидепрессанты включают бупропион, литий, нефазодон, тразодон, вилоксазин, сибутрамин и их фармацевтически приемлемые соли. Другие подходящие антидепрессанты включают адиназолам, алапроклат, аминептин, комбинацию амитриптилин/хлордиазепоксид, атипамезол, азамиансерин, базинаприн, бефуралин, бифемелан, бинодалин, бипенамол, брофаромин, бупропион, кароксазон, церикламин, цианопрамин, цимоксатон, циталопрам, клемепрол, кловоксамин, дазепинил, деанол, демексиптилин, дибензепин, дотиепин, дроксидопа,энефексин, эстазолам, этоперидон, фемоксетин, фенгабин, фезоламин, флуотрацен, идазоксан, индалпин,инделоксазин, иприндол, левопротилин, литоксетин, лофепрамин, медифоксамин, метапрамин, метралиндол, миансерин, милнаципран, минаприн, миртазапин, монирелин, небрацетам, нефопам, ниаламид,номифензин, норфлуоксетин, оротирелин, оксафлозан, пиназепам, пирлиндон, пизотилин, ритансерин,ролипрам, серклоремин, сетиптилин, сибутрамин, сулбутиамин, сульпирид, тенилоксазин, тозалинон,тимолиберин, тианептин, тифлукарбин, тофенацин, тофизопам, толоксатон, томоксетин, вералиприд,виквиалин, зимелидин и зометапин, и их фармацевтически приемлемые соли, и зверобой, или Hypericumperforatum, или экстракты из него. Подходящие классы средств против состояния тревоги включают бензодиазепины, и агонисты или антагонисты 5-HT1A-рецептора, особенно, частичные агонисты 5-НТ 1 А-рецептора, антагонисты фактора высвобождения кортикотропина (CRF), обладающие мускариновой холинергической активностью соединения и соединения, воздействующие на ионные каналы. В добавление к бензодиазепинам, другими пригодными классами средств против состояния тревоги являются небензодиазепиновые седативногипнотические лекарственные средства, такие как золпидем; стабилизирующие настроение лекарственные средства, такие как клобазам, габапентин, ламотригин, лореклезол, окскарбамазепин, стирипентол и вигабатрин; и барбитураты. Пригодные нейролептические средства выбирают из группы, состоящей из ацетофеназина, в частности, в виде соли малеиновой кислоты; алентемола, в частности, в виде гидробромида; алпертина; азаперона; бателапина; в частности, в виде соли малеиновой кислоты; бенперидола; бензиндопирина, в частности, в виде гидрохлорида; брофоксина; бромперидола; бутакламола, в частности, в виде гидрохлорида; бутаперазина; карфеназина, в частности, в виде соли малеиновой кислоты; карвотролина, в частности, в виде гидрохлорида; хлорпромазина; хлорпротиксена; цинперена; цинтриамида; кломакрана, в частности, в виде соли фосфорной кислоты; клопентиксола; клопимозида; клопипазана, в частности, в виде соли метансульфокислоты; клороперона, в частности, в виде гидрохлорида; клотиапина; клотиксамида, в частности, в виде соли малеиновой кислоты; клозапина; циклофеназина, в частности, в виде гидрохлорида; дроперидола; этазолата, в частности, в виде гидрохлорида; фенимида; флуциндола; флумезапина; флуфеназина, в частности, в виде соли декановой кислоты, соли энантовой кислоты и/или в виде гидрохлорида; флуспиперона; флуспирилена; флутролина; гевотролина, в частности, в виде гидрохлорида; галопемида; галоперидола; илоперидона; имидолина, в частности, в виде гидрохлорида; ленперона; локсапина; мазапертина, в частности, в виде соли янтарной кислоты; мезоридазина; метиапина; миленперона; милипертина; молиндона, в частности, в виде гидрохлорида; наранола, в частности, в виде гидрохлорида; нефлумозида, в частности, в виде гидрохлорида; окаперидона; оланзапина; оксиперомида, пенфлуридола; пентиапина, в частности, в виде соли малеиновой кислоты; перфеназина; пимозида; пиноксепина, в частности, в виде гидрохлорида; пипамперона; пиперацетазина; пипотиазина, в частности, в виде соли пальмитиновой кислоты; пиквииндона, в частности, в виде гидрохлорида; прохлорперазина, в частности, в виде эдизилата; прохлорперазина, в частности, в виде соли малеиновой кислоты; промазина, в частности, в виде гидрохлорида; квиэтиапина; ремоксиприда; рисперидона; римказола, в частности, в виде гидрохлорида; сеперидола, в частности, в виде гидрохлорида; сертиндола; сетоперона; спиперона; сулпирида; тиоридазина; тиотиксена; торазина; тиоперидона, в частности, в виде гидрохлорида; тиоспирона, в частности, в виде гидрохлорида; трифлуоперазина, в частности, в виде гидрохлорида; трифлуперидола; трифлупромазина; зипразидона, в частности, в виде гидрохлорида; и их смесей.- 13011514 Фармацевтические композиции Данное изобретение также относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель или разбавитель и в качестве активного ингредиента терапевтически эффективное количество соединения согласно данному изобретению, в частности соединения согласно формуле (I), его фармацевтически приемлемой аддитивной соли кислоты или основания, его стереохимически изомерной формы, его N-оксидной формы или его четвертичной аммониевой соли. Соединения согласно данному изобретению, в частности соединения согласно формуле (I), их фармацевтически приемлемая аддитивная соль кислоты или основания, их стереохимически изомерная форма, их N-оксидная форма или их четвертичная аммониевая соль, или их любая подгруппа или комбинация, могут быть использованы для получения различных фармацевтических форм для целей введения. В качестве соответствующих композиций в данном случае могут быть указаны все композиции, обычно используемые для систематически вводимых лекарственных средств. Для получения фармацевтических композиций согласно данному изобретению эффективное количество отдельного соединения, необязательно в форме аддитивной соли, в качестве активного ингредиента, комбинируют путем тщательного смешения с фармацевтически приемлемым носителем, который может иметь большое разнообразие форм в зависимости от формы препарата, желательной для введения. Эти фармацевтические композиции желательны в стандартной разовой лекарственной форме, пригодной,в особенности, для перорального введения, ректального введения, чрескожного введения, путем парентеральной инъекции или в виде ингаляции. Например, при получении композиций в пероральной лекарственной форме может быть использована любая из обычных фармацевтических сред, такая как, например, вода, гликоли, масла, спирты и т.п., в случае пероральных жидких препаратов, таких как суспензии,сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара, каолин,разбавители, смазочные вещества, связующие агенты, дезинтегрирующие агенты и т.п. в случае порошков, пилюль, капсул и таблеток. Вследствие легкости их введения таблетки и капсулы представляют собой наиболее выгодные пероральные стандартные разовые лекарственные формы, в случае которых используют твердые фармацевтические носители. В случае парентеральных композиций носитель обычно включает стерильную воду, по меньшей мере, в большей части, однако, могут быть включены другие ингредиенты, например, для способствования растворимости. Например, могут быть получены инъецируемые растворы, в которых носитель включает физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Также могут быть получены инъецируемые суспензии,в случае которых могут быть использованы соответствующие жидкие носители, суспендирующие агенты и т.п. Также сюда включают препараты в твердой форме, которые предназначены для превращения, незадолго до употребления, в препараты в жидкой форме. В композициях, пригодных для чрескожного введения, носитель необязательно включает усиливающий пенетрацию агент и/или подходящий смачивающий агент, необязательно комбинированный с подходящими добавками любой природы в незначительных пропорциях, причем добавки не оказывают значительного вредного воздействия на кожу. Вышеуказанные добавки могут облегчать введение через кожу и/или могут быть полезны для получения желательных композиций. Эти композиции можно вводить различными путями, например, в виде трансдермального пластыря, в виде притирок, в виде мази. Это дает особые преимущества для получения вышеуказанных фармацевтических композиций в стандартной разовой лекарственной форме для легкости введения и единообразия дозы. Стандартная разовая лекарственная форма, как используется в данном контексте, относится к физически дискретным единицам, пригодным в качестве стандартной дозы, причем каждая единица содержит заранее определенное количество активного ингредиента, рассчитанное для получения желательного терапевтического эффекта, в сочетании с необходимым фармацевтическим носителем. Примерами таких стандартных разовых лекарственных форм являются таблетки (включая таблетки с насечкой или покрытые оболочкой таблетки), капсулы, пилюли, порошки в пакетах, облатки, суппозитории, инъецируемые растворы или суспензии, и т.п., и их сегрегированные множества. Так как соединения согласно данному изобретению являются эффективными антагонистами допамина при пероральном введении, то особенно благоприятны фармацевтические композиции, содержащие вышеуказанные соединения, для перорального введения. Данное изобретение также относится к фармацевтическим композициям, содержащим соединения согласно данному изобретению и одно или более других соединений, выбираемых из группы, состоящей из антидепрессантов, анксиолитиков и нейролептиков, а также к применению таких композиций для получения лекарственного средства, в частности, для улучшения эффективности и/или начала действия,при лечении депрессии и/или состояния тревоги. Следующие примеры предназначены для иллюстрации, не ограничивая объем настоящего изобретения. Экспериментальная часть А. Получение промежуточных соединений В дальнейшем, RT означает комнатную температуру, CDI означает 1,1'-карбонилдиимидазол, DIPE означает диизопропиловый эфир, MIK означает метилизобутилкетон, BINAP означает [1,1'-бинафталин]2,2'-диилбис[дифенилфосфин],NMP означает 1-метил-2-пирролидинон,Pd2(dba)3 означает- 14011514 трис(дибензилиденацетон)дипалладий, BTTP означает 1,1',1"-[(1,1-диметилэтил)фосфинимилидин]триспирролидин, Xantphos означает (9,9-диметил-9 Н-ксантен-4,5-диил)бис[дифенилфосфин], HATU означает 1-[бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиний-3-оксидгексафторфосфат и ДМФА означает N,N-диметилформамид. Пример A1. а-1. Получение промежуточного соединения 1. Смесь 4-(4-бромфенил)-2,4-дигидро-3 Н-1,2,4-триазол-3-она (0,002 моль), 1,1-диметилэтилового эфира 4-йод-1-пиперидинкарбоновой кислоты (0,003 моль) и Cs2CO3 (0,004 моль) в CH3CN (7 мл) нагревают в течение 10 мин в условиях микроволнового излучения при температуре 150C и затем в течение 10 мин при температуре 180C. Полученные твердые вещества отфильтровывают и растворитель выпаривают. Остаток очищают на фильтре, используя CH2Cl2, затем смесь CH2Cl2/СН 3 ОН (98/2), и получают желательный продукт. Выход: 0,25 г промежуточного соединения 1 (30%).b. Получение промежуточного соединения 2. Смесь промежуточного соединения 1 (0,00106 моль), цианида цинка (0,00064 моль) и Pd(PPh3)4(0,000088 моль) в дезоксигенированном ДМФА (5 мл) вводят во взаимодействие в течение 20 мин в условиях микроволнового излучения при температуре 150C, затем твердые вещества отфильтровывают и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле, используя смесь CH2Cl2/СН 3 ОН (98/2) и смесь CH2Cl2/СН 3 ОН (96/4), и после этого получают желательный продукт. Выход: 0,235 г промежуточного соединения 2 (60%). с. Получение промежуточного соединения 3 (удаление трет-BOC). Смесь промежуточного соединения 2 (0,00064 моль) в трифторуксусной кислоте (0,5 мл) и CH2Cl2(2 мл) перемешивают в течение 1 ч при комнатной температуре и добавляют насыщенный растворd. Получение промежуточного соединения 4. Смесь промежуточного соединения 3 (получено в соответствии с примером A1.с) (0,00046 моль), 2 метил-3-фенил-2-пропеналя (0,00092 моль) и NaBH(OAc)3 (0,00092 моль) в 1,2-дихлорэтане (3 мл) нагревают в течение 10 мин в условиях микроволнового излучения при температуре 100C и затем добавляют насыщенный раствор NH4Cl. Органический слой отделяют, сушат (Na2SO4), отфильтровывают и растворитель выпаривают. Остаток очищают в коллекторе (вакуум) (градиентный элюент: CH2Cl2/СН 3 ОН=98/2,96/4) и затем очищают далее путем улавливания и высвобождения. Фракции продукта собирают и растворитель выпаривают. Выход: 0,014 г промежуточного соединения 4 (8%). е. Получение промежуточного соединения 5. Смесь промежуточного соединения 4 (0,0005 моль) в ангидриде трифторметансульфоновой кислоты (1 мл) и этаноле (4 мл) перемешивают и кипятят с обратным холодильником в течение 48 ч, затем реакционную смесь выливают в насыщенный раствор Na2CO3 (10 мл) и экстрагируют CH2Cl2. Органический слой отделяют, сушат (Na2SO4), отфильтровывают и растворитель выпаривают. Остаток перколируют, используя коллектор (градиентный элюент: CH2Cl2/EtOAc=4/1, 1/1). Фракции продукта собирают и растворитель выпаривают. Выход: 0,079 г промежуточного соединения 5 (35%).f. Получение промежуточного соединения 6.DIBAL (0,00045 моль; 1,0M раствор в толуоле) добавляют при температуре -78 С к смеси промежуточного соединения 5 (0,00018 моль) в безводном толуоле (2 мл), затем реакционную смесь выдерживают для достижения комнатной температуры и перемешивают в течение 30 мин при комнатной температуре. Добавляют смесь CH2Cl2/СН 3 ОН (1/1) и избыток исходного вещества DIBAL-H гасят насыщенным раствором NH4Cl (0,5 мл). Полученные твердые вещества отфильтровывают при использовании дикалита и затем органический фильтрат сушат (Na2SO4) и растворитель выпаривают. Выход: 0,078 г промежуточного соединения 6 (100%, используют как таковое на следующей реакционной стадии без дальнейшей очистки). Пример А 2. а. Получение промежуточного соединения 27. Смесь 1,1-диметилэтилового эфира 4-пиперидинилкарбаминовой кислоты (0,0349 моль), 2-метил-3 фенил-2-пропеналя (0,0268 моль) и NaBH(OAc)3 (0,0349 моль) в дихлорэтане (130 мл) и молекулярных сит (4) (достаточное количество) перемешивают в течение ночи при комнатной температуре, затем реакционную смесь отфильтровывают через целит. Фильтрат обрабатывают 10% водным раствором NH4Cl и экстрагируют EtOAc. Органический слой отделяют, сушат (Na2SO4), отфильтровывают и растворитель выпаривают досуха. Выход: 11,44 г промежуточного соединения 27 (99%).b. Получение промежуточного соединения 28. Трифторуксусную кислоту (23,6 мл) по каплям добавляют к раствору промежуточного соединения 27 (0,014 моль) в CH2Cl2 (100 мл), охлажденному на бане со льдом и водой. Реакционную смесь перемешивают при температуре в диапазоне от 0C до комнатной температуры в течение 2 ч, затем подщелачивают с помощью 50% раствора NaOH и экстрагируют. Органический слой отделяют, сушат (Na2SO4),отфильтровывают и растворитель выпаривают досуха. Выход: 2,72 г промежуточного соединения 28(84%). с. Получение промежуточного соединения 7. Смесь промежуточного соединения 28 (0,005 моль) и этилового эфира [(диметиламино)метилен]гидразинкарбоновой кислоты (0,010 моль) в CH3CN (20 мл) нагревают в микроволновой печи в течение 20 мин при температуре 180C, затем растворитель выпаривают и полученный остаток промывают диэтиловым эфиром. Выход: 1,400 г промежуточного соединения 7 (94%).d. Получение промежуточного соединения 8. Смесь промежуточного соединения 7 (0,00084 моль), метилового эфира 4-бромбензойной кислоты(0,00126 моль), Pd2(dba)3 (0,000042 моль), BINAP (0,000126 моль) и трет-BuONa (0,00126 моль) в дезоксигенированном толуоле (3 мл) нагревают в микроволновой печи в течение 15 мин при температуре 175C и затем добавляют CH2Cl2 и 10% водный раствор NH4Cl. Органический слой отделяют, сушат(Na2SO4), отфильтровывают и растворитель выпаривают. Остаток очищают в коллекторе (вакуум) (градиентный элюент: CH2Cl2/EtOAc=4/1, 2/1). Фракции продукта собирают и растворитель выпаривают. Выход: 0,107 г промежуточного соединения 8 (29%). Пример A3. Получение промежуточного соединения 9.(получено в соответствии с примером A1.f) (0,00010 моль) и MnO2 (0,00050 моль) в дихлорэтане (1 мл) нагревают в микроволновой печи в течение 10 мин при температуре 120C. Твердые вещества отфильтровывают при использовании дикалита и промывают с помощью CH2Cl2, затем растворитель выпаривают. Выход: 0,037 г промежуточного соединения 9 (92%). Пример А 4. а. Получение промежуточного соединения 13.(0,0030 моль) в CH3CN (10 мл) нагревают в условиях микроволнового излучения в течение 10 мин при температуре 120C и затем добавляют CH2Cl2. Полученные твердые вещества отфильтровывают и растворитель выпаривают. Наконец, полученный остаток промывают диэтиловым эфиром. Выход: 0,392 г промежуточного соединения 13 (57%).b. Получение промежуточного соединения 10. СО (газ) барботируют через смесь промежуточного соединения 13 (получено в соответствии с примером А 4.а) (0,00022 моль), NaHCO3 (0,00033 моль) и Cl2Pd(PPh3)2 (0,000009 моль) в ДМФА (5 мл), затем реакционную смесь нагревают до температуры 110C, все время барботируя через нее СО (газ). Добавляют еще NaHCO3 (2 раза в достаточном количестве) и Cl2Pd(PPh3)2 (2 раза в достаточном количестве) и смесь нагревают в течение 2 ч при температуре 110C, барботируя через нее СО (газ). Растворитель выпаривают и остаток обрабатывают CH2Cl2. Твердые вещества отфильтровывают при использовании дикалита и растворитель выпаривают. Полученный остаток очищают в коллекторе (вакуум) (элюент:CH2Cl2/СН 3 ОН=96/4). Фракции продукта собирают и растворитель выпаривают. Выход: 0,081 г промежуточного соединения 10 (91%). Пример А 5. а. Получение промежуточного соединения 11. СмесьN-[4-[4-(4-метоксифенил)-1-пиперазинил]фенил]гидразинкарбоксамида (получен в соответствии с изложенным в WO 94/18978, содержание которой включено в данный контекст) (0,001 моль) и метанимидамида (0,029 моль) в ДМСО (10 мл) нагревают в течение 2 ч при температуре 160C. После охлаждения реакционную смесь выливают в смесь MIK и DIPE. Осадок отфильтровывают и обрабатывают активированным углем в ДМФА. После фильтрации продукт оставляют кристаллизоваться. Продукт отфильтровывают и сушат. Выход: 1 г промежуточного соединения 11 (28%).b. Получение промежуточного соединения 12. Смесь промежуточного соединения 11 (получено в соответствии с примером А 5.а) (0,001 моль), 1,1 диметилэтилового эфира 4-йод-1-пиперидинкарбоновой кислоты (0,002 моль) и BTPP (0,002 моль) вCH3CN (3,5 мл) нагревают в течение 20 мин при температуре 120C в условиях микроволнового излучения и собранные твердые вещества промывают с помощью CH3CN, затем очищают колоночной флэшхроматографией (элюент 1: CH2Cl2/EtOAc = 4/1, 1/1; элюент 2: CH2Cl2/2-пропанон = 1/1). Фракции продукта собирают и растворитель выпаривают. Выход: 0,120 г промежуточного соединения 12 (22%). Пример А 6. а. Получение промежуточного соединения 26. К смеси 1,2-дигидро-3 Н-1,2,4-триазол-3-она (5,74 ммоль) в толуоле (70 мл) добавляют ,дифенилбензолметанол (4,7 ммоль) и п-толуолсульфоновую кислоту (1,91 ммоль). Реакционную смесь кипятят с обратным холодильником, используя отделитель Дина-Старка, в атмосфере азота в течение 20 ч. Раствор охлаждают и реакцию гасят 2% водным раствором NaHCO3 и экстрагируют с помощьюCH2Cl2 (3 раза по 100 мл). Органический слой отделяют, сушат (Na2SO4) и растворитель выпаривают. Остаток очищают с помощью колоночной хроматографии (элюент: CH2Cl2/МеОН=9/1). Выход: 925 мг промежуточного соединения 26 (60%).b. Получение промежуточного соединения 39. К смеси промежуточного соединения 26 (2,446 ммоль) в ДМФА (2 мл) добавляют NaH (4,077 ммоль). Реакционную смесь перемешивают в течение 30 мин при комнатной температуре. Затем добавляют 2-(3-бромпропил)-1 Н-изоиндол-1,3(2H)-дион (2,70 ммоль) и реакционную смесь нагревают в течение 20 ч при температуре 90C. Затем растворитель выпаривают и продукт очищают с помощью колоночной хроматографии (элюент: CH2Cl2/СН 3 ОН=9/1). Отобранные фракции собирают и выпаривают из них растворитель. Выход: 94,0 мг промежуточного соединения 39 (75%). с. Получение промежуточного соединения 58. Смесь промежуточного соединения 39 (0,972 ммоль) в ТФУК/H2O/CH2Cl2 (1:1:1) (10 мл) перемешивают в течение 20 ч при температуре 60C. Растворитель удаляют и продукт очищают с помощью колоночной хроматографии (элюент: CH2Cl2/CH3OH = 9/1). Отобранные фракции собирают и растворитель из них выпаривают. Выход: 265 мг промежуточного соединения 58 (100%). Этот сырой продукт используют на следующей стадии без дальнейшей очистки.d. Получение промежуточного соединения 59.- 18011514 К смеси промежуточного соединения 58 (0,0367 ммоль) в CH2Cl2 (4 мл) добавляют PS-PPh3 (0,0734 ммоль) и 1,1-диметилэтиловый эфир 4-(гидроксиметил)-1-пиперидинкарбоновой кислоты (0,5505 ммоль). Реакционную смесь перемешивают в течение 5 мин. Затем добавляют бис(1,1-диметилэтиловый) эфир диазнедикарбоновой кислоты (0,5505 ммоль) и реакционную смесь перемешивают в течение 3 ч при комнатной температуре. Смолу отфильтровывают и из фильтрата выпаривают растворитель. Продукт очищают с помощью колоночной хроматографии (элюент: CH2Cl2/MeOH = 9/1). Отобранные фракции собирают и из них выпаривают растворитель. Остаток обрабатывают смесьюCH2Cl2/трифторуксусная кислота = 8/2, и растворитель выпаривают. Выход: 25 мг промежуточного соединения 59 (100%). Этот сырой продукт используют на следующей стадии без дальнейшей очистки. Пример А 7. а. Получение промежуточного соединения 29. Смесь 1-(фенилметил)-4-пиперидинамина (0,0125 моль) и метил-2-[(диметиламино)метилен]гидразинкарбоксилата (0,025 моль) в CH3CN (50 мл) вводят во взаимодействие в условиях микроволнового излучения в течение 20 мин при температуре 180C и затем растворитель выпаривают. Наконец, полученный остаток промывают смесью CH3CN/диэтиловый эфир (1/9). Выход: 2,6 г промежуточного соединения 29 (81%).b. Получение промежуточного соединения 30. Смесь промежуточного соединения 29 (0,003 моль), этилового эфира бромуксусной кислоты(0,0045 моль) и K2CO3 (0,006 моль) в CH3CN (10 мл) нагревают в условиях микроволнового излучения в течение 15 мин при температуре 120C и затем добавляют CH2Cl2. Твердые вещества отфильтровывают и органический растворитель выпаривают. Остаток очищают с помощью колоночной флэшхроматографии (элюент 1: CH2Cl2/EtOAc = 1/1; элюент 2: CH2Cl2/СН 3 ОН = 96/4). Фракции продукта собирают и растворитель выпаривают. Выход: 1,01 г промежуточного соединения 30 (98%). с. Получение промежуточного соединения 31. Смесь промежуточного соединения 30 (0,0029 моль) и 1-хлорэтилового эфира хлоругольной кислоты (0,0087 моль) в ТГФ (10 мл) перемешивают и кипятят с обратным холодильником в течение 1 ч, затем добавляют еще 1-хлорэтиловый эфир хлоругольной кислоты (0,939 мл) и реакционную смесь нагревают в течение 1 ч. Добавляют насыщенный раствор NaHCO3 и смесь экстрагируют CH2Cl2. Органический слой отделяют, сушат (Na2SO4), отфильтровывают и растворитель выпаривают. Остаток очищают с помощью колоночной флэш-хроматографии на силикагеле (элюент 1: CH2Cl2/EtOAc = 1/0, 1/1; элюент 2:CH2Cl2/СН 3 ОН = 9/1). Фракции продукта собирают и растворитель выпаривают. Выход: 0,28 г промежуточного соединения 31.d. Получение промежуточного соединения 32. Смесь промежуточного соединения 31 (0,00078 моль) в CH3OH (10 мл) перемешивают и кипятят с обратным холодильником в течение 1 ч и затем добавляют CH2Cl2 и насыщенный раствор Na2CO3. Органический слой отделяют, сушат (Na2SO4), отфильтровывают и растворитель выпаривают. Выход: 0,200 г промежуточного соединения 32. е. Получение промежуточного соединения 33.- 19011514 Смесь промежуточного соединения 32 (0,00079 моль), 2-метил-3-фенил-2-пропеналя (0,00119 моль) и NaBH(OAc)3 (0,00119 моль) в дихлорэтане (4 мл) нагревают в течение 10 мин при температуре 105C и затем добавляют NH4OH (38% раствор NH3 в H2O). Органический слой отделяют, сушат (Na2SO4), отфильтровывают и растворитель выпаривают. Остаток очищают с помощью колоночной флэшхроматографии в коллекторе (элюент 1: CH2Cl2/EtOAc = 9/1; элюент 2: CH2Cl2/СН 3 ОН = 96/4). Фракции продукта собирают и растворитель выпаривают. Выход: 0,055 г промежуточного соединения 33 (18%).f. Получение промежуточного соединения 14.NaBH4 (0,00035 моль) добавляют к смеси промежуточного соединения 33 (0,00014 моль) в CH3OH(150 мл) и ТГФ (0,750 мл) и затем реакционную смесь перемешивают в течение 1 ч при комнатной температуре. Добавляют 10% водный раствор NH4Cl и смесь экстрагируют CH2Cl2. Органический слой отделяют, сушат (Na2SO4), отфильтровывают и растворитель выпаривают. Выход: 0,038 г промежуточного соединения 14 (79%).g. Получение промежуточного соединения 15. Метилсульфонилхлорид (0,00017 моль) добавляют при температуре 0C к раствору промежуточного соединения 14 (получено в соответствии с примером А 7.а) (0,00011 моль) и Et3N (0,00022 моль) вCH2Cl2 (1 мл), затем реакционную смесь перемешивают в течение 1 ч при комнатной температуре и добавляют насыщенный раствор NaHCO3. Органический слой отделяют, сушат (Na2SO4), отфильтровывают и растворитель выпаривают. Остаток перколируют в коллекторе (картридж, 5 г) (элюент: CH2Cl2/СН 3 ОН = 97/3). Фракции продукта собирают и растворитель выпаривают. Выход: 0,033 г промежуточного соединения 15 (71%). Пример А 8. а. Получение промежуточного соединения 16. Бис(1,1-диметилэтиловый) эфир дикарбоновой кислоты (0,0094 моль) добавляют при температуре 0C к раствору промежуточного продукта(получен в соответствии с примером В 8.а) (0,0094 моль) и CH2Cl2 (0,0094 моль) в Et3N (25 мл) и реакционную смесь перемешивают в течение 1 ч при температуре 0C и затем при комнатной температуре. Растворитель выпаривают и остаток очищают с помощью колоночной флэш-хроматографии на силикагеле(градиентный элюент: CH2Cl2/EtOAc = 1/0, 1/1). Фракции продукта собирают и растворитель выпаривают. Выход: 3,5 г промежуточного соединения 16 (74%).b. Получение промежуточного соединения 17.(16,5 ммоль), PdCl2(PPh3)2 (0,28 ммоль) и ДМФА (50 мл) вносят в PARR-сосуд. Систему закрывают и создают повышенное давление с помощью СО (газ) (40 бар). Реакционную смесь нагревают при температуре 120C в течение 20 ч. Затем систему открывают. Растворитель выпаривают и твердое вещество обрабатывают CH2Cl2, отфильтровывают через целит. Растворитель из фильтрата выпаривают и остаток очищают с помощью колоночной хроматографии (градиентный элюент: CH2Cl2/EtOAc = 9/1 и 4/1). Отобранные фракции собирают и их растворитель выпаривают. Выход: 1,1 г промежуточного соединения 17(27%). с. Получение промежуточного соединения 18. Смесь промежуточного соединения 17 (получено в соответствии с примером А 8.b) (0,00029 моль),морфолина (0,00044 моль) и NaBH(OAc)3 (0,00044 моль) в дихлорэтане (2 мл) вводят во взаимодействие в течение 10 мин при температуре 100C и затем добавляют концентрированный раствор NH4OH. Органический слой отделяют, сушат (Na2SO4), отфильтровывают и растворитель выпаривают. Остаток перколируют при использовании картриджа с диоксидом кремния (5 г) (элюент 1: CH2Cl2/EtOAc = 4/1; элюент 2: CH2Cl2/CH3OH = 96/4). Фракции продукта собирают и растворитель выпаривают. Выход: 0,122 г промежуточного соединения 18 (80%). Пример А 9. а. Получение промежуточного соединения 19.NaBH4 (0,00031 моль) добавляют к раствору промежуточного соединения 17 (получено в соответствии с примером А 8.b) (0,00031 моль) в CH3OH (2 мл) при температуре 0C и реакционную смесь перемешивают в течение 1 ч при комнатной температуре. Добавляют 10% водный раствор NH4Cl и смесь экстрагируют CH2Cl2. Органический слой отделяют, сушат (Na2SO4), отфильтровывают и растворитель выпаривают. Остаток очищают в коллекторе (вакуум), используя картридж с диоксидом кремния Sep-Pak(5 г) (элюент 1: CH2Cl2/EtOAc = 4/1; элюент 2: CH2Cl2/2-пропанон = 2/1). Фракции продукта собирают и растворитель выпаривают. Выход: 0,054 г промежуточного соединения 19 (38%).b. Получение промежуточного соединения 20. Взаимодействие в атмосфере азота: смесь промежуточного соединения 19 (получено в соответствии с примером А 9.а) (0,00012 моль) в безводном ТГФ (1 мл) добавляют при температуре 0C к смеси 60%NaH (0,00024 моль) в безводном ТГФ (1 мл) и полученную смесь перемешивают в течение 15 мин, затем добавляют CH3I (0,00048 моль) при температуре 0C и реакционную смесь перемешивают в течение 90 мин при комнатной температуре. Добавляют еще CH3I (0,00048 моль) и смесь перемешивают в течение 90 мин при комнатной температуре, затем добавляют 10% водный раствор NH4Cl и полученную смесь экстрагируют CH2Cl2. Органический слой отделяют, сушат (Na2SO4), отфильтровывают и растворитель выпаривают. Остаток очищают в коллекторе (вакуум), используя картридж с диоксидом кремния Sep-Pak(5 г) (градиентный элюент: CH2Cl2/EtOAc = 1/0, 4/1). Фракции продукта собирают и растворитель выпаривают. Выход: 0,047 г промежуточного соединения 20 (84%). Пример A10. а. Получение промежуточного соединения 21.NaBH4 (0,0170 моль) порциями добавляют при температуре 0C к раствору промежуточного соединения(получено в соответствии с примером А 7.е) (0,0068 моль) в CH3OH (7 мл) и безводном ТГФ (35 мл) и затем реакционную смесь перемешивают в течение 1 ч при комнатной температуре. Добавляют 10% водный раствор NH4Cl и смесь экстрагируют CH2Cl2. Органический слой отделяют, сушат (Na2SO4), отфильтровывают и растворитель выпаривают. Выход: 2,13 г промежуточного соединения 21 (87%).b. Получение промежуточного соединения 22. Метилсульфонилхлорид (0,0087 моль) по каплям добавляют при температуре 0 С к смеси промежуточного соединения 21 (получено в соответствии с примером A10.а) (0,0058 моль) и Et3N (0,0116 моль) вCH2Cl2 (35 мл) и затем реакционную смесь перемешивают в течение 1 ч при комнатной температуре. Добавляют насыщенный раствор NaHCO3 и смесь экстрагируют CH2Cl2. Органический слой отделяют,сушат (Na2SO4), отфильтровывают и растворитель выпаривают. Остаток осаждают из DIPE и затем полученные твердые вещества собирают. Выход: 2,5 г промежуточного соединения 22 (98%). с. Получение промежуточного соединения 23. Смесь промежуточного соединения 22 (получено в соответствии с примером A10.b) (0,0055 моль),2-феноксиэтанамина (0,0110 моль), Cs2CO3 (0,110 моль) и молекулярных сит 4 (0,5 г) в CH3CN (40 мл) нагревают в течение 20 мин при температуре 150C в условиях микроволнового излучения, затем добавляют CH2Cl2 и реакционную смесь отфильтровывают через целит. Растворитель выпаривают и полученный остаток очищают с помощью колоночной флэш-хроматографии (элюент: CH2Cl2/(CH3OH/NH3) = 97/3). Фракции продукта собирают и растворитель выпаривают. Выход: 2,330 г промежуточного соединения 23 (88%).d. Получение промежуточного соединения 24. Смесь промежуточного соединения 23 (получено в соответствии с примером A10.с) (0,0045 моль) иNaH (60%) (0,0068 моль) в ТГФ (25 мл) перемешивают в течение 3 ч при комнатной температуре и в атмосфере азота, затем добавляют бензилхлорформиат (0,0068 моль) и реакционную смесь перемешивают в течение 3 ч при комнатной температуре. Добавляют EtOAc и органический слой промывают водой и насыщенным солевым раствором, затем сушат (Na2SO4), отфильтровывают и растворитель выпаривают. Полученный остаток очищают с помощью колоночной флэш-хроматографии (градиентный элюент:CH2Cl2/EtOAc = 4/1, 2/1). Фракции продукта собирают и растворитель выпаривают. Выход: 2,14 г промежуточного соединения 24 (78%). е. Получение промежуточного соединения 25. Трифторуксусную кислоту (20 мл) по каплям добавляют к смеси промежуточного соединения 24(получено в соответствии с примером A10.d) (0,0034 моль) в CH2Cl2 (240 мл), затем реакционную смесь перемешивают в течение 1 ч при комнатной температуре и растворитель выпаривают. Полученный остаток подщелачивают насыщенным раствором Na2CO3 и полученную смесь экстрагируют CH2Cl2. Органический слой отделяют, сушат (Na2SO4), отфильтровывают и растворитель выпаривают. Выход: 1,78 г промежуточного соединения 25.f. Получение промежуточного соединения 34. Смесь промежуточного соединения 25 (0,0002921 моль), 1-(хлорметил)-4-фторбензола (0,0008763 моль) и нанесенного на полимер TBD (2,9 ммоль/г) (0,0008763 моль) в CH3CN (2 мл) и ДМФА (0,15 мл) вводят во взаимодействие в условиях микроволнового излучения в течение 20 мин при температуре 170C и затем реакционную смесь отфильтровывают и остаток на фильтре промывают CH2Cl2. Растворитель выпаривают и полученный остаток очищают в коллекторе (вакуум), используя картридж с диоксидом кремния Sep-Pak (элюент: CH2Cl2/(CH3OH/NH3) = 99/1). Фракции продукта собирают и растворитель выпаривают. Выход: 0,140 г промежуточного соединения 34 (77%). Пример A11. Получение промежуточного соединения 35. Смесь промежуточного соединения 8 (получено в соответствии с примером А 8.а) (0,0002 моль),N,N-диметил-1,2-этандиамина (0,0003 моль), Pd(OAc)2 (0,00001 моль), Xantphos (0,00002 моль) и Cs2CO3(0,0003 моль) в дезоксигенированном диоксане (1 мл) нагревают в течение 15 мин при температуре 150C и затем в течение 10 мин при температуре 170C. Твердые вещества отфильтровывают и растворитель выпаривают. Остаток очищают в коллекторе (элюент 1: CH2Cl2/CH3OH = 96/4; элюент 2:CH2Cl2/(CH3OH/NH3) = 95/5). Фракции продукта собирают и растворитель выпаривают. Выход: 0,040 г промежуточного соединения 35 (39%). Пример A12. а. Получение промежуточного соединения 36.NaBH4 (50,0085 моль) добавляют, при температуре 0 С, к смеси этилового эфира 4-(4-бромфенил)4,5-дигидро-5-оксо-1 Н-1,2,4-триазол-1-уксусной кислоты (0,0034 моль) в CH3OH (3 мл) и ТГФ (15 мл) и затем реакционную смесь перемешивают в течение 2 ч при комнатной температуре. Добавляют 10% водный раствор NH4Cl и полученную смесь экстрагируют CH2Cl2. Органический слой отделяют, сушатb. Получение промежуточного соединения 37. Метансульфонилхлорид (0,015 моль) добавляют в виде порций при температуре 0C к смеси промежуточного соединения 36 (получено в соответствии с примером А 12.а) (0,01 моль) и Et3N (0,02 моль) вCH2Cl2 (50 мл), затем реакционную смесь перемешивают в течение 1 ч при комнатной температуре и добавляют насыщенный раствор NaHCO3. Органический слой отделяют, сушат (Na2SO4), отфильтровывают и растворитель выпаривают. Наконец, остаток промывают диэтиловым эфиром. Выход: 3,39 г промежуточного соединения 37 (94%). с. Получение промежуточного соединения 38. Смесь промежуточного соединения 37 (получено в соответствии с примером А 12.b) (0,0094 моль),2-феноксиэтанамина (0,0188 моль), N,N,N-трибутил-1-бутанаминийбромида (0,0094 моль) и K2CO3(0,0188 моль) в CH3CN (40 мл) нагревают в течение 20 мин при температуре 120C и затем добавляютCH2Cl2. Твердые вещества отфильтровывают и фильтрат очищают с помощью колоночной хроматографии (элюент 1: CH2Cl2/EtOAc = 1/1; элюент 2: CH2Cl2/CH3OH = 96/4). Фракции продукта собирают и растворитель выпаривают. Выход: 5,9 г промежуточного соединения 38 (количественный выход, используют как таковое на следующей реакционной стадии без дальнейшей очистки).d. Получение промежуточного соединения 40. Смесь промежуточного соединения 39(0,001518 моль), 2-феноксиэтанамина (0,0030 моль) и Cs2CO3 (0,0030 моль) в безводном CH3CN (10 мл) перемешивают в микроволновой печи (Milestone) в течение 20 мин при температуре 150C, затем охлажденную реакционную смесь отфильтровывают через целит и фильтрат выпаривают. Остаток очищают с помощью колоночной флэш-хроматографии на силикагеле (элюент 1: CH2Cl2/EtOAc = 1/1; элюент 2:CH2Cl2/CH3OH = 96/4). Фракции продукта собирают и растворитель выпаривают. Выход: 0,52 г промежуточного соединения 40 (85%). Пример A13. Получение промежуточного соединения 41. Смесь промежуточного соединения 11 (получено в соответствии с примером А 5.а) (0,0014 моль),метилового эфира 4-(бромметил)бензойной кислоты (0,0021 моль) и K2CO3 (0,028 моль) в CH3CN (10 мл) нагревают в микроволновой печи в течение 15 мин при температуре 150C, затем добавляют CH2Cl2 и реакционную смесь отфильтровывают через дикалит. Растворитель из фильтрата выпаривают и полученный остаток промывают EtOAc. Выход: 0,335 г промежуточного соединения 41 (49%). Пример A14. а. Получение промежуточного соединения 43. Реакцию осуществляют в микроволновой печи. Смесь 1-(4-бромфенил)-1,3-дигидро-2 Н-имидазол 2-она (получен в соответствии с инструкцией, указанной в WO 2003/042188, содержание которой включено в данный контекст) (0,0058 моль), этилового эфира 2-бромуксусной кислоты (0,0070 моль) и K2CO3(0,0087 моль) в CH3CN (20 мл) нагревают в течение 15 мин при температуре 130C. Добавляют CH2Cl2. Осадок отфильтровывают через целит и растворитель из фильтрата выпаривают. Выход: 2,0 г промежуточного соединения 43 (количественный выход; используют на следующей реакционной стадии без дальнейшей очистки).b. Получение промежуточного соединения 44.NaBH4 (0,0145 моль) добавляют порциями к раствору промежуточного соединения 43 (0,0058 моль) в CH3OH (4 мл) и ТГФ (20 мл) при перемешивании при температуре 0C. Реакционную смесь перемешивают в течение 1 ч при комнатной температуре. Добавляют 10% водный раствор NH4Cl. Эту смесь экстрагируют CH2Cl2. Отделенный органический слой сушат (Na2SO4), отфильтровывают и растворитель выпаривают. Выход: 1,28 г промежуточного соединения 44 (78%). с. Получение промежуточного соединения 45. Метансульфонилхлорид (0,0050 моль) добавляют порциями к раствору промежуточного соединения 44 (0,0045 моль) и Et3N (0,0068 моль) в CH2Cl2 (15 мл) при перемешивании при температуре 0C. Полученную реакционную смесь перемешивают в течение 1 ч при комнатной температуре. Добавляют насыщенный водный раствор NaHCO3. Органический слой отделяют, сушат (Na2SO4), отфильтровывают и растворитель выпаривают. Остаток обрабатывают диэтиловым эфиром. Осадок отфильтровывают и сушат. Выход: 1,43 г промежуточного соединения 45 (88%).d. Получение промежуточного соединения 46. Реакцию осуществляют в микроволновой печи. Смесь промежуточного соединения 45 (0,0037 моль), 2-феноксиэтанамина (0,0074 моль), Cs2CO3 (0,0074 моль) и молекулярных сит 4 (0,330 г) вCH3CN (25 мл) нагревают в течение 20 мин при температуре 170C. Осадок отфильтровывают при использовании дикалита и растворитель из фильтрата выпаривают. Остаток очищают с помощью колоночной флэш-хроматографии на силикагеле (элюент: CH2Cl2/CH3OH = 94/6). Фракции продукта собирают и растворитель выпаривают. Выход: 1,4 г промежуточного соединения 46 (94%). е. Получение промежуточного соединения 47. Бис(1,1-диметилэтиловый) эфир дикарбоновой кислоты (0,0035 моль) добавляют к смеси промежуточного соединения 46 (0,0035 моль) и Et3N (0,0035 моль) в CH2Cl2 (15 мл) при перемешивании при температуре 0C. Затем реакционную смесь перемешивают в течение 1 ч при комнатной температуре. Продукт очищают с помощью колоночной флэш-хроматографии на силикагеле (элюент: CH2Cl2/EtOAc = 100/0, затем 3/1). Фракции продукта собирают и растворитель выпаривают. Остаток обрабатывают DIPE и затем сушат. Выход: 1,23 г промежуточного соединения 47 (70%).f. Получение промежуточного соединения 48. Реакцию осуществляют в микроволновой печи. Реакцию проводят в атмосфере азота. Смесь промежуточного соединения 47 (0,00033 моль), 1-метилпиперазина (0,0005 моль), Pd(OAc)2 (0,000017 моль),Xantphos (0,000033 моль) и Cs2CO3 (0,0005 моль) в смеси диоксан/ДМФА = 9/1, дезоксигенированного(1,5 мл) нагревают в течение 15 мин при температуре 175 С. Добавляют CH2Cl2. Твердое вещество отфильтровывают при использовании целита. Растворитель из фильтрата выпаривают. Остаток очищают с помощью колоночной хроматографии при использовании картриджа с 10 г силикагеля (элюент:CH2Cl2/CH3OH = 97/3; затем элюент: CH2Cl2/(CH3OH/NH3) = 96/4 и 95/5). Фракции продукта собирают и растворитель выпаривают. Выход: 0,085 г промежуточного соединения 48 (49%). Пример A15. а. Получение промежуточного соединения 49. Взаимодействие осуществляют в атмосфере азота. N-(1,1-диметилэтил)-N-этил-2-метил-2 пропанамин (0,0024 моль) добавляют к раствору промежуточного соединения 47 (получено в соответствии с примером А 14.е) (0,0012 моль), ацетилформилангидрида (0,0024 моль), PdCl2(PPh3)2 (0,00012 моль) и триэтилсилана (0,0018 моль) в безводном CH3CN (12 мл). В герметично закрытой пробирке реакцион- 25011514 ную смесь нагревают в течение 24 ч при температуре 60C. Добавляют еще ацетилформилангидрид,PdCl2(PPh3)2, триэтилсилан и N-(1,1-диметилэтил)-N-этил-2-метил-2-пропанамин. Реакционную смесь нагревают в течение 24 ч при температуре 60C. Осадок отфильтровывают при использовании целита,затем промывают CH2Cl2 и растворитель из фильтрата выпаривают. Остаток очищают с помощью колоночной флэш-хроматографии на силикагеле (элюент: CH2Cl2/EtOAc = 100/0, затем 4/1). Фракции продукта собирают и растворитель выпаривают. Выход: 0,400 г промежуточного соединения 49 (74%).b. Получение промежуточного соединения 50. Взаимодействие осуществляют в микроволновой печи. Смесь промежуточного соединения 49(0,00044 моль), морфолина (0,00075 моль) и NaBH(OAc)3 (0,00075 моль) в 1,2-дихлорэтане (2 мл) нагревают в течение 15 мин при температуре 80C. Добавляют 32% водный раствор NH3. Органический слой отделяют, сушат (Na2SO4), отфильтровывают и растворитель выпаривают. Остаток очищают с помощью колоночной хроматографии в коллекторе (элюент: CH2Cl2/EtOAc = 1/1, затем CH2Cl2/CH3OH = 95/5). Фракции продукта собирают и растворитель выпаривают. Выход: 0,160 г промежуточного соединения 50(70%). Пример A16. а. Получение промежуточного соединения 51. Раствор трихлорметанолкарбоната (0,008 моль) в безводном CH2Cl2 (25 мл) по каплям добавляют к раствору 2,2-диметоксиметанамина (0,022 моль) в безводном CH2Cl2 (50 мл), при перемешивании при температуре 0C. В виде трех порций добавляют Et3N (0,044 моль), все время перемешивая при температуре 0C. Реакционную смесь перемешивают в течение 5 мин при комнатной температуре. Добавляют раствор 1-(феноксиэтил)-4-пиперидинметанамина (0,011 моль) в безводном CH2Cl2 (25 мл) и полученную реакционную смесь перемешивают в течение 1 ч при комнатной температуре. Добавляют насыщенный водный раствор Na2CO3. Органический слой отделяют, сушат (Na2CO3), отфильтровывают и растворитель выпаривают. Выход: 5,6 г промежуточного соединения 51 (количественный выход; используют на следующей реакционной стадии без дальнейшей очистки).b. Получение промежуточного соединения 52. Взаимодействие осуществляют в микроволновой печи. Смесь промежуточного соединения 51(0,011 моль) в 2 н. растворе HCl (20 мл) и CH3OH (50 мл) нагревают в течение 10 мин при температуре 120C. Смесь выливают в насыщенный водный раствор Na2CO3. Эту смесь экстрагируют CH2Cl2. Отделенный органический слой сушат (Na2SO4), отфильтровывают и растворитель выпаривают. Остаток очищают с помощью колоночной флэш-хроматографии на силикагеле (элюент: CH2Cl2/(CH3OH/NH3) = 96/4, затем 90/10). Фракции продукта собирают и растворитель выпаривают. Остаток обрабатывают диэтиловым эфиром, затем собирают и сушат. Выход: 1,35 г промежуточного соединения 52 (41%). с. Получение промежуточного соединения 53. Реакцию осуществляют в микроволновой печи. Смесь промежуточного соединения 52 (0,0010 моль), этилового эфира хлоруксусной кислоты (0,0015 моль) и K2CO3 (0,0015 моль) в CH3CN (4 мл) нагревают в течение 15 мин при температуре 120C, затем в течение 15 мин при температуре 150C. Осадок отфильтровывают, затем очищают с помощью колоночной хроматографии в коллекторе (элюент:CH2Cl2/CH3OH = 95/5). Фракции продукта собирают и растворитель выпаривают. Выход: 0,243 г промежуточного соединения 53 (63%).d. Получение промежуточного соединения 54. Раствор LiOH (0,00076 моль) в H2O (1 мл) добавляют к раствору промежуточного соединения 53(0,00063 моль) в диоксане (10 мл). Полученную реакционную смесь перемешивают в течение 24 ч при комнатной температуре. Растворитель выпаривают. Остаток обрабатывают диэтиловым эфиром, затем собирают и сушат. Выход: 0,190 г промежуточного соединения 54 (83%). Пример A17 а. Получение промежуточного соединения 42. Взаимодействие осуществляют в микроволновой печи. Смесь 1-(4-бромфенил)-1,2-дигидро-5 Нтетразол-5-она (0,0058 моль), 1,1-диметилэтилового эфира 4-(йодметил)-1-пиперидинкарбоновой кислоты (0,0070 моль) и BTTP (0,0070 моль) в CH3CN (20 мл) нагревают в течение 30 мин при температуре 120C. Растворитель выпаривают. Остаток очищают с помощью колоночной флэш-хроматографии на силикагеле (элюент: CH2Cl2/EtOAc = 100/0, затем 4/1). Фракции продукта собирают и растворитель выпаривают. Выход: 2,58 г промежуточного соединения 42.b. Получение промежуточного соединения 55. Трифторуксусную кислоту (10 мл) добавляют к раствору промежуточного соединения 42 (получено в соответствии с примером А 17) (0,0058 моль) в CH2Cl2 (40 мл). Реакционную смесь перемешивают в течение 2 ч при комнатной температуре. Добавляют насыщенный водный раствор Na2CO3 (рН 8). Органический слой отделяют, сушат(Na2SO4), отфильтровывают и растворитель выпаривают. Остаток обрабатывают диэтиловым эфиром,затем собирают и сушат. Выход: 0,85 г промежуточного соединения 55 (45%). с. Получение промежуточного соединения 56. Взаимодействие осуществляют в микроволновой печи. Смесь промежуточного соединения 55 (получено в соответствии с примером А 17.b) (0,0025 моль), 2-бромэтоксибензола (0,00275 моль) и K2CO3(0,0050 моль) в CH3CN (10 мл) нагревают в течение 10 мин при температуре 120C. Добавляют CH2Cl2. Осадок отфильтровывают при использовании целита и растворитель из фильтрата выпаривают. Остаток обрабатывают диэтиловым эфиром, затем собирают и сушат. Выход: 0,85 г промежуточного соединения 56 (74%).d. Получение промежуточного соединения 57. Взаимодействие осуществляют в атмосфере азота. N-Этил-N-(1-метилэтил)-2-пропанамин (0,0030 моль) добавляют к смеси промежуточного соединения 56 (получено в соответствии с примером A17.d)(0,0015 моль), ацетилформиата (0,0030 моль), дихлорбис(трифенилфосфин)палладия (0,00015 моль) и триэтилсилана (0,00225 моль) в безводном CH3CN (15 мл). В герметично закрытой пробирке реакционную смесь нагревают в течение 24 ч при температуре 60C. Добавляют еще ацетилформиат, дихлорбис(трифенилфосфин)палладий, триэтилсилан и N-этил-N-(1-метилэтил)-2-пропанамин. Реакционную смесь нагревают в течение 24 ч при температуре 60C. Осадок отфильтровывают и растворитель из фильтрата выпаривают. Остаток очищают с помощью колоночной флэш-хроматографии на силикагеле(элюент: CH2Cl2/EtOAc = 4/1, затем CH2Cl2/CH3OH = 9/1). Фракции продукта собирают и растворитель выпаривают. Выход: 0,660 г промежуточного соединения 57. Это промежуточное соединение 57 используют в качестве исходного вещества для получения ко- 27011514 нечного соединения 104. Следующие структуры промежуточных продуктов, указанные в табл. 1, приведены в соответствии с примерами, описанными выше. Таблица 1
МПК / Метки
МПК: C07D 401/04, C07D 249/12, A61K 31/4196, C07D 403/10, C07D 401/10, C07D 233/70, A61P 25/00, C07D 257/04, A61K 31/41, A61K 31/4166, C07D 401/06
Метки: применения, антагонистов, имидазолона, производные, качестве, триазолона, альфа-2с-адренорецептора, тетразолона
Код ссылки
<a href="https://eas.patents.su/30-11514-proizvodnye-triazolona-tetrazolona-i-imidazolona-dlya-primeneniya-v-kachestve-antagonistov-alfa-2s-adrenoreceptora.html" rel="bookmark" title="База патентов Евразийского Союза">Производные триазолона, тетразолона и имидазолона для применения в качестве антагонистов альфа-2с-адренорецептора</a>
Предыдущий патент: Фунгицидные смеси
Следующий патент: Замещенные бензимидазол-, бензтриазол- и бензимидазолон-о-глюкозиды
Случайный патент: Способ получения халькогенонов