1,5-пентандиилзамещенные 1,2,3,4 – тетрагидробензо (фуро, азо и тио) [3,2 - c] пиридиновые производные в качестве &alpha2 – антагонистов
Номер патента: 3606
Опубликовано: 26.06.2003
Авторы: Мертенс Йозефус Каролус, Кеннис Людо Эдмонд Жозефин, Питерс Серж Мария Алойсиус
Формула / Реферат
1. Соединение, имеющее формулу
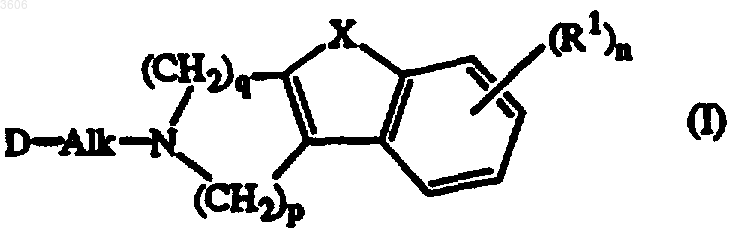
его N-оксидная форма, фармацевтически приемлемая соль присоединения и стереохимически изомерная форма,
где Alk представляет собой 1,5-пентадиил;
n равно 1 или 2;
p равно 1 и q равно 2; или
p равно 2 и q равно 1;
X представляет собой O, S или NH;
каждый R1 независимо представляет собой водород, галоген, C1-6алкил, нитро, гидрокси или C1-4алкилокси;
R2 представляет собой водород, C1-6алкил, арил или C1-6алкил, замещенный арилом;
арил представляет собой фенил или фенил, замещенный галогеном или C1-6алкилом;
D представляет собой радикал формулы
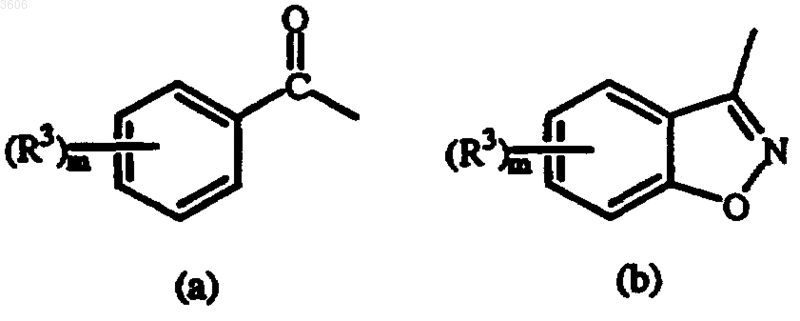
где m равно 1 или 2;
каждый R3 независимо представляет собой водород, C1-4алкил, C1-4алкилокси или галоген.
2. Соединение по п.1, где n равно 1 и R1 представляет собой водород, хлор, фтор, метил, метокси или нитро.
3. Применение соединения по п.1 или 2 в качестве лекарства.
4. Применение соединения по любому из пп.1 и 2 при получении лекарства для лечения депрессии или болезни Паркинсона.
5. Композиция, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество соединения по любому из пп.1 и 2.
6. Способ получения композиции по п.5 путем объединения при тщательном перемешивании указанного в любом из пп.1 и 2 соединения в качестве активного ингредиента с фармацевтически приемлемым носителем.
7. Способ получения соединения по п.1, заключающийся в том, что осуществляют
(a) N-алкилирование промежуточного соединения формулы (II) алкилирующим агентом формулы (III)
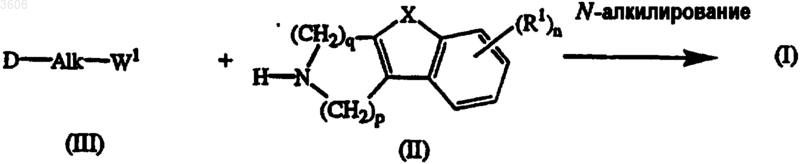
где W1 представляет собой подходящую удаляемую группу и D, Alk, X, n и R1 такие, как указано в п.1, в реакционно-инертном растворителе в присутствии основания и, необязательно, в присутствии катализатора;
(b) и, если желательно, преобразование соединений формулы (I) друг в друга известными методами, и далее, если желательно, преобразование соединений формулы (I) в терапевтически активную нетоксичную соль присоединения кислоты путем обработки кислотой или в терапевтически активную нетоксичную соль присоединения основания путем обработки основанием, или, наоборот, преобразование соли присоединения кислоты в свободное основание путем обработки щелочью, или преобразование соли присоединения основания в свободную кислоту путем обработки кислотой, или, если желательно, получение их стереохимически изомерных форм или N-оксидов.
Текст
1 Настоящее изобретение относится к бензизоксазолам и фенонам, обладающим антагонистической активностью по отношению к центральным 2-адренорецепторам. Кроме того,оно относится к их получению, содержащим их композициям и к их применению в качестве лекарственных средств. Известно, что антагонисты центральных 2-адренорецепторов увеличивают высвобождение норадреналина путем блокирования пресинаптических 2-рецепторов, которые вызывают ингибирующее действие на высвобождение нейротрансмиттера. Увеличивая концентрации норадреналина, 2-антагонисты могут быть использованы для лечения или профилактики депрессии, нарушений когнитивной функции,болезни Паркинсона, сахарного диабета, половой дисфункции и импотенции, повышенного внутриглазного давления и заболеваний, связанных с нарушенной перистальтикой кишечника, поскольку все данные состояния связаны с недостаточностью норадреналина в центральной или периферической нервной системе. В WO 98/45297, опубликованном 15 октября 1998, описаны производные 1,2,3,4-тетрагидробензофуро[3,2-с]пиридина, обладающие антагонистической активностью по отношению к центральным 2-адренорецепторам. Производные 1-(4-фторфенил)-4-(1,3,4,5 тетрагидро-2 Н-пиридо-[4,3-b]индол-2-ил)-1-бутанона описаны Kimura et al. [Arch. Int. Pharmacodyn. Ther. (1971), 190 (1), 124-134], Nagai et al.Zh. (1975), 9 (1), 7-9] в качестве средств, блокирующих центральную нервную систему. Соединения по настоящему изобретению являются новыми и обладают специфическим и селективным связующим сродством к различным известным подтипам 2-адренорецепторов,т.е. 2A, 2B и 2C-адренорецепторам. По сравнению с наиболее близкими из известных в данной области соединений настоящие соединения неожиданно показали улучшение диссоциации связующего сродства между 2 А-адренорецептором и рецептором допамина D2, что особенно ценно при лечении депрессии. Настоящее изобретение относится к соединениям формулы их N-оксидным формам, фармацевтически приемлемым солям присоединения и стереохимически изомерным формам, гдеn равно 1 или 2; р равно 1 и q равно 2; или р равно 2 и q равно 1; Х представляет собой -О-, -S-, -S(=O)-,-S(=O)2- или NR2; каждый R1 независимо представляет собой водород, галоген, C1-6 алкил, нитро, гидрокси или С 1-4 алкилокси;R2 представляет собой водород, C1-6 алкил,арил или C1-6 алкил, замещенный арилом; арил представляет собой фенил или фенил,замещенный галогеном или C1-6 алкилом;D представляет собой радикал формулы где m равно 1 или 2; каждый R3 независимо представляет собой водород, С 1-4 алкил, C1-4-алкилокси или галоген. Как использовано в предыдущих определениях, термин галоген является родовым для фтора, хлора, брома и йода. Термин С 1-4 алкил как группа или часть группы определяет насыщенные углеводороды с прямой или разветвленной цепью, имеющие от 1 до 4 атомов углерода, такие как, например, метил, этил, пропил,бутил, 1-метилэтил, 1,1-диметилэтил, 2 метилпропил и тому подобное. Подразумевается, что термин C1-6 алкил включает С 1-4 алкильные радикалы и их более высокие гомологи,имеющие 5 или 6 атомов углерода, такие как,например, пентил, гексил и тому подобное. Термин С 6-12 алкандиил определяет двухвалентные алкандиильные радикалы с прямой или разветвленной цепью, имеющие от 5 до 12 атомов углерода, такие как, например, 1,6-гександиил,1,7-гептандиил, 1,8-октандиил, 1,9-нонандиил,1,10-декандиил, 1,11-ундекандиил, 1,12-додекандиил и тому подобное. Подразумевается, что термин С 5-12 алкандиил включает С 6-12 алкандиилы и низшие гомологи, имеющие 5 атомов углерода, такие как, например, 1,5-пентадиил и тому подобное. Подразумевается, что указанные здесь соли присоединения включают виды терапевтически активных солей присоединения, которые соединения формулы (I) способны образовывать с подходящими кислотами, такими как, например, неорганические кислоты, такие как галогенводородные кислоты, например, хлористоводородная или бромисто-водородная кислота,серная, азотная, фосфорная и подобные кислоты, или органические кислоты, такие как, на 3 пример, уксусная, пропионовая, гидроксиуксусная, молочная, пировиноградная, щавелевая,малоновая, янтарная, малеиновая, фумаровая,яблочная, винная, лимонная, метансульфоновая,этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламиновая, салициловая, паминосалициловая, памовая и подобные кислоты. Подразумевается также, что фармацевтически приемлемые соли присоединения, указанные выше, включают терапевтически активное нетоксичное основание, в частности, в виде солей присоединения металла или амина, которые способны образовывать соединения формулы(I). Указанные соли обычно могут быть получены путем взаимодействия соединений формулы(I), имеющих кислотные водородные атомы, с подходящими органическими и неорганическими основаниями, и включают такие как, например, аммонийные соли, соли щелочных и щелочно-земельных металлов, например соли лития, натрия, калия, магния, кальция и тому подобное, соли с органическими основаниями,например соли бензатина,N-метил-Dглюкамина, гидрабамина, и соли с аминокислотами, такими как, например, аргинин, лизин и тому подобное. И наоборот, указанные солевые формы могут быть преобразованы взаимодействием с подходящими основанием или кислотой в свободную кислоту или основание. Термин соль присоединения, как он используется выше, включает также сольваты,которые способны образовывать соединения формулы (I), и имеется в виду, что указанные сольваты включены в предмет настоящего изобретения. Примерами таких сольватов являются, например, гидраты, алкоголяты и тому подобное. Подразумевается, что N-оксидные формы соединений формулы (I) включают те соединения формулы (I), в которых один или несколько атомов азота окислены до так называемого Nоксида. Термин стереохимически изомерные формы, как он использован здесь, определяет все возможные изомерные формы, в виде которых могут существовать соединения формулы (I). Если не упомянуто, или не указано другое, химическое название соединения обозначает смесь всех возможных стереохимически изомерных форм, где указанные смеси содержат все диастереомеры и энантиомеры базовой молекулярной структуры. Некоторые из соединений формулы (I) могут также существовать в виде своих таутомерных форм. Хотя такие формы и не указаны явно в указанной формуле, предполагается, что они входят в предмет настоящего изобретения. Подразумевается, что термин соединения формулы (I), где бы он ни использовался далее,включает также N-оксидные формы, фармацев 003606 4 тически приемлемые соли присоединения и все стереоизомерные формы. Как используется здесь далее, обозначая положение заместителя R1, применяют следующую нумерацию: Представляющей интерес группой соединений являются те соединения формулы (I), в которых n равно 1 и R1 представляет собой водород, хлор, фтор, метил, метокси или нитро, в особенности, где R1 представляет собой водород, хлор или метокси. В случае, когда R1 не является водородом,1R соответствующим образом присоединен к трициклической кольцевой системе в положении 6 или 7. Другой представляющей интерес группой соединений являются те соединения формулы(I), в которых Alk представляет собой 1,5 пентандиил. Еще одной группой соединений, представляющей интерес, являются те соединения формулы (I), у которых D представляет собой радикал формулы (а) и R3 представляет собой фтор,бром, метокси, метил или водород, в особенности, фтор. Особый интерес представляют также соединения формулы (I), в которых D представляет собой радикал формулы (b). Предпочтительными соединениями являются те соединения формулы (I), в которых Х представляет собой О, S или NH. Обычно соединения формулы (I) могут быть получены N-алкилированием промежуточного соединения формулы (II) алкилирующим реагентом формулы (III), следуя методике,описанной в ЕР-А-0037265, ЕР-А-0070053, ЕРА-0196132 и ЕР-А-0378255. В частности, Nалкилирование можно осуществлять в реакционно-инертном растворителе, таком как, например, метилизобутилкетон, N,N-диметилформамид или N,N-диметилацетамид, в присутствии основания, такого как, например, триэтиламин,карбонат натрия или бикарбонат натрия и, необязательно, в присутствии катализатора, такого как, например, йодид калия. В промежуточном соединении (III) W1 представляет собой подходящую реакционноспособную удаляемую группу, такую как, например, галоген, например, хлор, бром или йод,сульфонилокси, например, метансульфонилокси, 4-метилбензолсульфонилокси. В данной и в следующей реакциях реакционные продукты могут быть выделены из реакционной среды и, если необходимо, дополни 5 тельно очищены общеизвестными из практики методами, такими как экстракция, кристаллизация, растирание и хроматография. Соединения формулы (I) могут быть преобразованы друг в друга известными реакциями преобразования функциональных групп. Соединения формулы (I) могут также быть преобразованы в соответствующие N-оксидные формы известными из практики методиками преобразования трехвалентного азота в N-оксидную форму. Обычно указанную реакцию N-окисления можно осуществить путем взаимодействия исходного продукта формулы (I) с подходящей органической или неорганической перекисью. Подходящие неорганические перекиси включают, например, перекись водорода, перекиси щелочных металлов и щелочно-земельных металлов, например,перекись натрия, перекись калия; подходящие органические перекиси могут включать пероксикислоты, такие как, например, бензолкарбопероксикислота или галогенозамещенная бензолкарбопероксикислота, например 3-хлорбензолкарбопероксикислота, пероксиалкановые кислоты, например пероксиуксусная кислота, алкилгидроперекиси, например гидроперекись трет-бутила. Подходящими растворителями являются, например, вода, низшие алканолы, например этанол и тому подобное, углеводороды, например толуол, кетоны, например, 2-бутанон, галогенированные углеводороды, например дихлорметан, и смеси таких растворителей. Многие промежуточные и исходные материалы имеются в продаже или являются известными соединениями, которые могут быть получены по известным из практики методикам. Например, некоторые из промежуточных соединений формулы (III) и их получение описаны в ЕР-А-0037265, ЕР-А-0070053, ЕР-А 0196132 и в ЕР-А-0378255. Промежуточные соединения формулы (II),где Х представляет собой О, могут быть получены аналогично методу, описанному Cattanach С., et al. (J. Chem. Sоc., 1971, р. 53-60); Карташова Т. (Хим. гетероцикл. соед., 1979 (9), стр. 1178-1180) и Закусов В., и др. (Изобретение,1992 (15), стр. 247). Промежуточные соединения формулы (II), в которых Х представляет собой S, могут быть получены аналогично методу, описанному у Capps et al. (J. Am. Chem.Soc., 1953, р. 697) или в US-3752820. Предпочтительный путь синтеза для получения промежуточных соединений формулы(II), в которых р равно 1 и q равно 2, где указанные промежуточные соединения представлены формулой (II-1), представлены на схеме 1. Стадия (а) может быть проведена аналогично методу, описанному в Tetrahedron (1981),37, р. 979-982. Полученные на стадии (с) бензофураны были использованы в качестве промежуточных соединений в патенте US 7752820. Альтернативно, промежуточные соединения формулы (II-1) могут быть получены с использованием стадий реакции, представленных на схеме 2. Схема 2 Стадия (а) может быть проведена аналогично методу, описанному в Heterocycles (1994),39(1), р. 371-380. Стадия (b) может быть проведена аналогично методу, описанному в J. Med.Chem. (1986), 29(9), р. 1643-1650. Дальнейшие стадии реакции могут быть проведены аналогично стадиям, описанным в J. Heterocycl.Chem. (1979), 16, р. 1321. Промежуточные соединения формулы (II),в которых р равно 2 и q равно 1, где указанные промежуточные соединения представлены формулой (II-2), могут быть получены согласноSynth. Comm., 1995, р. 3883-3900 с использованием способов, известных в данной области. Общая методика представлена на схеме 3. Схема 3 Промежуточные соединения формулы (II),в которых Х представляет -О-, где указанные промежуточные соединения представлены формулой (II-2-a), могут быть получены так, как описано в Synth. Comm., 1995, р. 3883-3900 и J.Chem. Sоc., 1965, р. 4939-4953, и с использованием способов, известных в данной области. Общая методика представлена на схеме 4. Промежуточные соединения формулы (II2), в которых Х представляет -S-, где указанные промежуточные соединения представлены формулой (II-2-b), могут быть получены согласно J.Med. Chem., 1992, 35(7), р. 1176-1182, и с использованием способов, известных в данной области. Общая методика представлена на схеме 5. Схема 5 Некоторые из соединений формулы (I) и некоторые из промежуточных соединений по настоящему изобретению содержат, по меньшей мере, один асимметричный атом углерода. Чистые стереохимические изомерные формы указанных соединений и указанных промежуточных соединений могут быть получены с применением известных в данной области способов. Например, диастереомеры могут быть разделены физическими методами, такими как селективная кристаллизациz или хроматографическими методами, например противоточным распределением, жидкостной хроматографией и подобными способами. Энантиомеры могут быть выделены из рацемических смесей сначала преобразованием указанных рацемических смесей с помощью соответствующих разделяющих агентов, таких как, например, хиральные кислоты, в смеси диастереомерных солей или соединений, затем физическим разделением указанных смесей диастереомерных солей или соединений, например, селективной кристаллизацией или хроматографическими методами, например,жидкостной хроматографией и подобными способами, и, наконец, преобразованием указанных разделенных диастереомерных солей или соединений в соответствующие энантиомеры. Чистые стереохимические изомерные формы соединений формулы (I) могут также быть получены из чистых стереохимически изомерных форм подходящих промежуточных соединений и исходных материалов, при усло 003606 8 вии, что промежуточные реакции протекают стереоспецифически. Подразумевается, что чистые и смешанные стереохимически изомерные формы соединений формулы (I) охватываются предметом настоящего изобретения. Соединения формулы (I), N-оксиды, фармацевтически приемлемые соли присоединения и их стереохимически изомерные формы блокируют пресинаптические 2-рецепторы на центральных норадренергических нейронах, увеличивая тем самым высвобождение норадреналина. Блокирование указанных рецепторов будет подавлять или ослаблять различные симптомы,связанные с дефицитом норадреналина в центральной или периферической нервной системе. Терапевтическими показаниями для применения настоящих соединений являются депрессия,нарушение познавательной деятельности, болезнь Паркинсона, сахарный диабет, половая дисфункция и импотенция и повышенное внутриглазное давление. В частности, настоящие соединения показывают более сильную диссоциацию между связующим сродством для 2-рецепторов и таковым для рецепторов D2 допамина, в особенности между 2A-рецепторами и рецепторами D2 допамина. Более сильная диссоциация понижает риск экстрапирамидальных побочных эффектов(ЭППЭ), которые могут возникнуть от блокады рецепторов допамина и которых следует избегать при лечении депрессии. Было также показано, что блокада 2 рецепторов в центральной нервной системе улучшает высвобождение серотонина, которое может усилить терапевтическое действие при депрессии (Maura et al., 1992, NaunynSchmiedeberg's Arch. Pharmacol., 345: 410-416). Было также показано, что блокада 2 рецепторов может вызвать возрастание внеклеточной DOРАС (3,4-дигидрофенилуксусной кислоты), которая является метаболитом допамина и норадреналина. Ввиду полезности рассматриваемых соединений при лечении заболеваний, связанных с дефицитом норадреналина в центральной нервной системе, в частности, депрессии и болезни Паркинсона, настоящее изобретение относится к способу лечения теплокровных животных,страдающих от таких заболеваний, в частности,депрессии и болезни Паркинсона, причем указанный способ включает систематическое введение терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли присоединения. Настоящие соединения являются также потенциально полезными при лечении болезни Альцгеймера и слабоумия, так как известно, что 2-антагонисты промотируют высвобождение ацетилхолина (Telez et al., 1997, J. Neurochem. 68: 778-785). 9 Установлено, что обычно эффективное терапевтически ежедневное количество должно быть от примерно 0,01 мг/кг до примерно 4 мг/кг массы тела. Таким образом, настоящее изобретение относится также к соединениям формулы (I),как они определены здесь выше, для применения в качестве лекарственного средства. Далее,настоящее изобретение относится также к применению соединения формулы (I) для приготовления лекарственного средства для лечения депрессии или болезни Паркинсона. Для оценки антагонизма 2-адренорецептора настоящих соединений могут быть использованы исследования ex vivo, а также in vitro преобразования сигнала рецептора и связывания рецептора. В качестве индекса блокады центрального 2-адренорецептора in vivo могут быть использованы реверсирование потери установочного рефлекса, наблюдавшейся у крыс после внутривенного введения ксилазина, и ингибирование дрожаний, вызванных у крыс резерпином. Соединения по настоящему изобретению также обладают способностью быстро проникать в центральную нервную систему. С целью введения рассматриваемые соединения могут быть включены в состав различных фармацевтических композиций, содержащие фармацевтически приемлемый носитель и, в качестве активного ингредиента, терапевтически эффективное количество соединения формулы (I). Для приготовления фармацевтических композиций по данному изобретению эффективное количество конкретного соединения в виде соли присоединения или в виде свободной кислоты или основания, в качестве активного ингредиента, объединяют путем тщательного смешивания с фармацевтически приемлемым носителем, который может иметь широкое разнообразие видов, в зависимости от вида препарата, предназначенного для введения. Эти фармацевтические композиции желательно иметь в виде стандартной лекарственной формы, подходящей, предпочтительно, для введения перорально, подкожно или путем парентеральной инъекции. Например, при приготовлении композиции в виде пероральной стандартной формы может быть использована любая обычная фармацевтическая среда, такая как, например,вода, гликоли, масла, спирты и тому подобное для случая пероральных жидких препаратов,таких как суспензии, сиропы, эликсиры и растворы; или твердые носители, такие как крахмалы, сахара, глина, смазывающие агенты, связующие, разрыхлители и тому подобное для случая порошков, пилюль, капсул и таблеток. Ввиду простоты введения таблетки и капсулы представляют собой наиболее удобные пероральные стандартные лекарственные формы, в этом случае, очевидно, используют твердые 10 фармацевтические носители. Для парентеральных композиций носитель должен обычно включать стерильную воду, по меньшей мере как основную часть, хотя могут быть включены другие ингредиенты, например, для улучшения растворимости. Могут быть приготовлены, например, растворы для инъекций, в которых носитель включает физиологический раствор, раствор глюкозы или смесь физиологического и глюкозного растворов. Растворы для инъекций,содержащие соединения формулы (I), могут быть введены в масло для пролонгированного действия. Подходящими для этой цели маслами являются, например, арахисовое масло, конопляное масло, хлопковое масло, кукурузное масло, соевое масло, синтетические эфиры глицерина и жирных кислот с длинной цепью, и смеси тех и иных масел. Могут быть также приготовлены суспензии для инъекций, в этом случае могут быть применены подходящие жидкие носители, суспендирующие агенты и тому подобное. В композициях, пригодных для подкожного введения, носитель, необязательно, включает улучшающий проникание агент и/или подходящий увлажняющий агент, необязательно вместе с подходящими добавками любой природы в малых пропорциях, и эти добавки не оказывают сколько-нибудь значительного вредного влияния на кожу. Указанные добавки могут облегчить введение в кожу и/или могут быть полезными для приготовления желаемых композиций. Данные композиции могут быть введены различными способами, например, в качестве трансдермального пластыря, наклейки или мази. Соли прибавления (I), ввиду их повышенной растворимости в воде по сравнению со свободным основанием или свободной кислотой, являются, очевидно, более подходящими для приготовления водных композиций. Особенно удобны вышеуказанные фармацевтические композиции в виде стандартных лекарственных форм, для простоты введения и однородности дозировки. Термин стандартная лекарственная форма, как здесь используется в описании и в формуле изобретения, относится к физически дискретным единицам, пригодным в качестве единичных доз, где каждая доза содержит заранее определенное количество активного ингредиента, рассчитанное для оказания желаемого терапевтического эффекта, в сочетании с необходимым фармацевтическим носителем. Примерами таких стандартных лекарственных форм являются таблетки (включая глянцованные или покрытые таблетки), капсулы, пилюли, пакетики порошка, облатки, растворы или суспензии для инъекций, чайные ложки, столовые ложки, и тому подобное, и их отобранные группы. Следующие примеры предназначены для иллюстрации настоящего изобретения.(615 мл) перемешивали при 20 С. При 20 С по каплям добавляли НСl (353 мл). Реакционную смесь мягко нагревали до температуры кипения с обратным холодильником. Реакционную смесь перемешивали и кипятили с обратным холодильником в течение 3 ч, затем охлаждали до комнатной температуры. Осадок отфильтровывали, промывали диизопропиловым эфиром и сушили. Данную фракцию кристаллизовали из воды (1600 мл). Желаемому соединению давали возможность кристаллизовываться при перемешивании. Осадок отфильтровывали, промывали 2-пропанолом и диизопропиловым эфиром, затем сушили, получая 84 г (64%) гидрохлорида 1,2,3,4-тетрагидробензофуро[3,2 с]пиридина (1:1) (промежуточное соединение 1). Пример А 2. а) Реакцию проводили в атмосфере N2. 60% NaH (0,17 моль) перемешивали в тетрагидрофуране (350 мл). По каплям добавляли раствор диэтил(цианометил)фосфоната (0,17 моль) в тетрагидрофуране (150 мл) в течение 20 мин(экзотермический рост температуры до 30 С). Смесь перемешивали в течение 20 мин при комнатной температуре и затем охлаждали до 0 С. По каплям добавляли раствор 5-метил 3(2 Н)бензофуранона (0,15 моль) в тетрагидрофуране (350 мл) в течение 30 мин при 0 С. Реакционную смесь перемешивали в течение ночи при комнатной температуре, затем выливали в воду (1500 мл) и перемешивали. Смесь экстрагировали эфиром, диизопропиловым эфиром(2 х), сушили, фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/гексан 50/50). Целевые фракции собирали и растворитель выпаривали, получая 21,2 г (82%) 5-метил 3-бензофуранацетонитрилаb) Смесь промежуточного соединения (2)(0,12 моль) в NН 3/СН 3 ОН (400 мл) гидрировали на никеле Ренея (3 г) в качестве катализатора. После поглощения Н 2 (2 эквив.) катализатор отфильтровывали и фильтрат упаривали. Остаток очищали на силикагеле на стеклянном фильтре (элюент: СН 2 Сl2/(СН 3 ОН/NН 3) от 98/2 до 96/4). Целевые фракции собирали и растворитель выпаривали. Остаток (2,1 г) растворяли в 2-пропаноле (500 мл) и преобразовывали в гидрохлоридную соль с помощью смеси (1:1) НСl/2-пропанол. Смесь перемешивали при комнатной температуре. Растворитель выпаривали. Остаток перемешивали в диизопропиловом эфире, отфильтровывали и сушили, получая 24,4 г (96%) гидрохлорида 5-метил-3-бензофуранэтанамина (1:1) (промежуточное соединение 3).c) Смесь промежуточного соединения (3)(0,0024 моль) в H2O (2 мл), уксусной кислоте (2 мл) и 37% формальдегиде (2 мл) перемешивали в течение 1 ч при 100 С. Реакционную смесь охлаждали и выливали в 1 М NaOH (50 мл). Осадок отфильтровывали, промывали водой,затем растворяли в 1 н НСl (100 мл). Смесь перемешивали в течение 15 мин на бане с горячей водой (80 С). Растворитель выпаривали. Добавляли 2-пропанол. Растворитель выпаривали. Остаток перемешивали в кипящем 2-пропаноне,затем давали ему остыть до комнатной температуры при перемешивании. Осадок отфильтровывали и сушили, получая 0,40 г моногидрохлоридмоногидрата 1,2,3,4-тетрагидро-6-метилбензофуро[2,3-с]пиридина (промежуточное соединение 4). Пример A3. а) Бутиллитий (0,27 моль 2,5 М раствора) добавляли по каплям к раствору 6-метоксибензо[b]тиофена [полученного аналогично методике, описанной в J. Med. Chem. 1989,32(12), 2548-2554] (0,25 моль) в тетрагидрофуране (1000 мл), перемешиваемому при -30 С. Смесь перемешивали в течение 10 мин при-30 С. По каплям при -30 С добавляли окись этилена (0,38 моль в 100 мл тетрагидрофурана). Смеси давали нагреться до комнатной температуры и перемешивали ее в течение 3 ч. Смесь подкисляли разбавленным раствором НСl. Растворитель выпаривали. Остаток разбавляли водой, и эту смесь экстрагировали СН 2 Сl2. Отделенный органический слой сушили, фильтровали и растворитель выпаривали. Остаток перемешивали в гексане, отфильтровывали и сушили, получая 41,3 г 6-метоксибензо[b]тиофен-2 этанола (промежуточное соединение 5).b) Метансульфонилхлорид (0,21 моль) добавляли при перемешивании при 0 С к смеси промежуточного соединения 5 (0,19 моль) и триэтиламина (0,21 моль) в CH2Cl2 (1000 мл). Реакционную смесь перемешивали в течение 4 ч при комнатной температуре, затем выливали на воду. Отделенный органический слой сушили,фильтровали и растворитель выпаривали. Остаток растирали с диизопропиловым эфиром, отфильтровывали и сушили, получая 50,5 г (94%) 6-метоксибензо[b]тиофен-2-этанолметансульфоната (сложный эфир) (промежуточное соединение 6).c) Смесь промежуточного соединения 6(1000 мл) перемешивали и кипятили с обратным холодильником в течение 9 ч, затем охлаждали до комнатной температуры, и растворитель выпаривали. Остаток промывали водой и экстрагировали СН 2 Сl2. Отделенный органический слой сушили, фильтровали, и растворитель выпаривали, получая 57 г 2-(2-йодэтил)-6-метоксибензо[b]тиофена (промежуточное соединение 7).d) Промежуточное соединение 7 (0,18 моль) добавляли порциями к смеси 1,3,5,7 тетраазотрицило[5.1.1.13,5]декана (0,45 моль) в СНСl3 (600 мл). Реакционную смесь перемешивали и кипятили с обратным холодильником в течение ночи и затем охлаждали до комнатной температуры. Осадок отфильтровывали и сушили, получая 54,2 г 1-[2-(6-метоксибензо[b]тиофен-2-ил)этил]-1,3,5,7-тетраазатрицикло-[5.1.1.1 5,7]деканийиодида (промежуточное соединение 8).e) Смесь промежуточного соединения 8(0,12 моль) и НСl (0,50 моль) в этаноле (171 мл) перемешивали в течение 2 дней при комнатной температуре. Добавляли еще НСl (10 мл) и этанол (40 мл), и реакционную смесь перемешивали и кипятили с обратным холодильником в течение 1 ч, затем охлаждали до комнатной температуры. Растворитель выпаривали. Остаток перемешивали в 2-пропаноле, затем отфильтровывали. Твердое вещество сушили и остаток вновь преобразовывали в свободное основание 20% NaOH. Отделенный органический слой сушили, фильтровали и растворитель выпаривали. Остаток растворяли в 2-пропаноле и превращали в гидрохлоридную соль с помощью смеси (1:1) HCl/2-пропанол. Осадок отфильтровывали и сушили, получая 13,1 г (50%) 1,2,3,4-тетрагидро-7-метокси-[1]бензотиено[3,2 с]пиридина (промежуточное соединение 9). Аналогично получали гидрохлорид 1,2,3,4 тетрагидро-8-метил[1]бензотиено[3,2-с]пиридина (промежуточное соединение 10). Пример А 4.ZnCl2 (10 г) в этилацетате (90 мл) и НСl (12 н,190 мл) перемешивали при -10 С. Газообразный НСl барботировали в смесь до насыщения (при-10 С). При 0 С по каплям добавляли 5 фторбензо[b]тиофен (0,35 моль). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Добавляли толуол (200 мл) и смесь интенсивно перемешивали. Органический слой отделяли, промывали водным раствором NаНСО 3 и водой, сушили, фильтровали и растворитель выпаривали. Остаток растирали с гексаном, отфильтровывали и сушили, получая 58 г (82,6%) 3-(хлорметил)-5-фторбензо[b]тиофена (промежуточное соединение 11).(110 мл) перемешивали при 30 С. Медленно добавляли промежуточное соединение 11 (0,29 моль). Смеси давали охладиться до комнатной температуры, продолжая перемешивание. Затем реакционную смесь перемешивали на бане из смеси лед-вода. Осадок отфильтровывали, промывали водой, затем растворяли в CH2Cl2. Органический слой сушили, фильтровали, и растворитель выпаривали,получая 5 фторбензо[b]тиофен-3-ацетонитрил (промежуточное соединение 12).c) Смесь промежуточного соединения 12(0,29 моль) в смеси NH3 и СН 3 ОН (700 мл) гидрировали при 14 С на никеле Ренея (5 г) в качестве катализатора в присутствии раствора тиофена (10 мл). После поглощения H2 (2 эквив.) катализатор отфильтровывали через дикалит и фильтрат упаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент:CH2Cl2/(СН 3 ОН/NН 3) 96/4). Целевые фракции собирали и выпаривали растворитель. Остаток растворяли в диизопропиловом эфире и преобразовывали в гидрохлоридную соль с помощью смеси (1:1) HCl/2-пропанол. Осадок отфильтровывали, промывали диизопропиловым эфиром и сушили, получая 48,5 г гидрохлорида 5-фторбензо[b]тиофен-3-этанаминаd) Смесь промежуточного соединения 13(190 мл) и формальдегида (37%, 190 мл) перемешивали и кипятили с обратным холодильником в течение одного часа. Смеси давали остыть до комнатной температуры, затем при перемешивании выливали ее в NaOH (4M, 1200 мл). Осадок отфильтровывали и растирали с СН 3 СN,отфильтровывали, промывали диизопропиловым эфиром и сушили, получая 21 г 1,1'метилен-бис[6-фтор-1,2,3,4-тетрагидро[1]бензотиено[2,3-с]пиридина (промежуточное соединение 14).e) Смесь промежуточного соединения 14(0,049 моль) в воде (1700 мл) и НСl (12 н, 285 мл) перемешивали и кипятили с обратным холодильником в течение одного часа. Осадок отфильтровывали, промывали СН 3 СN и диизопропиловым эфиром и сушили, получая 17,7 г гидрохлорида 6-фтор-1,2,3,4-тетрагидро[1]бензотиено[2,3-с]пиридина (промежуточное соединение 15). Пример А 5. Смесь АlСl3 (32 г) в метоксибензоле (250 мл) перемешивали при 0 С. При 0 С по каплям добавляли 5-хлорпентаноилхлорид (0,24 моль). Реакционную смесь перемешивали в течение 3 ч при температуре от 0 до 5 С, и затем дали температуре подняться до 15 С. Смесь выливали в ледяную воду (400 г) и 12 н НСl (100 мл) и экстрагировали СН 2 Сl2. Органический слой отделяли, сушили, фильтровали через дикалит и растворитель выпаривали. Остаток перемешивали в петролейном эфире и диизопропиловом эфире и полученное масло отделяли, получая 50,4 г 6 хлор-1-(4-метоксифенил)-1-гексанон (промежуточное соединение 16). Пример А 6.a) Реакцию проводили в атмосфере N2. ВF3 в диэтиловом эфире (215 мл) охлаждали до 0 С. Добавляли 3-фторфенол (0,25 моль). Добавляли 6-хлоргексаноилхлорид (0,51 моль) и полученную реакционную смесь перемешивали в течение 15 мин при 0 С, затем давали ей нагреться до комнатной температуры. После этого реак 15 ционную смесь оставляли при перемешивании на ночь при 130 С. Смесь охлаждали до комнатной температуры. Во время охлаждения добавляли воду. Смесь дважды экстрагировали диизопропиловым эфиром. Отделенный органический слой сушили, фильтровали, и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/гексан 50/50), затем ЖХВР (элюент:b) Смесь промежуточного соединения 17(0,21 моль) и гидроксиламингидрохлорида (0,25 моль) в пиридине (100 мл) перемешивали в течение 2 суток при комнатной температуре, затем выливали в 1 н НСl (450 мл). Смесь перемешивали в течение 10 мин, затем экстрагировали этилацетатом (2 х). Отделенный органический слой сушили, фильтровали, и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагелеc) Промежуточное соединение 18 (0,017 моль) в тетрагидрофуране (50 мл) нагревали до 60 С. По каплям добавляли раствор 1,1'карбонил-бис-1 Н-имидазола (0,035 моль) в тетрагидрофуране, и полученную реакционную смесь перемешивали и кипятили с обратным холодильником в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и растворитель выпаривали. Остаток промывали водой, затем подкисляли НСl. Смесь экстрагировали СН 2 Сl2. Отделенный органический слой сушили, фильтровали, и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2). Целевые фракции собирали и выпаривали растворитель, получая 3-(5-хлорпентил)-6-фтор-1,2 бензизоксазол (промежуточное соединение 19). В. Получение соединений формулы (I). Пример В 1. Смесь 6-хлор-1-(4-фторфенил)-1-гексанона(200 мл) перемешивали и кипятили с обратным холодильником в течение ночи и затем охлаждали до комнатной температуры. Растворитель выпаривали. Остаток промывали H2O и смесь экстрагировали CH2Cl2. Органический слой отделяли, сушили, фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле(элюент: СН 2 Сl2/СН 3 ОН 95/5). Чистые фракции собирали и растворитель выпаривали. Остаток преобразовывали в соль (Е)-2-бутендионовой кислоты 16 чая 5,1 г (Е)-2-бутендиоата 1-(4-фторфенил)-6(1,2,3,4-тетрагидробензофуро[3,2-с]пиридин-2 ил)-1-гексанона (1:1) (71%). В табл. 1, 2 и 3 перечислены соединения формулы (I), которые были получены аналогично примеру В 1. Таблица 1 С. Фармакологические примеры. Пример С 1. Связующее сродство к 2 рецепторам in vitro. Взаимодействие соединений формулы (I) с 2-рецепторами определяли в экспериментах invitro по связыванию радиолиганда. В общем случае низкие концентрации радиолиганда с высоким связующим сродством к определенному рецептору инкубируют в забу 17 ференной среде с образцом препарата ткани,обогащенной данным рецептором, или с препаратом клеток, экспрессирующих клонированные рецепторы человека. Во время инкубации радиолиганд связывается с рецептором. Когда достигается равновесие связывания, связанную с рецептором радиоактивность отделяют от несвязанной радиоактивности и подсчитывают активность связанного рецептора. Взаимодействие испытуемых соединений с рецептором определяли в сравнительных опытах по связыванию. Испытуемое соединение в различных концентрациях добавляли к инкубационной среде,содержащей препарат рецептора и радиолиганд. Связывание радиолиганда должно ингибироваться испытуемым соединением пропорционально его связующей активности и его концентрации. Радиолигандом, использованным для связывания 2 А, 2B и 2C рецептора, является 3Hраувольсцин, а использованным препаратом рецептора является клетка яичника китайского хомячка (ЯКХ), экспрессированная клонированными 2A, 2B и 2C рецепторами человека. Величина IC50 (концентрации, при которой ингибируется 50% рецепторов) для соединений,приведенных выше в примерах экспериментальной части, для каждого из трех рецепторов была в интервале между 10-6 М и 10-10 М. Пример С 2. Диссоциация связующего родства с рецептором для 2A и допамина D2. Как уже указано выше, антагонизм к допамину D2 может привести к повышенному риску ЭППЭ. Таким образом, чем выше диссоциация между 2 А и D2, тем лучше. Столбцы, озаглавленные "диссоциация", показывают значенияIC50 (мольные) для 2 Арецептора и D2 рецептора. Под "соотношением" имеется в виду соотношение D2/2A, и оно является показателем диссоциации между двумя указанными рецепторами.D. Примеры композиций. Термин активный ингредиент (АИ), используемый в данных примерах, относится к соединению формулы (I), его фармацевтически приемлемой соли присоединения или стереохимически изомерной форме. Пример D1. Капсулы. 20 г АИ, 6 г лаурилсульфата натрия, 56 г крахмала, 56 г лактозы, 0,8 г коллоидной двуокиси кремния и 1,2 г стеарата магния тщательно смешивали. Затем полученной смесью заполняли 1000 капсул из отвержденного желатина, содержащих по 20 мг АИ каждая. Пример D2. Таблетки с пленочным покрытием. 18 Приготовление ядра таблетки Смесь 100 г АИ, 570 г лактозы и 200 г крахмала хорошо смешивали, после чего увлажняли раствором 5 г додецилсульфата натрия и 10 г поливинилпирролидона в примерно 200 мл воды. Влажную порошковую смесь просеивали, сушили и опять просеивали. Затем добавляли 100 г микрокристаллической целлюлозы и 15 г гидрированного растительного масла. Все хорошо смешивали и прессовали в таблетки,получая 10000 таблеток, содержащих по 10 мг активного ингредиента каждая. Покрытие К раствору 10 г метилцеллюлозы в 75 г денатурированного этанола добавляли раствор 5 г этилцеллюлозы в 150 мл дихлорметана. Затем добавляли 75 мл дихлорметана и 2,5 мл 1,2,3 пропантриола. Расплавляли 10 г полиэтиленгликоля и растворяли его в 75 мл дихлорметана. Последний раствор добавляли к первому и затем добавляли 2,5 г октадеканоата магния, 5 г поливинилпирролидона и 30 мл концентрированной суспензии красителя, и все гомогенизировали. Ядра таблеток покрывали полученной таким образом смесью в аппарате для нанесения покрытия. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, имеющее формулу его N-оксидная форма, фармацевтически приемлемая соль присоединения и стереохимически изомерная форма, гдеn равно 1 или 2; р равно 1 и q равно 2; или р равно 2 и q равно 1; Х представляет собой О, S или NH; каждый R1 независимо представляет собой водород, галоген, C1-6 алкил, нитро, гидрокси или С 1-4 алкилокси;R2 представляет собой водород, C1-6 алкил,арил или C1-6 алкил, замещенный арилом; арил представляет собой фенил или фенил,замещенный галогеном или C1-6 алкилом;D представляет собой радикал формулы где m равно 1 или 2; каждый R3 независимо представляет собой водород, С 1-4 алкил, С 1-4 алкилокси или галоген. 2. Соединение по п.1, где n равно 1 и R1 представляет собой водород, хлор, фтор, метил,метокси или нитро. 3. Применение соединения по п.1 или 2 в качестве лекарства. 4. Применение соединения по любому из пп.1 и 2 при получении лекарства для лечения депрессии или болезни Паркинсона. 5. Композиция, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество соединения по любому из пп.1 и 2. 6. Способ получения композиции по п.5 путем объединения при тщательном перемешивании указанного в любом из пп.1 и 2 соединения в качестве активного ингредиента с фармацевтически приемлемым носителем. 7. Способ получения соединения по п.1,заключающийся в том, что осуществляют(а) N-алкилирование промежуточного соединения формулы (II) алкилирующим агентом формулы (III) 20 где W1 представляет собой подходящую удаляемую группу и D, Alk, X, n и R1 такие, как указано в п.1, в реакционно-инертном растворителе в присутствии основания и, необязательно,в присутствии катализатора;(b) и, если желательно, преобразование соединений формулы (I) друг в друга известными методами, и далее, если желательно, преобразование соединений формулы (I) в терапевтически активную нетоксичную соль присоединения кислоты путем обработки кислотой или в терапевтически активную нетоксичную соль присоединения основания путем обработки основанием, или, наоборот, преобразование соли присоединения кислоты в свободное основание путем обработки щелочью, или преобразование соли присоединения основания в свободную кислоту путем обработки кислотой, или, если желательно, получение их стереохимически изомерных форм или N-оксидов.
МПК / Метки
МПК: C07D 495/04, C07D 491/04, A61K 31/44, C07D 471/04, A61P 25/16
Метки: тио, антагонистов, качестве, тетрагидробензо, alpha2, пиридиновые, фуро, азо, 1,2,3,4, производные, 1,5-пентандиилзамещенные
Код ссылки
<a href="https://eas.patents.su/11-3606-15-pentandiilzameshhennye-1234-tetragidrobenzo-furo-azo-i-tio-32-c-piridinovye-proizvodnye-v-kachestve-alpha2-antagonistov.html" rel="bookmark" title="База патентов Евразийского Союза">1,5-пентандиилзамещенные 1,2,3,4 – тетрагидробензо (фуро, азо и тио) [3,2 - c] пиридиновые производные в качестве &alpha2 – антагонистов</a>
Предыдущий патент: Производные камптотецина, обладающие противоопухолевой активностью
Следующий патент: 4-оксо-4,7-дигидротиено [2,3-b]пиридин-5-карбоксамиды в качестве антивирусных средств
Случайный патент: Сборка многополюсного распределительного устройства с двойным кожухом и прерыватель цепи, содержащий двойной кожух












