Спироциклические пиперидины, используемые в качестве антагонистов мкг1 , и их применения
Номер патента: 7387
Опубликовано: 27.10.2006
Авторы: Ветцель Джон, Андерсен Ким, Дзианг Ю, Делеон Джон, Марзабади Мохаммад, Лу Каи, Чен Чиен-Ан
Формула / Реферат
1. Соединение, имеющее структуру
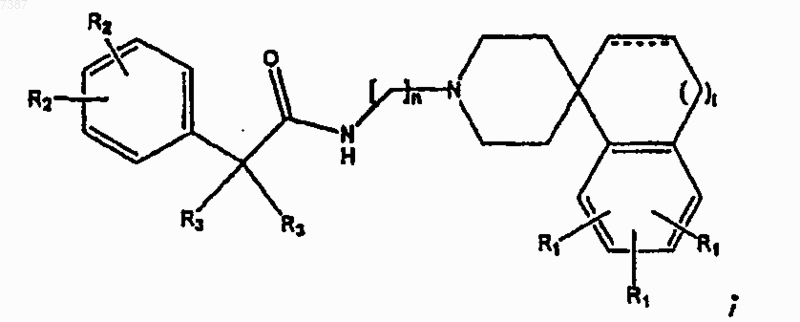
где  представляет собой СН2, О, -СО-, -СO2-, -СН2СН2- или -СНСН-;
представляет собой СН2, О, -СО-, -СO2-, -СН2СН2- или -СНСН-;
t равно 0 или 1, а цикл, содержащий t, является 5- или 6-членным;
n равно целому числу от 1 до 6 включительно;
каждый из R1 и R2 независимо представляет собой -Н, -F, -Cl, -Br, -I, прямой или разветвленный С1-С7алкил, монофторалкил или полифторалкил, арил или гетероарил;
каждый из R3 независимо представляет собой -Н; прямой или разветвленный C1-С6алкил; арил или гетероарил, где указанные арил или гетероарил необязательно замещены одной или несколькими группами, выбранными из -F, -Cl, -Br-, -I, -R2, прямого или разветвленного С1-С7алкила, арила, фенокси или гетероарила; и
где две группы R3, взятые вместе, могут образовывать С3-С6циклоалкил;
или его фармацевтически приемлемая соль.
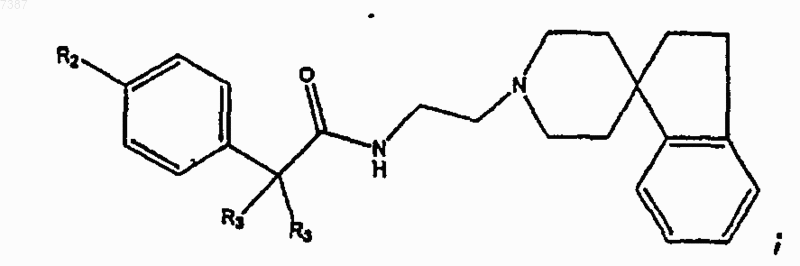
2. Соединение по п.1, имеющее структуру

где n, R1, R2 и R3 определены в п.1.
3. Соединение по п.2, имеющее структуру
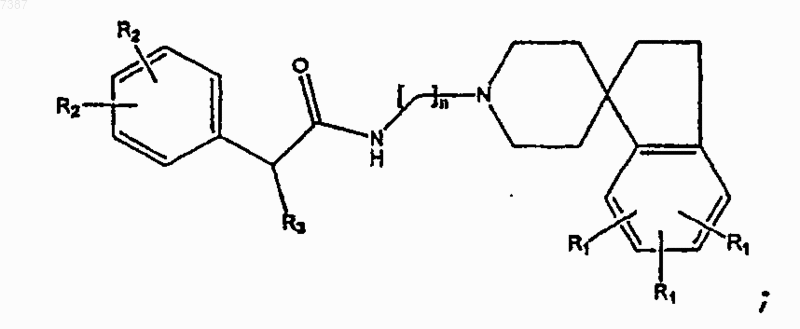
где R3 представляет собой прямой или разветвленный C1-С6алкил или арил, где указанный арил необязательно замещен одной или несколькими группами, выбранными из -F, -Cl, -Br, -I, -R2, прямого или разветвленного С1-С7алкила, арила, фенокси или гетероарила, и где n, R1 и R2 определены в п.1.
4. Соединение по п.3, имеющее структуру
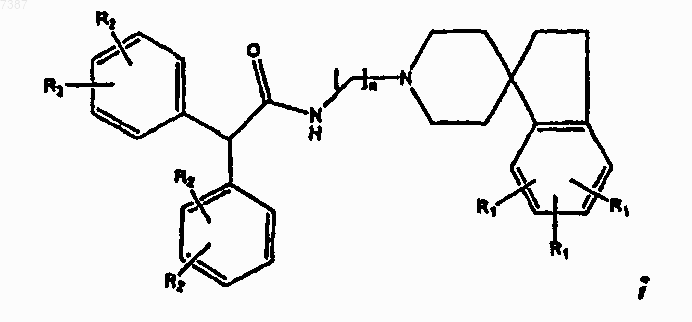
где n, R1 и R2 определены в п.1.
5. Соединение по п.4, имеющее структуру
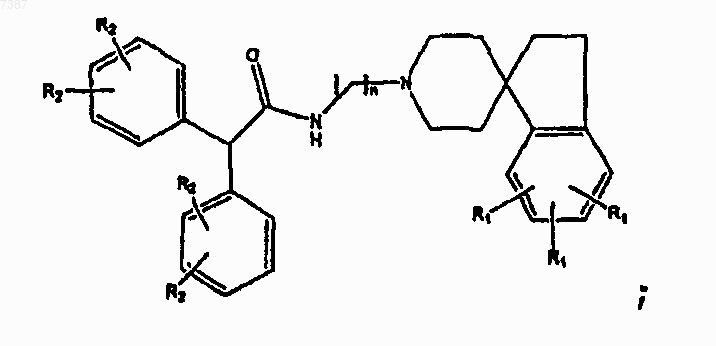
где каждый из R1 и R2 независимо представляет собой -Н, -F, -Сl, -Вr, -I, прямой или разветвленный С1-С7алкил, арил или гетероарил; и
где n определено в п.1.
6. Соединение по п.5, имеющее структуру
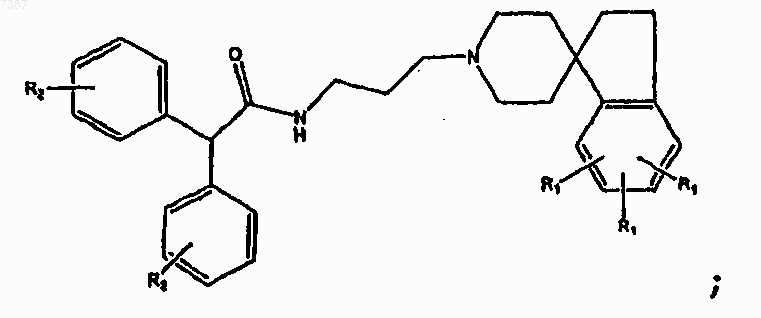
где R1 и R2 определены в п.1.
7. Соединение по п.6, имеющее структуру

где каждый из R2 определен в п.1.
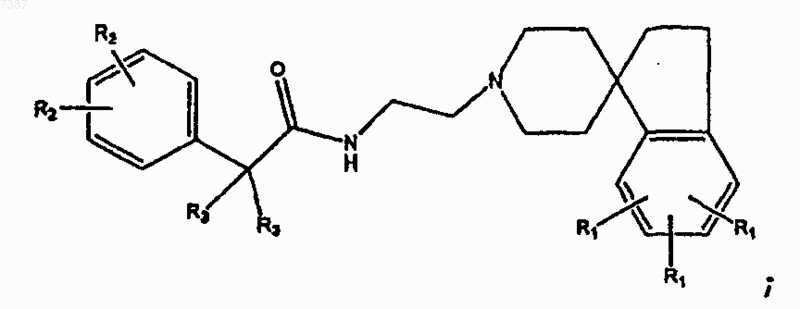
8. Соединение по п.7, имеющее структуру
9. Соединение по п.2, имеющее структуру

где каждый из R3 независимо представляет собой Н или C1-С6алкил с прямой или разветвленной цепью и
где n, R1 и R2 определены в п.1.
10. Соединение по п.9, имеющее структуру
где каждый из R3 представляет собой C1-С6алкил с прямой или разветвленной цепью, и
где R1 и R2 определены в п.1.
11. Соединение по п.10, имеющее структуру
где каждый из R1 представляет собой -F, -Cl, -Br или C1-С3алкил, каждый из R3 независимо представляет собой Н или С1-С7алкил с прямой или разветвленной цепью и
где R2 определен в п.1.
12. Соединение по п.11, имеющее структуру
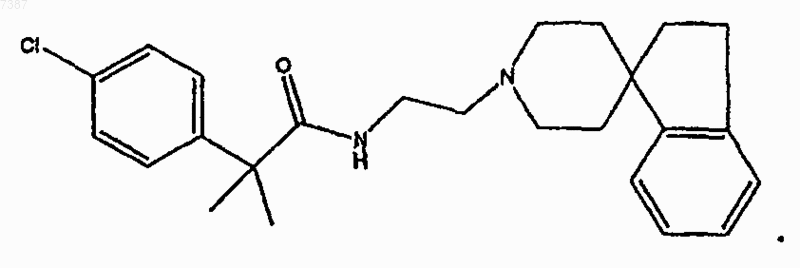
13. Соединение по п.2, имеющее структуру
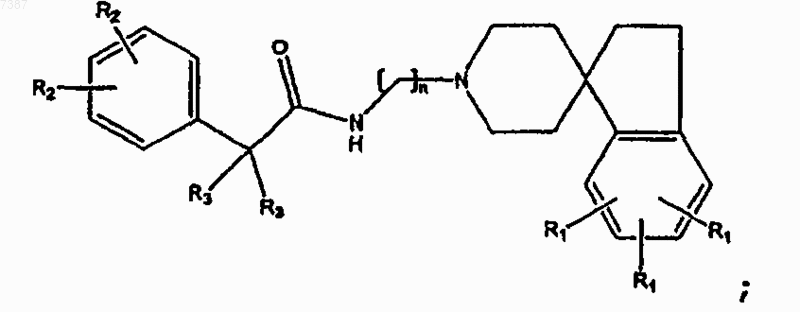
где две группы R3, взятые вместе, образуют С3-С6циклоалкил и
где n, R1 и R2 определены в п.1.
14. Соединение по п.13, имеющее структуру
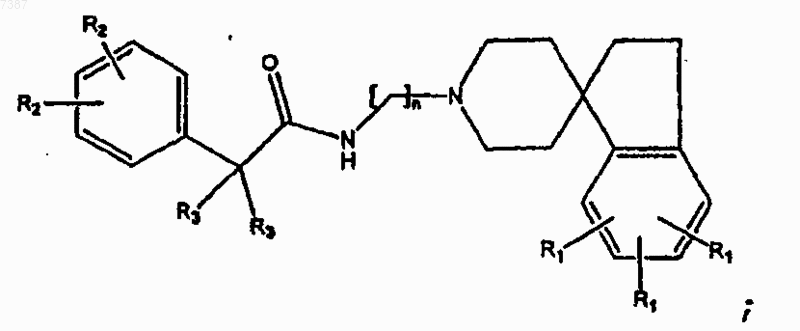
где две группы R3, взятые вместе, образуют С4-С6циклоалкил;
каждый из R1 и R2 независимо представляет собой -Н, -F, -Cl, -Br, -I или С1-С7алкил с прямой или разветвленной цепью и
где n определено в п.1.
15. Соединение по п.14, имеющее структуру
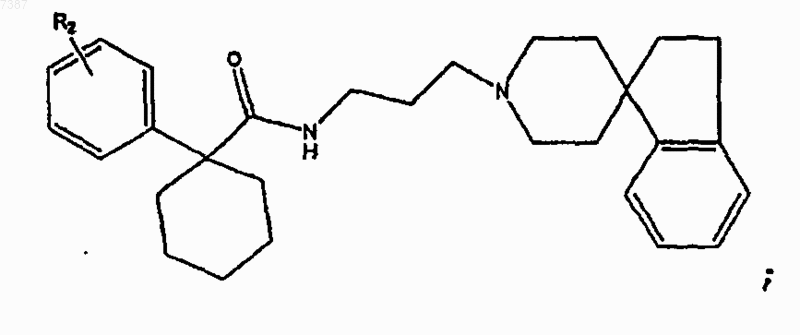
где R2 представляет собой -Н, -F, -Cl, -Br или -I.
16. Соединение по п.15, имеющее структуру
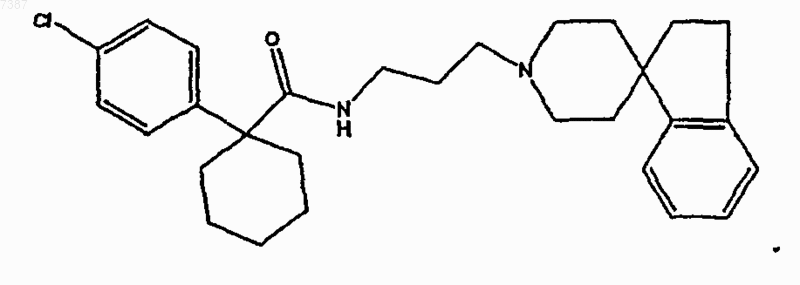
17. Соединение по п.1, имеющее структуру
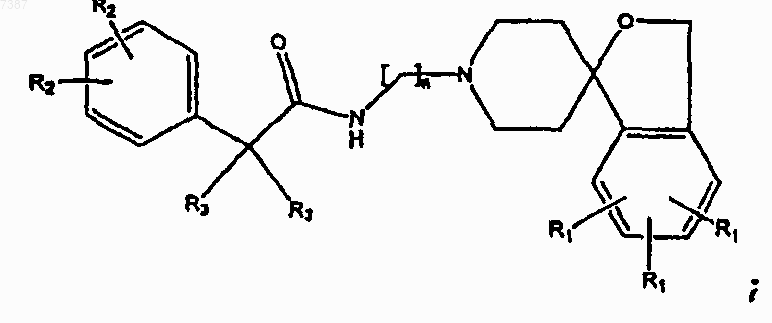
где n, R1, R2 и R3 определены в п.1.
18. Соединение по п.17, имеющее структуру
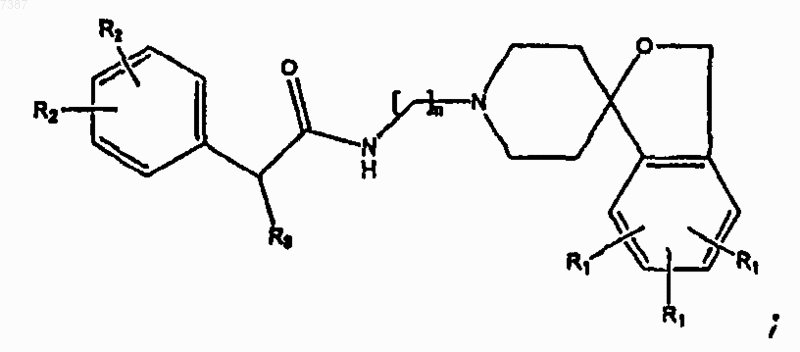
где R3 представляет собой прямой или разветвленный C1-С6алкил или арил, где указанный арил необязательно замещен одной или несколькими группами, выбранными из -F, -Cl, -Br, -I, -R2, прямого или разветвленного С1-С7алкила, арила, фенокси или гетероарила, и
где n, R1 и R2 определены в п.1.
19. Соединение по п.18, имеющее структуру

где n, R1 и R2 определены в п.1.
20. Соединение по п.19, имеющее структуру

где n, R1 и R2 определены в п.1.
21. Соединение по п.20, имеющее структуру
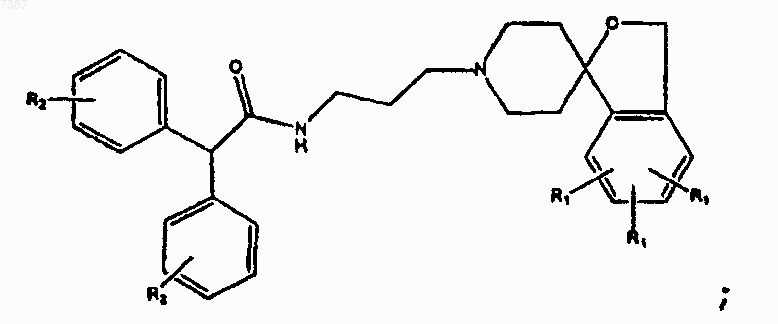
где каждый из R1 и R2 независимо представляет собой -Н, -F, -Сl, -Вr, -I, или прямой или разветвленный С1-С7алкил.
22. Соединение по п.21, имеющее структуру
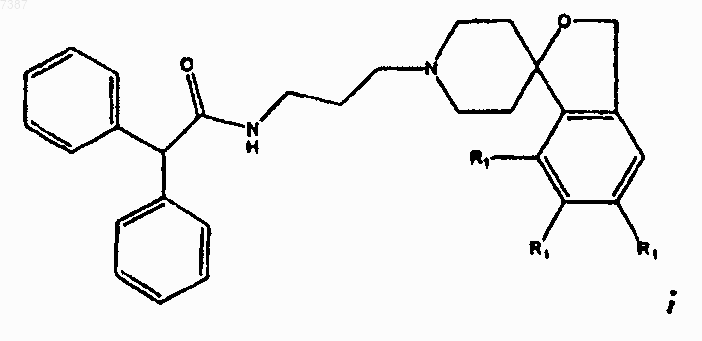
где каждый из R1 независимо представляет собой -F, -Cl, -Br, -I или прямой или разветвленный С1-С7алкил.
23. Соединение по п.22, имеющее структуру
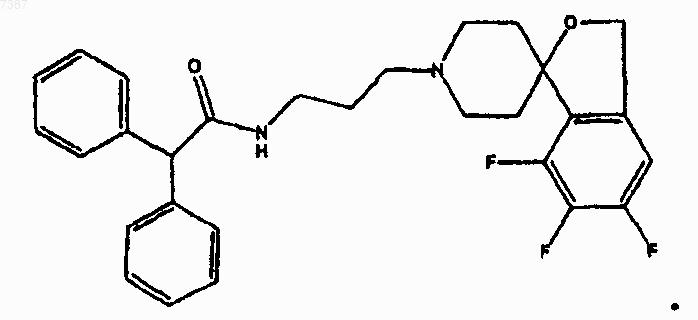
24. Соединение по п.23, имеющее структуру
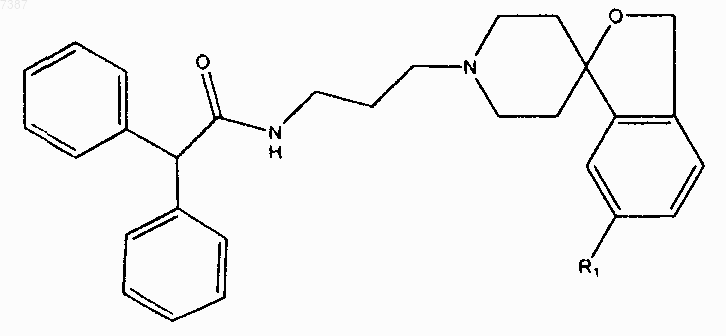
где R1 представляет собой -F, -Cl, -Br, -I или С1-С7алкил с прямой или разветвленной цепью.
25. Соединение по п.24, имеющее структуру
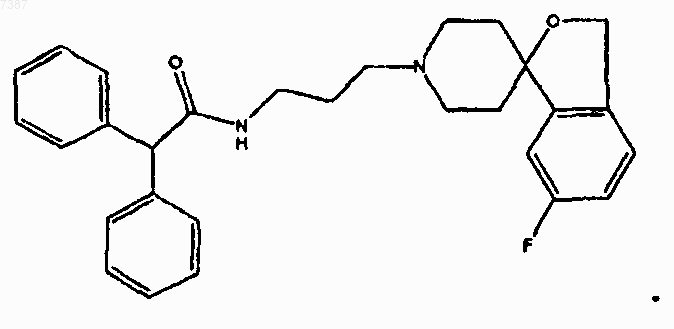
или
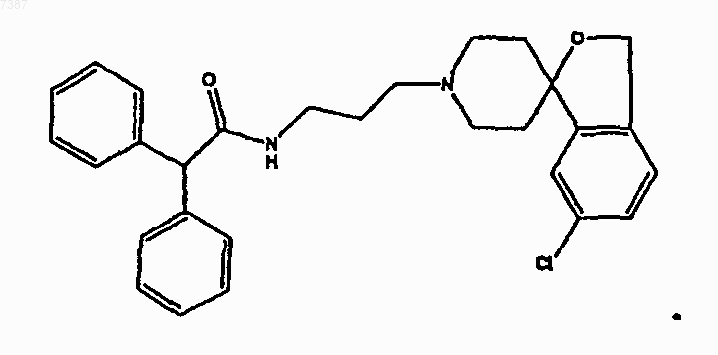
26. Соединение, имеющее структуру
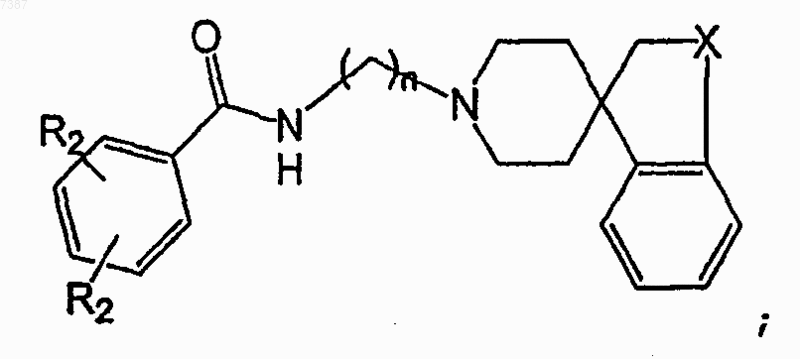
где каждый из R2 независимо представляет собой -Н, -F, -Cl, -Br, -CN или С1-С7алкил с прямой или разветвленной цепью;
X представляет собой СН2 или О; и
n равно целому числу от 1 до 6 включительно.
27. Соединение по п.26, имеющее структуру
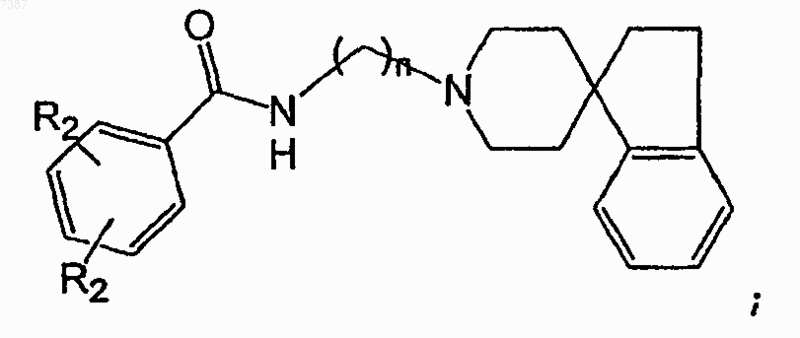
где каждый из R2 независимо представляет собой -Н, -F, -Cl или -Вr и где n равно целому числу от 1 до 6 включительно.
28. Соединение по п.27, имеющее структуру
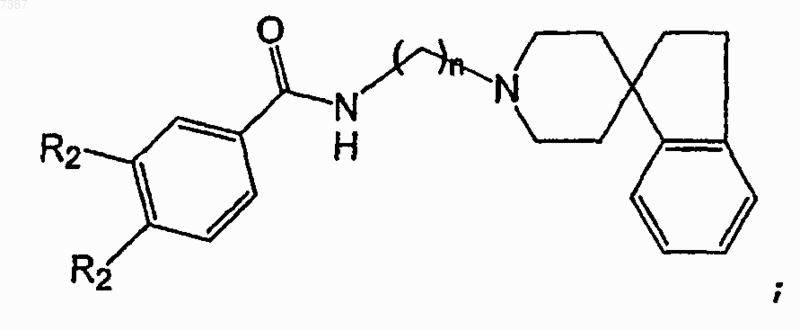
где каждый из R2 независимо представляет собой Н, F, Cl или Вr и где n равно целюьу числу от 3 до 6 включительно.
29. Соединение по п.28, имеющее структуру

где каждый из R2 представляет собой F, Cl или Вr.
30. Соединение по п.29, имеющее структуру
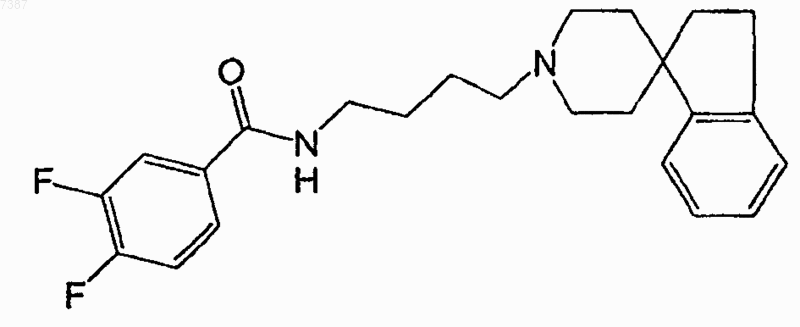
31. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по п.1 и фармацевтически приемлемый носитель.
32. Фармацевтическая композиция, полученная путем смешивания соединения по п.1 и фармацевтически приемлемого носителя.
33. Способ получения фармацевтической композиции, предусматривающий смешивание соединения по п.1 и фармацевтически приемлемого носителя.
34. Применение соединения по п.1 для получения лекарственного препарата для лечения расстройства, опосредуемого МКГ1-рецептором, где указанным расстройством является депрессия, тревожное состояние, ожирение или недержание мочи.
35. Применение по п.34, где терапевтически эффективное количество соединения по п.1 составляет примерно от 0,03 до 300 мг.
Текст
007387 В этой заявке испрашивается приоритет заявки США рег. 10/189146, поданной 3 июля 2002, содержание которой вводится в настоящее описание в качестве ссылки. Различные публикации, цитируемые в описании данной заявки, даны в скобках, где указаны авторы и дата. Полный список этих работ приведен в конце описания изобретения непосредственно перед формулой изобретения. Для более полного освещения предшествующего уровня техники, к которому относится настоящее изобретение, описание указанных публикаций во всей своей полноте приводится в настоящем описании в качестве ссылки. Предшествующий уровень техники Меланин-концентрирующий гормон (МКГ) представляет собой циклический пептид, впервые выделенный из гипофиза лососевых рыб (костистых рыб) (Kawauchi et al., 1983). У рыб указанный пептид,состоящий из 17 аминокислот, вызывает агрегацию меланина в меланофорах и ингибирует высвобождение АСТН, действуя как функциональный антагонист МСГ (меланостимулирующего гормона). МКГ млекопитающих (состоящий из 19 аминокислот) является в высокой степени консервативным у крыс,мышей и человека, и у этих животных аминокислотные последовательности указанного гормона имеют 100% идентичность, однако, его физиологическая роль пока еще не ясна. Сообщалось, что МКГ участвует в различных процессах, включая потребление пищи, водный баланс, энергетический метаболизм, общее состояние возбуждения/внимания, память и познавательные функции, а также психические расстройства (см. обзор Baker 1991, Baker 1994; Nahon, 1994; Knigge et al., 1996). Роль МКГ в потреблении пищи или в регуляции массы тела была подтверждена недавно появившейся публикацией в Nature (Qu etal., 1996), где было продемонстрировано, что он сверхэкспрессируется в гипоталамусе мышей оb/оb, но не у мышей ob/+, и что голодание также приводит к увеличению уровня мРНК МКГ как у мышей с ожирением, так и у нормальных мышей. У нормальных крыс введение МКГ в латеральный желудочек также стимулировало потребление пищи (Rossi et al., 1997). Кроме того, сообщалось, что МКГ является функциональным антагонистом поведенческих эффектов МСГ (Miller et al., 1993; Gonzalez et al, 1996; Sanchez et al., 1997), а также было показано, что стресс повышает уровни мРНК РОМС, но снижает уровни мРНК предшественника МКГ, препроМКГ (ррМКГ)(Presse et al., 1992). Таким образом, МКГ может служить в качестве интегративного нейропептида, участвующего в ответной реакции на стресс, а также в регуляции потребления пищи и половой активности(Baker, 1991; Knigge et al., 1996). Очевидно, что биологические эффекты МКГ опосредуются специфическими рецепторами. Сообщалось, что меченный тритием лиганд (3[Н]-МКГ) специфически связывается с мембранами головного мозга, однако, он оказался непригодным для использования в анализах методом насыщения, таким образом для определения аффинности или Bmax (DrozdzEberle, 1995). Мечение тирозина радиоактивным иодом в положении 13 приводит к образованию лиганда со значительно более низкой биологической активностью (см. DrozdzEberle, 1995). В противоположность этому, мечение аналога МКГ, [Phe13, Туr19]-МКГ,радиоактивным иодом оказалось успешным (Drozdz et al., 1995), то есть, этот лиганд сохранял биологическую активность и специфически связывался с различными клеточными линиями, включая мышиную меланому (B16-F1, G4F и G4F-7), РС 12 и клетки COS. В клетках G4F, KD составлял 0,118 нМ, а Вmах составлял 1100 сайтов/клетку. Важно отметить, что это связывание не ингибировалось МСГ (меланоцитостимулирующим гормоном), но при этом слабо ингибировалось крысиным ANF (Ki = 116 нМ, в отличие от нативного МКГ, для которого Ki = 12 нМ) (Drozdz et al., 1995). Позже сообщалось о специфическом связывании МКГ в трансформированных кератиноцитах (Burgaud et al., 1997) и в клетках меланомы(Drozdz et al., 1998), и в этих исследованиях по фотосшиванию было сделано предположение, что указанный рецептор представляет собой мембранный белок с кажущейся молекулярной массой 45-50 килодальтон, что соответствует диапазону молекулярных масс для суперсемейства рецепторов GPCR. О каких-либо радиоавторадиографических исследованиях по локализации МКГ-рецептора с использованием этого лиганда пока еще не сообщалось. Определение локализации и биологической активности пептида МКГ дало основание предположить, что модуляция активности рецептора МКГ может быть использована в различных терапевтических целях. Роль МКГ в потреблении пищи является наилучшим показателем его клинической ценности. МКГ экспрессируется в латеральном гипоталамусе, в области головного мозга, ответственной за регуляцию чувства жажды и голода (Grillon et al., 1997); причем, недавно было показано, что почти такую же локализацию в латеральном гипоталамусе имеют орексины А и В, которые являются сильными орексигенными (возбуждающими аппетит) агентами (Sakurai et al., 1998). У крыс, уровни мРНК МКГ в этой области головного мозга увеличивались после 24-часового голодания (HerveFellman, 1997), а после инъекции инсулина наблюдалось значительное увеличение уровней иммунореактивного МКГ (до избыточных) и интенсивное окрашивание перикарионов и волокон, содержащих, указанный иммунореактивный МКГ,одновременно со значительным увеличением уровня мРНК МКГ (Bahjaoui-Bouhaddi et al., 1994). Способность МКГ стимулировать потребление пищи у крыс (Rossi et al., 1997) подтверждает наблюдаемый факт увеличения уровней мРНК МКГ в гипоталамусе крыс с ожирением ob/ob (Qu et al.,1996) и снижение этих уровней в гипотоламусе крыс, леченных лептином, причем у этих крыс также-1 007387 снижалось потребление пищи и уменьшался прирост массы тела (Sahu, 1998). Очевидно, что в меланокортиновой системе, МКГ действует как функциональный антагонист в отношении его влияния на потребление пищи и секрецию гормонов в НРА (системе гипотоламус-гипофиз-надпочечники) (Ludwig etal., 1998). Эти данные, в целом, позволяют предположить, что эндогенный МКГ играет определенную роль в регуляции энергетического баланса и в ответной реакции на стресс, а поэтому желательно получить такие специфические соединения, которые оказывали бы воздействие на МКГ-рецепторы, и которые можно было бы использовать для лечения ожирения и ассоциированных со стрессом расстройств. У всех уже исследованных видов основная часть нейронов, относящихся к группе МКГсодержащих клеток, имеет относительно постоянную локализацию в тех областях латерального гипоталамуса и субталамуса, где они обычно присутствуют, и эти нейроны могут быть частью так называемых"экстрапирамидных двигательных схем". Они участвуют в субстанциальных стриато- и паллидофуговых путях, осуществляемых в таламусе, в коре головного мозга и в гипоталамических областях, в реципрокных связях с субталамическим ядром, черным веществом и центрами среднего мозга (Bittencourt et al.,1992). В этих областях группа МКГ-клеток представляет собой связующее звено или механизм для экспрессии гипоталамической висцеральной активности с соответствующей и координированной двигательной активностью. Исходя из клинических исследований, можно предположить, что МКГ-система играет определенную роль в двигательных расстройствах, таких как болезнь Паркинсона и хорея Гентингтона, в которых, как известно участвуют "экстрапирамидные схемы". При исследованиях на сцепление человеческих генов было установлено, что аутентичный локусhМКГ находится на хромосоме 12 (12q23-24), а вариантный локус hМКГ - на хромосоме 5 (5q12-13)(Pedeutour et al., 1994). Локус (12q23-24) совпадает с локусом, в котором был картирован аутосомный доминантный ген, ответственный за мозжечковую атаксию типа II (SCA2) (Auburger et al., 1992; Twells etal., 1992). Это заболевание охватывает нейродегенеративные расстройства, включая оливопонтоцеребеллярную атрофию. Кроме того, ген болезни Дарье был картирован в локусе 12q23-24 (Craddock et al., 1993). Болезнь Дарье характеризуется нарушением адгезии кератиноцитов I и психическими заболеваниями, наследуемыми в некоторых семьях. С точки зрения функциональной и нейроанатомической картины МКГ-клеток нервной системы в головном мозге крыс и человека, ген МКГ может быть хорошим геном-кандидатом,ответственным за SCA2 или болезнь Дарье. Интересно отметить, что в этом локусе были картированы гены, ответственные за заболевания, ассоциированные с высоким социальным значением. Действительно, при проведении анализа на сцепление генов было установлено, что ген, ответственный за хронические или острые формы атрофии позвоночных (остистых) мышц, находится на хромосоме 5q12-13 (Melkiet al., 1990; Westbrook et al., 1992). Кроме того, независимые исследования подтвердили уже установленную локализацию главного локуса шизофрении на хромосоме 5q11.2-13.3 (Sherrington et al., 1998; Bassettet al., 1988; Gilliam et al., 1989). Вышеупомянутые исследования дают основание предполагать, что МКГ может играть определенную роль в нейродегенеративных заболеваниях и в эмоциональных расстройствах. Эффекты МКГ, наблюдаемые в других биологических системах, дают основание предполагать, что МКГ-родственные соединения могут быть использованы и в других терапевтических целях. Так, например, МКГ может регулировать репродуктивные функции у самцов и самок крыс. Транскрипты МКГ и пептиды МКГ были обнаружены в зародышевых клетках в яичках взрослых крыс, что позволяет предположить, что МКГ может участвовать в обновлении стволовых клеток и/или в дифференцировке ранних сперматоцитов (Hervieu et al., 1996). МКГ, инъецированный непосредственно в срединное предзрительное поле (СПЗП) или в нижнемедиальное ядро (НМЯ), стимулировал половую активность у самок крыс(Gonzalez et al., 1996). У крыс, подвергнутых овариеэктомии и примированных экстрадиолом, МКГ стимулировал высвобождение лютеинизирующего гормона (ЛГ), а антисыворотка против МКГ ингибировала высвобождение ЛГ (Gonzalez et al., 1997). Неопределенная зона (zona incerta), которая содержит большую популяцию МКГ-клеточных телец, была ранее идентифицирована как регуляторный участок преовуляторного выброса ЛГ (MacKenzie et al., 1984). Сообщалось, что МКГ влияет на высвобождение гипофизарных гормонов, включая АСТН и окситоцин. Аналоги МКГ могут быть также использованы для лечения эпилепсии. В модели PTZиндуцированного эпилептического припадка, инъекция МКГ перед индуцированием припадка приводила к предотвращению эпилептического припадка у крыс и морских свинок, что дало основание предположить, что МКГ-содержащие нейроны могут участвовать в нейронных "схемах взаимодействий", лежащих в основе механизмов, вызывающих PTZ-индуцированный эпилептический припадок (KniggeWagner, 1997). Было также сделано наблюдение, что МКГ оказывает воздействие на поведенческие корреляты познавательных функций. МКГ-обработка ускоряет угасание ответа типа пассивного избегания у крыс (McBride et al., 1994), повышая возможность того, что антагонисты рецептора МКГ могут оказывать благоприятное воздействие на сохранение и/или замедление потери памяти. Возможная роль МКГ в модуляции или восприятии боли подтверждается плотной иннервацией серого вещества среднего мозга МКГ-положительными волокнами. И наконец, МКГ может участвовать в регуляции поглощения жидкости. Инфузия, i.c.v., МКГ "обученной" овце продуцировала диуретические, натриуретические и калиуре-2 007387 тические изменения ответа на увеличение объема плазмы (Parkes, 1996). Эти результаты, взятые вместе с анатомическими данными, указывающими на присутствие МКГ в областях головного мозга, ответственных за регуляцию динамики жидкости в организме, показали, что МКГ может представлять собой важный пептид, участвующий в центральной регуляции гомеостаза жидкости у млекопитающих. Недавно сообщалось об идентификации ассоциированного с G-белком рецептора для МКГ (Chambers et al., 1999; Saito et al., 1999). Этой группой ученых МКГ был идентифицирован как эндогенный лиганд для ассоциированного с G-белком человеческого рецептора-"сироты" SLC-1 (Lakaye et al., 1998). Сообщалось, что крысиный гомолог этого рецептора (в настоящее время называемого МКГ-1) локализован в областях крысиного головного мозга, ассоциированного с пищевым поведением (например, дорсомедиального и вентромедиального гипоталамуса). Недавние сообщения, относящиеся к фенотипу МКГ 1-дефицитных мышей, подтвердили связь между МКГ-1 и влиянием МКГ на потребление пищи. Две группы исследователей независимо показали (Marsh et al., Chen et al., 2002), что направленный разрыв гена рецептора МКГ-1 у мышей (дефицитных по МКГ-1) приводит к гиперфагии у этих животных, но при этом, в отличие от помета дикого типа, они худеют и теряют массу тела. Такое снижение массы тела,очевидно, обусловлено усилением метаболизма. Каждой группой (исследователей) было продемонстрировано, что МКГ-1-дефицитные мыши были резистентны к пищевому ожирению, и их масса тела поддерживалась на таком же уровне, как и масса тела в помете животных, получавших обычный корм для животных. И наконец, в литературе были описаны синтетические молекулы-антагонисты МКГ-1-рецепторов.Bednarek et al. (2002) сообщали о синтезе высокоаффинных пептидных антагонистов МКГ-1. Кроме того,Такекава и др. (Takekawa et al., 2002) описали небольшую молекулу-антагонист МКГ-1. Это соединение,Т-226296, обладает высокой аффинностью по отношению к МКГ-1-рецептору (5-9 нМ для крысиного и человеческого МКГ-1), и было показано, что оно подавляет потребление пищи, индуцированное интрацеребровентрикулярным введением МКГ. Эти данные подтвердили правильность стратегии с использованием антагониста МКГ-1-рецептора для лечения ожирения. Кроме того, в исследованиях авторов настоящего изобретения, антагонисты МКГ-1 были протестированы на нескольких животных-моделях, которые, как хорошо известно, являются предсказуемыми в отношении эффективности соединений у человека (Borowsky et al., Nature Medicine, 2003). Эти эксперименты показали, что антагонисты МКГ-1 могут быть использованы для лечения ожирения, депрессии,тревожного состояния, а также расстройств мочеиспускания. В данной заявке авторами настоящего изобретения описан синтез вторичных аминоанилиновых пиперидинов, которые связываются с клонированным рецептором меланин-концентрирующего гормона-1(МКГ 1). Кроме того, эти соединения связываются с МКГ 1-рецептором с большей селективностью, чем с другим клонированным и ассоциированным с G-белком рецептором. Также описывается способность этих соединений ингибировать активацию указанного клонированного рецептора, измеренная в in vitroанализе. Кроме того, соединения настоящего изобретения могут быть также использованы для лечения аномальных состояний, опосредованных инактивацией МКГ-1-рецептора, таких как нарушения питания(ожирение, булимия и нервно-психическая булимия), половые/репродуктивные расстройства, депрессия,тревожные состояния, депрессия и тревожные состояния, эпилептические припадки, гипертензия, внутримозговое кровоизлияние, застойная сердечная недостаточность, расстройство сна, или другое состояние, на которое может оказывать положительное влияние антагонист рецептора МКГ 1. Кроме того, соединения настоящего изобретения могут быть использованы для снижения массы тела индивидуума. Кроме того, соединения настоящего изобретения могут быть использованы для лечения расстройств мочеиспускания. Краткое описание изобретения Настоящее изобретение относится к соединению, имеющему структуру: где: представляет собой СН 2, О, -СО-, -СО 2, -СН 2 СН 2- или -СНСН-;n равно целому числу от 1 до 6 включительно; каждый из R1 и R2 независимо представляет собой -Н, -F, -Cl, -Br, -I, прямой или разветвленный С 1 С 7 алкил, монофторалкил или полифторалкил, арил или гетероарил; каждый из R3 независимо представляет собой -Н; прямой или разветвленный С 1-С 6 алкил; арил или гетероарил, где указанные арил или гетероарил необязательно замещены одним или несколькими группами, выбранными из -F, -Cl, -Br-, -I, -R2, прямого или разветвленного С 1-С 7 алкила, арила, фенокси или-3 007387 гетероарила; и где две группы R3, взятые вместе, могут образовывать С 3-С 6 циклоалкил; или к его фармацевтически приемлемой соли. Настоящее изобретение также относится к соединению, имеющему структуру: где каждый из R2 независимо представляет собой Н, F, Cl, Br, CN или прямой или разветвленный С 1-С 7 алкил;X представляет собой СН 2 или О; иn равно целому числу от 1 до 6 включительно. В настоящем изобретении описана фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и терапевтически эффективное количество любого из соединений настоящего изобретения. В настоящем изобретении описана фармацевтическая композиция, полученная путем смешивания любого из описанных выше соединений и фармацевтически приемлемого носителя. В настоящем изобретении описан способ получения фармацевтической композиции, предусматривающий смешивание любого из соединений настоящего изобретения и фармацевтически приемлемого носителя. В настоящем изобретении описан также способ синтеза любого из соединений настоящего изобретения. В настоящем изобретении проиллюстрирован способ лечения расстройства, опосредуемого МКГ 1 рецептором, у индивидуума, нуждающегося в этом, где указанный способ предусматривает введение указанному индивидууму терапевтически эффективного количества любого из соединений настоящего изобретения или любой из фармацевтических композиций настоящего изобретения, содержащей указанное соединение и фармацевтически приемлемый носитель. В одном из вариантов осуществления изобретения, терапевтически эффективное количество составляет примерно 0,03-300 мг. В одном из вариантов осуществления изобретения указанным расстройством является депрессия. В другом варианте осуществления изобретения указанным расстройством является тревожное состояние. В одном из вариантов осуществления изобретения указанным расстройством является ожирение. В одном из вариантов осуществления изобретения указанным расстройством является недержание мочи. В одном из вариантов своего осуществления настоящее изобретение относится к способу лечения индивидуума, страдающего расстройством, выбранным из депрессии, тревожного состояния, ожирения или недержания мочи, где указанный способ предусматривает введение индивидууму, нуждающемуся в этом, терапевтически эффективного количества соединения настоящего изобретения. В одном из вариантов настоящего изобретения указанное терапевтически эффективное количество составляет примерно от 0,03 до 300 мг. В другом варианте осуществления изобретения указанным расстройством является депрессия. В одном из вариантов осуществления изобретения указанным расстройством является тревожное состояние. В одном из вариантов осуществления изобретения указанным расстройством является ожирение. В одном из таких вариантов указанным расстройством является недержание мочи. Подробное описание изобретения Настоящее изобретение также относится к соединению, имеющему структуру: где каждый из В независимо представляет собой СН 2, О или NH, при условии, что если один из В представляет собой О или NH, то другой представляет собой СН 2;V представляет собой водород, арил, фенокси или гетероарил, где указанные арил, фенокси или гетероарил необязательно замещены одной или несколькими группами, выбранными из F, -Cl, -Br, -I,-ZR3-, -ZOR3, -OZR3, -ZN(R3)2, -N(R3)ZR3, -N(R3)ZN(R3)2, -CN, -NO2, -SR3-, (CH2)qOR3-, -(CH2)qSR3, арила,фенокси или гетероарила, прямого или разветвленного С 1-С 7 алкила, монофторалкила или полифторалкила, прямого или разветвленного С 2-С 7 алкенила или алкинила, или С 3-С 7 циклоалкила, монофторциклоал-4 007387 кила, полифторциклоалкила или циклоалкенила;W представляет собой водород, арил или гетероарил, где указанные арил или гетероарил необязательно замещены одной или несколькими группами, выбранными из F, -Cl, -Br, -I, -ZR3-, -ZOR3, -OZR3,-ZN(R3)2, -N(R3)ZR3, -N(R3)ZN(R3)2, -CN, -NO2, -SR3-, -OR3, (CH2)qOR3-, -(CH2)qSR3, арила, гетероарила,фенокси, прямого или разветвленного С 1-С 7 алкила, монофторалкила или полифторалкила;Z представляет собой СО, CS, SO2 или отсутствует; каждый из R независимо представляет собой -Н, -F, прямой или разветвленный С 1-С 7 алкил, монофторалкил или полифторалкил, прямой или разветвленный С 2-С 7 алкенил или алкинил, -N(R3)2, -NO2, CN, -CO2R3-, -OCOR3, -OR3, -N(R3)COR3 или -CON(R3)2; каждый из R2 независимо представляет собой -Н, прямой или разветвленный С 1-С 7 алкил, монофторалкил или полифторалкил, прямой или разветвленный С 2-С 7 алкенил или алкинил, арил или гетероарил,где указанные арил или гетероарил необязательно замещены одним или более -F, -Cl, -Br, -I, -NO2, -CN; каждый из R3 независимо представляет собой -Н, прямой или разветвленный С 1-С 7 алкил, монофторалкил или полифторалкил, прямой или разветвленный С 2-С 7 алкенил или алкинил, или С 3-С 7 циклоалкил,монофторциклоалкил, полифторциклоалкил или циклоалкенил, арил или гетероарил, где указанные арил или гетероарил необязательно замещены одной или несколькими группами, выбранными из -F, -Cl, -Br-,-I, -N(R2)2, -NO2, -CN, -COR2, -CO2R2-, -OCOR2, -OR2, -N(R2)COR2, -CON(R2)2, прямого или разветвленного С 1-С 7 алкила, арила, фенокси, бензила или гетероарила, где указанные арил, фенокси, бензил или гетероарил необязательно замещены одной или несколькими группами, выбранными из -F, -Cl, -Br, -I, прямого или разветвленного С 1-С 7 алкила, прямого или разветвленного С 1-С 7 алкила, монофторалкила или полифторалкила, или С 3-С 7 циклоалкила, монофторциклоалкила, полифторциклоалкила или циклоалкенила; каждый из R4 независимо представляет собой -Н, -F, -Сl, -Br, -I, -CN, -NO2, прямой или разветвленный С 1-С 7 алкил, арил, гетероарил, где указанные арил или гетероарил необязательно замещены одной или несколькими группами, выбранными из -F, -Сl-, -Br, -I, -NO2, -CN, прямого или разветвленного C1 С 7 алкила, монофторалкила или полифторалкила, прямого или разветвленного С 2-С 7 алкенила или алкинила, либо, две группы R4, которые являются смежными, образуют метилендиокси-связь; каждый из m независимо означает целое число от 0 до 1 включительно;n равно целому числу от 0 до 6 включительно; иq равно целому числу от 1 до 3 включительно; или к его фармацевтически приемлемой соли. Настоящее изобретение также относится к соединению, имеющему структуру: где каждый из В независимо представляет собой СО, О или NH, при условии, что если один из В представляет собой О или NH, то другой представляет собой СО, и при условии, что если один из В представляет собой СО, то другой представляет собой О или NH;V представляет собой водород, арил, фенокси или гетероарил, где указанные арил, фенокси или гетероарил необязательно замещены одной или несколькими группами, выбранными из -F, -Cl, -Br, -I,-ZR3-, -ZOR3, -OZR3, -ZN(R3)2, -N(R3)ZR3, -N(R3)ZN(R3)2, -CN, -NO2, -SR3, -(CH2)qOR3, -(CH2)qSR3, арила,фенокси или гетероарила, прямого или разветвленного С 1-С 7 алкила, монофторалкила или полифторалкила, прямого или разветвленного С 2-С 7 алкенила или алкинила, или С 3-С 7 циклоалкила, монофторциклоалкила, полифторциклоалкила или циклоалкенила;W представляет собой водород, арил или гетероарил, где указанные арил или гетероарил необязательно замещены одной или несколькими группами, выбранными из -F, -Cl, -Br, -I, -ZR3-, -ZOR3, -OZR3,-ZN(R3)2, -N(R3)ZR3, -N(R3)ZN(R3)2, -CN, -NO2, -SR3, -OR3, -(CH2)qOR3, -(CH2)qSR3, арила, гетероарила,фенокси, прямого или разветвленного С 1-С 7 алкила, монофторалкила или полифторалкила ;Z представляет собой СО, CS, SO2 или отсутствует; каждый из R независимо представляет собой -Н, -F, прямой или разветвленный С 1-С 7 алкил, монофторалкил или полифторалкил, прямой или разветвленный С 2-С 7 алкенил или алкинил, -N(R3)2, -NO2,-CN, -CO2R3, -OCOR3, -OR3, -N(R3)COR3 или -CON(R3)2;-5 007387 каждый из R2 независимо представляет собой -Н, прямой или разветвленный С 1-С 7 алкил, монофторалкил или полифторалкил, прямой или разветвленный С 2-С 7 алкенил или алкинил, арил или гетероарил,где указанные арил или гетероарил необязательно замещены одним или более -F, -Cl, -Br, -I, -NO2, -CN; каждый из R3 независимо представляет собой -Н, прямой или разветвленный С 1-С 7 алкил, монофторалкил или полифторалкил, прямой или разветвленный С 2-С 7 алкенил или алкинил, или С 3-С 7 циклоалкил,монофторциклоалкил, полифторциклоалкил или циклоалкенил, арил или гетероарил, где указанные арил или гетероарил необязательно замещены одной или несколькими группами, выбранными из -F, -Cl, -Br,-I, -N(R2)2, -NO2, -CN, -COR2, -CO2R2, -OCOR2, -OR2, -N(R2)COR2, -CON(R2)2, прямого или разветвленного С 1-С 7 алкила, арила, фенокси, бензила или гетероарила, где указанные арил, фенокси, бензил или гетероарил необязательно замещены одной или несколькими группами, выбранными из -F, -Cl, -Br, -I, прямого или разветвленного С 1-С 7 алкила, прямого или разветвленного С 1-С 7 алкила, монофторалкила или полифторалкила, или С 3-С 7 циклоалкила, монофторциклоалкила, полифторциклоалкила или циклоалкенила; каждый из R4 независимо представляет собой -Н, -F, -Сl, -Br, -I, -CN, -NO2, прямой или разветвленный С 1-С 7 алкил, арил, гетероарил, где указанные арил или гетероарил необязательно замещены одной или несколькими группами, выбранными из -F, -Сl-, -Br, -I, -NO2, -CN, прямого или разветвленного С 1-С 7 алкила, монофторалкила или полифторалкила, прямого или разветвленного С 2-С 7 алкенила или алкинила,либо две группы R4, которые являются смежными друг с другом, образуют метилендиокси-связь; каждый из m независимо означает целое число от 0 до 1 включительно;n равно целому числу от 0 до 6 включительно иq равно целому числу от 1 до 3 включительно; или к его фармацевтически приемлемой соли. Настоящее изобретение также относится к соединению, имеющему структуру: где связь означает простую или двойную связь;V представляет собой водород, арил, фенокси или гетероарил, где указанные арил, фенокси или гетероарил необязательно замещены одной или несколькими группами, выбранными из -F, -Cl, -Br, -I,-ZR3, -ZOR3, -OZR3, -ZN(R3)2, -N(R3)ZR3, -N(R3)ZN(R3)2, -CN, -NO2, -SR3, -(CH2)qOR3, -(CH2)qSR3, арила,фенокси или гетероарила, прямого или разветвленного С 1-С 7 алкила, монофторалкила или полифторалкила, прямого или разветвленного С 2-С 7 алкенила или алкинила, или С 3-С 7 циклоалкила, монофторциклоалкила, полифторциклоалкила или циклоалкенила;W представляет собой водород, арил или гетероарил, где указанные арил или гетероарил необязательно замещены одной или несколькими группами, выбранными из -F, -Cl, -Br, -I, -ZR3, -ZOR3, -OZR3,-ZN(R3)2, -N(R3)ZR3, -N(R3)ZN(R3)2, -CN, -NO2, -SR3, -OR3, -(CH2)qOR3, -(CH2)qSR3, арила, гетероарила,фенокси, прямого или разветвленного С 1-С 7 алкила, монофторалкила или полифторалкила;Z представляет собой СО, CS, SO2 или отсутствует; каждый из R независимо представляет собой -Н, -F, прямой или разветвленный С 1-С 7 алкил, монофторалкил или полифторалкил, прямой или разветвленный С 2-С 7 алкенил или алкинил, -N(R3)2, -NO2,-CN, -CO2R3, -OCOR3, -OR3, -N(R3)COR3 или -CON(R3)2; каждый из R2 независимо представляет собой -Н, прямой или разветвленный С 1-С 7 алкил, монофторалкил или полифторалкил, прямой или разветвленный С 2-С 7 алкенил или алкинил, арил или гетероарил,где указанные арил или гетероарил необязательно замещены одним или более -F, -Cl, -Br, -I, -NO2, -CN; каждый из R3 независимо представляет собой -Н, прямой или разветвленный С 1-С 7 алкил, монофторалкил или полифторалкил, прямой или разветвленный С 1-С 7 алкенил или алкинил, или С 3-С 7 циклоалкил,монофторциклоалкил, полифторциклоалкил или циклоалкенил, арил или гетероарил, где указанный арил или гетероарил необязательно замещены одной или несколькими группами, выбранными из -F, -Cl, -Br-,-I, -N(R2)2, -NO2, -CN, -COR2, -CO2R2, -OCOR2, -OR2, -N(R2)COR2 или -CON(R2)2, прямого или разветвленного С 1-С 7 алкила, арила, фенокси, бензила или гетероарила, где указанные арил, фенокси, бензил или гетероарил необязательно замещены одной или несколькими группами, выбранными из -F, -Cl, -Br, -I,прямого или разветвленного С 1-С 7 алкила, прямого или разветвленного С 1-С 7 алкила, монофторалкила или полифторалкила, или С 3-С 7 циклоалкила, монофторциклоалкила, полифторциклоалкила или циклоалкенила;-6 007387 каждый из R4 независимо представляет собой -Н, -F, -Сl, -Br, -I, -CN, -NO2, прямой или разветвленный С 1-С 7 алкил, арил, гетероарил, где указанные арил или гетероарил необязательно замещены одной или несколькими группами, выбранными из -F, -Сl, -Br, -I, -NO2, -CN, прямого или разветвленного С 1-С 7 алкила, монофторалкила или полифторалкила, прямого или разветвленного С 1-С 7 алкенила или алкинила,либо, две группы R4, которые являются смежными, образуют метилендиокси-связь; каждый из m независимо означает целое число от 0 до 1 включительно;n равно целому числу от 0 до 6 включительно иq равно целому числу от 1 до 3 включительно; или к его фармацевтически приемлемой соли. В одном из вариантов осуществления изобретения, V представляет собой водород, арил, фенокси или гетероарил, где указанные арил, фенокси или гетероарил необязательно замещены одним или несколькими -F, -Cl, -Br, -I;W представляет собой водород, арил или гетероарил, где указанные арил или гетероарил необязательно замещены одним или несколькими -F, -Cl, -Br, -I;Y представляет собой водород, =O (кислород карбонила), -ZOR3, -OZR3, -ZN(R3)2, -N(R3)ZR3,-N(R3)ZC(R3)3, или N(R3)ZN(R3)2; каждый из R независимо представляет собой -Н, -F, прямой или разветвленный С 1-С 7 алкил, монофторалкил или полифторалкил; а каждый из R4 независимо представляет собой -Н, -F, -Сl, -Br, -I, -CN, -NO2, прямой или разветвленный С 1-С 7 алкил. В одном из вариантов осуществления изобретения указанное соединение имеет структуру: В одном из вариантов осуществления изобретения указанное соединение имеет структуру: где каждый из R3 независимо представляет собой -Н, арил или гетероарил, где указанные арил или гетероарил необязательно замещены одной или несколькими группами, выбранными из -F, -Сl, -Br, -I,-N(R2)2 прямого или разветвленного С 1-С 7 алкила, арила, фенокси, бензила или гетероарила, где указанные арил, фенокси, бензил или гетероарил необязательно замещены одной или несколькими группами,выбранными из -F, -Cl, -Br-, -I, прямого или разветвленного С 1-С 7 алкила, прямого или разветвленного С 1-С 7 алкила, монофторалкила или полифторалкила. В одном из вариантов осуществления изобретения указанное соединение имеет структуру: В одном из вариантов осуществления изобретения указанное соединение имеет структуру: В одном из вариантов осуществления изобретения указанное соединение имеет структуру: где Y представляет собой -N(R3)ZR3 или N(R3)ZN(R3)2. В одном из вариантов осуществления изобретения, указанное соединение имеет структуру: В одном из вариантов осуществления изобретения указанное соединение имеет структуру: В одном из вариантов осуществления изобретения указанное соединение имеет структуру: В одном из вариантов осуществления изобретения указанное соединение имеет структуру: В одном из вариантов осуществления изобретения указанное соединение имеет структуру: В одном из вариантов осуществления изобретения указанное соединение имеет структуру: В одном из вариантов осуществления изобретения указанное соединение имеет структуру: Настоящее изобретение также относится к соединению, имеющему структуру: представляет собой СН 2, О, -СО-, -СO2-, -СН 2 СН 2- или -СНСН-; гдеn равно целому числу от 1 до 6 включительно; каждый из R1 и R2 независимо представляет собой -Н, -F, -Cl, -Br, -I, прямой или разветвленный С 1 С 7 алкил, монофторалкил или полифторалкил, арил или гетероарил; каждый из R3 независимо представляет собой -Н; прямой или разветвленный С 1-С 6 алкил; арил или-8 007387 гетероарил, где указанный арил или гетероарил необязательно замещены одной или несколькими группами, выбранными из -F, -Cl, -Br, -I, -R2, прямого или разветвленного С 1-С 7 алкила, арила, фенокси или гетероарила; и где две группы R3, взятые вместе, могут образовывать С 3-С 6 циклоалкил; или к его фармацевтически приемлемой соли. В одном из вышеуказанных вариантов осуществления изобретения указанное соединение имеет структуру: В одном из вышеуказанных вариантов осуществления изобретения указанное соединение имеет структуру: где R3 представляет собой прямой или разветвленный C1-С 6 алкил или арил, где указанный арил необязательно замещен одной или несколькими группами, выбранными из -F, -Cl, -Br, -I, -R2, прямого или разветвленного С 1-С 7 алкила, арила, фенокси или гетероарила. В другом варианте осуществления изобретения указанное соединение имеет структуру: В другом варианте осуществления изобретения указанное соединение имеет структуру: где каждый из R1 и R2 независимо представляет собой -Н, -F, -Cl, -Br, -I, прямой или разветвленный С 1-С 7 алкил, арил или гетероарил. В одном из вариантов осуществления изобретения указанное соединение имеет структуру: В одном из вариантов осуществления изобретения указанное соединение имеет структуру: В одном из вариантов указанное соединение имеет структуру: В одном из вариантов указанное соединение имеет структуру: В одном из вариантов указанное соединение имеет структуру: В еще одном из вариантов осуществления изобретения указанное соединение имеет структуру: где каждый из R3 независимо представляет собой Н или C1-С 6 алкил с прямой или разветвленной цепью. В одном из вариантов осуществления изобретения указанное соединение имеет структуру: где каждый из R3 независимо представляет собой C1-С 6 алкил с прямой или разветвленной цепью. В одном из вариантов осуществления изобретения указанное соединение имеет структуру: где каждый из R1 представляет собой F, Cl, Br или C1-С 3 алкил, и каждый из R3 независимо представляет собой Н или С 1-С 7 алкил с прямой или разветвленной цепью. В одном из вариантов осуществления изобретения указанное соединение имеет структуру: В другом варианте осуществления изобретения указанное соединение имеет структуру: где две группы R3, взятые вместе, образуют С 3-С 6 циклоалкил. В одном из вариантов осуществления изобретения указанное соединение имеет структуру: где две группы R3, взятые вместе, образуют С 4-С 6 циклоалкил, и каждый из R1 и R2 независимо представляет собой -Н, -F, -Cl, -Br, -I или С 1-С 7 алкил с прямой или разветвленной цепью. В одном из вариантов осуществления изобретения указанное соединение имеет структуру: где R2 представляет собой -Н, -F, -Cl, -Br или -I. В одном из вариантов осуществления изобретения указанное соединение имеет структуру: В одном из вариантов осуществления изобретения указанное соединение имеет структуру: В одном из вариантов осуществления изобретения указанное соединение имеет структуру: где R3 представляет собой прямой или разветвленный C1-С 6 алкил или арил, где указанный арил необязательно замещен одной или несколькими группами, выбранными из -F, -Cl, -Br, -I, -R2, прямого или разветвленного С 1-С 7 алкила, арила, фенокси или гетероарила. В одном варианте изобретения указанное соединение имеет структуру: В одном варианте изобретения указанное соединение имеет структуру: В одном варианте изобретения указанное соединение имеет структуру: где каждый из R1 и R2 независимо представляет собой -Н, -F, -Cl, -Br, -I, прямой или разветвленный С 1-С 7 алкил. В одном из вариантов осуществления изобретения указанное соединение имеет структуру: где каждый из R3 независимо представляет собой -F, -Сl, -Вr, -I, прямой или разветвленный С 1 С 7 алкил. В другом варианте изобретения указанное соединение имеет структуру: В одном из вариантов осуществления изобретения указанное соединение имеет структуру: где R1 представляет собой F, Cl, Br, I или С 1-С 7 алкил с прямой или разветвленной цепью. В одном из вариантов осуществления изобретения указанное соединение имеет структуру: В одном из вариантов осуществления изобретения указанное соединение имеет структуру: Настоящее изобретение также относится к соединению, имеющему структуру: где каждый из R2 представляет собой Н, F, Cl, Br, CN или С 1-С 7 алкил с прямой или разветвленной цепью;X представляет собой СН 2 или О; иn равно целому числу от 1 до 6 включительно. В одном из вариантов осуществления изобретения указанное соединение имеет структуру: где каждый из R2 независимо представляет собой Н, F, Cl или Вг. В одном из вариантов осуществления изобретения указанное соединение имеет структуру: где каждый из R2 независимо представляет собой Н, F, Cl или Br, an равно целому числу от 3 до 6 включительно. В одном из вариантов осуществления изобретения указанное соединение имеет структуру: где каждый из R2 представляет собой F, Cl или Вr. В одном из вариантов осуществления изобретения указанное соединение имеет структуру: В настоящем изобретении описана фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и терапевтически эффективное количество любого из соединений настоящего изобретения. В настоящем изобретении описана фармацевтическая композиция, полученная путем смешивания одного из описанных выше соединений и фармацевтически приемлемого носителя. В настоящем изобретении описан способ получения фармацевтической композиции, предусматривающий смешивание любого из соединений настоящего изобретения и фармацевтически приемлемого носителя. В настоящем изобретении описан способ синтеза любого из соединений настоящего изобретения. В настоящем изобретении описан способ лечения расстройства, опосредуемого МКГ 1-рецептором,у индивидуума, нуждающегося в этом, где указанный способ предусматривает введение указанному индивидууму терапевтически эффективного количества любого из соединений настоящего изобретения или любых фармацевтических композиций настоящего изобретения, содержащих указанное соединение и фармацевтически приемлемый носитель. В одном из вариантов осуществления изобретения терапевтически эффективное количество составляет примерно 0,03-300 мг. В одном из вариантов осуществления изобретения указанным расстройством является депрессия.- 13007387 В одном из таких вариантов указанным расстройством является тревожное состояние. В одном из вариантов осуществления изобретения указанным расстройством является ожирение. В одном из вариантов осуществления изобретения указанным расстройством является недержание мочи. В одном из вариантов своего осуществления настоящее изобретение относится к способу лечения индивидуума, страдающего расстройством, выбранным из депрессии, тревожного состояния, ожирения или недержания мочи, где указанный способ предусматривает введение индивидууму, нуждающемуся в этом, терапевтически эффективного количества соединения настоящего изобретения. В одном из вариантов настоящего изобретения указанное терапевтически эффективное количество составляет примерно от 0,03 до 300 мг. В другом варианте осуществления изобретения указанным расстройством является депрессия. В одном из вариантов осуществления изобретения указанным расстройством является тревожное состояние. В одном из вариантов осуществления изобретения указанным расстройством является ожирение. В одном из таких вариантов указанным расстройством является недержание мочи. Используемый в описании настоящего изобретения термин "гетероарил" означает пяти- и шестичленные ненасыщенные кольца, которые могут содержать один или несколько атомов кислорода, серы или азота. Примерами гетероарильных групп являются, но не ограничиваются ими, карбазол, фуранил,тиенил, пирролил, оксазолил, тиазолил, имидазолил, пиразолил, изоксазолил, изотиазолил, оксадиазолил,триазолил, тиадиазолил, пиридил, пиридазинил, пиримидинил, пиразинил и триазинил. Кроме того, используемый здесь термин "гетероарил" означает конденсированные бициклические системы, которые могут содержать один или несколько гетероатомов, таких как кислород, сера и азот. Примерами таких гетероарильных групп являются, но не ограничиваются ими, индолизинил, индолил,изоиндолил, бензо[b]фуранил, бензо[b]тиофенил, индазолил, бензимидазолил, пуринил, бензоксазолил,бензизоксазолил, бензо[b]тиазолил, имидазо[2,1-b]тиазолил, циннолинил, хиназолинил, хиноксалинил,1,8-нафтиридинил, птеридинил, хинолинил, изохинолинил, фталимидил и 2,1,3-бензотиазолил. Термин "гетероарил" также включает вышеперечисленные химические группы, которые могут быть замещены одной или несколькими группами, выбранными из -F, -Cl, -Br, -I, CN, -NO2, прямого или разветвленного С 1-С 7 алкила, прямого или разветвленного С 1-С 7 монофторалкила, прямого или разветвленного С 1-С 7 полифторалкила, прямого или разветвленного С 2-С 7 алкенила, прямого или разветвленного С 2-С 7 алкинила, С 3-С 7 циклоалкила, С 3-С 7 монофторциклоалкила, С 3-С 7 полифторциклоалкила и С 5-С 7 циклоалкенила. Термин "гетероарил", кроме того, включает N-оксиды вышеперечисленных химических групп, которые имеют по крайней мере один атом азота. В описании настоящего изобретения термин "арил" означает фенил или нафтил. В дополнительном варианте настоящего изобретения указанное соединение представляет собой чистый энантиомер или диастереомер. В другом варианте указанное соединение представляет собой чистый энантиомер или диастереомер. В одном из вариантов осуществления изобретения указанным соединением является (+)энантиомер. В одном из вариантов осуществления изобретения указанным соединением является (-)энантиомер. Настоящее изобретение относится к каждому чистому стереоизомеру любого из описанных здесь соединений. Такими стереоизомерами могут быть энантиомеры, диастереомеры или Е- или Z-алкеновые или иминовые изомеры. Настоящее изобретение также относится к стереоизомерным смесям, включая рацемические смеси, диастереомерные смеси или E/Z-изомерные смеси. Стереоизомеры могут быть синтезированы в чистой форме (Nogradi, М.; Stereoselective Synthesis, (1987) VCH Editor Ebel, H. and Assymmetric Synthesis, Volumes 3 В 5, (1983) Academic Press, Editor Morrison, J.), либо они могут быть выделены различными методами, такими как кристаллизация и хроматография (Jaques, J. Collet, A.; Wilen S.Enantiomer, Racemates and Resolutions, 1981, John Wiley and Sons and Asymmetric Synthesis, Vol. 2, 1983,Academic Press, Editor Morrison, J.). Кроме того, соединения настоящего изобретения могут присутствовать в виде энантиомеров, диастереомеров и изомеров, либо два или более таких соединений могут присутствовать в виде рацемической или диастереомерной смеси. Соединения настоящего изобретения предпочтительно имеют 80%-ную чистоту, более предпочтительно 90%-ную чистоту, а наиболее предпочтительно 95%-ную чистоту. Настоящее изобретение также включает фармацевтически приемлемые соли и комплексы всех описанных здесь соединений. Кислотами и основаниями, из которых могут быть получены такие соли, являются все перечисленные ниже кислоты и основания без ограничений. Кислотами являются, но не ограничиваются ими, следующие неорганические кислоты: хлористоводородная кислота, бромистоводородная кислота, иодистоводородная кислота, серная кислота и борная кислота. Такими кислотами также являются, но не ограничиваются- 14007387 ими, следующие органические кислоты: уксусная кислота, малоновая кислота, янтарная кислота, фумаровая кислота, винная кислота, малеиновая кислота, лимонная кислота, метансульфоновая кислота, бензойная кислота, гликолевая кислота, молочная кислота и миндальная кислота. Основаниями являются, но не ограничиваются ими, аммиак, метиламин, этиламин, пропиламин, диметиламин, диэтиламин, триметиламин, триэтиламин, этилендиамин, гидроксиэтиламин, морфолин, пиперазин и гуанидин. Настоящее изобретение также относится к гидратам и к полиморфам всех указанных здесь соединений. В объем настоящего изобретения входят также пролекарства соединений настоящего изобретения. В общих чертах, такие пролекарства представляют собой функциональные производные соединений настоящего изобретения, которые могут быть легко превращены in vivo в нужное соединение. Таким образом, используемый в настоящем изобретении термин "введение" включает также лечение различных описанных здесь состояний с использованием конкретно описанного здесь соединения, либо соединения,которое не было конкретно описано, но которое может превращаться в данное конкретное соединение invivo после его введения пациенту. Стандартные процедуры отбора и получения подходящих производных пролекарств описаны, например, в работе Design of Prodrugs, ed. H. Bundgaard, Elsevier, 1985. Настоящее изобретение, кроме того, относится к метаболитам соединений настоящего изобретения. Метаболитами являются активные молекулы, продуцируемые после введения соединений настоящего изобретения в биологическую среду. В настоящем изобретении описана фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и терапевтически эффективное количество любого из соединений настоящего изобретения. В настоящем изобретении описана фармацевтическая композиция, полученная путем смешивания любого из вышеописанных соединений и фармацевтически приемлемого носителя. В настоящем изобретении также описан способ получения фармацевтической композиции, предусматривающий смешивание любого из соединений настоящего изобретения с фармацевтически приемлемым носителем. Твердым носителем может быть одно или несколько веществ, которые действуют как эндогенные носители (например, питательные вещества или микроэлементы), ароматизаторы, смазывающие агенты,солюбилизаторы, суспендирующие агенты, наполнители, агенты, увеличивающие скольжение, технологические добавки для улучшения процесса прессования; связующие агенты или агенты, дезинтегрирующие таблетки; причем, такими агентами могут быть также инкапсулирующие вещества. В порошках указанный носитель является тонкодисперсным твердым веществом, которое представляет собой смесь с тонкодисперсным активным ингредиентом. В таблетках, активный ингредиент смешивают с носителем,обладающим необходимыми компрессионными свойствами, в подходящих соотношениях, и формуют в продукт нужной формы и нужного размера. Порошки и таблетки предпочтительно содержат до 99% активного ингредиента. Подходящими твердыми носителями являются, например, фосфат кальция, стеарат магния, тальк, сахара, лактоза, декстрин, крахмал, желатин, целлюлоза, поливинилпирролидин, низкоплавкие воски и ионообменные смолы. Жидкие носители используются при получении растворов, суспензий, эмульсий, сиропов, эликсиров и композиций, находящихся под давлением. Активный ингредиент может быть растворен или суспендирован в фармацевтически приемлемом жидком носителе, таком как вода, органический растворитель, а также их смесь или смесь фармацевтически приемлемых масел или жиров. Жидкий носитель может содержать другие подходящие фармацевтические добавки, такие как солюбилизаторы, эмульгаторы,буферы, консерванты, подсластители, ароматизаторы, суспендирующие агенты, загустители, красители,регуляторы вязкости, стабилизаторы или регуляторы осмотического давления. Подходящими примерами жидких носителей для перорального и парентерального введения являются вода (частично содержащая добавки, описанные выше, например, производные целлюлозы, а предпочтительно, раствор натрийкарбоксиметилцеллюлозы), спирты гликоли) и их производные, и масла (например, кокосовое масло и арахисовое масло). Для парентерального введения, носитель может также представлять собой эфир жирной кислоты, такой как этилолеат или изопропилмиристат. Стерильные жидкие носители могут быть использованы в стерильных жидких композициях для парентерального введения. Жидким носителем для композиций, находящихся под давлением, может быть галогенированный углеводород или другой фармацевтически приемлемый пропеллент. Жидкие фармацевтические композиции, которые представляют собой стерильные растворы или суспензии, могут быть использованы, например, для внутримышечного, интраректального, эпидурального, внутрибрюшинного или подкожного введения. Стерильные растворы могут быть также введены внутривенно. Такие соединения могут быть получены в виде стерильной твердой композиции, которая,перед ее введением, может быть растворена или суспендирована в стерильной воде, физиологическом растворе или в другой подходящей стерильной среде для инъекций. При необходимости могут быть использованы носители, и такими носителями являются инертные связующие агенты, суспендирующие агенты, замасливатели, ароматизаторы, подсластители, консерванты, красители и агенты для нанесения покрытий. Такое соединение может быть введено перорально в форме стерильного раствора или суспензии, содержащей другие растворенные вещества или суспендирующие агенты (например, физиологиче- 15007387 ский раствор или глюкозу в количестве, достаточном для придания раствору изотоничности), соли желчных кислот, аравийскую камедь, желатин, сорбитан моноолеат, полисорбат 80 (эфиры олеиновой кислоты и сорбита и сополимеры их ангидридов с этиленоксидом) и т.п. Указанное соединение может быть введено перорально в виде жидкой или твердой композиции. Композициями, подходящими для перорального введения, являются твердые формы, такие как пилюли,капсулы, гранулы, таблетки и порошки, и жидкие формы, такие как растворы, сиропы, эликсиры и суспензии. Формами, подходящими для парентерального введения, являются стерильные растворы, эмульсии и суспензии. Оптимальные дозы для введения могут быть самостоятельно определены специалистом и будут варьироваться в зависимости от конкретно используемого соединения, концентрации препарата, способа введения и степени прогрессирования патологического состояния. Эти дозы должны быть скорректированы в зависимости от других факторов, таких как возраст, вес, пол и режим питания конкретного индивидуума, подвергаемого лечению, а также от времени введения лекарственного препарата. В настоящем изобретении описан способ синтеза любого из соединений настоящего изобретения. В настоящем изобретении описан способ лечения расстройства, опосредованного МКГ 1 рецептором, у индивидуума, нуждающегося в этом, где указанный способ предусматривает введение указанному индивидууму терапевтически эффективного количества, по крайней мере, одного из соединений или одной из фармацевтических композиций настоящего изобретения, содержащих указанное соединение и фармацевтически приемлемого носителя. В одном из вариантов осуществления изобретения терапевтически эффективное количество составляет примерно от 0,03 до 300 мг. В одном из вариантов осуществления изобретения указанным расстройством является депрессия. В одном из вариантов осуществления изобретения указанным расстройством является тревожное состояние. В одном из вариантов осуществления изобретения указанным расстройством является ожирение. В одном из вариантов осуществления изобретения указанным расстройством является недержание мочи. В одном из своих вариантов настоящее изобретение относится к способу лечения индивидуума,страдающего расстройством, выбранным из депрессии, тревожного состояния, ожирения или недержания мочи, где указанный способ предусматривает введение указанному индивидууму терапевтически эффективного количества соединения настоящего изобретения. В одном из вариантов осуществления изобретения терапевтически эффективное количество составляет примерно 0,03- 300 мг. В другом варианте осуществления изобретения указанным расстройством является депрессия. В одном из вариантов осуществления изобретения, указанным расстройством является тревожное состояние. В одном из вариантов осуществления изобретения указанным расстройством является ожирение. В одном из вариантов осуществления изобретения указанным расстройством является недержание мочи. Используемый здесь термин "терапевтически эффективное количество" означает любое количество соединения, которое, при его введении индивидууму, страдающему заболеванием, против которого данное соединение является эффективным, приводит к ослаблению, ремиссии или обратному развитию данного заболевания. Термин "индивидуум" означает позвоночное животное, млекопитающее или человек. Настоящее изобретение относится к способу лечения индивидуума, страдающего патологией, где указанная патология может быть ослаблена путем снижения активности МКГ 1-рецептора, и где указанный способ предусматривает введение указанному индивидууму соединения настоящего изобретения,представляющие собой антагонист МКГ 1-рецептора, в количестве, эффективном для лечения указанной патологии у данного индивидуума. В отдельных вариантах осуществления изобретения, указанной патологией является нарушение регуляции стероидного или гипофизарного гормона, нарушение высвобождения эпинефрина, желудочнокишечное расстройство, сердечно-сосудистое расстройство, нарушение электролитного баланса, гипертензия, диабет, респираторные заболевания, астма, нарушение репродуктивной функции, иммунное расстройство, эндокринное расстройство, скелетно-мышечное расстройство, нейроэндокринное расстройство, нарушение познавательных функций, расстройство памяти, такое как болезнь Альцгеймера, сенсорно-модуляторное расстройство и расстройство трансмиссии, нарушения координации движений, сенсорно-интегративное расстройство, двигательно-интегративное расстройство, нарушение допаминергической функции, такое как болезнь Паркинсона, сенсорно-трансмиссивное расстройство, нарушение обоняния, расстройство симпатической иннервации, аффективное расстройство, такое как депрессия и тревожное состояние; расстройство, вызванное стрессом; нарушение жидкостного балланса; эпилептический припадок; боли; психотическое поведение, такое как шизофрения; толерантность к морфину; наркотическая зависимость; мигрень; или расстройство мочеиспускания, такое как недержание мочи. В предпочтительном варианте осуществления изобретения настоящее изобретение относится к спо- 16007387 собу лечения следующих заболеваний: депрессии, тревожного состояния, нарушения питания/нарушения регуляции массы тела и расстройства мочеиспускания. Примерами расстройств нарушения питания/нарушения регуляции массы тела являются ожирение, булимия или нервно-психическая булимия. Примерами расстройств мочеиспускания являются, но не ограничиваются ими, непроизвольное мочеиспускание, гиперактивность мочевого пузыря, недержание мочи, учащенное мочеиспускание, частые позывы на мочеиспускание, ночная полиурия или энурез. Гиперактивность мочевого пузыря и частые позывы на мочеиспускание может быть связано или не связано с доброкачественной гиперплазией простаты. Настоящее изобретение относится к способу модификации пищевого поведения индивидуума, предусматривающему введение указанному индивидууму соединения настоящего изобретения в количестве,эффективном для регуляции потребления пищи указанным индивидуумом. Настоящее изобретение также относится к способу лечения нарушения питания у индивидуума,предусматривающему введение индивидууму соединения настоящего изобретения в количестве, эффективном для снижения потребления пищи указанным индивидуумом. В одном из вариантов осуществления изобретения, таким нарушением питания является булимия, ожирение или нервно-психическая булимия. В одном из вариантов осуществления изобретения, указанным индивидуумом является позвоночное осуществления изобретения, указанное соединение вводят вместе с пищей. Настоящее изобретение, кроме того, относится к способу снижения массы тела у индивидуума,предусматривающему введение указанному индивидууму соединения настоящего изобретения в количестве, эффективном для снижения массы тела данного индивидуума. Настоящее изобретение также относится к способу лечения индивидуума, страдающего депрессией,где указанный способ предусматривает введение указанному индивидууму соединения настоящего изобретения в количестве, эффективном для лечения депрессии у данного индивидуума. Настоящее изобретение, кроме того, относится к способу лечения индивидуума, страдающего тревожным состоянием, где указанный способ предусматривает введение указанному индивидууму соединения настоящего изобретения в количестве, эффективном для лечения тревожного состояния у данного индивидуума. Настоящее изобретение также относится к способу лечения индивидуума, страдающего депрессией и тревожным состоянием, где указанный способ предусматривает введение указанному индивидууму соединения настоящего изобретения в количестве, эффективном для лечения депрессии и тревожного состояния у данного индивидуума. Настоящее изобретение также относится к способу лечения индивидуума, страдающего депрессивным расстройством, дистимией, биполярными расстройствами I и II, шизоаффективным расстройством,расстройством познавательной функции с подавленным настроением, расстройством личности, бессонницей, гиперсомнией, нарколепсией, нарушением суточного ритма сна, ночными кошмарами, кошмарными сновидениями, сомнамбулизмом, навязчивым состоянием, панической атакой с агорафобией или без агорафобии, посттравматическим стрессом, тревожным состоянием, ассоциированным с социальными неврозами, социальной фобией и генерализованным тревожным состоянием. Настоящее изобретение также относится к способу лечения индивидуума, страдающего расстройством мочеиспускания, где указанный способ предусматривает введение указанному индивидууму соединения настоящего изобретения в количестве, эффективном для лечения расстройства мочеиспускания у данного индивидуума. В некоторых вариантах осуществления изобретения, таким расстройством мочеиспускания является непроизвольное мочеиспускание, гиперактивность мочевого пузыря, недержание мочи, учащенное мочеиспускание, частые позывы на мочеиспускание, ночная полиурия или энурез. Для лучшего понимания настоящего изобретения, ниже описаны примеры экспериментов. Однако для каждого специалиста очевидно, что конкретно обсуждаемые способы и результаты приводятся лишь для иллюстрации настоящего изобретения, более полное описание которого приводится в формуле изобретения. Экспериментальная частьI. Примеры методов синтеза. Общие методы. Все реакции (за исключением многочисленных реакций параллельного синтеза) были проведены в атмосфере аргона, а реагенты, используемые в чистом виде или в соответствующих растворителях, были внесены в реакционный сосуд шприцем или с помощью канюли. Множество реакций параллельного синтеза осуществляли в сосудах (не в инертной атмосфере) с использованием снабженных нагревателем шейкеров J-KEM (Saint Louis, МО). Безводные растворители закупали у AldrichChemical Company и использовали в том виде, в котором они были получены. Описанным здесь соединениям давали названия с помощью программы Nomenclator (ChemInnovation Software, Inc. San Diego, CA). 1H-ЯМР-спектр регистрировали при 400 МГц на спектрометре Brker Avance с использованием тетраметилсилана в качестве внутреннего стандарта. Спектральные линии обозначали следующим образом: с = синглет, д = дублет; т = триплет; кв = квартет, квинтет; секстет; септет; шир. = широкий; м = мультиплет. Элементный анализ осуществляли в лаборатории Robertson Microlit, Laboratories Inc. Масс-спектры получали на спектрометрах Platform II (Fisons) или Quattro Micro (Micromass) с ионизацией электрораспылением (ESMS) и регистрировали МН+. Тонкослойную хроматографию (ТСХ) осуществляли на стеклян- 17007387 ных пластинах, предварительно покрытых силикагелем 60 F254 (0,25 мм, ЕМ Separations Tech.). Препаративную тонкослойную хроматографию осуществляли на стеклянных пластинах, предварительно покрытых силикагелем GF (2 мм, Analtech). Колоночную флеш-хроматографию осуществляли на силикагелеMerck 60 (230-400 меш). Микроволновые реакции осуществляли в микроволновом устройстве Smithcreator, Personal Chemistry Inc. Общие процедуры синтеза Примеры, описанные в экспериментальной части, приводятся лишь в целях иллюстрации способов синтеза соединений настоящего изобретения, то есть, антагонистов МКГ-1. Другие соединения настоящего изобретения могут быть получены в соответствии с общими процедурами синтеза, описанными в настоящем изобретении, или методами, в которые могут быть внесены изменения, очевидные для каждого специалиста. Схема Е 2,2-бис(4-Фторфенил)-N-(3-(спиро[инден-1,4'-пиперидин]-10-ил)пропил)ацетамид. Раствор 3-(спиро[инден-1,4'-пиперидин]-10-ил)пропиламина (0,190 ммоль, 46,0 мг), 2,2-бис(4-фторфенил)уксусной кислоты (0,290 ммоль, 72,0 мг), гидрохлорида 1-[3-(диметиламино)пропил]-3-этилкарбодиимида (0,380 ммоль, 334 мг) и 4-диметиламинопиридина (каталитическое количество) в ДМФ/ СН 2 С 12 (1:10, 5,0 мл) перемешивали в течение 24 ч при температуре 23 С. Растворитель удаляли в вакууме и неочищенный продукт хроматографировали (двуокись кремния, дихлорметан:метанол, 20:1) с получением конечного продукта (23,6 мг, 26,3%). 1 Н ЯМР (400 МГц, CDCl3)7,35-7,10 (м, 9 Н), 7,05-6,97(м, 4 Н), 6,79 (д, 1 Н, J=5,6 Гц), 6,75 (д, 1 Н, J=5,6 Гц), 4,83 (с, 1 Н), 3,43 (дд, 2 Н, J=6,0, 11,6 Гц), 2,98-2,90 (м,2 Н) , 2,53 (т, 2 Н, J=6,6 Гц), 2,29 (т, 2 Н, J=12,2 Гц), 2,10-1,96 (м, 2 Н), 1,80-1,70 (м, 2 Н), 1,34 (д, 2 Н, J=13,2 Гц); ESMS m/e 473,3 (М+Н)+. Библиотеку конструировали в полипропиленовых реакционных блоках Robbins "Reactor Blocks", в 48-луночных планшетах. В каждом планшете набор из 6 аминов (0,100 моль) и 8 карбоновых кислот(1,05 ммоль) с ПС-карбодиимидной смолой (2,0 ммоль) и ДМФ:ДХМ (1:10, 3,00 мл) смешивали в течение ночи при 23 С с получением 48 соединений/планшет. За ходом реакций строго следили с помощью ТСХ до полного израсходования исходного материала. Растворитель фильтровали и смолу промывали метанолом и дихлорметаном (х 3) поочередно каждым из растворителей (по 10 мин, каждым). После последней фильтрации, к смоле добавляли 2,0 М аммиак в метаноле (2,0 мл в каждую лунку), и реакционные блоки вращали в течение 2 ч с высвобождением нужных соединений из смолы. Конечные соединения фильтровали в "блоки-сборники" Robbins, растворитель удаляли и соединения анализировали с помощью ЯМР и ESMS.N-[3-(1-оксоспиро[1,3-гидроизобензофуран-3,4'-пиперидин]-10-ил)пропил]-2,2-дифенилацетамид. Раствор 10-(3-аминопропил)спиро[3-гидроизобензофуран-3,4'-пиперидин]-1-она (37,0 мг, 0,100 ммоль),2,2-дифенилацетилхлорида (23,0 мг, 0,100 ммоль) и диизопропилэтиламина (0,200 ммоль, 20,2 мг) в СН 2 Сl2 (или ТГФ или ТГФ/СН 2 Сl2, 2,0 мл) перемешивали в течение 24 ч при 23 С. Растворитель удаляли в вакууме и неочищенный продукт хроматографировали (двуокись кремния, дихлорметан:метанол, 20:1) с получением конечного продукта (20,3 мг, 41,0%). 1 Н ЯМР (400 МГц, CDCl3)7,94 (д, 1 Н, J=7,6 Гц),7,83-7,69 (м, 1 Н), 7,69-7,55 (м, 3 Н), 7,49-7,37 (м, 4 Н), 7,37-7,26 (м, 4 Н, 7,26-7,16 (м, 2 Н), 5,20 (с, 1 Н), 3,573,42 (м, 2 Н), 3,41-3,25 (м, 2 Н), 3,17-2,98 (м, 4 Н), 2,98-2,81 (м, 2 Н), 2,26-2,02 (м, 2 Н), 1,80-1,61 (м, 2 Н);ESMS m/e: 455,3 (М+Н)+. Метод "захвата" и высвобождения для синтеза и очистки библиотеки спироциклических пиперидинов Коммерчески доступную ионообменную смолу Amberlyst 15 (Aldrich) активировали в соответствии с нижеследующей процедурой: 1. Смолу встряхивали в метаноле в течение 24 ч. 2. Смолу фильтровали и промывали метанолом в воронке с фриттой. 3. Смолу нейтрализовали 2,0 М NH3 в МеОН (рН контролировали) и встряхивали в течение 1 часа. 4. Нейтрализованную смолу подкисляли 3,0 М НСl в МеОН (рН контролировали) и встряхивали в течение 1 ч. 5. Смолу переносили на воронку с фриттой и промывали МеОН. 6. Смолу сушили в вакууме и оставляли на хранение. Синтез (Ацилирование аминов). Библиотеку конструировали в полипропиленовых "реакционных блоках" Robbins, в 48-луночных планшетах. В каждом планшете, набор из 6 аминов (0,100 моль) и 8 электрофилов (хлорангидридов 1,50 экв.) в присутствии триэтиламина (2,00 экв.) в ТГФ:ДХМ 3:1 (2,00 мл) смешивали в течение ночи при 23 С с получением 48 соединений/планшет. За ходом реакций тщательно следили с помощью ТСХ до полного израсходования исходного амина в результате проведения очистки кислотной смолой Amberlyst 15. После исчезновения исходного амина, нужные продукты захватывали, а затем выделяли описанным ниже спосоом. Очистка спироциклических пиперидиновых продуктов В каждую лунку добавляли активированную ионообменную смолу Amberlyst 15 (0,90 г, Aldrich) и планшеты встряхивали в течение 2 ч в ротационной печи Robbins для захвата нужного конечного продукта из реакционной смеси. Растворитель фильтровали и смолу промывали метанолом и дихлорметаном(х 3), поочередно каждым из растворителей (10 мин - каждым). После последней фильтрации, к смоле добавляли 2,0 М аммиак в метаноле (2,0 мл в каждую лунку) и реакционные блоки встряхивали в течение 2 ч для выделения нужных соединений из указанной смолы. Конечные соединения фильтровали в Общая процедура в схеме G Библиотеку конструировали в полипропиленовых "реакционных блоках" Robbins, в 48-луночных планшетах. В каждом планшете набор из 6 аминов (0,100 ммоль) и 8 изоцианатов (1,05 ммоль) в присутствии триэтиламиновой смолы (2,00 ммоль) и ТГФ:ДХМ (1:1, 3,00 мл) смешивали в течение ночи при 23 С с получением 48 соединений/планшет. За ходом реакций тщательно следили с помощью ТСХ до полного израсходования исходного соединения. Очистка спироциклических пиперидиновых продуктов В каждую лунку добавляли активированную ионообменную смолу Amberlyst 15 (0,90 г, Aldrich) и планшеты встряхивали в течение 2 ч в ротационной печи Robbins для захвата нужного конечного продукта из реакционной смеси. Растворитель фильтровали и смолу промывали метанолом и дихлорметаном(х 3), поочередно каждым из растворителей (10 мин - каждым). После последней фильтрации к смоле добавляли 2,0 М аммиак в метаноле (2,0 мл в каждую лунку) и реакционные блоки встряхивали в течение 2 ч для выделения нужных соединений из указанной смолы. Конечные соединения фильтровали в "блокисборники" Robbins, растворитель удаляли и соединения анализировали с помощью ЯМР и ESMS. Процедура H1: Смесь спироциклического пиперидина (1,00 экв., 0,0226 ммоль), N-(бромалкил)- 20007387 фталимида (1,50 экв., 0,0338 ммоль), Bu4NI (200 мг) и диизопропилэтиламина (5,00 экв., 0,113 ммоль) в диоксане (200 мл) нагревали при 95 С в течение 24 ч. ТСХ-анализ (двуокись кремния, дихлорметан:метанол, 95:5) указывал на присутствие некоторого количества спироциклического пиперидина. В каждую реакционную смесь добавляли еще 0,0113 ммоль соответствующих бромалкилфталимидов и эту смесь продолжали нагревать в течение еще 48 ч. Реакционную смесь охлаждали до комнатной температуры, аммониевые соли отфильтровывали и растворитель удаляли при пониженном давлении. Неочищенный продукт хроматографировали [3% NH3 (2,0 М в метаноле) в CH2Cl2] с получением нужного продукта.N-(3-бромпропил)-2,2-дифенилацетамид. Смесь 2,2-дифенилацетилхлорида (6,00 г, 26,0 ммоль), гидробромида 3-бром-1-аминопропана (5,69 г, 26,0 ммоль) и триэтиламина (10,9 мл, 78,0 ммоль) в дихлорметане (100 мл) перемешивали при 25 С в течение 24 ч. К реакционной смеси добавляли воду (100 мл) и водный слой экстрагировали дихлорметаном (3 х 100 мл). Объединенные органические экстракты промывали насыщенным раствором соли, сушили над MgSO4 и концентрировали при пониженном давлении. Неочищенный продукт хроматографировали (гексан:ЕtОАc, 2:1) и получали нужный продукт (6,67 г, 77,5%). 1 Н ЯМР (400 МГц, CDCl3)7,307,17 (м, 10 Н), 6,64-6,55 (м, 1 Н), 4,86 (с, 1 Н), 3,29-3,19 (м, 4 Н), 1,95-1,85 (м, 2 Н); ESMS m/e: 332,21(М+Н)+. Общая процедура синтеза замещенного спиро[1,3-дигидроизобензофуран-1,4'-пиперидина](схема К): Замещенный фенил-N-бензамид Смесь 1 эквивалента замещенной бензойной кислоты, 3 эквивалентов тионилхлорида и 5% ДМФ в дихлорметане (1 М) нагревали с обратным холодильником в течение 1 ч и растворители удаляли в вакууме. Затем добавляли сухой толуол и растворитель удаляли в вакууме. Полученный хлорангидрид растворяли в сухом ТГФ. В реакционную смесь добавляли анилин (1,1 эквивалента) и триэтиламин (2 эквивалента) при 0-5 С и смесь перемешивали в течение еще одного часа при 0 С. Растворитель удаляли в вакууме и неочищенный продукт хроматографировали (двуокись кремния, EtOAc-гексан) с получением нужного замещенного фенил-N-бензамида. Замещенный 10-бензилспиро[3-гидроизобензофуран-3,4'- пиперидин]-1-он: Раствор замещенного фенил-N-бензамида в сухом ТГФ охлаждали до -10 С и в течение 2 ч добавляли 2 эквивалента n-BuLi (1,6 М) в гексане. Реакционную смесь перемешивали в течение 30 мин и в течение 15 мин добавляли 1-бензил-4-пиперидон (1,1 эквивалента). Реакционную смесь перемешивали при комнатной температуре в течение еще 45 мин. Реакционную смесь выливали в насыщенный NH4Cl, экстрагировали эфиром (х 3) и объединенные эфирные экстракты промывали насыщенным раствором соли, а затем экстрагировали 2 н. раствором НСl. Объединенные HCl-экстракты охлаждали и получали нужную HCl-соль амина. Свободное основание выделяли добавлением NH4OH, а затем его экстрагировали этилацетатом (х 3). Объединенные этилацетатные экстракты промывали насыщенным раствором соли, сушили (MgSO4) и растворитель удаляли в вакууме с получением нужного замещенного 10-бензилспиро[3-гидроизобензофуран-3,4'-пиперидин]-1 она. Замещенный 1-бензил-4-(2-гидроксиметилфенил)пиперидин-4-ол Смесь 1 эквивалента замещенного 10-бензилспиро[3-гидроизобензофуран-3,4'-пиперидин]-1-она и 1,3 эквивалентов LAH в ТГФ (1 М) нагревали с обратным холодильником в течение одного часа. Затем избыток LAH гасили путем последовательного добавления одного массового эквивалента воды, одного массового эквивалента 2 н. раствора NaOH и 3 массовых эквивалентов воды, как описано FieserFieser(Reagents for Organic Synthesis, Vol. 1). Реакционную смесь фильтровали и осадок на фильтре промывали этилацетатом. Объединенные органические экстракты сушили (MgSO4) и растворитель удаляли в вакууме с получением нужного замещенного 1-бензил-4-(2-гидроксиметилфенил)пиперидин-4-ола. 10-Бензилспиро[1,3-дигидроизобензофуран-1,4'-пиперидин] Смесь замещенного 1-бензил-4-(2-гидроксиметилфенил)-пиперидин-4-ола (1 эквивалент) и триэтиламина (2,5 эквивалентов) в смеси ТГФ-толуол обрабатывали метансульфонилхлоридом (1,2 эквивалента) при комнатной температуре (экзотермическая реакция с повышением температуры примерно до 35 С). Реакционную смесь перемешивали в течение 1 ч, выливали в воду, отделяли и водный слой экстрагировали этилацетатом. Объединенные органические экстракты промывали насыщенным раствором соли, сушили (MgSO4) и растворитель удаляли в вакууме. Неочищенный продукт хроматографировали(двуокись кремния, этилацетат-гексан) и получали нужный защищенный бензилом спироциклический пиперидин. Замещенный 2,2,2-трихлорэтил-спиро[1,3-дигидроизобензофуран-1,4'-пиперидин]-10-карбоксилат К раствору бензиламина в дихлорэтане добавляли 2,2,2-трихлорэтилхлорформиат (3 эквивалента) и полученную смесь нагревали с обратным холодильником в течение 1 ч. Растворитель удаляли в вакууме,к реакционной смеси добавляли воду и смесь экстрагировали этилацетатом (х 3). Объединенные этилацетатные экстракты промывали насыщенным раствором соли, сушили (MgSO4) и растворитель удаляли в вакууме. Неочищенный продукт хроматографировали (двуокись кремния, этилацетат-гексан) с получением нужного карбамата. Замещенный спиро[1,3-дигидроизобензофуран-1,4'-пиперидин](0,071 моль) в 400 мл уксусной кислоты нагревали до 40 С и в течение одного часа добавляли цинковый порошок. Полученную смесь нагревали при 40 С в течение ночи, охлаждали до комнатной температуры,фильтровали, охлаждали в ледяной бане и нейтрализовали добавлением NH4OH. Полученную смесь экстрагировали этилацетатом (х 3), объединенные этилацетатные экстракты промывали насыщенным раствором соли, сушили (MgSO4) и растворитель удаляли в вакууме. Неочи- 22007387 щенный продукт хроматографировали (двуокись кремния, этилацетат-гексан) с получением нужного спироциклического пиперидина. Гидрохлориды получали добавлением НСl в эфире (1 н.) к свободному основанию в этилацетате. 4,5,6-трифторспиро[1,3-дигидроизобензофуран-3,4'-пиперидин]:(м, 2 Н), 1,96-1,88 (м, 2 Н). Синтез и анализ конкретных соединений Пример 1. 2-(4-(Спиро[инден-1,4'-пиперидин]-10-ил)бутил)бензо[c]азолин-1,3-дион. Соединения примера 1 получали из спиро[инден-1,4'-пиперидина] и 2-(4-бромбутилбензо[с]азолин)-1,3-диона в соответствии с процедурами, описанными в схеме Н. 1 Н ЯМР (400 МГц, CDCl3)7,877,77 (м, 2 Н), 7,73-7,65 (м, 2 Н), 7,41-7,26 (м, 2 Н), 7,25-7,14 (м, 2 Н), 6,83 (д, 1 Н, J=5,8 Гц), 6,73 (д, 1 Н, J=5,8 Гц), 3,74 (т, 2 Н, J=6,8 Гц), 3,01 (д, 2 Н, J=11,6 Гц), 2,58-2,47 (м, 2 Н), 2,34 (т, 2 Н, J=11,8 Гц), 2,20 (т, 2 Н,J=12,6 Гц), 1,83-1,71 (м, 2 Н), 1,69-1,57 (м, 2 Н), 1,34 (д, 2 Н, J=12,8 Гц); ESMS m/е: 387,2 (М+Н)+. Пример 2. (4-Фенил)фенил)-N-(6-(спиро[индан-1,4'-пиперидин]-10-ил)гексил)карбоксамид. Соединение примера 2 получали из 6-(спиро[индан-1,4'-пиперидин]-10-ил)гексиламина и 4 фенилбензоилхлорида в соответствии с процедурами, описанными в схеме F: ESMS m/e: 467,2 (М+Н)+. Пример 3. 2,2-Дифенил-N-(5-(спиро[индан-1,4'-пиперидин]-10-ил)пентил)ацетамид. Соединение примера 3 получали из (5-(спиро[индан-1,4'-пиперидин]-10-ил)пентил)амина и 2,2 дифенилацетилхлорида в соответствии с процедурами, описанными в схеме F: ESMS m/e: 467,2 (М+Н)+. Пример 4. 2,2-Дифенил-N[- (4- (спиро [индан-1, 4' -пиперидин] -10-ил) бутил)ацетамид.
МПК / Метки
МПК: A61K 31/438, C07D 221/20, C07D 491/10
Метки: пиперидины, антагонистов, применения, качестве, мкг1, спироциклические, используемые
Код ссылки
<a href="https://eas.patents.su/30-7387-spirociklicheskie-piperidiny-ispolzuemye-v-kachestve-antagonistov-mkg1-i-ih-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Спироциклические пиперидины, используемые в качестве антагонистов мкг1 , и их применения</a>
Предыдущий патент: Гербицидные смеси с синергическим действием
Следующий патент: Модифицированные антитела и способы применения
Случайный патент: Изготовление материала на основе карбоната кальция и/или карбоната магния, имеющего пониженную тенденцию к декрепитации












