Производные хромана , полезные в качестве антагонистов кислотной помпы
Номер патента: 11512
Опубликовано: 28.04.2009
Авторы: Ямагиши Тацуйя, Джинно Мадока, Шимокава Хирохиса
Формула / Реферат
1. Соединение формулы (I)
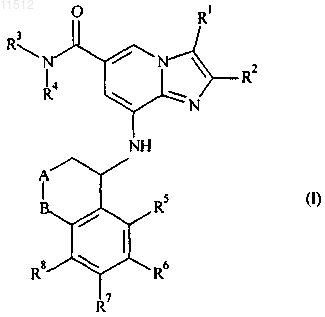
или его фармацевтически приемлемая соль, где
-А-В- представляет собой -О-СН2-, -S-CH2-, -СН2-О- или -CH2-S-;
R1 представляет собой C1-C6алкильную группу, незамещенную или замещенную 1-2 заместителями, независимо выбранными из группы, состоящей из гидроксильной группы, группировки, превращаемой in vivo в гидроксильную группу, и C1-C6алкоксигруппы;
R2 представляет собой C1-C6алкильную группу;
R3 представляет собой C1-C6алкильную группу, C3-С7циклоалкильную группу или C3-С7циклоалкилC1-C6алкильную группу;
R4 представляет собой C1-C6алкильную группу, незамещенную или замещенную 1-3 заместителями, независимо выбранными из группы, состоящей из атома галогена, гидроксильной группы, группировки, превращаемой in vivo в гидроксильную группу, и C1-C6алкоксигруппы; и
R5, R6, R7 и R8 независимо представляют собой атом водорода, атом галогена или C1-C6алкильную группу.
2. Соединение или фармацевтически приемлемая соль по п.1, где
-А-В- представляет собой -О-CH2- или -CH2-О-;
R1, R2 и R3 независимо представляют собой C1-C6алкильную группу;
R4 представляет собой C1-C6алкильную группу, незамещенную или замещенную 1 заместителем, выбранным из группы, состоящей из гидроксильной группы и C1-C6алкоксигруппы;
R5 представляет собой атом водорода, атом фтора или C1-C6алкильную группу;
R7 представляет собой атом водорода, атом галогена или C1-C6алкильную группу и
R6 и R8 независимо представляют собой атом водорода, атом галогена или C1-C6алкильную группу.
3. Соединение или фармацевтически приемлемая соль по п.1, где
-А-В- представляет собой -CH2-О-;
каждый из R1, R2 и R3 представляет собой метильную группу;
R4 представляет собой C1-C2алкильную группу, незамещенную или замещенную гидроксильной группой;
R5 и R7 независимо представляют собой атом водорода или метильную группу и
каждый из R6 и R8 представляет собой атом водорода.
4. Соединение по п.1, выбранное из
(-)-8-(3,4-дигидро-2H-хромен-4-иламино)-N,N,2,3-тетраметилимидазо[1,2-а]пиридин-6-карбоксамида;
(+)-8-(3,4-дигидро-2H-хромен-4-иламино)-N,N,2,3-тетраметилимидазо[1,2-а]пиридин-6-карбоксамида;
(+)-8-(3,4-дигидро-2H-хромен-4-иламино)-N-(2-гидроксиэтил)-N,2,3-триметилимидазо[1,2-а]пиридин-6-карбоксамида;
(+)-N-(2-гидроксиэтил)-N,2,3-триметил-8-[(5-метил-3,4-дигидро-2H-хромен-4-ил)амино]имидазо
[1,2-а]пиридин-6-карбоксамида;
(-)-8-[(7-фтор-3,4-дигидро-2H-хромен-4-ил)амино]-N,N,2,3-тетраметилимидазо[1,2-а]пиридин-6-карбоксамида;
(-)-8-[(7-фтор-3,4-дигидро-2H-хромен-4-ил)амино]-N-(2-гидроксиэтил)-N,2,3-триметилимидазо[1,2-а]пиридин-6-карбоксамида;
(+)-8-[(7-фтор-3,4-дигидро-2H-хромен-4-ил)амино]-N-(2-гидроксиэтил)-N,2,3-триметилимидазо[1,2-а]пиридин-6-карбоксамида;
(-)-8-[(5,7-дифтор-3,4-дигидро-2H-хромен-4-ил)амино]-N,N,2,3-тетраметилимидазо[1,2-а]пиридин-6-карбоксамида;
(+)-8-[(5,7-дифтор-3,4-дигидро-2H-хромен-4-ил)амино]-N,N,2,3-тетраметилимидазо[1,2-а]пиридин-6-карбоксамида;
(+)-8-[(5,7-дифтор-3,4-дигидро-2H-хромен-4-ил)амино]-N-(2-гидроксиэтил)-N,2,3-триметилимидазо
[1,2-а]пиридин-6-карбоксамида;
(-)-8-[(5-фтор-3,4-дигидро-2H-хромен-4-ил)амино]-N,N,2,3-тетраметилимидазо[1,2-а]пиридин-6-карбоксамида;
(+)-8-[(5-фтор-3,4-дигидро-2H-хромен-4-ил)амино]-N,N,2,3-тетраметилимидазо[1,2-a]пиридин-6-карбоксамида;
(-)-8-[(5-фтор-3,4-дигидро-2H-хромен-4-ил)амино]-N-(2-гидроксиэтил)-N,2,3-триметилимидазо[1,2-а]пиридин-6-карбоксамида;
(+)-8-[(5-фтор-3,4-дигидро-2H-хромен-4-ил)амино]-N-(2-гидроксиэтил)-N,2,3-триметилимидазо[1,2-а]пиридин-6-карбоксамида;
(-)-8-[(6-фтор-3,4-дигидро-2H-хромен-4-ил)амино]-N,N,2,3-тетраметилимидазо[1,2-а]пиридин-6-карбоксамида;
(+)-8-[(6-фтор-3,4-дигидро-2H-хромен-4-ил)амино]-N-(2-гидроксиэтил)-N,2,3-триметилимидазо[1,2-a]пиридин-6-карбоксамида;
(-)-8-[(8-фтор-3,4-дигидро-2H-хромен-4-ил)амино]-N,N,2,3-тетраметилимидазо[1,2-а]пиридин-6-карбоксамида;
(+)-8-[(8-фтор-3,4-дигидро-2H-хромен-4-ил)амино]-N,N,2,3-тетраметилимидазо[1,2-а]пиридин-6-карбоксамида;
(-)-N-(2-гидроксиэтил)-N,2,3-триметил-8-[(7-метил-3,4-дигидро-2H-хромен-4-ил)амино]имидазо
[1,2-а]пиридин-6-карбоксамида;
(+)-N-(2-гидроксиэтил)-N,2,3-триметил-8-[(7-метил-3,4-дигидро-2H-хромен-4-ил)амино]имидазо
[1,2-а]пиридин-6-карбоксамида;
(-)-N,N,2,3-тетраметил-8-[(5-метил-3,4-дигидро-2H-хромен-4-ил)амино]имидазо[1,2-а]пиридин-6-карбоксамида и
(+)-N,N,2,3-тетраметил-8-[(5-метил-3,4-дигидро-2H-хромен-4-ил)амино]имидазо[1,2-а]пиридин-6-карбоксамида
или их фармацевтически приемлемых солей.
5. Фармацевтическая композиция, содержащая соединение или его фармацевтически приемлемую соль по любому из пп.1-4 и фармацевтически приемлемый носитель.
6. Фармацевтическая композиция по п.5, дополнительно содержащая другой(ие) фармакологически активный(е) агент(ы).
7. Способ лечения состояния, опосредованного ингибиторной активностью в отношении кислотной помпы, у субъекта-млекопитающего, включая человека, включающий введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединения или его фармацевтически приемлемой соли по любому из пп.1-4.
8. Способ по п.7, где указанное состояние представляет собой заболевание желудочно-кишечного тракта, гастроэзофагеальную болезнь, гастроэзофагеальную рефлюксную болезнь (GERD), пептическую язву, язву желудка, язву двенадцатиперстной кишки, язвы, вызванные приемом нестероидных противовоспалительных лекарственных средств (NSAID), гастрит, инфекцию Helicobacter pylori, диспепсию, функциональную диспепсию, синдром Золлингера-Эллисона, неэрозивную рефлюксную болезнь (NERD), висцеральную боль, изжогу, тошноту, эзофагит, дисфагию, гиперсаливацию, расстройства дыхательных путей или астму.
9. Применение соединения формулы (I) или его фармацевтически приемлемой соли по любому из пп.1-4 для изготовления лекарственного средства для лечения состояния, опосредованного ингибиторной активностью в отношении кислотной помпы.
10. Применение по п.9, где указанное состояние представляет собой заболевание желудочно-кишечного тракта, гастроэзофагеальную болезнь, гастроэзофагеальную рефлюксную болезнь (GERD), пептическую язву, язву желудка, язву двенадцатиперстной кишки, язвы, вызванные приемом нестероидных противовоспалительных лекарственных средств (NSAID), гастрит, инфекцию Helicobacter pylori, диспепсию, функциональную диспепсию, синдром Золлингера-Эллисона, неэрозивную рефлюксную болезнь (NERD), висцеральную боль, изжогу, тошноту, эзофагит, дисфагию, гиперсаливацию, расстройства дыхательных путей или астму.
Текст
011512 Предшествующий уровень техники Данное изобретение относится к производным хромана. Эти соединения обладают селективной ингибиторной активностью в отношении кислотной помпы. Настоящее изобретение также относится к фармацевтической композиции, способу лечения и применению, включающему вышеуказанные производные для лечения болезненных состояний, опосредованных модулирующей активностью в отношении кислотной помпы; в частности ингибиторной активностью в отношении кислотной помпы. Было четко установлено, что ингибиторы протонной помпы (PPI) представляют собой пролекарства, претерпевающие катализируемую кислотой химическую перегруппировку, которая позволяет им ингибировать Н+/K+-АТФазу путем ковалентного связывания с ее цистеиновыми остатками (Sachs, G. et. al.,Digestive Diseases and Sciences, 1995, 40, 3S-23S; Sachs et. al., Annu. Rev. Pharmacol. Toxicol., 1995, 35,277-305). Однако, в отличие от PPI, антагонисты кислотной помпы ингибируют секрецию кислоты путем обратимого калий-конкурентного ингибирования H+/K+-АТФазы. SCH28080 является одним из таких обратимых ингибиторов и интенсивно исследуется. Другие более новые агенты (ревапразан, сорапразан,AZD-0865 и CS-526) испытываются в клинических исследованиях, подтверждающих их эффективность у человека (Pope, A.; Parsons, M., Trends in Pharmacological Sciences, 1993, 14, 323-5; Vakil, N., AlimentaryPharmacology and Therapeutics, 2004, 19, 1041-1049). В общем, обнаружено, что антагонисты кислотной помпы полезны для лечения различных заболеваний, включая желудочно-кишечное заболевание, гастроэзофагеальную болезнь, гастроэзофагеальную рефлюксную болезнь (GERD), пептическую язву, язву желудка, язву двенадцатиперстной кишки, язвы, вызванные приемом нестероидных противовоспалительных лекарственных средств (NSAID), гастрит, инфекцию Helicobacter pylori, диспепсию, функциональную диспепсию, синдром Золлингера-Эллисона, неэрозивную рефлюксную болезнь (NERD), висцеральную боль, изжогу, тошноту, эзофагит, дисфагию, гиперсаливацию, расстройства дыхательных путей или астму (далее называемые как "заболевания АРА", Kiljander, Toni О., American Journal of Medicine, 2003,115 (Suppl. 3A), 65S-71S). В WO 99/55706 и WO 04/046144 раскрыты соединения, о которых сообщается, что они представляют собой антагонисты кислотной помпы. Они относятся к соединениям, имеющим имидазо[1,2-а]пиридиновую структуру. Существует необходимость в предложении новых антагонистов кислотной помпы, являющихся хорошими кандидатами в лекарственные средства и направленных на неудовлетворенные PPI потребности в лечении заболеваний. В частности, предпочтительные соединения должны эффективно связываться с кислотной помпой, в то же время демонстрировать низкую аффинность в отношении других рецепторов и демонстрировать функциональную активность в качестве ингибиторов секреции кислоты в желудке. Они должны хорошо абсорбироваться из желудочно-кишечного тракта, быть метаболически стабильными и обладать благоприятными фармакокинетическими свойствами. Они должны быть нетоксичными. Кроме того, идеальный кандидат в лекарственное средство будет существовать в физической форме, которая является стабильной, негигроскопичной и легко изготавливаемой. Краткое изложение сущности изобретения В данном изобретении было обнаружено, что новый класс соединений, имеющих хромановую группировку, демонстрирует ингибиторную активность в отношении кислотной помпы и благоприятные свойства в качестве кандидата в лекарственные средства и, таким образом, полезен для лечения болезненных состояний, опосредованных ингибиторной активностью в отношении кислотной помпы, таких как заболевания АРА. В настоящем изобретении предложено соединение следующей формулы (I) или его фармацевтически приемлемая соль, гдеR1 представляет собой C1-C6 алкильную группу, незамещенную или замещенную 1-2 заместителями,независимо выбранными из группы, состоящей из гидроксильной группы, группировки, превращаемой inR3 представляет собой C1-C6 алкильную группу, C3-С 7 циклоалкильную группу или C3-С 7 циклоалкилС 1-C6 алкильную группу;R4 представляет собой C1-C6 алкильную группу, незамещенную или замещенную 1-3 заместителями,-1 011512 независимо выбранными из группы, состоящей из атома галогена, гидроксильной группы, группировки,превращаемой in vivo в гидроксильную группу, и C1-C6 алкоксигруппы; иR5, R6, R7 и R8 независимо представляют собой атом водорода, атом галогена или C1-C6 алкильную группу. Также в настоящем изобретении предложена фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль, как они описаны в данном описании изобретения, вместе с фармацевтически приемлемым носителем указанного соединения. Также в настоящем изобретении предложена фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль, как они описаны в данном описании изобретения, дополнительно содержащая другой(ие) фармакологически активный(е) агент(ы). Также в настоящем изобретении предложен способ лечения состояния, опосредованного модулирующей активностью в отношении кислотной помпы, у млекопитающего субъекта, включающий введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, как они описаны в данном описании изобретения. Примеры состояний, опосредованных модулирующей активностью в отношении кислотной помпы,включают заболевания АРА, но не ограничены ими. Кроме того, в настоящем изобретении предложено применение соединения формулы (I) или его фармацевтически приемлемой соли, как они описаны в данном описании изобретения, для изготовления лекарственного средства для лечения состояния, опосредованного ингибиторной активностью в отношении кислотной помпы. Предпочтительно в настоящем изобретении также предложено применение соединения формулы (I) или его фармацевтически приемлемой соли, как они описаны в данном описании изобретения, для изготовления лекарственного средства для лечения заболеваний, выбранных из заболеваний АРА. Соединения по настоящему изобретению могут демонстрировать хорошую ингибиторную активность в отношении кислотной помпы, меньшую токсичность, хорошую абсорбцию, хорошее распределение, хорошую растворимость, меньшую аффинность связывания с белками, отличающимися от кислотной помпы, меньшее межлекарственное взаимодействие и хорошую метаболическую стабильность. Некоторые стереоизомеры по настоящему изобретению могут демонстрировать более хорошие свойства в отношении фототоксичности. Подробное описание изобретения В соединениях по настоящему изобретению: когда R1, R2, R3, R4, R5, R6, R7 и R8 представляют собой C1-C6 алкильную группу, эта C1-C6 алкильная группа может представлять собой прямую или разветвленную группу, имеющую от 1 до 6 атомов, и примеры такой группы включают метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил и третбутил, пентил, 1-этилпропил и гексил, но не ограничиваются ими. Из них предпочтительным является С 1-С 4 алкил; более предпочтительным является С 1-С 2 алкил; метил является предпочтительным для R1, R2,R3, R5, R6, R7 и R8; метил и этил предпочтительны для R4; когда R3 представляет собой C3-С 7 циклоалкильную группу, он представляет собой циклоалкильную группу, имеющую от 3 до 7 атомов, и примеры включают циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Из них предпочтительной является C3-C5 циклоалкильная группа; более предпочтительным является циклопропил; когда R3 представляет собой C3-С 7 циклоалкилС 1-C6 алкильную группу, он представляет собой указанную С 1-C6 алкильную группу, замещенную указанной C3-С 7 циклоалкильной группой, и примеры включают циклопропилметил, циклопропилэтил, циклопропилпропил, циклопропилбутил, циклопропилпентил, циклопропилгексил, циклобутилметил, циклобутилэтил, циклопентилметил, циклогексилметил и циклогептилметил, но не ограничиваются ими. Из них предпочтительной является C3-С 5 циклоалкилС 1 С 4 алкильная группа; предпочтительной является C3-С 5 циклоалкилC1-С 2 алкильная группа; более предпочтителен циклопропилметил; когда заместители R1 и R4 представляют собой С 1-C6 алкоксигруппу, они представляют собой атом кислорода, замещенный указанной С 1-C6 алкильной группой, и примеры включают метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси и трет-бутокси, пентилокси и гексилокси, но не ограничиваются ими. Из них предпочтительным является С 1-С 4 алкилокси; предпочтителен C1-C2 алкилокси; более предпочтителен метокси; когда R5, R6, R7 и R8 представляют собой атом галогена, они могут представлять собой атом фтора,хлора, брома или йода. Из них предпочтительны атом фтора и атом хлора; когда указывается "группировка, превращаемая in vivo в гидроксигруппу", это означает группировку, трансформируемую in vivo, например путем гидролиза и/или при помощи фермента, например эстеразы, в гидроксильную группу. Примеры группировки включают простые и сложные эфирные группы,которые могут легко гидролизоваться in vivo, но не ограничиваются ими. Такие группировки известны специалистам в данной области техники как "прогруппировки", как описано, например, в "Design of-О- или -S-. Термины "лечить" и "лечение" при использовании здесь относятся к куративному, паллиативному и профилактическому лечению, включающему реверсирование, облегчение, ингибирование развития или профилактику расстройства или состояния, к которому этот термин применяется, или одного или более чем одного симптома такого расстройства или состояния. Предпочтительным классом соединений по настоящему изобретению являются соединения формулы (I) или их фармацевтически приемлемая соль, как они описаны в данном описании изобретения, где:(г) R1 представляет собой метильную группу;(е) R представляет собой метильную группу;(и) R3 представляет собой метильную группу;(к) R4 представляет собой С 1-С 4 алкильную группу, незамещенную или замещенную 1 заместителем,выбранным из группы, состоящей из гидроксильной группы и С 1-С 4 алкоксигруппы;(л) R4 представляет собой C1-C2 алкильную группу, незамещенную или замещенную 1 заместителем,выбранным из группы, состоящей из гидроксильной группы и С 1-С 4 алкоксигруппы;(м) R4 представляет собой C1-C2 алкильную группу, незамещенную или замещенную гидроксильной группой;(н) R4 представляет собой метильную группу, этильную группу или 2-гидроксиэтильную группу;(о) R5, R6, R7 и R8 независимо представляют собой атом водорода, атом водорода или С 1-С 2 алкильную группу;(п) R5, R6, R7 и R8 независимо представляют собой атом водорода, атом фтора, атом хлора или метильную группу;(р) R5, R6, R7 и R8 независимо представляют собой атом водорода или метильную группу;(с) R5 представляет собой атом водорода, атом фтора или метильную группу;(т) R6 представляет собой атом водорода;(у) R7 представляет собой атом водорода или атом фтора и(ф) R8 представляет собой атом водорода. Из этих классов соединений любая комбинация (а)-(ф) также является предпочтительной. Предпочтительными соединениями по настоящему изобретению являются те соединения формулы(I) или их фармацевтически приемлемая соль, описанные в данном описании изобретения, где:(А) -А-В- представляет собой -O-CH2-, -S-CH2-, -CH2-O- или -CH2-S-; R1 представляет собой C1-С 4 алкильную группу, незамещенную или замещенную 1-2 заместителями, независимо выбранными из группы, состоящей из гидроксильной группы и С 1-С 4 алкоксигруппы; R2 представляет собой С 1-С 4 алкильную группу; R3 представляет собой C1-C4 алкильную группу, C3-С 7 циклоалкильную группу или C3-С 7 циклоалкилC1-C4 алкильную группу; R4 представляет собой С 1-С 4 алкильную группу, незамещенную или замещенную 1-3 заместителями, независимо выбранными из группы, состоящей из атома галогена, гидроксильной группы и С 1-С 4 алкоксигруппы; и R5, R6, R7 и R8 независимо представляют собой атом водорода, атом галогена или C1-C6 алкильную группу;(Б) -А-В- представляет собой -O-СН 2- или -CH2-O-; R1, R2 и R3 независимо представляют собой С 1 С 4 алкильную группу; R4 представляет собой С 1-С 4 алкильную группу, незамещенную или замещенную 1 заместителем, выбранным из группы, состоящей из гидроксильной группы и С 1-С 4 алкоксигруппы; R5 иR7 независимо представляют собой атом водорода, атом галогена или С 1-С 4 алкильную группу; и каждый из R6 и R8 представляет собой атом водорода;(В) -А-В- представляет собой -O-СН 2- или -CH2-O-; R1, R2 и R3 независимо представляют собой С 1 С 2 алкильную группу; R4 представляет собой С 1-С 2 алкильную группу, незамещенную или замещенную гидроксигруппой; R5 и R7 независимо представляют собой атом водорода или С 1-С 2 алкильную группу; и каждый из R6 и R8 представляет собой атом водорода;(Г) -А-В- представляет собой -О-CH2- или -СН 2-О-; R1 представляет собой C1-С 4 алкильную группу,незамещенную или замещенную 1-2 заместителями, независимо выбранными из группы, состоящей из гидроксильной группы и С 1-С 4 алкоксигруппы; R2 представляет собой С 1-С 4 алкильную группу; R3 представляет собой С 1-С 4 алкильную группу, C3-С 7 циклоалкильную группу или C3-С 7 циклоалкилС 1-С 4 алкильную группу; R4 представляет собой С 1-С 4 алкильную группу, незамещенную или замещенную 1-3 заместителями, независимо выбранными из группы, состоящей из атома галогена, гидроксильной группы и С 1 С 4 алкоксигруппы; R5 и R7 независимо представляют собой атом водорода, атома галогена или C1-C4 алкильную группу; и каждый из R6 и R8 представляет собой атом водорода;(Д) -А-В- представляет собой -O-CH2-, -S-CH2-, -CH2-O- или -CH2-S-; R1 и R2 независимо представляют собой С 1-С 4 алкильную группу; R3 представляет собой С 1-С 4 алкильную группу, C3-С 7 циклоалкильную группу или C3-С 7 циклоалкилС 1-С 4 алкильную группу; R4 представляет собой С 1-С 4 алкильную группу, незамещенную или замещенную 1-3 заместителями, независимо выбранными из группы, состоящей из атома галогена, гидроксильной группы и С 1-С 4 алкоксигруппы; R5 и R7 независимо представляют собой атом водорода, атом галогена или С 1-С 4 алкильную группу; и каждый из R6 и R8 представляет собой атом водорода;(Е) -А-В- представляет собой -O-CH2-, -S-CH2-, -СН 2-О- или -CH2-S-; каждый из R1 и R2 представляет собой метильную группу; R3 представляет собой C1-С 4 алкильную группу, C3-С 7 циклоалкильную группу или C3-С 7 циклоалкилС 1-С 4 алкильную группу; R4 представляет собой С 1-С 4 алкильную группу, незамещенную или замещенную 1-3 заместителями, независимо выбранными из группы, состоящей из атома галогена, гидроксильной группы и С 1-С 4 алкоксигруппы; R5 и R7 независимо представляют собой атом водорода, атом галогена или C1-C4 алкильную группу; и каждый из R6 и R8 представляет собой атом водорода;(Ж) -А-В- представляет собой -О-CH2-, -S-CH2-, -CH2-О- или -CH2-S-; каждый из R1 и R2 представляет собой метильную группу; R3 представляет собой C1-С 4 алкильную группу, C3-С 7 циклоалкильную группу или C3-С 7 циклоалкилС 1-С 4 алкильную группу; R4 представляет собой C1-C4 алкильную группу, незамещенную или замещенную 1-3 заместителями, независимо выбранными из группы, состоящей из атома галогена, гидроксильной группы и С 1-С 4 алкоксигруппы; R5 и R7 независимо представляют собой атом водорода, атом галогена или C1-C2 алкильную группу; и каждый из R6 и R8 представляет собой атом водорода;(З) -А-В- представляет собой -О-CH2-, -S-CH2-, -СН 2-O- или -CH2-S-; каждый из R1 и R2 представляет собой метильную группу; R3 представляет собой С 1-С 4 алкильную группу; R4 представляет собой С 1-С 4 алкильную группу, незамещенную или замещенную 1 заместителем, выбранным из группы, состоящей из гидроксильной группы и C1-C4 алкоксигруппы; R5 и R7 независимо представляют собой атом водорода,атом галогена или метильную группу; и каждый из R6 и R8 представляет собой атом водорода;(И) -А-В- представляет собой -О-CH2-, -S-CH2-, -CH2-О- или -CH2-S-; каждый из R1 и R2 представляет собой метильную группу; R3 представляет собой C1-C2 алкильную группу; R4 представляет собой C1-C2 алкильную группу, незамещенную или замещенную гидроксигруппой; R5 и R7 независимо представляют собой атом водорода или метильную группу; и каждый из R6 и R8 представляет собой атом водорода;(К) -А-В- представляет собой -О-CH2- или -CH2-О-; R1, R2 и R3 независимо представляют собой C1C4 алкильную группу; R4 представляет собой С 1-С 4 алкильную группу, незамещенную или замещенную 1 заместителем, выбранным из группы, состоящей из гидроксильной группы и С 1-С 4 алкоксигруппы; и R5,R6, R7 и R8 независимо представляют собой атом водорода, атома галогена или С 1-С 4 алкильную группу;(Л) -А-В- представляет собой -СН 2-О-; R1, R2 и R3 независимо представляют собой метильную группу; R4 представляет собой C1-C2 алкильную группу, незамещенную или замещенную гидроксигруппой; R5 и R7 независимо представляют собой атом водорода или метильную группу; и каждый из R6 и R8 представляет собой атом водорода;(М) -А-В- представляет собой -О-СН 2- или -СН 2-О-; R1, R2 и R3 независимо представляют собой C1C6 алкильную группу; R4 представляет собой C1-C6 алкильную группу, незамещенную или замещенную 1 заместителем, выбранным из группы, состоящей из гидроксильной группы и C1-C6 алкоксигруппы; R5 представляет собой атом водорода, атом фтора или C1-C6 алкильную группу; R7 представляет собой атом водорода, атома галогена или C1-C6 алкильную группу; R6 и R8 независимо представляют собой атом водорода, атом галогена или C1-C6 алкильную группу;(Н) А-В- представляет собой -О-CH2- или -СН 2-О-; R1, R2 и R3 независимо представляют собой C1C6 алкильную группу; R4 представляет собой C1-C6 алкильную группу, незамещенную или замещенную 1 заместителем, выбранным из группы, состоящей из гидроксильной группы и C1-C6 алкоксигруппы; R5 представляет собой атом водорода, атом фтора или C1-C6 алкильную группу; R7 представляет собой атом водорода или атом галогена; и R6 и R8 независимо представляют собой атом водорода, атом галогена илиC1-C6 алкильную группу. Соединения формулы (I), содержащие 1 или более чем 1 асимметрический атом углерода, могут существовать в виде двух или более стереоизомеров. В объем настоящего изобретения включены все стереоизомеры и геометрические изомеры соединений формулы (I), включая соединения, демонстрирующие более чем один тип изомерии, и смеси одного или более этих соединений. Также включены соли присоединения кислоты, в которых противоион является оптически активным, например D-лактат, или L-лизин, или рацемат, DL-тартрат или DL-аргинин. В одном из воплощений изобретения предложено соединение, выбранное из группы, состоящей из(+)-N,N,2,3-тетраметил-8-[(5-метил-3,4-дигидро-2H-хромен-4-ил)амино]имидазо[1,2-а]пиридин-6 карбоксамида или их фармацевтически приемлемых солей. Предпочтительные стереоизомеры соединений формулы (I) представляют собой форму R в отношении хирального центра, где атом углерода на хромановом кольце связывается с атомом азота. Фармацевтически приемлемые соли соединения формулы (I) включают их соли присоединения кислоты (включая двойные соли). Подходящие соли присоединения кислоты образованы из кислот, образующих нетоксичные соли. Примеры включают соли ацетат, адипат, аспартат, бензоат, безилат, бикарбонат/карбонат, бисульфат/сульфат,борат, камзилат, цитрат, цикламат, эдизилат, эзилат, формиат, фумарат, глюцептат, глюконат, глюкуронат,гексафторфосфат, гибензат, гидрохлорид/хлорид, гидробромид/бромид, гидройодид/йодид, изетионат,лактат, малат, малеат, малонат, мезилат, метилсульфат, нафтилат, 2-напсилат, никотинат, нитрат, оротат,оксалат, пальмитат, памоат, фосфат/гидрофосфат/дигидрофосфат, пироглутамат, сахарат, стеарат, сукцинат,таннат, тартрат, тозилат, трифторацетат и ксинофоат. Обзор подходящих солей см. в "Handbook of Pharmaceutical Salts: Properties, Selection, and Use" byStahl and Wermuth (Wiley-VCH, Weinheim, Germany, 2002). Фармацевтически приемлемая соль соединения формулы (I) может быть легко получена путем смешивания растворов соединения формулы (I) и желаемой кислоты или основания, как это целесообразно. Соль можно осадить из раствора и собрать путем фильтрации, или она может быть выделена путем выпаривания растворителя. Степень ионизации соли может варьироваться от полностью ионизированной до почти неионизированной. Фармацевтически приемлемые соли соединений по изобретению включают несольватированные и сольватированные формы. Термин "сольват" используется здесь для описания молекулярного комплекса, включающего соединение по изобретению и 1 или более чем 1 фармацевтически приемлемую молекулу растворителя, например этанола. Термин "гидрат" используют, когда указанный растворитель представляет собой воду. Фармацевтически приемлемые сольваты по изобретению включают гидраты и сольваты, где кристаллизационный растворитель может быть изотопно замещен, например D2O, d6-ацетон, d6-DMSO (d6-диметилсульфоксид). В объем изобретения включены комплексы, такие как клатраты, комплексы включения лекарствохозяин, где, в отличие от вышеупомянутых сольватов, лекарство и хозяин присутствуют в стехиометрических или нестехиометрических количествах. Также включены комплексы лекарственного средства,содержащие два или более органических и/или неорганических компонента, которые могут присутство-5 011512 вать в стехиометрических или нестехиометрических количествах. Получающиеся в результате комплексы могут быть ионизированы, частично ионизированы или неионизированы. Обзор таких комплексов см. в J. Pharm. Sci., 64 (8), 1269-1288 by Haleblian (August 1975). Соединения формулы (I) могут существовать в одной или более кристаллических формах. Эти полиморфы, включая их смеси, также включены в объем настоящего изобретения. Настоящее изобретение включает все фармацевтически приемлемые меченные изотопами соединения формулы (I), где 1 или более чем 1 атом замещен атомами, имеющими такой же атомное число, но атомную массу или массовое число, отличающиеся от атомной массы или массового числа, обычно обнаруживаемых в природе. Примеры изотопов, подходящих для включения в соединения по изобретению, включают изотопы водорода,такие как 2 Н и 3 Н, углерода, такие как 11 С, 13 С и 14 С, хлора, такие как 36Cl, фтора, такие как 18F, йода, такие как 123I и 125I, азота, такие как 13N и 15N, кислорода, такие как 15 О, 17 О и 18 О, фосфора, такие как 32 Р, и серы, такие как 35S. Некоторые меченные изотопами соединения формулы (I), например соединения, включающие радиоактивный изотоп, полезны в исследованиях распределения лекарственного средства и/или субстрата в тканях. Радиоактивные изотопы трития, т.е. 3 Н, и углерода-14, т.е. 14 С, особенно полезны для этой цели ввиду легкости их включения и готовых способов обнаружения. Замещение более тяжелыми изотопами, такими как дейтерий, т.е. 2 Н, может обеспечить некоторые терапевтические преимущества, вытекающие из большей метаболической стабильности, например увеличенного периода полураспада in vivo или уменьшенных требований по дозе, и, следовательно, в некоторых случаях может быть предпочтительным. Замещение позитрон-излучающими изотопами, такими как 11 С, 18F, 15 О и 13N, может быть полезным в исследованиях посредством позитрон-эмиссионной томографии (PET) для оценки занятости рецептора субстратом. Изотопномеченые соединения формулы (I), в общем случае, могут быть получены обычными способами, известными специалистам в данной области техники, или способами, аналогичными способам,описанным в сопутствующих примерах и получениях с использованием соответствующих изотопномеченых реагентов вместо немеченого реагента, используемого ранее. Все соединения формулы (I) могут быть получены способами, описанными в общих способах,представленных ниже, или при помощи конкретных способов, описанных в разделе Примеры и в разделе Получение, или при помощи их стандартных модификаций. Настоящее изобретение также охватывает любой один или более чем один из этих способов получения соединений формулы (I), дополнительно к любым новым промежуточным соединениям, используемым в этих способах. Общий синтез Соединения по настоящему изобретению могут быть получены различными способами, хорошо известными для получения соединений этого типа, например, как показано в нижеследующем способе А. Если не указано иное, Rl, R2, R3, R4, R5, R6, R7, R8, А и В в следующих способах являются такими,как определено выше. Все исходные вещества в следующем общем способе синтеза могут иметься в продаже или могут быть получены при помощи обычных способов, известных специалистам в данной области техники, таких как описанные в WO 99/55706 и WO 02/20523, описания которых включены в данное описание изобретения посредством ссылки. 1. Способ А. Иллюстрирует получение соединений формулы (I). Реакционная схема А-6 011512 На реакционной схеме A Ra представляет собой защитную группу для карбокси; R1a представляет собой R1, как он определен выше, или R1, где гидроксильная группа защищена защитной группой для гидрокси; и X представляет собой уходящую группу. Термин "защитная группа для карбокси" при использовании здесь означает защитную группу, которую можно отщеплять различными способами с получением карбоксигруппы, такую как, например, C1C6 алкильная группа, галогеноC1-C6 алкильная группа или арилC1-C6 алкильная группа. Из них предпочтительными являются C1-C6 алкильная группа и арилC1-C6 алкильная группа. Термин "защитные группы для гидроксила" при использовании здесь означает защитную группу,которую можно отщеплять различными способами с получением гидроксильной группы, такими как гидрогенолиз, гидролиз, электролиз или фотолиз, и такие защитные группы для гидроксила описаны вProtective Groups in Organic Synthesis edited by T.W. Greene et al. (John WileySons, 1999), такие как,например, C1-С 4 алкоксикарбонильная, C1-C4 алкилкарбонильная, три-С 1-С 4 алкилсилильная или три-C1C4 алкиларилсилильная группы и С 1-С 4 алкоксиС 1-С 4 алкильные группы. Подходящие защитные группы для гидроксила включают ацетил и трет-бутилдиметилсилил. Термин "уходящая группа" при использовании здесь означает группу, которая может быть замещена нуклеофильными группами, такими как гидроксильные группы, амины или карбоанионы, и примеры таких уходящих групп включают атомы галогена, алкилсульфонильную группу и фенилсульфонильную группу. Из них предпочтительными являются атом брома, хлора, метилсульфонильная группа, трифторметилсульфонильная группа и 4-метилфенилсульфонильная группа. Стадия А 1. На этой стадии соединение формулы (IV) получают путем нуклеофильного замещения соединения формулы (III), которое имеется в продаже или может быть получено способом, описанным в WO 00/078751,соединением формулы (II), которое имеется в продаже или может быть получено способами, описанными в WO 99/55706 и WO 02/020523. Данную реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует конкретного ограничения природы используемого растворителя, при условии, что он не оказывает неблагоприятного воздействия на данную реакцию или участвующие реагенты и что он может растворять реагенты, по меньшей мере, до некоторой степени. Примеры подходящих растворителей включают простые эфиры, такие как тетрагидрофуран (THF), этиленгликоля диметиловый эфир и диоксан; амиды, такие какN,N-диметилформамид (DMF), N,N-диметилацетамид (DMA) и N-метил-2-пирролидинон (NMP); нитрилы,такие как ацетонитрил; и кетоны, такие как ацетон; спирты, такие как 2-метил-2-пропанол, 1-бутанол, 1-пропанол, 2-пропанол, этанол и метанол; и сульфоксид, такой как диметилсульфоксид (DMSO). Из этих растворителей предпочтительными являются амиды, кетоны и спирты. Более предпочтительным является ацетон. Данная реакция может быть осуществлена с использованием основания или без него. По-видимому,не существует конкретного ограничения природы используемых оснований, и любое основание, обычно используемое в реакциях данного типа, в равной степени может быть использовано здесь. Примеры таких оснований включают алкилаты щелочных металлов, такие как метилат натрия, этилат натрия и третбутилат калия; карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия, карбонат цезия и карбонат калия; гидрокарбонаты щелочных металлов, такие как гидрокарбонат натрия и гидрокарбонат калия; и органические амины, такие как триэтиламин, трипропиламин, трибутиламин, дициклогексиламин,N,N-диизопропилэтиламин, N-метилпиперидин, N-метилморфолин, 1,8-диазабицикло[5,4,0]ундец-7-ен(DBU) и 1,5-диазабицикло[4,3,0]нон-5-ен (DBN). Из них предпочтительным является карбонат калия. Реакция может быть осуществлена с йодидом и без него. Примеры таких йодидов включают йодид натрия, йодид калия и йодид цезия. Из них предпочтительными являются йодид натрия и йодид калия. Данная реакция может протекать в широком диапазоне температур, и точная температура реакционной смеси не является критичной для изобретения. Предпочтительная температура реакции зависит от таких факторов, как природа растворителя и исходных веществ. Однако в общем случае реакцию удобно проводить при температуре от приблизительно 0 до приблизительно 250 С. Время, требующееся для реакции, также может широко варьироваться в зависимости от множества факторов, а именно температуры реакции и природы используемых исходных веществ и растворителя. Однако, при условии, что реакция осуществляется в предпочтительных условиях, изложенных выше, обычно достаточным является период от приблизительно 5 мин до приблизительно 72 ч. Стадия А 2. На этой стадии целевое соединение формулы (I) получают путем гидролиза (А 2 а 1) соединения формулы (IV), полученного, как описано на стадии А 1, с последующей реакцией конденсации (А 2 а 2) с соединением формулы (IV) или реакцией замещения (А 2b) соединения формулы (IV) соединением формулы (V). Гидролиз (А 2 а 1). Реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует конкретного ограничения природы используемого растворителя, при условии, что он не оказывает неблагоприятного действия на реакцию или участвующие реагенты и что он может растворять реагенты, по меньшей мере, до некоторой степени. Примеры подходящих растворителей включают простой эфир,такой как тетрагидрофуран и диоксан; амиды, такие как N-диметилформамид; спирты, такие как этанол и-7 011512 метанол; и воду. Из этих растворителей предпочтительными являются метанол, тетрагидрофуран и вода. Реакция может быть осуществлена в присутствии основания. По-видимому, не существует конкретного ограничения природы используемых оснований, и любое основание, обычно используемое в реакциях данного типа, в равной степени может быть использовано здесь. Примеры таких оснований включают гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия. Из них предпочтительным является гидроксид натрия. Реакция может протекать в широком диапазоне температур, и точная температура реакции не является критичной для изобретения. Предпочтительная температура реакции зависит от таких факторов, как природа растворителя и исходных веществ. Однако в общем случае удобно проводить реакцию при температуре от приблизительно 0 до приблизительно 100 С. Время, требующееся для реакции, также может широко варьироваться в зависимости от множества факторов, а именно температуры реакции и природы используемых исходных веществ и растворителя. Однако, при условии, что реакция осуществляется в предпочтительных условиях, изложенных выше, обычно достаточным является период от приблизительно 5 мин до приблизительно 12 ч. Реакция конденсации (А 2 а 2). Данную реакцию обычно и предпочтительно осуществляют в присутствии растворителя. Не существует конкретного ограничения природы используемого растворителя, при условии, что он не оказывает неблагоприятного действия на реакцию или участвующие реагенты и что он может растворять реагенты,по меньшей мере, до некоторой степени. Примеры подходящих растворителей включают галогенированные углеводороды, такие как дихлорметан, хлороформ и 1,2-дихлорэтан; простые эфиры, такие как тетрагидрофуран и диоксан; амиды, такие как N-диметилформамид и N,N-диметилацетамид; и нитрилы,такие как ацетонитрил. Из этих растворителей предпочтительными являются галогенированные углеводороды и амиды; более предпочтительны дихлорметан и N,N-диметилформамид. Реакцию осуществляют в присутствии конденсирующего агента. По-видимому, не существует конкретного ограничения природы используемых конденсирующих агентов, и любой конденсирующий агент, обычно используемый в реакциях этого типа, в равной степени может быть использован здесь. Примеры таких конденсирующих агентов включают трифенилфосфины низшего алкилового диэфира азодикарбоновой кислоты, такие как диэтилазодикарбоксилаттрифенилфосфин; галогениды 2-галогено 1-низшего алкилпиридиния, такие как 2-хлор-1-метилпиридиния йодид и 2-бром-1-этилпиридиния тетрафторборат (ВЕР); диарилфосфорилазиды, такие как дифенилфосфорилазид (DPPA); хлорформиаты, такие как этилхлорформиат и изобутилхлорформиат; фосфороцианидаты, такие как диэтилфосфороцианидат (DEPC); производные имидазола, такие как N,N'-карбонилдиимидазол (CDI); производные карбодиимида, такие как N,N'-дициклогексилкарбодиимид (DCC) и 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (EDCI); соли иминия, такие как 2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфат (HBTU) и тетраметилфторформамидиния гексафторфосфат (TFFH); и соли фосфония,такие как бензотриазол-1-илокси-трис(диметиламино)фосфония гексафторфосфат (ВОР) и бром-триспирролидинофосфония гексафторфосфат (PyBrop). Из них предпочтительным является EDCI. На данной стадии могут быть использованы реагенты, такие как 4-(N,N-диметиламино)пиридин(DMAP) и N-гидроксибензотриазол (HOBt). Из них предпочтительным является HOBt. Реакция может быть осуществлена с использованием основания или без него. По-видимому, не существует конкретного ограничения природы используемых оснований, и любое основание, обычно используемое в реакциях этого типа, в равной степени может быть использовано здесь. Примеры таких оснований включают амины, такие как N-метилморфолин, триэтиламин, диизопропилэтиламин, N-метилпиперидин и пиридин. Из них предпочтительными являются триэтиламин и N-метилморфолин. Реакция может протекать в широком диапазоне температур, и точная температура реакции не является критичной для данного изобретения. Предпочтительная температура реакции зависит от таких факторов, как природа растворителя и исходных веществ. Однако в общем случае удобно проводить реакцию при температуре от приблизительно 0 до приблизительно 80 С. Время, требующееся для реакции,также может широко варьироваться в зависимости от множества факторов, а именно температуры реакции и природы используемых исходных веществ и растворителя. Однако, при условии, что реакция осуществляется в предпочтительных условиях, изложенных выше, обычно достаточен период от приблизительно 5 мин до приблизительно 24 ч. Реакция замещения (А 2b). Реакция может быть осуществлена путем нагревания реагентов в чистом аминосоединении или в инертном растворителе в стандартных условиях. Не существует конкретного ограничения природы используемого растворителя, при условии, что он не оказывает неблагоприятного действия на реакцию или участвующие реагенты и что он может растворять реагенты, по меньшей мере, до некоторой степени. Примеры подходящих растворителей включают простые эфиры, такие как этиленгликоля диметиловый эфир, тетрагидрофуран и диоксан; амиды, такие как N,N-диметилформамид и N,N-диметилацетамид; нитрилы, такие как ацетонитрил; и спирты, такие как 2-метил-2-пропанол, 1-бутанол, 1-пропанол, 2-пропанол, этанол и метанол. Из этих растворителей предпочтительными являются простые эфиры и спирты; более предпочтителен тетрагидрофуран.-8 011512 Реакция может быть осуществлена в присутствии катализатора или без него. По-видимому, не существует конкретного ограничения природы используемых катализаторов, и любые катализаторы, обычно используемые в реакциях этого типа, в равной степени могут быть использованы здесь. Примеры таких катализаторов включают цианид натрия или цианид калия. Из них предпочтительным является цианид натрия. Реакция может протекать в широком диапазоне температур, и точная температура реакции не является критичной для изобретения. Предпочтительная температура реакции зависит от таких факторов, как природа растворителя и исходных веществ. Однако в общем случае удобно проводить реакцию при температуре от приблизительно 4 до приблизительно 200 С. Время, требующееся для реакции, также может широко варьироваться в зависимости от множества факторов, а именно температуры реакции и природы используемых исходных веществ и растворителя. Однако, при условии, что реакция осуществляется в предпочтительных условиях, изложенных выше, обычно достаточным является период от приблизительно 30 мин до приблизительно 24 ч. Введение защитной группы для гидроксила. В случае, когда R1 имеет гидроксильную группу, если необходимо, реакция может быть осуществлена после защиты гидроксильной группы перед реакцией, на которую оказывает влияние гидроксильная группа. Введение защитной группы для гидроксила может быть осуществлено на подходящей стадии. Эта реакция подробно описана в Т.W. Greene et al., Protective Groups in Organic Synthesis, 369-453,(1999), описание которого включено в данное описание изобретения посредством ссылки. Ниже приведен пример типичного взаимодействия, вовлекающего защитную группу трет-бутилдиметилсилил. Например, когда защитная группа для гидроксила представляет собой "трет-бутилдиметилсилил",эту стадию осуществляют путем взаимодействия с нужной защитной галогенидной группой для гидроксила, в инертном растворителе в присутствии основания. Примеры подходящих растворителей включают галогенированные углеводороды, такие как дихлорметан, хлороформ, четыреххлористый углерод и 1,2-дихлорэтан; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран и диоксан; ароматические углеводороды, такие как бензол, толуол и нитробензол; амиды, такие как формамид, N,N-диметилформамид, N,N-диметилацетамид и триамид гексаметилфосфорной кислоты; или смешанные из них растворители. Из них предпочтительным является тетрагидрофуран или N,N-диметилформамид. Примеры галогенидной защитной группы для гидроксила, используемые в вышеприведенной реакции, включают предпочтительные триметилсилилхлорид, триэтилсилилхлорид, трет-бутилдиметилсилилхлорид, трет-бутилдиметилсилилбромид, ацетилхлорид. Примеры оснований включают гидроксиды щелочных металлов, такие как гидроксид лития, гидроксид натрия и гидроксид калия, карбонаты щелочных металлов, такие как карбонат лития, карбонат натрия и карбонат калия, и органические амины, такие как триэтиламин, трибутиламин, N-метилморфолин,пиридин, имидазол, 4-диметиламинопиридин, пиколин, лутидин, коллидин, DBN и DBU. Из них предпочтительным является триэтиламин, имидазол или пиридин. При применении органического амина в жидкой форме он также служит в качестве растворителя, когда находится в значительном избытке. Хотя температура реакции отличается в зависимости от природы исходного соединения, галогенида и растворителя, обычно она находится в диапазоне от 0 до 80 С (предпочтительно от 0 до 30 С). Хотя время реакции зависит от температуры реакции и подобнрого, оно находится в диапазоне от 10 мин до 2 суток (предпочтительно от 30 мин до 1 суток). Стадия удаления защиты. В случае, когда Rla имеет защищенную гидроксильную группу, осуществляют реакцию удаления защиты с получением гидроксильной группы. Эта реакция подробно описана в Т.W. Greene et al., ProtectiveGroups in Organic Synthesis, 369-453 (1999), описание которой включено в данное описание изобретения посредством ссылки. Ниже приведен пример типичной реакции, включающей защитную группу трет-бутилдиметилсилил. Удаление защиты с гидроксильной группы осуществляют с использованием кислоты, такой как уксусная кислота, фтористого водорода, комплекса фторид водорода-пиридин или фторид-иона, такого как тетрабутиламмонийфторид (TBAF). Реакцию удаления защиты обычно и предпочтительно осуществляют в присутствии растворителя. Не существует конкретного ограничения природы используемого растворителя, при условии, что он не оказывает неблагоприятного действия на реакцию или участвующие реагенты и что он может растворять реагенты, по меньшей мере, до некоторой степени. Примеры подходящих растворителей включают спирт, такой как метанол, этанол или смешанные растворители, но не ограничены ими. Реакция может протекать в широком диапазоне температур, и точная температура реакции не является критичной для изобретения. Предпочтительная температура реакции зависит от таких факторов, как природа растворителя и исходных веществ. Однако в общем случае удобно проводить реакцию при температуре от приблизительно 0 до приблизительно 100 С. Время, требующееся для реакции, также может широко варьироваться в зависимости от множества факторов, а именно температуры реакции и природы используемых исходных веществ и растворителя. Однако, при условии, что реакция осуществляется в предпочтительных условиях, изложенных выше, обычно достаточен период от приблизительно 10 мин-9 011512 до приблизительно 24 ч. Соединения формулы (I) и промежуточные соединения в вышеупомянутых способах получения могут быть выделены и очищены обычными способами, такими как перегонка, перекристаллизация или хроматографическая очистка. Соединения по изобретению, предназначенные для фармацевтического применения, могут быть введены в виде кристаллических или аморфных продуктов. Они могут быть получены, например, в виде твердых частиц, порошков или пленок с использованием таких способов, как осаждение, кристаллизация, лиофилизация, сушка распылением или сушка выпариванием. Для этой цели можно использовать сушку микроволнами или радиочастотами. Обычные способы получения/выделения отдельных энантиомеров включают хиральный синтез из подходящего оптически чистого предшественника или разделение рацемата (или рацемата соли или производного) с использованием, например хиральной жидкостной хроматографии высокого давления (HPLC). Альтернативно, способ оптического расщепления рацемата (или рацемического предшественника) может быть подходящим образом выбран из обычных способов, например предпочтительной кристаллизации или разделения диастереоизомерных солей между основной группировкой соединения формулы(I) и подходящей оптически активной кислоты, такой как винная. Соединения по изобретению, предназначенные для фармацевтического применения, могут быть введены в виде кристаллических или аморфных продуктов. Они могут быть получены, например, в виде твердых частиц, порошков или пленок с использованием способов, таких как осаждение, кристаллизация, лиофилизация, сушка распылением или сушка выпариванием. Для этой задачи может быть использована сушка микроволнами или радиочастотами. Они могут быть введены самостоятельно, или в комбинации с одним или более другими соединениями по изобретению, или в комбинации с одним или более другими лекарственными средствами (или в виде любой их комбинации). Как правило, они могут быть введены в виде фармацевтической композиции или препарата вместе с одним или более фармацевтически приемлемыми носителями или эксципиентами. Термин "носитель" или "эксципиент" используется здесь для описания любого ингредиента, отличающегося от соединения(й) по изобретению. Выбор носителя или эксципиента в значительной степени зависит от факторов, таких как конкретный способ введения, влияние эксципиента на растворимость и стабильность и природа лекарственной формы. Фармацевтические композиции, подходящие для доставки соединений по настоящему изобретению, и способы их приготовления легко понятны специалистам в данной области техники. Такие композиции и способы их приготовления можно найти, например в "Remington's Pharmaceutical Sciences", 19thEdition (Mack Publishing Company, 1995). Пероральное введение Соединения по изобретению могут быть введены перорально. Пероральное введение может включать проглатывание, так что соединение проникает в желудочно-кишечный тракт, или можно использовать трансбуккальное или подъязычное введение, при помощи которого соединение попадает в кровоток непосредственно из ротовой полости. Препараты, подходящие для перорального введения, включают твердые препараты, такие как, например, таблетки, капсулы, содержащие частицы, жидкости или порошки, лепешки (включающие заполненные жидкостью), жевательные резинки, мульти- и наночастицы, гели, твердый раствор, липосомы,пленки (включая мукоадгезивные), вагинальные суппозитории, спреи и жидкие препараты. Жидкие препараты включают, например, суспензии, растворы, сиропы и эликсиры. Такие препараты могут быть использованы в качестве наполнителей в мягких или твердых капсулах и, как правило,включают носитель, например воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу или подходящее масло, и один или более чем один эмульгирующий и/или суспендирующий агент. Жидкие препараты также могут быть приготовлены путем растворения твердого вещества, например из саше. Соединения по изобретению также могут быть использованы в быстрорастворимых, быстрораспадающихся лекарственных формах, таких как формы, описанные в Expert Opinion in Therapeutic Patents, 11(6), 981-986 by Liang and Chen (2001). Для таблеточных лекарственных форм, в зависимости от дозы, лекарственное средство может составлять от приблизительно 1 до приблизительно 80 мас.% лекарственной формы, более типично от приблизительно 5 до приблизительно 60 мас.% лекарственной формы. Дополнительно к лекарственному средству, таблетки, как правило, содержат разрыхлитель. Примеры разрыхлителей включают натрия крахмала гликолят, карбоксиметилцеллюлозу натрия, карбоксиметилцеллюлозу кальция, кроскамелозу натрия, кросповидон, поливинилпирролидон, метилцеллюлозу, микрокристаллическую целлюлозу, гидроксипропилцеллюлозу, замещенную низшим алкилом, крахмал, предварительно клейстеризованный крахмал и альгинат натрия. Как правило, разрыхлитель содержит от приблизительно 1 до приблизительно 25 мас.%, предпочтительно от приблизительно 5 до приблизительно 20 мас.% лекарственной формы. Связывающие вещества, как правило, используют для придания таблеточному препарату когезионных свойств. Подходящие связывающие вещества включают микрокристаллическую целлюлозу, желатин, сахара, полиэтиленгликоль, природные и синтетические смолы, поливинилпирролидон, предвари- 10011512 тельно клейстеризованный крахмал, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу. Таблетки также могут содержать разбавители, такие как лактоза (моногидрат, высушенный распылением моногидрат, безводная и т.д.), маннит, ксилит, декстроза, сахароза, сорбит, микрокристаллическая целлюлоза, крахмал и дигидрат дикальций фосфата. Таблетки также могут содержать поверхностно-активные агенты, такие как лаурилсульфат натрия и полисорбат 80, и скользящие вещества, такие как диоксид кремния и тальк. Если присутствуют поверхностно-активные агенты, они могут составлять от приблизительно 0,2 до приблизительно 5 мас.% от массы таблетки, и скользящие вещества могут составлять от приблизительно 0,2 до приблизительно 1 мас.% от массы таблетки. Таблетки также, как правило, содержат смазывающие вещества, такие как стеарат магния, стеарат кальция, стеарат цинка, стеарилфумарат натрия и смеси стеарата магния с лаурилсульфатом натрия. Смазывающие вещества, как правило, составляют от приблизительно 0,25 до приблизительно 10 мас.%,предпочтительно от приблизительно 0,5 до приблизительно 3 мас.% от массы таблетки. Другие возможные ингредиенты включают антиоксиданты, красители, ароматизаторы, консерванты и агенты, маскирующие вкус. Примеры таблеток содержат до приблизительно 80% лекарственного средства, от приблизительно 10 до приблизительно 90 мас.% связывающего вещества, от приблизительно 0 до приблизительно 85 мас.% разбавителя, от приблизительно 2 до приблизительно 10 мас.% разрыхлителя и от приблизительно 0,25 до приблизительно 10 мас.% смазывающего вещества. Таблеточные смеси можно прессовать непосредственно или при помощи валика с получением таблеток. Таблеточные смеси или части смесей альтернативно перед таблетированием можно подвергать влажному гранулированию, сухому гранулированию и гранулированию из расплава, затвердеванию из расплава или экструдированию. Конечный препарат может содержать один или более чем один слой и может быть покрыт оболочкой или не иметь оболочки; он даже может быть инкапсулирован. Приготовление таблеток обсуждается в "Pharmaceutical Dosage Forms: Tablets, Vol. 1", by H. Liebermanand L. Lachman, Marcel Dekker, N.Y., N.Y., 1980 (ISBN 0-8247-6918-X). Твердые препараты для перорального введения могут быть приготовлены для немедленного и/или модифицированного высвобождения. Препараты с модифицированным высвобождением включают отсроченное, пролонгированное, импульсное, контролируемое, нацеленное и программируемое высвобождение. Подходящие препараты с модифицированным высвобождением для целей изобретения описаны в патенте США 6106864. Подробную информацию о других подходящих способах высвобождения, таких как высокоэнергетические дисперсии и осмотические и покрытые оболочкой частицы, можно найти вVerma et al., Pharmaceutical Technology On-line, 25 (2), 1-14 (2001). Применение жевательной резинки для достижения контролируемого высвобождения описано в WO 00/35298. Парентеральное введение Соединения по изобретению также могут быть введены непосредственно в кровоток, в мышцу или внутренний орган. Походящие средства для парентерального введения включают внутривенное, внутриартериальное, внутриперитонеальное, внутриоболочечное, внутрисуставное, внутриуретральное, надчревное, внутричерепное, внутримышечное и подкожное введение. Подходящие устройства для парентерального введения включают игольные (включая микроигольные) инжекторы, безыгольные инжекторы и инфузионные средства. Препараты для парентерального введения обычно представляют собой водные растворы, которые могут содержать такие эксципиенты, как соли, углеводороды и буферные агенты (предпочтительно до рН от приблизительно 3 до приблизительно 9), но для некоторых применений они могут быть более удобно приготовлены в виде стерильного неводного раствора или в виде высушенной формы для использования вместе с подходящим носителем, таким как стерильная апирогенная вода. Приготовление препаратов для парентерального введения в стерильных условиях, например путем лиофилизации, можно легко осуществить с использованием стандартных фармацевтических методов,хорошо известных специалистам в данной области техники. Растворимость соединений формулы (I), используемых в изготовлении растворов для парентерального введения, может быть увеличена путем применения подходящих способов приготовления препарата, таких как введение агентов, увеличивающих растворимость. Препараты для парентерального введения могут быть приготовлены для немедленного и/или модифицированного высвобождения. Препараты для модифицированного высвобождения включают отсроченное,пролонгированное, импульсное, контролируемое, нацеленное и программируемое высвобождение. Таким образом, соединения по изобретению могут быть приготовлены в виде твердого вещества, полутвердого вещества или тиксотропной жидкости для введения в виде имплантируемого депо, обеспечивающего модифицированное высвобождение активного соединения. Примеры таких препаратов включают стенты, покрытые лекарственным средством, и PGLA (поли(сополимер DL-молочной и гликолевой кислоты-микросферы. Местное введение Соединения по изобретению также могут быть введены местно в кожу или слизистые оболочки, то есть кожно или трансдермально. Типичные препараты для этой задачи включают гели, гидрогели, лосьо- 11011512 ны, растворы, кремы, мази, присыпки, повязки, пены, пленки, кожные пластыри, облатки, имплантаты,губки, волокна, бандажи и микроэмульсии. Также могут быть использованы липосомы. Типичные носители включают спирт, воду, минеральное масло, вазелиновое масло, медицинский вазелин, глицерин,полиэтиленгликоль и пропиленгликоль. Могут быть включены агенты, усиливающие проницаемость,см., например, J. Pharm. Sci., 88 (10), 955-958 by Finnin and Morgan (October 1999). Другие средства для местного введения включают доставку посредством электропорации, электрофореза, фонофореза, сонофореза и микрошприцевую или безыгольную (например, Powderject, Bioject и т.д.) инъекцию. Препараты для местного введения могут быть приготовлены для немедленного и/или модифицированного высвобождения. Препараты для модифицированного высвобождения включают отсроченное,пролонгированное, импульсное, контролируемое, нацеленное и программируемое высвобождение. Ингаляционное/интраназальное введение Соединения по изобретению также могут быть введены интраназально или путем ингаляции, обычно в форме сухого порошка (самого по себе, в виде смеси, например сухой смеси с лактозой, или смеси с частицами компонентов, например смеси с фосфолипидами, такими как фосфатидилхолин) из ингалятора для сухого порошка или в виде аэрозольного спрея из контейнера под давлением, насоса, спрея, распылителя (предпочтительно распылителя с использованием электрогидродинамики для получения мелкого аэрозоля) или небулайзера, с применением или без применения подходящего пропеллента, такого как 1,1,1,2-тетрафторэтан или 1,1,1,2,3,3,3-гептафторпропан. Для интраназального применения порошок может включать биоадгезивный агент, например хитозан или циклодекстрин. Контейнер под давлением, насос, спрей, распылитель или небулайзер содержит раствор или суспензию соединения(й) по изобретению, содержащие, например, этанол, водный этанол или подходящий альтернативный агент для диспергирования, солюбилизации или удлинения высвобождения активного агента, пропеллент(ы) в качестве растворителя и возможное поверхностно-активное вещество, такое как сорбитантриолеат, олеиновая кислота или олигомолочная кислота. Перед применением в сухом порошкообразном или суспензионном препарате лекарственное средство измельчают до размера, подходящего для доставки путем ингаляции (обычно менее 5 мкм). Это может быть достигнуто при помощи любого подходящего способа измельчения, такого как перемалывание в мельнице со спиральной струей, перемалывание на струйной мельнице с псевдоожиженным слоем, обработка в сверхкритической среде с образованием наночастиц, гомогенизация при высоком давлении или сушка распылением. Капсулы (изготовленные, например, из желатина или НРМС (гидроксипропилметилцеллюлозы,блистеры и картриджи для применения в ингаляторе или инсуффляторе могут быть приготовлены таким образом, что они содержат порошкообразную смесь соединения по изобретению, подходящее порошкообразное основание, такое как лактоза или крахмал, и модификатор рабочих параметров, такой как l-лейцин, маннит или стеарат магния. Лактоза может быть безводной или в форме моногидрата, последнее является предпочтительным. Другие подходящие эксципиенты включают декстран, глюкозу, мальтозу,сорбит, ксилит, фруктозу, сахарозу и трегалозу. Подходящий препарат в виде раствора для применения в распылителе с использованием электрогидродинамики для получения мелкой дисперсии может содержать от приблизительно 1 мкг до приблизительно 20 мг соединения по изобретению на одно срабатывание, и объем при срабатывании может варьироваться от приблизительно 1 до приблизительно 100 мкл. Типичный препарат может содержать соединение формулы (I), пропиленгликоль, стерильную воду, этанол и хлорид натрия. Альтернативные растворители, которые можно использовать вместо пропиленгликоля, включают глицерин и полиэтиленгликоль. Подходящие корригенты, такие как метанол и левоментол, или подсластители, такие как сахарин или сахарин натрия, могут быть добавлены в препараты по изобретению, предназначенные для ингаляционного/интраназального введения. Препараты для ингаляционного/интраназального введения могут быть приготовлены для немедленного и/или модифицированного высвобождения с использованием, например, поли(сополимера DL-молочной и гликолевой кислоты) (PGLA). Препараты для модифицированного высвобождения включают отсроченное, пролонгированное, импульсное, контролируемое, нацеленное и программируемое высвобождение. В случае сухих порошковых ингаляторов и аэрозолей стандартную дозу устанавливают при помощи клапана, который выпускает отмеренное количество. Дозы в соответствии с изобретением, как правило, устанавливают таким образом, чтобы вводить отмеренную дозу или "пуф", содержащий от приблизительно 1 до приблизительно 100 мкг соединения формулы (I). Общая суточная доза, как правило, находится в диапазоне от приблизительно 50 мкг до приблизительно 20 мг и может быть введена в разовой дозе или, более типично, в виде разделенных доз в течение суток. Ректальное/внутривагинальное введение Соединения по изобретению могут быть введены ректально или вагинально, например в форме суппозиториев, пессариев или клизмы. Масло какао представляет собой традиционную основу для суппозитория, но при необходимости можно использовать различные альтернативы. Препараты для ректального/вагинального введения могут быть приготовлены для немедленного и/или модифицированного высвобождения. Препараты с модифицированным высвобождением включают отсро- 12011512 ченное, пролонгированное, импульсное, контролируемое, нацеленное и программируемое высвобождение. Глазное/ушное введение Соединения по изобретению также можно вводить непосредственно в глаз или ухо, обычно в форме капель микронизированной суспензии или раствора в изотоническом стерильном физиологическом растворе с установленным рН. Другие препараты, подходящие для глазного и ушного введения, включают мази, биоразлагаемые (например, абсорбируемые гелевые губки, коллаген) и небиоразлагаемые (например, силикон) имплантаты, облатки, линзы и корпускулярные или везикулярные системы, такие как ниосомы или липосомы. Полимер, такой как сшитая полиакриловая кислота, поливиниловый спирт, гиалуроновая кислота, целлюлозный полимер, например гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза или метилцеллюлоза, или гетерополисахаридный полимер, например гелановая смола, могут быть включены вместе с консервантом, таким как бензалкония хлорид. Такие препараты также могут быть доставлены путем электрофореза. Препараты для глазного/ушного введения могут быть приготовлены для немедленного и/или модифицированного высвобождения. Препараты для модифицированного высвобождения включают отсроченное, пролонгированное, импульсное, контролируемое, нацеленное и программируемое высвобождение. Другие методы Соединения по изобретению можно комбинировать с растворимыми макромолекулярными объектами, такими как циклодекстрин и его подходящие производные или полимеры, содержащие полиэтиленгликоль, для улучшения их растворимости, скорости растворения, маскировки вкуса, улучшения биодоступности и/или стабильности для применения в любом из вышеупомянутых способов введения. Обнаружено, что, например, комплексы лекарственное средство-циклодекстрин, как правило, полезны для большей части лекарственных форм и путей введения. Могут быть использованы как комплексы включения, так и комплексы без включения. В качестве альтернативы прямому комплексообразованию с лекарственным средством циклодекстрин можно использовать в качестве вспомогательной добавки, то есть в качестве носителя, разбавителя или солюбилизатора. Для этих задач наиболее часто используют альфа-, бетаи гамма-циклодекстрины, примеры которых можно найти в WO 91/11172, WO 94/02518 и WO 98/55148. Наборы Поскольку может быть желательно вводить комбинацию активного соединения, например, для целей лечения конкретного заболевания или состояния, в объем настоящего изобретения входит возможность того, что две или более фармацевтические композиции, по меньшей мере одна из которых содержит соединение по изобретению, удобно могут быть скомбинированы в форме набора, подходящего для совместного введения этих композиций. Таким образом, набор по изобретению содержит две или более отдельные фармацевтические композиции, по меньшей мере одна из которых содержит соединение формулы (I) по изобретению, и средства для раздельного хранения указанных композиций, такие как контейнер, разделенный флакон или разделенный пакет из фольги. Примером такого набора является привычная блистерная упаковка, используемая для упаковки таблеток, капсул и подобного. Набор по изобретению, в частности, подходит для введения разных лекарственных форм, например,перорально и парентерально, для введения отдельных композиций с разными интервалами приема доз или для титрования отдельных композиций относительно друг друга. Для того, чтобы способствовать соблюдению пациентом схемы лечения, набор, как правило, содержит указания по введению и может быть снабжен так называемой памяткой. Дозировка Для введения пациентам-людям общая суточная доза соединений по изобретению, как правило, находится в диапазоне от приблизительно 0,05 до приблизительно 500 мг в зависимости от курса, способа введения, предпочтительно в диапазоне от приблизительно 0,1 до приблизительно 400 мг и более предпочтительно в диапазоне от приблизительно 0,5 до приблизительно 300 мг. Например, для перорального введения может требоваться общая суточная доза от приблизительно 1 до приблизительно 300 мг, тогда как может требоваться внутривенная доза лишь от приблизительно 0,5 до приблизительно 100 мг. Общая суточная доза может быть введена в разовой или дробных дозах. Эти дозы основаны на усредненном субъекте-человеке, имеющем массу от приблизительно 65 до приблизительно 70 кг. Лечащий врач способен легко определить дозы для субъектов, масса которых выходит за пределы этого диапазона, таких как младенцы и пожилые люди. Комбинации Как обсуждалось выше, соединение по изобретению демонстрирует ингибиторную активность в отношении кислотной помпы. Антагонист кислотной помпы по настоящему изобретению можно успешно комбинировать с другим фармакологически активным соединением или с двумя или более другими фармакологически активными соединениями, в частности в лечении гастроэзофагеальной рефлюксной болезни. Например, антагонист кислотной помпы, в частности соединение формулы (I) или его фармацевтически приемлемая соль, как они определены выше, могут быть введены одновременно, последовательно или раздельно в комбинации с одним или более агентами, выбранными из:(1) антагонистов гистаминового рецептора H2, например ранитидина, лафутидина, низатидина, ци- 13011512 метидина, фамотидина и роксатидина;(4) защитных агентов для слизистой оболочки, например полапрецинка, экабета натрия, ребамипида, тепренона, цетраксата, сукралфата, хлорпиллин-меди и плаунотола;(15) ингибиторов синтазы оксида азота, например GW-274150, тиларгинина, Р 54, гуанидиоэтилдисульфида и нитрофлурбипрофена;(16) антагонистов ваниллоидного рецептора 1, например AMG-517 и GW-705498;(34) антагонистов слабопроводящего кальций-активируемого калиевого канала 3 (SK-3), например апамина, декуалиния, атракуриума, панципония и тубокурарина. Метод оценки биологических активностей Ингибиторную активность в отношении кислотной помпы и другие биологические активности соединений по изобретению определяли при помощи следующих методик. Символы имеют свои обычные значения: мл (миллилитр(ы, мкл (микролитр(ы, кг (килограмм(ы, г (грамм(ы, мг (миллиграмм(ы,мкг (микрограмм(ы, пмоль (пикомоль(и, ммоль (миллимоль(и, М (молярная масса (м 3/моль, мМ(миллимолярная масса), мкМ (микромолярная масса), колич. (количественный выход), нм (нанометр(ы,мин (минута(ы, Кат (каталожный номер). Приготовление гастральных везикул из свежевыделенных свиных желудков Свиные гастральные везикулы для анализов ингибирования Н+/K+-АТФазы из свиного желудка готовили из слизистой оболочки недавно полученных свиных желудков путем гомогенизации с использованием плотно подогнанного политетрафторэтиленового (Teflone) гомогенизатора в 0,25 М сахарозе при 4 С. Неочищенный осадок удаляли центрифугированием при 20000 g в течение 30 мин. Затем супернатант центрифугировали при 100000 g в течение 30 мин. Полученный осадок ресуспендировали в 0,25 М сахарозе и затем центрифугировали в градиенте плотности при 132000 g в течение 90 мин. Гастральные везикулы собирали с поверхности раздела на 0,25 М сахарозном слое, содержащем 7% Ficoll PM400(Amersham Biosciences). Эту процедуру проводили в холодной комнате. Ингибирование Н+/K+-АТФазы свиного желудка, обеспечивающей ионную утечку Ингибирование Н+/K+-АТФазы свиного желудка, обеспечивающей ионную утечку, измеряли в соответствии с модифицированным способом, описанным в Biochemical Pharmacology, 1988, 37, 2231-2236. Выделенные везикулы лиофилизировали и затем хранили в морозильнике для глубокого замораживания до применения. Для ферментативного анализа лиофилизированные везикулы разбавляли 3 мМMgSO4, содержащего 40 мМ бис-трис (рН 6,4 при 37 С). Ферментативную реакцию проводили, инкубируя 5 мМ KCl, 3 мМ Na2 АТФ, 3 мМ MgSO4 и 1,0 мкг разведенных везикул в течение 30 мин при 37 С в конечном объеме реакционной смеси 60 мкл (40 мМ бис-трис, рН 6,4) с тестируемым соединением или без него. Ферментативную реакцию останавливали путем добавления 10% додецилсульфата натрия (SDS). Высвободившийся из АТФ неорганический фосфат обнаруживали путем инкубации со смесью 1 части 35 мМ тетрагидрата молибдата аммония в 15 мМ гидрате ацетата цинка и 4 частях 10% аскорбиновой кислоты (рН 5,0), приводящей к образованию фосфоромолибдата, который имеет оптическую плотность при 750 нм. Все примеры соединений демонстрировали сильную ингибиторную активность. Результаты определения значений IC50, ингибирующей активности соединений из следующих ниже примеров, представлены в табл. 1. Таблица 1 Ингибирование Н+/K+-АТФазы свиного желудка, обеспечивающей иононепроницаемость Ингибирование иононепроницаемой Н+/K+-АТФазы свиного желудка, обеспечивающей иононепроницаемость, измеряли в соответствии с модифицированным способом, описанным в Biochemical Pharmacology,1988, 37, 2231-2236. Выделенные везикулы хранили в морозильном аппарате для глубокого замораживания до применения. Для ферментативного анализа лиофилизированные везикулы разбавляли 3 мМ MgSO4, содержащим 40 мМ бис-трис (рН 7,4 при 37 С). Ферментативную реакцию проводили, инкубируя 150 мМ KCl, 3 мМ Na2 АТФ, 3 мМ MgSO4, 15 мкМ валиномицина и 3,0 мкг везикул в течение 30 мин при 37 С в конечном объеме реакционной смеси 60 мкл(5 мМ Трис, рН 7,4) с тестируемым соединением или без него. Ферментативную реакцию останавливали путем добавления 10% додецилсульфата натрия (SDS). Высвободившийся из АТФ неорганический фосфат обнаруживали путем инкубации со смесью 1 части 35 мМ тетрагидрата молибдата аммония в 15 мМ гидрате ацетата цинка и 4 частях 10% аскорбиновой кислоты (рН 5,0), приводящей в результате к образованию фосфоромолибдата, который имеет оптическую плотность при 750 нм. Ингибирование Na+/K+-АТФазы почек собакиNa2 АТФ, 3 мМ MgSO4 и 12 мкг фермента в течение 30 мин при 37 С в конечном объеме реакционной смеси 60 мкл (40 мМ Трис, рН 7,4) с тестируемым соединением или без него. Ферментативную реакцию останавливали путем добавления 10% SDS. Высвободившийся из АТФ неорганический фосфат обнаруживали путем инкубации со смесью 1 части 35 мМ тетрагидрата молибдата аммония в 15 мМ гидрате ацетата цинка и 4 частей 10% аскорбиновой кислоты (рН 5,0), приводящей к получению фосфомолибдата, который имеет оптическую плотность при 750 нм. Ингибирование секреции кислоты у крысы с перфузией просвета желудка Секрецию кислоты у крысы с перфузией просвета желудка измеряли в соответствии с Watanabe etal. (Watanabe K. et al., J. Physiol. (Paris) 2000; 94: 111-116). Самцов крыс Sprague-Dawley в возрасте 8 недель, которых лишали корма за 18 ч до эксперимента со свободным доступом к воде, анестезировали уретаном (1,4 г/кг, интраперитонеально) и подвергали трахеотомии. После разреза брюшной стенки по срединной линии в кардиальный отдел желудка вставляли двойную полиэтиленовую канюлю и желудок перфузировали физиологическим раствором (37 С, рН 5,0) со скоростью 1 мл/мин. Выход кислоты в перфузате определяли с 5-минутным интервалом путем титро- 16011512 вания 0,02 М NaOH до рН 5,0. После определения базисной секреции кислоты в течение 30 мин секрецию кислоты стимулировали путем непрерывной внутривенной инфузии пентагастрина (16 мкг/кг/ч). Тестируемые соединения вводили путем внутривенной болюсной инъекции или интрадуоденального введения,после того как стимулированная секреция кислоты достигала фазы плато. После введения контролировали секрецию кислоты. Активность оценивали либо по ингибированию общей секреции кислоты с 0 до 1,5 или 3,5 ч после введения, либо по максимальному ингибированию после введения. Соединение примера 5-3 продемонстрировано хорошую ингибиторную активность. Ингибирование секреции кислоты в желудке собак с мешочком Гейденгайна Использовали самцов собак-биглей массой 7-15 кг с мешочком Гейденгайна (Heidenhain R.: Arch.Ges. Physiol. 1879; 19: 148-167). Животным давали возможность восстановиться от хирургической операции в течение по меньшей мере 3 недель перед экспериментами. Животных содержали при 12-часовом световом цикле в клетках поодиночке. Они получали стандартный корм 1 раз в сутки в 11:00 и водопроводную воду без ограничения, но их не кормили в течение ночи перед экспериментом при свободном доступе к воде. Образцы желудочного сока собирали в течение эксперимента посредством дренажа под действием силы тяжести каждые 15 мин. Кислотность в желудочном соке измеряли путем титрования до точки рН 7,0. Секрецию кислоты стимулировали путем непрерывной внутривенной инфузии гистамина(80 мкг/кг/ч). Пероральное или внутривенное болюсное введение тестируемых соединений осуществляли через 90 мин после начала инфузии гистамина. Секрецию кислоты контролировали после введения. Активность оценивали по максимальному ингибированию относительно соответствующего контрольного значения. Связывание дофетилида у людей Получали и выращивали клетки HEK293S, трансфицированные геном HERG (Human ether a-go-gorelated gene). Клеточная паста из клеток HEK-293, экспрессирующих HERG-продукт, может быть суспендирована в 10-кратном объеме 50 мМ Трис-буфера, доведенного до рН 7,5 при 25 С 2 М HCl, содержащей 1 мМ MgCl2, 10 мМ KCl. Клетки гомогенизировали с использованием гомогенизатора Polytron(при максимальной мощности в течение 20 с) и центрифугировали при 48000 g в течение 20 мин при 4 С. Осадок ресуспендировали, гомогенизировали и центрифугировали еще 1 раз таким же образом. Полученный супернатант сливали и конечный осадок ресуспендировали (10-кратный объем 50 мМ Трис-буфера) и гомогенизировали при максимальной мощности в течение 20 с. Мембранный гомогенат аликвотировали и хранили при -80 С до применения. Аликвоту использовали для определения концентрации белка с использованием набора для быстрого определения белка Protein Assay Rapid Kit (wako) и считывающего устройства для планшетов Spectra max (Wallac). Все манипуляции всегда выполняли на льду, а также исходный раствор и оборудование всегда хранили на льду. Для анализов насыщения эксперименты проводили в общем объеме 200 мкл. Насыщение определяли путем инкубации 36 мкл [3 Н]-дофетилиба и 160 мкл мембранных гомогенатов (20-30 мкг белка на лунку) в течение 60 мин при комнатной температуре в отсутствие или в присутствии 10 мкМ дофетилида при конечных концентрациях (4 мкл) для общего или неспецифического связывания, соответственно. Все инкубации прекращали путем быстрой вакуум-фильтрации через фильтровальную бумагу из стекловолокна, предварительно смоченную PEI(полиэтиленимином), с использованием аппарата для сбора клеток Skatron с последующими двумя промывками 50 мМ Трис-буфером (рН 7,4 при 25 С). Связанную с рецептором радиоактивность количественно оценивали посредством жидкостного сцинтилляционного подсчета с использованием аппарата для подсчета Packard LS counter. Для конкурентного анализа соединения разбавляли в 96-луночных полипропиленовых планшетах в виде 4-точечных разведений в полулогарифмическом формате. Все разведения осуществляли сначала вDMSO и затем переносили в 50 мМ Трис-буфер (рН 7,4 при 25 С), содержащий 1 мМ MgCl2, 10 мМ KCl,таким образом, что конечная концентрация DMSO становится равной 1%. Соединения диспергировали в трех параллелях в планшетах для анализов (4 мкл). Лунки с общим связыванием и неспецифическим связыванием представляли собой 6 лунок в качестве носителя и 10 мкМ дофетилида в конечной концентрации, соответственно. Радиоактивный лиганд готовили в 5,6 конечной концентрации и этот раствор добавляли в каждую лунку (36 мкл). Анализ инициировали путем добавления YSi поли-L-лизиновых SPA шариков (50 мкл, 1 мг/лунку) и мембран (110 мкл, 20 мкг/лунку). Инкубацию продолжали в течение 60 мин при комнатной температуре. Планшеты инкубировали в течение еще 3 ч при комнатной температуре для того, чтобы дать возможность шарикам осесть. Связавшуюся с рецептором радиоактивность количественно оценивали при помощи аппарата для подсчета на планшетах Wallac MicroBeta. Проницаемость Caco-2 Проницаемость Сасо-2 измеряли в соответствии со способом, описанным в Shiyin Yee, PharmaceuticalResearch, 763 (1997). Клетки Сасо-2 выращивали на фильтрующих носителях (Falcon HTS многолуночная система вкладышей) в течение 14 суток. Культуральную среду удаляли как из верхнего, так и базолатерального отделений, и монослои предварительно инкубировали с предварительно нагретыми 0,3 мл верхнего буфера и 1,0 мл базолатерального буфера в течение 0,5 ч при 37 С в водяной бане с встряхиванием с частотой- 17011512 50 циклов/мин. Верхний буфер состоял из сбалансированного солевого раствора Хэнкса, 25 мМ моногидрата D-глюкозы, 20 мМ биологического буфера на основе 2-морфолиноэтансульфоновой кислоты(MES), 1,25 мМ CaCl2 и 0,5 мМ MgCl2 (рН 6,5). Базолатеральный буфер состоял из сбалансированного солевого раствора Хэнкса, 25 мМ моногидрата D-глюкозы, 20 мМ биологического буфера на основе 2-[4(2-гидроксиэтил)-1-пиперазинил]этансульфоновой кислоты (HEPES), 1,25 мМ CaCl2 и 0,5 мМ MgCl2 (рН 7,4). В конце предварительной инкубации среду удаляли и в верхнее отделение добавляли раствор тестируемого соединения (10 мкМ) в буфере. Вкладыши перемещали в лунки, содержащие свежий базолатеральный буфер, на 1 ч. Концентрацию лекарственного средства в буфере измеряли посредством LC/MS анализа (сочетание жидкостной хроматографии и масс-спектрометрии). Скорость потока (F, масса/время) рассчитывали по наклону кумулятивного появления субстрата на стороне приема и кажущийся коэффициент проницаемости (Рарр) рассчитывали в соответствии со следующим уравнением: Рарр (см/с)=(FVD)/(SAMD) где SA представляет собой площадь поверхности для транспорта (0,3 см 2), VD представляет собой донорный объем (0,3 мл), MD представляет собой общее количество лекарственного средства на донорной стороне при t=0. Все данные представляют собой среднее значение для 2 вкладышей. Целостность монослоя определяли посредством транспорта Люцифера желтого. Период полувыведения в микросомах печени человека (HLM) Тестируемые соединения (1 мкМ) инкубировали с 3,3 мМ MgCl2 и 0,78 мг/мл HLM (HL101) в 100 мМ буфера на основе ортофосфата калия (рН 7,4) при 37 С в 96-луночном планшете. Реакционную смесь разделяли на две группы, группу без Р 450 и группу с Р 450. NADPH (восстановленный никотинамидадениндинуклеотидфосфат) добавляли только в реакционную смесь группы с Р 450. Аликвоты образцов из группы Р 450 собирали в моменты времени 0, 10, 30 и 60 мин, где момент времени 0 мин указывает на время добавления NADPH в реакционную смесь группы с Р 450. Аликвоту образцов из группы без Р 450 собирали в моменты времени -10 и 65 мин. Собранные аликвоты экстрагировали раствором ацетонитрила, содержащим внутренний стандарт. Осажденный белок подвергали центрифугированию (2000 об./мин, 15 мин). Концентрацию соединения в супернатанте измеряли при помощи системы LC/MS/MS. Значение периода полувыведения получали путем нанесения на график зависимости натурального логарифма площади пика соединений/внутреннего стандарта от времени. Наклон линии, которая наилучшим образом проходит через точки, позволяет получить скорость метаболизма (k). Ее преобразовывали в значение периода полувыведения, используя следующее уравнение: период полувыведения=ln2/k Исследования межлекарственных взаимодействий in vitro для пяти основных CYPs(Baculosome lot21198 Invitrogen, 50 пмоль Р 450/мл) в 100 мМ K+фосфатном буфере (рН 7,4) и 10 мкМ зонда Vivid blue 1A2 (Invitrogen) в качестве субстрата в течение 5 мин при 30 С. Реакцию инициировали путем добавления раствора нагретой NADPH-регенерирующей системы А, состоящей из 0,50 мМ NADP и 10 мМ MgCl2, 6,2 мМ DL-изолимонной кислоты и 0,5 Ед/мл дегидрогеназы изолимонной кислоты(ICD). Планшеты помещали в считывающее устройство для планшетов при 30 С и считывания осуществляли каждые 1,5 мин с 10-секундным встряхиванием между каждым считыванием для 15 циклов. Длины волн возбуждения/эмиссии составляли 408/465 нм, соответственно.MFC (Gentest) в качестве субстрата в течение 5 мин при 37 С. Реакцию инициировали путем добавления раствора нагретой NADPH-регенерирующей системы А. Планшеты помещали в считывающее устройство для планшетов при 37 С и считывания осуществляли каждые 2,0 мин с 10-секундным встряхиванием между каждым считыванием для 15 циклов. Длины волн возбуждения/эмиссии составляли 408/465 нм,соответственно.(Baculosorae lot20795 Invitrogen, 5 пмоль Р 450/мл) в 100 мМ K+фосфатном буфере (рН 7,4) и 10 мкМ зонда Vivid blue 2C19 (Invitrogen) в качестве субстрата в течение 5 мин при 37 С. Реакцию инициировали путем добавления раствора нагретой NADPH-регенерирующей системы А. Планшеты помещали в считывающее устройство для планшетов при 37 С и считывания осуществляли каждые 1,5 мин с 10-секундным встряхиванием между каждым считыванием для 15 циклов. Длины волн возбуждения/эмиссии составляли 408/465 нм, соответственно.- 18011512 зонда 3-[2-(N,N-диэтил-N-метиламмоний)этил]-7-метокси-4-метилкумарин (АММС) (Gentest) в качестве субстрата в течение 5 мин при 37 С. Реакцию инициировали путем добавления раствора нагретойNADPH-регенерирующей системы В, состоящей из 0,03 мМ NADP и 10 мМ MgCl2, 6,2 мМ DL-изолимонной кислоты и 0,5 Е/мл ICD. Планшеты помещали в считывающее устройство для планшетов при 37 С и считывания осуществляли каждые 2,0 мин с 10-секундным встряхиванием между каждым считыванием для 15 циклов. Длины волн возбуждения/эмиссии составляли 400/465 нм, соответственно.(Baculosome lot20814 Invitrogen, 5 пмоль Р 450/мл) в 100 мМ K+фосфатном буфере (рН 7,4) и 2 мкМ зонда Vivid Red (Invitrogen) в качестве субстрата в течение 5 мин при 30 С. Реакцию инициировали путем добавления раствора нагретой NADPH-регенерирующей системы А. Планшеты помещали в считывающее устройство для планшетов при 30 С и считывания осуществляли с минимальными интервалами с 10 секундным встряхиванием между каждым считыванием для 15 циклов. Длины волн возбуждения/эмиссии составляли 530/595 нм, соответственно. Межлекарственное взаимодействие оценивали по скорости образования метаболита, рассчитанной по наклону (время в зависимости от единиц флуоресценции) в линейной области, или процент ингибирования тестируемым соединением рассчитывали в соответствии со следующим уравнением:% ингибирования=(vo-Vi)/vo100 где vo представляет собой скорость контрольной реакции (в отсутствие тестируемого соединения), avi представляет собой скорость реакции в присутствии тестируемого соединения. Анализ IHERG. Получали и выращивали клетки HEK293, трансфицированные геном HERG (human ether a-go-go relatedgene). Методологию стабильной трансфекции этого канала в клетках HEK можно найти в различных источниках (Z. Zhou et al., 1998, Biophysical journal, 74, 230-241). В день проведения эксперимента клетки собирали из культуральных колб и хранили в виде клеточной суспензии в стандартном внешнем растворе(его состав см. ниже) при комнатной атмосфере при 23 С. Клетки исследовали через 0,5-5 ч после сбора. Потоки HERG исследовали с использованием стандартного способа пэтч-клампа в режиме цельных клеток. В процессе эксперимента клетки переливают со стандартным внешним раствором следующего состава (мМ): NaCl, 130; KCl, 4; CaCl2, 2; MgCl2, 1; глюкоза, 10; HEPES, 5; рН 7,4 посредством NaOH. Данные для цельных клеток получают с использованием усилителя для пэтч-клампа и пэтч-пипеток, которые имеют сопротивление 1-3 МОм, при заполнении стандартным внутренним раствором следующего состава (мМ); KCl, 130; MgATP, 5; MgCl2, 1; HEPES, 10; этиленгликольтетрауксусная кислота (EGTA 5),рН 7,2 с KOH. Только клетки, которые имеют сопротивление доступа менее 10 МОм и закрывающее сопротивление выше 1 ГОм, пригодны для дальнейших экспериментов. Серии резистентной компенсации прикладываются максимально к 80% без вычитания какой-либо утечки. После достижения конфигурации цельных клеток и достаточного времени для клеточного диализа с пипетируемым раствором (более 5 мин) мембрану деполяризуют с удерживающего потенциала -80 до +30 мВ в течение 1000 мс с последующим уменьшением падения напряжения (скорость 0,5 мВ мс-1) назад к удерживающему потенциалу. Эту деполяризацию и уменьшение прикладывают к клеткам постоянно каждые 4 с (0,25 Гц). Измеряют амплитуду максимального тока, генерируемого около -40 мВ во время уменьшения напряжения. Когда во внешнем растворе достигают стабильно вызываемых ответов тока с минимальными изменениями амплитуды, наносят тестируемое соединение в течение 10-20 мин путем множественных доз в единичную клетку. Клетки также подвергают воздействию высокой дозы дофетилиба (5 мкМ), представляющего собой специфический блокатор IKr, для оценки интенсивного эндогенного тока. Все эксперименты проводят при 23+/-1 С. Вызываемые мембранные токи оперативно регистрируют на компьютере, фильтруют на 500-1000 Гц (Bessel -3 дБ) и отбирают при 1-2 КГц. Осмолярность и изменение рН, вызванные тестируемым соединением во внешнем растворе, проверяют при самой высокой концентрации. Среднее арифметическое этих десяти значений максимального тока рассчитывают в условиях контроля и в присутствии лекарственного средства. Процентное уменьшение IN в каждом эксперименте получают при помощи нормализованного значения тока, используя следующую формулу: IN=(IC-ID)/(IC-Idof)100,где IC представляет собой среднее значение тока в условиях контроля, ID представляет собой среднее значение тока в присутствии тестируемого соединения и Idof представляет собой среднее значение тока при применении дофетилида. Проводят отдельные эксперименты и в результате исследования определяют объединенные данные по среднему арифметическому из каждого эксперимента. Биодоступность у крыс Использовали взрослых крыс линии Sprague-Dawley. За 1-2 дня перед экспериментами всем крысам вводили канюлю в правую яремную вену под анестезией. Канюлю выводили на заднюю часть шеи. Образцы крови (0,2-0,3 мл) отбирали из яремной вены с интервалами вплоть до 24 ч после внутривенного или перорального введения тестируемого соединения. Образцы замораживали до анализа. Биодоступность оценивали путем расчета отношения площади под кривой концентрации в плазме крови (AUC)- 19011512 после перорального введения или внутривенного введения. Биодоступность у собак Использовали взрослых собак породы бигль. Образцы крови (0,2-0,5 мл) отбирали из головной вены с интервалами вплоть до 24 ч после внутривенного или перорального введения тестируемого соединения. Образцы замораживали до анализа. Биодоступность оценивали путем расчета отношения площади под кривой концентрации в плазме крови (AUC) после перорального введения или внутривенного введения. Связывание белков плазмы крови Связывание белков плазмы крови тестируемым соединением (1 мкМ) измеряли методом равновесного диализа с использованием оборудования для 96-луночных планшетов. Spectra-Por, мембраны из регенерированной целлюлозы (отсечение молекулярной массы 12000-14000, 22 мм 120 мм) в течение ночи вымачивали в дистиллированной воде, затем в течение 20 мин в 30% этаноле и, наконец, в течение 15 мин в буфере для диализа (физиологический раствор Дульбекко, забуференный фосфатом, рН 7,4). Использовали замороженную плазму крови людей, крыс Sprague-Dawley и собак породы бигль. Собирали оборудование для диализа и добавляли 150 мкл плазмы крови с добавленным соединением с одной стороны каждой лунки и 150 мкл буфера для диализа с другой стороны каждой лунки. После инкубации в течение 4 ч при 37 С и 150 об./мин отбирали образцы аликвот плазмы крови и буфера. Соединение в плазме крови и буфере экстрагировали 300 мкл ацетонитрила. содержащего внутренний стандарт соединений для анализа. Концентрацию соединения определяли посредством LC/MS/MS анализа. Долю несвязанного соединения рассчитывали в соответствии со следующим уравнением:fu=1-([плазма]eq-[буфер]eq)/([плазма]eq) где [плазма]eq и [буфер]eq представляют собой концентрации соединения в плазме и буфере, соответственно. Растворимость в воде Растворимость в воде для сред (а)-(г) определяли в соответствии с следующим способом. Камеры Whatman mini-UniPrep (Clifton, NJ, USA), содержащие более 0,5 мг соединения и 0,5 мл каждой среды, встряхивали в течение ночи (около 8 ч) при температуре. Перед анализом все образцы фильтровали через 0,45 мкм поливинилидендифторидную (PVDF) мембрану в шприц Whatman mini-UniPrep. Фильтраты анализировали посредством HPLC. среда (а) искусственный желудочный сок без ферментов (SGN) при рН 1,2: растворяют 2,0 г NaCl в 7,0 мл 10 М HCl и количестве воды, достаточном для получения 1000 мл; (б) физиологический раствор,забуференный фосфатом (PBS) при рН 6,5: растворяют 6,35 г KH2PO4, 2,84 г Na2HPO4 и 5,50 г NaCl в количестве воды, достаточном для получения 1000 мл, рН доводят до 6,5; (в) 3,94 мг таурохолата натрия(NaTC) и 1,06 мг 1-пальмитоил-2-олеил-L-фосфатидилхолина (РОРС) в 1 мл PBS (рН 6,5). Оценка печеночного клиренса с использованием метаболической стабильности в человеческих гепатоцитах Тестируемые соединения (1 мкМ) статически инкубировали с гепатоцитами человека при 37 С в смеси 95% воздуха/5% CO2 при целевой плотности клеток 0,510 клеток/мл и общем объеме 50 мкл. Инкубацию останавливали путем добавления в каждый момент времени ледяного ацетонитрила (ACN). Аликвоты образцов смешивали с 10% ACN, содержащим внутренний стандарт для LC/MS/MS анализа. После ультразвуковой обработки образцов в течение 10 мин их центрифугировали при 2000 об./мин в течение 15 мин и затем супернатант переносили в другие планшеты для анализа. Концентрацию соединений в супернатанте измеряли в системе LC/MS/MS. Скорости исчезновения тестируемых соединений получали путем откладывания на графике зависимости отношения десятичных логарифмов площади пика соединения/внутреннего стандарта от времени. Наклон наиболее хорошо аппроксимированной к точкам линии позволил получить скорость метаболизма (ke). Это значение масштабировали, принимая во внимание насыщенность клетками печени, массу печени и тела, с получением значения собственного клиренса (CLint) в мл/мин/кг, как показано в уравнении 1. Печеночный клиренс (CLh) предсказывали, исходя из собственного значения клиренса с использованием модели параллельных трубок, как показано в уравнении 2. Предсказанный клиренс, разделенный на печеночный кровоток (Qh), позволил получить коэффициент очищения (Eh) (уравнение 3). Уравнение 1:Eh=CLh/Qh где "г массы печени/кг массы тела" составляет 21, "клетки/г печени" составляет 1,2108, "мл инкубируемой смеси/количество клеток в инкубируемой смеси" составляет 2,010-6 и Qh составляет 20 мл/мин/кг. Предполагая, что печеночный метаболизм представляет собой основной путь элиминирования лекарственного сресдвта, системное воздействие (AUCpo) после перорального введения рассчитывают с использованием уравнения 4. Уравнение 4:- 20011512 Способ оценки фототоксического потенциала соединений Фототоксический потенциал измеряли в точном соответствии со способом, описанным в OECDGuidelines for the Testing of Chemicals 432 (2002). Хлорпромазин (CPZ) и н-додецилсульфат натрия (SDS) использовали в качестве положительного и отрицательного контроля, соответственно. Клетки Balb/3T3, клон 31 (АТСС, CCL-163) засевали в 96-луночные планшеты (Nunc, 167008) с плотностью 1104 клеток/лунку. Клетки инкубировали в стандартных условиях (37 С, увлажненная атмосфера из 95% воздуха и 5% CO2) в культуральной среде-DMEM (среде Игла, модифицированной Дульбекко) (GIBCO; cat 11885-084) в течение 24 ч. После инкубации культуральную среду-DMEM сливали и клетки осторожно промывали 150 мкл сбалансированного солевого раствора Эрла (EBSS; Sigma,cat E3024), затем добавляли 100 мкл раствора тестируемого соединения в EBSS или растворитель в качестве контроля (EBSS, содержащий 1% диметилсульфоксида или 1% этанола). Планшеты готовили в двух параллелях. Все планшеты инкубировали в стандартных условиях в течение 60 мин в темноте. Один из параллельных планшетов использовали для определения цитотоксичности (-Irr) и хранили при комнатной температуре в темноте в течение 50 мин. Для определения фотоцитотоксичности (+Irr) другой параллельный планшет подвергали воздействию имитатора солнечного света (ультрафиолетовое излучение A(UVA): 1,7 мВт/см 2; SOL500, Dr. Horde UV Technology, Germany) в течение 50 мин (доза UVA=5 Дж/см 2). Затем растворы сливали с этих двух планшетов и их немедленно осторожно промывали 150 мкл EBSS. Клетки дополнительно инкубировали с 150 мкл/лунку среды DMED в течение 18-22 ч. После инкубации культуральную среду сливали, клетки осторожно промывали 150 мкл EBSS и затем немедленно инкубировали с 100 мкл/лунку 50 мкг/мл нейтрального красного (NR) (3-амино-7-диметиламино-2-метилфеназина гидрохлорид, Kanto Chemical Co., Inc., Japan) в DMEM без сыворотки крови в течение 3 ч в стандартных условиях. После включения нейтрального красного в клеточные лизосомы среду NR-DMED удаляли и клетки осторожно промывали 150 мкл EBSS. В каждую лунку планшета добавляли точно по 150 мкл смеси этанол/уксусная кислота/вода (50:1:49) и экстракцию осуществляли в течение 10 мин путем медленного встряхивания при комнатной температуре. Затем измеряли оптическую плотность (OD) NR-экстракта при 540 нм с использованием спектрофотометра (Plate-reader, POLARstarOPTIMA; BMG Labtechnologies, Germany). Значения OD (оптической плотности) использовали для расчета среднего значения фотоэффекта (МРЕ) с использованием программного обеспечения, предлагаемого OECD (Организацией экономического сотрудничества и развития), "3T3 NRU Phototox" (Version 2.0,Federal Institute for Risk Assessment, Germany). Результаты для контроля (CPZ и SDS) использовали для оценки качества проведения анализа. Значение МРЕ менее 0,1 оценивали как "отсутствие фототоксичности"; значение МРЕ, более или равное 0,1, но менее 0,15, оценивали как "возможная фототоксичность" и значение МРЕ, более или равное 0,15, оценивали как "фототоксичность". Примеры Следующие примеры предложены только для дополнительной иллюстрации и не предполагается,что они ограничивают описанное изобретение. Если не указано иное, в следующих примерах общие экспериментальные условия являются следующими: все операции осуществляли при комнатной температуре или температуре окружающей среды, то есть в диапазоне 18-25 С; выпаривание растворителя осуществляли с использованием роторного испарителя при пониженном давлении при температуре бани вплоть до 60 С; реакции контролировали при помощи тонкослойной хроматографии (ТСХ), и время реакций приведено только для иллюстрации; температуры плавления (т.пл.) приведены нескорректированными (полиморфизм может приводить разным температурам плавления); структура и чистота всех выделенных соединений подтверждены по меньшей мере одним из следующих способов: ТСХ (пластины для ТСХ, предварительно покрытые силикагелем 60 F254 Merck, или пластины для ТСХ, предварительно покрытые NH2 гелем (силикагель, покрытый амином) F254 Merck), масс-спектрометрия, спектры ядерного магнитного резонанса (ЯМР), спектры инфракрасного поглощения (ИК) или микроанализ. Выходы приведены только для иллюстрации. Колоночную флэш-хроматографию осуществляли с использованиемBiotage KP-SIL (40-63 мкм), Biotage KP-NH (силикагель, покрытый амином) (40-75 мкМ) или силикагеля 300HG Wako (40-60 мкМ). Препаративную ТСХ осуществляли с использованием пластин для ТСХ, покрытых силикагелем 60 F254 Merck (толщина 0,5 или 1,0 мм). Все данные по массам получены как данные масс-спектров низкого разрешения (ESI) с использованием ZMD или ZQ (Waters) и масс-спектрометра. Данные ЯМР определяли при 270 МГц (спектрометр JEOL JNM-LA 270) или 300 МГц (спектрометр JEOL JNM-LA300) с использованием в качестве растворителя, если не указано иное, дейтерированного хлороформа (99,8%) или диметилсульфоксида (99,9%) относительно тетраметилсилана (ТМС) в качестве внутреннего стандарта в миллионных долях (м.д.); обычные используемые сокращения:s=синглет, d=дублет, m=мультиплет, dd=дублет дублетов, br.s=широкий синглет и т.д. ИК-спектры регистрировали при помощи инфракрасного спектрофотометра с преобразованием Фурье (Shimazu FTIR-8300). Оптическое вращение измеряли с использованием цифрового поляриметра JASCO DOP-370 и Р-1020 Стадия 1. Изопропил-8-(3,4-дигидро-2H-хромен-4-иламино)-2,3-диметилимидазо[1,2-а 1 пиридин-6 карбоксилат. К суспензии изопропил-8-амино-2,3-диметилимидазо[1,2-а]пиридин-6-карбоксилата (8,00 г, 32,3 ммоль,WO 02/20523), йодида натрия (2,42 г, 16,2 ммоль) и карбоната калия (15,6 г, 113 ммоль) в ацетоне (100 мл) добавляли раствор 4-хлорхромана (10,9 г, 64,6 ммоль, WO 00/78751) в ацетоне (20 мл) при комнатной температуре и реакционную смесь перемешивали при температуре дефлегмации в течение 24 ч. Реакционную смесь гасили водой и экстрагировали дихлорметаном (80 мл 2). Объединенные экстракты промывали рассолом, сушили над сульфатом магния и концентрировали в вакууме. Остаток очищали посредством колоночной хроматографии на силикагеле (н-гексан:этилацетат=7:1 в качестве элюента) с получением указанного в заголовке соединения в виде белого твердого вещества (6,37 г, 52%). 1 Н ЯМР (300 МГц, CDCl3) : 8,06-8,03 (m, 1H), 7,34-7,28 (m, 1H), 7,24-7,17 (m, 1H), 6,93-6,83 (m,2H), 6,79 (s, 1H), 5,44 (d, J=6,61 Гц, 1H), 5,38-5,23 (m, 1H), 4,89-4,79 (m, 1H), 4,34-4,25 (m, 2H), 2,43 (s,3H), 2,37 (s, 3H), 2,29-2,20 (m, 2H), 1,41 (d, J=5,87 Гц, 6 Н) м.д.MC: 380 (M+H)+. Стадия 2. 8-(3,4-Дигидро-2H-хромен-4-иламино)-2,3-диметилимидазо[1,2-a]пиридин-6-карбоновой кислоты гидрохлорид. Смесь изопропил-8-(3,4-дигидро-2H-хромен-4-иламино)-2,3-диметилимидазо[1,2-а]пиридин-6-карбоксилата (2,00 г, 5,27 ммоль, стадия 1), метанола (100 мл) и 2 М раствора гидроксида натрия (14,2 мл) перемешивали при 60 С в течение 5 ч. Реакционную смесь охлаждали и к смеси добавляли воду (50 мл). рН доводили до 3 путем добавления 2 М соляной кислоты. Смесь экстрагировали смесью дихлорметан:метанол=10:1 (50 мл 2) и этилацетатом (30 мл). Объединенный органический слой промывали рассолом, сушили над сульфатом натрия и упаривали в вакууме с получением указанного в заголовке соединения в виде белого твердого вещества (1,70 г, 86%). 1 Н ЯМР (300 МГц, DMSO-d6) : 8,33 (s, 1H), 7,28-7,20 (m, 3H), 7,05-6,94 (m, 1H), 6,92-6,84 (m, 2H), 5,10-4,99MC: 338 (М+Н)+, 336 (М-Н)-. Стадия 3. 8-(3,4-Дигидро-2H-хромен-4-иламино)-N,N,2,3-тетраметилимидазо[1,2-а]пиридин-6-карбоксамид. К перемешиваемой смеси гидрохлорида 8-(3,4-дигидро-2H-хромен-4-иламино)-2,3-диметилимидазо[1,2-а]пиридин-6-карбоновой кислоты (1,00 г, 2,68 ммоль, стадия 2) и диметиламина гидрохлорида (362 мг,4,44 ммоль) в дихлорметане (50 мл) при 0 С добавляли 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (EDCI) (852 мг, 4,44 ммоль), 1-гидроксибензотриазола гидрат (HOBt) (680 мг, 4,44 ммоль) и триэтиламин (1,64 мл). После перемешивания при комнатной температуре в течение ночи реакционную смесь гасили водой (50 мл). Смесь экстрагировали дихлорметаном (50 мл 2) и объединенные экстракты промывали рассолом, сушили над сульфатом натрия и упаривали в вакууме. Остаток очищали колоночной хроматографией на силикагеле, элюируя этилацетатом, с получением указанного в заголовке соединение в виде белого твердого вещества (992 мг, 92%). 1H ЯМР (300 МГц, CDCl3) : 7,44 (d, J=1,32 Гц, 1 Н), 7,34-7,14 (m, 2H), 6,91-6,84 (m, 2H), 6,21 (s, 1H),5,48 (d, J=6,59 Гц, 1 Н), 4,78-4,72 (m, 1H), 4,34-4,22 (m, 2 Н), 3,11 (s, 6H), 2,36 (s, 6 Н), 2,32-2,11 (m, 2 Н) м.д. МС: 365 (М+Н)+. Фракцию-1 (400 мг) и фракцию-2 (418 мг) получали из рацемического 8-(3,4-дигидро-2H-хромен-4-иламино)-N,N,2,3-тетраметилимидазо[1,2-а]пиридин-6-карбоксамида (992 мг) посредством HPLC следующим образом. Условия разделения Колонка: CHIRALPAK AD-H (20 мм в.д.250 мм, DAICEL). Подвижная фаза: н-гексан/этанол/диэтиламин (80/20/0,1). Скорость потока: 18,9 мл/мин.(фракция-1) (пример 1-2). ЯМР: спектральные данные идентичны данным рацемата. Оптическое вращение: []D24=-13,0 (с=1,00, метанол). Время удерживания: 8 мин.(фракция-2) (пример 1-3). ЯМР: спектральные данные идентичны данным рацемата. Оптическое вращение: []D23=+13,4 (с=1,00, метанол). Время удерживания: 11 мин. Пример 2. 8-(3,4-Дигидро-2H-хромен-4-иламино)-N-(2-гидроксиэтил)-N,2,3-триметилимидазо[1,2-a]пиридин 6-карбоксамид (пример 2-1). Указанное в заголовке соединение получали с выходом 86% (1,11 г) из гидрохлорида 8-(3,4-дигидро-2H-хромен-4-иламино)-2,3-диметилимидазо[1,2-а]пиридин-6-карбоновой кислоты (1,10 г, 2,94 ммоль) и 2-(метиламино)этанола (367 мг, 4,89 ммоль) аналогично получению 8-(3,4-дигидро-2H-хромен-4-иламино)-N,N,2,3-тетраметилимидазо[1,2-а]пиридин-6-карбоксамида (стадия 3 примера 1). 1MC: 395 (М+Н)+. Фракцию-1 (511 мг) и фракцию-2 (532 мг) получали из рацемического 8-(3,4-дигидро-2H-хромен-4 иламино)-N-(2-гидроксиэтил)-N,2,3-триметилимидазо[1,2-а]пиридин-6-карбоксамида (1,11 г) посредством HPLC следующим образом. Условия разделения Колонка: CHIRALPAK AD-H (20 мм в.д.250 мм, DAICEL). Подвижная фаза: н-гексан/этанол/диэтиламин (85/15/0,1). Скорость потока: 18,9 мл/мин.(-)-8-(3,4-Дигидро-2H-хромен-4-иламино)-N-(2-гидроксиэтил)-N,2,3-триметилимидазо[1,2-а]пиридин 6-карбоксамид (фракция-1) (пример 2-2). ЯМР: спектральные данные идентичны данным рацемата. Оптическое вращение: []D23=-13,6 (с=1,00, метанол). Время удерживания: 10 мин.(+)-8-(3,4-Дигидро-2H-хромен-4-иламино)-N-(2-гидроксиэтил)-N,2,3-триметилимидазо[1,2-а]пиридин 6-карбоксамид (фракция-2) (пример 2-3). ЯМР: спектральные данные идентичны данным рацемата. Оптическое вращение: []D23=+15,0 (с=1,00, метанол). Время удерживания: 13 мин. Пример 3. 8-(3,4-Дигидро-1H-изохромен-4-иламино)-N,N,2,3-тетраметилимидазо[1,2-а]пиридин-6-карбоксамид(100 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи. После упаривания смеси в вакууме остаток выливали в лед и смесь экстрагировали диэтиловым эфиром (50 мл 2). Объединенные экстракты промывали рассолом, сушили над сульфатом магния и концентрировали в вакууме с получением указанного в заголовке соединение в виде желтого масла (6,55 г, 99%). 1 Н ЯМР (270 МГц, CDCl3) : 7,60-7,40 (m, 1H), 7,40-7,20 (m, 2H), 7,10-6,90 (m, 1H), 5,18-5,08 (m,1H), 4,95-4,72 (m, 2H), 4,35-4,10 (m, 2H) м.д.- 23011512 Стадия 2. Изопропил-8-(3,4-дигидро-1H-изохромен-4-иламино)-2,3-диметилимидазо[1,2-а]пиридин 6-карбоксилат. К суспензии изопропил-8-амино-2,3-диметилимидазо[1,2-а]пиридин-6-карбоксилата (6,40 г, 25,9 ммоль,WO 02/20523), йодида натрия (1,95 г, 13,0 моль) и карбоната калия (7,16 г, 51,8 ммоль) в 2-пропаноле (50 мл) по каплям добавляли раствор 4-хлор-3,4-дигидро-1H-изохромена (4,37 г, 25,9 ммоль, стадия 1) в 2-пропаноле (3,0 мл) при 70 С и реакционную смесь перемешивали при 70 С в течение ночи. К смеси добавляли раствор 4-хлор-3,4-дигидро-1H-изохромена (2,19 г, 13,0 ммоль) в 2-пропаноле (1,0 мл) и реакционную смесь перемешивали при 70 С в течение 24 ч. После охлаждения до комнатной температуры смесь упаривали в вакууме. Остаток обрабатывали водой и экстрагировали дихлорметаном (50 мл 2). Объединенные экстракты промывали рассолом, сушили над сульфатом магния и концентрировали в вакууме. Остаток очищали посредством колоночной хроматографии на силикагеле (н-гексан:этилацетат=7:1-3:1 в качестве элюента) с получением указанного в заголовке соединение в виде желтого твердого вещества (2,04 г, 21%). 1 Н ЯМР (270 МГц, CDCl3) : 8,04 (s, 1 Н), 7,49-7,41 (m, 1H), 7,32-7,16 (m, 2H), 7,07-7,00 (m, 1H), 6,80MC: 380 (M+H)+. Стадия 3. Гидрохлорид 8-(3,4-дигидро-1H-изохромен-4-иламино)-2,3-диметилимидазо[1,2-a]пиридин-6-карбоновой кислоты. Указанное в заголовке соединение получали с количественным выходом (2,05 г) из изопропил-8-(3,4 дигидро-1H-изохромен-4-иламино)-2,3-диметилимидазо[1,2-а]пиридин-6-карбоксилата (2,04 г, 5,38 ммоль,стадия 2) аналогично получению гидрохлорида 8-(3,4-дигидро-2H-хромен-4-иламино)-2,3-диметилимидазо[1,2-a]пиридин-6-карбоновой кислоты (стадия 2 примера 1). 1 Н ЯМР (300 МГц, DMSO-d6) : 8,19 (s, 1H), 7,42-7,08 (m, 4H), 6,97 (br.s, 1H), 6,15-5,89 (m, 1H), 5,04-4,89(m, 1H), 4,89-4,57 (m, 2H), 4,06-3,89 (m, 2H), 2,43 (s, 3H), 2,31 (s, 3H) м.д. (-СО 2 Н и соль HCl не обнаружены). Стадия 4. 8-(3,4-Дигидро-1H-изохромен-4-иламино)-N,N,2,3-тетраметилимидазо[1,2-а]пиридин-6 карбоксамид. Указанное в заголовке соединение получали с выходом 59% (46 мг) из гидрохлорида 8-(3,4-дигидро-1H-изохромен-4-иламино)-2,3-диметилимидазо[1,2-а]пиридин-6-карбоновой кислоты (80 мг, 0,22 ммоль,стадия 3) и диметиламина гидрохлорида (65 мг, 0,36 ммоль) аналогично получению 8-(3,4-дигидро-2Hхромен-4-иламино)-N,N,2,3-тетраметилимидазо[1,2-a]пиридин-6-карбоксамида (стадия 3 примера 1). 1 Н ЯМР (270 МГц, DMSO-d6) : 7,61 (s, 1 Н), 7,43-7,03 (m, 4H), 6,40 (s, 1H), 5,69 (d, J=9,99 Гц, 1H),5,07-4,88 (m, 1H), 4,88-4,61 (m, 2H), 4,09-3,83 (m, 2H), 2,98 (s, 6H), 2,34 (s, 3H), 2,24 (s, 3H) м.д.MC: 365 (M+H)+. Фракцию-1 (6,4 мг) и фракцию-2 (9,3 мг) получали из рацемического 8-(3,4-дигидро-1H-изохромен 4-иламино)-N,N,2,3-тетраметилимидазо[1,2-а]пиридин-6-карбоксамида (21 мг) посредством HPLC следующим образом. Условия разделения Колонка: CHIRALPAK AD-H (20 мм в.д.250 мм, DAICEL). Подвижная фаза: н-гексан/этанол/диэтиламин (85/15/0,1). Скорость потока: 18,9 мл/мин.(фракция-1) (пример 3-2). ЯМР: спектральные данные идентичны данным рацемата. Оптическое вращение: []D24=-19,4 (с=1,00, метанол). Время удерживания: 14 мин.(фракция-2) (пример 3-3). ЯМР: спектральные данные идентичны данным рацемата. Оптическое вращение: []D24=+20,4 (с=1,00, метанол). Время удерживания: 19 мин. Пример 4. 8-(3,4-Дигидро-1H-изохромен-4-иламино)-N-(2-гидроксиэтил)-N,2,3-триметилимидазо[1,2-a]пиридин 6-карбоксамид (пример 4-1).- 24011512 Смесь изопропил-8-(3,4-дигидро-1H-изохромен-4-иламино)-2,3-диметилимидазо[1,2-а]пиридин-6 карбоксилата (270 мг, 0,71 ммоль, стадия 2 примера 3), 2-(метиламино)этанола (530 мг, 7,1 ммоль) и цианида натрия (2,0 мг, 0,04 ммоль) кипятили с обратным холодильником в тетрагидрофуране (2,0 мл) в течение 14 ч. После охлаждения до комнатной температуры растворитель выпаривали в вакууме. Остаток очищали посредством колоночной хроматографии на NH-геле (от дихлорметана до смеси дихлорметан:метанол=40:1 в качестве элюента) с получением указанного в заголовке соединения в виде белого твердого вещества (100 мг, 37%). 1 Н ЯМР (300 МГц, CDCl3) : 7,55-7,49 (m, 1H), 7,44 (d, J=6,60 Гц, 1H), 7,34-7,16 (m, 3H), 7,04 (d,J=6,60 Гц, 1H), 6,28 (br.s, 1H), 5,65-5,42 (m, 1H), 4,94-4,69 (m, 3H), 4,10-4,01 (m, 2H), 3,97-3,82 (m, 2H),3,80-3,61 (m, 2H), 3,14 (s, 3H), 2,36 (s, 6H) м.д.MC: 395 (M+H)+. Фракцию-1 (22 мг) и фракцию-2 (20 мг) получали из рацемического 8-(3,4-дигидро-1H-изохромен 4-иламино)-N-(2-гидроксиэтил)-N,2,3-триметилимидазо[1,2-а]пиридин-6-карбоксамида (63 мг) посредством HPLC следующим образом. Условия разделения Колонка: CHIRALPAK AD-H (20 мм в.д.250 мм, DAICEL). Подвижная фаза: н-гексан/этанол/диэтиламин (80/20/0,1). Скорость потока: 18,9 мл/мин.(-)-8-(3,4-Дигидро-1H-изохромен-4-иламино)-N-(2-гидроксиэтил)-N,2,3-триметилимидазо[1,2-a]пиридин-6-карбоксамид (фракция-1) (пример 4-2). ЯМР: спектральные данные идентичны данным рацемата. Оптическое вращение: []D23=-39,8 (с=1,00, метанол). Время удерживания: 11 мин.(+)-8-(3,4-Дигидро-1H-изохромен-4-иламино)-N-(2-гидроксиэтил)-N,2,3-триметилимидазо[1,2-а]пиридин-6-карбоксамид (фракция-2) (пример 4-3). ЯМР: спектральные данные идентичны данным рацемата. Оптическое вращение: []D24=+40,8 (с=1,00, метанол). Время удерживания: 12 мин. Пример 5.(30 мл). Реакционную смесь перемешивали при комнатной температуре в течение 8 ч. После упаривания смеси в вакууме остаток выливали в лед и смесь экстрагировали этилацетатом (50 мл 2). Объединенные экстракты промывали рассолом, сушили над сульфатом магния и концентрировали в вакууме с получением указанного в заголовке соединение в виде желтого масла (3,2 г, количественный выход). 1 Н ЯМР (300 МГц, CDCl3) : 7,21-7,04 (m, 1H), 6,86-6,62 (m, 2H), 5,36-5,17 (m, 1H), 4,59-4,43 (m,1H), 4,43-4,30 (m, 1H), 2,41 (s, 3H), 2,57-2,24 (m, 2H) м.д. Стадия 2. Метил-2,3-диметил-8-[(5-метил-3,4-дигидро-2H-хромен-4-ил)амино]имидазо[1,2-а]пиридин 6-карбоксилат. Смесь 4-хлор-5-метилхромана (3,2 г, 16 ммоль, стадия 1), метил-8-амино-2,3-диметилимидазо[1,2-а] пиридин-6-карбоксилата (2,4 г, 11 ммоль, WO 02/020523), йодида натрия (0,83 г, 5,5 моль) и карбоната калия (5,3 г, 38 ммоль) в ацетоне (100 мл) перемешивали при кипячении с обратным холодильником в течение 2 суток. После охлаждения до комнатной температуры смесь гасили водой (50 мл) и экстрагировали дихлорметаном (100 мл 2). Объединенные экстракты промывали рассолом, сушили над сульфатом магния и концентрировали в вакууме. Остаток очищали посредством колоночной хроматографии на силикагеле (н-гексан:этилацетат=5:1 в качестве элюента) с получением указанного в заголовке соединение в виде белого твердого вещества (3,0 г, 74%). 1 Н ЯМР (300 МГц, CDCl3) : 8,09 (s, 1 Н), 7,18-7,06 (m, 1H), 6,83-6,68 (m, 3H), 5,36-5,25 (m, 1H), 4,794,68 (m, 1H), 4,32-4,17 (m, 2H), 3,96 (s, 3H), 2,41 (s, 3H), 2,36 (s, 3H), 2,22 (s, 3H), 2,48-1,98 (m, 2 Н) м.д.- 25011512 Стадия 3. 2,3-Диметил-8-[(5-метил-3,4-дигидро-2H-хромен-4-ил)амино]имидазо[1,2-а]пиридин-6 карбоновая кислота. К смеси метил-2,3-диметил-8-[(5-метил-3,4-дигидро-2H-хромен-4-ил)амино]имидазо[1,2-а]пиридин 6-карбоксилата (3,0 г, 8,2 ммоль, стадия 2) в метаноле (30 мл) и тетрагидрофуране (15 мл) добавляли 2 М раствор гидроксида натрия (12 мл) и реакционную смесь перемешивали при 50 С в течение 2 ч. После охлаждения до комнатной температуры смесь упаривали в вакууме. Остаток обрабатывали водой (10 мл) и рН доводили до значения 6 путем добавления 2 М соляной кислоты. Осадок собирали фильтрацией и промывали водой (5 мл), ацетоном (5 мл) и сушили с получением указанного в заголовке соединения в виде белого твердого вещества (3,6 г, количественный выход). 1 Н ЯМР (300 МГц, DMSO-d6) : 8,08 (s, 1H), 7,21-7,03 (m, 1H), 6,83-6,64 (m, 3H), 5,56 (d, J=7,34 Гц,1H), 4,86-4,73 (m, 1H), 4,31-4,01 (m, 2H), 2,39 (s, 3H), 2,25 (s, 3H), 2,14 (s, 3H), 2,45-1,86 (m, 2H) м.д. (-CO2H не обнаружен).(EDCI) (2,9 г, 15 ммоль) и 1-гидроксибензотриазола гидрат (HOBt) (2,1 г, 15 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь гасили насыщенным гидрокарбонатом натрия (30 мл). Смесь экстрагировали дихлорметаном (50 мл 2) и объединенные экстракты промывали рассолом, сушили над сульфатом натрия и упаривали в вакууме. Остаток очищали посредством колоночной хроматографии на силикагеле (дихлорметан:метанол=30:1 в качестве элюента) с получением указанного в заголовке соединения в виде белого твердого вещества (2,0 г, 63%). 1 Н ЯМР (270 МГц, CDCl3) : 7,52 (s, 1H), 7,17-7,06 (m, 1H), 6,82-6,65 (m, 2H), 6,30 (s, 1H), 5,38 (d,J=5,93 Гц, 1H), 4,73-4,59 (m, 1H), 4,34-4,15 (m, 2H), 4,03-3,84 (m, 2H), 3,84-3,62 (m, 2H), 3,18 (s, 3H), 2,36MC: 409 (M+H)+. ИК (KBr)макс: 3443, 1616, 1557, 1407, 1254,1095, 1056, 783, 748 см-1. Фракцию-1 (72 мг) и фракцию-2 (70 мг) получали из рацемического N-(2-гидроксиэтил)-N,2,3-триметил-8-[(5-метил-3,4-дигидро-2H-хромен-4-ил)амино]имидазо[1,2-а]пиридин-6-карбоксамида (180 мг) посредством HPLC следующим образом. Условия разделения Колонка: CHIRALPAK OD-H (20 мм в.д.250 мм, DAICEL). Подвижная фаза: н-гексан/этанол/диэтиламин (90/10/0,1). Скорость потока: 18,9 мл/мин.[1,2-а]пиридин-6-карбоксамид (фракция-1) (пример 5-2). ЯМР: спектральные данные идентичны данным рацемата. Оптическое вращение: []D24=-6,2 (с=1,00, метанол). Время удерживания: 11 мин. Абсолютную конфигурацию соединения из примера 5-2 определили как (S)-форму посредством рентгеновского анализа монокристалла.[1,2-а]пиридин-6-карбоксамид (фракция-2) (пример 5-3). ЯМР: спектральные данные идентичны данным рацемата. Оптическое вращение: []D24=+5,8 (с=1,00, метанол). Время удерживания: 13 мин. Абсолютную конфигурацию соединения примера 5-3 определили как (R)-форма путем рентгеновского анализа монокристалла. Следующие примеры 6-19 получали в соответствии с методиками, описанными в стадиях 1-3 примера 1. 1 Н-ЯМР измеряли с использованием CDCl3.
МПК / Метки
МПК: A61K 31/437, C07D 471/04, A61P 1/04
Метки: производные, качестве, кислотной, антагонистов, полезные, помпы, хромана
Код ссылки
<a href="https://eas.patents.su/30-11512-proizvodnye-hromana-poleznye-v-kachestve-antagonistov-kislotnojj-pompy.html" rel="bookmark" title="База патентов Евразийского Союза">Производные хромана , полезные в качестве антагонистов кислотной помпы</a>
Предыдущий патент: Полиэтиленовая композиция (варианты), ее применение, способ ее получения и изделие, содержащее композицию
Следующий патент: Фунгицидные смеси
Случайный патент: Устройство для защиты пешехода при лобовом столкновении с автомобилем