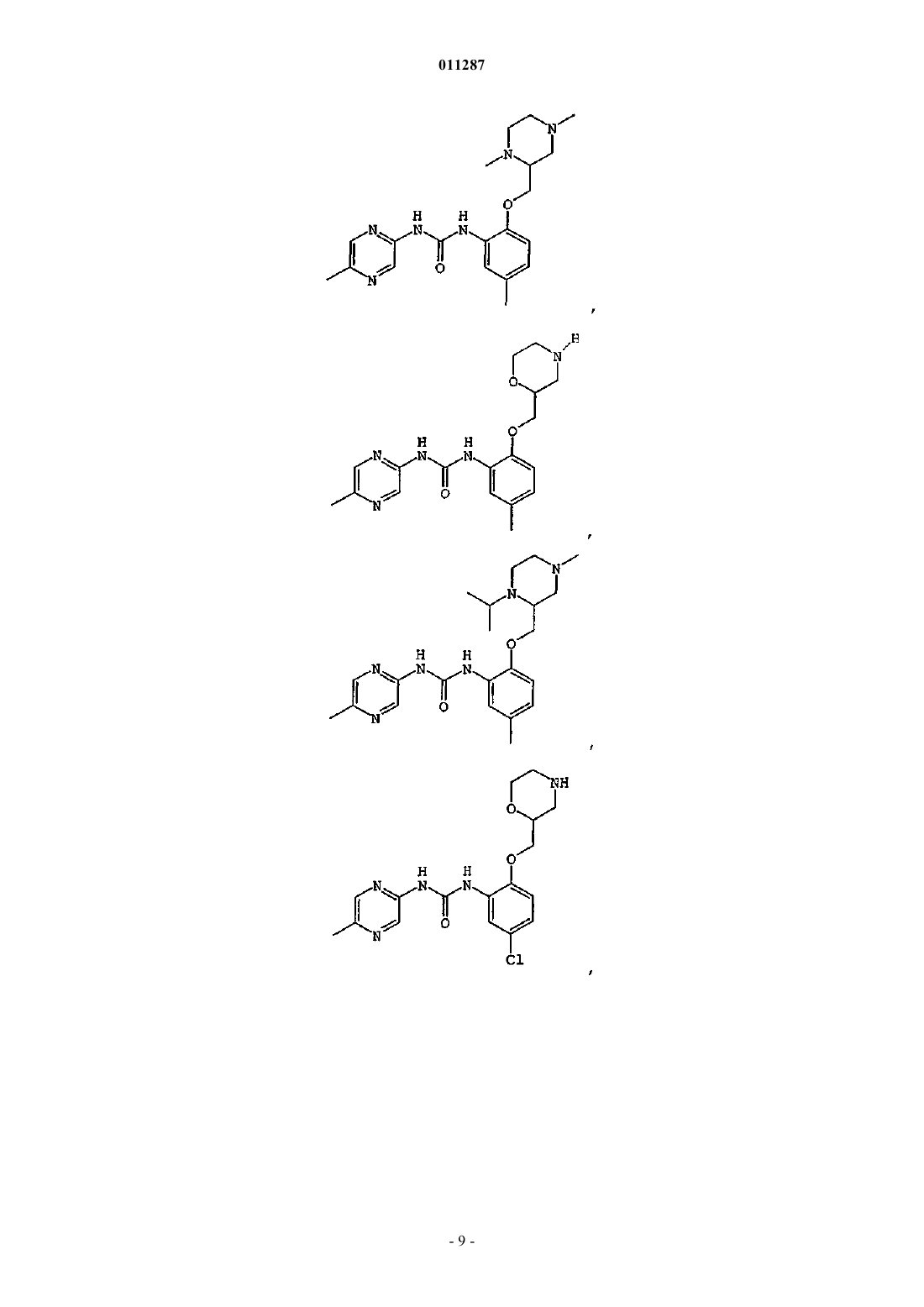
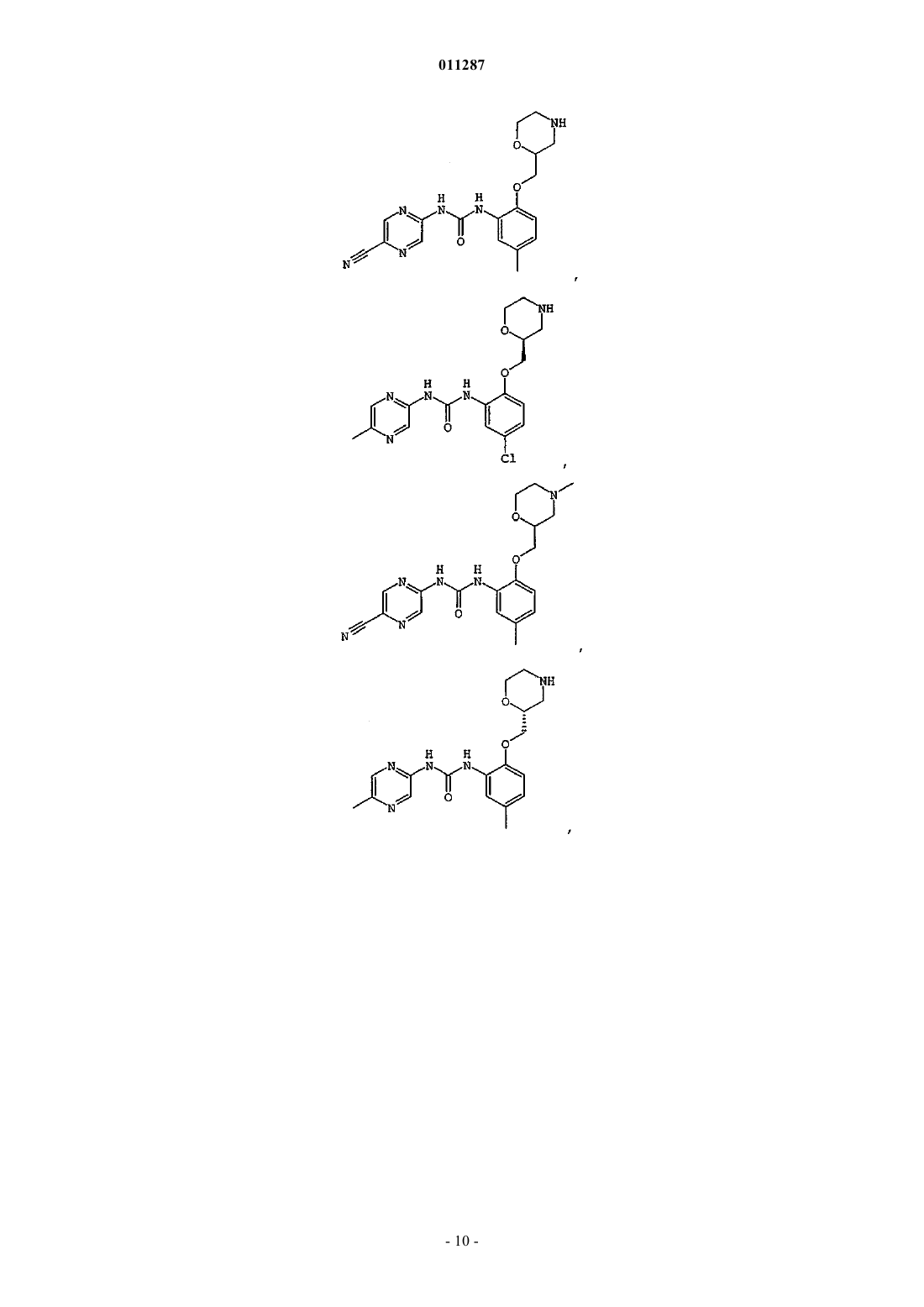
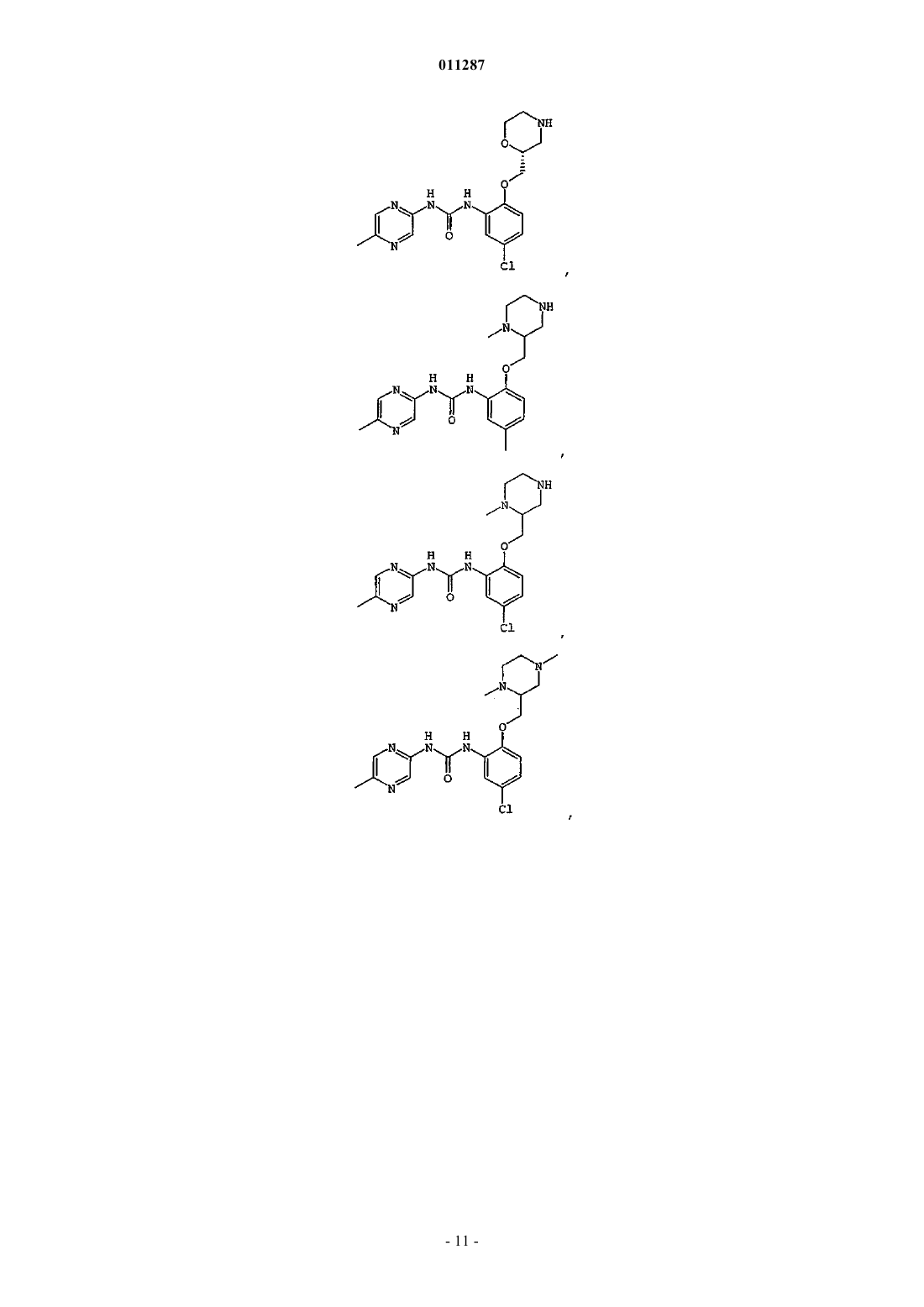
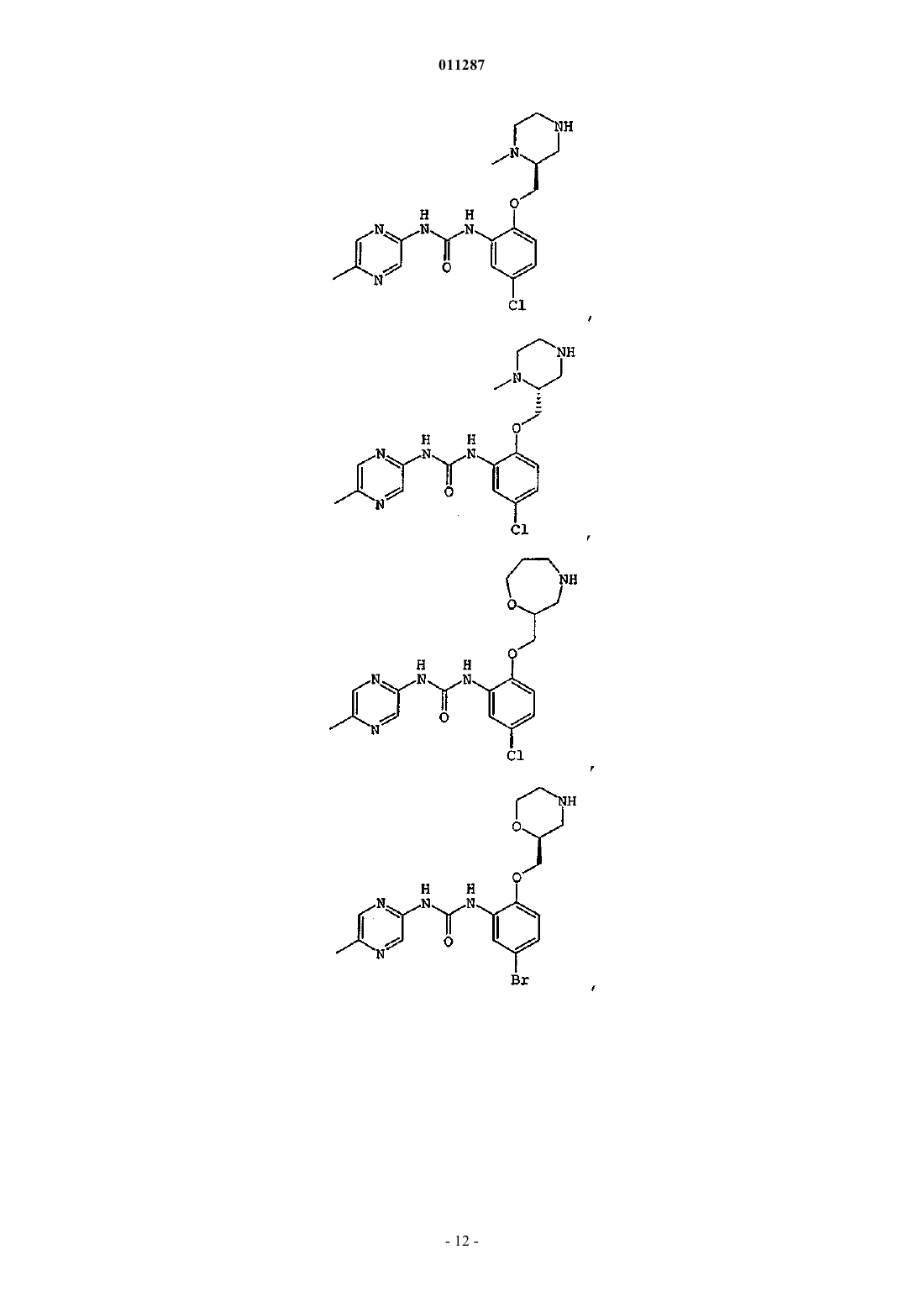
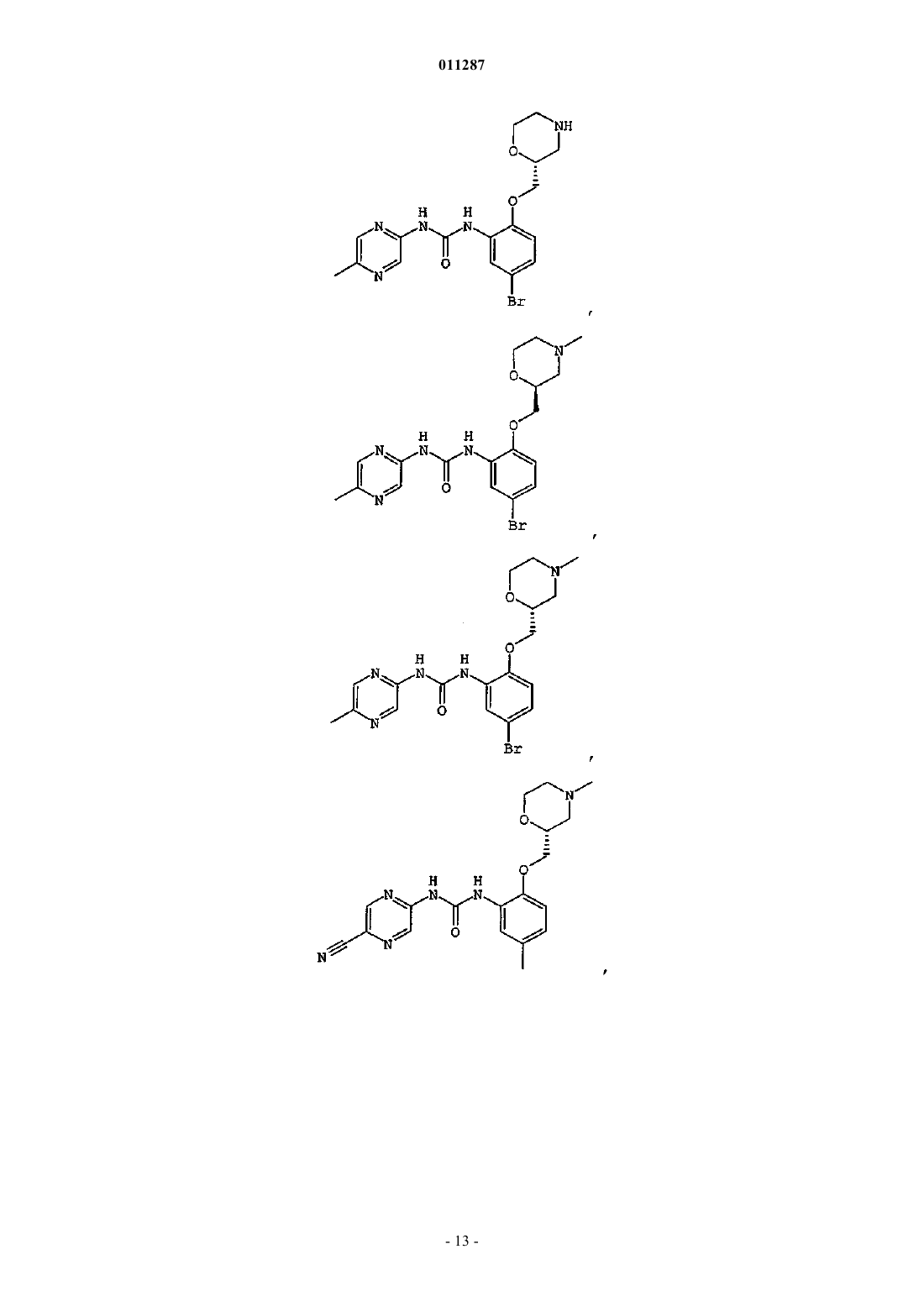
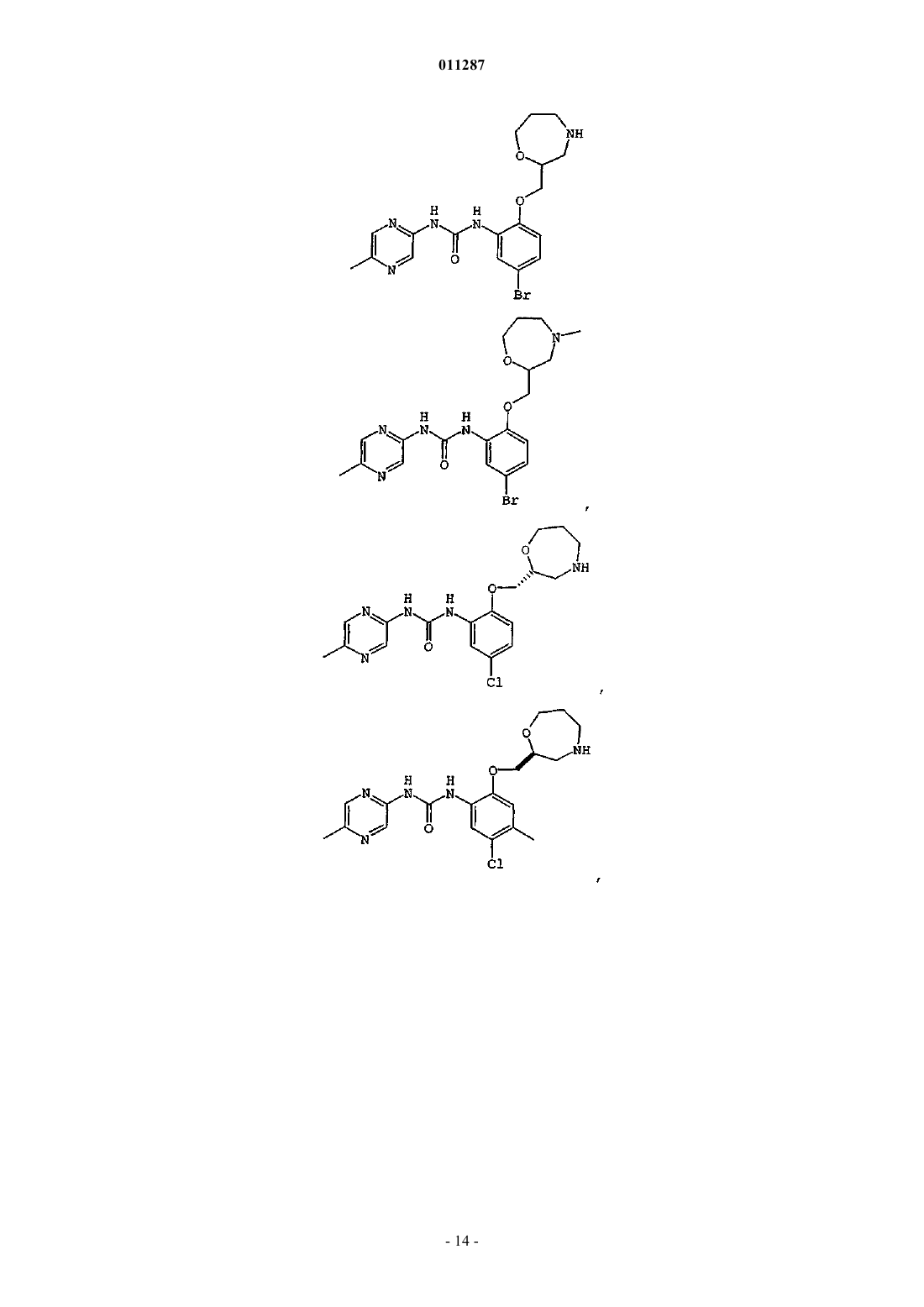
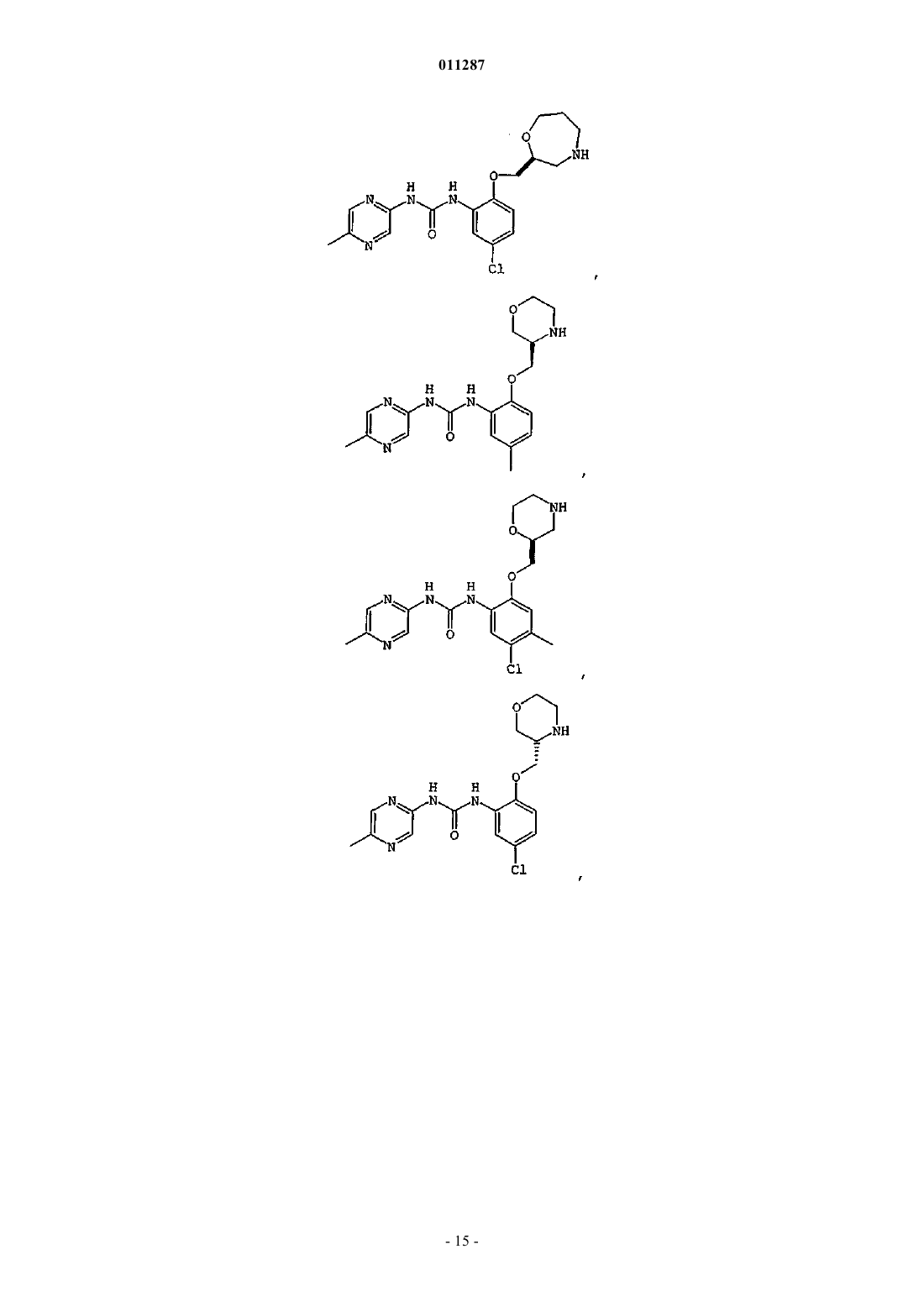
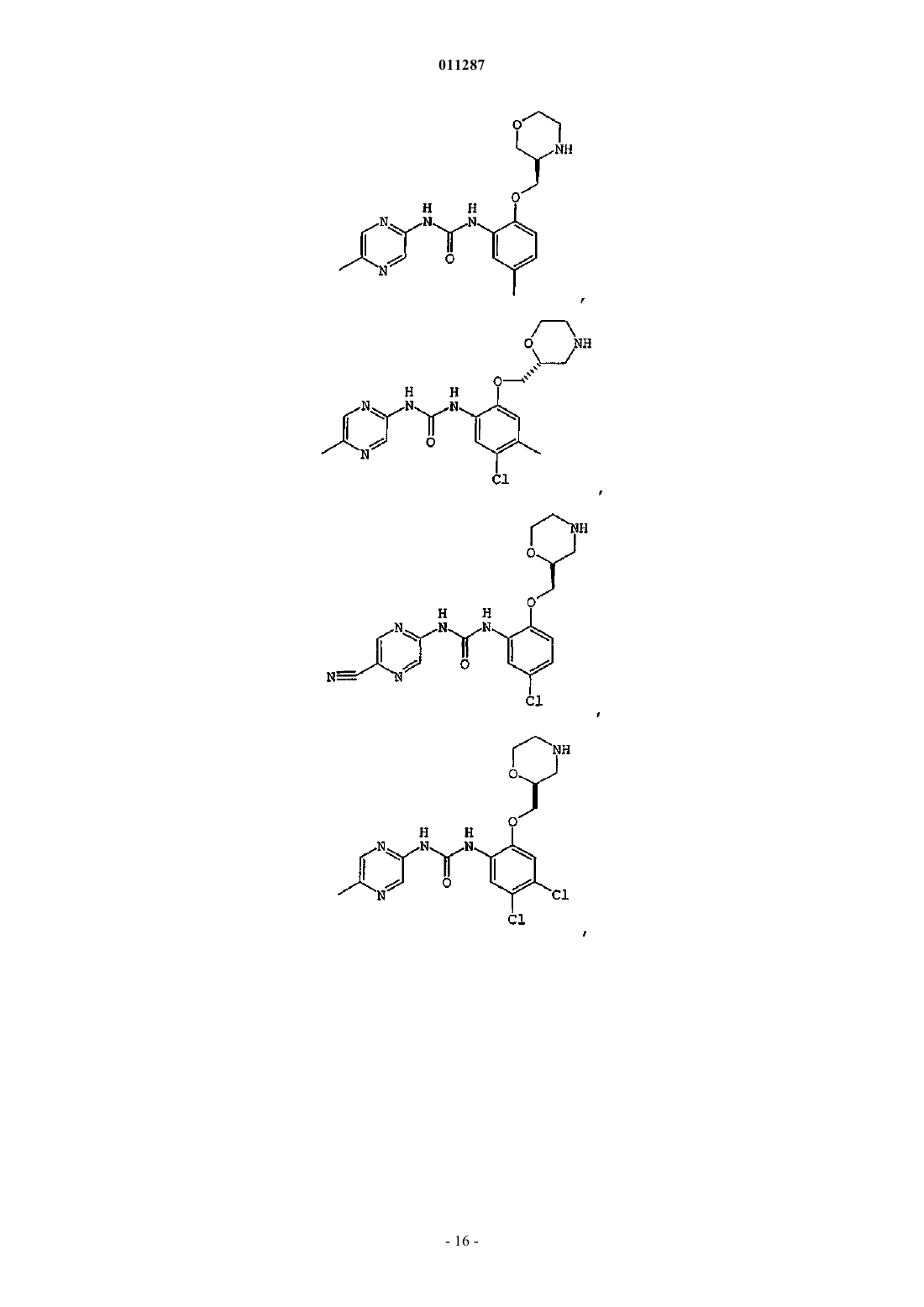
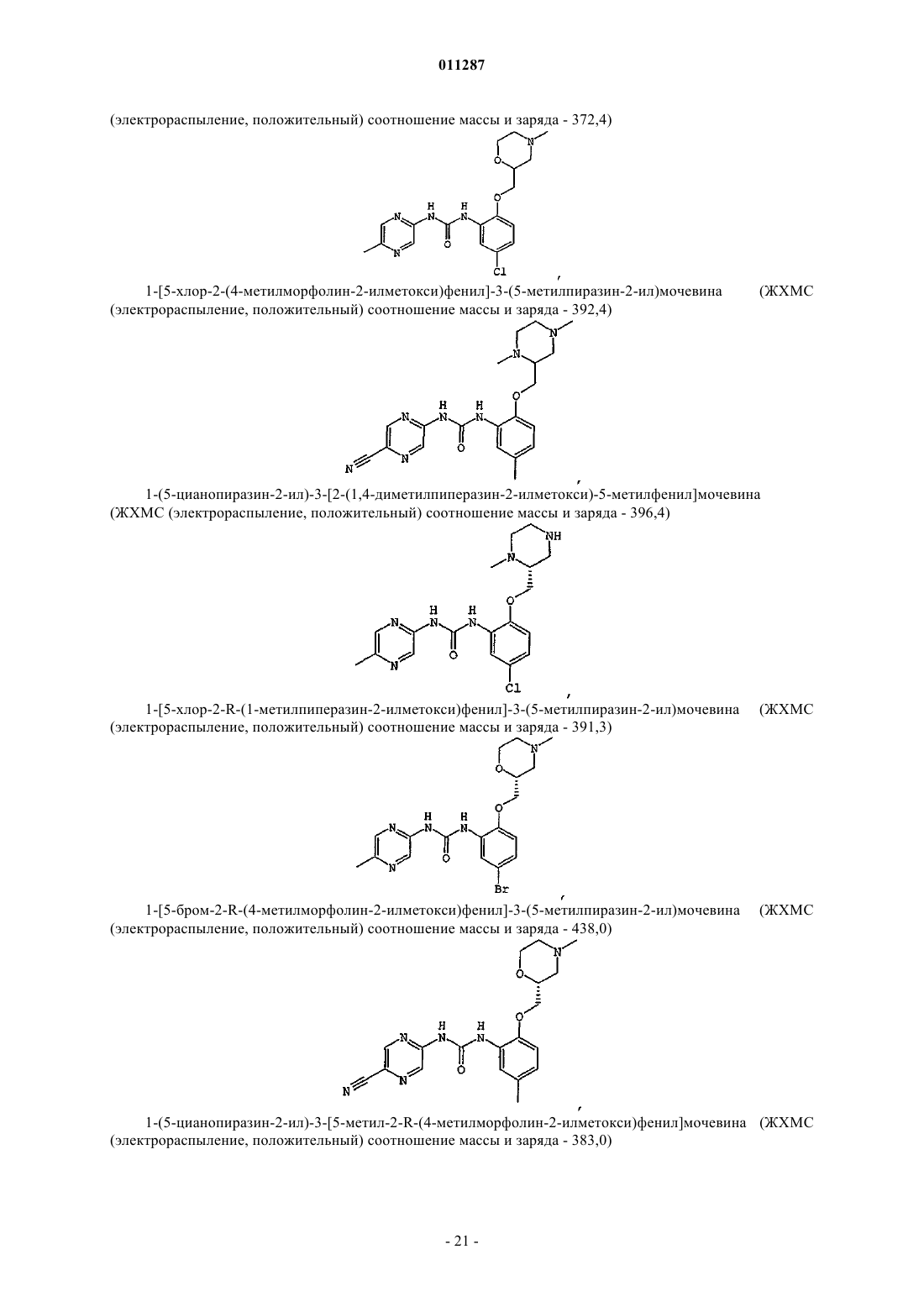
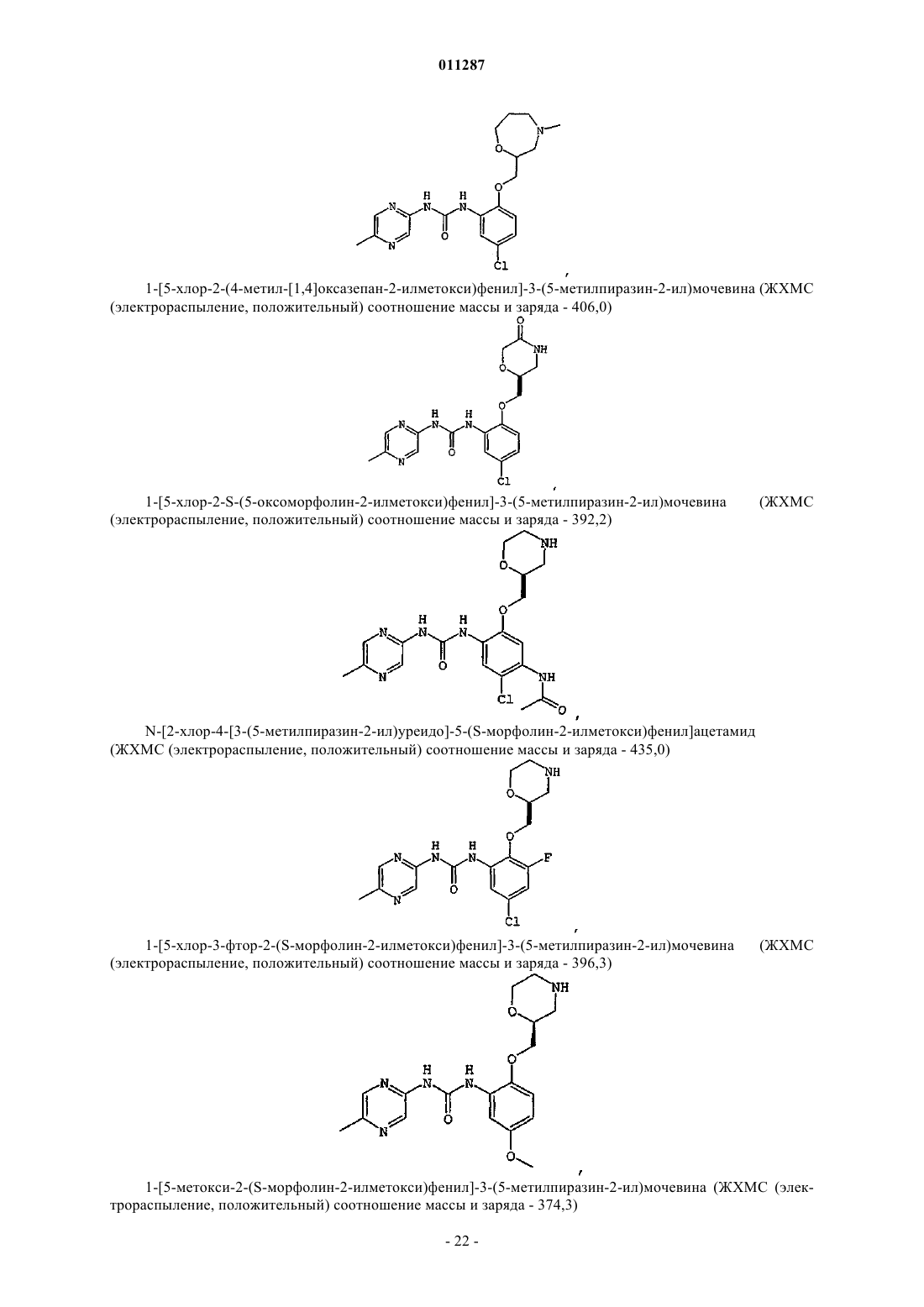
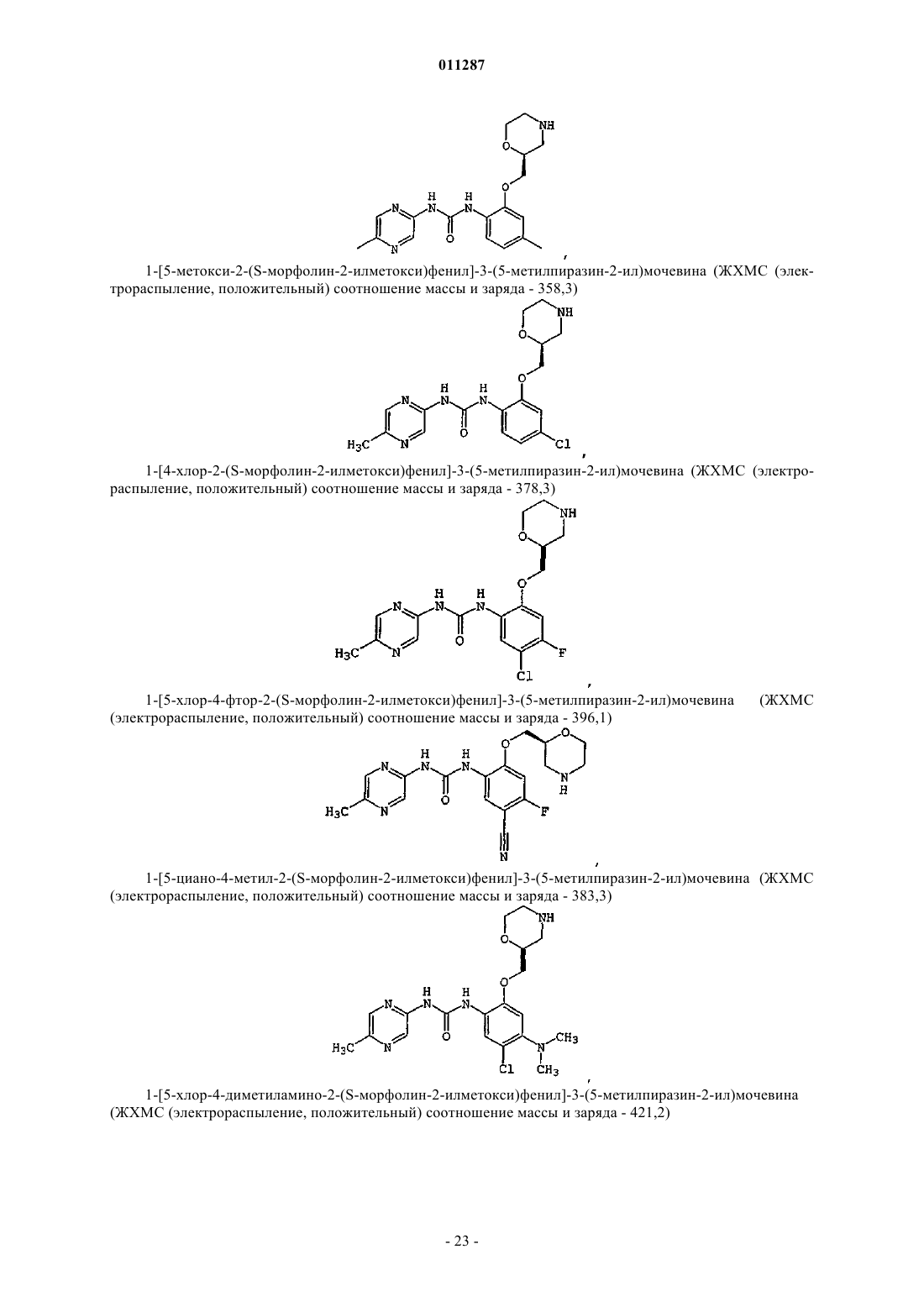
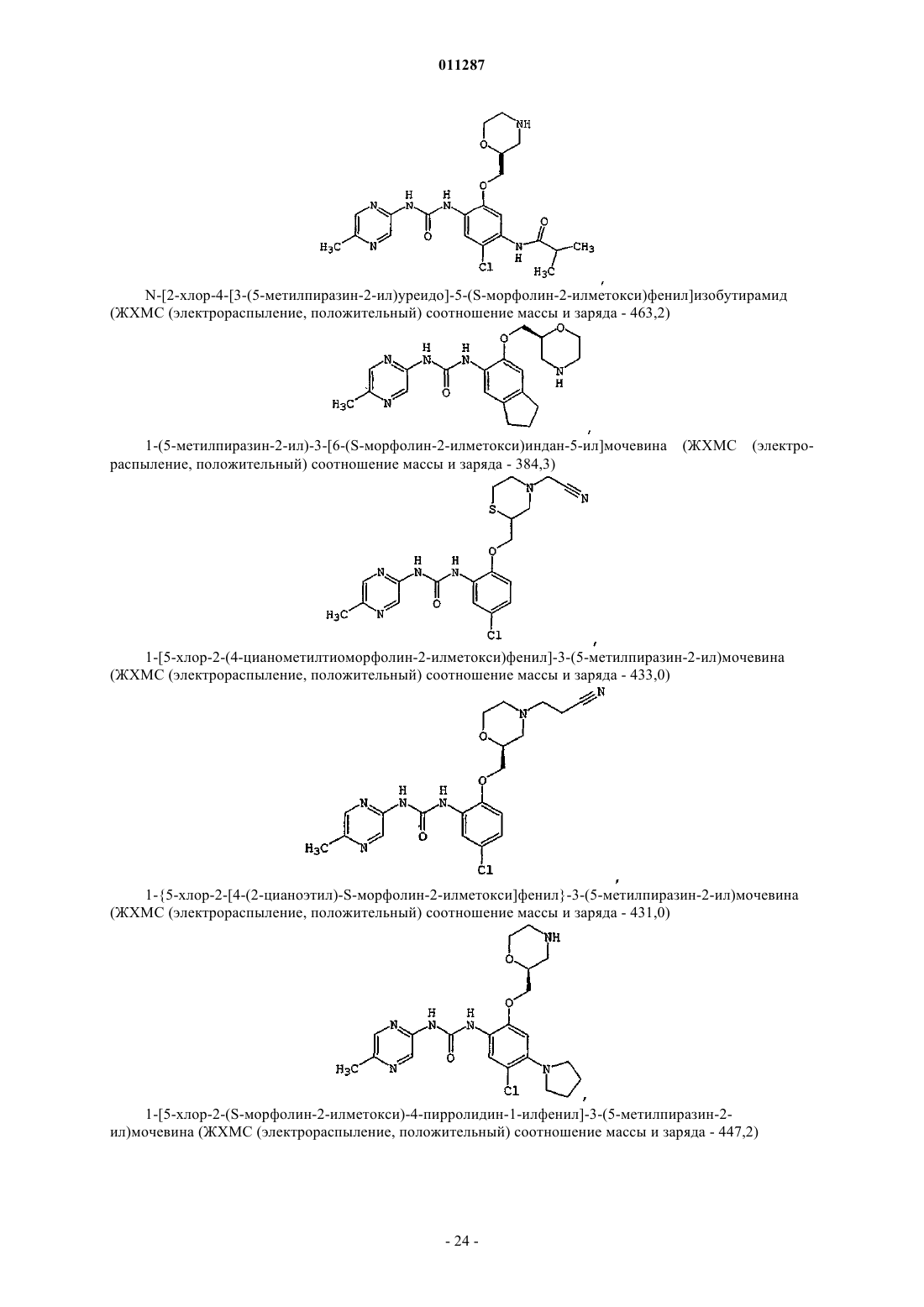
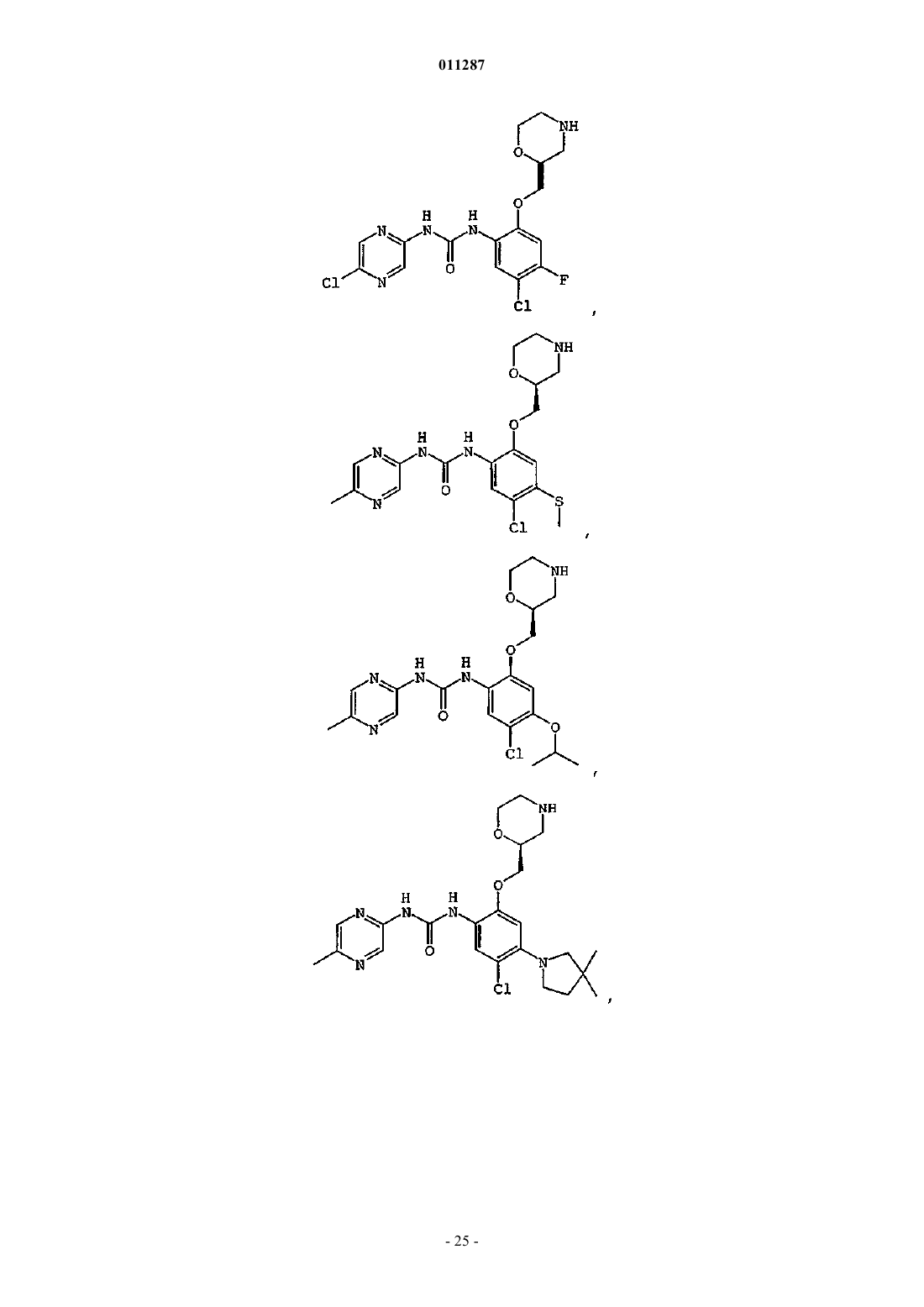
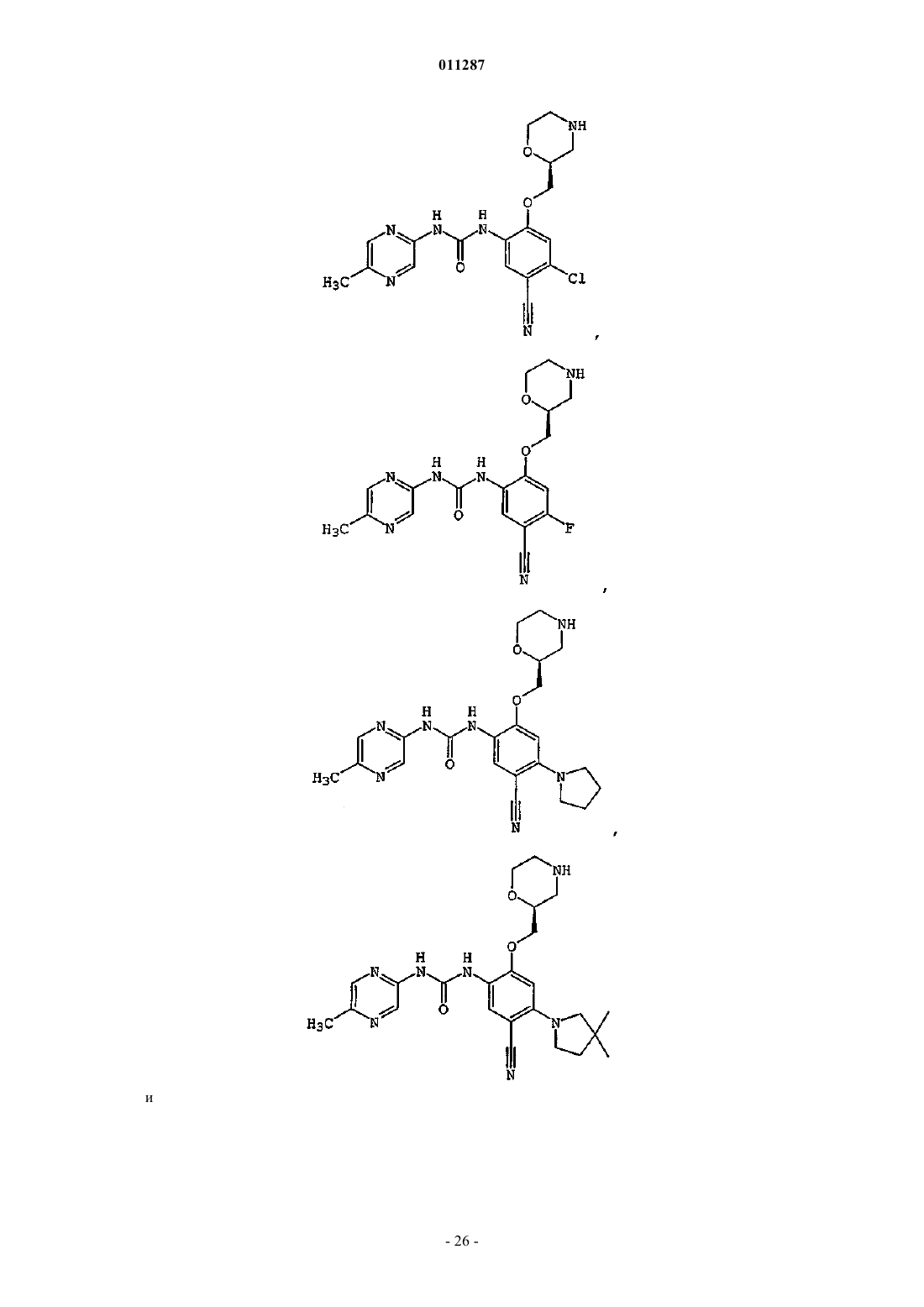
Производные гетероарилмочевины, пригодные для ингибирования chk1
Номер патента: 11287
Опубликовано: 27.02.2009
Авторы: Рудольф Александер, Оои Хуа Чее, Стэппенбек Фрэнк, Диаз Фрэнк, Фару Франсин С., Кейсики Эдвард А., Торсетт Юджин, Кук Адам Уэйд, Холкоум Райан, Гаудино Джон Джозеф, Фишер Кимба Л.
Формула / Реферат
1. Соединение, представляющее собой
1-[5-хлор-2-S-([1,4]оксазепан-2-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевину,
1-[5-хлор-2-([1,4]оксазепан-2-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевину,
1-[5-хлор-2-R-([1,4]оксазепан-2-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевину,
1-[5-хлор-4-метил-2-S-([1,4]оксазепан-2-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевину,
1-[5-бром-2-([1,4]оксазепан-2-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевину,
1-[5-бром-2-(4-метил-[1,4]оксазепан-2-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевину,
или его фармацевтически приемлемая соль.
2. Соединение, представляющее собой
1-[2-(1,4-диметилпиперазин-2-илметокси)-5-метилфенил]-3-(5-метилпиразин-2-ил)мочевину,
1-[5-метил-2-(1-метилпиперазин-2-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевину,
1-[5-хлор-2-(1-метилпиперазин-2-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевину,
1-[5-хлор-2-S-(1-метилпиперазин-2-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевину,
или его фармацевтически приемлемая соль.
3. Соединение, представляющее собой
1-(5-цианопиразин-2-ил)-3-[5-метил-2-(4-метилморфолин-2-илметокси)фенил]мочевину,
1-[5-бpoм-2-S-(4-метилморфолин-2-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевину,
1-[5-хлор-2-S-(4-цианометилморфолин-2-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевину,
1-[5-хлор-2-S-(4-метилморфолин-2-илметокси)фенил]-3-(5-цианопиразин-2-ил)мочевину,
1-[5-хлор-2-(S-4-метилморфолин-2-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевину,
или его фармацевтически приемлемая соль.
4. Соединение, представляющее собой
1-[5-хлор-2-(R-морфолин-3-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевину,
1-[4,5-дихлор-2-(S-морфолин-2-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевину,
1-(5-цианопиразин-2-ил)-3-[5-метил-2-(морфолин-2-илметокси)фенил]мочевину,
1-[5-хлор-4-метил-2-(S-морфолин-2-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевину,
1-[5-хлор-4-метил-2-(R-морфолин-2-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевину,
1-[4,5-дихлор-2-(R-морфолин-2-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевину,
1-[4,5-диметил-2-(морфолин-2-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевину,
1-[4-хлор-5-метил-2-(S-морфолин-2-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевину,
1-[5-циано-2-(S-морфолин-2-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевину,
1-[5-хлор-4-этил-2-(S-морфолин-2-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевину,
1-[5-хлор-4-метокси-2-(S-морфолин-2-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевину,
1-[5-диметиламино-2-(S-морфолин-2-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевину,
1-[5-метил-2-(морфолин-2-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевину,
1-[5-хлор-2-(морфолин-2-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевину,
1-[5-хлор-2-(S-морфолин-2-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевину,
1-[5-метил-2-(S-морфолин-2-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевину,
1-[5-хлор-2-(R-морфолин-2-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевину,
1-[5-бром-2-(S-морфолин-2-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевину,
1-[5-бром-2-R-(R-морфолин-2-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевину,
1-(5-метилпиразин-2-ил)-3-[3-S-(морфолин-2-илметокси)-5,6,7,8-тетрагидронафталин-2-ил]мочевину,
1-[5-хлор-2-S-(морфолин-3-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевину,
1-[5-метил-2-R-(морфолин-3-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевину,
1-[5-хлор-2-S-(морфолин-2-илметокси)фенил]-3-(5-трифторметилпиразин-2-ил)мочевину,
1-[4-хлор-5-метил-2-S-(морфолин-2-илметокси)фенил]-3-(5-цианопиразин-2-ил)мочевину,
1-[5-хлор-4-метокси-2-(S-морфолин-2-илметокси)фенил]-3-(5-цианопиразин-2-ил)мочевину,
1-[5-хлор-2-S-(морфолин-3-илметокси)фенил]-3-(5-цианопиразин-2-ил)мочевину,
или его фармацевтически приемлемая соль.
5. Соединение, представляющее собой 1-[5-бром-4-метил-2-S-(морфолин-2-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевину, или его фармацевтически приемлемая соль.
6. Соединение, представляющее собой 1-[5-хлор-2-(тиоморфолин-2-илметокси)фенил]-3-(5-метилпиразин-2-ил)мочевину, или его фармацевтически приемлемая соль.
7. Фармацевтическая композиция, включающая соединение по любому из пп.1-6 или его фармацевтически приемлемую соль и фармацевтически приемлемый разбавитель или носитель.
8. Применение соединения по любому из пп.1-6 или его фармацевтически приемлемой соли в терапии.
9. Применение соединения по любому из пп.1-6 или его фармацевтически приемлемой соли для лечения рака ободочной и прямой кишки, рака головы и шеи, рака поджелудочной железы, рака молочной железы, рака желудка, рака мочевого пузыря, рака вульвы, лейкоза, лимфомы, меланомы, почечно-клеточной карциномы, рака яичника, рака мозга, остеосаркомы или рака легкого.
Текст
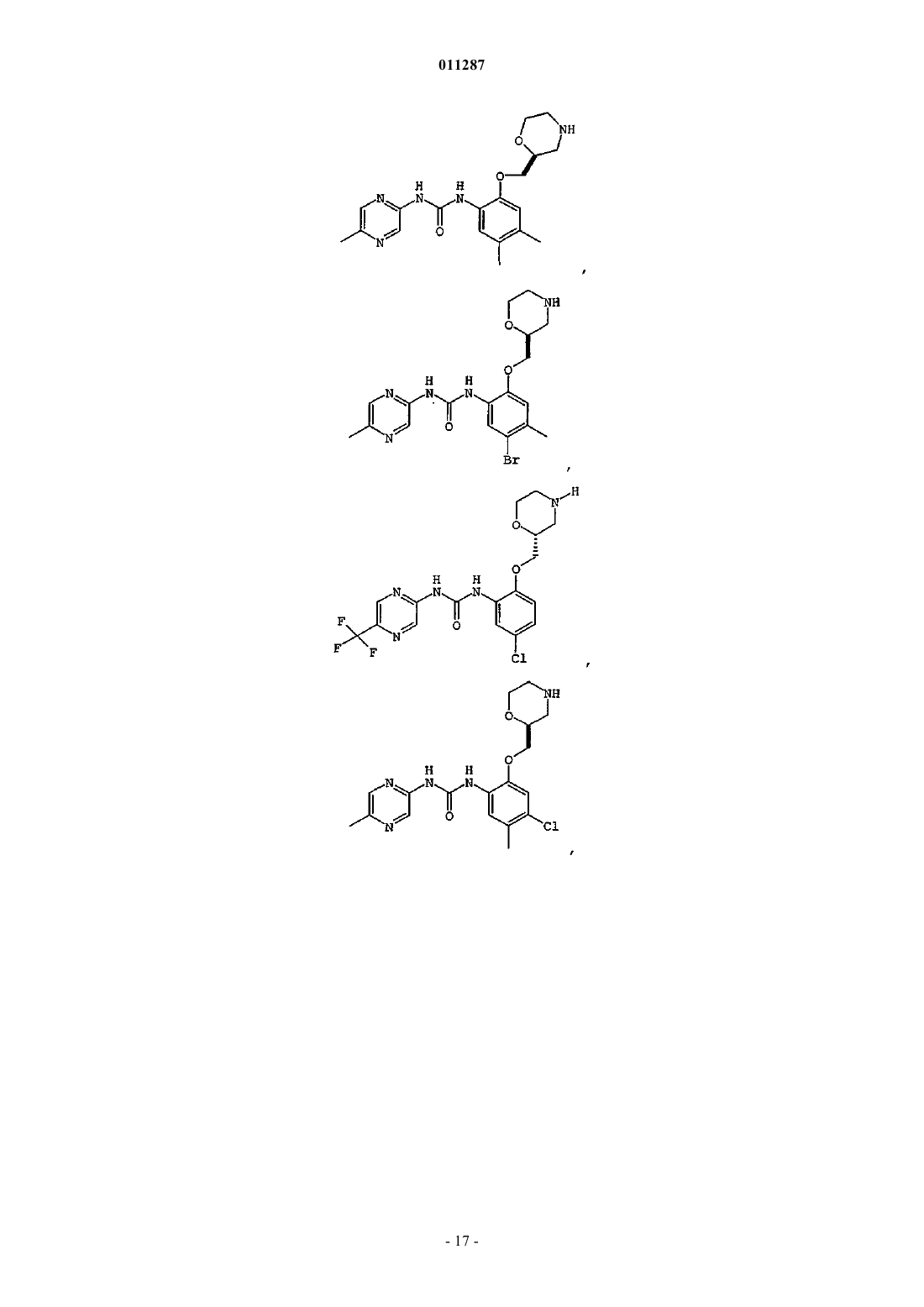
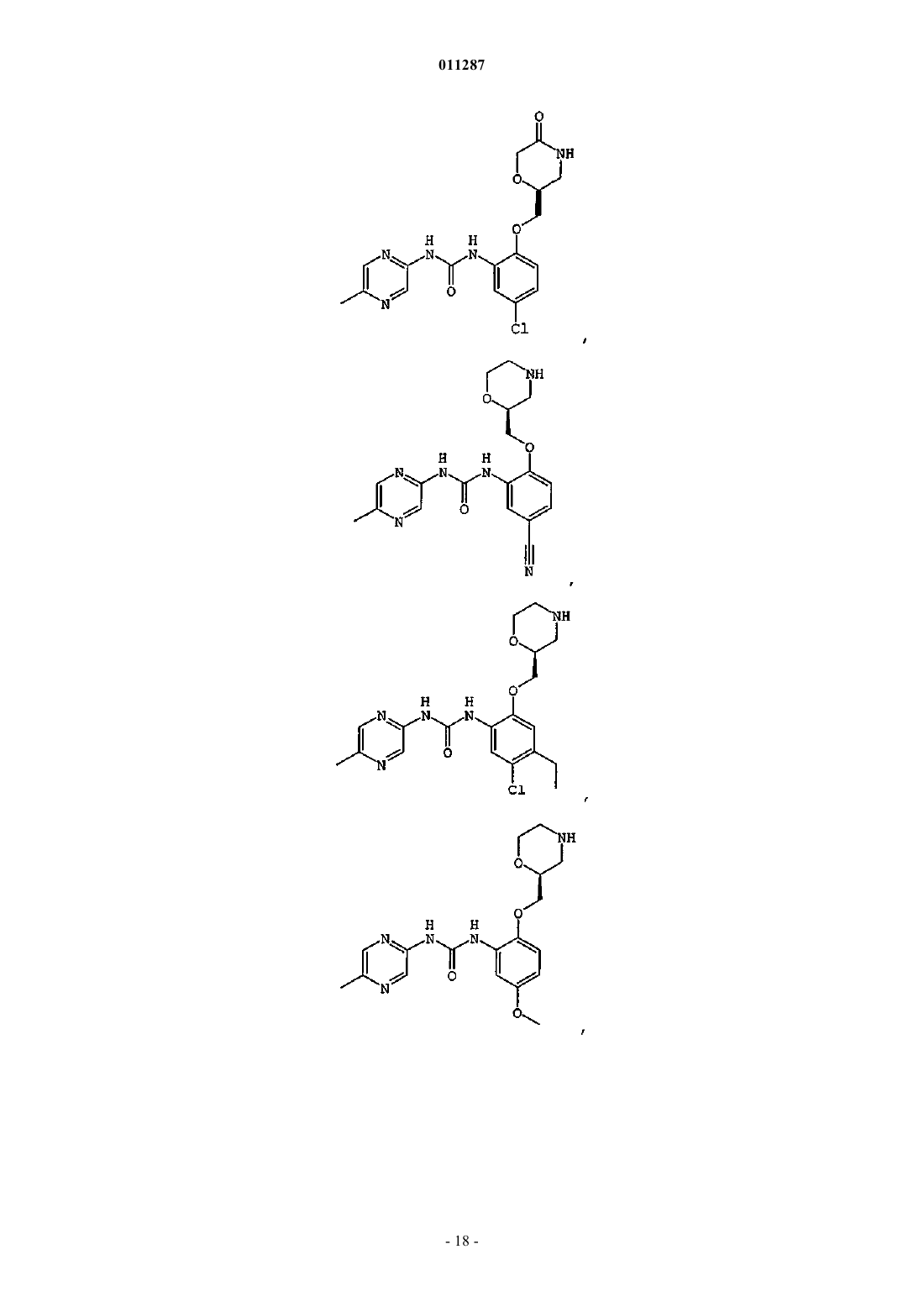
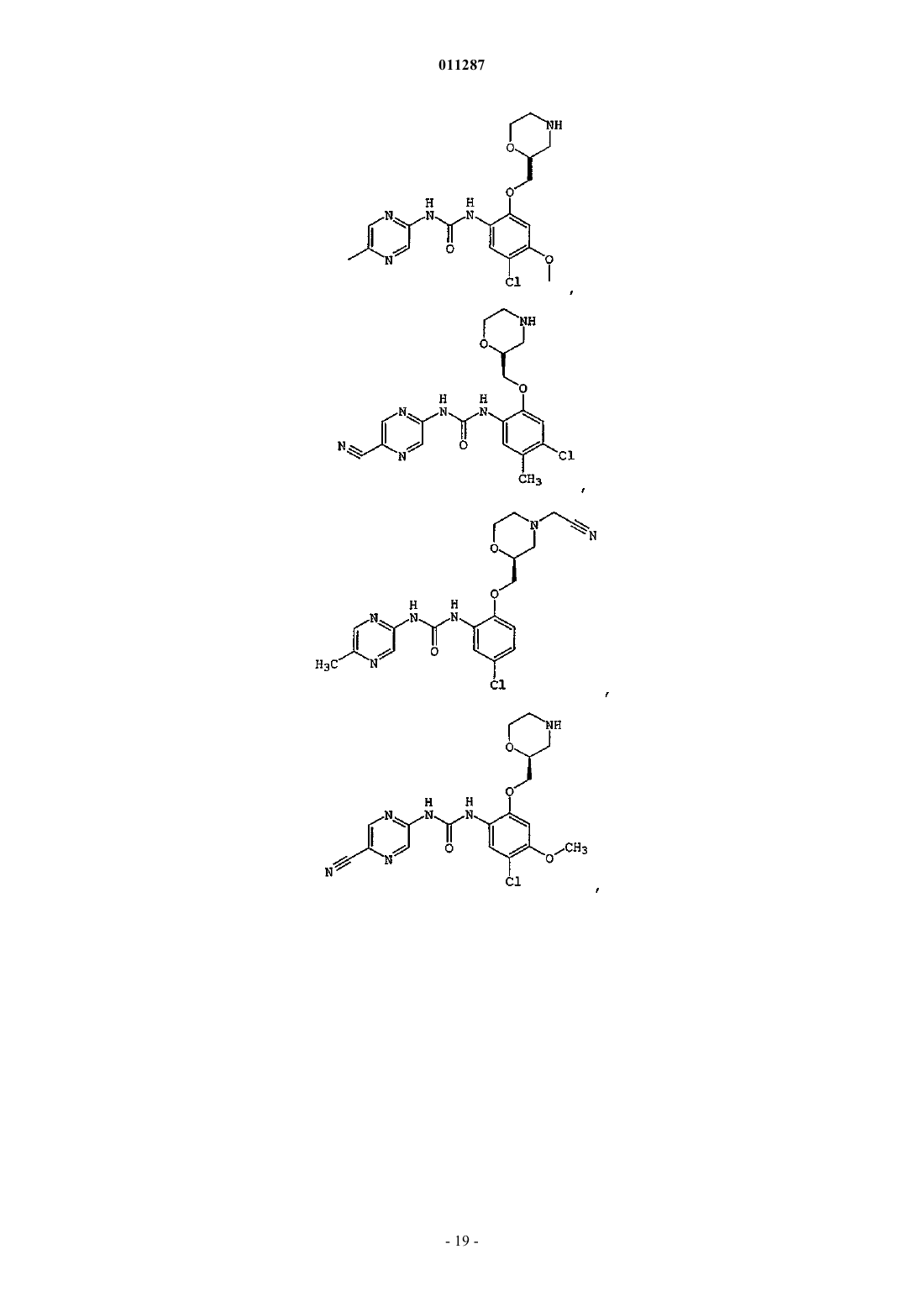
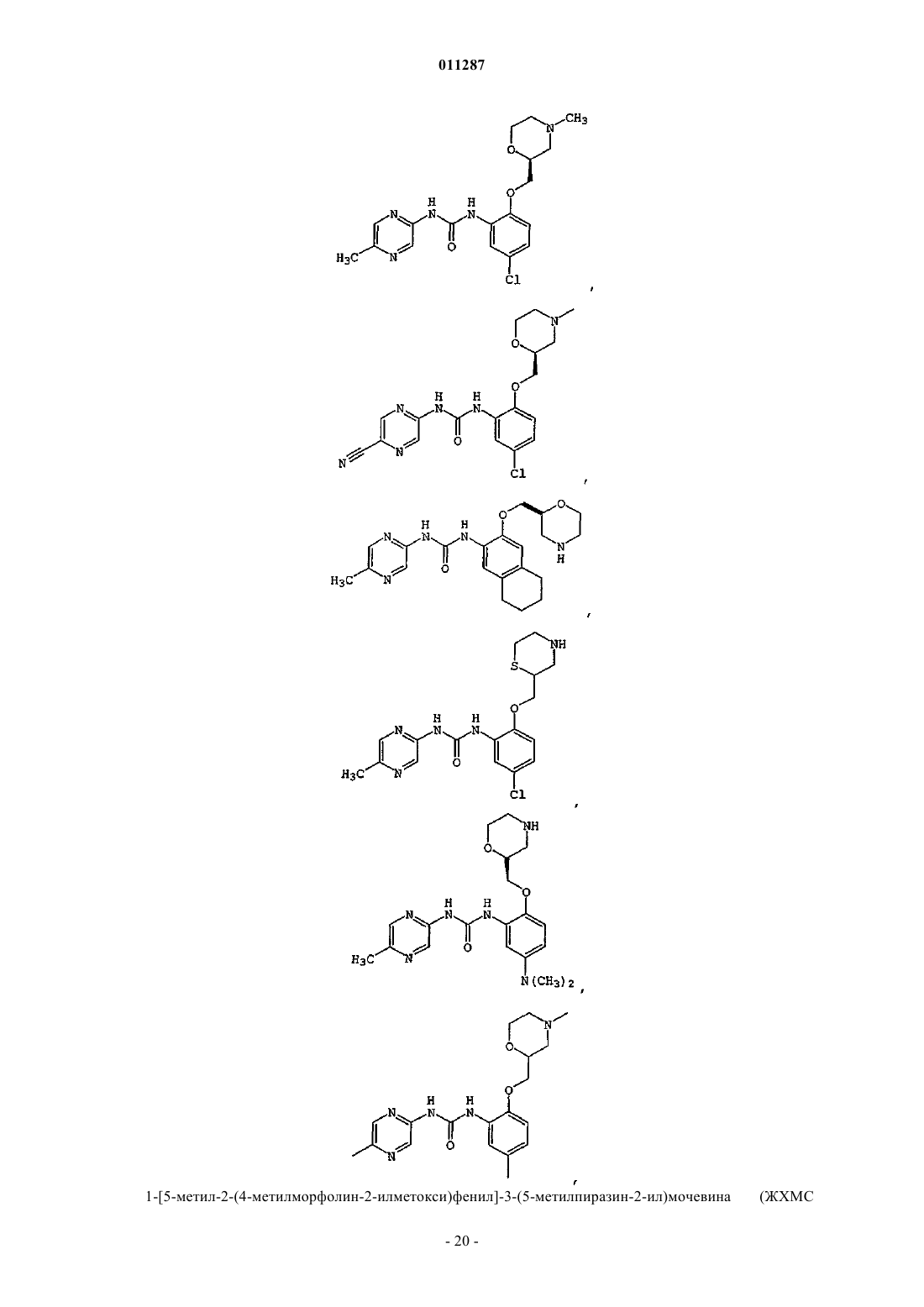
011287 Область изобретения Данное изобретение относится к соединениям, пригодным для ингибирования ферментов, которые сохраняют и восстанавливают целостность генетического материала. Более конкретно, настоящее изобретение относится к серии арил- и гетероарилзамещенных соединений мочевины, способам получения соединений и их применению в качестве терапевтических агентов, например, для лечения раковых и других заболеваний, которые характеризуются дефектами репликации дезоксирибонуклеиновой кислоты(ДНК), сегрегации хромосом или деления клеток. Предпосылки создания изобретения Большое количество болезней, патологических состояний и расстройств (в дальнейшем "показания") характеризуются наличием аберрантно пролиферирующих клеток. В данном описании "аберрантно пролиферирующие клетки" (или "аберрантная пролиферация клеток") подразумевает пролиферацию клеток, которая отличается от нормального, надлежащего или ожидаемого протекания. Например, аберрантная пролиферация клеток включает ненадлежащую пролиферацию клеток, при которой ДНК или другие компоненты клетки становятся поврежденными или дефектными. Аберрантной пролиферацией клеток также характеризуются клинические показания, вызванные, опосредованные или являющиеся результатом неадекватно высокого уровня деления клеток, неадекватно низкого уровня гибели клеток(например, апоптоза) или обоих этих факторов. Такие показания могут характеризоваться, например,однократной или множественной местной аномальной пролиферацией клеток, групп клеток или ткани(ей) и включать раковые (доброкачественные или злокачественные) и нераковые показания. По определению, все виды рака (доброкачественные и злокачественные) включают некоторую форму аберрантной пролиферации клетки. Некоторые нераковые показания также включают аберрантную пролиферацию клеток. Примеры нераковых показаний, включающих аберрантную пролиферацию клеток, включают ревматоидный артрит, псориаз, витилиго, гранулематоз Вегенера и системную волчанку. Один из подходов к лечению показаний, включающих аберрантную пролиферацию клеток, включает применение повреждающих ДНК агентов. Такие агенты разработаны, чтобы вызывать гибель аберрантно пролиферирующих клеток путем нарушения жизненно важных процессов в клетке, таких как метаболизм ДНК, синтез ДНК, транскрипция ДНК, и образование вытянутых микротрубочек. Они также могут действовать, например, вызывая повреждения в ДНК, которые нарушают структурную целостность хромосом. Повреждающие ДНК агенты разработаны и вводятся такими способами, чтобы вызвать максимальное повреждение и последующую гибель аберрантно пролиферирующих клеток с минимальным повреждением нормальных, здоровых клеток. В настоящее время создано большое разнообразие повреждающих ДНК агентов, в том числе химиотерапевтические средства и облучение, тогда как другие находятся в стадии разработки. К сожалению, эффективность повреждающих ДНК агентов в лечении состояний, включающих аберрантную пролиферацию клеток, была ниже желательной, особенно при лечении рака. Селективность таких агентов в отношении аберрантно пролиферирующих клеток по сравнению со здоровыми клетками (иногда носит название терапевтического индекса) часто является пограничной. Кроме того, все клетки располагают сенсорными и восстанавливающими механизмами, которые могут препятствовать действию повреждающих ДНК агентов. Такие сенсорные механизмы, которые называются сверочными точками клеточного цикла, помогают поддерживать порядок различных стадий репликации в клетке и гарантировать, что каждая стадия выполняется с высокой надежностью (Hartwellet al., Science, 246:629-634 (1989); Weinert et al., Genes Dev., 8:652 (1994. Когда клетки обнаруживают повреждение ДНК, в том числе повреждение, целенаправленно вызываемое повреждающими ДНК агентами, некоторые сигнальные пути активируют сверочные точки клеточного цикла и цикл репликации клетки временно прекращается ("остановки"). Такая остановка дает клеткам время для восстановления ДНК, часто до степени, достаточной для дальнейшего выживания и пролиферации. В случае аберрантно пролиферирующих клеток такое восстановление является нежелательным, так как оно может препятствовать усилиям по индукции повреждения ДНК, достаточного для гибели таких клеток. Например, химиотерапевтический агент под названием GEMZAR (гемцитабин или 2',2'-дифтор 2'-дезоксицитидин) повреждает ДНК, встраиваясь в ДНК в ходе синтеза. Без восстановления поврежденная ДНК в целом будет неспособной поддерживать жизнь. Однако во многих клетках-мишенях сверочные точки клеточного цикла обнаруживают неправильно синтезированную (или другим способом поврежденную) ДНК. Активированные сверочные точки клеточного цикла запускают остановку клеточного цикла на время, достаточное для восстановления поврежденной ДНК. Это один способ, с помощью которого аберрантно пролиферирующие клетки теоретически могут воспротивиться губительному для клетки действию повреждающих ДНК агентов, например химиотерапевтических средств, облучения и других терапевтических средств. Другие повреждающие ДНК агенты заставляют опухолевые клетки останавливаться в S-фазе. Обнаружено, что опухолевые клетки сопротивляются некоторым химиотерапевтическим средствам, просто останавливаясь в S-фазе во время введения химиотерапевтического средства. Затем, как только лекарство выводится, повреждение ДНК восстанавливается, остановка клеточного цикла прекращается и клетки-1 011287 прогрессируют через остальные стадии клеточного цикла (Shi et al., Cancer Res. 61:1065-1072, 2001). Другие терапевтические средства вызывают остановку клеточного цикла в других сверочных точках, в том числе G1 и G2. Таким образом, ожидается, что ингибирование различных сверочных точек повреждениями ДНК помогает воспрепятствовать восстановлению терапевтически вызванного повреждения ДНК клетками и делает клетки-мишени чувствительными к повреждающим ДНК агентам. В свою очередь, ожидается, что такая сенсибилизация увеличит терапевтический индекс таких терапевтических средств. С точки зрения основных процессов и способов регулирования клеточный цикл является структурно и функционально сходным для всех видов эукариот. Митотический (соматический) клеточный цикл состоит из четырех фаз: фаза G1 (интервал), фаза S (синтез), фаза G2 (интервал) и фаза М (митоз). ФазыG1, S и G2 вместе называются интерфазой клеточного цикла. В ходе фазы G1 биосинтетическая активность клетки прогрессирует с высокой скоростью. Фаза S начинается, когда начинается синтез ДНК, и заканчивается, когда содержание ДНК в клеточном ядре реплицируется и образуются два идентичных набора хромосом. Далее клетка входит в фазу G2, которая продолжается до начала митоза. В ходе митоза образуется пара хромосом и два новых ядра, а также происходит цитокинез, в ходе которого клетка расщепляется на две дочерние клетки, каждая из которых получает одно ядро, содержащее один из двух наборов хромосом. Цитокинез завершает фазу М и обозначает начало интерфазы следующего клеточного цикла. Последовательность, в которой происходят события клеточного цикла, строго регулируется таким образом,что начало одного события клеточного цикла зависит от завершения предшествующего события клеточного цикла. Это позволяет достичь надежности удвоения и выделения генетического материала от одного поколения соматических клеток к следующему. Сообщается, что сверочные точки клеточного цикла включают по крайней мере три четких класса полипептидов, которые действуют последовательно в ответ на сигналы клеточного цикла или дефекты в хромосомных механизмах (Carr, Science, 271:314-315, 1996). Первый класс представляет собой семейство белков, которые воспринимают или обнаруживают повреждение ДНК или аномалии клеточного цикла. Такие датчики включают мутантный белок атаксии-телеангиэктазии (Atm) и Rad-связанный белок атаксии-телеангиэктазии (Atr). Полипептиды второго класса амплифицируются и передают сигнал, обнаруженный детектором; примерами его представителей являются Rad53 (Alen et al. Genes Dev. 8:2416-2488,1994) и Chk1. Третий класс полипептидов включает эффекторы клеточного цикла, например, р 53, которые опосредуют клеточную реакцию, например, остановку митоза и апоптоз. Многое из текущего понимания функционирования сверочных точек клеточного цикла является результатом изучения линий опухолевых клеток. Во многих случаях опухолевые клетки утратили ключевые сверочные точки клеточного цикла (Hartwell et al., Science 266:1821-28, 1994). Сообщается, что ключевой шаг в эволюции клеток до состояния новообразования заключается в приобретении мутаций, которые инактивируют пути сверочной точки клеточного цикла, например, включающие р 53 (Weinberg,Cell 81:323-330, 1995; Levine, Cell 88:3234-331, 1997). Утрата таких сверочных точек клеточного цикла приводит к репликации опухолевых клеток, несмотря на повреждение ДНК. Нераковая ткань, которая обладает интактными сверочными точками клеточного цикла, обычно защищена от временного нарушения единого пути сверочных точек. Однако в путях опухолевых клеток,управляющих продвижением клетки через клеточный цикл, присутствуют такие дефекты, что расстройство дополнительных сверочных точек делает их особенно чувствительными к повреждающим ДНК агентам. Например, опухолевые клетки, которые содержат мутантный р 53, имеют дефекты как в сверочных точках повреждения G1 ДНК, так и в способности поддерживать сверочную точку для поврежденияG2 ДНК (Bunz et al., Science, 282:1497-501, 1998). Ожидается, что ингибиторы сверочной точки, которые нацелены на инициацию сверочной точки G2 или сверочной точки S-фазы, будут дополнительно нарушать способность таких опухолевых клеток восстанавливать повреждение ДНК и, таким образом, являются кандидатами на увеличение терапевтического индекса как для облучения, так и системной химиотерапии (Gesner, Abstract at SRI Conference: Protein Phosphorylation and Drug Discovery World Summit,March 2003). В присутствии повреждения ДНК или какого-либо препятствия для репликации ДНК сверочные точки белков Atm и Atr инициируют путь преобразования сигнала, который приводит к остановке клеточного цикла. Показано, что Atm играет роль в сверочной точке повреждения ДНК в ответ на действие ионизирующего излучения (IR). Агенты, которые вызывают разрывы двухнитевой ДНК, разрывы однонитевой ДНК, и агенты, которые блокируют облучение ДНК, стимулируют Atr.Chk1 представляет собой протеинкиназу, которая расположена в 5'-3' направлении по отношению кAtm и/или Atr в пути преобразования сигнала сверочной точки повреждения ДНК (Sanchez et al., Science,277:1497-1501, 1997; патент США 6,218,109). В клетках млекопитающих Chk1 фосфорилируется в ответ на действие агентов, которые вызывают повреждение ДНК, в том числе ионизирующего излучения (IR), ультрафиолетового (UV) света и гидроксимочевины (Sanchez et al., выше; Lui et al., Genes Dev., 14:1448-1459, 2000). Такое фосфорилирование,которое активизирует Chk1 в клетках млекопитающих, зависит от Atm (Chen et al., Oncogene, 18:249-256,-2 011287 1999) и Atr (Lui et al., выше). К тому же показано, что Chk1 фосфорилирует как wee1 (O'Connell et al.,EMBO J., 16:545-554, 1997), так и Pds1 (Sanchez et al., Science, 286:1166-1171, 1999), то есть генные продукты, которые важны для контроля клеточного цикла. Эти исследования продемонстрировали, что Chk1 млекопитающих играет роль в Atm-зависимой сверочной точке повреждения ДНК, ведущего к остановке в S фазе. Недавно была прояснена роль Chk1 вS фазе клеток млекопитающих (Feijoo et al., J. Cell Biol., 154:913-923, 2001; Zhao et al., PNAS U.S.A,99:14795-800, 2002; Xiao et al., J Biol Chem., 278(24):21767-21773, 2003; Sorensen et al., Cancer Cell,3(3):247-58, 2003), а именно, показана роль Chk1 в мониторинге целостности синтеза ДНК. Chk1 вызывает остановку в S-фазе путем фосфорилирования Cdc25A, который регулирует активность циклинаА/сd1k2 (Xiao et al., выше и Sorensen et al., выше). Chk1 также вызывает остановку G2 путем фосфорилирования и инактивации Cdc25C, фосфатазы с двойной специфичностью, которая в норме дефосфорилирует циклин-B/cdc2 (также известный как Cdk1) по мере прогресса клеток от G2 к митозу (Fernery et al.,Science, 277:1495-7, 1997; Sanchez et al., выше; Matsuoka et al., Science, 282:1893-1897, 1998; и Blasina etal., Curr. Biol., 9:1-10, 1999). В обоих случаях регулирование активности Cdk вызывает остановку клеточного цикла, чтобы воспрепятствовать вхождению клеток в фазу митоза при наличии повреждения ДНК или нереплицированной ДНК. Дополнительные классы ингибиторов сверочных точек клеточного цикла действуют в фазе G1 илиG2/M. UCN-01 или 7-гидроксистауроспорин, первоначально был выделен как неспецифический ингибитор киназы, действующий в основном на протеинкиназу С, но недавно было обнаружено, что он ингибирует активность Chk1 и инактивирует сверочную точку клеточного цикла G2 (Shi et al., выше). Таким образом, поскольку UCN-01 является неселективным ингибитором Chk1, в высоких дозах он токсичен для клеток. В низких дозах он неспецифически ингибирует многие клеточные киназы, а также ингибирует сверочную точку G1 (Tenzer et al., Curr. Med Chem. Anticancer Agents, 3:35-46, 2003).UCN-01 с ограниченным успехом применяли в сочетании с противораковыми средствами, такими как облучение, противораковый агент камптотецин (Tenzer et al., выше), и гемцитабин (Shi et al., выше). Кроме того, UCN-01 использовали для того, чтобы потенцировать действие индуцированного темозоломидом (TMZ) восстановление несоответствия ДНК (MMR) в клетках глиобластомы (Hirose et al., CancerRes., 61:5843-5849, 2001). В клинике UCN-01 не является таким эффективным химиотерапевтическим средством, как ожидалось, возможно из-за несоблюдения схемы лечения и отсутствия идентификации конкретных ключевых молекулярных мишеней (Grant et al., Drug Resistance Updates, 6:15-26, 2003). Поэтому Mack et al. сообщают о зависимой от клеточного цикла потенциации цисплатина агентом UCN-01 в культивированной клеточной линии немелкоклеточной карциномы легких, но не соотносят со специфической ключевой(ыми) сверочной(ыми) точкой(ами) клеточного цикла, на которую нацелен UCN-01(Mack et al., Cancer Chemother. Pharmacol., 51(4):337-348, 2003). Существует несколько других стратегий сенсибилизации опухолевых клеток к лечению с помощью химиотерапевтических средств, воздействующих на клеточный цикл. Например, введение 2-аминопурина инактивирует многочисленные механизмы сверочной точки клеточного цикла, такие как индуцированная мимозином остановка G1 или индуцированная гидроксимочевиной остановка в S-фазе, что позволяет клетке прогрессировать до митоза и через митоз (Andreassen et al., Proc Natl Acad Sci U.S.A., 86:2272-2276, 1992). Производное метилксантина - кофеин также использовали для увеличения цитотоксичности повреждающих ДНК агентов, таких как цисплатин и ионизирующее излучение, путем опосредования прогресса через сверочную точку G2 и, таким образом, индукции гибели клеток (Bracey et al., Clin. Cancer Res., 3:1371-1381, 1997). Однако доза кофеина, которую применяли, чтобы достичь инактивации клеточного цикла, превышала клинически приемлемые уровни и не является жизнеспособным терапевтическим вариантом. Кроме того, использовали антисмысловые нуклеотиды к киназе Chk1 для повышения чувствительности к ингибитору топоизомеразыBNP1350 (Yin et al., Biochem. Biophys. Res. Commun., 295:435-44, 2002), но они продемонстрировали проблемы, обычно связанные с антисмысловой и генной терапией. Раскрыты ингибиторы Chk1, в том числе арил- и гетероарилзамещенные соединения мочевины, описанные в патентной заявке США 10/087715 и временных патентных заявках США 60/583080, 60/585292 и 60/602968; диарильные соединения мочевины, описанные в патентной публикации США 2004/0014765, патентной публикации США US 2003/199511, патентной публикации США 2004/0014765 и WO 03/101444; метилксантины и родственные соединения, описанные в Fan et al., Cancer Res. 55:1649-54. 1995; уреидотифены,описанные в WO 03/029241 и WO 03/028731; N-пирролпиридинилкарбоксамиды, описанные в WO 03/028724; антисмысловые олигонуклеотиды Chk1, описанные в WO 01/57206 и патенте США 6211164; антагонисты рецептора Chk1, описанные в WO 00/16781; гетероароматические производные карбоксамида, описанные вWO 03/037886; аминотиофены, описанные в WO 03/029242; (индазолил)бензимидазолы, описанные в WO 03/004488; бензимидазолхинолиноны, описанные в патентной публикации США 20040092535 и WO 04/018419; гетероциклические гидроксииминофлуорены, описанные в WO 02/16326; производные сцитонемана (scytoneman), такие как сцитонемин (scytonemin), описанный в патенте США 6495586; гетероарилбензамиды, описанные в WO 01/53274; индазолы, описанные в WO 01/53268; индолакарбазолы, описанные в Tenzer et al., выше; производные хромана, описанные в WO 02/070515; пауллоны (paullones), описанные в SchultzSedlacek et al., Int J. Oncol., 9:1143-1168, 1996; производные пептидной петли серинтреонинкиназ, описанные вWO 98/53050; оксиндолы, описанные в WO 03/051838; диазепиноиндолоны, описанные в WO 2004/063198; пиримидины, описанные в WO 2004/048343; соединения мочевины, описанные в WO 2004/014876; и пирролкарбазолы, бензофуроизоиндолы и азациклопентафлюорены, описанные в WO 2003/091255. Однако в уровне техники по-прежнему существует потребность в эффективных и селективных ингибиторах Chk1. Данное изобретение направлено на удовлетворение этой и других потребностей. Краткое описание изобретения Данное изобретение относится к высокоактивным селективным ингибиторам сверочной точки киназы Chk1, которые демонстрируют неожиданные свойства в биохимических и/или клеточных анализах. Данные ингибиторы Chk1 пригодны для лечения показаний, включающих аберрантную пролиферацию клеток, а также в качестве хемосенсибилизирующих и радиосенсибилизирующих агентов для лечения показаний, связанных с повреждением ДНК или нарушениями репликации ДНК. Таким образом, один аспект настоящего изобретения состоит в обеспечении соединениями структурной формулы (I). Среди прочего, соединения пригодны для способа ингибирования Chk1, который включает стадию введения эффективного количества соединения структурной формулы (I) индивидууму, который в этом нуждается. Соединения формулы (I), строение которых может быть выражено структурной формулой:R2 представляет собой водород, C1-3 алкил, CN, OC1-3 алкил, галоген или N(Rb)2, где Rb независимо представляет собой водород или C1-3 алкил;R3 представляет собой 6- или 7-членное насыщенное гетероциклическое кольцо, содержащее в кольце одну группу N-Ra, а также содержащее в кольце вторую группу N-Ra, атом кислорода или атом серы, где Ra независимо представляет собой водород, C1-3 алкил, CH2CN или CH2CH2CN и где R3 необязательно замещен оксо(=O);R4 представляет собой водород, C1-3 алкил, OC1-3 алкил, SC1-3 алкил, N(Rb)2, NRbC (=O) C1-3 алкил или 5- или 6-членное насыщенное гетероциклическое кольцо, содержащее одну группу N-Ra, причем кольцо необязательно замещено 1-3 группами C1-3 алкил; или R2 и R4, взятые вместе с атомами углерода, к которым они присоединены, образуют 5-7 членное насыщенное карбоциклическое кольцо; и R5 представляет собой водород или галоген,при условии, что по крайней мере один из R2 и R4 не является водородом, и если R5 представляет собой галоген, то R2 или R4 представляет собой водород,или их фармацевтически приемлемые соли, пролекарства или сольваты. Другой аспект настоящего изобретения представляет собой соединения структурной формулы (II),которые, среди прочего, могут применяться в способе ингибирования Chk1R2 представляет собой водород, C1-3 алкил, CN, OC1-3 алкил, галоген или N(Rb)2, где Rb независимо представляет собой водород или C1-3 алкил;R3 представляет собой 6- или 7-членное насыщенное гетероциклическое кольцо, содержащее в кольце одну группу N-Ra, а также содержащее в кольце вторую группу N-Ra, атом кислорода или атом серы, где Ra независимо представляет собой водород, C1-3 алкил или CH2CN, и где R3 необязательно замещен оксо(=O);R4 представляет собой водород, C1-3 алкил, OC1-3 алкил или галоген; или R2 и R4, взятые вместе с атомами углерода, к которым они присоединены, образуют 5-7 членное насыщенное карбоциклическое кольцо; при условии, что по крайней мере один из R2 и R4 не является водородом,или их фармацевтически приемлемые соли, пролекарства или сольваты. Другой аспект настоящего изобретения представляет собой фармацевтические композиции, которые содержат одно или несколько соединений структурной формулы (I) или (II), и применение таких композиций для лечения показания, где ингибирование Chk1 in vivo или ex vivo обеспечивает терапевтическое преимущество или является предметом исследовательского или диагностического интереса.-4 011287 Еще один аспект настоящего изобретения представляет собой способ сенсибилизации клеток у субъекта, проходящего курс химиотерапии или радиотерапии по поводу показания, который включает введение индивидууму соединения структурной формулы (I) или (II) в сочетании с химиотерапевтическим средством, радиотерапевтическим средством или обоими. Не ограничивающее показание, которое лечат с помощью такого способа, представляет собой рак. Другой аспект настоящего изобретения представляет собой способ ингибирования или предупреждения аберрантной пролиферации клеток. В одном варианте способ включает обеспечение контакта популяции, которая содержит аберрантно пролиферирующие клетки, по крайней мере с одним активаторомChk1 в количестве и на протяжении периода времени, достаточного для того, чтобы в существенной мере синхронизировать остановку клеточного цикла у аберрантно пролиферирующих клеток. После достижения существенной меры синхронизации остановки клеточного цикла в популяции клеток обеспечивают контакт популяции клеток по крайней мере с одним ингибитором Chk1 в количестве и на протяжении периода времени, достаточного для того, чтобы в существенной мере отменить остановку клеточного цикла. Другой аспект настоящего изобретения представляет собой промышленный продукт для фармацевтического применения у человека, который включает:(a) фармацевтическую композицию, которая содержит соединение структурной формулы (I) или(b) вкладыш в упаковку, на котором указано, что композиция пригодна для лечения показаний,включающих аберрантную пролиферацию клеток; и(c) емкость. Другой аспект настоящего изобретения представляет собой:(a) фармацевтическую композицию, которая содержит соединение структурной формулы (I) или(b) вкладыш в упаковку, на котором указано, что композиция пригодна в качестве хемосенсибилизатора или радиосенсибилизатора для лечения показания, связанного с повреждениями ДНК или нарушением репликации ДНК;(c) емкость. Этот и другие аспекты настоящего изобретения будут понятны из следующего подробного описания. Подробное описание Соединения по настоящему изобретению имеет структурную формулу (I)R2 представляет собой водород, C1-3 алкил, CN, OC1-3 алкил, галоген или N(Rb)2, где Rb независимо представляет собой водород или C1-3 алкил;R3 представляет собой 6- или 7-членное насыщенное гетероциклическое кольцо, содержащее в кольце одну группу N-Ra, а также содержащее в кольце вторую группу N-Ra, атом кислорода или атом серы, где Ra независимо представляет собой водород, C1-3 алкил, CH2CN или CH2CH2CN и где R3 необязательно замещен оксо(=O);R4 представляет собой водород, C1-3 алкил, OC1-3 алкил, SC1-3 алкил, N(Rb)2, NRbC(=O)C1-3 алкил или 5 или 6-членное насыщенное гетероциклическое кольцо, содержащее одну группу N-Ra, причем кольцо необязательно замещено 1-3 группами C1-3 алкил; или R2 и R4, взятые вместе с атомами углерода, к которым они присоединены, образуют 5-7 членное насыщенное карбоциклическое кольцо; и R5 представляет собой водород или галоген,при условии, что по крайней мере один из R2 и R4 не является водородом, и если R5 представляет собой галоген, то R2 или R4 представляет собой водород,или их фармацевтически приемлемые соли, пролекарства или сольваты. В одном предпочтительном варианте соединения имеют структурную формулу (II)R2 представляет собой водород, C1-3 алкил, CN, OC1-3 алкил, галоген или N(Rb)2, где Rb независимо представляет собой водород или C1-3 алкил;R3 представляет собой 6- или 7-членное насыщенное гетероциклическое кольцо, содержащее в кольце одну группу N-Ra, а также содержащее в кольце вторую группу N-Ra, атом кислорода или атом серы, где Ra независимо представляет собой водород, C1-3 алкил или CH2CN, и где R3 необязательно замещен оксо(=O);R4 представляет собой водород, C1-3 алкил, OC1-3 алкил или галоген; или R2 и R4, взятые вместе с атомами углерода, к которым они присоединены, образуют 5-7 членное насыщенное карбоциклическое кольцо; при условии, что по крайней мере один из R2 и R4 не является водородом,или их фармацевтически приемлемые соли, пролекарства или сольваты. В одном предпочтительном варианте соединений формул (I) и (II) R1 представляет собой хлор, метил, CN или CF3. В другом предпочтительном варианте R2 представляет собой водород, метил, этил,хлор, бром, диметиламино, циано или метокси. В более предпочтительных вариантах R2 не является водородом. В других предпочтительных вариантах формул (I) и (II) R4 представляет собой метил, хлор, фтор,метокси изопропокси, диметиламино, -SCH3, -NHC(=O)СН(СН 3)2, -NHC(=O)CH3, пирролидинил или 3,3 диметилпирролидинил. В более предпочтительных вариантах R4 представляет собой метил, хлор или метокси. Еще в одном предпочтительном варианте R2 и R4, взятые вместе с атомами углерода, к которым они присоединены, образуют 5-членное или 6-членное насыщенное карбоциклическое кольцо. В другом предпочтительном варианте формул (I) и (II), если R5 представляет собой галоген, то R4 представляет собой водород. В предпочтительном варианте R5 представляет собой фтор. В более предпочтительных вариантах R5 представляет собой водород. В одном варианте формул (I) и (II), если R1 представляет собой циано, то R2 представляет собой водород и R4 предпочтительно представляет собой хлор или метил. В другом варианте R5 представляет собой фтор, R4 представляет собой водород и R2 представляет собой метил, хлор или бром. Примеры предпочтительных R3 групп в формулах (I) и (II) включают, не ограничиваясь ими, В данном описании термин "C1-3 алкил" включает алкильные группы с неразветвленной и разветвленной цепью, содержащие от одного до трех атомов углерода, т.е. метил, этил, н-пропил и изопропил."Галоген" в данном описании означает фтор, хлор, бром и йод.-6 011287 Повреждающие ДНК агенты, которые активируют сверочные точки клеточного цикла, в целом в данном описании обозначаются как активаторы сверочных точек. Повреждающие ДНК агенты, которые активируют сверочную точку, обозначенные "Chk1" (произносится как чек-ван), обозначают активаторы Chk1. Подобным образом, ингибиторы таких сверочных точек в данном описании обозначаются "ингибиторы сверочной точки" и ингибиторы "Chk1", соответственно. В данном описании ингибиторы Chk1 представляют собой соединения, способные по крайней мере частично инактиваровать по крайней мере одну сверочную точку клеточного цикла белка Chk1. Инактивация сверочной точки клеточного цикла достигается, когда клеточный механизм сверочной точки в достаточной степени преодолен, чтобы позволить клетке прогрессировать от фазы клеточного цикла, в которой она остановилась, до следующей фазы клеточного цикла или перейти непосредственно к гибели клетки. Инактивация сверочной точки клеточного цикла позволяет клеткам нести поврежденный или несовершенный генетический материал на последующие фазы клеточного цикла, таким образом вызывая или способствуя гибели клетки. Гибель клетки может происходить по любому механизму, включая апоптоз и митотическую катастрофу. Соединения по изобретению представляют собой ингибиторы Chk1. Активатор Chk1 включает любой известный или открытый впоследствии агент, обладающий способностью активировать киназу Chk1, и, таким образом, вызывать по крайней мере частичную остановку клеточного цикла. Активаторы Chk1 включают агенты, способные останавливать клеточный цикл в какой-либо фазе клеточного цикла, и соответствующая фаза в данном описании может носить название"фазы-мишени" для такого активатора. Фазы-мишени включают любую из фаз клеточного цикла, кроме митоза, т.е. любую из фаз G1, S и G2. Пригодные активаторы Chk1 в соответствии с настоящим изобретением включают повреждающие ДНК агенты, например химиотерапевтические средства и/или облучение. Радиационные активаторы Chk1 включают, не ограничиваясь ими, ионизирующее излучение. Ионизирующее излучение означает электромагнитное облучение или облучение частицами, способное образовывать пары ионов при взаимодействии с веществом. Ионизирующее излучение включает рентгеновские и гамма-лучи, альфа- и бета-частицы, нейтроны и заряженные ядра. Облучение включает ультрафиолетовый свет, видимый свет, инфракрасное облучение, микроволновое облучение и комбинации этих видов. Для определения того, является ли конкретный агент активатором Chk1, могут использоваться анализы, например, такие как описаны в примере 8."Ингибирование аберрантной пролиферации клетки" означает замедление скорости пролиферации аберрантно пролиферирующих клеток или полное прекращение такой пролиферации. Такое ингибирование может быть результатом снижения скорости репликации, повышения скорости гибели клеток или обоих этих факторов. Гибель клетки может происходить по любому механизму, включая апоптоз и митотическую катастрофу."Предупреждение аберрантной пролиферации клеток" означает ингибирование аберрантной пролиферация клеток до ее возникновения или ингибирование ее рецидива."In vivo" означает в пределах живого субъекта, например в пределах животного или человека. В данном контексте агенты могут использоваться терапевтически in vivo, чтобы затормозить или прекратить пролиферацию аберрантно делящихся клеток. Агенты также могут использоваться in vivo в качестве профилактического средства для предупреждения аберрантной пролиферации клеток или появления связанных с ней симптомов."Ex vivo" означает за пределами живого субъекта. Примеры популяций клеток ex vivo включают культуры клеток и биологические образцы, такие как образцы жидкости или ткани, полученные от человека или животных. Такие образцы могут быть получены способами, хорошо известными в уровне техники. Примеры образцов биологических жидкостей включают кровь, спинномозговую жидкость, мочу и слюну. Примеры образцов ткани включают опухоли и биопсию. В данном контексте предлагаемые соединения могут найти разнообразное применение как терапевтическое, так и экспериментальное."Радиосенсибилизатор" в данном описании означает соединение, которое вводят человеку или другому животному в терапевтически эффективном количестве, чтобы увеличить чувствительность клеток к электромагнитному облучению и/или способствовать лечению заболеваний, которые поддаются лечению электромагнитным облучением."Излучение" в данном описании включает, не ограничиваясь им, излучение с длиной волны в интервале 10-20-100 м. Термин "емкость" означает любое вместилище с крышкой, подходящее для хранения, доставки, отпуска и/или обращения с фармацевтическим продуктом. Термин "вкладыш в упаковку" означает информацию, сопровождающую продукт, в которой приведено описание способа введения продукта, а также данные по безопасности и эффективности, необходимые для принятия информированного решения врачом, провизором и пациентом относительно применения продукта. Вкладыш в упаковку в общем рассматривается как "этикетка" фармацевтического продукта. Настоящее изобретение включает все возможные стереоизомеры и геометрические изомеры соединений структурной формулы (I) или (II). Настоящее изобретение включает не только рацемические соединения, но и отдельные оптически активные изомеры. Если желательно получение соединения струк-7 011287 турной формулы (I) или (II) в виде отдельного энантиомера, он может быть получен разделением конечного продукта или стереоспецифическим синтезом из изомерно чистого исходного материала или путем использования хирального вспомогательного реагента, например, см. Z. Ma et al., Tetrahedron:Asymmetry, 8(6), 883-888 (1997). Разделение конечного продукта, промежуточных соединений или исходного материала может быть достигнуто любым подходящим способом, известным из уровня техники. Дополнительно, в ситуациях, где возможно существование таутомеров соединений структурной формулы (I) или (II), настоящее изобретение предназначено включать все таутомерные формы соединений. Как продемонстрировано ниже, конкретные стереоизомеры могут демонстрировать исключительную способность ингибировать Chk1 в сочетании с лечением химиотерапевтическими или радиотерапевтическими средствами. Пролекарства соединений структурной формулы (I) или (II) также могут использоваться в качестве соединения в способе по настоящему изобретению. Хорошо доказано, что подход с получением пролекарств, в котором получают соединение в форме, подходящей для введения в препарат и/или введения субъекту, из которого лекарственное средство в дальнейшем высвобождается in vivo, успешно использовался для временного (например, обратимого в биологической системе) изменения физико-химических свойств соединения (см. Н. Bundgaard, Ed., "Design of Prodrugs," Elsevier, Amsterdam, (1985); R.B.Silverman, "The Organic Chemistry of Drug Design and Drug Action," Academic Press, San Diego, chapter 8,(1992); K.M. Hillgren et al., Med. Res. Rev., 15, 83 (1995. Соединения по настоящему изобретению содержат одну или несколько функциональных групп. Функциональные группы, если это желательно или необходимо, могут быть изменены для получения пролекарства. Подходящие пролекарства включают, например, производные кислот, такие как амиды и эфиры. Специалисты в данной области также понимают, что в качестве пролекарства могут использоваться N-оксиды. Соединения по изобретению могут существовать в виде солей. Фармацевтически приемлемые соли соединений по изобретению в целом являются предпочтительными в способах по изобретению. В данном описании термин "фармацевтически приемлемые соли" означает соли или цвиттерионные формы соединений структурной формулы (I) или (II). Соли соединений формулы (I) или (II) могут быть получены в ходе окончательного выделения и очистки соединений или отдельно путем реакции соединения с кислотой, имеющей подходящий катион. Пригодные фармацевтически приемлемые катионы включают катионы щелочных металлов (например, натрий или калий) и щелочно-земельных металлов (например,кальций или магний). Кроме того, фармацевтически приемлемые соли соединений структурной формулы(I) или (II), которые содержат основный центр, представляют собой кислотно-аддитивные соли, образованные с фармацевтически приемлемыми кислотами. Примеры кислот, которые могут использоваться для получения фармацевтически приемлемых солей, включают неорганические кислоты, такие как хлористо-водородная, бромисто-водородная, серная и фосфорная, а также органические кислоты, такие как щавелевая, малеиновая, янтарная, малоновая и лимонная. Не ограничивающие примеры солей соединений по изобретению включают, не ограничиваясь ими, соли гидрохлорид, гидробромид, гидроиодид, сульфат, бисульфат, 2-гидроксиэтансульфонат, фосфат, гидрофосфат, ацетат, адипат, альгинат, аспартат, бензоат, бутират, камфорат, камфорсульфонат,цитрат, биглюконат, глицерофосфат, гемисульфат, гептаноат, гексаноат, формиат, сукцинат, малонат,фумарат, малеат, метансульфонат, мезитиленсульфонат, нафтиленсульфонат, никотинат, 2 нафталинсульфонат, оксалат, памоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, трихлорацетат, трифторацетат, глутамат, бикарбонат, ундеканоат, лактат, цитрат, тартрат, глюконат, бензолсульфонат и п-толуолсульфонат. Кроме того, доступные аминогруппы в соединениях по изобретению могут быть кватернизованы с помощью метил-, этил-, пропил- и бутилхлоридов, -бромидов и -иодидов; диметил-, диэтил-, дибутил- и диамилсульфатов; децил-, лаурил-, миристил- и стерилхлоридов, -бромидов и -иодидов; а также бензил- и фенилэтилбромидов. В свете вышеизложенного любая ссылка на соединения по настоящему изобретению, приведенная в данном описании, предназначена включать соединения структурной формулы (I) или (II), а также их фармацевтически приемлемые соли,сольваты или пролекарства. Неограничивающими примерами соединений по настоящему изобретению являются: или их соли, сольваты (например, гидраты) или пролекарства. Соединения по настоящему изобретению могут вводиться с терапевтической целью в виде неразведенных химических соединений, но предпочтительным является введение соединений в составе фармацевтической композиции или препарата. Поэтому настоящее изобретение предлагает фармацевтическую композицию, которая содержит соединение формулы (I) или (II) вместе с фармацевтически приемлемым наполнителем или носителем. Также предлагается способ приготовления фармацевтической композиции,который включает смешивание соединения формулы (I) или (II) с фармацевтически приемлемым наполнителем или носителем. Соответственно, настоящее изобретение дополнительно предлагает фармацевтические препараты,содержащие соединение структурной формулы (I) или (II) или его фармацевтически приемлемую соль,пролекарство или сольват, вместе с одним или несколькими фармацевтически приемлемыми носителями и, необязательно, другими терапевтическими и/или профилактическими ингредиентами. Носители "приемлемы" в смысле совместимости с другими ингредиентами препарата и нетоксичности для реципиента. Соединения по изобретению демонстрируют неожиданно высокую активность. Активность обычно выражается как концентрация соединения, необходимая для достижения некоторого результата. Чем выше активность, тем менее количество соединения необходимо для осуществления им предусмотренной функции. Активность in vitro обычно выражается в терминах значений IC50 и измеряется с использованием анализа доза-реакция. Значения IC50 могут быть измерены путем обеспечения контакта чувствительной системы анализа с целевым соединением в интервале концентраций, в том числе концентраций, при которых наблюдается минимальный эффект или он вообще отсутствует, через более высокие концентрации, при которых наблюдается частичный эффект, к насыщающим концентрациям, при которых наблюдается максимальный эффект. Теоретически, такие анализы эффекта доза-реакция для соединений-ингибиторов могут быть описаны как сигмовидная кривая, выражающая степень ингибирования как функцию концентрации при нанесении на график с логарифмической шкалой. Теоретически кривая также проходит через точку, в которой концентрация является достаточной для снижения активности фермента сверочной точки до уровня, который составляет 50% различия между минимальной и максимальной активностью фермента, которая наблюдается в анализе. Эта концентрация определена как ингибиторная концентрация, которая позволяет достичь 50% ингибирования, или значение IC50. Значения IC50 могут быть определены с использованием обычных биохимических (неклеточных) методов анализа или клеточных методов анализа, хорошо известных среднему специалисту в данной области. Пример такого анализа приведен в примере 1 ниже. Предпочтительно, значения IC50 получают, выполняя соответствующий анализ по крайней мере дважды и выражая значение IC50, как среднюю величину (арифметическое среднее или "среднее значение") полученных отдельных значений. Более предпочтительно, анализ повторяют от 3 до 10 (или более) раз и выражают значение IC50 как среднее полученных значений. Наиболее предпочтительно, количество повторений анализа должно быть достаточным для того, чтобы генерировать надежное со статистической точки зрения среднее значение IC50 с применением статистических методов, известных среднему специалисту в данной области. Соединения по изобретению демонстрируют неожиданно низкие значения IC50, что соответствует неожиданно высокой активности in vitro. Соединения по изобретению в анализах, описанных в примере 1 ниже, демонстрируют значения IC50 менее приблизительно 200 нМ, в некоторых вариантах менее приблизительно 150 нМ, в других вариантах менее приблизительно 100 нМ, в других - менее приблизительно 50 нМ, в других - менее приблизительно 10 нМ и в других - менее приблизительно 5 нМ. В других вариантах соединения по изобретению демонстрируют значения IC50 от приблизительно 0,1 до приблизительно 5 нМ. Соединения по изобретению демонстрируют селективность ингибирования Chk1 по сравнению с другими протеинкиназами. Селективность может быть преимуществом с точки зрения уменьшения неблагоприятных побочных эффектов и/или увеличения терапевтического индекса."Селективность" в данном описании выражается в "кратных" значениях. В целом, селективность,выраженная в кратных значениях, как используется в данном описании, представляет собой IC50 исследуемого соединения для сравниваемого фермента, деленное на IC50 фермента сравнения. В частности,- 27011287 селективность, выраженная в кратных значениях, для ингибитора Chk1, как используется в данном описании, это IC50 ингибитора Chk1 (исследуемое соединение) для Chk1 (сравниваемый фермент), деленное на IC50 для фермента сравнения. Ферменты сравнения, против которых могут исследоваться соединения по изобретению, включают по крайней мере следующие протеинкиназы: Cdc2, Chk2, СТАК, EphAl,EphA2, Erk1, FGFR1, FGFR4, IR, JNK1, с-Kit, p38alpha, p38beta, p38delta, Ros, Rse, Rsk2, TrkA, TrkB, протеинкиназа А, протеинкиназа С, pp60v-src, протеинкиназа B/Akt-1, p38MapK, p70S6K, кальмодулинзависимая киназа кальция II, а также тирозинкиназа ab1. Анализы для определения значений IC50 для исследуемого соединения против фермента сравнения описаны в примере 2 и хорошо известны средним специалистам в данной области. Соединения по изобретению демонстрируют по крайней мере 20-кратную селективность по сравнению с вышеупомянутыми протеинкиназами. В некоторых вариантах ингибиторы Chk1 по настоящему изобретению демонстрируют по крайней мере 50-кратную селективность, в других вариантах - 75-кратную селективность, в других вариантах - по крайней мере 100-кратную селективность ингибирования Chk1 по сравнению с ингибированием вышеупомянутых исследованных протеинкиназ. Соединения по изобретению демонстрируют неожиданно высокую активность в клеточных анализах. Для измерения клеточной активности ингибитора Chk1 был разработан анализ, который позволяет измерять концентрацию ингибитора Chk1, необходимую для усиления ингибирующего рост действия повреждающего ДНК агента в клеточной модели, включающей аберрантно пролиферирующие клетки. Такая мера клеточной активности выражается в данном описании как значение ECTFS, где ECTFS представляет собой эффективную концентрацию ингибитора Chk1, которая приводит к 2-кратной сенсибилизации популяции аберрантно пролиферирующих клеток к ингибирующему рост действию повреждающего ДНК агента. ECTFS вычисляется как концентрация ингибитора Chk1, которая снижает количество повреждающего ДНК агента, необходимое для ингибирования роста 90% клеток наполовину. Заявители обнаружили, что соединения по изобретению демонстрируют неожиданно низкие значения ECTFS, что соответствует неожиданно высокой клеточной активности. Другой параметр, который может быть измерен, - повышение чувствительности в разы, достигнутое в дозе LD50 (доза соединения, которая сама по себе ингибирует рост 50% клеток) для соединенияингибитора Chk1. Эти два значения, ECTFS и повышение чувствительности в разы при дозе LD50 позволяют осуществить прямое ранжирование ингибиторов Chk1 друг относительно друга как по активности,так и по токсичности. Пример анализа, пригодного для измерения значений ECTFS, описан в примере 3 ниже. Если коротко, в данном анализе в качестве популяции аберрантно пролиферирующих клеток используются клетки карциномы ободочной кишки человека НТ 29, гемцитабин - как повреждающий ДНК агент/активаторChk1 и соединение по изобретению - как ингибитор Chk1. Популяцию аберрантно пролиферирующих клеток культивируют и позволяют расти в подходящей среде для культивирования. Впоследствии клетки подвергают действию повреждающего ДНК агента в различных концентрациях. По прохождении предварительно определенного периода времени повреждающий ДНК агент удаляют, и клетки подвергают действию ингибитора Chk1 в различных концентрациях и на протяжении предварительно определенного периода времени. Далее собирают планшеты с культурой клеток и подсчитывают относительное количество выживших клеток. Данные нормализуют против применения только ингибитора Chk1 в качестве контроля, а затем наносят на логарифмический график концентрацию повреждающего ДНК агента против относительного выживания клетки (100% равно 1,0). Кратное увеличение чувствительности определяют на основе разницы между количеством повреждающего ДНК агента, необходимым для достижения 90% ингибирования роста с ингибитором Chk1 и без него для каждой используемой концентрации ингибитора Chk1. Затем эти данные наносят на график концентрации ингибитора Chk1 против повышения чувствительности в кратных значениях, на основе которого вычисляют ECTFS. Предпочтительно, значения ECTFS получают путем проведения анализа по крайней мере дважды, с выражением значения ECTFS как среднего полученных отдельных значений. Более предпочтительно, анализ повторяют от 3 до 10 (или более) раз и выражают значение ECTFS как среднее полученных значений. Наиболее предпочтительно, количество повторений анализа должно быть достаточным для того, чтобы генерировать надежное со статистической точки зрения среднее значение ECTFS с применением статистических методов, известных среднему специалисту в данной области. Все соединения, которые анализировали в анализе ECTFS, продемонстрировали значения ECTFS менее приблизительно 1000 нМ. И наоборот, структурно подобные соединения, которые были известны ранее, продемонстрировали значения ECTFS около 11000 нМ. В некоторых вариантах соединения по настоящему изобретению продемонстрировали значения ECTFS менее приблизительно 500 нМ, в других менее приблизительно 300 нМ, в других - менее приблизительно 200 нМ, в других - менее приблизительно 150 нМ, в других - менее приблизительно 100 нМ, в других - менее приблизительно 50 нМ, в других - менее приблизительно 30 нМ и в других - менее приблизительно 20 нМ или менее приблизительно 10 нМ или в других вариантах - менее приблизительно 5 нМ. Соединения и фармацевтические композиции, пригодные для использования по настоящему изобретению, включают такие, где активный ингредиент вводится в эффективном количестве для достиже- 28011287 ния предусмотренной цели. Более конкретно, "терапевтически эффективное количество" подразумевает количество, достаточное для лечения индивидуума, страдающего от показания, или для облегчения присутствующих симптомов показания. Определение терапевтически эффективного количества находится в пределах компетенции специалиста в данной области, особенно в свете подробного раскрытия, приведенного в данном описании. Кроме ингибитора Chk1 рецептуры фармацевтических композиций по изобретению могут включать биологически активные агенты, такие как цитокины, лимфокины, факторы роста, другие гематопоэтические факторы или их смеси с целью уменьшения нежелательных побочных эффектов, которые могут быть результатом или могут сопровождать введение фармацевтической композиции самой по себе. Альтернативно, такие биологически активные агенты могут быть включены в фармацевтические композиции по изобретению, чтобы способствовать достижению желательного терапевтического эффекта. Вспомогательные биологически активные агенты, пригодные для фармацевтических композиций по изобретению,включают, не ограничиваясь ими, M-CSF, GM-CSF, TNF, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9,IL-10, IL-11, IL-12, IL-13, IL-14, IL-15, IL-16, IL-17, IL-18, IFN, TNF, G-CSF, Meg-CSF, GM-CSF, тромбопоэтин, фактор стволовых клеток, эритропоэтин, ангиопоэтины, в том числе Ang-1, Ang-2, Ang-4, Ang-Y и/или человеческий ангиопоэтин-подобный полипептид, фактор роста эндотелия сосудов (VEGF), ангиогенин, костный морфогенный протеин-1 (ВМР-1), ВМР-2, ВМР-3, ВМР-4, BMP-5, BMP-6, BMP-7, BMP8, BMP-9, BMP-10, BMP-11, BMP-12, BMP-13, BMP-14, BMP-15, BMP рецептор IA, BMP рецептор IB,полученный из мозга нейротрофный фактор, нейротрофный фактор ресничек, рецептор нейротрофного фактора ресничек, цитокининдуцирований хемотаксический фактор 1 нейтрофилов, цитокининдуцированый хемотаксический фактор 2 нейтрофилов, фактор роста эндотелиальных клеток, эндотелии 1, эпидермальный фактор роста, выделенный из эпителия аттрактант нейтрофилов, фактор роста фибробластов (FGF) 4, FGF 5, FGF 6, FGF 7, FGF 8, FGF 8b, FGF 8c, FGF 9, FGF 10, FGF кислый, FGF основный, рецептор 1 нейротрофного фактора, полученный из линии глиальных клеток, рецептор 2 нейротрофного фактора, полученный из линии глиальных клеток, связанный с ростом белок, гепаринсвязывающий эпидермальный фактор роста, фактор роста гепатоцитов, рецептор фактора роста гепатоцитов, инсулиноподобный фактор роста I, рецептор инсулиноподобного фактора роста, инсулиноподобный фактор роста II, белок, связывающийся с инсулиноподобным фактором роста, фактор роста кератиноцитов, ингибиторный фактор лейкемии, рецептор ингибиторного фактора лейкемии, фактор роста нервов, рецептор фактора роста нервов, нейротрофин-3, нейротрофин-4, фактор роста плаценты, фактор роста плаценты 2, полученный из тромбоцитов фактор роста эндотелиальных клеток, полученный из тромбоцитов фактор роста, цепь А фактора роста, полученного из тромбоцитов, полученный из тромбоцитов фактор роста АА, полученный из тромбоцитов фактор роста АВ, цепь В фактора роста, полученного из тромбоцитов, полученный из тромбоцитов фактор роста ВВ, рецептор полученного из тромбоцитов фактора роста, фактор, стимулирующий рост пре-В клеток, фактор стволовых клеток, рецептор фактора стволовых клеток, трансформирующий фактор роста (TGF), TGF, TGF 1, TGF 1,2, TGF 2, TGF 3,TGF 5, латентный TGF 1, TGF связывающийся протеин I, TGF связывающийся протеин II, TGF связывающийся протеин III, рецептор опухолевого некротического фактора типа I, рецептор опухолевого некротического фактора типа II, рецептор активатора плазминогена урокиназного типа, фактор роста эндотелия сосудов, а также их химерные белки и биологически или иммунологически активные фрагменты. Соединения структурных формул (I) и (II) также могут быть конъюгированы или связаны со вспомогательными фрагментами, которые придают полезное свойство (или ослабляют нежелательное свойство) соединениям в способе терапевтического применения. Такие конъюгаты могут улучшать доставку соединений в конкретную анатомическую область или целевой участок (например, опухоль), поддерживать длительное время терапевтические концентрации соединений в клетках-мишенях, изменять фармакокинетические и фармакодинамические свойства соединений и/или улучшать терапевтический индекс или профиль безопасности соединений. Пригодные вспомогательные фрагменты включают, например,аминокислоты, олигопептиды или полипептиды, например антитела, такие как моноклональные антитела и другие сконструированные антитела; а также природные или синтетические лиганды рецепторов в клетках- или тканях-мишенях. Другие подходящие вспомогательные фрагменты включают остатки жирных кислот или липидов, которые способствуют распределению в биологической системе и/или захвату соединения клетками-мишенями (см., например, Bradley et al., Clin. Cancer Res. 7:3229, 2001). Препараты по настоящему изобретению могут вводиться стандартным способом для лечения указанных болезней, например, перорально, парентерально, через слизистую оболочку (например, сублингвально или буккально), местно, трансдермально, ректально, путем ингаляции (например, назальной или глубоко в легкие). Парентеральное введение включает, не ограничиваясь ими, внутривенное, внутриартериальное, внутрибрюшное, подкожное, внутримышечное, интратекальное и внутрисуставное. Парентеральное введение также может осуществляться с использованием техники высокого давления, например, POWDERJECT (Powderject Pharmaceuticals, Plc, Оксфорд, Англия). Для перорального и буккального введения композиция может иметь форму таблеток или пастилок,полученных в обычной форме. Например, таблетки и капсулы могут содержать обычные вспомогательные вещества, например связующие агенты (такие как сироп, акациевая камедь, желатин, сорбит, трага- 29011287 кантовая камедь, крахмальная слизь или поливинилпирролидон), наполнители (например, лактоза, сахар,микрокристаллическая целлюлоза, кукурузный крахмал, фосфат кальция или сорбит), смазывающие вещества (например, стеарат магния, стеариновая кислота, тальк, полиэтиленгликоль или диоксид кремния), дезинтегранты (например, картофельный крахмал или натрийкрахмалгликолят) или увлажняющие агенты (например, лаурилсульфат натрия). Таблетки могут быть покрыты оболочкой в соответствии со способами, хорошо известными из уровня техники. Альтернативно, соединения по настоящему изобретению могут быть введены в жидкие препараты для перорального применения, например водные или масляные суспензии, растворы, эмульсии, сиропы или эликсиры. Кроме того, препараты, содержащие эти соединения, могут быть представлены как сухой продукт для разбавления водой или другим подходящим носителем перед использованием. Такие жидкие препараты могут содержать обычные добавки, например суспендирующие агенты, такие как сироп сорбита, метилцеллюлоза, сироп глюкозы/сахара, желатин, гидроксиэтилцеллюлоза, гидроксипропилметилцеллюлоза, карбоксиметилцеллюлоза, гель стеарата алюминия и гидрогенизированные пищевые жиры; эмульгирующие агенты, такие как лецитин, сорбитан моноолеат или акациевая камедь; неводные носители (которые могут включать пищевые масла), такие как миндальное масло, фракционированное кокосовое масло, эфиры масел, пропиленгликоль и этиловый спирт; а также консерванты, такие как метилили пропил-п-гидроксибензоат и сорбиновая кислота. Препараты также могут иметь форму суппозиториев, например, содержать обычные суппозиторные основы, такие как масло какао или другие глицериды. Композиции для ингаляций обычно могут быть представлены в форме раствора, суспензии или эмульсии, которая может вводиться в виде сухого порошка или в форме аэрозоля, где используется обычный пропеллент, такой как дихлордифторметан или трихлорфторметан. Препараты для местного и трансдермального введения содержат обычные водные или неводные носители, например глазные капли, кремы, мази, примочки и пасты, или иметь форму медицинского пластыря, наклейки или мембраны. Кроме того, композиции по настоящему изобретению могут быть предназначены для инъекционного или инфузионного введения. Препараты для инъекций могут иметь форму суспензий, растворов или эмульсий в масляном или водном растворителе и могут содержать вспомогательные вещества, такие как суспендирующие, стабилизирующие и/или диспергирующие средства. Альтернативно, активный ингредиент может иметь форму порошка для разбавления подходящим растворителем (например, стерильной апирогенной водой) перед использованием. Композиция по настоящему изобретению также может иметь форму препарата-депо. Такие препараты пролонгированного действия могут вводиться имплантацией (например, подкожно или внутримышечно) или внутримышечной инъекцией. Соответственно, соединения по изобретению могут быть введены в препараты с подходящими полимерными материалами (например, водорастворимые полимеры),пригодными гидрофобными материалами (например, эмульсия в соответствующем масле), ионообменными смолами или слаборастворимыми производными (например, слаборастворимая соль). Для ветеринарного применения соединение формулы (I) или (II) или его фармацевтически приемлемая соль, пролекарство или сольват вводится в виде соответствующего пригодного препарата в соответствии с обычной ветеринарной практикой. Ветеринар может легко определить схему введения и способ введения, который является наиболее подходящим для конкретного животного. Животные, которые подлежат лечению данными соединениями и способами, включают, не ограничиваясь ими, домашних животных, сельскохозяйственных животных, декоративных животных и виды, содержащиеся в зоопарках. Методы синтеза Соединения по данному изобретению могут быть получены в соответствии со следующими схемами синтеза. Во-первых, алкоксиариламины, которые используются для получения описанных в данном описании ингибиторов Chk1, могут быть получены по различным общим схемам синтеза. Например, на общей схеме 1 кратко представлены реакции нитрофенола с активированной формой спирта, образующейся in situ или полученной и выделенной независимо, с получением нитрофенилового эфира в качестве продукта. Восстановление эфира в стандартных условиях дает ариламин, который используют для получения соединения по изобретению. Общая схема 1 Альтернативно, реакция галогензамещенного нитробензола со спиртом в присутствии сильного основания, такого как гидрид натрия или бис(триметилсилил)амид калия, также дает нитроарильные эфиры, как проиллюстрировано на общей схеме 2. Затем указанные эфиры восстанавливают, как показано на общей схеме 1.
МПК / Метки
МПК: C07D 413/12, A61K 31/541, C07D 403/12, A61K 31/5355, A61P 35/00, A61K 31/497, C07D 417/12
Метки: ингибирования, пригодные, производные, гетероарилмочевины
Код ссылки
<a href="https://eas.patents.su/30-11287-proizvodnye-geteroarilmocheviny-prigodnye-dlya-ingibirovaniya-chk1.html" rel="bookmark" title="База патентов Евразийского Союза">Производные гетероарилмочевины, пригодные для ингибирования chk1</a>
Предыдущий патент: Таблетка для профилактики и лечения заболеваний зубов и пародонта
Следующий патент: Способ удержания плазмы, имеющей электроны и ионы, в камере
Случайный патент: Дозирующие ингаляторы вытеснительного типа