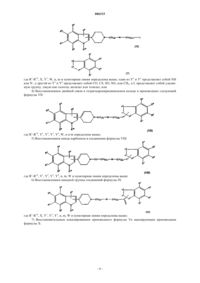
Производные индола, пригодные для лечения расстройств цнс
Номер патента: 6315
Опубликовано: 27.10.2005
Авторы: Келер Ян, Андерсен Ким, Банг-Андерсен Бенни, Феллинг Якоб
Формула / Реферат
1. Замещенное производное индола формулы I
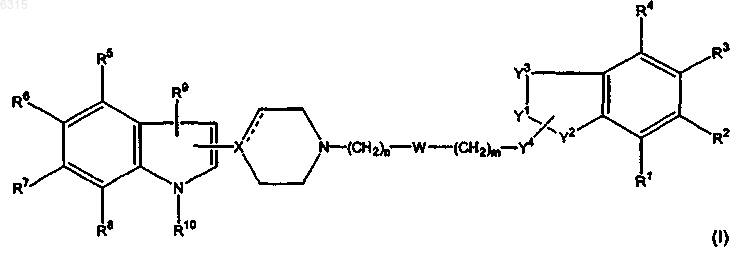
где (a) один из Y1 и Y2 представляет собой N, который связан с Y4, а другой из Y1 и Y2 представляет собой CO, CS, SO или SO2 и Y4 представляет собой CH2;
(b) один из Y1 и Y2 представляет собой N, который связан с Y4, а другой из Y1 и Y2 представляет собой CH2 и Y4 представляет собой CO, CS, SO или SO2; или
(c) один из Y1 и Y2 представляет собой N, который связан с Y4, а другой из Y1 и Y2 представляет собой CH2 и Y4 представляет собой CH2;
Y3 представляет собой Z-CH2, CH2-Z или CH2CH2, а Z представляет собой O или S; при условии, что когда Y1 представляет собой N, Y3 может не быть Z-CH2;
W представляет собой связь или группу O, S, CO, CS, SO или SO2;
n равно 0-5, m равно 0-5, а m+n равно 1-10; при условии, что когда W представляет собой O или S, то n_ 2, а m_ 1; когда W представляет собой CO, CS, SO или SO2, то n_ 1, а m_ 1;
X представляет собой C, CH или N; при условии, что когда X представляет собой C, пунктирная линия обозначает связь, а когда X представляет собой N или CH, пунктирная линия не является связью;
R1-R9 независимо выбраны из водорода, галогена, цианогруппы, нитрогруппы, аминогруппы, гидроксильной группы, C1-6-алкиламина, ди-C1-6-алкиламина, C1-6-алкила, C2-6-алкенила, C2-6-алкинила, C1-6-алкокси, C1-6-алкилтио, C1-6-алкила, замещенного гидроксильной группой или тиоловой группой, C3-8-циклоалкила, C3-8-циклоалкил-C1-6-алкила, ацильной группы, тиоацильной группы, арильной группы, трифторметильной группы, трифторметилсульфонильной группы и C1-6-алкилсульфонила;
R10 представляет собой водород, C1-6-алкил, C2-6-алкенил, C2-6-алкинил, C1-6-алкил, замещенный гидроксильной группой или тиоловой группой, C3-8-циклоалкил, C3-8-циклоалкил-C1-6-алкил, арильную группу, арил-C1-6-алкил, ацильную группу, тиоацильную группу, C1-6-алкилсульфонил, трифторметилсульфонильную или арилсульфонильную группу,
или его фармацевтически приемлемая кислотно-аддитивная соль.
2. Соединение по п.1, в котором индол связан с X по позиции 3 индола.
3. Соединение по п.1 или 2, в котором один из Y1 и Y2 представляет собой N, который связан с Y4, а другой из Y1 и Y2 представляет собой CO и Y4 представляет собой CH2.
4. Соединение по п.1 или 2, в котором один из Y1 и Y2 представляет собой N, который связан с Y4, а другой из Y1 и Y2 представляет собой CH2 и Y4 представляет собой CO.
5. Соединение по п.1 или 2, в котором Y1 представляет собой азот, который связан с Y4, а один из Y4 и Y2 представляет собой CO, а другой представляет собой CH2.
6. Соединение по п.3 или 5, в котором Y1 представляет собой азот, который связан с Y4, Y2 представляет собой CO, а Y4 представляет собой CH2.
7. Соединение по п.4 или 5, в котором Y1 представляет собой азот, который связан с Y4, Y2 представляет собой CH2, а Y4 представляет собой CO.
8. Соединение по п.1 или 2, в котором Y2 представляет собой азот, который связан с Y4, а один из Y1 и Y4 представляет собой CO, а другой представляет собой CH2.
9. Соединение по п.4 или 8, в котором Y2 представляет собой атом азота, который связан с Y4, Y1 представляет собой CH2, а Y4 представляет собой CO.
10. Соединение по п.3 или 8, в котором Y2 представляет собой атом азота, который связан с Y4, Y1 представляет собой CO, а Y4 представляет собой CH2.
11. Соединение по п.1 или 2, в котором один из Y1 и Y2 представляет собой N, который связан с Y4, а другой из Y1 и Y2 представляет собой CH2 и Y4 представляет собой CH2.
12. Соединение по любому из пп.1-11, в котором Y3 представляет собой CH2CH2 или CH2Z.
13. Соединение по любому из пп.1-12, в котором X представляет собой C.
14. Соединение по любому из пп.1-12, в котором X представляет собой N.
15. Соединение по любому из пп.1-12, в котором X представляет собой CH.
16. Соединение по любому из пп.1-15, в котором R1-R9 независимо выбраны из водорода, галогена, цианогруппы, нитрогруппы, аминогруппы, C1-6-алкиламина, ди-C1-6-алкиламина, C1-6-алкила, C3-8-циклоалкила и трифторметильной группы, а R10 представляет собой водород, C1-6-алкил или ацильную группу, и/или его фармацевтически приемлемая кислотно-аддитивная соль.
17. Соединение по любому из пп.1-16, в котором W представляет собой связь, а n+m равно 1-6.
18. Соединение по п.17, в котором n+m равно 3-6.
19. Соединение по п.1, выбранное из
5-фтор-3-{1-[2-(2-оксо-3,4-дигидро-2H-хинолин-1-ил)этил]пиперидин-4-ил}-1H-индола,
5-фтор-3-{1-[3-(1-оксо-3,4-дигидро-1H-хинолин-2-ил)пропан-1-ил]пиперидин-4-ил}-1H-индола,
5-фтор-3-{1-[4-(1-оксо-3,4-дигидро-1H-хинолин-2-ил)бутан-1-ил]пиперидин-4-ил}-1H-индола,
5-фтор-3-{1-[3-(2-оксо-3,4-дигидро-2H-хинолин-1-ил)пропан-1-ил]пиперидин-4-ил}-1H-индола,
5-фтор-3-{1-[5-(2-оксо-3,4-дигидро-2H-хинолин-1-ил)пентан-1-ил]пиперидин-4-ил}-1H-индола,
5-хлор-3-{1-[3-(2-оксо-3,4-дигидро-2H-хинолин-1-ил)пропан-1-ил]пиперидин-4-ил}-1H-индола,
5-хлор-3-{1-[4-(2-оксо-3,4-дигидро-2H-хинолин-1-ил)бутан-1-ил]пиперидин-4-ил}-1H-индола,
5-хлор-3-{1-[5-(2-оксо-3,4-дигидро-2H-хинолин-1-ил)пентан-1-ил]пиперидин-4-ил}-1H-индола,
7-хлор-3-{1-[4-(2-оксо-3,4-дигидро-2H-хинолин-1-ил)бутан-1-ил]пиперидин-4-ил}-1H-индола,
5-фтор-3-{1-[4-(3-оксо-3,4-дигидро-2H-1,4-бензоксазин-4-ил)бутан-1-ил]пиперидин-4-ил}-1H-индола,
5-хлор-3-{1-[4-(3-оксо-3,4-дигидро-2H-1,4-бензоксазин-4-ил)бутан-1-ил]пиперидин-4-ил}-1H-индола,
5-фтор-3-{1-[3-(2-оксо-3,4-дигидро-2H-хинолин-1-ил)пропан-1-ил]-3,6-дигидро-2H-пиридин-4-ил}-1H-индола,
5-фтор-3-{1-[4-(2-оксо-3,4-дигидро-2H-хинолин-1-ил)бутан-1-ил]-3,6-дигидро-2H-пиридин-4-ил}-1H-индола,
5-фтор-3-{1-[5-(2-оксо-3,4-дигидро-2H-хинолин-1-ил)пентан-1-ил]-3,6-дигидро-2H-пиридин-4-ил}-1H-индола,
5-фтор-3-{1-[4-(2-оксо-3,4-дигидро-2H-хинолин-1-ил)бутан-1-ил]пиперидин-4-ил}-1H-индола,
5-фтор-1-метил-3-{1-[3-(2-оксо-3,4-дигидро-2H-хинолин-1-ил)пропан-1-ил]пиперидин-4-ил}-1H-индола,
5-фтор-1-метил-3-{1-[4-(2-оксо-3,4-дигидро-2H-хинолин-1-ил)бутан-1-ил]пиперидин-4-ил}-1H-индола,
1-(бутан-1-ил)-5-фтор-3-{1-[4-(2-оксо-3,4-дигидро-2H-хинолин-1-ил)бутан-1-ил]-3,6-дигидро-2H-пиридин-4-ил}-1H-индола,
5-фтор-3-{1-[3-(3,4-дигидро-1H-изохинолин-2-ил)-3-оксопропан-1-ил]пиперидин-4-ил}-1H-индола,
7-хлор-3-{1-[3-(3,4-дигидро-1H-изохинолин-2-ил)-3-оксопропан-1-ил]пиперидин-4-ил}-1H-индола,
5-хлор-3-{1-[4-(3,4-дигидро-2H-хинолин-1-ил)-4-оксобутан-1-ил]пиперидин-4-ил}-1H-индола,
5-фтор-3-{1-[4-(3,4-дигидро-1H-изохинолин-2-ил)-4-оксобутан-1-ил]пиперидин-4-ил}-1H-индола,
5-хлор-3-{1-[4-(3,4-дигидро-1H-изохинолин-2-ил)-4-оксобутан-1-ил]пиперидин-4-ил}-1H-индола,
5-фтор-3-{1-[3-(3,4-дигидро-2H-хинолин-1-ил)пропан-1-ил]пиперидин-4-ил}-1H-индола,
5-фтор-3-{1-[4-(3,4-дигидро-2H-хинолин-1-ил)бутан-1-ил]пиперидин-4-ил}-1H-индола,
5-фтор-3-{1-[5-(3,4-дигидро-2H-хинолин-1-ил)пентан-1-ил]пиперидин-4-ил}-1H-индола,
5-хлор-3-{1-[3-(3,4-дигидро-2H-хинолин-1-ил)пропан-1-ил]пиперидин-4-ил}-1H-индола,
5-хлор-3-{1-[4-(3,4-дигидро-2H-хинолин-1-ил)бутан-1-ил] пиперидин-4-ил}-1H-индола,
5-хлор-3-{1-[5-(3,4-дигидро-2H-хинолин-1-ил)пентан-1-ил]пиперидин-4-ил}-1H-индола,
7-хлор-3-{1-[4-(3,4-дигидро-2H-хинолин-1-ил)бутан-1-ил]пиперидин-4-ил}-1H-индола,
5-фтор-1-метил-3-{1-[3-(3,4-дигидро-2H-хинолин-1-ил)пропан-1-ил]пиперидин-4-ил}-1H-индола,
5-фтор-1-метил-3-{1-[4-(3,4-дигидро-2H-хинолин-1-ил)бутан-1-ил]пиперидин-4-ил}-1H-индола,
5-фтор-3-{1-[4-(3,4-дигидро-2H-1,4-бензоксазин-4-ил)бутан-1-ил]пиперидин-4-ил}-1H-индола,
5-хлор-3-{1-[4-(3,4-дигидро-2H-1,4-бензоксазин-4-ил)бутан-1-ил]пиперидин-4-ил}-1H-индола,
5-фтор-3-{1-[3-(3,4-дигидро-2H-хинолин-1-ил)пропан-1-ил] 3,6-дигидро-2H-пиридин-4-ил}-1H-индола,
5-фтор-3-{1-[4-(3,4-дигидро-2H-хинолин-1-ил)бутан-1-ил]-3,6-дигидро-2H-пиридин-4-ил}-1H-индола,
5-фтор-3-{1-[5-(3,4-дигидро-2H-хинолин-1-ил)пентан-1-ил] 3,6-дигидро-2H-пиридин-4-ил}-1H-индола,
4-фтор-3-{1-[3-(3,4-дигидро-1H-изохинолин-2-ил)-3-оксопропан-1-ил]пиперидин-4-ил}-1H-индола,
4-фтор-3-{1-[4-(3,4-дигидро-1H-изохинолин-2-ил)-4-оксобутан-1-ил]пиперидин-4-ил}-1H-индола,
4-фтор-3-{1-[6-(3,4-дигидро-1H-изохинолин-2-ил)-6-оксогексан-1-ил]пиперидин-4-ил}-1H-индола,
4-хлор-3-{1-[4-(3,4-дигидро-1H-изохинолин-2-ил)-4-оксобутан-1-ил]пиперидин-4-ил}-1H-индола,
4-хлор-3-{1-[5-(3,4-дигидро-1H-изохинолин-2-ил)-5-оксопентан-1-ил]пиперидин-4-ил}-1H-индола,
4-хлор-3-{1-[6-(3,4-дигидро-1H-изохинолин-2-ил)-6-оксогексан-1-ил]пиперидин-4-ил}-1H-индола,
5-фтор-3-{1-[5-(3,4-дигидро-1H-изохинолин-2-ил)-5-оксопентан-1-ил]пиперидин-4-ил}-1H-индола,
5-фтор-3-{1-[6-(3,4-дигидро-1H-изохинолин-2-ил)-6-оксогексан-1-ил]пиперидин-4-ил}-1H-индола,
6-хлор-3-{1-[3-(3,4-дигидро-1H-изохинолин-2-ил)-3-оксопропан-1-ил]пиперидин-4-ил}-1H-индола,
6-хлор-3-{1-[6-(3,4-дигидро-1H-изохинолин-2-ил)-6-оксогексан-1-ил]пиперидин-4-ил}-1H-индола,
7-хлор-3-{1-[4-(3,4-дигидро-1H-изохинолин-2-ил)-4-оксобутан-1-ил]пиперидин-4-ил}-1H-индола,
7-хлор-3-{1-[5-(3,4-дигидро-1H-изохинолин-2-ил)-5-оксопентан-1-ил]пиперидин-4-ил}-1H-индола,
7-хлор-3-{1-[6-(3,4-дигидро-1H-изохинолин-2-ил)-6-оксогексан-1-ил]пиперидин-4-ил}-1H-индола,
4-фтор-3-{1-[3-(3,4-дигидро-2H-хинолин-1-ил)-3-оксопропан-1-ил]пиперидин-4-ил}-1H-индола,
4-фтор-3-{1-[4-(3,4-дигидро-2H-хинолин-1-ил)-4-оксобутан-1-ил]пиперидин-4-ил}-1H-индола,
4-хлор-3-{1-[3-(3,4-дигидро-2H-хинолин-1-ил)-3-оксопропан-1-ил]пиперидин-4-ил}-1H-индола,
4-хлор-3-{1-[4-(3,4-дигидро-2H-хинолин-1-ил)-4-оксобутан-1-ил]пиперидин-4-ил}-1H-индола,
5-фтор-3-{1-[3-(3,4-дигидро-2H-хинолин-1-ил)-3-оксопропан-1-ил]пиперидин-4-ил}-1H-индола,
5-фтор-3-{1-[4-(3,4-дигидро-2H-хинолин-1-ил)-4-оксобутан-1-ил]пиперидин-4-ил}-1H-индола,
5-фтор-3-{1-[5-(3,4-дигидро-2H-хинолин-1-ил)-5-оксопентан-1-ил]пиперидин-4-ил}-1H-индола,
5-фтор-3-{1-[6-(3,4-дигидро-2H-хинолин-1-ил)-6-оксогексан-1-ил]пиперидин-4-ил}-1H-индола,
6-хлор-3-{1-[3-(3,4-дигидро-2H-хинолин-1-ил)-3-оксопропан-1-ил]пиперидин-4-ил}-1H-индола,
6-хлор-3-{1-[6-(3,4-дигидро-2H-хинолин-1-ил)-6-оксогексан-1-ил]пиперидин-4-ил}-1H-индола,
7-хлор-3-{1-[4-(3,4-дигидро-2H-хинолин-1-ил)-4-оксобутан-1-ил]пиперидин-4-ил}-1H-индола,
7-хлор-3-{1-[5-(3,4-дигидро-2H-хинолин-1-ил)-5-оксопентан-1-ил]пиперидин-4-ил}-1H-индола,
7-хлор-3-{1-[6-(3,4-дигидро-2H-хинолин-1-ил)-6-оксогексан-1-ил]пиперидин-4-ил}-1H-индола,
5-фтор-3-{1-[4-(3,4-дигидро-1H-изохинолин-2-ил)бутан-1-ил]пиперидин-4-ил}-1H-индола,
5-фтор-3-{1-[4-(6,7-диметокси-3,4-дигидро-1H-изохинолин-2-ил)бутан-1-ил]пиперидин-4-ил}-1H-индола
или их фармацевтически приемлемых солей.
20. Фармацевтическая композиция, включающая терапевтически эффективное количество соединения по любому из пп.1-19 в сочетании с одним или более фармацевтически приемлемым носителем или разбавителем.
21. Применение соединения по любому из пп.1-19 для производства лекарственного средства, пригодного для лечения положительных и отрицательных симптомов шизофрении, других психозов, тревожных расстройств, таких как генерализованное тревожное расстройство, паническое расстройство и обсессивно-компульсивное расстройство, депрессии, агрессии, побочных эффектов, индуцированных обычными антипсихотическими агентами, мигрени, когнитивных расстройств, ADHD, а также для улучшения сна.
22. Способ лечения положительных и отрицательных симптомов шизофрении, других психозов, тревожных расстройств, таких как генерализованное тревожное расстройство, паническое расстройство и обсессивно-компульсивное расстройство, депрессии, агрессии, побочных эффектов, индуцированных обычными антипсихотическими агентами, мигрени, когнитивных расстройств, ADHD, а также улучшения сна, включающий введение терапевтически эффективного количества соединения по любому из пп.1-19.
Текст
006315 Область изобретения Настоящее изобретение относится к новому классу производных индола, обладающих аффинностью в отношении дофаминового рецептора D4. Данные соединения оказывают антагонистическое действие на дофаминовый рецептор D4 и, таким образом, являются пригодными для лечения определенных психических и неврологических расстройств, в частности, психозов. Некоторые из данных соединений обладают также аффинностью в отношении дофаминового рецептора D3, рецептора 5-НТ 2 А и/или рецептора, 5-НТ 2 с, а некоторые из данных соединений являются ингибиторами обратного захвата серотонина. Предпосылки к созданию изобретения Лиганды дофаминовых рецепторов D4, родственные соединениям по настоящему изобретению, известны из WO 98/28293. Производные индана и дигидроиндола, описанные в указанном документе,имеют общую формулу где А представляет собой индол, a Y представляет собой группу, завершающую индан или дигидроиндол, и другие заместители, определенные в заявке.WO 00/23441 описывает соединения общей формулы где заместители R1, R2, R3, m, n и р определены в заявке. Говорится о том, что данные соединения показывают высокую аффинность в отношении дофаминовых рецепторов D2, а также о том, что они являются ингибиторами обратного захвата серотонина. Заявляется о том, что данные соединения являются пригодными для лечения шизофрении и других психических расстройств. Другие соединения, структурно родственные соединениям по настоящему изобретению, описаны вWO 99/58525. Говорится о том, что соединения, описанные в указанном документе, являются лигандами 5-НТ 2A и ингибиторами обратного захвата серотонина и имеют общую формулу где заместители определены в заявке. Говорится о том, что данные соединения являются пригодными для лечения шизофрении. WO 00/31074 относится к соединениям общей формулы где X представляет собой СО или SO2, a Y представляет собой N-R4 или CR4R5, и заместители определены в заявке. Говорится о том, что данные соединения являются активными в отношении рецептора 5 НТ 2A, обладают ингибирующей активностью в отношении обратного захвата 5-НТ и усиливают высвобождение 5-НТ. Заявки WO 94/18197, ЕР 329168, WO 93/16073, ЕР 732332, WO 98/37893 и WO 95/11680 описывают лиганды дофаминовых рецепторов D4, которые, подобно соединениям по настоящему изобретению,представляют собой замещенные производные тетрагидрохинолинона и тетрагидроизохинолинона. Однако данные соединения не содержат индола, как соединения по настоящему изобретению. Говорится о том, что данные соединения являются лигандами дофаминовых рецепторов D4, пригодными в качестве-1 006315 антипсихотических лекарственных средств. Заявляется также, что соединения, описанные в WO 93/16073, обладают антагонистической активностью в отношении рецепторов 5-НТ 2. Дофаминовые рецепторы D4 принадлежат к подсемейству дофаминовых рецепторов D2, которое считается ответственным за антипсихотический эффект нейролептиков. Побочные эффекты нейролептических лекарственных средств, которые оказывают свое действие, прежде всего, через антагонизм в отношении рецепторов D2, как известно, возникают в результате антагонизма в отношении рецепторов D2 в стриарных областях головного мозга. Однако дофаминовые рецепторы D4 расположены, прежде всего, в других, а не стриарных, областях головного мозга, что наводит на мысль о том, что антагонисты дофаминового рецептора D4 будут лишены экстрапирамидных побочных эффектов. Это показывает антипсихотическое лекарственное средство клозапин, которое проявляет более высокую аффинность в отношении рецепторов D4, чем D2, и не имеет экстрапирамидных побочных эффектов (Van Tol et al. Nature 1991,350, 610; Hadley Medicinal Research Reviews 1996, 16, 507-526 и Sanner Exp. Opin. Ther. Patents 1998, 8,383-393). Показано, что ряд лигандов D4, которые, как заявлено, являются селективными антагонистами рецептора D4 (L-745879 и U-101958), обладают антипсихотическим потенциалом (Mansbach et al. Psychopharmacology 1998, 135, 194-200). Однако, недавно сообщалось, что данные соединения являются частичными агонистами рецепторов D4 в различных in vitro исследованиях эффективности (Gazi et al. Br. J.Pharmacol. 1998, 124, 889-896 и Gazi et al. Br. J. Pharmacol. 1999, 128, 613-620). Кроме того, было показано, что клозапин, который является эффективным антипсихотическим лекарственным средством, является скрытым антагонистом (Gazi et al. Br. J. Pharmacol. 1999, 128, 613-620). Таким образом, лиганды D4, которые являются частичными агонистами или антагонистами рецепторов D4, могут обладать благоприятным действием при психозах. Антагонисты дофаминовых рецепторов D4 также могут быть пригодными для лечения когнитивных дефицитов (Jentsch et al. Psychopharmacology 1999, 142, 78-84). Кроме того, были опубликованы данные, свидетельствующие о генетической связи между "первично невнимательным" подтипом ADHD и полиморфизмом тандемных дупликаций в гене, кодирующем дофаминовый рецептор D4 (McCracken et al. Mol. Psychiat. 2000, 5, 531-536). Это ясно указывает на связь между дофаминовым рецептором D4 и ADHD, и лиганды, действующий на указанный рецептор, могут быть пригодными для лечения данного конкретного расстройства. Дофаминовые рецепторы D3 также принадлежат к подсемейству дофаминовых рецепторов D2, и они расположены, преимущественно, в лимбических областях головного мозга (Sokoloff et al. Nature 1990, 347, 146-151), таких как nucleus accumbens, где блокада дофаминовых рецепторов связана с антипсихотической активностью (Willner Int. Clinical Psychopharmacology 1997, 12, 297-308). Кроме того, сообщалось о повышении уровня рецепторов D3 в лимбической части головного мозга людей, страдающих шизофренией (Gurevich et al. Arch. Gen. Psychiatry 1997, 54, 225-32). Следовательно, антагонисты рецепторов D3 потенциально могут использоваться для эффективной антипсихотической терапии без экстрапирамидных побочных эффектов, присущих классическим антипсихотическим лекарственным средствам, которые оказывают свое действие, прежде всего, за счет блокады рецепторов D2 (Shafer et al. Psychopharmacology 1998, 135, 1-16 и Schwartz et al. Brain Research Reviews 2000, 31, 277-287. Кроме того, блокада рецепторов D3 вызывает легкую стимуляцию префронтальной коры головного мозга (Merchant et al. Cerebral Cortex 1996, 6, 561-570), что может быть благоприятным против отрицательных симптомов и когнитивных дефицитов, связанных с шизофренией. Помимо этого, антагонисты рецепторов D3 могут реверсировать индуцированный антагонистом D2 EPS (Millan et al. Eur. J. Pharmacol. 1997, 321, R7-R9), и не вызывают изменений уровня пролактина (Reavill et al. J. Pharmacol. Exp. Ther. 2000, 294, 1154-1165). Следовательно, антагонистические в отношении D3 свойства антипсихотического лекарственного средства могут снижать отрицательные симптомы и когнитивные дефициты и приводить к улучшению профиля побочных эффектов в точки зрения EPS и гормональных изменений. Считается также, что агонисты дофаминовых рецепторов D3 пригодны для лечения шизофрении(Wustow et al. Current Pharmaceutical Design 1997, 3, 391-404). Известны различные эффекты, связанные с соединениями, которые являются лигандами различных подтипов серотониновых рецепторов. Что касается рецептора 5-НТ 2A, которые прежде называли рецептором 5-НТ 2, сообщалось о следующих эффектах, например: Антидепрессивный эффект и улучшение качества сна (Meert et al. Drug Dev. Res. 1989, 18, 119),уменьшение отрицательных симптомов шизофрении и экстрапирамидных побочных эффектов, вызванных лечением классическими нейролептиками, у пациентов, страдающих шизофренией (Gelders British J.Psychiatry 1989, 155 (suppl. 50), 33). Кроме того, селективные антагонисты 5-НТ 2 А могли бы быть эффективными для профилактики и лечения мигрени (Scrip Report; "Migraine - Current trends in research andtreatment"; PJB Publications Ltd., май 1991) и для лечения тревожных состояний (Colpart et al. Psychopharmacology 1985, 86, 303-305 и Perregaard et al. Current Opinion in Therapeutic Patents 1993, 1, 101-128). В некоторых клинических исследованиях подтипу рецепторов 5-НТ 2 приписывают роль в агрессивном поведении. Кроме того, атипичные нейролептики, являющиеся антагонистами серотониновыхдофаминовых рецепторов, обладают антагонистическим в отношении рецепторов 5-НТ 2 действием, по-2 006315 мимо их свойств блокировать дофаминовые рецепторы, и, как сообщается, обладают свойствами лечить агрессивное поведение (Connor et al. Exp. Opin. Ther. Patents 1998, 8(4), 350-351). В последнее время также накоплены данные, свидетельствующие в пользу селективных антагонистов 5-НТ 2A как лекарственных средств, способных лечить положительные симптомы психоза (Leysen et al. Current PharmaceuticalDesign 1997, 3, 367-390 и Carlsson Current Opinion in CPNS Investigational Drugs 2000, 2(1), 22-24). Соединения, которые являются ингибиторами обратного захвата 5-НТ, хорошо известны как антидепрессанты. Лиганды 5-НТ 2 с, как было установлено, усиливают действие ингибиторов обратного захвата 5-НТ в экспериментах с микродиализом и на экспериментальных животных, а соединения, имеющие ингибирующее обратный захват 5-НТ действие, в сочетании с аффинностью в отношении рецептора 5-НТ 2 с,могут, следовательно, быть особенно пригодными для лечения депрессии и других расстройств, поддающихся лечению ингибиторами обратного захвата серотонина (РСТ заявкаPCT/DK00/00671). Соответственно, лиганды дофаминовых рецепторов D4 представляют собой потенциальные лекарственные средства для лечения шизофрении и других психозов, а соединения с комбинированными эффектами в отношении транспортера 5-НТ могут иметь дополнительные преимущества с точки зрения улучшенного действия на депрессивные и отрицательные симптомы у пациентов, страдающих шизофренией. Соединения с комбинированным действием на дофаминовый рецептор D4 и рецептор 5-НТ 2 А могут иметь дополнительные преимущества с точки зрения улучшенного действия на положительные и отрицательные симптомы шизофрении, и дополнительные преимущества с точки зрения действия на депрессивные и тревожные симптомы. Кроме того, антагонистические в отношении дофаминовых рецепторовD3 свойства антипсихотического лекарственного средства могут редуцировать отрицательные симптомы и когнитивные дефициты шизофрении и вызывать улучшение профиля побочных эффектов. Краткое описание существа изобретения Целью настоящего изобретения является получение соединений, которые являются частичными агонистами или антагонистами дофаминового рецептора D4, и подобных соединений с комбинированными эффектами в отношении дофаминового рецептора D4, рецептора D3, рецептора 5-НТ 2 А, рецептора 5-НТ 2 с и/или транспортера 5-НТ. Еще одной целью настоящего изобретения является создание соединений с указанными свойствами, которые имеют улучшенную растворимость по сравнению с известными ранее соединениямипрототипами. Соответственно, настоящее изобретение относится к новым соединениям формулы I(a) один из Y1 и Y2 представляет собой N, который связан с Y4, а другой из Y1 и Y2 представляет собой СО, CS, SO или SO2, и Y4 представляет собой СН 2;(b) один из Y1 и Y2 представляет собой N, который связан с Y4, а другой из Y1 и Y2 представляет собой СН 2, и Y4 представляет собой СО, CS, SO или SO2; или(c) один из Y1 и Y2 представляет собой N, который связан с Y4, а другой из Y1 и Y2 представляет собой СН 2, и Y4 представляет собой CH2;Y3 представляет собой Z-CH2, CH2-Z или СН 2 СН 2, a Z представляет собой О или S; при условии,что, когда Y1 представляет собой N, Y3 может не быть Z-CH2;W представляет собой связь или группу О, S, CO, CS, SO или SO2;X представляет собой С, СН или N; при условии, что, когда X представляет собой С, пунктирная линия обозначает связь, а когда X представляет собой N или СН, пунктирная линия не является связью;R1-R9 независимо выбраны из водорода, галогена, цианогруппы, нитрогруппы, аминогруппы, гидроксильной группы, C1-6-алкиламина, ди-C1-6-алкиламина, C1-6-алкила, C2-6-алкенила, C2-6-алкинила, C1-6 алкокси, C1-6-алкилтио, C1-6-алкила, замещенного гидроксильной группой или тиоловой группой, C3-8 циклоалкила, C3-8-циклоалкил-C1-6-алкила, ацильной группы, тиоацильной группы, арильной группы, трифторметильной группы, трифторметилсульфонильной группы и C1-6-алкилсульфонила;R10 представляет собой водород, C1-6-алкил, C2-6-алкенил, C2-6-алкинил, C1-6-алкил, замещенный гидроксильной группой или тиоловой группой, C3-8-циклоалкил, C3-8-циклоалкил-C1-6-алкил, арильную-3 006315 группу, арил-C1-6-алкил, ацильную группу, тиоацильную группу, C1-6-алкилсульфонил, трифторметилсульфонильную или арилсульфонильную группу, или к его фармацевтически приемлемым кислотноаддитивным солям. В первом конкретном варианте осуществления настоящего изобретения индол связан с X по 3 позиции индола. Во втором варианте осуществления настоящего изобретения один из Y1 и Y2 представляет собой N,который связан с Y4, а другой из Y1 и Y2 представляет собой СО, и Y4 представляет собой СН 2. В третьем варианте осуществления настоящего изобретения один из Y1 и Y2 представляет собой N,который связан с Y4, а другой из Y1 и Y2 представляет собой СН 2, и Y4 представляет собой СО. В четвертом варианте осуществления настоящего изобретения Y1 представляет собой азот, который связан с Y4, а один из Y4 и Y2 представляет собой СО, а другой представляет собой СН 2. В пятом варианте осуществления настоящего изобретения Y1 представляет собой азот, который связан с Y4, Y2 представляет собой СО, a Y4 представляет собой СН 2. В шестом варианте осуществления настоящего изобретения Y1 представляет собой азот, который связан с Y4, Y2 представляет собой СН 2, a Y4 представляет собой СО. В седьмом варианте осуществления настоящего изобретения Y2 представляет собой азот, который связан с Y4, а один из Y1 и Y4 представляет собой СО, а другой представляет собой СН 2. В восьмом варианте осуществления настоящего изобретения Y2 представляет собой азот, который связан с Y4, Y1 представляет собой СН 2, a Y4 представляет собой СО. В девятом варианте осуществления настоящего изобретения Y2 представляет собой азот, который связан с Y4, Y1 представляет собой СО, a Y4 представляет собой СН 2. В десятом варианте осуществления настоящего изобретения один из Y1 и Y2 представляет собой N,который связан с Y4, а другой из Y1 и Y2 представляет собой СН 2, и Y4 представляет собой СН 2. Указанные соединения, предпочтительно, находятся в форме их фармацевтически приемлемых двойных солей. В еще одном варианте осуществления настоящего изобретения Y3 представляет собой СН 2 СН 2 илиCH2Z. В еще одних вариантах осуществления настоящего изобретения X представляет собой С, X представляет собой N или X представляет собой СН. Заместители R1-R9, в частности, выбраны из водорода, галогена, цианогруппы, нитрогруппы, аминогруппы, C1-6-алкиламина, ди-С 1-6-алкиламина, С 1-6-алкила, С 3-8-циклоалкила и трифторметильной группы, a R10 представляет собой водород, C1-6-алкил или ацильную группу, и/или W представляет собой связь, а n+m равно от 1 до 6, в частности, от 3 до 6. Соединения по настоящему изобретению являются частичными агонистами или антагонистами дофаминового рецептора D4. Многие соединения обладают комбинированным действием на дофаминовый рецептор D4 и дофаминовый рецептор D3, рецептор 5-НТ 2 А, рецептор 5-НТ 2 с и/или действием, ингибирующим обратный захват 5-НТ. Соответственно, соединения по настоящему изобретению считаются пригодными для лечения положительных и отрицательных симптомов шизофрении, других психозов, тревожных расстройств, таких как генерализованное тревожное расстройство, паническое расстройство и обсессивно-компульсивное расстройство, депрессии, агрессии, побочных эффектов, индуцированных обычными антипсихотическими агентами, мигрени, когнитивных расстройств, ADHD, а также для улучшения сна. В другом аспекте настоящее изобретение относится к фармацевтической композиции, включающей по меньшей мере одно соединение формулы I, как определено выше, или его фармацевтически приемлемую кислотно-аддитивную соль в терапевтически эффективном количестве и в сочетании с одним или более фармацевтически приемлемыми носителями или разбавителями. В еще одном аспекте настоящее изобретение относится к применению соединения формулы I, как определено выше, или его кислотно-аддитивной соли для производства фармацевтического препарата для лечения упомянутых выше расстройств. Подробное описание изобретения Соединения общей формулы I могут существовать в виде оптических изомеров, и указанные оптические изомеры также входят в объем настоящего изобретения. Термин C1-6-алкилотносится к разветвленной или неразветвленной алкильной группе, имеющей от одного до шести атомов углерода, такой как метил, этил, 1-пропил, 2-пропил, 1-бутил, 2-бутил, 2 метил-2-пропил, 2-метил-1-пропил, пентил и гексил. Подобно этому, С 2-6-алкенил или С 2-6-алкинил, соответственно, обозначают указанные группы,имеющие от двух до шести атомов углерода, включающие одну двойную связь и тройную связь, соответственно, такие как этенил, пропенил, бутенил, этинил, пропинил и бутинил. Термины C1-6-алкокси, C1-6-алкилтио, C1-6-алкилсульфонил, C1-6-алкиламин, C1-6-алкилкарбонил и т.п. обозначают указанные группы, в которых алкильная группа представляет собой С 1-6-алкил, как определено выше. Термин С 3-8-циклоалкил обозначает моноциклический или бициклический карбоцикл, имеющий от-4 006315 трех до восьми С-атомов, такой как циклопропил, циклопентил, циклогексил и т.п. Термин арил относится к карбоциклической ароматической группе, такой как фенил, нафтил, в частности, фенил, включая фенил, замещенный метилом, или нафтил. Галоген означает фтор, хлор, бром или йод. Используемый в настоящем документе термин ацил относится к формильной, C1-6-алкилкарбонильной, арилкарбонильной, арил-C1-6-алкилкарбонильной, С 3-8 циклоалкилкарбонильной или С 3-8-циклоалкил-С 1-6-алкилкарбонильной группе, а термин тиоацил относится к соответствующей ацильной группе, в которой карбонильная группа заменена на тиокарбонильную группу. Кислотно-аддитивные соли соединений по настоящему изобретению представляют собой фармацевтически приемлемые соли, образованные с нетоксичными кислотами. Примерами указанных органических солей являются соли с малеиновой, фумаровой, бензойной, аскорбиновой, янтарной, щавелевой,бис-метиленсалициловой, метансульфоновой, этандисульфоновой, уксусной, пропионовой, винной, салициловой, лимонной, глюконовой, молочной, яблочной, миндальной, циннамовой, цитраконовой, аспаргиновой, стеариновой, пальмитиновой, итаконовой, гликолевой, п-аминобензойной, глутаминовой,бензолсульфоновой и теофиллинуксусной кислотами, а также с 8-галогентеофиллинами, например, 8 бромтеофиллином. Примерами указанных неорганических солей являются соли с хлористо-водородной,бромисто-водородной, серной, сульфамовой, фосфорной и азотной кислотами. Фармацевтические композиции по настоящему изобретению или композиции, которые изготовлены в соответствии с настоящим изобретением, можно вводить любым удобным путем, например перорально, в форме таблеток, капсул, порошков, сиропов и т.п., или парентерально, в форме растворов для инъекций. Для изготовления указанных композиций можно использовать хорошо известные специалистам способы и любые фармацевтически приемлемые носители, разбавители, наполнители или другие вспомогательные вещества, которые обычно используются в данной области. Соединения по настоящему изобретению удобно вводить в виде дозированной лекарственной формы, содержащей указанные соединения в количестве приблизительно от 0,01 до 100 мг. Суммарная суточная доза обычно находится в пределах приблизительно от 0,05 до 500 мг, и наиболее предпочтительно приблизительно от 0,1 до 50 мг активного соединения по настоящему изобретению. Соединения по настоящему изобретению можно получить следующим образом: 1) Алкилированием пиперазина, пиперидина или тетрагидропиридина формулы II алкилирующим производным формулы III где R1-R10, X, Y1, Y2, Y3, Y4, W, n, m и пунктирная линия определены выше, a L представляет собой удаляемую группу, такую как галоген, мезилат или тозилат; 2) Восстановительным алкилированием амина формулы II реагентом формулы IV где R1-R10, X, Y1, Y2, Y3, Y4, W, n, m и пунктирная линия определены выше, а Е представляет собой альдегид или группу активированной карбоновой кислоты; 3) Алкилированием соединения формулы V алкилирующим производным формулы VI где R1-R10, X, Y3, W, n, m и пунктирная линия определены выше, один из Y5 и Y6 представляет собой NH или N-, а другой из Y5 и Y6 представляет собой СО, CS, SO, SO2 или СН 2, a L представляет собой удаляемую группу, такую как галоген, мезилат или тозилат; или 4) Восстановлением двойной связи в тетрагидропиридинильном кольце в производных следующей формулы VII где R1-R10, Y1, Y2, Y3, Y4, W, n и m определены выше; 5) Восстановлением амида карбонила в соединении формулы VIII где R1-R10, Y1, Y2, Y3, Y4, n, m, W и пунктирная линия определены выше 6) Восстановлением амидной группы соединений формулы IX где R1-R10, X, Y1, Y2, Y3, n, m, W и пунктирная линия определены выше; 7) Восстановительным алкилированием производного формулы Va ацилирующим производным формулы X: где R1-R10, X, Y3, W, n, m и пунктирная линия определены выше, один из Y7 и Y8 представляет собой NH,а другой из Y7 и Y8 представляет собой СН 2, а Е представляет собой альдегид или группу активированной карбоновой кислоты; 8) Ацилированием амина формулы Va реагентом формулы X где R1-R10, X, Y3, W, n, m и пунктирная линия определены выше, один из Y7 и Y8 представляет собой NH,а другой из Y7 и Y8 представляет собой СH2, а Е представляет собой альдегид или группу активированной карбоновой кислоты; 9) Расщеплением полимерной связи производного формулы XI где R1-R9, Y1, Y2, Y3, X, W, m и n определены выше, a R'OH представляет собой гидроксиэтил- или гидроксиметилполистирол, смолу Wang или аналогичные полиэтиленгликоль-полистироловые смолы; после чего соединение формулы I выделяют в виде свободного основания или его фармацевтически приемлемой кислотно-аддитивной соли. Алкилирование согласно способу 1) и 3) удобно осуществлять в инертном органическом растворителе, таком как спирт или кетон с подходящей температурой кипения, предпочтительно, в присутствии органического или неорганического основания (карбоната калия, диизопропилэтиламина или триэтиламина) при температуре кипения с обратным холодильником. Альтернативно, алкилирование можно осуществлять при фиксированной температуре, которая отличается от температуры кипения, в одном из упомянутых выше растворителей или в диметилформамиде (DMF), диметилсульфоксиде (DMSO) или Nметилпирролидин-2-оне (NMP), предпочтительно, в присутствии основания. Синтез аминов формулы (II), 3-(пиперидин-4-ил)-1 Н-индолов и 3-(3,6-дигидро-2 Н-пиридин-4-ил)1 Н-индолов описан в литературе (см., например, ЕР-А 1-465398). Алкилирующие реагенты формулы (III) известны из литературы (см. Oshiro et al. J. Med. Chem. 2000, 43, 177-189 и ЕР-В 1-512525) или их можно получить способами, очевидными для специалиста-химика (см., например, Kowalski et al. J. HeterocyclicChem. 2000, 37, 187-189, Mokrosz et al. Pharmazie 1997, 52, 423-428 и Misztal et al. Med. Chem. Res. 1992,-7 006315 2, 82-87). Алкилирующие реагенты формулы (VI) можно получить способами, очевидными для специалиста-химика, а амины формулы (V) имеются в продаже или описаны в литературе. Восстановительное алкилирование согласно способам 2) и 7) осуществляют с помощью обычных способов, описанных в литературе. Реакцию можно осуществлять в две стадии, например, сопряжением производных формулы II/Va и реагента формулы IV/X с помощью обычных способов, через хлорид карбоновой кислоты, или с использованием сопрягающих реагентов, таких как дициклогексилкарбодиимид,после чего следует восстановление полученного амида гидридом литий-алюминия или аланом. Реакцию можно осуществлять с помощью обычной процедуры, в одном сосуде. Карбоновые кислоты или альдегиды формулы IV/X можно получить способами, очевидными для специалиста-химика. Алкилирование согласно способу 3) можно удобно осуществлять, как описано выше, или взаимодействием аниона азота V с VI. Анион азота V можно получить в инертном органическом растворителе,например, в диметилформамиде (DMF), диметилсульфоксиде (DMSO) или N-метилпирролидин-2-оне(NMP), с использованием сильного основания, например, NaH, перед алкилированием. Восстановление двойной связи согласно способу 4) обычно осуществляют каталитическим гидрированием под низким давлением (3 атм.) в аппарате Парра или с использованием восстанавливающих агентов, таких как диборан или гидроборные производные, получаемые in situ из NaBH4 в трифторуксусной кислоте в инертных растворителях, таких как тетрагидрофуран (THF), диоксан или диэтиловый эфир. Исходные материалы формулы (VII) можно получить способами 1), 3), 7) и 8). Восстановление амидных групп согласно способам 5) и 6) наиболее удобно осуществлять с гидридом литий-алюминия или аланом в инертном органическом растворителе, таком как, например, тетрагидрофуран (THF) или диэтиловый эфир, при температуре от 0 С до температуры кипения с обратным холодильником. Исходные материалы формулы (VIII) можно получить способами 2) и 3) в то время, как исходные материалы формулы (IX) можно получить способами 1), 7) и 8). Взаимодействие согласно способу 8) удобно осуществлять с использованием взаимодействующих реагентов, таких как, например, дициклогексилкарбодиимид. Производные структуры (XI) получают посредством следующей последовательности твердофазного синтеза, представленной на схеме 1, ниже. Первый строительный блок (XII), полученный способами,очевидными для специалиста-химика, обычно присоединяют к смоле (этил-4-нитрофенилкарбонат, связанный с полистиролом), с использованием основания, например,N,N-диметиламинопиридина и N,N-диизопропилэтиламина, при повышенной температуре (например, 50-100 С) в апротонном растворителе (например, DMF или DMSO), с получением (XIII). После снятия защиты с аминогруппы трифторуксусной кислотой (смола XIV), посредством алкилирования вводят второй диверсифицирующий строительный блок. Алкилирование осуществляют при повышенной температуре (50-100C) в апротонном растворителе, таком как DMF, ацетон или ацетонитрил, в результате чего получают смолу (XV). После снятия защиты с эфира карбоновой кислоты трифторуксусной кислотой (смола XVI), посредством стандартной последовательности амидобразующих реакций, например превращением карбоновой кислоты в соответствующий хлорид кислоты с использованием тионилхлорида при низкой температуре в дихлорметане, ацетонитриле или DMF, с последующим действием амином,вводят третий диверсифицирующий строительный блок формулы (Va). Конечный продукт отщепляют от смолы с использованием разбавленного метоксида натрия в смеси метанол/тетрагидрофуран при комнатной температуре. Схема 1-8 006315 Экспериментальный раздел Температуру плавления определяли на аппарате Buchi B-540 и не корректировали. Масс-спектры получали с помощью системы Quattro MS-MS от компании VG Biotech, Fisons Instruments. Аналитические данные LC-MS получали с помощью инструмента РЕ Sciex API 150EX, оборудованном источникомIonSpray и LC-системой Shimadzu LC-8A/SLC-10A. Условия LC (50x4,6 мм YMC ODS-A с размером частиц 5 мкм) представляли собой линейное градиентное элюирование смесью вода/ацетонитрил/трифторуксусная кислота (90:10:0,05) до смеси вода/ацетонитрил/трифторуксусная кислота (10:90:0,03) за 7 мин со скоростью 2 мл/мин. Чистоту определяли по интеграции У/Ф следа. (254 нм) . Время задержки Rt выражали в минутах. Препаративное LC-MS-разделение осуществляли с помощью того же инструмента. Условия LC (50x20 мм YMC ODS-A с размером частиц 5 мкм) представляли собой линейное градиентное элюирование смесью вода/ацетонитрил/трифторуксусная кислота(80:20:0,05) до смеси вода/ацетонитрил/трифторуксусная кислота (5:95:0,03) за 7 мин со скоростью 22,7 мл/мин. Сбор фракций осуществляли с помощью MS-детектирования с разделением потоком. Спектры 1 Н ЯМР фиксировали на 250,13 МГц с использованием Bruker AC 250 или на 500,13 МГц с использованием Bruker DRX 500. В качестве растворителей использовали дейтерированный хлороформ(99,8% D) или диметилсульфоксид (99,9% D). В качестве внутреннего стандарта использовали TMS. Химические сдвиги выражали в миллионных долях. Следующие аббревиатуры использовали для множества сигналов ЯМР: s = синглет, d = дублет, t = триплет, q = квартет, qv = квинтет, h = гептет, dd = двойной дублет, dt = двойной триплет, dq = двойной квартет, tt = триплет триплетов, m = мультиплет, b = широкий. Сигналы ЯМР, соответствующие протонам кислот, до некоторой степени опускали. Содержание воды в кристаллических соединениях определяли титрованием по Карлу Фишеру. Для колоночной хроматографии использовали силикагель типа Kieselgel 60, меш 40-60. Для ионообменной хроматографии использовали следующий материал: SCX-колонки (1 г) от компании Varian Mega Bond Elut, Chrompack кат.220776. Перед использованием SCX-колонки предварительно обрабатывали 10% раствором уксусной кислоты в метаноле (3 мл). Примеры Получение промежуточных соединений А. Алкилирующие реагенты 1-(2-хлорэтил)-3,4-дигидрохинолин-2(1 Н)-он Суспензию гидрида натрия (3,0 г, 60% в минеральном масле) и диметилформамида (100 мл) держали при 15-18 С, после чего добавляли раствор 3,4-дигидрохинолин-2(1 Н)-она (10,0 г) в диметилформамиде (150 мл). Полученную смесь перемешивали при комнатной температуре в течение 60 мин, после чего добавляли раствор 2-хлорэтилацетата (10,0 г) в диметилформамиде (50 мл) при температуре 20 С. Полученную смесь нагревали до 80 С в течение 24 ч, охлаждали и выливали на лед. Водную фазу экстрагировали этилацетатом, и объединенные органические фазы промывали насыщенным раствором соли,высушивали (MgSO4) и концентрировали в условиях вакуума. Сырой продукт очищали флэшхроматографией на силикагеле (элюент: этилацетат/гептан 1:1) с получением сырого 1-(2-ацетоксиэтил)3,4-дигидрохинолин-2(1 Н)-она (10,2 г). Смесь сырого 1-(2-ацетоксиэтил)-3,4-дигидрохинолин-2(1 Н)-она,метанолята натрия (2,5 мл, 30% в метаноле) и метанола (250 мл) перемешивали при комнатной температуре в течение 16 ч, а затем концентрировали в условиях вакуума. Остаток очищали флэшхроматографией на силикагеле (элюент: этилацетат/гептан 1:1) с получением соответствующего спирта в виде кристаллического соединения красного цвета (4,9 г). Данный спирт растворяли в тетрагидрофуране(100 мл), после чего добавляли триэтиламин (8,2 мл). Полученную смесь охлаждали до 5-6 С, после чего добавляли раствор хлорида метансульфоновой кислоты (2 мл) в тетрагидрофуране (25 мл). Смесь фильтровали и выпаривали досуха в условиях вакуума. Остаток растворяли в диметилформамиде (50 мл), после чего добавляли хлорид лития (4,9 г) и полученную смесь нагревали до 70 С в течение 5 мин. Смесь выливали в насыщенный раствор соли и водную фазу экстрагировали этилацетатом. Объединенные органические фазы высушивали (MgSO4) фильтровали и концентрировали в условиях вакуума. Остаток очищали флэш-хроматографией на силикагеле (элюент: этилацетат/гептан 1:1) с получением продукта в виде масла красного цвета (2,9 г). 1-(3-бромпролан-1-ил)-3,4-дигидрохинолин-2(1 Н)-он Суспензию гидрида натрия (6,8 г, 60% в минеральном масле) и диметилформамида (200 мл) держали при 20-25 С, после чего добавляли раствор 3,4-дигидрохинолин-2(1 Н)-она (25,0 г) в диметилформамиде (180 мл). Полученную смесь перемешивали при комнатной температуре в течение 10 мин, после чего добавляли раствор 1,3-дибромпропана (172 г) в диметилформамиде (150 мл) при температуре 2035 С. Полученную смесь перемешивали при 30 С в течение 20 мин и концентрировали в условиях вакуума. Остаток выливали на лед и водную фазу экстрагировали этилацетатом. Объединенные органические фазы промывали насыщенным раствором соли, высушивали (MgSO4) и концентрировали в условиях вакуума. Сырой продукт очищали флэш-хроматографией на силикагеле (элюент: этилацетат/гептан 1:1) с получением продукта в виде масла желтого цвета (27 г).-9 006315 Следующие соединения получали аналогичным способом: 1-(4-бромбутан-1-ил)-3,4-дигидрохинолин-2(1 Н)-он из 3,4-дигидрохинолин-2(1 Н)-она и 1,4-дибромбутана; 1-(5-бромпентан-1-ил)-3,4-дигидрохинолин-2(1 Н)-он из 3,4-дигидрохинолин-2(1 Н)-она и 1,5-дибромпентана; 4-(4-бромбутан-1-ил)-3,4-дигидро-2 Н-1,4-бензоксазин-3(4 Н)-он из 3,4-дигидро-2 Н-1,4-бензоксазин-3(4 Н)-она и 1,4-дибромбутана; 2-(3-гидроксипропан-1-ил)-3,4-дигидроизохинолин-1(2 Н)-он из 3,4-дигидроизохинолин-1(2 Н)-она и 3-бромпропанола; 2-(4-бромбутан-1-ил)-3,4-дигидроизохинолин-1(2 Н)-он из 3,4-дигидроизохинолин-1(2 Н)-она и 1,4-дибромбутана 1-(3-бромпропан-1-ил)-3,4-дигидроизохинолин-1(2 Н)-он. Соединение 2-(3-гидроксипропан-1-ил)-3,4-дигидроизохинолин-1(2 Н)-он растворяли в тетрагидрофуране (100 мл), после чего добавляли триэтиламин (5,2 мл). Полученную смесь охлаждали до 6-11 С, после чего добавляли раствор хлорида метансульфоновой кислоты (1,4 мл) в тетрагидрофуране (25 мл) . Смесь перемешивали при 5 С в течение 10 мин, фильтровали и концентрировали в условиях вакуума. Остаток растворяли в ацетоне (250 мл), после чего добавляли бромид лития (6,5 г) и полученную смесь кипятили с обратным холодильником в течение 2 ч. Смесь выливали в насыщенный раствор соли и водную фазу экстрагировали этилацетатом. Объединенные органические фазы высушивали (MgSO4), фильтровали и концентрировали в условиях вакуума. Остаток очищали флэш-хроматографией на силикагеле (элюент: этилацетат/гептан 1:2) с получением продукта в виде масла желтого цвета (2,7 г). 3-хлор-1-(3,4-дигидро-1 Н-изохинолин-2-ил)пропан-1-он Раствор 3-хлорпропаноилхлорида (10,5 г) в тетрагидрофуране (400 мл) охлаждали до 6 С, после чего добавляли раствор 3,4-дигидро-1 Н-изохинолина (10,0 г). Полученную смесь перемешивали при 10 С в течение 30 мин, фильтровали и концентрировали в условиях вакуума. Остаток подвергали стандартной водной обработке, после чего очищали флэш-хроматографией на силикагеле (элюент: этилацетат/гептан 1:1) с получением продукта в виде бесцветного масла (10 г). Следующие соединения получали аналогичным способом: 3-бром-1-(3,4-дигидро-1 Н-изохинолин-2-ил)пропан-1-он из 3,4-дигидро-1 Н-изохинолина и 3-бромпропаноилхлорида; 4-хлор-1-(3,4-дигидро-1 Н-изохинолин-2-ил)бутан-1-он из 3,4-дигидро-1 Н-изохинолина и 4-хлорбутаноилхлорида; 4-хлор-1-(3,4-дигидро-2 Н-хинолин-1-ил)бутан-1-он из 3,4-дигидро-2 Н-хинолина и 4-хлорбутаноилхлорида Получение промежуточных соединений на твердой основе Получение 4-нитрофенилоксикарбонилоксиэтилполистирола 2 л колбу с круглым дном загружали гидроксиэтилполистиролом (62,9 г, 83 ммоль, продается компанией Rapp Polymere, кат.НА 1 400 00), N-метилморфолином (20 мл, 183 ммоль) и сухим дихлорметаном (900 мл). Суспензию охлаждали на бане со льдом и в течение 5 мин добавляли 4 нитрофенилхлорформиат, растворенный в сухом дихлорметане (400 мл) . Смесь перемешивали при комнатной температуре в течение 16 ч. Смолу отфильтровывали и промывали сухим дихлорметаном (5x200 мл). Смолу высушивали в условиях вакуума (20 С, 72 ч) с получением указанной в заголовке смолы(79,6 г). Получение 7-хлор-3-(пиперидин-4-ил)-1 Н-индола, связанного с полимером 100 мл колбу с круглым дном загружали 4-нитрофенилоксикарбонилоксиэтилполистиролом (4,0 г,4,3 ммоль), 7-хлор-3-(1-трет-бутоксикарбонилпиперидин-4-ил)-1 Н-индолом (2,7 г, 8,1 ммоль), диизопропилэтиламином (3,5 мл, 20,2 ммоль), 4-диметиламинопиридином (0,5 г, 4 ммоль) и сухим диметилформамидом (50 мл). Смесь перемешивали при 90 С в течение 72 ч. После охлаждения до комнатной температуры смолу отфильтровывали и промывали сухим диметилформамидом (3x25 мл), сухим ацетонитрилом (3x25 мл) и сухим дихлорметаном (3x25 мл). Смолу переносили в 250 мл стеклянный цилиндр с фриттой и тройным переходником на дне. На смолу затем действовали в течение 20 мин 60 мл 1:1 смеси дихлорметана и трифторуксусной кислоты, содержащей анизол (2% мас./мас.) и метионин (0,2% мас./мас.), с использованием потока азота для перемешивания смолы (предупреждение: выделение диоксида углерода). Смолу отфильтровывали и промывали сухим дихлорметаном (25 мл), 1:1 смесью дихлорметан:триэтиламин (3x25 мл) и сухим дихлорметаном (3x25 мл). Смолу высушивали в условиях вакуума (20 С, 20 ч) с получением указанной в заголовке смолы (3,8 г). Следующие соединения, связанные с полимером, получали аналогичным способом: 4-хлор-3-(пиперидин-4-ил)-1 Н-индол; 4-фтор-3-(пиперидин-4-ил)-1 Н-индол; 5-хлор-3-(пиперидин-4-ил)-1 Н-индол; 5-фтор-3-(пиперидин-4-ил)-1 Н-индол;- 10006315 6-хлор-3-(пиперидин-4-ил)-1 Н-индол. Получение 3-[4-(7-хлор-1 Н-индол-3-ил)пиперидин-1-ил]пропионовой кислоты, связанной с полимером 25 мл колбу с круглым дном загружали 7-хлор-3-(пиперидин-4-ил)-1H-индолом, связанным с полимером (1,0 г, 0,98 ммоль), триэтиламином (80,2 мл), трет-бутил-3-бромпропионатом и сухим ацетонитрилом (5 мл). Смесь перемешивали при 80 С в течение 3 ч. После охлаждения до комнатной температуры смолу отфильтровывали и промывали сухим ацетонитрилом (3 х 10 мл) и сухим дихлорметаном (3x10 мл). Смолу обрабатывали в течение 20 мин 8 мл 1:1 смеси дихлорметана и трифторуксусной кислоты, содержащей анизол (2% мас./мас.) и метионин (0,2% мас./мас.) (предупреждение: выделение диоксида углерода). Смолу отфильтровывали и промывали сухим дихлорметаном (10 мл), 1:1 смесью дихлорметан:триэтиламин (3x10 мл) и сухим дихлорметаном (3 х 10 мл). Смолу высушивали в условиях вакуума(20 С, 20 ч) с получением указанной в заголовке смолы (1,0 г). Следующие соединения, связанные с полимером, получали аналогичным способом: 3-[4-(4-хлор-1 Н-индол-3-ил)пиперидин-1-ил]пропионовая кислота 3-[4-(4-фтор-1 Н-индол-3-ил)пиперидин-1-ил]пропионовая кислота 3-[4-(5-фтор-1 Н-индол-3-ил)пиперидин-1-ил]пропионовая кислота 3-[4-(6-хлор-1 Н-индол-3-ил)пиперидин-1-ил]пропионовая кислота 4-[4-(4-хлор-1 Н-индол-3-ил)пиперидин-1-ил]масляная кислота 4-[4-(4-фтор-1 Н-индол-3-ил)пиперидин-1-ил]масляная кислота 4-[4-(5-хлор-1 Н-индол-3-ил)пиперидин-1-ил]масляная кислота 4-[4-(5-фтор-1 Н-индол-3-ил)пиперидин-1-ил]масляная кислота 4-[4-(7-хлор-1 Н-индол-3-ил)пиперидин-1-ил]масляная кислота 5-[4-(4-хлор-1 Н-индол-3-ил)пиперидин-1-ил]пентановая кислота 5-[4-(5-фтор-1 Н-индол-3-ил)пиперидин-1-ил]пентановая кислота 5-[4-(7-хлор-1 Н-индол-3-ил)пиперидин-1-ил]пентановая кислота 6-[4-(4-фтор-1 Н-индол-3-ил)пиперидин-1-ил]гексановая кислота 6-[4-(4-хлор-1 Н-индол-3-ил)пиперидин-1-ил]гексановая кислота 6-[4-(5-фтор-1 Н-индол-3-ил)пиперидин-1-ил]гексановая кислота 6-[4-(6-хлор-1 Н-индол-3-ил)пиперидин-1-ил]гексановая кислота 6-[4-(7-хлор-1 Н-индол-3-ил)пиперидин-1-ил]гексановая кислота Получение соединений по настоящему изобретению Пример 1. 1 а, гидрохлорид 5-фтор-3-1-[2-(2-оксо-3,4-дигидро-2 Н-хинолин-1-ил)этил]пиперидин-4 ил-1 Н-индола Смесь 5-фтор-3-(пиперидин-4-ил)-1H-индола (0,3 г), 1-(2-хлорэтил)-3,4-дигидрохинолин-2(1 Н)-она(0,41 г) и триэтиламина (0,75 г) в диметилформамиде (5 мл) и бутаноне (10 мл) кипятили с обратным холодильником в течение 6 ч. Смесь концентрировали в условиях вакуума, а остаток очищали флэшхроматографией на силикагеле (элюент: этилацетат/этанол/триэтиламин 90:10:5) с получением сырого продукта, который выделяли из ацетона в форме соли гидрохлорида в виде кристаллического соединения белого цвета (0,04 г). 1H ЯМР (ДМСО-d6): 2,00-2,25 (м, 4 Н); 2,60 (т, 2 Н); 2,90 (т, 2 Н); 2,95-3,10 (м, 1 Н); 3,10-3,30 (м, 4 Н); 3,70 (д, 2 Н); 4,35 (т, 2 Н); 6,90 (т, 1 Н); 7,05 (т, 1 Н); 7,15-7,40 (м, 5 Н); 7,50 (д, 1 Н); 10,95(шир.с, 1 Н); 11,05 (с, 1 Н), МС m/z: 392 (МН+), 174. Следующие соединения получали аналогичным способом:H ЯМР (ДМСО-d6): 1,90-2,15 (м, 6 Н); 2,95-3,15 (м, 7 Н); 3,55-3,60 (м, 6 Н); 6,90 (т, 1 Н); 7,20 (с, 1 Н); 7,30 (д, 1 Н); 7,30-7,40 (м, 4 Н); 7,45-7,50 (м, 1 Н); 7,90 (д, 1 Н); 11,05 (с, 1 Н), МС m/z: 406 (МН+), 188. 1 с, гидрохлорид 5-фтор-3-1-[4-(1-оксо-3,4-дигидро-1H-хинолин-2-ил)бутан-1-ил]пиперидин-4-ил 1 Н-индола из 5-фтор-3-(пиперидин-4-ил)-1 Н-индола и 2-(4-бромбутан-1-ил)-3,4-дигидроизохинолин-1(2 Н)она. 1 Н ЯМР (ДМСО-d6): 1,55-1,70 (м, 2 Н); 1,70-1,85 (м, 2 Н); 2,05 (д, 2 Н); 2,10-2,25 (м, 2 Н); 2,90-3,15 (7 Н); 3,40-3,65 (м, 6 Н); 6,90 (т, 1 Н); 7,20 (с, 1 Н); 7,30 (д, 1 Н); 7,30-7,40 (м, 2 Н); 7,40-7,55 (м, 2 Н); 7,90 (д, 1 Н); 10,75 (шир.с, 1 Н); 11,05 (с, 1 Н), МС m/z: 420 (МН+). Пример 2. 2 а, гидрохлорид 5-фтор-3-1-[3-(2-оксо-3,4-дигидро-2 Н-хинолин-1-ил)пропан-1-ил]пиперидин-4 ил-1 Н-индола Смесь 5-фтор-3-(пиперидин-4-ил)-1 Н-индола (5,0 г), 1-(3-бромпропан-1-ил)-3,4-дигидрохинолин 2(1 Н)-она (7,7 г) и карбоната калия (7,0 г) в диметилформамиде (40 мл) нагревали до 100 С в течение 2,5 ч. Смесь охлаждали, фильтровали и концентрировали в условиях вакуума. Остаток очищали флэшхроматографией на силикагеле (элюент: этилацетат, затем этилацетат/этанол 90:10) с получением продукта в виде масла оранжевого цвета (9,1 г). Указанное в заголовке соединение (1,8 г свободного основания) выделяли в форме соли гидрохлорида из тетрагидрофурана в виде кристаллического соединения- 11006315 белого цвета (1,5 г). Т. пл. 210-212 С. 1 Н ЯМР (ДМСО-d6): 2,00-2,20 (м, 6 Н); 2,60 (т, 2 Н); 2,90 (т, 2 Н); 2,95-3,10 (м, 3 Н); 3,10-3,20 (м, 2 Н); 3,55 (д, 2 Н); 3,95 (т, 2 Н); 6,90 (т, 1 Н); 7,05 (т, 1 Н); 7,15-7,30 (м, 4 Н); 7,30-7,40 (м, 1 Н); 7,50 (д, 1 Н); 10,55 (шир.с, 1 Н); 11,05 (с, 1 Н), МС m/z: 406 (МН+). Следующие соединения получали аналогичным способом: 2b, гидрохлорид 5-фтор-3-1-[5-(2-оксо-3,4-дигидро-2 Н-хинолин-1-ил)пентан-1-ил]пиперидин-4 ил-1 Н-индола из 5-фтор-3-(пиперидин-4-ил)-1 Н-индола и 1-(5-бромпентан-1-ил)-3,4-дигидрохинолин-2(1 Н)-она. Т. пл. 199-200 С. 1 Н ЯМР (ДМСО-d6): 1,30-1,40 (м, 2 Н); 1,55-1,60 (м, 2 Н); 1,70-1,80 (м, 2 Н); 2,05-2,15 (м,4 Н); 2,55 (т, 2 Н); 2,85 (т, 2 Н); 2,95-3,10 (м, 5 Н); 3,55 (д, 2 Н); 3,90 (т, 2 Н); 6,90 (т, 1 Н); 7,00 (т, 1 Н); 7,15 (д,1 Н); 7,20-7,30 (м, 3 Н); 7,30-7,35 (м, 1 Н); 7,50 (д, 1 Н); 12,20 (шир.с, 1 Н); 11,05 (с, 1 Н) , MC m/z: 434m/z: 450 (MH+), 299. 2f, гидрохлорид 7-хлор-3-1-[4-(2-оксо-3,4-дигидро-2H-хинолин-1-ил)бутан-1-ил]пиперидин-4-ил 1 Н-индола из 7-хлор-3-(пиперидин-4-ил)-1 Н-индола и 1-(4-бромбутан-1-ил)-3,4-дигидрохинолин-2(1 Н)-она. Т. пл. 253-254 С. 1H ЯМР (ДМСО-d6); 1,55-1,65 (м, 2 Н); 1,75-1,85 (м, 2 Н); 2,05-2,25 (м, 4 Н); 2,55 (т, 2 Н); 2,90 (т, 2 Н); 2,95-3,15 (м, 5 Н); 3,55 (д, 2 Н); 3,95 (т, 2 Н); 6,95-7,05 (м, 2 Н); 7,15-7,30 (м, 5 Н); 7,70 (д, 1H); 10,60 (шир.с, 1 Н); 11,30 (с, 1 Н), МС m/z: 436 (МН+), 289. 2g, гидрохлорид 5-фтор-3-1-[4-(3-оксо-3,4-дигидро-2 Н-1,4-бензоксазин-4-ил)бутан-1-ил]пиперидин-4-ил-1 Н-индола из 5-фтор-3-(пиперидин-4-ил)-1 Н-индола и 4-(4-бромбутан-1-ил)-3,4-дигидро-2 Н-1,4-бензоксазин 3(4 Н)-она. Т. пл. 83-92 С. 1 Н ЯМР (ДМСО-d6): 1,60-1,70 (м, 2 Н); 1,75-1,85 (м, 2 Н); 2,00-2,20 (м, 4 Н); 2,953,15 (м, 5 Н); 3,55 (д, 2 Н); 3,95 (т, 2 Н); 4,65 (с, 2 Н); 6,90 (т, 1 Н); 7,00-7,05 (м, 2 Н); 7,05-7,15 (м, 1 Н); 7,20 (с,1 Н); 7,25 (д, 1 Н); 7,30-7,40 (м, 1 Н); 7,50 (д, 1 Н); 10,45 (шир.с, 1 Н); 11,05 (с, 1 Н), МС m/z: 422 (МН+), 273. 2h, гидрохлорид 5-хлор-3-1-[4-(3-оксо-3,4-дигидро-2 Н-1,4-бензоксазин-4-ил)бутан-1-ил]пиперидин-4-ил-1 Н-индола из 5-хлор-3-(пиперидин-4-ил)-1 Н-индола и 4-(4-бромбутан-1-ил)-3,4-дигидро-2 Н-1,4-бензоксазин 3(4 Н)-она. Т. пл. 222-224 С. 1 Н ЯМР (ДМСО-d6): 1,60-1,7,0 (м, 2 Н); 1,75-1,85 (м, 2 Н); 2,05-2,15 (м, 4 Н); 3,00-3,15 (м, 5 Н); 3,55 (д, 2 Н); 3,95 (т, 2 Н); 4,65 (с, 2 Н); 7,00-7,10 (м, 4 Н); 7,20 (с, 1 Н); 7,25 (д, 1 Н); 7,40 (д,1 Н); 7,75 (с, 1 Н); 10,30 (шир.с, 1 Н); 11,15 (с, 1 Н), МС m/z: 438 (МН+), 291, 204. Пример 3. 3 а, оксалат 5-фтор-3-1-[3-(2-оксо-3,4-дигидро-2 Н-хинолин-1-ил)пропан-1-ил]-3,6-дигидро-2 Нпиридин-4-ил-1H-индола Смесь 5-фтор-3-(3,6-дигидро-2 Н-пиридин-4-ил)-1 Н-индола (3,0 г) и карбоната калия (6,2 г) в бутаноне (250 мл) нагревали до температуры кипения с обратным холодильником, после чего добавляли 1-(3 бромпропан-1-ил)-3,4-дигидрохинолин-2(1 Н)-он (5,0 г) в бутаноне (50 мл). Полученную смесь кипятили с обратным холодильником в течение 10 ч, фильтровали и концентрировали в условиях вакуума (7,7 г). Остаток очищали флэш-хроматографией на силикагеле (элюент: этилацетат/триэтиламин 100:5) с получением сырого продукта, который кристаллизовали из смеси тетрагидрофуран/этилацетат. Указанное в заголовке соединение выделяли в форме соли оксалата в виде кристаллического соединения желтоватого цвета (1,7 г). Т. пл. 203-206 С. 1 Н ЯМР (ДМСО-d6): 1,95-2,05 (м, 2 Н); 2,55 (т, 2 Н); 2,75 (с, 2 Н); 2,85 (т,2 Н); 3,15 (т, 2 Н); 3,35 (с, 2 Н); 3,80 (с, 2 Н); 3,95 (т, 2 Н); 6,05 (с, 1 Н); 6,95-7,05 (м, 2 Н); 7,15-7,30 (м, 3 Н); 7,35-7,45 (м, 1 Н); 7,50-7,60 (м, 2 Н); 11,50 (с, 1 Н), МС m/z: 404 (МН+), 218.- 12006315 Следующие соединения получали аналогичным способом: 3b, гидрохлорид 5-фтор-3-1-[4-(2-оксо-3,4-дигидро-2 Н-хинолин-1-ил)бутан-1-ил]-3,6-дигидро-2 Нпиридин-4-ил-1 Н-индола из 5-фтор-3-(3,6-дигидро-2 Н-пиридин-4-ил)-1 Н-индола и 1-(4-бромбутан-1-ил)-3,4-дигидрохинолин 2(1 Н)-она. Т. пл. 124-125 С. 1 Н ЯМР (ДМСО-d6): 1,55-1,65 (м, 2 Н); 1,80 (к, 2 Н); 2,55 (т, 2 Н); 2,75 (д, 1 Н); 2,852,95 (м, 3 Н); 3,15-3,30 (м, 3 Н); 3,55-3,65 (м, 1 Н); 3,75 (д, 1 Н); 3,90-4,00 (м, 3 Н); 6,10 (с, 1 Н); 6,95-7,05 (м, 2 Н); 7,15 (д, 1 Н); 7,20-7,30 (м, 2 Н); 7,40-7,45 (м, 1 Н); 7,55-7,65 (м, 2 Н); 10,70 (шир.с, 1 Н); 11,50 (с, 1 Н), МС m/z: 418(МН+), 231. 3 с, оксалат 5-фтор-3-1-[5-(2-оксо-3,4-дигидро-2 Н-хинолин-1-ил)пентан-1-ил]-3,6-дигидро-2 Нпиридин-4-ил-1 Н-индола из 5-фтор-3-(3,6-дигидро-2 Н-пиридин-4-ил)-1 Н-индола и 1-(5-бромпентан-1-ил)-3,4-дигидрохинолин 2(1 Н)-она. Т. пл. 205-207 С. 1 Н ЯМР (ДМСО-d6): 1,35 (т, 2 Н); 1,55 (т, 2 Н); 1,75 (т, 2 Н); 2,55 (т, 2 Н); 2,75 (с,2 Н); 2,85 (т, 2 Н); 3,10 (т, 2 Н); 3,35 (с, 2 Н); 3,80 (с, 2 Н); 3,90 (т, 2 Н); 6,10 (с, 1 Н); 6,95-7,05 (м, 2 Н); 7,15 (д, 1 Н); 7,20-7,30 (м, 2 Н) ; 7,40-7,45 (м, 1 Н); 7,55-7,60 (м, 2 Н); 11,50 (с, 1 Н), MC m/z: 432 (МН+), 245. Пример 4. 4, гидрохлорид 5-фтор-3-1-[4-(2-оксо-3,4-дигидро-2 Н-хинолин-1-ил)бутан-1-ил]пиперидин-4-ил 1 Н-индола Смесь 5-фтор-3-1-[4-(2-оксо-3,4-дигидро-2 Н-хинолин-1-ил)бутан-1-ил]-3,6-дигидро-2 Н-пиридин 4-ил-1 Н-индола (3,5 г), этанола (100 мл), уксусной кислоты (100 мл) и оксида платины (0,4 г) встряхивали при 3 атм в течение 16 ч. Смесь фильтровали, выпаривали в условиях вакуума приблизительно до 100 мл, затем выливали на лед и добавляли водный раствор аммиака до основной рН. Водную фазу экстрагировали этилацетатом и объединенные органические фазы промывали насыщенным раствором соли,высушивали (MgSO4) и концентрировали в условиях вакуума. Остаток очищали флэш-хроматографией на силикагеле (элюент: этилацетат/триэтиламин 100:4) с получением сырого продукта (2,0 г). Указанное в заголовке соединение выделяли из этилацетата в форме соли гидрохлорида в виде кристаллического соединения белого цвета (2,0 г). Т. пл. 212-213 С. 1H ЯМР (ДМСО-d6): 1,55-1,65 (м, 2 Н); 1,75-1,85 (м,2 Н); 2,00-2,20 (м, 4 Н); 2,55 (т, 2 Н); 2,85 (т, 2 Н); 2,95-3,15 (м, 5 Н); 3,55 (д, 2 Н); 3,95 (т, 2 Н); 6,90 (т, 1 Н); 7,00 (т, 1 Н); 7,15-7,30 (м, 4 Н); 7,30-7,40 (м, 1 Н); 7,50 (д, 1 Н); 10,55 (шир.с, 1 Н); 11,05 (с, 1 Н), МС m/z: 420(МН+), 273, 202. Пример 5. 5 а, оксалат 5-фтор-1-метил-3-1-[3-(2-оксо-3,4-дигидро-2 Н-хинолин-1-ил)пропан-1-ил]пиперидин 4-ил-1 Н-индола Суспензию гидрида натрия (0,5 г, 60% в минеральном масле) и диметилформамида (60 мл) держали при 22-24 С, после чего добавляли раствор 5-фтор-3-1-[3-(2-оксо-3,4-дигидро-2 Н-хинолин-1-ил)пропан 1-ил]пиперидин-4-ил-1 Н-индола (4,9 г) в диметилформамиде (50 мл). Полученную смесь перемешивали при комнатной температуре в течение 25 мин, после чего добавляли раствор метилйодида (2,0 г) в диметилформамиде (15 мл) при температуре 22-27 С. Полученную смесь перемешивали при 22 С в течение 1 ч и выливали на лед. Водную фазу экстрагировали этилацетатом и объединенные органические фазы промывали насыщенным раствором соли, высушивали (MgSO4) и концентрировали в условиях вакуума. Сырой продукт очищали флэш-хроматографией на силикагеле (элюент: этилацетат/гептан/триэтиламин 50:50:5) с получением продукта в виде масла оранжевого цвета (2,4 г). Указанное в заголовке соединение выделяли из ацетона в форме соли оксалата в виде кристаллического соединения белого цвета (0,6 г). Т. пл. 188-189 С. 1 Н ЯМР (ДМСО-d6): 1,85-2,05 (м, 4 Н); 2,10 (д, 2 Н); 2,55 (т, 2 Н); 2,90 (т, 2 Н); 2,95-3,05 (м,3 Н); 3,10 (т, 2 Н); 3,50 (д, 2 Н); 3,75 (с, 3 Н); 3,95 (т, 2 Н); 6,95-7,05 (м, 2 Н); 7,15-7,30 (м, 4 Н); 7,35-7,45 (м,2 Н), МС m/z: 420 (МН+), 188. Следующие соединения получали аналогичным способом: 5b, гидрохлорид 5-фтор-1-метил-3-1-[4-(2-оксо-3,4-дигидро-2 Н-хинолин-1-ил)бутан-1-ил]пиперидин-4 ил-1 Н-индола из 5-фтор-3-1-[4-(2-оксо-3,4-дигидро-2 Н-хинолин-1-ил)бутан-1-ил]пиперидин-4-ил-1 Н-индола и метилйодида. Т. пл. 177-179 С. 1 Н ЯМР (ДМСО-d6): 1,55-1,65 (м, 2 Н); 1,75-1,85 (м, 2 Н); 2,00-2,15 (м, 4 Н); 2,55 (т, 2 Н); 2,90 (т, 2 Н); 2,95-3,15 (м, 5 Н); 3,55 (д, 2 Н); 3,75 (с, 3 Н); 3,95 (т, 2 Н); 6,95-7,05 (м, 2 Н); 7,15 (д,1 Н); 7,20-7,30 (м, 3 Н); 7,35-7,45 (м, 1 Н); 7,55 (д, 1 Н); 11,40 (шир.с, 1 Н), МС m/z: 434 (МН+). 5 с, оксалат 1-(бутан-1-ил)-5-фтор-3-1-[4-(2-оксо-3,4-дигидро-2 Н-хинолин-1-ил)бутан-1-ил]-3,6 дигидро-2 Н-пиридин-4-ил-1 Н-индола из 5-фтор 3-1-[4-(2-оксо-3,4-дигидро-2 Н-хинолин-1-ил)бутан-1-ил]-3,6-дигидро-2 Н-пиридин-4 ил-1 Н-индола и бутилбромида. Т. пл. 152-154 С. 1 Н ЯМР (ДМСО-d6): 0,90 (т, 3 Н); 1,20-1,30 (м, 2 Н); 1,55-1,65 (м, 2 Н); 1,65-1,80 (м, 4 Н); 2,55 (т, 2 Н); 2,75 (с, 2 Н); 2,85 (т, 2 Н); 3,10 (т, 2 Н); 3,35 (с, 2 Н); 3,80 (с,2 Н); 3,95 (т, 2 Н); 4,15 (т, 2 Н); 6,10 (с, 1 Н); 6,95-7,05 (м, 2 Н); 7,15 (д, 1 Н); 7,20-7,30 (м, 2 Н); 7,50-7,55 (м,1); 7,55-7,70 (м, 2 Н), МС m/z: 474 (МН+), 231.- 13006315 Пример 6. 6 а, оксалат 5-фтор-3-1-[3-(3,4-дигидро-1 Н-изохинолин-2-ил)-3-оксопропан-1-ил]пиперидин-4-ил 1 Н-индола Смесь 5-фтор-3-(пиперидин-4-ил)-1 Н-индола (3,0 г), бутанона (200 мл), тетрагидрофурана (100 мл) ,метанола (50 мл) и триэтиламина (2,4 мл) нагревали до температуры кипения с обратным холодильником, после чего добавляли раствор 3-хлор-1-(3,4-дигидро-1 Н-изохинолин-2-ил)пропан-1-она (3,5 г) в бутаноне (60 мл). Смесь кипятили с обратным холодильником в течение 30 ч, после чего добавляли дополнительное количество 3-хлор-1-(3,4-дигидро-1 Н-изохинолин-2-ил)пропан-1-она (2,0 г) и триэтиламина(1,6 мл) в тетрагидрофуране (50 мл). Полученную смесь кипятили с обратным холодильником в течение еще 12 ч. Смесь охлаждали, фильтровали и концентрировали в условиях вакуума. Остаток очищали флэш-хроматографией на силикагеле (элюент: этилацетат/этанол/триэтиламин 100:4:4) с получением сырого продукта. Указанное в заголовке соединение выделяли из ацетона в форме соли оксалата в виде кристаллического соединения белого цвета (0,75 г). Т. пл. 206-209 С. 1 Н ЯМР (ДМСО-d6): 1,95 (к, 2 Н); 2,05-2,15 (м, 2 Н); 2,80 (т, 0,8 Н); 2,90 (т, 1,2 Н); 2,90-3,10 (м, 5 Н); 3,30 (т, 2 Н); 3,55 (д, 2 Н); 3,70 (т, 2 Н); 4,65 (с, 1,20 Н); 4,70 (с, 0,8 Н); 6,85-6,95 (м, 1 Н); 7,15-7,25 (м, 5 Н); 7,30-7,40 (м, 1 Н); 7,40 (д, 1 Н); 11,05 (с,1 Н), МС m/z: 406 (МН+), 231. Следующие соединения получали аналогичным способом: 6b, гидрохлорид 1-хлор-3-1-[3- (3,4-дигидро-1 Н-изохинолин-2-ил)-3-оксопропан-1-ил]пиперидин 4-ил-1 Н-индола из 7-хлор-3-(пиперидин-4-ил)-1 Н-индола и 3-бром-1-(3,4-дигидро-1 Н-изохинолин-2-ил)пропан-1 она. 1 Н ЯМР (ДМСО-d6): 2,05-2,25 (м, 4 Н); 2,80 (т, 0,8 Н); 2,95 (т, 1,2 Н); 3,00-3,20 (м, 5 Н); 3,30-3,45 (м,2 Н); 3,55-3,65 (м, 2 Н); 3,65-3,75 (м, 2 Н); 4,65 (с, 1,2 Н); 4,75 (с, 0,8 Н); 7,00 (т, 1 Н); 7,15-7,25 (м, 6 Н); 7,70(д, 1 Н); 10,70 (шир.с, 1 Н); 11,30 (с, 1 Н), МС m/z: 422 (МН+), 247. 6 с, гидрохлорид 5-хлор-3-1-[4-(3,4-дигидро-2 Н-хинолин-1-ил)-4-оксобутан-1-ил]пиперидин-4-ил 1 Н-индола из 5-хлор-3-(пиперидин-4-ил)-1 Н-индола и 4-хлор-1-(3,4-дигидро-2 Н-хинолин-1-ил)бутан-1-она. Т. пл. 158-162 С 1H ЯМР (ДМСО-d6): 1,85-1,95 (м, 2 Н); 1,95-2,20 (м, 6 Н); 2,60-2,75 (м, 4 Н); 2,95-3,15 (м,5 Н); 3,55 (д, 2 Н); 3,70 (т, 2 Н); 7,05-7,25 (м, 6 Н); 7,40 (д, 1 Н); 7,75 (с, 1 Н); 10,45 (шир.с, 1 Н); 11,15 (с, 1 Н),МС m/z: 436 (МН+), 303. Пример 7. 7, 5-фтор-3-1-[4- (3,4-дигидро-1 Н-изохинолин-2-ил)-4-оксобутан-1-ил]пиперидин-4-ил-1 Н-индол Смесь 5-фтор-3-(пиперидин-4-ил)-1 Н-индола (3,0 г), бутанона (200 мл) , тетрагидрофурана (200 мл),метанола (30 мл), йодида калия (11,4 г) и триэтиламина (7,6 мл) нагревали до температуры кипения с обратным холодильником, после чего добавляли раствор 4-хлор-1-(3,4-дигидро-1 Н-изохинолин-2 ил)бутан-1-она (14,6 г) в бутаноне (50 мл). Смесь кипятили с обратным холодильником в течение 2 ч,фильтровали в горячем виде и концентрировали в условиях вакуума. Остаток очищали флэшхроматографией на силикагеле (элюент:этилацетат/этанол/триэтиламин 100:5:5) с получением сырого продукта. Указанное в заголовке соединение выделяли из этилацетата в форме свободного основания в виде кристаллического соединения белого цвета (0,9 г). Т. пл. 146-148 С. 1 Н ЯМР (ДМСО-d6): 1,55-1,70(м, 2 Н); 1,70-1,80 (м, 2 Н); 1,85-1,95 (м, 2 Н); 2,00 (к, 2 Н); 2,30 (к, 2 Н); 2,35-2,45 (м, 2 Н); 2,60-2,70 (м, 1 Н); 2,75 (т, 0,8 Н); 2,80-3,00 (м, 3,2 Н); 3,65 (т, 2 Н); 4,60 (с, 1,2 Н); 4,70 (с, 0,8 Н); 6,85-6,95 (м, 1 Н); 7,10-7,20 (м,5 Н); 7,25 (д, 1 Н); 7,30-7,35 (м, 1 Н); 10,85 (с, 1 Н), МС m/z: 420 (МН+), 202. Пример 8. 8, 5-хлор-3-1-[4- (3,4-дигидро-1 Н-изохинолин-2-ил)-4-оксобутан-1-ил]пиперидин-4-ил-1 Н-индол Смесь 5-фтор-3-(пиперидин-4-ил)-1 Н-индола (3,0 г), бутанона (200 мл) и триэтиламина (8,9 мл) нагревали до температуры кипения с обратным холодильником, после чего добавляли раствор 4-хлор-1(3,4-дигидро-1 Н-изохинолин-2-ил)бутан-1-она (15,2 г) в бутаноне (80 мл). Смесь кипятили с обратным холодильником в течение 6 ч. Полученную смесь фильтровали и концентрировали в условиях вакуума. Остаток очищали флэш-хроматографией на силикагеле (элюент:этилацетат/этанол/триэтиламин 100:4:4) с получением сырого продукта. Указанное в заголовке соединение выделяли из ацетона в форме свободного основания в виде кристаллического соединения белого цвета (0,6 г). Т. пл. 172-175 С. 1 Н ЯМР(ДМСО-d6): 1,55-1,65 (м, 2 Н); 1,65-1,75 (м, 2 Н); 1,90 (с, 2 Н); 2,00 (к, 2 Н); 2,30 (к, 2 Н); 2,40 (к, 2 Н); 2,652,80 (м, 1,8 Н); 2,80-3,00 (м, 3,2 Н); 3,70 (т, 2 Н); 4,60 (с, 1,2 Н); 4,70 (с, 0,8 Н); 7,05 (д, 1 Н); 7,10-7,25 (м, 5 Н); 7,35 (д, 1 Н); 7,55 (с, 1 Н); 11,00 (с, 1 Н), МС m/z: 436 (МН+), 202. Пример 9. 9 а, дигидрохлорид 5-фтор-3-1-[3-(3,4-дигидро-2 Н-хинолин-1-ил)пропан-1-ил]пиперидин-4-ил 1 Н-индола Суспензию гидрида литий-алюминия (0,94 г) в тетрагидрофуране (40 мл) перемешивали при 5 С,после чего добавляли концентрированную серную кислоту (1,2 г) в тетрагидрофуране (20 мл). Смесь перемешивали при 7 С в течение 60 мин, после чего добавляли 5-фтор-3-1-[3-(2-оксо-3,4-дигидро-2 Нхинолин-1-ил)пропан-1-ил]пиперидин-4-ил-1 Н-индол (2,0 г) в тетрагидрофуране (60 мл). Полученную смесь перемешивали при 5 С в течение 60 мин, после чего обрабатывали стандартным образом. Остаток- 14006315 очищали флэш-хроматографией на силикагеле (элюент: этилацетат) с получением сырого продукта в виде бесцветного масла. Указанное в заголовке соединение выделяли из тетрагидрофурана в форме соли дигидрохлорида в виде кристаллического соединения белого цвета (1,0 г). Т.пл. 230-236 С. 1H ЯМР(ДМСО-d6): 1,95 (т, 2 Н); 2,00-2,30 (м, 4 Н); 2,75 (т, 2 Н); 2,95-3,20 (м, 5 Н); 3,30 (т, 2 Н); 3,40 (т, 2 Н); 3,55 (д,2 Н); 6,20 (шир.с, 1 Н); 6,70 (шир.с, 1 Н); 6,95 (м, 2 Н); 7,00 (д, 1 Н); 7,10 (т, 1 Н); 7,20 (с, 1 Н); 7,30-7,40 (м,1 Н); 7,50 (д, 1 Н); 10,95 (шир.с, 1 Н); 11,05 (с, 1 Н), MC m/z: 392 (MH+), 259. Следующие соединения получали аналогичным способом: 9b, дигидрохлорид 5-фтор-3-1-[4-(3,4-дигидро-2 Н-хинолин-1-ил)бутан-1-ил]пиперидин-4-ил-1Hиндола из 5-фтор-3-1-[4-(2-оксо-3,4-дигидро-2 Н-хинолин-1-ил)бутан-1-ил]пиперидин-4-ил-1 Н-индола. Т.пл. 207-212 С. 1 Н ЯМР (ДМСО-d6): 1,65 (с, 2 Н); 1,80-1,90 (м, 2 Н); 1,95 (с, 2 Н); 2,05 (д, 2 Н); 2,20 (к, 2 Н); 2,65-2,80 (м, 2 Н); 2,95-3,25 (м, 4 Н); 3,15-3,25 (м, 1 Н); 3,35 (с, 4 Н); 3,55 (д, 2 Н); 4,65 (шир.с); 5,55-6,95 (м,3 Н); 7,00 (с, 1 Н); 7,10 (с, 1 Н); 7,20 (с, 1 Н); 7,30-7,40 (м, 1 Н); 7,55 (д, 1 Н); 11,75 (шир.с, 1 Н); 11,05 (с, 1 Н),MC m/z: 406 (МН+), 274. 9 с, дигидрохлорид 5-фтор-3-1-[5-(3,4-дигидро-2 Н-хинолин-1-ил)пентан-1-ил]пиперидин-4-ил-1 Ниндола из 5-фтор-3-1-[5-(2-оксо-3,4-дигидро-2 Н-хинолин-1-ил)пентан-1-ил]пиперидин-4-ил-1 Н-индола. Т. пл. 155-158 С. 1 Н ЯМР (ДМСО-d6): 1,30-1,45 (м, 2 Н); 1,65 (с, 2 Н); 1,75-1,80 (м, 2 Н); 1,95 (с, 2 Н); 2,20(м, 1 Н); 3,70-3,80 (м, 1 Н); 3,95 (д, 1 Н); 6,10 (с, 1 Н); 6,80-7,25 (м, 4 Н); 7,00 (т, 1 Н); 7,40-7,45 (м, 1 Н); 7,557,65 (м, 2 Н); 11,00 (с, шир.с, 1 Н); 11,60 (с, 1 Н), МС m/z: 418 (МН+), 231, 188. Пример 10. 10 а,4-фтор-3-1-[3-(3,4-дигидро-1 Н-изохинолин-2-ил)-3-оксопропан-1-ил]пиперидин-4-ил-1 Ниндол 3-[1-(4-фтор-1 Н-индол-3-ил)пиперидин-1-ил)пропионовую кислоту, связанную с полимером (0,1 г,0,08 ммоль), и сухой дихлорметан (1 мл) перемешивали в химической пробирке. Смесь охлаждали до 0 С и обрабатывали в течение 2 ч 2 М раствором тионилхлорида (0,4 мл, 0,8 ммоль) в дихлорметане. Смолу отфильтровывали и промывали сухим дихлорметаном (3x1 мл), ресуспендировали в дихлорметане (1 мл) и обрабатывали при комнатной температуре в течение 3 ч 3,4-дигидро-1 Н-изохинолином (0,05 г, 0,4 ммоль). Смолу отфильтровывали и промывали дихлорметаном (3x1 мл), 1:1 смесью дихлорметан:триэтиламин (3x1 мл) и сухим дихлорметаном (3x1 мл). Смолу обрабатывали в течение 1 ч 1 мл смеси метоксида натрия (2 мл, 5 Н раствор метоксида натрия в метаноле), метанола (50 мл) и тетрагидрофурана (50 мл). После фильтрования смолу промывали метанолом (1 мл). Объединенные фильтраты загружали в предварительно обработанную ионообменную колонку (500 мг SCX-колонка, продается компанией Analytical Instruments,партии 1210-2040), промывали ацетонитрилом (1 мл) и метанолом (1 мл). Продукт элюировали 4 М раствором аммиака в метаноле. После выпаривания летучих растворителей сырой продукт очищали препаративной ВЭЖХ хроматографией с обратной фазой. Полученный раствор затем загружали в предварительно обработанную ионообменную колонку, промывали ацетонитрилом (1 мл) и метанолом (1 мл). Продукт элюировали 4 М раствором аммиака в метаноле. После выпаривания летучих растворителей получали указанное в заголовке соединение в виде масла желтого цвета (5 мг, 12 мкмоль) . LC/MC (m/z) 406 (МН+), RT=3,61, чистота 66%. Следующие соединения получали аналогичным способом (10b-10m) или с использованием 3,4 дигидро-2 Н-хинолина (10n-10z): 10b,4-фтор-3-1-[4-(3,4-дигидро-1 Н-изохинолин-2-ил)-4-оксобутан-1-ил]пиперидин-4-ил-1 Ниндол(500 мл) охлаждали до 7 С, а затем добавляли смесь янтарного ангидрида (2,5 г) в тетрагидрофуране (50- 17006315 мл). Смесь перемешивали при 8-10 С в течение 2 ч и растворитель удаляли в условиях вакуума. Остаток растворяли в этилацетате и органическую фазу промывали холодным 2 Н водным раствором гидрохлорида и насыщенным раствором соли. Органическую фазу высушивали (MgSO4), фильтровали и концентрировали в условиях вакуума (6,4 г). Остаток (1,5 г) и 3,4-дигидро-1 Н-изохинолин (0,63 г) растворяли в смеси ацетонитрила (25 мл) и диметилформамида (10 мл) и полученную смесь охлаждали (5 С) , а затем добавляли 1,3-дициклогексилкарбодиимид (1,0 г). Смесь перемешивали при комнатной температуре в течение 16 ч, фильтровали и выливали в насыщенный раствор соли. Водную фазу экстрагировали этилацетатом и тетрагидрофураном, а объединенную органическую фазу промывали насыщенным раствором соли, высушивали (MgSO4) и концентрировали в условиях вакуума. Остаток очищали флэшхроматографией на силикагеле (элюент: этилацетат) с получением твердого вещества белого цвета (1,0 г), которое затем добавляли к смеси алана в тетрагидрофуране (100 мл) при 5-10 С. Алан получали из гидрида литий-алюминия (0,55 г) и концентрированной серной кислоты (0,72 г). Смесь гасили добавлением воды (1 мл), 15% водного раствора гидроксида натрия (0,5 мл) и воды (2,5 мл) и полученную смесь высушивали (MgSO4), фильтровали и концентрировали в условиях вакуума. Указанные в заголовке соединения кристаллизовали из ацетона в форме соли диоксалата (0,8 г). Т. пл. 105-111 С. 1 Н ЯМР (ДМСОd6): 1,75 (с, 4 Н); 1,85-2,05 (м, 2 Н); 2,10 (д, 2 Н); 2,90-3,20 (м, 9 Н); 3,25 (т, 2 Н); 3,50 (д, 2 Н); 4,15 (с, 2 Н); 6,85-6,95 (м, 1 Н); 7,10-7,25 (м, 5 Н); 7,30-7,45 (м, 2 Н); 11,05 (с, 1 Н), МС m/z: 406 (МН+), 273, 188. Следующее соединение получали аналогичным способом: 11b, диоксалат 5-фтор-3-1-[4-(6,7-диметокси-3,4-дигидро-1 Н-изохинолин-2-ил)бутан-1-ил]пиперидин-4 ил-1 Н-индола из 5-фтор-3-(пиперидин-4-ил)-1 Н-индола и 6,7-диметокси-3,4-дигидро-1 Н-изохинолина. Т.пл. 98105 С. 1 Н ЯМР (ДМСО-d6): 1,75 (с, 4 Н); 1,85-2,00 (м, 2 Н); 2,10 (д, 2 Н); 2,90-3,15 (м, 9 Н); 3,30 (с, 2 Н); 3,50(д, 2 Н); 3,75 (д, 6 Н); 4,10 (с, 2 Н); 6,75 (с, 1 Н); 6,80 (с, 1 Н); 6,90-6,95 (м, 1 Н); 7,20 (с, 1 Н); 7,30-7,45 (м, 2 Н); 11,05 (с, 1 Н), MC m/z: 466 (МН+), 273, 248. Фармакологические исследования Соединения по настоящему изобретению изучали с использованием хорошо известных и надежных тестов. Данные тесты были следующими: Ингибирование связывания [3 Н]YM-09152-2 с дофаминовыми рецепторами D4 человека С помощью данного способа определяют in vitro ингибирование связывания [3H] YM-09152-2 (0,06 нМ) с мембранами клонированных дофаминовых рецепторов D4,2, экспрессированных в клетках СНО,лекарственными средствами. Способ, модифицированный от NEN Life Products, Inc., сертификат технических данных РС 2533-10/96. В табл. 1 ниже представлены результаты тестов: Таблица 1: Данные связывания (величины IC50 в нМ или % ингибирования связывания при 50 нМ) (nt. означает "не испытывался") Соединения по настоящему изобретению, как было установлено, мощно ингибируют связывание тритированного YM-09152-2 с дофаминовыми рецепторами D4. Соединения испытывали также в функциональном исследовании, описанном Gazi et al. в BritishJournal of Pharmacology 1999, 128, 613-620. В данном тесте, как было показано, соединения являются частичными агонистами или антагонистами в отношении дофаминовых рецепторов D4. Соединения по настоящему изобретению также испытывали в следующих тестах: Ингибирование связывания [3 Н]спиперона с рецепторами D2 Соединения по настоящему изобретению и изучали на предмет аффинности в отношении дофаминового рецептора D2 посредством определения их способности ингибировать связывание [3 Н]спиперона с рецепторами D2, способом, описанным Hyttel et al. J. Neurochem. 1985, 44, 1615.- 18006315 Ингибирование связывания [3 Н]спиперона с рецепторами D3 С помощью данного способа определяли in vitro ингибирование лекарственными средствами связывания [3 Н]спиперона (0,3 нМ) с мембранами клонированных дофаминовых рецепторов D3 человека, экспрессированных клетками СНО. Способ модифицирован по MacKenzie et al. Eur. J. Pharm.-Mol. Pharm.Sec. 1994, 266, 79-85. Ингибирование захвата [3 Н]серотонина в синаптосомы интактного головного мозга крысы Соединения испытывали на предмет их ингибирующего эффекта в отношении обратного захвата 5 НТ, посредством измерения их способности ингибировать поглощение [3 Н]серотонина в синаптосомы интактного головного мозга крысы in vitro. Данный анализ выполняли, как описано Hyttel в Psychopharmacology 1978, 60, 13. Ингибирование связывания [3 Н]кетансерина с рецепторами 5-НТ 2 А Соединения изучали на предмет аффинности в отношении рецепторов 5-НТ 2 А посредством определения их способности ингибировать связывание [3 Н]кетансерина (0,50 нМ) с мембранами из головного мозга (коры) крысы in vitro. Данный способ описан Sanchez et al. Drug Dev. Res. 1991, 22, 239-250. Эффективность в отношении рецепторов 5-НТ 2 С по результатам флюорометрии Соединения изучали на предмет их эффективности в отношении клеток СНО, экспрессирующих рецепторы 5-НТ 2 С, с использованием анализа с помощью флюорометрического визуализирующего планшет-ридера (FLIPR). Данное исследование выполняли согласно инструкциям Molecular Devices Inc. для их FLIPR Calcium Assay Kit и с модификацией по Porter et al. British Journal of Pharmacology 1999,128:13. Было установлено, что данные соединения не обладают или обладают весьма слабой аффинностью в отношении дофаминового рецептора D2. Было установлено, что многие соединения ингибируют связывание [3 Н]спиперона с дофаминовым рецептором D3, некоторые из соединений ингибируют обратный захват серотонина, и некоторые из соединений представляют собой лиганды рецепторов 5-НТ 2 А и/или лиганды рецепторов 5-НТ 2 с. Как упоминалось выше, соединения по настоящему изобретению хорошо растворяются в воде по сравнению с родственными соединениями, описанными в WO 98/28293. Соответственно, как ожидается,данные соединения будут иметь улучшенную биодоступность. Таким образом, соединения по настоящему изобретению считаются пригодными для лечения положительных и отрицательных симптомов шизофрении, других психозов, тревожных расстройств, таких как генерализованное тревожное расстройство, паническое расстройство и обсессивно-компульсивное расстройство, депрессии, побочных эффектов, индуцированных обычными антипсихотическими агентами, мигрени, ADHD, а также для улучшения сна. В частности, соединения по настоящему изобретению считаются пригодными для лечения положительных и отрицательных симптомов шизофрении без вызывания экстрапирамидных побочных эффектов. Примеры композиций Фармацевтические композиции по настоящему изобретению можно изготавливать обычными способами, известными специалистам. Например, таблетки можно изготавливать смешиванием активного ингредиента с обычными вспомогательными веществами и/или разбавителями с последующим прессованием смеси на обычном оборудовании для таблетирования. Примеры вспомогательных веществ или разбавителей включают: кукурузный крахмал, картофельный крахмал, тальк, стеарат магния, желатин, лактозу, камеди и т.п. Можно использовать также любые другие вспомогательные вещества или добавки, которые обычно используют для указанных целей, такие как красители, корригенты, консерванты и т.п., при условии, что они совместимы с активными ингредиентами. Растворы для инъекций можно изготавливать растворением активного ингредиента и возможных добавок в части растворителя для инъекций, предпочтительно, в стерильной воде, доведением раствора до желательного объема, стерилизацией раствора и розливом его в подходящие ампулы или флаконы. Можно добавлять любой подходящий дополнительный агент, который обычно используется в данной области, такой как агенты, создающие тонус, консерванты, антиоксиданты и т.п. Типичные примеры прописей для композиций по настоящему изобретению следующие: 1) Таблетки, содержащие 5,0 мг соединения по настоящему изобретению из расчета на свободное основание: Соединение 5,0 мг Лактоза 60 мг Кукурузный крахмал 30 мг Гидроксипропилцеллюлоза 2,4 мг Микрокристаллическая целлюлоза 19,2 мг Натрийкроскармеллоза типа А 2,4 мг Стеарат магния 0,84 мг- 19006315 2) Таблетки, содержащие 0,5 мг соединения по настоящему изобретению из расчета на свободное основание: Соединение 0,5 мг Лактоза 46,9 мг Кукурузный крахмал 23,5 мг Повидон 1,8 мг Микрокристаллическая целлюлоза 14,4 мг Натрийкроскармеллоза типа А 1,8 мг Стеарат магния 0,63 мг 3) Сироп, содержащий в миллилитре: Соединение 25 мг Сорбит 500 мг Гидроксипропилцеллюлоза 15 мг Глицерин 50 мг Метилпарабен 1 мг Пропилпарабен 0,1 мг Этанол 0,005 мл Корригент 0,05 мг Сахариннатрий 0,5 мг Вода до 1 мл 4) Раствор для инъекций, содержащий в миллилитре: Соединение 0,5 мг Сорбит 5,1 мг Уксусная кислота 0,05 мг Сахариннатрий 0,5 мг Вода до 1 мл ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Замещенное производное индола формулы I где (a) один из Y1 и Y2 представляет собой N, который связан с Y4, а другой из Y1 и Y2 представляет собой СО, CS, SO или SO2 и Y4 представляет собой СН 2;(b) один из Y1 и Y2 представляет собой N, который связан с Y4, а другой из Y1 и Y2 представляет собой СН 2 и Y4 представляет собой СО, CS, SO или SO2; или(c) один из Y1 и Y2 представляет собой N, который связан с Y4, а другой из Y1 и Y2 представляет собой СН 2 и Y4 представляет собой СН 2;Y3 представляет собой Z-CH2, CH2-Z или СН 2 СН 2, a Z представляет собой О или S; при условии, что когда Y1 представляет собой N, Y3 может не быть Z-CH2;W представляет собой связь или группу О, S, CO, CS, SO или SO2;X представляет собой С, СН или N; при условии, что когда X представляет собой С, пунктирная линия обозначает связь, а когда X представляет собой N или СН, пунктирная линия не является связью;R1-R9 независимо выбраны из водорода, галогена, цианогруппы, нитрогруппы, аминогруппы, гидроксильной группы, C1-6-алкиламина, ди-С 1-6-алкиламина, C1-6-алкила, С 2-6-алкенила, С 2-6-алкинила, C1-6 алкокси, C1-6-алкилтио, C1-6-алкила, замещенного гидроксильной группой или тиоловой группой, С 3-8 циклоалкила, С 3-8-циклоалкил-С 1-6-алкила, ацильной группы, тиоацильной группы, арильной группы,трифторметильной группы, трифторметилсульфонильной группы и C1-6-алкилсульфонила;R10 представляет собой водород, C1-6-алкил, С 2-6-алкенил, С 2-6-алкинил, C1-6-алкил, замещенный гидроксильной группой или тиоловой группой, С 3-8-циклоалкил, С 3-8-циклоалкил-С 1-6-алкил, арильную группу, арил-С 1-6-алкил, ацильную группу, тиоацильную группу, C1-6-алкилсульфонил, трифторметилсульфонильную или арилсульфонильную группу,или его фармацевтически приемлемая кислотно-аддитивная соль. 2. Соединение по п.1, в котором индол связан с X по позиции 3 индола. 3. Соединение по п.1 или 2, в котором один из Y1 и Y2 представляет собой N, который связан с Y4, а- 20006315 другой из Y1 и Y2 представляет собой СО и Y4 представляет собой СН 2. 4. Соединение по п.1 или 2, в котором один из Y1 и Y2 представляет собой N, который связан с Y4, а другой из Y1 и Y2 представляет собой СН 2 и Y4 представляет собой СО. 5. Соединение по п.1 или 2, в котором Y1 представляет собой азот, который связан с Y4, а один из Y4 2 и Y представляет собой СО, а другой представляет собой СН 2. 6. Соединение по п.3 или 5, в котором Y1 представляет собой азот, который связан с Y4, Y2 представляет собой СО, a Y4 представляет собой СН 2. 7. Соединение по п.4 или 5, в котором Y1 представляет собой азот, который связан с Y4, Y2 представляет собой СН 2, a Y4 представляет собой СО. 8. Соединение по п.1 или 2, в котором Y2 представляет собой азот, который связан с Y4, а один из Y1 4 и Y представляет собой СО, а другой представляет собой СН 2. 9. Соединение по п.4 или 8, в котором Y2 представляет собой атом азота, который связан с Y4, Y1 представляет собой СН 2, a Y4 представляет собой СО. 10. Соединение по п.3 или 8, в котором Y2 представляет собой атом азота, который связан с Y4, Y1 представляет собой СО, a Y4 представляет собой СН 2. 11. Соединение по п.1 или 2, в котором один из Y1 и Y2 представляет собой N, который связан с Y4,а другой из Y1 и Y2 представляет собой СН 2 и Y4 представляет собой СН 2. 12. Соединение по любому из пп.1-11, в котором Y3 представляет собой СН 2 СН 2 или CH2Z. 13. Соединение по любому из пп.1-12, в котором X представляет собой С. 14. Соединение по любому из пп.1-12, в котором X представляет собой N. 15. Соединение по любому из пп.1-12, в котором X представляет собой СН. 16. Соединение по любому из пп.1-15, в котором R1-R9 независимо выбраны из водорода, галогена,цианогруппы, нитрогруппы, аминогруппы, C1-6-алкиламина, ди-С 1-6-алкиламина, C1-6-алкила, С 3-8 циклоалкила и трифторметильной группы, a R10 представляет собой водород, C1-6-алкил или ацильную группу, и/или его фармацевтически приемлемая кислотно-аддитивная соль. 17. Соединение по любому из пп.1-16, в котором W представляет собой связь, a n+m равно 1-6. 18. Соединение по п.17, в котором n+m равно 3-6. 19. Соединение по п.1, выбранное из 5-фтор-3-1-[2-(2-оксо-3,4-дигидро-2 Н-хинолин-1-ил)этил]пиперидин-4-ил-1 Н-индола,5-фтор-3-1-[3-(1-оксо-3,4-дигидро-1 Н-хинолин-2-ил)пропан-1-ил]пиперидин-4-ил-1 Н-индола,5-фтор-3-1-[4-(1-оксо-3,4-дигидро-1 Н-хинолин-2-ил)бутан-1-ил]пиперидин-4-ил-1 Н-индола,5-фтор-3-1-[3-(2-оксо-3,4-дигидро-2 Н-хинолин-1-ил)пропан-1-ил]пиперидин-4-ил-1 Н-индола,5-фтор-3-1-[5-(2-оксо-3,4-дигидро-2 Н-хинолин-1-ил)пентан-1-ил]пиперидин-4-ил-1 Н-индола,5-хлор-3-1-[3-(2-оксо-3,4-дигидро-2 Н-хинолин-1-ил)пропан-1-ил]пиперидин-4-ил-1 Н-индола,5-хлор-3-1-[4-(2-оксо-3,4-дигидро-2 Н-хинолин-1-ил)бутан-1-ил]пиперидин-4-ил-1 Н-индола,5-хлор-3-1-[5-(2-оксо-3,4-дигидро-2 Н-хинолин-1-ил)пентан-1-ил]пиперидин-4-ил-1 Н-индола,7-хлор-3-1-[4-(2-оксо-3,4-дигидро-2 Н-хинолин-1-ил)бутан-1-ил]пиперидин-4-ил-1 Н-индола,5-фтор-3-1-[4-(3-оксо-3,4-дигидро-2 Н-1,4-бензоксазин-4-ил)бутан-1-ил]пиперидин-4-ил-1 Ниндола,5-хлор-3-1-[4-(3-оксо-3,4-дигидро-2 Н-1,4-бензоксазин-4-ил)бутан-1-ил]пиперидин-4-ил-1 Ниндола,5-фтор-3-1-[3-(2-оксо-3,4-дигидро-2 Н-хинолин-1-ил)пропан-1-ил]-3,6-дигидро-2 Н-пиридин-4-ил 1 Н-индола,5-фтор-3-1-[4-(2-оксо-3,4-дигидро-2 Н-хинолин-1-ил)бутан-1-ил]-3,6-дигидро-2 Н-пиридин-4-ил 1 Н-индола,5-фтор-3-1-[5-(2-оксо-3,4-дигидро-2 Н-хинолин-1-ил)пентан-1-ил]-3,6-дигидро-2 Н-пиридин-4-ил 1 Н-индола,5-фтор-3-1-[4-(2-оксо-3,4-дигидро-2 Н-хинолин-1-ил)бутан-1-ил]пиперидин-4-ил-1 Н-индола,5-фтор-1-метил-3-1-[3-(2-оксо-3,4-дигидро-2 Н-хинолин-1-ил)пропан-1-ил]пиперидин-4-ил-1 Ниндола,5-фтор-1-метил-3-1-[4-(2-оксо-3,4-дигидро-2 Н-хинолин-1-ил)бутан-1-ил]пиперидин-4-ил-1 Ниндола,1-(бутан-1-ил)-5-фтор-3-1-[4-(2-оксо-3,4-дигидро-2 Н-хинолин-1-ил)бутан-1-ил]-3,6-дигидро-2 Нпиридин-4-ил-1 Н-индола,5-фтор-3-1-[3-(3,4-дигидро-1 Н-изохинолин-2-ил)-3-оксопропан-1-ил]пиперидин-4-ил-1 Н-индола,7-хлор-3-1-[3-(3,4-дигидро-1 Н-изохинолин-2-ил)-3-оксопропан-1-ил]пиперидин-4-ил-1 Н-индола,5-хлор-3-1-[4-(3,4-дигидро-2 Н-хинолин-1-ил)-4-оксобутан-1-ил]пиперидин-4-ил-1 Н-индола,5-фтор-3-1-[4-(3,4-дигидро-1 Н-изохинолин-2-ил)-4-оксобутан-1-ил]пиперидин-4-ил-1 Н-индола,5-хлор-3-1-[4-(3,4-дигидро-1 Н-изохинолин-2-ил)-4-оксобутан-1-ил]пиперидин-4-ил-1 Н-индола,5-фтор-3-1-[3-(3,4-дигидро-2 Н-хинолин-1-ил)пропан-1-ил]пиперидин-4-ил-1 Н-индола,5-фтор-3-1-[4-(3,4-дигидро-2 Н-хинолин-1-ил)бутан-1-ил]пиперидин-4-ил-1 Н-индола,5-фтор-3-1-[5-(3,4-дигидро-2 Н-хинолин-1-ил)пентан-1-ил]пиперидин-4-ил-1 Н-индола,- 21006315 5-хлор-3-1-[3-(3,4-дигидро-2 Н-хинолин-1-ил)пропан-1-ил]пиперидин-4-ил-1 Н-индола,5-хлор-3-1-[4-(3,4-дигидро-2 Н-хинолин-1-ил)бутан-1-ил] пиперидин-4-ил-1 Н-индола,5-хлор-3-1-[5-(3,4-дигидро-2 Н-хинолин-1-ил)пентан-1-ил]пиперидин-4-ил-1 Н-индола,7-хлор-3-1-[4-(3,4-дигидро-2 Н-хинолин-1-ил)бутан-1-ил]пиперидин-4-ил-1 Н-индола,5-фтор-1-метил-3-1-[3-(3,4-дигидро-2 Н-хинолин-1-ил)пропан-1-ил]пиперидин-4-ил-1 Н-индола,5-фтор-1-метил-3-1-[4-(3,4-дигидро-2 Н-хинолин-1-ил)бутан-1-ил]пиперидин-4-ил-1 Н-индола,5-фтор-3-1-[4-(3,4-дигидро-2 Н-1,4-бензоксазин-4-ил)бутан-1-ил]пиперидин-4-ил-1 Н-индола,5-хлор-3-1-[4-(3,4-дигидро-2 Н-1,4-бензоксазин-4-ил)бутан-1-ил]пиперидин-4-ил-1 Н-индола,5-фтор-3-1-[3-(3,4-дигидро-2 Н-хинолин-1-ил)пропан-1-ил]3,6-дигидро-2 Н-пиридин-4-ил-1 Ниндола,5-фтор-3-1-[4-(3,4-дигидро-2 Н-хинолин-1-ил)бутан-1-ил]-3,6-дигидро-2 Н-пиридин-4-ил-1 Ниндола,5-фтор-3-1-[5-(3,4-дигидро-2 Н-хинолин-1-ил)пентан-1-ил]3,6-дигидро-2 Н-пиридин-4-ил-1 Ниндола,4-фтор-3-1-[3-(3,4-дигидро-1 Н-изохинолин-2-ил)-3-оксопропан-1-ил]пиперидин-4-ил-1 Н-индола,4-фтор-3-1-[4-(3,4-дигидро-1 Н-изохинолин-2-ил)-4-оксобутан-1-ил]пиперидин-4-ил-1 Н-индола,4-фтор-3-1-[6-(3,4-дигидро-1 Н-изохинолин-2-ил)-6-оксогексан-1-ил]пиперидин-4-ил-1 Н-индола,4-хлор-3-1-[4-(3,4-дигидро-1 Н-изохинолин-2-ил)-4-оксобутан-1-ил]пиперидин-4-ил-1 Н-индола,4-хлор-3-1-[5-(3,4-дигидро-1 Н-изохинолин-2-ил)-5-оксопентан-1-ил]пиперидин-4-ил-1 Н-индола,4-хлор-3-1-[6-(3,4-дигидро-1 Н-изохинолин-2-ил)-6-оксогексан-1-ил]пиперидин-4-ил-1 Н-индола,5-фтор-3-1-[5-(3,4-дигидро-1 Н-изохинолин-2-ил)-5-оксопентан-1-ил]пиперидин-4-ил-1 Н-индола,5-фтор-3-1-[6-(3,4-дигидро-1 Н-изохинолин-2-ил)-6-оксогексан-1-ил]пиперидин-4-ил-1 Н-индола,6-хлор-3-1-[3-(3,4-дигидро-1 Н-изохинолин-2-ил)-3-оксопропан-1-ил]пиперидин-4-ил-1 Н-индола,6-хлор-3-1-[6-(3,4-дигидро-1 Н-изохинолин-2-ил)-6-оксогексан-1-ил]пиперидин-4-ил-1 Н-индола,7-хлор-3-1-[4-(3,4-дигидро-1 Н-изохинолин-2-ил)-4-оксобутан-1-ил]пиперидин-4-ил-1 Н-индола,7-хлор-3-1-[5-(3,4-дигидро-1 Н-изохинолин-2-ил)-5-оксопентан-1-ил]пиперидин-4-ил-1 Н-индола,7-хлор-3-1-[6-(3,4-дигидро-1 Н-изохинолин-2-ил)-6-оксогексан-1-ил]пиперидин-4-ил-1 Н-индола,4-фтор-3-1-[3-(3,4-дигидро-2 Н-хинолин-1-ил)-3-оксопропан-1-ил]пиперидин-4-ил-1 Н-индола,4-фтор-3-1-[4-(3,4-дигидро-2 Н-хинолин-1-ил)-4-оксобутан-1-ил]пиперидин-4-ил-1 Н-индола,4-хлор-3-1-[3-(3,4-дигидро-2 Н-хинолин-1-ил)-3-оксопропан-1-ил]пиперидин-4-ил-1 Н-индола,4-хлор-3-1-[4-(3,4-дигидро-2 Н-хинолин-1-ил)-4-оксобутан-1-ил]пиперидин-4-ил-1 Н-индола,5-фтор-3-1-[3-(3,4-дигидро-2 Н-хинолин-1-ил)-3-оксопропан-1-ил]пиперидин-4-ил-1 Н-индола,5-фтор-3-1-[4-(3,4-дигидро-2 Н-хинолин-1-ил)-4-оксобутан-1-ил]пиперидин-4-ил-1 Н-индола,5-фтор-3-1-[5-(3,4-дигидро-2 Н-хинолин-1-ил)-5-оксопентан-1-ил]пиперидин-4-ил-1 Н-индола,5-фтор-3-1-[6-(3,4-дигидро-2 Н-хинолин-1-ил)-6-оксогексан-1-ил]пиперидин-4-ил-1 Н-индола,6-хлор-3-1-[3-(3,4-дигидро-2 Н-хинолин-1-ил)-3-оксопропан-1-ил]пиперидин-4-ил-1 Н-индола,6-хлор-3-1-[6-(3,4-дигидро-2 Н-хинолин-1-ил)-6-оксогексан-1-ил]пиперидин-4-ил-1 Н-индола,7-хлор-3-1-[4-(3,4-дигидро-2 Н-хинолин-1-ил)-4-оксобутан-1-ил]пиперидин-4-ил-1 Н-индола,7-хлор-3-1-[5-(3,4-дигидро-2 Н-хинолин-1-ил)-5-оксопентан-1-ил]пиперидин-4-ил-1 Н-индола,7-хлор-3-1-[6-(3,4-дигидро-2 Н-хинолин-1-ил)-6-оксогексан-1-ил]пиперидин-4-ил-1 Н-индола,5-фтор-3-1-[4-(3,4-дигидро-1 Н-изохинолин-2-ил)бутан-1-ил]пиперидин-4-ил-1 Н-индола,5-фтор-3-1-[4-(6,7-диметокси-3,4-дигидро-1 Н-изохинолин-2-ил)бутан-1-ил]пиперидин-4-ил-1 Ниндола или их фармацевтически приемлемых солей. 20. Фармацевтическая композиция, включающая терапевтически эффективное количество соединения по любому из пп.1-19 в сочетании с одним или более фармацевтически приемлемым носителем или разбавителем. 21. Применение соединения по любому из пп.1-19 для производства лекарственного средства, пригодного для лечения положительных и отрицательных симптомов шизофрении, других психозов, тревожных расстройств, таких как генерализованное тревожное расстройство, паническое расстройство и обсессивно-компульсивное расстройство, депрессии, агрессии, побочных эффектов, индуцированных обычными антипсихотическими агентами, мигрени, когнитивных расстройств, ADHD, а также для улучшения сна. 22. Способ лечения положительных и отрицательных симптомов шизофрении, других психозов,тревожных расстройств, таких как генерализованное тревожное расстройство, паническое расстройство и обсессивно-компульсивное расстройство, депрессии, агрессии, побочных эффектов, индуцированных обычными антипсихотическими агентами, мигрени, когнитивных расстройств, ADHD, а также улучшения сна, включающий введение терапевтически эффективного количества соединения по любому из пп.1-19. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6
МПК / Метки
МПК: C07D 401/14, A61K 31/4045, A61P 25/06, C07D 413/14
Метки: индола, производные, цнс, пригодные, расстройств, лечения
Код ссылки
<a href="https://eas.patents.su/23-6315-proizvodnye-indola-prigodnye-dlya-lecheniya-rasstrojjstv-cns.html" rel="bookmark" title="База патентов Евразийского Союза">Производные индола, пригодные для лечения расстройств цнс</a>
Предыдущий патент: Способ ингибирования прогрессивного развития или стабилизации волчаночного нефрита
Следующий патент: Комбинация, включающая комбретастатин и противораковые средства
Случайный патент: Способ получения эрбумина периндоприла