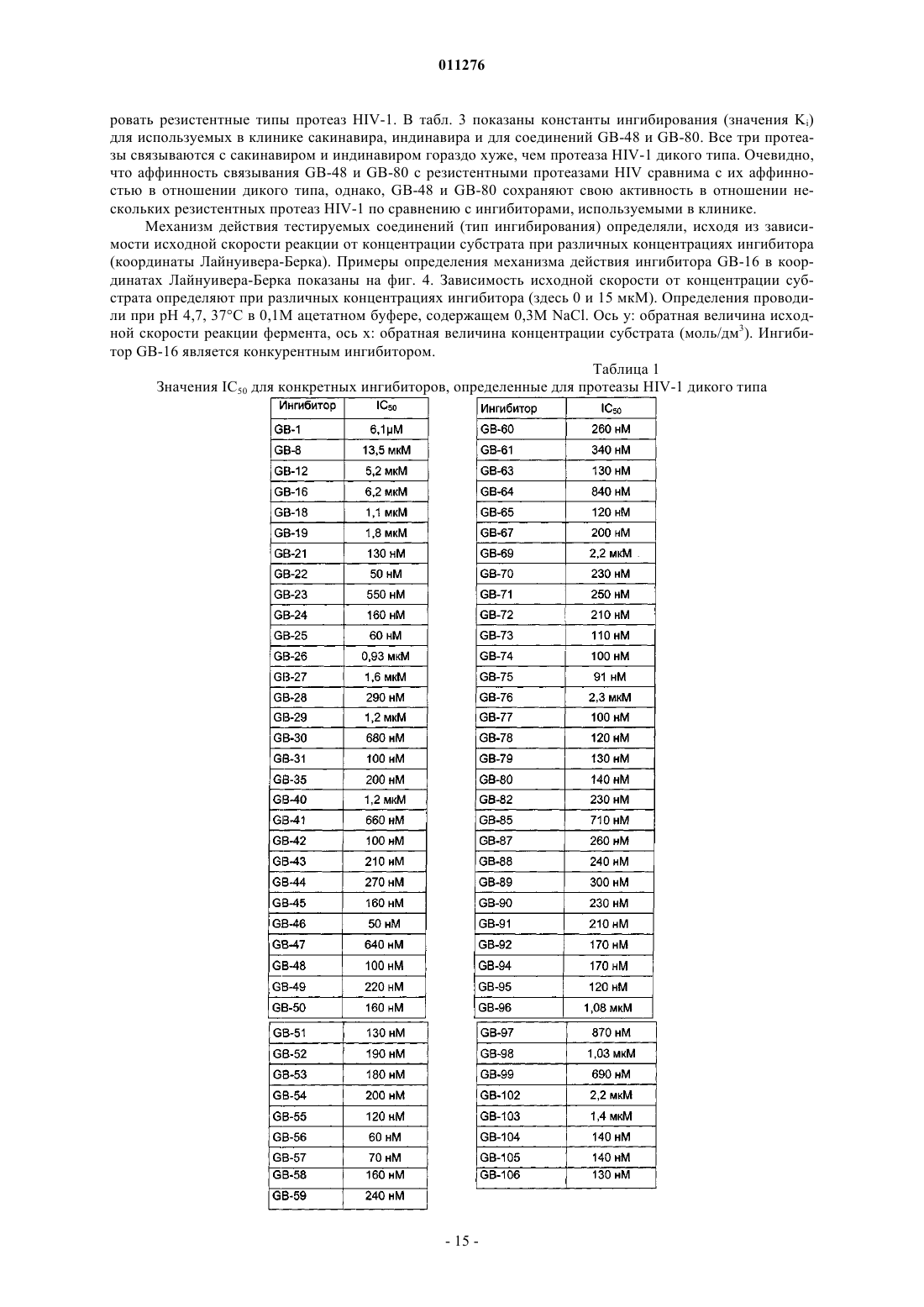
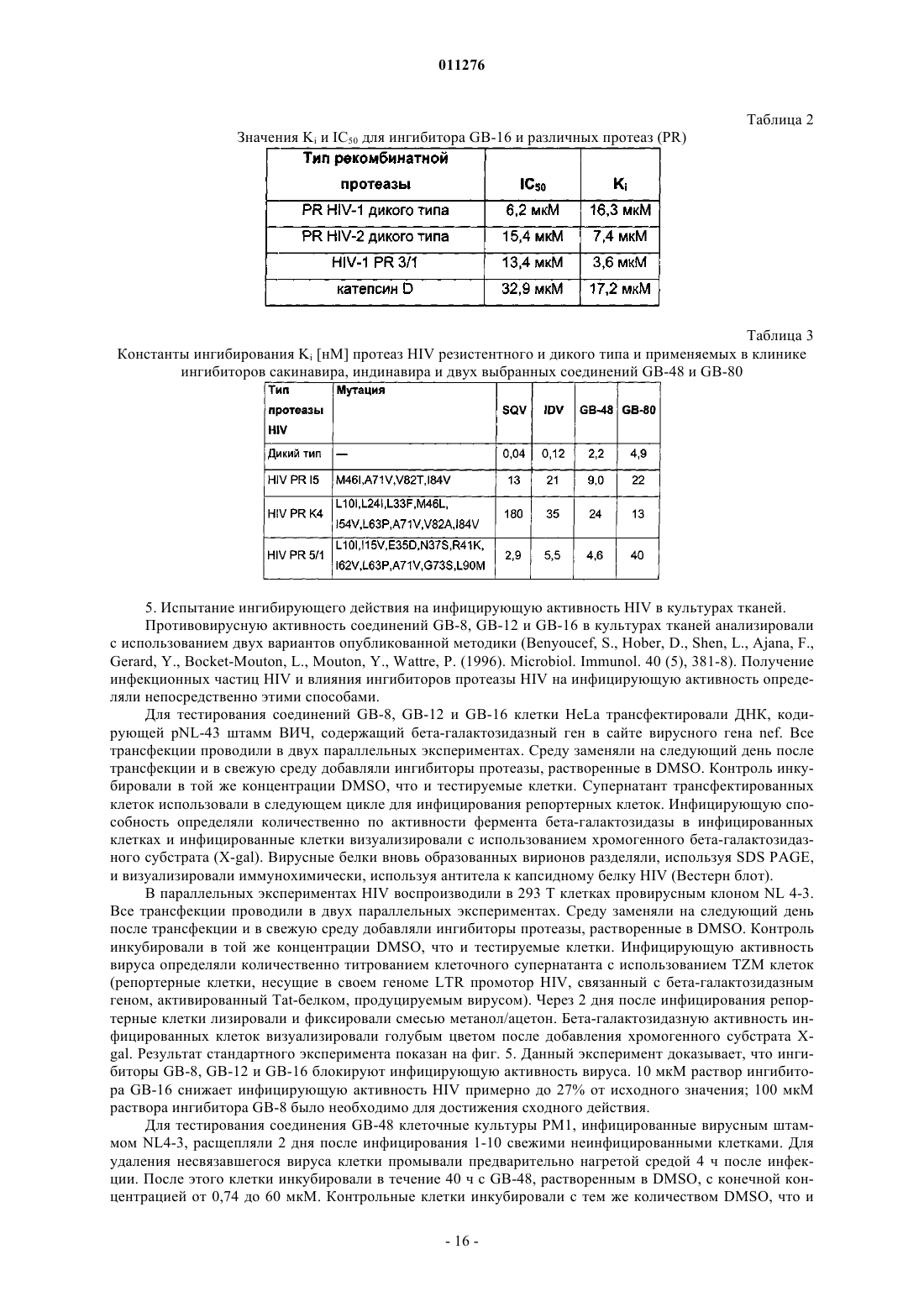
Новые ингибиторы протеазы hiv
Номер патента: 11276
Опубликовано: 27.02.2009
Авторы: Прейдова Яна, Козисек Милан, Бодем Йохен, Сиглер Петр, Крал Владимир, Краусслих Ханс-Георг, Грюнер Богумир, Плесек Яромир, Конвалинка Ян, Лепсик Мартин, Покорна Яна
Формула / Реферат
1. Применение соединений, содержащих кластеры, выбранные из группы, включающей бораны, и/или карбораны, и/или металкарбораны, имеющие от 6 до 12 атомов бора в каждом кластере, где заряд каждого индивидуального кластера борана, карборана или металкарборана равен 0, -1 или -2; число кластеров борана, карборана или металкарборана в молекуле составляет от 1 до 9 и данные карборановые кластеры в металкарборановых фрагментах координированы с атомом переходного металла, выбранного из группы, содержащей кобальт, железо, никель и рутений, в качестве ингибитора протеазы ВИЧ.
2. Применение по п.1, отличающееся тем, что в кластерах присутствуют гетероатомы, выбранные из группы, содержащей азот, фосфор, кремний, германий, олово и серу.
3. Применение по п.1 или 2, отличающееся тем, что соединения характеризуются общей формулой (I)
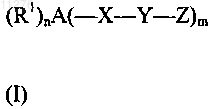
где А представляет собой анионный кластер ![]()
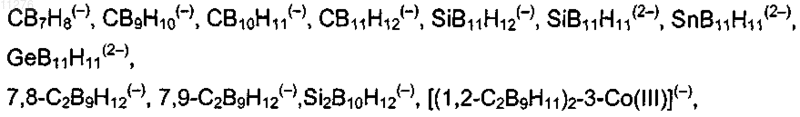

где заместители общей формулы -X-Y-Z и R1 связаны с атомами углерода, атомами бора или гетероатомами кластера А,
где j составляет от 1 до 3,
М представляет Fe, Co, Ni, Ru
и где R1 тот же или иной и выбран из группы, содержащей водород, галоген, метил, гидрокси, фенил, фенилен, тиол, метокси и трифторметоксигруппу,
m равно 0, 1 или 2,
n составляет от 0 до 12,
X такой же или иной и представляет -О-, -С(=O)-, -СН2-, -N(R3)-, -P(R3)-, -S-, C1-C10алкандиил, -(CH2CH2O)q-, -O(CH2CH2O)q-, -(OCH2CH2)q-, -(CH2CH2O)qCH2CH2-, -(OCH2CH2)qN(R3)-, -(OCH2CH2)qN+(R3)(R7)-,
-(OCH2CH2)qN(R3)(CH2CH2O)q-, -(OCH2CH2)qN+(R3)(R7)(CH2CH2O)q-, фенилен, замещенный независимо 0-3 R14, в случае металкарборанов типа [(1,2-С2В9Н11)2-3-M(III)](-) X представляет одну из мостиковых групп >S, >N, >N(R3)+, >P, >O2P, >O2P(=O), фенилен, независимо замещенный 0-3 R14, этандиил, независимо замещенный 0-3 R14, заместитель Y соединен с мостиковой группой, где М определено выше в данном пункте, где q составляет от 0 до 12,
где R3 такой же или иной и представляет водород, А, -(CH2CH2O)q-А, -S(=O)k(R7), -C(=O)(R5),
-S(=O)2N(R7)(R8), С1-C8алкил, замещенный 0-3 R10, C2-C8алкенил, замещенный 0-3 R10, C2-C8алкинил, замещенный 0-3 R10, фенил, замещенный 0-5 R10, нафтил, замещенный 0-5 R10, адамантил, замещенный 0-5 R10, и C3-C14 карбоциклический остаток, замещенный 0-5 R10 или 0-5 R11, или 5-10-членный гетероцикл, содержащий от 1 до 4 гетероатомов, выбранных из группы, содержащей кислород, серу и азот, или тот же гетероцикл, замещенный 0-4 R11, где q определено выше в этом пункте, где k равно 0, 1 или 2,
где R10 такой же или иной и представляет водород, кетогруппу, галоген, цианогруппу, -CH2N(R7)(R8), -N(R7)(R8), -C(=O)O(R7), -C(=O)(R5), -OC(=O)(R7), -O(R7), C2-C6алкоксиалкил, -S(=O)k(R7), -NHC(=NH)NH(R7), -C(=NH)NH(R7), -C(=O)N(R7)(R8), -N(R8)C(=O)(R7), =N-O(R8), -N(R8)C(=O)O(R8), -OC(=O)N(R7)(R8),
-N(R7)C(=O)N(R7)(R8), -N(R8)S(=O)2N(R7)(R8), -N(R8)S(=O)2(R7), -S(=O)2N(R7)(R8), С1-C4алкил, C2-C4алкенил, C3-C10циклоалкил, C3-C6циклоалкилметил, фенил, пентафторфенил, фенилметил, фенетил, фенокси, фенилметокси, нитро, С7-C10арилалкил, -С(=O)-NH(OH), -С(=O)-NH(NH2), -В(ОН)2, сульфонамид, формил, C3-C6циклоалкокси, С1-C4алкил, замещенный -N(R7)(R8), С1-C4гидроксиалкил, метилендиокси, этилендиокси, С1-C4галоалкил, C1-C4галоалкокси, C1-C4алкоксикарбонил, C1-C4алкилкарбонилокси, C1-C4алкилкарбонил, C1-C4алкилкарбониламино, -OCH2C(=O)O(R7), 2-(1-морфолино)этокси, азидо, -C(R8)=N-O(R8), C5-C14карбоциклический остаток, замещенный 0-5 R11, или 5-10-членный гетероцикл, содержащий от 1 до 4 гетероатомов, выбранных независимо из группы, содержащей кислород, серу и азот, или тот же гетероцикл, замещенный 0-2 R11, где k определено выше в этом пункте,
где R7 такой же или иной и представляет водород, фенил, замещенный 0-3 R14, фенилметил, замещенный 0-3 R14, С1-C6алкил, замещенный 0-3 R14, C2-C4алкенил, замещенный 0-3 R14, C1-C6алкилкарбонил, замещенный 0-3 R14, C1-C6алкоксикарбонил, замещенный 0-3 R14, C1-C6алкиламинокарбонил, замещенный 0-3 R14, C3-C6алкоксиалкил, замещенный 0-3 R14, любую группу, обычно используемую для защиты аминогруппы, если R7 связан с атомом азота, или любую группу, обычно используемую для защиты гидроксигруппы, если R7 связан с атомом кислорода,
где R14 такой же или иной и представляет водород, кето, галоген, цианогруппу, -CH2NH2, -NH2, -С(=O)ОН, -OC(=O)(C1-C3алкил), -ОН, C2-C6алкоксиалкил, -C(=O)NH2, -OC(=O)NH2, -NHC(=O)NH2, -S(=O)2NH2, C1-C4алкил, C2-C4алкенил, C3-C10циклоалкил, C3-C6циклоалкилметил, фенил, бензил, фенетил, фенокси, бензилокси, нитро, C1-C10арилалкил, -С(=O)-NH(OH), -С(=O)-NH(NH2), -В(ОН)2, C3-C6циклоалкокси, С1-C4алкил, замещенный -NH2, С1-C4гидроксиалкил, метилендиокси, этилендиокси, С1-C4галоалкил, С1-C4галоалкокси, С1-C4алкоксикарбонил, С1-C4алкилкарбонилокси, C1-C4алкилкарбонил, C1-C4алкилкарбониламино, -ОСН2С(=O)ОН, 2-(1-морфолино)этокси, азидо, арил(С1-C3алкил), С5-C14карбоциклический остаток, 5-10-членный гетероцикл, содержащий от 1 до 4 гетероатомов, выбранных независимо из группы, содержащей кислород, серу и азот, или тот же гетероцикл, замещенный 0-3 R6,
где R6, в том случае, если связан с атомом углерода, такой же или иной и представляет фенил, фенилметил, фенетил, фенокси, фенилметокси, галогхэ, гидрокси, нитро, цианогруппу, С1-C4алкил, C3-C6циклоалкил, C3-C6циклоалкилметил, С7-C10арилалкил, C1-C4алкокси, -С(=O)ОН, -C(=O)-NH(OH), -C(=O)-NH(NH2), -В(ОН)2, сульфонамид, формил, C3-C6циклоалкокси, -O(R7), С1-C4алкил, замещенный -N(R7)(R8), -N(R7)(R8), C2-C6алкоксиалкил, C1-C4гидроксиалкил, метилендиокси, этилендиокси, C1-C4галоалкил, C1-C4галоалкокси, C1-C4алкоксикарбонил, C1-C4алкилкарбонилокси, C1-C4алкилкарбонил, С1-C4алкилкарбониламино, -S(=O)k(R7), -S(=O)2N(R7)(R8), -NHS(=O)2(R8), -ОСН2С(=O)ОН, 2-(1-морфолино)этокси, -C(R8)=N-O(R8), 5-10-членный гетероцикл, содержащий от 1 до 4 гетероатомов, выбранных независимо из группы, содержащей кислород, серу и азот, или тот же гетероцикл, замещенный 0-3 R9, C3-C4углеродную цепь, которая связывается другим своим концом с соседним атомом углерода кольца и, таким образом, образует 5- или 6-членное кольцо, это 5- или 6-членное кольцо может быть замещено при любом алифатическом атоме углерода галогеновой группой, С1-C4алкилом, С1-C4алкокси, гидрокси, -N(R7)(R8), или, в том случае, если R6 связан с насыщенным атомом углерода, R6 может быть =O или =S, где k и R7 определены выше в этом пункте,
где R8 такой же или иной и представляет водород, гидрокси, трифторметил, С1-C6алкокси, C2-C6алкенил, фенилметил, амино, C1-C6алкил, C1-C6алкил, замещенный 0-3 группами, независимо выбранными из группы, содержащей гидрокси, С1-C4алкокси, галоген, амино, любую группу, обычно используемую для защиты аминогруппы, если R8 связан с атомом азота, или любую группу, обычно используемую для защиты гидроксигруппы, если R8 связан атомом кислорода,
где R9 такой же или иной и представляет водород или метил,
где R6, в том случае, если связан с атомом азота, такой же или иной и представляет фенил, фенилметил, фенетил, гидрокси, C1-C4гидроксиалкил, C1-C4алкокси, С1-C4алкил, C3-C6циклоалкил, C3-C6циклоалкилметил, -CH2N(R7)(R8), -N(R7)(R8), C2-C6алкоксиалкил, C1-C4галоалкил, C1-C4алкоксикарбонил, -С(=O)ОН, C1-C4алкилкарбонилокси, С1-C4алкилкарбонил C(R8)=N-O(R8), где R7 и R8 определены выше в этом пункте,
R7 и R8 альтернативно могут быть связаны таким образом, что образуют группы -(СН2)4-, -(СН2)5-, -CH2CH2N(R9)CH2CH2- или-СН2СН2ОСН2СН2-,
где R5 такой же или иной и представляет водород, галоген, фенилметил, фенетил, -C(=O)-NH(OH), -С(=O)-NH(NH2), -В(ОН)2, сульфонамид, азидо, формил, фенокси, фенилметокси, нитро, цианогруппу, -CH2N(R7)(R8), -N(R7)(R8), -OCH2C(=O)OH, -C(=O)O(R7), -OC(=O)(R7), -O(R7), C2-C6алкоксиалкил, -S(=O)k(R7), -NHC(=NH)NH(R7), -C(=NH)NH(R7), -C(=O)N(R7)(R8), -N(R8)C(=O)(R7), =N-O(R8), -N(R8)C(=O)O(R8), OC(=O)N(R7)(R8), -N(R7)C(-O)N(R7)(R8), -C(R8)=N-O(R8), -N(R8)S(=O)2N(R7)(R8), -N(R8)S(=O)2(R7), -S(=O)2N(R7)(R8), C1-C4алкил, C2-C4алкенил, C3-C10циклоалкил, C3-C6циклоалкилметил, C7-C10арилалкил, C3-C6циклоалкокси, C1-C4алкил, замещенный -N(R7)(R8), С1-C4гидроксиалкил, С1-C4галоалкил, C1-C4галоалкокси, C1-C4алкоксикарбонил, C1-C4алкилкарбонилокси, С1-C4алкилкарбонил, C1-C4алкилкарбониламино, 2-(1-морфолино)этокси, -(C1-C3алкил)арил, замещенный 0-2 R6, С5-C14карбоциклический остаток, замещенный 0-3 R6, 5-10-членный гетероцикл, содержащий от 1 до 4 гетероатомов, выбранных независимо из группы, содержащей кислород, серу и азот, или тот же гетероцикл, замещенный 0-3 R6, где k, R6, R7 и R8 определены выше в этом пункте,
где R11, в том случае, если связан с атомом углерода, такой же или иной и представляет фенетил, фенокси, C3-C10циклоалкил, C3-C6циклоалкилметил, С7-C10арилалкил, -С(=O)-NH(NH2), C2-C6алкоксиалкил, метилендиокси, этилендиокси, С1-C4алкилкарбонилокси, -NHS(=O)-(R8), фенилметокси, галоген, 2-(1-морфолино)этокси, -C(=O)O(R7), -C(=O)-NH(OH), -C(=O)N(R7)N(R7)(R8), цианогруппу, -B(OH)2, сульфонамид, формил, C3-C6циклоалкокси, C1-C4галоалкил, C1-C4галоалкокси, C2-С4галоалкенил, C2-C4галоалкинил, -N(R7)(R8), -C(R8)=N-O(R8), -NO2, -O(R7), -N(R12)(R13), -S(=O)k(R7), -S(=O)kN(R7)(R8), -C(=O)N(R7)(R8), -OC(=O)N(R7)(R8), -C(=O)(R5), -OC(=O)(R5), -OC(=O)O(R7), фенил, -C(=O)N(R7)-(С1-C4алкил), N(R7)(R8), -C(=O)N(R12)(R13), -C(=O)-(C1-C4алкил)-N(R7)C(=O)O(R7), С1-C4алкокси, замещенный 0-4 группами, выбранными независимо из группы, содержащей R5, C3-C6циклоалкил, -C(=O)O(R7), -C(=O)N(R7)(R8), -N(R7)(R8) или гидроксил, С1-C4алкил, замещенный 0-4 группами, выбранными независимо из группы, содержащей R5, =N(R8), =NN(R7)C(=O)N(R7)(R8) или -N(R7)(R8), C2-C4алкенил, замещенный 0-4 R5, C2-C4алкинил, замещенный 0-4 R5, 5-6-членный гетероцикл, содержащий от 1 до 4 гетероатомов, выбранных независимо из группы, содержащей кислород, серу и азот, C3-C4углеродную цепь, другой конец которой связан со следующим атомом углерода кольца, тем самым, образуя 5- или 6-членное кольцо, это 5- или 6-членное кольцо может быть на любом алифатическом атоме углерода замещено галогеном, С1-C4алкилом, С1-C4алкокси, гидрокси, -N(R7)(R8), или, в случае, если R11 связан насыщенным атомом углерода, R11 может быть =O или =S, где k, R5, R7 и R8 определены выше в этом пункте,
где R12 такой же или иной и представляет водород или С1-C3алкил,
где R13 такой же или иной и представляет -C(=O)N(R7)(R8), -C(=O)N(R7)NH(R8), -C(=O)C(R5)2N(R7)(R8), -C(=O)C(R5)2N(R7)NH(R8), -C(=O)C(R5)2N(R7)C(=O)O(R7), -C(=O)H, -C(=O)(R5), -C(=O)-(C1-C4алкил)-N(R7)(R8), -C(=O)-(С1-C4алкил)-, N(R7)C(=O)O(R7) или от 1 до 3 аминокислот, связанных амидными связями с атомом азота через карбоксильные группы, где R5, R7 и R8 определены выше в этом пункте,
где R11, в том случае, если связан с атомом азота, такой же или иной и представляет фенил, фенилметил, фенетил, гидроксил, С1-C4гидроксиалкил, С1-C4алкокси, С1-C4алкил, С3-С6циклоалкил, C3-C6циклоалкилметил, -CH2N(R7)(R8), -N(R7)(R8), C2-C6алкоксиалкил, С1-C4галоалкил, C1-C4алкоксикарбонил, -С(=O)ОН, C1-C4алкилкарбонилокси, C1-C4алкилкарбонил или -C(R8)=N-O(R8), где R7 и R8 определены выше в этом пункте,
где R11, если связан с атомом серы, представляет =O,
где Y такой же или иной и представляет С1-C10алкандиил, замещенный 0-4 заместителями, выбранными независимо из группы, содержащей R2 и R3, С1-C10циклоалкандиил, замещенный 0-4 R2, -X-, -С(=O)-, -(CH2CH2O)q-, -O(CH2CH2O)q-, -(OCH2CH2)q-, -(CH2CH2O)qCH2CH2-, -S(=O)k-, -P(=O)(OR3)-X-, -P(=O)(N(R3)(R4))-X-, -P(=O)(N(R3)(R4))-X-, -C(=O)-X-, -(CF2)q-, фенилен, независимо замещенный 0-3 R14, где k, q, X, R3 и R14 определены выше в этом пункте,
где R2 такой же или иной и представляет водород, -А, -X-А, -O(R7), -S(R7), -N(R7), -C(=O)O(R7), кетогруппу, C1-C8алкил, замещенный 0-3 R5, C2-C8алкенил, замещенный 0-3 R5, фенил, бензил, фенил, независимо замещенный 0-5 R14, алкинил, замещенный 0-3 R5, С1-C8перфторалкил, C3-C14карбоцикл, замещенный 0-3 R5 или 0-3 R6, или 5-10-членный гетероцикл, содержащий от 1 до 4 гетероатомов, выбранных из группы, содержащей кислород, серу и азот, или тот же гетероцикл, замещенный 0-2 R11, олигоэтиленгликолем, R6, где А, X, R5, R6, R7, R11 и R14 определены выше в этом пункте,
где R4 такой же или иной и представляет водород, C1-C8алкил, замещенный 0-3 R10, C2-C8алкенил, замещенный 0-3 R10, C2-C8алкинил, замещенный 0-3 R10, C3-C14карбоциклический остаток, замещенный 0-5 R10 или 0-5 R11, или 5-10-членный гетероцикл, содержащий от 1 до 4 гетероатомов, выбранных из группы, содержащей кислород, серу и азот, или тот же гетероцикл, замещенный 0-2 R11, где R10 и R11 определены выше в этом пункте,
где Z такой же или иной и представляет водород, А, -X-А, (-X-А)2, -С(=O)-X-А, -СН(ОН)-X-А, -CH(NH2)-X-А, -NH-A, -NH-CH(OH)CH-NH-A, -S(=O)k-X-А, -О-P(=O)(OR3)-X-А, -О-P(=O)(N(R3)(R4))-X-A, R3, R7, R10, C1-C10алкил, замещенный 0-4 R2, -ОН, -O(R3), каликс[4]арен, замещенный 0-4 R3, где k, А, X, R2, R3, R4, R7 и R10 определены выше в этом пункте,
и их фармацевтически приемлемые соли.
4. Применение по п.1 или 2, отличающееся тем, что соединения характеризуются общей формулой (II)
![]()
где А, X, Z, R1 и m, n определены в п.3,
и их фармацевтически приемлемые соли.
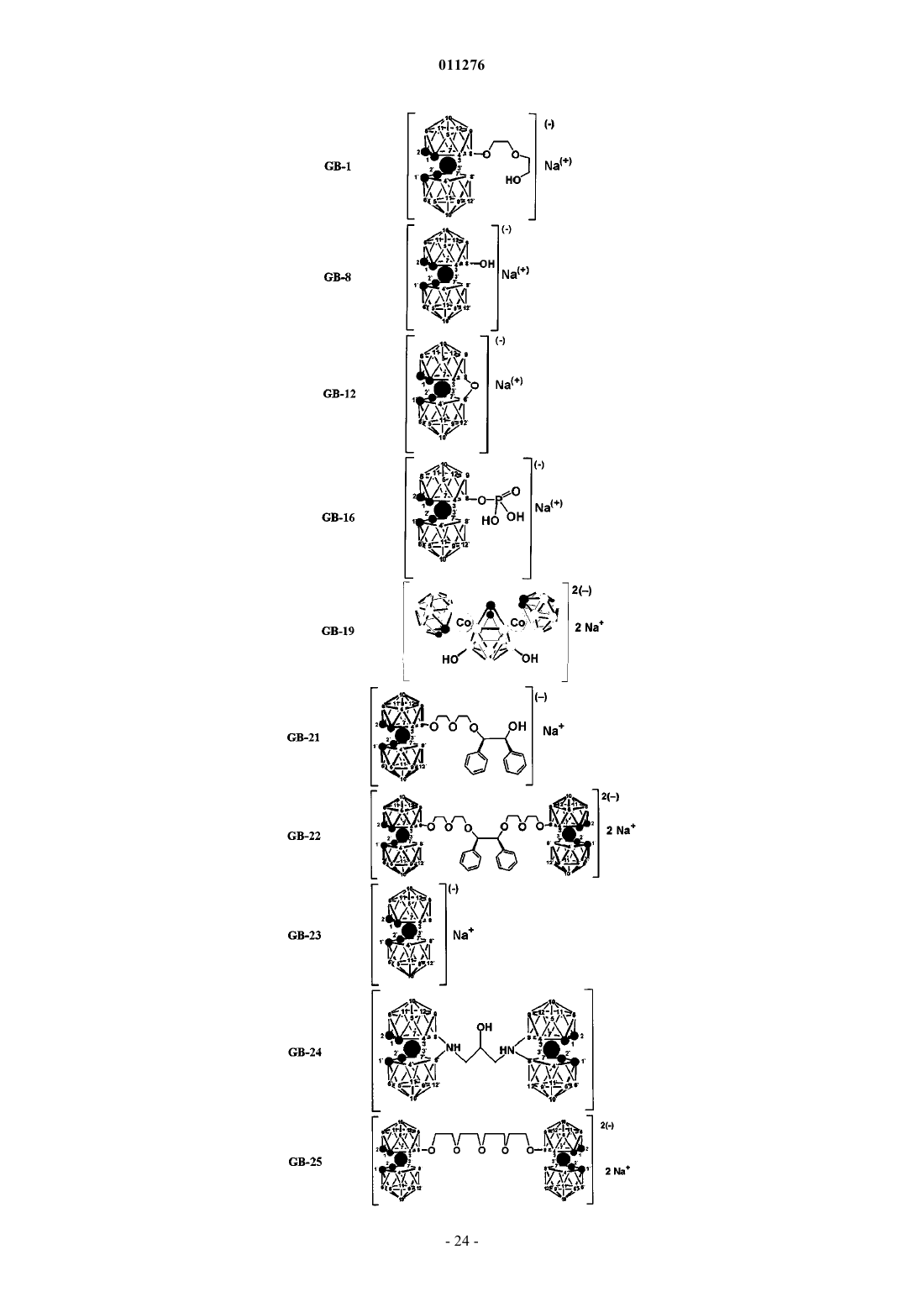
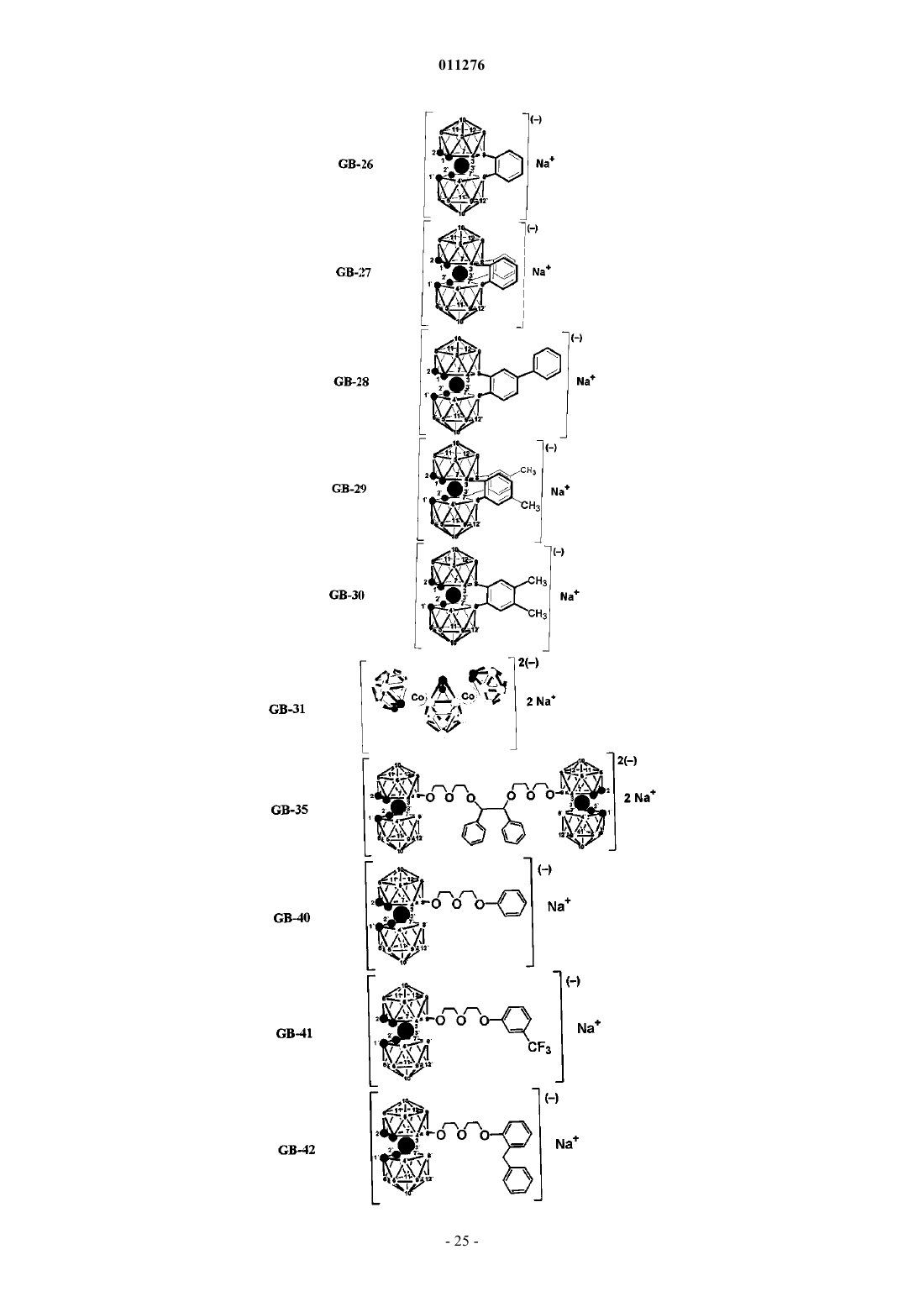
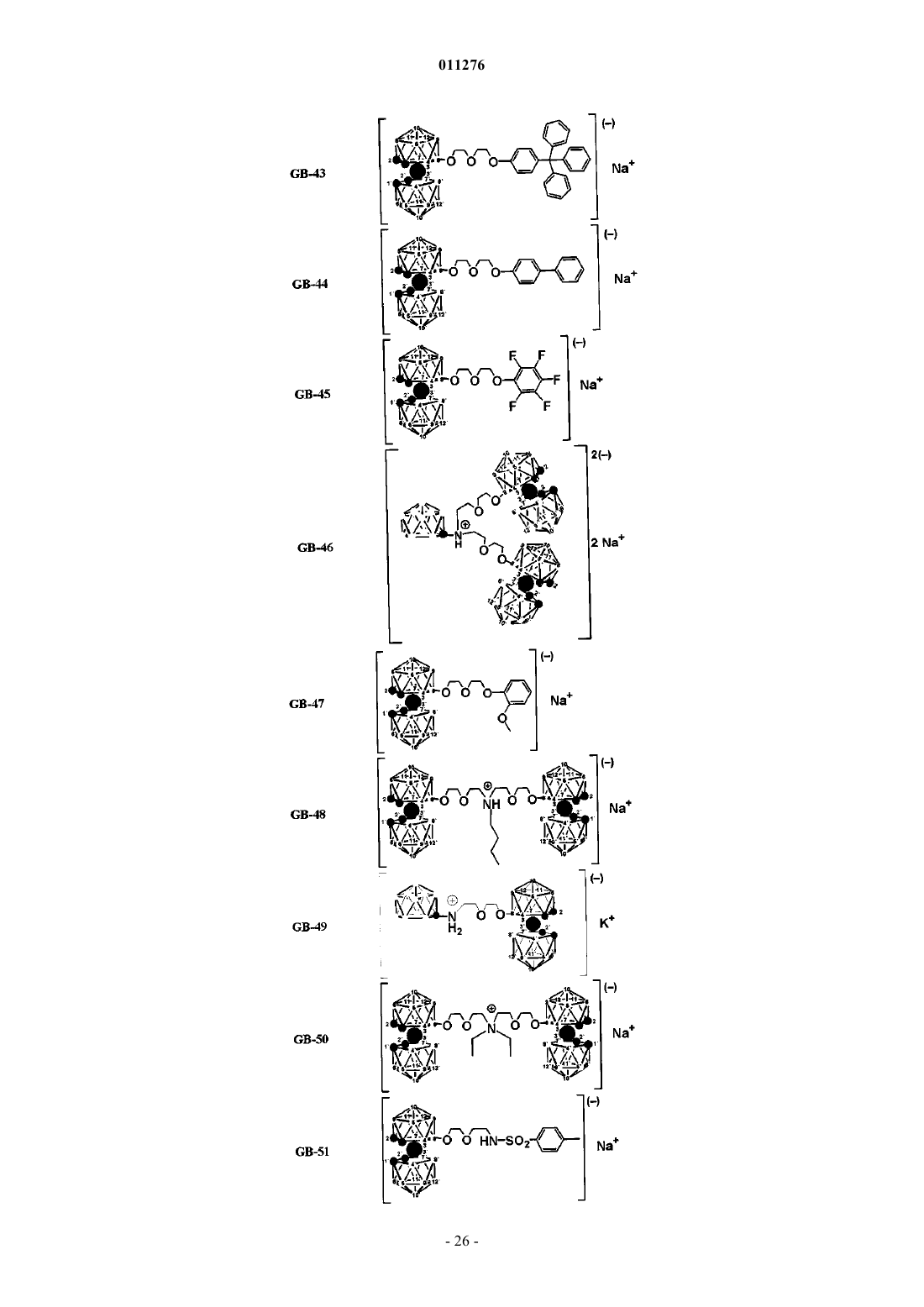
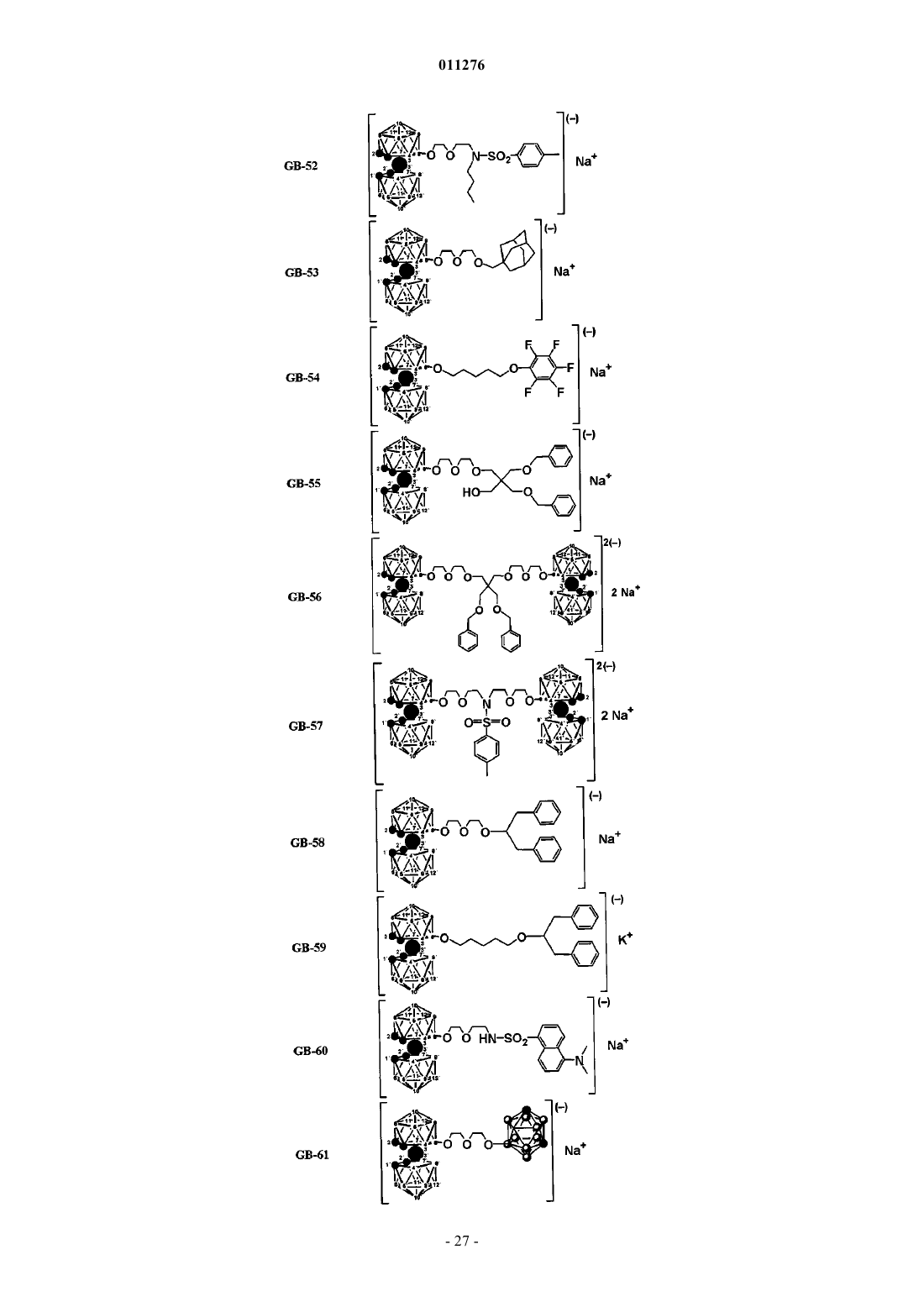
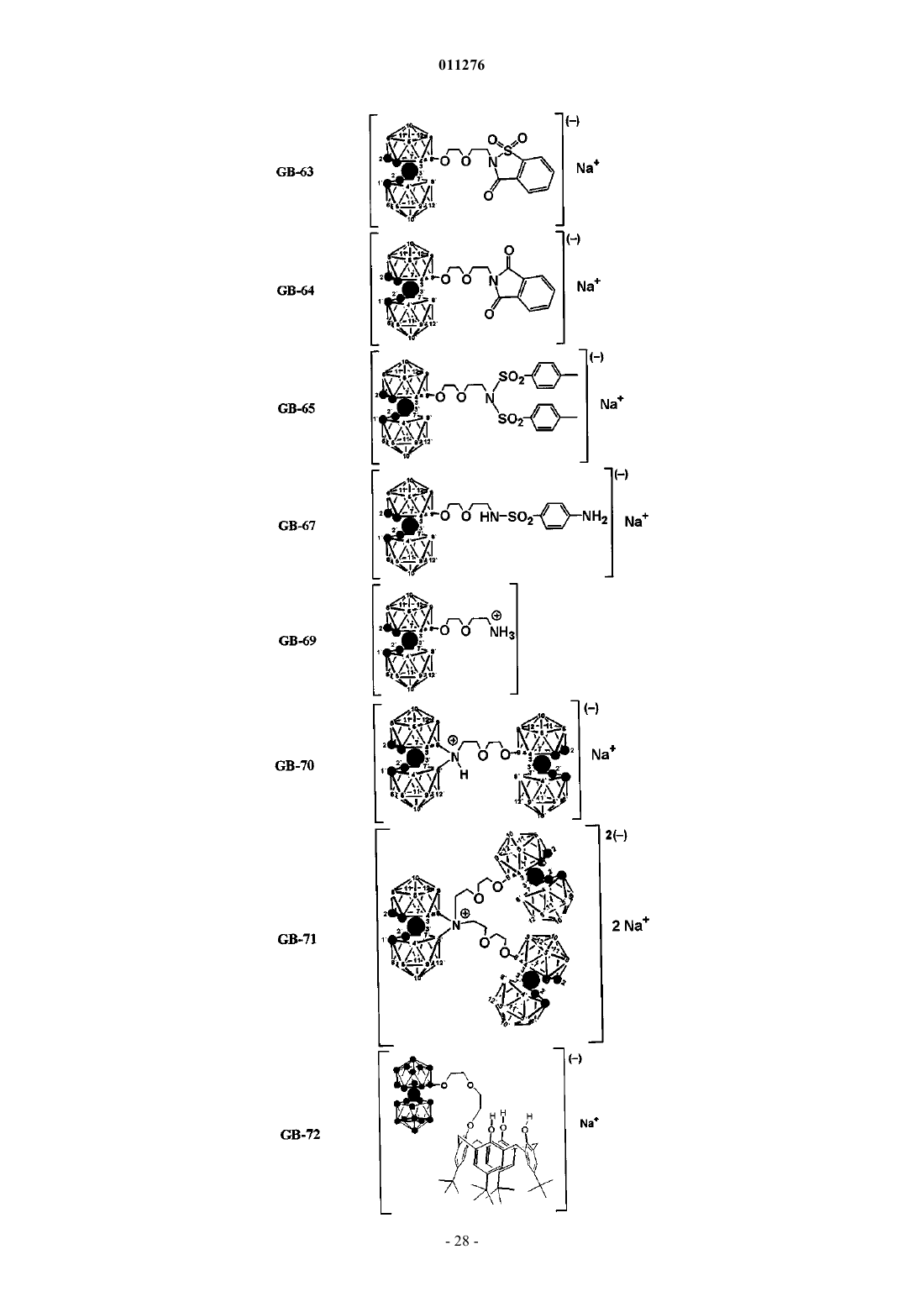
5. Применение по п.1, отличающееся тем, что соединения выбраны из группы, содержащей
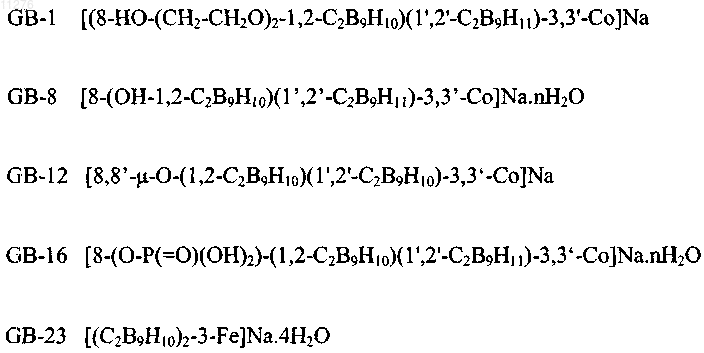

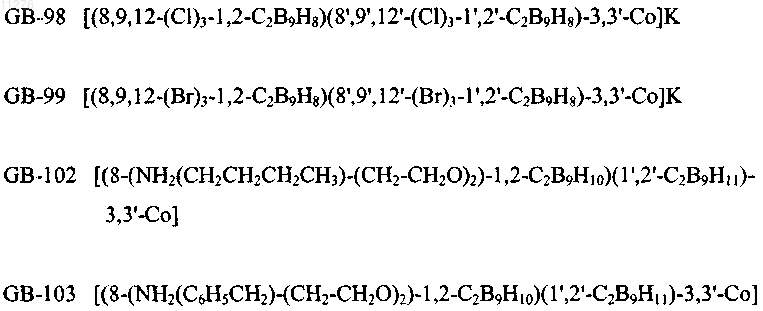
и их фармацевтически приемлемые соли.
6. Соединение, выбранное из группы, содержащей





и их фармацевтически приемлемые соли, которые могут быть использованы в качестве ингибитора протеазы ВИЧ.
7. Способ получения соединений GB-21, GB-40, GB-41, GB-43, GB-44, GB-45, GB-49, GB-51, GB-52, GB-53, GB-54, GB-55, GB-58, GB-59, GB-60, GB-61, GB-63, GB-64, GB-65, GB-67, GB-70, GB-76, GB-82, GB-85, GB-87, GB-88, GB-89, GB-90, GB-91, GB-92, GB-94, GB-95, GB-102, GB-103 по п.5 или 6, включающий в себя стадию, на которой бис-(дикарболид) 8-диоксанкобальта обрабатывают соединением L-Y-Z или, необязательно, L-Z, где L выбран из группы, содержащей депротонированную гидроксигруппу, и/или аминогруппу, и/или замещенную аминогруппу, и/или амид, и/или сульфонамид, или тиоэфир, и где Y и Z определены в п.3.
8. Способ получения соединений GB-22, GB-25, GB-35, GB-46, GB-48, GB-50, GB-56, GB-57, GB-71, GB-77, GB-78, GB-79, GB-80, GB-104, GB-105, GB-106 по п.5 или 6, включающий в себя стадию, на которой бис-(дикарболид) 8-диоксанкобальта повторно обрабатывают соединением L-Y-Z или, необязательно, L-Z, где L, Y и Z определены в п.7 и полученный в результате продукт дополнительно, после его очистки, обрабатывают бис-(дикарболидом) 8-диоксанкобальта, данный процесс повторяют до достижения желаемой степени замещения реакционноспособных протонов в полиолах, полифенолах, аминах, амидах и сульфонамидах.
9. Способ получения новых соединений GB-54 и GB-59 по п.6, включающий в себя стадию, на которой бис-(дикарболид) 8-тетрагидрофуранкобальта обрабатывают соединением депротонированного пентафторфенола или депротонированного дибензилметанола.
10. Способ получения нового соединения GB-19 по п.6, включающий в себя стадию, на которой соединение [(1,2-C2B9H11)-3,3'-Co-8',10'-(OH)2-(1,2-C2B8H10)-3''-Co-(1'',2''-C2B9H11)]Cs2 (Канастид) обрабатывают раствором серной кислоты при повышенной температуре.
11. Способ получения нового соединения GB-24 по п.6, включающий в себя стадию, на которой соединение [(1,2-C2B9H10)-3,3'-Co(1',2'-C2B9H10)-8,8'-m-NH], депротонированное гидридом натрия и растворенное в диметиловом эфире диэтиленгликоля (DME), обрабатывают при температуре окружающей среды эпихлоргидрином и данный продукт получают очисткой реакционной смеси на колонке с силикагелем.
12. Фармацевтическая композиция, предназначенэря для применения при лечении HIV-инфекции и СПИД, содержащая по меньшей мере один ингибитор протеазы ВИЧ, выбранный из указанных выше соединений общей формулы (I), (R1)nA(-X-Y-Z)m, по п.3 и/или общей формулы (II), (R')nA(-X-Z)m, по п.4, и их фармацевтически приемлемые соли.
13. Фармацевтическая композиция, предназначенная для применения при лечении HIV-инфекции и СПИД, содержащая по меньшей мере одно соединение по пп.5 и 6 или их фармацевтически приемлемые соли.
Текст
011276 Область, к которой относится изобретение Данное изобретение относится к новым ингибиторам протеазы HIV и их применению как in vitro, так и in vivo. Уровень техники Вирус иммунодефицита человека (HIV) был назван этиологическим фактором СПИД независимо в Париже и в Вашингтоне (Barre-Sinoussi, F., Chermann, J.С., Rey, F., Nugeyre, M.T., Chamaret, S., Gruest, J.,Dauguet, C. Axler-Blin, C., Vezinet-Brun, F., Rouzinoux C., Rozenbaum W., Montagnier, L. (1983) Science 220,868-871; Popovic, M., Sarngadharan, M.G., Read, E., Gallo, R.C. (1984) Science 224, 497-500). За последние 18 лет попытки, направленные на разработку активных виростатиков, приводят к изобретению большого количества лекарственных средств, которые вносят большой вклад в лечение данного заболевания. Несмотря на это,ученым все еще не удается контролировать и остановить распространение данного заболевания. СПИД остается серьезной мировой проблемой. Особенно в развивающихся странах и в центральной Африке эпидемия катастрофически распространяется, ставя под угрозу основные социальные и национальные принципы. Вирус иммунодефицита человека (HIV) принадлежит подсемейству Lentivirus семейства Retroviridae. Вирусы, принадлежащие этому семейству, содержат диплоидный РНК геном и для репликации используют обратную транскриптазу. Ретровирусы дополнительно подразделяются на три подсемейства: онковирусы, лентивирусы и спумавирусы (H.R. Gelderblom, P.A. Marx, M. Ozel, D. Gheysen, R.J. Munn, K.I. Joy,и G. Pauli (1990). Morphogenesis и Fine Structure of Lentiviruses. В Pearl, Lawrence (Ed.). Retroviral Proteinases:Control of Maturation и Morphogenesis). Подсемейство Lentivirus включает в себя вирусы, вызвающие медленнотекущие хронические заболевания. Наиболее важными представителями являются HIV-1, HIV-2(оба далее обозначены общей аббревиатурой HIV) и обезьяний лентивирус SIV. Зрелый вирион HIV представляет собой сферическую частицу с диаметром от 100 до 110 нм. Ядро вируса, инкапсулированное капсидным белком, состоит из двух копий геномной одноцепочечной РНК,нуклеокапсидных белков (NC) и вирусных ферментов обратной транскриптазы (RT), интегразы (IN) и протеазы (PR). Наружный капсид состоит из фосфолипидной мембраны, образуемой из клетки-хозяина. Структуры, имеющие форму гриба, состоящие из трех молекул гликозилированного повехностного белка SU, свободно погружены в трансмембранный белок ТМ, выступающий из капсида (H.R. Gelderblom,Р.А. Marx, M. Ozel, D. Gheysen, R.J. Munn, K.I. Joy, и G. Pauli (1990). Morphogenesis and Fine Structure ofLentiviruses. В Pearl, Lawrence (Ed.). Retroviral Proteinases: Control of Maturation and Morphogenesis). Геном HIV образован двумя идентичными молекулами РНК размером примерно 9,2 тыс. н.п., кодирующими девять различных генов. Основная структура генома, характерная для всех ретровирусов, состоит из трех структурных генов gag, pol и env. Кроме структурных генов, в геноме HIV было установлено шесть генов, кодирующих белки с регуляторными функциями, принимающими участие в репликации вируса. Репликативный цикл HIV внутри клетки-хозяина можно разделить на несколько стадий (Carrasco L.,Sonenberg N., Wimmwe, E. (1993). Regulation of Gene Expression in Animal Viruses, ed. by L. Carrasco, et al.,Plenum Press, New York): поверхностный гликопротеин вирусного капсида SU распознает белковый рецептор CD4+, экспрессируемый на поверхности Т-лимфоцитов, и связывается с ним с высокой аффинностью. Для эффективного связывания необходим специфический корецептор, соответствующий типу клеткихозяина. Вирус проникает в клетку путем эндоцитоза или путем слияния вирусного капсида с поверхностью клетки, и содержимое капсида попадает в цитоплазму клетки. Обратная транскриптаза (RT) транскрибирует вирусную РНК в двухцепочечную ДНК, которая интегрируется в хромосому клетки-хозяина под действием фермента интегразы (IN). Так вирус продолжает существование в состоянии бездействия (латентная инфекция) до момента активации и транскрипции вирусных генов под действием РНК полимеразыII организма-хозяина. Согласно провирусной мРНК на рибосомах синтезируются вирусные полибелковые предшественники Gag и Gag-Pol. Полибелки, прошедшие просттрансляционную модификацию, и геномная РНК собираются вблизи поверхности клетки, и во время процесса, называемого бадинг, вирусы выходят из клетки. В незрелой частице полибелковые предшественники Gag и Gag-Pol расщепляются под действием кодируемой вирусом протеазы (PR), давая функционально активные белки, образуя, тем самым, зрелую вирусную частицу. При повреждении PR HIV или подавлении ее активности вирион остается незрелым. Наиболее тщательно изученной является HIV-1 PR. Она представляет собой димерную аспартатпротеазу, состоящую из двух идентичных нековалентно связанных субъединиц. Первичная структура мономерной субъединицы состоит из 99 аминокислот. Наиболее важный вклад в познание вторичный структуры ВИЧ-1 PR внесли методы кристаллографического структурного анализа (Wlodawer, A., Miller,M., Jaskolski, M., Sathyanarayana, В.K., Baldwin, E., Weber, I.T., Selk, L.M., Clawson, L., Schneider, J., Kent,S.B. (1989). Science 245, 616-621), которые раскрыли двойную ротационную C2 симметрию и высокое содержание -структур. Четыре цепи в сердцевине молекулы образуют лист в форме буквы , что характерно для всех аспартат-протеаз. Триплет активного сайта (Asp25-Thr26-Gly27) расположен в изгибе белковой цепи, и его структура стабилизирована сетью водородных связей. HIV PR сначала должна расщепиться автокатализом из полибелкового предшественника, и впоследствии она расщепляет предшественник в девяти точно определенных сайтах. HIV PR специфически расщепляет вирусный полибелок,несмотря на тот факт, что аминокислотные последовательности расщепленных сайтов несколько различаются. В отличие от других эндопептидаз (пепсин, трипсин, ренин), которые гидролизуют пептидные связи, следующие за конкретными аминокислотами, в HIV PR аналоги в отношении первичный структу-1 011276 ры не могут быть определены. Вместо этого, предполагают специфичность, возникающую вследствие кумулятивного эффекта автономных, в основном, слабых взаимодействий среди индивидуальных боковых цепей субстрата и соответствующего субсайта фермента. Важным является эффект гидрофобного взаимодействия, поверхности, полярности, возможной вторичной структуры и т.д. (Poorman, R.A.,Tomasselli, A.G., Heinrikson, R.L., Kzdy, F.J. (1991). J. Biol. Chem. 266, 14554-14561). Ингибиторы протеазы HIV Некоторые стадии жизненного цикла HIV выбраны в качестве мишеней для терапевтического лечения. Наиболее важными являются обратная транскриптаза (дидезоксинуклеозиды, их аналоги и ненуклеозидные ингибиторы), связывание и вход вириона в клетку-хозяина (растворимые CD4 рецепторы и их производные, полианионные соединения, ингибиторы слияния), интеграция провируса под действием интегразы в хромосому хозяина, регуляция транскрипции белковыми продуктами генов tat и rev и т.д.(обзор: De Clercq, E. (1998). Collect. Czech. Chem. Commun. 63, 449-479). Созревание ретровируса и его приведенный выше наиболее важный фермент HIV-протеаза, которая представляет собой объект данной патентной заявки, также является объектом интенсивного исследования и рационального создания лекарственных средств. В Чешской Республике семь ингибиторов были одобрены или должны быть одобрены для клинического применения: сакинавир, ритонавир, индинавир, нельфинавир, ампренавир, лопинавир и атазанавир. Все эти ингибиторы конкурентно ингибируют связывание природных субстратов сHIV PR и снижают инфекционность вируса, блокируя созревание вириона. Развитие устойчивости к ингибиторам HIV PR Внедрение ингибиторов протеазы в 1995-1996 годах и проведение HAART - высокоактивной противоретровирусной терапии - привело к замедлению проявлений оппортунистических инфекций и снижению смертности. Это усилило надежду пациентов и лечащих врачей на разработку адекватного лечения СПИД. К сожалению, вскоре после выпуска новых лекарственных средств также было обнаружено,что их возможности ограничены. При применении ингибитора PR происходит подавление репликации вируса. Если репликация не полностью подавлена, небольшая популяция вируса, устойчивая к данному ингибитору, может выжить под селекционным давлением. Это приводит к резистентности вируса (Larder, В., Richman, D., Vella, S.(1998). HIV resistance and implications for therapy, MediCom Inc., Atlanta, USA). К настоящему времени были обнаружены мутации по меньшей мере в 49 положениях в 99-аминокислотном мономере (Gulnik,S., Erickson, J.W., Xie, D. (2000). Vitam. Horm. 58, 213-256). Основными факторами, ответственными за быстрое развитие устойчивых вариантов, являются природная вариабельность генома HIV (полиморфизм) и динамичная вирусная репликация во время латентной фазы и во время периода бездействия (Erickson, J.W., Burt, S.K. (1996). Annu. Rev. Pharmacol. Toxicol. 36, 545-571). Генетическая вариабельность HIV, возможно, происходит вследствие объединения высокой ошибки скорости обратной транскриптазы, рекомбинации генома и селективного давления иммунной системы человека. Существует несколько возможных стратегий, которые может использовать вирус для развития резистентности к ингибиторам протеазы. Среди наиболее важных находятся мутации в сайте связывания фермента, которые напрямую влияют на связывание; мутации вне сайта связывания фермента, которые опосредовано влияют на связывание; мутации расщепленных участков HIV PR в полибелковых субстратах. Также мутации, которые снижают стабильность димера HIV PR и, тем самым, его аффинность к ингибитору, могут способствовать резистентности; и, наконец, также мутации вне области действия протеазы, которые в результате могут приводить, например, к более эффективному сдвигу рамки считывания (Erickson, J.W., Burt, S.K. (1996). Annu. Rev. Pharmacol. Toxicol. 36, 545-571; Boden, D., Markowitz, M.(1998). Antimicrob. Agents Chemother. 42, 2775-2783). Ингибиторы протеазы ВИЧ, известные к настоящему времени, могут быть разделены на три основные группы: (i) соединения, созданные в виде изостер переходного состояния субстрата (статины, гидроксиэтиламиновый, гидроксиметиленовый, гидроксиэтиленовый тип, ,'-дифторкетоны и т.д.); (ii) соединения,представленные с помощью конструктивной разработки на основе геометрического сходства с субстратом(например, ингибиторы DMP); (iii) соединения, имеющие случайное структурное сходство с субстратом,полученные скринингом природных веществ, выделенных, например, из биологического материала (Lebon F.,Ledecq M. (2000). Curr. Med. Chem. 7, 455-477). Создание ингибиторов вирусной протеазы является нетривиальной проблемой. В отличие от многих других ферментов, субстрат которых представляет собой простую органическую молекулу (например, природным субстратом синтазы оксида азота(II) является Lаргинин, поэтому простые модификации, подобные N-OH-Arg или N-Me-Arg, являются эффективными ингибиторами), создание ингибиторов протеазы HIV представляет собой гораздо более сложный вопрос. Их природным субстратом является полипептид, который распознается в специфическом сайте и расщепляется,давая функционально активные ферменты и структурные белки вириона. Теоретически, и с помощью методов молекулярного моделирования, и неэмпирических расчетов, а также практически создание специфического ингибитора протеазы HIV представляет трудную проблему в тех случаях, когда низкомолекулярный субстрат должен проявлять более высокую аффинность к ферменту, чем природный полипептид. Все ингибиторы протеазы ВИЧ, используемые в лечении (сакинавир, ритонавир, индинавир, нель-2 011276 финавир, ампренавир, лопинавир и атазанавир), могут быть отнесены к группе (i). Они носят пептидомиметический характер и являются конкурентными ингибиторами активного сайта фермента. Такие соединения обычно проявляют неблагоприятные фармакодинамические свойства (для достижения уровня эффективной концентрации в инфицированных клетках необходимо вводить перорально достаточно высокие дозы лекарственных средств), и в последствии может развиваться резистентность. Для преодоления проблемы, связанной с резистентностью, предпринимается важная попытка открытия непептидных ингибиторов, которые можно было создать с помощью конструктивной разработки на основе структурной информации, полученной рентгеноструктурным анализом комплексов HIV PR и известных ингибиторов, в конечном счете, скринингом комбинаторных или других библиотек химических соединений. Описание изобретения Вышеупомянутые недостатки устраняются ингибиторами протеазы HIV по данному изобретению,которые содержат кластеры, выбранные из группы, состоящей из боранов, и/или карборанов, и/или металкарборанов, содержащих от 6 до 12 атомов бора в каждом кластере, где заряд каждого индивидуального кластера борана, карборана или металкарборана равен 0, -1 или -2; количество кластеров борана,карборана или металкарборана в молекуле ингибитора составляет от 1 до 9, а карборановые кластеры в металкарборановых ингибиторах координированы с атомом переходного металла, выбранного из группы, содержащей кобальт, железо, никель и рутений. Другие соединения по данному изобретению представляют собой ингибиторы протеазы HIV, содержащие вышеуказанные кластеры, где в кластерах могут присутствовать гетероатомы, выбранные из группы, содержащей азот, фосфор, кремний, германий, олово и серу. Первый аспект данного изобретения представляет собой ингибиторы протеазы HIV общей формулы (I) где А представляет собой анионный кластер где заместители общей формулы -X-Y-Z и R1 связаны с атомами углерода, бора или гетероатомами кластера А,где j составляет от 1 до 3,М представляет Fe, Co, Ni, Ru и где R1 такой же или иной и выбран из группы, содержащей водород, галоген, метил, гидрокси,фенил, фенилен, тиол, метокси и трифторметоксигруппу,m равно 0, 1 или 2,n равно 0-12,X такой же или иной и представляет -О-, -С(=O)-, -СН 2-, -N(R3)-, -P(R3)-, -S-, C1-C10 алкандиил,-(CH2CH2O)q-, -O(CH2CH2O)q-, -(OCH2CH2)q-, -(CH2CH2O)qCH2CH2-, -(OCH2CH2)qN(R3)-, -(OCH2CH2)qN+(R3)(R7)-,-(OCH2CH2)qN(R3)(CH2CH2O)q-, -(OCH2CH2)qN+(R3)(R7)(CH2CH2O)q-, фенилен, независимо замещенный 0-3 R14, в случае металкарборанов типа [(1,2-C2B9H11)2-3-М(III)](-) X представляет одну из мостиковых групп S, N, N(R3)+, P, O2P, O2P(=O), фенилен, независимо замещенный 0-3 R14, этандиил, независимо замещенный 0-3 R14, заместитель Y соединен с этой мостиковой группой, где М определено выше,-3 011276 где q составляет от 0 до 12,где R3 такой же или иной и представляет водород, А, -(CH2CH2O)q-A, -S(=O)k(R7), -C(=O)(R5),-S(=O)2N(R7)(R8), С 1-C8 алкил, замещенный 0-3 R10, С 2-С 8 алкенил, замещенный 0-3 R10, С 2-C8 алкинил,замещенный 0-3 R10, фенил, замещенный 0-5 R10, нафтил, замещенный 0-5 R10, адамантил, замещенный 0-5 R10, и C3-C14 карбоциклический остаток, замещенный 0-5 R10 или 0-5 R11, или 5-10-членный гетероцикл, содержащий от 1 до 4 гетероатомов, выбранных из группы, содержащей кислород, серу и азот, или тот же гетероцикл, замещенный 0-4 R11, где q определено выше, где k равно 0, 1 или 2,где R10 такой же или иной и представляет водород, кетогруппу,галоген, цианогруппу, -CH2N(R7)(R8),7-N(R )(R8), -C(=O)O(R7), -C(=O)(R5), -OC(=O)(R7), -O(R7), C2-C6 алкоксиалкил, -S(=O)k(R7), -NHC(=NH)NH(R7),-C(=NH)NH(R7), -C(=O)N(R7)(R8), -N(R8)C(=O)(R7), =N-O(R8), -N(R8)C(=O)O(R8), -OC(=O)N(R7)(R8),-N(R7)C(=O)N(R7)(R8), -N(R8)S(=O)2N(R7)(R8), -N(R8)S(=O)2(R7), -S(=O)2N(R7)(R8), C1-C4 алкил, C2-C4 алкенил,C3-C10 циклоалкил, C3-C6 циклоалкилметил, фенил, пентафторфенил, фенилметил, фенетил, фенокси, фенилметокси, нитро, С 7-C10 арилалкил, -C(=O)-NH(OH), -С(=O)-NH(NH2), -В(ОН)2, сульфонамид, формил,С 3-C6 циклоалкокси, C1-C4 алкил, замещенный -N(R7)(R8), C1-C4 гидроксиалкил, метилендиокси, этилендиокси, C1-C4 галоалкил, C1-C4 галоалкокси, C1-C4 алкоксикарбонил, C1-C4 алкилкарбонилокси, C1-C4 алкилкарбонил, C1-C4 алкилкарбониламино, -OCH2C(=O)O(R7), 2-(1-морфолино)этокси, азидо, -C(R8)=N-O(R8),C5-C14 карбоциклический остаток, замещенный 0-5 R11, или 5-10-членный гетероцикл, содержащий от 1 до 4 гетероатомов, выбранных независимо из группы, содержащей кислород, серу и азот, или тот же гетероцикл, замещенный 0-2 R11, где k определено выше,где R7 такой же или иной и представляет водород, фенил, замещенный 0-3 R14, фенилметил, замещенный 0-3 R14, C1-C6 алкил, замещенный 0-3 R14, C2-C4 алкенил, замещенный 0-3 R14, C1-C6 алкилкарбонил,замещенный 0-3 R14, C1-C6 алкоксикарбонил, замещенный 0-3 R14, C1-C6 алкиламинокарбонил, замещенный 0-3 R14, C3-C6 алкоксиалкил, замещенный 0-3 R14, любую группу, обычно используемую для защиты аминогруппы, если R7 связан с атомом азота, или любую группу, обычно используемую для защиты гидроксигруппы, если R7 связан с атомом кислорода,где R14 такой же или иной и представляет водород, кето, галоген, цианогруппу, -CH2NH2, -NH2,-С(=O)ОН, -ОС(=O)(С 1-C3 алкил), -ОН, C2-C6 алкоксиалкил, -C(=O)NH2, -OC(=O)NH2, -NHC(=O)NH2, -S(=O)2NH2,C1-C4 алкил, C2-C4 алкенил, C3-C10 циклоалкил, C3-C6 циклоалкилметил, фенил, бензил, фенетил, фенокси,бензилокси, нитро, C1-C10 арилалкил, -С(=O)-NH(OH), -С(=O)-NH(NH2), -В(ОН)2, C3-C6 циклоалкокси, C1C4 алкил, замещенный -NH2, C1-C4 гидроксиалкил, метилендиокси, этилендиокси, C1-C4 галоалкил, C1-C4 галоалкокси, C1-C4 алкоксикарбонил, C1-C4 алкилкарбонилокси, C1-C4 алкилкарбонил, C1-C4 алкилкарбониламино, -ОСН 2 С(=O)ОН, 2-(1-морфолино)этокси, азидо, арил(C1-C3 алкил), C5-C14 карбоциклический остаток, 5-10-членный гетероцикл, содержащий от 1 до 4 гетероатомов, выбранных независимо из группы, содержащей кислород, серу и азот, или тот же гетероцикл, замещенный 0-3 R6,где R6, в том случае, когда он связан с атомом углерода, такой же или иной и представляет фенил,фенилметил, фенетил, фенокси, фенилметокси, галоген, гидрокси, нитро, цианогруппу, C1-C4 алкил, C3-C6 циклоалкил, C3-C6 цикпоалкилметил, С 7-C10 арилалкил, C1-C4 алкокси, -С(=O)ОН, -C(=O)-NH(OH), -С(=O)NH(NH2), -В(ОН)2, сульфонамид, формил, C3-C6 циклоалкокси, -O(R7), C1-C4 алкил, замещенный -N(R7)(R8),-N(R7)(R8), C2-C6 алкоксиалкил, C1-C4 гидроксиалкил, метилендиокси, этилендиокси, C1-C4 галоалкил, C1C4 галоалкокси, C1-C4 алкоксикарбонил, C1-C4 алкилкарбонилокси, C1-C4 алкилкарбонил, C1-C4 алкилкарбониламино, -S(=O)k(R7), -S(=O)2N(R7)(R8), -NHS(=O)2(R8), -OCH2C(=O)OH, 2-(1-морфолино)этокси, -C(R8)=NO(R8), 5-10-членный гетероцикл, содержащий от 1 до 4 гетероатомов, выбранных независимо из группы,содержащей кислород, серу и азот, или тот же гетероцикл, замещенный 0-3 R9, C3-C4 углеродную цепь,которая связывается другим концом с соседним атомом углерода в кольце и, таким образом, образует 5 или 6-членное кольцо, это 5- или 6-членное кольцо может быть замещено при любом из алифатических атомов углерода галогеновой группой, C1-C4 алкилом, C1-C4 алкокси, гидрокси, -N(R7)(R8), или, в том случае,если R6 связан с насыщенным атомом углерода, R6 может быть =O или =S, где k и R7 определены выше,где R8 такой же или иной и представляет водород, гидрокси, трифторметил, C1-C6 алкокси, C2-C6 алкенил, фенилметил, амино, C1-C6 алкил, C1-C6 алкил, замещенный 0-3 группами, выбранными независимо из группы, содержащей гидрокси, C1-C4 алкокси, галоген, амино, любую группу, обычно используемую для защиты аминогруппы, если R8 связан с атомом азота, или любую группу, обычно используемую для защиты гидроксигруппы, если R8 связан с атомом кислорода,где R9 такой же или иной и представляет водород или метил,где R6, в том случае, когда связан с атомом азота, такой же или иной и представляет фенил, фенилметил, фенетил, гидрокси, C1-C4 гидроксиалкил, C1-C4 алкокси, C1-C4 алкил, C3-C6 циклоалкил, C3-C6 циклоалкилметил, -CH2N(R7)(R8), -N(R7)(R8), C2-C6 алкоксиалкил, C1-C4 галоалкил, C1-C4 алкоксикарбонил, -C(=O)OH,C1-C4 алкилкарбонилокси, C1-C4 алкилкарбонил C(R8)=N-O(R8), где R7 и R8 определены выше,R7 и R8 альтернативно могут быть связаны таким образом, что образуют группы -(СН 2)4-, -(СН 2)5-,-CH2CH2N(R9)CH2CH2- или -CH2CH2OCH2CH2-,где R5 такой же или иной и представляет водород, галоген, фенилметил, фенетил, -C(=O)-NH(OH),-С(=O)-NH(NH2), -В(ОН)2, сульфонамид, азидо, формил, фенокси, фенилметокси, нитро, цианогруппу,-CH2N(R7)(R8), -N(R7)(R8), -ОСН 2 С(=O)ОН, -C(=O)O(R7), -OC(=O)(R7), -O(R7), C2-C6 алкоксиалкил, -S(=O)k(R7),-4 011276-NHC(=NH)NH(R7), -C(=NH)NH(R7), -C(=O)N(R7)(R8), -N(R8)C(=O)(R7), =N-O(R8), -N(R8)C(=O)O(R8),OC(=O)N(R7)(R8), -N(R7)C(-O)N(R7)(R8), -C(R8)=N-O(R8), -N(R8)S(=O)2N(R7)(R8), -N(R8)S(=O)2(R7),-S(=O)2N(R7)(R8), C1-C4 алкил, C2-C4 алкенил, C3-C10 циклоалкил, C3-C6 циклоалкилметил, С 7-C10 арилалкил,C3-C6 циклоалкокси, C1-C4 алкил, замещенный -N(R7)(R8), C1-C4 гидроксиалкил, C1-C4 галоалкил, C1-C4 галоалкокси, C1-C4 алкоксикарбонил, C1-C4 алкилкарбонилокси, C1-C4 алкилкарбонил, C1-C4 алкилкарбониламино, 2-(1-морфолино)этокси, -(C1-C3 алкил)арил, замещенный 0-2 R6, С 5-C14 карбоциклический остаток,замещенный 0-3 R6, 5-10-членный гетероцикл, содержащий от 1 до 4 гетероатомов, выбранных независимо из группы, содержащей кислород, серу и азот, или тот же гетероцикл, замещенный 0-3 R6, где k, R6,R7 и R8 определены выше,где R11, в том случае, когда связан с атомом углерода, такой же или иной и представляет фенетил,фенокси, C3-C10 циклоалкил, C3-C6 циклоалкилметил, С 7-C10 арилалкил, -С(=O)-NH(NH2), C2-C6 алкоксиалкил, метилендиокси, этилендиокси, C1-C4 алкилкарбонилокси, -NHS(=O)-(R8), фенилметокси, галоген,2-(1-морфолино)этокси, -C(=O)O(R7), -C(=O)-NH(OH), -C(=O)N(R7)N(R7)(R8), цианогруппу, -B(OH)2,сульфонамид, формил, C3-C6 циклоалкокси, C1-C4 галоалкил, C1-C4 галоалкокси, C2-C4 галоалкенил, C2C4 галоалкинил, -N(R7)(R8), -C(R8)=N-O(R8), -NO2, -O(R7), -N(R12)(R13), -S(=O)k(R7), -S(=O)kN(R7)(R8),-C(=O)N(R7)(R8), -OC(=O)N(R7)(R8), -C(=O)(R5), -OC(=O)(R5), -OC(=O)O(R7), фенил, -C(=O)N(R7)-(C1C4 алкил), N(R7)(R8), -C(=O)N(R12)(R13), -C(=O)-(C1-C4 алкил)-N(R7)C(=O)O(R7), C1-C4 алкокси, замещенный 0-4 группами, выбранными независимо из группы, содержащей R5, C3-C6 циклоалкил, -C(=O)O(R7),-C(=O)N(R7)(R8), -N(R7)(R8) или гидроксил, C1-C4 алкил, замещенный 0-4 группами, выбранными независимо из группы, содержащей R5, =N(R8), =NN(R7)C(=O)N(R7)(R8) или -N(R7)(R8), C2-C4 алкенил, замещенный 0-4 R5, C2-C4 алкинил, замещенный 0-4 R5, 5-6-членный гетероцикл, содержащий от 1 до 4 гетероатомов, выбранных независимо из группы, содержащей кислород, серу и азот, C3-C4 углеродную цепь, другой конец которой связан со следующим атомом углерода кольца, тем самым, образуя 5- или 6-членное кольцо, это 5- или 6-членное кольцо может быть на любом алифатическом атоме углерода, замещенном галогеном, C1-C4 алкилом, C1-C4 алкокси, гидрокси, -N(R7)(R8), или, если R11 связан с насыщенным атомом углерода, R11 может быть =O или =S, где k, R5, R7 и R8 определены выше,где R12 такой же или иной и представляет водород или C1-C3 алкил,где R13 такой же или иной и представляет -C(=O)N(R7)(R8), -C(=O)N(R7)NH(R8), -C(=O)C(R5)2N(R7)(R8),-C(=O)C(R5)2N(R7)NH(R8), -C(=O)C(R5)2N(R7)C(=O)O(R7), -C(=O)H, -C(=O)(R5), -C(=O)-(C1-C4 алкил)-N(R7)(R8),-C(=O)-(C1-C4 алкил)-, N(R7)C(=O)O(R7) или 1-3 аминокислоты, связанные амидными связями с атомом азота через карбоксильные группы, где R5, R7 и R8 определены выше,где R11, в том случае, когда связан с атомом азота, такой же или иной и представляет фенил, фенилметил, фенетил, гидроксил, C1-C4 гидроксиалкил, C1-C4 алкокси, C1-C4 алкил, C3-C6 циклоалкил, C3-C6 циклоалкилметил, -CH2N(R7)(R8), -N(R7)(R8), C2-C6 алкоксиалкил, C1-C4 галоалкил, C1-C4 алкоксикарбонил,-С(=O)ОН, C1-C4 алкилкарбонилокси, C1-C4 алкилкарбонил или -C(R8)=N-O(R8), где R7 и R8 определены выше,где R11, в том случае, когда связан с атомом серы, представляет =O,где Y такой же или иной и представляет C1-C10 алкандиил, замещенный 0-4 заместителями, выбранными независимо из группы, содержащей R2 и R3, C1-C10 циклоалкандиил, замещенный 0-4 R2, -X-, -С(=O)-,-(CH2CH2O)q-, -O(CH2CH2O)q-, -(OCH2CH2)q-, -(CH2CH2O)qCH2CH2-, -S(=O)k-, -P(=O)(OR3)-X-, -P(=O)(N(R3)(R4-X-,-P(=O)(N(R3)(R4-X-, -C(=O)-X-, - (CF2)q-, фенилен, замещенный независимо 0-3 R14, где k, q, X, R3 и R14 определены выше,где R2 такой же или иной и представляет водород, -А, -X-А, -O(R7), -S(R7), -N(R7), -C(=O)O(R7), кетогруппу, C1-C8 алкил, замещенный 0-3 R5, C2-C8 алкенил, замещенный 0-3 R5, фенил, бензил, фенил, замещенный независимо 0-5 R14, алкинил, замещенный 0-3 R5, C1-C8 перфторалкил, C3-C14 карбоцикл, замещенный 0-3 R5 или 0-3 R6, или 5-10-членный гетероцикл, содержащий от 1 до 4 гетероатомов, выбранных из группы, содержащей кислород, серу и азот, или тот же гетероцикл, замещенный 0-2 R11, олигоэтиленгликолем, R6, где А, X, R5, R6, R7, R11 и R14 определены выше,где R4 такой же или иной и представляет водород, C1-C8 алкил, замещенный 0-3 R10, C2-C8 алкенил, замещенный 0-3 R10, C2-C8 алкинил, замещенный 0-3 R10, C3-C14 карбоциклический остаток, замещенный 0-5 R10 или 0-5 R11, или 5-10-членный гетероцикл, содержащий от 1 до 4 гетероатомов, выбранных из группы, содержащей кислород, серу и азот, или тот же гетероцикл, замещенный 0-2 R11, где R10 и R11 определены выше,где Z такой же или иной и представляет водород, А, -X-А, (-X-А)2, -C(=O)-X-А, -CH(OH)-X-A,-CH(NH2)-X-А, -NH-A, -NH-CH(OH)CH-NH-A, - S(=O)k-X-А, -О-P(=O)(OR3)-X-А, -О-P(=O)(N(R3)(R4-X-A,R3, R7, R10, C1-C10 алкил, замещенный 0-4 R2, -ОН, -O(R3), каликс[4]арен, замещенный 0-4 R3, где k, А, X,R2, R3, R4, R7 и R10 определены выше,и их фармацевтически приемлемые соли. Другим аспектом данного изобретения являются ингибиторы протеазы HIV общей формулы (II) где А, X, Z, R1 и m, n определены выше,-5 011276 и их фармацевтически приемлемые соли. Еще одним аспектом данного изобретения являются соединения, также представляющие собой ингибиторы протеазы HIV. Сокращение и их фармацевтически приемлемые соли. Их структурные формулы изображены на фиг. 1. Способ получения новых соединений GB-21, GB-40, GB-41, GB-43, GB-44, GB-45, GB-49, GB-51,GB-52, GB-53, GB-54, GB-55, GB-58, GB-59, GB-60, GB-61, GB-63, GB-64, GB-65, GB-67, GB-70, GB-76,GB-82, GB-85, GB-87, GB-88, GB-89, GB-90, GB-91, GB-92, GB-94, GB-95 в соответствии с изобретением включает в себя стадию, на которой бис(дикарболид) 8-диоксанкобальта обрабатывают соединением LY-Z, или, необязательно, L-Z, где L выбран из группы, содержащей депротонированную гидроксигруппу и/или аминогруппу и/или замещенную аминогруппу, и/или амид, и/или сульфонамид, и/или тиоэфир, и где Y и Z определены выше. Этот способ был описан в литературе для других соединений (Pleek J.,Grner В., Hemnek S., Ba J., Mareek M., Jnchenov J., Lhotsk A., Holub K., Seluck P., Rais J.,Cisaov I., aslavsk J., Polyhedron 2002, 21, 975-86; Grner В., Pleek J., Ba J., Cisaova I., Dozol J.-F.,Rouquette H., Vias C., Seluck P., Rais J., New J. Chem. 2002, 26, 1519-1527; Sivaev I.B., Starikova Z.A.,Sjberg S., Bregadze V.I., J. Organomet. Chem. 2002, 649, 1-8), однако, здесь используется для усовершенствования способа получения новых соединений. Способ получения новых соединений GB-22, GB-25, GB-35, GB-46, GB-48, GB-50, GB-56, GB-57,GB-71, GB-77, GB-78, GB-79, GB-80, GB-104, GB-105 и GB-106 в соответствии с данным изобретением-9 011276 включает в себя аналогичную стадию. бис(Дикарболид) 8-диоксанкобальта повторно обрабатывают соединением L-Y-Z или L-Z. Однако данную реакцию проводят повторно, так, чтобы более реакционноспособные протоны были замещены последовательно в полиолах, аминах, амидах и сульфонамидах. Соединения, полученные таким способом, содержат более одного кластера кобальт бис(дикарболид). Это является преимуществом при очистке промежуточных соединений с использованием жидкостной хроматографии на силикагеле. Способ получения новых соединений GB-54 и GB-59 в соответствии с данным изобретением включает в себя стадию, на которой 8-бис(дикарболид) тетрагидрофуранкольбальта обрабатывают депротонированным пентафторфенолом или депротонированным дибензилметанолом. Способ получения нового соединения GB-19 в соответствии с данным изобретением включает в себя стадию, на которой соединение GB-31 (Canastide) обрабатывают раствором серной кислоты при повышенной температуре. Данный продукт очищают кристаллизацией и жидкостной хроматографией на силикагеле. Способ получения нового соединения GB-24 в соответствии с данным изобретением включает в себя стадию, на которой соединение [(1,2-C2B9H10)-3,3'-Co(1',2'-C2B9H10)-8,8'NH], депротонированное гидридом натрия и растворенное в диметиловом эфире диэтиленгликоля (DME), обрабатывают при температуре окружающей среды эпихлоргидрином и продукт получают очисткой реакционной смеси на колонке с силикагелем. Другим аспектом данного изобретения является фармацевтическая композиция, предназначенная для использования при лечении пациентов, инфицированных HIV, и для использования при лечении СПИД, содержащая по меньшей мере один ингибитор протеазы ВИЧ, выбранный из вышеуказанных соединенений общей формулы (I), (R1)nA(-X-Y-Z)m и/или общей формулы (II), (R1)nA(-X-Z)m, предпочтительно указанных выше новых соединений. Внедрение производных соединений бороновых кластеров как нового структурного элемента придает существенные ингибирующие свойства протеазе HIV и в отношении мутантов, резистентных к другим ингибиторам. Они эффективны как in vitro, так и in vivo. Они характеризуются высокой эффективностью и стабильностью. Фигуры Фиг. 1, которая изображена на стр. 1-16, представляет структуры соединений, описанных в примерах. Каждое соединение отмечено аббревиатурой. Фиг. 2 демонстрирует модель взаимодействия соединения GB-16 с протеазой HIV-1. Фиг. 3 демонстрирует модель соединения GB-24, вставленного в активный сайт протеазы HIV-1. Фиг. 4 графически представляет зависимость скорости ферментативной реакции от концентрации субстрата в присутствии ингибитора GB-16. На фиг. 5 представлен ингибирующий эффект ингибиторов GB-8, GB-12 и GB-16 в культурах тканей, трансфектированных провирусным клоном NL4-3. На фиг. 6 представлен ингибирующий эффект ингибитора GB-48 в культурах тканей, трансфектированных провирусным клоном NL4-3. Примеры Данное изобретение дополнительно иллюстрируется следующими примерами, которые не следует толковать как дополнительное ограничение. 1. Молекулярное моделирование. 2. Синтез новых соединений. 3. Синтез известных соединений. 4. Исследование активности известных и новых соединений in vitro. 5. Исследование ингибирующего действия на инфекционность HIV virus в культурах тканей. Структуры и аббревиатуры всех соединений, изучаемых в примерах, приведены на фиг. 1. Серые шарики представляют атомы бора, несущие водород или заместитель, черные шарики представляют атомы углерода, несущие водород или заместитель, кобальт и атомы железа помечены их символами. Химические сдвиги спектров ЯМР даны в частях на миллион (ppm). 1. Молекулярное моделирование. Основной философской концепцией данного изобретения являются ингибиторы протеазы HIV, содержащие кластеры борана, карборана или металкарборана. Эти кластеры, полученные в медицине к настоящему времени, использовали только для терапии с использованием метода захвата нейтронов боромChem. Rev. 232, 173-230; Sivaev, I.B. et al. (2002). Russ. Chem. Bull., Int. Ed., 51, 1362-1374; Hawthorne, M.F.,Lee, M.W. (2003). J. Neurooncol., 62, 33-45) представляют новую потенциально важную структурную единицу для селективных взаимодействий с белками и, тем самым, развивают высокоэффективные и стабильные нетоксичные ингибиторы с высокой терапевтической активностью. Для анализа предложенного типа связывания ингибиторов на основе карборановых клеток, с протеазой HIV, методом молекулярного моделирования, было выбрано два соединения: GB-16 и GB-24. Похожее соединение, [8,8'пропар- 10011276 гилтио(1,2-С 2 В 9 Н 10)2-3-Со]-, использовали в качестве исходной кристаллической структуры (Cambridgestructure database code: TENQAE) (Vohlidal, et al. (1996). Collect. Czech. Chem. Commun., 61, 877-887). Методом молекулярного моделирования добавляли атомы водорода и атом серы заменяли фосфатной группой, соответствующей соединяющей цепи. Добавляемые атомы или группы оптимизировали полуэмпирическим методом MNDO. Модели соединений вставляли в активный сайт протеазы HIV-1 дикого типа в соответствии с QF34 матрицей ингибитора (Protein Data Bank code 1IZI) (Weber J., Mesters J.R., Lepsik M., Prejdova J.,Svec M., Sponarova J., Mlcochova P., Skalicka K., Strisovsky K., Uhlikova Т., Soucek M., Machala L., Stankova M.,Vondrasek J., Klimkait Т., Kraeusslich H.G., Hilgenfeld R., Konvalinka J. (2002). J. Mol. Biol., 324 (4), 739-754). Результаты процесса молекулярного моделирования показывают, что соединения на основе металкарборанового кластера удовлетворяют требованиям к пространственной структуре и размеру для связывания ингибитора с активным сайтом протеазы HIV. Более того, структуры комлексов протеазы HIV и ингибиторов демонстрируют два заметных преимущества соединений по данному изобретению. Вопервых, исходя из расстояний, измеренных между атомами кислорода ингибитора и атомами кислорода протеазы, очевидно, что функциональные группы металкарборановых ингибиторов могут занимать такие положения, которые способны образовывать водородные мостиковые связи с каталитическими аспартатами (фиг. 2). Во-вторых, превосходная комплементарность поверхностей между активным сайтом протеазы HIV и металкарборанового ингибитора обусловливает сильные гидрофобные взаимодействия с полостью фермента (фиг. 3), которые обеспечивают образование прочных химических связей. Фиг. 2 демонстрирует модель взаимодействия GB-16, соединение (1) с каталитическими аспартатами Asp25 и Asp25' (2), которые являются частью активного сайта протеазы HIV-1. Атомы ингибитораGB-16 показаны в виде шаров, палочки представляют связи между атомами. Атомы ингибитора GB-16 помечены цветом следующим образом: черные шары представляют атомы углерода, серые шары представляют атомы бора, белые шары представляют атомы кислорода, а атомы фосфора (Р) и кобальта (Со) отмечены их символами. Менее крупные белые шары и белые линии между ними представляют атомы и связи, которые образуют каталитические аспартаты Asp25 и Asp25'. Линии с цифрами обозначают расстояния (в ангстремах, 1 =0,1 нм) между атомами кислорода каталитических аспартатов и ингибитораGB-16. Тот факт, что расстояния не превышают 2,5 , подтверждает, что положения функциональных групп ингибитора GB-16 и каталитических аспартатов являются оптимальными для образования водородных мостиковых связей. Активный сайт протеазы HIV (за исключением каталитических аспартатов) представлен с помощью реберной модели и показан серым цветом. Фиг. 3 демонстрирует модель соединения GB-24, вставленного в активный сайт протеазы HIV-1. Можно увидеть, что поверхность ингибитора высоко комплементарна полости протеазы. Такой близкий подход преимущественно гидрофобных поверхностей вызывает образование прочного связывания между ингибитором GB-24 и протеазой HIV-1. Ван-дер-Ваальсова поверхность ингибитора (1) представлена с помощью пространственной модели (черная), тогда как полость протеазы HIV представлена в виде поверхности Конноли (серые точки). Каталитические аспартаты протеазы HIV-1 Asp25 и Asp25' (2) показаны черным цветом, тогда как остальной активный сайт показан серым цветом. 2. Синтез новых соединений. Общий способ синтеза новых соединений GB-21, GB-22, GB-25, GB-35, GB-40, GB-41, GB-43, GB44, GB-45, GB-46, GB-48, GB-49, GB-50, GB-51, GB-52, GB-53, GB-54, GB-55, GB-56, GB-57, GB-58, GB59, GB-60, GB-61, GB-63, GB-64, GB-65, GB-67, GB-70, GB-71, GB-76, GB-77, GB-78, GB-79, GB-80, GB82, GB-85, GB-87, GB-88, GB-89, GB-90, GB-91, GB-92, GB-94, GB-95, GB-104, GB-105 и GB-106. Соединение L-Y-Z или, необязательно, L-Z (1,5 ммоль), где L, Y и Z определены выше, добавляют к суспензии гидрида натрия (80%, масляная защита) (0,1 г, 3,3 ммоль) в бензоле (1,5 мл) и 1,2-диметоксиэтане (3 мл). Затем добавляют бис(дикарболид) 8-диоксанкобальта (0,50 г, 1,22 ммоль) или бис(дикарболид) 8-тетрагидрофуранкобальта (0,48 г, 1,22 ммоль) и реакционную смесь нагревают до 70 С. За ходом реакции наблюдают с помощью тонкослойной хроматографии (TLC) до исчезновения пятна, соответствующего реакционноспособному бис(дикарболиду) кобальта (Rf=0,6 на Силуфоле, CHCl3 в качестве элюента). Реакция обычно завершается через 5-10 мин. После охлаждения до комнатной температуры добавляют 10 мл диэтилового эфира, а затем смесь фильтруют через бумажный фильтр, который в последствии промывают несколькими миллилитрами этанола (удаление оставшегося NaH). Фильтрат выпаривают под вакуумом, к остатку добавляют 20 мл воды и приблизительно 2 мл суспензии выпаривают для удаления оставшихся растворителей. Затем продукт дважды экстрагируют дихлорметаном (10 мл в сумме). Для ускорения разделения фаз следует добавить хлорид натрия (0,2 г). Объединенные органические фракции фильтруют через бумажный фильтр и проверяют с помощью тонкослойной хроматографии(Силуфол, ацетонитрил/хлороформ 1:2 об./об.). Если присутствует только одно пятно, двукратное количество гексана выливают на раствор дихлорметана и систему оставляют для кристаллизиции по меньшей мере на 2 дня. После этого продукт появляется в форме кристаллов или в виде твердого масла. В последнем случае супернатант декантируют из масляного слоя, который затем преобразуют в хрупкую пену под вакуумом при 50 С (приблизительно 15 мин). В случае, когда TLC исходного продукта показывает более одного пятна, продукт закрепляют на силикагеле и компоненты смеси разделяют градиентной элюцией смеси с использованием ацетонитрила/хло- 11011276 роформа (1:2 об./об.). После выпаривания подвижной фазы компоненты обрабатывают, как описано выше. Выходы препарата почти количественные в отношении исходного количества бис(дикарболид) кобальта. Соли натрия обычно кристаллизуются с 2 молекулами воды на 1 катион Na+. Для соединений GB35, GB-46, GB-48, GB-50, GB-56, GB-57, GB-71, GB-77, GB-78, GB-79, GB-80, GB-104, GB-105 и GB-106 данный процесс повторяют до требуемой степени замещения реакционноспособных протонов в полиолах, полифенолах, аминах, амидах и сульфонамидах. Соединения, полученные данным способом, содержат более одного кластера бис(дикарболид) кобальта. Характеристика соединений, полученных в соответствии с общим способом синтеза новых соединений. Соединения, полученные описанным выше способом, имеют почти идентичные 1 Н и 11 В ЯМР спектры молекулы, за исключением 1 Н ЯМР сигналов Y-Z групп или Z группы. Все новые соединения были охарактеризованы с помощью 1 Н и 11 В ЯМР спектроскопии, данные могут быть суммированы в общие характеристики, описанные далее. В 1 Н ЯМР спектрах две группы СНкарборан: 4,23 ppm (s, H) и 3,10 ppm (s, 2H) являются характеристическими, так же, как О-СН 2 СН 2 О-В группа: 4,11-3,60 ppm (t, 2H) и 3,81-3,20 ppm (t, 2H), O-CH2CH2Oгруппа: обе СН 2-группы резонируют в интервале 4,5-2,0 ppm (m, 4H). Гидратная вода: широкий характеристический сигнал приблизительно 4,3 ppm. 11 В ЯМР: перекрытие двух секстетов сигналов с отношениями интенсивностей 1:1:2:2:2:1, т.е. теоретически 12 сигналов. 11 сигналов могут быть различимыми, 2 сигнала обычно накладываются (например, при -22,1 ppm). Только сигнал приблизительно 23 ppm представляет собой синглет (соответствует В(8')-O-), другие являются дублетами. Исключительно широкий диапазон спектра (приблизительно 52 ppm от +22,93 до -28,42 ppm) определяли диапазоном спектра замещенного дикарболидного лиганда. Сигналы незамещенного дикарболидного лиганда находятся в пределах более узкого диапазона (приблизительно 22,5 ppm) и только слегка сдвинуты по сравнению с сигналами исходного бис(дикарболид) кобальта. Исходя из этого, их можно различить, но иногда они скрыты в спектре замещенного лиганда. В качестве примера приводятся следующие.[(1,2-C2B9H11)-3,3'-Co-(1,2-C2B8H10)-3Co-(1",2"-C2B9H11)]Cs2 (1 г, 13 ммоль), полученный, как описано в публикации Curchill, А.Н., Reis, J.N., Francis, J.N., Hawthorne, M.F. (1970). J. Am. Chem. Soc. 92,4993-4994; St.Clair, D., Zalkin, A., Templeton, D.H. (1969). Inorg. Chem. 8, 2080-2086, объединяли с 50 мл 60% (мас./мас.) H2SO4 и суспензию нагревали до 125 С (температура бани) в течение 35 ч приблизительно до исчезновения 90% пика моногидроксипроизводного (за ходом реакции наблюдали с помощьюHPLC, используя метод гидрофобного борат-анионного анализа, изложенного в публикации Grner, В.,Plzk, Z.: J. Chromatogr. А (1997) 789, 497). После охлаждения реакционной смеси добавляли 150 мл воды и продукты экстрагировали в диэтиловый эфир (320 мл). К объединенным эфирным слоям добавляли воду (20 мл) и эфир выпаривали под вакуумом. К водному раствору добавляли хлорид цезия (1,0 г) в 10 мл воды и полученную в результате суспензию отфильтровывали и сушили на воздухе. Твердое вещество объединяли с водой (15 мл) и суспензию нагревали на водяной бане при 85 С. Добавляли этанол до растворения твердого вещества. Выпавшие в осадок кристаллы отфильтровывали и сушили под вакуумом,повторно растворяли в смеси растворителей CH3CN-CH2Cl2 1:2 и хроматографировали с помощью хроматографии низкого давления на колонке Merck 60 m в подвижной фазе CH3CN-CH2Cl2 1:2 с градиен- 12011276 том до 1:1. После выпаривания растворителей твердую фазу растворяли в смеси этанол-вода (1:1), добавляли CsCl (500 мг) и раствор оставляли охлаждаться до комнатной температуры и для кристаллизации на 2 дня. Темно-красные кристаллы отфильтровывали и перекристаллизовывали из смеси этанол-вода. Выход: 390 мг (37%) несимметрично замещенного изомера, 105 мг (10,1%) изомера, симметрично замещенного в центральном кластере. Симметричный изомер: 1 Н 11BселективныйЯМР: 400 MHz, ацетон-d6, 3,564 (4 Н, СНкарборан), 3,336 (2 Н,СНкарборан), [3,288] (ВН), [2,775] (ВН), [2,593] (ВН), [2,406] (ВН), [1,737] (ВН), [1,740] (ВН), [1,631] (ВН),[1,550] (ВН), [1,424] (ВН). 11 В ЯМР: 128 MHz, ацетон-d6, 28,28 d (2 В), 4,59 d (2 В), -2,23 d (4B), -4,16 d (2 В), -7,85 d (8 В), -8,89 d(2 В), -18,98 d (4B), -22,92 d (2B). Соль дицезия преобразовывали в динатриевую соль (GB-19) следующим образом: 100 мг соли встряхивали между 3 М HCl (10 мл) и диэтиловым эфиром (10 мл), органический слой отделяли и дважды встряхивали с 3 М HCl (10 мл). Органическую фазу встряхивали три раза поэтапно с 20 мл 10% водного раствора Na2CO3, 20 мл воды, эфирную фазу отделяли и выпаривали и сушили при 80 С под вакуумом. Синтез GB-24. 2 раза по 150 мг (0,44 ммоль) аминопроизводного [(1,2-C2B9H10)-3,3'-Co(1',2'-C2B9H10)-8,8'NH],полученного, как указано в работе (Plesek J., Hemnek S., Base K., Todd L.J., F. WW. (1976). CollectionCzechoslovak. Chem. Commun. 59, 1326-1336), растворяли в диметиловом эфире диэтиленгликоля (DME)(15 мл) в двух колбах и к обоим растворам добавляли 12 мг гидрида натрия с большой удельной поверхностью (2 м 2 г-1) при перемешивании в атмосфере сухого азота. Реакционную смесь в колбе А перемешивали 1 ч при температуре окружающей среды, затем добавляли 35 мкл эпихлоргидрина через мембрану и реакционную смесь перемешивали 2 ч при температуре окружающей среды. Содержимое колбы В добавляли канюлей в колбу А. Реакционную смесь перемешивали 2 ч при температуре окружающей среды,а затем 26 ч с рефлюксом. После охлаждения реакционной смеси в колбу добавляли силикагель для хроматографии (Merck, 2 г) и выпаривали растворитель. Силикагель, покрытый продуктами реакции, переносили на колонку с силикагелем (225 см) и продукты элюировали смесью бензол-гексан 2:1 до вымывания непрореагировавшего реагента, а затем бензолом. Собирали раствор, содержащий соединение, соответствующее красному пятну в TLC (Силуфол, бензол) с RF=0,37. Раствор выпаривали и продукт очищали хроматографией на силикагеле. Выход: 105 мг (32%). 1 Н ЯМР: 400 MHz, ацетон-d6, 7,41 (2 Н, NH), 4,791 (2 Н, СН 2), 4,241 (2 Н, СН), 3,296 (8 Н, СНкарборан). 11 В ЯМР: 128 MHz, ацетон-d6, 5,044 s (4 В), -1,021 d (4B), -8,66 d, -9,891 d, -11,15 d (16 В), -15,77 dGB-1. Данное соединение получали путем реакции стабилизированного нейтрального соединения, производного бис(дикарболид) 8-диоксанкобальта (Pleek J., Hemnek S., Franken A, Csaov I., Nachtigal C.(1997). Collection Czechoslovak. Chem. Commun. 62, 47-56), с гидроксидом натрия в водном диоксане по следующей методике: 1,0 г бис(дикарболида) 8-диоксанкобальта растворяли в 50 мл смеси диоксан-вода 4:6 и добавляли 10 мл 10% раствора гидроксида натрия. Реакционную смесь нагревали до 80 С в течение 2 ч. После охлаждения смеси добавляли 100 мл воды, диоксан выпаривали при низкой температуре, а затем добавляли 50 мл 3 М HCl. Водную фазу экстрагировали диэтиловым эфиром (330 мл). Объединенные органические слои промывали водой (220 мл) и отделяли. После добавления 50 мл воды эфир выпаривали. Добавляли этанол до растворения продукта и затем продукт осаждали избытком водногоM.S. m/z=415,3. Анализ:% В рассчитанный: 41,22, найдено: 40,84,% Со рассчитанный: 12,49, найдено: 12,33. Соль триэтиламмония превращали в соль натрия следующим способом: 1 г соли встряхивали между 3 М HCl (50 мл) и диэтиловым эфиром (30 мл), органическую фазу отделяли и дважды промывали с использованием 3 М HCl (50 мл). Затем органический слой промывали 3 раза с использованием 50 мл 10% водного Na2CO3, 50 мл воды, эфирную фазу отделяли и выпаривали до сухости. Продукт сушили в вакууме. В литературе можно найти получение данного соединения другим, более сложным способомGB-8. Данное соединение было получено прямым гидроксилированием аниона бис(карболид) кобальта разбавленной H2SO4 при повышенных температурах способом, описанным в литературе (Pleek J., Grner В., Ba J., Fusek J., Csaov I. (2002). J. Organometal. Chem. 649, 181-190).GB-12. Мостиковое производное бис(дикарболида) кобальта получали на основе известных способов реакцией незамещенного иона с параформальдегидом (Pleek J., Hemnek S., Bae K., Todd L.J., F. W.W.GB-16. Данное соединение получали реакцией вышеуказанного соединения GB-8 с фосфорилхлоридом и последующим гидролизом промежуточного соединения, как ранее описывалось в литературе (Pleek J.,Grner В., Csaov I, Ba J., Seluck P., Rais J. (2002). J. Organometal. Chem. 657, 59-70).GB-23. Данное соединение получали способом, изложенным в литературе (Hawthorne, M.F., Young, D.C.,Wegner, P.A. (1965). J. Am. Chem. Soc. 87, 1818).GB-26 и GB-27. Данные соединения получали реакцией бензола с бис(дикарболид)кобальтом при повышенной температуре, катализируемой AlCl3, способом, описанным в литературе (Pleek J., Hemnek S. (1995). Coll.GB-28, GB-29 и GB-30. Данные соединения получали реакцией бифенила (в случае GB-28), толуола (в случае GB-29) и 1,2 диметилбензола (в случае GB-30) с бис(дикарболидом) кобальта при повышенной температуре, катализируемой AlCl3, способом, описанным в литературе (Teixidor F., Casensky В., Dozol J.F., Hemnek S.,Mongeot H., Rais J. (1998). Report EC, EUR 18217 EN, Louxemburg).GB-69. Данное соединение получали из бис(дикарбонат) 8-диоксанкобальта, как ранее описывалось в литературе (Sivaev I.B., Starikova Z.A., Sjberg S., Bregadze V.I. (2002). J. Organomet. Chem. 649, 1-8).GB-72, GB-73, GB-74 и GB-75. Данные соединения получали реакцией каликс[4]арена с бис(дикарболидом) 8-диоксанкобальта способом, описанным в литературе (Grner В., Mikulasek L., Baca J., Cisarova I., Bohmer V., Danila C.,Reinoso-Garcia M., Verboom W., Reinhoudt D.N., Casnati A., Ungaro R. (2005). Eur. J. Org. Chem., 10, 2022-2039).GB-96, GB-97, GB-98 и 99. Данные соединения получали прямым галогенированием бис(дикарболида) кобальта способом,описанным в литературе (Matel J., Macasek F., Rajec P., Hermanek S., Plesek J. (1982). Polyhedron 1, 511-519).GB-102, GB-103. Данные соединения получали реакцией бутиламина или бензиламина, соответственно, с бис(дикарболид) 8-диоксанкобальтом способом, описанным в литературе (Grner В. et al. (2002). New J.Chem. 26, 1519-1527). 4. Испытание активности известных и новых соединений in vitro. Сначала известные и новые соединения испытывали на их способность ингибировать специфическую активность протеазы HIV и хромогенного субстрата, полученного из аминокислотной последовательности одного из сайтов расщепления вирусного полибелка. Тестирование проводили с использованием способа, опубликованного одним из соавторов данного изобретения (Konvalinka, J., Litera, J., Weber, J.,Vondrsek, J., Hradilek, M., Souek, M., Pichov, I., Majer, P., Strop, P., Sedlek, J., Heuser, A.-M., Kottler, H. и Kraeusslich, H.-G. (1997). Eur. J. Biochem. 250, 559-566). В стандартном эксперименте различные количества тестируемого ингибитора, растворенного в DMSO (так, чтобы конечная концентрация DMSO не превышала 2,5%), добавляли к 8 нМ чистой рекомбинантной протеазы HIV в 1 мл ацетатного буфера (рН 4,7), содержащего 0,3 М хлорида натрия, и реакцию инициировали добавлением хромогенного субстрата последовательности KARVNIeF(NO2)EANIe-NH2 (где NIe представляет норлейцин, a F(NO2) представляет собой паранитрофенилаланин) до конечной концентрации 15 мкМ. Ход реакции наблюдали спектрофотометрически как снижение поглощения при 305 нм. Значения IC50 тестируемых соединений рассчитывали,исходя из экспериментальных данных, как описано в (Majer, P., Urban, J., Gregorov, Е., Konvalinka, J.,Novek, P., Stehlikov, J., Andrensky, M., Sedlek, J. и Strop, P. (1993). Arch. Biochem. Biophys. 304, 1-8) и показано в табл. 1. Тестирование ингибирующего действия GB-16 также проводили для протеазы HIV-2 дикого типа, мутантного HIV-1 PR 3/1 и катепсина D. Результаты показаны в табл. 2. Кроме того, выбранные новые соединения GB-48 и GB-80 тестировали на их способность ингиби- 14011276 ровать резистентные типы протеаз HIV-1. В табл. 3 показаны константы ингибирования (значения Ki) для используемых в клинике сакинавира, индинавира и для соединений GB-48 и GB-80. Все три протеазы связываются с сакинавиром и индинавиром гораздо хуже, чем протеаза HIV-1 дикого типа. Очевидно,что аффинность связывания GB-48 и GB-80 с резистентными протеазами HIV сравнима с их аффинностью в отношении дикого типа, однако, GB-48 и GB-80 сохраняют свою активность в отношении нескольких резистентных протеаз HIV-1 по сравнению с ингибиторами, используемыми в клинике. Механизм действия тестируемых соединений (тип ингибирования) определяли, исходя из зависимости исходной скорости реакции от концентрации субстрата при различных концентрациях ингибитора(координаты Лайнуивера-Берка). Примеры определения механизма действия ингибитора GB-16 в координатах Лайнуивера-Берка показаны на фиг. 4. Зависимость исходной скорости от концентрации субстрата определяют при различных концентрациях ингибитора (здесь 0 и 15 мкМ). Определения проводили при рН 4,7, 37 С в 0,1 М ацетатном буфере, содержащем 0,3M NaCl. Ось у: обратная величина исходной скорости реакции фермента, ось х: обратная величина концентрации субстрата (моль/дм 3). Ингибитор GB-16 является конкурентным ингибитором. Таблица 1 Значения IC50 для конкретных ингибиторов, определенные для протеазы HIV-1 дикого типа Таблица 3 Константы ингибирования Ki [нМ] протеаз HIV резистентного и дикого типа и применяемых в клинике ингибиторов сакинавира, индинавира и двух выбранных соединений GB-48 и GB-80 5. Испытание ингибирующего действия на инфицирующую активность HIV в культурах тканей. Противовирусную активность соединений GB-8, GB-12 и GB-16 в культурах тканей анализировали с использованием двух вариантов опубликованной методики (Benyoucef, S., Hober, D., Shen, L., Ajana, F.,Gerard, Y., Bocket-Mouton, L., Mouton, Y., Wattre, P. (1996). Microbiol. Immunol. 40 (5), 381-8). Получение инфекционных частиц HIV и влияния ингибиторов протеазы HIV на инфицирующую активность определяли непосредственно этими способами. Для тестирования соединений GB-8, GB-12 и GB-16 клетки HeLa трансфектировали ДНК, кодирующей pNL-43 штамм ВИЧ, содержащий бета-галактозидазный ген в сайте вирусного гена nef. Все трансфекции проводили в двух параллельных экспериментах. Среду заменяли на следующий день после трансфекции и в свежую среду добавляли ингибиторы протеазы, растворенные в DMSO. Контроль инкубировали в той же концентрации DMSO, что и тестируемые клетки. Супернатант трансфектированных клеток использовали в следующем цикле для инфицирования репортерных клеток. Инфицирующую способность определяли количественно по активности фермента бета-галактозидазы в инфицированных клетках и инфицированные клетки визуализировали с использованием хромогенного бета-галактозидазного субстрата (X-gal). Вирусные белки вновь образованных вирионов разделяли, используя SDS PAGE,и визуализировали иммунохимически, используя антитела к капсидному белку HIV (Вестерн блот). В параллельных экспериментах HIV воспроизводили в 293 Т клетках провирусным клоном NL 4-3. Все трансфекции проводили в двух параллельных экспериментах. Среду заменяли на следующий день после трансфекции и в свежую среду добавляли ингибиторы протеазы, растворенные в DMSO. Контроль инкубировали в той же концентрации DMSO, что и тестируемые клетки. Инфицирующую активность вируса определяли количественно титрованием клеточного супернатанта с использованием TZM клеток(репортерные клетки, несущие в своем геноме LTR промотор HIV, связанный с бета-галактозидазным геном, активированный Tat-белком, продуцируемым вирусом). Через 2 дня после инфицирования репортерные клетки лизировали и фиксировали смесью метанол/ацетон. Бета-галактозидазную активность инфицированных клеток визуализировали голубым цветом после добавления хромогенного субстрата Xgal. Результат стандартного эксперимента показан на фиг. 5. Данный эксперимент доказывает, что ингибиторы GB-8, GB-12 и GB-16 блокируют инфицирующую активность вируса. 10 мкМ раствор ингибитора GB-16 снижает инфицирующую активность HIV примерно до 27% от исходного значения; 100 мкМ раствора ингибитора GB-8 было необходимо для достижения сходного действия. Для тестирования соединения GB-48 клеточные культуры РМ 1, инфицированные вирусным штаммом NL4-3, расщепляли 2 дня после инфицирования 1-10 свежими неинфицированными клетками. Для удаления несвязавшегося вируса клетки промывали предварительно нагретой средой 4 ч после инфекции. После этого клетки инкубировали в течение 40 ч с GB-48, растворенным в DMSO, с конечной концентрацией от 0,74 до 60 мкМ. Контрольные клетки инкубировали с тем же количеством DMSO, что и- 16011276 клетки, обработанные GB-48. Для сбора свободного вируса клетки центрифугировали при 1500 об./мин в течение 5 мин и 10 мкл супернатантов использовали для титрования. Изменения инфицирующей активности вируса анализировали титрованием супернатантов на TZM-клетках, описанных выше. Через 2 дня после инфицирования TZM-клетки лизировали и фиксировали метанолом/ацетоном. Бета-галактозидазную активность инфицированных клеток визуализировали голубым окрашиванием при добавлении XGal. Все титрования проводили в двух параллельных анализах. Титр вируса и стандартное отклонение рассчитывали, исходя их трех независимых титрований. Пример тестирования активности приведен на фиг. 6. GB-48 существенно ингибировал инфицирующую активность вируса в концентрациях от 6,6 до 60 мкМ. При этих концентрациях наблюдали падения титра вируса по меньшей мере на 3 порядка величины инфицирующей активности вируса. Промышленная применимость Данное изобретение применимо в фармацевтической промышленности и в медицине для лечения пациентов, инфицированных HIV, и для лечения СПИД. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение соединений, содержащих кластеры, выбранные из группы, включающей бораны,и/или карбораны, и/или металкарбораны, имеющие от 6 до 12 атомов бора в каждом кластере, где заряд каждого индивидуального кластера борана, карборана или металкарборана равен 0, -1 или -2; число кластеров борана, карборана или металкарборана в молекуле составляет от 1 до 9 и данные карборановые кластеры в металкарборановых фрагментах координированы с атомом переходного металла, выбранного из группы, содержащей кобальт, железо, никель и рутений, в качестве ингибитора протеазы ВИЧ. 2. Применение по п.1, отличающееся тем, что в кластерах присутствуют гетероатомы, выбранные из группы, содержащей азот, фосфор, кремний, германий, олово и серу. 3. Применение по п.1 или 2, отличающееся тем, что соединения характеризуются общей формулой (I) где А представляет собой анионный кластер где заместители общей формулы -X-Y-Z и R1 связаны с атомами углерода, атомами бора или гетероатомами кластера А,где j составляет от 1 до 3,М представляет Fe, Co, Ni, Ru и где R1 тот же или иной и выбран из группы, содержащей водород, галоген, метил, гидрокси, фенил, фенилен, тиол, метокси и трифторметоксигруппу,m равно 0, 1 или 2,n составляет от 0 до 12,X такой же или иной и представляет -О-, -С(=O)-, -СН 2-, -N(R3)-, -P(R3)-, -S-, C1-C10 алкандиил, -(CH2CH2O)q-,-O(CH2CH2O)q-, -(OCH2CH2)q-, -(CH2CH2O)qCH2CH2-, -(OCH2CH2)qN(R3)-, -(OCH2CH2)qN+(R3)(R7)-,-(OCH2CH2)qN(R3)(CH2CH2O)q-, -(OCH2CH2)qN+(R3)(R7)(CH2CH2O)q-, фенилен, замещенный независимо 0-3 R14, в случае металкарборанов типа [(1,2-С 2 В 9 Н 11)2-3-M(III)](-) X представляет одну из мостиковых групп S, N, N(R3)+, P, O2P, O2P(=O), фенилен, независимо замещенный 0-3 R14, этандиил, независимо замещенный 0-3 R14, заместитель Y соединен с мостиковой группой, где М определено выше в данном пункте, где q составляет от 0 до 12,- 17011276 где R3 такой же или иной и представляет водород, А, -(CH2CH2O)q-А, -S(=O)k(R7), -C(=O)(R5),-S(=O)2N(R7)(R8), С 1-C8 алкил, замещенный 0-3 R10, C2-C8 алкенил, замещенный 0-3 R10, C2-C8 алкинил,замещенный 0-3 R10, фенил, замещенный 0-5 R10, нафтил, замещенный 0-5 R10, адамантил, замещенный 0-5 R10, и C3-C14 карбоциклический остаток, замещенный 0-5 R10 или 0-5 R11, или 5-10-членный гетероцикл, содержащий от 1 до 4 гетероатомов, выбранных из группы, содержащей кислород, серу и азот, или тот же гетероцикл, замещенный 0-4 R11, где q определено выше в этом пункте, где k равно 0, 1 или 2,где R10 такой же или иной и представляет водород, кетогруппу, галоген, цианогруппу, -CH2N(R7)(R8),7-N(R )(R8), -C(=O)O(R7), -C(=O)(R5), -OC(=O)(R7), -O(R7), C2-C6 алкоксиалкил, -S(=O)k(R7), -NHC(=NH)NH(R7),-C(=NH)NH(R7), -C(=O)N(R7)(R8), -N(R8)C(=O)(R7), =N-O(R8), -N(R8)C(=O)O(R8), -OC(=O)N(R7)(R8),-N(R7)C(=O)N(R7)(R8), -N(R8)S(=O)2N(R7)(R8), -N(R8)S(=O)2(R7), -S(=O)2N(R7)(R8), С 1-C4 алкил, C2-C4 алкенил,C3-C10 циклоалкил, C3-C6 циклоалкилметил, фенил, пентафторфенил, фенилметил, фенетил, фенокси, фенилметокси, нитро, С 7-C10 арилалкил, -С(=O)-NH(OH), -С(=O)-NH(NH2), -В(ОН)2, сульфонамид, формил,C3-C6 циклоалкокси, С 1-C4 алкил, замещенный -N(R7)(R8), С 1-C4 гидроксиалкил, метилендиокси, этилендиокси, С 1-C4 галоалкил, C1-C4 галоалкокси, C1-C4 алкоксикарбонил, C1-C4 алкилкарбонилокси, C1-C4 алкилкарбонил, C1-C4 алкилкарбониламино, -OCH2C(=O)O(R7), 2-(1-морфолино)этокси, азидо, -C(R8)=N-O(R8),C5-C14 карбоциклический остаток, замещенный 0-5 R11, или 5-10-членный гетероцикл, содержащий от 1 до 4 гетероатомов, выбранных независимо из группы, содержащей кислород, серу и азот, или тот же гетероцикл, замещенный 0-2 R11, где k определено выше в этом пункте,где R7 такой же или иной и представляет водород, фенил, замещенный 0-3 R14, фенилметил, замещенный 0-3 R14, С 1-C6 алкил, замещенный 0-3 R14, C2-C4 алкенил, замещенный 0-3 R14, C1-C6 алкилкарбонил, замещенный 0-3 R14, C1-C6 алкоксикарбонил, замещенный 0-3 R14, C1-C6 алкиламинокарбонил, замещенный 0-3 R14, C3-C6 алкоксиалкил, замещенный 0-3 R14, любую группу, обычно используемую для защиты аминогруппы, если R7 связан с атомом азота, или любую группу, обычно используемую для защиты гидроксигруппы, если R7 связан с атомом кислорода,где R14 такой же или иной и представляет водород, кето, галоген, цианогруппу, -CH2NH2, -NH2,-С(=O)ОН, -OC(=O)(C1-C3 алкил), -ОН, C2-C6 алкоксиалкил, -C(=O)NH2, -OC(=O)NH2, -NHC(=O)NH2,-S(=O)2NH2, C1-C4 алкил, C2-C4 алкенил, C3-C10 циклоалкил, C3-C6 циклоалкилметил, фенил, бензил, фенетил, фенокси, бензилокси, нитро, C1-C10 арилалкил, -С(=O)-NH(OH), -С(=O)-NH(NH2), -В(ОН)2, C3-C6 циклоалкокси, С 1-C4 алкил, замещенный -NH2, С 1-C4 гидроксиалкил, метилендиокси, этилендиокси, С 1-C4 галоалкил, С 1-C4 галоалкокси, С 1-C4 алкоксикарбонил, С 1-C4 алкилкарбонилокси, C1-C4 алкилкарбонил, C1-C4 алкилкарбониламино, -ОСН 2 С(=O)ОН, 2-(1-морфолино)этокси, азидо, арил(С 1-C3 алкил), С 5-C14 карбоциклический остаток, 5-10-членный гетероцикл, содержащий от 1 до 4 гетероатомов, выбранных независимо из группы, содержащей кислород, серу и азот, или тот же гетероцикл, замещенный 0-3 R6,где R6, в том случае, если связан с атомом углерода, такой же или иной и представляет фенил, фенилметил, фенетил, фенокси, фенилметокси, галоген, гидрокси, нитро, цианогруппу, С 1-C4 алкил, C3-C6 циклоалкил, C3-C6 циклоалкилметил, С 7-C10 арилалкил, C1-C4 алкокси, -С(=O)ОН, -C(=O)-NH(OH), -C(=O)-NH(NH2),-В(ОН)2, сульфонамид, формил, C3-C6 циклоалкокси, -O(R7), С 1-C4 алкил, замещенный -N(R7)(R8), -N(R7)(R8),C2-C6 алкоксиалкил, C1-C4 гидроксиалкил, метилендиокси, этилендиокси, C1-C4 галоалкил, C1-C4 галоалкокси,C1-C4 алкоксикарбонил, C1-C4 алкилкарбонилокси, C1-C4 алкилкарбонил, С 1-C4 алкилкарбониламино, -S(=O)k(R7),-S(=O)2N(R7)(R8), -NHS(=O)2(R8), -ОСН 2 С(=O)ОН, 2-(1-морфолино)этокси, -C(R8)=N-O(R8), 5-10-членный гетероцикл, содержащий от 1 до 4 гетероатомов, выбранных независимо из группы, содержащей кислород,серу и азот, или тот же гетероцикл, замещенный 0-3 R9, C3-C4 углеродную цепь, которая связывается другим своим концом с соседним атомом углерода кольца и, таким образом, образует 5- или 6-членное кольцо,это 5- или 6-членное кольцо может быть замещено при любом алифатическом атоме углерода галогеновой группой, С 1-C4 алкилом, С 1-C4 алкокси, гидрокси, -N(R7)(R8), или, в том случае, если R6 связан с насыщенным атомом углерода, R6 может быть =O или =S, где k и R7 определены выше в этом пункте,где R8 такой же или иной и представляет водород, гидрокси, трифторметил, С 1-C6 алкокси, C2-C6 алкенил, фенилметил, амино, C1-C6 алкил, C1-C6 алкил, замещенный 0-3 группами, независимо выбранными из группы, содержащей гидрокси, С 1-C4 алкокси, галоген, амино, любую группу, обычно используемую для защиты аминогруппы, если R8 связан с атомом азота, или любую группу, обычно используемую для защиты гидроксигруппы, если R8 связан атомом кислорода,где R9 такой же или иной и представляет водород или метил,где R6, в том случае, если связан с атомом азота, такой же или иной и представляет фенил, фенилметил, фенетил, гидрокси, C1-C4 гидроксиалкил, C1-C4 алкокси, С 1-C4 алкил, C3-C6 циклоалкил, C3-C6 циклоалкилметил, -CH2N(R7)(R8), -N(R7)(R8), C2-C6 алкоксиалкил, C1-C4 галоалкил, C1-C4 алкоксикарбонил, -С(=O)ОН,C1-C4 алкилкарбонилокси, С 1-C4 алкилкарбонил C(R8)=N-O(R8), где R7 и R8 определены выше в этом пункте,R7 и R8 альтернативно могут быть связаны таким образом, что образуют группы -(СН 2)4-, -(СН 2)5-, CH2CH2N(R9)CH2CH2- или-СН 2 СН 2 ОСН 2 СН 2-,где R5 такой же или иной и представляет водород, галоген, фенилметил, фенетил, -C(=O)-NH(OH),-С(=O)-NH(NH2), -В(ОН)2, сульфонамид, азидо, формил, фенокси, фенилметокси, нитро, цианогруппу,-CH2N(R7)(R8), -N(R7)(R8), -OCH2C(=O)OH, -C(=O)O(R7), -OC(=O)(R7), -O(R7), C2-C6 алкоксиалкил, -S(=O)k(R7),-NHC(=NH)NH(R7), -C(=NH)NH(R7), -C(=O)N(R7)(R8), -N(R8)C(=O)(R7), =N-O(R8), -N(R8)C(=O)O(R8),- 18011276OC(=O)N(R7)(R8), -N(R7)C(-O)N(R7)(R8), -C(R8)=N-O(R8), -N(R8)S(=O)2N(R7)(R8), -N(R8)S(=O)2(R7),-S(=O)2N(R7)(R8), C1-C4 алкил, C2-C4 алкенил, C3-C10 циклоалкил, C3-C6 циклоалкилметил, C7-C10 арилалкил,C3-C6 циклоалкокси, C1-C4 алкил, замещенный -N(R7)(R8), С 1-C4 гидроксиалкил, С 1-C4 галоалкил, C1-C4 галоалкокси, C1-C4 алкоксикарбонил, C1-C4 алкилкарбонилокси, С 1-C4 алкилкарбонил, C1-C4 алкилкарбониламино, 2-(1-морфолино)этокси, -(C1-C3 алкил)арил, замещенный 0-2 R6, С 5-C14 карбоциклический остаток,замещенный 0-3 R6, 5-10-членный гетероцикл, содержащий от 1 до 4 гетероатомов, выбранных независимо из группы, содержащей кислород, серу и азот, или тот же гетероцикл, замещенный 0-3 R6, где k, R6,R7 и R8 определены выше в этом пункте,где R11, в том случае, если связан с атомом углерода, такой же или иной и представляет фенетил,фенокси, C3-C10 циклоалкил, C3-C6 циклоалкилметил, С 7-C10 арилалкил, -С(=O)-NH(NH2), C2-C6 алкоксиалкил, метилендиокси, этилендиокси, С 1-C4 алкилкарбонилокси, -NHS(=O)-(R8), фенилметокси, галоген, 2(1-морфолино)этокси, -C(=O)O(R7), -C(=O)-NH(OH), -C(=O)N(R7)N(R7)(R8), цианогруппу, -B(OH)2, сульфонамид, формил, C3-C6 циклоалкокси, C1-C4 галоалкил, C1-C4 галоалкокси, C2-С 4 галоалкенил, C2-C4 галоалкинил, -N(R7)(R8), -C(R8)=N-O(R8), -NO2, -O(R7), -N(R12)(R13), -S(=O)k(R7), -S(=O)kN(R7)(R8), -C(=O)N(R7)(R8),-OC(=O)N(R7)(R8), -C(=O)(R5), -OC(=O)(R5), -OC(=O)O(R7), фенил, -C(=O)N(R7)-(С 1-C4 алкил), N(R7)(R8),-C(=O)N(R12)(R13), -C(=O)-(C1-C4 алкил)-N(R7)C(=O)O(R7), С 1-C4 алкокси, замещенный 0-4 группами, выбранными независимо из группы, содержащей R5, C3-C6 циклоалкил, -C(=O)O(R7), -C(=O)N(R7)(R8),-N(R7)(R8) или гидроксил, С 1-C4 алкил, замещенный 0-4 группами, выбранными независимо из группы,содержащей R5, =N(R8), =NN(R7)C(=O)N(R7)(R8) или -N(R7)(R8), C2-C4 алкенил, замещенный 0-4 R5, C2C4 алкинил, замещенный 0-4 R5, 5-6-членный гетероцикл, содержащий от 1 до 4 гетероатомов, выбранных независимо из группы, содержащей кислород, серу и азот, C3-C4 углеродную цепь, другой конец которой связан со следующим атомом углерода кольца, тем самым, образуя 5- или 6-членное кольцо, это 5- или 6 членное кольцо может быть на любом алифатическом атоме углерода замещено галогеном, С 1-C4 алкилом, С 1-C4 алкокси, гидрокси, -N(R7)(R8), или, в случае, если R11 связан насыщенным атомом углерода,R11 может быть =O или =S, где k, R5, R7 и R8 определены выше в этом пункте,где R12 такой же или иной и представляет водород или С 1-C3 алкил,где R13 такой же или иной и представляет -C(=O)N(R7)(R8), -C(=O)N(R7)NH(R8), -C(=O)C(R5)2N(R7)(R8),-C(=O)C(R5)2N(R7)NH(R8), -C(=O)C(R5)2N(R7)C(=O)O(R7), -C(=O)H, -C(=O)(R5), -C(=O)-(C1-C4 алкил)-N(R7)(R8),-C(=O)-(С 1-C4 алкил)-, N(R7)C(=O)O(R7) или от 1 до 3 аминокислот, связанных амидными связями с атомом азота через карбоксильные группы, где R5, R7 и R8 определены выше в этом пункте,где R11, в том случае, если связан с атомом азота, такой же или иной и представляет фенил, фенилметил, фенетил, гидроксил, С 1-C4 гидроксиалкил, С 1-C4 алкокси, С 1-C4 алкил, С 3-С 6 циклоалкил, C3-C6 циклоалкилметил, -CH2N(R7)(R8), -N(R7)(R8), C2-C6 алкоксиалкил, С 1-C4 галоалкил, C1-C4 алкоксикарбонил,-С(=O)ОН, C1-C4 алкилкарбонилокси, C1-C4 алкилкарбонил или -C(R8)=N-O(R8), где R7 и R8 определены выше в этом пункте,где R11, если связан с атомом серы, представляет =O,где Y такой же или иной и представляет С 1-C10 алкандиил, замещенный 0-4 заместителями, выбранными независимо из группы, содержащей R2 и R3, С 1-C10 циклоалкандиил, замещенный 0-4 R2, -X-,-С(=O)-, -(CH2CH2O)q-, -O(CH2CH2O)q-, -(OCH2CH2)q-, -(CH2CH2O)qCH2CH2-, -S(=O)k-, -P(=O)(OR3)-X-,-P(=O)(N(R3)(R4-X-, -P(=O)(N(R3)(R4-X-, -C(=O)-X-, -(CF2)q-, фенилен, независимо замещенный 0-3R14, где k, q, X, R3 и R14 определены выше в этом пункте,где R2 такой же или иной и представляет водород, -А, -X-А, -O(R7), -S(R7), -N(R7), -C(=O)O(R7), кетогруппу, C1-C8 алкил, замещенный 0-3 R5, C2-C8 алкенил, замещенный 0-3 R5, фенил, бензил, фенил, независимо замещенный 0-5 R14, алкинил, замещенный 0-3 R5, С 1-C8 перфторалкил, C3-C14 карбоцикл, замещенный 0-3 R5 или 0-3 R6, или 5-10-членный гетероцикл, содержащий от 1 до 4 гетероатомов, выбранных из группы, содержащей кислород, серу и азот, или тот же гетероцикл, замещенный 0-2 R11, олигоэтиленгликолем, R6, где А, X, R5, R6, R7, R11 и R14 определены выше в этом пункте,где R4 такой же или иной и представляет водород, C1-C8 алкил, замещенный 0-3 R10, C2-C8 алкенил,замещенный 0-3 R10, C2-C8 алкинил, замещенный 0-3 R10, C3-C14 карбоциклический остаток, замещенный 0-5 R10 или 0-5 R11, или 5-10-членный гетероцикл, содержащий от 1 до 4 гетероатомов, выбранных из группы, содержащей кислород, серу и азот, или тот же гетероцикл, замещенный 0-2 R11, где R10 и R11 определены выше в этом пункте,где Z такой же или иной и представляет водород, А, -X-А, (-X-А)2, -С(=O)-X-А, -СН(ОН)-X-А,-CH(NH2)-X-А, -NH-A, -NH-CH(OH)CH-NH-A, -S(=O)k-X-А, -О-P(=O)(OR3)-X-А, -О-P(=O)(N(R3)(R4-X-A,R3, R7, R10, C1-C10 алкил, замещенный 0-4 R2, -ОН, -O(R3), каликс[4]арен, замещенный 0-4 R3, где k, А, X,R2, R3, R4, R7 и R10 определены выше в этом пункте,и их фармацевтически приемлемые соли. 4. Применение по п.1 или 2, отличающееся тем, что соединения характеризуются общей формулой (II) где А, X, Z, R1 и m, n определены в п.3,и их фармацевтически приемлемые соли.- 19011276 5. Применение по п.1, отличающееся тем, что соединения выбраны из группы, содержащей и их фармацевтически приемлемые соли. и их фармацевтически приемлемые соли, которые могут быть использованы в качестве ингибитора протеазы ВИЧ. 7. Способ получения соединений GB-21, GB-40, GB-41, GB-43, GB-44, GB-45, GB-49, GB-51, GB52, GB-53, GB-54, GB-55, GB-58, GB-59, GB-60, GB-61, GB-63, GB-64, GB-65, GB-67, GB-70, GB-76, GB82, GB-85, GB-87, GB-88, GB-89, GB-90, GB-91, GB-92, GB-94, GB-95, GB-102, GB-103 по п.5 или 6,включающий в себя стадию, на которой бис-(дикарболид) 8-диоксанкобальта обрабатывают соединением L-Y-Z или, необязательно, L-Z, где L выбран из группы, содержащей депротонированную гидроксигруппу, и/или аминогруппу, и/или замещенную аминогруппу, и/или амид, и/или сульфонамид, или тиоэфир, и где Y и Z определены в п.3. 8. Способ получения соединений GB-22, GB-25, GB-35, GB-46, GB-48, GB-50, GB-56, GB-57, GB71, GB-77, GB-78, GB-79, GB-80, GB-104, GB-105, GB-106 по п.5 или 6, включающий в себя стадию, на которой бис-(дикарболид) 8-диоксанкобальта повторно обрабатывают соединением L-Y-Z или, необязательно, L-Z, где L, Y и Z определены в п.7 и полученный в результате продукт дополнительно, после его очистки, обрабатывают бис-(дикарболидом) 8-диоксанкобальта, данный процесс повторяют до достижения желаемой степени замещения реакционноспособных протонов в полиолах, полифенолах, аминах,амидах и сульфонамидах. 9. Способ получения новых соединений GB-54 и GB-59 по п.6, включающий в себя стадию, на которой бис-(дикарболид) 8-тетрагидрофуранкобальта обрабатывают соединением депротонированного пентафторфенола или депротонированного дибензилметанола. 10. Способ получения нового соединения GB-19 по п.6, включающий в себя стадию, на которой соединение [(1,2-C2B9H11)-3,3'-Co-8',10'-(OH)2-(1,2-C2B8H10)-3-Co-(1,2-C2B9H11)]Cs2 (Канастид) обрабатывают раствором серной кислоты при повышенной температуре. 11. Способ получения нового соединения GB-24 по п.6, включающий в себя стадию, на которой соединение [(1,2-C2B9H10)-3,3'-Co(1',2'-C2B9H10)-8,8'NH], депротонированное гидридом натрия и растворенное в диметиловом эфире диэтиленгликоля (DME), обрабатывают при температуре окружающей среды эпихлоргидрином и данный продукт получают очисткой реакционной смеси на колонке с силикагелем. 12. Фармацевтическая композиция, предназначенная для применения при лечении HIV-инфекции и СПИД, содержащая по меньшей мере один ингибитор протеазы ВИЧ, выбранный из указанных выше соединений общей формулы (I), (R1)nA(-X-Y-Z)m, по п.3 и/или общей формулы (II), (R')nA(-X-Z)m, по п.4,и их фармацевтически приемлемые соли. 13. Фармацевтическая композиция, предназначенная для применения при лечении HIV-инфекции и СПИД, содержащая по меньшей мере одно соединение по пп.5 и 6 или их фармацевтически приемлемые соли.
МПК / Метки
МПК: A61P 31/18, A61K 31/69, C07F 5/05
Метки: ингибиторы, протеазы, новые
Код ссылки
<a href="https://eas.patents.su/30-11276-novye-ingibitory-proteazy-hiv.html" rel="bookmark" title="База патентов Евразийского Союза">Новые ингибиторы протеазы hiv</a>
Предыдущий патент: Суточная дозированная единица комплекса этинилэстрадиол- циклодекстрин
Следующий патент: Производные хинолина и их применение в качестве ингибиторов микобактерий
Случайный патент: Краска для глубокой печати с ванадиевым сиккативом