Приемлемые для лечения вич соединения
Формула / Реферат
1. Применение 2',3'-дидезокси-3'-С-гидроксиметилцитозина или его пролекарства, высвобождающего in vivo 2',3'-дидезокси-3'-С-гидроксиметилцитозин или его 5'-монофосфат, или его соли для получения лекарственного средства для лечения ВИЧ-инфекции, где обратная транскриптаза ВИЧ несет по меньшей мере одну мутацию, обеспечивающую удаление терминирующего облигатную цепь нуклеозид- или нуклеотидфосфата из возникающей цепи ДНК путем опосредованного АТФ или пирофосфатом удаления.
2. Применение по п.1, где обратная транскриптаза несет по меньшей мере один из следующих генотипических профилей:

3. Применение по п.2, где генотипический профиль М41, +D67, L210 и Т215 включает в себя M41L, +D67N, L210W и T215Y/F.
4. Применение по п.2 или 3, где генотипический профиль дополнительно включает в себя по меньшей мере одну дополнительную мутацию в положении Е44, K70, V118, Н208, R211K, L214, K219 или G333.
5. Применение по п.2 или 3, где генетический профиль дополнительно включает в себя по меньшей мере одну дополнительную мутацию в положении ![]() Т69, Е203, L210, D218, Н221, D223 или L228.
Т69, Е203, L210, D218, Н221, D223 или L228.
6. Применение по п.2, где генетический профиль D67, K70 и K219 включает в себя D67N, K70R и K219Q/E.
7. Применение по п.2 или 6, где генетический профиль D67, K70 и K219 дополнительно включает в себя по меньшей мере одну дополнительную мутацию в положении М41, Е44, V118, Н208, R211K, L214, Т215, K219 или G333.
8. Применение по п.2 или 6, где генетический профиль D67, K70 и K219 дополнительно включает в себя по меньшей мере одну дополнительную мутацию в положении ![]() Т69, Е203, L210, D218, Н221, D223 или L228.
Т69, Е203, L210, D218, Н221, D223 или L228.
9. Применение по п.2, где генетический профиль T69S-XX дополнительно включает в себя по меньшей мере одну дополнительную мутацию в положении М41, Е44, D67, K70, V118, Н208, L210, R211K, L214, Т215, K219 или G333.
10. Применение по п.2, где генетический профиль T69S-XX дополнительно включает в себя по меньшей мере одну дополнительную мутацию в положении ![]() Т69, Е203, L210, D218, Н221, D223 или L228.
Т69, Е203, L210, D218, Н221, D223 или L228.
11. Применение по п.2, где генетический профиль ![]() дополнительно включает в себя по меньшей мере одну дополнительную мутацию в положении М41, Е44, D67, K70, V118, Н208, L210, R211K, L214, Т215, K219 или G333.
дополнительно включает в себя по меньшей мере одну дополнительную мутацию в положении М41, Е44, D67, K70, V118, Н208, L210, R211K, L214, Т215, K219 или G333.
12. Применение по п.2, где генетический профиль ![]() дополнительно включает в себя по меньшей мере одну дополнительную мутацию в положении Т69, T69S+XX, Е203, L210, D218, Н221, D223 или L228.
дополнительно включает в себя по меньшей мере одну дополнительную мутацию в положении Т69, T69S+XX, Е203, L210, D218, Н221, D223 или L228.
13. Применение по любому из пп.2, 3 или 6, где обратная транскриптаза дополнительно несет по меньшей мере одну характерную мутацию в положении K65 или L74 или М184 или Q151.
14. Применение по п.13, где характерная мутация представляет собой K65R или L74V или M184V или Q151M.
15. Применение по п.13 или 14, где характерная мутация дополнительно включает в себя по меньшей мере одну дополнительную мутацию в положении А62, V75, F77, Y115 или F116.
16. Применение по любому из пп.1-15, где 5'-(2',3'-дидезокси-3'-С-гидроксиметилцитозин)монофосфат включается в возникающую цепь ДНК, в результате чего один остаток, выбранный из природных нуклеотидов, монофосфатных нуклеозидных аналогов (включая 5'-(2',3'-дидезокси-3'-С-гидроксиметилцитозин)монофосфат) и фосфатных нуклеотидных аналогов ковалентно присоединяется к включенному 5'-(2',3'-дидезокси-3'-С-гидроксиметилцитозин)монофосфату, индуцируя, таким образом, терминацию цепи.
17. Применение по любому из пп.1-16, где соединение в лекарственном средстве представляет собой 2',3'-дидезокси-3'-С-гидроксиметилцитозин или его фармацевтически приемлемую соль.
18. Применение по любому из пп.1-16, где включенное в лекарственное средство соединение представляет собой пролекарство формулы
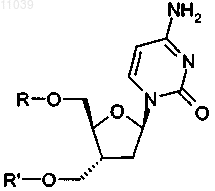
где один из R и R' представляет собой часть пролекарства с частичной структурой
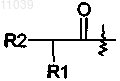
где R1 представляет собой Н или C1-C18 неразветвленный или разветвленный алкил;
R2 представляет собой Н или NHR3;
R3 представляет собой Н или L-валиловый или L-изолейциловый сложный эфир;
а оставшийся из R и R' представляет собой Н или идентичную часть пролекарства;
или его фармацевтически приемлемую соль.
19. Применение по п.18, где
R1 представляет собой C1-C18 неразветвленную или разветвленную алифатическую цепь и R2 представляет собой Н;
R1 представляет собой метил и R2 представляет собой NH-L-валил или NH-L-изолейцил;
R1 представляет собой С3-С4 разветвленную алифатическую цепь и R2 представляет собой NH2;
или его фармацевтически приемлемую соль.
20. Применение по п.19, где один или оба из R и R' представляют собой L-валил-L-лактил-,
L-валил- или C1-С6 алканоил-.
21. Применение по п.20, где соединение обозначает
5'-О-[2-S-(L-валилокси)пропионил]-2'-3'-дидезокси-3-С-гидроксиметилцитозин;
2',3'-дидезокси-3'-С-[2-S-(L-валилокси)пропионил]оксиметилцитозин;
5'-O-пентаноил-2'-3'-дидезокси-3-С-гидроксиметилцитозин;
2',3'-дидезокси-3'-С-пентаноилоксиметилцитозин или
5'-O-пентаноил-2'-3'-дидезокси-3-С-пентаноилоксиметилцитозин;
или их фармацевтически приемлемые соли.
22. Применение по любому из предшествующих пунктов, где лекарственное средство дополнительно включает в себя по меньшей мере один терминатор цепи NRTI, в результате чего одновременное или последовательное введение указанного 2',3'-дидезокси-3'-С-гидроксиметилцитозина, или его соли, или его пролекарства и указанного терминатора цепи предназначено для ингибирования появления или распространения мутантов ВИЧ у инфицированного ВИЧ индивидуума, где указанные мутанты способны удалять указанный терминирующий цепь нуклеотид NRTI, включенный в комплекс праймер/матрица ВИЧ, удаление, обеспечиваемое механизмом удаления, зависимым от АТФ или пирофосфата.
23. Применение по п.22, где терминирующий цепь NRTI выбирают из группы, состоящей из зидовудина (AZT, ZDV), ставудина (d4Т), зальцитабина (ddC), диданозина (ddI), абакавира, (ABC), ламивудина (3ТС), эмтрицитабина (FTC), адефовира (ADV), энтакавира (BMS 200475), аловудина (FLT), дизопроксилфумарата тенофовира (TNF), амдоксавира (DAPD), D-d4FC (DPC-817), -dOTC (SPD754), SPD-756, рацивира, D-FDOC и GS7340.
24. Применение по п.23, где терминирующий цепь NRTI выбирают из группы, состоящей из зидовудина, ставудина, диданозина, ламивудина, абакавира, тенофовира, эмтрицитабина и их сочетаний.
25. Применение по п.23, где терминирующий цепь NRTI представляет собой зидовудин, ламивудин или комбинированные лекарственные формы комбивир или тризивир; ламивудин, абакавир или комбинированную лекарственную форму эпзиком; тенофовир, эмтрицитабин или комбинированную лекарственную форму трувада.
26. Применение по любому из предшествующих пунктов, где 2',3'-дидезокси-3'-С-гидроксиметилцитозин вводят в диапазоне от 0,05 до 0,5 мг/кг/сутки.
27. Применение по п.26, где 2',3'-дидезокси-3'-С-гидроксиметилцитозин вводят в дозе менее
0,1 мг/кг/сутки.
28. Способ лечения пациента с ВИЧ, где обратная транскриптаза ВИЧ несет по меньшей мере одну высвобождающую праймер мутацию, обеспечивающую удаление терминирующего облигатную цепь нуклеозид- или нуклеотидфосфата из возникающей цепи ДНК при помощи опосредованного АТФ или пирофосфатом удаления, где способ включает в себя введение пациенту эффективного количества 2',3'-дидезокси-3'-гидроксиметилцитозина или его пролекарства, высвобождающего in vivo 2',3'-дидезокси-3'-С-гидроксиметилцитозин или его 5'-монофосфат, или его соли.
29. Способ ингибирования появления или распространения высвобождающих праймер мутантов ВИЧ, способных удалять терминирующий цепь нуклеотид NRTI, включенный в комплекс ВИЧ праймер/матрица, где удаление осуществляется зависимым от АТФ или пирофосфата механизмом удаления, где способ включает в себя одновременное или последовательное введение инфицированному ВИЧ индивидууму эффективного количества 2',3'-дидезокси-3'-С-гидроксиметилцитозина или его пролекарства, высвобождающего 2',3'-дидезокси-3'-С-гидроксиметилцитозин или его 5'-монофосфат in vivo, или его соли и по меньшей мере одного терминатора цепи NRTI, индуцирующего высвобождающие праймер мутанты.
Текст
011039 Область изобретения Данное изобретение относится к способам и фармацевтическим композициям для профилактики или лечения вируса иммунодефицита человека (ВИЧ), который имеет по меньшей мере один хорошо изученный класс мутаций в гене обратной транскриптазы (RT, ОТ), который создает фенотип высвобождения (вырезания) праймера. Данные классы мутаций связаны с отдельными мутациями аналогов тимидина (ТАМ) и названы связанными с высвобождением праймера мутациями. В способах и фармацевтических композициях по изобретению используют нуклеозид 2',3'-дидезокси-3'-С-гидроксиметилцитозин или пролекарства, высвобождающие данный нуклеозид in vivo. Техническая область В отличие от других средств против ВИЧ, таких как ингибиторы протеазы или ненуклеозидные ингибиторы обратной транскриптазы, нуклеозидные ингибиторы обратной транскриптазы (NRTI) являются фармакологически неактивными в применяемой форме и требуют фосфорилирования клеточными киназами хозяина для получения активного трифосфатного метаболита. Данная трифосфатная форма сходна с встречающимися в природе дезоксинуклеотидтрифосфатными субстратами вирусной обратной транскриптазы и конкурирует за связывание с ВИЧ-1 ОТ и включение в вирусную ДНК. У всех одобренных для лечения ВИЧ NRTI и подавляющего большинства всех других представленных в патентной или академической литературе NRTI отсутствует 3'-гидроксильная группа на рибозной части нуклеозида. Примеры включают в себя зидовудин (AZT), ставудин (d4 Т), ламивудин (3 ТС), зальцитабин (ddC), абакавир (ABC), диданозин (ddI) и тенофовир (TNF) (последний обычно вводят в виде пролекарственной формы дизопроксилфумарата). При фосфорилировании такой нуклеозид или аналог нуклеотида ковалентно связан ферментом обратной транскриптазы с появляющейся цепью ДНК, но отсутствие 3'-гидроксильной группы в нуклеозиде или нуклеотиде предотвращает дальнейшее присоединение дополнительных нуклеотидов. Следовательно, данные NRTI прекращают удлинение цепи вирусной ДНК, таким образом, приводя к ингибированию репликации ВИЧ (Mitsuya et al., 1990, Jacob Molina et al., 1993, Reardon 1993). Краеугольным камнем всех существующих антиретровирусных способов лечения (ART) является применение NRTI. Однако NRTI способны только замедлять распространение ВИЧ в кровотоке и на сегодняшний день не способны ликвидировать ВИЧ у пациентов. ВИЧ действует посредством вставки своей ДНК в покоящиеся клетки-хозяева, вовлеченные в иммунологическую память человека. Данный способ инфицирования предполагает, что пациенты вынуждены принимать противовирусные средства против ВИЧ пожизненно, чтобы предотвратить увеличение титра ВИЧ у пришедшего к норме после окончания терапии пациента. Однако на практике эффективный период введения конкретного лекарственного средства против ВИЧ для данного пациента резко ограничен появлением "ускользающих мутантов". Ускользающий мутант представляет собой вирус, содержащий отдельную группу мутаций, придающую резистентность к лекарственному средству и позволяющую ему пролиферировать в присутствии лекарственного средства. Ускользающие мутанты возникают у пациента в результате селективного воздействия принимаемого пациентом конкретного противовирусного(ых) средства(в). Поэтому эффективный период введения зависит от быстроты появления и пролиферации ускользающих мутантов. Становится все более очевидно, что в странах, где постоянно назначают противовирусные средства против ВИЧ, в новых случаях ВИЧ первичная инфекция часто представляет собой не ВИЧ дикого типа, а скорее ВИЧ с цепью, которая уже частично или в большой степени резистентна к существующим противовирусным средствам. Другими словами, образующиеся у инфицированных пациентов in situ ускользающие мутанты также могут быть перенесены незараженным пациентам путем горизонтальной или вертикальной передачи инфекции. Это, в свою очередь, означает, что даже некоторые пациенты, которых можно было бы иначе классифицировать как не подвергавшихся лечению, уже инфицированы вирусом,резистентным к обычным способам лечения первого ряда. Отбору ускользающих от лекарственных препаратов мутантов способствует множество факторов,включающих в себя общую величину пула ВИЧ, процессивность ОТ и ошибку в репликации вирусного генома, приспособленность вируса и многократные возможности использования клеток-мишеней. К концу 1990-х данные на основании длительного применения сочетаний на основе зидовудина (AZT) или ставудина (оМТ) показали, что группы конкретных мутаций в ОТ были образованы последовательно. Данные группы мутаций представляют собой прототип, в настоящее время известный как мутации аналогов тимидина (ТАМ). Присутствие ТАМ увеличивало вероятность отбора дополнительных мутаций и приводило к развитию более продвинутых резистентных фенотипов NRTI, которые не находились четко в пределах семейства аналогов тимидина. Подобные фенотипы в настоящее время известны как мутация аналога нуклеозида (NAM) и множественная лекарственная устойчивость (MDR) ВИЧ. Гипотеза резистентности NRTIAZT был первым широко применяемым антиретровирусным средством, и не удивительно, что средство вызывало образование ускользающих мутантов (Larder et al., 1989). Однако, принимая во внимание большое количество мутаций по всему геному ВИЧ в изолятах обычного пациента, невозможно создать in vitro резистентный фенотип с применением рекомбинантного фермента ОТ с конкретной-1 011039 ТАМ. В результате механизмы, посредством которых ТАМ придают резистентность, не были исчерпывающе объяснены. Различные гипотетические модели и теоретические прогнозы механизма резистентности после ТАМ основывались на вовлечении нуклеофильной атаки донором пирофосфата (Boyer et al., 2002 andMeyer et al., 2002). По-видимому, теория переноса ОТ представляет собой ключевой шаг в понимании связанного с ТАМ механизма резистентности. Однако она была недостаточно понятна до конца 2002, так как промежуточные соединения пре- и постпереноса ОТ являются неустойчивыми и коротко живущими,и не могут быть легко получены экспериментальным путем. Современное понимание теории переноса ОТ предполагает, что катализируемая ОТ полимеризация ДНК проходит подробно описанным каскадным способом, как проиллюстрировано на фиг. 3, заимствованной у Sarafianos et al., (2003). Эти стадии представляют собой следующее. 1) Связывание субстрата ДНК свободным ферментом Е в положениях 3'-праймерного конца на Ручастке (праймерный участок). 2) Связывание dNTP рядом с N-участком (участком для dNTP) образует "открытый" тройной комплекс. 3) При помощи конформационных изменений фермента образуется "закрытый" тройной комплекс. 4) Образование фосфодиэфирной связи между 3'-ОН праймерного конца и альфа фосфатом dNTP сопровождается высвобождением пирофосфата (PPi) с образованием претранслоцируемого комплекса ОТ на N-участке. 5) Перенос праймерного конца с N-участка к Р-участку с образованием посттранслоцируемого комплекса, необходимого для присоединения следующего dNTP и продолжения синтеза ДНК. В случае, если используют терминаторный нуклеозидтрифосфат цепи ДНК (обычно нуклеозидный аналог, у которого отсутствует 3'-гидроксильная группа на дезоксирибозной части), он имитирует свой встречающийся в природе аналог dNTP и связывается с ОТ. После соответствующего химического преобразования включенный NRTI образует претранслоцируемый комплекс на N-участке полимеризации. Это прекращает дальнейший синтез ДНК из-за отсутствия 3'-гидроксила праймера на дезоксирибозной части NRTI. В отличие от этого ОТ с мутациями, связанными с ТАМ, использует отличающийся от ОТ дикого типа механизм нуклеотидного включения. А именно, новый механизм приводит к высвобождению (вырезанию) включенного в праймерный конец NRTI, отменяя цепную терминирующую активность NRTI. Данный новый механизм зависит от взаимосвязи между накоплением комплексов с претранслоцируемыми структурами (на N-участке) и доступностью АТФ или доноров пирофосфата, которые часто отсутствуют в области инфицирования, т.е. в нормальных лимфоцитах. В нормальных условиях АТФ или пирофосфат не участвуют в реакциях вирусной ДНКполимеризации, но структура ОТ, экспрессирующая связанный с ТАМ резистентный фенотип, способствует их проникновению к участку, расположенному рядом с только что встроенным NRTI. Равновесие между пре- и посттранслокационными кинетическими типами предоставляет механизм для обеспечения свободного доступа праймерного конца к N-участку, а также допускает одновременное связывание пирофосфатного донора АТФ на Р-участке после присоединения терминатора цепи NRTI и высвобождения пирофосфата. Если это происходит, АТФ (или пирофосфат) атакует фосфодиэфирную связь, связывающую присоединенный в конце ДНК NRTI, приводя к удалению NRTI посредством пирофосфоролиза. Если донором пирофосфата является АТФ, NRTI высвобождается в виде динуклеозидтетрафосфатного продукта. На фиг. 4 проиллюстрировано данное "высвобождение праймера" в AZT-терминированной ДНК (заимствовано у ClinicCareOptions). В настоящее время предполагают, что в фенотипическую резистентность к NRTI вовлечены два различных механизма (Sluis-Cremer et al., 2000). Первый, известный как активность "высвобождения праймера", описан выше. В нем терминирующий цепь нуклеотид удаляют из 3'-конца праймерного конца посредством зависимого от АТФ или зависимого от пирофосфата пирофосфоролиза. Однако существует еще одна группа резистентных фенотипов, обозначенная как "избирательные мутанты". Данные мутанты имеют ОТ с усиленной способностью различать NRTI и нативные dNTP. В данном случае механизм приводит к ОТ, способной к предпочтительному выбору нужного субстрата (т.е. нативного dNTP), таким образом, избегая терминации цепи NRTI и обеспечивая размножение вирусного генома. Образование мутаций у ВИЧ Ретровирусы, такие как ВИЧ, обладают потенциалом для обеспечения быстро растущего генетического многообразия. Несмотря на то, что это энергетически невыгодный процесс, он предоставляет организму очевидные адаптивные преимущества. Используемый ВИЧ способ репликации особенно способствует появлению ошибок, образованию большого количества мутаций и обладает способностью приводить к накоплению мутаций, если организм находится под селективным воздействием. Как правило, подавляющее большинство образованных привирусной репликации мутаций приводит к образованию менее жизнеспособных ферментов. При этом накопление второй и особенно третьей мутации менее вероятно, так как популяционный пул для менее жизнеспособного мутанта, в пределах-2 011039 которого должна накапливаться вторая мутация, будет растворен быстрее размножающимся организмом дикого типа. Более жизнеспособные вирусные мутанты могут возникать и распространяться двумя возможными путями. Первый встречается, если существует быстрый рост высокорезистентного варианта, который уже присутствует во всей вирусной популяции. Наиболее часто это отдельная точечная мутация, обеспечивающая фенотипическую резистентность к селективному воздействию. В случае ускользающих от лекарственного средства мутаций примеры включают в себя K103, быстро индуцированную ненуклеозидным ингибитором обратной транскриптазы невирапином. Второй путь встречается, когда существует продолжительная вирусная репликация при наличии селективного воздействия. Это допускает прогрессивное накопление мутаций, способных затем распространяться. В этом случае вероятность накопления мутации связана с объемом происходящей вирусной репликации. Таким образом, при более высоких вирусных нагрузках (например, 200000 копий/мл) могут происходить накопления двойных мутаций. Однако накопление тройных мутаций встречается редко и может возникать только как следствие сложной схемы лечения, обычно предусматривающей несколько различных лекарственных средств, являющихся стимулирующими для поддержания пациента. Таким образом, даже для аккуратного пациента чрезвычайно трудно гарантировать, что все активные ингредиенты присутствуют в крови в концентрациях, выше необходимых ингибиторных концентраций в течение всего 24-часового периода каждых суток ("24 часовой провал концентрации"). При этом временное удаление любого из селективных воздействий при использовании лекарственного средства из-за ошибок во введении/24-часового провала концентрации одного или нескольких лекарственных средств допускает стихийную вирусную репликацию, таким образом, обеспечивая образование и сохранение многих новых мутантов. Когда снова применяют селективное воздействие (т.е. возобновляют сложную схему лечения), некоторые новые мутанты, которые накопили еще одну точечную мутацию, придающую лучшую резистентность к лекарственному препарату,могут распространяться в условиях, аналогичных тем, которые рассматриваются для первого пути (см. выше). Изложенное выше обсуждение сфокусировано на накоплении точечных мутаций в отличие от, например, делеций или мутаций присоединения. Однако здесь применим сценарий, аналогичный описанному для тройной мутации. Таким образом, большинство мутаций делеции/присоединения исходно затрагивают один нуклеотид. Это имеет эффект полного изменения будущей аминокислотной последовательности кодируемого белка, если изменение происходит в пределах кодирующей области и приводит к урезанному и/или неактивному белку. Для того чтобы сохранить рамку считывания и изменить целевой белок посредством делеций или присоединения одной отдельной аминокислоты, должны быть делетированы/добавлены три нуклеотида. Так как неактивные ферменты снижают жизнеспособность организма ВИЧ, особенно если пораженным ферментом является ОТ, делеции/присоединения не будут накапливаться per se, а должны произойти одновременно. Другими словами, эквивалент тройной мутации должен возникнуть в одном событии, что случается крайне редко (см. Boyer et al. (2004) J Virol 78(18): 99879997, которая включена сюда в качестве ссылки в полном объеме). Как следствие данного процесса в отношении накопления/включения тройного мутанта, только относительно недавно выявили вирус ВИЧ, демонстрирующий по меньшей мере три мутации в ОТ, создающие особенно высокую резистентность ко многим лекарственным средствам. Например, в Соединенных Штатах Америки FDA одобрила применение комбинированного лечения лекарственными средствами (ddC и AZT) в 1992. Еще до сентября 1995 клинические испытания показали, что сочетание AZT с ddC или ddI было более эффективно, чем один AZT. Только в результате применения комбинированных способов лечения, где используют множество лекарственных препаратов, но при режимах дозирования, неспособных эффективно гарантировать адекватный 24-часовой провал концентрации соответствующих лекарственных средств, получили особенно проблематичные штаммы полирезистентного вируса ВИЧ, известные в настоящее время в западном мире. Высвобождающие праймер мутации Высвобождающий праймер ТАМ мутант, содержащий различные перестановки в пределах группы из шести резистентных к лекарственным средствам фенотипов в аминокислотных положениях M41L,D67N, K70R, L210W, T215Y/F и K219Q/E на ОТ, первоначально описан (Larder and Kemp, 1989, Schinaziet al., 2000). Предыдущие данные указывали на два отличающихся мутационных пути развития множества высвобождающих праймер мутантов ТАМ, оба возникают при помощи неизвестных факторов. Первый путь приводил к аминокислотной замене в 210 кодоне (210W) и был предпочтительно связан с мутациями в кодонах 41 (41L; более 98%) и 215 (215Y; более 94%), а также замене в кодоне 67 (67N). Второй путь вызывал мутацию в кодоне 219 (219K/Е), предпочтительно связанную с мутациями в кодонах 67(67N) и 70 (70R) (Yahi et al., 1999). Таким образом, существовало два фенотипических профиля:(1) L210W, M41L, T215Y/F, D67N, которые предоставляют высокие уровни вирусной резистентности к AZT и d4T, и(2) K219K/Е, D67N, K70R, которые предоставляют средние уровни вирусной резистентности к AZT и d4T.Marcelin et al. (2004) суммировали распространение связанных с ТАМ высвобождающих праймер-3 011039 мутаций у пациентов с вирусологическими нарушениями. При этом было исследовано 1098 последовательностей ОТ и показано два генотипических профиля, как указано на фиг. 1 и 2. Несмотря на то, что до терапии могли присутствовать различные генетические профили, последовательность и композиция антиретровирусной терапии, применяемая в виде комбинированной терапии с индивидуальными различиями в фармакологии, приводили к вирусной резистентности не только к AZT и d4T, а также к другимNRTI. В зависимости от присутствия мутационного профиля, резистентность к лекарственным средствам включала в себя резистентность к абакавиру (ABC), диданозину (ddI), тенофовиру (TNF), ламивудину(3 ТС), эмтрицитабину (FTC) и зальцитабину (ddC). Следовательно, возникновение связанного с ТАМ высвобождения праймера часто играет важную роль в дальнейшем развитии генотипических профилей ВИЧ с более выраженной резистентностью. Таким образом, один шаг в предотвращении множественной нуклеозидной резистентности относится к разработке нового NRTI, с тем чтобы избежать накопления связанного с ТАМ высвобождения праймера. Связанные с высвобождением праймера ТАМ мутации могут появляться одновременно с другими семействами ускользающих мутантов, обычно возникающими при комбинированной антиретровирусной терапии (также известной как сочетанная терапия). В настоящее время смесь "комбивир" (AZT+3TC) представляет собой наиболее часто применяемую и рекомендованную схему терапии первого ряда для лечения наивных не подвергавшихся лечению пациентов с ВИЧ. Однако оно приводит к образованию ускользающих мутантов, резистентных к обоим лекарственным средствам. Например, Miller et al. (1998) сообщали о выделении 3 ТС-резистентного вируса с мутацией M184V всего лишь через 4-12 недель после начала комбинированной терапии AZT+3TC. С течением времени постепенно появлялись дополнительные связанные с AZT мутации, образуя характерный генотипический профиль из M184V, M41L, D67N,K70R, L210W, T215Y/F и K219Q/E, обычно обнаруживаемый в настоящее время у подвергавшихся лечению пациентов. Сообщали, что дополнительные мутации в ОТ в положениях Н 208, R211 и L214 (Sturmeret al., 2003) и в положении G333 (Kemp et al. 1998) вовлечены в двойную резистентность AZT-3TC и особенно увеличивают способность к резистентности относительно AZT. Таким образом, был расширен генотипический фон связанных с высвобождением праймера ТАМ для включения перестановок вM184V, M41L, D67N, K70R, H208Y, L210W, R211K, L214F, T215Y/F, K219Q/E и G333E. Другие типы мутаций, обычно наблюдаемые у подвергавшихся лечению пациентов, представляют собой V118I и E44D/A. Эти мутации прочно связаны с предшествующим воздействием ddI и d4T. Кроме того, они часто связаны с присутствием определенных групп ТАМ, включающих в себя M41L плюсT215Y/F или D67N плюс L210W. Результатом является повышенная резистентность к семейству аналогов тимидина из-за связанного с ТАМ высвобождения праймера, а также особая роль в двойной резистентности к AZT+3TC (Montes et al., 2002, Girouard et al., 2003). Распространенность ускользающих от лекарственных средств мутантов увеличивается в виде функции ряда NRTI, применяемых во время терапии, и формирует профиль характерных ТАМ или NAM,включающих в себя различные перестановки в M41L, E44D/A, D67N, K70R, V118I, M184V, H208Y,L210W, R211K, L214F, T215Y/F, K219Q/E и G333E. Эта группа, как правило, также резистентна к AZT- иd4T-содержащей комбинированной терапии и перекрестно резистентна ко всему классу NRTI. Значимая резистентность к аналогам тимидина, а именно AZT, d4T и TNF, также обнаружена у ускользающих мутантов с делецией аминокислоты в положении 67 в пальцеобразной области ОТ часто совместно с аминокислотной заменой в T69G с сопутствующей ТАМ (см. Imamichi et al., 2000 и 2001). Предполагают, что повышенная активность полимеризации ОТ, связанная с данным конкретным генотипом, приводит к более эффективному, зависимому от пирофосфоролиза удалению праймера (описанному выше), приводя к повышенной резистентности. Boyer et al. (2004) также обнаружили, что с сопутствующей ТАМ придавали повышенную способность обеспечивать зависимую от высвобождения(удаления) праймера резистентность вируса к AZT и TNF по сравнению только с ТАМ. ВИЧ эволюционирует с развитием антиретровирусной терапии. Новые мутационные фенотипы появились, когда в клинической терапии ВИЧ применяли двойные и тройные коктейли из нуклеозидных аналогов, особенно для лечения не подвергавшихся терапии пациентов. Сложные схемы лечения, требующие множества лекарственных средств, принимаемых в различное время в течение суток, некоторые с пищей, а некоторые без, являются для пациентов стимулирующими. Отказ точно подчиняться данным режимам дозирования, приводящий к перерывам с 24-часовым провалом, способствовал появлению множества резистентных к NRTI вирусов ВИЧ, преимущественно как результат приобретенных вирусомNAM или MDR. Например, ряд групп (например, Mas et al., 2000) наблюдали появление вирусного мутанта T69S-XX, связанного с применением AZT. Данный мутант имеет вставку из 6 п.о. в кодирующую область его ОТ между нуклеиновыми кислотами, соответствующими 69 и 70 аминокислотам. Полученные двойные аминокислотные инсерционные комплексы (обычно инсерции SS, SG или AG) не только приводят к вирусной резистентности к AZT, но также почти ко всему набору NRTI, включающему в себяd4 Т, 3 ТС, ddI, ddC и ABC, и TNF. Наблюдали повышенное высвобождение праймера, зависимое от пирофосфоролиза, с Т 69S+двойная аминокислотная вставка, особенно в присутствии ТАМ. Данный феномен, как правило, связан с "M41L/T215Y" или "M41L/L210W/R211K/L214F/T215Y" резистентными фе-4 011039 нотипами и играет важную фенотипическую роль в множественной нуклеозидной резистентности (Meyeret al., 2003). Еще один класс MDR имеет в кодоне аминокислотную замену Q151M. Эта мутация наблюдается в клинике с относительно низкой частотой и часто представлена вместе со вторичными мутациями A62V,V75I, F77L и F116Y. Однако она придает значительную резистентность почти ко всему классу NRTI. Кроме того, были обнаружены связанные с ТАМ генотипы, обычно "M41L, L210W и T215Y/F" или"D67N, K70R и K219K/Е". Она появляется у пациентов, подвергавшихся интенсивной терапии комбинированными схемами лечения AZT/ddI и AZT/ddC.L74V наиболее часто определяется при монотерапии ddI (Martin et al., 1993) и проявляет перекрестную резистентность к ABC и 3 ТС. Ее действие на получение ускользающих от терапии вирусов зависит от присутствия других мутаций. В обзорах по резистентности предполагают, что частота L74V в значительной степени связана с ТАМ, обычно в области M41L, L210W и T215Y/F (Marcelin et al., 2004), хотя предполагали, что мутация L74V вызывает уменьшение вирусной репликации и обратно повышает чувствительность AZT-резистентных вирусов, содержащих ряд ТАМ (St. Clair et al., 1991). Сочетание мутаций L74V и M184V в ОТ ВИЧ-1 представляет собой наиболее частый профиль, связанный с резистентностью к ABC и ddI (Harrigan et al., 2000 and Miller et al., 2000). Хотя высокий уровень резистентности к ABC обычно требует нескольких мутаций, включающих в себя K65R, L74V, Y115F и M184V, отдельная мутация M184V часто возникает первой. Эта мутация, в настоящее время признанная как ключевая мутация в специфическом механизме ускользающей от лекарственных средств резистентности, дает умеренное снижение чувствительности к ABC (Tisdale et al.,1997). Исследование CNA3005, в котором 562 пациента случайным образом получали AZT и 3 ТС либо сABC или ddI, продемонстрировали низкое, но устойчивое увеличение части пациентов, несущих ТАМ вAZT и 3 ТС плюс ABC плече. К 48 неделе до 56% пациентов имели по меньшей мере одну ТАМ, связанную с высвобождением праймера (1TAM), кроме быстро индуцируемой M184V мутации (Melby et al.,2001), иллюстрируя важность предотвращения появления резистентности, связанной с высвобождением праймера. Аналогичным образом, перенос in vitro AZT-резистентного вируса, несущего генотипический профиль 67, 70, 215 и 219, при селективном воздействии 3 ТС приводил к появлению мутации M184V и обеспечивал перекрестную резистентность к ABC (Tisdale et al., 1997). Это еще раз подчеркивает концепцию, что лечение существующей ранее ТАМ, связанной с высвобождением праймера, и предотвращение накопления связанных с высвобождением праймера мутантов является основным шагом в предупреждении развития множественной нуклеозидной резистентности. Становится все более очевидно, что мутация K65R быстро обнаруживается у очень большой части пациентов, получавших TNF или ABC. Valer et al. (2004) сообщали, что в клинике Мадрида уровень распространения K65R возрастал от 1% между 1997-2000 до 7% в 2003 и 12% в первые 4 месяца 2004. Действие мутанта K65R усиливалось в присутствии других мутаций, связанных со сниженной чувствительностью к ABC, 3TC, ddI и ddC (Parikh et al., 2003). Кроме того, одновременное появление K65R связанных с высвобождением праймера генотипов ТАМ, несмотря на редкое появление, приводит к более сильному действию на высвобождение (вырезание) праймера TNF по сравнению с AZT (Naeger et al.,2001). Сообщалось, что TNF активен против ВИЧ-1, имеющего до 3 ТАМ, если группа ТАМ не включала в себя мутацию М 41L или L210W. В настоящее время неясно, почему ТАМ могут отменять некоторые из эффектов K65R в отношении чувствительности к TNF и ABC, которые, как иначе думали, препятствуют вырезающим праймер мутантам. Наконец, мутацию T69D исходно идентифицировали по ее роли в появлении резистентности к ddC. Также сообщали, что она связана со сниженным ответом к ddI, если она возникает в сочетании с мутацией T215Y и другими генотипами ТАМ, связанных с высвобождением праймера. В течение многих лет WHO и DHHS (US Department of Health and Human Health Service) рекомендовали для лечения не подвергавшихся лечению пациентов антиретровирусную терапию первого ряда,состоящую из введения d4T или AZT в сочетании с 3 ТС плюс невирапин или эфавиренц (Guidelines forthe Use of Antiviral Retroviral Agents in HIV-1-Infected Adults and Adolescents, July 14 2003 and March 23 2004). Однако значительное количество ВИЧ-инфицированных пациентов имеют проверенный на практике неудачный результат, несмотря на исходные высокоактивные схемы антиретровирусной терапии(HAART), показывая, что данные пациенты уже инфицированы ускользающими от лекарственных средств вирусами. Резистентные мутанты ТАМ, связанные с высвобождением праймера, продолжают играть ведущую роль в развитии резистентности к лекарственным средствам. Таким образом, разработка лекарственных средств или способов лечения, препятствующих действию резистентных мутантов ТАМ,связанных с высвобождением праймера, могли бы усиливать действие или продлевать применение существующих NRTI для лечения не подвергавшихся лечению пациентов, а также могли бы применяться в терапии по жизненным показаниям для лечения инфицированной ВИЧ популяции, несущей связанный с высвобождением праймера резистентный мутант.-5 011039 Стратегия лекарственных средств для предупреждения/ингибирования мутантов с высвобождением праймера Высвобождение праймера и характерные мутации часто возникают вместе в том же мутантном генотипе, главным образом, из-за текущей терапевтической стратегии. Мутация M184V является характерной мутацией семейства характерных мутантов. Однако если она возникает в сочетании со связанными с высвобождением праймера мутациями, такими как M41L, D67N, K70R, L210W, T215Y/F и K219Q/E, она играет роль в двойной резистентности к AZT и 3 ТС (Miller et al., 1998). Считается, что данные фенотипы с высвобождением праймера и характерной резистентностью связаны с различными группами мутаций в ОТ. Например, связанные с AZT мутации, включающие в себя различные перестановки в M41L, E44D/A, D67N, K70R, V118I, M184V, H208Y, L210W, R211K, L214F,T215Y/F, K219Q/E и G333E, MDR мутация T69S со вставками из 6 п.о. и как правило, демонстрируют активность высвобождающего праймер мутанта. С другой стороны, мутации в положениях 65, 74,89, 151, и 184 приводят к способности отличать NRTI и соответствующие эквиваленты dNTP или они могут вовлекаться в перемещение комплекса праймера и матрицы. В недавней статье "Designing anti-AIDS drugs targeting the major mechanism of HIV-1 RT resistance tonucleoside analog drugs" (IJBCB 36 (2004) 1706-1715, которая включена сюда в полном объеме в качестве ссылки), Sarafianos с соавторами заключают, что механизм высвобождения (вырезания) праймера может осуществляться только до переноса ОТ в N-участок, и, кроме того, заключают, что он становится доминантным механизмом резистентности к NRTI. В разделе, названном "Strategies for inhibition of the Excision Reaction" (см. с. 1711), они предлагают три подхода для предотвращения такого механизма резистентности. 1. Применение противовирусных средств, препятствующих эффективному связыванию АТФ (в Ручастке), возможно посредством связывания в или рядом с АТФ-связывающим сайтом, тем самым, блокируя реакцию высвобождения без воздействия на дальнейшую реакцию синтеза ДНК. 2. Применение соединений, способных блокировать синтез ДНК, но так или иначе резистентных к удалению, таких как боран- или тиозамещенных альфа фосфатных вариантов существующих NRTI. Аналогичным образом можно конструировать варианты существующих NRTI для возвращения на место увеличенной/терминированной матрицы/праймера способом без удаления, как показано при помощи низкой способности к вырезанию индуцированных 3 ТС мутантов M184I/V. 3. Применение ингибиторов на основе динуклеотидтетрафосфатов для обеспечения двойного связывания в N- и Р-участках. Каждый из этих трех предложенных подходов для предупреждения механизмов резистентности кNRTI с высвобождением праймера подвергают критике за различные теоретические недостатки. Например, в первом подходе связывания АТФ не требуется для нормальных функций ОТ. Таким образом, профилактические средства, основанные на ингибировании АТФ или связывании пирофосфата посредством конкурентного связывания или блокирования, не будут предотвращать развитие резистентности, так как форма подразумеваемого вируса не будет подвергаться опасности при помощи подобных средств. Другими словами, резистентные мутанты возникнут без эволюционных издержек. Избыточное количество АТФ, присутствующее в нормальных лимфоцитах, также ставит под сомнение разумное объяснение этого подхода. Во втором предложенном подходе кажется вероятным, что боран- или тиозамещенные альфа фосфатные аналоги различали бы характерные резистентные мутанты, как было показано с 3 ТС и FTC, и продуцировали резистентные мутанты ВИЧ. Третий предложенный подход ограничен потребностью в понимании фармакокинетики в клеткемишени больших и сильно заряженных динуклеотидтетрафосфатных частиц. Это станет серьезной фармацевтической проблемой и проблемой доставки лекарственного средства. Примечательно, что каждый из подходов Serafaniano, включая 1 подход, который по своей сущности не является противовирусным, но предполагает совместное введение обычного NRTI, основан на вариантах существующего поколения NRTI. Таким образом, соединения, у которых отсутствует 3'гидроксильная группа и поэтому действующих, как требуют терминаторы цепи. В противоположность обсуждавшимся выше "классическим" NRTI (т.е. соединениям, не имеющим 3'-гидроксильной группы), Ohrui et al. (J Med Chem (2000) 43, 4516-4525, которая включена сюда в полном объеме в качестве ссылки) описывают 4'-С-этинильные ингибиторы ВИЧ Данные соединения сохраняют 3'-гидроксильную группу, но все-таки проявляют активность против ВИЧ-1, включая обычный характерный MDR штамм, несущий мутации A62V, V75L, F77L, F116Y иQ151M. Предполагали, что механизм действия осуществляется посредством аффинности к нуклеозидной фосфорилирующей киназе. Однако также наблюдали, что данные соединения могут функционировать-6 011039 как терминаторы цепи ДНК, благодаря их свойству неопентилового спирта и серьезного стерического несоответствия соседнего цис-4'-заместителя, которые приводили к сильно сниженной реактивности 3'гидроксила.Kodama et al. (Antimicrob Agents Chemother (2001) 1539-1546, которая включена сюда в полном объеме в качестве ссылки) описывают очень похожую серию соединений, несущих 4'-С-этинильную группу рядом с сохраненной 3'-гидроксильной группой, которые были исследованы в клеточной культуре с дополнительными резистентными штаммами ВИЧ. Так как Kodama et al. не получали трифосфатов их соединений, они не могли объяснить механизм действия, но из различных косвенных наблюдений сделали вывод, что соединения в самом деле действуют как NRTI. Позднее Kodama et al. сообщали (abstract 388T, 2003 9th Conference on Retroviruses и Opportunistic Infections, который включен сюда в полном объеме в качестве ссылки), что при селективном воздействии их 4-С-этинилнуклеозида in vitro обнаружен важный резистентный ВИЧ, несущий локализованные в каталитической области ОТ мутации T165I и M184V. Этот мутантный фенотип, очевидно, является характерным типом мутации и обладает высокой перекрестной резистентностью к 3 ТС. Таким образом, связывали стерическое несоответствие, блокирующее включение 4-С-этинилнуклеозида. Это было определено 3 ТС ингибиторным механизмом и поэтому почти наверняка он является характерным механизмом резистентности. В связи с этим кажется маловероятным, что соединения Kodama обеспечат доставку к целевым мутантам, облегчающим высвобождение праймера (опосредованное АТФ или пирофосфатом удаление).Chen et al. (Biochemistry (1993) 32: 6000-6002, которая включена сюда в полном объеме в качестве ссылки) проводили обширные исследования механизма на структурно родственных сериях соединений,несущих на 4' азидогруппуChen показывает,что ОТ эффективно включает два следующих подряд 4'азидотимидинмонофосфатных нуклеотида, которые прекращают элонгацию цепи. Кроме того, ОТ также способна к включению первого 4'-азидотимидинмонофосфата, затем нативного dNTP, а после этого второго 4'-азидотимидинового нуклеотида, который также приводил к обрыву цепи. Отмечают, что оба этих механизма приводили к тому, что 4'-азидотимидинмонофосфат располагался на терминированном праймерном конце ДНК, представляя собой ингибиторный механизм, очень напоминающий существующиеNRTI. Также было очевидно, что каждая из клеточных (т.е. невирусных) полимеразиспособна включать в появляющуюся цепь ДНК хозяина один, но не два 4'-азидонуклеотида. Затем эти клеточные полимеразы обеспечивали элонгацию цепи ДНК хозяина с дополнительными нативными dNTP и, таким образом, в гены ДНК хозяина навсегда вставляли нуклеотид NRTI. Данные соединения не были исследованы на людях, так как неправильное включение ненативных нуклеотидов при помощи клеточных ферментов имеет очевидные канцерогенезные последствия. Аналогично, фармацевтическая разработка Kodama, соответствующая 4'-С-этинильным соединениям, была остановлена, предположительно из-за высокой токсичности у высших организмов. В ЕР 341911 описывается большое семейство 3'-Сгидроксиметилнуклеозидов формулы и предлагается их применение преимущественно против герпесвирусов, таких как CMV, а также против ретровирусов. В WO 92/06201 также раскрывается аналогичное семейство соединений и показаний. В US 5612319 (который включен сюда в полном объеме в качестве ссылки) показана ретровирусная активность 2'-3'-дидезокси-3'-С-гидроксиметилцитозина против ВИЧ-1IIIB дикого типа и обезьяньего эквивалента SIV-1 на модели острой ВИЧ-инфекции яванских макак. В данной публикации предлагается применение соединения в качестве дополнительного средства профилактики, особенно против повреждений, вызванных уколом иглы. Дополнительная профилактика предполагает, что людям срочно вводят активный ингредиент, как, например, медицинскому персоналу, кто нечаянно уколол себя иглой от шприца, потенциально инфицированного ВИЧ. Для обеспечения быстрого введения соединения по понятным причинам потрясенному медицинскому работнику, оснащенные пружиной шприцы для самостоятельного применения, такие как применяемые для антидотов при химической и биологической войне, представляют собой предпочтительный путь введения. Цель дополнительной профилактики состоит в том, чтобы препятствовать инфекции укореняться вместо того, чтобы лечить продолжающуюся инфекцию. По существу, предполагают, что лечение следует применять в течение короткого периода времени, как, например, 24-48 ч, используя чрезвычайно высокие дозы соединения. В данной публикации указано, что из-за дискретного интервала времени введения кратковременная токсичность приемлема, так как данным соединением пытаются предотвратить-7 011039 неизлечимое заболевание. Описанный в US 5612319 способ дополнительной профилактики никогда не исследовали на людях по сведениям авторов 2',3'-дидезокси-3'-С-гидроксиметилцитозин вообще никогда не вводили людям. В 1994 г., когда была подана представленная как US 5612319 заявка, полирезистентный ВИЧ, как это известно в настоящее время, не возникал в какой-либо убедительной форме. Существующий в настоящее время полирезистентный ВИЧ имеет высвобождающие праймер мутации, индуцированные и накапливавшиеся в течение многих лет селективного воздействия терапии NRTI. Другими словами, существующие во время предоставления этих патентов ВИЧ и особенно ОТ структурно и по механизмам действия сильно отличались от существующих в настоящее время вирусов. Краткое описание изобретения Настоящее изобретение относится к способу лечения пациента с ВИЧ, где ОТ ВИЧ несет по меньшей мере одну высвобождающую праймер мутацию, которая позволяет вырезать из возникающей цепи ДНК обрывающий существующую цепь нуклеозид- или нуклеотидфосфат при помощи опосредованного АТФ или пирофосфатом удаления. Способ включает в себя введение пациенту эффективного количества 2',3'-дидезокси-3'-С-гидроксиметилцитозина или его соли. Еще один вариант осуществления изобретения относится к способу ингибирования появления или распространения высвобождающих праймер мутаций ВИЧ, способных удалять обрывающий цепь нуклеотид NRTI, включенный в комплекс праймер/матрица ВИЧ, где удаление осуществляется АТФзависимым или зависимым от пирофосфата механизмом вырезания. Способ включает в себя одновременное или последовательное введение инфицированному ВИЧ индивидууму эффективного количества 2',3'-дидезокси-3'-С-гидроксиметилцитозина и по меньшей мере одного терминатора цепи NRTI, который индуцирует высвобождающие праймер мутанты. Согласно настоящему изобретению также предусматривается применение 2',3'-дидезокси-3'-Сгидроксиметилцитозина или его соли для производства лекарственного средства для лечения ВИЧинфекции, где обратная транскриптаза ВИЧ несет по меньшей мере одну мутацию, которая позволяет вырезать из возникающей цепи ДНК обрывающий существующую цепь нуклеозид- или нуклеотидфосфат при помощи опосредованного АТФ или пирофосфатом удаления. Также предоставляется 2',3'-дидезокси-3'-С-гидроксиметилцитозин или его соль для применения при лечении ВИЧ-инфекции, где обратная транскриптаза ВИЧ несет по меньшей мере одну мутацию,которая позволяет вырезать из возникающей цепи ДНК обрывающий существующую цепь нуклеозидили нуклеотидфосфат при помощи опосредованного АТФ или пирофосфатом удаления. Кроме того, предусматривается применение 2',3'-дидезокси-3'-С-гидроксиметилцитозина или его соли вместе по меньшей мере с одним терминатором цепи NRTI в качестве активных ингредиентов для производства лекарственного средства для одновременного или последовательного введения указанных активных ингредиентов для ингибирования возникновения или распространения мутантов ВИЧ у инфицированного ВИЧ индивидуума, где указанные мутанты способны удалять обрывающий цепь нуклеотидNRTI, включенный в комплекс праймер/матрица ВИЧ, причем удаление обеспечивается АТФ-зависимым или зависимым от пирофосфата механизмом удаления. Также предоставляется 2',3'-дидезокси-3'-С-гидроксиметилцитозин или его соль вместе по меньшей мере с одним терминатором цепи NRTI в качестве активных ингредиентов для применения для одновременного или последовательного введения указанных активных ингредиентов для ингибирования возникновения или распространения мутантов ВИЧ у инфицированного ВИЧ индивидуума, где указанные мутанты способны удалять обрывающий цепь нуклеотид NRTI, включенный в комплекс праймер/матрица ВИЧ, причем удаление обеспечивается АТФ-зависимым или зависимым от пирофосфата механизмом удаления. Если желательно, в применениях и способах по изобретению 2',3'-дидезокси-3'-Сгидроксиметилцитозин можно использовать в форме его пролекарства, высвобождающего in vivo 2',3'дидезокси-3'-С-гидроксиметилцитозин или его 5'-монофосфат. Не желая ограничиваться этим предложенным механизмом, авторы предполагают, что 2',3'дидезокси-3'-С-гидроксиметилцитозин фосфорилируется в соответствующий 5'-трифосфат клеточными ферментами. Сильно мутировавшая ОТ полирезистентного ВИЧ, в частности, связанный с высвобождением праймера мутант ОТ, включает в возникающую цепь ДНК данный трифосфат в виде 5'-(2',3'дидезокси-3'-С-гидроксиметилцитозин)монофосфата. Обычные NRTI действуют как терминаторы существующей цепи, обрывая синтез ДНК в N-участке,и, таким образом, подтверждая описанный выше опосредованный АТФ или пирофосфатом механизм высвобождения (вырезания) праймера, присущий только полирезистентному ВИЧ. Напротив, представленные здесь данные предполагают, что 5'-(2',3'-дидезокси-3'-С-гидроксиметилцитозин)монофосфат не действует как терминатор существующей цепи, но скорее позволяет дополнительному остатку ковалентно связываться с 3'-гидроксиметильной группой 5'-(2',3'-дидезокси-3'-С-гидроксиметилцитозин)монофосфата. Затем он способствует ОТ претерпевать необходимое трансформационное изменение для ее переноса в Р-участок для следующего цикла полимеризации. Предварительный результат, основанный на представленной ниже последовательности матрицы, предполагает, что данный прикрепленный конце-8 011039 вой остаток представляет собой нативный нуклеотид вместо дополнительного 5'-(2',3'-дидезокси-3'-Сгидроксиметилцитозин)монофосфата. Важно, что результат, полученный с применением способов по данному изобретению и представленный ниже, предполагает, что последний включенный нуклеотид не-2',3'-дидезокси-3'-Сгидроксиметилцитозин не доступен для дальнейшего присоединения нуклеотидов мутировавшей обратной транскриптазой. Таким образом, обрыв цепи обнаруживает возникновение одного основания послеNRTI по изобретению, а не в NRTI. Кроме того, после применения соединения по изобретению оказывается, что ОТ успешно перемещается в Р-участок, чтобы связать следующий поступающий нуклеотид. Этот результат предполагает, что соединение по изобретению в сочетании с мутировавшей ОТ, связанной с высвобождением праймера, обеспечивает вид обрыва цепи, который не доступен индуцированному АТФ- или пирофосфатом высвобождению. В результате, заявленный способ обеспечивает эффективное лечение инфекций ВИЧ, не отвечающих на существующие схемы лечения. Таким образом, обсуждавшийся выше ингибиторный механизм существенно отличается от механизма обрыва цепи 4'-замещенных нуклеозидов Chen et al. (см. выше), который предусматривает включение нескольких нуклеотидов после включения 4-замещенного соединения. Во-первых, механизм Chen резко увеличивает риск "прочитывания". Таким образом, ДНК-полимераза продолжает наращивать кодирующую цепь и продолжает добавлять закодированные остатки для нормального стоп-кодона, тем самым, неправильно вставляя неправильный нуклеозид в цепь ДНК. Однако противовирусная эффективность может быть потеряна, если цепь вирусной ДНК сконструирована при помощи вирусной полимеразы (т.е. ОТ), так как прочитываемая конструкция все еще может являться жизнеспособной, несмотря на неправильно включенный 4'-замещенный нуклеозид. Более того, как описывает Chen, если 4'замещенный нуклеозид прочитывается клеточной полимеразой (т.е. полимеразой хозяина), то полученная конструкция в дальнейшем будет представлять собой тератоген и резко повышать риск клеточного повреждения и злокачественного новообразования. Кроме того, соединения Chen требуют присоединения второго 4'-замещенного нуклеотида, либо непосредственно рядом с первым, неправильно вставленным 4'-замещенным нуклеотидом (т.е. Х-Х), либо отделенного одним нативным нуклеотидом (т.е. X-N-X). Фактически это означает, что нуклеотид в последнем положении праймерного конца является ненативным (т.е. лекарственным) нуклеотидом. Это является аналогичной ситуацией случаю терминации цепи классических NRTI (т.е. NRTI, не имеющих 3 гидроксильную группу). Таким образом, нуклеотид NRTI также находится в последнем положении праймерного конца, где, как обсуждалось выше, он доступен для опосредованного АТФ или пирофосфатом удаления. Для действия 4'-замещенного нуклеотида Chen в качестве эффективного ингибитора ОТ необходимы множественные повторы. Следовательно, эффективность лекарственного средства зависит от последовательности считывающей цепи. Например, если соединение Chen представляет собой аналог тимидина, оно будет обладать наилучшей аффинностью, если считывающая цепь имеет последовательность АА или A-N-A. Таким образом, лекарственное средство было бы целесообразным и эффективным в терминации синтеза ДНК. Однако если последовательность считывающей цепи не содержит многочисленных повторов последовательности АА или A-N-А, то лекарственное средство Chen будет в меньшей степени способным терминировать синтез ДНК при данной концентрации. Поскольку дуплет АА или триплет AN-A встречается в геноме намного реже, чем синглет А, лекарственное средство Chen будет намного менее эффективным, чем другие NRTI, которые не имеют необходимых множественных повторов. Подвергаемый лечению или профилактике по изобретению полирезистентный ВИЧ обычно имеет ОТ, несущую генетический профиль, включающий в себя по меньшей мере одно из: где XX представляет собой вставку в последовательность ОТ двух любых природных аминокислот,представляет собой аминокислотную делецию в кодоне 67. Предполагают, что хотя указанные выше 4 генетических профиля представляют собой необходимую основу удаления ускользающего от лекарственного средства фенотипа, очевидно, что мутанты, подверженные лечению или профилактике при помощи способа по изобретению, как правило, содержат дополнительные мутации в гене ОТ и где-либо еще, часто по меньшей мере три мутации в гене ОТ. Как правило, но не всегда, группа М 41, D67, L210 и Т 215 часто включает в себя M41L, D67N,L210W и T215Y или T215F. Необязательно, перечисленные выше группы могут дополнительно включать в себя по меньшей мере одну дополнительную мутацию в положении Е 44, K70, V118, Н 208, R211K, L214, K219 или G333. Перечисленные выше группы могут дополнительно включать в себя по меньшей мере одну дополнительную мутацию в положении Т 69, Е 203, L210, D218, Н 221, D223 или L228. Как правило, но не всегда, группа D67, K70 и K219 включает в себя D67N, K70R и K219Q или аK219 Е. Необязательно, группа D67, K70 и K219 может дополнительно включать в себя по меньшей мере одну дополнительную мутацию в положении М 41, Е 44, V118, Н 208, L210, R211K, L214, Т 215 или G333. Кроме того, группа D67, K70 и K219 необязательно дополнительно включает в себя по меньшей Т 69, Е 203, L210, D218, Н 221, D223 или L228. мере одну дополнительную мутацию в положении Как правило, но не всегда группа T69S-XX может дополнительно содержать по меньшей мере одну дополнительную мутацию в положении М 41, Е 44, D67, K70, V118, Н 208, L210, R211K, L214, Т 215, K219 или G333. Необязательно, группа T69S-XX может дополнительно содержать по меньшей мере одну дополнительную мутацию в положении Т 69, Е 203, L210, D218, Н 221, D223 или L228. Как правило, но не всегда, группа может дополнительно содержать по меньшей мере одну дополнительную мутацию в положении М 41, Е 44, D67, K70, V118, Н 208, L210, R211K, L214, Т 215, K219 или G333. Необязательно, группа может дополнительно содержать по меньшей мере одну дополнительную мутацию в положении Т 69, T69S+XX, Е 203, L210, D218, Н 221, D223 или L228. Необязательно, обратная транскриптаза может дополнительно содержать по меньшей мере одну характерную мутацию в положении K65, L74, М 184 или Q151, особенно K65R, L74V, или M184V, илиQ151M. Обычно группа характерных мутаций может быть связана по меньшей мере с одной дополнительной мутацией в положении А 62, V75, F77, Y115 или F116. Подвергающиеся лечению по изобретению штаммы ВИЧ являются полирезистентными штаммами ВИЧ, ОТ которых имеет мутации, способствующие АТФ- или пирофосфат-опосредованному высвобождению праймера (удалению) из цепи, терминированной нуклеотидами NRTI, и возникшие у пациента в результате предшествующего лечения ВИЧ при помощи по меньшей мере одного противовирусного средства, выбранного из зидовудина (AZT, ZDV), ставудина (d4T), зальцитабина (ddC), диданозина (ddI),абакавира, (ABC), ламивудина (3 ТС), эмтрицитабина (FTC), адефовира (ADV), энтакавира (BMS 200475), аловудина (FLT), дизопроксилфумарата тенофовира (TNF), амдоксавира (DAPD), D-d4FC (DPC817), -dOTC (SPD754), SPD-756, рацивира, D-FDOC или GS7340. С другой стороны, штаммы ВИЧ представляют собой штаммы, обнаруженные у пациентов, получивших такой резистентный или полирезистентный штамм ВИЧ непосредственно или опосредованно от другого человека, у которого резистентный или полирезистентный штамм ВИЧ образовался при длительном лечении при помощи по меньшей мере одного противовирусного средства из перечисленного выше списка противовирусных средствNRTI. Часто полирезистентные штаммы ВИЧ содержат по меньшей мере три мутации в вирусной ОТ по сравнению со штаммом дикого типа. Таким образом, очевидно, что способы и композицию по изобретению можно применять в качестве дополнения к существующим противовирусным способам лечения, таким как HAART, или, в некоторых случаях, как неотложную терапию или терапию по жизненным показаниям. Как правило, это случай,когда полирезистентный ВИЧ индуцирован у конкретного пациента, при более ранней противовирусной терапии лекарственным средством того же пациента в прошлом. С другой стороны, способы и композиции по изобретению представляют терапию первого ряда, как правило, для пациентов, у которых наблюдалась первичная ВИЧ-инфекция с уже мутировавшим полирезистентным штаммом. Такие полирезистентные штаммы ВИЧ, имеющие высвобождающие праймер мутации ОТ, способствующие опосредованному АТФ- или пирофосфатом удалению из цепи терминирующих нуклеотидов NRTI, часто индуцируют перечисленные ниже противовирусные лекарственные средства: зидовудин, ламивудин или комбинированные лекарственные формы комбивир или тризивир; ламивудин, абакавир или комбинированная лекарственная форма эпзиком; тенофовир, эмтрицитабин или комбинированная лекарственная форма трувада. Так как данные лекарственные средства часто индуцируют такие полирезистентные штаммы ВИЧ,этот список лекарственных средств не является исключительным. Следовательно, очевидно, что 2',3'-дидезокси-3'-С-гидроксиметилцитозин вводят с целью предотвращения появления одного или нескольких полирезистентных штаммов ВИЧ с высвобождающими праймер мутациями ОТ, способствующими опосредованному АТФ- или пирофосфатом удалению из цепи терминирующих нуклеотидов NRTI. Эту профилактическую меру проводят, даже если одновременно вводят индуцирующие такие мутации лекарственные средства NRTI. Третий аспект изобретения относится к фармацевтической композиции в стандартной лекарственной форме или комбинированной лекарственной форме, включающей в себя 2',3'-дидезокси-3'-Сгидроксиметилцитозин и по меньшей мере один терминатор цепи NRTI, где после продолжительного введения доз с NRTI возникают высвобождающие праймер мутации ОТ ВИЧ, способствующие зависимому от АТФ или пирофосфата вырезанию присоединенного монофосфата NRTI из 3'-конца комплекса праймер/матрица и дающие возможность продолжить синтез ДНК. Предпочтительные варианты осуществления фармацевтической композиции по изобретению и способ по изобретению включают в себя варианты осуществления и способ, где NRTI выбирают из зидову- 10011039 дина (AZT, ZDV), ставудина (d4T), зальцитабина (ddC), диданозина (ddI), абакавира (ABC), ламивудина(3TC), эмтрицитабина (FTC), адефовира (ADV), энтакавира (BMS 200475), аловудина (FLT), дизопроксилфумарата тенофовира (TNF), амдоксавира (DAPD), D-d4FC (DPC-817), -dOTC (SPD754), SPD-756,рацивира, D-FDOC или GS7340 и их сочетаний. В частности, предпочтительные варианты осуществления включают в себя варианты осуществления, где NRTI выбирают из зидовудина, ставудина, диданозина, ламивудина, абакавира, тенофовира,эмтрицитабина или/и их сочетаний. В противоположность описанным вUS 5612319 способам,2',3'-дидезокси-3'-Сгидроксиметилцитозин по изобретению вводят пациенту в относительно низкой дозе и с расчетом на непрерывное и продолжительное противовирусное лечение. Данная указанная дозировка схемы лечения обеспечивает определенные концентрации лекарственного средства и избегает токсичности в отличие от дополнительного профилактического лечения, где кратковременная токсичность приемлема. В US 5612319 предлагаются дозировки 2',3'-дидезокси-3'-С-гидроксиметилцитозина приблизительно 10-25 мг/кг/сутки для дополнительного профилактического лечения человека, а в экспериментах на обезьянах использовали 30 мг/кг/сутки. Однако по настоящему изобретению 2',3'-дидезокси-3'-С-гидроксиметилцитозин вводят в концентрации менее 1 мг/кг/сутки, предпочтительно в диапазоне 0,05-0,5 мг/кг/сутки и наиболее предпочтительно менее 0,1 мг/кг/сутки. Соответствующая дозировка зависит от показаний и пациента и легко определяется обычным метаболизмом лекарственного средства животного и фармакокинетикой (DMPK) или клиническими испытаниями и in silico диагностическим программным обеспечением. Стандартная дозировка или совместная дозировка фармацевтических композиций по изобретению соответствует количествам 2',3'-дидезокси-3'-С-гидроксиметилцитозина, как правило, пересчитанным на взрослого человека 60 кг или 75 кг, и необязательно разделена на один, два или три приема по QD, BID или TID схеме приема. Дозировки пересчитывают в большую сторону, если пролекарство применяют для того, чтобы учесть дополнительную массу пролекарства, и пересчитывают в меньшую сторону, принимая во внимание повышенную биодоступность. Если терапевтическая доза находится в диапазоне 0,05-0,5 мг/кг/сутки, то клиническая доза QD на человека в сутки может составлять 3-30 мг для взрослого человека 60 кг или 3,75-37,5 мг для взрослого человека 75 кг. Дозировка и ограничения введения дополнительного обычного NRTI в смешанной стандартной дозировке фармацевтической композиции аспекта по изобретению может требовать QD, BID или TID дозирования. Формы совместных дозировок включают в себя отдельные упаковки, содержащие блистерные упаковки 2',3'-дидезокси-3'-С-гидроксиметилцитозина или его пролекарства и дополнительный NRTI, как указано выше. Блистерная упаковка может содержать блистеры для обоих компонентов на одном блистерном листе (обычно с обозначением, облегчающим правильное введение соответствующего количества таблеток/капсул каждого средства, например, 2 таблетки одного лекарственного средства и 1 таблетку другого). Альтернативно, форма совместной дозировки представляет собой упаковку с некоторым количеством вложенных блистерных листов, где каждое из лекарственных средств имеет свой собственный блистерный лист. Принятое выше во внимание положение, что 2',3'-дидезокси-3'-С-гидроксиметилцитозин в контексте ОТ ВИЧ, мутировавшей таким образом, чтобы обеспечить вырезание терминатора цепи опосредованным пирофосфатом путем, работает при помощи отличного от обрывающих цепь нуклеозидов механизма действия, может быть осуществлено на практике введением исходного соединения 2',3'-дидезокси 3'-С-гидроксиметилцитозина или введением пролекарств, высвобождающих 2',3'-дидезокси-3'-Сгидроксиметилцитозин in vivo. В одной группе пролекарств 2',3'-дидезокси-3'-С-гидроксиметилцитозина используется модификация основания, как показано у Mauldon et al. Biorg Med Chem 6 (1998) 577-585. Обычные пролекарства модифицированного основания имеют формулу где Rcon независимо представляет собой Н или обычный фармацевтически приемлемый сложный эфир;R6 представляет собой Н; или R5 и R6 вместе обозначают имин =CR8R8;R8 и R8' независимо представляют собой Н, C1-С 6 алкил, С 0-С 3 алкилциклил; или R8 представляет собой Н и R8' представляет собой -NR9V9';R9 и R9' независимо представляют собой Н, C1-С 6 алкил, С 0-С 3 алкилциклил; или R9 и R9' вместе с атомом N, к которому они присоединены, обозначают насыщенное 5- или 6 членное кольцо;n представляет собой 1, 2 или 3; Обычные фармацевтически приемлемые сложные эфиры включают в себя сложные алкиловые эфиры, такие как ацетил, пропионил, бутирил, пивалоил, пальмитил, стеарил и т.п. и сложные ариловые эфиры, такие как бензоил. Другие обычные фармацевтически приемлемые сложные эфиры включают в себя сложные эфиры аминокислот, таких как L-валил, L-изолейцин или L-фенилаланин. Примеры пролекарств модифицированного основания 2',3'-дидезокси-3'-С-гидроксиметил у Mauldon включали в себя имины-N=CHNR,где NR представляет собой N(CH3)2, N(iPr)2, N(Pr)2, N(CH2)4, N(CH2)5, N(CH2)6, N(CH2CH2)2O. Кроме того, пролекарства модифицированного основания Mauldon включают в себя амиды цитозинового азота где Rcon представляет собой Н или обычный фармацевтически приемлемый сложный эфир,Ra представляет собой NH(Boc-L-валил), NH-Boc-L-Phe, L-валил, L-Phe; или Ra представляет собой C(=O)CH3, COPh, COC(CH3)3 и т.п. Пролекарства модифицированного основания, такие как Mauldin, могут иметь преимущество сниженной чувствительности к клеточным и физиологическим цитозиндезаминазам, но, принимая во внимание многие реакции трансгликозилирования, происходящие в человеческих клетках, необходимо убедиться в гарантии того, что модифицированное основание не трансгликозилировано на нативном рибозиде и не включено в человеческую ДНК с канцерогенными или тератогенными проявлениями. Предпочтительные группы пролекарств 2',3'-дидезокси-3'-С-гидроксиметилцитозина, приемлемые по изобретению, представляют собой 3'- и/или 5'-сложные эфиры пролекарств формулы где один из R и R' представляет собой часть пролекарства с частичной структурой где R1 представляет собой Н или C1-C18 неразветвленный или разветвленный алкил;R3 представляет собой Н или L-валиловый или L-изолейциловый сложный эфир; а оставшийся из R и R' представляет собой Н или идентичную часть пролекарства; или их фармацевтически приемлемую соль. Многие из данных сложных эфиров пролекарств или 2',3'-дидезокси-3'-С-гидроксиметилцитозина представляют собой новые соединения и создают дополнительный аспект изобретения. Один вариант осуществления сложных эфиров пролекарств по изобретению включает в себя соединения формулы V, где R1 представляет собой C1-C18 неразветвленную или разветвленную цепь алкила, aR2 представляет собой Н. Характерные алкильные части включают в себя обозначающие сложные эфиры октаноил (С 8, включая кетон С), деканоил (С 10), лаурил (С 12), миристоил (C14), пальмитоил (C16), стеароил (C18) или эйкозаноил (С 20). Предпочтительные алкильные части включают в себя метил (т.е. ацетил),этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил (т.е. пивалоил), н-пентил, 1 метилбутил, 2,2-диметилбутил, 2-метилпентил, 2,2-диметилпропил, н-гексил и т.п. Пролекарство может иметь сложный эфир на R (т.е. 5'-О-сложный эфир) или R' (т.е. 3'-О-сложный эфир) или на обоих (бис 3',5'-О-сложный эфир). Для облегчения синтеза и анализа предпочтительно, но обязательно, чтобы сложные эфиры на 3' и 5' представляли собой идентичные части пролекарства. Дополнительный вариант осуществления сложных эфиров пролекарств по изобретению включает в себя эфиры, где R1 представляет собой низший алкил, главным образом метил, и R2 представляет собойNHRb, где Rb представляет собой остаток алифатической L-аминокислоты, выбранной из аланина, валина, лейцина, трет-лейцина, изолейцина и норлейцина, главным образом, где R2 представляет собой NH-L- 12011039 валил или NH-L-изолейцил. В данном варианте осуществления R1 имеет соответствующую L-молочной кислоте стереохимию. Пролекарство может нести этот сложный эфир части пролекарства на R (т.е. 5'-Осложный эфир) или R' (т.е. 3'-О-сложный эфир) или на обоих (бис-3',5'-О-сложный эфир). Для облегчения синтеза и анализа предпочтительно, но обязательно, чтобы сложные эфиры на 3' и 5' представляли собой идентичные части пролекарства. Дополнительные сложные эфиры пролекарств для применения в изобретении включают в себя эфиры, где R1 представляет собой разветвленную цепь С 3-С 4 алкила и R2 представляет собой NH2. Боковая цепь R1 предпочтительно имеет стереохимию L-аминокислоты, такой как L-валин, L-лейцин, Lизолейцин или L-трет-лейцин. Пролекарство может нести сложный эфир на R (т.е. 5'-О-сложный эфир) или R' (т.е. 3'-О сложный эфир) или на обоих (бис-3',5'-О-сложный эфир). Для облегчения синтеза и анализа предпочтительно, но необходимо, чтобы сложные эфиры на 3' и 5' представляли собой идентичные части пролекарства. Предпочтительные пролекарства включают в себя 5'-О-L-валил-2',3'-дидезокси-3'-С-гидроксиметилцитозин; 5'-О-L-изолейцил-2',3'-дидезокси-3'-С-гидроксиметилцитозин; 5'-O-ацетил-2',3'-дидезокси-3-С-гидроксиметилцитозин; 5'-O-пропионил-2',3'-дидезокси-3-С-гидроксиметилцитозин; 5'-O-бутирил-2',3'-дидезокси-3-С-гидроксиметилцитозин; 5'-O-пивалоил-2',3'-дидезокси-3-С-гидроксиметилцитозин; 2',3'-дидезокси-3-С-(ацетилоксиметил)цитозин; 2',3'-дидезокси-3-С-(пропионилоксиметил)цитозин; 2',3'-дидезокси-3-С-(бутирилоксиметил)цитозин; 2',3'-дидезокси-3-С-(пивалоилоксиметил)цитозин; 2',3'-дидезокси-3-С-(L-валилоксиметил)цитозин; 2',3'-дидезокси-3-С-(L-изолейцилоксиметил)цитозин; 5'-О-L-валил-2',3'-дидезокси-3'-C-L-валилоксиметилцитозин; 5'-О-L-изолейцил-2',3'-дидезокси-3'-C-L-изолейцилоксиметилцитозин; 5'-O-ацетил-2',3'-дидезокси-3-С-ацетилоксиметилцитозин; 5'-O-пропионил-2',3'-дидезокси-3-С-пропионилоксиметилцитозин; 5'-O-бутирил-2',3'-дидезокси-3-С-бутирилоксиметилцитозин; 5'-O-пивалоил-2',3'-дидезокси-3-С-пивалоилоксиметилцитозин; и их фармацевтически приемлемые соли. Особенно предпочтительные пролекарства включают в себя 5'-О-[2-S-(L-валилокси)пропионил]-2',3'-дидезокси-3-С-гидроксиметилцитозин; 2',3'-дидезокси-3'-С-[2-S-(L-валилокси)пропионил]оксиметилцитозин; 5'-O-пентаноил-2',3'-дидезокси-3-С-гидроксиметилцитозин; 2',3'-дидезокси-3'-С-пентаноилоксиметилцитозин; или 5'-О-пентаноил-2',3'-дидезокси-3-С-пентаноилоксиметилцитозин; или их фармацевтически приемлемые соли. Не желая ограничиваться теорией, авторы предполагают, что подобно другим нуклеозидным аналогам 2',3'-дидезокси-3-С-гидроксиметилцитозин внутриклеточно фосфорилируется клеточными киназами до 5'-монофосфата, который, в свою очередь, дополнительно фосфорилируется до дифосфата и трифосфата. Ди- и трифосфорилирующие киназы имеют тенденцию проявлять большую активность, чем первичная монофосфорилирующая киназа, особенно в некоторых типах клеток. Другими словами, монофосфорилирование теоретически может являться скорость-лимитирующей стадией. Следовательно, в некоторых условиях может быть целесообразным введение исходного соединения в готовой монофосфорилированной форме с целью обеспечения быстро продвигающегося фосфорилирования до трифосфата. Однако не просто переправить высокополярное лекарственное средство, такое как монофосфат нуклеозида, через клеточную мембрану. Однако существуют основы лекарственных средств, которые, как полагают, обеспечивают проникновение пролекарства внутрь клетки, которое гидролизируется in situ до монофосфата. Один такой подход проиллюстрирован фазой II пролекарства зидовудина-фозивудина тидоксила, в котором используют конъюгат липидного тиоэфира со сложным эфиром фосфата зидовудина. См., например, Girard в JAIDS 23 227-235 и патент США 5756711, патент США 5563257 и ЕР 545966. Аналогичная конструкция, примененная в 5'-монофосфат-2',3'-дидезокси-3'-С-гидроксиметилцитозине,представляет собой где алкил обычно представляет собой C8-C15 и n равно 0 (меркапто), 1 (тионил) или 2 (сульфонил). Предпочтительные значения включают в себя додецилмеркапто в сочетании с дециловым эфиром. В контексте изобретения пролекарство 2',3'-дидезокси-3'-С-гидроксиметилцитозина также включает в себя пролекарства 5'-монофосфата, внутриклеточно высвобождающие 2',3'-дидезокси-3-Сгидроксиметилцитозин-5'-О-фосфат. Настоящее изобретение включает в себя фармацевтически приемлемые соли, такие как соли органических кислот, особенно карбоновых кислот, включая, но не ограничиваясь ими, ацетат, трифторацетат, лактат, глюконат, цитрат, тартрат, малеат, малат, пантотенат, изетионат, адипат, альгинат, аспартат,бензоат, бутират, диглюконат, циклопентанат, глюкогептанат, глицерофосфат, оксалат, гептаноат, гексаноат, фумарат, никотинат, пальмоат, пектинат, 3-фенилпропионат, пикрат, пивалат, пропионат, тартрат,лактобионат, пиволат, камфорат, ундеканоат и сукцинат. Также включены соли органических сульфокислот, такие как метансульфонат, этансульфонат, 2-гидроксиэтансульфонат, камфорсульфонат, 2 нафталинсульфонат, бензолсульфонат, п-хлорбензолсульфонат и п-толуолсульфонат. Приемлемые соли также включают в себя соли неорганических кислот, такие как гидрохлорид, гидробромид, гидроиодид,сульфат, бисульфат, гемисульфат, тиоцианат, персульфат, фосфорной и сульфоновой кислот. Настоящее изобретение относится к активным средствам, представляющим собой гидраты, сольваты,комплексы и другие физические формы,высвобождающие 2',3'-дидезокси-3'-Сгидроксиметилцитозин in vivo. Хотя можно вводить активное вещество отдельно, предпочтительным является его присутствие как части фармацевтической композиции. Такая композиция будет включать в себя активное вещество 2',3'дидезокси-3'-С-гидроксиметилцитозин вместе с одним или несколькими приемлемыми носителями/эксципиентами и необязательно другие терапевтические ингредиенты. Носитель(и) должен быть приемлемым в смысле совместного существования с другими ингредиентами композиции и не вредным для реципиента. Композиции включают в себя композиции, приемлемые для ректального, назального, местного(включая буккальное и сублингвальное), вагинального или парентерального (включая подкожное, внутримышечное, внутривенное и внутрикожное) введения. Предпочтительно композиция представляет собой композицию для перорального введения. Как правило, композиции могут быть представлены в стандартной лекарственной форме, например, таблетках и капсулах с замедленным высвобождением, и могут быть получены любыми способами, хорошо известными в области фармации. Такие хорошо известные способы включают в себя стадию введения активного вещества 2',3'дидезокси-3'-С-гидроксиметилцитозина в соединение с носителем. Как правило, композиции получают путем непрерывного и непосредственного введения активного вещества в соединение с жидкими носителями или измельченными твердыми носителями, или с теми и другими, и после этого придают форму продукту, если необходимо. Изобретение охватывает способы получения фармацевтической композиции, включающие в себя введение соединения 2',3'-дидезокси-3'-С-гидроксиметилцитозина или его фармацевтически приемлемой соли в соединение или в комплекс с фармацевтически приемлемым носителем или растворителем. Если получение фармацевтической композиции включает в себя тщательное перемешивание фармацевтических эксципиентов и активного ингредиента, находящегося в солевой форме,после этого часто является предпочтительным применение не основных по природе эксципиентов, т.е. кислых или нейтральных. Композиции для перорального применения по настоящему изобретению могут быть представлены в виде дискретных единиц, таких как капсулы, капсулы с оболочкой или таблетки, каждая из которых содержит предварительно установленное количество активного вещества. В качестве альтернативы, они могут быть представлены в виде порошка или гранул; в виде раствора или суспензии активного вещества в водном растворе или безводной жидкости, или в виде жидкой эмульсии масло-в-воде или жидкой эмульсии вода-в-масле, в виде пилюли и т.д. В отношении композиций для перорального введения (например, таблетки и капсулы) термин "приемлемый носитель" включает в себя наполнители, такие как обычные эксципиенты, например, связующие средства, такие как сироп, гуммиарабик, желатин, сорбит, трагакант, поливинилпирролидон (повидон), метилцеллюлоза, этилцеллюлоза, натрий-карбоксиметилцеллюлоза, гидроксипропилметилцеллюлоза, сахароза и крахмал; наполнители и носители, например, кукурузный крахмал, желатин, лактоза,сахароза, микрокристаллическая целлюлоза, каолин, маннит, дикальцийфосфат, хлорид натрия и альгиновая кислота; и скользящие вещества, такие как стеарат магния, стеарат натри и другие стеараты метал- 14011039 лов, стеарат глицерина, стеариновая кислота, кремнийорганическая жидкость, тальк, воски, масла и коллоидный диоксид кремния. Также можно использовать ароматизирующие вещества, такие как мята перечная, масло гаультерии, вишневая отдушка или т.п. Для создания легко идентифицируемой лекарственной формы может быть желательным добавление красителя. Таблетки также можно покрывать с помощью хорошо известных в данной области способов. Таблетка может быть получена прессованием или формованием, необязательно с одним или несколькими дополнительными ингредиентами. Прессованные таблетки могут быть получены прессованием в подходящем аппарате активного вещества в сыпучей форме, такой как порошок или гранулы, необязательно смешанного со связующим, скользящим веществом, инертным разбавителем, консервантом,поверхностно-активным или диспергирующим веществом. Формованные таблетки могут быть получены формованием в подходящем аппарате смеси порошкообразного соединения, смоченного инертным жидким разбавителем. Таблетки необязательно могут быть с покрытием или с насечкой и могут быть составлены таким образом, чтобы обеспечить медленное или контролируемое высвобождение активного вещества. Другие подходящие для перорального применения композиции включают в себя пастилки, содержащие активное вещество в ароматизированной основе, обычно сахарозе и гуммиарабике или трагаканте; пластинки, содержащие активное вещество в инертной основе, такой как желатин и глицерин, или сахароза и гуммиарабик; и жидкости для полоскания рта, содержащие активное вещество в приемлемом жидком носителе. 2',3'-Дидезокси-3-С-гидроксиметилцитозин синтезируют с использованием обычной химии нуклеозидов, как описано в US 5612319, US 5473063, Svansson L. et al. in J. org. Chem (1991) Vol 56: 2993-2997 иBjrsne M. et al. in Tetrahedron, Vol 49: 8637-8644 (1993). Синтез пролекарств с модифицированным основанием и некоторые обычные 3' и 5' сложные эфиры описаны у Mauldin et al. Biiorg Med Chem 6 (1998) 577-585. Синтез 3' и 5' сложных эфиров обычно осуществляют взаимодействием нуклеозида (в необходимых случаях с основанием, N-защищенным обычной N-защитной группой) с кислотой функциональной группы пролекарства: совместно с обычным связующим реагентом или с активированным производным данного сложного эфира, таким как галогенангидриды, такие как хлорангидриды, и активированными сложными эфирами,включая, но не ограничиваясь ими, ангидриды, полученные из муравьиной и уксусной кислоты, ангидриды, полученные из галогенангидридов алкоксикарбоновой кислоты, такие как изобутилоксикарбонилхлорид и т.п., полученные из N-гидроксисукцинимида сложные эфиры, полученные из Nгидроксифталимида сложные эфиры, полученные из N-гидроксибензотриазола сложные эфиры, полученные из N-гидрокси-5-норборнен-2,3-дикарбоксамида сложные эфиры, полученные из 2,4,5 трихлорфенила сложные эфиры и т.п. Диапазон выбора 3' или 5' положений для соединений, содержащих одну функциональную группу пролекарства, обеспечивается применением больших защитных групп, например, как показано в WO 97/30051, или применением дифференциально выбираемых пар групп, защищающих гидроксил, как показано у Sanghvi et al. Synthesis 1994, 1163, Sanghvi et al. Tett Lett, vol. 35, p. 4697 (1994) и HalySanghviNucleosidesNucleotides, Vol 15, 1383 (1996). Известны многие пары дифференциально выбираемых защищающих гидроксилгрупп, например Озащитные группы, описанные у Greene, "Protective Groups In Organic Synthesis," (John WiLeySons, NewYork (1981. Таким образом, защитные группы для гидроксигруппы включают в себя эфиры, такие как метиловый эфир или замещенные метиловые эфиры, например метоксиметил (MOM), бензилоксиметил, третбутоксиметил, 2-метоксиэтоксиметил (MEM), 2,2,2-трихлорэтоксиметил, бис-(2-хлорэтокси)метил, 2(триметилсилил)этоксиметил, тетрагидропиранил (ТНР), 3-бромтетрагидропиранил, тетрагидротиопиранил, 4-метокситетрагидропиранил, 4-метокситетрагидротиопиранил S,S-диоксидо, тетрагидрофуранил и тетрагидротиофуранил. Этиловые эфиры включают в себя 1-этоксиэтил, 1-метил-1-метоксиэтил, 1(изопропокси)этил, 2,2,2-трихлорэтил и 2-(фенилселенил)этил. Другие эфиры включают в себя третбутил, аллил, циннамил, п-хлорфенил и бензиловые эфиры, такие как незамещенный бензил, пметоксибензил, о-нитробензил, п-нитробензил, п-галогенбензил и п-цианобензил. Другие эфиры включают в себя 3-метил-2-пиколил-N-оксидо, дифенилметил, 5-дибензосуберил, трифенилметил, альфанафтилдифенилметил, п-метоксифенилдифенилметил, п(п'-бромфенацилокси)фенилдифенилметил, 9 антрил, 9-(9-фенил)ксантенил, 9-(9-фенил-10-оксо)антрил (тритилон) и бензизотиазлил-S,S-диоксидо. Силиловые эфиры включают в себя триметилсилил (TMS), триэтилсилил, изопропилдиметилсилил, третбутилдиметилсилил (TBDMS), (трифенилметил)диметилсилил, трет-бутилдифенилсилил, метилдиизопропилсилил, метилди-трет-бутилсилил, трибензилсилил, три-п-ксилилсилил, триизопропилсилил и трифенилсилил. Альтернативные защищающие гидроксилгруппы включают в себя сложные эфиры, та- 15011039 кие как формиат, бензоилформиат, ацетат, хлорацетат, дихлорацетат, трихлорацетат, трифторацетат, метоксиацетат,трифенилметоксиацетат,феноксиацетат,п-хлорфеноксиацетат,2,6-дихлор-4 метилфеноксиацетат,2,6-дихлор-4-(1,1,3,3-тетраметилбутил)феноксиацетат,2,4-бис-(1,1-диметилпропил)феноксиацетат, хлордифенилацетат, п-(Р)-фенилацетат, 3-фенилпропионат, 3-бензоилпропионат,изобутират, моносукцинат, 4-оксопентаноат (левинулат), пивалоат, адамантоат, кротонат, 4 метоксикротонат, (Е)-2-метил-2-бутеноат (тиглоат) и бензоаты, такие как незамещенные или о(дибромметил)-, о-(метоксикарбонил)-, п-фенил-, 2,4,6-триметил-(мезитат) или п-(Р)-бензоаты, или альфа-нафтоат. Защищающие гидроксилкарбонатные группы включают в себя метил, этил, 2,2,2 трихлорэтил, изобутил, винил, аллил, циннамил, п-нитрофенил, бензилы, такие как незамещенные, пметокси-, 3,4-диметокси-, о-нитро- или п-нитробензилы, или S-бензилтиокарбонат. Прочие защищающие гидроксилгруппы включают в себя N-фенилкарбамат, N-имидазолилкарбамат, борат, нитрат, N,N,N,Nтетраметилфосфородиамидат и 2,4-динитрофенилсульфенат. Greene предоставляет обширные таблицы реакционной способности, чтобы облегчить выбор сопряженных пар различных защитных групп. Характерные защищающие гидроксилгруппы включают в себя группы в примерах и эфиры, такие как третбутиловый и другие низшие алкиловые эфиры, такие как изопропиловый, этиловый и особенно метиловый, бензиловый и трифенилметиловый; тетрагидропираниловые эфиры; замещенные этиловые эфиры,например 2,2,2-трихлорэтиловый; силиловые эфиры, например триметилсилиловый, третбутилдиметилсилиловый и трет-бутилдифенилсилиловый; и сложные эфиры, полученные взаимодействием гидроксильной группы с карбоновой кислотой, например ацетат, пропионат, бензоат и т.п. В случае необходимости функциональные группы в молекуле пролекарства, такие как NH, или нуклеозидное основание защищают и снимают защиту с использованием обычных способов воздействия,как показано, например, у Greene, "Protective Groups in Organic Synthesis" (John WileySons, New York,1981), которая включена сюда в качестве ссылки. N-защитные группы включают в себя ацильные группы, такие как формил, ацетил, пропионил, пивалоил, трет-бутилацетил, 2-хлорацетил, 2-бромацетил,трифторацетил, трихлорацетил, фталил, о-нитрофеноксиацетил, -хлорбутирил, бензоил, 4-хлорбензоил,4-бромбензоил, 4-нитробензоил и т.п.; сульфонильные группы, такие как бензолсульфонил, птолуолсульфонил и т.п., образующие карбамат группы, такие как бензилоксикарбонил, пхлорбензилоксикарбонил,п-метоксибензилоксикарбонил,п-нитробензилоксикарбонил,2 нитробензилоксикарбонил,п-бромбензилоксикарбонил,3,4-диметоксибензилоксикарбонил,4 метоксибензилоксикарбонил, 2-нитро-4,5-диметоксибензилоксикарбонил, 3,4,5-триметоксибензилоксикарбонил, 1-(п-бифенилил)-1-метилэтоксикарбонил, ,-диметил-3,5-диметоксибензилоксикарбонил,бензгидрилоксикарбонил, трет-бутоксикарбонил, диизопропилметоксикарбонил, изопропилоксикарбонил, этоксикарбонил, метоксикарбонил, аллилоксикарбонил, 2,2,2-трихлорэтоксикарбонил, феноксикарбонил, 4-нитрофеноксикарбонил, флуоренил-9-метоксикарбонил, циклопентилоксикарбонил, адамантилоксикарбонил, циклогексилоксикарбонил, фенилтиокарбонил, и т.п.; алкильные группы, такие как бензил, трифенилметил, бензилоксиметил и т.п.; и силильные группы, такие как триметилсилил и т.п. Предпочтительные N-защитные группы включают в себя формил, ацетил, бензоил, пивалоил, третбутилацетил, фенилсульфонил, бензил, трет-бутоксикарбонил (ВОС) и бензилоксикарбонил (Cbz). Синтез пролекарств монофосфата 2',3'-дидезокси-3'-С-гидроксиметила проводят аналогичноUS 5756711, US 5563257, ЕР 545966 и WO95/32984, с соответствующей защитой 3'-гидроксиметильной группы. Галеновые композиции для подобных соединений показаны в WO 97/26867. Краткое описание рисунков Фиг. 1 представляет собой диаграмму, изображающую распространение ТАМ с высвобождающим праймер фенотипом M41L/L210W/T215Y на основе 1086 последовательностей ОТ пациентов с вирусологическими нарушениями; фиг. 2 представляет собой диаграмму, изображающую распространение ТАМ с высвобождающим праймер фенотипом D67N/K70R/L210W на основе 1098 последовательностей пациентов с вирусологическими нарушениями; фиг. 3 представляет собой схему катализируемой ОТ полимеризации ДНК; фиг. 4 представляет собой схему опосредованной АТФ активности высвобождения праймера на терминированном AZT праймерном конце; на фиг. 5 изображено ингибирование типичных штаммов ТАМ с высвобождающим праймер фенотипом 2',3'-дидезокси-3-С-гидроксиметилцитозином по сравнению с ингибированием обычными NRTI; на фиг. 6 изображено ингибирование M184V+ТАМ с высвобождающим праймер фенотипом 2',3'дидезокси-3-С-гидроксиметилцитозином по сравнению с ингибированием обычными NRTI; на фиг. 7 изображено ингибирование T69S+XX+ТАМ 2',3'-дидезокси-3'-С-гидроксиметилцитозином по сравнению с ингибированием обычными NRTI; на фиг. 8 изображено ингибирование штаммов ТАМ 2',3'-дидезокси-3'-С-гидроксиметилцитозином по сравнению с ингибированием зидовудином и ламивудином; фиг. 9 представляет собой диаграмму, изображающую синтез ДНК в виде функции времени, отображая включение 2',3'-дидезокси-3'-С-гидроксиметилцитозин-монофосфата;- 16011039 фиг. 10 представляет собой диаграмму, изображающую остаточный 3'-ОН праймер, указывая, что включение 2',3'-дидезокси-3'-С-гидроксиметилцитозина допускает ограниченный дополнительный синтез ДНК; фиг. 11 представляет собой авторадиограмму геля, показывая, что индуцированный 2',3'-дидезокси 3'-С-гидроксиметилцитозин-монофосфатом обрыв цепи отличается от вызванного ddC монофосфатом обрыва цепи ДНК. Вызванный ddC-монофосфатом обрыв фрагмента цепи ДНК возникает в меньшей степени в геле, чем фрагмент, полученный с применением соединения по изобретению. Подробное описание изобретения Различные варианты осуществления и аспекты изобретения описаны только при помощи примера со ссылкой на сопутствующие примеры и рисунки. Пример 1. Активность 2',3'-дидезокси-3'-С-гидроксиметилцитозина против связанной с высвобождением праймера ТАМ резистентного ВИЧ в анализе ВИЧ PhenoSense. Чувствительность к 2',3'-дидезокси-3'-С-гидроксиметилцитозину изолятов ВИЧ-1 образцов плазмы от пациентов, имеющих обычные ТАМ высвобождающие праймер мутантные резистентные генотипы,определяли коммерчески доступным анализом ВИЧ PhenoSense (описан Petropoulos, C.J. et al., (2000)Antimicrob. Agents Chemother. 44: 920-928 и произведен ViroLogics, Inc). Анализ выполняли амплификацией протеазного сегмента (PR)-RT гена ВИЧ pol плазмы пациента и вставкой продуктов амплификации в модифицированный вектор ВИЧ-1, полученный из молекулярного клона NL4-3. Вирусный материал получали котрансфекцией клеточных культур 293 рекомбинантной вирусной векторной ДНК и экспрессионным вектором, продуцирующим амфотропные белки оболочки вируса лейкемии мышей. Псевдотипированные вирусные частицы собирали из трансфицированных клеточных культур и использовали для инфицирования свежих клеточных культур 293. Рекомбинантная вирусная ДНК содержала люциферазную генную кассету в области гена env ВИЧ, и продукция люциферазы в клетках-мишенях зависела от завершения одного цикла вирусной репликации. Чувствительность к лекарственному средству измеряли добавлением к клеткам последовательных концентраций соединения по изобретению и ссылочных соединений. Ингибирующие вирусную репликацию лекарственные средства снижали люциферазный сигнал в дозозависимых условиях, обеспечивая количественное измерение чувствительности к лекарственному средству. Пример 1 а. В табл. 1 суммирована основная группа используемых в эксперименте связанных с высвобождением праймера ТАМ-мутантов, являющихся резистентными ВИЧ и несущих характерный ТАМ-генотип,обычно возникающий в процессе противовирусной терапии с применением AZT. Таблица 1 Характерный генотип в связанных с высвобождением праймера ТАМ изолятах пациентов 20 и 21 Результаты изображены на фиг. 5. В качестве стандарта использовали вирус ВИЧ дикого типа. Таким образом, ингибирование штаммов изолятов пациентов 20 и 21 выражали в виде кратного изменения снижения чувствительности к лечению лекарственными средствами по сравнению с параллельными дорожками стандарта. Тестировали следующие противовирусные лекарственные средства: AZT, 3TC, TNF,ABC, d4T, FTC и соединение по изобретению. Четко видно, что соединение по изобретению 2',3'дидезокси-3'-С-гидроксиметилцитозин сохранял активность против несущих ТАМ штаммов. Результаты показали всего лишь 1,0-кратное снижение чувствительности для изолята 20 штамма и менее 1,0 кратного снижения чувствительности для изолята 21 штамма. Это означает, что 2',3'-дидезокси-3'-Сгидроксиметилцитозин сохранял активность против связанной с высвобождением праймера мутантной ОТ ВИЧ пациента на уровне активности, аналогичной его активности против ОТ ВИЧ дикого типа. Напротив, другие лекарственные средства, особенно AZT (451-кратное снижение чувствительности), а также 3 ТС, TFN, ABC, d4T и FTC теряли активность против вируса данных пациентов по сравнению с вирусом дикого типа. Другими словами, вирус данных пациентов демонстрировал резистентность, выражающуюся сильным снижением чувствительности к этим лекарственным средствам, как показано на фиг. 5. Важно отметить, что изоляты двух пациентов содержат различные аминокислотные транзиции в кодоне 215; Т на F в изоляте 20 и Т на Y в изоляте 21. Это является характерным признаком связанных с высвобождением праймера ТАМ резистентных мутантов. Пример 1b. В табл. 2 указан связанный с высвобождением праймера мутантный ВИЧ с генетическим фономM184V (характерный мутант), обычно возникающий при очень часто используемой антиретровирусной- 17011039 терапии AZT+3TC (комбивир). Таблица 2 Генотипические изменения в связанной с высвобождением праймера ТАМ изолята пациента 19 Как показано на фиг. 6, 2',3'-дидезокси-3'-С-гидроксиметилцитозин еще раз сохранял активность против данного резистентного вируса, демонстрируя всего лишь 1,78-кратное отличие в чувствительности по сравнению с ВИЧ дикого типа. 3 ТС и AZT оба теряли активность и показывали сниженную активность (т.е. выраженное снижение чувствительности вируса) в отношении резистентного вируса(фиг. 6). Пример 1 с. Продолжительное введение пациентам противовирусных лекарственных средств приводит к появлению MDR. Мутация T69S с инсерцией 6 п.о. между аминокислотами 68 и 70 в пальцеобразной области ОТ часто обнаруживается в сочетании с различными формами ТАМ и способствует повышенной активности высвобождения праймера. Была выбрана группа MDR (с различными формами аминокислотной(ых) инсерцией(ями в сочетании с ТАМ, как указано в табл. 3. Таблица 3 Генотипические изменения в связанных с высвобождением праймера изолятах пациентов 31, 32 и 35 Как показано на фиг. 7, соединение по изобретению ингибирует изоляты данных пациентов, проявляя наименьшее изменение чувствительности к лекарственному средству по сравнению с шестью ссылочными противовирусными средствами, применяемыми в настоящее время при обычной противовирусной терапии. Авторы отмечают, что для изолятов пациентов 32 и 35 наблюдали выраженное (от 500- до 1000 кратного) снижение чувствительности к AZT, тогда как соединение по изобретению демонстрировало изменения в 2,79 и 4,29 раза соответственно. Это согласуется с тем, что соединение по изобретению иллюстрирует отличный механизм ингибирования по сравнению с терминаторами облигатной цепи ДНК,представленными обычными NRTI. Пример 1d. Изолят 4 представляет собой дополнительный характерный мутант, несущий генотип K65R+M184V в не являющемся необходимым фоне ТАМ, состоящем из мутаций в R211S и K219 Е. Данный изолят вызывает обычную перекрестную резистентность к абакавиру, 3 ТС и недавно одобренному нуклеозидуFTC, но сохраняет чувствительность к аналогам тимидина, таким как AZT и d4T. Данный изолят не несет характерных высвобождающих праймер мутаций, однако соединение по изобретению еще ингибирует данный вирусный фенотип, как указано значением FC 3,88. Данное значение сравнимо с аналогами тимидина AZT (FC=1,11) и d4T (FC=0,71), тогда как существенная резистентность была обнаружена для 3TC (FC200), FTC (FC40) и до некоторой степени для ABC (FC9,0). Эти экспериментальные данные демонстрируют, что соединение по изобретению не только имеет уникальные свойства против "высвобождающих праймер" мутантов, но также способен ингибировать мутанты ВИЧ из характерного семейства. Таким образом, это отличается от ингибиторного механизма, используемого 3 ТС и FTC, а также,возможно, механизма Kodama 4'-С-этинильных соединений, описанного выше, в котором M184V вместе с одной дополнительной аминокислотной заменой в кодоне T165R в каталитической области обеспечивает перекрестную резистентность к 4-С-этинилнуклеозиду (Kodama 2002). Пример 2. Активность 2',3'-дидезокси-3'-С-гидроксиметилцитозина против связанного с высвобождением праймера резистентного ВИЧ в РВМС. Противовирусное действие соединения по изобретению против резистентных изолятов ВИЧ с дополнительной связанной с высвобождением праймера ТАМ анализировали в культуре РВМС. Изоляты ВИЧ-1 получали и наращивали до высокого титра путем совместного культивирования РВМС инфицированного пациента о ФГА-стимулированными РВМС донора (Virology Manual for ACTG HIV Laboratories). Свободные от клеток супернатанты собирали, секвенировали и хранили в аликвотах при -70 С для анализа чувствительности к лекарственному средству. Исследования чувствительности к лекарственным средствам in vitro проводили с использованием- 18011039 модифицированного консенсусного способа ACTG/DOD (Virology Manual for ACTG HIV laboratories). РВМС предварительно инфицировали вирусными штаммами в течение 4 ч при 37 С во влажной атмосфере при 5% CO2 с последующей 4-часовой инкубацией. Инфицированные клетки дважды отмывали в среде и раскапывали в микротитровальный планшет с восемью последовательными разведениями лекарственного средства. Каждая лунка содержала 100000 предварительно инфицированных РВМС, а все разведения лекарственных средств готовили со средой клеточной культуры. Разведения лекарственных средств выбирали таким образом, чтобы покрыть 50% ингибиторную концентрацию (IC50) для каждого отдельного лекарственного средства. Контрольные лунки, содержащие клетки и вирус, совместно инкубировали в каждом планшете. После 7-суточной инкубации при 37 С во влажной атмосфере при 5% CO2 определяли рост вируса, используя антигенный анализ супернатантов р 24 (Abbott Laboratories, Chicago,USA). Считали процент ингибирования вирусного роста по сравнению с контрольной лункой, не содержащей лекарственного средства, и выражали в виде кратных изменений (снижение чувствительности соединений) относительно контрольной лунки. Стандартное соединение AZT рассматривали параллельно с соединением по изобретению. Выбирали группу характерного связанного с высвобождением праймера мутантного вируса, содержащего основной признак резистентных связанных с высвобождением праймера ТАМ мутаций ОТ. Как указано в табл. 4, применяли штаммы с мутациями в положении M41L, D67N, K70R, L210W, T215Y/F иK219Q/E в различных сочетаниях с добавлением или без характерного мутанта M184V. Таблица 4 Связанный с высвобождением праймера ТАМ генотип в изолятах 9 пациентов Большинство из этих выбранных высвобождающих праймер мутантов придавали выраженную резистентность к AZT, в несколько сотен раз снижая значение FC. Исключением был изолят 7086 (FC=3,0),несущий аминокислотную мутацию T215V. Полное описание значений FC представлено на фиг. 8. Таким образом, 2',3'-дидезокси-3'-С-гидроксиметилцитозин ингибировал все 8 изолятов с самым высоким значением FC, составляющим всего 2,7. Пример 3. 2',3'-Дидезокси-3'-С-гидроксиметилцитозин сохраняет способность к поддержанию синтеза ДНК. Присутствие 3'-гидроксиметильной группы в соединении по изобретению должно, в принципе,поддерживать включение и элонгацию вирусной нуклеиновой кислоты, катализируемую ОТ ВИЧ-1. Использовали скорость-ограничивающее количество праймер-матрицы (16S и 23S рибосомную РНК отжигали олигонуклеотидым ДНК-праймером с последовательностью 5'-TAACCTTGCGGCCGT-3' (SEQ IDNO:1), как правило, синтезированным INNOVAGEN). Его предварительно инкубировали со 100 мкМ(55-кратная IC50) 2',3'-дидезокси-3'-С-гидроксиметилцитозин-трифосфата, 6,0 мкМ ddC-трифосфата (54 кратная IC50 ddCTP), 20 мкМ дезоксицитозин-трифосфата (20-кратная Km dCTP) или в качестве контроля с H2O. В указанные временные точки (0, 10, 30, 60 и 120 мин) процесс полимеризации ДНК останавливали инактивацией ОТ при 70 С в течение 2 мин во время первого цикла полимеризации ДНК (фиг. 9). Остаточное количество праймер-матрицы прямо отражает доступность свободного 3'-ОН праймерного конца, представленного после первого цикла реакции. Чтобы ее измерить, инициировали новую полимеризацию путем добавления новой ОТ в присутствии 150 мкМ (160-кратная Km) dCTP и меченного тритиемdCTP, необходимого для конкуренции за любое ингибиторное действие оставшихся от первого цикла полимеризации ДНК 2',3'-дидезокси-3'-С-гидроксиметилцитозин ТР и ddCTP. Доступность свободных 3'ОН на праймерном конце в оставшемся количестве праймер-матрицы, обеспечивающей дополнительную полимеризацию ДНК, измеряли и выражали в виде функции от времени предварительной инкубации(фиг. 10). Со ссылкой на фиг. 9 и 10, хотя предполагали обеспечить одинаковую степень ингибированияddCTP и 2',3'-дидезокси-3'-С-гидроксиметил ТР, наблюдали резкий контраст по их относительной способности поддерживать второй цикл катализируемой ОТ ВИЧ полимеризации ДНК. Предварительная инкубация с терминатором облигатной цепи, таким как ddCTP, является причиной обрыва цепи и дает существенное снижение свободных 3'-ОН праймерного конца по сравнению с трифосфатом соединения по изобретению. Если присутствовал ddCTP, во временных точках предварительной инкубации 10 и- 19011039 30 мин менее половины количества оставшихся 3'-ОН праймерного конца продолжали поддерживать дополнительное удлинение ДНК, по сравнению с трифосфатом соединения по изобретению, несмотря на то, что в первом цикле полимеризации ДНК применяли сравнимые количества ТР соединений. Это четко указывает на то, что включение ТР соединения по изобретению в появляющуюся нуклеиновую кислоту предоставляет сохраняющуюся возможность для некоторого дополнительного синтеза ДНК. Для того чтобы произошел следующий цикл синтеза, полимеризация ДНК должна включать в себя связывание фермента с матрицей, комплекса с соответствующим dNTP, образование фосфодиэфира, высвобождение пирофосфата и транслокацию фермента из N-участка в Р-участок. Таким образом, очевидно, что соединение по изобретению способно включаться и транслоцироваться ферментом в следующее положение,после которого прекращается дальнейшая элонгация. Пример 4. Включение 2',3'-дидезокси-3'-С-гидроксиметилцитозин-монофосфата приводит к отличному профилю терминации цепи по сравнению с ddC. Два аналога дезоксицитозина, обычный NRTI ddC, лишенный функции 3'-гидроксильной группы, и соединение по изобретению подвергали анализу терминации цепи ДНК, в котором удлинение ДНК проводили с одноцепочеченой матрицей ДНК М 13mp18, предварительно отжигаемой с олигонуклеотидным праймером ДНК (прямая последовательность праймера 5'-GTTTTCCCAGTCACGACGTTGTA-3' (SEQ IDNO:2), получали от Amersham UK). Одноцепочечную РНК М 13mp18 отжигали с данным олигонуклеотидным праймером ДНК, получая конечную концентрацию 1 мг/мл в буфере, содержащем 10 мМ TrisHCl, pH 7,9 и 100 мМ NaCl, и хранили в аликвотах при -20 С. Полимеризацию ДНК проводили с использованием этого отожженного праймера/матрицы, ОТ ВИЧ-1 и природных dNTP в реакции, инкубированной при 37 С в течение 25 мин. Реакцию останавливали добавлением останавливающего раствора, содержащего 95% формамида, 20 мМ ЭДТА, 0,05% бромфенолового синего и 0,05% ксилол-цианола FF(получены от USB, United States Biochemical via Amersham UK). После денатурации продуктов ДНК фрагмент элонгированной ДНК подвергали электрофорезу в 8,0% полиакриламидном геле и визуализировали с использованием авторадиографии. Анализ включал в себя отрицательный контроль (природные dNTP), два положительных контроляUnited States Biochemical via Amersham UK). Использовали различные молекулярные соотношения трифосфата соединения по изобретению и природных dNTP. После реакции, проведенной как описано выше, фрагменты денатурированной ДНК из каждой отдельной реакции вносили в 8,0% полиакриламидный гель в следующей далее последовательности: 1 - отрицательный контроль 2 - первый положительный контроль 8 мкМ ddCTP (получен от Sigma) 3 - 20 мкМ ТР по изобретению в 200 мкМ dNTP 4 - 30 мкМ ТР по изобретению в 300 мкМ dNTP 5 - 40 мкМ ТР по изобретению в 400 мкМ dNTP 6 - 50 мкМ ТР по изобретению в 500 мкМ dNTP 7 - 20 мкМ ТР по изобретению в 80 мкМ dNTP 8 - 40 мкМ ТР по изобретению в 80 мкМ dNTP 9 - пустая дорожка (без загрузки) 10 - второй положительный контроль ddCTP (от USB sequence kit) Для того чтобы устранить любой другой фактор, способный повлиять на интерпретацию результатов анализа, как, например, связанный с полиакриламидными гелями краевой эффект, в середину геля вносили второй набор образцов. На фиг. 11 показана цифровая фотография, изображающая результаты авторадиографии, полученные в центральной части геля. 1. Отрицательный контроль (dNTP): не обнаружена остановка полимеризации ДНК. 2. Первый положительный контроль 8 мкМ ddCTP: приводит к терминации цепи в ожидаемых участках 2',3'-дезоксидезоксицитозина. 3. 20 мкМ ТР по изобретению в 200 мкМ dNTP: приводит к терминации цепи в участке после/за участком 2',3'-дезоксидезоксицитозина. 4. 30 мкМ ТР по изобретению в 300 мкМ dNTP: приводит к терминации цепи в участке после участка 2',3'-дезоксидезоксицитозина по сравнению с ddCTP. 5. 40 мкМ ТР по изобретению в 4 00 мкМ dNTP: приводит к терминации цепи в участке после участка 2',3'-дезоксидезоксицитозина по сравнению с ddCTP. 6. 50 мкМ ТР по изобретению в 500 мкМ dNTP: не обнаружена специфичная остановка (профиль терминации цепи), но, как полагают, находится в пределах экспериментальной ошибки. 7. 20 мкМ ТР по изобретению в 80 мкМ dNTP: приводит к более выраженному действию терминации цепи между участками в участке после участка 2',3'-дезоксидезоксицитозина по сравнению с ddCTP и выше экспериментального образца по изобретению. 8. 40 мкМ ТР по изобретению в 80 мкМ dNTP: приводит к более выраженному действию термина- 20011039 ции цепи между участками в участке после участка 2',3'-дезоксидезоксицитозина по сравнению с ddCTP и выше экспериментального образца по изобретению. 9. Пустая дорожка (образец не вносили). 10. Второй положительный контроль ddCTP: приводит к терминации цепи в ожидаемых участках 2',3'-дезоксидезоксицитозина. Соединение по изобретению вызывало терминацию цепи ДНК во всех образцах, за исключением образца 6, содержащего 50 мкМ ТР по изобретению в 500 мкМ dNTP. Причина этого исключения не известна, но вероятна в пределах экспериментальной сшибки. Интересно, что фрагменты ДНК, возникающие в результате включения 2',3'-дидезокси-3'-С-гидроксиметилцитозин-монофосфата, мигрируют более медленно, чем полученные в результате двух положительных контрольных терминированныхddCTP фрагментов ДНК (фиг. 11). Дублированные реакции демонстрируют постоянный профиль, предполагающий, что соединение по изобретению включается в только что синтезированную цепь ДНК и обеспечивает образование дополнительной 3',5'-фосфодиэфирной связи в следующем цикле нуклеотидного включения. Хотя был обнаружен фрагмент длиннее на одно основание, нельзя исключать, что может играть роль последовательность использованной матрицы. Пример 3 ясно показывает, что если применяют рибосомальную РНК матрицу, то 3'-ОН праймерный конец, предварительно терминированный соединением по изобретению, в большей степени обеспечивает дополнительное нуклеотидное включение, чем 3'-ОН праймерный конец, предварительно терминированный ddCTP. Эта особенность является причиной медленного движения при электрофорезе, и подразумевается, что ОТ подвергается транслокации, чтобы начать следующий цикл полимеризации. Не желая ограничиваться данным механизмом, авторы полагают, что соединение по изобретению,таким образом, представляет новую стратегию в ингибировании удаляющих праймер мутантов. Оно представляет собой соединение, включающееся в растущий вирусный геном, при этом одновременно сохраняя способность позволять молекуле ОТ подвергаться необходимому трансформационному изменению, чтобы подготовиться к следующему циклу синтеза ДНК. Примеры 3 и 4 ясно продемонстрировали, что соединение по изобретению обладает такими свойствами и, таким образом, способно подавлять/препятствовать механизму резистентности с высвобождением праймера, как продемонстрировано в примерах 1 и 2.Sarafinano et al. (2002 and 2003) предоставляют очевидные экспериментальные данные, подтверждающие заключение, что реакция высвобождения праймера может происходить только до транслокации ОТ в следующее положение. Таким образом, для эффективного действия высвобождающего праймер мутанта претранслоцируемый комплекс является необходимым условием. Представленные в примерах результаты показывают, что для соединения и способов по настоящему изобретению это не является доказательством. Пример 5. Получение сложноэфирных высвобождающих 2',3'-дидезокси-3'-С-гидроксиметилцитозин пролекарств. Схема 1 Получение соединения 1. 3'-MMTR/5'-TMBDS, избирательно защищающий соединение 1, получали в виде соответствующего уридина, как описано у Sanghvi et al.: Synthesis (1994) p. 1163Tetrahedron Lett v35 (1994) p. 4697NuclesoidesNucleotides v15 (1996) 1383. Замены U на С показаны у Kozlov et al. NucleosidesNucleotides,v17 (1998) 2249. Получение соединения 2.- 21011039 Соединение 1 (5,0 г, 6,7 ммоль) растворяли в 80% уксусной кислоте (30 мл) и перемешивали в течение 24 ч при комнатной температуре. Смесь упаривали и продукт очищали флэш-хроматографией с использованием от 5 до 10% MeOH в CH2Cl2 в качестве элюента. Выход 2,1 г (64%). Получение соединения 3. Соединение 1 (2,3 г, 3,06 ммоль) в ТГФ (150 мл) обрабатывали фторидом тетрабутиламмония (1 М в ТГФ, 3,0 мл) в течение 1 ч при комнатной температуре. Добавляли бикарбонат натрия (насыщ., 100 мл) и экстрагировали смесь дихлорметаном (350 мл). Органический слой сушили и упаривали. Остаток очищали флэш-хроматографией с получением 1,3 г (82%) соединения 3. Схема 2 Получение соединения 4. Триэтиламин (0,4 55 г, 4,5 ммоль) и этилхлорформиат (0,26 г, 2,4 ммоль) добавляли к раствору Восвалина (0,49 г, 2,25 ммоль) в ТГФ (15 мл) при 0 С. Реакционную смесь перемешивали в течение 3 ч при той же температуре, а затем фильтровали в раствор соединения 2 (0,72 г, 1,5 ммоль) и DMAP (0,55 г,4,5 ммоль) в ТГФ (15 мл). Реакционную смесь перемешивали в течение ночи при комнатной температуре. К смеси добавляли EtOAc и трижды промывали 2% лимонной кислотой и один раз насыщеннымNaHCO3. Органический слой сушили над Na2SO4, фильтровали и упаривали. Остаток очищали флэшхроматографией с использованием в качестве элюента 2-5% MeOH в CH2Cl2, получая 0,35 г (34%) соединения 4. Получение соединения 5. Соединение 4 (30 мг, 0,066 ммоль) растворяли в концентрированной HCl (1 мл) при комнатной температуре и перемешивали в течение 5 мин. К раствору добавляли ацетон и упаривали. Снова добавляли ацетон и раствор упаривали и сушили в вакууме с получением 18 мг (69%) соединения 5. Получение соединения 6. Соединение 4 (0,35 г, 0,5 ммоль) растворяли в ТГФ (20 мл) и добавляли 1,0 М фторид тетрабути- 22011039 ламмония в ТГФ (0,5 мл, 0,5 ммоль). Реакционную смесь перемешивали в течение 2 суток при комнатной температуре. Смесь упаривали и продукт очищали флэш-хроматографией с использованием в качестве элюента 5-10% MeOH в CH2Cl2, получая 0,225 г (98%) соединения 6. Получение соединения 7. Синтез проводили в тех же условиях, что и для соединения 4, с использованием в качестве исходного вещества соединения 6. Получение соединения 8. Соединение 7 (75 мг, 0,114 ммоль) растворяли в 3 мл MeOH и при 0 С добавляли концентрированную HCl (0,5 мл). Смесь перемешивали в течение 5 мин при 0 С и в течение 3 мин при комнатной температуре и после этого упаривали. К остатку добавляли ацетон и упаривали. Добавляли CH2Cl2 и остаток упаривали и сушили в вакууме с получением 58 мг (96%) соединения 8. Получение соединения 9. Этилхлорформиат (110 мг, 1,0 ммоль) добавляли к раствору Вос-валина (220 мг, 1,0 ммоль) и триэтиламина (200 мг, 2,0 ммоль) в ТГФ (30 мл) при 0 С и перемешивали смесь в течение 3 ч. Температуре давали достичь комнатной температуры и фильтровали смесь. Фильтрат добавляли к раствору соединения 3 (350 мг, 0,68 ммоль) и DMAP (244 мг, 2,0 ммоль) в ТГФ (20 мл). Реакционную смесь перемешивали в течение ночи при комнатной температуре, к смеси добавляли этилацетат (100 мл) и промывали лимонной кислотой (10%, 230 мл) и бикарбонатом натрия (насыщ., 30 мл). Растворитель удаляли и продукт разделяли на колонке с силикагелем, получая соединение 9 (220 мг, 45%). Получение соединения 10. Соединение 9 (200 мг, 0,28 ммоль) растворяли в 3 мл концентрированной HCl и перемешивали в течение 3 мин при комнатной температуре. Смесь упаривали, промывали ацетоном, ацетонитрилом и диэтиловым эфиром и сушили в вакууме с получением 85 мг (77%) соединения 10. Получение соединения 11. Этилхлорформиат (110 мг, 1,0 ммоль) добавляли к раствору Вос-валил-молочная кислота (290 мг,1,0 ммоль) и триэтиламина (200 мг, 2,0 ммоль) в ТГФ (30 мл) при 0 С и перемешивали смесь в течение 3 ч при 0 С. Давали температуре достичь комнатной температуры. Смесь фильтровали и добавляли фильтрат к раствору соединения 3 (300 мг, 0,58 ммоль) и DMAP (24 4 мг, 2,0 ммоль) в ТГФ (20 мл). Реакционную смесь перемешивали в течение ночи при комнатной температуре, к смеси добавляли этилацетат (100 мл) и промывали лимонной кислотой (10%, 230 мл) и бикарбонатом натрия (насыщ., 30 мл). Растворитель удаляли и продукт разделяли на колонке с силикагелем, получая соединение 11 (250 мг,38%). Получение соединения 12. Соединение получали из соединения 11 в тех же условиях, что и соединение 8. Получение соединения 13. Соединение получали из соединения 2 в тех же условиях, что и соединение 4, с использованием в качестве исходного вещества Вос-валил-молочной кислоты вместо Вос-валина. Получение соединения 14. Проводили синтез из соединения 13, как для соединения 10. Получение соединения 15. Соединение 1 (1 г, 1,33 ммоль) растворяли в 14 мл концентрированной HCl и перемешивали смесь в течение 8 мин при комнатной температуре и затем упаривали. Остаток промывали ацетоном и фильтровали с получением 334 мг (90%) соединения 15. Получение соединения 16. Триэтиламин (0,487 г, 4,82 ммоль) и этилхлорформиат (0,30 г, 2,77 ммоль) добавляли к раствору Вос-валин-молочная кислота (0,77 г, 2,65 ммоль) в ТГФ (30 мл) при 0 С. Реакционную смесь перемешивали в течение 3 ч при той же температуре и затем фильтровали в раствор соединения 15 (0,334 г,1,20 ммоль) и DMAP (0,74 г, 6,0 ммоль) в ТГФ (30 мл) и ДМФА (30 мл). Смесь перемешивали в течение ночи при комнатной температуре. К смеси добавляли EtOAc и трижды промывали 2% лимонной кислотой и один раз насыщенным NaHCO3. Органический слой сушили над Na2SO4, фильтровали и упаривали. Неочищенный продукт очищали флэш-хроматографией с использованием в качестве элюента 2-5% Получение соединения 17. Синтез осуществляли из соединения 16, как для соединения 8. Получение соединения 18. Валерилхлорид (460 мг, 3,8 ммоль) добавляли к раствору валериановой кислоты (390 мг, 3,8 ммоль) и триэтиламина (770 мг, 7,6 ммоль) в ТГФ (50 мл) при 0 С и перемешивали смесь в течение 3 ч, а затем фильтровали. Фильтрат добавляли к раствору соединения 3 (1,3 г, 2,53 ммоль) и DMAP (930 мг,7,6 ммоль) в ТГФ (50 мл). Реакционную смесь перемешивали в течение ночи при комнатной температуре. К смеси добавляли лимонную кислоту (10%, 50 мл) и экстрагировали этилацетатом (250 мл). Объединенный органический слой промывали лимонной кислотой (10%, 30 мл), а затем бикарбонатом натрия(50 мл) и насыщенным раствором соли (50 мл). После высушивания удаляли органический слой и остаток разделяли на колонке с силикагелем, получая соединение 18 (850 мг, 56%). Получение соединения 19. Соединение 18 (850 мг, 1,42 ммоль) растворяли в метаноле (10 мл), и при 0 С к раствору добавляли концентрированную HCl (1,5 мл). Реакционную смесь перемешивали в течение 0,5 ч. К смеси добавляли- 24011039 карбонат натрия (50 мл) и экстрагировали дихлорметаном (350 мл). Растворитель удаляли и продукт разделяли на колонке с силикагелем, получая соединение 19 (230 мг, 50%). Получение соединения 20. Синтез осуществляли из соединения 19, как для соединения 9. Получение соединения 21. Синтез осуществляли из соединения 20, как для соединения 8. Получение соединения 22. Синтез осуществляли из соединения 19, как для соединения 18. Схема 4 Получение соединения 23. Соединение 2 (1,02 г, 2,1 ммоль) и DMAP (1,05 г, 8,61 ммоль) растворяли в ТГФ (35 мл) и охлаждали до -78 С. В течение 15 мин добавляли валерилхлорид (642 мкл, 2,14 ммоль). Смесь перемешивали при низкой температуре в течение 2 ч, а затем 1 ч без охлаждающей бани. Реакционную смесь вливали в 5% лимонную кислоту и затем экстрагировали EtOAc. Объединенные органические слои промывали насыщенным раствором соли, сушили над Na2SO4 и упаривали с получением сухого вещества белого цвета,которое очищали на колонке с силикагелем, используя в качестве элюента 0-6% MeOH в CH2Cl2, с получением 0,31 г (25%) соединения 23.- 25011039 Получение соединения 24. Соединение 23 (0,35 г, 0,58 ммоль) растворяли в ТГФ (20 мл), добавляли 1 М TBAF в ТГФ (0,58 мл,0,58 ммоль) и перемешивали смесь в течение 90 мин при комнатной температуре. Растворитель упаривали и остаток очищали флэш-хроматографией с использованием в качестве элюента 0-10% MeOH вCH2Cl2, получая 166 мг (92%) соединения 24. Получение соединения 25. Синтез осуществляли из соединения 24, как для соединения 4. Получение соединения 26. Синтез осуществляли из соединения 25, как для соединения 8. Пример 6. Высвобождение 2',3'-дидезокси-3'-С-гидрометилцитозина из пролекарств. Утверждение, что пролекарства по изобретению полностью превращаются в активное исходное соединение 2',3'-дидезокси-3'-С-гидрометилцитозин, можно оценить мониторингом появления исходного соединения в объединенной человеческой плазме, 37 С, меченной 5 мкМ пролекарства. Пример 7. Биодоступность пролекарств. Пролекарства обычно смешивали в высокоочищенной воде MQ до концентрации 3 мг/мл и перорально вводили интубацией двум крысам. Приемлемая доза составляет 5 мг/кг. В приемлемые моменты времени, как, например, 0, 15 и 30 мин, 1, 2, 4 и 6 ч забирали образцы плазмы. Выход в плазме (в виде метаболита 2',3'-дидезокси-3'-С-гидроксиметилD-эритропентофуранозилцитозина) измеряли при помощи масс-спектрометрии, определяли как натриевый аддукт с m/z (отношение массы к заряду) 264 (M+Na)+. Результаты изображены в виде концентрации плазмы в зависимости от времени и в большинстве случаев показывают Cmax порядка от 3 до 5 мкМ. Абсолютную биодоступность %F вычисляли в стандартных условиях, т.е. исходя из клиренса дозы исходного вещества in vitro, как показано в WO 97/30051. Так как крыс нельзя инфицировать ВИЧ, невозможно непосредственно измерить антиретровирусную активность такой пероральной композиции, но следует заметить, что для метаболита 2',3'-дидезокси 3'-С-гидроксиметилD-эритропентофуранозилцитозина ED50 в человеческих клетках Н 9 обычно составляет приблизительно 0,01 мкМ. Это, в свою очередь, означает, что порядок наблюдаемых пиковых концентраций плазмы данных пролекарств в несколько сотен раз выше ED50. Другие фармацевтические параметры, такие как AUC и клиренс, обычно соответствуют достижению 24-часового провала концентрации со значительно более высокой ED50 при QD или BID введении доз. Каждый патент и процитированные в тексте научные ссылки перечислены ниже и, таким образом, в полном объеме включены сюда в качестве ссылки. СсылкиK65R: tenofovir use and lack of TAMs. Antivir Ther. 2004; 9:S46. По всему описанию и в следующей далее формуле изобретения, если смысл не подразумевает другого значения, следует понимать, что слово "содержат" и варианты, такие как "включает в себя" и "включающий в себя", подразумевают включение указанного целого числа, стадии, группы целых чисел или группы стадий, но не исключение любого другого целого числа, стадии, группы целых чисел или группы стадий. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение 2',3'-дидезокси-3'-С-гидроксиметилцитозина или его пролекарства, высвобождающего in vivo 2',3'-дидезокси-3'-С-гидроксиметилцитозин или его 5'-монофосфат, или его соли для получения лекарственного средства для лечения ВИЧ-инфекции, где обратная транскриптаза ВИЧ несет по меньшей мере одну мутацию, обеспечивающую удаление терминирующего облигатную цепь нуклеозид- или нуклеотидфосфата из возникающей цепи ДНК путем опосредованного АТФ или пирофосфатом удаления. 2. Применение по п.1, где обратная транскриптаза несет по меньшей мере один из следующих генотипических профилей: 3. Применение по п.2, где генотипический профиль М 41, D67, L210 и Т 215 включает в себя M41L,D67N, L210W и T215Y/F. 4. Применение по п.2 или 3, где генотипический профиль дополнительно включает в себя по меньшей мере одну дополнительную мутацию в положении Е 44, K70, V118, Н 208, R211K, L214, K219 илиG333. 5. Применение по п.2 или 3, где генетический профиль дополнительно включает в себя по меньшей Т 69, Е 203, L210, D218, Н 221, D223 или L228. мере одну дополнительную мутацию в положении 6. Применение по п.2, где генетический профиль D67, K70 и K219 включает в себя D67N, K70R иK219Q/E. 7. Применение по п.2 или 6, где генетический профиль D67, K70 и K219 дополнительно включает в себя по меньшей мере одну дополнительную мутацию в положении М 41, Е 44, V118, Н 208, R211K, L214,Т 215, K219 или G333. 8. Применение по п.2 или 6, где генетический профиль D67, K70 и K219 дополнительно включает в себя по меньшей мере одну дополнительную мутацию в положении Т 69, Е 203, L210, D218, Н 221,D223 или L228. 9. Применение по п.2, где генетический профиль T69S-XX дополнительно включает в себя по меньшей мере одну дополнительную мутацию в положении М 41, Е 44, D67, K70, V118, Н 208, L210,R211K, L214, Т 215, K219 или G333.- 28011039 10. Применение по п.2, где генетический профиль T69S-XX дополнительно включает в себя по Т 69, Е 203, L210, D218, Н 221, D223 или меньшей мере одну дополнительную мутацию в положенииL228. 11. Применение по п.2, где генетический профиль дополнительно включает в себя по меньшей мере одну дополнительную мутацию в положении М 41, Е 44, D67, K70, V118, Н 208, L210, R211K, L214,Т 215, K219 или G333. 12. Применение по п.2, где генетический профиль дополнительно включает в себя по меньшей мере одну дополнительную мутацию в положении Т 69, T69S+XX, Е 203, L210, D218, Н 221, D223 илиL228. 13. Применение по любому из пп.2, 3 или 6, где обратная транскриптаза дополнительно несет по меньшей мере одну характерную мутацию в положении K65 или L74 или М 184 или Q151. 14. Применение по п.13, где характерная мутация представляет собой K65R или L74V или M184V или Q151M. 15. Применение по п.13 или 14, где характерная мутация дополнительно включает в себя по меньшей мере одну дополнительную мутацию в положении А 62, V75, F77, Y115 или F116. 16. Применение по любому из пп.1-15, где 5'-(2',3'-дидезокси-3'-С-гидроксиметилцитозин)монофосфат включается в возникающую цепь ДНК, в результате чего один остаток, выбранный из природных нуклеотидов, монофосфатных нуклеозидных аналогов (включая 5'-(2',3'-дидезокси-3'-Сгидроксиметилцитозин)монофосфат) и фосфатных нуклеотидных аналогов ковалентно присоединяется к включенному 5'-(2',3'-дидезокси-3'-С-гидроксиметилцитозин)монофосфату, индуцируя, таким образом,терминацию цепи. 17. Применение по любому из пп.1-16, где соединение в лекарственном средстве представляет собой 2',3'-дидезокси-3'-С-гидроксиметилцитозин или его фармацевтически приемлемую соль. 18. Применение по любому из пп.1-16, где включенное в лекарственное средство соединение представляет собой пролекарство формулы где один из R и R' представляет собой часть пролекарства с частичной структурой где R1 представляет собой Н или C1-C18 неразветвленный или разветвленный алкил;R3 представляет собой Н или L-валиловый или L-изолейциловый сложный эфир; а оставшийся из R и R' представляет собой Н или идентичную часть пролекарства; или его фармацевтически приемлемую соль. 19. Применение по п.18, гдеR1 представляет собой C1-C18 неразветвленную или разветвленную алифатическую цепь и R2 представляет собой Н;R1 представляет собой метил и R2 представляет собой NH-L-валил или NH-L-изолейцил;R1 представляет собой С 3-С 4 разветвленную алифатическую цепь и R2 представляет собой NH2; или его фармацевтически приемлемую соль. 20. Применение по п.19, где один или оба из R и R' представляют собой L-валил-L-лактил-,L-валил- или C1-С 6 алканоил-. 21. Применение по п.20, где соединение обозначает 5'-О-[2-S-(L-валилокси)пропионил]-2'-3'-дидезокси-3-С-гидроксиметилцитозин; 2',3'-дидезокси-3'-С-[2-S-(L-валилокси)пропионил]оксиметилцитозин; 5'-O-пентаноил-2'-3'-дидезокси-3-С-гидроксиметилцитозин; 2',3'-дидезокси-3'-С-пентаноилоксиметилцитозин или 5'-O-пентаноил-2'-3'-дидезокси-3-С-пентаноилоксиметилцитозин; или их фармацевтически приемлемые соли. 22. Применение по любому из предшествующих пунктов, где лекарственное средство дополнительно включает в себя по меньшей мере один терминатор цепи NRTI, в результате чего одновременное или последовательное введение указанного 2',3'-дидезокси-3'-С-гидроксиметилцитозина, или его соли, или его пролекарства и указанного терминатора цепи предназначено для ингибирования появления или распространения мутантов ВИЧ у инфицированного ВИЧ индивидуума, где указанные мутанты способны удалять указанный терминирующий цепь нуклеотид NRTI, включенный в комплекс праймер/матрица- 29011039 ВИЧ, удаление, обеспечиваемое механизмом удаления, зависимым от АТФ или пирофосфата. 23. Применение по п.22, где терминирующий цепь NRTI выбирают из группы, состоящей из зидовудина (AZT, ZDV), ставудина (d4 Т), зальцитабина (ddC), диданозина (ddI), абакавира, (ABC), ламивудина (3 ТС), эмтрицитабина (FTC), адефовира (ADV), энтакавира (BMS 200475), аловудина (FLT), дизопроксилфумарата тенофовира (TNF), амдоксавира (DAPD), D-d4FC (DPC-817), -dOTC (SPD754), SPD756, рацивира, D-FDOC и GS7340. 24. Применение по п.23, где терминирующий цепь NRTI выбирают из группы, состоящей из зидовудина, ставудина, диданозина, ламивудина, абакавира, тенофовира, эмтрицитабина и их сочетаний. 25. Применение по п.23, где терминирующий цепь NRTI представляет собой зидовудин, ламивудин или комбинированные лекарственные формы комбивир или тризивир; ламивудин, абакавир или комбинированную лекарственную форму эпзиком; тенофовир, эмтрицитабин или комбинированную лекарственную форму трувада. 26. Применение по любому из предшествующих пунктов, где 2',3'-дидезокси-3'-С-гидроксиметилцитозин вводят в диапазоне от 0,05 до 0,5 мг/кг/сутки. 27. Применение по п.26, где 2',3'-дидезокси-3'-С-гидроксиметилцитозин вводят в дозе менее 0,1 мг/кг/сутки. 28. Способ лечения пациента с ВИЧ, где обратная транскриптаза ВИЧ несет по меньшей мере одну высвобождающую праймер мутацию, обеспечивающую удаление терминирующего облигатную цепь нуклеозид- или нуклеотидфосфата из возникающей цепи ДНК при помощи опосредованного АТФ или пирофосфатом удаления, где способ включает в себя введение пациенту эффективного количества 2',3'дидезокси-3'-гидроксиметилцитозина или его пролекарства, высвобождающего in vivo 2',3'-дидезокси-3'С-гидроксиметилцитозин или его 5'-монофосфат, или его соли. 29. Способ ингибирования появления или распространения высвобождающих праймер мутантов ВИЧ, способных удалять терминирующий цепь нуклеотид NRTI, включенный в комплекс ВИЧ праймер/матрица, где удаление осуществляется зависимым от АТФ или пирофосфата механизмом удаления,где способ включает в себя одновременное или последовательное введение инфицированному ВИЧ индивидууму эффективного количества 2',3'-дидезокси-3'-С-гидроксиметилцитозина или его пролекарства,высвобождающего 2',3'-дидезокси-3'-С-гидроксиметилцитозин или его 5'-монофосфат in vivo, или его соли и по меньшей мере одного терминатора цепи NRTI, индуцирующего высвобождающие праймер мутанты. Распространение ТАМ в 1098 последовательностях при вирусологических расстройствах Фиг. 1
МПК / Метки
МПК: A61P 31/18, A61K 31/513
Метки: приемлемые, соединения, вич, лечения
Код ссылки
<a href="https://eas.patents.su/30-11039-priemlemye-dlya-lecheniya-vich-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Приемлемые для лечения вич соединения</a>
Предыдущий патент: Оптимизация процесса биовыщелачивания
Следующий патент: Способ приготовления катализатора и процесс полимеризации этилена и сополимеризации этилена с альфа-олефинами












