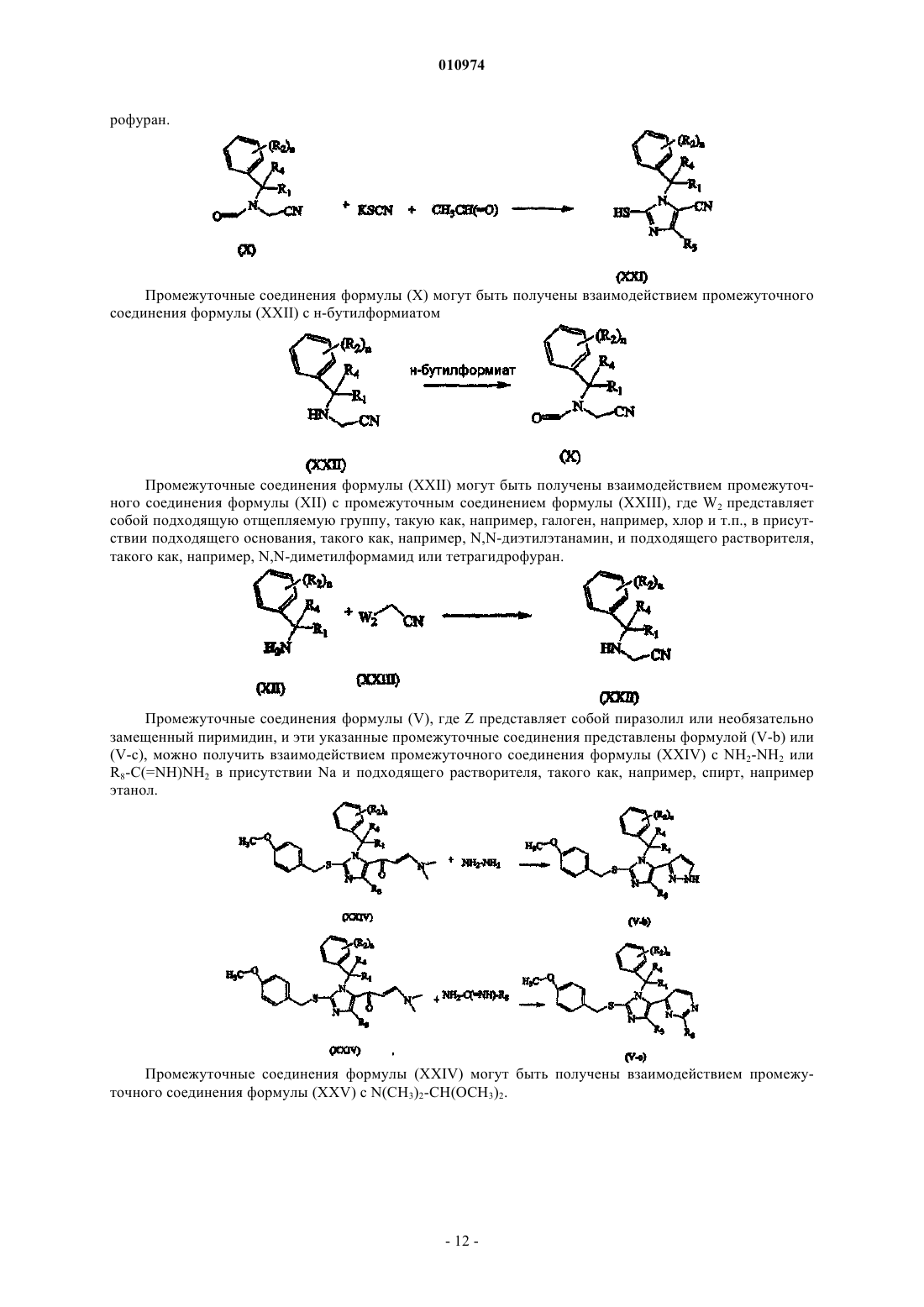
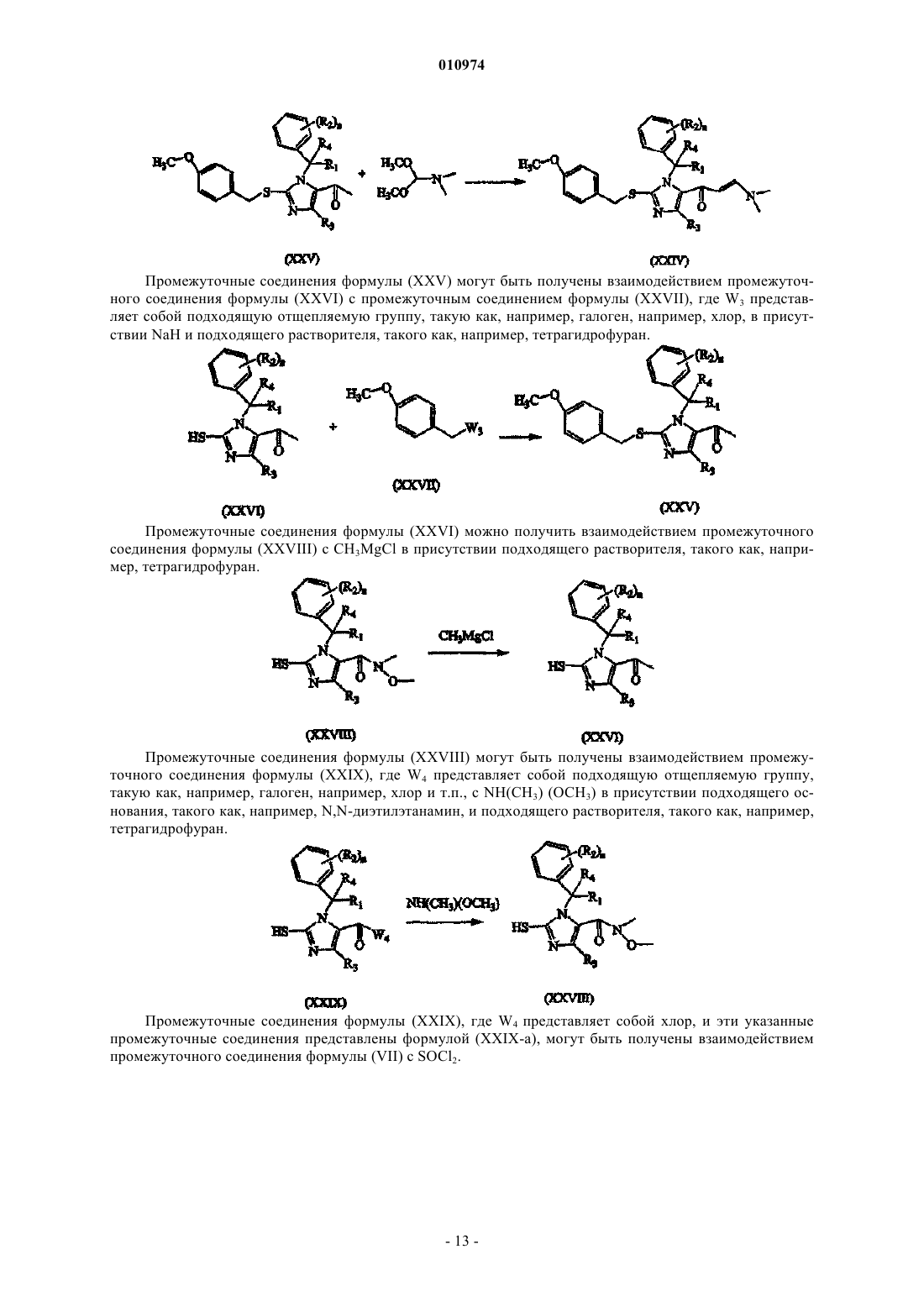
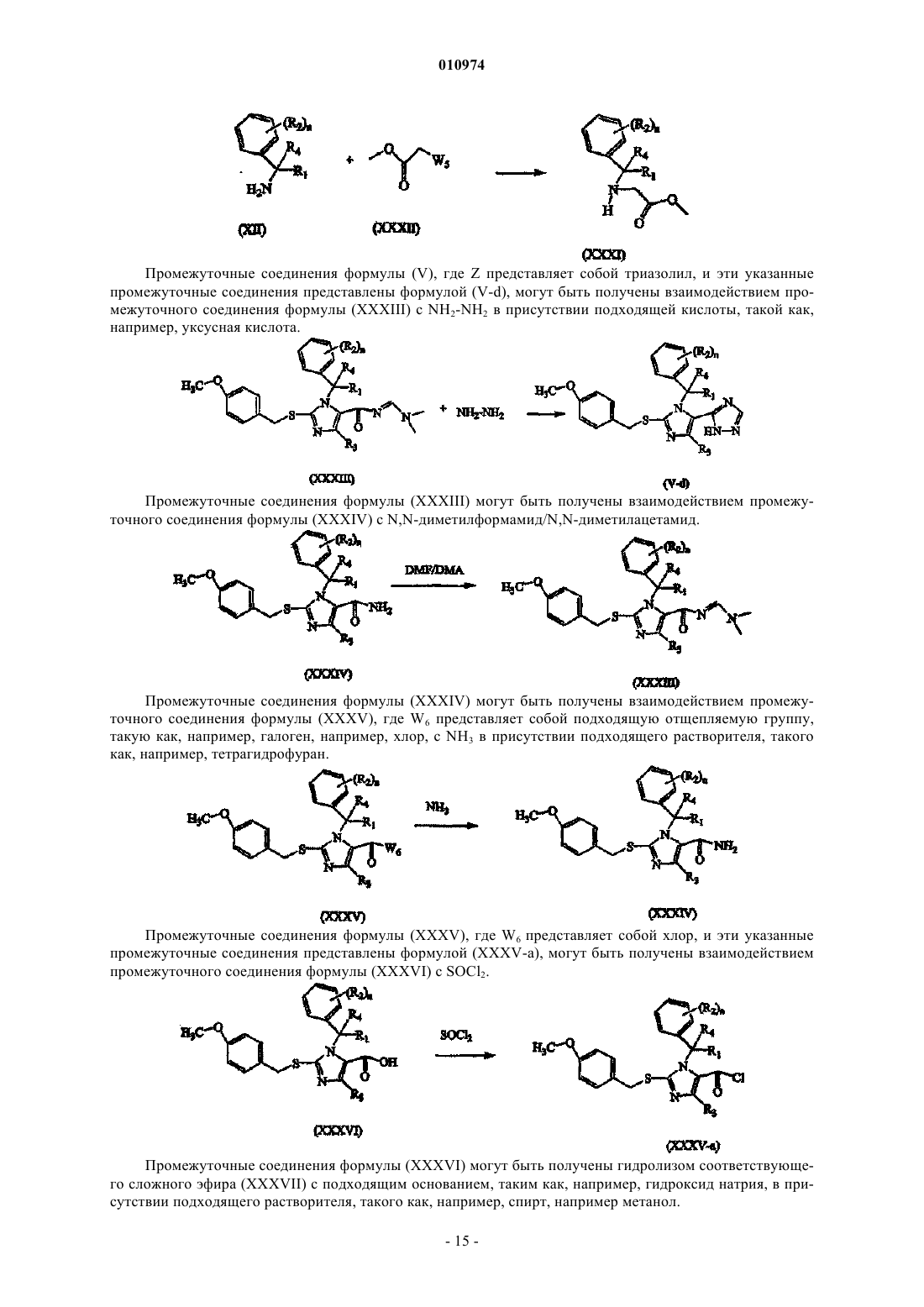
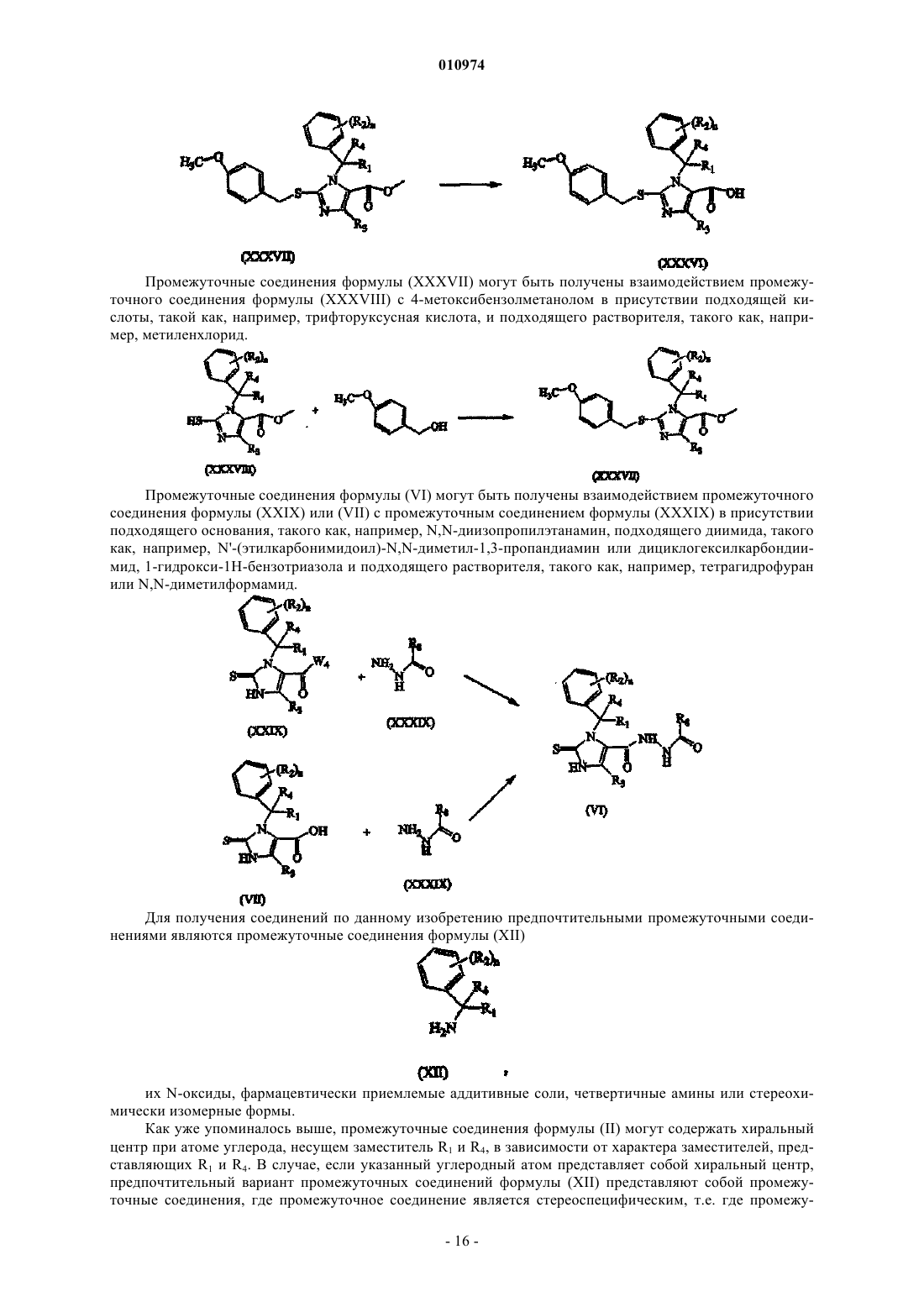
Меркаптоимидазолы в качестве антагонистов рецепторов ccr2
Номер патента: 10974
Опубликовано: 30.12.2008
Авторы: Дойон Жюльен Жорж Пьер-Оливье, Кусеманс Эрвин, Букс Густаф Мария, Ван Ломмен Ги Розалия Эген
Формула / Реферат
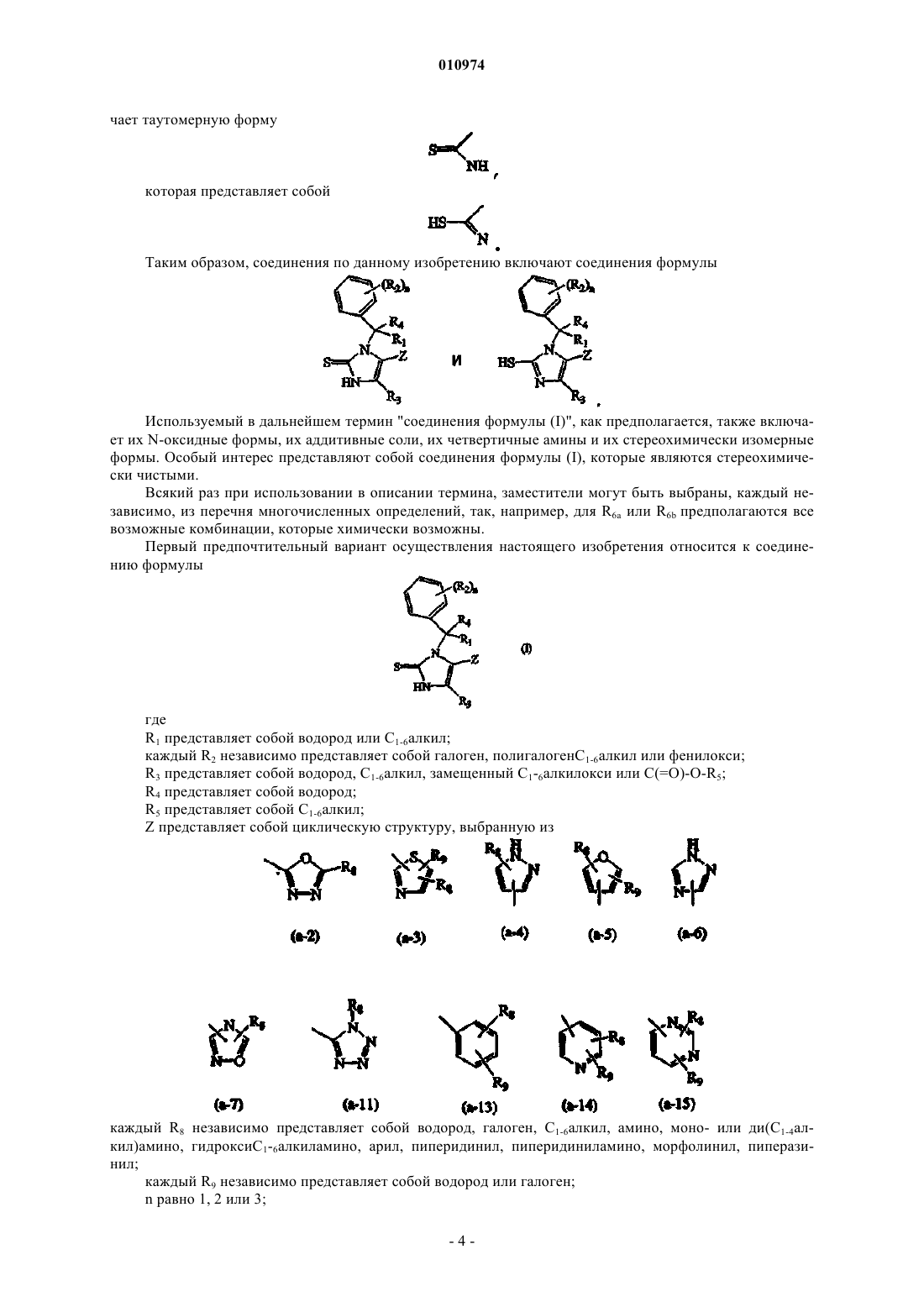
1. Соединение формулы (I)
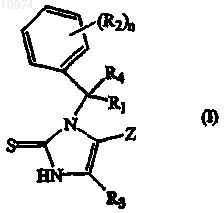
его N-оксид, фармацевтически приемлемая аддитивная соль, его четвертичный амин или стереохимически изомерная форма, где
R1 представляет собой водород или C1-6алкил;
каждый R2 независимо представляет собой галоген, полигалогенС1-6алкил или фенилокси;
R3 представляет собой водород, C1-6алкил, замещенный C1-6алкилокси или С (=O) -O-R5;
R4 представляет собой водород;
R5 представляет собой C1-6алкил;
Z представляет собой циклическую структуру, выбранную из
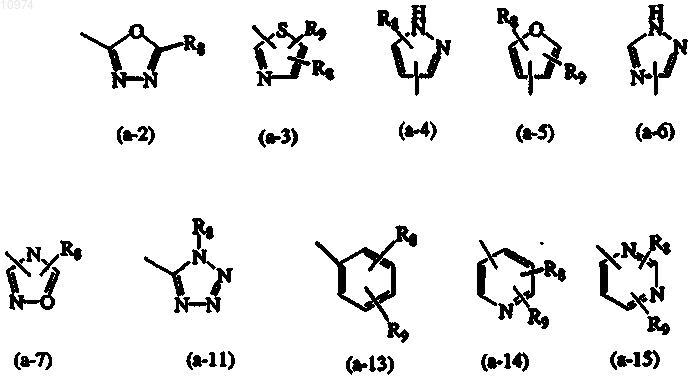
каждый R8 независимо представляет собой водород, галоген, C1-6алкил, амино, моно- или ди(C1-4алкил) амино, гидроксиС1-6алкиламино, арил, пиперидинил, пиперидиниламино, морфолинил, пиперазинил;
каждый R9 независимо представляет собой водород или галоген;
n равно 1, 2 или 3;
арил представляет собой фенил или фенил, замещенный одним или двумя галогенами.
2. Соединение по п.1, где R2 представляет собой галоген.
3. Соединение по п.1 или 2, где Z представляет собой циклическую систему, выбранную из (а-2) или (а-15).
4. Соединение по любому из пп.1-3, где R3 представляет собой водород или C(=O)-O-R5.
5. Соединение по любому из предшествующих пунктов, где R1 представляет собой C1-6алкил.
6. Соединение по любому из предшествующих пунктов, где n равно 2.
7. Соединение по любому из предшествующих пунктов, где соединение является стереохимически чистым.
8. Применение соединения по любому из пп.1-7 для получения лекарственного средства для предотвращения или лечения заболеваний, опосредованных через активацию рецептора CCR2.
9. Применение по п.8, где заболевание представляет собой воспалительное заболевание.
10. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и в качестве активного компонента терапевтически эффективное количество соединения по любому из пп.1-7.
11. Способ получения композиции по п.10, отличающийся тем, что фармацевтически приемлемый носитель смешивают с терапевтически эффективным количеством соединения по любому из пп.1-7 с получением однородной смеси.
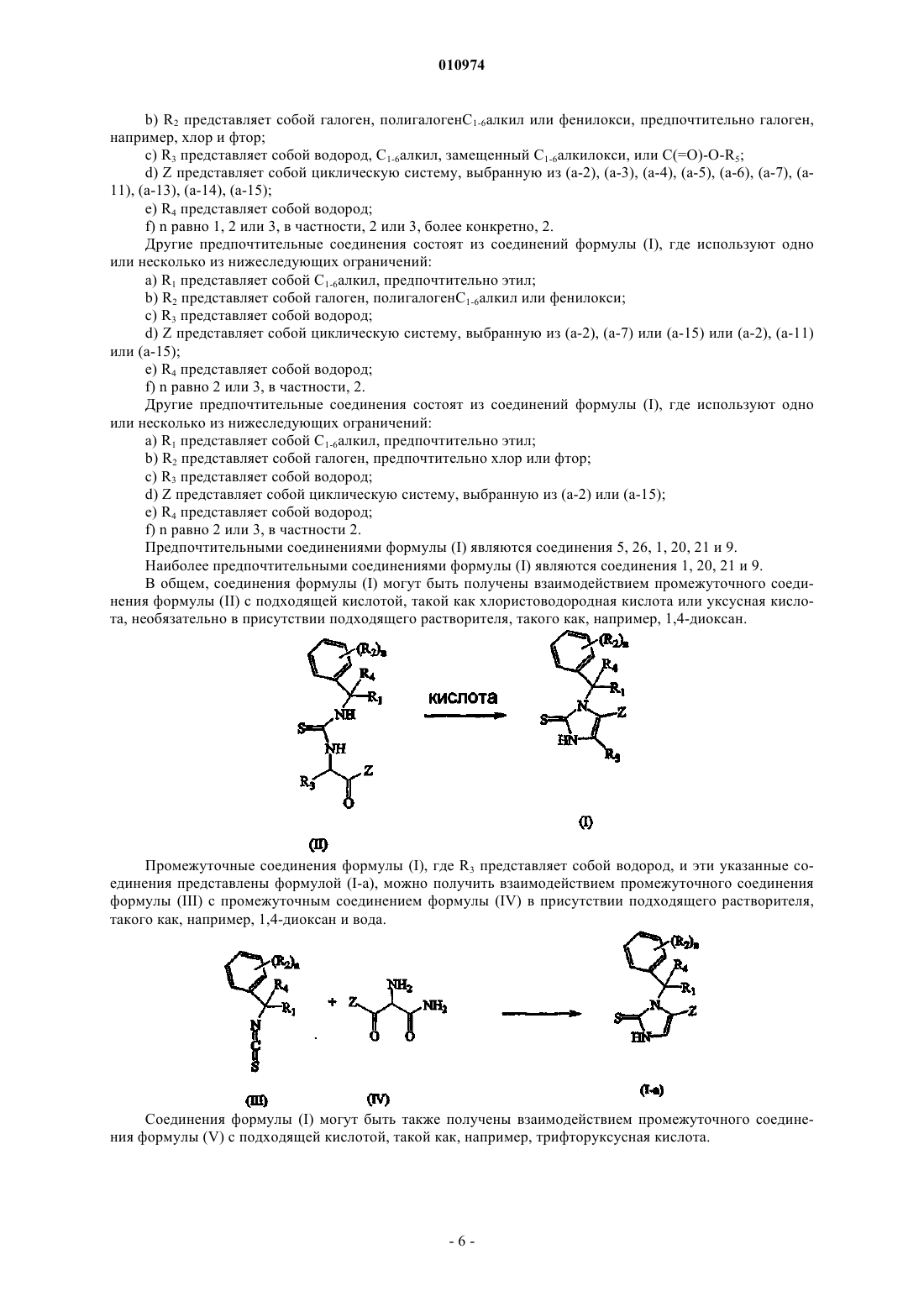
12. Способ получения соединения по п.1, включающий взаимодействие промежуточного соединения формулы (II) с соответствующей кислотой необязательно в присутствии подходящего растворителя
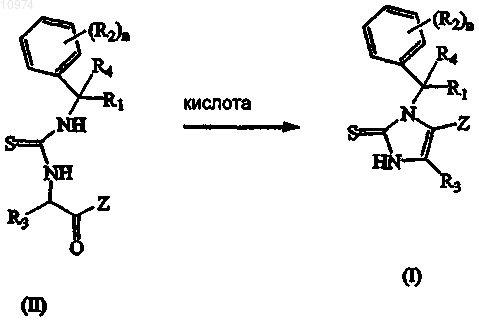
где R1, R2, R3, R4, Z и n такие, как определены в п.1; или, если это требуется, превращение соединений формулы (I) друг в друга, следуя известным в данной области техники превращениям, и далее, если это необходимо, превращение соединений формулы (I) в терапевтически активную нетоксичную аддитивную соль кислоты обработкой кислотой, или в терапевтически активную нетоксичную аддитивную соль основания путем обработки основанием, или наоборот, превращение формы аддитивной соли кислоты в свободное основание обработкой щелочью, или превращение аддитивной соли основания в свободную кислоту обработкой кислотой; и, если это требуется, получение его стереохимически изомерных форм, его четвертичных аминов или его N-оксидных форм.
13. Способ получения соединения по п.1, включающий взаимодействие промежуточного соединения формулы (III) с промежуточным соединением формулы (IV) в присутствии подходящего растворителя

где R1, R2, R4, Z и n такие, как определены в п.1; или, если это требуется, превращение соединений формулы (I) друг в друга, следуя известным в данной области техники превращениям, и далее, если это необходимо, превращение соединений формулы (I) в терапевтически активную нетоксичную аддитивную соль кислоты обработкой кислотой, или в терапевтически активную нетоксичную аддитивную соль основания путем обработки основанием, или наоборот, превращение формы аддитивной соли кислоты в свободное основание обработкой щелочью, или превращение аддитивной соли основания в свободную кислоту обработкой кислотой; и, если это требуется, получение его стереохимически изомерных форм, его четвертичных аминов или его N-оксидных форм.
14. Способ получения соединения по п.1, включающий взаимодействие промежуточного соединения формулы (V) с подходящей кислотой
где R1, R2, R3, R4, Z и n такие, как определены в п.1; или, если это требуется, превращение соединений формулы (I) друг в друга, следуя известным в данной области техники превращениям, и далее, если это необходимо, превращение соединений формулы (I) в терапевтически активную нетоксичную аддитивную соль кислоты обработкой кислотой, или в терапевтически активную нетоксичную аддитивную соль основания путем обработки основанием, или наоборот, превращение формы аддитивной соли кислоты в свободное основание обработкой щелочью, или превращение аддитивной соли основания в свободную кислоту обработкой кислотой; и, если это требуется, получение его стереохимически изомерных форм, его четвертичных аминов или его N-оксидных форм.
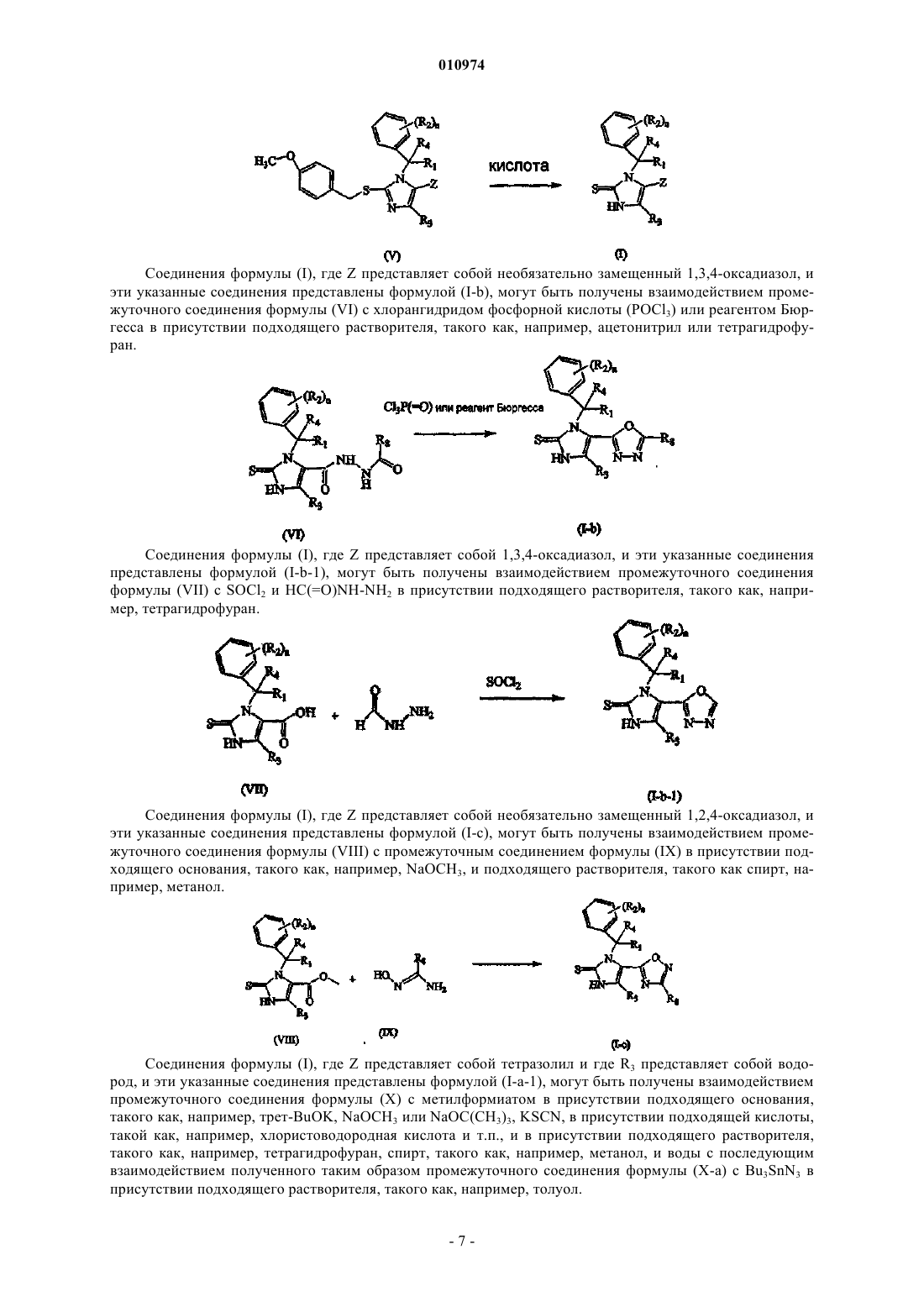
15. Способ получения соединения по п.1, включающий взаимодействие промежуточного соединения формулы (VI) с хлорангидридом фосфорной кислоты (POCl3) или реагентом Бюргесса в присутствии подходящего растворителя
где R1, R2, R3, R4, R8 и n такие, как определены в п.1; или, если это требуется, превращение соединений формулы (I) друг в друга, следуя известным в данной области техники превращениям, и далее, если это необходимо, превращение соединений формулы (I) в терапевтически активную нетоксичную аддитивную соль кислоты обработкой кислотой, или в терапевтически активную нетоксичную аддитивную соль основания путем обработки основанием, или наоборот, превращение формы аддитивной соли кислоты в свободное основание обработкой щелочью, или превращение аддитивной соли основания в свободную кислоту обработкой кислотой; и, если это требуется, получение его стереохимически изомерных форм, его четвертичных аминов или его N-оксидных форм.
16. Способ получения соединения по п.1, включающий взаимодействие промежуточного соединения формулы (VII) с SOCl2 и НС(=O)NH-NH2 в присутствии подходящего растворителя
где R1, R2, R3, R4 и n такие, как определены в п.1; или, если это требуется, превращение соединений формулы (I) друг в друга, следуя известным в данной области техники превращениям, и далее, если это необходимо, превращение соединений формулы (I) в терапевтически активную нетоксичную аддитивную соль кислоты обработкой кислотой, или в терапевтически активную нетоксичную аддитивную соль основания путем обработки основанием, или наоборот, превращение формы аддитивной соли кислоты в свободное основание обработкой щелочью, или превращение аддитивной соли основания в свободную кислоту обработкой кислотой; и, если это требуется, получение его стереохимически изомерных форм, его четвертичных аминов или его N-оксидных форм.
17. Способ получения соединения по п.1, включающий взаимодействие промежуточного соединения формулы (VIII) с промежуточным соединением формулы (IX) в присутствии подходящего основания и подходящего растворителя
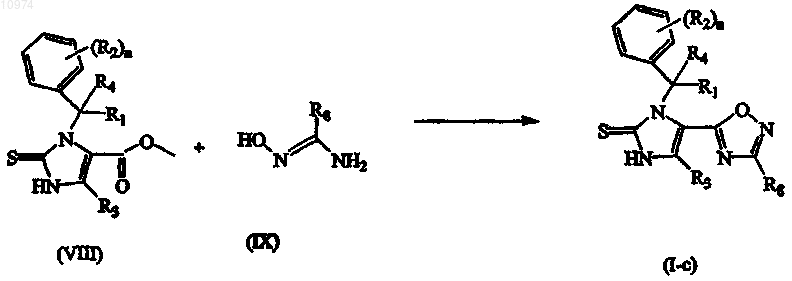
где R1, R2, R3, R4, R8 и n такие, как определены в п.1; или, если это требуется, превращение соединений формулы (I) друг в друга, следуя известным в данной области техники превращениям, и далее, если это необходимо, превращение соединений формулы (I) в терапевтически активную нетоксичную аддитивную соль кислоты обработкой кислотой, или в терапевтически активную нетоксичную аддитивную соль основания путем обработки основанием, или наоборот, превращение формы аддитивной соли кислоты в свободное основание обработкой щелочью, или превращение аддитивной соли основания в свободную кислоту обработкой кислотой; и, если это требуется, получение его стереохимически изомерных форм, его четвертичных аминов или его N-оксидных форм.
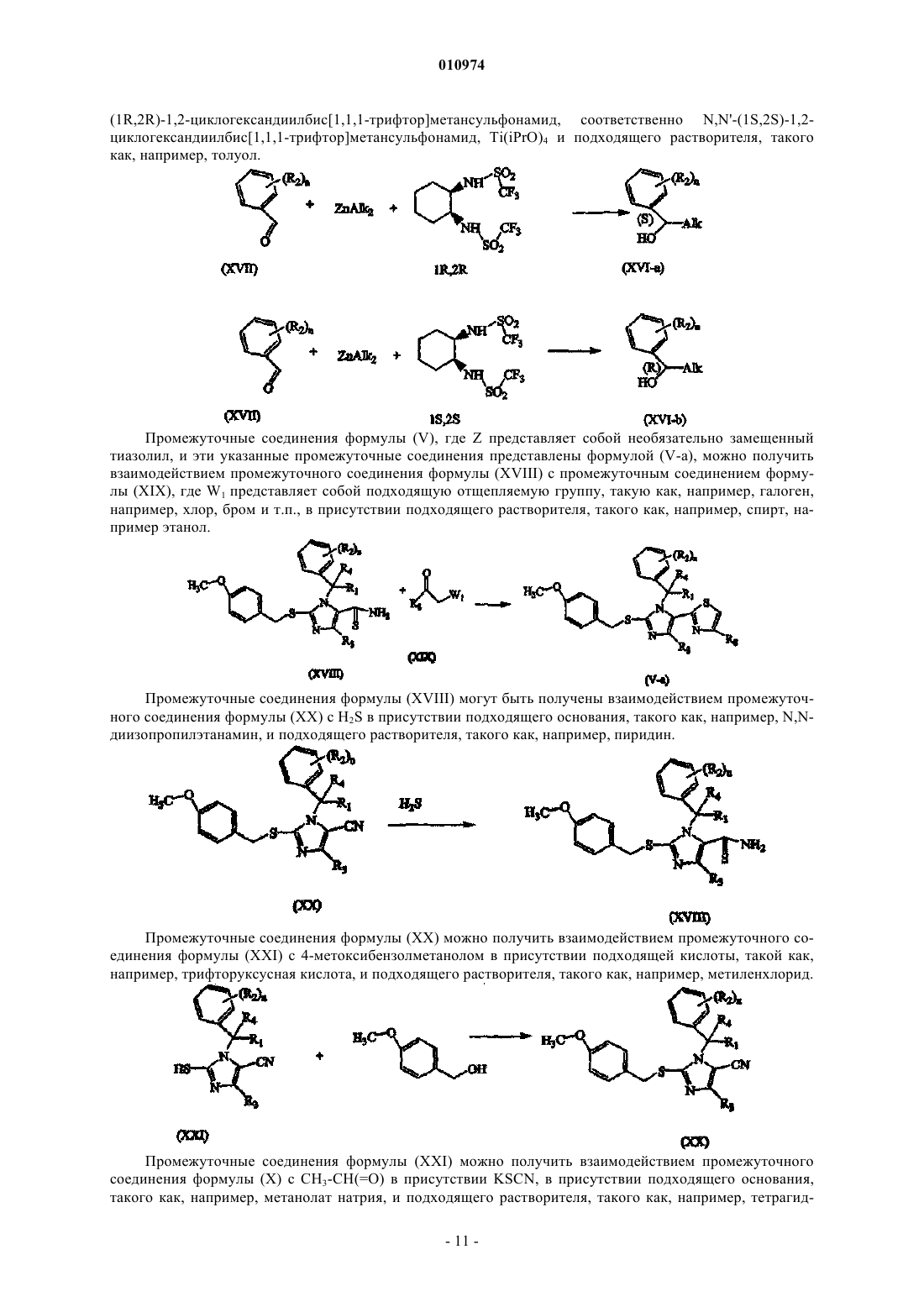
18. Способ получения соединения по п.1, включающий взаимодействие промежуточного соединения формулы (X) с метилформиатом, KSCN в присутствии подходящего основания, подходящей кислоты и подходящего растворителя, с последующим взаимодействием полученного таким образом промежуточного соединения формулы (Х-а) с Bu3SnN3 в присутствии подходящего растворителя
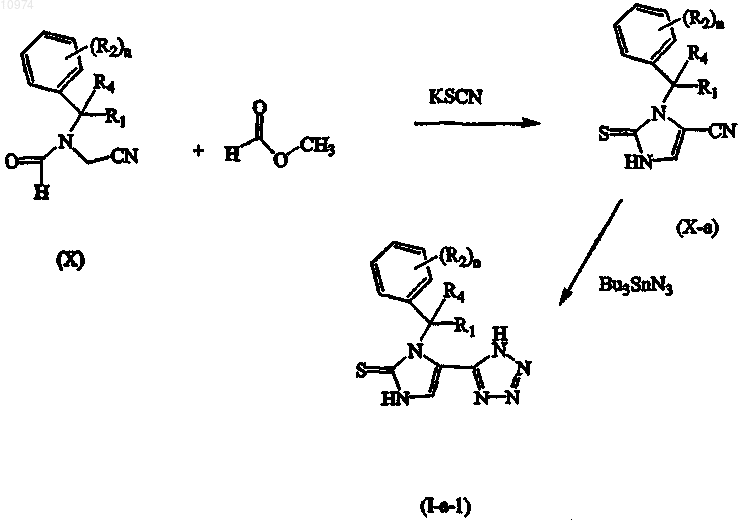
где R1, R2, R4 и n такие, как определены в п.1; или, если это требуется, превращение соединений формулы (I) друг в друга, следуя известным в данной области техники превращениям, и далее, если это необходимо, превращение соединений формулы (I) в терапевтически активную нетоксичную аддитивную соль кислоты обработкой кислотой, или в терапевтически активную нетоксичную аддитивную соль основания путем обработки основанием, или наоборот, превращение формы аддитивной соли кислоты в свободное основание обработкой щелочью, или превращение аддитивной соли основания в свободную кислоту обработкой кислотой; и, если это требуется, получение его стереохимически изомерных форм, его четвертичных аминов или его N-оксидных форм.
Текст
010974 Настоящее изобретение относится к производным меркаптоимидазола, имеющих антагонистические свойства в отношении рецепторов CCR2. Кроме того, данное изобретение относится к способам их получения и фармацевтическим композициям, содержащим вышеуказанные соединения. Изобретение также относится к применению указанных соединений для получения лекарственного средства для профилактики или лечения заболеваний, опосредованных через активацию рецептора CCR2, в частности,рецептора CCR2B. В международной публикации WO 02/066458 раскрываются производные 2-тиозамещенного имидазола, обладающие иммуномодулирующей и/или ингибирующей активностью в отношении освобождения цитокинов, особенно TNF- и IL-S. Патент Франции 1487326 относится к производным тиоимидазола, используемым в качестве анальгетика и имеющим сосудорасширяющую активность.FR 6751 М раскрывает производные тиоимидазола в качестве седативных средств и анальгезирующих средств. Патент США 3850944 раскрывает производные 2-меркапто-5-(3-пиридил)имидазола, имеющие противовоспалительную активность. Европейский патент 0277384 раскрывает производные 1H-имидазол-5-карбоновой кислоты для сдерживания роста сорняков. Соединения по данному изобретению отличаются от соединений предшествующего уровня по структуре, фармакологической активности и/или фармакологическому воздействию (эффективности). Один аспект настоящего изобретения относится к соединению формулы его N-оксиду, фармацевтически приемлемой аддитивной соли, его четвертичному амину или стереохимически изомерной форме, где R1 представляет собой водород или C1-6 алкил; каждый R2 независимо представляет собой галоген, полигалогенC1-6 алкил или фенилокси;Z представляет собой циклическую структуру, выбранную из каждый R8 независимо представляет собой водород, галоген, C1-6 алкил, амино, моно- или ди(С 1 амино, гидроксиС 1-6 алкиламино, арил, пиперидинил, пиперидиниламино, морфолинил, пиперазинил; каждый R9 независимо представляет собой водород или галоген;n равно 1, 2 или 3; арил представляет собой фенил или фенил, замещенный одним или двумя галогенами. Настоящее изобретение также относится к применению соединения для получения лекарственного средства для профилактики или лечения заболеваний,опосредованных через активацию рецептора CCR2, в частности, для профилактики или лечения воспалительных заболеваний, и это указанное соединение представляет собой соединение формулы (I) 4 алкил) его N-оксид, его фармацевтически приемлемую аддитивную соль, его четвертичный амин или стереохимически изомерную форму, гдеR1 представляет собой водород или C1-6 алкил; каждый R2 независимо представляет собой галоген, полигалогенC1-6 алкил или фенилокси;Z представляет собой циклическую структуру, выбранную из каждый R8 независимо представляет собой водород, галоген,C1-6 алкил, амино, моно- или ди(С 1-4 алкил)амино, гидроксиС 1-6 алкиламино, арил, пиперидинил, пиперидиниламино, морфолинил, пиперазинил; каждый R9 независимо представляет собой водород или галоген;n равно 1, 2 или 3; арил представляет собой фенил или фенил, замещенный одним или двумя галогенами. Используемый в описании термин "С 1-4 алкил" в качестве группы или части группы означает насыщенные углеводородные радикалы с прямой или разветвленной цепью, имеющие от 1 до 4 углеродных атомов, такие как метил, этил, пропил, 1-метилэтил, бутил; C1-6 алкил в качестве группы или части группы означает насыщенные углеводородные радикалы с прямой или разветвленной цепью, имеющие от 1 до 6 углеродных атомов, такие как группа, определенная для С 1-4 алкила, и пентил, гексил, 2-метилбутил и т.п.; Термин "галоген" является общим обозначением для фтора, хлора, брома и йода. Термин "полигалогенметил", используемый в описании в качестве группы или части группы, подразумевает моно- или полигалогензамещенный метил, в частности, метил с одним или несколькими атомами фтора, например,дифторметил или трифторметил; полигалогенС 1-6 алкил в качестве группы или части группы подразумевает моно- или полигалогензамещенный C1-6 алкил, например, группы, определенные для полигалогенметила, 1,1-дифторэтила и т.п. В случае когда в пределах определения "полигалогенметил" или "полигалогенС 1-6 алкил" с алкильной группой связаны больше чем один атом галогена, указанные атомы галогена могут быть одинаковыми или отличными друг от друга. Линии, начерченные в направлении от заместителей внутрь циклических структур, указывают на то, что связь может быть присоединена к любому из подходящих атомов цикла. В тех случаях, когда линии начерчены в направлении внутрь бициклических структур, это означает, что связь может быть присоединена к любому из подходящих кольцевых атомов любого одного из двух колец бициклической структуры. В случае терапевтического использования соли соединений формулы (I) представляют собой соли,в которых противоион является фармацевтически приемлемым. Однако соли кислот и оснований, которые не являются фармацевтически приемлемыми, могут также найти применение, например, для получения или очистки фармацевтически приемлемого соединения. Все соли, независимо от того, являются-2 010974 ли они фармацевтически приемлемыми или нет, входят в объем настоящего изобретения. Упомянутые выше фармацевтически приемлемые аддитивные соли, как подразумевается, включают терапевтически активные нетоксичные формы аддитивных солей кислоты, которые способны образовывать соединения формулы (I). Последние могут быть удобно получены обработкой основной формы соответствующими кислотами, такими как неорганические кислоты, например, галогенводородные кислоты, например, хлористо-водородная, бромисто-водородная и т.п.; серная кислота; азотная кислота; фосфорная кислота и т.п.; или органические кислоты, например, уксусная, пропановая, гидроксиуксусная, 2-гидроксипропановая, 2-оксопропановая, щавелевая, малоновая, янтарная, малеиновая, фумаровая,яблочная, винная, 2-гидрокси-1, 2, 3-пропантрикарбоновая, метансульфоновая, этансульфоновая, бензолсульфоновая, 4-метилбензолсульфоновая, циклогексансульфаминовая, 2-гидроксибензойная, 4-амино-2 гидроксибензойная и тому подобные кислоты. И наоборот, солевая форма может быть превращена обработкой щелочью в свободную основную форму. Соединения формулы (I), содержащие кислые протоны, могут быть превращены в соответствующие терапевтически активные нетоксичные формы аддитивных солей металлов или амина обработкой подходящими органическими и неорганическими основаниями. Подходящие солевые формы оснований включают, например, соли аммония, соли щелочных и щелочно-земельных металлов, например, соли лития,натрия, калия, магния, кальция и т.п., соли с органическими основаниями, например, соли первичных,вторичных и третичных алифатических и ароматических аминов, таких как метиламин, этиламин, пропиламин, изопропиламин, четыре изомера бутиламина, диметиламин, диэтиламин, диэтаноламин, дипропиламин, диизопропиламин, ди-н-бутиламин, пирролидин, пиперидин, морфолин, триметиламин,триэтиламин, трипропиламин, хинуклидин, пиридин, хинолин и изохинолин, бензатин, N-метил-Dглюкамин, 2-амино-2-(гидроксиметил)-1,3-пропандиол, гидрабамин, и соли с аминокислотами, такими как, например, аргинин, лизин и т.п. И наоборот, солевая форма может быть превращена обработкой кислотой в свободную кислотную форму. Термин "аддитивная соль" также включает гидраты и аддитивные формы растворителя, которые могут образовывать соединения формулы (I). Примерами таких форм являются, например, гидраты, алкоголяты и т.п. Используемый ранее термин "четвертичный амин" означает соли четвертичного аммония, которые способны образовывать соединения формулы (I) путем взаимодействия основного азота соединения формулы (I) с подходящим четвертичным агентом, таким как, например, необязательно замещенный алкилгалогенид, арилгалогенид или арилалкилгалогенид, например, метилиодид или бензилиодид. Могут быть также использованы и другие реагенты с легко отщепляемыми группами, такие как алкилтрифторметансульфонаты, алкилметансульфонаты и алкил-п-толуолсульфонаты. Четвертичный амин имеет положительно заряженный азот. Фармацевтически приемлемые противоионы включают хлор, бром, йод,трифторацетат и ацетат. Желаемый противоион может быть введен с использованием ионообменных смол (ионитов).N-оксидные формы по данному изобретению подразумевают включение соединений формулы (I), в которых один или несколько третичных атомов азота окислены в так называемый N-оксид. Следует иметь в виду, что некоторые из соединений формулы (I) и их N-оксидов, аддитивных солей, четвертичных аминов и стереохимически изомерных форм могут содержать один или несколько центров хиральности и поэтому могут существовать в виде стереохимически изомерных форм. Используемый выше термин "стереохимически изомерные формы" означает все возможные стереоизомерные формы, которые могут иметь соединения формулы (I) и их N-оксиды, аддитивные соли, четвертичные амины или физиологически функциональные производные. Если не упомянуто выше или не оговорено особо, химическое обозначение соединений означает смесь всех возможных стереохимически изомерных форм, при этом указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры, а также каждую из индивидуальных изомерных форм (соединений) формулы (I) и их N-оксидов, солей, сольватов или четвертичных аминов, в основном, в свободном состоянии, т.е. связанную с меньше чем 10%, предпочтительно меньше чем 5%, в частности, меньше чем 2% и наиболее предпочтительно меньше чем 1% других изомеров. Таким образом, когда соединение формулы (I) определяют, например, как (Е), это означает, что соединение, по существу, не содержит изомера (Z). В частности, стереогенные центры могут иметь R- или S-конфигурацию; заместители на двухвалентных циклических (частично) насыщенных радикалах могут иметь либо цис-, либо трансконфигурацию. Соединения, заключающие в себе двойные связи, могут иметь Е ('против')- или Z('вместе')-стереохимию при указанной двойной связи. Термины "цис, транс, R, S, E Z" общеизвестны специалисту средней квалификации в данной области. Предполагается, что все стереохимически изомерные формы соединений формулы (I) включены в объем данного изобретения. Некоторые из соединений формулы (I) могут также существовать в соответствующей таутомерной форме. Предполагается, что такие формы, хотя они и не представлены в явном виде в вышеупомянутой формуле (I), входят в объем настоящего изобретения. Например, подразумевается, что формула (I) вклю-3 010974 чает таутомерную форму Таким образом, соединения по данному изобретению включают соединения формулы Используемый в дальнейшем термин "соединения формулы (I)", как предполагается, также включает их N-оксидные формы, их аддитивные соли, их четвертичные амины и их стереохимически изомерные формы. Особый интерес представляют собой соединения формулы (I), которые являются стереохимически чистыми. Всякий раз при использовании в описании термина, заместители могут быть выбраны, каждый независимо, из перечня многочисленных определений, так, например, для R6a или R6b предполагаются все возможные комбинации, которые химически возможны. Первый предпочтительный вариант осуществления настоящего изобретения относится к соединению формулыR1 представляет собой водород или С 1-6 алкил; каждый R2 независимо представляет собой галоген, полигалогенC1-6 алкил или фенилокси;Z представляет собой циклическую структуру, выбранную из каждый R8 независимо представляет собой водород, галоген, С 1-6 алкил, амино, моно- или ди(С 1-4 алкил)амино, гидроксиС 1-6 алкиламино, арил, пиперидинил, пиперидиниламино, морфолинил, пиперазинил; каждый R9 независимо представляет собой водород или галоген;-4 010974 арил представляет собой фенил или фенил, замещенный одним или двумя галогенами. Второй предпочтительный вариант представляет собой соединения формулы (I) или любую подгруппу их, упомянутую выше в качестве предпочтительного варианта, где R3 представляет собой водород или C(=O)-R7. Третий предпочтительный вариант представляет собой соединения формулы (I) или любую подгруппу их, упомянутую выше в качестве предпочтительного варианта, где Z не является 3-пиридилом. Четвертый предпочтительный вариант представляет собой соединения формулы (I) или любую подгруппу их, упомянутую выше в качестве предпочтительного варианта, где n равно 2 или 3, в частности, n равно 2. Пятый предпочтительный вариант представляет собой соединения формулы (I) или любую подгруппу их, упомянутую выше в качестве предпочтительного варианта, где n равно 2 и указанные два заместителя находятся в мета- и пара-положении. Шестой предпочтительный вариант представляет собой соединения формулы (I) или любую подгруппу их, упомянутую выше в качестве предпочтительного варианта, где Z представляет собой циклическую структуру, выбранную из (а-2), (а-3), (а-4), (а-5), (а-6), (а-7), (а-11), (а-13), (а-14), (а-15); предпочтительно циклическую структуру, выбранную из (а-2), (а-3), (а-4), (а-5), (a-6), (а-7), (а-11), (а-13), (а-14) или (а-15); более предпочтительно циклическую структуру, выбранную из (а-2), (а-3), (а-4), (а-5), (a-6),(а-7), (а-11), (а-13), (а-14) или (а-15); еще более предпочтительно циклическую структуру, выбранную из(а-2), (а-11) или (а-15); наиболее предпочтительно циклическую структуру, выбранную из (а-2) или (а 15). Седьмой предпочтительный вариант представляет собой соединения формулы (I) или любую подгруппу их, упомянутую выше в качестве предпочтительного варианта, где Z представляет собой циклическую структуру, выбранную из (а-2) или (а-15) и R3 представляет собой водород. Восьмой предпочтительный вариант представляет собой соединения формулы (I) или любую подгруппу их, упомянутую выше в качестве предпочтительного варианта, где R2 представляет собой галоген, в частности, хлор, фтор, наиболее предпочтительно галоген, в частности, хлор или фтор. Девятый предпочтительный вариант представляет собой соединения формулы (I) или любую подгруппу их, упомянутую выше в качестве предпочтительного варианта, где R1 представляет собой водород, метил, этил, н-пропил; более предпочтительно R1 представляет собой C1-6 алкил, в частности, метил,этил и пропил, более конкретно, метил, этил или н-пропил; наиболее предпочтительно R1 представляет собой этил. Десятый предпочтительный вариант представляет собой соединения формулы (I) или любую подгруппу их, упомянутую выше в качестве предпочтительного варианта, которые являются стереохимически чистыми. Одиннадцатый предпочтительный вариант представляет собой соединения формулы (I) или любую подгруппу их, упомянутую выше в качестве предпочтительного варианта, где атом углерода, несущий R1 и R4 заместитель, имеет конфигурацию (S), т.е. соединение формулы (I') его N-оксид, его фармацевтически приемлемую аддитивную соль, его четвертичный амин или стереохимически изомерную форму. Также предпочтительными соединениями являются соединения формулы (I), где используют одно или несколько, предпочтительно все из нижеследующих ограничений:d) Z представляет собой циклическую систему, выбранную из (а-2), (а-3), (а-4), (а-5), (а-6), (а-7), (а 11), (а-13), (а-14), (а-15);f) n равно 2 или 3. Кроме того, предпочтительные соединения состоят из соединений формулы (I), где используют одно или несколько из нижеследующих ограничений:a) R1 представляет собой C1-6 алкил, предпочтительно этил или н-пропил, более предпочтительно этил;d) Z представляет собой циклическую систему, выбранную из (а-2), (а-3), (а-4), (а-5), (a-6), (а-7), (а 11), (а-13), (а-14), (а-15);f) n равно 1, 2 или 3, в частности, 2 или 3, более конкретно, 2. Другие предпочтительные соединения состоят из соединений формулы (I), где используют одно или несколько из нижеследующих ограничений:d) Z представляет собой циклическую систему, выбранную из (а-2), (а-7) или (а-15) или (а-2), (а-11) или (а-15);f) n равно 2 или 3, в частности, 2. Другие предпочтительные соединения состоят из соединений формулы (I), где используют одно или несколько из нижеследующих ограничений:b) R2 представляет собой галоген, предпочтительно хлор или фтор;d) Z представляет собой циклическую систему, выбранную из (а-2) или (а-15);f) n равно 2 или 3, в частности 2. Предпочтительными соединениями формулы (I) являются соединения 5, 26, 1, 20, 21 и 9. Наиболее предпочтительными соединениями формулы (I) являются соединения 1, 20, 21 и 9. В общем, соединения формулы (I) могут быть получены взаимодействием промежуточного соединения формулы (II) с подходящей кислотой, такой как хлористоводородная кислота или уксусная кислота, необязательно в присутствии подходящего растворителя, такого как, например, 1,4-диоксан. Промежуточные соединения формулы (I), где R3 представляет собой водород, и эти указанные соединения представлены формулой (I-а), можно получить взаимодействием промежуточного соединения формулы (III) с промежуточным соединением формулы (IV) в присутствии подходящего растворителя,такого как, например, 1,4-диоксан и вода. Соединения формулы (I) могут быть также получены взаимодействием промежуточного соединения формулы (V) с подходящей кислотой, такой как, например, трифторуксусная кислота. Соединения формулы (I), где Z представляет собой необязательно замещенный 1,3,4-оксадиазол, и эти указанные соединения представлены формулой (I-b), могут быть получены взаимодействием промежуточного соединения формулы (VI) с хлорангидридом фосфорной кислоты (POCl3) или реагентом Бюргесса в присутствии подходящего растворителя, такого как, например, ацетонитрил или тетрагидрофуран. Соединения формулы (I), где Z представляет собой 1,3,4-оксадиазол, и эти указанные соединения представлены формулой (I-b-1), могут быть получены взаимодействием промежуточного соединения формулы (VII) с SOCl2 и HC(=O)NH-NH2 в присутствии подходящего растворителя, такого как, например, тетрагидрофуран. Соединения формулы (I), где Z представляет собой необязательно замещенный 1,2,4-оксадиазол, и эти указанные соединения представлены формулой (I-c), могут быть получены взаимодействием промежуточного соединения формулы (VIII) с промежуточным соединением формулы (IX) в присутствии подходящего основания, такого как, например, NaOCH3, и подходящего растворителя, такого как спирт, например, метанол. Соединения формулы (I), где Z представляет собой тетразолил и где R3 представляет собой водород, и эти указанные соединения представлены формулой (I-а-1), могут быть получены взаимодействием промежуточного соединения формулы (X) с метилформиатом в присутствии подходящего основания,такого как, например, трет-BuOK, NaOCH3 или NaOC(CH3)3, KSCN, в присутствии подходящей кислоты,такой как, например, хлористоводородная кислота и т.п., и в присутствии подходящего растворителя,такого как, например, тетрагидрофуран, спирт, такого как, например, метанол, и воды с последующим взаимодействием полученного таким образом промежуточного соединения формулы (Х-а) с Bu3SnN3 в присутствии подходящего растворителя, такого как, например, толуол. Соединения формулы (I') можно получить согласно вышеописанным реакциям, но исходя из промежуточного соединения, в котором углеродный атом, несущий R1 и R4 заместитель, имеет конфигурацию (S). Альтернативно, соединения формулы (I), где углеродный атом, несущий R1 и R4 заместитель, имеет конфигурацию (R), можно получить согласно вышеописанным реакциям, но исходя из промежуточного соединения, в котором углеродный атом, несущий R1 и R4 заместитель, имеет конфигурацию (R). Кроме того, соединения формулы (I) можно получить путем превращения соединений формулы (I) друг в друга в соответствии с известными в данной области техники реакциями превращения групп. Соединения формулы (I) могут быть превращены в соответствующие N-оксидные формы, следуя общеизвестным способам превращения трехвалентного азота в его N-оксидную форму. Указанная реакция N-окисления может быть осуществлена путем взаимодействия исходного продукта формулы (I) с соответствующим органическим или неорганическим пероксидом. Подходящие неорганические пероксиды включают, например, пероксид водорода, пероксиды щелочных металлов или щелочно-земельных металлов, например, пероксид натрия, пероксид калия; подходящие органические пероксиды могут включать пероксикислоты, такие как, например, бензолкарбопероксовая кислота или галогензамещенная бензолкарбопероксовая кислота, например, 3-хлорбензолкарбопероксовая кислота, пероксоалкановые кислоты,например,пероксоуксусная кислота,алкилгидропероксиды,например,третбутилгидропероксид. Подходящими растворителями являются, например, вода, низшие спирты, например, этанол и т.п., углеводороды, например, толуол, кетоны, например, 2-бутанон, галогенированные углеводороды, например дихлорметан, и смеси таких растворителей. Соединения формулы (I), где R3 представляет собой С(=O)-O-C1-6 алкил, могут быть превращены в соединение формулы (I), где R3 представляет собой СН 2-ОН, реакцией с подходящим восстановителем,таким как, например, LiHBEt3 в присутствии подходящего растворителя, такого как, например, тетрагидрофуран. Соединения формулы (I), где R3 представляет собой С(=O)-O-С 1-6 алкил, может быть также превращены в соединение формулы (I), где R3 представляет собой С(=O)-ОН, путем реакции с подходящим основанием, таким как NaOH, в присутствии подходящего растворителя, такого как, например, H2O, тетрагидрофуран или подходящий спирт, например, метанол и т.п. Соединения формулы (I), где R3 представляет собой С(=O)-O-C1-6 алкил, могут быть также превращены в соединение формулы (I), где R3 представляет собой С(=O) -NR6aR6b, реакцией с соответствующим основанием формулы NHR6aR6b в подходящем растворителе, таком как, например, H2O. Соединения формулы (I), где R3 представляет собой С(=O)-O-Н, могут быть превращены в соединение формулы (I), где R3 представляет собой С(=O) -NR6aR6b, реакцией с соответствующим основанием формулы NHR6aR6b в присутствии N'-(этилкарбонимидоил)-N,N-диметил-1,3-пропандиамина, 1 гидрокси-1H-бензотриазола и подходящего растворителя, такого как, например, N,N-диметилформамид. Соединения формулы (I), где R3 представляет собой С(=O)-O-Н, могут быть также превращены в соединение формулы (I), где R3 представляет собой C(=O)-NH2, реакцией с NH4OH в присутствии SOCl2. Соединения формулы (I), где R3 представляет собой С(=O)-O-С 1-6 алкил, могут быть превращены в соединение формулы (I), где R3 представляет собой С(=O)-O-С 1-6 алкил-O-С 1-6 алкил, реакцией с НО-С 1-6 алкил-O-С 1-6 алкилом в присутствии NaBH4. Соединения формулы (I), где R3 представляет собой циано или С(=O) -O-С 1-6 алкил, могут быть превращены в соединение формулы (I), где R3 представляет собой аминокарбонил, реакцией с NH4OH. Соединения формулы (I), где R3 представляет собой циано, могут быть также превращены в соединение формулы (I), где R3 представляет собой C(=S)NR6aR6b, реакцией с гидросульфидом в присутствииN-этил-N-(1-метилэтил)-2-пропанамина в подходящем растворителе, таком как пиридин. Соединения формулы (I), где R3 представляет собой С(=O)-NR6aR6b, могут быть превращены в со-8 010974 единение формулы (I), где R3 представляет собой С(=O) -С 1-6 алкил, реакцией с хлорС 1-6 алкилMg в подходящем растворителе, таком как тетрагидрофуран. Соединения формулы (I), где R3 представляет собой С(=O)-С 1-6 алкил, могут быть превращены в соединения формулы (I), где R3 представляет собой гидроксиC1-6 алкил, реакцией с подходящим восстановителем, таким как NaBH4, в присутствии подходящего растворителя, такого как метанол. Некоторые из соединений формулы (I) и некоторые из промежуточных соединений в настоящем изобретении могут содержать асимметричный атом углерода. Чистые стереохимически изомерные формы указанных соединений и указанных промежуточных соединений можно получить, применяя известные в данной области способы. Например, диастереоизомеры могут быть разделены физическими методами, такими как селективная кристаллизация или хроматографическими методами, например противоточное распределение, жидкостная хроматография и т.п. методы. Энантиомеры могут быть получены из рацемических смесей, сначала превращением указанных рацемических смесей с подходящими разделяющими агентами, такими как, например, хиральные кислоты, в смеси диастереомерных солей или соединений; затем разделением указанных смесей диастереомерных солей или соединений физическими методами путем, например, селективной кристаллизации или хроматографическими методами, например, жидкостной хроматографией и т.п. методами; и, наконец, превращением указанных разделенных диастереомерных солей или соединений в соответствующие энантиомеры. Чистые стереохимически изомерные формы можно также получить из чистых стереохимически изомерных форм соответствующих промежуточных соединений и исходных продуктов при условии, что промежуточные (интервенирующие) реакции происходят стереоспецифически. Альтернативный способ разделения энантиомерных форм соединений формулы (I) и промежуточных соединений включает жидкостную хроматографию, в частности, жидкостную хроматографию с использованием хиральной стационарной фазы. Некоторые из промежуточных соединений и исходных продуктов являются известными соединениями и могут быть коммерчески доступными или их можно получить известными в данной области техники способами. Промежуточные соединения формулы (II) можно получить взаимодействием промежуточного соединения формулы (III) с промежуточным соединением формулы (XI) в присутствии подходящего основания, такого как, например, карбонат калия, и подходящего растворителя, такого как, например, диоксан или тетрагидрофуран и вода. Промежуточные соединения формулы (III) могут быть получены взаимодействием промежуточного соединения формулы (XII) с C(=S)Cl2 в присутствии подходящего основания, такого как, например, N,Nдиизопропилэтанамин, и подходящего растворителя, такого как, например, метиленхлорид. Промежуточные соединения формулы (XII), где R4 представляет собой водород, и эти указанные промежуточные соединения представлены формулой (XII-а), можно получить взаимодействием промежуточного соединения формулы (XIII) с подходящим восстановителем, таким как, например, Н 2, в присутствии подходящего катализатора, такого как, например, никель Ренея, необязательно подходящего каталитического яда, такого как, например, раствор тиофена, подходящего основания, такого как, например, NH3, и подходящего растворителя, такого как, например, спирт, например, метанол. Промежуточные соединения формулы (XIII) могут быть получены взаимодействием промежуточного соединения формулы (XIV) с HO-NH2 в присутствии подходящего основания, такого как, например,Na2CO3 или ацетат натрия, и подходящего растворителя, такого как, например, спирт, например, этанол,и воды. Промежуточные соединения формулы (XII) могут быть получены, как описано выше. Промежуточные соединения формулы (XII) могут содержать хиральный центр при атоме углерода, несущем R1 и R4 заместитель, в зависимости от природы заместителей, представляющих R1 и R4. В случае, если указанный углеродный атом представляет собой хиральный центр, стереоспецифические промежуточные соединения формулы (XII), представленные формулой (XII-b), могут быть получены взаимодействием промежуточного соединения формулы (XV) с трифенилфосфином, в присутствии подходящих растворителей, таких как, например, тетрагидрофуран и вода, или путем взаимодействия промежуточного соединения формулы (XV) с подходящим восстановителем, таким как, например, Н 2, в присутствии подходящего катализатора, такого как, например, Pt на угле или Pd на угле, и подходящего растворителя, такого как, например, спирт, например метанол. обозначает хиральный центр и может представлять (R) или (S) в зависимости от заместителей Rx Когда стереоспецифическое промежуточное соединение формулы (XII-b) затем подвергают взаимодействию согласно способам, описанным выше, то образующиеся при этом промежуточные соединения также являются стереоспецифическими и, наконец, образующиеся конечные соединения также являются стереоспецифическими. Промежуточные соединения формулы (XV) могут быть получены взаимодействием промежуточного соединения формулы (XVI) с дифенилфосфорилазидом в присутствии 2,3,4,6,7,8,9,10 октагидропиримидо[1,2-а]азепина и в присутствии подходящего растворителя, такого как, например,толуол. обозначает хиральный центр и может представлять (R) или (S) в зависимости от заместителей R1 Стереоспецифические промежуточные соединения формулы (XVI), где R4 представляет собой водород и R1 представляет собой метил, этил или н-пропил, и этот указанный R1 представлен Alk и указанные промежуточные соединения представлены формулами(XVI-а) и (XVI-b), можно получить взаимодействием промежуточного соединения формулы (XVII) с ZnAlk2, где Alk представляет собой метил,этил или н-пропил, в присутствии стереоспецифического катализатора, такого как, например, N,N'- 10010974 Промежуточные соединения формулы (V), где Z представляет собой необязательно замещенный тиазолил, и эти указанные промежуточные соединения представлены формулой (V-a), можно получить взаимодействием промежуточного соединения формулы (XVIII) с промежуточным соединением формулы (XIX), где W1 представляет собой подходящую отщепляемую группу, такую как, например, галоген,например, хлор, бром и т.п., в присутствии подходящего растворителя, такого как, например, спирт, например этанол. Промежуточные соединения формулы (XVIII) могут быть получены взаимодействием промежуточного соединения формулы (XX) с H2S в присутствии подходящего основания, такого как, например, N,Nдиизопропилэтанамин, и подходящего растворителя, такого как, например, пиридин. Промежуточные соединения формулы (XX) можно получить взаимодействием промежуточного соединения формулы (XXI) с 4-метоксибензолметанолом в присутствии подходящей кислоты, такой как,например, трифторуксусная кислота, и подходящего растворителя, такого как, например, метиленхлорид. Промежуточные соединения формулы (XXI) можно получить взаимодействием промежуточного соединения формулы (X) с СН 3-СН(=O) в присутствии KSCN, в присутствии подходящего основания,такого как, например, метанолат натрия, и подходящего растворителя, такого как, например, тетрагид- 11010974 рофуран. Промежуточные соединения формулы (X) могут быть получены взаимодействием промежуточного соединения формулы (XXII) с н-бутилформиатом Промежуточные соединения формулы (XXII) могут быть получены взаимодействием промежуточного соединения формулы (XII) с промежуточным соединением формулы (XXIII), где W2 представляет собой подходящую отщепляемую группу, такую как, например, галоген, например, хлор и т.п., в присутствии подходящего основания, такого как, например, N,N-диэтилэтанамин, и подходящего растворителя,такого как, например, N,N-диметилформамид или тетрагидрофуран. Промежуточные соединения формулы (V), где Z представляет собой пиразолил или необязательно замещенный пиримидин, и эти указанные промежуточные соединения представлены формулой (V-b) или(V-c), можно получить взаимодействием промежуточного соединения формулы (XXIV) с NH2-NH2 или Промежуточные соединения формулы (XXIV) могут быть получены взаимодействием промежуточного соединения формулы (XXV) с N(CH3)2-CH(OCH3)2. Промежуточные соединения формулы (XXV) могут быть получены взаимодействием промежуточного соединения формулы (XXVI) с промежуточным соединением формулы (XXVII), где W3 представляет собой подходящую отщепляемую группу, такую как, например, галоген, например, хлор, в присутствии NaH и подходящего растворителя, такого как, например, тетрагидрофуран. Промежуточные соединения формулы (XXVI) можно получить взаимодействием промежуточного соединения формулы (XXVIII) с СН 3MgCl в присутствии подходящего растворителя, такого как, например, тетрагидрофуран. Промежуточные соединения формулы (XXVIII) могут быть получены взаимодействием промежуточного соединения формулы (XXIX), где W4 представляет собой подходящую отщепляемую группу,такую как, например, галоген, например, хлор и т.п., с NH(СН 3) (ОСН 3) в присутствии подходящего основания, такого как, например, N,N-диэтилэтанамин, и подходящего растворителя, такого как, например,тетрагидрофуран. Промежуточные соединения формулы (XXIX), где W4 представляет собой хлор, и эти указанные промежуточные соединения представлены формулой (XXIX-а), могут быть получены взаимодействием промежуточного соединения формулы (VII) с SOCl2. Промежуточные соединения формулы (VII) могут быть получены взаимодействием промежуточного соединения формулы (VIII) с подходящим основанием, таким как, например, гидроксид натрия, в присутствии подходящего растворителя, такого как, например, спирт, например, метанол, или тетрагидрофуран. Промежуточные соединения формулы (VIII), где R3 представляет собой водород, и эти указанные промежуточные соединения представлены формулой (VIII-а), можно получить взаимодействием промежуточного соединения формулы (XXX) с метиловым эфиром муравьиной кислоты или метиловым эфиром уксусной кислоты в присутствии KSCN, подходящего основания, такого как, например, NaOCH3 или трет-BuONa, и подходящего растворителя, такого как, например, тетрагидрофуран или спирт, например метанол. Промежуточные соединения формулы (XXX) могут быть получены из промежуточного соединения формулы (XXXI) в присутствии муравьиной кислоты или формиата, такого как, например, нбутилформиат, и в присутствии подходящего растворителя, такого как, например, ксилол или диэтиловый эфир. Промежуточные соединения формулы (XXXI) могут быть получены взаимодействием промежуточного соединения формулы (XII) с промежуточным соединением формулы (XXXII), где W5 представляет собой подходящую отщепляемую группу, такую как, например, галоген, например, хлор или бром, в присутствии подходящего растворителя, такого как, например, тетрагидрофуран или N,Nдиметилформамид, и необязательно в присутствии подходящего основания, такого как, например, N,Nдиэтилэтанамин и N,N-диметил-4-пиридинамин. Промежуточные соединения формулы (V), где Z представляет собой триазолил, и эти указанные промежуточные соединения представлены формулой (V-d), могут быть получены взаимодействием промежуточного соединения формулы (XXXIII) с NH2-NH2 в присутствии подходящей кислоты, такой как,например, уксусная кислота. Промежуточные соединения формулы (XXXIII) могут быть получены взаимодействием промежуточного соединения формулы (XXXIV) с N,N-диметилформамид/N,N-диметилацетамид. Промежуточные соединения формулы (XXXIV) могут быть получены взаимодействием промежуточного соединения формулы (XXXV), где W6 представляет собой подходящую отщепляемую группу,такую как, например, галоген, например, хлор, с NH3 в присутствии подходящего растворителя, такого как, например, тетрагидрофуран. Промежуточные соединения формулы (XXXV), где W6 представляет собой хлор, и эти указанные промежуточные соединения представлены формулой (XXXV-a), могут быть получены взаимодействием промежуточного соединения формулы (XXXVI) с SOCl2. Промежуточные соединения формулы (XXXVI) могут быть получены гидролизом соответствующего сложного эфира (XXXVII) с подходящим основанием, таким как, например, гидроксид натрия, в присутствии подходящего растворителя, такого как, например, спирт, например метанол. Промежуточные соединения формулы (XXXVII) могут быть получены взаимодействием промежуточного соединения формулы (XXXVIII) с 4-метоксибензолметанолом в присутствии подходящей кислоты, такой как, например, трифторуксусная кислота, и подходящего растворителя, такого как, например, метиленхлорид. Промежуточные соединения формулы (VI) могут быть получены взаимодействием промежуточного соединения формулы (XXIX) или (VII) с промежуточным соединением формулы (XXXIX) в присутствии подходящего основания, такого как, например, N,N-диизопропилэтанамин, подходящего диимида, такого как, например, N'-(этилкарбонимидоил)-N,N-диметил-1,3-пропандиамин или дициклогексилкарбондиимид, 1-гидрокси-1H-бензотриазола и подходящего растворителя, такого как, например, тетрагидрофуран или N,N-диметилформамид. Для получения соединений по данному изобретению предпочтительными промежуточными соединениями являются промежуточные соединения формулы (XII) их N-оксиды, фармацевтически приемлемые аддитивные соли, четвертичные амины или стереохимически изомерные формы. Как уже упоминалось выше, промежуточные соединения формулы (II) могут содержать хиральный центр при атоме углерода, несущем заместитель R1 и R4, в зависимости от характера заместителей, представляющих R1 и R4. В случае, если указанный углеродный атом представляет собой хиральный центр,предпочтительный вариант промежуточных соединений формулы (XII) представляют собой промежуточные соединения, где промежуточное соединение является стереоспецифическим, т.е. где промежу- 16010974 точное соединение имеет конфигурацию (R) или (S) при углеродном атоме, несущем заместитель R1 и R4(промежуточные соединения формулы (XII-b). Особенно предпочтительными являются промежуточные соединения формулы (XII-b), которые имеют (S)-конфигурацию (промежуточные соединения формулы(XII-b-1). Таким образом, настоящее изобретение также относится к промежуточным соединениям формулы их N-оксидам, фармацевтически приемлемым аддитивным солям или их четвертичным аминам. Кроме того, настоящее изобретение относится к промежуточным соединениям формулы (XII-b-1) при условии, что когда n=2 и каждый R2 представляет собой хлор и указанные два хлор-заместителя находятся в мета- и пара-положении, тогда R1 не является этилом. Другой предпочтительный вариант представляют собой промежуточные соединения формулы (XIIb-1), где каждый R2 независимо выбран из галогена, C1-6 алкила, С 1-6 алкилокси или полигалогенC1-6 алкила, при условии, что когда n=2 и каждый R2 представляет собой хлор и указанные два хлорзаместителя находятся в мета- и пара-положении, тогда R1 не является этилом. Дополнительный вариант представляют собой промежуточные соединения формулы (XII-b-1), где n равно 1, 2 или 3, в частности 2, и при условии, что когда n=2 и каждый R2 представляет собой хлор и указанные два хлор-заместителя находятся в мета- и пара-положении, тогда R1 не является этилом. Следующий вариант представляют собой промежуточные соединения формулы (XII-b-1), где n равно 2 и два заместителя R2, расположены в мета- и пара-положении, при условии, что когда каждый R2 представляет собой хлор, тогда R1 не является этилом. Другой вариант представляют собой промежуточные соединения формулы (XII-b-1), описанные выше, где R4 представляет собой водород. Интерес представляют также промежуточные соединения формулы (XII) и (XII-b-1), где R1 представляет собой водород, метил, этил, н-пропил, метоксиметил, циклогексил, циклопропил, диметиламинометил, 2-тиенил, 3,4-дихлорфенил, в частности, метил, этил, н-пропил, метоксиметил, более предпочтительно метил, этил и н-пропил, при условии, что когда n равно 2 и R2 представляет собой хлор, и указанные два хлор-заместителя находятся в мета- и пара-положении и R4 представляет собой водород, тогда R1 не является этилом, циклопропилом, фенилом, и при условии, что когда n равно 2 и R2 представляет собой хлор, и указанные два хлор-заместителя расположены в мета- и пара-положении и R4 представляет собой метил, тогда R1 не является метилом, и при условии, что когда n равно 2 и указанные два заместителя R2 расположены в мета- и пара-положении и R2 в мета-положении представляет собой трифторметил и R2 в пара-положении представляет собой фтор и R4 представляет собой водород, тогда R1 не является этилом. Также представляют интерес промежуточные соединения формулы (XII) или (XII-b-1), описанные выше, где R2 представляет собой хлор, фтор или трифторметил, в особенности, хлор. Особенно предпочтительными промежуточными соединениями являются промежуточные соединения формулы (XII-а) или (XII-b-l), имеющие нижеследующую формулу их N-оксиды, фармацевтически приемлемые аддитивные соли или четвертичные амины, где Alk такой, как определен выше, т.е. Alk представляет собой метил, этил и н-пропил, и каждый R2a и R2b независимо представляет собой хлор, фтор, трифторметил. Представляют интерес промежуточные соединения формулы (XII-а-1) при условии, что когда R2a иR2b представляют собой, оба, хлор или когда R2a представляет собой трифторметил и R2b представляет собой фтор, тогда Alk не является этилом. Следующими предпочтительными промежуточными соединениями формулы (XII-а-1) являются промежуточные соединения (XII-а-1) при условии, что когда R2a и R2b представляют собой, оба, хлор,тогда Alk не является метилом, этилом, н-пропилом, и при условии, что когда R2a и R2b представляют- 17010974 собой, оба, фтор или R2a представляет собой трифторметил и R2b представляет собой фтор или R2a представляет собой фтор и R2b представляет собой трифторметил, тогда Alk не является этилом. Кроме того, представляют интерес промежуточные соединения формулы (XII-b-1-1) при условии,что когда R2a и R2b представляют собой, оба, хлор, тогда Alk не является этилом. Соединения формулы (I) и (I') демонстрируют антагонистические свойства в отношении рецептораCCR2. Рецептор 2 С-С хемокина (CCR2) и его лиганд, белок моноцитов со свойствами хемоатрактанта(хемотаксическими свойствами) (МСР-1; в новой номенклатуре хемокинов также называемый CCL2),как признано, вовлечены как в острые, так и хронические воспалительные процессы. Хемокины (сокращение "хемотаксические цитокины") являются наиболее важными регуляторами направленной миграции лейкоцитов. Эта биологическая роль проявляется при взаимодействии - на клетках-мишенях - с рецепторами семитрансмембранного домена, которые связаны с гетеродимерными Gбелками. Хемокины классифицируют, главным образом, по 2 основным семействам (С-С или С-Х-С семейство) в зависимости от присутствия аминокислоты (представленной X) между двумя консервативными остатками цистеина (представленными С) вблизи аминоконца. В общем, хемокины из С-С семейства притягивают моноциты, макрофаги, Т-клетки и NK-клетки. Хемокин, который действует через рецептор CCR2, представляет собой МСР-1, указанный выше. Поэтому рецептор CCR2 также известен как рецептор МСР-1. МСР-2, МСР-3 и МСР-4 могут также действовать, по крайней мере частично, через этот рецептор. Признано, что рецепторы CCR2 и МСР-1 играют роль в патофизиологии различных воспалительных заболеваний. Поэтому антагонисты рецептора CCR2, которые блокируют рецептор CCR2, имеют потенциал в качестве фармацевтических средств для борьбы с воспалителительными состояниями, такими как артрит, остеоартрит, ревматоидный артрит, гломерулонефрит, диабетическая нефропатия, пневмофиброз, идиопатический пневмофиброз, саркоидоз, васкулит, гепатит, неалкогольный стеатогепатит,воспалительные состояния головного мозга, такие как болезнь Альцгеймера, рестеноз, альвеолит, астма,аллергический ринит, аллергический конъюнктивит, атеросклероз, псориаз, аллергические реакции кожи замедленного типа, воспаление кишечника, острое или хроническое воспаление головного мозга, например, рассеянный склероз, аутоиммунный энцефаломиелит, хроническая обструктивная болезнь легких(COPD), увеит, дерматит, диффузный нейродермит. Антагонисты рецептора CCR2 могут быть также использованы для лечения аутоиммунных заболеваний, таких как диабет или отторжение трансплантата,инсульт, поражение, вызванное реперфузией, ишемия, рак, инфаркт миокарда, боль, в частности, нейропатическая боль. Соединения по данному изобретению могут быть также использованы для ингибирования вторжения вируса иммунодефицита человека (ВИЧ) в моноциты и лимфоциты, тем самым играя терапевтическую роль в лечении СПИД (синдрома приобретенного иммунодефицита). Рецептор CCR2 существует в двух изоформах, а именно, рецептор CCR2A и CCR2B. Благодаря своей антагонистической активности в отношении рецептора CCR2, в частности, свойственной им антагонистической активности в отношении рецептора CCR2B, соединения формулы (I), ихN-оксиды, фармацевтически приемлемые аддитивные соли, четвертичные амины или стереохимически изомерные формы являются полезными для лечения или профилактики, в частности, для лечения заболеваний или состояний, опосредованных через активацию рецептора CCR2, в частности, рецептора CCR2B. Заболевания или состояния, связанные с активацией рецептора CCR2, включают воспалительные состояния, такие как артрит, остеоартрит, ревматоидный артрит, гломерулонефрит, диабетическая ретинопатия,пневмофиброз, идиопатический пневмофиброз, саркоидоз, васкулит, гепатит, неалкогольный стеатогепатит, воспалительные состояния головного мозга, такие как болезнь Альцгеймера, рестеноз, альвеолит,астма, аллергический ринит, аллергический конъюнктивит, атеросклероз, псориаз, аллергические реакции кожи замедленного типа, воспаление кишечника, острое или хроническое воспаление головного мозга, например, рассеянный склероз, аутоиммунный энцефаломиелит, хроническая обструктивная болезнь легких (COPD), увеит, дерматит, диффузный нейродермит, аутоиммунные заболевания, такие как диабет или отторжение трансплантата, инсульт, поражение, вызванное реперфузией, ишемия, рак, инфаркт миокарда, боль (нейропатическая боль). В частности, соединения формулы (I) используют для лечения или профилактики воспалительных заболеваний и аутоиммунных заболеваний, в особенности,ревматоидного артрита, атеросклероза, рассеянного склероза, воспаления кишечника и хронической обструктивной болезни легких (COPD). Кроме того, соединения формулы (I) представляют особый интерес для лечения или профилактики псориаза, астмы, ревматоидного артрита или боли (нейропатической боли), и особенно псориаза, астмы или ревматоидного артрита. Принимая во внимание вышеописанные фармакологические свойства, соединения формулы (I), иN-оксиды, фармацевтически приемлемые аддитивные соли, четвертичные амины и стереохимически изомерные формы, могут быть использованы в качестве лекарственного средства. В частности, предлагаемые соединения могут быть использованы для получения лекарственного средства для лечения или профилактики заболеваний, опосредованных через активацию рецептора CCR2, в частности, рецептораCCR2B. Более конкретно, соединения по данному изобретению могут быть использованы для получения- 18010974 лекарственного средства для лечения или профилактики воспалительных заболеваний, в особенности ревматоидного артрита, атеросклероза, рассеянного склероза, воспаления кишечника и хронической обструктивной болезни легких (COPD). Кроме того, соединения по данному изобретению могут быть, в частности, использованы для получения лекарственного средства для лечения или профилактики псориаза, астмы, ревматоидного артрита или боли (нейропатической боли), и особенно псориаза, астмы или ревматоидного артрита. С учетом полезности соединений формулы (I), предлагается способ профилактики или способ лечения теплокровных животных, включая людей, страдающих заболеваниями, опосредованными через активацию рецептора CCR2, в частности, опосредованных через рецептор CCR2B. Указанные способы включают введение эффективного количества соединения формулы (I), его N-оксидной формы, фармацевтически приемлемой аддитивной соли, четвертичного амина или его возможной стереоизомерной формы, теплокровным животным, включая людей. Блокада рецептора CCR2 предлагаемыми соединениями формулы (I) ингибирует нормальную функцию МСР-1. Поэтому предлагаемые соединения могут быть также описаны (охарактеризованы) как ингибиторы МСР-1, и, следовательно, могут быть использованы для предотвращения или лечения заболеваний, опосредованных через МСР-1. Кроме того, настоящее изобретение относится к композициям для профилактики или лечения заболеваний, опосредованных через активацию рецептора CCR2, в частности рецептора CCR2B. Указанные композиции содержат терапевтически эффективное количество соединения формулы (I) и фармацевтически приемлемый носитель или разбавитель. С целью обеспечения введения лекарственного средства соединения по данному изобретению могут быть объединены в соответствующие составы с получением различных фармацевтических форм. В качестве подходящих композиций могут быть указаны все композиции, обычно используемые для системного введения лекарственных средств. Для получения фармацевтических композиций по данному изобретению эффективное количество конкретного соединения, необязательно в форме аддитивной соли,в качестве активного компонента тщательно смешивают с фармацевтически приемлемым носителем с получением однородной смеси, и этот носитель может способствовать получению разнообразных форм в зависимости от того, какая форма препарата требуется для введения. Желательно, чтобы эти фармацевтические композиции находились в стандартной лекарственной форме, подходящей, в частности, для введения перорально, ректально, чрескожно или с помощью парентеральной инъекции. Например, для получения композиций в пероральной лекарственной форме можно использовать любую из обычных фармацевтических сред, таких как, например, вода, гликоли, масла, спирты и т.п. в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара, каолин, разбавители, смазки, связующие средства, дезинтегрирующие средства и т.п. в случае порошков, пилюль, капсул и таблеток. Из-за легкости введения таблетки и капсулы являются наиболее предпочтительными пероральными дозированными лекарственными формами,и в этом случае очевидно использование твердых фармацевтических носителей. В случае парентеральных композиций носитель обычно включает стерильную воду, по крайней мере, в значительной степени,хотя могут быть включены и другие ингредиенты, например, чтобы способствовать растворимости. Например, можно получить растворы для инъекции, в которых носитель включает физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Можно получить суспензии для инъекции, и в этом случае могут быть использованы соответствующие жидкие носители, суспендирующие средства и т.п. Также включены и препараты в твердой форме, которые, как подразумевается, превращают, непосредственно перед использованием, в препараты в жидкой форме. В композициях, подходящих для чрескожного введения, носитель необязательно включает средство, усиливающее проникновение через кожу, и/или подходящее увлажняющее средство, необязательно смешанные с подходящими добавками любой природы в незначительных пропорциях, при этом эти добавки не оказывают значимого вредного воздействия на кожу. Вышеуказанные добавки могут облегчать введение (лекарственного средства) в кожу и/или могут быть полезными для получения требуемых композиций. Эти композиции можно вводить различными способами, например, в виде трансдермального пластыря, нанесением в виде пятна, в виде мази. Кроме того, соединения по данному изобретению можно вводить путем ингаляции или инсуффляции при помощи способов и препаратов, используемых в данной области для введения этим путем. Таким образом, в общем, соединения по данному изобретению могут быть введены в легкие в форме раствора, суспензии или в виде сухого порошка. Любая система, разработанная для доставки растворов,суспензий или сухих порошков путем ингаляции или инсуффляции через рот или нос, является подходящей для введения предлагаемых соединений. Соединения по данному изобретению можно также вводить местно в форме капель, в частности,глазных капель. Указанные глазные капли могут быть в форме раствора или суспензии. Любая система,разработанная для доставки растворов или суспензий в виде глазных капель, является подходящей для введения предлагаемых соединений. Особенно целесообразно составление вышеупомянутых фармацевтических композиций в стандарт- 19010974 ной дозированной лекарственной форме из-за простоты введения и однородности дозирования. Используемый в описании термин "стандартная дозированная лекарственная форма" относится к физически дискретным единицам, подходящим в качестве стандартных доз, при этом каждая единица содержит предварительно установленное количество активного компонента в расчете на достижение желаемого терапевтического эффекта в связи с требуемым фармацевтическим носителем. Примерами таких стандартных дозированных лекарственных форм являются таблетки (включая таблетки с насечкой или таблетки с покрытием), капсулы, пилюли, пакетики с порошком, облатки, суппозитории, растворы или суспензии для инъекции и т.п., и их изолированные множества. Как очевидно для специалистов в данной области, точная доза и частота введения зависят от конкретного используемого соединения формулы (I), индивидуального состояния, подлежащего лечению,тяжести состояния, подлежащего лечению, возраста, массы тела, пола, степени (интенсивности) нарушения и общего (физического) состояния здоровья конкретного пациента, а также другого лекарственного препарата, который может принимать индивидуум. Кроме того, очевидно, что возможно уменьшение или увеличение указанного эффективного суточного количества (дозы) в зависимости от реакции лечимого субъекта и/или в зависимости от оценки лечащего врача, прописывающего соединения по данному изобретению. Кроме того, соединения формулы (I) могут быть использованы в комбинации с другими обычными противовоспалительными или иммунодепрессивными средствами, такими как стероиды, ингибиторы циклооксигеназы-2, нестероидные противовоспалительные средства, антитела TNF-, такие как, например, ацетилсалициловая кислота, буфексамак, диклофенак калий, сулиндак, диклофенак натрий, кеторолак трометамол, толметин, ибупрофен, напроксен, напроксен натрий, тиапрофеновая кислота, флурбипрофен, мефенамовая кислота, нифлуминовая кислота, меклофенамат, индометацин, проглуметацин,кетопрофен, набуметон, парацетамол, пироксикам, теноксикам, нимесулид, фенилбутазон, трамадол,беклометазон, дипропионат, бетаметазон, бекламетазон, будесонид, флутиказон, мометазон, дексаметазон, гидрокортизон, метилпреднизолон, преднизолон, преднизон, триамцинолон, целекоксиб, рофекоксиб, валдекоксиб, инфликсимаб, лефлуномид, этанерцепт, СРН 82, метотрексат, сульфасалазин, антилимфоцитарные иммуноглобулины, антитимоцитарные иммуноглобулины, азатиоприн, циклоспорин,такролимус, аскомицин, рапамицин, муромонаб-CD3. Таким образом, настоящее изобретение также относится к комбинации соединения формулы (I) и другого противовоспалительного или иммунодепрессивного средства. Такая комбинация может быть использована в качестве лекарственного средства. Кроме того, настоящее изобретение относится к продукту, содержащему (а) соединение формулы (I) и (b) другое противовоспалительное или иммунодепрессивное соединение, как комбинированному препарату для одновременного, раздельного или последовательного использования для лечения заболеваний, опосредованных через активацию рецептора CCR2, в частности, опосредованного через рецептор CCR2B. В таких продуктах в одном препарате различные лекарственные средства могут быть смешаны вместе с фармацевтически приемлемыми носителями. Альтернативно, такие продукты могут включать, например, набор, включающий контейнер с подходящей композицией, содержащей соединение формулы (I), и другой контейнер с композицией, содержащей другое противовоспалительное или иммунодепрессивное соединение. Такой продукт может иметь преимущество, заключающее в том, что врач может подобрать, исходя из диагноза пациента, подлежащего лечению, соответствующие количества каждого компонента и последовательность и хронометраж его введения. Нижеследующие примеры предназначены для иллюстрации настоящего изобретения. Экспериментальная часть В дальнейшем, "THF" означает тетрагидрофуран, "DEPE" означает диизопропиловый эфир, "DMF" обозначает N,N-диметилформамид и "DMA" обозначает N,N-диметилацетамид. А. Получение промежуточных соединений Пример А 1. а. Получение промежуточного соединения 1 Раствор Na2CO3 (часть от 0,52 моля) в H2O (150 мл) добавляют к перемешиваемой смеси 1-(3,4 дихлорфенил)-1-пропанона (0,345 моль) в этаноле, р.а. (чистый для анализа) (150 мл), затем добавляют остаток Na2CO3 и порциями при энергичном перемешивании добавляют моногидрохлорид гидроксиламина (0,345 моль). Реакционную смесь нагревают до температуры кипения с обратным холодильником и добавляют дополнительно H2O (75 мл), затем полученную смесь перемешивают и кипятят с обратным холодильником в течение 6 ч. Добавляют дополнительное количество моногидрохлорида гидроксиламина (2,4 г) и смесь кипятят с обратным холодильником еще в течение 18 ч. Снова добавляют дополнительное количество моногидрохлорида гидроксиламина (3 г); реакционную смесь кипятят с обратным холодильником в течение 24 ч и перемешивают в течение 2 дней при комнатной температуре. Твердыеb. Получение промежуточных соединений 2 и 3 Смесь промежуточного соединения 1 (0,3 моль) в смеси CH3OH/NH3 (7N) (500 мл) гидрируют при 14 С в присутствии никеля Ренея (каталитическое количество) в качестве катализатора и в присутствии тиофена (6 мл). После поглощения Н 2 (2 экв.) катализатор отфильтровывают и фильтрат упаривают, затем совместно упаривают с толуолом 2 раза. Остаток перемешивают в кипящем 2-пропаноле (250 мл) и смесь фильтруют горячей. Фильтрату дают возможность достигнуть комнатной температуры и медленно добавляют смесьHCl/2-пропанол (6N, 150 мл) при энергичном перемешивании. Растворитель выпаривают и остаток перемешивают в DIPE, затем отфильтровывают, промывают и сушат (вакуум) при 60 С. Выход: 53 г промежуточного соединения 2 (73,4%). Часть этой фракции превращают в соответствующее свободное основание: промежуточное соединение 2 (18,0 г) перемешивают в CH2Cl2 (200 мл) и добавляют 15% водный раствор K2CO3, затем полученную смесь перемешивают в течение 1 ч и добавляют 50% раствор NaOH для повышения рН. Органический слой отделяют, промывают H2O, сушат (MgSO4), фильтруют и растворитель выпаривают. Выход: 12,4 г промежуточного соединения 3. с. Получение промежуточного соединения 4 Раствор промежуточного соединения 2 (полученного согласно A1.b) (0,0748 моль) и метилового эфира хлоруксусной кислоты (0,08 моль) в DMF, р.а., осушенном с использованием молекулярных сит, (150 мл),перемешивают при комнатной температуре в атмосфере N2 и медленно добавляют Et3N (0,224 моль), затем реакционную смесь перемешивают в течение 20 ч при комнатной температуре и добавляют дополнительное количество метилового эфира хлоруксусной кислоты (3,3 мл). Смесь перемешивают в течение еще 20 ч при комнатной температуре и снова добавляют дополнительно метиловый эфир хлоруксусной кислоты (2 мл). Полученную смесь перемешивают в течение 24 ч и затем отфильтровывают твердые вещества и промывают(MgSO4), фильтруют и растворитель выпаривают, затем выпаривают совместно с толуолом. Остаточное масло (23,4 г) фильтруют через силикагель (элюент: смесь CH2Cl2/CH3OH 99/1). Фракции продукта собирают и растворитель выпаривают, наконец, выпаривают совместно с толуолом. Выход: 20,6 г промежуточного соединения 4 (99,7%).d. Получение промежуточного соединения 5 Раствор муравьиной кислоты (7,5 мл) и промежуточного соединения 4 (полученного согласно A1.c)(0,0746 моль) в ксилоле, р.а. (225 мл) перемешивают и кипятят с обратным холодильником в течение 4 ч и затем реакционной смеси дают возможность достигнуть комнатной температуры. Смесь промывают 2 раза H2O (2200 мл), насыщенным водным раствором NaHCO3 (200 мл) и насыщенным раствором соли(200 мл), затем отделенный органический слой сушат (MgSO4) и фильтруют. Наконец, растворитель выпаривают. Выход: 21,3 г промежуточного соединения 5 (93,9%). е-1. Получение промежуточного соединения 6NaOCH3 (0,07 моль) добавляют к перемешиваемому раствору промежуточного соединения 5 (полученного согласно A1.d) (0,066 моль) и метилового эфира муравьиной кислоты (0,19 моль) в THF, р.а.(100 мл) в атмосфере N2 и реакционную смесь перемешивают при комнатной температуре в течение 40 ч. Растворитель выпаривают и неочищенный остаток перемешивают в воде (90 мл). Водный слой промы- 21010974 вают 2 раза Et2O (50 мл) и добавляют СН 3 ОН (60 мл). Добавляют HCl, 36%, р.а. (15,7 мл) и раствор нагревают на масляной бане и перемешивают при 45 С в течение 24 ч, затем добавляют KSCN (0,11 моль). Смесь перемешивают при комнатной температуре в течение 40 ч и при 80 С в течение 5 ч. Реакционной смеси дают возможность достигнуть комнатной температуры и твердые вещества отфильтровывают,промывают смесью H2O/СН 3 ОН (2/1), затем сушат при 60 С (вакуум). Выход: 19,35 г фракции, которую перекристаллизовывают из CH3CN (200 мл), отфильтровывают, промывают CH3CN и сушат при 50 С(вакуум). Выход: 17,2 г промежуточного соединения 6 (75,5%). е-2. Получение промежуточного соединения 44 Метил 2-1-(3,4-дифторфенил)бутил]формил)амино]ацетат (полученный согласно A1.d) (15,0 г, 53 ммоль), растворенный в 250 мл абсолютного эфира, охлаждают при перемешивании до -78 С в атмосфере аргона, и по каплям при -78 С добавляют 55 мл 2 М раствора литийдиизопропиламида в смесиTHF/гексан. Смесь перемешивают в течение еще 0,5 часа при той же температуре. К смеси по каплям добавляют хлорангидрид метоксиуксусной кислоты (6,9 г, 63,6 ммоль), растворенный в 40 мл сухогоTHF, и температуре реакционной смеси предоставляют возможность достичь комнатной температуры на протяжении 2 ч. К смеси добавляют смесь метанола (270 мл), воды (135 мл), KCNS (13,43 г) и 67 мл концентрированной HCl. Полученную смесь нагревают до 70 С и перемешивают в течение 18 ч при этой температуре. Затем смеси дают возможность охладиться до комнатной температуры, нейтрализуют водным раствором NaHCO3 и экстрагируют метиленхлоридом. Экстракт сушат над MgSO4 и концентрируют в вакууме. Полученный остаток подвергают флэш-хроматографии на силикагеле 60/100 (CH2Cl2). Фракцию, содержащую требуемый продукт (согласно ЖХ/МС), концентрируют и обрабатывают смесью гексан/эфир (1/1). Выход: 2,46 г (12,5%) промежуточного соединения 44.f-1. Получение промежуточного соединения 7 Раствор промежуточного соединения 6 (полученного согласно A1.e) (0,004 моль) в NaOH (1N) (7,5 мл), метаноле, р.а. (10 мл) и THF, p.a. (20 мл), перемешивают при комнатной температуре в течение 20 ч,затем перемешивают в течение 5 дней при 75 С. Добавляют дополнительное количество NaOH (1N) (7,5 мл) и реакционную смесь перемешивают в течение 1 ч при 75 С, затем смеси дают возможность достичь комнатной температуры. Добавляют H2O (45 мл), затем Et2O (50 мл) и реакционную смесь перемешивают в течение 30 мин. Водный слой отделяют, промывают смесью EtOAc/гексан (250 мл, 1/1) и подкисляют HCl (1N) до рН 3. Смесь экстрагируют смесью CH2Cl2/CH3OH (95/5), затем органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток растворяют в смесиEt2O/гексан/CH2Cl2 (1/1/1) и концентрируют при 60 С (без вакуума) до тех пор, пока не начнется кристаллизация, затем смесь выдерживают при стоянии в течение 30 мин. Осадок отфильтровывают, промывают смесью гексан/Et2O (3/1) и сушат (вакуум, 50 С) с последующей сушкой при помощи вакуумного насоса в течение 5 ч). Выход: 0,55 г промежуточного соединения 7 (41,5%).f-2. Получение промежуточного соединения 42 Смесь промежуточного соединения 42 (0,045 моль) и NaOH 1N (0,025 моль) в метаноле (25 мл) перемешивают в течение 24 ч при 60 С, затем добавляют дополнительное количество NaOH 1N (10 мл) и реакционную смесь перемешивают в течение 20 ч при 60 С. Часть растворителя выпаривают и к концентрату добавляют 1N HCl (36 мл). Продукт осаждается в виде масла и его экстрагируют CH2Cl2. Органический слой отделяют, сушат и фильтруют. Растворитель выпаривают и остаток сушат. Выход: 1,4 г промежуточного соединения 42.g. Получение промежуточного соединения 8 Смесь промежуточного соединения 7 (полученного согласно A1.f) (0,001 моль) в SOCl2 (10 мл) перемешивают и кипятят с обратным холодильником в течение 2 ч и затем растворитель выпаривают. К остатку добавляют 2 раза толуол (р.а.) и растворитель выпаривают после каждого добавления. Выход: 0,35 г промежуточного соединения 8.h. Получение промежуточного соединения 9 Смесь N-метоксиметанамин гидрохлорида (0,0017 моль) и Et3N (0,005 моль) в THF (10 мл) перемешивают при комнатной температуре и к ней по каплям добавляют смесь промежуточного соединения 8(полученного согласно A1.g) (0,0015 моль) в THF (5 мл) на протяжении 15 мин, затем реакционную смесь перемешивают на протяжении ночи при комнатной температуре и растворитель выпаривают. Остаток перемешивают в H2O и смесь экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4),фильтруют и растворитель выпаривают. Остаток растворяют в 2-пропаноне (15 мл, р.а.) и поток SO2 пропускают через раствор в течение 20 мин. Растворитель выпаривают и остаток фильтруют через силикагель (элюент: смесь CH2Cl2/CH3OH 95/5). Фракции продукта собирают и растворитель выпаривают. Выход: 0,310 г промежуточного соединения 9.i. Получение промежуточного соединения 10 Смесь промежуточного соединения 9 (полученного согласно A1.h) (0,0008 моль) в THF (10 мл) перемешивают при 0-5 С на бане со льдом и по каплям добавляют CH3MgCl, 20% в THF (0,002 моль), затем реакционную смесь перемешивают в течение 1 ч и добавляют по каплям дополнительное количествоCH3MgCl, 20% в THF (0,0044 моль). Смесь перемешивают в течение 1 ч и снова по каплям добавляют еще CH3MgCl, 20% в THF (0,002 моль), затем реакционную смесь перемешивают в течение 1 ч и добавляют, при охлаждении льдом, по каплям 1N HCl (10 мл). Добавляют H2O и смесь экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток растворяют в 2-пропаноне (р.а.) и поток SO2 пропускают через раствор в течение 20 мин. Растворитель выпаривают и остаток очищают колоночной флэш-хроматографией (элюент: EtOAc). Фракции продукта собирают и растворяют в смеси CH2Cl2/CH3OH (90/10), затем смесь фильтруют и растворитель фильтрата выпаривают. Выход: 0,060 г промежуточного соединения 10.j. Получение промежуточного соединения 11 Смесь промежуточного соединения 10 (полученного согласно A1.i) (0,005 моль) в сухом THF (40 мл) перемешивают при комнатной температуре и порциями добавляют 60% NaH (0,0055 моль) на протяжении 10 мин, затем смесь перемешивают в течение 30 мин и сразу добавляют смесь 1-(хлорметил)-4 метоксибензола (0,0055 моль) в сухом THF (10 мл). Реакционную смесь перемешивают при комнатной температуре в течение 6 дней и растворитель выпаривают. Остаток перемешивают в H2O и экстрагируютk. Получение промежуточного соединения 12 Смесь промежуточного соединения 11 (полученного согласно A1.j) (0,00115 моль) в 1,1-диметоксиN,N-диметилметанамине (10 мл) перемешивают при 100 С в течение 18 ч и затем растворитель выпаривают. Остаток растворяют в толуоле и растворитель снова выпаривают. Выход: 0,580 г промежуточного соединения 12.l-1. Получение промежуточных соединений 13 и 14 Смесь Na (0,0008 моль) в этаноле (4 мл) перемешивают в атмосфере N2 при комнатной температуре до полного растворения и добавляют гуанидин (0,0004 моль), затем смесь перемешивают в течение 30 мин и добавляют смесь промежуточного соединения 12 (полученного согласно A1.k) (0,00055 моль) в этаноле (1 мл). Реакционную смесь перемешивают в закрытом сосуде при 100 С в течение 20 ч и упаривают. Сырое соединение (продукт) очищают, пропуская через SiO2 (элюент: смесь CH2Cl2/CH3OH 98/2) и растворитель выпаривают, получая промежуточное соединение 13. Остаток растворяют в 2-пропаноле и превращают в соль хлористо-водородной кислоты (1:1) с помощью обработки смесью HCl/2-пропанол. Кристаллизованную соль отфильтровывают, промывают DIPE и сушат. Выход: 0,320 г промежуточного соединения 14.l-2. Получение промежуточного соединения 15 Смесь промежуточного соединения 12 (полученного согласно A1.k) (0,00115 моль) и моногидрата гидразина (0,007 моль) в этаноле (20 мл) перемешивают и кипятят с обратным холодильником на масляной бане в течение 3 ч. Растворитель выпаривают и остаток подвергают фильтрации в силикагеле (элюент: смесь CH2Cl2/СН 3 ОН 98/2). Фракции продукта собирают и растворитель выпаривают при 50 С в потоке N2. Выход: 0,240 г промежуточного соединения 15. Пример А 2. а. Получение промежуточного соединения 16 Смесь N,N'-(1R,2R)-1,2-циклогександиилбис[1,1,1-трифторметансульфонамида] (0,005 моль) и Ti(iPrO)4 (0,030 моль) в толуоле (достаточное количество) дегазируют и помещают в Ar-поток, затем реакционную смесь перемешивают в течение 20 мин при 40 С и охлаждают до -78 С. Добавляют по каплямEt2Zn (0,030 моль) и через 20 мин добавляют по каплям смесь 3,4-дихлорбензальдегида (0,0250 моль) в- 24010974 толуоле (достаточное количество). Реакционной смеси дают возможность достигнуть 0 С. Смесь перемешивают на протяжении ночи при комнатной температуре, затем гасят HCl (2N). Эту смесь экстрагируют CH2Cl2. Отделенный органический слой промывают, сушат, фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: смесь CH2Cl2/СН 30 Н 98/2). Фракции продукта собирают и растворитель выпаривают. Выход: 5,1 г промежуточного соединения 16. Изомер R можно получить согласно вышеупомянутой реакции, используя N,N'-(1S,2S)-1,2 циклогександиилбис[1,1,1-трифторметансульфонамид] в качестве катализатора.b. Получение промежуточного соединения 17 Смесь промежуточного соединения 16 (полученного согласно А 2.а) (0,025 моль) и дифенилфосфорилазида (0,030 моль) в толуоле (50 мл) перемешивают при 0 С и добавляют 2,3,4,6,7,8,9,10 октагидропиримидо[1,2-а]азепин (0,030 моль). Реакционную смесь перемешивают в течение 2 ч при 0 С,затем перемешивают на протяжении ночи при комнатной температуре. Смесь разбавляют водой и толуолом. Органический слой отделяют, промывают один раз водой, один раз 5% HCl и растворитель выпаривают, получая промежуточное соединение 17, используемый на следующей стадии. с. Получение промежуточного соединения 18 Смесь промежуточного соединения 17 (полученного согласно А 2.b) (0,025 моль), трифенилфосфина(0,027 моль) в THF (70 мл) и H2O (20 мл) перемешивают на протяжении ночи при комнатной температуре. Растворитель выпаривают. Остаток обрабатывают 10% HCl. Кислый слой промывают DIPE, затем подщелачивают, с последующей экстракцией CH2Cl2. Отделенный органический слой сушат, фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле. Фракции продукта собирают и растворитель выпаривают. Выход: 1,1 г промежуточного соединения 18.d. Получение промежуточного соединения 19 Раствор промежуточного соединения 3 (полученного согласно A1.b) (0,0116 моль) в Et3N (0,013 моль) и DMF, р.а., осушенный на молекулярных ситах (20 мл), перемешивают на бане со льдом. Добавляют по каплям раствор хлорацетонитрила (0,0128 моль) в DMF, р.а., осушенный на молекулярных ситах, (2,5 мл). Реакционную смесь перемешивают при комнатной температуре в течение 6 ч. Добавляют по каплям еще хлорацетонитрил (0,0063 моль) в DMF, р.а., осушенный на молекулярных ситах (1 мл). Реакционную смесь перемешивают в течение еще 24 ч. Добавляют по каплям еще хлорацетонитрил(0,0063 моль) в DMF, р.а., осушенный на молекулярных ситах (1 мл), и реакционную смесь перемешивают в течение еще 24 ч. Добавляют еще Et3N (1 мл), затем добавляют по каплям еще хлорацетонитрил(0,0079 моль) в DMF, р.а., осушенный на молекулярных ситах, (1 мл). Реакционную смесь перемешивают в течение 20 ч. Осадок отфильтровывают. Фильтрат выливают в Et2O (200 мл) и промывают смесьюH2O/NaHCO3 (10%; 100 мл) и H2O (2). Отделенный органический слой сушат (MgSO4), фильтруют и растворитель выпаривают и затем выпаривают совместно с толуолом. Остаток очищают на силикагеле(элюент: смесь CH2Cl2/MeOH 99:1). Требуемые фракции собирают и растворитель выпаривают и совместно выпаривают с толуолом. Выход: 2,3 г промежуточного соединения 19 (81,6%). е. Получение промежуточного соединения 20- 25010974 Смесь промежуточного соединения 19 (полученного согласно A2.d) (0,021 моль) в нбутилформиате (25 мл) перемешивают и кипятят с обратным холодильником в течение 48 ч и затем охлаждают. Растворитель выпаривают и остаток разбавляют и остаток разбавляют CH2Cl2. Полученную смесь промывают водой, сушат и растворитель выпаривают. Выход: 5,25 г промежуточного соединения 20.f. Получение промежуточного соединения 21NaOMe (полученный in situ) (достаточное количество) добавляют по каплям к смеси промежуточного соединения 20 (полученного согласно А 2.е) (0,022 моль) и ацетальдегида (0,022 моль) в THF (100 мл). Через 7 ч растворитель выпаривают и остаток распределяют между несмешивающимися растворителями, водой и эфиром. Водный слой подкисляют концентрированной HCl до рН 2-3 и экстрагируютCH2Cl2. Экстракт упаривают и остаток растворяют в смеси CH3OH/H2O. Добавляют KSCN (0,050 моль) с последующим добавлением концентрированной HCl (5 мл) и затем реакционную смесь перемешивают и кипятят с обратным холодильником на протяжении выходных. Смесь охлаждают и растворитель выпаривают. Остаток распределяют между (несмешивающимися) водой и CH2Cl2, затем органический слой отделяют, сушат и растворитель выпаривают. Остаток очищают колоночной флэш-хроматографией на силикагеле (элюент: смесь гексан/EtOAc 80/20). Фракции продукта собирают и растворитель выпаривают. Выход: 2 г промежуточного соединения 21. Примечание: NaOMe генерируют in situ при помощи NaH и СН 3 ОН в THF.g. Получение промежуточного соединения 22 Смесь промежуточного соединения 21 (полученного согласно A2.f) (0,0128 моль) в трифторуксусной кислоте (5 мл) и CH2Cl2 (40 мл) перемешивают при 0-5 С на бане со льдом и добавляют по каплям раствор 4-метоксибензолметанола (0,017 моль) в CH2Cl2 (10 мл) на протяжении 30 мин при 0-5 С, затем реакционную смесь перемешивают в течение 2 ч при 0-5 С и растворитель выпаривают (вакуум). Остаток растворяют в CH2Cl2 и промывают H2O и NaHCO3. Органический слой отделяют, сушат (MgSO4),фильтруют и растворитель выпаривают. Остаток очищают на силикагеле (элюент: смесь CH2Cl2/CH3OH 99/1). Фракции продукта собирают и растворитель выпаривают. Выход: 4,3 г промежуточного соединения 22.h. Получение промежуточного соединения 23 Смесь промежуточного соединения 22 (полученного согласно А 2.g) (0,01 моль) и N-этил-N-(1 метилэтил)-2-пропанамина (0,02 моль) в пиридине (100 мл) перемешивают при 80 С и затем через раствор пропускают H2S (газ) в течение 5 ч, затем, чтобы удалить H2S из раствора, через раствор пропускают N2 в течение 2 ч при 80 С. Растворитель выпаривают и остаток растворяют в CH2Cl2. Раствор промывают H2O и 1N HCl. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток очищают, пропуская через силикагель (элюент: смесь CH2Cl2/CH3OH 99/1). Фракции продукта собирают и растворитель выпаривают. Выход: 3 г промежуточного соединения 23.i-1. Получение промежуточного соединения 24 Смесь промежуточного соединения 23 (полученного согласно A2.h) (0,0005 моль) и 1-хлор-2 пропанона (0,00055 моль) в этаноле (4 мл) перемешивают при 80 С в течение 3 ч, затем смесь выдерживают при стоянии на протяжении ночи при комнатной температуре и растворитель выпаривают. Остаток очищают, пропуская через силикагель (элюент: смесь CH2Cl2/CH3OH 97/3). Фракции продукта собирают и растворитель выпаривают, получая фракцию (I). Фракции, содержащие промежуточное соединение 23,собирают и растворитель выпаривают. К остатку добавляют этанол (4 мл) и дополнительное количество 1-хлор-2-пропанона (0,04 мл) и реакционную смесь перемешивают в течение 3 ч. Растворитель выпаривают и остаток подвергают фильтрации в силикагеле (элюент: смесь CH2Cl2/CH3OH 97/3). Фракции продукта собирают и растворитель выпаривают, получая фракцию (II). Наконец, фракцию (I) и фракцию (II) объединяют. Выход: 0,030 г промежуточного соединения 24.i-2. Получение промежуточного соединения 25 Смесь промежуточного соединения 23 (полученного согласно A2.h) (0,0005 моль) и 2-бром-1-(3,4 дихлорфенил)этанона (0,0007 моль) в этаноле (4 мл) перемешивают в закрытом сосуде в течение 18 ч при комнатной температуре и затем растворитель выпаривают. Остаток подвергают фильтрации 2 раза (элюент: смесь CH2Cl2/CH3OH 99/1, 100/0), затем фракции продукта собирают и растворитель выпаривают. Выход: 0,120 г промежуточного соединения 25. Пример A3. а. Получение промежуточного соединения 26 Смесь промежуточного соединения 6 (полученного согласно A1.e) (0,03 моль) в трифторуксусной кислоте (20 мл) и CH2Cl2 (150 мл) перемешивают при 0-5 С на бане со льдом и к ней добавляют по каплям смесь 4-метоксибензолметанола (0,033 моль) в CH2Cl2 (50 моль) на протяжении 30 мин при 0-5 С,затем реакционную смесь перемешивают в течение 1 ч при 0-5 С и растворитель выпаривают. Остаток растворяют в CH2Cl2 и промывают H2O и NaHCO3. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают, наконец, остаток сушат. Выход: 13,9 г промежуточного соединения 26.b. Получение промежуточного соединения 27 Смесь промежуточного соединения 26 (полученного согласно A3. а) (0,03 моль) в 1N NaOH (150 мл) и метанола (150 мл) перемешивают при 80 С в течение 18 ч и затем органический растворитель (ме- 27010974 танол) выпаривают. К водному концентрату добавляют 1N HCl (150 мл), затем полученный осадок отфильтровывают и сушат. Выход: 12 г промежуточного соединения 27. с. Получение промежуточного соединения 28 Смесь промежуточного соединения 27 (полученного согласно А 3.b) (0,026 моль) в SOCl2 (100 мл) перемешивают и кипятят с обратным холодильником в течение 2 ч, затем растворитель выпаривают и 2 раза совместно выпаривают с толуолом. Выход: 12,5 г промежуточного соединения 28.d. Получение промежуточного соединения 29 Раствор промежуточного соединения 28 (полученного согласно A3,с) (0,026 моль) в THF (200 мл) добавляют по каплям к перемешиваемой смеси NH3/H2O (50 мл) при комнатной температуре и реакционную смесь перемешивают в течение 2 ч. Растворитель частично (1/2) выпаривают и концентрат экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток очищают, пропуская через силикагель (элюент: смесь CH2Cl2/CH3OH 95/5). Фракции продукта собирают и растворитель выпаривают. Выход: 3,5 г промежуточного соединения 29. е. Получение промежуточного соединения 30 Смесь промежуточного соединения 29 (полученного согласно A3.d) (0,0022 моль) в смесиDMF/DMA (25 мл) перемешивают при 100 С в течение 18 ч и затем растворитель выпаривают. Остаток подвергают фильтрации в силикагеле 2 раза (элюент: смесь CH2Cl2/CH3OH 99/1), затем фракции продукта собирают и растворитель выпаривают. Выход: 0,51 г промежуточного соединения 30.f. Получение промежуточного соединения 31 Смесь промежуточного соединения 30 (полученного согласно A3.е) (0,001 моль) и моногидрата гидразина (0,0015 моль) в уксусной кислоте (5 мл) перемешивают в закрытом сосуде в течение 2 ч при 90 С и затем растворитель выпаривают. Остаток растворяют в CH2Cl2 и промывают H2O и K2CO3. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: смесь CH2Cl2/СН 3 ОН 97/3). Фракции продукта собирают и растворитель выпаривают. Выход: 0,200 г промежуточного соединения 31.- 28010974 Пример A4. а. Получение промежуточного соединения 32(0,150 моль) в метаноле (достаточное количество) перемешивают на протяжении ночи при комнатной температуре, затем реакционную смесь фильтруют и фильтрат выпаривают. Выход: 21,5 г промежуточного соединения 32.b. Получение промежуточного соединения 33 Смесь промежуточного соединения 32 (полученного согласно А 4.а) (0,11 моль) в смеси CH3OH/NH3(500 мл) гидрируют в присутствии никеля Ренея (2 г) в качестве катализатора. После поглощения Н 2 (2 экв.) катализатор отфильтровывают и фильтрат упаривают. Выход: 20 г промежуточного соединения 33. с. Получение промежуточного соединения 34 Смесь промежуточного соединения 33 (полученного согласно А 4.b) (0,105 моль) и метилового эфира бромуксусной кислоты (0,196 моль) в Et3N (30 мл) подвергают взаимодействию на протяжении ночи при комнатной температуре и добавляют дополнительное количество метилового эфира бромуксусной кислоты (10 г). Добавляют N,N-диметил-4-пиридинамин (1 г) и реакционную смесь перемешивают в течение 3 дней при комнатной температуре. Растворитель выпаривают и остаток разбавляют CH2Cl2. Полученное твердое вещество отфильтровывают и сушат (вакуум) при 50 С. Выход: 6,8 г промежуточного соединения 34.d. Получение промежуточного соединения 35 Смесь ацетилхлорида (0,1 моль) и HCO2Na (10 г) в Et2O (100 мл) перемешивают в течение 6 ч при комнатной температуре и затем твердое вещество отфильтровывают. Добавляют смесь промежуточного соединения 34 (полученного согласно А 4.с) (0,024 моль) в Et2O (достаточное количество) и реакционную смесь перемешивают в течение 4 ч при комнатной температуре. Растворитель выпаривают и остаток гасят NaHCO3, затем экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Выход: 4,4 г промежуточного соединения 35. е. Получение промежуточного соединения 36 трет-BuONa (2 г) добавляют к смеси промежуточного соединения 35 (полученного согласно A4.d)(0,0052 моль) в метиловом эфире уксусной кислоты (3 мл) и THF (80 мл) при комнатной температуре и смесь подвергают взаимодействию в течение 20 мин, затем добавляют воду (20 мл) и раствор концентрируют до остаточного объема 30 мл. К остатку добавляют воду (20 мл) и метанол (40 мл), с последующим- 29010974 добавлением KSCN (3 г) и HCl (3 мл). Реакционную смесь нагревают в течение 3 ч и гасят Na2CO3 (до нейтральности). Раствор концентрируют до остаточного объема 40 мл и концентрат экстрагируютCH2Cl2. Органический слой сушат над MgSO4, фильтруют и упаривают. Выход: 1,5 г промежуточного соединения 36 (88%).f. Получение промежуточного соединения 37 Смесь промежуточного соединения 36 (полученного согласно А 4.е) (0,0015 моль) в 1 М NaOH (5 мл) и метанола (3 мл) перемешивают и кипятят с обратным холодильником в течение 24 ч при 100 С,затем реакционную смесь охлаждают и растворитель выпаривают. Остаток гасят концентрированнойHCl и требуемый продукт собирают. Выход: 360 мг промежуточного соединения 37. Пример A5. а. Получение промежуточного соединения 38N-этил-N-(1-метилэтил)-2-пропанамин (0,1 моль) добавляют к перемешиваемой смеси промежуточного соединения 3 (полученного согласно A1.b) (0,0415 моль) в CH2Cl2, р.а. (100 мл) в атмосфере N2. После перемешивания в течение 15 мин реакционную смесь помещают на баню со льдом и добавляют по каплям при 0 С раствор хлорангидрида тиокислоты (0,0457 моль) в CH2Cl2, p.a. (15 мл). Смесь перемешивают при 0 С в течение 30 мин и при комнатной температуре в течение 18 ч, затем добавляют дополнительное количество N-этил-N-(1-метилэтил)-2-пропанамина (9 мл) и полученную смесь перемешивают в течение 2 ч. Смесь промывают 2 раза H2O, один раз HCl (1N) и снова H2O. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают, затем выпаривают совместно с толуолом. Остаток очищают колоночной хроматографией на силикагеле (элюент: смесь CH2Cl2/гексан 15/85). Фракции продукта собирают и растворитель выпаривают. Выход: 7,4 г промежуточного соединения 38b-1. Получение промежуточного соединения 39 К раствору промежуточного соединения 38 (полученного согласно А 5.а) (0,00175 моль) в THF (20 мл) добавляют моногидрохлорид метилового эфира бета-оксофенилаланина (0,00175 моль), с последующим добавлением K2CO3 (0,00175 моль) и затем H2O (5 мл) и реакционную смесь перемешивают при комнатной температуре в течение 18 ч. Смесь выливают в H2O (50 мл) и экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток очищают колоночной флэш-хроматографией (элюент: смесь CH2Cl2/CH3OH). Фракции продукта собирают и растворитель выпаривают. Выход: 0,095 г промежуточного соединения 39 (12,4%).b-2. Получение промежуточного соединения 40 Моногидрохлорид 2-амино-1-(2-фуранил)этанона (0,00146 моль) добавляют к раствору промежуточного соединения 38 (полученного согласно А 5.а) (0,00122 моль) в 1,4-диоксане, р.а. (6 мл), затем добавляют H2O (0,5 мл) с последующим добавлением K2CO3 (0,00122 моль). Реакционную смесь перемешивают при комнатной температуре в течение 18 ч и растворитель выпаривают, получая промежуточное
МПК / Метки
МПК: C07D 405/04, C07D 417/04, A61K 31/506, A61K 31/4439, C07D 233/84, A61K 31/427, C07D 413/04, C07D 401/04, A61K 31/4245, C07D 403/04, A61K 31/4164
Метки: антагонистов, качестве, рецепторов, меркаптоимидазолы
Код ссылки
<a href="https://eas.patents.su/30-10974-merkaptoimidazoly-v-kachestve-antagonistov-receptorov-ccr2.html" rel="bookmark" title="База патентов Евразийского Союза">Меркаптоимидазолы в качестве антагонистов рецепторов ccr2</a>
Предыдущий патент: Способ получения фосфорной кислоты
Следующий патент: Применение спинозинов для заживления ран
Случайный патент: Новые промежуточные соединения для пестицидов