Новые промежуточные соединения для пестицидов
Формула / Реферат
Способ получения соединения формулы (I)
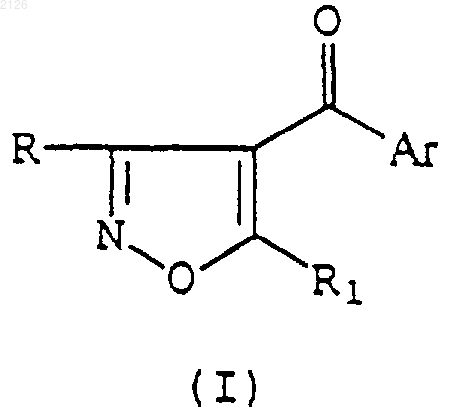
где R представляет -СО2R3;
R1 - представляет C1-6 алкил или циклоалкил с тремя-семью атомами углерода в кольце, необязательно замещенный C1-6 алкилом или галогеном;
Аr представляет
фенил, замещенный одкой-пятью группами R2, которые могут быть одинаковыми или различными;
или фенил, необязательно замещенный одной-тремя группами R2, которые могут быть одинаковыми или различными, и при этом два дополнительных заместителя в смежных положениях фенильного кольца, вместе с двумя атомами, к которым они присоединены, образуют 5-7-членное кольцо, которое, необязательно, замещено одной или несколькими группами R11, которые могут быть одинаковыми или различными;
или группу Het, необязательно замещенную одной или несколькими группами R2, при этом Het представляет первое гетероциклическое кольцо, содержащее от одного до четырех гетероатомов в кольце, выбранных из атомов кислорода, азота и серы, которое необязательно конденсируется с бензольным или карбоциклическим или вторым гетероциклическим кольцом (которое, необязательно, является насыщенным или частично насыщенным) с образованием бициклической системы, при этом первое гетероциклическое кольцо группы Het присоединяется к карбонильной группе в положении 4 изоксазольного кольца;
R2 представляет галоген, C1-6 алкил, C1-6 алкокси, C1-6 галогеноалкил, C1-6 галогеноалкокси, -S(О)mR4, -(CR5R6)qS(O)mR4, нитро, циано, -N(R5)SO2R8, -OSO2R8, циклоалкил с тремя-семью атомами углерода в кольце, алкенил или алкинил с линейной или разветвленной цепью, содержащий до 6 атомов углерода, -CO2R7, -S(О)mR9, -O(СН2)rОR8, -NR5R6, -CONR5R6, -N(R5)С(=O)R10, -(CR5R6)qN(R5)SO2R8, -(CR5R6)qN(R5)С(=O)R10, -(CR5R6)qP(=О)R12R13, -(CR5R6)qR14, -(CR5R6)qR16 или алкил с линейной или разветвленной цепью, содержащий до шести атомов углерода, замещенный -OR5;
когда R2 присутствует на гетероциклическом или карбоциклическом кольце группы Het, R2 может также представлять =O, =S, циклический кеталь или циклический тиокеталь;
R3 представляет C1-6 алкил, C1-6 галогеноалкил, арил или бензил;
R4 представляет C1-6 алкил или фенил, необязательно замещенный одной-пятью группами, выбранными из C1-6 алкила, C1-6 галогеноалкила, галогена и -S-алкила;
R5 и R6 независимо представляют водород, C1-6 алкил или C1-6 галогеноалкил;
R7 представляет водород или C1-6 алкил;
R8 представляет C1-6 алкил или C1-6 галогеноалкил;
R9 представляет C1-6 галогеноалкил, C1-6 алкенил или C1-6 галогеноалкенил;
R10 представляет R8, C1-6 алкокси или C1-6 алкилтио;
R11 представляет R2 или =O, =S, C1-6 алкилимино, циклический кеталь или циклический тиокеталь;
R12 и R13 представляют C1-6 алкил, гидроксил, C1-6 алкокси или C1-6 галогеноалкокси;
R14 представляет 5-членное гетероароматическое кольцо формулы

в которой D, Е, G и J, независимо, представляют -CR15- или
атом азота, причем, по меньшей мере, один из D, Е, G и J представляет -CR15-;
две соседние группы D, Е, G и J могут вместе образовывать второе фенильное или 5-7-членное гетероароматическое кольцо, необязательно замещенное одной или несколькими группами, выбранными из галогена или C1-6 алкила, где указанное 5-7-членное гетероциклическое кольцо содержит от одного до четырех гетероатомов в кольце, которые могут быть одинаковыми или различными, выбранными из атомов азота, кислорода и серы;
R15 представляет водород, галоген, C1-6 алкил, C1-6 галогеноалкил, нитро, циано, -CО2R7, -S(О)mR8, C1-6 алкокси, C1-6 галогеноалкокси или циклопропил;
R16 представляет фенил, необязательно замещенный галогеном, нитро, циано, C1-6 алкил, C1-6 алкокси, C1-6 галогеноалкил, C1-6 галогеноалкокси, -S(O)mR8, -(CR5R6)S(О)mR8;
m равно 0, 1 или 2;
q равно 1 или 2; и
r равно 1, 2 или 3;
отличающийся тем, что соединение формулы (II)
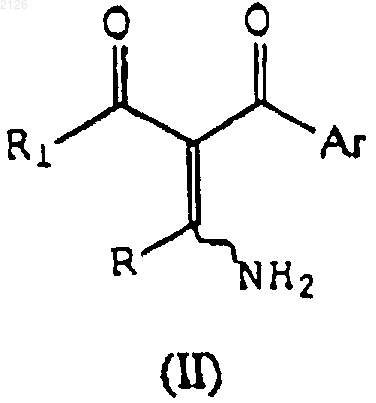
где R, R1 и Аr имеют указанные выше значения, вводят во взаимодействие с гидроксиламином или его солью.
2. Способ получения соединения формулы (Iа)
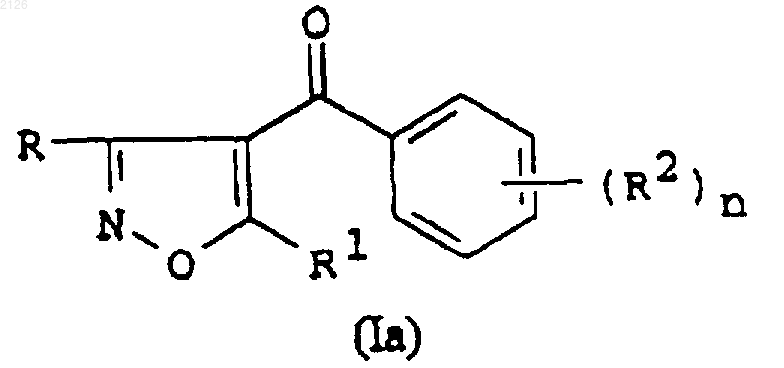
где R представляет -CO2R3;
R1 представляет C1-6 алкил или циклоалкил с тремя-семью кольцевыми атомами углерода, необязательно замещенный C1-6 алкилом или галогеном;
R2 представляет галоген, C1-6 алкил, C1-6 алкокси, С1-6 галогеноалкил, C1-6 галогеноалкокси, -S(О)mR4, -(CR5R6)qS(O)mR4, нитро, циано, -N(R7)SO2R8, -OSO2R8, циклоалкил с тремя-семью атомами углерода в кольце, либо алкенил или алкинил с линейной или разветвленной цепью, содержащий до 6 атомов углеродa;
R3 представляет C1-6 алкил, C1-6 галогеноалкил, арил или бензил;
n является целым числом от 1 до 5;
R4 представляет C1-6 алкил или фенил, необязательно замещенный одной-пятью группами, выбранными из C1-6 алкила, C1-6 галогеноалкила, галогена и -S-алкила;
R5 и R6 независимо представляют водород, C1-6 алкил или C1-6 галогеноалкил;
R7 представляет водород или C1-6 алкил;
R8 представляет C1-6 алкил или C1-6 галогеноалкил;
m равно 0, 1 или 2; и q равно 1 или 2;
отличающийся тем, что соединение формулы (IIа)
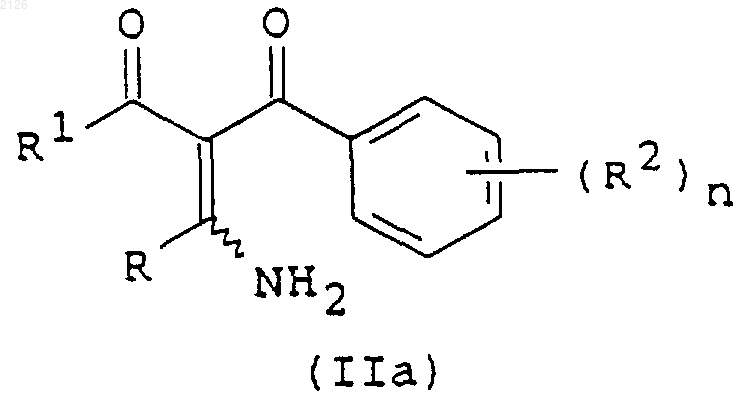
где R, R1, R2 и n имеют указанные выше значения, вводят во взаимодействие с гидроксиламином или его солью.
3. Способ по п.1 или 2, отличающийся тем, что взаимодействие осуществляют при температуре от 20шС до температуры кипения растворителя, предпочтительно - от 30 до 80шС.
4. Способ по пп. 1, 2 или 3, отличающийся тем, что молярное соотношение соединения формулы (II) и гидроксиламина составляет, вообще, от 1:1 до 1:2, предпочтительно от 1:1,01 до 1:1,2.
5. Способ по любому из пп.1-4, отличающийся тем, что взаимодействие осуществляют в присутствии основания.
6. Соединение формулы (II)
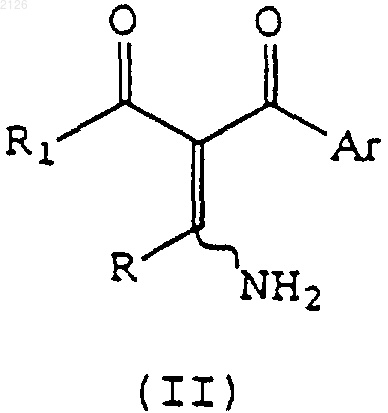
где R, R1 и Аr имеют значения, указанные в п.1.
7. Соединение формулы (IIа)
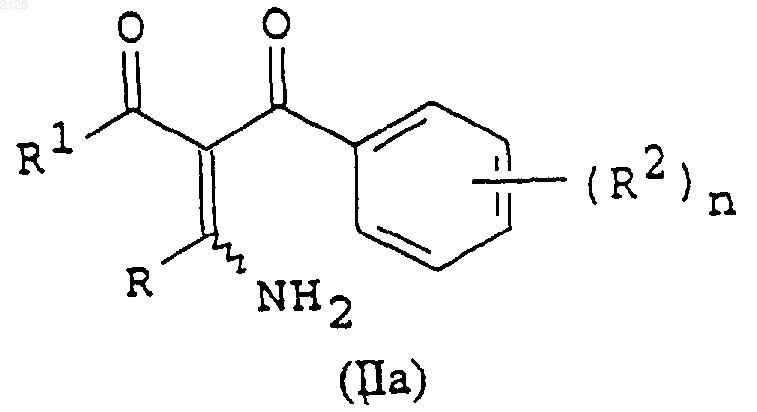
где R, R1, R2 и n имеют значения, указанные в п.2.
8. Соединение по п.6 или 7, в котором R1 представляет циклоалкил с тремя-семью атомами углерода в кольце, необязательно замещенный C1-6 алкилом или галогеном.
9. Соединение по п.8, в котором R1 представляет 1-метил-циклопропил или циклопропил.
10. Применение соединения формулы (II) по п.6 в качестве промежуточного соединения в синтезе гербицида формулы (I) по п.1.
11. Способ получения соединения формулы (II) по п.1, отличающийся тем, что соединение формулы (III)
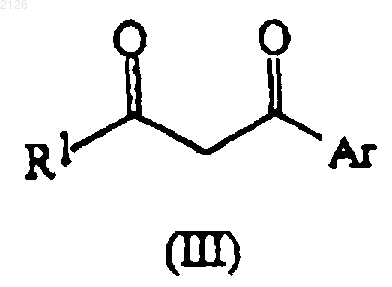
где R1 и Аr имеют значения, указанные в п.1, вводят во взаимодействие с цианоацетатом формулы (IV)
R3OC(=O)-CN (IV),
где R3 имеет значения, указанные в п.1, в присутствии катализатора.
12. Способ по п.11, отличающийся тем, что катализатор представляет катализатор на основе переходного металла, предпочтительно цинковый или никелевый катализатор; или органический кислотный катализатор, такой как уксусная кислота или трифторуксусная кислота.
13. Способ по п.11 или 12, отличающийся тем, что взаимодействие осуществляют при температуре от 20шС до температуры кипения растворителя, предпочтительно от 50 до 90шС.
14. Способ по пп.10, 11 или 12, отличающийся тем, что молярное соотношение соединений формул (III) и (IV) составляет от 1:1 до 1:2, предпочтительно от 1:1,05 до 1:1,2.
Текст
1 Данное изобретение относится к новым производным 2-(аминометилиден)пропан-1,3 диона, способам их получения и применению их в качестве промежуточных соединений при производстве гербицидно активных соединений. В публикациях европейских патентов 0487357, 0560482, 0580439, 0609797, 0609798,0636622, 0682659, и в публикации международного патентаWO 95/16678 описываются,среди прочего, гербициды на основе сложных 3 эфиров 4-бензоилизоксазола. В частности, в ЕРА-0560482 описывается синтез этил-5 циклопропил-4-[3,4-дихлор-2-(метилсульфенил)бензоил]изоксазол-3-карбоксилата. Гербицидные сложные 3-эфиры 4-гетероароилизоксазолов также известны из литературы, например, из ЕР-А-0588357, ЕР-А-0636622 иW096/25413. В каждой из этих публикаций описываются различные способы получения таких 3-эфир-4-арилизоксазолов, например, взаимодействием 1-циклопропил-3-арилпропан-1,3 диона с хлороксимом. Однако существует потребность в альтернативных способах получения таких соединений. В литературе описаны некоторые производные 2-(аминометилиден)пропан-1,3-диона. в которой Ra и R1a, которые могут быть одинаковыми или различными, представляют, каждый, (C1-C4)-алкил, арил или (C1-C4)-алкокси, иR2a представляет (C1-C4)-алкил или бензил. Указывается, что эти соединения полезны в качестве промежуточных соединений при синтезе,например, фармацевтических препаратов. Целью настоящего изобретения является новый способ получения гербицидно активных соединений. Другой целью изобретения является получение новых промежуточных соединений при производстве гербицидно активных соединений. И еще одной целью изобретения являются способы получения таких промежуточных соединений и гербицидов с высоким выходом. Эти и другие цели изобретения станут очевидными из дальнейшего описания, и достигаются в целом или частично с помощью настоящего изобретения. Настоящее изобретение относится к способу получения соединения формулы (I)R1 является низшим алкилом или циклоалкилом с тремя-семью атомами углерода в кольце, необязательно замещенным низшим алкилом или галогеном; Аr представляет фенил, необязательно замещенный однойпятью группами R2, которые могут быть одинаковыми или различными; или фенил, необязательно замещенный одной-тремя группами R2,которые могут быть одинаковыми или различными, и при этом два дополнительных заместителя в соседних позициях фенильного кольца,вместе с двумя атомами, к которым они присоединены, образуют несколькими группами R11,которые могут быть одинаковыми или различными; или представляет группу Het, необязательно замещенную одной или несколькими группами R2, при этом Het представляет первое гетероциклическое кольцо, содержащее одинчетыре гетероатома в кольце, выбранных из атомов кислорода, азота и серы, которое, необязательно, сконденсировано с бензольным или карбоциклическим или вторым гетероциклическим кольцом (которое, необязательно, является насыщенным или частично насыщенным) с образованием бициклической системы, при этом первое гетероциклическое кольцо группы Het присоединяется к карбонильной группе в положении 4 изоксазольного кольца;R2 представляет галоген, низший алкил, низший алкокси, низший галогеноалкил, низший галогеноалкокси, -S(O)mR4, -(CR5R6)qS(O)mR4, нитро,циано, -N(R5)SO2R8, -OSO2R8, циклоалкил с тремясемью атомами углерода в кольце, алкенил или алкинил с линейной или разветвленной цепью, содержащий до 6 атомов углерода, -CO2R7, -S(O)mR9,-O(CH2)rOR8, -NR5R6, -CONR5R6, -N(R5)С(=O)R10, -(CR5R6)qP(=O)R12R13, -(CR5R6)qR14,-(CR5R6)qR16 или алкил с линейной или разветвленной цепью, содержащий до шести атомов углерода, замещенный -OR5; когда R2 присутствует на гетероциклическом или карбоциклическом кольце группы Het,R2 может также представлять =O, =S, циклический кеталь или циклический тиокеталь;R4 представляет низший алкил или фенил,необязательно замещенный одной-пятью группами, выбранными из низшего алкила, низшего галогеноалкила, галогена и -S-алкила;R5 и R6, независимо, представляют водород, низший алкил или низший галогеноалкил;R7 представляет водород или низший алкил;R8 представляет низший алкил или низший галогеноалкил;R9 представляет низший галогеноалкил,низший алкенил или низший галогеноалкенил;R10 представляет R8, низший алкокси или низший алкилтио;R11 представляет R2 или =O, =S, низший алкилимино, циклический кеталь или циклический тиокеталь;R12 и R13 представляют низший алкил, гидроксил, низший алкокси или низший галогеноалкокси;-CR15- или атом азота, причем, по меньшей мере, один из D, Е, G и J представляет -CR15-; две соседние группы D, Е, G и J могут вместе образовывать второе фенильное или 5-7 членное гетероароматическое кольцо, необязательно замещенное одной или несколькими группами, выбранными из галогена или низшего алкила, где указанное 5-7-членное гетероциклическое кольцо содержит один-четыре гетероатома в кольце, которые могут быть одинаковыми или различными, выбранными из атомов азота, кислорода и серы;R15 представляет водород, галоген, низший алкил, низший галогеноалкил, нитро, циано,-CO2R7, -S(O)mR8, низший алкокси, низший галогеноалкокси или циклопропил;r равно 1, 2 или 3; отличающемуся тем, что соединение формулы (II) где R, R1 и Аr имеют указанные выше значения,вводят во взаимодействие с гидроксиламином или его солью. Гидроксиламин в этой реакции можно использовать в форме соли, например, сульфата гидроксиламина или гидрохлорида гидроксиламина. Когда взаимодействие осуществляют с использованием соли гидроксиламина, предпочтительно для ускорения реакции, введения в реакционную смесь основания для высвобожде 002126 4 ния гидроксиламина и инициирования реакции. Примерами подходящих оснований являются соединения металлов с щелочными свойствами,такие как ацетат, карбонат или гидрокарбонат натрия; или органические основания, например,амины, такие как диизопропиламин и триэтиламин. Когда основание присутствует, соотношение основание:гидроксиламин обычно составляет от 0,01:1 до 1,5:1, предпочтительно - от 0,1:1 до 1,1:1. Взаимодействие предпочтительно осуществляют в растворителе. Примерами подходящих растворителей являются ароматические,алифатические и циклоалифатические углеводороды и галогенированные или негалогенированные углеводороды, например, дихлорметан,толуол, дихлорэтан или хлорбензол; простые эфиры,такие как третбутилметиловый эфир (МТВЕ) и тетрагидрофуран; спирты, такие как этанол и метанол; или вода. Следует понимать, что взаимодействие можно осуществлять в смеси двух или более различных растворителей. Взаимодействие обычно осуществляют при температуре от 20 С до температуры кипения растворителя, предпочтительно от 30 до 80 С. Молярное соотношение соединения формулы (II): гидроксиламин составляет обычно от 1:1 до 1:2, предпочтительно от 1:1,01 до 1:1,2. Терминами "низший алкил", "низший алкенил", "низший алкокси", или "низший алкилтио" обозначаются, соответственно, линейный или разветвленный алкильный, алкенильный,алкоксильный или алкилтиорадикал, с однимшестью атомами углерода. Терминами"низший галогеноалкил","низший галогеноалкенил" или "низший гелогеноалкокси" обозначаются, соответственно, линейный или разветвленный алкильный, алкенильный или алкоксильный радикал с однимшестью атомами углерода, замещенный одним или несколькими атомами галогена. Когда присутствует 5-7-членное кольцо,образующее часть группы Аr, оно может являться карбоциклическим или гетероциклическим, содержащим один или несколько гетероатомов, выбранных, предпочтительно, из атомов кислорода, серы и азота (предпочтительно от одного до четырех), причем следует понимать,что когда присутствует атом серы, он может находиться в форме группы -SO- или -SO2-, и может являться ароматическим, насыщенным или частично насыщенным. Когда R11 представляет циклический кеталь или циклический тиокеталь, кетальное или тиокетальное кольцо, предпочтительно, содержит 5 или 6 членов в кольце. Примерами группы Аr, когда она представляет фенил, сконденсированный с 5-7 5 членным кольцом, являются следующие, необязательно замещенные, циклические системы и соответствующие дигидросоединения (когда они являются подходящими): бензо-1,2,3-тиадиазол, бензо[b]тиофен, бензо[b]фуран, бензо[с]тиофен, бензо[с]фуран, бензтиазол, 1,2-бензизотиазол, 2,1-бензизотиазол, 1,2 бензтиазин, 2,1-бензтиазин, 1,3-бензотиазин, 1,4 бензотиазин, бензимидазол, индазол, тиохроман,хроман, 2 Н-тиохромен, 2 Н-хромен, 4 Н-тиохромен,4 Н-хромен, изотиохроман, изохроман, изотиохромен, изохромен, бензофуран, 1,3-бензодитиол, 1,3 бензодиоксол, 1,3-бензоксатиол, 1,4-бензодитиин,1,4-бензоксатиин,1,3-бензоксатиин,3,1 бензоксатиин, 1,3-бензодитиин, тиохроман-4-он и сахарин. Соединения приведенной выше формулы(I) такого типа описаны в ЕР-А-0636622. Когда присутствует группа Het, предпочтительно, первое гетероциклическое кольцо содержит 4-7 кольцевых атомов, а карбоциклическое или второе гетероциклическое кольцо содержит 4-7 кольцевых атомов. Het может являться ароматическим или неароматическим. Примерами кольцевой системы Het являются тиенил, фурил, пирролил и их бензоконденсированные аналоги; оксазинил, тиазинил, пиразинил, пиримидинил, пиридазинил и их бензоконденсированные аналоги; тиазолил, оксазолил, имидазолил и их бензоконденсированные аналоги; пиразолил, изоксазолил, изотиазолил и их бензоконденсированные аналоги; оксадиазолил, тиадиазолил, триазолил и,когда являются подходящими, их бензоконденсированные аналоги; пиридинил, пиранил, тиинил и их бензоконденсированные аналоги; оксадиазинил, тиадиазинил, триазинил и,когда являются подходящими, их бензоконденсированные аналоги; тетразолил, пиперидинил, морфолинил и пиперазинил. Соединения формулы (I), в которых Аr представляет Het, описаны в ЕР-А 0588357. Предпочтительно, соединение формулы (I) является соединением формулы (Iа) где R и R1 имеют установленные выше значения;R2 представляет галоген, низший алкил, низший алкокси, низший галогеноалкил, низший галогеноалкокси, -S(O)mR4, -(CR5R6)qS(O)mR4, нитро,циано, -N(R7)SO2R8, -OSO2R8, циклоалкил с тремясемью атомами углерода в кольце; или алкенил или алкинил с линейной или разветвленной цепью,содержащий до 6 атомов углерода;n является целым числом от 1 до 5;R4 представляет низший алкил или фенил,необязательно замещенный одной-пятью группами, выбранными из низшего алкила, низшего галогеноалкила, галогена и-S-алкила;R5 и R6, независимо, представляют водород, низший алкил или низший галогеноалкил;R7 представляет водород или низший алкил;R8 представляет низший алкил или низший галогеноалкил;m равно 0, 1 или 2; и q равно 1 или 2; которое получают посредством взаимодействия соединения формулы (IIа) где R, R1, R2 и n имеют указанные выше значения,с гидроксиламином или его солью. Соединения приведенных выше формул(II) и (IIа) являются новыми соединениями и,следовательно, составляют еще один признак настоящего изобретения. Соединения приведенных выше формул(II) и (IIа), в которых R1 представляет циклоалкил с тремя-семью кольцевыми атомами углерода, необязательно замещенный низшим алкилом или галогеном, являются предпочтительными. Более предпочтительно R1 представляет 1-метилциклопропил или, наиболее предпочтительно, циклопропил. В приведенной выше формуле (IIа) одна группа R2, предпочтительно, находится в ортоположении фенильного кольца.-СF3, галогена и -S(O)mR4. В приведенной выше формуле (IIа) предпочтительными группами (R2)n являются 2SСН 3-3-Сl-4-Сl, 2-SОСН 3-3-Сl-4-Сl, 2-SСН 3-4 СF3, 2-SO2 СН 3-4-СF3 и 2-SO2 СН 3-4-галоген(предпочтительно, Сl или Br). Соединения формулы (IIа), в которых (R2)n представляют 2-SСН 3-3-Сl-4-Сl или 2-SСН 3-4 СF3, являются особенно предпочтительными. Предпочтительно, R3 представляет низший алкил, в особенности, этил. В приведенной выше формуле (IIа) n,предпочтительно, равен 2 или 3. В соответствии с другим признаком настоящего изобретения, соединения формулы (II) можно получить посредством взаимодействия соединения формулы (III) где R1 и Аr имеют установленные выше значения, с цианоацетатом формулы (IV)R3OC(=O)-CN (IV),3 где R имеет указанные выше значения, в присутствии катализатора. Это взаимодействие описано в литературе, см., например, limori etal., Tetrahedron letters, 1979, vol.27, pp.25252528, A. Veronese et al., J. Molecular Catalysis,vol.54 (1989), pp.73-80; и патент Италии 1200768. Реакцию осуществляют, предпочтительно,в растворителе. Примерами растворителей, которые могут быть подходящими, являются ароматические, алифатические и циклоалифатические углеводороды, галогенированные или негалогенированные углеводороды, например,хлорбензолы, дихлорметан, дихлорэтан или,предпочтительно, толуол; и простые эфиры,например, метил-трет-бутиловый эфир (МТВЕ). Подходящими катализаторами являются катализатор на основе переходного металла, предпочтительно, цинковый или никелевый катализатор, такой как ацетат цинка, ацетоацетат цинка, ацетоацетат никеля или хлорид цинка; или органический кислотный катализатор, такой как уксусная кислота или трифторуксусная кислота. Также можно использовать различные смеси указанных выше катализаторов. Щелочные катализаторы, как правило, дают плохие результаты и приводят к образованию побочных продуктов. Катализатор на основе металла обычно присутствует в небольшом количестве, например, в количестве примерно 2 мол. % от количества соединения формулы (III). Взаимодействие предпочтительно осуществлять при температуре от 20 С до температуры кипения растворителя, предпочтительно от 40 до 90 С (например, от 50 до 90 С). Молярное соотношение соединений формул (III) и (IV) обычно составляет от 1:1 до 1:2,предпочтительно от 1:1,05 до 1:1,2. Соединения формулы (III) известны из литературы из публикаций европейских и международных патентов, перечисленных выше, или могут быть получены известными способами. Соединения приведенной выше формулы (IV) также известны из литературы или могут быть получены известными способами. В соответствии с еще одним признаком настоящего изобретения, соединения приведенной выше формулы (I), в которых R, R1, R2 и n имеют указанные выше значения, можно получить посредством взаимодействия соединения приведенной выше формулы (III) с соединением 8 приведенной выше формулы (IV) и непосредственным взаимодействием полученного таким образом соединения формулы (II) с гидроксиламином или его солью. Приведенные далее, не являющиеся ограничительными примеры поясняют изобретение. В дальнейшем описании обозначение "мМ" означает миллимоли, а "т.пл." означает температуру плавления. Пример 1. Получение этил-5-циклопропил 4-(3,4-дихлор-2-метилсульфенилбензоил)изоксазол-3-карбоксилата. В реактор емкостью 100 мл загружают 1 циклопропил-3-(3,4-дихлор-2-метилсульфенилфенил)пропан-1,3-дион (9,087 г, 30 мМ), а затем толуол (10 мл), этилцианоформиат (3,11 мл, 31,5 мМ) и дигидрат ацетата цинка (132,5 мг, 0,6 мМ). Смесь перемешивают при 80 С в течение 2,3 ч, и получают этил-2-амино-3-циклопропилкарбонил-4-оксо-(3,4-дихлор-2-метилсульфенилфенил)бут-2-еноат. Температуре реакции дают снизиться до 50 С, добавляют гидрохлорид гидроксиламина(2,296 г, 33 мМ) и ацетат натрия (0,494 г, 6 мМ) в этаноле (40 мл), и смесь перемешивают при 50 С в течение 2,8 ч, после чего реакцию завершают. Реакционную смесь разбавляют, добавляя толуол (15 мл), и этанол удаляют посредством испарения при пониженном давлении при 45 С. Добавляют еще толуол, и смесь снова частично упаривают. Реакционную смесь экстрагируют при 50 С водой, и водные фазы снова экстрагируют толуолом. Толуольные фазы упаривают досуха при пониженном давлении. Сырой продукт реакции (светло-оранжевое твердое вещество) сушат до постоянного веса, и получают указанное в заголовке соединение (т.пл. 79,5 С) в количестве 11,84 г (теоретически 12 г, выход 98,7%). Получение 1-циклопропил-3-(3,4-дихлор 2-метилсульфенилфенил)пропан-1,3-диона описано в ЕР-А-0560482, где также описывается синтез этил-5-циклопропил-4-(3,4-дихлор-2 метилсульфенил-бензоил)изоксазол-3-карбоксилата посредством обработки магниевой соли 1 циклопропил-3-(3,4-дихлор-2-метилсульфенилфенил)пропан-1,3-диона этилхлороксимидоацетатом в дихлорметане (см. пример 2 в ЕР-А 0560482). Сообщается, что при этой реакции получают 2,19 г (5,47 мМ) названного в заголовке соединения из 2,0 г (6,60 мМ) диона, т.е.,выход составляет 82,9 % (против 98,7% по настоящему изобретению), что также иллюстрирует преимущества настоящего изобретения. Пример 2. Получение этил-2-амино-3 циклопропилкарбонил-4-оксо-4-(3,4-дихлор-2 метилсульфенилфенил)бут-2-еноата. 1-Циклопропил-3-(3,4-дихлор-2-метилсульфенилфенил)пропан-1,3-дион (1,82 г, 6 мМ) и этилцианоацетат (0,66 мл, 6,6 мМ) перемешивают в 1,2-дихлорэтане (5 мл) в течение 1,5 ч при 50 С, а затем в течение 3 ч при 80 С. После 9 охлаждения до температуры окружающей среды раствор промывают водой. Органическую фазу упаривают при пониженном давлении и получают 2,5 г сырого продукта реакции, который очищают колоночной хроматографией с использованием смеси гептана и этилацетата. Получают твердое вещество, которое кристаллизуют в пентане с образованием 1,5 г названного в заголовке продукта, т.пл. 78 С. Пример 3. Получение этил-5-циклопропил 4-(3,4-дихлор-2-метилсульфенилбензоил)изоксазол-3-карбоксилата. Этил-2-амино-3-циклопропилкарбонил-4 оксо-4-(2,4-дихлор-2-метилсульфенилфенил)бут-2-еноат (1,0 г, 2,58 мМ) растворяют в этаноле (7 мл). Добавляют гидрохлорид гидроксиламина (0,198 г, 2,85 мМ) и ацетат натрия (0,233 г,2,84 мМ), и реакционную смесь перемешивают в течение 1 ч при 50 С. Реакционную смесь охлаждают до комнатной температуры, и добавляют воду, а затем удаляют присутствующий этанол при пониженном давлении. Реакционную смесь экстрагируют МТВЕ, и органическую фазу промывают водой и упаривают при пониженном давлении. Получают 0,82 г указанного в заголовке соединения в виде белого твердого вещества. Пример 4. Получение этил-2-амино-3 циклопропилкарбонил-4-оксо-4-(2-метилсульфенил-4-трифторметилфенил)бут-2-еноата. В реактор емкостью 25 мл загружают 1 циклопропил-3-(2-метилсульфенил-4-трифторметилфенил)пропан-1,3-дион (2,41 г, 8 мМ), а затем толуол (6 мл), дигидрат ацетата цинка (35 мг, 0,16 мМ) и этилцианоформиат (860 мкл, 8,7 мМ). Смесь перемешивают при 78 С в течение 4 ч. После охлаждения до температуры окружающей среды к смеси добавляют толуол (20 мл), и раствор промывают рассолом. Органическую фазу упаривают при пониженном давлении, и получают 3,34 г сырого продукта в виде вязкого масла, которое обрабатывают диэтиловым эфиром и пентаном. После фильтрования полученного нерастворимого вещества раствор упаривают при пониженном давлении, и получают 2,95 г темного вязкого масла (выход 87,5%, анализ: 95%). Пример 5. Получение этил-5-циклопропил 4-(2-метилсульфенил-4-трифторметилбензоил)изоксазол-3-карбоксилата. В реактор емкостью 50 мл загружают дигидрат ацетата цинка (151 мг, 0,69 мМ), а затем дихлорметан (14 мл), 1-циклопропил-3-(2 метилсульфенил-4-трифторметилфенил)пропан 1,3-дион (10 г, 33 мМ) и этилцианоформиат (3,7 мл, 37,5 мМ). Смесь перемешивают при 45 С в течение 6 ч, и получают этил-2-амино-3 циклопропилкарбонил-4-оксо-4-(2-метилсульфенил-4-трифторметилфенил)бут-2-еноат. Перед добавлением этанола (20 мл) отгоняют дихлорметан. Добавляют гидрохлорид гидроксиламина (2,53 г, 36,38 мМ) в этаноле (5 10 мл), затем ацетат натрия (0,546 г, 6,66 мМ), и смесь перемешивают при 50 С в течение 4 ч. После охлаждения до температуры окружающей среды добавляют этанол (10 мл), и получающуюся в результате желтую суспензию выливают в воду. Твердое вещество отфильтровывают и затем сушат до постоянного веса, и получают указанное в заголовке соединение в виде желтого твердого вещества (13 г, т.пл. 93-95 С) с общим выходом 93,4% (анализ: 95%). ФОРМУЛА ИЗОБРЕТЕНИЯ Способ получения соединения формулы (I)R1 представляет C1-6 алкил или циклоалкил с тремя-семью атомами углерода в кольце, необязательно замещенный C1-6 алкилом или галогеном; Аr представляет фенил, замещенный одной-пятью группами R2, которые могут быть одинаковыми или различными; или фенил, необязательно замещенный одной-тремя группами R2, которые могут быть одинаковыми или различными, и при этом два дополнительных заместителя в смежных положениях фенильного кольца, вместе с двумя атомами, к которым они присоединены, образуют 5-7-членное кольцо, которое, необязательно,замещено одной или несколькими группами R11,которые могут быть одинаковыми или различными; или группу Het, необязательно замещенную одной или несколькими группами R2, при этом Het представляет первое гетероциклическое кольцо, содержащее от одного до четырех гетероатомов в кольце, выбранных из атомов кислорода, азота и серы, которое необязательно конденсируется с бензольным или карбоциклическим или вторым гетероциклическим кольцом(которое, необязательно, является насыщенным или частично насыщенным) с образованием бициклической системы, при этом первое гетероциклическое кольцо группы Het присоединяется к карбонильной группе в положении 4 изоксазольного кольца;R2 представляет галоген, C1-6 алкил, C1-6 алкокси, C1-6 галогеноалкил, C1-6 галогеноалкокси, -S(О)mR4, -(CR5R6)qS(O)mR4, нитро, циано,-N(R5)SO2R8, -OSO2R8, циклоалкил с тремясемью атомами углерода в кольце, алкенил или алкинил с линейной или разветвленной цепью,содержащий до 6 атомов углерода, -CO 2 R 7 ,-S(О) mR 9 , -O(СН 2) rОR 8, -NR 5 R 6 , -CONR 5 R 6 ,-N(R 5)С(=O)R 10, -(CR 5 R 6) q N(R 5 )SO 2 R 8 , 11-(CR 5 R 6) qN(R5 )С(=O)R 10, -(CR5R6)qP(=О)R12R13, (CR5R6)qR14, -(CR5R6)qR16 или алкил с линейной или разветвленной цепью, содержащий до шести атомов углерода, замещенный -OR5; когда R2 присутствует на гетероциклическом или карбоциклическом кольце группы Het,R2 может также представлять =O, =S, циклический кеталь или циклический тиокеталь;R7 представляет водород или C1-6 алкил;R11 представляет R2 или =O, =S, C1-6 алкилимино, циклический кеталь или циклический тиокеталь;-CR15- или атом азота, причем, по меньшей мере, один из D, Е, G и J представляет -CR15-; две соседние группы D, Е, G и J могут вместе образовывать второе фенильное или 5-7 членное гетероароматическое кольцо, необязательно замещенное одной или несколькими группами, выбранными из галогена или C1-6 алкила, где указанное 5-7-членное гетероциклическое кольцо содержит от одного до четырех гетероатомов в кольце, которые могут быть одинаковыми или различными, выбранными из атомов азота, кислорода и серы; где R, R1 и Аr имеют указанные выше значения,вводят во взаимодействие с гидроксиламином или его солью. 2. Способ получения соединения формулыR1 представляет C1-6 алкил или циклоалкил с тремя-семью кольцевыми атомами углерода,необязательно замещенный C1-6 алкилом или галогеном;R2 представляет галоген, C1-6 алкил, C1-6 алкокси, С 1-6 галогеноалкил, C1-6 галогеноалкокси, -S(О)mR4, -(CR5R6)qS(O)mR4, нитро, циано,-N(R7)SO2R8, -OSO2R8, циклоалкил с тремясемью атомами углерода в кольце, либо алкенил или алкинил с линейной или разветвленной цепью, содержащий до 6 атомов углеродa;n является целым числом от 1 до 5;R7 представляет водород или C1-6 алкил; где R, R1, R2 и n имеют указанные выше значения, вводят во взаимодействие с гидроксиламином или его солью. 3. Способ по п.1 или 2, отличающийся тем,что взаимодействие осуществляют при температуре от 20 С до температуры кипения растворителя, предпочтительно от 30 до 80 С. 4. Способ по пп. 1, 2 или 3, отличающийся тем, что молярное соотношение соединения формулы (II) и гидроксиламина составляет, вообще, от 1:1 до 1:2, предпочтительно от 1:1,01 до 1:1,2. 5. Способ по любому из пп.1-4, отличающийся тем, что взаимодействие осуществляют в присутствии основания. 6. Соединение формулы (II) где R, R1, R2 и n имеют значения, указанные в п.2. 8. Соединение по п.6 или 7, в котором R1 представляет циклоалкил с тремя-семью атомами углерода в кольце, необязательно замещенный C1-6 алкилом или галогеном. 9. Соединение по п.8, в котором R1 представляет 1-метилциклопропил или циклопропил. 10. Применение соединения формулы (II) по п.6 в качестве промежуточного соединения в синтезе гербицида формулы (I) по п.1. 14 11. Способ получения соединения формулы (II) по п.1, отличающийся тем, что соединение формулы (III)R3OC(=O)-CN (IV) 3 где R имеет значения, указанные в п.1, в присутствии катализатора. 12. Способ по п.11, отличающийся тем, что катализатор представляет катализатор на основе переходного металла, предпочтительно цинковый или никелевый катализатор; или органический кислотный катализатор, такой как уксусная кислота или трифторуксусная кислота. 13. Способ по п.11 или 12, отличающийся тем, что взаимодействие осуществляют при температуре от 20 С до температуры кипения растворителя, предпочтительно от 50 до 90 С. 14. Способ по пп.10, 11 или 12, отличающийся тем, что молярное соотношение соединений формул (III) и (IV) составляет от 1:1 до 1:2,предпочтительно от 1:1,05 до 1:1,2.
МПК / Метки
МПК: C07D 261/08
Метки: пестицидов, новые, промежуточные, соединения
Код ссылки
<a href="https://eas.patents.su/8-2126-novye-promezhutochnye-soedineniya-dlya-pesticidov.html" rel="bookmark" title="База патентов Евразийского Союза">Новые промежуточные соединения для пестицидов</a>
Предыдущий патент: Способ производства азотной кислоты и ее рекуперации.
Следующий патент: Композиция для окрашивания in vivo, способ ее получения и способы ее применения для идентификации диспластической ткани
Случайный патент: Способ определения присутствия антигена папилломатозного пальцевидного дерматита в образце сыворотки жвачного животного












