Лиганды ванилоидных рецепторов
Номер патента: 10380
Опубликовано: 29.08.2008
Авторы: Дохерти Элизабет М., Фотш Кристофер Х., Халм Кристофер, Ванг Хаи-Линг, Норман Марк Х., Огнянов Вассил И., Петтус Липинг Х., Жу Джиаванг, Домингэз Селиа, Рзаса Роберт Майкл, Никси Томас, Фэлси Джеймс Ричард, Кэйтон Джоди, Стек Маркиан, Чакрабарти Партха П., Чен Нинг
Формула / Реферат
1. Соединение общей формулы
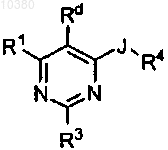
где J обозначает О или S;
Rd обозначает Н;
R1 обозначает:
(i) фенил, необязательно замещенный одним или более заместителями, выбранными из группы, включающей -С(СН3)3, СН3, CF3, F, Cl, Br, CN, ОН, -OCH3, -C(O)H, -CH2OH, -OCF3, NO2, NH2,
-О(СН2)2морфолин, -ОСН2ОСН3, пиперидинил, -OBz, -SMe, пирролидинил, пиридинил, -OSO2CF3,
-NHC(O)CH3, фенил, фторфенил, -СН=СН2, -NHC(O)OC(CH3)3, -C(O)OMe, -NHSO2Me, -NHSO2Ph,
-NHC(O)C6H4CF3, -NHC(О)циклогексан, -NHC(O)CH2циклогексан, -NHC(O)C(CH3)3, -NHC(O)пиридин,
-NHCH2пиридин, -NHCH2пиперидинилC(O)OC(CH3)3, -NHCH2пиперидинил, -NH(CH2)4CH3, -NHBz,
-NHCH2C6H4C(CH3)3, -NHCH2пиридинил, 2,2-диметил[1,3]диоксолан-4-илметокси, -ОСН2СН(ОН)СН2ОН и -ОСН2циклогексан;
(ii) нафтил;
(iii) пиридил, необязательно замещенный Cl, OMe, CF3, F, OBz, Me, Ph, пиперидинил или
-NHCH2циклогексан;
(iv) индолил, замещенный метилом;
(v) дигидроиндолил, замещенный метилом и ацетилом;
(vi) бензофуранил, необязательно замещенный метилом;
(vii) 3,6-дигидро-2Н-пиридил замещенный С(О)С(СН3)3;
(viii) пиперидинил, замещенный одним или более заместителем, выбранным из группы, включающей CF3, F и Ph;
(ix) пиролидинил, замещенный Ph; или
(х) пиперазинил, замещенный iPr, циклопентанилом, циклогептанилом, Ph, -С(О)О(СН3)3, Bz,
-CH(CH3)Ph, -CH(CH3)PhF, -C6H4CF3 или диметилС6Н4-;
R3 обозначает Н или NH2;
R4 обозначает:
(i) фенил, замещенный Br, метокси, NH2, пиридинилом, -NНС(О)пиридином; -NHC(О)фураном,
-NHC(O)CH2N(CH3)2, -NHC(O)CH2OC(O)CH3, -NHC(O)(CH2)2CH3 или -NHC(O)CH3;
(ii) хинолил, необязательно замещенный одним или более заместителями, выбранными из группы, включающей метокси, NH2, N3, F, Cl, СН3, CF3, -NHC(O)CH3, -NHSO2CH3, -NHCH3, -NH(CH2)2OH,
-NH(CH2)2NHC(O)OC(CH3)3, -NH(CH2)2NH2, -C(O)H, -CH2OH, -CH(CH3)OH, морфолинил, -С(О)ОСН3,
-СН(СН3)2ОН, пропанол, пиперазинил и трет-бутилоксикарбонилпиперазинил;
(iii) изохинолил;
(iv) индолил;
(v) бензотиазолил, необязательно замещенный одним или более заместителями, выбранными из группы, включающей СН3, Cl, Br, I, NH2, пиридинил, -C6H4-CF3, имидазолил, -NHCH3, -N(CH3)2, -NH(CH2)2OH,
-NHSO2CH3, -NHC(O)CH3, -NHC(O)CH(OH)CH3, -NHC(O)CH(OAc)CH3, -NHC(O)CH(OH)CH3, -NH(CH3)2,
-NHC(O)C(OAc)(CH3)2, -NHC(O)OH(CH3)2, -NHC(O)CH(OAc)Ph, -NHC(O)CH(OAc)Ph, -NHC(O)CH2OAc,
-NHC(O)CH2OH, -NHC(O)CH(OH)Ph, -NHC(O)CH2Ph, -NHC(O)Et, -NHC(O)CH2Cl, -NHC(O)CH2N(CH3)2,
-NHC(С))СН2морфолин, -NHпиридин, -NHC(O)CF3, пиперазинил, морфолинил, гомопиперазинил, -C(O)NH2, -C(O)N(CH3)2 и -NHC(O)OCH3;
(vi) хиноксалинил, необязательно замещенный СН3, Br, ОСН3, NH2 или NHC(O)CH3;
(vii) хиноксалинонил, необязательно замещенный NH2 или метилом;
(viii) дигидрохиноксалинонил;
(ix) хинолинил, необязательно замещенный CF3;
(х) хиназолинил, замещенный метилом, -NH2, -NH(CH2)3CH3 или -NH(CH3)2;
(xi) нафтил;
(xii) 3,4-дигидронафтален-1 (2Н)-один-ил;
(xiii) пиридин, замещенный Cl или NH2;
(xiv) бензо[е]1,4-диоксан;
(xv) бензоксазолил, замещенный NH2 или -NHC(O)CH3;
(xvi) бензоимидазолил необязательно замещенный NH2;
(xvii) бензо(в)тиофенил или
(xviii) имидазо[1,2-1а]пиридил;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, выбранное из группы
4-(4-трет-бутилфенил)-6-(3-метоксифенокси)пиримидин;
8-[6-(4-трифторметилфенил)пиримидин-4-илокси]хинолин-2-иламин;
2-азидо-8-[6-(4-трифторметилфенил)пиримидин-4-илокси]хинолин;
2-хлор-8-[6-(4-трифторметилфенил)пиримидин-4-илокси]хинолин;
4-(4-трет-бутилфенил)-6-(3-метоксифенилсульфанил)пиримидин;
2-морфолин-4-ил-8-[6-(4-трифторметилфенил)пиримидин-4-илокси]хинолин;
7-[6-(4-трет-бутилфенил)пиримидин-4-илокси]хинолин;
2-метокси-8-[6-(4-трифторметилфенил)пиримидин-4-илокси]хинолин;
8-[6-(4-трифторметилфенил)пиримидин-4-илокси]изохинолин;
5-[6-(4-трет-бутилфенил)пиримидин-4-илокси]-1Н-индол;
5-[6-(4-трет-бутилфенил)пиримидин-4-илокси]-2-метилбензотиазол;
7-[6-(4-трифторметилфенил)пиримидин-4-илокси]хинолин;
4-(3-метоксифенокси)-6-(4-трифторметилфенил)пиримидин;
8-[6-(4-трифторметилфенил)пиримидин-4-илокси]хинолин;
6-[6-(4-трифторметилфенил)пиримидин-4-илокси]-1Н-индол;
6-метокси-2-метил-4-[6-(4-трифторметилфенил)пиримидин-4-илокси]хинолин;
4-(4-трет-бутилфенил)-6-(хинолин-7-илокси)пиримидин-2-иламин;
2-азидо-7-[6-(4-трифторметилфенил)пиримидин-4-илокси]хинолин;
7-[6-(4-трифторметилфенил)пиримидин-4-илокси]хинолин-2-иламин;
6-[6-(4-трифторметилфенил)пиримидин-4-илокси]хиноксалин;
4-хлор-7-[6-(4-трифторметилфенил)пиримидин-4-илокси]хинолин;
2-хлор-7-[6-(4-трифторметилфенил)пиримидин-4-илокси]хинолин;
4-трифторметил-7-[6-(4-трифторметилфенил)пиримидин-4-илокси]-1H-хинолин-2-он;
2-хлор-4-трифторметил-7-[6-(4-трифторметилфенил)пиримидин-4-илокси]хинолин;
4-трифторметил-7-[6-(4-трифторметилфенил)пиримидин-4-илокси]хинолин;
трет-бутиловый эфир 4-{7-[6-(4-трифторметилфенил)пиримидин-4-илокси]хинолин-4-илокси}пиперазин-1-карбоновой кислоты;
4-пиперазин-1-ил-7-[6-(4-трифторметилфенил)пиримидин-4-илокси]хинолин;
6-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-иламин;
2-[6-(4-трифторметилфенил)пиримидин-4-илокси]фениламин;
N-{2-[6-(4-трифторметилфенил)пиримидин-4-илокси]фенил}бутирамид;
8-[6-(4-трифторметилфенил)пиримидин-4-илокси]-1H-хинолин-2-он;
2-метил-8-[6-(4-трифторметилфенил)пиримидин-4-илокси]хиноксалин;
2-метил-5-[6-(4-трифторметилфенил)пиримидин-4-илокси]хиноксалин;
5-[6-(4-трифторметилфенил)пиримидин-4-илокси]хиноксалин;
8-[6-(4-трифторметилфенил)пиримидин-4-илокси]-3,4-дигидро-1Н-хиноксалин-2-он;
5-[6-(4-трифторметилфенил)пиримидин-4-илокси]-1Н- хиноксалин-2-он;
5-[6-(4-трифторметилфенил)пиримидин-4-илокси]-3,4-дигидро-1Н-хиноксалин-2-он;
2-бром-5-[6-(4-трифторметилфенил)пиримидин-4-илокси]-1Н-хиноксалин;
2-метокси-5-[6-(4-трифторметилфенил)пиримидин-4-илокси]хиноксалин;
8-[6-(4-трифторметилфенил)пиримидин-4-илокси]хиноксалин-2-иламин;
N-{8-[6-(4-трифторметилфенил)пиримидин-4-илокси]хиноксалин-2-ил}ацетамид;
5-[6-(4-трифторметилфенил)пиримидин-4-илокси]хиноксалин-2-иламин;
3-амино-8-[6-(4-трифторметилфенил)пиримидин-4-илокси]-1Н-хиноксалин-2-он;
7-[6-(4-трифторметилфенил)пиримидин-4-илокси]-1Н-хинолин-2-он;
1-метил-8-[6-(4-трифторметилфенил)пиримидин-4-илокси]-1Н-хиноксалин-2-он;
1-метил-5-[6-(4-трифторметилфенил)пиримидин-4-илокси]-1Н-хиноксалин-2-он;
3-амино-5-[6-(4-трифторметилфенил)пиримидин-4-илокси]-1Н-хиноксалин-2-он;
N-{3-[6-(4-трифторметилфенил)пиримидин-4-илокси]фенил}ацетамид;
4-метил-8-[6-(4-трифторметилфенил)пиримидин-4-илокси]хиназолин;
8-[6-(4-трифторметилфенил)пиримидин-4-илокси]хиназолин-2-иламин;
бутил-{8-[6-(4-трифторметилфенил)пиримидин-4-илокси]хиназолин-4-ил}амин;
диэтил-{8-[6-(4-трифторметилфенил)пиримидин-4-илокси]хиназолин-4-ил}амин;
7-{6-[4-(трифторметил)фенил]пиримидин-4-илокси}хинолин-3-карбальдегид;
(7-{6-[4-(трифторметил)фенил]пиримидин-4-илокси}-3-хинолин)метан-1-ол;
1-(7-{6-[4-(трифторметил)фенил]пиримидин-4-илокси}-3-хинолин)этан-1-ол;
метил 7-{6-[4-(трифторметил)фенил]пиримидин-4-илокси}хинолин-3-карбоксилат;
2-(7-{6-[4-(трифторметил)фенил]пиримидин-4-илокси}-3-хинолил)пропан-2-ол;
6-{6-[4-(трифторметил)фенил]пиримидин-4-илокси}-2Н,3Н-бензо[е]1,4-диоксан;
4-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-иламин;
N-{4-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-ил}ацетамид;
2-гидрокси-N-{4-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-ил}пропионамид;
(S)-1-{4-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-илкарбамоил}этиловый эфир уксусной кислоты;
2-(S)-гидрокси-N-{4-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-ил}пропио-намид;
2-(R)-гидрокси-N-{4-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-ил}пропионамид;
4-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензоксазол-2-иламин;
N-{4-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензоксазол-2-ил}ацетамид;
метил-{8-[6-(4-трифторметилфенил)пиримидин-4-илокси]хинолин-2-ил}амин;
N-{8-[6-(4-трифторметилфенил)пиримидин-4-илокси]хинолин-2-ил}ацетамид;
N-{8-[6-(4-трифторметилфенил)пиримидин-4-илокси]хинолин-2-ил}метансульфонамид;
2-{8-[6-(4-трифторметилфенил)пиримидин-4-илокси]хинолин-2-иламино}этанол;
(2-{8-[6-(4-трифторметилфенил)пиримидин-4-илокси]хинолин-2-иламино}этил)карбаминовой кислоты трет-бутиловый эфир;
N-{8-[6-(4-трифторметилфенил)пиримидин-4-илокси]хинолин-2-ил}этан-1,2-диамина трифторацетат;
уксусной кислоты {4-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-илкарбамоил} метиловый эфир;
2-гидрокси-N-{4-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-ил}ацетамид;
1-метил-1-{4-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-илкарбамоил}этиловый эфир уксусной кислоты;
2-гидрокси-2-метил-N-{4-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-ил}пропионамид;
{4-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-илкарбамоил}метиловый эфир уксусной кислоты;
2-гидрокси-2-фенил-N-{4-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-ил}ацетамид;
2-фенил-N-{4-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-ил}ацетамид;
N-{4-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-ил}пропионамид;
2-хлор-N-{4-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-ил}ацетамид;
2-диметиламино-N-{4-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-ил}ацетамида трифторацетат;
2-морфолин-4-ил-N-{4-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-ил}ацетамид;
2,2,2-трифтор-N-{4-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-ил}ацетамид;
метил-{4-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-ил}амин;
2-бром-4-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензотиазол;
2-{4-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-иламино}этанол;
N-{4-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-ил}метансульфонамид;
3-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензол-1,2-диамина трифторацетат;
4-[6-(4-трифторметилфенил)пиримидин-4-илокси]-1Н-бензимидазол;
4-[6-(4-трифторметилфенил)пиримидин-4-илокси]-1Н-бензимидазол-2-иламина трифторацетат;
2-йод-4-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензотиазола трифторацетат;
4-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензотиазола трифторацетат;
2-хлор-4-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензотиазол;
2-пиридин-4-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензотиазола трифторацетат;
диметил-{4-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-ил}амина трифторацетат;
пиридин-2-ил-{4-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-ил}амина трифторацетат;
7-[6-(4-хлорфенил)пиримидин-4-илокси]хинолин;
7-[6-(4-трифторметоксифенил)пиримидин-4-илокси]хинолин;
8-[6-(трифторметоксифенил)пиримидин-4-илокси]хинолин-2-иламин;
4-[6-(2-аминохинолин-8-илокси]пиримидин-4-ил]бензонитрил;
7-[6-(3-пирролидин-1-ил)пиримидин-4-илокси]хинолин;
7-(6-бензофуран-5-ил-пиримидин-4-илокси)хинолин;
7-[6-(4-бромфенил)пиримидин-4-илокси]хинолин;
4-[6-(4-бромфенил)пиримидин-4-илокси]бензотиазол-2-иламин;
N-{4-[6-(4-бромфенил)пиримидин-4-илокси]бензотиазол-2-ил}ацетамид;
2-[6-(хинолин-7-илокси)пиримидин-4-ил]фенол;
7-(6-пиридин-3-илпиримидин-4-илокси)хинолин;
4-[6-(2,2-диметил-2,3-дигидробензофуран-6-ил)пиримидин-4-илокси]бензотиазол-2-иламин;
N-{4-[6-(2,2-диметил-2,3-дигидробензофуран-6-ил)пиримидин-4-илокси]бензотиазол-2-ил}ацетамид;
4-[6-(2-метоксиметокси-4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-иламин;
N-{4-[6-(2-метоксиметокси-4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-ил}ацетамид;
N-{4-[6-(2-гидрокси-4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-ил}ацетамид;
2-[6-(2-аминобензотиазол-4-илокси)пиримидин-4-ил]-5-трифторметил-фенол;
N-{4-[6-(2-бензилокси-4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-ил}ацетамид;
2-[6-(2-ацетиламинобензотиазол-4-илокси)пиримидин-4-ил]-5-трифторметилфениловый эфир трифторметансульфоновой кислоты;
N-{4-[6-(4-трифторметил-2-винилфенил)пиримидин-4-илокси]бензотиазол-2-ил}ацетамид;
метиловый эфир 2-[6-(2-ацетиламинобензотиазол-4-илокси)пиримидин-4-ил]-5-трифторметилбензойной кислоты;
трифторацетат 1-{3,3-диметил-6-[6-(хинолин-7-илокси)пиримидин-4-ил]-2,3-дигидроиндол-1-ил} этанона;
трет-бутиловый эфир {2-[6-(2-аминохинолин-8-илокси)пиримидин-4-ил)-5-трифторметилфенил} карбаминовой кислоты;
8-[6-(2-амино-4-трифторметилфенил)пиримидин-4-илокси]хинолин-2-иламин;
трет-бутиловый эфир {2-[6-(2-ацетиламинобензотиазол-4-илокси)пиримидин-4-ил]-5-трифторметилфенил}карбаминовой кислоты;
N-{4-[6-(2-амино-4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-ил}ацетамид;
N-{2-[6-(2-ацетиламиноминобензотиазол-4-илокси)пиримидин-4-ил]-5-трифторметилфенил}ацетамид;
N-{2-[6-(2-ацетиламиноминобензотиазол-4-илокси)пиримидин-4-ил]-5-трифторметилфенил}-2-циклогексилацетамид;
N-(4-{6-[2-(циклогексилметиламино)-4-трифторметилфенил]пиримидин-4-илокси}бензотиазол-2-ил)ацетамид;
трет-бутиловый эфир 4-{2-[6-(2-ацетиламинобензотиазол-4-илокси)пиримидин-4-ил]-5-трифторметилфениламино}метилпиперидин-1-карбоновой кислоты;
N-(4-{6-[2-(пиперидин-4-илметил)амино]-4-трифторметилфенил}пиримидин-4-илокси)бензотиазол-2-ил-ацетамид;
трет-бутиловый эфир {2-[(6-хинолин-7-илокси)пиримидин-4-ил]-5-трифторметилфенил}карбаминовой кислоты;
[2-(6-хинолин-7-илокси)пиримидин-4-ил]-5-трифторметилфениламин;
циклогексилметил-{2-[(6-хинолин-7-илокси)пиримидин-4-ил]-5-трифторметилфенил}амин;
6-[6-(4-трифторметилфенил)пиримидин-4-илокси]изохинолин;
4-[6-(4-трифторметилфенил)пиримидин-4-илокси]изохинолин;
N-{2-[(6-хинолин-7-илокси)пиримидин-4-ил]-5-трифторметилфенил}ацетамид;
N-{2-[(6-хинолин-7-илокси)пиримидин-4-ил]-5-трифторметилфенил}метансульфонамид;
N-{2-[(6-хинолин-7-илокси)пиримидин-4-ил]-5-трифторметилфенил}бензолсульфонамид;
7-{6-[2-бром-4-трифторметилфенил]пиримидин-4-илокси}хинолин;
N-{4-[6-(2-бром-4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-ил}ацетамид;
N-{4-[6-(2-хлор-4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-ил}ацетамид;
N-{4-[6-(2-йод-4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-ил}ацетамид;
4-(3-бромфенокси)-6-(4-трифторметилфенил)пиримидин;
4-(бензо)[b]тиофен-4-илокси-6-(4-трифторметилфенил)пиримидин;
амид 4-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-карбоновой кислоты;
диметиламид 4-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-карбоновой кислоты;
8-[6-(4-трифторметилфенил)пиримидин-4-илокси]имидазо[1,2-a]пиридина трифторацетат;
4-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2,6-диамина трифторацетат;
N-{6-диметиламино-4-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-ил}ацетамида трифторацетат;
метиловый эфир {4-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-ил}карбаминовой кислоты;
7-пиридин-4-ил-4-[6-(4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-иламин;
7-[6-(2-хлор-6-трифторметилпиридин-3-ил)пиримидин-4-илокси]хинолин;
3'-[6-(хинолин-7-илокси)пиримидин-4-ил]-6'-трифторметил-3,4,5,6-тетрагидро-2H-[1,2']бипиридинила трифторацетат;
циклогексилметил-{3-[6-(хинолин-7-илокси)пиримидин-4-ил]-6-трифторметилпиридин-2-ил}амин;
7-[6-(2-метоксиметокси-4-трифторметилфенил)пиримидин-4-илокси]хинолин;
2-[6-(хинолин-7-илокси)пиримидин-4-ил]-5-трифторметилфенол;
2-[6-(хинолин-7-илокси)пиримидин-4-ил]-5-трифторметилфениловый эфир трифторметансульфоновой кислоты;
7-[6-(5-трифторметилбифенил-2-ил)пиримидин-4-илокси]хинолин;
7-[6-(4'-фтор-5-трифторметилбифенил)пиримидин-4-илокси]хинолин;
7-(6-[2-пиридин-3-ил-4-трифторметилфенил]пиримидин-4-илокси)хинолин;
7-(6-[2-(2-морфолин-4-илэтокси)-4-трифторметилфенил]пиримидин-4-илокси}хинолин;
7-{6-[2-(2,2-диметил-[1,3]диоксолан-4-илэтокси)-4-трифторметилфенил]пиримидин-4-илокси}хинолин;
3-{2-[6-(хинолин-7-илокси)пиримидин-4-ил]-5-трифторметилфенокси}пропан-1,2-диол;
7-[6-(2-циклогексилметокси-4-трифторметилфенил)пиримидин-4-илокси]хинолин;
7-[6-(2-бензилокси-4-трифторметилфенил)пиримидин-4-илокси]хинолин;
7-[6-(4-трифторметил-2-винилфенил)пиримидин-4-илокси]хинолин;
трет-бутиловый эфир 4-[6-(2-аминобензотиазол-4-илокси)пиримидин-4-ил]-3,6-дигидро-2H-пиридин-1-карбоновой кислоты;
трет-бутиловый эфир 4-[6-(2-ацетиламинобензотиазол-4-илокси)пиримидин-4-ил]-3,6-дигидро-2H- пиридин-1-карбоновой кислоты;
N-{4-[6-(2-формил-4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-ил}ацетамид;
N-{4-[6-(2-гидроксиметил-4-трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-ил}ацетамид;
4-[6-(4-трифторметилфенилпиперидин-1-ил)пиримидин-4-илокси]бензотиазол-2-иламин;
4-(2-бромфенокси)-6-(4-трифторметилфенил)пиримидин;
2-(пиридин-3-ил)-4-(6-4-(трифторметилфенил)пиримидин-4-илокси)бензо[d]тиазол;
2-3-(трифторметилфенил)-4-(6-4-(трифторметилфенил)пиримидин-4-илокси)бензо[d]тиазол;
2-(1Н-пиразол-4-ил)-4-(6-4-(трифторметилфенил)пиримидин-4-илокси)бензо[d]тиазол;
2-(пиперазин-1-ил)-4-(6-4-(трифторметилфенил)пиримидин-4-илокси)бензо[d]тиазол;
4-(4-6-(4-(трифторметилфенил)пиримидин-4-илокси)бензо[d]тиазол-2-ил)морфолин;
2-(4-метил-1,4-диазепан-1-ил)-4-({6-[4-(трифторметил)фенил]пиримидин-4-ил}окси)бензо[d]тиазол;
7-{(6-(4-фторфенил)пиримидин-4-ил)окси}хинолин;
7-{(6-(2,4-дихлорфенил)пиримидин-4-ил)окси}хинолин;
7-{[6-(нафтил-2-ил)пиримидин-4-ил]окси}хинолин;
4-[6-(хинолин-7-илокси)пиримидин-4-ил]бензонитрил;
7-({6-[3,4-дихлорфенил]пиримидин-4-ил}окси)хинолин;
7-({6-[3-хлор-4-фторфенил]пиримидин-4-ил}окси)хинолин;
7-({6-[2-метоксифенил]пиримидин-4-ил}окси)хинолин;
7-({6-[3,4-дифторфенил]пиримидин-4-ил}окси)хинолин;
7-({6-[6-метоксипиридин -3-ил}пиримидин-4-ил}окси)хинолин;
7-({6-[2,4-бис(трифторметил)фенил]пиримидин-4-ил}окси)хинолин;
7-({6-[4-(бензилокси)-3-фторфенил]пиримидин-4-ил}окси)хинолин;
6-({6-[3-фтор-4-метилфенил]пиримидин-4-ил}окси)хиноксалин;
7-({6-[2-фторбифенил-4-ил]пиримидин-4-ил}окси)хинолин;
7-{[6-(1-метил-1 Н-индол-5-ил)пиримидин-4-ил}окси)хинолин;
N-[2-(6-{[2-(ацетиламино)бензо[d]тиазол-4-ил]окси}пиримидин-4-ил)-5-(трифторметил)фенил]-4-(трифторметил)бензамид;
N-[2-(6-{[2-(ацетамино)бензо[d]тиазол-4-ил]окси}пиримидин-4-ил)-5-(трифторметил)фенил]циклогексанкарбоксамид;
N-[2-(6-{[2-(ацетамино)бензо[d]тиазол-4-ил]окси}пиримидин-4-ил)-5-(трифторметил)фенил]пиваламид;
N-[2-(6-{[2-(ацетамино)бензо[d]тиазол-4-ил]окси}пиримидин-4-ил)-5-(трифторметил)фенил]изоникотинамид;
N-[2-(6-{[2-(ацетамино)бензо[d]тиазол-4-ил]окси}пиримидин-4-ил)-5-(трифторметил)фенил]никотинамид;
N-пентил-2-[6-(хинолин-7-илокси)пиримидин-4-ил]-5-(трифторметил)анилин;
N-бензил-2-[6-(хинолин-7-илокси)пиримидин-4-ил]-5-(трифторметил)анилин;
N-(4-трет-бутилбензил)-2-[6-(хинолин-7-илокси)пиримидин-4-ил]-5-(трифторметил)анилин;
N-(пиридин-4-илметил)-N-[2-6-(хинолин-7-илокси)пиримидин-4-ил]-5-(трифторметил)анилин;
4-(6-[4,4-дифторпиперидин-1-ил]пиримидин-4-ил)окси-бензо[d]тиазол-2-амин;
4-(6-[4-фенилпиперидин-1-ил]пиримидин-4-ил)окси-бензо[d]тиазол-2-амин;
N-(4-{[6-(4-фенилпиперидин-1-ил)пиримидин-4-ил]окси}бензо[d]тиазол-2-ил)ацетамид;
4-{[6-(3-фенилпиперидин-1-ил)пиримидин-4-ил]окси}бензо[d]тиазол-2-амин;
N-(4-{[6-(3-фенилпирролидин-1-ил)пиримидин-4-ил]окси}бензо[d]тиазол-2-ил)ацетамид;
4-{[6-(4-изопропилпиперазин-1-ил)пиримидин-4-ил]окси}бензо[d]тиазол-2-амин;
N-(4-{[6-(4-изопропилпиперазин-1-ил)пиримидин-4-ил]окси}бензо[d]тиазол-2-ил)ацетамид;
4-(6-{4-[3-(трифторметил)пиридин-2-ил]пиперазин-1-ил}пиримидин-4-ил}окси)бензо[d]тиазол-2-амин;
N-{4-[(6-{4-[3-(трифторметил)пиридин-2-ил]пиперазин-1-ил}пиримидин-4-ил)окси]бензо[d]тиазол-2-ил}ацетамид;
4-{[6-(4-циклопентилпиперазин-1-ил)пиримидин-4-ил]окси}бензо[d]тиазол-2-амин;
4-{[6-(4-циклогептилпиперазин-1-ил)пиримидин-4-ил]окси}бензо[d]тиазол-2-амин;
N-(4-{[6-(4-фенилпиперазин-1-ил)пиримидин-4-ил]окси}бензо[d]тиазол-2-ил)ацетамид;
N-4-[(6-{4-[2-(трифторметилфенил)пиперазин-1-ил]пиримидин-4-ил}окси)бензо[d]тиазол-2-ил]ацетамид;
N-4-[(6-{4-[3-(трифторметилфенил)пиперазин-1-ил]пиримидин-4-ил}окси)бензо[d]тиазол-2-ил]ацета-мид;
N-4-[(6-{4-[2,6-(диметилфенил)пиперазин-1-ил]пиримидин-4-ил}окси)бензо[d]тиазол-2-ил]ацетамид;
трет-бутил-4-(6-{[2-ацетиламидобензо[d]тиазол-4-ил]окси}пиримидин-4-ил)пиперазин-1-карбоксилат;
4-{[6-(4-фенилпиперазин-1-ил)пиримидин-4-ил]окси}бензо[d]тиазол-2-амин;
N-(4-{[6-(4-бензилпиперазин-1-ил)пиримидин-4-ил]окси}бензо[d]тиазол-2-ил)ацетамид;
N-(4-{[6-(4-(1-фенилэтил)пиперазин-1-ил)пиримидин-4-ил]окси}бензо[d]тиазол-2-ил)ацетамид;
3-({6-[4-(трифторметил)фенил]пиримидин-4-ил}окси)изохинолин;
7-({6-[4-(трифторметил)фенил]пиримидин-4-ил}окси)изохинолин;
2-({6-[4-(трифторметил)фенил]пиримидин-4-ил}окси)хинолин;
4-(нафталин-1-илокси)-6-[4-(трифторметил)фенил]пиримидин;
4-(нафталин-2-илокси)-6-[4-(трифторметил)фенил]пиримидин;
4-({6-[4-(трифторметил)фенил]пиримидин-4-ил}окси)хинолин;
5-фтор-2-метил-4-({6-[4-(трифторметил)фенил]пиримидин-4-ил}окси)хинолин;
5-({6-[4-(трифторметил)фенил]пиримидин-4-ил}окси)изохинолин;
2-метил-5-({6-[4-(трифторметил)фенил]пиримидин-4-ил}окси)бензо[d]тиазол;
5-({6-[4-(трифторметил)фенил]пиримидин-4-ил}окси)хинолин;
7-({6-[4-(трифторметил)фенил]пиримидин-4-ил}окси)-3,4-дигидронафталин-1(2Н)-он;
6-({6-[4-(трифторметил)фенил]пиримидин-4-ил}окси)хинолин;
N-[2-({6-[4-(трифторметил)фенил]пиримидин-4-ил}окси)фенил]ацетамид;
2-оксо-(2-(2-(6-(4-(трифторметил)фенил)пиримидин-4-ил)окси)фениламино)этилацетат;
2-диметиламино-N-[2-({6-[4-(трифторметил)фенил]пиримидин-4-ил}окси)фенил]ацетамид;
N-[2-({6-[4-(трифторметил)фенил]пиримидин-4-ил}окси)фенил]фуран 2-карбоксамид;
N-[2-({6-[4-(трифторметил)фенил]пиримидин-4-ил}окси)фенил]пиколинамид;
4-(2-хлорпиридин-3-илокси)-6-[4-(трифторметил)фенил]пиримидин;
4-({6-[4-(трифторметил)фенил]пиримидин-4-ил}окси)хинолин-2-амин и
3-({6-[4-(трифторметил)фенил]пиримидин-4-ил}окси)пиридин-2-амин
или их фармацевтически приемлемые соли.
3. Соединение по п.1, где R1 обозначает пиперазинил, замещенный iPr, циклопентил, циклогептил, Ph, -С(О)О(СН3)3, Bz, -CH(CH3)Ph, -CH(CH3)PhF, -C6H4CF3 или диметилС6Н4-.
4. Соединение по п.1, где R1 обозначает -СН(СН3)PhF.
5. Фармацевтическая композиция, содержащая соединение по любому из пп.1-4 и фармацевтически приемлемый разбавитель или носитель.
Текст
010380 Предпосылки создания изобретения Ванилоидный рецептор 1 (VR1) является молекулярной мишенью капсаицина, активного ингредиента стручкового перца. Julius и др. описали молекулярное клонирование VR1 (Caterina et al., 1997). VR1 является неселективным катионным каналом, который активируется или сенсибилизируется рядом различных раздражителей, включая капсаицин и резинфератоксин (экзогенные активаторы), тепловое и кислотное стимулирование и продукты липидного двухслойного метаболизма, анандамид (Premkumar et al.,2000, Szabo et al., 2000, Gauldie et al., 2001, Olah et al., 2001) и метаболиты липоксигеназы (Hwang et al.,2000). VR1 экспрессируется в первичных сенсорных нейронах (Caterina et al., 1997) у крыс, мышей и людей (Onozawa et al., 2000; Mezey et al., 2000; Helliwell et al., 1998; Cortright et al., 2001). Эти сенсорные нейроны иннервируют многие внутренностные органы, включая дермис, кости, мочевой пузырь, желудочно-кишечный тракт и лгкие; VR1 экспрессируется также в других нейронных и ненейронных тканях,включая, но не ограничиваясь этим, ядра ЦНС, почки, желудок и Т-клетки (Nozawa et al., 2001; Yiangouet al., 2001; Birder et al., 2001). Предпочтительно, экспрессия в этих различных клетках и органах может влиять на их основные свойства, такие как передача сигнала и деление клеток. До молекулярного клонирования VR1 опыты с капсаицином показали наличие чувствительного рецептора капсаицина, который может увеличивать активность сенсорных нейронов у людей, крыс и мышей (Holzer, 1991; Dray, 1992; Szallasi and Blumberg 1996, 1999). Результатом острой активации капсаицина у людей была боль в точке инъекции, а у других субъектов - увеличенная поведенческая чувствительность к сенсорным раздражителям (Szallasi and Blumberg, 1999). Нанесение капсаицина на кожу у людей вызывает болезненную реакцию, характеризующуюся не только восприятием тепла и боли в месте применения, но также более широкой областью гипералгезии и аллодинии, двух характерных симптомов невропатической боли у людей (Holzer, 1991). С учтом всего этого кажется вероятным, что повышенная активность VR1 играет значительную роль в возникновении и сохранении боли. Топическая или интрадермальная инъекция капсаицина, как это было также показано, вызывает локализованное расширение сосудов и появление отка (Szallasi and Blumberg, 1999; Singh et al., 2001). Это показывает, что капсаицин вследствие его активации VR1 может регулировать афферентную и эфферентную функцию сенсорных нервов. Участие сенсорных нервов в развитии болезней может быть, следовательно, модифицировано молекулами, которые влияют на функцию ванилоидного рецептора повышать или понижать активность сенсорных нервов. Мыши с нокаутированным геном VR1 имеют сниженную сенсорную чувствительность к термическим и кислотным раздражителям (Caterina et al., 2000). Это подтверждает концепцию того, что VR1 вносит свой вклад не только в генерирование болевых реакций (а именно, благодаря термическим и кислотным раздражителям или капсаицину), но также в сохранение базальной активности сенсорных нервов. Это согласуется с исследованиями, демонстрирующими участие нервов, чувствительных к капсаицину, в развитии болезни. Первичные сенсорные нервы у людей и других субъектов могут быть превращены в неактивные путм непрерывной стимуляции капсаицина. Эта парадигма вызывает вызванную активацией рецептора десенсибилизацию первичного сенсорного нерва - такое снижение активности сенсорного нерва in vivo делает субъектов менее чувствительными к последующим болезненным раздражителям. В этом отношении как капсаицин, так и резинфератоксин (экзогенные активаторы VR1) вызывают десенсибилизацию и их использовали для многих исследований на in vivo моделях болезниWang-H. Bian-D. Zhu-D. Zajic-G. Loeloff-R. Lile-J. Wild-K. Treanor-J. Curran-E. (2000) Inflammationinduced upregulation of VR1 in rat spinal cord and DRG correlates with enhanced nociceptive processing. Society for Neuroscience Abstracts 26:1-2: 632.15. Сущность изобретения Данное изобретение охватывает новый класс соединений, пригодных для лечения болезней, опосредованных ванилоидными рецепторами, и других болезней, таких как воспалительная или невропатическая боль, и болезней с участием функции сенсорных нервов, таких как астма, ревматоидный артрит,остеоартрит, воспаление кишечника, недержание мочи, мигрень и псориаз. В частности, соединения по изобретению пригодны для лечения острой, воспалительной и невропатической боли, зубной боли, генеральной боли, мигрени, гистаминовой боли, смешанных сосудистых и несосудистых синдромов, головной боли от переутомления, общего воспаления, артрита, ревматических, болезней, остеоартрита, воспаления кишечника, воспаления глаз, воспаления или нестабильности мочевого пузыря, псориаза, кожных заболеваний с воспалительными компонентами, хронического воспаления, воспалительной боли и ассоциированной гипералгезии и аллодинии, невропатической боли и ассоциированной гипералгезии и аллодинии, диабетической невропатии, каузалгии, симпатетически сохраняющейся боли, синдрома деафферентации, астмы, повреждения эпителиальной ткани или дисфункции, герпеса simplex, нарушений висцеральной подвижности в респираторной, мочеполовой, желудочно-кишечной или сосудистой областях,ран, ожогов, аллергических кожных реакций, зуда, витилиго, нарушений работы желудочно-кишечного тракта, язвы желудка, язвы двенадцатиперстной кишки, диареи, повреждений желудка, вызванных вызывающими некроз агентами, роста волос, вазомоторного или аллергического ринита, бронхиальных болезней или нарушений работы мочевого пузыря. Изобретение также охватывает фармацевтические композиции, включающие заявленные соединения, способы лечения болезней, опосредованных ванилоидными рецепторами, таких как воспалительная или невропатическая боль, астма, ревматоидный артрит, остеоартрит, воспаление кишечника, недержание мочи, мигрень и псориаз, с применением соединений и композиций по изобретению, промежуточных продуктов и способы получения соединений по изобретению. Ниже описаны некоторые аспекты изобретения, которые никоим образом не ограничивают его объм. Подробное описание изобретения. Один аспект данного изобретения относится к соединениям общей формулы(i) фенил, необязательно замещенный одним или более заместителей, выбранными из группы, включающей -С(СН 3)3, СН 3, CF3, F, Cl, Br, CN, ОН, -OCH3,-C(O)H,-CH2OH,-OCF3,NO2,NH2, -О(СН 2)2 морфолин,-ОСН 2 ОСН 3, пиперидинил, -OBz, -SMe, пирролидинил, пиридинил, -OSO2CF3, -NHC(O)CH3, фенил, фторфенил, -СН=СН 2, -NHC(O)OC(CH3)3, -C(O)OMe, -NHSO2Me, -NHSO2Ph, -NHC(O)C6H4CF3, -NHC(О)циклогексан, -NHC(O)CH2 циклогексан, -NHC(O)C(CH3)3, -NHC(О)пиридин, -NHCH2 пиридин, -NHCH2 пиперидинилC(О)ОС(СН 3)3, -NHCH2 пиперидинил, -NH(CH2)4CH3, -NHBz, -NHCH2C6H4C(CH3)3, -NHCH2 пиридинил, 2,2-диметил[1,3]диоксолан-4-илметокси, -ОСН 2 СН(ОН)СН 2 ОН и -ОСН 2 циклогексан;(viii) пиперидинил, замещенный одним или более заместителем, выбранным из группы, включающей CF3, F и Ph.(ii) хинолил, необязательно замещенный одним или более заместителей, выбранными из группы,включающей метокси, NH2, N3, F, Cl, СН 3, CF3, -NHC(O)CH3, -NHSO2CH3, -NHCH3, -NH(CH2)2OH,-NH(CH2)2NHC(O)OC(CH3)3, -NH(CH2)2NH2, -C(O)H, -CH2OH, -CH(CH3)OH, морфолинил, -С(О)ОСН 3,-CH(CH3)2OH, пропанол, пиперазинил и трет, бутилоксикарбонилпиперазинил;(v) бензотиазолил, необязательно замещенный одним или более заместителей, выбранными из группы, включающей СН 3, Cl, Br, I, NH2, пиридинил, -C6H4-CF3, имидазолил, -NHCH3, -N(CH3)2,-NH(CH2)2OH, -NHSO2CH3, -NHC(O)CH3, -NHC(O)CH(OH)CH3, -NHC(O)CH(OAc)CH3, -NHC(O)CH(OH)CH3,-NH(CH3)2, -NHC(O)C(OAc)(CH3)2, -NHC(O)OH(CH3)2, -NHC(O)CH(OAc)Ph, -NHC(O)CH(OAc)Ph,-NHC(O)CH2OAc, -NHC(O)CH2OH, -NHC(O)CH(OH)Ph, -NHC(O)CH2Ph, -NHC(O)Et, -NHC(O)CH2Cl,-NHC(O)CH2N(CH3)2, -NHC(О)СН 2 морфолин, -NHпиридин, -NHC(O)CF3, пиперазинил, морфолинил, гомопиперазинил, -C(O)NH2, -C(O)N(CH3)2 и -NHC(O)OCH3;(vi) хиноксалинил, необязательно замещенный СН 3, Br, OCH3, NH2 или NHC(O)CH3;(xviii) имидазо[1,2-1 а]пиридил; или их фармацевтически приемлемым солям. Предпочтительными являются соединения, выбранные из группы 4-(4-трет-бутилфенил)-6-(3-метоксифенокси)пиримидин; 8-[6-(4-трифторметилфенил)пиримидин-4-илокси]хинолин-2-иламин; 2-азидо-8-[6-(4-трифторметилфенил)пиримидин-4-илокси]хинолин;N-[2-(6-[4-(трифторметил)фенил]пиримидин-4-илокси)фенил]пиколинамид; 4-(2-хлорпиридин-3-илокси)-6-[4-(трифторметил)фенил]пиримидин; 4-(6-[4-(трифторметил)фенил]пиримидин-4-илокси)хинолин-2-амин и 3-(6-[4-(трифторметил)фенил]пиримидин-4-илокси)пиридин-2-амин,или их фармацевтически приемлемые соли. Другой аспект данного изобретения относится к фармацевтической композиции, содержащей соединение согласно изобретению и фармацевтически приемлемый разбавитель или носитель, которая может быть использована для лечения острой, воспалительной и невропатической боли, зубной боли, генеральной боли, мигрени, гистаминовой боли, смешанных сосудистых и не сосудистых синдромов, головной боли от переутомления, общего воспаления, артрита, ревматических болезней, остеоартрита, воспаления кишечника, воспаления глаз, воспаления или нестабильности мочевого пузыря, псориаза, кожных заболеваний с воспалительными компонентами, хронического воспаления, воспалительной боли и ассоциированной гипералгезии и аллодинии, невропатической боли и ассоциированной гипералгезии и аллодинии, диабетической невропатии, каузалгии, симпатетически сохраняющейся боли, синдрома деафферентации, астмы, повреждения эпителиальной ткани или дисфункции, герпеса simplex, нарушений висцеральной подвижности в респираторной, мочеполовой, желудочно-кишечной или сосудистой областях,ран, ожогов, аллергических кожных реакций, зуда, витилиго, нарушений работы желудочно-кишечного тракта, язвы желудка, язвы двенадцатиперстной кишки, диареи, повреждений желудка, вызванных вызывающими некроз агентами, роста волос, вазомоторного или аллергического ринита, бронхиальных болезней или нарушений работы мочевого пузыря. Соединения по данному изобретению в целом могут иметь несколько асимметрических центров и обычно изображаются в виде смеси рацемических смесей. Предполагается, что настоящее изобретение охватывает рацемические смеси, частично рацемические смеси и отдельные энантиомеры и диастереомеры. Если не указано иначе, следующие определения применяются к терминам, встречающимся в описании и в формуле изобретения:"С-алкил" означает алкильную группу, содержащую минимальное числои максимальное числоуглеродных атомов, связанных в разветвлнную или линейную цепь, или в цикл, или в любую комбинацию из этих трх, причмипредставляют собой целые числа. Алкильные группы, описанные в данном разделе, также содержат одну или две двойных или тройных связи. Примеры C1-6 алкилов включают, но без ограничения, следующие:"Бензогруппа", одна или в комбинации, означает двухвалентный радикал С 4 Н 4=, одним из изображений которого является -CH=CH-CH=CH-, который, будучи вицинально присоединн к другому циклу,образует подобный бензолу цикл, например тетрагидронафталин, индол и т.п. Термины "оксо" и "тиоксо" представляют собой группы =О (как в карбониле) и =S (как в тиокарбониле), соответственно."Cv-wгалогеналкил" ("Cv-wгалоалкил") означает алкильную группу по описанию выше, в которой любое число, по меньшей мере один, из атомов углерода, присоединнных к алкильной цепи, замещн на"Гетероцикл" означает цикл, содержащий по меньшей мере один углеродный атом и по меньшей мере один другой атом, выбранный из N, О и S. Примеры гетероциклов, которые можно найти в формуле изобретения, но без ограничения, следующие:"Подходящие (соответствующие) атомы азота" означают такие атомы азота, которые являются частью гетероцикла и связаны (в цикле) двумя ординарными (простыми) связями (например, пиперидин),при этом остатся внешняя связь, пригодная для замены, например, на Н или СН 3."Фармацевтически приемлемая соль" означает соль, полученную обычным методом и они (эти соли) хорошо известны специалистам в данной области техники. "Фармакологически приемлемые соли" включают основные соли неорганических и органических кислот, включая, но без ограничения, хлористо-водородную кислоту, бромисто-водородную кислоту, серную кислоту, фосфорную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, яблочную кислоту, уксусную кислоту, щавелевую кислоту, винную кислоту, лимонную кислоту, молочную кислоту, фумаровую кислоту, янтарную кислоту,малеиновую кислоту, салициловую кислоту, бензойную кислоту, фенилуксусную кислоту, миндальную кислоту и т.п. Если соединения по изобретению включают кислотную функциональную группу, такую как карбоксигруппа (карбоксильная группа), то подходящие фармацевтически приемлемые катионные лары для карбоксигруппы хорошо известны специалистам в данной области техники и включают катионы щелочных, щелочно-земельных металлов, алюминия, четвертичные аммониевые катионы и т.п. Дополнительные примеры "фармакологически приемлемых солей" см. ниже и Berge et al., J. Pharm. Sci. 66:1(1977). Термин "насыщенный или ненасыщенный" включает заместители, насыщенные относительно атомов водорода, заместители, полностью ненасыщенные относительно атомов водорода, и заместители,-9 010380 частично насыщенные относительно атомов водорода. Термин "уходящая группа", как правило, относится к группам, легко замещаемым нуклеофилом,таким как амино, тиольная или спиртовая нуклеофильные группы. Такие уходящие группы хорошо известны в уровне техники. Примеры таких групп включают, но без ограничения, N-гидроксисукцинимид,N-гидроксибензотриазол, галоидные группы, трифлаты, тозилаты и т.п. Предпочтительные уходящие группы указываются в данном описании в соответствующих местах. Термин "защитная группа", как правило, относится к хорошо известным в уровне техники группам,которые используются для предотвращения участия выбранных реакционноспособных групп, таких как карбокси, амино, гидрокси, меркапто и тому подобных групп, в нежелательных реакциях, таких как нуклеофильные реакции, электрофильные реакции, реакции окисления, восстановления и т.п. Предпочтительные защитные группы указываются в данном описании в соответствующих местах. Примеры защитных групп для аминогрупп включают, но без ограничения, аралкил, замещнный аралкил, циклоалкенилалкил и замещнный циклоалкенилалкил, аллил, замещнный аллил, ацил, алкоксикарбонил, аралкоксикарбонил, силил и т.п. Примеры аралкилов включают, но без ограничения, бензил, ортометилбензил,тритил и бензгидрил, которые могут, необязательно, иметь в качестве заместителя галоген, алкил, алкокси, гидрокси, нитро, ациламино, ацил и т.п., и соли, такие как фосфониевые и аммониевые соли. Примеры арильных групп включают фенил, нафтил, инданил, антраценил, 9-(9-фенилфлуоренил), фенантренил,дюренил и т.п. Примеры циклоалкенилалкильных или замещнных циклоалкенилалкильных радикалов,предпочтительно содержащих 6-10 углеродных атомов, включают, но без ограничения, циклогексенилметил и т.п. Подходящие ацильная, алкоксикарбонильная и аралкоксикарбонильная группы включают бензилоксикарбонил, трет-бутоксикарбонил, изобутоксикарбонил, бензоил, замещнный бензоил, бутирил, ацетил, трифторацетил, трихлорацетил, фталоил и т.п. Для защиты одной и той же аминогруппы можно использовать смесь защитных групп, так первичную аминогруппу можно защищать как аралкильной группой, так и аралкоксикарбонильной группой. Защитный группы для аминогруппы могут также образовывать гетероциклическое кольцо вместе с атомом азота, к которому они присоединены,например, 1,2-бис(метилен)бензол, фталимидил, сукцинимидил, малеинимидил и т.п., и там, где эти гетероциклические группы могут дополнительно включать присоединнный арильный или циклоалкильный циклы. Кроме того, гетероциклические группы могут быть моно, ди или тризамещнными, такими как нитрофталимидил. Аминогруппы также можно защитить от участия в нежелательных реакциях, таких как окисление, с помощью образования соли присоединения, такой как гидрохлорид, соль толуолсульфокислоты, соль трифторуксусной кислоты и т.п. Многие группы для защиты аминогрупп также пригодны для защиты карбокси, гидрокси и меркаптогрупп. Например, аралкильные группы. Алкильные группы также пригодны для защиты гидрокси и меркаптогрупп, такие как трет-бутильная. Силильные защитные группы представляют собой атомы кремния, необязательно замещнные одной или более алкильной, арильной и аралкильной группами. Подходящие силильные защитные группы включают, но без ограничения, триметилсилил, триэтилсилил, триизопропилсилил, трет-бутилметилсилил, диметилфенилсилил, 1,2-бис(диметилсилил)бензол, 1,2-бис(диметилсилил)этан и дифенилметилсилил. При силилировании аминогрупп получают моно- или дисилиламиногруппы. В результате силилирования аминоспиртов можно получать N,N,О-трисилильные производные. Снятие силильной функциональной группы с силилового эфира легко осуществить, например, при действии гидроксида металла или фторида аммония, или как отдельную стадию реакции или in situ во время реакции со спиртовой группой. Подходящими силилирующими агентами являются, например, триметилсилилхлорид, третбутилдиметилсилилхлорид, фенилдиметилсилилхлорид, дифенилметилсилилхлорид или продукты их комбинации с имидазолом или ДМФА. Методы силилирования аминов и снятия силильных защитных групп хорошо известны специалистам в данной области техники. Методы получения этих аминопроизводных из соответствующих аминокислот, амидов аминокислот или эфиров аминокислот также хорошо известны специалистам вобласти органической химии, включая химию аминокислот/эфиров аминокислот или аминоспиртов. Защитные группы снимают (удаляют) в условиях, которые не влияют на остальную часть молекулы. Эти методы хорошо известны из уровня техники и включают кислый гидролиз, гидрогенолиз и т.п. Предпочтительный метод включает снятие защитной группы, например снятие бензилоксикарбонильной группы, гидрогенолизом с катализатором палладием на угле в соответствующей системе растворителей,такой как спирт, уксусная кислота и т.п. или их смесь. Трет-бутоксикарбонильную защитную группу можно удалить, используя неорганическую или органическую кислоту, такую как HCl или трифторуксусную кислоту, в подходящей системе растворителей, такой как диоксан или хлористый метилен. Проученную соль амина можно легко нейтрализовать и получить свободный амин. Защитную группу для карбоксигруппы, такую как метильная, этильная, бензильная, трет-бутильная, 4-метоксифенилметильная и т.п., можно снять в условиях гидролиза и гидрогенолиза, общеизвестных специалистам в данной области техники. Следует заметить, что соединения по изобретению могут содержать группы, которые могут существовать в таутомерных формах, например циклические и ациклические амидины и гуанидины, гетероарильные группы с заместителем при гетероатоме (гетероатом- замещнные гетероарильные группы)(Y'=О, S, NR) и т.п., которые иллюстрируются нижеприведнными примерами: и хотя в данном описании называется, описывается и/или заявляется одна форма, предполагается, что это название, описание, изображение, пункт формулы изобретения, естественно, включают все таутомерные формы. Соединения по данному изобретению могут быть использованы в виде пролекарств. Пролекарство представляет собой активное или неактивное соединение, которое в результате in vivo физиологического воздействия, такого как гидролиз, метаболизм и т.п., химически модифицируется в соединение по данному изобретению после введения пролекарства больному. Пригодность и методики получения и применения пролекарств хорошо известны специалистам в данной области техники. Общее обсуждение пролекарств, включая сложные эфиры, см. Svensson and Tunek Drag Metabolism Reviews 165 (1988) и Bundgaard Design of Prodrugs, Elsevier (1985). Примеры скрытого карбоксилатаниона включают различные сложные эфиры, такие как алкиловый (например, метиловый, этиловый), циклоалкиловый (например,циклогексиловый), аралкиловый (например, бензиловый, п-метоксибензиловый) и алкилкарбонилоксиалкиловый (например, пивалоилоксиметиловый). Амины маскируют в виде арилкарбонилоксиметилзамещнных производных, которые in vivo расщепляются эстеразами, высвобождая свободное лекарственное вещество и формальдегид (Bungaard J. Med. Chem. 2503 (1989. Также лекарственные вещества, содержащие кислую NH группу, такие как имидазол, имид, индол и т.п. маскируют с помощью N-ацилоксиметильных групп (Bundgaard Design of Prodrugs, Elsevier (1985. Гидроксигруппы маскируют в виде сложных и простых эфиров. Европейский патент ЕР 039051(выдан Sloan and Little, 4/11/81 года) охватывает пролекарства основание Манниха гидроксамовая кислота, их получение и применение. Описание и формула изобретения также содержат перечень видов, при этом используются выражения "выбранный изи " и "представляет собой или " (иногда называемые "группы Маркуша"). Если не указано иначе, когда это выражение применяется в данном описании, предполагается, что оно включает группу в целом или любые единичные члены е, или любую е подгруппу. Это выражение применяется только в целях краткости и ни в коей мере не предполагает ограничить при необходимости удаление отдельных элементов или подгрупп. Экспериментальная часть Общие замечания Если не указано иначе, все материалы получают из промышленных источников и используют без дополнительной очистки. Если не указано иначе, все части представляют собой весовые части, а температуры выражены в градусах Цельсия. ЯМР спектры всех соединений соответствуют приписанным им структурам. Температуры плавления определяют на приборе Buchi и не корректируются. Данные массспектрометрических исследований получают методом ионизации электрораспылением. Соединения во всех примерах очищают до степени чистоты 95% по определению методом ВЭЖХ. Если не указано иначе, реакции проводят при комнатной температуре в атмосфере азота. Реакции в микроволновой печи проводят в аппарате Smith Synthesizer (Personal Chemistry, Inc., Uppsala, Sweden). В тексте применяются следующие сокращения:satd, нас. - насыщенный ТГФ - тетрагидрофуран Общие схемы получения пиримидинового цикла (II) Схема 2.а Подписи: основание нагревание сочетание в присутствии ионов переходного металла (или переходный металл сочетание). Схема 2.b(а) 4-(4-трет-Бутилфенил)-6-хлорпиримидин. В круглодонную колбу на 250 мл, содержащую 4,6 дихлорпиримидин (4.0 г, 27 ммоля, Aldrich) в CH3CN (80 мл), прибавляют 4-трет-бутилфенилбороновую кислоту (1,9 г, 11 ммолей, Aldrich) и Pd(PPh3)4 (0,62 г, 0,54 ммоля, Aldrich). Прибавляют 10% растворNa2CO3 (50 мл) и смесь перемешивают под N2 при 90 С в течение 8 ч. Реакционную смесь оставляют охлаждаться до комнатной температуры, а затем прибавляют EtOAc (200 мл) и 5% рассол (80 мл). Выпадает осадок, его отфильтровывают. Фильтрат выливают в делительную воронку и собирают органические вытяжки. Отфильтрованный ранее осадок и органические вытяжки объединяют и полученный раствор упаривают в вакууме. Остаток растворяют в CH2Cl2, сушат Na2SO4, фильтруют и упаривают в вакууме. Хроматографией на силикагеле, элюент смесь гексанов/EtOAc (5:1), получают титульное соединение в виде тврдого вещества белого цвета. MS (ESI, положит. ион) m/z: 247(М+1).(b) 4-(4-трет-Бутилфенил)-6-(3-метоксифенокси)пиримидин. В круглодовную колбу на 25 мл, содержащую 4-(4-трет-бутилфенил)-6-хлорпиримидин (пример 1 а) (0.10 г, 0.41 ммоля), 3-метоксифенол(0,10 г, 0,81 ммоля, Aldrich) и ДМФА (4 мл), при комнатной температуре прибавляют NaH (0.032 г, 0.81 ммоля, 60% дисперсия в масле). Реакционная смесь становится зелной и наблюдается выделение газа. Раствор перемешивают в течение 20 ч в атмосфере N2. К реакционной смеси прибавляют Н 2 О (50 мл) и раствор экстрагируют EtOAc (325 мл). Объединнные органические вытяжки промывают Н 2 О (325 мл) и рассолом, сушат Na2SO4 и наносят на силикагель. Сырой продукт очищают хроматографией (0-20% этилацетат/смесь гексанов) на силикагеле, получают титульное соединение в виде тврдого вещества белого цвета. Т.пл. 73-76 С. MS (ES. положит. ион) m/z: 335.1 (М+1). Пример 2.(а) 4-Хлор-6-[4-(трифторметил)фенил]пиримидин. В круглодонную колбу на 500 мл помещают 4,6 дихлорпиримидин (14 г, 95 ммолей, Aldrich), 4-(трифторметил)фенилбороновую кислоту (6,0 г, 32 ммоля, Aldrich), ацетонитрил (95 мол) и 1 М раствор карбоната натрия (95 мл). Продувают N2 в течение 15 мин, затем добавляют Pd(PPh2)2 (1-9 г, 1,6 ммоля, Strem) и полученную смесь жлтого цвета нагревают в атмосфере N2 при 80 С в течение 15 ч. По охлаждении до 25 С раствор упаривают в вакууме и к раствору прибавляют aq. NaHCO3 и экстрагируют СН 2 С 2. Объединнные органические вытяжки сушат Na2SO4,фильтруют и упаривают в вакууме. Очисткой хроматографией на силикагеле (градиент, 1,5-10% этилацетат/гексаны) получают титульное соединение в виде тврдого вещества белого цвета. MS (ESI, положит. ион) m/z: 259 (М+1).(b) 8-[6-(4-Трифторметилфенил)пиримидин-4-илокси]хинолин-2-иламин. В круглодонную колбу на 50 мл помещают NaH (175 мг, 4,37 ммоля, 60% дисперсия в минеральном масле, Aldrich) и сухой ДМФА(10 мл). Полученную суспензию перемешивают под N2 при 25 С и прибавляют 2-амино-8-хинолинол(700 мг, 4.37 ммоля, Sigma). Перемешивают в течение 10 мин при 25 С, к светло-жлтому раствору прибавляют 4-хлор-6-[4-(трифторметил)фенил]пиримидин (1,24 г, 4,79 ммоля) и перемешивают при температуре масляной бани 50 С в течение 3 ч. Реакционную смесь оставляют охлаждаться до 25 С, прибавляют 1 N раствор NaOH (100 мл) и экстрагируют EtOAc (200 мл). Органические вытяжки промывают 1NNaOH (100 мл), водой (50 мл), насыщ. NaCl (50 мл), сушат Na2SO4, фильтруют и упаривают в вакууме. Очистка хроматографией на силикагеле (98:2 хлористый метилен: 2 М NH3 в МеОН) дат титульное соединение в виде тврдого вещества белого цвета. Т.пл. 203 С. MS (ESI, положит. ион) m/z: 259 (М+1). Пример 2.(а) 2-Хлорхинолин-8-ол. Смесь 2,8-дигидрохинолина (4,0 г, 25 ммолей, Fluka) в POCl3 (20 мл, Aldrich) перемешивают при 100 С в течение 1 ч. Смесь охлаждают до комнатной температуры и выливают в смесь льда (200 г) и 30% водн. NH3 (100 мл). Белый осадок отфильтровывают и промывают водой. Осадок на фильтре растворяют в 12 N HCl (200 мл) и полученную смесь перемешивают при 100 С в течение 1 ч. Смесь охлаждают до комнатной температуры и прибавляют 30% водн. NH3 до прекращения выпадения осадка. Полученный белый осадок отфильтровывают и сушат в вакууме (25 С, 18 ч), получают титульное соединение. MS (ESI, положит. ион) m/z: 179.9 (М+1).(b) 2-Азидохинолин-8-ол. Смесь 2-хлорхинолин-8-ола (2.5 г, 14 ммоля) и азида натрия (4.6 г, 70 ммолей, Aldrich) в ДМФА (20 мл) перемешивают при 110 С в течение 16 ч. По охлаждении до комнатной температуры прибавляют воду (50 мл) и смесь экстрагируют EtOAc (250 мл). Объединнные органические вытяжки промывают водой (220 мл), рассолом (20 мл), сушат (Na2SO4) и фильтруют. После удаления части растворителя в вакууме выпадает осадок. Осадок отфильтровывают, промывают 20%(с) 2-Азидо-8-[6-(4-трифторметилфенил)пиримидин-4-илокси]хинолин. Смесь 4-хлор-6-(4-трифторметилфенил)пиримидина (пример 2(а), метод А), (2,0 г, 7,7 ммоля), 2-хлорхинолина-8-ола (3,0 г, 7,0 ммолей) и K2CO3 (1,9 г, 14 ммолей) в ДМФА (15 мл) перемешивают при 80 С в течение 6 ч. По охлаждении до комнатной температуры прибавляют воду (50 мл) и экстрагируют EtOAc (2100 мл). Объединнные органические вытяжки промывают водой (230 мл), рассолом (30 мл), сушат (Na2SO4) и фильтруют. После удаления части растворителя в вакууме выпадает осадок, который отфильтровывают, промывают 20% EtOAc/смесь гексанов и сушат, подсоединив к вакуумной линии (25 С, 16 ч), получают титульное соединение. MS (ESI, положит. ион) m/z: 409.0 (М+1).(d) 8-[6-(4-Трифторметилфенил)пиримидин-4-илокси]хинолин-2-иламин. Смесь 2-азидо-8-[6-(4 трифторметилфенил)пиримидин-4-илокси]хинолина (2,7 г, 6,6 ммоля) и трифенилфосфина (3,5 г, 13 ммолей, Aldrich) в толуоле (50 мл) кипятят в течение 4 ч. Растворитель отгоняют в вакууме и остаток растворяют в АсОН: Н 2 О (2:1, 30 мл) и полученную смесь перемешивают при 50 С в течение 18 ч. После отгонки растворителя в вакууме остаток очищают хроматографией на силикагеле, элюент 60%EtOAc/смесь гексанов. После перекристаллизации из 20% EtOAc/смесь гексанов выделяют титульное соединение. Т.пл. 225,6-227,9 С. MS (ESI, положит. ион) m/z: 382.8 (М+1). Анализ. Вычислено для C20H13F3N4O: С, 62.83; Н, 3.43; N, 14.65. Найдено: С, 62.53; Н, 3.43; N, 14.74. 2-Хлор-8-[6-(4-трифторметилфенил)-пиримидин-4-илокси]-хинолин. К раствору 4-хлор-6-(4 трифторметилфенил)пиримидина (пример 2(а), метод А), (259 мг, 1 ммоль) и 2-хлорхинолин-8-ола (пример 2(а), метод В) (180 мг, 1 ммоль) в 2 мл ДМФА прибавляют карбонат калия (276 мг, 2 ммоля). Реакционную смесь перемешивают на масляной бане с температурой 90 С в течение 2 ч. Прибавляют EtOAc рассол и водный слой экстрагируют EtOAc. Объединнные EtOAc вытяжки промывают рассолом, сушатEtOAc/смесь гексанов, дат титульное соединение в виде тврдого вещества белого цвета. MS (ESI, положит. ион) m/z: 402 (М+1). Т.пл. 171,5-173,0 С. Анализ. Вычислено для C20H11ClF3N3O: С, 59.79; Н, 2.76; N, 10.46. Найдено: С, 60.01; Н, 2.80; N, 10.50. 4-(4-трет-Бутилфенил)-6-(3-метоксифенилсульфанил)пиримидин. В круглодонную колбу на 25 мл,содержащую 4-(4-трет-бутилфенил)-6-хлорпиримидин пример 1(а, (0.20 г, 0.82 ммоля), 3-метоксибензолтиол (0.23 г, 1.6 ммоля, Aldrich) и ДМФА (4 мл), в атмосфере N2 при комнатной температуре прибавляют NaH (0.066 г, 1.6 ммоля, 60% дисперсия в масле, Aldrich). Смесь становится зелной и наблюдается выделение газа. Раствор перемешивают в течение 20 ч при комнатной температуре в атмосфере N2. Прибавляют Н 2 О (50 мл) и полученный раствор экстрагируют EtO Ас (325 мл). Объединнные органические вытяжки промывают Н 2 О (325 мл) и рассолом, сушат Na2SO2 и адсорбируют на силикагеле. Сырой продукт очищают хроматографией (0-15% этилацетат/смесь гексанов) на силикагеле, получают титульное соединение в виде бесцветного масла. MS (ESI, положит. ион) m/z: 351.2 (М+1). Пример 5.(а) 2-Морфолин-4-илхинолин-8-ол. В ампулу (сосуд) на 5 мл помещают 2-хлорхинолин-8-ол (пример 2(а), метод В), (180 мг, 1 ммоль), морфолин (1.75 мл, 20 ммолей) и 3 мл диоксана. Реакционную смесь нагревают в микроволновом синтезаторе при 220 С в течение 12 мин. Смесь распределяют между 1 N NaOH и EtOAc. Водный слой отделяют и экстрагируют EtOAc, объединнные EtOAc вытяжки промывают рассолом, сушат Na2SO4, фильтруют и упаривают. Перекристаллизацией из МеОН/Н 2 О титульное соединение в виде оранжево-коричневого тврдого вещества. MS (ESI, положительный ион) m/z: 231(b) 2-Морфолин-4-ил-8-[6-(4-трифторметилфенил)пиримидин-4-илокси]хинолин. Этот продукт получают по методу, описанному в примере 3 с применением 2-хлор-4-(4-трифторметилфенил)пиримидина(пример 2(а), метод А), (196 мг, 0.76 ммоля), 2-морфолин-4-илхинолин-8-ола (175 мг, 0.76 ммоля) и карбоната калия (210 мг, 1.5 ммоля) в ДМФА (1.5 мл). Очистка колоночной хроматографией на силикагеле(3:1 смесь гексанов: EtOAc) дат титульное соединение в виде тврдого вещества белого цвета. MS (ESI,положит. ион) m/z: 453 (М+1). Т.пл. 162.8-174.3 С. Анализ. Вычислено для C24H19F3N3O2: С, 63.71; Н, 4.23; N, 12.38. 7-[6-(4-трет-Бутилфенил)пиримидин-4-илокси]хинолин. В круглодонную колбу на 100 мл, содержащую 4-(4-трет-бутилфенил)-6-хлорпиримидин (пример 1(а, (0.15 г, 0.61 ммоля) и 7- гидроксихинолин (0.12 г, 0.85 ммоля, Acros) в ДМФА (4 мл), при комнатной температуре прибавляют NaH (34 мг, 0.85 ммоля, 60% в минеральном масле, Aldrich). Раствор перемешивают при комнатной температуре в течение 4 ч. Растворитель отгоняют в вакууме, к остатку прибавляют EtOAc (10 мл) и органический слой промывают водой (8 мл), сушат Na2SO4, фильтруют и упаривают в вакууме. Хроматографией на силикагеле (3:1 смесь гексанов/EtOAc) получают титульное соединение в виде тврдого вещества белого цвета. Т.пл. 133-135 С, MS (ESI, положит. ион) m/z: 356 (М+1). Анализ. Вычислено для C23H21N3O: С, 77.72; Н, 5.96; N, 11.82. Найдено: С, 77.43; Н, 5.99; N, 11.74. 2-Метокси-8-[6-(4-трифторметилфенил)пиримидин-4-илокси]хинолин. Это соединение получают из 4-хлор-6-(4-трифторметилфенил)пиримидина (пример 2(а), Метод А) и 2-метоксихинолин-8-ола (полученного по Ataev, A; et al. Teoreticheskaya i Eksperimenal'naya Khimya 1980, 16(2), 243-249) в условиях из примера 6. Т.пл. 158.5-161 С. MS (ESI, положит. ион) m/z: 398 (М+1). Пример 8 8-[6-(4-Трифторметилфенил)пиримидин-4-илокси]хинолин. Титульное соединение получают из 4 хлор-6-(4-трифторметилфенил)пиримидина (пример 2(а), Метод А) и изохинолин-8-ола (MonomerChem) в условиях примера 6. 194-195 С. MS (ESI, положит. ион) m/z: 368.2 (М+1). Пример 9 5-[6-(4-трет-Бутилфенил)пиримидин-4-илокси]-1H-индол. В круглодонную колбу на 100 мл, содержащую 4-(4-трет-бутилфенил)пиримидин, (пример 1(а, (0.15 г, 0.61 ммол) и 5-гидроксииндол (0.24 г,1.8 ммоля, Aldrich) в 1,4-диоксане (12 мл), прибавляют NaOH (8.0 мл, 8.0 ммолей, 1.0 N). Смесь кипятят в течение 4 ч, охлаждают до комнатной температуры, растворитель отгоняют в вакууме. К остатку прибавляют EtOAc (15 мл) и органический слой промывают 1 N NaOH (10 мл), водой (10 мл), сушат Na2SO4,фильтруют и упаривают в вакууме. Очищают сырой продукт хроматографией на силикагеле (4:1 смесь гексанов/EtOAc), полученное тврдое вещество растворяют в ацетоне (3 мл). К этой смеси по каплям прибавляют воду (5 мл) и выпавший белый осадок отфильтровывают, промывают водой (0.5 мл) и сушат в вакууме при 50 С в течение 48 ч, получают титульное соединение. Т.пл. 143-145 С. MS (ESI, положит. ион) m/z: 344 (М+1). Анализ. Вычислено для C22H21N3O: (H2O)1/8: С, 76.44; Н, 6.20; N, 12.16. Найдено: С, 76.63; Н, 6.20; N, 12.12. Пример 10- 16010380 5-[6-(4-трет-Бутилфенил)пиримидин-4-илокси]-2-метилбензотиазол. В круглодонную колбу на 100 мл, содержащую 4-(4-трет-бутилфенил)-6-хлор-пиримидин (пример 1(а, (0.15 г, 0.61 ммоля) и 2 метилбензотиазол-5-ол (0.14 г, 0.85 ммоля, Aldrich) в ДМФА (10 мл), при комнатной температуре прибавляют NaH (34 мг, 0.85 ммоля, 60% в минеральном масле, Aldrich). Раствор перемешивают при комнатной температуре в течение 4 ч. Растворитель отгоняют в вакууме, к остатку прибавляют EtOAc (10 мл)и органический слой промывают водой (8 мл), сушат Na2SO4, фильтруют и упаривают в вакууме. Очищают хроматографией на силикагеле (4:1 смесь гексанов/EtOAc), полученное тврдое вещество растворяют в ацетоне (5 мл). К этой смеси по каплям прибавляют воду (8 мл), выпадает белый осадок, его отфильтровывают, промывают водой (0.5 мл) и сушат в вакууме при 50 С в течение 48 ч, получают титульное соединение. Т.пл. 163-165 С. MS (ESI, положит. ион) m/z: 376 (М+1). Анализ. Вычислено для C23H21N3OS: (H2O)1/3: С, 69.26; Н, 5.72; N, 11.01. Найдено: С, 69.19; Н, 5.61; N, 11.03. Пример 11 7-[6-(4-Трифторметилфенил)пиримидин-4-илокси]хинолин. В круглодонную колбу на 250 мл, содержащую 4-хлор-6-(4-трифторметилфенил)пиримидин, (пример 2(а), Метод А), (2.5 г, 9.7 ммоля) и 7 гидроксихинолин (2.0 г, 14 ммолей, Acros) в ДМФА (30 мл), при комнатной температуре прибавляютNaH (5.4 г, 14 ммолей, 60% в минеральном масле, Aldrich). Раствор перемешивают при комнатной температуре в течение 4 ч. Растворитель отгоняют в вакууме, к остатку прибавляют EtOAc (100 мл) и воду(50 мл). Выпавший осадок отфильтровывают, а фильтрат выливают в делительную воронку. Органический слой отделяют, объединяют с полученным ранее осадком, упаривают в вакууме и очищают хроматографией на силикагеле (2:1 смесь гексанов/EtOAc). Очищенный продукт растворяют в ацетоне (30 мл) и МеОН (10 мл), к раствору небольшими порциями прибавляют воду (30 мл). Выпавший осадок отфильтровывают, промывают водой (5 мл) и сушат в вакууме при 50 С в течение 48 ч, получают титульное соединение в виде тврдого вещества белого цвета. Т.пл. 178-180 С. MS (ESI, положит. ион) m/z: 368 4-(3-Метоксифенокси)-6-(4-трифторметилфенил)пиримидин. В круглодонную колбу на 100 мл, содержащую 4-хлор-6-(4-трифторметилфенил)пиримидин (пример 2(а), метод А), (0.15 г, 0.58 ммоля) и 3 метоксифенол (0.10 г, 0.81 ммоля, Aldrich) в ДМФА (6 мл), при комнатной температуре прибавляют NaH(32 мг, 0.81 ммоля, 60% в минеральном масле, Aldrich). Раствор перемешивают при комнатной температуре в течение 4 ч. Растворитель отгоняют в вакууме, к остатку прибавляют EtOAc (10 мл) и смесь промывают водой (8 мл), сушат Na2SO4, фильтруют и упаривают в вакууме. Хроматографией на силикагеле(5:1 смесь гексанов/EtOAc) получают титульное соединение в виде тврдого вещества белого цвета. Т.пл. 87-88 С. MS (ESI, положит. ион) m/z: 347 (М+1). Анализ. Вычислено для C18H13F3N2O2: С, 62.54; Н, 3.75; N, 8.09. Найдено: С, 62.54; Н, 3.75; N, 7.99. Пример 13(а) 1-Фенил-2-(4-трифторметилфенил)этанон. В круглодонную колбу на 250 мл помещают 1-бром 4-трифторметилбензол (10 г, 44 ммоля, Aldrich) и ТГФ (50 мл). К реакционной смеси прибавляют калия бис(триметилсилил)амид (176 мл, 88.0 ммолей, Aldrich), бис(дибензилиден)ацетон палладий (3.08 г, 3.37 ммоля, Acros) и 1,1'-бис(дифенилфосфино)ферроцен (2.2 г, 3.99 ммоля, Aldrich). Перемешивают под азотом в течение 10 мин, прибавляют ацетофенон (5.4 мл, 46.6 ммоля, Aldrich) и смесь кипятят в течение 18 ч. Охлаждают до комнатной температуры, прибавляют EtOAc (100 мл) и промывают 0.5 М фосфорной кислотой (50 мл), Н 2 О (50 мл) и рассолом (50 мл). Органический слой сушат Na2SO4, фильтруют и упаривают в вакууме. Сырой продукт очищают флеш-хроматографией на силикагеле (5% EtOAc в смеси- 17010380 гексанов), получают титульное соединение в виде темно-коричневого масла. MS (ESI, положит. ион) m/z: 265 (М+1).(b) Этиловый эфир 4-оксо-4-фенил-3-(4-трифторметилфенил)масляной кислоты. В круглодонную колбу помещают гидрид натрия (416 мг, 10.4 ммоля, 60% суспензия в минеральном масле, Aldrich) и дважды промывают смесью гексанов. Затем прибавляют 1-фенил-2-(4-трифторметилфенил)этанон (2.0 г,7.57 ммоля) и ДМСО (90 мл) и реакционную смесь перемешивают в течение 1 ч при комнатной температуре. Прибавляют по каплям этилхлорацетат (1.05 мл, 10.4 ммоля, Aldrich) и смесь перемешивают при комнатной температуре в течение 18 ч. Прибавляют EtOAc (100 мл) и органический слой промывают 0.5 М фосфорной кислотой (50 мл), Н 2 О (50 мл) и рассолом (50 мл). Органический слой сушат Na2SO4,фильтруют и упаривают в вакууме, получают неочищенное титульное соединение в виде оранжевокоричневого масла. MS (ESI, положит. ион) m/z: 351 (М+1).(с) 6-Фенил-5-(4-трифторметилфенил)-4,5-дигидро-2H-пиридазин-3-он. В круглодонную колбу помещают этиловый эфир 4-оксо-4-фенил-3-(4-трифторметилфенил)масляной кислоты (2.0 г, 5.71 ммоля),диоксан (5 мл) и гидразин (0.28 мл, 8.57 ммоля, Aldrich) и реакционную смесь кипятят в течение 18 ч. Прибавляют EtOAc (100 мл) и органический слой промывают 0.5 М фосфорной кислотой (50 мл), Н 2 О(50 мл) и рассолом (50 мл). Органический слой сушат Na2SO4, фильтруют и упаривают в вакууме, получают неочищенное титульное соединение в виде оранжево-коричневого масла. MS (ESI, положит. ион)(1.00 г, 6.28 ммоля) и смесь нагревают при 60 С в течение 10 мин. Охлаждают до комнатной температуры, прибавляют EtOAc (100 мл), промывают насыщ. NaHCO3 (100 мл) и рассолом (50 мл), сушат Na2SO4,фильтруют и упаривают в вакууме, получают титульное соединение. MS (ESI, положит. ион) m/z: 317(е) 6-Хлор-3-фенил-4-(4-трифторметилфенил)пиридазин. Смесь 6-фенил-5-(4-трифторметилфенил)пиридазин-3-ола (1.00 г, 3.16 ммоля) и POCl3 (6 мл) нагревают при 100 С в течение 18 ч. По охлаждении реакционной смеси до комнатной температуры отгоняют летучие в вакууме, а остаток растворяют в EtOAc (100 мл) Раствор промывают насыщ. NaHCO3 (100 мл) и рассолом (50 мл), сушат Na2SO4,фильтруют и упаривают в вакууме. Сырой продукт очищают флеш-хроматографией на силикагеле (10%EtOAc в смеси гексанов), получают титульное соединение в виде коричневого масла. MS (ESI, положит. ион) m/z: 335 (М+1).(f) 2-Азидо-8-[6-фенил-5-(4-трифторметилфенил)пиридазин-3-илокси]хинолин. В круглодонную колбу помещают гидрид натрия (19.6 мг, 0.816 ммоля, 60% суспензия в минеральном масле, Aldrich) и дважды промывают смесью гексанов. Прибавляют 6-хлор-3-фенил-4-(4-трифторметилфенил)пиридазин(250 мг, 0.749 ммоля), а затем 2-азидохинолин-8-ол, (пример 2(b, (123 мг, 0.680 ммоля) и ДМФА (15 мл) и смесь нагревают при 200 С в течение 48 ч. По охлаждении до комнатной температуры прибавляютEtOAc, промывают H2O и рассолом, сушат Na2SO4, фильтруют и упаривают в вакууме, получают титульное соединение в виде коричневого масла. MS (ESI, положит. ион) m/z: 485 (М+1).(g) 8-[6-Фенил-5-(4-трифторметилфенил)-пиридазин-3-илокси]хинолин-2-иламин. Смесь 2-азидо-8[6-фенил-5-(4-трифторметилфенил)пиридазин-3-илокси]хинолина (230 мг, 0.475 ммоля), трифенилфосфина (249 мг, 0.950 ммоля, Aldrich) и толуола (25 мл) кипятят в течение 4 ч. Растворитель удаляют в вакууме и прибавляют уксусную кислоту и Н 2 О (10 мл:5 мл) и смесь перемешивают при 50 С в течение 18 ч. Растворитель отгоняют в вакууме и остаток очищают хроматографией на силикагеле (2.5% МеОН в хлористом метилене), получают титульное соединение в виде тврдого вещества белого цвета. Ms (ESI,положит. ион) m/z: 459 (М+1). Т.пл. 103-105 С. Пример 14 8-[6-(4-Трифторметилфенил)пиримидин-4-илокси]хинолин. В круглодонную колбу на 100 мл, содержащую 4-хлор-6-(4-трифторметилфенил)пиримидин (пример 2(а), Метод А) (0.30 г, 1.2 ммоля) и 8 гидроксихинолин (0.17 г, 1.2 ммоля, Aldrich) в ДМФА (5 мл), при комнатной температуре прибавляютNaH (56 мг, 1.4 ммоля, 60% в минеральном масле, Aldrich) и смесь перемешивают при комнатной температуре в течение 48 ч. Растворитель отгоняют в вакууме, к остатку прибавляют EtOAc (25 мл) и смесь промывают водой (215 мл), сушат Na2SO4, фильтруют и упаривают в вакууме. Хроматографией на силикагеле (4:1 смесь гексанов/EtOAc) получают титульное соединение в виде тврдого вещества белого цвета: Т.пл. 155-157 С. MS (ESI, положит. ион) m/z: 368 (М+1). Анализ. Вычислено для C20H12F3N3O: С, 65.40, Н, 3.29; N, 11.44. Найдено: С, 65.29; Н, 3.25; N, 11.41. Пример 15 6-[6-(4-Трифторметилфенил)пиримидин-4-илокси]-1 Н-индол. В круглодонную колбу на 100 мл, содержащую 4-хлор-6-(4-трифторметилфенил)пиримидин (пример 2(а), метод А) (0.20 г, 0.77 ммоля) и 6 гидроксииндол (0.21 г, 1.5 ммоля, Aldrich) в 1,4-диоксане (10 мл), прибавляют NaOH (8.0 мл, 8.0 ммоля,1.0 N). Смесь кипятят 8 ч, охлаждают до комнатной температуры, упаривают в вакууме. ПрибавляютEtOAc (30 мл) и органический слой промывают рассолом (10 мл), водой (15 мл), сушат Na2SO4, фильтруют и упаривают в вакууме. Продукт очищают хроматографией на силикагеле (5:1 смесь гексалов/EtOAc), остаток растворяют в ацетоне (3 мл). По каплям прибавляют воду (4 мл), выпадает белый осадок, который отфильтровывают, промывают водой (0.5 мл) и сушат в вакууме при 50 С в течение 48 ч,получают титульное соединение. Т.пл. 206-209 С. MS (ESI, положит. ион) m/z: 356 (М+1). Анализ. Вычислено для C19H12F3N3O(H2O)0.2: С, 63.58, Н, 3.48; N, 11.71. Найдено: С, 63.82; Н, 3.37; N, 11.61. 6-Метокси-2-метил-4-[6-(4-трифторметилфенил)пиримидин-4-илокси]хинолин. В круглодонную колбу на 100 мл, содержащую 4-хлор-6-(4-трифторметилфенил)пиримидин (пример 2(а), метод А) (0.26 г, 1.0 ммоль) и 6-метокси-2-метилхинолин (0.19 г, 1.0 ммоль, Ubichem) в ДМФА (5 мл), при комнатной температуре прибавляют NaH (48 мг, 1.2 ммоля, 60% в минеральном масле, Aldrich). Раствор перемешивают при комнатной температуре в течение 24 ч. Растворитель отгоняют в вакууме, к остатку прибавляют EtOAc (30 мл) и смесь промывают водой (215 мл), сушат Na2SO4, фильтруют и упаривают в вакууме. Хроматографируют продукт на силикагеле (5:1 смесь гексанов/EtOAc), полученное тврдое вещество растворяют в ацетоне (10 мл) и МеОН (8 мл). По каплям прибавляют воду (15 мл), выпадает белый осадок, который отфильтровывают, промывают водой (2 мл) и сушат в вакууме при 50 С в течение 48 ч,получают титульное соединение. Т.пл. 165-166 С. MS (ESI, положит. ион) m/z: 412 (М+1). Анализ. Вычислено для C22H16F3N3O2: С, 64.23, Н, 3.92; N, 10.21. Найдено: С, 64.20; Н, 3.85; N,10.14). Пример 17(а) 4-(4-трет-Бутилфенил)-6-хлорпиримидин-2-иламин. В круглодонную колбу на 250 мл помещают 2-амино-4,6-дихлорпиримидин (1.4 г, 8.1 ммоля, Aldrich), 4-трет-бутилфенилбороновую кислоту (1.2 г,6.7 ммоля, Aldrich), ацетонитрил (30 мл) и 1 М водн. карбонат натрия (25 мл). Затем прибавляютPd(PPh3)4 (0.39 г, 0.34 ммоля, Strem) и полученную жлтую смесь перемешивают в атмосфере N2 при 90 С в течение 15 ч. Реакционную смесь охлаждают до 25 С и прибавляют EtOAc (100 мл). Органический слой отделяют, промывают водой (30 мл), сушат Na2SO4, фильтруют и упаривают в вакууме. Очистка остатка хроматографией на силикагеле (градиент, 4:1 смесь гексанов: EtOAc) дат титульное соединение в виде прозрачного масла. MS (ESI, положит. ион) m/z 263 (М+1).(b) 4-(4-трет-Бутилфенил)-6-(хинолин-7-илокси)пиримидин-2-иламин. В круглодонную колбу на 50 мл помещают 4-(4-трет-бутилфенил)-6-хлорпиримидин-2-иламин (0.25 г, 0.96 ммоля), 7-гидроксихинолин (70 мг, 0.48 ммоля, Acros), K2CO3 (66 мг, 0.48 ммоля) и сухой ДМФА (10 мл). Полученную суспензию нагревают при 100 С в течение 3 ч при перемешивании под N2. Реакционную смесь охлаждают до 25 С, прибавляют 1 N NaOH (100 мл) и экстрагируют EtOAc (50 мл). Органические вытяжки промывают 1 N NaOH (10 мл), водой (10 мл), насыщ. NaCl (10 мл), сушат Na2SO4, фильтруют и упаривают в вакууме. Очисткой остатка хроматографией на силикагеле (градиент, 1:1 смесь гексанов: EtOAc) получают титульное соединение в виде тврдого вещества белого цвета. Т.пл. 154-157 С. MS (ESI, положит. ион) m/z 371 (М+1). Пример 18(а) 7-Бензилоксихинолин. В круглодонную колбу на 250 мл, содержащую раствор 7 гидроксихинолина (2.3 г, 16 ммолей, Acros) в ДМФА (15 мл) при перемешивании при 0 С небольшими порциями при прибавляют NaH (0.75 г, 19 ммолей, 60% в минеральном масле, Aldrich). Перемешивают при 0 С в течение 15 мин, при 0 С в течение 15 мин по каплям прибавляют раствор бензилбромида (1.9 мл, 16 ммолей, Aldrich) в ТГФ (10 мл). После прибавления смесь перемешивают при 0 С в течение 30 мин и прибавляют EtOAc (65 мл) и воду (30 мл). Органическую фазу отделяют, промывают водой (220 мл), сушат Na2SO4, фильтруют и упаривают в вакууме. Очистка остатка хроматографией на силикагеле(b) 7-Бензилоксихинолин 1-оксид. В круглодонную колбу на 100 мл, содержащую смесь 7-бензилоксихинолина (0.70 г, 3.0 ммоля) и MeReO3 (74 мг, 0.30 ммоля, Aldrich) в дихлорэтане (15 мл), при комнатной температуре при перемешивании в течение 10 мин по каплям прибавляют Н 2 О 2 (15 мл, 0.15 моля,35 вес. % раствор в воде, Aldrich). Смесь перемешивают при комнатной температуре в течение 3 ч, прибавляют воду (15 мл) и экстрагируют CH2Cl2 (230 мл). Объединнные органические вытяжки промывают водой (220 мл), сушат Na2SO4, фильтруют и упаривают в вакууме, получают титульное соединение.(с) 2-Хлор-7-бензилоксихинолин. В круглодонную колбу на 100 мл помещают 7-бензилоксихинолин 1- оксид (0.72 г, 2.9 ммоля) и POCl3 (4.0 мл, 44 ммоля, Aldrich) и смесь кипятят под N2 3 ч. По охлаждении до комнатной температуры растворитель отгоняют в вакууме, а остаток растворяют вEtOAc (50 мл). Раствор промывают 5% K2CO3 (220 мл) и водой (220 мл), сушат Na2SO4, фильтруют и упаривают в вакууме. Очистка остатка хроматографией на силикагеле (градиент, 3:1 смесь гексанов:(d) 2-Азидо-7-бензилокси-2-хинолин. В круглодонную колбу на 100 мл помещают 2-хлор-7 бензилоксихинолин (0.35 г, 1.3 ммоля), NaN3 (0.34 г, 5.2 ммоля, Aldrich) и ДМСО (10 мл). Смесь кипятят при 110 С в течение 2 ч, охлаждают до комнатной температуры, прибавляют воду (10 мл) и экстрагируют EtOAc (2x50 мл). Объединнные органические вытяжки промывают водой (15 мл), сушат Na2SO4,фильтруют и упаривают в вакууме. Очистка остатка хроматографией на силикагеле (градиент, 3:1 смесь гексанов: EtOAc) дат титульное соединение. MS (ESI, положит. ион) m/z 277 (М+1).(е) 2-Азидохинолин-7-ол. В круглодонную колбу на 100 мл, содержащую раствор 2-азидо-7 бензилокси-2-хинолина (0.32 г, 1.2 ммоля) в CH2Cl2 (5 мл), при перемешивании при -40 С под N2 по каплям прибавляют 1.0 М раствор BBr3 в хлористом метилене (5.8 мл, 5.8 ммоля, Aldrich). Затем реакционную смесь перемешивают в течение 10 ч при комнатной температуре и при охлаждении на бане со льдом при перемешивании прибавляют смесь льда с водой (10 мл). Основную часть органического растворителя отгоняют в вакууме и кислотность водного остатка доводят до рН 5, добавляя 2 N NaOH. Выпадающий в осадок продукт экстрагируют Et2O (340 мл) и объединнные органические вытяжки промывают водой (20 мл), сушат Na2SO4, фильтруют и упаривают в вакууме, получают титульное соединение. MS(f) 2-Азидо-7-[6-(4-трифторметилфенил)-пиримидин-4-илокси]-хинолин. В круглодонную колбу на 50 мл помещают 4-хлор-6-[4-(трифторметил)фенил]пиримидин (пример 2(а), метод А) (0.27 г, 1.0 ммоль) и 2-азидохинолин-7-ол (0.13 г, 0.69 ммоля), К 2 СО 3 (0.19 г 1.6 ммоля) и сухой ДМФА (15 мл). Полученную суспензию перемешивают при 90 С в течение 3 час. под N2. Реакционную смесь охлаждают до 25 С,прибавляют EtOAc (100 мл) и промывают 5% рассолом (35 мл). Органическую фазу сушат Na2SO4,фильтруют и упаривают в вакууме. Очистка остатка хроматографией на силикагеле (градиент, 2:1 смесь гексанов: EtOAc) дат титульное соединение. MS (ESI, положит. ион) m/z 409 (М+1).(g) 7-[6-(4-Трифторметилфенил)пиримидин-4-илокси]хинолин-2-иламин. В круглодонную колбу на 50 мл помещают 2-азидо-7-[6-(4-трифторметилфенил)пиримидин-4-илокси]хинолин (0.20 г, 0.49 ммоля),PPh3 (0.26 г 0.98 ммоля, Aldrich) и толуол (10 мл). Смесь кипятят 4 ч, охлаждают до комнатной температуры и растворитель отгоняют в вакууме. К остатку прибавляют воду (3 мл) и АсОН (6 мл) и получен- 21010380 ную смесь нагревают при 50 С в течение 5 ч. Растворители отгоняют в вакууме и остаток растворяют вEtOAc (50 мл), промывают 5% K2CO3 (25 мл), водой (25 мл), сушат Na2SO4, фильтруют и упаривают в вакууме. Остаток суспендируют в 5:1 CH2Cl2: MeOH и титульное тврдое соединение (осадок) отфильтровывают. Очистка фильтрата хроматографией на силикагеле (градиент: 10:1 EtOAc: МеОН) дат дополнительное количество продукта, которое объединяют с полученным ранее осадком, получая титульное соединение. Т.пл. 257-259 С. MS (ESI, положит. ион) m/z: 383 (М+1). Пример 19(а) 3,4-Диаминофенола натриевая соль. В круглодонную колбу на 200 мл, содержащую раствор 1,2 диамино-4-метоксибензола (0.50 г, 3.6 ммоля, Avocado) в CH2Cl2 (5 мл) при перемешивании при -30 С под N2 по каплям прибавляют раствор BBr3 в CH2Cl2 (15 мл, 15 ммолей, 1.0 М, Aldrich). Смесь перемешивают при комнатной температуре в течение 5 ч и при охлаждении в бане со льдом прибавляют ледяную воду (25 мл). Смесь подщелачивают до рН 9, добавляя 1 N NaOH и экстрагируют водой (28 мл). Объединнные водные вытяжки, содержащие титульное соединение, непосредственно используют на следующей стадии. Небольшую порцию водного раствора нейтрализуют, добавляя 1 N NaOH, получают аналитический образец 3,4-диаминофенола. MS (ESI, положит. ион) m/z: 125 (М+1).(b) 7-Гидрокси-1,4-хиноксалин. В круглодонную колбу на 100 мл помещают раствор натриевой соли 3,4-диаминофенола из предыдущей стадии (а) (1.6 ммоля, 8 мл) и глиоксаль (0.70 мл, 4.8 ммоля, 40 вес.% раствор в воде, Aldrich). Смесь перемешивают в течение 2 ч при комнатной температуре, подкисляют до рН 5, добавляя 2 N HCl, и экстрагируют смесью EtOAc: ТГФ (320 мл, 1:1). Объединнные органические вытяжки промывают 5% рассолом (20 мл), сушат Na2SO4, фильтруют и упаривают в вакууме. Очистка остатка хроматографией на силикагеле (градиент, 2:1 смесь гексанов: EtOAc) дат титульное соединение. MS (ESI, положит. ион) m/z 147 (М+1).(с) 6-[6-(4-Трифторметилфенил)пиримидин-4-илокси]хиноксалин. В круглодонную колбу на 50 мл помещают 4-хлор-6-[4-(трифторметил)фенил]пиримидин (пример 2(а), метод А), (0.40 г, 1.6 ммоля), 7 гидрокси-1,4-хиноксалин (0.19 г, 1.3 ммоля), сухой ДМФА (10 мл) и NaH (78 мг, 1.9 ммоля, 60% дисперсия в минеральном масле, Aldrich) и полученную суспензию перемешивают под N2 при 90 С в течение 10 ч. Реакционную смесь охлаждают до комнатной температуры, прибавляют EtOAc (50 мл), промывают 5% рассолом (220 мл), сушат Na2SO4, фильтруют и упаривают в вакууме. Очистка остатка хроматографией на силикагеле (градиент, 3:1 смесь гексанов: EtOAc) дат титульное соединение. Т.пл. 168-170 С.(а) 4-Гидрокси-7-метоксихинолин-3-карбоновая кислота. В круглодонную колбу на 200 мл, содержащую этиловый эфир 4-гидрокси-7-метоксихинолин-3-карбоновой кислоты (2.6 г, 11 ммолей, Aldrich), прибавляют 2 N NaOH (25 мл, 50 ммолей) и смесь кипятят в течение 3 ч. По охлаждении до комнатной температуры смесь нейтрализуют до рН 7, прибавляя 2 N HCl, и белый осадок отфильтровывают и сушат в вакууме при 60 С в течение 3 дней, получают титульное соединение. MS (ESI, положит. ион) m/z 220 (М+1).(b) 7-Метокси-4-гидроксихинолин. В круглодонную колбу на 50 мл помещают 4-гидрокси-7 метоксихинолин-3-карбоновую кислоту (1.2 г, 5.5 ммоля) и фениловый эфир (15 мл). Смесь нагревают при 200 С при перемешивании под N2 в течение 1 ч. По охлаждении до комнатной температуры к смеси прибавляют EtOAc (50 мл) и промывают 1 N NaOH (30 мл). Водную фазу подкисляют до рН 5, добавляя 2 N HCl, и экстрагируют EtOAc (340 мл). Объединнные органические вытяжки сушат Na2SO4, фильт- 22010380 руют и упаривают в вакууме, получают титульное соединение в виде жлтого масла. MS (ESI, положит. ион) m/z 176 (М+1).(с) 7-Метокси-4-хлорхинолин. В круглодонную колбу на 100 мл помещают 7-метокси-4 гидроксихинолин (0.43 г, 2.5 ммоля) и POCl3 (5.0 мл, 55 ммоля, Aldrich), и смесь кипятят 2 ч под N2. По охлаждении до комнатной температуры растворитель отгоняют в вакууме и остаток растворяют в EtOAc(40 мл). Раствор промывают 5% K2CO3 (220 мл) и водой (220 мл), сушат Na2SO4, фильтруют и упаривают в вакууме. Очистка остатка хроматографией на силикагеле (градиент, 3:1 смесь гексанов: EtOAc) дат титульное соединение. MS (ESI, положит. ион) m/z 194 (М+1).(d) 7-Гидрокси-4-хлорхинолин. В круглодонную колбу на 100 мл, содержащую раствор 7-метокси 4-хлорхинолин (0.17 г, 0.86 ммоля) в дихлорэтане (5 мл) при перемешивании при -30 С под N2 по каплям прибавляют 1.0 М раствор BBr3 в CH2Cl2 (15 мл, 15 ммолей, Aldrich). Смесь перемешивают при комнатной температуре в течение 20 ч и при перемешивании при охлаждении в бане со льдом прибавляют ледяную воду (10 мл). Основную часть органических растворителей отгоняют в вакууме и доводят кислотность водного остатка до рН 6, прибавляя 1 N NaOH. Выпавший продукт экстрагируют Et2O (320 мл) и объединнные органические вытяжки промывают 5% рассолом (210 мл), сушат Na2SO4, фильтруют и упаривают в вакууме, получают титульное соединение в виде жлтого масла. MS (ESI, положит. ион)(е) 4-Хлор-7-[6-(4-трифторметилфенил)-пиримидин-4-илокси]-хинолин. В круглодонную колбу на 150 мл помещают 4-хлор-6-[4-(трифторметил)фенил]-пиримидин (пример 2(а), метод А), (0.35 г, 1.4 ммоля), 7- гидрокси-4-хлорхинолин (0.12 г, 0.68 ммоля), сухой ДМФА (8 мл) и NaH (54 мг, 1.4 ммоля,60% дисперсия в минеральном масле, Aldrich). Полученную суспензию перемешивают при комнатной температуре в течение 6 ч, затем прибавляют EtOAc (80 мл). Раствор промывают 5% рассолом (220 мл),сушат Na2SO4, фильтруют и упаривают в вакууме. Очистка остатка хроматографией на силикагеле (градиент, 3:1 смесь гексанов: EtOAc) дат титульное соединение. Т.пл. 205-208 С. MS (ESI, положит. ион)(а) 7-Бензилоксикарбонилокси-2-хлорхинолин. Титульное соединение получают из 7 гидроксихинолина (Acros) и бензилхлорформиата (Aldrich) в три стадии, аналогичные по условиям стадиям (а), (b) и (с) из примера 18. MS (ESI, положит. ион) m/z 314 (М+1).(b) 7-Гидрокси-2-хлорхинолин. В круглодонную колбу на 100 мл помещают 7 бензилоксикарбонилокси -2-хлорхинолин. (0.32 г, 1.0 ммоль), NaN3 (0.26 мг, 4.0 ммоля, Aldrich) и ДМФА(10 мл) и смесь нагревают при перемешивании под N2 при 100 С в течение 3 ч. По охлаждении до комнатной температуры к смеси прибавляют EtOAc (40 мл) и подкисляют до рН 4, прибавляя 1 N HCl. Органическую фазу отделяют, промывают 5% рассолом (220 мл), сушат Na2SO4, фильтруют и упаривают в вакууме. Очистка остатка хроматографией на силикагеле (градиент, 3:1 смесь гексанов: EtOAc) дат титульное соединение. MS (ESI, положит. ион) m/z 180 (М+1).(с) 2-Хлор-7-[6-(4-трифторметилфенил)пиримидин-4-илокси]хинолин. В круглодонную колбу на 50 мл помещают 4-хлор-6-[4-(трифторметил)фенил]пиримидин (пример 2(а), метод А), (0.27 г, 1.0 ммоль),7-гидрокси-4-хлорхинолин (56 мг, 0.31 ммоля), K2CO3 (42 мг, 0.30 ммоля) и сухой ДМФА (6 мл). Полученную суспензию перемешивают при 90 С под N2 в течение 6 ч. Реакционную смесь охлаждают до комнатной температуры, прибавляют EtOAc (50 мл), промывают 5% рассолом (15 мл), сушат Na2SO4,фильтруют и упаривают в вакууме. Очистка остатка хроматографией на силикагеле (градиент: 6:1 смесь гексанов: EtOAc) дат титульное соединение. Т.пл. 171-173 С. MS (ESI, положит. ион) m/z 402 (М+1). Пример 22(с) 4-Трифторметил-7-[6-(4-трифторметилфенил)пиримидин-4-илокси]-1H-хинолин-2-он. В круглодонную колбу на 250 мл помещают 4-хлор-6-[4-(трифторметил)фенил]пиримидин (пример 2(а), метод А), (1.07 г, 4.1 ммоля), 2,7-дигидрокси-4-трифторметилхлорхинолин (0.79 г, 3.5 ммоля, Aldrich), K2CO3(0.67 г, 4.8 ммоля) и сухой ДМФА (15 мл). Полученную суспензию перемешивают при 90 С под N2 в течение 4 ч. Реакционную смесь охлаждают до 25 С, прибавляют EtOAc (50 мл) и белый осадок отфильтровывают, получают титульное соединение. MS (ESI, положит. ион) m/z 452 (М+1).(b) 2-Хлор-4-трифторметил-7-[6-(4-трифторметилфенил)пиримидин-4-илокси]хинолин. В круглодонную колбу на 250 мл, содержащую раствор 4-трифторметил-7-[6-(4-трифторметилфенил)пиримидин 4-илокси]-1H-хинолин-2-она (1.1 г, 2.4 ммоля) в толуоле (20 мл), при перемешивании при 0 С под N2 по каплям прибавляют POCl3 (1.8 мл, 19 ммолей, Aldrich). Реакционную смесь перемешивают при комнатной температуре в течение 0.5 ч и при кипении в течение 5 ч. Растворитель отгоняют в вакууме и остаток растворяют в EtOAc (200 мл). Раствор промывают 5% K2CO3 (240 мл) и водой (240 мл), сушат Na2SO4,фильтруют и упаривают в вакууме. Перекристаллизацией остатка из CH2Cl2: МеОН (10:1) получают титульное соединение. Т.пл. 192-194 С. MS (ESI, положит. ион) m/z 470 (М+1). Пример 23 4-Трифторметил-7-[6-(4-трифторметилфенил)пиримидин-4-илокси]хинолин. В круглодонную колбу на 100 мл, содержащую раствор 2-хлор-4-трифторметил-7-[6-(4-трифторметилфенил)пиримидин-4 илокси]хинолина (пример 22(b, (0.25 г, 0.53 ммоля) в EtOAc (20 мл), прибавляют Zn (0.87 г, 13 ммолей,Aldrich), AcOH (61 мг, 1.1 ммоля) и воду (40 мг, 1.1 ммоля). Смесь перемешивают при 70 С в течение 2.5 ч, прибавляют 5% водн. Na2CO3 и реакционную смесь экстрагируют EtOAc (30 мл). Органическую фазу промывают водой (210 мл), сушат Na2SO4, фильтруют и упаривают в вакууме. Очистка остатка хроматографией на силикагеле (градиент, 3:1 смесь гексанов: EtOAc) дат титульное соединение. Т.пл. 129131 С. MS (ESI, положит. ион) m/z 436 (М+1). Пример 24(а) Натриевая соль 4-пиперазин-1-илхинолин-7-ола. В круглодонную колбу на 100 мл, содержащую раствор 7-метокси-4-пиперазинхинолина (0.40 г, 1.7 ммоля, Ubichem, Plc.) в дихлорэтане (15 мл), при- 24010380 перемешивании при -70 С под N2 по каплям прибавляют 1.0 М раствор BBr3 в хлористом метилене (8.2 мл, 8.2 ммоля, Aldrich). Реакционную смесь перемешивают в течение 20 ч при комнатной температуре и при охлаждении на бане со льдом при перемешивании прибавляют смесь льда с водой (20 мл). Основную часть органического растворителя отгоняют в вакууме и кислотность водного остатка доводят до рН 9,подщелачивая с помощью 1 N NaOH. Водный слой промывают EtOAc (30 мл), получают водный раствор титульного соединения, которое непосредственно используют на следующей стадии. Небольшую порцию водного раствора нейтрализуют, добавляя 1 N NaOH, получают аналитический образец 4 пиперазин-илхинолин-7-ола. MS (ESI, положит. ион) m/z: 230 (М+1).(b) трет-Бутиловый эфир 4-(7-гидроксихинолин-4-ил)пиперазин-1-карбоновой кислоты. В круглодонную колбу на 100 мл, содержащую водный раствор натриевой соли 4-пиперазин-1-илхинолин-7-ола из предыдущей стадии (а) (0.31 г, 1.36 ммоля), прибавляют ди-трет-бутилкарбонат (0.42 г, 1.9 ммоля,Aldrich), K2CO3 (0.38 г, 2.72 ммоля), воду (15 мл) и ТГФ (25 мл). Смесь перемешивают при комнатной температуре в течение 1 ч, подкисляют до рН 6, добавляя 2 N HCl и экстрагируют EtOAc (50 мл). Органическую фазу промывают водой (20 мл), сушат Na2SO4, фильтруют и упаривают в вакууме. Очистка остатка хроматографией на силикагеле (градиент: 5:5:1 смесь гексанов: EtOAc: MeOH) дат титульное соединение. MS (ESI, положит. ион) m/z 330 (М+1).(с) трет-Бутиловый эфир 4-7-[6-(4-трифторметилфенил)пиримидин-4-илокси]хинолин-4 илоксипиперазин-1-карбоновой кислоты. В круглодонную колбу на 100 мл помещают 4-хлор-6-[4(трифторметил)фенил]пиримидин (пример 2(а), метод А) (0.40 г, 1.5 ммоля), трет-бутиловый эфир 4-(7 гидроксихинолин-4-ил)пиперазин-1-карбоновой кислоты (0.34 г, 1.0 ммоля), K2CO3 (0.28 г, 2.0 ммоля) и сухой ДМФА (12 мл). Смесь перемешивают при 90 С под N2 в течение 2 ч. Реакционную смесь охлаждают до 25 С, прибавляют EtOAc (80 мл), промывают водой (20 мл), сушат Na2SO4, фильтруют и упаривают в вакууме. Очистка остатка хроматографией на силикагеле (градиент, 2:1 смесь гексанов: EtOAc) дат титульное соединение. MS (ESI, положит. ион) m/z 552 (М+1).(d) 4-Пиперазин-1-ил-7-[6-(4-трифторметилфенил)пиримидин-4-илокси]хинолин. В круглодонную колбу на 100 мл, содержащую трет-бутиловый эфир 4-7-[6-(4-трифторметилфенил)пиримидин-4 илокси]хинолин-4-илоксипиперазин-1-карбоновой кислоты (0.41 г, 0.74 ммоля) в CH2Cl2 (15 мл), прибавляют CF3COOH (15 мл, 195 ммоля, Aldrich). Реакционную смесь перемешивают при комнатной температуре в течение 0.5 ч и растворитель отгоняют в вакууме. К остатку прибавляют EtOAc (40 мл), промывают 5% K2CO3 (220 мл) и водой (210 мл), сушат Na2SO4, фильтруют и упаривают в вакууме, получают титульное соединение. Т.пл. 143-145 С. MS (ESI, положит. ион) m/z 452 (М+1).(а) 2-(Бензгидрилиденамино)бензотиазол-6-ол. В круглодонную колбу на 200 мл, содержащую раствор 2-амино-6-гидроксибензотиазола (1.0 г, 6.0 ммоля, Astatech, Inc.) в ТГФ (30 мл), прибавляют бензофенон (1.1 г, 6.0 ммоля, Aldrich). Реакционную смесь кипятят в течение 3 ч, охлаждают до комнатной температуры и растворители отгоняют в вакууме, получают титульное соединение. MS (ESI, положит. ион) m/z 333 (М+1).(b) 6-[6-(4-Трифторметилфенил)пиримидин-4-илокси]бензотиазол-2-иламин. В круглодонную колбу на 100 мл помещают 4-хлор-6-[4-трифторметил)фенил]пиримидин (пример 2(а), метод А), (0.26 г, 1.0 ммоль), 2-(бензгидрилиденамино)бензотиазол-6-ол (0.39 г, 1.2 ммоля), K2CO3 (0.25 г, 1.8 ммоля) и сухой ДМФА (10 мл). Смесь перемешивают при 50 С под N2 в течение 5 ч. Реакционную смесь охлаждают до 25 С, прибавляют EtOAc (45 мл), промывают 5% рассолом (220 мл), сушат Na2SO4, фильтруют и упаривают в вакууме. К остатку прибавляют ацетон (15 мл) и 1 N NaOH (15 мл)и смесь перемешивают при комнатной температуре 15 мин. Смесь экстрагируют EtOAc (40 мл), органическую фазу отделяют, промывают 5% рассолом (220 мл), сушат Na2SO4, фильтруют и упаривают в вакууме. Очистка остатка хроматографией на силикагеле (градиент, 20:10:3 смесь гексанов: EtOAc: МеОН) дат титульное соединение. Т.пл. 222-225 С. MS (ESI, положит. ион) m/z 389 (М+1). Пример 26 2-[6-(4-Трифторметилфенил)пиримидин-4-илокси]фениламин. К смеси 4-хлор-6-[4-трифторметил) фенил]пиримидина (пример 2(a) метод А) (0.52 г, 2.0 ммоля) и 2-аминофенола (0.26 г, 2.4 ммоля, Aldrich) в ДМФА (10 мл) прибавляют гидрид натрия (0.09 г, 2.2 ммоля, 60% дисперсия в минеральном масле, Aldrich). Смесь нагревают при 50 С в течение 2 ч, охлаждают до комнатной температуры и прибавляют воду. Полученный осадок отфильтровывают, промывают Н 2 О и сушат в вакууме при комнатной температуре в течение 20 ч, получают титульное соединение в виде белого порошка. Т.пл. 188 С. MS (ESI,положит. ион) m/z 332 (М+1). Пример 27(10 мл) и прибавляют Н 2 О (2 мл). Полученный осадок отфильтровывают, промывают Н 2 О и смесью гексанов и сушат в вакууме при комнатной температуре в течение 16 ч, получают титульное соединение в виде белого порошка. Т.пл. 112 С. MS (ESI, положит. ион) m/z 402 (М+1). Пример 28(0.075 г, 0.46 ммоля, Fluka) в ацетонитриле (5 мл) прибавляют 1,8-диазабицикло[5.4.0]ундец-7-ен (0.069 мл, 0.46 ммоля, Aldrich). Смесь кипятят в течение 6 ч, охлаждают до комнатной температуры и промывают EtOAc, осадок отфильтровывают, промывают EtOAc и сушат в вакууме в течение 16 ч, получают титульное соединение в виде длинных белых игл. Т.пл. 312 С. MS (ESI, положит. ион) m/z 384 (М+1). Пример 29 2-Метил-8-[6-(4-трифторметилфенил)пиримидин-4-илокси]хиноксалин. К смеси 4-хлор-6-[4-трифторметил)фенил]пиримидина (пример 2(а), метод А), и 3-метилхиноксалин-5-ола (0.14 г, 0.85 ммоля,получен по J. Med. Chem. 1988, 41, 4062-4079.) в ДМФА (3 мл) прибавляют гидрид натрия (0.040 г, 1.0 ммоль, 60% дисперсия в минеральном масле, Aldrich). Смесь нагревают при 60 С в течение 24 ч, охлаждают до комнатной температуры и распределяют между Н 2 О и EtOAc. Водный слой экстрагируют EtOAc(4x). Объединнные органические вытяжки сушат MgSO4, фильтруют и растворитель отгоняют в вакууме. Остаток очищают флеш-хроматографией (075% EtOAc/смесь гексанов), получают титульное соединение в виде порошка цвета слоновой кости. Т.пл. 139- 144 С. MS (ESI, положит. ион) m/z 383 (М+1). Пример 30 2-Метил-5-[6-(4-трифторметилфенил)пиримидин-4-илокси]хиноксалин. Титульное соединение получают по методике, аналогичной методике, описанной в примере 29, используя 4-хлор-6-[4 трифторметил)фенил]пиримидин (пример 2(а), метод А) (0.20 г, 0.77 ммоля), 2-метилхиноксалин-5-ол(0.14 г, 0.85 ммоля, J. Med. Chem, 1988. 41, 4062.), ДМФА (3 мл) и 60 % дисперсию гидрида натрия в минеральном масле (0.040 г, 1.0 ммоля, Aldrich). Очищают флеш-хроматографией (075% EtOAc/смесь гексанов), получают титульное соединение в виде порошка цвета слоновой кости. Т.пл. 135-141 С. MS(а) Хиноксалин-5-ол. К суспензии 2,3-диаминофенола (1.5 г, 12 ммоля, Aldrich) в 2 М уксусной кислоте (24 мл) и 4 М растворе ацетата натрия (15 мл) прибавляют 40% водн. раствор глиоксаля (1.4 мл,12.4 ммоля, Aldrich). Смесь нагревают при 60 С в течение 40 мин, охлаждают до комнатной температуры и рН раствора доводят до рН 8, добавляя насыщенный водный раствор NaHCO3. Раствор экстрагируютCH2Cl2 (3 х). Объединнные органические вытяжки промывают насыщ. водн. раствором NaHCO3, Н 2 О и рассолом. Органический слой сушат MgSO4 и упаривают в вакууме. Очищают флеш-хроматографией(020% EtOAc/смесь гексанов), получают титульное соединение в виде жлтого порошка. MS (ESI, положит. ион) m/z 147 (М+1).(b) 5-[6-(4-трифторметилфенил)пиримидин-4-илокси]хиноксалин. Титульное соединение получают по методике, аналогичной методике, описанной в примере 29, используя 4-хлор-6-[4 трифторметил)фенил]пиримидин (пример 2(а), метод А) (0.30 г, 1.2 ммоля), хиноксалин-5-ол (0.19 г, 1.3 ммоля), ДМФА (5 мл) и 60 % дисперсию гидрида натрия в минеральном масле (0.060 г, 1.5 ммоля, Aldrich). Очищают флеш-хроматографией (075% EtOAc/смесь гексанов), получают титульное соединение в виде белого порошка. MS (ESI, положит. ион) m/z 369 (М+1). Пример 32K2CO3 (27 г, 195 ммоль) в ДМФА (65 мл) перемешивают при комнатной температуре в течение 1 ч. Прибавляют метилйодид (12.2 мл, 195 ммоля. Aldrich) и реакционную смесь перемешивают при комнатной температуре в течение 30 ч. К реакционной смеси прибавляют Н 2 О и экстрагируют EtOAc (3 х). Объединнные органические вытяжки сушат Na2SO4, фильтруют и упаривают в вакууме. Темно-красное тврдое вещество перекристаллизовывают из смеси гексанов, получают титульное соединение в виде оранжевых игл. MS (ESI, положит. ион) m/z 169 (М+1).(b) 3-Метоксибензол-1,2-диамина сульфат. Смесь 3-метокси-2-нитрофениламина (4.6 г, 27 ммоля),порошка железа (10.7 г, 191 ммоль, Aldrich), EtOH (130 мл) и Н 2 О (10 мл) нагревают при 50 С. Прибавляют по каплям при перемешивании раствор HCl (12.1 М, 1.7 мл). Смесь кипятят в течение 3 ч и охлаждают до комнатной температуры. Нейтрализуют, прибавляя NaOH, фильтруют через целит (Celite),растворитель отгоняют в вакууме, остаток распределяют между CH2Cl2 и насыщ. водн. NaHCO3. Экстрагируют CH2Cl2 (3 х), объединнные органические вытяжки упаривают. Остаток снова растворяют в EtOH(30 мл) и прибавляют концентрированную H2SO4 до прекращения выпадения осадка. Полученный осадок отфильтровывают, промывают EtOH и сушат в вакууме в течение 20 ч при комнатной температуре, получают титульное соединение в виде не чисто-белого порошка. MS (ESI, положит. ион) m/z 139 (МHSO4).(с) 8-Метокси-1 Н-хиноксалин-2-он и 5-Метокси-1 Н-хиноксалин-2-он. Раствор 3-метоксибензол-1,2 диамина сульфата (4.1 г, 17 ммолей) в EtOH (21 мл) и Н 2 О (48 мл) нейтрализуют, осторожно прибавляя тврдый NaHCO3. Прибавляют раствор этилглиоксилата (50% в толуоле, 3.8 мл, 19 ммолей, Fluka), смесь кипятят в течение 1 ч. Охлаждают до комнатной температуры и распределяют между насыщ. водн.NH4CI и 25% i-PrOH/CHCl3. Водный слой экстрагируют 25% i- PrOH/CHCl3 (3 х). Объединнные органические вытяжки сушат Na2SO4, фильтруют и упаривают в вакууме. Очищают хроматографией на силикагеле (02.5% МеОН/ CHCl3), получают 8-метокси-1 Н-хиноксалин-2-он в виде не чисто-белого порошка.(d) 8-Гидрокси-1H-хиноксалин-2-он. К суспензии 8-метокси-1 Н-хиноксалин-2-она (0.3 г, 1.7 ммоля) в бензоле (20 мл) прибавляют AlCl3 (2.0 г, 15.5 ммоля, Aldrich) и смесь кипятят в течение 2 ч. Реакционную смесь охлаждают до комнатной температуры и осторожно прибавляя насыщ. водн. NaHCO3. Полученную смесь экстрагируют 25% i-PrOH/CHCl3 (3 х). Объединнные органические вытяжки сушат(е) 8-[6-(4-Трифторметилфенил)пиримидин-4-илокси]-1 Н-хиноксалин-2-он. К суспензии 8 гидрокси-1H-хиноксалин-2-она (0.22 г, 1.4 ммоля) и 1,8-диазабицикло[5.4.0]ундец-7-ена (0.25 мл, 1.6 ммоля, Aldrich) в CH3CN (20 мл) прибавляют 4-хлор-6-[4-трифторметил)фенил]пиримидин (пример 2(а),метод А), (0.43 г, 1.6 ммоля). Раствор кипятят в течение 18 ч, охлаждают до комнатной температуры и упаривают в вакууме. Очищают флеш-хроматографией (080% EtOAc/смесь гексанов), получают титульное соединение в виде не чисто-белого порошка. Т.пл. 265 С, MS (ESI, положит. ион) m/z 385 8-[6-(4-Трифторметилфенил)пиримидин-4-илокси]-3,4-дигидро-1 Н-хиноксалин-2-он. К суспензии 8-[6-(4-трифторметилфенил)пиримидин-4-илокси]-1 Н-хиноксалин-2-она (пример 32(е, (0.25 г, 0.65 ммоля) в EtOH (5 мл) прибавляют борогидрид натрия (0.11 мг, 2.8 ммоля, Aldrich). Смесь перемешивают при комнатной температуре в течение 2 ч, прибавляют насыщ. водн. NaHCO3 и экстрагируют 25% iPrOH/CHCl3 (3 х). Объединнные органические вытяжки сушат Na2SO4, фильтруют и упаривают в вакууме. Очищают флеш-хроматографией (01.5% 2 М NH3/MeOH в CH2Cl2), получают титульное соединение в вид в виде светло-жлтого порошка. Т.пл. 305 С, MS (ESI, положит. ион) m/z 387 (М+1). Пример 34(а) 5-Гидрокси-1H-хиноксалин-2-он. Титульное соединение получают по методу, аналогичному методу, описанному в примере 32(d), используя 5-метокси-1H-хиноксалин-2-он (пример 32(с (0.3 г, 1.7 ммоля) и AlCl3 (2.0 г, 15.5 ммоля, Aldrich) в бензоле (20 мл). Очищают флеш-хроматографией (08% МеОН/ CH2Cl2), получают титульное соединение в вид в виде коричневого порошка. MS (ESI, положит. ион) m/z 163 (М+1).(b) 5-[6-(4-Трифторметилфенил)пиримидин-4-илокси]-1 Н-хиноксалин-2-он. Титульное соединение получают аналогично соединению из Примера 32(е), используя 4-хлор-6-(4-трифторметилфенил)пиримидин (Пример 2(а), Метод А), (0.38 г, 1.5 ммоля), 5-гидрокси-1 Н-хиноксалин-2-он (0.20 г, 1.2 ммоля) и 1,8-диазабицикло[5.4.0]ундец-7-ен (0.22 мл, 1.5 ммоля, Aldrich) в CH3CN (20 мл). Очистка флешхроматографией (080% EtOAc/смесь гексанов) дат титульное соединение в вид в виде не чисто-белого порошка. Т.пл. 265 С, MS (ESI, положит. ион) m/z 385 (М+1). Пример 35 5-[6-(4-Трифторметилфенил)пиримидин-4-илокси]-3,4-дигидро-1 Н-хиноксалин-2-он. Титульное соединение получают методами, аналогичными описанным в примере 33 с применением 5-[6-(4 трифторметилфенил)пиримидин-4-илокси]-1 Н-хиноксалин-2-она, (пример 34(b, (0.25 г, 0.65 ммоля) и натрийборогидрида (0.11 мг, 2.8 ммоля, Aldrich) в EtOH (5 мл). Очистка флеш-хроматографией (01.5% 2 М NH3/MeOH в CH2Cl2), дат титульное соединение в виде светло-жлтого порошка. Т.пл. 305 С, MSPOBr3 (10.0 г, 35 ммоля, Alfa-Aesar) нагревают при 105 С в течение 2 ч. Смесь охлаждают до комнатной температуры, растворяют в CH2Cl2 и к ней осторожно прибавляют насыщ. водн. NaHCO3. Водный слой экстрагируют CH2Cl2 (4 х). Объединнные органические вытяжки сушат Na2SO4, фильтруют и упаривают в вакууме. Очищают флеш-хроматографией (01.5% 2 М NH3/МеОН в CH2Cl2), получают титульное соединение в вид в виде белого порошка. Т.пл. 81 С, MS (ESI, положит. ион) m/z 447 (М+1).(b) 2-Метокси-5-[6-(4-трифторметилфенил)пиримидин-4-илокси]хиноксалин. К раствору 2-бром-5[6-(4-трифторметилфенил)пиримидин-4-илокси]хиноксалина (0.12 г, 0.27 ммоля) в МеОН (5 мл) прибавляют раствор метоксида натрия (25% в МеОН, 0.090 мл, 0.33 ммоля, Aldrich). Раствор перемешивают при комнатной температуре в течение 24 ч. Добавляют воду и продукт экстрагируют 25% i-PrOH/CHCl3 (4 х). Объединнные органические вытяжки сушат Na2SO4, фильтруют и упаривают в вакууме. Очищают флеш-хроматографией (025% EtOAc/смесь гексанов), получают титульное соединение в виде белых кристаллов. Т.пл. 162 С, MS (ESI, положит. ион) m/z 399 (М+1). Пример 37(а) 2-Хлор-8-метоксихиноксалин. Смесь 8-метокси-1 Н-хиноксалин-2-она (пример 32(с, (0.62 г, 3.5 ммоля) и POCl3 (6.0 мл, 64 ммоля, Aldrich) нагревают при 105 С в течение 4 ч. Реакционную смесь охлаждают до комнатной температуры и упаривают в вакууме. Остаток распределяют между NaHCO3 иCH2Cl2 и перемешивают в течение 3 ч. Водный слой экстрагируют CH2Cl2 (3 х). Объединнные органические вытяжки сушат Na2SO4, фильтруют через силикагель, элюируют EtOAc. Растворитель упаривают в вакууме. MS (ESI, положит. ион) m/z 195 (М+1).(0.21 г, 1.1 ммоля, Aldrich) в конц. NH4OH (1.5 мл, Baker) нагревают при 140 С в микроволновом синтезаторе в течение 10 мин. Прибавляют Н 2 О и осадок отфильтровывают, промывают большим количеством Н 2 О. Коричневый порошок сушат в вакууме при комнатной температуре в течение 20 ч. MS (ESI, положит. ион) m/z 176 (М+1).(с) 3-Аминохиноксалин-5-ол. Титульное соединение получают методами, аналогичными описанным в примере 32(d) с применением 8-метоксихиноксалин-2-иламина (0.12 г, 0.68 ммоля) и AlCl3 (0.82 г,6.2 ммоля, Aldrich) в бензоле (10 мл). Очищают флеш-хроматографией (07.5% MeOH/CH2Cl2), получают титульное соединение в вид в виде коричневого порошка. MS (ESI, положит. ион) m/z 162 (М+1).(d) 8-[6-(4-Трифторметилфенил)пиримидин-4-илокси]хиноксалин-2-иламин. Титульное соединение получают методами, аналогичными описанным в примере 32(е) с применением 4-хлор-6-(4 трифторметилфенил)пиримидина (пример 2(а), метод А), (0.13 г, 0.51 ммоля), 3-аминохиноксалин-5-ола(0.069 г, 0.51 ммоля) и 1,8-диазабицикло[5.4.0]ундец-7-ена (0.077 мл, 0.51 ммоля, Aldrich) в CH3CN (5 мл). Очистка флеш-хроматографией (075% EtOAc/смесь гексанов) дат титульное соединение в виде не чисто-белого порошка. Т.пл. 215 С, MS (ESI, положит. ион) m/z 384 (М+1). Пример 38N-8-[6-(4-Трифторметилфенил)пиримидин-4-илокси]хиноксалин-2-илацетамид. Смесь 8-[6-(4 трифторметилфенил)пиримидин-4-илокси]хиноксалин-2-иламина (пример 37(d (0.55 г, 1.4 ммоля) и уксусного ангидрида (0.82 мл, 8.6 ммоля, Aldrich) в толуоле (15 мл) нагревают при 75 С в течение 4 ч. Перемешивают при комнатной температуре в течение 16 ч, к смеси прибавляют смесь гексанов. Осадок
МПК / Метки
МПК: C07D 413/12, C07D 405/12, C07D 401/12, C07D 403/12, C07D 239/38, C07D 239/34, C07D 417/12, C07D 413/14, C07D 401/14, C07D 405/14, C07D 409/12
Метки: рецепторов, лиганды, ванилоидных
Код ссылки
<a href="https://eas.patents.su/30-10380-ligandy-vaniloidnyh-receptorov.html" rel="bookmark" title="База патентов Евразийского Союза">Лиганды ванилоидных рецепторов</a>
Предыдущий патент: Ингибирующие вич 1,2,4-триазины
Следующий патент: Способ получения метил-2-дифенилметилсульфинилацетата
Случайный патент: Гетероциклы с фунгицидными свойствами












