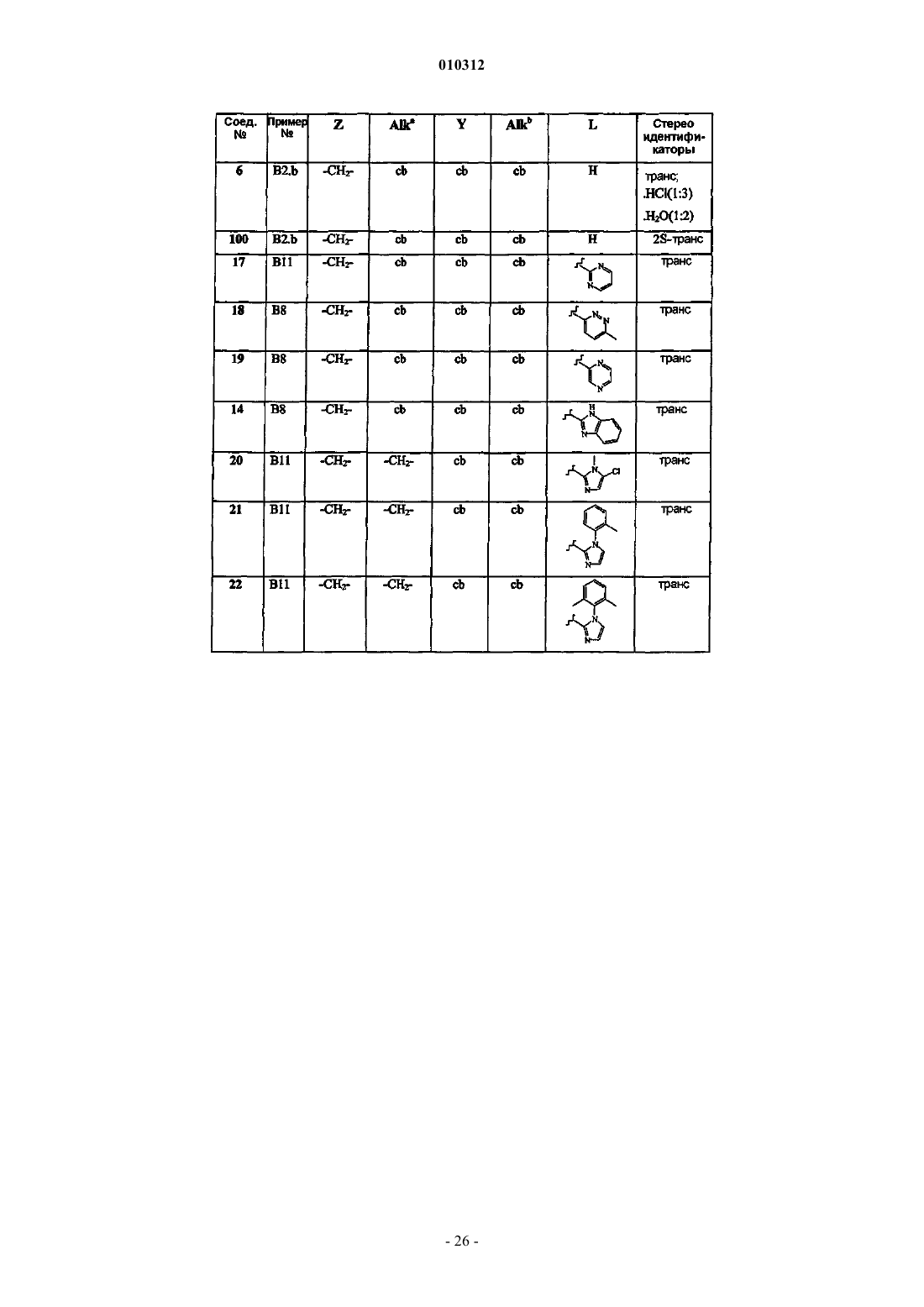
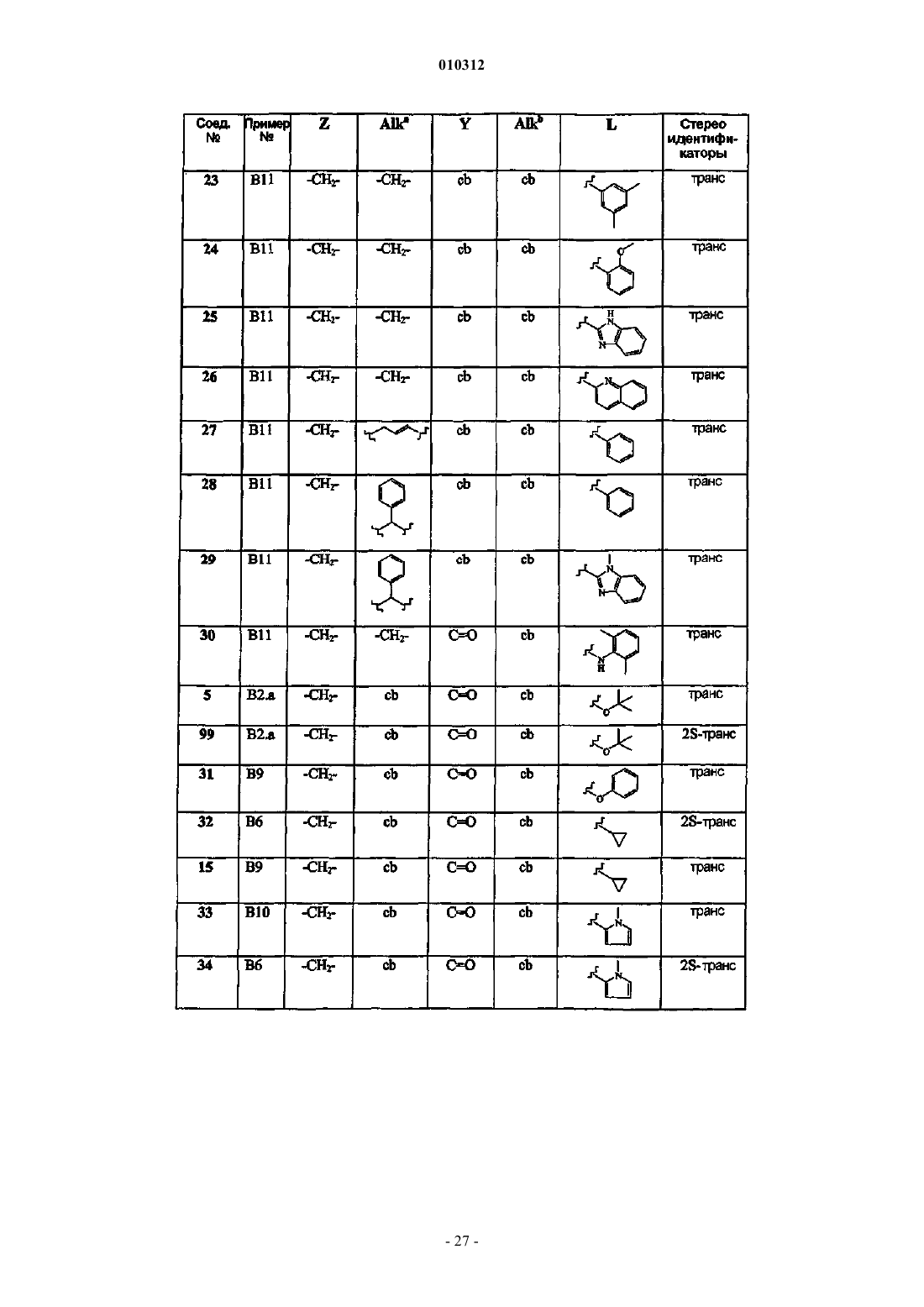
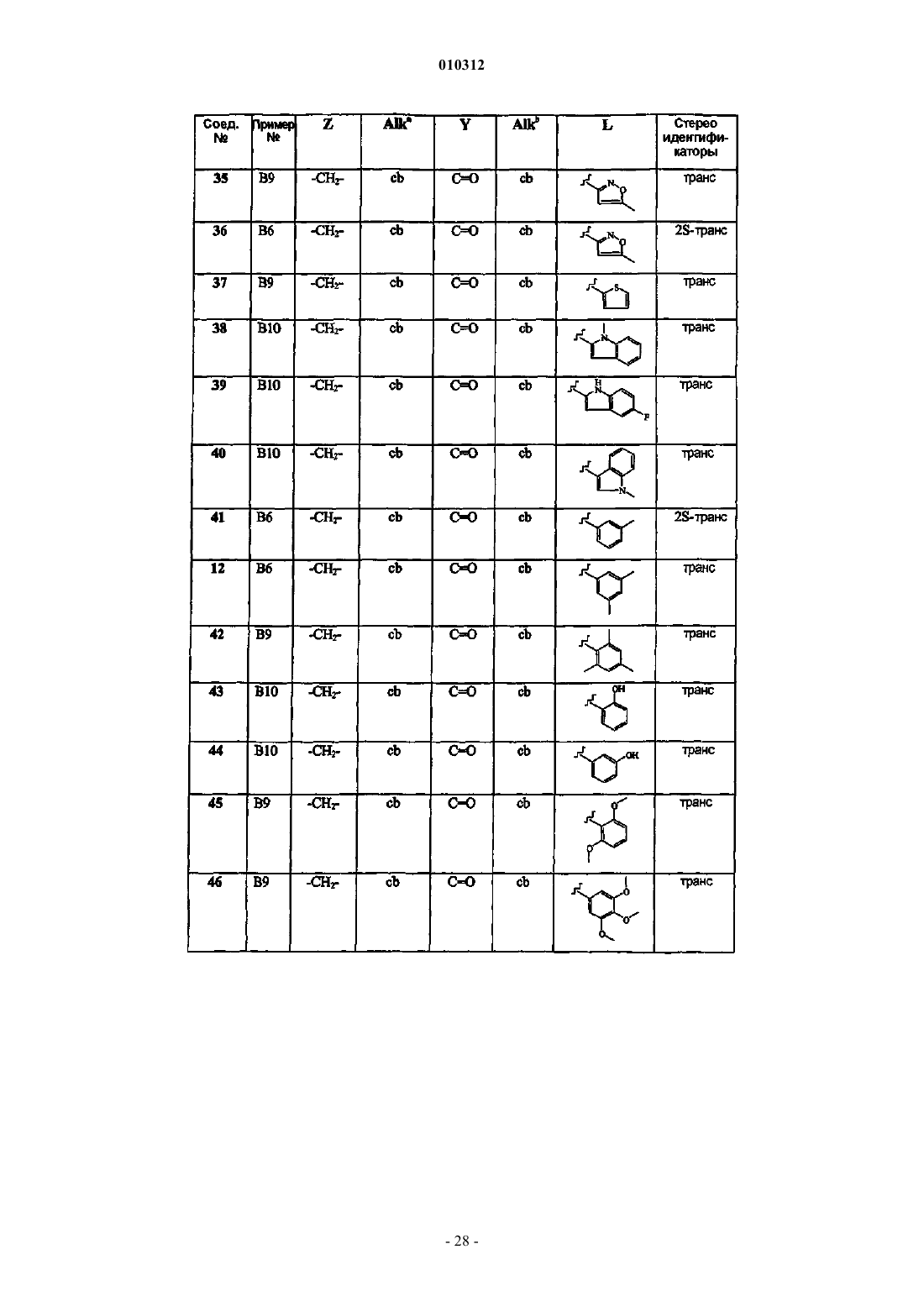
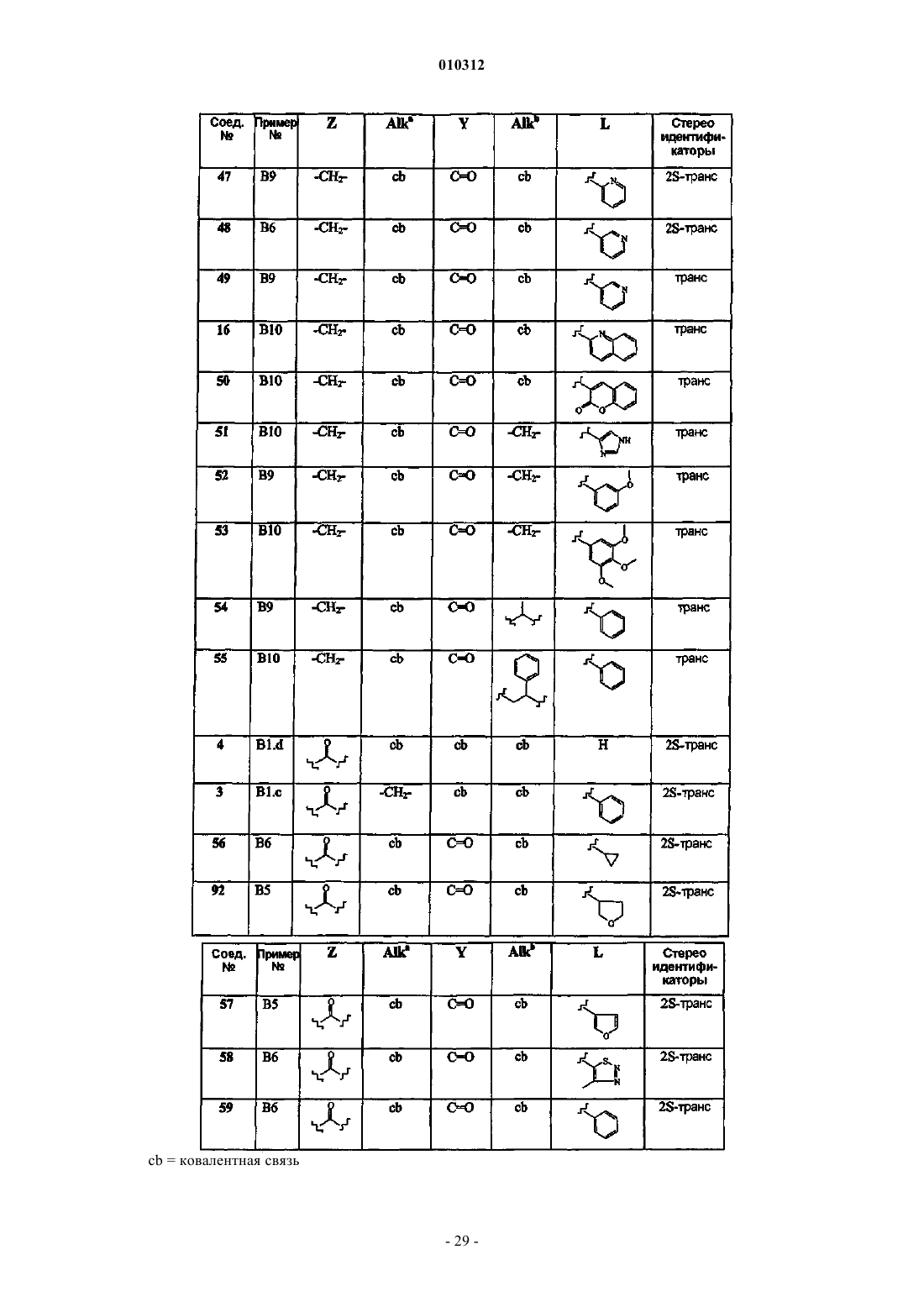
Замещенные производные 4-алкил- и 4-алканоилпиперидина и их применение в качестве антагонистов нейрокининов
Номер патента: 10312
Опубликовано: 29.08.2008
Авторы: Соммен Франсуа Мария, Янссенс Франс Эдуард, Ленартс Йозеф Элизабет, Де Бук Бенуа Кристиан Альберт Гилейн
Формула / Реферат
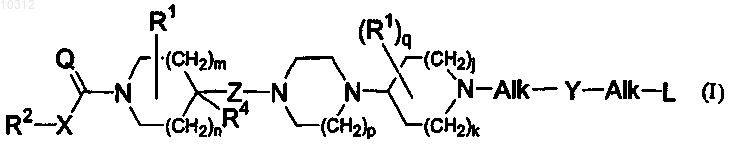
1. Соединение общей формулы (I)
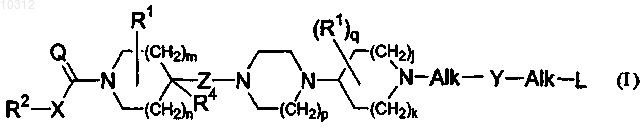
его фармацевтически приемлемые аддитивные соли кислоты или основания, их стереохимически изомерные формы, формы N-оксида и пролекарства, где
n равно целому числу 1;
m равно целому числу 1;
каждый R1 независимо друг от друга, выбран из группы, включающей Ar1, Ar1-алкил и ди(Ar1)-алкил;
R4 выбран из группы, включающей водород, гидрокси и алкилокси;
Z представляет собой двухвалентный радикал -(СН2)r-, где r равно целому числу 1, 2, 3, 4 или 5, и где один радикал -СН2-необязательно заменен >С=O радикалом; или
R4 и Z, взятые вместе, образуют трехвалентный радикал =СН-(CH2)r-1-, где r равно целому числу 2, 3, 4 или 5, и где один радикал -СН2- необязательно заменен >С=O радикалом;
р равно целому числу 1;
Q представляет собой О или NR3;
X представляет собой ковалентную связь или двухвалентный радикал формулы -O-, -S- или -NR3-;
каждый R3 независимо друг от друга представляют собой водород или алкил;
R2 представляет собой алкил, Ar2, Ar2-алкил, Het1 или Het1-алкил;
q равно целому числу 0 или 1;
j равно целому числу 1;
k равно целому числу 0 или 1;
Y представляет собой ковалентную связь или двухвалентный радикал формулы >С=O или -SO2-;
каждый Alk независимо друг от друга представляет ковалентную связь; двухвалентный, линейный или разветвленный, насыщенный или ненасыщенный углеводородный радикал, содержащий от 1 до 6 атомов углерода; или циклический насыщенный или ненасыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода; причем каждый радикал необязательно замещен на одном или нескольких атомах углерода одним или несколькими алкильными, фенильными галогенами, циано, гидрокси, формильными или аминорадикалами;
L выбран из группы, включающей водород, алкил, алкилокси, Ar3-окси, алкилоксикарбонил, моно- и ди(алкил)амино, моно- и ди(Ar3)амино, моно- и ди(алкилоксикарбонил)амино, Ar3, Ar3-карбонил, Het2 и Het2-карбонил;
Ar1 представляет собой фенил, необязательно замещенный 1, 2 или 3 заместителями, независимо друг от друга выбранными из группы, включающей галоген, алкил, циано, аминокарбонил и алкилокси;
Ar2 представляет собой нафталенил или фенил, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо друг от друга выбранными из группы, включающей галоген, нитро, амино, моно- и ди(алкил)амино, циано, алкил, гидрокси, алкилокси, карбоксил, алкилоксикарбонил, аминокарбонил и моно- и ди(алкил)аминокарбонил;
Ar3 представляет собой нафталенил или фенил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо друг от друга выбран из группы, включающей алкилокси, алкил, галоген, гидрокси, пиридинил, морфолинил, пирролидинил, имидазо[1,2-а]пиридинил, морфолинилкарбонил, пирролидинилкарбонил, амино или циано;
Het1 представляет собой моноциклический гетероциклический радикал, выбранный из группы, включающей пирролил, пиразолил, имидазолил, фуранил, тиенил, оксазолил, изоксазолил, тиазолил, тиадиазолил, изотиазолил, пиридинил, пиримидинил, пиразинил и пиридазинил; или бициклический гетероциклический радикал, выбранный из группы, включающей хинолинил, хиноксалинил, индолил, бензимидазолил, бензоксазолил, бензизоксазолил, бензотиазолил, бензизотиазолил, бензофуранил и бензотиенил;
причем каждый гетероциклический радикал может быть необязательно замещен на любом атоме одним или несколькими радикалами, выбранными из группы, включающей галоген и алкил;
Het2 представляет собой моноциклический гетероциклический радикал, выбранный из группы, включающей пирролидинил, диоксолил, имидазолидинил, пирразолидинил, пиперидинил, морфолинил, дитианил, тиоморфолинил, пиперазинил, имидазолидинил, тетрагидрофуранил, 2Н-пирролил, пирролинил, имидазолинил, пирразолинил, пирролил, имидазолил, пиразолил, триазолил, фуранил, тиенил, оксазолил, изоксазолил, тиазолил, тиадиазолил, изотиазолил, пиридинил, пиримидинил, пиразинил, пиридазинил и триазинил; или бициклический гетероциклический радикал, выбранный из группы, включающей бензопиперидинил, хинолинил, хиноксалинил, индолил, изоиндолил, хроменил, бензимидазолил, имидазо[1,2-а]пиридинил, бензоксазолил, бензизоксазолил, бензотиазолил, бензизотиазолил, бензофуранил и бензотиенил, причем каждый гетероциклический радикал может быть необязательно замещен на любом атоме одним или несколькими радикалами, выбранными из группы, включающей Ar1, Ar1-алкил, галоген, гидрокси, алкил, пиперидинил, пирролил, тиенил, оксо, алкилокси, алкилоксиалкил и алкилоксикарбонил; и
алкил представляет собой линейный или разветвленный насыщенный углеводородный радикал, содержащий от 1 до 6 атомов углерода, или циклические насыщенные углеводородные радикалы, содержащие от 3 до 6 атомов углерода, необязательно замещенные на одном или нескольких атомах углерода одним или несколькими радикалами, выбранными из группы, включающей фенил, галоген, циано, оксо, гидрокси, формил и амино.
2. Соединение по п.1, где R1 представляет собой Ar1метил и присоединен в положении 2, или R1 представляет собой Ar1 и присоединен в положении 3.
3. Соединение по любому из пп.1, 2, где группа R2-X-C(=Q)- представляет собой 3,5-ди(трифторметил)фенилкарбонил.
4. Соединение по любому из пп.1-3, где Z выбран из группы, включающей -СН2-, >С=O, -СН2СН2- и -СН2С(=O)-, или Z и R4, взятые вместе, образуют трехвалентный радикал =СН-С(=O)-.
5. Соединение по любому из пп.1-4, где R4 выбран из группы, включающей водород, гидрокси и метокси.
6. Соединение по любому из пп.1-5, где Alk представляет собой ковалентную связь, -СН2-, СН(CH3)-, -СН(фенил)-, -СН2СН(фенил)- или -СН2СН=СН-.
7. Соединение по любому из пп.1-6, где L выбран из группы, включающей водород, алкил, алкилокси, Ar3-окси, моно- и ди(Ar3)амино, Ar3, Het2 и Het2карбонил, и Ar3 и Het2 определены, как в формуле (I).
8. Соединение по любому из пп.1-7, где
n равно целому числу 1;
m равно целому числу 1;
R1 представляет собой Ar1-алкил;
R4 выбран из группы, включающей водород, гидрокси и алкилокси;
Z представляет собой двухвалентный радикал -(СН2)r-, где r равно 1 или 2, и где один радикал -СН2- необязательно заменен >С=O радикалом; или
R4 и Z, взятые вместе, образуют трехвалентный радикал =СН-(СН2)r-1-, где r равно 2, и где один радикал -СН2- необязательно заменен >С=O радикалом;
р равно целому числу 1;
Q представляет собой О;
X представляет собой ковалентную связь;
R2 представляет собой Ar2;
q равно целому числу 0;
j равно целому числу 1;
k равно целому числу 0 или 1;
Y представляет собой ковалентную связь или двухвалентный радикал формулы >С=O или -SO2-;
каждый Alk независимо друг от друга представляет ковалентную связь; двухвалентный, линейный или разветвленный, насыщенный или ненасыщенный углеводородный радикал, содержащий от 1 до 6 атомов углерода, причем каждый радикал необязательно замещен на одном или нескольких атомах углерода фенильным радикалом;
L выбран из групяы, включающей водород, алкил, алкилокси, Ar3-окси, моно- и ди(Ar3)амино, Ar3, Het2 и Het2-карбонил;
Ar1 представляет собой фенил;
Ar2 представляет собой фенил, необязательно замещенный 2 алкильными заместителями;
Ar3 представляет собой фенил, необязательно замещенный 1, 2 или 3 заместителями, независимо друг от друга выбранными из группы, включающей алкилокси, алкил, галоген и гидрокси;
Het2 представляет собой моноциклический гетероциклический радикал, выбранный из группы, включающей тетрагидрофуранил, пирролил, имидазолил, пиразолил, фуранил, тиенил, изоксазолил, тиадиазолил, пиридинил, пиримидинил, пиразинил и пиридазинил; или бициклический гетероциклический радикал, выбранный из группы, включающей хинолинил, индолил, хроменил и бензимидазолил, причем каждый гетероциклический радикал может быть необязательно замещен на любом атоме одним или несколькими радикалами, выбранными из группы, включающей Ar1, галоген, алкил и оксо; и алкил представляет собой линейный или разветвленный насыщенный углеводородный радикал, содержащий от 1 до 6 атомов углерода, или циклические насыщенные углеводородные радикалы, содержащие от 3 до 6 атомов углерода.
9. Применение соединения по любому из пп.1-8 в качестве лекарственного средства.
10. Применение соединения по любому из пп.1-8 для изготовления лекарственного средства для лечения состояний, опосредованных нейрокининами.
11. Применение соединения по п.10 для изготовления лекарственного средства для лечения и/или профилактики шизофрении, рвоты, тревоги и депрессии, синдрома раздраженного кишечника (СРК), нарушения циркадного ритма, пре-эклампсии, ноцицепции, боли, в частности, висцеральной и невропатической боли, панкреатита, нейрогенного воспаления, астмы, хронического обструктивного заболевания легких (ХОЗЛ) и расстройств мочеиспускания, таких как недержание мочи.
12. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и, в качестве активного ингредиента, терапевтически эффективное количество соединения по любому из пп.1-8.
13. Фармацевтическая композиция по п.12, отличающаяся тем, что она находится в форме, подходящей для перорального введения.
14. Способ получения фармацевтической композиции по любому из пп.12-13, отличающийся тем, что фармацевтически приемлемый носитель тщательно смешивают с терапевтически эффективным количеством соединения по одному из пп.1-8.
15. Способ получения соединения формулы (I) восстановительным N-алкилированием промежуточного соединения формулы (II), где R1, R2, R4, X, Q, m, n, p и Z являются такими, как определено в формуле (I), N-замещенным пиперидиноном формулы (III), где R1, Alk, Y, L, j, k и q являются такими, как определено в формуле (I), в инертном по отношению к реакции растворителе и в присутствии восстановителя,
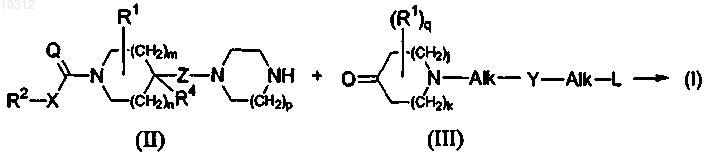
и, если необходимо, полученные конечные соединения формулы (I) превращают друг в друга, следуя известным в данной области реакциям превращения; и далее, необязательно превращая соединения формулы (I) в аддитивную соль кислоты обработкой кислотой, или в аддитивную соль основания обработкой основанием, или наоборот форму аддитивной соли кислоты можно превратить в свободное основание обработкой щелочью, или форму аддитивной соли основания можно превратить в свободную кислоту обработкой кислотой; и получением его N-оксидных и/или стереохимически изомерных форм.
16. Способ получения соединения формулы (I), более конкретно, формулы (Ia), взаимодействием конечного соединения формулы (I'), где R1, R2, R4, X, Q, Z, m, n, p и q являются такими, как определено в формуле (I), с ацильным соединением формулы (V), где Alk и L являются такими, как определено в формуле (I), и W1 представляет собой уходящую группу, в инертном по отношению к реакции растворителе и в присутствии основания,
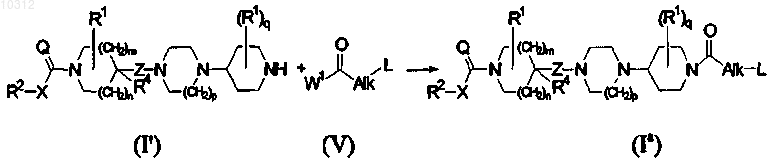
и, если необходимо, полученные конечные соединения формулы (I) превращают друг в друга, следуя известным в данной области реакциям превращения; и далее, необязательно превращая соединения формулы (I) в аддитивную соль кислоты обработкой кислотой, или в аддитивную соль основания обработкой основанием, или наоборот форму аддитивной соли кислоты можно превратить в свободное основание обработкой щелочью, или форму аддитивной соли основания можно превратить в свободную кислоту обработкой кислотой; и получением его N-оксидных и/или стереохимически изомерных форм.
17. Способ получения соединения формулы (I), более конкретно, формулы (Ia), катализируемой основанием реакцией нуклеофильного присоединения конечного соединения формулы (I'), где R1, R2, R4, X, Q, Z, m, n, p и q являются такими, как определено в формуле (I), с карбоновой кислотой формулы (VI), где Alk и L являются такими, как определено в формуле (I), в инертном по отношению к реакции растворителе и в присутствии основания
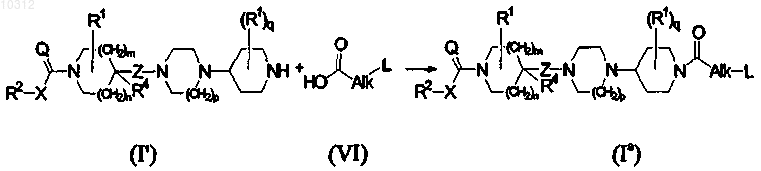
и, если необходимо, полученные конечные соединения формулы (I) превращают друг в друга, следуя известным в данной области реакциям превращения; и далее, необязательно превращая соединения формулы (I) в аддитивную соль кислоты обработкой кислотой, или в аддитивную соль основания обработкой основанием, или наоборот форму аддитивной соли кислоты можно превратить в свободное основание обработкой щелочью, или форму аддитивной соли основания можно превратить в свободную кислоту обработкой кислотой; и получением его N-оксидных и/или стереохимически изомерных форм.
18. Способ получения соединения формулы (I), более конкретно, формулы (Ib), катализируемой основанием реакцией нуклеофильного присоединения конечного соединения формулы (I'), где R1, R2, R4, X, Q, Z, m, n, p и q являются такими, как определено в формуле (I), с соединением кетона формулы (VII), где Alk и L являются такими, как определено в формуле (I), и W2 представляет собой уходящую группу, в инертном по отношению к реакции растворителе и в присутствии основания
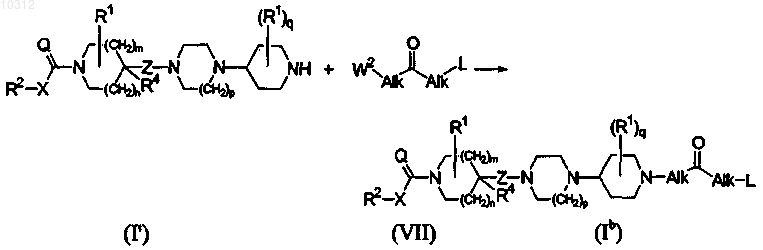
и, если необходимо, полученные соединения формулы (I) превращают друг в друга, следуя известным в данной области реакциям превращения; и далее, необязательно превращая соединения формулы (I) в аддитивную соль кислоты обработкой кислотой, или в аддитивную соль основания обработкой основанием, или наоборот форму аддитивной соли кислоты можно превратить в свободное основание обработкой щелочью, или форму аддитивной соли основания можно превратить в свободную кислоту обработкой кислотой; и получением его N-оксидных и/или стереохимически изомерных форм.
19. Способ получения соединения формулы (I), более конкретно, формулы (Ic), восстановительным аминированием/алкилированием конечного соединения формулы (I'), где R1, R2, R4, X, Q, Z, m, n, p и q являются такими, как определено в формуле (I), соединением формулы (VIII), где Alk и L являются такими, как определено в формуле (I), и W3 представляет собой уходящую группу, в инертном по отношению к реакции растворителе и в присутствии основания
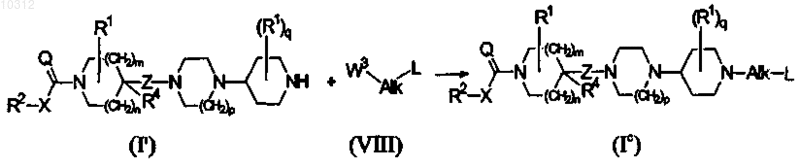
и, если необходимо, полученные соединения формулы (I) превращают друг в друга, следуя известным в данной области реакциям превращения; и далее, необязательно превращая соединения формулы (I) в аддитивную соль кислоты обработкой кислотой, или в аддитивную соль основания обработкой основанием, или наоборот форму аддитивной соли кислоты можно превратить в свободное основание обработкой щелочью, или форму аддитивной соли основания можно превратить в свободную кислоту обработкой кислотой; и получением его N-оксидных и/или стереохимичеёъш изомерных форм
Текст
010312 Область, к которой относится изобретение Данное изобретение относится к замещенным производным 4-алкил- и 4-алканоилпиперидина, обладающим антагонистической активностью к нейрокининам, в частности, NK1 антагонистической активностью и объединенной NK1/NK3 антагонистической активностью, к содержащим их композициям и к их применению в качестве лекарственного средства, в частности, для лечения и/или профилактики шизофрении, рвоты, тревоги и депрессии, синдрома раздраженного кишечника (СРК), нарушения циркадного ритма, преэклампсии, ноцицепции, боли, в частности, висцеральной и невропатической боли, панкреатита, нейрогенного воспаления, астмы, хронического обструктивного заболевания легких (ХОЗЛ) и расстройств мочеиспускания, таких как недержание мочи. Предпосылки создания изобретения Тахикинины принадлежат к семейству коротких пептидов, которые широко распространены в центральной и периферической нервной системе млекопитающих (Bertrand and Geppetti, Trends Pharmacol.Sci. 17:255-259 (1996); Lvmdberg, Can. J. Physiol. Pharmacol. 73:908-914 (1995); Maggi, Gen. Pharmacol. 26:911-944 (1995); Regoli et al., Pharmacol. Rev. 46 (1994. Они имеют общую С-терминальную последовательность Phe-Xaa-Cly-Leu-Met-NH2. Тахикинины, высвобождаемые из окончаний периферического сенсорного нерва, как полагают, вовлечены в нейрогенное воспаление. В спинном мозге/центральной нервной системе тахикинины могут играть роль в передаче боли/восприятии боли и в некоторых автономных рефлексах и поведенческих реакциях. Три основных тахикинина представляют собой вещество Р(SP), нейрокинин A (NKA) и нейрокинин В (NKB) с предпочтительной аффинностью к трем различным подтипам нейрокининовых рецепторов, называемым NK1, NK2 и NK3, соответственно. Однако функциональные исследования на клонированных рецепторах наводят на мысль о сильном функциональном кросс-взаимодействии между 3 тахикининами и их соответствующими нейрокининовыми рецепторами(Maggi and Schwartz, Trends Pharmacol. Sci. 18:351-355 (1997. Типовые различия в структуре NK1 рецепторов ответственны за связанные с видом различия в эффективности антагонистов NK1 (Maggi, Gen. Pharmacol. 26:911-944 (1995); Regoli et al., Pharmacol. Rev. 46(4):551-599 (1994. NK1 рецептор человека близко походит на NK1 рецептор морских свинок и песчанок, но заметно отличается от NK1 рецептора грызунов. Разработка нейрокининовых антагонистов в настоящее время привела к серии пептидных соединений, которые, как можно предвидеть, являются метаболически слишком нестабильными, чтобы использоваться в качестве фармацевтически активных веществ (Longmore J. et al., DNP 8(1): 5-23 (1995. Тахикинины вовлечены в шизофрению, депрессию, тревожные состояния (связанные со стрессом),рвоту, воспалительные реакции, сокращение гладких мышц и восприятие боли. Нейрокининовые антагонисты разрабатываются для таких показаний, как рвота, тревожное расстройство и депрессия, синдром раздраженного кишечника (СРК), нарушение циркадного ритма, висцеральная боль, нейрогенное воспаление, астма, расстройства мочеиспускания и ноцицепция. В частности, антагонисты NK1 имеют высокий терапевтический потенциал при рвоте и депрессии, а антагонисты NK2 имеют высокий терапевтический потенциал при лечении астмы. Антагонисты NK3, как оказалось, играют роль при лечении боли/воспаления (Giardina, G. et al., Exp. Opin. Ther. Patents, 10(6): 939-960 (2000 и шизофрении. Шизофрения Как было недавно показано, NK3 антагонист SR142801 (Safoni) обладает антипсихотической активностью у пациентов, страдающих шизофренией, не оказывая отрицательного воздействия (Arvantis, L.ACNP Meeting, December 2001). Активация NK1 рецепторов вызывает тревогу, стрессовые события вызывают повышение уровней вещества Р (SP) в плазме, и антагонисты NK1, как сообщают, являются анксиолитиками на некоторых животных моделях. Антагонист NK1 от Merck, MK-869 показывает антидепрессивное действие при большой депрессии, но данные не были убедительными вследствие высокого показателя эффективности плацебо. Кроме того, антагонист NK1 от Glaxo-Welcome (S)-GR205,171, как было показано, увеличивает выделение допамина в лобной коре, но не в стриатуме (Lejeune et al., Soc.Neurosci., November 2001). Следовательно, предполагается, что антагонизм NK3 в сочетании с антагонизмом NK1 будет выгоден против как позитивных, так и негативных симптомов шизофрении. Тревожное расстройство и депрессия Депрессия представляет собой наиболее общее аффективное расстройство в современном обществе с высоким и все возрастающим распространением, особенно у молодых членов общества. Прижизненный коэффициент распространенности большой депрессии (MDD, DSM-IV), как оценивается в настоящее время, составляет 10-25% для женщин и 5-12% для мужчин, посредством чего примерно у 25% пациентов прижизненный MDD является рецидивным, без полного выздоровления между приступами, и наложенным на дистимическое расстройство. Существует высокая сочетаемость депрессии с другими психическими болезнями и, в частности, у молодого населения, сильная связь с наркотиками и алкоголизмом. Принимая во внимание факт, что депрессия, прежде всего, воздействует на население в возрасте между 18-44 годами, т.е. на наиболее продуктивное население, очевидно, что она накладывает большое бремя на отдельных людей, на семьи и на все общество. Среди всех терапевтических возможностей терапия антидепрессантами неоспоримо является наиболее эффективной. Огромное количество антидепрессантов было разработано и поступило на рынок в-1 010312 течение последних 40 лет. Тем не менее, ни один из имеющихся в настоящее время антидепрессантов не удовлетворяет всем критериям идеального лекарственного средства (высокая терапевтическая и профилактическая эффективность, быстрое наступление действия, полностью удовлетворительная кратковременная и долговременная безопасность, простая и благоприятная фармакокинетика), или они имеют побочные эффекты, которые так или иначе ограничивают их применение во всех группах и подгруппах,страдающих депрессией пациентов. Поскольку в настоящее время не существует, и не появится в ближайшее время никакой терапии причины депрессии, и никакие антидепрессанты не являются эффективными у более чем 60-70% пациентов, оправданной является разработка нового антидепрессанта, который может обойти любой из недостатков имеющихся в настоящее время лекарственных средств. Несколько находок показывают вовлечение SP в состояния тревоги, связанные со стрессом. Центральная инъекция SP вызывает сердечно-сосудистую реакцию, подобную классической реакции "борьбы или бегства", физиологически характеризующуюся расширением сосудов в скелетных мышцах и снижением потока мезентериальной и почечной крови. Эта сердечно-сосудистая реакция сопровождается поведенческой реакцией, наблюдаемой у грызунов после вредного воздействия или стресса (Culmanand Unger, Can. J. Physiol. Pharmacol. 73:885-891 (1995. В мышах центрально введенные агонисты и антагонисты NK1 являются анксиогенными и анксиолитическими, соответственно (Teixeira et al., Eur. J.SP (или электрошоком; Ballard et al., Trends Pharmacol. Sci. 17:255-259 (2001, может соответствовать данной антидепрессивной/анксиолитической активности, поскольку у песчанок возбуждение играет роль в качестве предупреждающего или предостерегающего сигнала для животных того же вида. Рецептор NK1 широко распространен в лимбической системе и путях головного мозга, ответственные за обработку состояния страха, включая миндалину, гиппокамп, перегородку, гипоталамус и околоводопроводное серое вещество. Кроме того, вещество Р центрально высвобождается в ответ на травматический или вредный раздражитель, и связанная с веществом Р нейропередача может вносить вклад или быть вовлеченной в состояние тревоги, страх и эмоциональные нарушения, которые сопровождают аффективные расстройства, такие как депрессия и тревожное расстройство. В поддержку этого взгляда,изменения содержания вещества Р в отдельных областях головного мозга могут наблюдаться в ответ на стрессовый раздражитель (Brodin et al., Neuropeptides 26:253-260 (1994. Центральная инъекция миметиков (агонистов) вещества Р вызывает ряд защитных поведенческих и сердечно-сосудистых изменений, включая обусловленную аверсию места (Elliott, Exp, Brain. Res. 73:354356 (1988, усиленную акустическую старт-реакцию (Krase et al., Behav. Brain. Res. 63:81-88 (1994, дистресс вокализацию, реакцию избегания (Kramer et al., Science 281:1640-1645 (1998 и тревогу в приподнятом крестообразном лабиринте (Aguiar and Brandao, Physiol. Behav. 60:1183-1186 (1996. Данные соединения не изменяют моторную деятельность и координацию на аппарате ротарод или в клетке для бега. Понижающая регуляция биосинтеза вещества Р происходит в ответ на введение известных анксиолитических и антидепрессивных лекарственных средств (Brodin et al., Neuropeptides 26:253-260 (1994;Shirayama et al., Brain. Res. 739:70-78 (1996. Аналогичным образом, реакцию вокализации у морской свинки, вызванную центрально введенным агонистом NK1, можно антагонизировать антидепрессантами,такими как имипрамин и флуоксетин, а также L-733,060, антагонистом NK1. Данные исследования обеспечивают свидетельство, наводящее на мысль, что блокада центральных NK1 рецепторов может подавить психологический стресс аналогично действию антидепрессантов и анксиолитиков (Rupniak and Kramer,Trends Pharmacol. 20:1-12 (1999, но без побочных эффектов современных лекарственных препаратов. Рвота Тошнота и рвота представляют собой наиболее тревожащие побочные эффекты при химиотерапии рака. Они снижают качество жизни и могут заставить пациентов приостановить прием или отказаться от приема потенциально лечебных лекарственных препаратов (Kris et al., J. Clin. Oncol. 3:1379-1384 (1985. Частота возникновения, интенсивность и картина рвоты определяется различными факторами, такими как химиотерапевтический агент, дозировка и путь введения. Типично, ранняя или острая рвота начинается в первые 4 ч после химиотерапевтического введения, достигая пика между 4 и 10 ч, и снижается между 12 и 24 ч. Отложенная рвота (развивающаяся после 24 ч и продолжающаяся до 3-5 дней после химиотерапии) наблюдается для большинства "высокоэметогенных" химиотерапевтических препаратов(уровень 4 и 5 согласно Hesketh et al., J. Clin. Oncol. 15:103 (1997. У людей эти "высокоэметогенные" противораковые терапии, включающие цис-платинум, вызывают острую рвоту у 98% и отложенную рвоту у 60-90% раковых пациентов. Животные модели химиотерапии, такие как вызванная цисплатином рвота у песчанок (Rudd andNaylor, Neuropharmacology 33:1607-1608 (1994); Naylor and Rudd, Cancer Surv. 21:117-135 (1996 успешно предсказали клиническую эффективность антагонистов 5-HT3 рецепторов. Хотя данное открытие привело к успешной терапии для лечения болезненного состояния у раковых пациентов, вызванного химиотерапией или лучевой терапией, антагонисты 5-НТ 3, такие как ондансетрон и гранисетрон (в сочетании с дексаметазоном или без него) являются эффективными для контроля фазы острой рвоты (в первые-2 010312 24 ч), но способны лишь уменьшить развитие отложенной рвоты (24 ч) с низкой эффективностью (DeMulder et al., Annuals of Internal Medicine 113:834-840 (1990); Roila, Oncology 50:163-167 (1993. Несмотря на данные наиболее эффективные на текущий момент терапии для предотвращения как острой, так и отложенной рвоты, все еще 50% пациентов страдают от отложенной тошноты и/или рвоты (AntiemeticKramer et al., Science 281:1640-1645 (1998); Rupniak and Kramer, Trends Pharmacol. Sci. 20:1-12 (1999,как было недавно показано, подавляют фазу не только острой, но также и отложенной рвоты, вызванной цисплатином, у животных (Rudd et al., Br. J. Pharmacol. 119:931-936 (1996); Tattersall et al., Neuropharmacology 39:652-663 (2000. Также было продемонстрировано, что антагонисты NK1 снижают "отложенную" рвоту у человека в отсутствие сопутствующей терапии (Cocquyt et al., Eur. J. Cancer. 37:835-842(2001); Navari et al., N. Engl. L. Med. 340:190-195 (1999. Кроме того, при введении совместно с дексаметазоном и антагонистами 5-HT3, антагонисты NK1 (такие как, МK-869 и CJ-11,974, также известный как эзлопитант), как было показано, оказывают дополнительное воздействие по предотвращению острой рвоты (Campos et al., J. Clin. Oncol. 19:1759-1767 (2001); Hesketh et al., Clin. Oncol. 17:338-343 (1999. Центральные нейрокининовые NK1 рецепторы играют важную роль в регуляции рвоты. Антагонисты NK1 являются активными по отношению к широкому множеству рвотных стимулов (Watson et al.,Br. J. Pharmacol. 115:84-94 (1995); Tattersall et al., Neuropharmacol. 35:1121-1129 (1996); Megens et al., J.Pharmacol. Exp. Ther. 302:696-709 (2002. Предполагается, что данные соединения действуют, блокируя центральные NK1 рецепторы в nucleus tractus solitarius. Кроме NK1 антагонизма, проникновение в ЦНС является, таким образом, предпосылкой для противорвотной активности данных соединений. Рвоту, вызванную у песчанок лоперамидом, можно использовать как быструю и надежную модель скрининга противорвотной активности антагонистов NK1. Дальнейшая оценка их терапевтического значения при лечении фазы как острой, так и отложенной рвоты, вызванной цисплатином, была продемонстрирована на принятой модели песчанок (Rudd et al., Br. J. Pharmacol. 119:931-936 (1994. Данная модель изучает как"острую", так и "отложенную" рвоту после цисплатина, и она была обоснована на основании своей чувствительности к антагонистам 5-HT3 рецептора, глюкокортикоидам, Sam et al., Eur. J. Pharmacol. 417:231237 (2001 и другим фармакологическим веществам. Маловероятно, что будущее противорвотное средство найдет клиническое применение без успешной терапии фазы как "острой", так и "отложенной" рвоты. Висцеральная боль и синдром раздраженного кишечника (СРК) Висцеральные ощущения относятся ко всей сенсорной информации, источником которой являются внутренние органы (сердце, легкие, ЖК тракт, гепатобилиарный тракт и мочеполовой тракт), и передаются в центральную нервную систему, приводя к осознанным ощущениям. Как вагальный нерв посредством нижнего ганглия, так и первичные симпатические афферентные нервы посредством дорзального корневого ганглия (DRG) и нейронов второго порядка в дорзальном роге служат в качестве начального пути, вдоль которого висцеральная сенсорная информация передается в ствол мозга и к висцеросоматическому кортикальному слою. Висцеральная боль может быть вызвана опухолевыми процессами (например, раком поджелудочной железы), воспалением (например, холециститом, перитонитом), ишемией и механической обструкцией (например, камень в мочеточнике). Главная опора медицинского лечения висцеральной боли, связанной с органическими заболеваниями (в данном случае, раком внутренних органов) все еще фокусируется на опиатах. Недавние свидетельства наводят на мысль, что неорганические висцеральные расстройства, такие как синдром раздраженного кишечника (СРК), несердечная боль в груди (NCCP) и хроническая тазовая боль, могут происходить из-за состояния "висцеральной гипералгии". Последнюю определяют как состояние, при котором физиологические, неболевые висцеральные раздражители (например, растяжение кишки) ведут к осознанному ощущению боли, вследствие пониженного порога для боли. Висцеральная гипералгезия может отражать состояние постоянного, послевоспалительного восстановления порога деполяризации мембраны у нейронного синапсиса внутри висцерального сенсорного пути. Начальное воспаление может иметь место на периферии (например, инфекционный гастроэнтерит) или в месте интеграции висцеральной сенсорной информации (нейрогенное воспаление в дорзальном роге). Как SP, так и пептид, связанный с геном кальцитонина (CGRP), как было показано, действуют в качестве провоспалительных нейропептидов при нейрогенном воспалении. Висцеральная гипералгезия в настоящее время рассматривается в качестве одной из основных целей для разработки лекарственных средств, нацеленных на лечение функциональных заболеваний кишечника, которые встречаются у 15-20% населения западных стран. Они составляют огромную социально-экономическую проблему с точки зрения стоимости медицинского лечения, стоимости лекарств и невыходов на работу. Текущие варианты терапии включают антиспазматические (СРК и NCCP), стимулирующие вещества (например, тегасород при запоре - СРК), слабительные (запор - СРК) и лоперамид(диарея - СРК), среди прочего. Ни один из данных подходов, как было показано, не является достаточно эффективным, особенно при лечении боли. Низкие дозы трициклических антидепрессантов и SSRI ис-3 010312 пользуют для лечения висцеральной гипералгезии при СРК с преобладающей болью, но оба класса соединений могут оказывать значительное воздействие на толстокишечный транзит. Проводимые исследования в данной области идентифицировали значительное число молекулярных мишеней, которые могли бы служить для разработки лекарственных средств при висцеральной гипералгезии. Они включают NK рецепторы, CGRP рецептор, 5-НТ 3 рецепторы, глутаматные рецепторы и опиоидные каппа-рецепторы. В идеальном случае "висцеральное обезболивающее соединение" должно блокировать повышенный сенсорный перенос от внутренних органов к ЦНС без воздействия на нормальный физиологический гомеостаз ЖК тракта в отношении пропульсивной моторной активности, поглощения, выделения и чувствительности. Существует несомненное свидетельство связи тахикининов с висцеральной ноцицептивной передачей сигнала. Ряд доклинических публикаций о роли NK1, NK2 и NK3 рецепторов в висцеральной боли и висцеральной гипералгезии демонстрируют различие между вовлечением NK1, NK2 и NK3 рецепторов на различных моделях воспалительной гиперчувствительности у грызунов. Недавно Kamp et al., J.Pharmacol. Exp. Ther. 299:105-113 (2001) предположил, что объединенный антагонист нейрокининового рецептора мог бы быть более активным, чем селективный антагонист нейрокининового рецептора. Вещество Р, NK1, NK2 и NK3 рецепторы повышаются при клинических состояниях боли, включая состояния висцеральной боли (Lee et al., Gastroenterol. 118:A846 (2000. Принимая во внимание недавние неудачи антагонистов NK1 рецепторов в качестве обезболивающего в болевых тестах на человеке (Goldshtein et al., Clin. Pharm. Ther. 67:419-426 (2000, для значительного клинического эффекта могут потребоваться комбинации антагонистов. Антагонисты NK3 рецептора являются анти-гипералгезическими(Julia et al., Gastroenterol. 116:1124-1131 (1999); J. Pharmacol. Exp. Ther. 299:105-113 (2001. Недавно вовлечение NK1 и NK3 рецепторов, но не NK2 рецепторов, на спинальном уровне было продемонстрировано в висцеральной гиперчувствительности, опосредованной ноцицептивным и не ноцицептивным афферетным вкладом (GaudreauPloudre, Neurosci. Lett. 351:59-62 (2003. Следовательно, комбинированиеNK1-2-3 антагонистической активности могло бы представлять интересную терапевтическую мишень для разработки новых терапий висцеральной гипералгезии. Было опубликовано умеренное количество доклинических публикаций о роли NK1 рецепторов в висцеральной боли. При использовании мышей с нокаутированным NK1 рецептором и антагонистов NK1 на животных моделях, различные группы продемонстрировали важную роль, играемую NK1 рецептором в гипералгезии и висцеральной боли. Распределение NK1 рецепторов и вещества Р благоприятствует основной роли скорее при висцеральной, а не при соматической боли. Действительно, более 80% висцеральных первичных афферентов содержат вещество Р по сравнению только с 25% кожных афферентов.NK1 рецепторы также вовлечены в желудочно-кишечную моторику (Tonini et al., Gastroenterol. 120:938945 (2001); Okano et al., J. Pharmacol. Exp. Ther. 298:559-564 (2001. Вследствие данной двойственной роли, как в желудочно-кишечной моторике, так и в ноцицепции, считается, что антагонисты NK1 обладают потенциалом улучшать симптомы у пациентов с СРК. Недержание мочи Недержание мочи (непроизвольное мочеиспускание) вызвано гиперрефлексией мочевого пузыря или детрузора ("раздраженный мочевой пузырь"). Данная гиперрефлексия связана с гипервозбудимостью чувствительных афферентных С-волокон мочевого пузыря, простирающихся в спинной мозг. Природа гипервозбудимости С-волокон является многофакторной, но встречается, например, после инфекции мочевого пузыря и хронического расширения стенки мочевого пузыря (например, доброкачественной гипертрофии простаты, ВРН). Следовательно, лечение должно быть нацелено на снижение нейронной гипервозбудимости. Внутрипузырная инстилляция ваниллоидов (например, капсаицина) приводит к долговременному благоприятному действию на гиперрефлексию детрузора, устойчивую к традиционному лечению антихолинергическими лекарственными средствами. Аналогично исследованиям на животных,действие ваниллоидов опосредовано через нейротоксическое действие на чувствительные нервные окончания. В мочевом пузыре человека субэндотелиальные сенсорные нервы содержат тахикинины, которые стимулируют гипервозбудимость детрузора. NK рецепторы, вовлеченные в данное действие, являются периферийными NK2 рецепторами и, в меньшей степени, NK1 рецепторами. Последние, как заявлено,играют роль в гиперрефлексии мочевого пузыря на уровне спинного мозга. Как следствие, центрально воздействующие NK1/периферийно воздействующие NK2 антагонисты являются предпочтительными для лечения гипервозбудимости детрузора. Интересно, что активация NK2 рецептора увеличивает активность ароматазы в клетках Сертоли. Антагонисты рецептора NK2 снижают уровни тестостерона в сыворотке крови мышей, и это может являться терапевтически важным при ВРН. Предшествующий уровень техники Соединения, содержащие 1-пиперидин-4-илпиперазинильную группу, описаны в WO97/16440-A1,опубликованной 9 мая 1997 Janssen Pharmaceutica N.V., для использования в качестве антагонистов вещества Р, в WO02/32867, опубликованной 25 апреля 2002 Glaxo Group Ltd., за их особые преимущества в качестве нейрокининовых антагонистов (более конкретно, описаны амидные производные 4-пиперазин 1-илпиперидин-1-карбоновой кислоты), в WO01/30348-A1, опубликованной 3 мая 2001 Janssen Pharmaceutics N.V., для использования в качестве антагонистов вещества Р для влияния на циркадную временную систему, и в WO02/062784-A1, опубликованной 15 августа 2002 Hoffmann-La Roche AG, для исполь-4 010312 зования в качестве антагонистов нейрокинина 1. Соединения по настоящему изобретению отличаются от соединений предшествующего уровня техники замещением пиперазинил/имидазолидинильной группы, а также их улучшенной способностью в качестве эффективных, орально и центрально активных нейрокининовых антагонистов с терапевтической ценностью, в особенности для лечения и/или профилактики шизофрении, рвоты, тревоги и депрессии, синдрома раздраженного кишечника (СРК), нарушения циркадного ритма, преэклампсии, ноцицепции, боли, в частности, висцеральной и невропатической боли, панкреатита, нейрогенного воспаления,астмы, хронического обструктивного заболевания легких (ХОЗЛ) и расстройств мочеиспускания, таких как недержание мочи. Описание изобретения Настоящее изобретение относится к новым производным 4-алкил- и 4-алканоилпиперидина общей формулы (I) их фармацевтически приемлемым аддитивным солям кислоты или основания, их стереохимически изомерным формам, формам N-оксида и пролекарствам, гдеn равно целому числу 0, 1 или 2;m равно целому числу 1 или 2, при условии, если m равно 2, тогда n равно 1; каждый R1 независимо друг от друга, выбран из группы, включающей Ar1, Ar1-алкил и ди (Ar1)алкил;Z представляет собой двухвалентный радикал -(СН 2)r-, где r равно целому числу 1, 2, 3, 4 или 5, и один радикал -СН 2- необязательно замещен С=O радикалом; илиR4 и Z, взятые вместе, образуют трехвалентный радикал =СН-(СН 2)r-1-, где r равно целому числу 2,3, 4 или 5, и где один радикал -CH2- необязательно замещен С=O радикалом; р равно целому числу 1 или 2;X представляет собой ковалентную связь или двухвалентный радикал формулы -O-, -S- или -NR3-; каждый R3 независимо друг от друга представляет собой водород или алкил;q равно целому числу 0 или 1;j равно целому числу 0, 1 или 2;k равно целому числу 0, 1 или 2;Y представляет собой ковалентную связь или двухвалентный радикал формулы С=O или -SO2-; каждый Alk независимо друг от друга представляет ковалентную связь; двухвалентный, линейный или разветвленный, насыщенный или ненасыщенный углеводородный радикал, содержащий от 1 до 6 атомов углерода; или циклический насыщенный или ненасыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода; причем каждый радикал необязательно замещен на одном или нескольких атомах углерода одним или несколькими алкильными, фенильными, галогенами, циано, гидрокси,формильными или аминорадикалами;Ar1 представляет собой фенил, необязательно замещенный 1, 2 или 3 заместителями, независимо друг от друга выбранными из группы, включающей галоген, алкил, циано, аминокарбонил и алкилокси;Ar2 представляет собой нафталенил или фенил, каждый из которых необязательно замещен 1, 2 или 3 заместителями, независимо друг от друга выбранными из группы, включающей галоген, нитро, амино,моно- и ди(алкил)амино, циано, алкил, гидрокси, алкилокси, карбоксил, алкилоксикарбонил, аминокарбонил и моно- и ди(алкил)аминокарбонил;Ar3 представляет собой нафталенил или фенил, необязательно замещенный 1, 2 или 3 заместителями, каждый из которых независимо друг от друга выбран из группы, включающей алкилокси, алкил, галоген, гидрокси, пиридинил, морфолинил, пирролидинил, имидазо[1,2-а]пиридинил, морфолинилкарбонил, пирролидинилкарбонил, амино или циано;Het1 представляет собой моноциклический гетероциклический радикал, выбранный из группы,включающей пирролил, пиразолил, имидазолил, фуранил, тиенил, оксазолил, изоксазолил, тиазолил,тиадиазолил, изотиазолил, пиридинил, пиримидинил, пиразинил и пиридазинил; или бициклический гетероциклический радикал, выбранный из группы, включающей хинолинил, хиноксалинил, индолил, бензимидазолил, бензоксазолил, бензизоксазолил,бензотиазолил, бензизотиазолил, бензофуранил и бензотиенил; причем каждый гетероциклический радикал может быть необязательно замещен на любом атоме-5 010312 одним или несколькими радикалами, выбранными из группы, включающей галоген и алкил;Het2 представляет собой моноциклический гетероциклический радикал, выбранный из группы,включающей пирролидинил, диоксолил, имидазолидинил, пирразолидинил, пиперидинил, морфолинил,дитианил, тиоморфолинил, пиперазинил, имидазолидинил, тетрагидрофуранил, 2 Н-пирролил, пирролинил, имидазолинил, пирразолинил, пирролил, имидазолил, пиразолил, триазолил, фуранил, тиенил, оксазолил, изоксазолил, тиазолил, тиадиазолил, изотиазолил, пиридинил, пиримидинил, пиразинил, пиридазинил и триазинил; или бициклический гетероциклический радикал, выбранный из группы, включающей бензопиперидинил, хинолинил, хиноксалинил, индолил, изоиндолил, хроменил, бензимидазолил, имидазо[1,2-а]пиридинил, бензоксазолил, бензизоксазолил, бензотиазолил, бензизотиазолил, бензофуранил и бензотиенил; причем каждый гетероциклический радикал может быть необязательно замещен на любом атоме одним или несколькими радикалами, выбранными из группы, включающей Ar1, Ar1 алкил, галоген,гидрокси, алкил, пиперидинил, пирролил, тиенил, оксо, алкилокси, алкилоксиалкил и алкилоксикарбонил; и алкил представляет собой линейный или разветвленный насыщенный углеводородный радикал, содержащий от 1 до 6 атомов углерода, или циклические насыщенные углеводородные радикалы, содержащие от 3 до 6 атомов углерода, необязательно замещенные на одном или нескольких атомах углерода одним или несколькими радикалами, выбранными из группы, включающей фенил, галоген, циано, оксо,гидрокси, формил и амино. Более конкретно, изобретение относится к соединению общей формулы (I), его фармацевтически приемлемым аддитивным солям кислоты или основания, их стереохимически изомерным формам, формам N-оксида и пролекарству, где R1 представляет собой Ar1 метил и присоединен в положении 2, или R1 представляет собой Ar1 и присоединен в положении 3, как иллюстрируется в любой из следующих ниже формул для соединений формулы (I), где m и n равны 1, и Ar представляет собой незамещенный фенил. Предпочтительно, Ar1 представляет собой незамещенный фенильный радикал, и Ar1 метил представляет собой незамещенный бензильный радикал. Более конкретно, изобретение относится к соединению общей формулы (I), его фармацевтически приемлемым аддитивным солям кислоты или основания, их стереохимически изомерным формам, форпредставляет собой 3,5 мамR2-X-C(=Q)ди(трифторметил)фенилкарбонил. Более конкретно, изобретение относится к соединению общей формулы (I), его фармацевтически приемлемым аддитивным солям кислоты или основания, их стереохимически изомерным формам, формам N-оксида и пролекарству, где m и n оба равны 1. Более конкретно, изобретение относится к соединению общей формулы (I), его фармацевтически приемлемым аддитивным солям кислоты или основания, их стереохимически изомерным формам, формам N-оксида и пролекарству, где Z выбран из группы, включающей -СН 2-, С=O, -СН 2 СН 2- и-СН 2 С(=O)-, или где Z и R4, взятые вместе, образуют трехвалентный радикал =СН-С(=O)-. Более конкретно, изобретение относится к соединению общей формулы (I), его фармацевтически приемлемым аддитивным солям кислоты или основания, их стереохимически изомерным формам, формам W-оксида и пролекарству, где R4 выбран из группы, включающей водород, гидрокси и метокси. Более конкретно, изобретение относится к соединению общей формулы (I), его фармацевтически приемлемым аддитивным солям кислоты или основания, их стереохимически изомерным формам, формам N-оксида и пролекарству, где р равно 1. Более конкретно, изобретение относится к соединению общей формулы (I), его фармацевтически приемлемым аддитивным солям кислоты или основания, их стереохимически изомерным формам, формам N-оксида и пролекарству, где j равно 1, и к равно 0 или 1. Более конкретно, изобретение относится к соединению общей формулы (I), его фармацевтически приемлемым аддитивным солям кислоты или основания, их стереохимически изомерным формам, формам N-оксида и пролекарству, где Alk представляет собой ковалентную связь, -СН 2-, -СН(СН 3)-,-СН(фенил)-, -СН 2 СН(фенил)-или -СН 2 СН=СН-. Более конкретно, изобретение относится к соединению общей формулы (I), его фармацевтически приемлемым аддитивным солям кислоты или основания, их стереохимически изомерным формам, формам N-оксида и пролекарству, где L выбран из группы, включающей водород, алкил, алкилокси, Ar3 окси, моно- и ди(Ar3)амино, Ar3, Het2 и Het2 карбонил, и Ar3 и Het2 являются такими, как определено в формуле (I).-6 010312 Более конкретно, изобретение относится к соединению общей формулы (I), его фармацевтически приемлемым аддитивным солям кислоты или основания, их стереохимически изомерным формам, формам N-оксида и пролекарству, гдеn равно целому числу 1;m равно целому числу 1;Z представляет собой двухвалентный радикал -(СН 2)r-, где r равно 1 или 2, и где один радикал -СН 2 необязательно замещен С=O радикалом; илиR4 и Z, взятые вместе, образуют трехвалентный радикал =СН-(СН 2)r-1-, где r равно 2, и где один радикал -СН 2- необязательно замещен С=O радикалом; р равно целому числу 1;X представляет собой ковалентную связь;q равно целому числу 0;j равно целому числу 1;k равно целому числу 0 или 1;Y представляет собой ковалентную связь или двухвалентный радикал формулы С=O или -SO2-; каждый Alk независимо друг от друга представляет ковалентную связь; двухвалентный, линейный или разветвленный, насыщенный или ненасыщенный углеводородный радикал, содержащий от 1 до 6 атомов углерода; причем каждый радикал необязательно замещен на одном или нескольких атомах углерода фенильным радикалом;Ar3 представляет собой фенил, необязательно замещенный 1, 2 или 3 заместителями, независимо друг от друга выбранными из группы, включающей алкилокси, алкил, галоген и гидрокси;Het2 представляет собой моноциклический гетероциклический радикал, выбранный из группы,включающей тетрагидрофуранил, пирролил, имидазолил, пиразолил, фуранил, тиенил, изоксазолил, тиадиазолил, пиридинил, пиримидинил, пиразинил и пиридазинил; или бициклический гетероциклический радикал, выбранный из группы, включающей хинолинил, индолил, хроменил и бензимидазолил; причем каждый гетероциклический радикал может быть необязательно замещен на любом атоме одним или несколькими радикалами, выбранными из группы, включающей Ar1, галоген, алкил и оксо; и алкил представляет собой линейный или разветвленный насыщенный углеводородный радикал, содержащий от 1 до 6 атомов углерода, или циклические насыщенные углеводородные радикалы, содержащие от 3 до 6 атомов углерода. В рамках данной заявки "алкил" определяют как одновалентный линейный или разветвленный насыщенный углеводородный радикал, содержащий от 1 до 6 атомов углерода, например, метил, этил, пропил, бутил, 1-метил-пропил, 1,1-диметилэтил, пентил, гексил; далее "алкил" определяют как одновалентный циклический насыщенный углеводородный радикал, содержащий от 3 до 6 атомов углерода, например, циклопропил, метилциклопропил, циклобутил, циклопентил и циклогексил. Определение "алкил" также включает алкильный радикал, который необязательно замещен на одном или нескольких атомах углерода одним или более фенильным, галогеном, циано, оксо, гидрокси, формильным или аминорадикалами, например, гидроксиалкил, в частности, гидроксиметил и гидроксиэтил, и полигалогеналкил, в частности, дифторметил и трифторметил. В рамках данной заявки "галоген" является общим названием для фтора, хлора, брома и йода. В рамках данной заявки термин "соединения по изобретению" означает соединение общей формулы(I), его фармацевтически приемлемые аддитивные соли кислоты или основания, их стереохимически изомерные формы, форму N-оксида и пролекарство. В рамках данной заявки, особенно в группе Alka-Y-Alkb в формуле (I), где два или более последовательных элементов указанной группы означают ковалентную связь, тогда обозначается простая ковалентная связь. Например, когда Alka и Y означают ковалентные связи, и Alkb означает -CH2-, тогда группа Alka-Y-Alkb означает -СН 2-. Аналогично, если каждый из Alka, Y и Alkb означает ковалентную связь, иL означает Н, тогда группа Alkа-Y-Alkb-L представляет -Н. Фармацевтически приемлемые соли, как определено, включают терапевтически активные нетоксичные формы аддитивных солей кислоты, которые способны образовать соединения формулы (I). Указанные соли можно получить обработкой основной формы соединений формулы (I) соответствующими кислотами, например, неорганическими кислотами, например, галогенводородной кислотой, в частности,хлористо-водородной кислотой, бромисто-водородной кислотой, серной кислотой, азотной кислотой и-7 010312 фосфорной кислотой; органическими кислотами, например, уксусной кислотой, гидроксиуксусной кислотой, пропионовой кислотой, молочной кислотой, пировиноградной кислотой, щавелевой кислотой,малоновой кислотой, янтарной кислотой, малеиновой кислотой, фумаровой кислотой, яблочной кислотой, винной кислотой, лимонной кислотой, метансульфоновой кислотой, этансульфоновой кислотой,бензолсульфоновой кислотой, п-толуолсульфоновой кислотой, цикламовой кислотой, салициловой кислотой, п-аминосалициловой кислотой и памовой кислотой. Соединения формулы (I), содержащие кислотные протоны, также можно преобразовывать в их терапевтически активные нетоксичные формы аддитивных солей металлов или аминов обработкой соответствующими органическими и неорганическими основаниями. Соответствующие формы основных солей включают, например, соли аммония, соли щелочных и щелочно-земельных металлов, в частности,соли лития, натрия, калия, магния и кальция, соли с органическими основаниями, например, соли бензатина, N-метил-D-глюкамина, соли гибрамина и соли с аминокислотами, например аргинином и лизином. Наоборот, указанные солевые формы можно преобразовывать в свободные формы обработкой соответствующим основанием или соответствующей кислотой. Термин "аддитивная соль", используемый в рамках данной заявки, также включает сольваты, которые способно образовать соединение формулы (I), а также его соли. Такими сольватами являются, например, гидраты и алкоголяты.N-оксидные формы соединений формулы (I), как имеется в виду, включают такие соединения формулы (I), где один или несколько атомов азота окислены в так называемый N-оксид, в частности, те Nоксиды, где один или несколько третичных азотов (например, пиперазинильного или пиперидинильного радикала) являются N-окисленными. Такие N-оксиды может легко получить специалист в данной области без опыта изобретательства, и они являются очевидной альтернативой соединений формулы (I), поскольку данные соединения являются метаболитами, которые образуются при окислении в организме человека при поглощении. Как общеизвестно, окисление обычно является первой стадией, вовлеченной в метаболизм лекарственного вещества (Textbook of Organic Medicinal and Pharmaceutical Chemistry, 1977,pp.70-75). Как является общеизвестным, метаболическую форму соединения также можно вводить человеку вместо самого соединения почти с такими же эффектами. Соединения по изобретению обладают по меньшей мере 2 способными к окислению азотами (группы третичных аминов). Следовательно, весьма вероятно, что N-оксиды должны образовываться при метаболизме у человека. Соединения формулы (I) можно преобразовывать в соответствующие N-оксидные формы, следуя известным в данной области методам превращения трехвалентного азота в его N-оксидные формы. Указанную реакцию N-окисления, как правило, можно осуществить взаимодействием исходного вещества формулы (I) с соответствующим органическим или неорганическим пероксидом. Соответствующие неорганические пероксиды включают, например, пероксид водорода, пероксиды щелочных или щелочноземельных металлов, например, пероксид натрия, пероксид калия; соответствующие органические пероксиды могут включать надкислоты, такие как, например, бензолкарбопероксикислоту или галогензамещенную бензолкарбопероксикислоту, например 3-хлорбензолкарбопероксикислоту, пероксиалкановые кислоты,например пероксиуксусную кислоту,алкилгидропероксиды,например,третбутилгидропероксид. Подходящим растворителями являются, например, вода, низшие спирты, например, этанол и аналогичные, углеводороды, например, толуол, кетоны, например, 2-бутанон, галогенированные углеводороды, например дихлорметан и смеси таких растворителей. Используемый выше термин "стереохимически изомерные формы" означает все возможные изомерные формы, которые могут иметь соединения формулы (I). Если не указано или продемонстрировано иное, химическое название соединений обозначает смесь всех возможных стереохимически изомерных форм, причем указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. Более конкретно, стереогенные центры могут иметь R- или S-конфигурацию; заместители на двухвалентных циклических (частично) насыщенных радикалах могут иметь цис-, либо трансконфигурацию. Соединения, имеющие двойные связи, могут иметь Е или Z-стереохимию на указанной двойной связи. Очевидно, что стереохимически изомерные формы соединений формулы (I) охватываются объемом данного изобретения. Следуя правилам номенклатуры CAS, когда в молекуле присутствуют два стереогенных центра известной абсолютной конфигурации, R или S идентификатор приписывают (основываясь на правиле последовательности Кана-Ингольда-Прелога) нижайшему пронумерованному хиральному центру, референсному центру. R и S показывают оптически чистые стереогенные центры с неопределенной абсолютной конфигурацией. Если используют и , положение заместителя наиболее высокого приоритета на асимметричном атоме углерода в циклической системе, имеющее низший номер цикла, находится произвольно всегда в положении от средней плоскости, определяемой циклической системой. Положение заместителя наиболее высокого приоритета на другом асимметричном атоме углерода в циклической системе (атом водорода в соединениях формулы (I относительно положения заместителя наиболее высокого приоритета на референсном атоме обозначают , если он расположен на той же стороне-8 010312 от средней плоскости, определяемой циклической системой, или , если он расположен на противоположной стороне от средней плоскости, определяемой циклической системой. Соединения формулы (I) и некоторые промежуточные соединения имеют по меньшей мере два стереогенных центра в своей структуре. Изобретение также включает производные соединения (обычно называемые "пролекарствами") фармакологически активных соединений по изобретению, которые распадаются in vivo, давая соединения по изобретению. Пролекарства обычно (но не всегда) обладают меньшей эффективностью к целевому рецептору, чем соединения, на которые они распадаются. Пролекарства особенно полезны, когда желаемое соединение имеет химические или физические свойства, которые делают их введение затрудненным или неэффективным. Например, желаемое соединение может быть просто плохо растворимо, оно может плохо переносится через эпителий слизистой оболочки или оно может иметь нежелательно короткое время полужизни в плазме. Дальнейшее обсуждение пролекарств можно найти у Stella, V.J. et al., в"Prodrugs", Drug Delivery Systems, 1985, pp.112-176, и Drugs, 1985, 29, pp.455-473. Пролекарственные формы фармакологически активных соединений по изобретению обычно будут представлять собой соединения формулы (I), их фармацевтически приемлемые аддитивные соли кислоты или основания, их стереохимически изомерные формы и N-оксидные формы, содержащие кислотную группу, которая этерифицирована или амидирована. Включенными в такие этерифицированные кислотные группы являются группы формулы -COORx, где Rx представляет собой C1-6 алкил, фенил, бензил или одну из следующих ниже групп: Амидированные группы включают группы формулы -CONRyRz, где Ry представляет собой Н, C1-6 алкил, фенил или бензил, и Rz представляет собой -ОН, Н, С 1-6 алкил, фенил или бензил. Соединения по изобретению, имеющие аминогруппу, могут быть модифицированы кетоном или альдегидом, таким как формальдегид, с образованием основания Манниха. Данное основание будет гидролизоваться с кинетикой первого порядка в водном растворе. Соединения формулы (I), полученные в способах, описанных ниже, можно синтезировать в форме рацемических смесей энантиомеров, которые можно отделить один от другого, следуя известным в данной области методам. Рацемические соединения формулы (I) можно преобразовывать в соответствующие формы диастереомерных солей взаимодействием с подходящей хиральной кислотой. Указанные диастереомерные солевые формы затем разделяют, например, селективной или фракционированной кристаллизацией, и энантиомеры выделяют обработкой щелочью. Альтернативный метод разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию с использованием хиральной стационарной фазы. Указанные чистые стереохимически изомерные формы можно также получить из соответствующих чистых стереохимически изомерных форм соответствующих исходных веществ, при условии, что реакция протекает стереоспецифически. Предпочтительно, если желательным является конкретный стереоизомер, указанное соединение синтезируют стереоспецифическими способами получения. В данных способах преимущественно будут использоваться энантиомерно чистые исходные вещества. Фармакология Соединения по настоящему изобретению являются сильными ингибиторами эффектов, опосредованных нейрокининами, в частности эффектов, опосредованных NK1 и NK3 рецепторами, и следовательно могут описываться в качестве нейрокининовых антагонистов, особенно в качестве антагонистов вещества Р, как может быть показано in vitro антагонизмом вызванной веществом Р релаксации коронарных артерий свиньи. Аффинность связывания настоящих соединений с нейрокининовыми рецепторами человека, морской свинки и песчанки также можно определить in vitro в тесте рецепторного связывания с использованием 3 Н-вещества-Р в качестве радиолиганда. Соединения, являющиеся предметом изобретения, также показывают антагонистическую активность по отношению к веществу Р in vivo, о чем может свидетельствовать, например, антагонизм вызванной веществом Р экстравазации плазмы у морских свинок, или антагонизм вызванной приемом лекарственных веществ рвоты у хорьков (Watson et al., Br. J.Pharmacol. 115:84-94 (1995. Принимая во внимание их способность противодействовать действию тахикининов, блокируя нейрокининовые рецепторы, и, в частности, блокируя NK1 и NK3 рецептор, соединения по изобретению полезны в качестве лекарственного средства, в частности, для профилактики и терапевтического лечения опосредованных тахикининами состояний. В частности, соединения по изобретению полезны в качестве перорально активных, центрально проникающих лекарственных средств для профилактики и терапевтического лечения опосредованных тахикининами состояний. Более конкретно, было обнаружено, что некоторые соединения показывают объединеннуюNK1/NK3 антагонистическую активность, как можно видеть из таблиц в экспериментальном разделе.-9 010312 Следовательно, изобретение относится к соединению общей формулы (I), его фармацевтически приемлемым аддитивным солям кислоты или основания, их стереохимически изомерным формам, формам N-оксида и пролекарству для применения в качестве лекарственного средства. Изобретение также относится к применению соединения общей формулы (I), его фармацевтически приемлемых аддитивных солей кислоты или основания, их стереохимически изомерных форм, форм Nоксида и пролекарства для изготовления лекарственного средства для лечения, профилактического, либо терапевтического, либо того и другого, состояний, опосредованных нейрокининами. Соединения по изобретению полезны для лечения расстройств ЦНС, в частности, депрессии, тревожных расстройств, связанных со стрессом расстройств, нарушений сна, расстройства познавательной способности, расстройств личности, шизоаффективных расстройств, расстройств пищевого поведения,нейродегенеративных заболеваний, наркологических расстройств, расстройств настроения, сексуальных дисфункций, боли и других связанный с ЦНС состояний; воспаления; аллергических заболеваний; рвоты; желудочно-кишечных расстройств, в частности, синдрома раздраженного кишечника (СРК); заболеваний кожи; вазоспастических заболеваний; фиброзов и коллагеновой болезни; заболеваний, связанных с иммунологическим усилением или подавлением иммунитета, ревматических заболеваний и регуляции массы тела. В частности, соединения по изобретению также полезны для лечения или профилактики депрессии,включая, но не ограничиваясь этим, большую депрессию, включая биполярную депрессию; однополярную депрессию; одиночные или рецидивные эпизоды большой депрессии с психотическими проявлениями или без них, кататоническими проявлениями, меланхолическими проявлениями, атипическими проявлениями или послеродовым началом и, в случае рецидивных эпизодов, с сезонным характером или без него. Другие расстройства настроения, охватываемые термином "большое депрессивное расстройство" включают дистимическое расстройство с ранним или поздним началом и с присутствием или отсутствием атипических проявлений, биполярное расстройство I, биполярное расстройство II, циклотимию, рекуррентное кратковременное депрессивное расстройство, смешанное аффективное расстройство,невротическую депрессию, нарушения, вызванные посттравматическим стрессом и социальную фобию; деменцию альцгеймеровского типа с ранним или поздним началом, с подавленным настроением; сосудистую деменцию с подавленным настроением; расстройства настроения, вызванные различными веществами, такие как расстройства настроения, вызванные алкоголем, амфетаминами, кокаином, галлюциногенами, средствами для ингаляции, опиоидами, фенциклидином, седативными препаратами, снотворными средствами, анксиолитиками и другими веществами; шизоаффективное расстройство депрессивного типа и расстройство адаптации с подавленным настроением. Основные депрессивные расстройства могут проистекать из общего медицинского состояния, включая, но не ограничиваясь этим, инфаркт миокарда, диабет, самопроизвольный аборт или прерывание беременности и т.д. В частности, соединения по изобретению полезны для лечения или профилактики тревожного расстройства, включая, но не ограничиваясь этим, острое тревожное состояние с реакцией паники; агорафобию; расстройства панического типа без агорафобии; агорафобию без истории болезни, связанной с расстройствами панического типа; специфическую фобию; социальную фобию; обсессивно-компульсивное расстройство; нарушение, вызванное посттравматическим стрессом; нарушение, вызванное острым стрессом; генерализованное тревожное расстройство; тревожное расстройство, обусловленное общим медицинским состоянием; тревожное расстройство, вызванное приемом веществ, и не уточненное тревожное расстройство. В частности, соединения по изобретению также полезны для лечения или профилактики расстройств, связанных со стрессом, связанных с депрессией и/или тревогой, включая, но не ограничиваясь этим, острую стрессовую реакцию; расстройства адаптации, такие как краткая депрессивная реакция,затяжная депрессивная реакция, смешанная тревожная и депрессивная реакция, расстройство адаптации с преобладающим нарушением других эмоций, расстройство адаптации с преобладающим нарушением поведения, расстройство адаптации со смешанным нарушением эмоций и поведения и расстройство адаптации с другими уточненными преобладающими симптомами; и другие реакции на сильный стресс. В частности, соединения по изобретению также полезны для лечения или профилактики нарушений сна, включая, но не ограничиваясь этим, дисомнию и/или парасомнию в качестве первичных нарушений сна; бессонницу, апноэ во сне; нарколепсию; нарушение циркадного ритма; нарушения сна, связанные с другой психической болезнью; нарушение сна, обусловленное общим медицинским состоянием и нарушение сна, вызванное приемом веществ. В частности, соединения по изобретению также полезны для лечения или профилактики расстройства познавательной способности, включая, но не ограничиваясь этим, деменцию; амнестические расстройства и неуточненные расстройства познавательной способности, в особенности деменцию, вызванную дегенеративными расстройствами, патологическими изменениями, травмой, инфекциями, сосудистыми нарушениями, токсинами, аноксией, дефицитом витаминов или эндокринными расстройствами; деменцию Альцгеймеровского типа, с ранним или поздним наступлением, с подавленным настроением; деменцию, связанную со СПИД или амнестические расстройства, вызванные алкоголем или другими причинами дефицита тиамина, двухсторонним повреждением височной доли большого мозга вследствие- 10010312 простого герпетического энцефалита и другого лимбического энцефалита, нейронной потерей после аноксии/гипогликемии/сильных конвульсий и хирургическим вмешательством, дегенеративными расстройствами, васкулярными расстройствами и патологией вокруг желудочка III. Кроме того, соединения по изобретению также полезны в качестве усилителей памяти или познавательной способности у здоровых людей с отсутствием дефицита познавательной способности и/или памяти. В частности, соединения по изобретению также полезны для лечения или профилактики расстройства личности, включая, но не ограничиваясь этим, параноидное расстройство личности; шизоидное расстройство личности; шизотипическое расстройство личности; асоциальное расстройство личности; пограничное расстройство личности; мимическое раздвоение личности; нарциссическое беспокойство индивида; неконтактное расстройство личности; эмоционально зависимое расстройство личности; обсессивно-компульсивное расстройство личности и неуточненное расстройство личности. В частности, соединения по изобретению также полезны для лечения или профилактики шизоаффективных расстройств, в результате различных причин, включая шизоаффективные расстройства маниакального типа, депрессивного типа, смешанного типа; параноидную, спонтанную, кататоническую,недифференцированную или остаточную шизофрению; шизофреноподобное расстройство; шизоаффективное расстройство; бредовое расстройство; кратковременное психотическое расстройство; общее психотическое расстройство; психотическое расстройство, вызванное приемом лекарственных веществ; и неустановленное психотическое расстройство. В частности, соединения по изобретению также полезны для лечения или профилактики расстройств пищевого поведения, включая нервную анорексию; атипичную нервную анорексию; нейрогенную булимию; атипичную нейрогенную булимию; переедание, связанное с другими психологическими отклонениями; рвоту, связанную с другими психологическими отклонениями, и не охарактеризованные расстройства питания. В частности, соединения по изобретению также полезны для лечения или профилактики нейродегенеративных заболеваний, включая, но не ограничиваясь этим, болезнь Альцгеймера; хорею Гентингтона; болезнь Крейтцвельда-Якоба; болезнь Пика; демиелинизирующие заболевания, такие как рассеянный склероз и боковой амиотрофический склероз; другие невропатии и невралгии; рассеянный склероз; боковой амиотрофический склероз; инсульт и травму головы. В частности, соединения по изобретению также полезны для лечения или профилактики привыкания, включая, но не ограничиваясь этим, зависимость от употребления веществ или неправильного употребления лекарства с наличием или отсутствием психологической зависимости, в частности, когда вещество представляет собой алкоголь, амфетамины, амфетаминоподобные вещества, кофеин, кокаин, галлюциногены, средства для ингаляции, никотин, опиоиды (такие как марихуана, героин и морфин), фенциклидин, фенциклидиноподобные вещества, седативно-снотворные вещества, бензодиазепины и/или другие вещества, в частности, полезны для лечения отмены приема вышеуказанных веществ и делириозного синдрома при отмене приема алкоголя. В частности, соединения по изобретению также полезны для лечения или профилактики расстройств настроения, вызванных, в частности, алкоголем, амфетаминами, кофеином, марихуаной, кокаином, галлюциногенами, средствами для ингаляции, никотином, опиоидами, фенциклидином, седативными, снотворными, анксиолитическими и другими веществами. В частности, соединения по изобретению также полезны для лечения или профилактики сексуальной дисфункции, включая, но не ограничиваясь этим, расстройство сексуального желания; расстройства сексуального возбуждения, расстройство оргазма; болевые сексуальные расстройства; сексуальную дисфункцию, обусловленную общим медицинским состоянием; сексуальную дисфункцию, вызванную приемом веществ, и неуточненную сексуальную дисфункцию. В частности, соединения по изобретению также полезны для лечения или профилактики боли,включая, но не ограничиваясь этим, травматическую боль, такую как послеоперационную боль; боль травматического разрыва, такую как плечевой плексит; хроническую боль, такую как вызванную панкреатитом хроническую боль, или артритную боль, такую как встречающуюся при остео-, ревматоидном и псориатическом артрите; невропатическую боль, такую как пост-герпетическая невралгия, невралгия тройничного нерва, сегментарная или межреберная невралгия, фибромиалгия, каузалгия, периферийная невропатия, диабетическая невропатия, невропатия, вызванная химиотерапией, невропатия, связанная со СПИД, затылочная невралгия, невралгия лицевого нерва, глоссофарингеальная невралгия, симпатическая рефлекторная дистрофия и боль от ампутированной конечности; различные формы головной боли,такие как мигрень, острая и хроническая тензионная головная боль, височно-челюстная боль, боль верхнечелюстной пазухи и гистаминовая головная боль; зубную боль; боль при раке; висцеральную боль; желудочно-кишечную боль; боль от ущемления нерва; боль от спортивной травмы; дисменорею, менструальную боль; менингиты; арахноидит; скелетно-мышечную боль; боль в спине, такую как стеноз позвоночного канала, выпадение межпозвоночного диска, невралгия седалищного нерва, ангина, анкилозирующий спондилит; подагру; ожог; рубцовую боль, зуд и травматическую боль, такую как таламическая боль после инсульта. В частности, соединения по изобретению также полезны для лечения или профилактики следую- 11010312 щих других связанных с ЦНС состояний: акинезии, акинетико-ригидного синдрома, дискинезии и вызванного лекарственными препаратами паркинсонизма, синдрома Жиля де ла Туретта и его симптомов,тремора, хореи, миоклонуса, тика и дистонии, синдрома дефицита внимания и гиперактивности (СДВГ),болезни Паркинсона, паркинсонизма, вызванного лекарственным средством, послеэнцефалитного паркинсонизма, прогрессирующего супрануклеарного паралича, множественной системной атрофии, кортикобазальной дегенерации, комплекса паркинсонизм - боковой амиотрофический склероз и кальцификацию подкорковых узлов, нарушений поведения и кондуктивных расстройств при деменции и у умственно отсталых, включая дисфорию и ажитацию, экстрапирамидальных расстройств движения, синдрома Дауна и акатизии. В частности, соединения по изобретению также полезны для лечения или профилактики воспаления, включая, но не ограничиваясь этим, воспалительные состояния при астме, гриппе, хроническом бронхите и ревматоидном артрите; воспалительные состояния желудочно-кишечного тракта, такие как болезнь Крона, язвенный колит, воспалительные заболевания кишечника и поражение, вызванное нестероидным противовоспалительным лекарственным средством, но не ограничиваясь этим; воспалительные состояния кожи, такие как герпес и экзема; воспалительные состояния мочевого пузыря, такие как цистит и неотложное недержание мочи; воспаления глаз и воспаление зубов, и панкреатит, в частности, хронический и острый панкреатит. В частности, соединения по изобретению также полезны для лечения или профилактики аллергических заболеваний, включая, но не ограничиваясь этим, аллергические заболевания кожи, такие как крапивница, но не ограничиваясь этим; аллергические заболевания дыхательных путей, такие как ринит, но не ограничиваясь этим. В частности, соединения по изобретению также полезны для лечения или профилактики рвоты, т.е. тошноты, позыва на рвоту и рвоты, включая, но не ограничиваясь этим, острую рвоту, отложенную рвоту и преждевременную рвоту; рвоту, вызванную лекарственными препаратами, например химиотерапевтическими веществами, такими как алкилирующие агенты, например, циклофосфамидом, кармустином,ломустином и хлорамбуцилом; цититоксическими антибиотиками, например, дактиномицином, доксорубицином, митомицином-С и блеомицином; антиметаболитами, например, цитарабином, метотрексатом и 5-фтороурацилом; алкалоидами барвинка, например, этопосидом, винбластином и винкристином; и другими лекарственными веществами, такими как цисплатин, дакарбазин, прокарбазин и гидроксимочевина; и их комбинациями; лучевой болезнью; радиотерапией, например, при лечении рака; ядами; токсинами,например, токсинами, вызванными нарушением обмена веществ или инфекцией, например, гастритом,или выделяющимися вследствие бактериальной или вирусной желудочно-кишечной инфекции; беременностью; расстройствами вестибулярного аппарата, такими как морская болезнь, головокружение, вертиго и болезнь Меньера; послеоперационной тошнотой; обструкцией желудочно-кишечного тракта; пониженной моторикой пищеварительного тракта; висцеральной болью, такой как при инфаркте миокарда или перитоните; мигренью; повышенным внутричерепным давлением; пониженным внутричерепным давлением (например, при высотной болезни); опиоидными обезболивающими, такими как морфин; гастроэзофагеальной рефлюксной болезнью, изжогой; неумеренностью в еде или питья; кислым желудком; изжогой/регургитацией, изжогой, такой как эпизодическая изжога, ночная изжога и вызванная металлами изжога; и диспепсией. В частности, соединения по изобретению также полезны для лечения или профилактики желудочно-кишечных заболеваний, включая, но не ограничиваясь ими, синдром раздраженного кишечника(СРК), заболевания кожи, такие как псориаз, зуд и солнечная эритема; вазоспастических заболеваний,таких как ангина, сосудистая головная боль и болезнь Рейно, ишемия головного мозга, такая как спазм мозговых сосудов с последующим субарахноидальным кровоизлиянием; фиброзов и коллагеновой болезни, таких как склеродерма и эозинофильный фасциолез; расстройств, связанных с иммунологической активацией или ослаблением иммунитета, таких как системная красная волчанка, и ревматических заболеваний, таких как фиброзит; кашля; и регуляции массы тела, включая ожирение. Более конкретно, соединения по изобретению полезны для изготовления лекарственного средства для лечения и/или профилактики шизофрении, рвоты, тревоги и депрессии, синдрома раздраженного кишечника (СРК), нарушения циркадного ритма, пре-эклампсии, ноцицепции, боли, в частности, висцеральной и невропатической боли, панкреатита, нейрогенного воспаления, астмы, хронического обструктивного заболевания легких (ХОЗЛ) и расстройств мочеиспускания, таких как недержание мочи. Настоящее изобретение также относится к способу лечения и/или профилактики заболеваний, опосредованных нейрокининами, в частности, лечения и/или профилактики шизофрении, рвоты, тревоги и депрессии, синдрома раздраженного кишечника (СРК), нарушения циркадного ритма, пре-эклампсии,ноцицепции, боли, в частности, висцеральной и невропатической боли, панкреатита, нейрогенного воспаления, астмы, хронического обструктивного заболевания легких (ХОЗЛ) и расстройств мочеиспускания, таких как недержание мочи, включающему введение человеку, нуждающемуся в таком введении,эффективного количества соединения по изобретению, в частности, соединения формулы (I), его фармацевтически приемлемых аддитивных солей кислоты или основания, их стереохимически изомерных форм, форм N-оксида, а также их пролекарств.- 12010312 Изобретение также относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель и, в качестве активного ингредиента, терапевтически эффективное количество соединения по изобретению, в частности, соединения формулы (I), его фармацевтически приемлемых аддитивных солей кислоты или основания, их стереохимически изомерных форм, форм N-оксида, а также их пролекарств. Соединения по изобретению, в частности, соединения формулы (I), его фармацевтически приемлемые аддитивные соли кислоты или основания, их стереохимически изомерные формы, формы N-оксида и их пролекарства, или любая их подгруппа или комбинация могут быть составлены в различные фармацевтические формы для целей введения. В качестве подходящих композиций можно процитировать все композиции, обычно применяемые для систематически вводимых лекарственных веществ. Для приготовления фармацевтических композиций по данному изобретению эффективное количество конкретного соединения, необязательно в форме аддитивной соли, в качестве активного ингредиента объединяют в однородную смесь с фармацевтически приемлемым носителем, причем носитель может принимать разнообразные формы в зависимости от формы препарата, желаемого для введения. Данные фармацевтические композиции желательны в единичной дозированной форме, подходящей, в частности, для введения перорально, ректально, через кожу, парентеральной инъекцией или ингаляцией. Например, при приготовлении композиций в пероральной дозированной форме можно использовать любую обычную фармацевтическую среду, такую как, например, вода, гликоли, масла, спирты и аналогичное в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара, каолин, разбавители, лубриканты, связующие вещества, дезинтегранты, и аналогичные в случае порошков, пилюль, капсул и таблеток. Из-за простоты введения таблетки и капсулы представляют наиболее выгодные пероральные дозированные единичные формы, причем в данном случае, очевидно, используют твердые фармацевтические носители. Для парентеральных композиций носитель обычно включает стерильную воду, по меньшей мере, в большей части, хотя могут быть включены другие ингредиенты, например, для содействия растворимости. Можно приготовить, например, растворы для инъекций, в которых носитель включает физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Также можно приготовить суспензии для инъекций, и в данном случае можно использовать подходящие жидкие носители, суспендирующие агенты и аналогичное. Также включенными являются препараты в твердой форме, которые предназначены,незадолго перед применением, для превращения в препараты в жидкой форме. В композициях, подходящих для чрескожного введения носитель необязательно включает вещество для усиления проницаемости и/или подходящий увлажняющий агент, необязательно в сочетании с подходящими добавками любой природы в меньших пропорциях, причем добавки не оказывают значительного вредного влияния на кожу. Указанные добавки могут облегчать введение на кожу и/или могут быть полезными для приготовления желаемых композиций. Данные композиции можно вводить различными путями, например, в виде трансдермального пластыря, местно, в виде мази. Особенно выгодно составлять рецептуру вышеуказанной фармацевтической композиции в виде единичной дозированной формы для простоты введения и единообразия дозы. Используемый в данном описании термин "единичная дозированная форма" относится к физически дискретным единицам, подходящим в качестве стандартных доз, причем каждая единица содержит предварительно определенное количество активного ингредиента, вычисленное для получения желаемого терапевтического эффекта, в сочетании с требующимся фармацевтическим носителем. Примерами таких единичных дозированных форм являются таблетки (включая таблетки без покрытия и с покрытием), капсулы, пилюли, пакетики с порошком, капсулы, суппозитории, растворы или суспензии для инъекций и аналогичное, и их отдельные множества. Поскольку соединения по изобретению представляют собой сильные перорально вводимые антагонисты NK1 и NK1/NK3, фармацевтические композиции для перорального введения, включающие указанные соединения, являются особенно выгодными. Синтез Соединения по изобретению обычно можно получить последовательностью стадий, каждая из которых известна специалисту в данной области. Соединение формулы (I) легко получают восстановительным N-алкилированием промежуточного соединения формулы (II), где R1, R2, R4, X, Q, m, n, p и Z являются такими, как определено в формуле (I),N-замещенным пиперидиноном формулы (III), где R1, Alk, Y, L, j, k и q являются такими, как определено в формуле (I). Указанное восстановительное N-алкилирование можно осуществить в инертном по отношению к реакции растворителе, таком как, например, дихлорметан, этанол или толуол или их смесь, и в присутствии соответствующего восстановителя, такого как, например, боргидрид, например, боргидрид натрия, цианоборгидрид натрия или триацетоксиборгидрид. В случае, когда в качестве восстановителя используют боргидрид, может быть удобно использовать комплексообразующий агент, такой как, например, изопропилат титана (IV), как описано в J. Org. Chem., 1990, 55, 2552-2554. Использование указанного комплексообразующего агента может также привести к улучшенному цис/транс отношению в пользу транс-изомера. Также может оказаться удобным использовать в качестве восстановителя водород- 13010312 в комбинации с подходящим катализатором, таким как, например, палладий на древесном угле или платина на древесном угле. В случае, когда в качестве восстановителя используют водород, может оказаться выгодным добавить к реакционной смеси дегидратирующее вещество, такое как, например, третбутоксид алюминия. Чтобы предотвратить нежелательное дополнительное гидрирование определенных функциональных групп в реагирующих веществах и продуктах реакции, также может оказаться выгодным добавить к реакционной смеси соответствующий каталитический яд, например, тиофен или хинолин-серу. Перемешивание и необязательно повышенные температуры и/или давление могут увеличить скорость реакции. В данном и следующих далее способах получения продукты реакции можно выделить из реакционной среды и, если необходимо, дополнительно очистить, следуя методам, обычно известным в данной области, таким как, например, экстракция, кристаллизация, растирание и хроматография. Особенно выгодным является получение соединения по изобретению в соответствии с предшествующей реакционной схемой, в которой Alk-Y-Alk-L-группа представляет собой бензил, таким образом,приводя к соединению формулы (I), в котором Alk-Y-Alk-L-группа представляет собой бензил. Указанное соединение является фармакологически активным и может быть конвертировано в соединение по изобретению, где Alk-Y-Alk-L-группа представляет собой водород, восстановительным гидрированием с использованием, например, водорода в качестве восстановителя в сочетании с подходящим катализатором, таким как, например, палладий на древесном угле или платина на древесном угле. Полученное в результате соединение по изобретению затем можно преобразовывать в другие соединения по изобретению известными в данной области превращениями, например, ацилированием и алкилированием. В частности, соединения формулы (Ia) можно получить взаимодействием конечного соединения формулы (I'), где R1, R2, R4, X, Q, Z, m, n, p и q являются такими, как определено в формуле (I), с ацильным соединением формулы (V), где Alk и L являются такими, как определено в формуле (I), и W1 представляет собой соответствующую уходящую группу, такую как, например, галоген, например, хлор или бром, или уходящую сульфонилоксигруппу, например, метансульфонилокси или бензолсульфонилокси. Реакцию можно осуществить в инертном по отношению к реакции растворителе, таком как, например,хлорированный углеводород, например, дихлорметан, спирт, например, этанол, или кетон, например,метилизобутилкетон, и в присутствии подходящего основания, такого как, например, карбонат натрия,гидрокарбонат натрия или триэтиламин. Перемешивание может увеличить скорость реакции. Реакцию можно легко осуществить при температуре, находящейся в диапазоне от комнатной температуры до температуры дефлегмации. Альтернативно, соединение формулы (Ia) также можно получить взаимодействием конечного соединения формулы (I'), где R1, R2, R4, X, Q, Z, m, n, p и q являются такими, как определено в формуле (I),с карбоновой кислотой формулы (VI), где Alk и L являются такими, как определено в формуле (I), (катализируемой основанием реакцией нуклеофильного присоединения). Данную реакцию можно осуществить в инертном по отношению к реакции растворителе, таком как, например, хлорированный углеводород, например, дихлорметан, спирт, например, этанол, или кетон, например, метилизобутилкетон, и в присутствии подходящего основания, такого как, например, карбонат натрия, гидрокарбонат натрия или триэтиламин. Перемешивание может увеличить скорость реакции. Реакцию можно легко осуществить при температуре, находящейся в диапазоне от комнатной температуры до температуры дефлегмации. Вышеуказанную реакцию также можно осуществить в эквивалентных условиях со сложным эфиром карбоновой кислоты формулы (VI).- 14010312 В частности, соединение формулы (Ib) можно получить взаимодействием конечного соединения формулы (I'), где R1, R2, R4, X, Q, Z, m, n, p и q являются такими, как определено в формуле (I), с кетосоединением формулы (VII), где Alk и L являются такими, как определено в формуле (I), и W2 представляет собой соответствующую уходящую группу, такую как, например, галоген, например, хлор или бром, или уходящую сольфонилоксигруппу, например, метансульфонилокси или бензолсульфонилокси. Реакцию можно осуществить в инертном по отношению к реакции растворителе, таком как, например,хлорированный углеводород, например дихлорметан, спирт, например, этанол, или кетон, например, метилизобутилкетон, и в присутствии подходящего основания, такого как, например, карбонат натрия, гидрокарбонат натрия или триэтиламин. Перемешивание может увеличить скорость реакции. Реакцию можно легко осуществить при температуре, находящейся в диапазоне от комнатной температуры до температуры дефлегмации. Соединение формулы (Ic) можно получить восстановительным аминированием/алкилированием конечного соединения формулы (I'), где R1, R2, R4, X, Q, Z, m, n, p и q являются такими, как определено в формуле (I), соединением формулы (VIII), где Alk и L являются такими, как определено в формуле (I), иW3 представляет собой соответствующую уходящую группу, такую как, например, галоген, например,хлор или бром, или уходящую сольфонилоксигруппу, например, метансульфонилокси или бензолсульфонилокси. Реакцию можно осуществить в инертном по отношению к реакции растворителе, таком как,например, хлорированный углеводород, например, дихлорметан, спирт, например, этанол, или кетон,например, метилизобутилкетон, и в присутствии подходящего основания, такого как, например, карбонат натрия, гидрокарбонат натрия или триэтиламин. Перемешивание может увеличить скорость реакции. Реакцию можно легко осуществить при температуре, находящейся в диапазоне от комнатной температуры до температуры дефлегмации. Исходные вещества и некоторые промежуточные соединения являются известными соединениями,и они коммерчески доступны или их можно получить обычными реакционными способами, известными в данной области. Получение промежуточных соединений, между прочим, описано в экспериментальной секции, в WO 97/16440-A1, опубликованной 9 мая 1997 Janssen Pharmaceutica N.V., которая включена в данное описание посредством ссылки, также как в других публикациях, указанных в WO 97/16440-A1,таких как, например, ЕР-0 532 456-А. Соединения по изобретению можно преобразовывать друг в друга, следуя известным в данной области реакциям превращения, например, как иллюстрируются далее. Более конкретно, соединения формулы (XIII), где А представляет собой арил или гетероарил, K может быть любой группой, предпочтительно, группой K1, как определено ниже, Het представляет собой ненасыщенный гетероарил и r равно целому числу в диапазоне от 1 до числа, равного количеству имеющихся атомов углерода в арильной или гетероарильной группе А, например, 5 в фениле и 4 в пирролиле,можно получить реакцией Хека нового типа, где соединение формулы (XI), где K, А и r, являются такими, как определено в формуле (XIII), и Hal представляет собой галоген, таким образом включающее активный и неактивный арил и галогензамещенный гетероарил, более предпочтительно, моно- и полизамещенную бром- и/или йодарильную или -гетероарильную группу, подвергают взаимодействию с ненасыщенным гетероарилом формулы (XII) в присутствии каталитических количеств Pd(OAc)2 и 1,3-бисдифенилфосфинопропана, в присутствии подходящего основания, предпочтительно CS2CO3 или K(AcO),в полярном растворителе, инертном по отношению к реакции, таком как, предпочтительно, NPM, DMA,ДМФА или аналогичный, при повышенной температуре реакции, предпочтительно при 140-150 С, в течение определенного промежутка времени предпочтительно примерно 6-20 ч, более предпочтительно,12-18 ч. Предпочтительно, r равно 1. Het может представлять собой ненасыщенную моноциклическую или- 15010312 бициклическую гетероарильную группу, такую как, например, имидазо[1,2-]пиридинил, пирролил, тиенил, тиазолил, имидазолил, оксазолил, фуранил, тиенил, бензимидазолил, бензоксазолил, бензотиазолил,бензофуранил, бензотиенил или индолил или такую как любой из ненасыщенных радикалов в группахHet1 и Het2, как определено в формуле (I), необязательно замещенную одним или несколькими радикалами, выбранными из группы, включающей Ar1, Ar1 алкил, галоген, гидрокси, алкил, пиперидинил, пирролил, тиенил, оксо, алкилокси, алкилоксиалкил и алкилоксикарбонил. Предпочтительно, А представляет собой фенил или пиридинил. Указанная реакция имеет улучшенный выход по сравнению со способом предшествующего уровня техники (Yutaka Aoyagi et al., Heterocycles, 1992, 33, 257 и Sommai Pivsa-Art, Bull. Chem. Soc. Jpn., 1988,71, 467). Все соединения по изобретению можно преобразовывать в аддитивную соль кислоты обработкой кислотой, или в аддитивную соль основания обработкой основанием, или, противоположным образом,форму аддитивной соли кислоты можно преобразовывать в свободное основание обработкой щелочью,или аддитивную соль основания можно преобразовывать в свободную кислоту обработкой кислотой. Следующие ниже примеры предназначены для иллюстрации и не имеют намерения ограничивать объем настоящего изобретения. Экспериментальная часть Далее "КТ" обозначает комнатную температуру, "CDI" обозначает 1,1'-карбонилдиимидазол,"DIPE" обозначает диизопропиловый эфир, "MIK" обозначает метилизобутилкетон, "BINAP" обозначаетN,Nдиметилформамид, "DMAP" обозначает N,N-диметил-4-пиридинамин, "EDCI" обозначает 1-(3 диметиламинопропил)-3-этилкарбодиимидHCl и "НОВТ" обозначает гидроксибензотриазол. Получение промежуточных соединений Пример А 1. а. Получение промежуточного соединения 1 К перемешиваемой смеси 7-(фенилметил)-1,4-диокса-8-азаспиро[4,5]декана (полученного согласно описанию WO97/24350, содержание которого включено в данное описание посредством ссылки) (0,5 моль) в толуоле (1500 мл) добавляют Et3N (0,55 моль). В течение 1 ч добавляют бис(трифторметил)бензоилхлорид (0,5 моля) (экзотермическая реакция). Смесь перемешивают при комнатной температуре в течение 2 ч, затем ее выдерживают в течение выходных и три раза промывают водой (500 мл, 2250 мл). Органический слой отделяют, сушат, фильтруют и растворитель выпаривают,получая 245 г фракции 1 (100%). Часть данной фракции кристаллизуют из петролейного эфира. Осадок отфильтровывают и сушат, получая 1,06 г промежуточного соединения 1.b. Получение промежуточного соединения 2 и 3 промежуточное соединение 3 К раствору промежуточного соединения 1 (полученного согласно A1.a) (0,5 моль) в смеси этанола(300 мл) и H2O (300 мл) добавляют HCl ср (300 мл). Реакционную смесь перемешивают при 60 С в течение 20 ч. Осадок отфильтровывают, измельчают, перемешивают в H2O, отфильтровывают, промывают петролейным эфиром и сушат, получая 192 г фракции 1 (89,4%). Часть данной фракции (75 г) разделяют на ее оптические изомеры хиральной колоночной хроматографией на Chiralcel AS (20 мкм, 100 А; элюент: гексан/2-пропанол 70/30). Собирают две группы фракций и выпаривают растворитель. Выход: 36,9 г промежуточного соединения 2 и 37,5 г промежуточного соединения 3. с. Получение промежуточного соединения 4NaH, 60% (0,04 моль) 3 раза промывают гексаном, затем добавляют ДМСО (30 мл) и смесь перемешивают в течение 1 ч в атмосфере N2 и при 60 С. Смесь охлаждают до комнатной температуры и добавляют ТГФ (40 мл). Полученную в результате смесь охлаждают до 0 С и по каплям добавляют раствор йодида триметилсульфоксония (0,032 моль) в ДМСО (40 мл). После перемешивания в течение 30 мин при 0 С по каплям добавляют раствор промежуточного соединения 2 (полученного согласно A1.b) (0,02 моль) в ДМСО (20 мл) и реакционную смесь перемешивают в течение 3 ч при комнатной температуре. Смесь выливают на лед, промывают раствором NH4Cl и слои разделяют. Органический слой сушат(83%). Пример А 2. а. Получение промежуточного соединения 5 Реакцию проводят в атмосфере N2. Смесь хлорида (метоксиметил)трифенилфосфония (0,0055 моль) и N-(1-метилэтил)-2-пропанамина (0,0083 моль) в сухом ТГФ, р.а., (20 мл) перемешивают при -70 С. По каплям добавляют смесь 2,3 М BuLi/гексан (0,0055 моль). Добавляют еще смесь 2,3 М BuLi/гексан (2,2 моль). Смеси дают нагреться до комнатной температуры. Реакционную смесь перемешивают в течение 30 мин при 20 С. Смесь повторно охлаждают до -25 С. По каплям добавляют раствор 1-[3,5 бис(трифторметил)бензоил]-2-(фенилметил)-4-пиперидинонаWO97/24350, содержание которого включено в данное описание посредством ссылки) (0,005 моль) в небольшом количестве сухого ТГФ, р.а., и реакционной смеси дают нагреться до комнатной температуры. Реакционную смесь перемешивают в течение ночи при комнатной температуре, затем разлагают водой. Органический растворитель выпаривают и водный концентрат экстрагируют CH2Cl2. Отделенный органический слой сушат, фильтруют и растворитель выпаривают. Остаток очищают на силикагеле на стек- 17010312 лянном фильтре (элюент: CH2Cl2). Собирают желаемые фракции и выпаривают растворитель. Выход: 1,30 г промежуточного соединения 5 (57%).b. Получение промежуточного соединения 6 Смесь промежуточного соединения 5 (полученного согласно А 2.а) (0,0028 моль) в 1,6 н. HCl (6 мл) и ТГФ (6 мл) перемешивают в течение одного часа при 40 С. ТГФ выпаривают и водный концентрат экстрагируют CH2Cl2. Отделенный органический слой промывают водным раствором Na2CO3, сушат,фильтруют и растворитель выпаривают. Выход: 1,24 г промежуточного соединения 6 (100%). с. Получение промежуточного соединения 7 Смесь промежуточного соединения 6 (полученного согласно А 2.b) (0,0028 моль) и 1(фенилметил)пиперазина (0,0028 моль) в ТГФ (5 мл) и метаноле (100 мл) гидрируют с использованиемPd/C, 10% (0,5 г) в качестве катализатора в присутствии раствора тиофена (0,5 мл). После поглощения Н 2(1 экв.) катализатор отфильтровывают и фильтрат выпаривают. Остаток обрабатывают (Е)-2(бутендиовой) кислотой в метаноле. Соль отфильтровывают и повторно преобразовывают в свободное основание 50% NaOH, затем экстрагируют CH2Cl2. Отделенный органический слой сушат, фильтруют и растворитель выпаривают. Остаток самопроизвольно отверждается, и его сушат. Выход: 0,56 г промежуточного соединения 7 (33%).d. Получение промежуточного соединения 7 Смесь промежуточного соединения 7 (полученного согласно А 2.с) (0,133 моль) в метаноле (500 мл) гидрируют в течение выходных с использованием Pd/C, 10% (5 г) в качестве катализатора. После поглощения H2 (1 экв.) катализатор отфильтровывают и фильтрат выпаривают. Выход: 67,5 г промежуточного соединения 8. Пример A3. Получение промежуточного соединения 9 Смесь промежуточного соединения 6 (полученного согласно А 2.b) (0,0081 моль) в CH3CN (p.a.) (20 мл) перемешивают на ледяной бане, получая смесь (I). К смеси (I) при 10 С по каплям добавляют смесьNaOCl2 (0,00975 моль), растворенного в H2O (20 мл). Реакционную смесь перемешивают в течение 2 ч при 10 С и в течение ночи перемешивают при комнатной температуре. К данной смеси при комнатной температуре по каплям добавляют NaOH (25 мл, 10%) и реакционную смесь промывают DIPE (2 раза). Водный слой подкисляют HCl (10%) при 10 С, затем экстрагируют CH2Cl2. Органический слой сушат(MgSO4) и отфильтровывают. Растворитель выпаривают и остаток кристаллизуют из DIPE. Выход: 3,0 г промежуточного соединения 9 (80%).- 18010312 Пример А 4. а. Получение промежуточного соединения 10 Смесь промежуточного соединения 4 (полученного согласно A1.c) (0,0165 моль) и эфира 1,1 диметилэтил-1-пиперазинкарбоновой кислоты (0,0165 моль) в этаноле р.а. (100 мл) перемешивают и кипятят с обратным холодильником в течение 14 ч. Растворитель выпаривают и остаток очищают на силикагеле на стеклянном фильтре (элюент: CH2Cl2/CH3OH 97,5/2,5). Собирают фракции продукта и растворитель выпаривают. Выход: 8,3 г промежуточного соединения 10 (80%).b. Получение промежуточного соединения 11 Смесь промежуточного соединения 10 (полученного согласно А 4.а) (8,3 г; 0,0132 моль) в ДМФА р.а. (250 мл) перемешивают при комнатной температуре в атмосфере N2. Добавляют NaH 60% (0,64 г; 0,016 моль) и реакционную смесь перемешивают в течение 1 ч при комнатной температуре. По каплям добавляют CH3I (2,25 г; 0,0158 моль), растворенный в ДМФА. Реакционную смесь перемешивают в течение 18 ч при комнатной температуре. Добавляют дополнительное количество NaH 60% (0,64 г) и смесь перемешивают в течение 1 ч при комнатной температуре. Добавляют дополнительное количество CH3I(2,25 г) и смесь перемешивают в течение 18 ч при комнатной температуре. Затем смесь выливают в H2O и экстрагируют DIPE. Органический слой сушат над MgSO4, фильтруют и выпаривают. Выход: 6,4 г промежуточного соединения 11 (75%). с. Получение промежуточного соединения 12 Смесь промежуточного соединения 11 (полученного согласно А 4.b) (6,0 г; 0,0093 моль), HCl/изоС 3 Н 7 ОН (25 мл) и метанола (100 мл) перемешивают при 50 С в течение 1 ч. Растворитель выпаривают и остаток выливают в H2O. Добавляют K2CO3 10% (3 г). Фильтрат экстрагируют CH2Cl2. Органический слой промывают H2O, сушат (MgSO4), фильтруют и растворитель выпаривают. Выход: 5,1 г промежуточного соединения 12 (100%). Пример А 5. а. Получение промежуточного соединения 13 Смесь NaH, 60% (0,036 моль) в ТГФ, р. а., осушенном на молекулярных ситах (200 мл), перемешивают при комнатной температуре и по каплям добавляют раствор этилового эфира (диэтоксифосфинил)уксусной кислоты (0,036 моль) в высушенном на молекулярных ситах (q.s.) ТГФ, р.а., затем смесь перемешивают в течение 30 мин при комнатной температуре и по каплям добавляют раствор промежуточного соединения 2 (полученного согласно A1.b) (0,03 моль) в высушенном на молекулярных ситах(q.s.) ТГФ, р. а. Реакционную смесь перемешивают в течение 90 мин при комнатной температуре. Добавляют NH4Cl (15 г) и H2O. Органический растворитель выпаривают и водный концентрат экстрагируютCH2Cl2. Органический слой промывают H2O, сушат (MgSO4), фильтруют и растворитель выпаривают.- 19010312 Остаток очищают на силикагеле на стеклянном фильтре (градиент элюента: CH2Cl2/CH3OH от 100/0 до 98/2). Собирают фракции продукта и растворитель выпаривают. Выход: 14,3 г промежуточного соединения 13 (95%).b. Получение промежуточного соединения 14 Смесь промежуточного соединения 13 (полученного согласно А 5.а) (0,0126 моль) в этаноле (100 мл) гидрируют при 20 С в течение 18 ч с использованием Pd/C 10% (1 г) в качестве катализатора. После поглощения H2 (1 экв.), катализатор отфильтровывают и фильтрат выпаривают. Выход: 7,1 г промежуточного соединения 14 (100%). с. Получение промежуточного соединения 15 Промежуточное соединение 14 (полученное согласно А 5.b) (0,014 моль) в смеси NaOH (1 н.) (75 мл),метанола (70 мл) и H2O (70 мл) перемешивают при комнатной температуре в течение 24 ч. Органический растворитель выпаривают, добавляют HCl (100 мл, 1 н) и реакционную смесь экстрагируют (2 раза)CH2Cl2. Органический слой промывают H2O, сушат (MgSO4), отфильтровывают и растворитель выпаривают. Выход: 5,5 г промежуточного соединения 15 (83%). Пример А 6. Получение промежуточного соединения 16(полученного согласно А 2.b) (0,0133 моль) в смеси 37% HCl (10 мл), H2O (30 мл) и ТГФ (40 мл) перемешивают в течение 2 ч при 50 С, затем органический растворитель выпаривают и водный концентрат экстрагируют CH2Cl2. Органический слой промывают раствором NaHCO3 и H2O, сушат (MgSO4), отфильтровывают и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (градиент элюента: CH2Cl2/CH3OH от 100/0 до 98/2). Собирают фракции продукта и растворитель выпаривают. Выход: 2,7 г промежуточного соединения 16 (66%). Пример А 7. Получение промежуточного соединения 17 Промежуточное соединение 13 (полученное согласно А 5.а) (0,0143 моль) в смеси NaOH (1 н.) (75 мл), метанола (170 мл) и H2O (100 мл) перемешивают при комнатной температуре в течение 48 ч. Растворитель выпаривают до воды и остаток промывают DIPE. Добавляют HCl (100 мл, 1 н.) и реакционную смесь экстрагируют CH2Cl2. Органический слой сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (градиент элюента: CH2Cl2/CH3OH от 100/0 до 90/10). Собирают фракции продукта и растворитель выпаривают. Выход: 5,9 г промежуточного соединения 17 (88%).- 20010312 Получение конечных соединений Пример В 1. а) Получение конечного соединения 1 Смесь промежуточного соединения 8 (полученного согласно A2.d) (0,04 моль) и 1-(фенилметил)-3 пирролидинона (0,04 моль) в метаноле (250 мл) гидрируют при 50 С в течение 18 ч с использованиемPd/C 10% (3 г) в качестве катализатора в присутствии раствора тиофена (2 мл). После поглощения Н 2 (1 экв.) катализатор отфильтровывают и фильтрат выпаривают. Остаток забирают в смесь H2O/CH2Cl2 иK2CO3 (5 г). Слои разделяют. Водный слой экстрагируют CH2Cl2 и органический слой сушат (MgSO4),фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле(градиент элюента: CH2Cl2/СН 3 ОН от 95/5 до 90/10). Собирают фракции продукта и растворитель выпаривают. Выход: 22,0 г конечного соединения 1 (82%).b) Получение конечного соединения 2 Смесь промежуточного соединения 4 (полученного согласно A1.c) (0,0165 моль) и 1-[1(фенилметил)-3-пирролидинил]пиперазина (полученного согласно описанию WO96/20173, содержание которого включено в данное описание посредством ссылки) (0,0165 моль) в этаноле р.а. (100 мл) перемешивают и кипятят с обратным холодильником в течение ночи. Растворитель выпаривают и остаток очищают на силикагеле на стеклянном фильтре (градиент элюента: CH2Cl2/CH3OH от 95/5 до 90/10). Собирают фракции продукта и растворитель выпаривают. Выход: 7,6 г конечного соединения 2 (67%). с) Получение конечного соединения 3 Смесь промежуточного соединения 9 (полученного согласно A3) (0,02 моль), N,N-диметил-4 пиридинамина (0,028 моль) и Et3N (0,028 моль) в CH2Cl2, р.а. (300 мл) перемешивают при комнатной температуре, затем частями добавляют EDCI (0,028 моль) и реакционную смесь перемешивают в течение 5 ч при комнатной температуре. По каплям добавляют раствор 1-[1-(фенилметил)-4 пиперидинил]пиперазина (полученного согласно описанию WO96/20173, содержание которого включено в данное описание посредством ссылки) (0,02 моль) в CH2Cl2 и смесь перемешивают в течение выходных при комнатной температуре. Добавляют NaOH (150 мл, 1 н.) и реакционную смесь перемешивают в течение 15 мин при комнатной температуре. Слои разделяют и водный слой экстрагируют CH2Cl2. Органический слой промывают H2O, сушат (MgSO4), фильтруют и растворитель выпаривают. Выход: 3,2 г конечного соединения 3 (23%).d) Получение конечного соединения 4 Смесь конечного соединения 3 (0,0041 моль) в Н 2 (50 мл) гидрируют при комнатной температуре в течение 72 ч с использованием Pd/C 10% (0,5 г) в качестве катализатора. После поглощения Н 2 (1 экв.),катализатор отфильтровывают и фильтрат выпаривают. Выход: 2,4 г конечного соединения 4 (96%).- 21010312 Пример В 2. а) Получение конечного соединения 5(транс) (полученного согласно A2.d) (0,02 моль) и Смесь промежуточного соединения 1,1-диметилэтилового эфира 4-оксо-1-пиперидинкарбоновой кислоты (0,02 моль) в метаноле (250 мл) гидрируют при 50 С с использованием Pd/C 10% (2 г) в качестве катализатора в присутствии раствора тиофена (1 мл). После поглощения Н 2 (1 экв.) катализатор отфильтровывают и растворитель выпаривают. Остаток очищают на силикагеле на стеклянном фильтре (градиент элюента: CH2Cl2/СН 3 ОН от 97/3 до 94/6). Собирают желаемые фракции и растворитель выпаривают. Выход: 10,4 г конечного соединения 5b) Получение конечного соединения 6 Конечное соединение 5 (полученное согласно В 2.а) (0,0139 моль) в смеси HCl/2-пропанол (15 мл) и 2-пропанола (60 мл) перемешивают при 50 С в течение 3 ч. Растворитель выпаривают. Выход: 9,3 г конечного соединения 6 (95%). Пример В 3. а) Получение конечного соединения 7 Смесь промежуточного соединения 15 (полученного согласно А 5.с) (0,006 моль), DMAP (0,0077 моль) и Et3N (0,0077 моль) в CH2Cl2 (100 мл) перемешивают при комнатной температуре. ДобавляютEDCI (0,0077 моль) и смесь перемешивают в течение 2 ч при комнатной температуре, получая смесь (I). К смеси (I) по каплям добавляют смесь 1,1-диметилэтилового эфира 3-(1-пиперазинил)-1 пирролидинкарбоновой кислоты (полученного согласно описанию WO2004/056799, содержание которого включено в данное описание посредством ссылки) (0,006 моль), растворенного в CH2Cl2, и реакционную смесь перемешивают в течение ночи при комнатной температуре. Добавляют H2O (100 мл) и NaOH(50 мл, 1 н.) и смесь перемешивают в течение 5 мин. при комнатной температуре. Слои разделяют. Водный слой экстрагируют CH2Cl2 и органический слой промывают H2O, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (градиент элюента:CH2Cl2/CH3OH от 100/0 до 90/0). Собирают фракции продукта и растворитель выпаривают. Выход: 2,1 г конечного соединения 7 (50%).b) Получение конечного соединения 8 Смесь конечного соединения 7 (0,00295 моль) в CF3COOH (20 мл) перемешивают при комнатной температуре в течение 1 ч. Реакционную смесь выливают в смесь лед/H2O/K2CO3. Водный слой экстрагируют CH2Cl2 и органический слой сушат (MgSO4), фильтруют и растворитель выпаривают. Выход: 1,7- 22010312 г конечного соединения 8 (94%). Пример В 4. а) Получение конечного соединения 9 Смесь промежуточного соединения 16 (полученного согласно А 6) и 1,1-диметилэтилового эфира 3(1-пиперазинил)-1-пирролидинкарбоновой кислоты (полученного согласно описанию WO2004/056799,содержание которого включено в данное описание посредством ссылки) (0,01 моль) в метаноле (150 мл) гидрируют при 50 С в течение 48 ч с использованием Pd/C 10% (1 г) в качестве катализатора в присутствии раствора тиофена (1 мл). После поглощения Н 2 (1 экв.) катализатор отфильтровывают и фильтрат выпаривают. Остаток очищают колоночной хроматографией на силикагеле (градиент элюента:CH2Cl2/CH3OH от 100/0 до 95/5). Собирают фракции продукта и растворитель выпаривают. Выход: 3,6 г конечного соединения 9 (75%).b) Получение конечного соединения 10 Конечное соединение 9 (полученное согласно В 4.а) (0,0066 моль) в смеси HCl/2-пропанол (10 мл) и метанола (40 мл) перемешивают и кипятят с обратным холодильником в течение 1 ч. Растворитель выпаривают и остаток забирают в H2O. Смесь подщелачивают NaOH и экстрагируют CH2Cl2. Органический слой промывают H2O, сушат (MgSO4), фильтруют и растворитель выпаривают. Выход: 2,6 г конечного соединения 10 (88%). Пример В 5. Получение конечного соединения 11CH2Cl2, р.а. (100 мл) перемешивают при комнатной температуре. Затем добавляют EDCI (0,0027 моль) и реакционную смесь перемешивают при комнатной температуре в течение 1 ч, получая смесь (I). К смеси(I) по каплям добавляют смесь конечного соединения 6 (полученного согласно B1.d) (0,002 моль), растворенного в CH2Cl2, и реакционную смесь перемешивают в течение ночи при комнатной температуре. Смесь выливают в NaOH (1 н.) и перемешивают в течение 15 мин при комнатной температуре. Слои разделяют. Водный слой экстрагируют CH2Cl2 и органический слой сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (градиент элюента:CH2Cl2/CH3OH от 100/0 до 90/10). Собирают фракции продукта и растворитель выпаривают. Выход: 0,914 г конечного соединения 11 (67%). Пример В 6. Получение конечного соединения 12 Смесь конечного соединения 6 (полученного согласно B1.d) (0,0021 моль) и Et3N (0,01 моль) вCH2Cl2, р.а. (50 мл) перемешивают на ледяной бане. 3,5-диметилбензоилхлорид (0,0025 моль) растворяют в CH2Cl2, по каплям добавляют к реакционной смеси и перемешивают в течение 1 ч при комнатной температуре. Добавляют K2CO3 (2 г) и H2O и смесь экстрагируют. Отделенный водный слой экстрагируют CH2Cl2 и отделенные объединенные органические слои сушат (MgSO4), фильтруют и фильтрат выпаривают. Остаток очищают колоночной хроматографией на силикагеле (градиент элюента: CH2Cl2/МеОН- 23010312 от 100/0 до 90/10). Собирают фракции продукта и растворитель выпаривают. Выход: 1,38 г конечного соединения 12 (90%). Пример В 7. Получение конечного соединения 13 Смесь конечного соединения 6 (полученного согласно Bl.d) (0,00134 моль) и Et3N (0,01 моль) вCH2Cl2, р.а. (40 мл) перемешивают при комнатной температуре, затем по каплям добавляют раствор 2 тиофенсульфонилхлорида (0,0016 моль) в CH2Cl2, p.a. (q.s.) и реакционную смесь перемешивают в течение ночи при комнатной температуре. По каплям добавляют NaOH (1 н, 20 мл), полученную в результате смесь перемешивают в течение 10 мин при комнатной температуре и затем слои разделяют. Водный слой экстрагируют CH2Cl2; органический слой промывают H2O, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (градиент элюента:CH2Cl2/CH3OH от 100/0 до 90/10). Собирают фракции продукта и растворитель выпаривают. Выход: 0,791 г конечного соединения 13 (80%). Пример В 8. Получение конечного соединения 14 Конечное соединение 6 (полученное согласно В 2.b) (0,000168 моль) преобразовывают в свободное основание. Смесь свободного основания конечного соединения 6 (0,000168 моль), 2-хлор-1Hбензимидазола (0,000182 моль) и CuO (0,010 г) в N,N-диметилацетамиде (3 мл) перемешивают в течение 3 ч при 150 С и затем растворитель выпаривают. Полученный остаток забирают в CH2Cl2 (5 мл) и добавляют H2O/NH3. Смесь перемешивают в течение 2 ч и фильтруют через Extrelut, затем остаток на фильтре промывают CH2Cl2 (22 мл) и очищают высокоэффективной жидкостной хроматографией (элюент:CH2Cl2/CH3OH 90/10). Собирают фракции продукта и растворитель выпаривают. Выход: 0,011 г конечного соединения 14. Пример В 9. Получение конечного соединения 15 Конечное соединение 6 (полученное согласно В 2.b) (0,000168 моль) преобразовывают в свободное основание. Смесь свободного основания конечного соединения 6 (0,000168 моль), циклопропанкарбонилхлорида (0,001182 моль) и Et3N (0,0005 моль) в CH2Cl2 (4 мл) перемешивают в течение выходных при комнатной температуре и затем добавляют H2O (2 мл). Смесь перемешивают в течение 30 мин и фильтруют через Extrelut, затем остаток на фильтре промывают CH2Cl2 (22 мл) и очищают высокоэффективной жидкостной хроматографией (элюент: CH2Cl2/СН 3 ОН 90/10). Собирают фракции продукта и растворитель выпаривают. Выход: 0,109 г конечного соединения 15. Пример В 10. Получение конечного соединения 16- 24010312 Конечное соединение 6 (полученное согласно В 2.b) (0,000168 моль) преобразовывают в свободное основание. Смесь 2-хинолинкарбоновой кислоты (0,000182 моль), Et3N (0,0005 моль) и РуВОР (гексафторфосфата бензотриазол-1-илокси-трис-пирролидинофосфония) (0,0002 моль) в CH2Cl2 (4 мл) перемешивают в течение 3 ч, затем добавляют свободное основание конечного соединения 6 (0,000168 моль) и реакционную смесь перемешивают в течение выходных при комнатной температуре. Растворитель выпаривают и остаток очищают высокоэффективной жидкостной хроматографией с обращенной фазой. Собирают фракции продукта и растворитель выпаривают. Выход: 0,083 г конечного соединения 16. Пример В 11. Получение конечного соединения 17 Конечное соединение 6 (полученное согласно В 2.b) (0,000168 моль) преобразовывают в свободное основание. Смесь свободного основания конечного соединения 6 (0,000168 моль), 2-хлорпиримидина(0,000182 моль) и Na2CO3 (0,0005 моль) в N,N-диметилацетамиде (4 мл) перемешивают в течение выходных при 60 С и затем растворитель выпаривают. Полученный остаток забирают в CH2Cl2 (5 мл) и добавляют H2O (2 мл). Смесь перемешивают в течение 30 мин, фильтруют через Extrelut, затем остаток на фильтре промывают CH2Cl2 (22 мл) и очищают высокоэффективной жидкостной хроматографией (градиент 90/10). Собирают фракции продукта и растворитель выпаривают. Выход: 0,059 г конечного соединения 17. Таблица 1
МПК / Метки
МПК: C07D 405/14, A61K 31/495, C07D 409/14, C07D 401/14, C07D 207/00, C07D 401/02, C07D 417/14, C07D 413/14, C07D 211/00, C07D 401/04
Метки: качестве, производные, применение, замещенные, 4-алкил, 4-алканоилпиперидина, антагонистов, нейрокининов
Код ссылки
<a href="https://eas.patents.su/30-10312-zameshhennye-proizvodnye-4-alkil-i-4-alkanoilpiperidina-i-ih-primenenie-v-kachestve-antagonistov-nejjrokininov.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные производные 4-алкил- и 4-алканоилпиперидина и их применение в качестве антагонистов нейрокининов</a>
Предыдущий патент: Состав аэрозоля, дозированный ингалятор под давлением и способ его заполнения
Следующий патент: Многофазный препарат для контрацепции на основе натурального эстрогена
Случайный патент: Производные бензилпиперазина и их применение для лечения состояний или расстройств, опосредованных gpr38-рецепторами