Производные пиридина
Номер патента: 25166
Опубликовано: 30.11.2016
Авторы: Анзельм Лилли, Петерс Йенс-Уве, Шпиннлер Беат, Любберс Томас, Хаап Вольфганг, Кун Бернд, Бэннер Дэвид
Формула / Реферат
1. Соединение формулы (I)
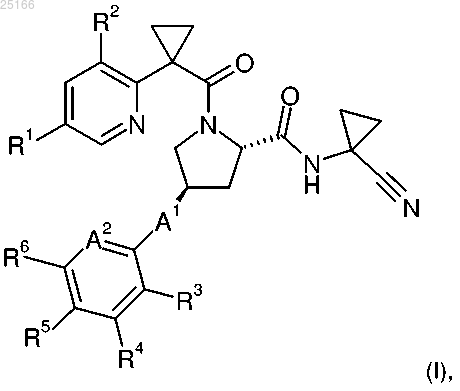
где А1 представляет собой -S- или -S(O)2-;
А2 представляет собой атом азота или -(СН)-;
R1 представляет собой атом галогена или галоген-С1-С4-алкил;
R2 представляет собой атом водорода или атом галогена;
R3 представляет собой атом водорода, атом галогена, галоген-С1-С4-алкил, пиразолил, [1,2,3]-триазолил или [1,2,4]-триазолил;
R4 и R6 независимо выбраны из атома водорода, С1-С4-алкила, галоген-C1-С4-алкила и галогенфенила; и
R5 представляет собой атом водорода, атом галогена, галоген-С1-С4-алкил, С1-С4-алкокси, галоген-С1-С4-алкокси, С1-С4-алкилпиридинил, галогенпиридинил или С1-С4-алкилпиразолил;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где А1 представляет собой -S(O)2-.
3. Соединение по п.1 или 2, где А2 представляет собой -(СН)-.
4. Соединение по любому из пп.1-3, где R1 представляет собой атом хлора, брома, иода или трифторметил.
5. Соединение по любому из пп.1-4, где R2 представляет собой атом галогена.
6. Соединение по любому из пп.1-5, где R2 представляет собой атом хлора или фтора.
7. Соединение по любому из пп.1-6, где R3 представляет собой атом галогена.
8. Соединение по любому из пп.1-7, где R3 представляет собой атом хлора.
9. Соединение по любому из пп.1-8, где R4 и R6 независимо выбраны из атома водорода и галоген-С1-С4-алкила.
10. Соединение по любому из пп.1-9, где R4 и R6 независимо выбраны из атома водорода и трифторметила.
11. Соединение по любому из пп.1-10, где R5 представляет собой атом водорода, С1-С4-алкокси, галоген-С1-С4-алкокси, атом галогена, С1-С4-алкилпиридинил или С1-С4-алкилпиразолил.
12. Соединение по любому из пп.1-11, где R5 представляет собой атом водорода, метокси, трифторэтокси, атом фтора, трифторпропилокси, атом брома, метилпиридинил или метилпиразолил.
13. Соединение по любому из пп.1-12, выбранное из следующих соединений:
(2S,4R)-4-(2-хлор-4-метоксибензолсульфонил)-1-[1-(5-хлорпиридин-2-ил)циклопропанкарбонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-4-(2-хлорбензолсульфонил)-1-[1-(5-хлорпиридин-2-ил)циклопропанкарбонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-1-[1-(5-хлорпиридин-2-ил)циклопропанкарбонил]-4-[2-хлор-4-(2,2,2-трифторэтокси)бензолсульфонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(2-хлор-4-метоксибензолсульфонил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-4-(2-хлорбензолсульфонил)-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-[2-хлор-4-(2,2,2-трифторэтокси)бензолсульфонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-1-[1-(5-бром-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(2-хлор-4-метоксибензолсульфонил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-1-[1-(5-бром-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(2-хлорбензолсульфонил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(4'-фтордифенил-3-илсульфанил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(3-хлорпиридин-2-илсульфанил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-1-(1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил)-4-(2-хлор-4-фторфенилсульфонил)-N-(1-цианоциклопропил)пирролидин-2-карбоксамида;
(2S,4R)-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(пиридин-2-илсульфанил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(4'-фтордифенил-3-сульфонил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(3-хлорпиридин-2-сульфонил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4S)-4-(2-хлор-4-фторбензолсульфонил)-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(3-хлор-5-трифторметилпиридин-2-илсульфанил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(5-хлорпиридин-2-илсульфанил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(пиридин-2-сульфонил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(6-метилпиридин-2-илсульфанил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(5-трифторметилпиридин-2-илсульфанил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(3-трифторметилпиридин-2-илсульфанил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(5-хлорпиридин-2-сульфонил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(6-метилпиридин-2-сульфонил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(5-трифторметилпиридин-2-сульфонил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(3-трифторметилпиридин-2-сульфонил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(2-хлор-5-трифторметилфенилсульфанил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-1-(1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил)-4-(2-хлор-4-((S)-1,1,1-трифторпропан-2-илокси)фенилсульфонил)-N-(1-цианоциклопропил)пирролидин-2-карбоксамида;
(2S,4R)-1-(1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил)-4-(2-хлор-5-(трифторметил)фенилсульфонил)-N-(1-цианоциклопропил)пирролидин-2-карбоксамида;
(2S,4R)-1-[1-(5-хлорпиридин-2-ил)циклопропанкарбонил]-4-(2-хлор-5-трифторметилбензолсульфонил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-4-(4-бром-2-хлорбензолсульфонил)-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-1-(1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил)-4-(2-хлор-4-(2-метилпиридин-4-ил)фенилсульфонил)-N-(1-цианоциклопропил)пирролидин-2-карбоксамида;
(2S,4R)-4-[2-хлор-4-(2-хлорпиридин-4-ил)бензолсульфонил]-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-[2-хлор-4-(1-метил-1Н-пиразол-4-ил)бензолсульфонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-[2-хлор-4-(2-метилпиридин-3-ил)бензолсульфонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-4-[2-хлор-4-(2-метилпиридин-3-ил)бензолсульфонил]-1-[1-(3-фтор-5-трифторметилпиридин-2-ил)циклопропанкарбонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-4-[2-хлор-4-(2-метилпиридин-3-ил)бензолсульфонил]-1-[1-(3-фтор-5-иодпиридин-2-ил)циклопропанкарбонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-4-[2-хлор-4-(2-метилпиридин-3-ил)бензолсульфонил]-1-[1-(3,5-дихлорпиридин-2-ил)циклопропанкарбонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)-амида;
(2S,4R)-4-[2-хлор-4-(1-метил-1Н-пиразол-4-ил)бензолсульфонил]-1-[1-(3-фтор-5-иодпиридин-2-ил)циклопропанкарбонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-4-[2-хлор-4-(1-метил-1Н-пиразол-4-ил)бензолсульфонил]-1-[1-(3-фтор-5-трифторметилпиридин-2-ил)циклопропанкарбонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-4-[2-хлор-4-(1-метил-1Н-пиразол-4-ил)бензолсульфонил]-1-[1-(3,5-дихлорпиридин-2-ил)циклопропанкарбонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-4-(2-фторбензолсульфонил)-1-[1-(3-фтор-5-иодпиридин-2-ил)циклопропанкарбонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(2-фторбензолсульфонил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-1-[1-(3-фтор-5-иодпиридин-2-ил)циклопропанкарбонил]-4-(2-пиразол-1-ил-бензолсульфонил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-1-[1-(3-фтор-5-иодпиридин-2-ил)циклопропанкарбонил]-4-(2-[1,2,3]триазол-1-ил-бензолсульфонил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-1-[1-(3-фтор-5-иодпиридин-2-ил)циклопропанкарбонил]-4-(2-[1,2,4]триазол-1-ил-бензолсульфонил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
((2S,4R)-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(2-пиразол-1-ил-бензолсульфонил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(2-[1,2,3]триазол-1-ил-бензолсульфонил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(2-[1,2,4]триазол-1-ил-бензолсульфонил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида.
14. Соединение по любому из пп.1-13, выбранное из следующих соединений:
(2S,4R)-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(2-хлор-4-метоксибензолсульфонил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-4-(2-хлорбензолсульфонил)-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-[2-хлор-4-(2,2,2-трифторэтокси)бензолсульфонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-1-[1-(5-бром-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(2-хлор-4-метоксибензолсульфонил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-1-[1-(5-бром-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(2-хлорбензолсульфонил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-1-(1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил)-4-(2-хлор-4-фторфенилсульфонил)-N-(1-цианоциклопропил)пирролидин-2-карбоксамида;
(2S,4R)-1-(1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил)-4-(2-хлор-4-((S)-1,1,1-трифторпропан-2-илокси)фенилсульфонил)-N-(1-цианоциклопропил)пирролидин-2-карбоксамида;
(2S,4R)-1-(1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил)-4-(2-хлор-5-(трифторметил)фенилсульфонил)-N-(1-цианоциклопропил)пирролидин-2-карбоксамида;
(2S,4R)-4-(4-бром-2-хлорбензолсульфонил)-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-1-(1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил)-4-(2-хлор-4-(2-метилпиридин-4-ил)фенилсульфонил)-N-(1-цианоциклопропил)пирролидин-2-карбоксамида;
(2S,4R)-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-[2-хлор-4-(1-метил-1Н-пиразол-4-ил)бензолсульфонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-[2-хлор-4-(2-метилпиридин-3-ил)бензолсульфонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-4-[2-хлор-4-(2-метилпиридин-3-ил)бензолсульфонил]-1-[1-(3-фтор-5-трифторметилпиридин-2-ил)циклопропанкарбонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-4-[2-хлор-4-(2-метилпиридин-3-ил)бензолсульфонил]-1-[1-(3-фтор-5-иодпиридин-2-ил)циклопропанкарбонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-4-[2-хлор-4-(2-метилпиридин-3-ил)бензолсульфонил]-1-[1-(3,5-дихлорпиридин-2-ил)циклопропанкарбонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-4-[2-хлор-4-(1-метил-1Н-пиразол-4-ил)бензолсульфонил]-1-[1-(3-фтор-5-иодпиридин-2-ил)циклопропанкарбонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида;
(2S,4R)-4-[2-хлор-4-(1-метил-1Н-пиразол-4-ил)бензолсульфонил]-1-[1-(3-фтор-5-трифторметилпиридин-2-ил)циклопропанкарбонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида и
(2S,4R)-4-[2-хлор-4-(1-метил-1Н-пиразол-4-ил)бензолсульфонил]-1-[1-(3,5-дихлорпиридин-2-ил)циклопропанкарбонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида.
15. Применение соединения по любому из пп.1-14 в качестве терапевтически активного вещества.
16. Фармацевтическая композиция, содержащая соединение по любому из пп.1-14 и терапевтически инертный носитель.
17. Применение соединения по любому из пп.1-14 для получения лекарственного средства для лечения или профилактики диабета, атеросклероза, аневризмы брюшной аорты, болезни периферических артерий или диабетической нефропатии.
18. Применение соединения по любому из пп.1-14 для лечения или профилактики диабета, атеросклероза, аневризмы брюшной аорты, болезни периферических артерий или диабетической нефропатии.
19. Способ лечения или профилактики для лечения или профилактики диабета, атеросклероза, аневризмы брюшной аорты, болезни периферических артерий или диабетической нефропатии, включающий введение эффективного количества соединения, как определено в любом из пп.1-14.
Текст
Изобретение относится к органическим соединениям, полезным для терапии или профилактики у млекопитающего, и, в частности, к соединениям, являющимся преимущественными ингибиторами цистеиновой протеазы катепсина, в частности, цистеиновой протеазы катепсина S или L. Изобретение относится, в частности, к соединению формулы (I) где А 1 представляет собой -S- или -S(O)2-; А 2 представляет собой атом азота или -(СН)-;R1 представляет собой атом галогена или галогеналкил;R2 представляет собой атом водорода или атом галогена;R3 представляет собой атом водорода, атом галогена, галогеналкил, пиразолил, [1,2,3]-триазолил или [1,2,4]-триазолил;R4 и R6 независимо выбраны из атома водорода, алкила, галогеналкила и галогенфенил; иR5 представляет собой атом водорода, атом галогена, галогеналкил, алкокси, галогеналкокси, алкилпиридинил, галогенпиридинил или алкилпиразолил; или к его фармацевтически приемлемой соли. Соединения по изобретению являются преимущественными ингибиторами цистеиновой протеазы катепсина (Cat), в частности катепсина S или катепсина L, и, следовательно, полезны для лечения метаболических расстройств, таких как диабет, атеросклероза, аневризмы брюшной аорты, болезни периферических артерий, рака, уменьшения сердечно-сосудистых осложнений при хроническом заболевании почек, гломерулонефрита, возрастной макулярной дегенерации, диабетической нефропатии и диабетической ретинопатии. Кроме того, иммуноопосредованные заболевания, такие как ревматоидный артрит,болезнь Крона, рассеянный склероз, синдром Шегрена, системная красная волчанка, нейропатическая боль, диабет типа I, астма и аллергия, и также иммунопатологическое заболевание кожи, представляют собой заболевания, подходящие для лечения ингибитором катепсина S. Объектами настоящего изобретения являются соединения формулы (I) и их упомянутые выше соли,как таковые, и их применение в качестве терапевтически активных веществ, способ получения этих соединений, промежуточные соединения, фармацевтические композиции, лекарственные средства, содержащие данные соединения, их фармацевтически приемлемые соли, применение этих соединений и их солей для профилактики и/или терапии заболеваний, в частности, при лечении или профилактике диабета, атеросклероза, аневризмы брюшной аорты, болезни периферических артерий, рака, уменьшения сердечно-сосудистых осложнений при хроническом заболевании почек и диабетической нефропатии, и применение этих соединений и их солей для получения лекарственных средств для лечения или профилактики диабета, атеросклероза, аневризмы брюшной аорты, болезни периферических артерий, рака,уменьшения сердечно-сосудистых осложнений при хроническом заболевании почек и диабетической нефропатии. Катепсины млекопитающих представляют собой протеазы цистеинового типа, вовлеченные в ключевые стадии биологических и патологических событий. Катепсины считают легко управляемыми мишенями лекарственных средств, поскольку возможно ингибировать их ферментативную активность малыми молекулами, и, следовательно, они представляют интерес для фармацевтической промышленности(10), 605-14). Катепсин S выражению экспрессируется в антигенпрезентирующих клетках, таких как макрофаги и дендритные клетки, и в гладкомышечных клетках (Hsing, L. С. and Rudensky, A. Y. (2005), 'The lysosomal(2006), 'Lysosomal cysteine proteases and antigen presentation', Ernst Schering Res Found Workshop, (56), 8195). Хотя катепсин S только слабо экспрессируется в нормальной артериальной ткани, наблюдают его сильную повышающую регуляцию в атеросклеротических артериях (Liu, J., et al. (2006), 'Increased serumsmooth muscle cells', J Clin Invest, 102(3), 576-83). Доклинические данные позволяют предположить, что функция катепсина S является критической для атеросклероза, поскольку мыши с дефицитом катепсина S обладают ослабленным атеросклеротическим фенотипом при тестировании в соответствующих мышиных моделях. У рекомбинантных мышей с дефицитом липопротеина низкой плотности ЛПНП-Rec описана сниженная аккумуляция липидов, разрушение эластиновых волокон и хроническое воспаление артерий. У мышей с дефицитом по аполипопротеину Е (АРО Е) описано значимое снижение числа случаев острого разрыва бляшки. Когда хроническое заболевание почек индуцируют у мышей CatS/ln с дефицитом по АРО-Е, наблюдают сильное уменьшение ускоренной кальцификации при самой высокой противоатеросклеротической активности в артериях и сердечных клапанах (Aikawa, E., et al. (2009), 'Arterial and aortic valve calcification abolished bymurine atherosclerotic plaques', Arterioscler Thromb Vase Biol, 26 (4), 851-6; Sukhova et al. (2003), 'Deficiency of cathepsin S reduces atherosclerosis in LDL receptor-deficient mice', J Clin Invest, 111 (6), 897-906). Это позволяет предположить, что потенциальный ингибитор катепсина S стабилизирует атеросклеротическую бляшку посредством уменьшения разрушения внеклеточного матрикса, посредством уменьшения провоспалительного состояния и посредством уменьшения ускоренной кальцификации, и, следовательно, ее клинических проявлений. Эти фенотипы, описанные в моделях атеросклероза, согласуются с известными клеточными функциями катепсина S. Во-первых, катепсин S вовлечен в разрушение внеклеточного матрикса, стабилизирующего бляшку. В частности, катепсин S обладает сильной эластинолитической активностью и может проявлять ее при нейтральном рН, и данный признак отличает катепсин S от всех других катепсинов. Вовторых, катепсин S является основной протеазой, вовлеченной в процессирование антигена, в частности,в расщепление инвариантной цепи в антигенпрезентирующих клетках, приводящее к сниженному участию Т-клеток в хроническом воспалении атеросклеротической ткани. Повышенное воспаление приводит в результате к дальнейшему окислительному и протеолитическому повреждению ткани, и впоследствии к дестабилизации бляшки (Cheng, X. W., et al. (2004), 'Increased expression of elastolytic cysteine proteases, cathepsins S and K, in the neointima of balloon-injured rat carotid arteries', Am J Pathol, 164 (1), 243-51;and antigen presentation', Ernst Schering Res Found Workshop, (56), 81-95). Противовоспалительные и антиэластинолитические свойства ингибитора Cat S также делают его перспективной мишенью при хронической обструктивной болезни легких (Williams, A. S., et al. (2009),'Role of cathepsin S in ozone-induced airway hyperresponsiveness and inflammation', Pulm Pharmacol Ther, 22(1), 27-32). Кроме того, вследствие его внеклеточных функций в расщеплении матрикса ингибирование катепсина S повлияет на образование неоинтимы и ангиогенез (Burns-Kurtis, С. L, et al. (2004), 'CathepsinWang, В., et al. (2006), 'Cathepsin S controls angiogenesis and tumor growth via matrix-derived angiogenic factors', J Biol Chem, 281 (9), 6020-9). Ингибитор катепсина S может быть, следовательно, полезен при нескольких различных болезненных состояниях. Катепсин S также играет роль в снижении опухолевого роста и инвазии опухолевых клеток, как описано автором Roberta E. Burden в статье Clin Cancer Res 2009; 15(19). Кроме того, нефрэктомированные нокаут-мыши по катепсину S показали значимое снижение артериальной кальцификации по сравнению с нефрэктомированными мышами дикого типа. Это указывает на то, что ингибирование катепсина S может обладать полезным действием, снижающим число сердечно-сосудистых эпизодов у пациентов с хроническим заболеванием почек (Elena Aikawa, Circulation, 2009, 1785-1794). Катепсин L проявляет более широкий профиль экспрессии, чем катепсин S, и также имеются данные, позволяющие предположить роль катепсина L при атеросклерозе, например, мыши с дефицитом ЛПНП-Rec и Cat L проявляют ослабленный атеросклеротический фенотип (Kitamoto, S., et al. (2007), 'Cathepsin L deficiency reduces diet-induced atherosclerosis in low-density lipoprotein receptor-knockout mice',Circulation, 115 (15), 2065-75). Кроме того, предположили, что Cat L вовлечен в метаболический синдром,поскольку он контролирует адипогенез и периферическую толерантность к глюкозе. Описано, что при заболевании почек катепсин L регулирует функцию подоцитов посредством протеолитического процессинга динамина и, следовательно, протеинурию (Sever, S., et al. (2007), 'Proteolytic processing of dynaminby cytoplasmic cathepsin L is a mechanism for proteinuric kidney disease', J Clin Invest, 117 (8), 2095-104). Клеточными активностями, описанными для катепсина L, являются следующие активности: ремоделирование ткани, расщепление внеклеточного матрикса, образование активных нейропептидов и роли в презентировании антигена в эпителиальных клетках тимуса (Funkelstein et al. (2008), (a) Major role ofsion, Journal of Neurochemistry, 106(1), 384-391, Rudensky and Beers 2006). В настоящем описании термин "алкил", отдельно или в комбинации, означает прямоцепочечную или разветвленную алкильную группу, имеющую от 1 до 8 атомов углерода, в частности, прямоцепочечную или разветвленную алкильную группу, имеющую от 1 до 6 атомов углерода, и, в частности, прямоцепочечную или разветвленную алкильную группу, имеющую от 1 до 4 атомов углерода. Примерами прямоцепочечных и разветвленных C1-C8 алкильных групп являются следующие группы: метил, этил,пропил, изопропил, бутил, изобутил, трет-бутил, изомерные пентилы, изомерные гексилы, изомерные гептилы и изомерные октилы, в частности, метил, этил, пропил, изопропил, изобутил и трет-бутил, более конкретно метил. Термин "алкокси", отдельно или в комбинации, означает группу формулы алкил-О-, в которой термин "алкил" имеет приведенное выше значение, такую как метокси, этокси, н-пропокси, изопропокси, нбутокси, изобутокси, втор-бутокси и трет-бутокси, в частности, метокси. Термин "окси", отдельно или в комбинации, означает группу -О-. Термин "атом галогена" или "галоген", отдельно или в комбинации, означает атом фтора, хлора, брома или иода. Термины "галогеналкил" и "галогеналкокси", отдельно или в комбинации, означают алкильную группу и алкоксигруппу, замещенную по меньшей мере одним атомом галогена, в частности, замещенную атомами галогена в количестве от одного до пяти, в частности, атомами галогена в количестве от одного до трех. Конкретный "галогеналкил" представляет собой трифторметил. Конкретные галогеналкоксигруппы представляют собой трифторэтокси и трифторпропилокси. Термин "фармацевтически приемлемые соли" относится к солям, сохраняющим биологическую эффективность и свойства свободных оснований или свободных кислот, и не являющимся ни биологически, ни иначе нежелательными. Эти соли образуют с неорганическими кислотами, такими как соляная кислота, бромисто-водородная кислота, серная кислота, азотная кислота, фосфорная кислота, в частности, соляная кислота, и с органическими кислотами, такими как уксусная кислота, пропионовая кислота,гликолевая кислота, пировиноградная кислота, щавелевая кислота, малеиновая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, паратолуолсульфоновая кислота, салициловая кислота, N-ацетилцистеин. Кроме того, эти соли могут быть получены путем присоединения неорганического основания или органического основания к свободной кислоте. Соли, образованные из неорганического основания, включают, но не ограничены ими, соли натрия, калия, лития, аммония, кальция, магния. Соли, образованные из органических оснований, включают, но не ограничены ими, соли первичных, вторичных и третичных аминов, замещенных аминов, включая встречающиеся в природе замещенные амины, циклических аминов и основных ионообменных смол,таких как изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, этаноламин, лизин,аргинин, N-этилпиперидин, пиперидин, полииминные смолы. Соединение формулы (I) может быть также представлено в форме цвиттерионов. Конкретные фармацевтически приемлемые соли соединений формулы (I) представляют собой соли соляной кислоты, бромисто-водородной кислоты, серной кислоты,фосфорной кислоты и метансульфоновой кислоты. Если любое из исходных веществ или соединений формулы (I) содержат одну или более функциональных групп, являющихся нестабильными или активными в условиях реакции одной или более стадий реакции, перед критической стадией можно вводить подходящие защитные группы (как раскрыто, например, в кн. "Protective Groups in Organic Chemistry" by T. W. Greene and P. G. M. Wutts, 3rd Ed., 1999,Wiley, New York), применяя способы, хорошо известные в данной области техники. Такие защитные группы можно удалить на последующей стадии синтеза, используя стандартные способы, описанные в литературе. Примерами подходящих защитных групп являются следующие группы: трет-бутоксикарбонил (Вос), 9-флуоренилметилкарбамат (Fmoc), 2-триметилсилилэтилкарбамат (Теос), карбобензилокси (Cbz) и параметоксибензилоксикарбонил (Moz). Соединения формулы (I) могут содержать несколько асимметрических центров, и могут быть представлены в форме оптически чистых энантиомеров, смесей энантиомеров, таких как, например, рацематы, смесей диастереоизомеров, диастереоизомерных рацематов или смесей диастереоизомерных рацематов. Термин "асимметрический атом углерода" означает атом углерода с четырьмя различными заместителями. Согласно правилу Кана - Ингольда - Прелога асимметрический атом углерода может иметь "R" или "S" конфигурацию. Изобретение, в частности, относится к следующим соединениям: соединение формулы (I), где А 1 представляет собой -S(O)2-; соединение формулы (I), где А 2 представляет собой -(СН)-; соединение формулы (I), где R1 представляет собой атом хлора, атом брома, атом иода или трифторметил; соединение формулы (I), где R2 представляет собой атом галогена; соединение формулы (I), где R2 представляет собой атом хлора или фтора; соединение формулы (I), где R3 представляет собой атом водорода, атом галогена или галогеналкил;-3 025166 соединение формулы (I), где R3 представляет собой атом галогена; соединение формулы (I), где R3 представляет собой атом хлора; соединение формулы (I), где R4 и R6 независимо выбраны из атома водорода и галогеналкила; соединение формулы (I), где R4 и R6 независимо выбраны из атома водорода и трифторметила; соединение формулы (I), где R5 представляет собой атом водорода, алкокси, галогеналкокси, атом галогена, алкилпиридинил или алкилпиразолил; и соединение формулы (I), где R5 представляет собой атом водорода, метокси, трифторэтокси, атом фтора, трифторпропилокси, атом брома, метилпиридинил или метилпиразолил. Изобретение далее относится к соединению формулы (I), выбранному из следующих соединений:(2S,4R)-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(2-[1,2,4]триазол-1-ил-бензолсульфонил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амид. Изобретение, в частности, относится к соединению формулы (I), выбранному из следующих соединений:(2S,4R)-4-[2-хлор-4-(1-метил-1 Н-пиразол-4-ил)бензолсульфонил]-1-[1-(3,5-дихлорпиридин-2-ил) циклопропанкарбонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида. Соединение формулы (I) может быть получено, используя методы, известные в данной области техники. Соединение формулы (I) может быть также получено, используя описанные ниже методы. В настоящем описании использованы следующие сокращения.KOH. Производное пиридина, такое как 1, обрабатывают циклопропанкарбонитрилом 2 в присутствии основания (основания 1, как определено выше) с получением производного пиридина 3. Соединение 3 обрабатывают основанием (основанием 2, как определено выше) с получением конечного производного карбоновой кислоты 4 в виде свободной кислоты или в виде ее соли. Схема 2LG представляет собой уходящую группу, такую как трифлат, мезилат, тозилат, брозилат или нозилат; А 2 и R3-R6 являются такими, как определено выше; R представляет собой, например, метил, этил,изопропил или бензил. Вос-защищенное производное пролина 5 подвергают взаимодействию с производным фенилтиола в присутствии основания, такого как триэтиламин, DIEA, 2,6-лутидин и т.д., с получением производного тиоэфира 6. В результате окисления соединения 6 пероксидным реагентом, таким как Н 2 О 2, оксон,mCPBA, получают сульфоновое производное 7. В результате омыления сложного эфира до кислоты основанием, таким как LiOH, NaOH или KOH получают соответствующую карбоновую кислоту 8 или ее соли. Амидное сочетание осуществляют путем взаимодействия соединения 8 с 1-аминокарбонитрильным производным и реагентом сочетания, таким как EDCl, CDl, BOP-Cl, TBTU, HATU, РуВОР или ВОР, в присутствии основания, такого как DIEA, триэтиламин или лутидин, с получением амида 9. Наконец,защитную группу Boc удаляют путем обработки соединения 9 кислотой, такой как ТФУ, HCl, в органическом растворителе (например, в AcOEt, диоксане) или муравьиной кислоте с получением амина 10. Схема 3 А 2 и R1-R6 являются такими, как определено выше. Карбоновую кислоту 4 подвергают взаимодействию с амином 10 в присутствии любого из реагентов амидного сочетания, таких как EDCl, CDl, BOP-Cl, TBTU, HATU, РуВОР или ВОР, в присутствииR1-R4 и R6 являются такими, как определено выше; LG представляет собой уходящую группу, такую как Cl, Br, I; R5 представляет собой фенил, замещенный фенил, гетероциклил или замещенный гетероциклил, как определено выше; R представляет собой Н или метил, или оба R вместе с атомом бора. К которому они присоединены, образуют 2,4,4,5,5-пентаметил-[1,3,2]диоксаборолан. Соединение 12 подвергают взаимодействию с производным бороновой кислоты или ее сложного эфира 13 в присутствии основания, такого как Na2CO3, K2CO3, Cs2CO3, KOtBu, K3PO4, и катализатора,известного в данной области техники для проведения реакций Сузуки, такого как Pd(PPh3)4, Pd2(dba)3 или источник Pd с фосфиновым лигандом, с получением производного биарила 11. Схема 5LG представляет собой уходящую группу, такую как трифлат, мезилат, тозилат, брозилат или нозилат; А 2 и R1-R6 являются такими, как определено выше; X представляет собой F, Cl, Br, I или X = O-LG. Аминолактон 14 или его соответствующую соль, такую как гидрохлорид, гидробромид, фосфат,гидрофосфат, сульфат, гидросульфат, метансульфонат и т.д., подвергают взаимодействию с карбоновой кислотой 4 в присутствии реагента амидного сочетания, такого как EDCl, CDl, BOP-Cl, TBTU, HATU,РуВОР или ВОР, в присутствии основания, такого как DIEA, триэтиламин, 2,6-лутидин, или альтернативно в присутствии галогенангидрида, такого как фосген, трифосген, оксалилхлорид или тионилхлорид,с получением амида 15. Размыкание лактона 15 амином проводят в присутствии подходящего основания,такого как натрий-2-этилгексаноат, TEA, DIEA, ДМАП, 2,6-лутидин или пиридин, с получением спирта 16. Соединение 16 обрабатывают X-LG в присутствии основания, такого как TEA, DIEA, ДМАП, 2,6 лутидин или пиридин, с получением промежуточного соединения 17, которое затем подвергают взаимодействию с тиолами с получением тиоэфира 18. Окисления тиоэфира 18 до сульфона 19 достигают путем взаимодействия соединения 18 с окисляющими реагентами, такими как Н 2 О 2, оксон, МСРВА.R3 представляет собой уходящую группу, такую как F, Cl или S(O)2-Me; X представляет собой либоN, либо СН; Основание представляет собой неорганическое основание, такое как Na2CO3, K2CO3, Cs2CO3,или органическое основание, такое как DIEA, триэтиламин или 2,6-лутидин. Соединение 20 растворяют в подходящем растворителе, таком как ДМФ, DMA или ТГФ, к реакционной смеси добавляют основание, как определено выше, и азотсодержащий 5-членный гетероцикл. Сначала смесь перемешивают при комнатной температуре, а затем нагревают до повышенной температуры от 30 до 100 С до завершения реакции. Изобретение также относится к способу получения соединения формулы (I), как определено выше,включающему любую из следующих стадий: (а) взаимодействие соединения формулы (А) в присутствии кислоты, где А 1, А 2 и R1-R6 являются такими, как определено выше, и где PG представляет собой защитную группу амина; (b) взаимодействие соединения формулы (В 1) в присутствии основания и реагента амидного сочетания и основания, где А 1, А 2 и R1-R6 являются такими, как определено выше;(с) взаимодействие соединения формулы (С) в присутствии R5B(OR)2, основания и катализатора Сузуки, где А 1, А 2 и R1-R4 и R6 являются такими, как определено выше, LG представляет собой уходящую группу, R5 представляет собой алкилпиридинил, галогенпиридинил или алкилпиразолил, и R представляет собой атом водорода или метил, или оба R вместе с атомом бора, к которому они присоединены, образуют 2,4,4,5,5-пентаметил[1,3,2]диоксаборолан; или(d) взаимодействие соединения формулы (D) На стадии (а) кислота представляет собой, например, ТФУ, HCl или муравьиную кислоту. На стадии (а) защитная группа амина представляет собой, например, boc, Fmoc, Cbz, Teoc, бензил или Moz. На стадии (b) агент амидного сочетания представляет собой, например, EDCl, CDl, BOP-Cl, TBTU,HATU, РуВОР или ВОР. На стадии (b) основание представляет собой, например, DIEA, триэтиламин или 2,6-лутидин. На стадии (с) уходящая группа представляет собой, например, Cl, Br или I. На стадии (с) основание представляет собой, например, Na2CO3, K2CO3, Cs2CO3, KOtBu или K3PO4. На стадии (с) катализатор Сузуки представляет собой, например, Pd(PPh3)4, Pd2(dba)3 или источникPd с фосфиновым лигандом. На стадии (d) окисляющий агент представляет собой, например, Н 2 О 2, оксон или МСРВА. Соединение формулы (I), полученное описанным выше способом, также является объектом изобретения. Соединения формулы (I) и их фармацевтически приемлемые соли можно применять в качестве лекарственных средств (например, в форме фармацевтических препаратов). Эти фармацевтические препараты можно вводить внутрь, как, например, перорально (например, в форме таблеток, таблеток с покрытием, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий), назально (например, в форме назальных спреев) или ректально (например, в форме суппозиториев). Тем не менее,введение может быть также выполнено парентерально, например, внутримышечно или внутривенно (например, в форме инъекционных растворов). Соединения формулы (I) и их фармацевтически приемлемые соли можно обрабатывать с фармацевтически инертными, неорганическими или органическими адъювантами для получения таблеток, таблеток с покрытием, драже и твердых желатиновых капсул. В качестве таких адъювантов для таблеток, драже и твердых желатиновых капсул можно использовать, например, лактозу, кукурузный крахмал или его производные, тальк, стеариновую кислоту или ее соли и т.д. Подходящими адъювантами для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы. Подходящими адъювантами для получения растворов и сиропов являются, например, вода, полиолы, сахароза, инвертный сахар и глюкоза. Подходящими адъювантами для инъекционных растворов являются, например, вода, спирты, полиолы, глицерин и растительные масла. Подходящими адъювантами для суппозиториев являются, например, натуральные или отвержденные масла, воски, жиры, полутвердые и жидкие полиолы. Кроме того, фармацевтические препараты могут содержать консерванты, солюбилизаторы, вещества, увеличивающие вязкость, стабилизаторы, увлажняющие агенты, эмульгаторы, подсластители, красители, корригенты, соли для варьирования осмотического давления, буферы, маскирующие агенты или антиоксиданты. Эти препараты могут также содержать другие терапевтически ценные вещества. Изобретение, таким образом, также относится, в частности, к следующему: К соединению формулы(I), применяемому в качестве терапевтически активного вещества. К фармацевтической композиции, содержащей соединение формулы (I) и терапевтически инертный носитель. К применению соединения формулы (I) для получения лекарственного средства для лечения или профилактики диабета, атеросклероза, аневризмы брюшной аорты, болезни периферических артерий,рака, снижение числа сердечно-сосудистых эпизодов при хроническом заболевании почек, диабетической нефропатии, диабетической ретинопатии или возрастной макулярной дегенерации. К соединению формулы (I) для лечения или профилактики для лечения или профилактики диабета,атеросклероза, аневризмы брюшной аорты, болезни периферических артерий, рака, снижение числа сердечно-сосудистых эпизодов при хроническом заболевании почек, диабетической нефропатии, диабетической ретинопатии или возрастной макулярной дегенерации. К способу лечения или профилактики для лечения или профилактики диабета, атеросклероза, аневризмы брюшной аорты, болезни периферических артерий, рака, снижение числа сердечно-сосудистых эпизодов при хроническом заболевании почек, диабетической нефропатии, диабетической ретинопатии или возрастной макулярной дегенерации, включающий введение эффективного количества соединения формулы (I). Далее изобретение проиллюстрировано приведенными ниже примерами, не имеющими ограничивающего характера. Примеры осуществления изобретения Пример 1. (2S,4R)-4-(2-Хлор-4-метоксибензолсульфонил)-1-[1-(5-хлорпиридин-2-ил)-циклопропанкарбонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амид К раствору 5-хлор-2-фторпиридина (2 г, 1,53 мл, 15,2 ммоль, экв.: 1,00) и циклопропанкарбонитрила (1,02 г, 1,15 мл, 15,2 ммоль, экв.: 1,00) в толуоле (20,0 мл) добавляли по каплям в течение 5 минKHMDS 0,5 М в толуоле (30,4 мл, 15,2 ммоль, экв.: 1,00) при 0 С. Раствор становился коричневым. Через 45 мин реакционной смеси давали подогреться до 22 С и перемешивали в течение 2,5 ч. Затем добавляли насыщенный водный раствор NH4Cl (50 мл), и водную фазу экстрагировали AcOEt (360 мл). Объединенные органические фазы высушивали над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенное вещество очищали флэш-хроматографией (силикагель, 70 г, от 0 до 20% EtOAc в гептане) с получением соединения, указанного в заголовке, в виде белого твердого вещества (840 мг; 31%). m/z = 179,0373 [М+Н]+. Соединение 1 а) (600 мг, 3,36 ммоль, экв.: 1,00) растворяли в 1% водном растворе KOH (18 мл, 207 мг, 3,7 ммоль, экв.: 1,1). Реакционную смесь перемешивали 17 ч при 100 С. Неочищенную реакционную смесь концентрировали в вакууме и подкисляли до рН 4. Неочищенное вещество очищали препаративной высокоэффективной жидкостной хроматографией (ВЭЖХ) с получением соединения, указанного в заголовке, в виде белого твердого вещества (339 мг; 51%). m/z =198,1 [М+Н]+. с) (2S,4R)-4-(2-Хлор-4-метоксибензолсульфонил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амид, соль HClCAS 1252640-17-7 (номер по журналу Кемикал Абстрактс; от англ. "Chemical Abstracts") (600 мг,1,24 ммоль, экв.: 1,00) растворяли в HCl/диоксане (1,55 мл, 6,2 ммоль, экв.: 5,00) и перемешивали при 22 С в течение 4 ч. Неочищенную реакционную смесь концентрировали в вакууме с получением белого твердого вещества (309 мг; 65%), которое использовали без дополнительной очистки, m/z = 384,2(198 мг, 521 мкмоль, экв.: 2,00), DIEA (67,3 мг, 91,0 мкл, 521 мкмоль, экв.: 2,00) и пример 1 с) (100 мг, 261 мкмоль, экв.: 1,00) и перемешивали при 22 С в течение 15 ч. Неочищенное вещество очищали препаративной ВЭЖХ с получением соединения, указанного в заголовке, в виде белого твердого вещества (106 мг; 72%). m/z = 563,2 [М+Н]+. Пример 2. (2S,4R)-4-(2-Хлорбензолсульфонил)-1-[1-(5-хлорпиридин-2-ил)циклопропанкарбонил] пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амид Пример 2 был получен по аналогии с примером 1, начиная с CAS 1252638-10-0, с получением соединения, указанного в заголовке, в виде белого твердого вещества (106 мг; 72%). m/z = 533,2 [М+Н]+. Пример 3. (2S,4R)-1-[1-(5-Хлорпиридин-2-ил)циклопропанкарбонил]-4-[2-хлор-4-(2,2,2-трифторэтокси)бензолсульфонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амид Пример 3 был получен по аналогии с примером 1, начиная с CAS 1252634-04-0, с получением соединения, указанного в заголовке, в виде белого твердого вещества (50 мг; 36%). m/z = 631,1 [М+Н]+. Пример 4. (2S,4R)-1-[1-(5-Хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(2-хлор-4-метоксибензолсульфонил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амид Пример 4 был получен по аналогии со способами, описанными в примере 1, начиная с 5-хлор-2,3 дифторпиридина и примера 1 с), с получением соединения, указанного в заголовке, в виде белого твердого вещества (45 мг; 30%). m/z = 581,1 [М+Н]+. Пример 5. (2S,4R)-4-(2-Хлорбензолсульфонил)-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амид Пример 5 был получен по аналогии со способами, описанными в примере 1, начиная с 5-хлор-2,3 дифторпиридина и CAS 1252638-10-0, с получением соединения, указанного в заголовке, в виде белого твердого вещества (99 мг; 64%). m/z = 551,1 [М+Н]+. Пример 6. (2S,4R)-1-[1-(5-Хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-[2-хлор-4-(2,2,2-трифторэтокси)бензолсульфонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амид Пример 6 был получен по аналогии со способами, описанными в примере начиная с 5-хлор-2,3 дифторпиридина и CAS 1252634-04-0, с получением соединения, указанного в заголовке, в виде белого твердого вещества (114 мг; 79%). m/z = 649,2 [М+Н]+. Пример 7. (2S,4R)-1-[1-(5-Бром-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(2-хлор-4-метоксибензолсульфонил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амид Пример 7 был получен по аналогии со способами, описанными в примере 1, начиная с 5-бром-2,3 дифторпиридина и примера 1 с), с получением соединения, указанного в заголовке, в виде белого твердого вещества (14 мг; 17%). m/z = 627,0 [М+Н]+. Пример 8. (2S,4R)-1-[1-(5-Бром-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(2-хлорбензолсульфонил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амид Пример 8 был получен по аналогии со способами, описанными в примере 1, начиная с 5-бром-2,3 дифторпиридина и CAS 1252638-10-0, с получением соединения, указанного в заголовке, в виде белой пены (48 мг; 57%). m/z = 597,0 [М+Н]+. Пример 9. (2S,4R)-1-[1-(5-Хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(4'-фтордифенил-3 илсульфанил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амид К молочно-белой суспензии 5-хлор-3-фторпиридин-2-карбоновой кислоты, полученной по аналогии с примером 1b) (670 мг, 3,11 ммоль, экв.: 1,00), в толуоле (6 мл) при 25 С добавляли ДМФ (11,4 мг, 12,0 мкл, 155 мкмоль, экв.: 0,05). Смесь охлаждали до 0 С, затем добавляли по каплям раствор оксалилхлорида (434 мг, 299 мкл, 3,42 ммоль, экв.: 1,10) в толуоле (2,00 мл) в течение 10 мин. Реакционную смесь перемешивали при 0 С в течение 30 мин, затем без охлаждения в течение 3 ч. При 0 С к реакционной смеси добавляли по каплям (1S,4S)-2-окса-5-аза-бицикло[2.2.1]гептан-3-она метансульфонат (CAS 76916753-5) (650 мг, 3,11 ммоль, экв.: 1,00) и ТГФ (4,00 мл), а затем TEA (1,18 г, 1,62 мл, 11,7 ммоль, экв.: 3,75) в течение 10 мин (экзотермическая реакция). Смесь перемешивали при 22 С в течение 16 ч. Реакционную смесь наливали в 20% водный раствор лимонной кислоты (25 мл) и экстрагировали EtOAc (320 мл). Органические слои высушивали над Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали флэш-хроматографией (силикагель, 40 г, от 0% до 50% EtOAc в гептане) с получением соединения, указанного в заголовке, в виде оранжевого масла (850 мг; 88%). m/z = 311,1 [М+Н]+.(422 мг, 3,56 ммоль, экв.: 1,30), натрия 2-этилгексаноата (705 мг, 4,24 ммоль, экв.: 1,55) в воде (3 мл) и ТГФ (2,00 мл) перемешивали при 55 С в течение 18 ч. К реакционной смеси добавляли соляную кислоту(189 мг, 157 мкл, 1,91 ммоль, экв.: 0,70) и хлорид натрия (1,36 г, 1,36 мл, 23,3 ммоль, экв.: 8,50). Смесь перемешивали в течение 15 мин, затем наливали в AcOEt (25 мл) и экстрагировали. Водный слой снова экстрагировали AcOEt (320 мл). Органические слои высушивали над Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали флэш-хроматографией (силикагель, 40 г, от 0% до 90% EtOAc в гептане) с получением соединения, указанного в заголовке, в виде белой пены (560 мг; 52%). m/z = 393,0 сульфонилхлорид (335 мг, 1,51 ммоль, экв.: 1,06). Смесь охлаждали до 0 С о медленно и осторожно добавляли TEA (433 мг, 596 мкл, 4,28 ммоль, экв.: 3,00) шприцом. Ледяную баню удаляли, и реакционную смесь перемешивали при 25 С в течение 18 ч. Реакционную смесь экстрагировали 10% водным раствором Na2CO3 и 0,1 н. водным раствором HCl. Органические слои высушивали над Na2SO4, фильтровали и выпаривали. Неочищенное вещество очищали флэш-хроматографией (силикагель, 40 г, от 0 до 85%EtOAc в гептане) с получением соединения, указанного в заголовке, в виде беловатого твердого вещества Пример 9 с) (70 мг, 121 мкмоль, экв.: 1,00) и 4'-фтордифенил-3-тиол (27,2 мг, 133 мкмоль, экв.: 1,10) растворяли в пропионитриле (1 мл). Добавляли TEA (30,6 мг, 42,2 мкл, 303 мкмоль, экв.: 2,50), и реакционную смесь перемешивали при 90 С в течение 3 ч. Реакционную смесь наливали в 0,1 М водный растворHCl (10 мл) и экстрагировали EtOAc (310 мл). Органические слои объединяли, высушивали над Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали флэш-хроматографией (силикагель, 10 г,от 0 до 66% EtOAc в гептане) с получением соединения, указанного в заголовке, в виде беловатого масла Пример 10 был получен по аналогии со способами, описанными в примере 9, начиная с 3 хлорпиридин-2-тиола и примера 9 с), с получением соединения, указанного в заголовке, в виде светложелтого масла (50 мг; 79%). m/z = 522,0 [М+Н]+. Пример 11. (2S,4R)-1-(1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил)-4-(2-хлор-4-фторфенилсульфонил)-N-(1-цианоциклопропил)пирролидин-2-карбоксамид Пример 11 был получен по аналогии со способами, описанными в примере 1, начиная с 5-хлор-2,3 дифторпиридина и CAS 1252633-65-0, с получением соединения, указанного в заголовке, в виде белого твердого вещества (46 мг; 30%). m/z = 569,0632 [М+Н]+. Пример 12. (2S,4R)-1-[1-(5-Хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(пиридин-2-илсульфанил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амид Пример 12 был получен по аналогии со способами, описанными в примере 9, начиная с пиридин-2 тиола и примера 9 с), с получением соединения, указанного в заголовке, в виде бесцветного масла (4 мг; 7%). m/z = 486,1 [М+Н]+. Пример 13. (2S,4R)-1-[1-(5-Хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(4'-фтордифенил-3 сульфонил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амид Пример 9 (41 мг, 70,8 мкмоль, экв.: 1,00) растворяли в ДХМ (1 мл) и добавляли mCPBA (25,7 мг,149 мкмоль, экв.: 2,10). Реакционную смесь перемешивали в течение 3 ч при 22 С. Реакционную смесь наливали в 10% водный раствор Na2CO3 (5 мл) и экстрагировали ДХМ (35 мл). Органические слои высушивали над Na2SO4, фильтровали и концентрировали в вакууме с получением соединения, указанного в заголовке, в виде белого твердого вещества (42 мг; 97%). m/z = 611,0 [М+Н]+. Пример 14. (2S,4R)-1-[1-(5-Хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(3-хлорпиридин-2 сульфонил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амид Пример 14 был получен по аналогии со способами, описанными в примере 13, начиная с примера 10, с получением соединения, указанного в заголовке, в виде белого твердого вещества (44 мг; 99%). m/z Пример 15 был получен в виде побочного продукта во время синтеза примера 11 в виде желтого твердого вещества (36 мг; 21%). Пример 16. (2S,4R)-1-[1-(5-Хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(3-хлор-5-трифторметилпиридин-2-илсульфанил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амид Пример 16 был получен по аналогии со способами, описанными в примере 9, начиная с 3-хлор-5(трифторметил)пиридин-2-тиола и примера 9 с), с получением соединения, указанного в заголовке, в виде светло-желтого масла (4 мг; 5%). m/z = 585,9 [М+Н]+. Пример 17. (2S,4R)-1-[1-(5-Хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(5-хлорпиридин-2 илсульфанил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амид Пример 17 был получен по аналогии со способами, описанными в примере 9, начиная с 5 хлорпиридин-2-тиола и примера 9 с), с получением соединения, указанного в заголовке, в виде беловатого твердого вещества (30 мг; 83%). m/z = 522,0 [М+Н]+. Пример 18. Пример 18 был получен по аналогии со способами, описанными в примере 13, начиная с примера 10, с получением соединения, указанного в заголовке, в виде беловатого твердого вещества (3 мг; 94%). Пример 19 был получен по аналогии со способами, описанными в примере 9, начиная с 6 метилпиридин-2-тиола и примера 9 с), с получением соединения, указанного в заголовке, в виде беловатого твердого вещества (17 мг; 49%). m/z = 500,1 [М+Н]+. Пример 20. (2S,4R)-1-[1-(5-Хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(5-трифторметилпиридин-2-илсульфанил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амид Пример 20 был получен по аналогии со способами, описанными в примере 9, начиная с 5(трифторметил)пиридин-2-тиола и примера 9 с), с получением соединения, указанного в заголовке, в виде светло-желтого твердого вещества (32 мг; 84%). m/z = 554,1 [М+Н]+. Пример 21. (2S,4R)-1-[1-(5-Хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(3-трифторметилпиридин-2-илсульфанил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амид Пример 21 был получен по аналогии со способами, описанными в примере 9, начиная с 3(трифторметил)пиридин-2-тиола и примера 9 с), с получением соединения, указанного в заголовке, в виде желтого твердого вещества (33 мг; 86%). m/z = 554,1 [М+Н]+. Пример 22. (2S,4R)-1-[1-(5-Хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(5-хлорпиридин-2 сульфонил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амид Пример 22 был получен по аналогии со способами, описанными в примере 13, начиная с примера 17, с получением соединения, указанного в заголовке, в виде белой пены (22 мг; 80%). m/z = 552,1 Пример 23 был получен поаналогии со способами, описанными в примере 13, начиная с примера 19, с получением соединения, указанного в заголовке, в виде белой пены (13 мг; 82%). m/z = 532,0 Пример 24 был получен по аналогии со способами, описанными в примере 13, начиная с примера 20, с получением соединения, указанного в заголовке, в виде белого твердого вещества (29 мг; 98%). m/z Пример 25 был получен по аналогии со способами, описанными в примере 13, начиная с примера 21, с получением соединения, указанного в заголовке, в виде белого твердого вещества (16 мг; 52%). m/z Пример 26 был получен по аналогии со способами, описанными в примере 9, начиная с 2-хлор-5(трифторметил)бензолтиола и примера 9 с), с получением соединения, указанного в заголовке, в виде белого твердого вещества (10 мг; 25%). m/z = 586,9 [М+Н]+. Пример 27. (2S,4R)-1-(1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил)-4-(2-хлор-4-S)-1,1,1 трифторпропан-2-илокси)фенилсульфонил)-N-(1-цианоциклопропил)пирролидин-2-карбоксамид(23,2 мг, 71,1 мкмоль, экв.: 1,50) и (S)-1,1,1-трифторпропан-2-ол (5,95 мг, 52,2 мкмоль, экв.: 1,10) и перемешивали при 40 С в течение 4 ч. Неочищенное вещество очищали препаративной ВЭЖХ с получением соединения, указанного в заголовке, в виде белого твердого вещества (17 мг; 54%). m/z = 663,2 [М+Н]+. Пример 28. (2S,4R)-1-(1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил)-4-(2-хлор-5-(трифторметил)фенилсульфонил)-N-(1-цианоциклопропил)пирролидин-2-карбоксамид Пример 28 а) был получен по аналогии со способами, описанными для CAS 1252638-10-0 (см. Наар Пример 28b) был получен по аналогии с примером 1, начиная с примера 28 а) и 5-хлор-2,3 дифторпиридина, с получением соединения, указанного в заголовке, в виде белого твердого вещества (37 мг; 50%). m/z = 619,1 [М+Н]+. Пример 29. (2S,4R)-1-[1-(5-Хлорпиридин-2-ил)циклопропанкарбонил]-4-(2-хлор-5-трифторметилбензолсульфонил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амид Пример 29 был получен по аналогии с примером 1, начиная с примера 28 а) и примера 1b), с получением соединения, указанного в заголовке, в виде белого твердого вещества (37 мг; 50%). m/z = 601,1 Пример 30 был получен по аналогии с примером 28, начиная с 4-бром-2-хлорбензолтиола, с получением соединения, указанного в заголовке, в виде белой пены (860 мг; 79%) m/z = 631,0 [М+Н]+. Пример 31. (2S,4R)-1-(1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил)-4-(2-хлор-4-(2-метилпиридин-4-ил)фенилсульфонил)-N-(1-цианоциклопропил)пирролидин-2-карбоксамид Пример 30 (100 мг, 159 мкмоль, экв.: 1,00) растворяли в 1,2-диметоксиэтане (2 мл). Добавляли 2 метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин (45,2 мг, 206 мкмоль, экв.: 1,30), трифенилфосфин (8,32 мг, 31,7 мкмоль, экв.: 0,20), 2 М водный раствор Na2CO3 (500 мкл) и Pd(OAc)2 (3,56 мг,15,9 мкмоль, экв.: 0,10) и перемешивали при 45 С в течение 4 ч. Реакционную смесь наливали в 0,1 М водный раствор HCl (10 мл) и экстрагировали ДХМ (310 мл). Органические слои высушивали надNa2SO4 и концентрировали в вакууме. Неочищенное вещество очищали препаративной ВЭЖХ с получением соединения, указанного в заголовке, в виде беловатой пены (61 мг; 60%). m/z = 642,1 [М+Н]+. Пример 32. (2S,4R)-4-[2-Хлор-4-(2-хлорпиридин-4-ил)бензолсульфонил]-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амид Пример 32 был получен по аналогии с примером 31, начиная с примера 30 и 2-хлор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридина, с получением соединения, указанного в заголовке, в виде белого твердого вещества (27 мг; 26%) m/z = 664,1 [М+Н]+. Пример 33. (2S,4R)-1-[1-(5-Хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-[2-хлор-4-(1-метил 1 Н-пиразол-4-ил)бензолсульфонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амид Пример 33 был получен по аналогии с примером 31, начиная с примера 30 и 1-метил-4-(4,4,5,5 тетраметил-1,3,2-диоксаборолан-2-ил)-1 Н-пиразола, с получением соединения, указанного в заголовке, в виде белого твердого вещества (25 мг; 25%). m/z = 631,1 [М+Н]+. Пример 34. (2S,4R)-1-[1-(5-Хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-[2-хлор-4-(2-метилпиридин-3-ил)бензолсульфонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амид Пример 34 был получен по аналогии с примером 31, начиная с примера 30 и 2-метил-3-(4,4,5,5 тетраметил-1,3,2-диоксаборолан-2-ил)пиридина, с получением соединения, указанного в заголовке, в виде белой пены (47 мг; 38%), m/z = 642,2 [М+Н]+. Пример 35. (2S,4R)-4-[2-Хлор-4-(2-метилпиридин-3-ил)бензолсульфонил]-1-[1-(3-фтор-5-трифторметилпиридин-2-ил)циклопропанкарбонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил) амид Пример 35 а) был получен по аналогии со способами, описанными для CAS 1252631-66-5 (see Haapet al.; US20100267722), начиная с (2S,4R)-1,2-пирролидиндикарбоновой кислоты 4-гидрокси-1-(1,1-диметилэтил)эфира и 4-бром-2-хлор-бензолтиола, с получением соединения, указанного в заголовке, в виде белого твердого вещества (3,2 г; 58%). m/z = 434,1 [М+Н-Вос]+.(29,5 мг, 131 мкмоль, экв.: 0,10) и перемешивали при 22 С в течение 24 ч. После этого реакционную смесь перемешивали при 50 С в течение 24 ч. Затем к реакционной смеси добавляли 2-метил-3-(4,4,5,5 тетраметил-1,3,2-диоксаборолан-2-ил)пиридин (57,6 мг, 263 мкмоль, экв.: 0,2), а затем перемешивали при 60 С в течение 6 ч. Реакционную смесь наливали в 0,1 М водный раствор HCl (50 мл) и экстрагировали ДХМ (320 мл). Органические слои высушивали над Na2SO4 и концентрировали в вакууме. Неочищенное вещество очищали флэш-хроматографией (силикагель, 40 г, от 0% до 100% EtOAc в гептане) с получением соединения, указанного в заголовке, в виде светло-желтого масла (200 мг; 28%). m/z = 545,3 Пример 35b) (200 мг, 367 мкмоль, экв.: 1,00) растворяли в муравьиной кислоте (2,4 г, 2 мл, 52,1 ммоль, экв.: 142) и перемешивали при 22 С в течение 15 ч. Реакционную смесь осторожно доводили охлажденным во льду водным 10% раствором Na2CO3 до рН 8 и экстрагировали CH2Cl2. Водный слой промывали суммарно 3 раза CH2Cl2/ТГФ (1:1; 30 мл), объединенные органические слои высушивали над Пример 35d) был получен по аналогии со способами, описанными для примеров 1 а) и b), с получением соединения, указанного в заголовке, в виде светло-коричневого твердого вещества (50 мг; 41%),m/z = 250,0 [М+Н]+. е) Соединение, указанное в заголовке, было получено по аналогии с примером 1d), начиная с примера 35 с) (45 мг) и 35d) (30 мг), с получением беловатого твердого вещества (34 мг, 50%), m/z = 676,3 [М+Н]+. Пример 36. (2S,4R)-4-[2-Хлор-4-(2-метилпиридин-3-ил)бензолсульфонил]-1-[1-(3-фтор-5-иодпиридин-2-ил)циклопропанкарбонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амид Пример 36 был получен по аналогии с примером 35, начиная с примера 35 с) и 1-(3-фтор-5-иодпиридин-2-ил)-циклопропанкарбоновой кислоты, которая была получена по аналогии с примерами 1 а) и 1b), с получением соединения, указанного в заголовке, в виде беловатого твердого вещества (35 мг; 47%), m/z = 734,2 [М+Н]+. Пример 37. (2S,4R)-4-[2-Хлор-4-(2-метилпиридин-3-ил)бензолсульфонил]-1-[1-(3,5-дихлорпиридин 2-ил)циклопропанкарбонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амид Пример 37 был получен по аналогии с примером 35, начиная с примера 35 с) и 1-(5-хлор-3-фторпиридин-2-ил)-циклопропанкарбоновой кислоты, которая была получена по аналогии с примерами 1 а) и 1b), с получением соединения, указанного в заголовке, в виде беловатого твердого вещества (26 мг; 39%), m/z = 660,2 [М+Н]+. Пример 38. Пример 38 а) был получен по аналогии с примером 35 с), начиная с примеров 35 а) и 1-метил-4(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1 Н-пиразола, с получением соединения, указанного в заголовке, в виде светло-коричневой пены (173 мг; 95%). m/z = 434,2 [М+Н]+. Пример 38b) был получен по аналогии с примером 35, начиная с примера 38 а) и 1-(3-фтор-5-иодпиридин-2-ил)-циклопропанкарбоновой кислоты, которая была получена по аналогии с примерами 1 а) и 1b), с получением соединения, указанного в заголовке, в виде беловатого твердого вещества (40 мг; 48%), m/z = 723,1 [М+Н]+. Пример 39. (2S,4R)-4-[2-Хлор-4-(1-метил-1 Н-пиразол-4-ил)бензолсульфонил]-1-[1-(3-фтор-5-трифторметилпиридин-2-ил)циклопропанкарбонил]пирролидин-2-карбоновой кислоты Пример 39 был получен по аналогии с примером 38b), начиная с примера 38 а) и 35d), с получением соединения, указанного в заголовке, в виде беловатого твердого вещества (16 мг; 60%). m/z = 665,1 Пример 40 был получен по аналогии с примером 35, начиная с примера 38 а) и 1-(3,5-дихлорпиридин-2-ил)-циклопропанкарбоновой кислоты, которая была получена по аналогии с примерами 1 а) и 1b), с получением соединения, указанного в заголовке, в виде беловатого твердого вещества (29 мг; 39%), m/z = 649,2 [М+Н]+. Пример 41. (2S,4R)-4-(2-Фторбензолсульфонил)-1-[1-(3-фтор-5-иодпиридин-2-ил)циклопропанкарбонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амид Пример 41 был получен по аналогии с примером 8, начиная с 2-фторбензолтиола и 1-(3-фтор-5-иодпиридин-2-ил)-циклопропанкарбоновой кислоты, с получением соединения, указанного в заголовке, в виде белой пены (328 мг; 68%). m/z = 627,3 [М+Н]+. Пример 42. (2S,4R)-1-[1-(5-Хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(2-фторбензолсульфонил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амид Пример 42 был получен по аналогии с примером 41, начиная с 2-фторбензолтиола и 1-(5-хлор-3 фтор-пиридин-2-ил)-циклопропанкарбоновой кислоты, с получением соединения, указанного в заголовке, в виде белой пены (212 мг; 67%). m/z = 535,4 [М+Н]+. Пример 43. (2S,4R)-1-[1-(3-Фтор-5-иодпиридин-2-ил)циклопропанкарбонил]-4-(2-пиразол-1-илбензолсульфонил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амид В пробирку на 5 мл добавляли пример 41 (60 мг, 95,8 мкмоль, экв.: 1,00), 1 Н-пиразол (9,78 мг, 144 мкмоль, экв.: 1,50), Cs2CO3 (37,4 мг, 115 мкмоль, экв.: 1,20) и ДМФ (1 мл). Реакционную смесь перемешивали в течение 24 ч при 22 С. К реакционной смеси снова добавляли 1Н-пиразол (9,78 мг, 144 мкмоль,экв.: 1,50) и перемешивали в течение 24 ч при 50 С. Неочищенное вещество очищали препаративной ВЭЖХ с получением соединения, указанного в заголовке, в виде белой пены (8 мг; 12,4%). m/z = 675,0647 [М+Н]+. Пример 44. (2S,4R)-1-[1-(3-Фтор-5-иодпиридин-2-ил)циклопропанкарбонил]-4-(2-[1,2,3]триазол-1 ил-бензолсульфонил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амид В пробирку на 5 мл добавляли пример 41 (60 мг, 95,8 мкмоль, экв 1,00), 1 Н-1,2,3-триазол (9,92 мг,8,32 мкл, 144 мкмоль, экв 1,50), Cs2CO3 (37,4 мг, 115 мкмоль, экв 1,20) и ДМА (1 мл) Реакционную смесь перемешивали в течение 24 ч при 22 С К реакционной смеси снова добавляли 1 Н-1,2,3-триазол (9,92 мг,8,32 мкл, 144 мкмоль, экв 1,50) и перемешивали в течение 24 ч при 50 С Неочищенное вещество очищали препаративной ВЭЖХ с получением соединения, указанного в заголовке, в виде белой пены (25 мг,23%, чистота 50-80%) m/z = 676,0638 [М+Н]+ Пример 45. (2S,4R)-1-[1-(3-Фтор-5-иодпиридин-2-ил)циклопропанкарбонил]-4-(2-[1,2,4]триазол-1 ил-бензолсульфонил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амид В пробирку на 5 мл добавляли пример 41 (60 мг, 95,8 мкмоль, экв 1,00), 1 Н-1,2,4-триазол (9,92 мг,- 22025166 144 мкмоль, экв 1,50), 1 Н-1,2,4-триазол (9,92 мг, 144 мкмоль, экв 1,50) и ДМА (1 мл) Реакционную смесь перемешивали в течение 24 ч при 22 С. К реакционной смеси снова добавляли 1 Н-1,2,4-триазол (9,92 мг,144 мкмоль, экв.: 1,50) и перемешивали в течение 24 ч при 50 С. Неочищенное вещество очищали препаративной ВЭЖХ с получением соединения, указанного в заголовке, в виде белой пены (15 мг; 18,8%; чистота 50-80%). m/z = 676,0629 [М+Н]+. Пример 46. 2S,4R)-1-[1-(5-Хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(2-пиразол-1-илбензолсульфонил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амид В пробирку на 5 мл добавляли пример 42 (50 мг, 93,5 мкмоль, экв.: 1,00), 1 Н-пиразол (9,54 мг, 140 мкмоль, экв.: 1,50), Cs2CO3 (36,5 мг, 112 мкмоль, экв.: 1,20) и ДМА (1 мл). Реакционную смесь перемешивали в течение 24 ч при 22 С. К реакционной смеси снова добавляли 1 Н-пиразол (9,54 мг, 140 мкмоль,экв.: 1,50) и перемешивали в течение 24 ч при 50 С. Неочищенное вещество очищали препаративной ВЭЖХ с получением соединения, указанного в заголовке, в виде белой пены (10 мг; 15%; чистота 80%). В пробирку на 5 мл добавляли пример 42 (50 мг, 93,5 мкмоль, экв.: 1,00), 1 Н-1,2,3-триазол (9,68 мг,8,12 мкл, 140 мкмоль, экв.: 1,50), Cs2CO3 (36,5 мг, 112 мкмоль, экв.: 1,20) и ДМА (1 мл). Реакционную смесь перемешивали в течение 24 ч при 22 С. К реакционной смеси снова добавляли 1 Н-1,2,3-триазол(9,68 мг, 8,12 мкл, 140 мкмоль, экв.: 1,50) и перемешивали в течение 24 ч при 50 С. Неочищенное вещество очищали препаративной ВЭЖХ с получением соединения, указанного в заголовке, в виде белой пены (10 мг; 11%; чистота 60%). m/z = 584,1272 [М+Н]+. Пример 48. (2S,4R)-1-[1-(5-Хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(2-[1,2,4]триазол-1 ил-бензолсульфонил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амид В пробирку на 5 мл добавляли пример 42 (50 мг, 93,5 мкмоль, экв.: 1,00), 1 Н-1,2,4-триазол (9,68 мг,140 мкмоль, экв.: 1,50), Cs2CO3 (36,5 мг, 112 мкмоль, экв.: 1,20) и ДМА (1 мл). Реакционную смесь перемешивали в течение 24 ч при 22 С. К реакционной смеси снова добавляли 1 Н-1,2,4-триазол (9,68 мг, 140 мкмоль, экв.: 1,50) и перемешивали в течение 24 ч при 50 С. Неочищенное вещество очищали препаративной ВЭЖХ с получением соединения, указанного в заголовке, в виде белой пены (25 мг; 35%; чистота 77%). m/z = 584,1281 [М+Н]+. Пример 49. Анализ ингибирования ферментативной активности катепсина Активность фермента измеряют путем наблюдения повышения интенсивности флуоресценции, вызванного расщеплением пептидного субстрата, содержащего флуорофор, испускание которого гасится интактным пептидом. Аналитический буфер: 100 мМ фосфат калия рН 6,5, ЭДТА-Na 5 мМ, Тритон Х-100 0,001%, дитиотрейтол (ДТТ) 5 мМ. Ферменты (все при 1 нМ): Катепсин S, Cat К, Cat В, Cat L человека и мыши. Субстрат (20 мкМ): Z-Val-Val-Arg-AMC, за исключением Cat К, который использует Z-Leu-ArgAMC (оба субстрата от фирмы Bachem). АМС = 7-Амино-4-метил-кумарин. ДТТ = дитиотрейтол. Конечный объем: 100 мкл. Возбуждение 360 нм, испускание 465 нм. Фермент добавляют к разведениям вещества в 96-луночных микротитрационных планшетах, и реакцию запускают субстратом. Испускание флуоресценции измеряют в течение 20 мин, и в течение этого времени наблюдают линейное возрастание в отсутствие ингибитора. IC50 вычисляют стандартными способами. Ингибирование Cat S человека, Cat S мыши, Cat К человека, Cat В человека, Cat L человека и Cat L мыши измерено по отдельности. Результаты, полученные для Cat S и L человека для репрезентативных соединений по изобретению, выражены в приведенной ниже таблице в микромоль (мкМ). Соединения по изобретению являются преимущественными ингибиторами катепсинов S и L по сравнению с катепсинами K и В. Соединения согласно изобретению в описанном выше анализе имеют IC50 для Cat S и/или L, составляющую от 0,00001 до 100 мкМ. Конкретные соединения по изобретению имеют IC50 при Cat S и/или L от 0,00001 до 50 мкМ, и более конкретно от 0,00001 до 20 мкМ. Конкретные соединения по изобретению по меньшей мере в одном из описанных выше анализов имеют IC50 ниже 0,09 мкМ. Пример А. Соединение формулы (I) можно применять способом, который сам по себе известен, в качестве активного ингредиента для получения таблеток следующей композиции: Пример В. Соединение формулы (I) можно применять способом, который сам по себе известен, в качестве активного ингредиента для получения капсул следующей композиции: где А 1 представляет собой -S- или -S(O)2-; А 2 представляет собой атом азота или -(СН)-;R1 представляет собой атом галогена или галоген-С 1-С 4-алкил;R2 представляет собой атом водорода или атом галогена;R3 представляет собой атом водорода, атом галогена, галоген-С 1-С 4-алкил, пиразолил, [1,2,3]-триазолил или [1,2,4]-триазолил;R4 и R6 независимо выбраны из атома водорода, С 1-С 4-алкила, галоген-C1-С 4-алкила и галогенфенила; иR5 представляет собой атом водорода, атом галогена, галоген-С 1-С 4-алкил, С 1-С 4-алкокси, галогенС 1-С 4-алкокси, С 1-С 4-алкилпиридинил, галогенпиридинил или С 1-С 4-алкилпиразолил; или его фармацевтически приемлемая соль. 2. Соединение по п.1, где А 1 представляет собой -S(O)2-. 3. Соединение по п.1 или 2, где А 2 представляет собой -(СН)-. 4. Соединение по любому из пп.1-3, где R1 представляет собой атом хлора, брома, иода или трифторметил. 5. Соединение по любому из пп.1-4, где R2 представляет собой атом галогена. 6. Соединение по любому из пп.1-5, где R2 представляет собой атом хлора или фтора. 7. Соединение по любому из пп.1-6, где R3 представляет собой атом галогена. 8. Соединение по любому из пп.1-7, где R3 представляет собой атом хлора. 9. Соединение по любому из пп.1-8, где R4 и R6 независимо выбраны из атома водорода и галогенС 1-С 4-алкила. 10. Соединение по любому из пп.1-9, где R4 и R6 независимо выбраны из атома водорода и трифторметила. 11. Соединение по любому из пп.1-10, где R5 представляет собой атом водорода, С 1-С 4-алкокси, галоген-С 1-С 4-алкокси, атом галогена, С 1-С 4-алкилпиридинил или С 1-С 4-алкилпиразолил. 12. Соединение по любому из пп.1-11, где R5 представляет собой атом водорода, метокси, трифторэтокси, атом фтора, трифторпропилокси, атом брома, метилпиридинил или метилпиразолил. 13. Соединение по любому из пп.1-12, выбранное из следующих соединений:(2S,4R)-1-[1-(5-хлор-3-фторпиридин-2-ил)циклопропанкарбонил]-4-(2-[1,2,4]триазол-1-ил-бензолсульфонил)пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида. 14. Соединение по любому из пп.1-13, выбранное из следующих соединений:(2S,4R)-4-[2-хлор-4-(1-метил-1 Н-пиразол-4-ил)бензолсульфонил]-1-[1-(3,5-дихлорпиридин-2-ил) циклопропанкарбонил]пирролидин-2-карбоновой кислоты (1-цианоциклопропил)амида. 15. Применение соединения по любому из пп.1-14 в качестве терапевтически активного вещества. 16. Фармацевтическая композиция, содержащая соединение по любому из пп.1-14 и терапевтически инертный носитель. 17. Применение соединения по любому из пп.1-14 для получения лекарственного средства для лечения или профилактики диабета, атеросклероза, аневризмы брюшной аорты, болезни периферических артерий или диабетической нефропатии. 18. Применение соединения по любому из пп.1-14 для лечения или профилактики диабета, атеросклероза, аневризмы брюшной аорты, болезни периферических артерий или диабетической нефропатии. 19. Способ лечения или профилактики для лечения или профилактики диабета, атеросклероза, аневризмы брюшной аорты, болезни периферических артерий или диабетической нефропатии, включающий введение эффективного количества соединения, как определено в любом из пп.1-14.
МПК / Метки
МПК: C07D 401/14, A61K 31/4439, A61K 31/444
Метки: пиридина, производные
Код ссылки
<a href="https://eas.patents.su/29-25166-proizvodnye-piridina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пиридина</a>
Предыдущий патент: Арилэтинилпиримидины
Следующий патент: Тонкопленочное покрытие и способ его изготовления
Случайный патент: Способ получения защитных покрытий на лопатках газовых турбин












