Производные замещенных пиридинов
Номер патента: 16244
Опубликовано: 30.03.2012
Авторы: Роттлендер Марио, Уотсон Уилльям Патрик, Ханжин Николай, Греве Даниель Родригез, Торнее Кристиан Венсель
Формула / Реферат
1. Соединение, имеющее общую формулу I
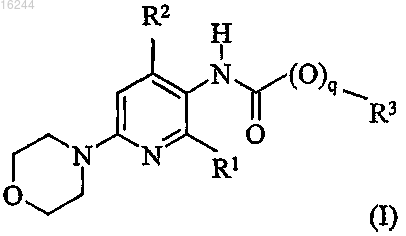
где q равно 0 или 1;
каждый из R1 и R2 независимо выбран из группы, состоящей из C1-6-алкила, C2-6-алкенила, С2-6-алкинила,
C3-8-циклоалкила, C3-8-циклоалкенила, C3-8-циклоалк(ен)ил-C1-8-алкила, C3-8-циклоалк(ен)ил-C2-8-алкенила, C3-8-циклоалк(ен)ил-C2-8-алкинила, C1-6-алкилокси, C2-6-алкенилокси, С2-6-алкинилокси и галогена; и
R3 выбран из группы, состоящей из C1-8-алкила, C2-8-алкенила, C2-8-алкинила, C3-8-циклоалкила, С3-8-циклоалкенила, C3-8-циклоалк(ен)ил-C1-6-алкила, C3-8-циклоалк(ен)ил-С2-6-алкенила, C3-8-циклоалк(ен)ил-С2-6-алкинила, необязательно замещенного арил-C1-6-алкила, необязательно замещенного арил-C2-6-алкенила, необязательно замещенного арил-С2-6-алкинила, необязательно замещенного арил-С3-8-циклоалк(ен)ила, необязательно замещенного арил-С3-8-циклоалк(ен)ил-C1-6-алкила, необязательно замещенного арил-C3-8-циклоалк(ен)ил-C2-6-алкенила, необязательно замещенного арил-C3-8-циклоалк(ен)ил-С2-6-алкинила, гетероарил-C1-6-алкила, гетероарил-С2-6-алкенила, гетероарил-С2-6-алкинила, гетероарил-C3-8-циклоалк(ен)ила, гетероарил-C3-8-циклоалк(ен)ил-C1-6-алкила, гетероарил-C3-8-циклоалк(ен)ил-С2-6-алкенила и гетероарил-С3-8-циклоалк(ен)ил-C2-6-алкинила;
где арильная часть необязательно замещена 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, C1-6-алкила, C2-6-алкенила, C2-6-алкинила, С3-8-циклоалк(ен)ила, C3-8-циклоалк(ен)ил-C1-6-алкила, C3-8-циклоалк(ен)ил-C2-6-алкенила, C3-8-циклоалк(ен)ил-С2-6-алкинила, галоген-C1-6-алкила, галоген-C2-6-алкенила, галоген-C2-6-алкинила, галоген-C3-8-циклоалк(ен)ила, галоген-C3-8-циклоалк(ен)ил-C1-6-алкила, галоген-C3-8-циклоалк(ен)ил-С2-6-алкенила, галоген-С3-8-циклоалк(ен)ил-С2-6-алкинила, C1-6-алкилокси, С2-6-алкенилокси, С2-6-алкинилокси, C3-8-циклоалк(ен)илокси и С3-8-циклоалк(ен)ил-C1-6-алкилокси, C3-8-циклоалк(ен)ил-С2-6-алкенилокси C3-8-циклоалк(ен)ил-С2-6-алкинилокси; и
где гетероарил выбран из группы, состоящей из пиридина, тиофена, фурана, пиррола, пиразола, триазола, тетразола, оксазола, имидазола, тиазола, бензофурана, бензотиофена и индола;
и его фармацевтически приемлемая соль.
2. Соединение по п.1, где q равно 0.
3. Соединение по п.1, где q равно 1.
4. Соединение по п.2 или 3, где как R1, так и R2 представляют собой C1-6-алкил, С2-6-алкенил или C2-6-алкинил.
5. Соединение по п.2 или 3, где R1 представляет собой C1-6-алкилокси, С2-6-алкенилокси или C2-6-алкинилокси и R2 представляет собой галоген или где R1 представляет собой галоген и R2 представляет собой С1-6-алкилокси, C2-6-алкенилокси или С2-6-алкинилокси.
6. Соединение по п.4 или 5, где R3 выбран из группы, состоящей из C1-8-алкила, C2-8-алкенила, С2-8-алкинила, C3-8-циклоалк(ен)ил-С1-6-алкила, C3-8-циклоалк(ен)ил-С2-6-алкенила, С3-8-циклоалк(ен)ил-С2-6-алкинила, необязательно замещенного арил-С1-6-алкила, необязательно замещенного арил-C2-6-алкенила, необязательно замещенного арил-C2-6-алкинила, необязательно замещенного арил-С3-8-циклоалк(ен)ила, гетероарил-С1-6-алкила, гетероарил-С2-6-алкенила, гетероарил-С2-6-алкинила.
7. Соединение по п.6, где необязательно замещенный арил может быть замещен одним или несколькими заместителями, независимо выбранными из группы, состоящей из галогена, C1-6-алкила, С2-6-алкенила, C2-6-алкинила, галоген-C1-6-алкила, галоген-C2-6-алкенила, галоген-C2-6-алкинила, C1-6-алкилокси, C2-6-алкенилокси, C2-6-алкинилокси.
8. Соединение по п.1, выбранное из группы, состоящей из
бензилового эфира (2,4-диметил-6-морфолин-4-илпиридин-3-ил)карбаминовой кислоты;
2-хлорбензилового эфира (2,4-диметил-6-морфолин-4-илпиридин-3-ил)карбаминовой кислоты;
2-(4-хлорфенил)-N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)ацетамида;
(2,4-диметил-6-морфолин-4-илпиридин-3-ил)амида 2-фенилциклопропанкарбоновой кислоты;
N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)-2-тиофен-2-илацетамида;
3-циклогексил-N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)пропионамида;
изобутилового эфира (2,4-диметил-6-морфолин-4-илпиридин-3-ил)карбаминовой кислоты;
3-(3-хлорфенил)-N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)пропионамида;
N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)-2-(3,5-диметилфенил)ацетамида;
N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)-3-п-толилпропионамида;
или его фармацевтически приемлемая соль.
9. Соединение по п.1, выбранное из группы, состоящей из
2-(3-хлорфенил)-N-(2,4-диметил-6-морфолин-4-ил-пиридин-3-ил)ацетамида;
2-(3,4-дихлорфенил)-N-(2,4-диметил-6-морфолин-4-ил-пиридин-3-ил)ацетамида;
N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)-2-тиофен-3-илацетамида;
N-(2,4-диметил-6-морфолин-4-ил-пиридин-3-ил)-2-п-толилпропионамида;
2-(3-бромфенил)-N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)ацетамида;
N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)-2-(3-трифторметилфенил)ацетамида;
N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)-2-фенилацетамида;
(2,4-диметил-6-морфолин-4-илпиридин-3-ил)амида 3,5,5-триметилгексановой кислоты;
(2,4-диметил-6-морфолин-4-илпиридин-3-ил)амида октановой кислоты;
N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)-2-нафталин-2-илацетамида;
или его фармацевтически приемлемая соль.
10. Соединение по п.1, выбранное из группы, состоящей из
(2,4-диметил-6-морфолин-4-илпиридин-3-ил)амида гептановой кислоты;
N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)-2-(3,4-диметилфенил)ацетамида;
2-(циклогекс-1-енил)-N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)ацетамида;
N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)-2-(4-метокси-3-метилфенил)ацетамида;
N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)-2-(4-метоксифенил)ацетамида;
N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)-3-(4-метоксифенил)пропионамида;
N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)-2-м-толилацетамида;
N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)-2-(4-фторфенил)ацетамида;
N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)-3,3-диметилбутирамида;
N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)-2-(3-фторфенил)ацетамида;
2-бицикло[2.2.1]гепт-2-ил-N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)ацетамида;
2-(3,4-дифторфенил)-N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)ацетамида;
(2,4-диметил-6-морфолин-4-илпиридин-3-ил)амида 4-метилпентановой кислоты;
2-(циклопент-2-енил)-N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)ацетамида;
2-циклогексил-N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)ацетамида;
(2,4-диметил-6-морфолин-4-илпиридин-3-ил)амида 5-метил-гексановой кислоты;
2-циклопентил-N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)ацетамида;
3-циклопентил-N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)пропионамида;
(2,4-диметил-6-морфолин-4-илпиридин-3-ил)амида гексановой кислоты;
N-(4-хлор-2-метокси-6-морфолин-4-илпиридин-3-ил)-2-циклопентилацетамида;
N-(2-хлор-4-метокси-6-морфолин-4-илпиридин-3-ил)-2-циклопентилацетамида;
N-(2-хлор-4-метокси-6-морфолин-4-илпиридин-3-ил)-3,3-диметилбутирамида;
N-(4-хлор-2-метокси-6-морфолин-4-илпиридин-3-ил)-3,3-диметилбутирамида;
N-(4-хлор-2-метокси-6-морфолин-4-илпиридин-3-ил)пропионамида;
или его фармацевтически приемлемая соль.
11. Фармацевтическая композиция для терапии, включающая один или несколько фармацевтически приемлемых носителей или разбавителей и соединение по п.1.
12. Применение фармацевтической композиции по п.11 для увеличения потока ионов в калиевом канале млекопитающего.
13. Применение фармацевтической композиции по п.11 для лечения нарушения или заболевания, восприимчивого к увеличенному ионному потоку в калиевом канале, причем таким нарушением или заболеванием является нарушение или заболевание центральной нервной системы.
14. Применение по п.13, где подвергаемое лечению нарушение или заболевание выбрано из группы, состоящей из эпилептических нарушений, тревожных расстройств, нарушений, относящихся к невропатической боли и мигреневой боли, нейродегенеративных нарушений, инсульта, злоупотребления кокаином, синдрома отмены приема никотина, синдрома отмены приема этанола и шума в ушах.
15. Применение по п.14, где эпилептические нарушения выбраны из группы, состоящей из острых эпилептических припадков, судорог, эпилептического состояния, эпилепсии, такой как эпилептические синдромы и эпилептические припадки.
16. Применение по п.14, где тревожные расстройства выбраны из группы, состоящей из тревоги и нарушений и заболеваний, относящихся к паническому приступу, агорафобии, паническому нарушению с агарофобией, паническому расстройству без агарофобии, агорафобии без истории болезни панического нарушения, специфической фобии, социальной фобии и другим специфическим фобиям, навязчивому компульсивному нарушению, послетравматическому стрессовому нарушению, острым стрессовым нарушениям, генерализованному тревожному расстройству, тревожному расстройству вследствие общего медицинского состояния, тревожному расстройству, вызванному веществом, тревожному расстройству, связанному со страхом разлуки, нарушениям из-за приспособляемости, тревоги в отношении возможности выполнения работы, нарушениям, связанным с ипохондрическим синдромом, тревожному расстройству вследствие общего медицинского состояния и тревожному расстройству, вызванному веществом.
17. Применение по п.14, где нарушения, относящиеся к невропатической боли и мигреневой боли, выбраны из группы, состоящей из аллодиния, гипералгической боли, фантомной боли, невропатической боли, относящейся к диабетической невропатии, невропатической боли, относящейся к невралгии тройничного нерва.
18. Применение по п.14, где нейродегенеративные нарушения выбраны из группы, состоящей из болезни Альцгеймера; хореи Гантингтона, рассеянного склероза, бокового амиотрофического склероза, болезни Крейтцфельда-Якоба, болезни Паркинсона, энцефалопатий, индуцированных СПИДом или инфекцией вирусами краснухи, вирусами герпеса, боррелией или неизвестными патогенами, индуцированных травмой нейродегенераций, состояний нейронной повышенной возбудимости и нейродегенеративных заболеваний периферической нервной системы.
19. Применение по п.13, где подвергаемое лечению нарушение или заболевание выбрано из группы, состоящей из биполярных нарушений.
20. Применение по п.13, где подвергаемое лечению нарушение или заболевание выбрано из нарушений сна.
Текст
Настоящее изобретение относится к производным пиридина общей формулы I и их применению в качестве открывателей каналов калиевых ионов семейства KCNQ для лечения нарушений ЦНС Торнее Кристиан Венсель, Ханжин Николай, Роттлендер Марио, Уотсон Уилльям Патрик, Греве Даниель Родригез (DK) Медведев В.Н. (RU) 016244 Настоящее изобретение относится к соединениям, которые являются открывателями каналов калиевых ионов семейства KCNQ. Соединения являются полезными при лечении нарушений и заболеваний, восприимчивых к открытию каналов калиевых ионов семейства KCNQ, причем одним таким заболеванием является эпилепсия. Ионные каналы являются клеточными белками, которые регулируют поток ионов, в том числе ионов калия, кальция, хлорида и натрия в клетки и из клеток. Такие каналы присутствуют во всех клетках животных и человека и оказывают влияние на различные процессы, включающие перенос нейронов,мышечное сокращение и клеточную секрецию. У людей имеется свыше 70 генов, кодирующих подтипы калиевых каналов (Jentsch Nature ReviewsNeuroscience 2000, 1, 21-30) с огромным разнообразием в отношении как структуры, так и функции. Нейронные калиевые каналы, которые обнаружены в головном мозге, являются главным образом ответственными за поддержание отрицательного остаточного потенциала мембраны, а также регулирование реполяризации мембраны после действия потенциала. Одной субпопуляцией генов калиевых каналов является семейство KCNQ. Показано, что мутации в четырех из пяти генов KCNQ лежат в основе заболеваний, включающих сердечную аритмию, глухоту и эпилепсию (Jentsch Nature Reviews Neuroscience 2000, 1, 21-30). Считается, что ген KCNQ4 кодирует молекулярную корреляцию калиевого канала, обнаруженного в наружных клетках волосков улитки (внутреннего уха) и в клетках волосков типа I вестибулярного аппарата, в котором мутации могут привести к индукции унаследованной глухоты.KCNQ1 (KvLQT1) совместно собирается с продуктом гена KCNE1 (минимальным белком K(+)канала) в сердце с образованием сердечного, замедленного, подобного очистителю K(+)-тока. Мутации в этом канале могут вызвать одну форму унаследованного длительного QT-синдрома типа 1 (LQT1), а также связаны с формой глухоты (Robbins Pharmacol Ther 2001, 90, 1-19). Гены KCNQ2 и KCNQ3 были обнаружены в 1988 г., и, как оказалось, они мутируются в наследственную форму эпилепсии, известную как слабые семейные неонатальные судороги (Rogawski Trends inKCNQ3, локализованы в пирамидальных нейронах коры головного мозга и гиппокампе, областях головного мозга, связанных с генерацией и воспроизведением эпилептических припадков (Cooper et al. Proceedings National Academy of Science USA 200, 97, 4914-4919).KCNQ2 и KCNQ3 являются двумя субъединицами калиевых каналов, которые образуют М-токи при экспрессии in vitro. M-ток является неинактивирующим калиевым током, обнаруженным во многих типах нейронных клеток. В каждом типе клеток он является доминантным в регулировании возбудимости мембран благодаря тому, что он является только непрерывным током в диапазоне инициации потенциала действия (Marrion Annual Review Physiology 1997, 59, 483-504). Модуляция М-тока оказывает сильные действия на нейронную возбудимость, например, активация тока будет снижать нейронную возбудимость. Открыватели этих каналов KCNQ, или активаторы М-тока, могут уменьшить избыточную нейронную активность и поэтому их можно применять при лечении эпилепсий и других заболеваний и нарушений, характеризующихся избыточной нейронной активностью, таких как нейронная сверхвозбудимость, в том числе судорожные нарушения, эпилепсия и невропатическая боль. Ретигабин (D-23129; этиловый эфир N-(2-амино-4-(4-фторбензиламино)фенил)карбаминовой кислоты) и его аналоги описаны в ЕР 554543. Ретигабин является противосудорожным соединением с широким спектром действия и с сильными противосудорожными свойствами, как in vitro, так и in vivo. Он является активным после перорального и внутрибрюшинного введения крысам и мышам в ряде противосудорожных испытаний, включающих в себя индуцированные электрическим током эпилептические припадки, эпилептические припадки, индуцированные химическим способом пентилентетразолом, пикротоксином и N-метил-D-аспартатом (NMDA), и на генетической животной модели, мышах DBA/2(Rostock et al. Epilepsy Research 1996, 23, 211-223). Кроме того, ретигабин является активным на модели возбуждения миндалевидного тела комбинированных отдельных эпилептических припадков, что таким образом дополнительно показывает, что это соединение является перспективным в противосудорожной терапии. В клинических испытаниях ретигабин недавно проявил эффективность в снижении числа случаев эпилептических припадков у эпилептических пациентов (Bialer et al. Epilepsy Research 2002, 51, 3171). Обнаружено, что ретигабин активирует (K(+)-ток в нейронных клетках, и фармакология этого индуцированного тока демонстрирует соответствие с опубликованной фармакологией М-канала, которую недавно коррелировали с гетеромультимером K(+)-канала KCNQ2/3. Это позволяет предположить, что активация каналов KCNQ2/3 может быть ответственной за некоторую часть противосудорожной активности этого агента (Wickenden et al. Molecular Pharmacology 2000, 58, 591-600) и что другие агенты, действующие по такому же механизму, могут иметь аналогичные применения. Описано, что каналы KCNQ2 и 3 позитивно регулируются в моделях невропатической боли(Wickenden et al. Society for Neuroscience Abstracts 2002, 454.7), и была высказана гипотеза, что модуляторы калиевых каналов являются активными как при невропатической боли, так и при эпилепсии-1 016244 Обнаружено также, что ретигабин является полезным на животных моделях невропатической боли(Blackburn-Munro and Jensen European Journal of Pharmacology 2003, 460, 109-116), и это таким образом позволяет предположить, что открыватели каналов KCNQ можно применять при лечении болевых нарушений, в том числе невропатической боли. Описано, что локализация мРНК каналов KCNQ в головном мозге и других участках центральной нервной системы связана с болью (Goldstein et al. Society for Neuroscience Abstracts 2003, 53.8). Помимо роли в невропатической боли экспрессия мРНК для KCNQ 2-5 в ганглиях тройничного нерва и спинномозговых узлах и в ядерной каудальной части тройничного нерва означает, что открыватели этих каналов могут также влиять на сенсорный процесс мигреневой боли (Goldstein et al. Society forNeuroscience Abstracts 2003, 53.8). Последние публикации показывают, что мРНК для KCNQ 3 и 5 помимо мРНК для KCNQ2 экспрессируются в астроцитах и глиальных клетках. Поэтому каналы KCNQ 2, 3 и 5 могут помогать модулированию синаптической активности в ЦНС и вносят вклад в неврозащитные действия открывателей каналов KCNQ (Noda et al., Society for Neuroscience Abstracts 2003, 53.9). Ретигабин и другие модуляторы KCNQ могут, таким образом, проявлять защитное действие против нейродегенеративных разновидностей эпилепсии, так как обнаружено, что ретигабин предотвращает нейродегенерацию в конечностях и экспрессию маркеров апоптоза после индуцированного каиновой кислотой эпилептического состояния у крысы (Ebert et al. Epilepsia 2002, 43 Suppl 5, 8 6-95). Он может быть пригодным для предотвращения прогресса эпилепсии у пациентов, т.е. является антиэпилептогенным. Обнаружено также, что ретигабин замедляет прогрессирование возбуждения гиппокампа у крысы,следующей модели развития эпилепсии (Tober et al. European Journal of Pharmacology 1996, 303, 163-169). Таким образом, предполагается, что эти свойства ретигабина и других модуляторов KCNQ могут предотвращать нейронное повреждение, индуцированное избыточной нейронной активацией, и такие соединения можно применять при лечении нейродегенеративных заболеваний и модифицировании (или являются антиэпилептогенными) заболевания у пациентов с эпилепсией. Зная, что противосудорожные соединения, такие как бензодиазепины и хлорметиазол, применяют клинически при лечении синдрома отмены приема этанола и что другие противосудорожные соединения, например габапентин, являются очень эффективными на животных моделях этого синдрома (Watsonet al. Neuropharmacology 1997, 36, 1369-1375), вследствие этого предполагают, что другие противосудорожные соединения, такие как открыватели KCNQ, являются эффективными при таком состоянии. мРНК для субъединиц KCNQ 2 и 3 обнаружены в участках головного мозга, связанных с тревожными и эмоциональными поведениями, такими как биполярное нарушение, например гиппокампа и миндалевидного тела (Saganich et al. Journal of Neuroscience 2001, 21, 4609-4624), и описано, что ретигабин является активным на некоторых животных моделях подобного тревоге поведения (Hartz et al. Journal ofPsychopharmacology 2003, 17 suppl 3, A28, B16), и другие клинически применяемые противосудорожные соединения применяют при лечении биполярного нарушения. Таким образом, открыватели KCNQ могут быть полезными для лечения тревожных расстройств и биполярного нарушения. В WO 200196540 описано применение модуляторов М-тока, образованного экспрессией геновKCNQ5 можно применять для лечения нарушений сна. В WO 01/022953 описано применение ретигабина для профилактики и лечения невропатической боли, такой как аллодиния, гипералгическая боль, фантомная боль, невропатическая боль, относящаяся к диабетической невропатии, и невропатическая боль, относящаяся к мигрени. В WO 02/049628 описано применение ретигабина для лечения тревожных расстройств, таких как тревога, генерализованное тревожное расстройство, панический страх, навязчивое компульсивное нарушение, социальная фобия, тревога по причине возможности выполнения работы, послетравматическое стрессовое нарушение, острая стрессовая реакция, нарушения из-за приспособляемости, нарушения, связанные с ипохондрическим синдромом, нарушение, связанное со страхом разлуки, агорафобия и специфические фобии. В WO 97/15300 описано применение ретигабина для лечения нейродегенеративных нарушений, таких как болезнь Альцгеймера; хорея Гантингтона; склероз, такой как рассеянный склероз и боковой амиотрофический склероз; болезнь Крейтцфельда-Якоба; болезнь Паркинсона; энцефалопатии, индуцированные СПИДом или инфекцией вирусами краснухи, вирусами герпеса, боррелией и неизвестными патогенами; индуцированные травмой нейродегенерации; состояния нейронной повышенной возбудимости, такие как синдром отмены лекарственного средства или интоксикация, и нейродегенеративные заболевания периферической нервной системы, такие как полиневропатия и полиневриты. Обнаружено, что открыватели каналов KCNQ являются эффективными при лечении инсульта, следовательно, можно ожидать, что селективные открыватели KCNQ являются эффективными при лечении инсульта (Schroder et al., Pflugers Arch., 2003; 446(5):607-16; Cooper and Jan, Arch Neurol., 2003, 60(4):496500; Jensen, CNS Drug Rev., 2002, 8 (4):353-60). Обнаружено, что каналы KCNQ экспрессируются в допаминергических и холинергических контурах в головном мозге, которые связаны с системой снабжения головного мозга, особенно в вентральном-2 016244 покровном участке (Cooper et al., J. Neurosci, 2001, 21, 9529-9540). Поэтому предполагается, что открыватели каналов KCNQ являются эффективными при лечении нарушений, связанных с повышенной возбудимостью, которые включают в себя систему снабжения головного мозга, таких как злоупотребление кокаином, синдром отмены приема никотина и синдром отмены приема этанола. Калиевые каналы, состоящие из субъединиц KCNQ4, экспрессируются во внутреннем ухе (Kubischet al., Cell., 1999 Feb 5; 96(3):437-46), и поэтому предполагается, что открытие этих каналов будет лечить шум в ушах. Следовательно, существует огромная потребность в новых соединениях, которые являются сильнодействующими открывателями калиевых каналов семейства KCNQ. Желательными являются также новые соединения с улучшенными свойствами по сравнению с известными соединениями, которые являются открывателями калиевых каналов семейства KCNQ, таких как ретигабин. Желательным является улучшение одного или нескольких следующих параметров: полупериод жизни (лекарственного соединения в организме), выведение лекарственного соединения (из организма), селективность, взаимодействия с другими лекарственными средствами, биологическая доступность, активность, технологические свойства при изготовлении препарата, химическая стабильность,метаболическая стабильность, мембранная проницаемость, растворимость и терапевтический индекс. Улучшение таких параметров может привести к таким усовершенствованиям, как улучшенная схема приема лекарственного средства снижением числа требуемых доз в день, легкость введения пациенту при множественных лекарственных терапиях, ослабленные побочные действия, повышенный терапевтический индекс, повышенная толерантность или улучшенное соблюдение больным режима и схемы лечения. Одной задачей изобретения является создание соединений, которые являются сильнодействующими открывателями калиевых каналов семейства KCNQ. Соединения изобретения являются производными замещенных пиридинов указанной ниже формулы I в виде свободного основания или его соли где R1, R2, R3 и q имеют значения, указанные ниже. Изобретение предлагает соединение формулы I для применения в качестве лекарственного средства. Изобретение также относится к фармацевтической композиции, включающей в себя соединение формулы I и фармацевтически приемлемый носитель или разбавитель. Изобретение относится к применению соединения формулы I для получения лекарственного средства для лечения эпилептических нарушений, тревожных нарушений, невропатической боли и нарушений, относящихся к мигреневой боли, или нейродегенеративных нарушений. Кроме того, изобретение относится к применению соединения формулы I в способе лечения эпилептических нарушений, тревожных нарушений, невропатической боли и нарушений, относящихся к мигреневым болям, или нейродегенеративных нарушений. Определение заместителей Термин гетероатом относится к атому азота, кислорода или серы. Галоген означает атом фтора, хлора, брома или иода. Циано означает CN, который присоединен к остальной части молекулы через атом углерода. Выражение C1-6-алк(ен/ин)ил означает C1-6-алкил, C2-6-алкенил или C2-6-алкинил. Термин C1-6 алкил относится к неразветвленной или разветвленной алкильной группе, имеющей от одного до шести атомов углерода, включающей в себя, но не ограничивающейся перечисленным, метил, этил, проп-1-ил,проп-2-ил, 2-метилпроп-1-ил, 2-метилпроп-2-ил, 2,2-диметилпроп-1-ил, бут-1-ил, бут-2-ил, 3-метилбут-1 ил, 3-метилбут-2-ил, пент-1-ил, пент-2-ил, пент-3-ил, гекс-1-ил, гекс-2-ил и гекс-3-ил. Термин C2-6 алкенил относится к неразветвленной или разветвленной алкенильной группе, имеющей от двух до шести атомов углерода и одну двойную связь, включающей в себя, но не ограничивающейся перечисленным, этенил, пропенил и бутенил. Термин C2-6-алкинил относится к неразветвленной или разветвленной алкинильной группе, имеющей от двух до шести атомов углерода и одну тройную связь, включающей в себя, но не ограничивающейся перечисленным, этинил, пропинил и бутинил. Выражение C1-8-алк(ен/ин)ил означает C1-8-алкил, C2-8-алкенил или C2-8-алкинил. Термин C1-8 алкил относится к неразветвленной или разветвленной алкильной группе, имеющей от одного до восьми атомов углерода, включающей в себя, но не ограничивающейся перечисленным, метил, этил, проп-1-ил,проп-2-ил, 2-метилпроп-1-ил, 2-метилпроп-2-ил, 2,2-диметилпроп-1-ил, бут-1-ил, бут-2-ил, 3-метилбут-1 ил, 3-метилбут-2-ил, пент-1-ил, пент-2-ил, пент-3-ил, гекс-1-ил, гекс-2-ил, гекс-3-ил, 2-метил-4,4 диметилпент-1-ил и геп-1-ил. Термин C2-8-алкенил относится к неразветвленной или разветвленной-3 016244 алкенильной группе, имеющей от двух до восьми атомов углерода и одну двойную связь, включающей в себя, но не ограничивающейся перечисленным, этенил, пропенил и бутенил. Термин C2-8-алкинил относится к неразветвленной или разветвленной алкинильной группе, имеющей от двух до восьми атомов углерода и одну тройную связь, включающей в себя, но не ограничивающейся перечисленным, этинил,пропинил и бутинил. Выражение C3-8-циклоалк(ен/ин)ил означает C3-8-циклоалкил или C3-8-циклоалкенил. ТерминC3-8-циклоалкил означает моноциклический или бициклический карбоцикл, имеющий от трех до восьми атомов углерода, включающий в себя, но не ограничивающийся перечисленным, циклопропил, циклопентил, циклогексил, бициклогептил, такой как 2-бицикло[2.2.1]гептил. Термин C3-8-циклоалкенил означает моноциклический или бициклический карбоцикл, имеющий от трех до восьми атомов углерода и одну двойную связь, включающий в себя, но не ограничивающийся перечисленным, циклопентенил и циклогексенил. Термин C3-8-гетероциклоалк(ен/ин)ил означает C3-8-гетероциклоалкил или C3-8-гетероциклоалкенил. Термин C3-8-гетероциклоалкил означает моноциклическую или бициклическую систему колец, в которой кольцо образовано 3-8 атомами, выбранными из 2-7 атомов углерода и 1 или 2 гетероатомов, независимо выбранных из атомов азота, кислорода и серы. Примерами C3-8-гетероциклоалкилов являются пирролидин, азепан, морфолин, пиперидин, пиперазин и тетрагидрофуран. Термин C3-8 гетероциклоалкенил означает моноциклическую или бициклическую систему колец с одной двойной связью, в которой кольцо образовано 3-8 атомами, выбранными из 2-7 атомов углерода и 1 или 2 гетероатомов, независимо выбранных из атомов азота, кислорода и серы. Примерами C3-8 гетероциклоалкенилов являются дигидропиррол, дигидрофуран и дигидротиофен. Когда C3-8 гетероциклоалк(ен/ин)ил включает в себя атом азота, то C3-8-гетероциклоалк(ен/ин)ил присоединен к остальной части молекулы через атом углерода или атом азота гетероциклического кольца. Когда C3-8 гетероциклоалк(ен/ин)ил не включает в себя атом азота, то C3-8-гетероциклоалк(ен/ин)ил присоединен к остальной части молекулы через атом углерода гетероциклического кольца. Термин галоген-C1-6-алк(ен/ин)ил означает C1-6-алк(ен/ин)ил, замещенный галогеном, включающий в себя, но не ограничивающийся указанным, трифторметил. Аналогично этому галоген-C3-8 циклоалк(ен)ил означает C3-8-циклоалк(ен)ил, замещенный галогеном, включающий в себя, но не ограничивающийся указанным, хлорциклопропан и хлорциклогексан. Аналогично этому галоген-C3-8 циклоалк(ен)ил-С 1-6 алк(ен/ин)ил означает галоген-C3-8-циклоалк(ен)ил, присоединенный к остальной части молекулы через C1-6-алк(ен/ин)ил. Термин C1-6-алк(ен/ин)илокси означает C1-6-алк(ен/ин)ил, присоединенный к остальной части молекулы через атом кислорода. Аналогично этому C3-8-циклоалк(ен)илокси означает C3-8-алк(ен)ил, присоединенный к остальной части молекулы через атом кислорода. В выражениях C3-8-циклоалк(ен)ил-C1-6-алк(ен/ин)ил, арил-C1-6-алк(ен/ин)ил, арил-C3-8C3-8-гетероциклоалк(ен)ил-C1-6 циклоалк(ен)ил,арил-C3-8-циклоалк(ен)ил-C1-6-алк(ен/ин)ил,гетероарил-C1-6 алк(ен/ин)ил,C1-6-алк(ен/ин)ил-C3-8-гетероциклоалк(ен)ил-C1-6-алк(ен/ин)ил,алк(ен/ин)ил, гетероарил-C3-8-циклоалк(ен)ил, гетероарил-C3-8-циклоалк(ен)ил-C1-6-алк(ен/ин)ил,NR4R5-С 1-6-алк(ен/ин)ил, NR4R5-C3-8-циклоалк(ен)ил, NR4R5-C3-8-циклоалк(ен)ил-С 1-6-алк(ен/ин)ил,C3-8-циклоалк(ен)ил-C1-6-алк(ен/ин)илокси,C1-6-алк(ен/ин)илокси-C1-6-алк(ен/ин)ил,C3-8 циклоалк(ен)илокси-C1-6-алк(ен/ин)ил и C3-8-циклоалк(ен)ил-C2-6-алк(ен/ин)илокси-C1-6-алк(ен/ин)ил термины C1-6-алк(ен/ин)ил, C3-8-циклоалк(ен)ил, арил, C3-8-гетероциклоалк(ен)ил, гетероарил,C1-6-алк(ен/ин)илокси и C3-8-циклоалк(ен)илокси имеют значения, указанные выше. Термин гетероарил относится к моноциклическим или бициклическим гетероароматическим системам, выбранным из группы, состоящей из пиридина, тиофена, фурана, пиррола, пиразола, триазола,тетразола, оксазола, имидазола, тиазола, бензофурана, бензотиофена и индола. Термин арил означает моноциклические или бициклические ароматические системы, выбранные из группы, состоящей из фенила и нафтила. Термин необязательно замещенный арил-C1-6-алк(ен/ин)ил означает арил-C1-6-алк(ен/ин)ил, где арильная часть необязательно замещена, такая как арильная часть с 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, C1-6-алк(ен/ин)ила, C3-8-циклоалк(ен)ила, C3-8 циклоалк(ен)ил-C1-6-алк(ен/ин)ила, галоген-C1-6-алк(ен/ин)ила, галоген-C3-8-циклоалк(ен)ила, галоген-C3-8 циклоалк(ен)ил-C1-6-алк(ен/ин)ила, C1-6-алк(ен/ин)илокси, C3-8-циклоалк(ен)илокси и C3-8-циклоалк(ен)ил-C1-6-алк(ен/ин)илокси. Аналогично этому необязательно замещенный арил-C3-8 циклоалк(ен)ил означает арил-C3-8-циклоалк(ен)ил, где арильная часть необязательно замещена, такая как арильная часть с 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, C1-6-алк(ен/ин)ила, C3-8-циклоалк(ен)ила, C3-8-циклоалк(ен)ил-C1-6-алк(ен/ин)ила, галоген-C1-6 алк(ен/ин)ила, галоген-C3-8-циклоалк(ен)ила, галоген-C3-8-циклоалк(ен)ил-C2-6-алк(ен/ин)ила, C1-6 алк(ен/ин)илокси, C3-8-циклоалк(ен)илокси и C3-8-циклоалк(ен)ил-С 1-6-алк(ен/ин)илокси. Аналогично этому необязательно замещенный арил-C3-8-циклоалк(ен)ил-C1-6-алк(ен/ин)ил означает арил-C3-8-4 016244 циклоалк(ен)ил-С 1-6-алк(ен/ин)ил, где арильная часть необязательно замещена 1, 2 или 3 заместителями,независимо выбранными из группы, состоящей из галогена, циано, C1-6-алк(ен/ин)ила, C3-8 циклоалк(ен)ила, C3-8-циклоалк(ен)ил-C1-6-алк(ен/ин)ила, галоген-C2-6-алк(ен/ин)ила, галоген-C3-8 циклоалк(ен)ила, галоген-C3-8-циклоалк(ен)ил-С 1-6-алк(ен/ин)ила, C1-6-алк(ен/ин)илокси, C3-8-циклоалк(ен)илокси и C3-8-циклоалк(ен)ил-C1-6-алк(ен/ин)илокси. Описание изобретения Настоящее изобретение относится к производным замещенных пиридинов, которые являются открывателями калиевых каналов KCNQ. Настоящее изобретение относится к соединению, представленному общей формулой I где q равно 0 или 1; каждый из R1 и R2 независимо выбран из группы, состоящей из C1-6-алкила, C2-6-алкенила, C2-6 алкинила, C3-8-циклоалкила, C3-8-циклоалкенила, C3-8-циклоалк(ен)ил-С 1-8-алкила, C3-8-циклоалк(ен)ил-C2-8 алкенила, С 3-8-циклоалк(ен)ил-C2-8-алкинила, C1-6-алкилокси, C2-6-алкенилокси, C2-6-алкинилокси и галогена; иR3 выбран из группы, состоящей из C1-8-алкила, C2-8-алкенила, С 2-8-алкинила, C3-8-циклоалкила, C3-8 циклоалкенила, C3-8-циклоалк(ен)ил-С 1-6-алкила, C3-8-циклоалк(ен)ил-C2-6-алкенила, C3-8-циклоалк(ен)илС 2-6-алкинила, необязательно замещенного арил-С 1-6-алкила, необязательно замещенного арил-C2-6 алкенила, необязательно замещенного арил-C2-6-алкинила, необязательно замещенного арил-C3-8 циклоалк(ен)ила, необязательно замещенного арил-C3-8-циклоалк(ен)ил-C1-6-алкила, необязательно замещенного арил-C3-8-циклоалк(ен)ил-C2-6-алкенила,необязательно замещенного арил-C3-8 циклоалк(ен)ил-C2-6-алкинила, гетероарил-С 1-6-алкила, гетероарил-С 2-6-алкенила, гетероарил-C2-6 алкинила, гетероарил-С 3-8-циклоалк(ен)ила, гетероарил-C3-8-циклоалк(ен)ил-C1-6-алкила, гетероарил-C3-8 циклоалк(ен)ил-С 2-6-алкенила и гетероарил-С 3-8-циклоалк(ен)ил-C2-6-алкинила; где арильная часть необязательно замещена 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, C1-6-алкила, C2-6-алкенила, С 2-6-алкинила, C3-8-циклоалк(ен)ила,C3-8-циклоалк(ен)ил-C2-6-алкила, C3-8-циклоалк(ен)ил-С 2-6-алкенила, C3-8-циклоалк(ен)ил-С 2-6-алкинила,галоген-C1-6-алкила, галоген-С 2-6-алкенила, галоген-С 2-6-алкинила, галоген-C3-8-циклоалк(ен)ила, галогенC3-8-циклоалк(ен)ил-С 1-6-алкила, галоген-C3-8-циклоалк(ен)ил-С 2-6-алкенила, галоген-C3-8-циклоалк(ен)илC2-6-алкинила, C1-6-алкилокси, C2-6-алкенилокси, С 2-6-алкинилокси, C3-8-циклоалк(ен)илокси и C3-8 циклоалк(ен)ил-C1-6-алкилокси, C3-8-циклоалк(ен)ил-C2-6-алкенилокси C3-8-циклоалк(ен)ил-C2-6-алкинилокси; и где гетероарил выбран из группы, состоящей из пиридина, тиофена, фурана, пиррола, пиразола,триазола, тетразола, оксазола, имидазола, тиазола, бензофурана, бензотиофена и индола; и его фармацевтически приемлемой соли. В одном варианте осуществления соединения формулы I q равно 0; в другом варианте осуществления соединения формулы I q равно 1. В одном варианте осуществления соединения формулы I R1, так и R2 представляют собой C1-6 алкил, C2-6-алкенил или C2-6-алкинил. В следующем варианте осуществления соединения формулы I R1 представляет собой C1-6 алкилокси, С 2-6-алкенилокси или C2-6-алкинилокси и R2 представляет собой галоген или где R1 представляет собой галоген и R2 представляет собой C1-6-алкилокси, С 2-6-алкенилокси или С 2-6-алкинилокси; в другом варианте осуществления каждый из R1 и R2 независимо выбран из группы, состоящей из галогена, C1-6-алкила, С 2-6-алкенила, С 2-6-алкинила, C1-6-алкилокси, С 2-6-алкенилокси, С 2-6-алкинилокси; в другом варианте осуществления каждый из R1 и R2 независимо выбран из группы, состоящей изC1-6-алкила, С 2-6-алкенила, C2-6-алкинила, C3-8-циклоалкила, C3-8-циклоалкенила, C3-8-циклоалк(ен)ил-C1-8 алкила, C3-8-циклоалк(ен)ил-С 2-8-алкенила, C3-8-циклоалк(ен)ил-С 2-8-алкинила; в другом варианте осуществления R1 представляет собой С 1-6-алкил, такой как метил; в другом варианте осуществления R2 представляет собой C1-6-алкил, такой как метил; в другом варианте осуществления R1 представляет собой C1-6-алкилокси, такой как метокси, и R2 представляет собой галоген; в другом варианте осуществления R1 представляет собой галоген и R2 представляет собой C1-6 алкилокси, такой как метокси. Обычно как R1, так и R2 представляют собой C1-6-алкил, такой как метил; в другом варианте осуществления R3 выбран из группы, состоящей из C1-8-алкила, С 2-8-алкенила, C2-8 алкинила, C3-8-циклоалкила, C3-8-циклоалкенила, C3-8-циклоалк(ен)ил-С 1-6-алкила, C3-8-циклоалк(ен)ил-C2-6-5 016244 алкенила, C3-8-циклоалк(ен)ил-C2-6-алкинила, необязательно замещенного арил-C1-6-алкила, необязательно замещенного арил-C2-6-алкенила, необязательно замещенного арил-C2-6-алкинила, необязательно замещенного арил-C3-8-циклоалк(ен)ила, необязательно замещенного арил-C3-8-циклоалк(ен)ил-C1-6-алкила,необязательно замещенного арил-C3-8-циклоалк(ен)ил-C2-6-алкенила, необязательно замещенного арилC3-8-циклоалк(ен)ил-C2-6-алкинила, гетероарил-C1-6-алкила, гетероарил-C2-6-алкенила, гетероарил-С 2-6 алкинила, гетероарил-C3-8-циклоалк(ен)ила, гетероарил-C3-8-циклоалк(ен)ил-С 1-6-алкила, гетероарил-C3-8 циклоалк(ен)ил-С 2-6-алкенила и гетероарил-C3-8-циклоалк(ен)ил-C2-6-алкинила; в другом варианте осуществления R3 выбран из группы, состоящей из C1-8-алкила, C2-8-алкенила, C2-8 алкинила, C3-8-циклоалк(ен)ил-C1-6-алкила, C3-8-циклоалк(ен)ил-C2-6-алкенила, C3-8-циклоалк(ен)ил-С 2-6 алкинила, необязательно замещенного арил-C1-6-алкила, необязательно замещенного арил-С 2-6-алкенила,необязательно замещенного арил-C2-6-алкинила, необязательно замещенного арил-C3-8-циклоалк(ен)ила,гетероарил-С 1-6-алкила, гетероарил-C2-6-алкенила, гетероарил-С 2-6-алкинила; в другом варианте осуществления R3 выбран из группы, состоящей из C1-8-алкила, С 2-8-алкенила, С 2-8 алкинила, C3-8-циклоалкила, C3-8-циклоалкенила, C3-8-циклоалк(ен)ил-C1-6-алкила, C3-8-циклоалк(ен)ил-С 2-6 алкенила, C3-8-циклоалк(ен)ил-C2-6-алкинила, необязательно замещенного арил-С 1-6-алкила, необязательно замещенного арил-С 2-6-алкенила, необязательно замещенного арил-С 2-6-алкинила, необязательно замещенного арил-C3-8-циклоалк(ен)ила, необязательно замещенного арил-С 3-8-циклоалк(ен)ил-C1-6-алкила,необязательно замещенного арил-C3-8-циклоалк(ен)ил-С 2-6-алкенила, необязательно замещенного арилC3-8-циклоалк(ен)ил-С 2-6-алкинила, гетероарил-C1-6-алкила, гетероарил-С 2-6-алкенила, гетероарил-С 2-6 алкинила. Обычно R3 выбран из группы, состоящей из С 1-8-алкила, С 2-8-алкенила, С 2-8-алкинила, C3-8 циклоалк(ен)ил-C1-6-алкила, C3-8-циклоалк(ен)ил-С 2-6-алкенила, C3-8-циклоалк(ен)ил-С 2-6-алкинила, необязательно замещенного арил-C1-6-алкила, необязательно замещенного арил-С 2-6-алкенила, необязательно замещенного арил-С 2-6-алкинила, необязательно замещенного арил-C3-8-циклоалк(ен)ила, гетероарил-C1-6-алкила, гетероарил-С 2-6-алкенила, гетероарил-С 2-6-алкинила. Для дополнительной иллюстрации изобретения, но без его ограничения, в одном варианте осуществления R3 представляет собой C1-6-алкил, С 2-6-алкенил, С 2-6-алкинил; в другом варианте осуществления R3 представляет собой C3-8-циклоалк(ен)ил-C1-6-алкил, C3-8 циклоалк(ен)ил-С 2-6-алкенил, С 3-8-циклоалк(ен)ил-С 2-6-алкинил; в другом варианте осуществления R3 представляет собой необязательно замещенный арил-С 1-6 алкил, необязательно замещенный арил-С 2-6-алкенил, необязательно замещенный арил-С 2-6-алкинил; в другом варианте осуществления R3 представляет собой необязательно замещенный арил-C3-8 циклоалк(ен)ил; в другом варианте осуществления R3 представляет собой гетероарил-C1-6-алкил, гетероарил-С 2-6 алкенил, гетероарил-С 2-6-алкинил. В следующем варианте осуществления изобретения в соединении формулы I любой гетероарил, который указывается либо отдельно, либо как часть большего заместителя, выбран из группы, состоящей из пиридина, фурана, пиррола, пиразола, триазола, тетразола, оксазола, имидазола, тиазола, бензофурана,бензотиофена и индола; в другом варианте осуществления любой гетероарил, который указывается либо отдельно, либо как часть большего заместителя, представляет собой тиофен. В следующем варианте осуществления изобретения в соединении формулы I любой арил, который указывается либо отдельно, либо как часть большего заместителя, представляет собой фенил; в другом варианте осуществления любой арил, который указывается либо отдельно, либо как часть большего заместителя, представляет собой нафтил. В следующем варианте осуществления изобретения в соединении формулы I любой необязательно замещенный арил, который указывается либо отдельно, либо как часть большего заместителя, может быть замещен 1 или 2 заместителями. Для дальнейшей иллюстрации изобретения, но без его ограничения, вариант осуществления относится к таким соединениям формулы I, у которых любой необязательно замещенный арил, который указывается либо отдельно, либо как часть большего заместителя, является незамещенным; в другом варианте осуществления любой необязательно замещенный арил, который указывается либо отдельно, либо как часть большего заместителя, замещен 1 заместителем; в другом варианте осуществления любой необязательно замещенный арил, который указывается либо отдельно, либо как часть большего заместителя, замещен 2 заместителями. В следующем варианте осуществления изобретения в соединении формулы I любой необязательно замещенный арил, который указывается либо отдельно, либо как часть большего заместителя, может быть замещен заместителями, выбранными из группы, состоящей из циано, C3-8-циклоалк(ен)ила, C3-8 циклоалк(ен)ил-C2-6-алкила, С 3-8-циклоалк(ен)ил-C2-6-алкенила, C3-8-циклоалк(ен)ил-C2-6-алкинила, галоген-C3-8-циклоалк(ен)ила, галоген-C3-8-циклоалк(ен)ил-C1-6-алкила, галоген-C3-8-циклоалк(ен)ил-C2-6 алкенила, галоген-C3-8-циклоалк(ен)ил-C2-6-алкинила, C3-8-циклоалк(ен)илокси и C3-8-циклоалк(ен)ил-С 1-6 алкилокси, С 3-8-циклоалк(ен)ил-C2-6-алкенилокси C3-8-циклоалк(ен)ил-C2-6-алкинилокси; в другом варианте осуществления любой необязательно замещенный арил, который указывается-6 016244 либо отдельно, либо как часть большего заместителя, может быть замещен заместителями, выбранными из группы, состоящей из галогена, C1-6-алкила, C2-6-алкенила, C2-6-алкинила, галоген-C1-6-алкила, галогенС 2-6-алкенила, галоген-С 2-6-алкинила и C1-6-алкилокси, С 2-6-алкенилокси, C2-6-алкинилокси. В следующей иллюстрации, не ограничивающей изобретение, вариант осуществления относится к таким соединениям формулы I, у которых любой необязательно замещенный арил, который указывается либо отдельно, либо как часть большего заместителя, замещен галогеном; в другом варианте осуществления любой необязательно замещенный арил, который указывается либо отдельно, либо как часть большего заместителя, замещен C1-6-алкилом, C2-6-алкенилом, C2-6 алкинилом; в другом варианте осуществления любой необязательно замещенный арил, который указывается либо отдельно, либо как часть большего заместителя, замещен галоген-C1-6-алкилом, галоген-C2-6 алкенилом, галоген-C2-6-алкинилом; в другом варианте осуществления любой необязательно замещенный арил, который указывается либо отдельно, либо как часть большего заместителя, замещен C1-6-алкилокси, C2-6-алкенилокси, C2-6 алкинилокси. Следующий вариант осуществления относится к соединению формулы I в виде свободного основания или его соли; причем указанное соединение выбрано из соединений, представленных в следующей таблице: Каждое из этих соединений рассматривается как конкретный вариант осуществления и может подчиняться отдельным пунктам формулы изобретения. Настоящее изобретение включает в себя также соли соединений изобретения, в типичном случае фармацевтически приемлемые соли. Соли изобретения включают в себя кислотно-аддитивные соли, соли металлов, соли аммония и алкилированного аммония. Соли по изобретению предпочтительно представляют собой кислотно-аддитивные соли. Кислотноаддитивные соли изобретения предпочтительно являются фармацевтически приемлемыми солями соединений изобретения, образованными с нетоксичными кислотами. Кислотно-аддитивные соли включают в себя соли неорганических кислот, а также органических кислот. Примеры подходящих неорганических кислот включают в себя хлористо-водородную, бромисто-водородную, иодисто-водородную, фосфорную, серную, сульфаминовую, азотную кислоты и тому подобное. Примеры подходящих органических-8 016244 кислот включают в себя муравьиную, уксусную, трихлоруксусную, трифторуксусную, пропионовую,бензойную, коричную, лимонную, фумаровую, гликолевую, итаконовую, молочную, метансульфоновую,малеиновую, яблочную, малоновую, миндальную, щавелевую, пикриновую, пировиноградную, салициловую, янтарную, метансульфоновую, этансульфоновую, винную, аскорбиновую, памовую, бисметиленсалициловую, этандисульфоновую, глюконовую, цитраконовую, аспарагиновую, стеариновую, пальмитиновую, EDTA, гликолевую, п-аминобензойную, глутаминовую, бензолсульфоновую, птолуолсульфоновую кислоты, теофиллинуксусные кислоты, а также 8-галогентеофиллины, например 8 бромтеофиллин, и тому подобное. Дополнительные примеры фармацевтически приемлемых аддитивных солей с неорганической или органической кислотой включают в себя фармацевтически приемлемые соли, перечисленные в публикации J. Pharm. Sci. 1977, 66, 2, которая включена здесь в качестве ссылки. В изобретение включены также кислотно-аддитивные соли в виде гидратов, которые способны образовывать настоящие соединения. Примеры солей металлов включают в себя соли лития, натрия, калия, магния и тому подобное. Примеры солей аммония и алкилированного аммония включают в себя соли аммония, метил-, диметил-, триметил-, этил-, гидроксиэтил-, диэтил-, н-бутил-, втор-бутил-, трет-бутил-, тетраметиламмония и тому подобное. Кроме того, соединения данного изобретения могут существовать в несольватированных, а также в сольватированных формах с фармацевтически приемлемыми растворителями, такими как вода, этанол и тому подобное. Обычно сольватированные формы рассматривают как эквивалентные несольватированным формам для целей данного изобретения. Соединения настоящего изобретения могут иметь один или несколько асимметричных центров, и предполагается, что любые оптические изомеры (т.е. энантиомеры или диастереомеры), в виде разделенных, чистых или частично очищенных оптических изомеров и любых их смесей, в том числе рацемических смесей, т.е. смесей стереоизомеров, включены в объем изобретения. Рацемические формы можно разделить на оптические антиподы известными методами, например разделением диастереомерных солей с оптически активной кислотой и выделением оптически активного аминного соединения обработкой основанием. Другой метод разделения рацематов на оптические антиподы основан на хроматографии на оптически активной матрице. Рацемические соединения настоящего изобретения можно также разделить на их оптические антиподы, например, фракционной кристаллизацией. Соединения настоящего изобретения можно также разделить посредством образования диастереомерных производных. Можно применять дополнительные методы для разделения оптических изомеров,известные специалистам в данной области. Такие методы включают в себя методы, описанные J. Jaques,A. Collet and S. Wilen in "Enantiomers, Racemates, and Resolutions", John Wiley and Sons, New York (1981). Оптически активные соединения можно также получить из оптически активных исходных веществ или стереоселективным синтезом. Кроме того, когда в молекуле присутствует двойная связь или система полностью или частично насыщенных колец, могут образовываться геометрические изомеры. Предполагается, что любые геометрические изомеры в виде разделенных, чистых или частично очищенных геометрических изомеров или их смесей включены в объем изобретения. Подобным же образом молекулы, имеющие связь с ограниченным вращением, могут образовывать геометрические изомеры. Предполагается, что они также включены в объем настоящего изобретения. Кроме того, некоторые соединения настоящего изобретения могут существовать в разных таутомерных формах, и предполагается, что любые таутомерные формы, которые способны образовывать соединения, включены в объем настоящего изобретения. Изобретение включает в себя также пролекарства настоящих соединений, которые при введении подвергаются химическому превращению метаболическими процессами перед тем, как они становятся фармакологически активными веществами. Обычно, такие пролекарства являются функциональными производными соединений общей формулы I, которые способны легко превращаться in vivo в требуемое соединение формулы I. Общепринятые методики для выбора и получения подходящих пролекарственных производных описаны, например, в "Design of Prodrugs", ed. H. Bundgaard, Elsevier, 1985. Изобретение включает в себя также активные метаболиты настоящих соединений. Соединения по изобретению имеют аффинность для подтипа рецептора KCNQ2 с величиной EC50 меньше чем 15000 нМ, такой как 10000 нМ, измеряемой испытанием Относительное вытекание через канал KCNQ2, которое описано ниже. Один вариант осуществления относится к таким соединениям формулы I, которые имеют аффинность для подтипа рецептора KCNQ2 с величиной EC50 меньше чем 2000 нМ, такой как 1500 нМ, измеряемой испытанием Относительное вытекание через канал KCNQ2,которое описано ниже. Для дальнейшей иллюстрации изобретения, но без его ограничения, вариант осуществления относится к таким соединениям, которые имеют аффинность для подтипа рецептораKCNQ2 с величиной EC50 меньше чем 200 нМ, такой как 150 нМ, измеряемой испытанием Относительное вытекание через канал KCNQ2", которое описано ниже. Один вариант осуществления относится к таким соединениям формулы I, которые имеют величинуEC50 меньше чем 15 мг/кг, при испытании Максимальный электрошок, которое описано ниже. Для дальнейшей иллюстрации изобретения, но без его ограничения, вариант осуществления относится к таким соединениям, которые имеют величину ED50 меньше чем 5 мг/кг, при испытании Максимальный электрошок, которое описано ниже. Один вариант осуществления относится к таким соединениям формулы I, которые имеют величинуEC50 меньше чем 5 мг/кг, при испытании на Пороговую величину вызванных электрическим током эпилептических припадков и испытании на Пороговую величину вызванных химическим соединением эпилептических припадков, которые описаны ниже. Один вариант осуществления относится к таким соединениям формулы I, которые почти не имеют или имеют клинически незначительные побочные действия. Так, например, некоторые из соединений по изобретению испытывали на моделях на нежелательные седативные, гипотермические и атаксические действия. Один вариант осуществления относится к таким соединениям формулы I, которые имеют высокий терапевтический индекс между противосудорожной активностью и побочными действиями, такими как недостаточность двигательной активности или атаксические действия, измеряемые в тесте на вращающемся стержне. Ожидается, что такие соединения будут вполне толератными для пациентов, что позволит применять высокие дозы до того, как обнаруживаются побочные действия. Таким образом, ожидается, что податливость пациента к проведению терапии будет хорошей, и введение высоких доз может позволить проведение лечения более эффективно для пациентов, которые могут иметь в противном случае побочные действия с другими лекарственными средствами. Как уже указывалось, соединения согласно изобретению обладают действием на калиевые каналы семейства KCNQ, в частности на субъединицу KCNQ2, и поэтому их считают пригодными для повышения потока ионов в зависимом от напряжения калиевом канале у млекопитающего, такого как человек. Соединения по изобретению применимы при лечении нарушения или заболевания, восприимчивого к повышенному потоку ионов в калиевом канале, таком как каналы ионов калия семейства KCNQ. Таким нарушением или заболеванием является предпочтительно нарушение или заболевание центральной нервной системы. В одном аспекте соединения изобретения можно вводить в качестве единственного терапевтически эффективного соединения. В другом аспекте соединения изобретения можно вводить в качестве части комбинированной терапии, т.е. соединения изобретения можно вводить в комбинации с другими терапевтически эффективными соединениями, имеющими, например, противосудорожные свойства. Действия таких других соединений, обладающих противосудорожными свойствами, могут включать в себя, но не ограничиваются перечисленным, действия на ионные каналы, такие как натриевые, калиевые или кальциевые каналы,системы возбуждающих аминокислот, например блокаду или модуляцию рецепторов NMDA,систему ингибирующих нейротрансмиттеров, например усиление высвобождения GABA или блокаду поглощения GABA, или стабилизацию мембран. Современные противосудорожные лекарственные средства включают в себя, но не ограничиваются перечисленным, тиагабин, карбамазепин, валпроат натрия, ламотригин, габапентин, прегабалин, этосуксимид, леветирацетам, фенитоин, топирамат, зонизамид, а также члены класса бензодиазепина и барбитуратов. Изобретение относится к применению соединения формулы I в виде основания или его соли в качестве лекарственного средства. В одном варианте осуществления изобретение относится к применению соединения формулы I в виде свободного основания или его соли в способе лечения. Вариантом осуществления изобретения является фармацевтическая композиция, включающая в себя соединение формулы I в виде свободного основания или его соли и фармацевтически приемлемый носитель или разбавитель. Композиция может включать в себя любой из вариантов осуществления формулы I, описываемой выше. Следующий вариант осуществления изобретения относится к применению соединения формулы I в виде свободного основания или его соли для получения фармацевтической композиции для лечения заболевания или нарушения, при котором полезным является открыватель калиевого канала KCNQ, такого как открыватель калиевого канала KCNQ2. В типичном случае такое нарушение или заболевание выбрано из группы, состоящей из эпилептических нарушений, тревожных нарушений, нарушений, относящихся к невропатической боли и мигреневой боли, нейродегенеративных нарушений, инсульта, злоупотребления кокаином, синдрома отмены приема никотина, синдрома отмены приема этанола и шума в ушах. Следующий вариант осуществления изобретения относится к применению соединения формулы I в виде свободного основания или его соли для получения фармацевтической композиции для лечения эпилептических нарушений. В типичном случае, подвергаемые лечению эпилептические нарушения выбраны из группы, состоящей из острых эпилептических припадков, судорог, эпилептического состояния и- 10016244 эпилепсии, такой как эпилептические синдромы и эпилептические припадки. Следующий вариант осуществления изобретения относится к применению соединения формулы I в виде свободного основания или его соли для получения фармацевтической композиции для лечения тревожных расстройств. В типичном случае подвергаемые лечению тревожные расстройства выбраны из группы, состоящей из тревоги и нарушений и заболеваний, относящихся к паническому приступу, агорафобии, паническому нарушению с агарофобией, паническому нарушению без агарофобии, агорафобии без истории болезни панического нарушения, специфической фобии, социальной фобии и другим специфических фобиям, навязчивому компульсивному нарушению, послетравматическому стрессовому нарушению, острым стрессовым нарушениям, генерализованному тревожному расстройству, тревожному расстройству вследствие общего медицинского состояния, тревожному расстройству, вызванному веществом, расстройству, связанному со страхом разлуки, нарушениям из-за приспособляемости, тревоги в отношении возможности выполнения работы, нарушению, связанному с ипохондрическим синдромом,тревожному нарушению вследствие общего медицинского состояния, тревожному расстройству, вызванному веществом, и тревожному расстройству. Следующий вариант осуществления изобретения относится к применению соединения формулы I в виде свободного основания или его соли для получения фармацевтической композиции для лечения невропатической боли и нарушений, относящихся к мигреневой боли. В типичном случае подвергаемые лечению невропатическая боль и нарушения, относящиеся к мигреневой боли, выбраны из группы, состоящей из аллодинии, гипералгической боли, фантомной боли, невропатической боли, относящейся к диабетической невропатии, невропатической боли, относящейся к невралгии тройничного нерва, и невропатической боли, относящейся к мигрени. Следующий вариант осуществления изобретения относится к применению соединения формулы I в виде свободного основания или его соли для получения фармацевтической композиции для лечения нейродегенеративных нарушений. В типичном случае подвергаемые лечению нейродегенеративные нарушения выбраны из группы, состоящей из болезни Альцгеймера; хореи Гантингтона, рассеянного склероза, бокового амиотрофического склероза, болезни Крейтцфельда-Якоба, болезни Паркинсона, энцефалопатий, индуцированных СПИДом или инфекцией вирусами краснухи, вирусами герпеса, боррелией и неизвестными патогенами, индуцированных травмой нейродегенераций, состояний нейронной повышенной возбудимости, таких как при синдроме отмены лекарственного средства или интоксикация, и нейродегенеративных заболеваний периферической нервной системы, таких как полиневропатия и полиневриты. Следующий вариант осуществления изобретения относится к применению соединения формулы I в виде свободного основания или его соли для получения фармацевтической композиции для лечения биполярных нарушений. Следующий вариант осуществления изобретения относится к применению соединения формулы I в виде свободного основания или его соли для получения фармацевтической композиции для лечения нарушений сна, таких как инсомния. Термин лечение, применяемый в описании в связи с заболеванием или нарушениями, включает в себя также профилактику, подавление и уменьшение интенсивности симптомов, в зависимости от того,какой может быть случай. Изобретение относится к соединениям, проявляющим активность по меньшей мере в одном из следующих испытаний: относительное вытекание через канал KCNQ2, которое является показателем активности соединения у целевого канала; максимальный электрошок, который является показателем эпилептических припадков, индуцированных неспецифической стимуляцией ЦНС электрическими методами; вызванные пилокарпином эпилептические припадки; вызванные пилокарпином эпилептические припадки часто трудно поддаются лечению многими существующими лекарственными средствами против эпилепсии и поэтому они изображают модель устойчивых к лекарственным средствам эпилептических припадков. Испытания на электрический порог эпилептического припадка и испытания на химический порог эпилептического припадка. Эти модели измеряют порог, при котором начинаются эпилептические припадки, таким образом являясь моделями, которые определяют, могут ли соединения задержать начало эпилептического припадка. Испытание с возбуждением миндалевидного тела, которое применяют как показатель развития заболевания, так как у нормальных животных эпилептические припадки на этой модели становятся более тяжелыми, когда животное получает дополнительные стимуляции. Электрофизиологические пэтч-кламп-регистрации данных в клетках СНО и электрофизиологические регистрации данных каналов KCNQ2, KCNQ3/KCNQ3 или KCNQ4 в ооцитах. В этих испытаниях регистрируют токи активированных напряжением каналов KCNQ2,KCNQ3/KCNQ3 или KCNQ4.- 11016244 Фармацевтические композиции Настоящее изобретение относится также к фармацевтической композиции. Соединения изобретения в виде свободного основания или его солей можно вводить отдельно или в комбинации с фармацевтически приемлемыми носителями или разбавителями в виде либо одной, либо многих доз. Фармацевтические композиции по изобретению можно приготовить с фармацевтически приемлемыми носителями или разбавителями, а также любыми другими известными адъювантами и эксципиентами согласно общепринятым методикам, таким как методики, описанные в Remington: The Science and Practice of Pharmacy, 19 Edition, Gennaro, Ed., Mack Publishing Co., Easton, PA, 1995. Фармацевтические композиции можно, в частности, приготовить для введения любым подходящим путем, таким как пероральный, ректальный, назальный, легочный, местный (в том числе трансбуккальный и сублингвальный), чрескожный, внутриполостной, внутрибрюшинный, вагинальный и парентеральный (в том числе подкожный, внутримышечный, внутриоболочечный, внутривенный и внутрикожный) путь, причем пероральный путь является предпочтительным. Должно быть понятно, что предпочтительный путь будет зависеть от общего состояния и возраста подвергаемого лечению субъекта, природы подвергаемого лечению нарушения или заболевания и выбранного активного ингредиента. Фармацевтические композиции, полученные смешиванием соединения изобретения и фармацевтически приемлемых носителей, затем легко вводят в различных лекарственных формах, подходящих для описанных путей введения. Препараты можно подходящим образом преобразовать в стандартную лекарственную форму методами, известными в области фармации. Соединения данного изобретения обычно применяют в виде свободного основания или в виде его фармацевтически приемлемой соли. Одним примером является кислотно-аддитивная соль соединения,являющегося полезным в виде свободного основания. Когда соединение изобретения является свободным основанием, такие соли получают общепринятым способом обработкой раствора или суспензии свободного основания изобретения химическим эквивалентом фармацевтически приемлемой кислоты. Репрезентативные примеры указываются выше. Фармацевтические композиции для перорального введения могут быть твердыми или жидкими. Твердые лекарственные формы для перорального введения включают в себя, например, капсулы, таблетки, драже, пилюли, лепешки, порошки, гранулы и пилюли, например, помещенные в твердую желатиновую капсулу, в форме порошка или гранул или, например, в форме пастилки или лепешки. При необходимости фармацевтические композиции для перорального введения можно получить с покрытиями, такими как энтеросолюбильные покрытия, или их можно изготовить так, чтобы обеспечить регулируемое высвобождение активного ингредиента, такое как стойко поддерживаемое или пролонгированное высвобождение, по методам, хорошо известным в данной области. Жидкие лекарственные формы для перорального введения включают в себя, например, растворы, эмульсии, суспензии, сиропы и эликсиры. Препараты настоящего изобретения, подходящие для перорального введения, можно представить в виде дискретных единиц, таких как капсулы или таблетки, причем каждая единица содержит предварительно определенное количество активного ингредиента, которые могут включать в себя подходящий эксципиент. Кроме того, перорально пригодные препараты могут быть в форме порошка или гранул, раствора или суспензии в водной или неводной жидкости или жидкой эмульсии типа масло в воде или вода в масле. Подходящие фармацевтические носители включают в себя инертные твердые разбавители или наполнители, стерильный водный раствор и различные органические растворители. Примерами твердых носителей являются лактоза, сульфат кальция, сахароза, циклодекстрин, тальк, желатина, агар, пектин,аравийская камедь, стеарат магния, стеариновая кислота, низшие алкиловые эфиры целлюлозы, кукурузный крахмал, картофельный крахмал, камеди и тому подобное. Примерами жидких носителей являются сироп, арахисовое масло, оливковое масло, фосфолипиды, жирные кислоты, амиды жирных кислот, полиоксиэтилен и вода. Носитель или разбавитель может включать в себя любое известное в данной области вещество с замедленным высвобождением, такое как глицерилмоностеарат или глицерилдистеарат, по отдельности или в смеси с воском. Можно применять любые адъюванты или добавки, обычно применяемые для определенных целей,такие как окрашивающие агенты, корригенты, консерванты и т.д., при условии, что они совместимы с активными ингредиентами. Количество твердого носителя обычно варьирует от приблизительно 25 мг до приблизительно 1 г. Если применяют жидкий носитель, препарат может быть в форме сиропа, эмульсии, мягкой желатиновой капсулы или стерильной инъецируемой жидкости, такой как водная или неводная жидкая суспензия или раствор. Таблетки можно приготовить смешиванием активного ингредиента с традиционными адъювантами или разбавителями с последующим прессованием смеси в таблетирующей машине. Фармацевтические композиции для парентерального введения включают в себя стерильные водные и неводные инъецируемые растворы, дисперсии, суспензии или эмульсии, а также стерильные порошки для пересоздания в стерильные инъецируемые растворы или дисперсии перед применением. Инъецируе- 12016244 мые препараты-депо также рассматриваются как находящиеся в пределах объема настоящего изобретения. Для парентерального введения можно применять растворы соединения изобретения в стерильном водном растворе, водном пропиленгликоле, водном витамине Е или кунжутном или арахисовом масле. Если необходимо, такие водные растворы следует подходящим образом забуферить и жидкому разбавителю сначала придать изотоничность достаточным количеством солевого раствора или глюкозы. Водные растворы являются особенно подходящими для внутривенного, внутримышечного, подкожного и внутрибрюшинного введения. Все применяемые стерильные водные среды являются легко доступными при помощи стандартных методик, известных специалистам в данной области. Растворы для инъекций можно получить растворением активного ингредиента и возможных добавок в части растворителя для инъекции, предпочтительно стерильной воде, регулированием объема раствора до требуемой величины, стерилизацией раствора и заполнением им подходящих ампул и пузырьков. Можно добавить любую подходящую добавку, обычно применяемую в данной области, такую как агенты тоничности, консерванты, антиоксиданты и т.д. Другие подходящие для введения формы включают в себя суппозитории, спреи, мази, кремы, гели,лекарственные формы для ингаляции, кожные пластыри, имплантаты и т.д. Типичная пероральная доза находится в диапазоне от приблизительно 0,001 до приблизительно 100 мг/кг массы тела в день, предпочтительно от приблизительно 0,01 до приблизительно 50 мг/кг массы тела в день и более предпочтительно от приблизительно 0,05 до приблизительно 10 мг/кг массы тела в день, причем указанную дозу вводят в виде одной или нескольких доз, например 1-3 доз. Точная доза будет зависеть от частоты и способа введения, пола, возраста, массы и общего состояния подвергаемого лечению субъекта, природы и тяжести подвергаемого лечению нарушения или заболевания и любых подвергаемых лечению сопутствующих заболеваний и других факторов, очевидных для специалиста в данной области. Препараты можно подходящим образом представить в виде стандартной лекарственной формы методами, известными специалистам в данной области. Типичная стандартная лекарственная форма для перорального введения один или несколько раз в день, например 1-3 раза в день, может содержать от 0,01 до приблизительно 1000 мг, например приблизительно 0,01-100 мг, предпочтительно от приблизительно 0,05 до приблизительно 500 мг и более предпочтительно от приблизительно 0,5 до приблизительно 200 мг. Для парентеральных путей введения, таких как внутривенное, внутриоболочечное, внутримышечное и аналогичное введение, типичные дозы составляют порядка приблизительно половины дозы, применяемой для перорального введения. Типичными примерами рецептов для препарата по изобретению являются следующие примеры. 1) Таблетки, содержащие 5,0 мг соединения изобретения, причем количество соединения вычислено для свободного основания: соединение изобретения 5,0 мг лактоза 60 мг кукурузный крахмал 30 мг гидроксипропилцеллюлоза 2,4 мг микрокристаллическая целлюлоза 19,2 мг натриевая соль кроскармеллозы типа А 2,4 мг стеарат магния 0,84 мг. 2) Таблетки, содержащие 0,5 мг соединения изобретения, причем количество соединения вычислено для свободного основания: соединение изобретения 0,5 мг лактоза 46,9 мг кукурузный крахмал 23,5 мг повидон 1,8 мг микрокристаллическая целлюлоза 14,4 мг натриевая соль кроскармеллозы типа А 1,8 мг стеарат магния 0,63 мг. 3) Сироп, содержащий на 1 мл соединение изобретения 25 мг сорбит 500 мг гидроксипропилцеллюлозу 15 мг глицерин 50 мг метилпарабен 1 мг пропилпарабен 0,1 мл сорбит 500 мг гидроксипропилцеллюлозу 15 мг глицерин 50 мг- 13016244 метилпарабен 1 мг пропилпарабен 0,1 мл этанол 0,005 мг корригент 0,05 мг натриевую соль сахарина 0,5 мг воду до 1 мл. 4) Раствор для инъекции, содержащий на 1 мл соединение изобретения 0,5 мг сорбит 5,1 мг уксусную кислоту 0,05 мг натриевую соль сахарина 0,5 мг воду до 1 мл. Выражение соединение изобретения означает любое соединение формулы I описываемых вариантов осуществления. Следующий аспект настоящего изобретения относится к способу получения соединения изобретения, как описано ниже. Получение соединений изобретения Настоящее изобретение относится к соединению, представленному общей формулой I где q равно 0 или 1; каждый из R1 и R2 независимо выбран из группы, состоящей из C1-6-алкила, C2-6-алкенила, C2-6 алкинила, C3-8-циклоалкила, C3-8-циклоалкенила, C3-8-циклоалк(ен)ил-С 1-8-алкила, C3-8-циклоалк(ен)ил-C2-8 алкенила, C3-8-циклоалк(ен)ил-C2-8-алкинила, С 1-6-алкилокси, С 2-6-алкенилокси, С 2-6-алкинилокси и галогена; иR3 выбран из группы, состоящей из С 1-8-алкила, С 2-8-алкенила, С 2-8-алкинила, C3-8-циклоалкила, C3-8 циклоалкенила, C3-8-циклоалк(ен)ил-С 1-6-алкила, C3-8-циклоалк(ен)ил-C2-6-алкенила, C3-8-циклоалк(ен)илC2-6-алкинила, необязательно замещенного арил-C1-6-алкила, необязательно замещенного арил-С 2-6 алкенила, необязательно замещенного арил-С 2-6-алкинила, необязательно замещенного арил-C3-8 циклоалк(ен)ила, необязательно замещенного арил-C3-8-циклоалк(ен)ил-C1-6-алкила, необязательно замещенного арил-C3-8-циклоалк(ен)ил-C2-6-алкенила, необязательно замещенного арил-C3-8-циклоалк(ен)ил-C2-6-алкинила, гетероарил-C1-6-алкила, гетероарил-C2-6-алкенила, гетероарил-C2-6-алкинила,гетероарил-C3-8-циклоалк(ен)ила, гетероарил-C3-8-циклоалк(ен)ил-C1-6-алкила, гетероарил-C3-8-циклоалк(ен)ил-С 2-6-алкенила и гетероарил-C3-8-циклоалк(ен)ил-С 2-6-алкинила; где арильная часть необязательно замещена 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, C1-6-алкила, С 2-6-алкенила, С 2-6-алкинила, C3-8-циклоалк(ен)ила,C3-8-циклоалк(ен)ил-C1-6-алкила, С 3-8-циклоалк(ен)ил-C2-6-алкенила, C3-8-циклоалк(ен)ил-C2-6-алкинила,галоген-С 1-6-алкила, галоген-C2-6-алкенила, галоген-C2-6-алкинила, галоген-C3-8-циклоалк(ен)ила, галогенC3-8-циклоалк(ен)ил-C1-6-алкила, галоген-C3-8-циклоалк(ен)ил-C2-6-алкенила, галоген-C3-8-циклоалк(ен)илС 2-6-алкинила, C1-6-алкилокси, C2-6-алкенилокси, С 2-6-алкинилокси, C3-8-циклоалк(ен)илокси и C3-8 циклоалк(ен)ил-C1-6-алкилокси,C3-8-циклоалк(ен)ил-С 2-6-алкенилоксиC3-8-циклоалк(ен)ил-C2-6 алкинилокси; и где гетероарил выбран из группы, состоящей из пиридина, тиофена, фурана, пиррола, пиразола,триазола, тетразола, оксазола, имидазола, тиазола, бензофурана, бензотиофена и индола; и его фармацевтически приемлемой соли. Соединения изобретения общей формулы I, где R1, R2, R3 и q имеют значения, указанные выше,можно получить способами, представленными на схемах и описываемыми ниже. В соединениях общих формул I-XV R1, R2, R3 и q имеют значения, указанные для формулы I. Соединения общих формул II, VII, VIII, IX, X, XI и XII либо получают из коммерческих источников,либо получают стандартными методами, известными квалифицированным химикам в данной области. Соединения общей формулы III (схема 1) можно получить реакцией соединений общей формулы II с бис-(2-галогенэтиловыми) простыми эфирами с добавлением или без добавления оснований, таких как триалкиламины, карбонат калия или алкоголяты лития, натрия или калия, с добавлением или без добавления катализаторов, таких как иодид натрия, в подходящем растворителе, таком как диметилсульфоксид, N,N-диметилформамид или этанол, при подходящей температуре, такой как комнатная температура или температура флегмы. Соединения общей формулы IV (схема 1) можно получить из соединений общей формулы III реакцией нитрования, известной квалифицированным химикам в данной области, такой как реакция с концентрированной азотной кислотой, нитритом натрия или нитратом натрия, в подходящем растворителе, таком как ледяная уксусная кислота, уксусный ангидрид, трифторуксусная кислота,концентрированная серная кислота или их смеси, при подходящих температурах, например, как описано Соединения общей формулы V (схема 2) можно получить из соединений общей формулы II реакциями нитрования, известными квалифицированным химикам в данной области, как описано в схеме 1 для получения соединений формулы IV. Соединения общей формулы IV (схема 2) можно получить реакцией соединений общей формулы V с подходящим образом замещенными бис-(2-галогенэтиловыми) простыми эфирами, как описано на схеме 1 для получения соединений общей формулы III. Схема 3 Соединения общей формулы VI (схема 3) можно получить из соединений общей формулы IV восстановлением нитрогруппы в аминогруппу подходящими восстанавливающими агентами, такими как порошок цинка или железа в присутствии кислоты, такой как уксусная кислота или водная хлористоводородная кислота, или газообразным водородом, или формиатом аммония в присутствии подходящего катализатора гидрирования, такого как палладий на активированном угле, в подходящих растворителях,таких как метанол, этанол, этилацетат или тетрагидрофуран, при подходящих температурах или при ультразвуковом излучении. В альтернативном случае в качестве восстанавливающих агентов можно применять хлорид олова(II) или дитионит натрия в подходящих условиях, хорошо известных квалифицированным химикам в данной области. Соединения общей формулы I (схема 3) можно получить реакцией соединений общей формулы VI с подходящими электрофильными реагентами, такими как, но без ограничения перечисленным, фторангидриды подходящим образом замещенных карбоновых кислот, хлорангидриды карбоновых кислот,бромангидриды карбоновых кислот, иодангидриды карбоновых кислот, активированные сложные эфиры, хлорформиаты, с добавлением или без добавления оснований, таких как пиридин, триалкиламины,карбонат калия, оксид магния или алкоголяты лития, натрия или калия, в подходящем растворителе, таком как этилацетат, диоксан, тетрагидрофуран, ацетонитрил или диэтиловый простой эфир, при подходящей температуре, такой как комнатная температура или температура флегмы. Активированные сложные эфиры и ангидриды карбоновых кислот можно получить из подходящим образом замещенных карбоновых кислот в условиях, известных квалифицированным химикам в данной области, например, как описано F. Alberico and L.A. Carpino, "Coupling reagents and activation" in Methods in enzymology: Solidphase peptide Synthesis, pp. 104-125, Academic Press, New York, 1997. Галогенангидриды карбоновых кислот можно получить из подходящим образом замещенных карбоновых кислот активацией реагентами,такими как, но без ограничения перечисленным, тионилхлорид, оксалилхлорид, трибромид фосфора или трииодид фосфора, в условиях, хорошо известных квалифицированным химикам в данной области. Соединения общей формулы II (схема 4) можно получить реакцией соединений общей формулы VII с амидом натрия в подходящем растворителе, таком как ксилол, при подходящей температуре, такой как температура флегмы, как описано J. Lecocq, Bull. Soc. Chim. Fr., 1950, 188. Схема 5Соединения общей формулы VII, где R2 представляет собой F, Cl, Br или I (схема 5), можно получить из соединений общей формулы VIII посредством металлирования и последующей реакции с подходящим электрофилом, известным квалифицированным химикам в данной области, с применением подходящих оснований, таких как бутиллитий или ди-трет-бутил-(2,2,6,6-тетраметилпиперидино)цинкат лития, с последующим добавлением подходящего электрофила, такого как фтор, хлор, бром, иод, иод,тетрабромид углерода или гексахлорэтан, в подходящих растворителях, таких как гептан или тетрагидрофуран, при подходящих температурах, таких как -78 С или комнатная температура, например, как описано F. Mongin and G. Queguiner, Tetrahedron, 2001, 57, 4059. Соединения общей формулы VII, где R1 представляет собой F, Cl, Br или I (схема 5), можно получить из соединений общей формулы IX посредством металлирования и последующего электрофильного ароматического замещения, как описано выше. Схема 6 Соединения формулы VII, где R2 представляет собой С 1-6-алкил, С 2-6-алкенил, C2-6-алкинил, C3-8 циклоалкил, C3-8-циклоалкенил, С 3-8-циклоалк(ен)ил-C1-8-алкил, С 3-8-циклоалк(ен)ил-С 2-8-алкенил, С 3-8 циклоалк(ен)ил-C2-8-алкинил (схема 6), можно получить из соединений общей формулы X посредством реакций перекрестного сочетания, известных квалифицированным химикам в данной области, такой как сочетание Negishi (E.-I. Negishi, A.O. King and N. Okukado, J. Org. Chem., 1977, 42, 1821), сочетаниеSonogashira (K. Sonogashira, У. Tohda and N. Hagihara, Tet. Lett., 1975, 16, 4467) или другие, катализируемые переходными металлами реакции перекрестного сочетания, такие как катализируемые медью реакции (W. Dohle, D.M. Lindsay and P. Knochel, Org. Lett., 2001, 3, 2871). Соединения формулы VII, где R1 представляет собой C1-6-алкил, C2-6-алкенил, C2-6-алкинил, C3-8 циклоалкил, C3-8-циклоалкенил, C3-8-циклоалк(ен)ил-C1-8-алкил, С 3-8-циклоалк(ен)ил-C2-8-алкенил, С 3-8 циклоалк(ен)ил-С 2-8-алкинил (схема 6), можно получить из соединений общей формулы XI посредством реакций перекрестного сочетания, как описано выше. Кроме того, соединения общей формулы VII, где R2 представляет собой циано (схема 6), можно получить из соединений общей формулы X посредством катализируемых никелем реакций цианирования,известных квалифицированным химикам в данной области, например, как описано L. Cassar, J. Organomet. Chem., 1973, 54, С 57-С 58. Соединения общей формулы VII, где R1 представляет собой циано (схема 6), можно получить из соединений общей формулы XI посредством катализируемых никелем реакций цианирования, как описано выше. Соединения общей формулы VII, где R1=R2 (схема 6), можно получить из соединений общей формулы X, где R1=R2=Br, посредством реакций перекрестного сочетания или реакций цианирования, как описано выше. Кроме того, соединения формулы XIII (схема 7), где R1 и R2 представляют собой галоген, можно получить из 2,4,6-тригалогенпиридинов общей формулы XII, где R1 и R2 представляют собой галоген,реакциями нитрования, известными квалифицированным химикам в данной области, как описано на схеме 1 для получения соединений общей формулы IV. Соединения общей формулы XIV (схема 7), где R1 и R2 представляют собой галоген, можно получить из соединений общей формулы XII, где R1 и R2 представляют собой галоген, реакцией с морфолином в подходящем растворителе, таком как диметилсульфоксид или N-метилпирролидинон, с добавлением или без добавления оснований, таких как пиридин, триалкиламины, карбонат калия, оксид магния,при подходящих температурах, таких как комнатная температура или температура флегмы. Соединения общей формулы XV можно получить из соединений общей формулы XIII реакцией с морфолином в подходящем растворителе, таком как диметилсульфоксид или N-метилпирролидинон, с добавлением или без добавления оснований, таких как пиридин, триалкиламины, карбонат калия, оксид магния, при подходящих температурах, таких как комнатная температура или температура флегмы. Кроме того, соединения общей формулы XV можно получить из соединений общей формулы XIV реакциями нитрования, известными квалифицированным химикам в данной области, как описано на схеме 1 для получения соединений общей формулы IV. Кроме того, соединения общей формулы IV, где R1 или R2 или как R1, так и R2 представляют собой циано (схема 7), можно получить из соединений общей формулы XV с применением реакций цианирования, как описано выше. Соединения общей формулы III, где R1 или R2 или как R1, так и R2 представляют собой циано, можно получить из соединений общей формулы XIV с применением реакций цианирования, как описано выше. Соединения общей формулы III, где R1 представляет собой C1-6-алкила, C2-6-алкенила, C2-6 алкинила, C3-8-циклоалкила, C3-8-циклоалкенила, C3-8-циклоалк(ен)ил-С 1-8-алкила, C3-8-циклоалк(ен)ил-C2-8 алкенила, C3-8-циклоалк(ен)ил-C2-8-алкинила (схема 6), можно получить из соединений общей формулыXIV посредством реакций перекрестного сочетания, как описано выше (схема 6). Соединения общей формулы III, где R2 представляет собой C2-6-алкил, C2-6-алкенил, C2-6-алкинил,С 3-8-циклоалкил, С 3-8-циклоалкенил, C3-8-циклоалк(ен)ил-С 1-8-алкил, С 3-8-циклоалк(ен)ил-С 2-8-алкенил, C3-8 циклоалк(ен)ил-C2-8-алкинил (схема 6), можно получить из соединений общей формулы XIV посредством реакций перекрестного сочетания, как описано выше (схема 6). Соединения общей формулы IV, где R1 представляет собой C1-6-алкил, C2-6-алкенил, C2-6-алкинил,C3-8-циклоалкил, C3-8-циклоалкенил, C3-8-циклоалк(ен)ил-С 1-8-алкил, C3-8-циклоалк(ен)ил-C2-8-алкенил, C3-8 циклоалк(ен)ил-С 2-8-алкинил (схема 6), можно получить из соединений общей формулы XV посредством реакций перекрестного сочетания, как описано выше (схема 6). Соединения общей формулы VI, где R2 представляет собой C1-6-алкил, C2-6-алкенил, C2-6-алкинил,C3-8-циклоалкил, C3-8-циклоалкенил, C3-8-циклоалк(ен)ил-С 1-8-алкил, C3-8-циклоалк(ен)ил-С 2-8-алкенил, C3-8 циклоалк(ен)ил-C2-8-алкинил (схема 6), можно получить из соединений общей формулы XV посредством реакций перекрестного сочетания, как описано выше (схема 6). Соединения общей формулы IV, где R1 или R2 или как R1, так и R2 представляют собой С 1-6 алкилокси, C2-6-алкенилокси, С 2-6-алкинилокси, можно получить из соединений общей формулы XV реакцией с подходящими алкоголятами лития, натрия или калия или со спиртами в присутствии основания,такого как гидроксид лития, натрия или калия, гидрид лития, натрия или калия, и с добавлением или без добавления катализатора, такого как сульфат меди, в подходящем растворителе, таком как диоксан, при подходящих температурах, таких как комнатная температура или температура флегмы. Соединения общей формулы III, где R1 или R2 или как R1, так и R2 представляют собой C1-6 алкилокси, C2-6-алкенилокси, C2-6-алкинилокси, можно получить из соединений общей формулы XIV реакцией с подходящими алкоголятами лития, натрия или калия или со спиртами в присутствии основания, такого как гидроксид лития, натрия или калия, гидрид лития, натрия или калия, и с добавлением или без добавления катализатора, такого как сульфат меди, в подходящем растворителе, таком как диоксан,при подходящих температурах, таких как комнатная температура или температура флегмы.- 17016244 Кроме того, для следующего варианта R1 и R2 соединения, содержащие метоксигруппу, можно деметилировать методами, известными квалифицированным химикам в данной области, такими как обработка трибромидом бора в подходящем растворителе, таком как дихлорметан, при подходящих температурах, таких как 0 С или комнатная температура. Образовавшиеся фенолы можно затем алкилировать методами, известными квалифицированным химикам в данной области. Такие методы включают в себя(а) реакцию с электрофилами, такими как алкилхлориды, алкилбромиды, алкилиодиды, хлорангидриды угольных кислот, бромангидриды угольных кислот или ангидриды угольных кислот, в присутствии подходящих оснований, таких как карбонат калия, в подходящем растворителе, таком как тетрагидрофуран,N,N-диметилформамид или 1,2-дихлорэтан, при подходящих температурах, таких как комнатная температура или температура флегмы; (b) реакцию с алкиловыми спиртами в условиях, известных как реакция Мицунобу (О. Mitsunobu, Synthesis 1981, 1). Соединения, содержащие функциональные группы, такие как гидроксигруппы, не совместимые с предполагаемыми условиями реакции, можно защитить и снять у них защиту методами, известными квалифицированным химикам в данной области, например, как описано T.W. Greene and P.G.M. Wuts, Protective groups in organic synthesis, 2nd edition, Wiley Interscience, 1991. В частности, гидроксигруппы можно защитить превращением в такие простые эфиры, но без ограничения перечисленным, как метиловые,трет-бутиловые, триалкилсилиловые, триарилсилиловые, аллиловые или тритиловые простые эфиры. Алкины, полученные реакциями Sonogashira, можно восстановить в алкены или алканы восстановлением газообразным водородом или формиатом аммония в присутствии подходящего катализатора гидрирования, такого как палладий на активированном угле или платина на активированном угле, в подходящих растворителях, таких как метанол, этанол или тетрагидрофуран, при подходящих температурах,например, как описано S. Siegel, "Heterogeneous catalytic hydrogenation of C=C and alkynes" in Comprehensive Organic Synthesis, v. 8, pp 417-442, Pergamon Press, 1991. Получение соединений изобретения Примеры Аналитические данные ЖХ-МС получали на приборе Ре Sciex API 150EX, снабженном системой фотоионизации при атмосферном давлении и ЖХ Shimadzu LC-8A/SLC-10A. Колонка: С 18 304,6 ммWaters Symmetry с размером частиц 3,5 мкм; система растворителей: А=смесь вода/трифторуксусная кислота (100:0,05) и В=смесь вода/ацетонитрил/трифторуксусная кислота (5:95:0,03); метод: элюирование с линейным градиентом от 90% А до 100% В в течение 4 мин и со скоростью потока 2 мл/мин. Чистоту определяли сочетанием УФ-спектроскопии (254 нм) и записи прибора для метода ELSD. Времена удерживания (tR) выражали в минутах. Очистку препаративной ЖХ-МС проводили на таком же приборе с химической ионизацией при атмосферном давлении. Колонка: YMC ODS-A 5020 мм с размером частиц 5 мкм; метод: элюирование с линейным градиентом от 80% А до 100% В в течение 7 мин и со скоростью потока 22,7 мл/мин. Сбор фракций проводили детектированием потока разделения МС. Аналитические данные ЖХ-MC-TOF (TOF - время пролета) получали на приборе micromass LCT 4ways MUX, снабженном детекторной системой Waters 2488/Sedex 754. Колонка: С 18 304,6 мм Waters(100:0,05) и В=смесь вода/ацетонитрил/трифторуксусная кислота (5:95:0,03); метод: элюирование с линейным градиентом от 90% А до 100% В в течение 4 мин и со скоростью потока 2 мл/мин. Чистоту определяли сочетанием УФ (254 нм) и записи прибора для метода ELSD. Времена удерживания (tR) выражали в минутах. Данные ГХ-МС получали на газовом хроматографе Varian CP 3800, снабженном колонкой Phenomenex (Zebron ZB-5, длина: 15 м, внутренний диаметр: 0,25 мм), соединенной с масс-спектрометром с ионной ловушкой Varian Saturn 2000. Метод: продолжительность анализа 15 мин, скорость потока в колонке 1,4 мл/мин (газом-носителем был гелий), градиент термостата колонки: 0-1 мин, 60 С; 1-13 мин,60-300 С; 13-15 мин, 300 С. 1 Н ЯМР-спектры регистрировали при 500,13 МГц на приборе Bruker Avance DRX500. В качестве растворителя применяли дейтерированный диметилсульфоксид (99,8% D). Тетраметилсилан применяли в качестве внутреннего стандарта. Величины химических сдвигов выражали в м.д. относительно тетраметилсилана. Для мультиплетности сигналов применяют следующие аббревиатуры: с=синглет; д=дублет, т=треплет, кв.=квартет, кви.=квинтет, г=гептет, дд=двойной дублет,ддд=двойной двойной дублет, дт=двойной триплет, дкв.=двойной квартет, тт=триплет триплетов,м=мультиплет и шир. с=широкий синглет. Получение промежуточных соединений 4-(4,6-Диметилпиридин-2-ил)морфолин. 2-Амино-4,6-диметилпиридин (50 г), бис-(2-хлорэтиловый) простой эфир (57,5 мл), иодид натрия(6,13 г) и триэтиламин (137 мл) смешивают в сухом N,N-диметилформамиде (1 л) в атмосфере аргона и смесь нагревают до 150 С в течение 16 ч. К охлажденной реакционной смеси добавляют смесь вода/насыщенный раствор соли/насыщенный водный бикарбонат натрия (2:1:1, 750 мл) и ее экстрагируют- 18016244 этилацетатом (5200 мл). Объединенные органические фазы концентрируют в вакууме приблизительно до 500 мл. Добавляют воду (500 мл) и концентрированную водную хлористо-водородную кислоту (35 мл), фазы разделяют и водную фазу промывают этилацетатом (200 мл). Водную фазу подщелачивают добавлением концентрированного водного гидроксида натрия (50 мл) и экстрагируют изопропилацетатом (5200 мл). Объединенные фазы сушат над сульфатом магния и концентрируют в вакууме до получения 44,0 г (выход 56%) указанного в заголовке соединения в виде черного масла. Неочищенный продукт применяют без дополнительной очистки. ГХ-МС (m/z) 192 (М+); tR=5,60. 1(с, 1 Н). 4-(4,6-Диметил-5-нитропиридин-2-ил)морфолин. К 4-(4,6-диметилпиридин-2-ил)морфолину (9,4 г), растворенному в трифторуксусной кислоте (250 мл), охлажденной до 0 С, добавляют нитрит натрия (3,54 г) на протяжении 15 мин и реакционную смесь затем перемешивают 15 мин при 0 С. Реакционную смесь концентрируют в вакууме приблизительно до 100 мл и рН регулируют до 11 концентрированным водным гидроксидом натрия (150 мл). Добавляют насыщенный раствор соли (200 мл) и смесь экстрагируют диэтиловым эфиром (4150 мл), органическую фазу сушат над сульфатом магния и концентрируют в вакууме. Неочищенный продукт подвергают очистке флэш-хроматографией (SiO2, гептан/этилацетат, 4:1),получая при этом 2,01 г (выход 17%) указанного в заголовке соединения в виде желтого твердого вещества. ГХ-МС (m/z) 237 (М+); tR=7,69. 1 Н ЯМР (500 МГц, ДМСО-d6): 2,28 (с, 3H), 2,39 (с, 3H), 3,60 (м, 4 Н), 3,67 (м, 4 Н), 6,72 (с, 1 Н). 2,4-Диметил-6-морфолин-4-илпиридин-3-иламин. Ледяную уксусную кислоту (25 мл) медленно добавляют к смеси цинковой пыли (2,76 г) и 4-(4,6 диметил-5-нитропиридин-2-ил)морфолина (2,01 г) в тетрагидрофуране (100 мл), охлажденной до 0 С. Реакционную смесь затем перемешивают в течение 16 ч при 25 С, фильтруют через целит, подщелачивают 25% водным аммиаком и экстрагируют тетрагидрофураном (375 мл). Объединенные органические фазы сушат над сульфатом магния и концентрируют в вакууме, получая при этом 1,76 г (100%) указанного в заголовке соединения в виде темно-красного твердого вещества. ГХ-МС (m/z) 207 (М+); tR=7,27. 1 Н ЯМР (500 МГц, ДМСО-d6): 2,07 (с, 3H), 2,20 (с, 3H), 3,16 (м, 4 Н), 3,67 (м, 4 Н), 4,10 (шир., 2 Н),6,38 (с, 1 Н). 4-(4,6-Дихлорпиридин-2-ил)морфолин. Морфолин (5,0 г) добавляют к суспензии 2,4,6-трихлорпиридина (10,0 г) и карбоната натрия (5,9 г) в ацетонитриле (100 мл). Реакционную смесь затем перемешивают при 70 С в течение 16 ч, охлаждают до температуры окружающей среды, фильтруют через целит и концентрируют в вакууме. Неочищенный продукт подвергают очистке флэш-хроматографией (SiO2, гептан/этилацетат, 4:1), получая при этом 3,90 г (выход 30%) указанного в заголовке соединения в виде не совсем белого твердого вещества. ЖХ-МС(m/z) 323,8 (М+); tR=3,10, (УФ, ELSD) 98,5%, 98,9%. 1 Н ЯМР (500 МГц, CDCl3): 3,50 (м, 4 Н), 3,80 (м, 4 Н), 6,45 (с, 1 Н), 6,67 (с, 1 Н). 4-(4,6-Дихлор-5-нитропиридин-2-ил)морфолин. К раствору 4-(4,6-дихлорпиридин-2-ил)морфолина (3,90 г) в концентрированной серной кислоте (40 мл) добавляют нитрат калия (1,80 г) на протяжении 10 мин. Реакционную смесь перемешивают в течение 16 ч при температуре окружающей среды и затем выливают в измельченный лед (500 г). Реакционную смесь подщелачивают концентрированным гидроксидом натрия и экстрагируют этилацетатом (2100 мл). Объединенные органические фазы сушат над сульфатом магния и концентрируют в вакууме. Неочищенный продукт подвергают очистке флэш-хроматографией (SiO2, гептан/этилацетат, 3:1), получая при этом 2,26 г (выход 49%) указанного в заголовке соединения в виде желтого твердого вещества. ЖХМС (m/z) 278,0 (М+); tR=3,10, (УФ, ELSD) 96,5%, 98,8%. 1H ЯМР (500 МГц, CDCl3): 3,62 (м, 4 Н), 3,80 (м, 4 Н), 6,50 (с, 1 Н). 4-(4-Хлор-6-метокси-5-нитропиридин-2-ил)морфолин и 4-(6-хлор-4-метокси-5-нитропиридин-2 ил)морфолин. К раствору 4-(4,6-дихлор-5-нитропиридин-2-ил)морфолина (2,02 г) в метаноле (15 мл) добавляют метоксид натрия (0,98 г) и смесь нагревают в течение 16 ч при 65 С. После охлаждения до температуры окружающей среды реакционную смесь концентрируют в вакууме. Неочищенный продукт подвергают очистке флэш-хроматографией (SiO2, гептан/этилацетат, 3:1), получая при этом 0,89 г (выход 45%) 4-(4 хлор-6-метокси-5-нитропиридин-2-ил)морфолина (быстро элюирующаяся полоса) и 0,38 г (19%) 4-(6 хлор-4-метокси-5-нитропиридин-2-ил)морфолина (поздно элюирующаяся полоса), причем оба соединения получают в виде желтых твердых веществ. 4-(4-Хлор-6-метокси-5-нитропиридин-2-ил)морфолин: ЖХ-МС (m/z) 273 (М+); tR=2,77, (УФ, ELSD) 95%, 97%. 1 Н ЯМР (500 МГц, CDCl3): 3,60 (м, 4 Н), 3,80 (м, 4 Н), 3,96 (с, 1 Н), 6,17 (с, 1 Н). 4-(6-Хлор-4-метокси-5-нитропиридин-2-ил)морфолин: ЖХ-МС (m/z) 273 (М+); tR=2,39, (УФ, ELSD) 93%, 95%.H ЯМР (500 МГц, CDCl3): 3,57 (м, 4 Н), 3,80 (м, 4 Н), 3,95 (с, 3H), 5,95 (с, 1 Н). 4-Хлор-2-метокси-6-морфолин-4-илпиридин-3-иламин. К раствору 4-(4-хлор-6-метокси-5-нитропиридин-2-ил)морфолина (0,82 г) в концентрированной хлористо-водородной кислоте (50 мл) добавляют раствор дихлорида олова(II) (3,38 г) в концентрированной хлористо-водородной кислоте (80 мл). Реакционную смесь нагревают до 75 С в течение 1 ч и затем выливают на измельченный лед (400 г) и экстрагируют этилацетатом (2100 мл). Объединенные органические фазы сушат над сульфатом магния и концентрируют в вакууме, получая при этом 0,45 г (выход 61%) указанного в заголовке соединения в виде не совсем белого твердого вещества. ЖХ-МС (m/z) 244 (М+); tR=1,48, (УФ, ELSD) 89%, 94%. 1H ЯМР (500 МГц, CDCl3): 3,30 (м, 4 Н), 3,65 (шир. с, 2 Н), 3,85 (м, 4 Н), 3,97 (с, 3H), 6,20 (с, 1 Н). 2-Хлор-4-метокси-6-морфолин-4-илпиридин-3-иламин. К раствору 4-(6-хлор-4-метокси-5-нитропиридин-2-ил)морфолина (0,38 г) в концентрированной хлористо-водородной кислоте (20 мл) добавляют раствор дихлорида олова(II) (1,57 г) в концентрированной хлористо-водородной кислоте (60 мл). Реакционную смесь нагревают до 75 С в течение 5 мин и затем выливают на измельченный лед (100 г) и экстрагируют этилацетатом (220 мл). Объединенные органические фазы сушат над сульфатом магния и концентрируют в вакууме, получая при этом 0,28 г (выход 83%) указанного в заголовке соединения в виде не совсем белого твердого вещества. 1 Н ЯМР (500 МГц, CDCl3): 3,35 (м, 4 Н), 3,65 (шир. с, 2 Н), 3,80 (м, 4 Н), 3,90 (с, 3H), 6,10 (с, 1 Н). Соединения изобретения Кислотно-аддитивные соли соединений изобретения можно легко получить методами, известными квалифицированному специалисту в данной области. Пример 1. 1 аа. Бензиловый эфир (2,4-диметил-6-морфолин-4-илпиридин-3-ил)карбаминовой кислоты. Бензилхлорформиат (18 мг) добавляют к 0,085 М раствору 2,4-диметил-6-морфолин-4-илпиридин-3 иламина и 0,17 М раствору N,N-диизопропилэтиламина в 1,2-дихлорэтане (1 мл). Реакционную смесь в ампуле встряхивают в течение 16 ч в атмосфере аргона и содержимое ее концентрируют в вакууме. Добавляют водный гидроксид натрия (1 М, 1 мл) и сырую смесь экстрагируют смесью изопропилацетат/тетрагидрофуран (4:1, 21 мл). Органическую фазу промывают насыщенным раствором соли (1 мл), концентрируют в вакууме и снова растворяют в смеси 1-пропанол/диметилсульфоксид (1:1, 0,4 мл), 0,2 мл раствора подвергают очистке препаративной ЖХ-МС, получая при этом 4,5 мг (выход 31%) указанного в заголовке соединения в виде масла. ЖХ-МС (m/z) 342 (МН)+; tR=1,58, (УФ, ELSD), 99%, 99%. Аналогично получают нижеследующие соединения. 1ab. 2-Хлорбензиловый эфир (2,4-диметил-6-морфолин-4-илпиридин-3-ил)карбаминовой кислоты. Выход: 18%. ЖХ-МС (m/z) 376 (МН)+; tR=1,78, (УФ, ELSD), 99%, 100%. 1ac. 2-(4-Хлорфенил)-N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)ацетамид. Выход: 4%. ЖХ-МС (m/z) 360 (МН)+; tR=1,59, (УФ, ELSD), 96%, 100%. 1ad. (2,4-Диметил-6-морфолин-4-илпиридин-3-ил)амид 2-фенилциклопропанкарбоновой кислоты. Выход: 24%. ЖХ-МС (m/z) 352 (МН)+; tR=1,64, (УФ, ELSD), 96%, 100%. 1ae. N-(2,4-Диметил-6-морфолин-4-илпиридин-3-ил)-2-тиофен-2-илацетамид. Выход: 16%. ЖХ-МС (m/z) 332 (МН)+; tR=1,20, (УФ, ELSD), 93%, 99%. 1af. 3-Циклогексил-N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)пропионамид. Выход: 15%. ЖХ-МС (m/z) 346 (МН)+; tR=1,81, (УФ, ELSD), 91%, 100%. 1ag. Изобутиловый эфир (2,4-диметил-6-морфолин-4-илпиридин-3-ил)карбаминовой кислоты. Выход: 29%. ЖХ-МС (m/z) 308 (МН)+; tR=1,44, (УФ, ELSD), 97%, 99%. 1ah. 3-(3-Хлорфенил)-N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)пропионамид. 3-(3-Хлорфенил)пропионовую кислоту (20 мг) перемешивают при 25 С в течение 2 ч в атмосфере аргона в оксалилхлориде (2 М раствор в дихлорметане, 1 мл). Растворитель удаляют в вакууме и к реакционной смеси добавляют 0,085 М раствор 2,4-диметил-6-морфолин-4-илпиридин-3-иламина и 0,17 М раствор N,N-диизопропилэтиламина в 1,2-дихлорэтане (1 мл). Реакционную смесь в ампуле встряхивают в течение 16 ч в атмосфере аргона и концентрируют в вакууме. Добавляют водный гидроксид натрия(1 М, 1 мл) и неочищенную смесь экстрагируют смесью изопропилацетат/тетрагидрофуран (4:1, 21 мл). Органическую фазу промывают насыщенным раствором соли (1 мл), концентрируют в вакууме и снова растворяют в смеси 1-пропанол/диметилсульфоксид (1:1, 0,4 мл), 0,2 мл полученного раствора подвергают очистке препаративной ЖХ-МС, получая при этом 2,3 мг (выход 14%) указанного в заголовке соединения в виде масла. ЖХ-МС (m/z) 374 (МН)+; tR=1,71, (УФ, ELSD), 99%, 99%. Аналогично получают нижеследующие соединения. 1ai. N-(2,4-Диметил-6-морфолин-4-илпиридин-3-ил)-2-(3,5-диметилфенил)ацетамид. Выход: 19%. ЖХ-МС (m/z) 354 (МН)+; tR=1,69, (УФ, ELSD), 99%, 99%. 1aj. N-(2,4-Диметил-6-морфолин-4-илпиридин-3-ил)-3-п-толилпропионамид. Выход: 20%. ЖХ-МС (m/z) 354 (МН)+; tR=1,64, (УФ, ELSD), 99%, 100%.- 20016244 1ak. 2-(3-Хлорфенил)-N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)ацетамид. Выход: 14%. ЖХ-МС (m/z) 360 (МН)+; tR=1,58, (УФ, ELSD), 97%, 99%. 1al. 2-(3,4-Дихлорфенил)-N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)ацетамид. Выход: 9%. ЖХ-МС (m/z) 395 (МН)+; tR=1,84, (УФ, ELSD), 97%, 99%. 1am. N-(2,4-Диметил-6-морфолин-4-илпиридин-3-ил)-2-тиофен-3-илацетамид. Выход: 18%. ЖХ-МС (m/z) 332 (МН)+; tR=1,18, (УФ, ELSD), 97%, 99%. 1an. N-(2,4-Диметил-6-морфолин-4-илпиридин-3-ил)-2-п-толилацетамид. Выход: 16%. ЖХ-МС (m/z) 340 (МН)+; tR=1,50, (УФ, ELSD), 96%, 99%. 1 ао. 2-(3-Бромфенил)-N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)ацетамид. Выход: 12%. ЖХ-МС (m/z) 405 (МН)+; tR=1,63, (УФ, ELSD), 96%, 99%. 1ap. N-(2,4-Диметил-6-морфолин-4-илпиридин-3-ил)-2-(3-трифторметилфенил)ацетамид. Выход: 20%. ЖХ-МС (m/z) 394 (МН)+; tR=1,77, (УФ, ELSD), 94%, 99%. 1aq. N-(2,4-Диметил-6-морфолин-4-илпиридин-3-ил)-2-фенилацетамид. Выход: 11%. ЖХ-МС (m/z) 326 (МН)+; tR=1,29, (УФ, ELSD), 93%, 99%. 1ar. (2,4-Диметил-6-морфолин-4-илпиридин-3-ил)амид 3,5,5-триметилгексановой кислоты. Выход: 20%. ЖХ-МС (m/z) 348 (МН)+; tR=1,97, (УФ, ELSD), 93%, 99%. 1as. (2,4-Диметил-6-морфолин-4-илпиридин-3-ил)амид октановой кислоты. Выход: 44%. ЖХ-МС (m/z) 334 (МН)+; tR=1,92, (УФ, ELSD), 92%, 99%. 1at. N-(2,4-Диметил-6-морфолин-4-илпиридин-3-ил)-2-нафталин-2-илацетамид. Выход: 4%. ЖХ-МС (m/z) 376 (МН)+; tR=1,73, (УФ, ELSD), 92%, 99%. 1au. (2,4-Диметил-6-морфолин-4-илпиридин-3-ил)амид гептановой кислоты. Выход: 24%. ЖХ-МС (m/z) 320 (МН)+; tR=1,56, (УФ, ELSD), 90%, 99%. 1av. N-(2,4-Диметил-6-морфолин-4-илпиридин-3-ил)-2-(3,4-диметилфенил)ацетамид. Выход: 26%. ЖХ-МС (m/z) 354 (МН)+; tR=1,65, (УФ, ELSD), 77%, 99%. 1aw. 2-Циклогекс-1-енил-N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)ацетамид. Выход: 13%. ЖХ-МС (m/z) 330 (МН)+; tR=1,50, (УФ, ELSD), 72%, 99%. 1ax. N-(2,4-Диметил-6-морфолин-4-илпиридин-3-ил)-2-(4-метокси-3-метилфенил)ацетамид. Выход: 16%. ЖХ-МС (m/z) 370 (МН)+; tR=1,56, (УФ, ELSD), 94%, 99%. 1ay. N-(2,4-Диметил-6-морфолин-4-илпиридин-3-ил)-2-(4-метоксифенил)ацетамид. Выход: 19%. ЖХ-МС (m/z) 356 (МН)+; tR=1,35, (УФ, ELSD), 96%, 99%. 1az. N-(2,4-Диметил-6-морфолин-4-илпиридин-3-ил)-3-(4-метоксифенил)пропионамид. Выход: 15%. ЖХ-МС (m/z) 370 (МН)+; tR=1,48, (УФ, ELSD), 76%, 99%. 1ba. N-(2,4-Диметил-6-морфолин-4-илпиридин-3-ил)-2-м-толилацетамид. м-Толилуксусную кислоту (0,33 г), N,N-диизопропилэтиламин (0,90 мл) и N-оксид гексафторфосфата N-[(диметиламино)-1 Н-1,2,3-триазоло[4,5-b]пиридин-1-илметилен]-N-метилметанаминия (1,00 г) смешивают в сухом N,N-диметилформамиде (3 мл) и смесь перемешивают в атмосфере аргона в течение 2 мин. К реакционной смеси добавляют 2,4-диметил-6-морфолин-4-илпиридин-3-иламин (0,30 г), растворенный в сухом N,N-диметилформамиде (2 мл), и смесь перемешивают при 25 С в атмосфере аргона в течение 16 ч. Добавляют этилацетат (20 мл) и органическую фазу промывают смесью насыщенный водный хлорид аммония/вода (1:1, 20 мл), водой (20 мл), смесью насыщенный раствор соли/вода (1:1, 20 мл), сушат над сульфатом натрия, концентрируют в вакууме и очищают флэш-хроматографией (SiO2,смесь гептан/этилацетат, 3:1), получая при этом 0,069 г (выход 14%) указанного в заголовке соединения в виде белого твердого вещества. ЖХ-МС (m/z) 340 (MH+); tR=1,42, (УФ, ELSD) 96%, 100%. 1(м, 4 Н), 6,52 (с, 1 Н), 7,06 (д, 1 Н), 7,15 (м, 2 Н), 7,21 (т, 1 Н), 9,30 (с, 1 Н). Аналогично получают нижеследующие соединения. 1bb. N-(2,4-Диметил-6-морфолин-4-илпиридин-3-ил)-2-(4-фторфенил)ацетамид. Выход: 14%. ЖХ-МС (m/z) 344 (МН+); tR=1,34, (УФ, ELSD), 99%, 99%. 1 Н ЯМР (500 МГц, ДМСО-d6): 1,99 (с, 3H), 2,10 (с, 3H), 3,37 (м, 4 Н), 3,60 (с, 2 Н), 3,66 (м, 4 Н), 6,52(т, 2 Н), 3,37 (м, 4 Н), 3,67 (м, 4 Н), 6,53 (с, 1 Н), 9,05 (с, 1 Н). 1bk. 2-Циклопентил-N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)ацетамид. 2,4-Диметил-6-морфолин-4-илпиридин-3-иламин (0,22 г) и циклопентилацетилхлорид (0,19 мл) растворяют в ацетонитриле (5 мл) и раствор нагревают до 150 С в течение 10 мин в запаянной ампуле при микроволновом облучении. Реакционную смесь концентрируют в вакууме и очищают флэшхроматографией (SiO2, гептан/этилацетат, 3:1), получая при этом 0,17 г (выход 49%) указанного в заголовке соединения в виде белого твердого вещества. ЖХ-МС (m/z) 318 (МН)+; tR=1,40, (УФ, ELSD), 97%,99%. 1 Н ЯМР (500 МГц, ДМСО-d6): 1,21 (м, 2 Н), 1,52 (м, 2 Н), 1,61 (м, 2 Н), 1,77 (м, 2 Н), 2,05 (с, 3H), 2,17(с, 3H), 2,24 (м, 1 Н), 2,26 (м, 2 Н), 3,37 (м, 4 Н), 3,67 (м, 4 Н), 6,53 (с, 1 Н), 9,05 (с, 1 Н). Аналогично получают следующие соединения, за исключением соединений 1bl и 1bm, которые перекристаллизовывают из этилацетата после флэш-хроматографии. 1bl. 3-Циклопентил-N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)пропионамид. Выход: 34%. ЖХ-МС (m/z) 332 (МН+); tR=1,57, (УФ, ELSD), 99%, 99%. 1 Н ЯМР (500 МГц, ДМСО-d6): 1,11 (м, 2 Н), 1,49 (м, 2 Н), 1,60 (м, 4 Н), 1,77 (м, 3H), 2,04 (с, 3H), 2,16- 22016244 Таблица 1 Реагенты, применяемые для получения соединений в примере 1 Испытание in vitro и in vivo. Соединения изобретения испытывали и определили активность по меньшей мере на одной из указанных ниже моделей. Относительное вытекание через канал KCNQ2. Здесь приводится пример протокола скрининга KCNQ2 для оценки соединений настоящего изобретения. Данный анализ измеряет относительное вытекание через канал KCNQ2, его проводили по методу,описанному Tang et al. (Tang, W. et al., J. Biomol. Screen. 2001, 6, 325-331) для калиевых каналов hERG с модификациями, описанными ниже. Адекватное число клеток СНО, стабильно экспрессирующих регулируемые напряжением каналыKCNQ2, засевали в планшете при плотности, достаточной для образования конфлюэнтного монослоя, за день до эксперимента. Клетки загружали 1 мкКи [86Rb] на протяжении ночи. В день эксперимента клетки промывали HBSS-содержащим буфером (сбалансированным солевым раствором Хэнкса, полученным отInvitrogen, cat 14025-050). Клетки предварительно инкубировали с лекарственным средством в течение 30 мин и вытекание Rb+ стимулировали субмаксимальной концентрацией 15 мМ хлорида калия при постоянном присутствии лекарственного средства в течение дополнительных 30 мин. После подходящего периода инкубации супернатант удаляли и подсчет импульсов проводили с применением сцинтилляционной жидкости (Tricarb). Клетки лизировали 2 мМ гидроксидом натрия и подсчитывали количество Rb+. Относительное вытекание вычисляли следующим образом: Соединения изобретения имеют EC50 меньше чем 20000 нМ, в большинстве случаев меньше чем 2000 нМ и во многих случаях меньше чем 200 нМ. В соответствии с этим, считают, что соединения изобретения являются полезными при лечении заболеваний, связанных с калиевыми каналами семействаKCNQ. Электрофизиологические пэтч-кламп-регистрации в клетках СНО. Активированные напряжением токи KCNQ2 регистрировали у клеток СНО млекопитающих применением общепринятых методик пэтч-кламп-регистрации в конфигурации пэтч-клампа целых клеток(Hamill O.P. et al. Pflugers Arch 1981; 391: 85-100). Клетки СНО со стабильной экспрессией активированных напряжением каналов KCNQ2 выращивали при нормальных условиях культивирования клеток в инкубаторах с CO2 и применяли для электрофизиологических регистраций через 1-7 дней после высевания. Калиевые каналы KCNQ2 активировали скачками напряжения до + 80 мВ с инкрементами 5-20 мВ(или протоколом с линейным повышением) от потенциала поддержания мембраны между -100 и -40 мВ(Tatulian L. et al. J Neuroscience 2001; 21 (15): 5535-5545). Электрофизиологические эффекты, индуцированные соединениями, оценивали по различным параметрам тока активированного напряжением KCNQ2. Особенно изучали влияния на порог активации для тока и на максимальный индуцированный ток. По указанному испытанию изучали некоторые из соединений изобретения. Предполагается, что смещение порога активации влево или повышение в максимальном индуцированном токе калия снижает активность нейронных сетей и поэтому делает соединения полезными при заболеваниях с повышенной нейронной активностью, подобных эпилепсии. Электрофизиологические регистрации каналов KCNQ2, KCNQ2/KCNQ3 или KCNQ5 в ооцитах. Активированные напряжением токи KCNQ2, KCNQ2/KCNQ3 или KCNQ5 регистрировали от ооцитов Xenopus, которым инъецировали мРНК, кодирующую ионные каналы KCNQ2, KCNQ2+ KCNQ3 илиKCNQ5 (Wang et al., Science 1998, 282, 1890-1893; Lerche et al., J. Biol Chem 2000, 275, 22395-400). Калиевые каналы KCNQ2, KCNQ2/KCNQ3 или KCNQ5 активировали скачками напряжения от потенциала поддержания мембраны (между -100 и -40 мВ) до + 40 мВ с инкрементами 5-20 мВ (или протоколом с линейным повышением). Электрофизиологические действия, индуцированные соединениями, оценивали по различным параметрам активированных напряжением токов KCNQ2, KCNQ2/KCNQ3 или KCNQ5. Особенно изучали действия на порог активации для тока и на максимальный индуцированный ток. Действия гиперполяризации некоторых соединений испытывали также непосредственно на потенциал мембран во время фиксации тока. Максимальный электрошок. Испытание проводили в группах самцов мышей с применением корнеальных электродов и введением тока прямоугольного импульса 26 мА в течение 0,4 с для индукции судороги, характеризующейся тонизирующим выпрямлением задних конечностей (Wlaz et al. Epilepsy Research 1998, 30, 219-229). Эпилептические припадки, индуцированные пилокарпином. Индуцируемые пилокарпином эпилептические припадки индуцируют внутрибрюшинной инъекцией 250 мг/кг пилокарпина группе самцов мышей и наблюдали эпилептическую активность, приводящую к потери положения тела в пределах периода 30 мин (Starr et al. Pharmacology Biochemistry and Behavior 1993, 45, 321-325). Испытание на электрический порог эпилептического припадка. Модификацию метода вверх и вниз (Kimball et al. Radiation Research 1957, 1-12) применяли для определения среднего порога для индукции тонизирующего выпрямления задних конечностей в ответ на корнеальный электрошок в группах самцов мышей. Первая мышь каждой группы получала электрошок при 14 мА (0,4 с, 50 Гц) и затем ее обследовали на эпилептическую активность. Если эпилептический припадок наблюдали, ток снижали на 1 мА для следующей мыши, однако, если эпилептический припадок не наблюдали, то ток повышали на 1 мМ. Эту процедуру повторяли для всех 15 мышей в группе обработки. Испытание на химический порог эпилептического припадка. Пороговую дозу пентилентетразола, требуемую для индукции клонической судороги, измеряли регулируемой по времени инфузией пентилентетразола (5 мг/мл при скорости 0,5 мл/мин) в латеральную вену хвоста группы самцов мышей (Nutt et al. J. Pharmacy and Pharmacology 1986, 38, 697-698).- 25016244 Активация миндалевидного тела. Крыс подвергали хирургической операции для имплантации триполярных электродов в дорсолатеральное миндалевидное тело. После хирургической операции животным давали возможность восстановиться перед тем, как группы крыс получали либо изменяемые дозы испытуемого соединения, либо носитель для лекарственного средства. Животных стимулировали их начальным током после порога разрядки + 25 мкА ежедневно в течение 3-5 недель и в каждом случае отмечали тяжесть эпилептического припадка, продолжительность эпилептического припадка, продолжительность присутствия электрического тока после разрядки (Racine. Electroencephalography and Clinical Neurophysiology 1972, 32, 281-294). Побочные действия. Побочные действия на центральную нервную систему определяли измерением времени, в течение которого мыши могли оставаться на аппарате с вращающимся стержнем (Capacio et al. Drug and ChemicalToxicology 1992, 15, 177-201), или измерением их локомоторной активности подсчетом числа инфракрасных лучей, пересекающихся в клетке для испытания (Watson et al. Neuropharmacology 1997, 36, 13691375). Гипотермические действия соединения на температуру внутренней части тела животных измеряли либо ректальным зондом, либо имплантированными датчиками радиотелеметрии, способными измерить температуру (Keeney et al. Physiology and Behaviour 2001, 74, 177-184). Фармакокинетики. Фармакокинетические свойства соединений определяли посредством внутривенного и перорального дозированного введения их крысам Spraque Dawley и после этого отбором образцов крови на протяжении 20 ч. Концентрации их в плазме определяли ЖХ/МС/МС. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, имеющее общую формулу I где q равно 0 или 1; каждый из R1 и R2 независимо выбран из группы, состоящей из C1-6-алкила, C2-6-алкенила, С 2-6 алкинила, C3-8-циклоалкила, C3-8-циклоалкенила, C3-8-циклоалк(ен)ил-C1-8-алкила, C3-8-циклоалк(ен)ил-C2-8 алкенила, C3-8-циклоалк(ен)ил-C2-8-алкинила, C1-6-алкилокси, C2-6-алкенилокси, С 2-6-алкинилокси и галогена; иR3 выбран из группы, состоящей из C1-8-алкила, C2-8-алкенила, C2-8-алкинила, C3-8-циклоалкила, С 3-8 циклоалкенила, C3-8-циклоалк(ен)ил-C1-6-алкила, C3-8-циклоалк(ен)ил-С 2-6-алкенила, C3-8-циклоалк(ен)илС 2-6-алкинила, необязательно замещенного арил-C1-6-алкила, необязательно замещенного арил-C2-6 алкенила, необязательно замещенного арил-С 2-6-алкинила, необязательно замещенного арил-С 3-8 циклоалк(ен)ила, необязательно замещенного арил-С 3-8-циклоалк(ен)ил-C1-6-алкила, необязательно замещенного арил-C3-8-циклоалк(ен)ил-C2-6-алкенила,необязательно замещенного арил-C3-8 циклоалк(ен)ил-С 2-6-алкинила, гетероарил-C1-6-алкила, гетероарил-С 2-6-алкенила, гетероарил-С 2-6 алкинила, гетероарил-C3-8-циклоалк(ен)ила, гетероарил-C3-8-циклоалк(ен)ил-C1-6-алкила, гетероарил-C3-8 циклоалк(ен)ил-С 2-6-алкенила и гетероарил-С 3-8-циклоалк(ен)ил-C2-6-алкинила; где арильная часть необязательно замещена 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из галогена, циано, C1-6-алкила, C2-6-алкенила, C2-6-алкинила, С 3-8-циклоалк(ен)ила,C3-8-циклоалк(ен)ил-C1-6-алкила, C3-8-циклоалк(ен)ил-C2-6-алкенила, C3-8-циклоалк(ен)ил-С 2-6-алкинила,галоген-C1-6-алкила, галоген-C2-6-алкенила, галоген-C2-6-алкинила, галоген-C3-8-циклоалк(ен)ила, галогенC3-8-циклоалк(ен)ил-C1-6-алкила, галоген-C3-8-циклоалк(ен)ил-С 2-6-алкенила, галоген-С 3-8-циклоалк(ен)илС 2-6-алкинила, C1-6-алкилокси, С 2-6-алкенилокси, С 2-6-алкинилокси, C3-8-циклоалк(ен)илокси и С 3-8 циклоалк(ен)ил-C1-6-алкилокси,C3-8-циклоалк(ен)ил-С 2-6-алкенилокси,C3-8-циклоалк(ен)ил-С 2-6 алкинилокси; и где гетероарил выбран из группы, состоящей из пиридина, тиофена, фурана, пиррола, пиразола,триазола, тетразола, оксазола, имидазола, тиазола, бензофурана, бензотиофена и индола; и его фармацевтически приемлемая соль. 2. Соединение по п.1, где q равно 0. 3. Соединение по п.1, где q равно 1. 4. Соединение по п.2 или 3, где как R1, так и R2 представляют собой C1-6-алкил, С 2-6-алкенил или C2-6 алкинил. 5. Соединение по п.2 или 3, где R1 представляет собой C1-6-алкилокси, С 2-6-алкенилокси или C2-6 алкинилокси и R2 представляет собой галоген или где R1 представляет собой галоген и R2 представляет- 26016244 собой С 1-6-алкилокси, C2-6-алкенилокси или С 2-6-алкинилокси. 6. Соединение по п.4 или 5, где R3 выбран из группы, состоящей из C1-8-алкила, C2-8-алкенила, С 2-8 алкинила, C3-8-циклоалк(ен)ил-С 1-6-алкила, C3-8-циклоалк(ен)ил-С 2-6-алкенила, С 3-8-циклоалк(ен)ил-С 2-6 алкинила, необязательно замещенного арил-С 1-6-алкила, необязательно замещенного арил-C2-6-алкенила,необязательно замещенного арил-C2-6-алкинила, необязательно замещенного арил-С 3-8-циклоалк(ен)ила,гетероарил-С 1-6-алкила, гетероарил-С 2-6-алкенила, гетероарил-С 2-6-алкинила. 7. Соединение по п.6, где необязательно замещенный арил может быть замещен одним или несколькими заместителями, независимо выбранными из группы, состоящей из галогена, C1-6-алкила, С 2-6 алкенила, C2-6-алкинила, галоген-C1-6-алкила, галоген-C2-6-алкенила, галоген-C2-6-алкинила, C1-6 алкилокси, C2-6-алкенилокси, C2-6-алкинилокси. 8. Соединение по п.1, выбранное из группы, состоящей из бензилового эфира (2,4-диметил-6-морфолин-4-илпиридин-3-ил)карбаминовой кислоты; 2-хлорбензилового эфира (2,4-диметил-6-морфолин-4-илпиридин-3-ил)карбаминовой кислоты; 2-(4-хлорфенил)-N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)ацетамида;N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)-3-п-толилпропионамида; или его фармацевтически приемлемая соль. 9. Соединение по п.1, выбранное из группы, состоящей из 2-(3-хлорфенил)-N-(2,4-диметил-6-морфолин-4-ил-пиридин-3-ил)ацетамида; 2-(3,4-дихлорфенил)-N-(2,4-диметил-6-морфолин-4-ил-пиридин-3-ил)ацетамида;N-(2,4-диметил-6-морфолин-4-илпиридин-3-ил)-2-нафталин-2-илацетамида; или его фармацевтически приемлемая соль. 10. Соединение по п.1, выбранное из группы, состоящей изN-(4-хлор-2-метокси-6-морфолин-4-илпиридин-3-ил)пропионамида; или его фармацевтически приемлемая соль. 11. Фармацевтическая композиция для терапии, включающая один или несколько фармацевтически приемлемых носителей или разбавителей и соединение по п.1.- 27016244 12. Применение фармацевтической композиции по п.11 для увеличения потока ионов в калиевом канале млекопитающего. 13. Применение фармацевтической композиции по п.11 для лечения нарушения или заболевания,восприимчивого к увеличенному ионному потоку в калиевом канале, причем таким нарушением или заболеванием является нарушение или заболевание центральной нервной системы. 14. Применение по п.13, где подвергаемое лечению нарушение или заболевание выбрано из группы,состоящей из эпилептических нарушений, тревожных расстройств, нарушений, относящихся к невропатической боли и мигреневой боли, нейродегенеративных нарушений, инсульта, злоупотребления кокаином, синдрома отмены приема никотина, синдрома отмены приема этанола и шума в ушах. 15. Применение по п.14, где эпилептические нарушения выбраны из группы, состоящей из острых эпилептических припадков, судорог, эпилептического состояния, эпилепсии, такой как эпилептические синдромы и эпилептические припадки. 16. Применение по п.14, где тревожные расстройства выбраны из группы, состоящей из тревоги и нарушений и заболеваний, относящихся к паническому приступу, агорафобии, паническому нарушению с агарофобией, паническому расстройству без агарофобии, агорафобии без истории болезни панического нарушения, специфической фобии, социальной фобии и другим специфическим фобиям, навязчивому компульсивному нарушению, послетравматическому стрессовому нарушению, острым стрессовым нарушениям, генерализованному тревожному расстройству, тревожному расстройству вследствие общего медицинского состояния, тревожному расстройству, вызванному веществом, тревожному расстройству,связанному со страхом разлуки, нарушениям из-за приспособляемости, тревоги в отношении возможности выполнения работы, нарушениям, связанным с ипохондрическим синдромом, тревожному расстройству вследствие общего медицинского состояния и тревожному расстройству, вызванному веществом. 17. Применение по п.14, где нарушения, относящиеся к невропатической боли и мигреневой боли,выбраны из группы, состоящей из аллодиния, гипералгической боли, фантомной боли, невропатической боли, относящейся к диабетической невропатии, невропатической боли, относящейся к невралгии тройничного нерва. 18. Применение по п.14, где нейродегенеративные нарушения выбраны из группы, состоящей из болезни Альцгеймера; хореи Гантингтона, рассеянного склероза, бокового амиотрофического склероза,болезни Крейтцфельда-Якоба, болезни Паркинсона, энцефалопатий, индуцированных СПИДом или инфекцией вирусами краснухи, вирусами герпеса, боррелией или неизвестными патогенами, индуцированных травмой нейродегенераций, состояний нейронной повышенной возбудимости и нейродегенеративных заболеваний периферической нервной системы. 19. Применение по п.13, где подвергаемое лечению нарушение или заболевание выбрано из группы,состоящей из биполярных нарушений. 20. Применение по п.13, где подвергаемое лечению нарушение или заболевание выбрано из нарушений сна.
МПК / Метки
МПК: A61K 31/5377, A61P 25/00, C07D 413/04
Метки: пиридинов, производные, замещенных
Код ссылки
<a href="https://eas.patents.su/29-16244-proizvodnye-zameshhennyh-piridinov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные замещенных пиридинов</a>
Предыдущий патент: Курительные изделия с ограничителем и источником аэрозоля
Следующий патент: Способ выделения секоизоларицирезинола и дигидрокверцетина из древесины
Случайный патент: Гетероциклические соединения, содержащая их фармацевтическая композиция и их применение для лечения pask-опосредованного заболевания












