Производные имидазо[1,5-а]пиридинов, способ их получения и содержащие их фармацевтические композиции
Номер патента: 13408
Опубликовано: 30.04.2010
Авторы: Борд Мари-Франсуаз, Боно Франсуаз, Бадорк Ален, Алькуфф Шанталь
Формула / Реферат
1. Соединения формулы (I)

в которой R в положениях 5, 6, 7 или 8 имидазо[1,5-а]пиридина обозначает атом водорода, атом галогена, алкильный радикал с 1-5 атомами углерода, гидроксильный радикал, алкоксильный радикал с 1-5 атомами углерода, радикал -COOR6или радикал формул
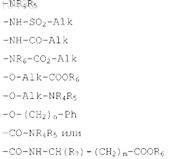
в которых Alk обозначает алкильный или алкиленовый радикал с 1-5 атомами углерода;
n обозначает целое число от 1 до 5;
m обозначает целое число от 0 до 4;
R4 и R5независимо друг от друга обозначают атом водорода, алкильный радикал с 1-5 атомами водорода или бензильный радикал;
R6 обозначает атом водорода или алкильный радикал с 1-5 атомами углерода;
R7 обозначает атом водорода, алкильный радикал с 1-5 атомами углерода или радикал формул
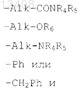
Ph обозначает фенильный радикал, в случае необходимости замещенный одной или несколькими группами, выбираемыми из атомов галогена, алкоксильных радикалов с 1-5 атомами углерода и радикалов -COOR6, где R6 имеет значения, указанные выше;
R1 обозначает атом водорода, атом галогена, цианогруппу, радикал -COCR6или радикал формул
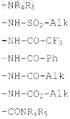
фенильный радикал, в случае необходимости замещенный одной или несколькими группами, выбираемыми из атомов галогена, алкильных радикалов с 1-5 атомами углерода, алкоксильных радикалов с 1-5 атомами углерода и радикалов -COOR6;
гетероарильный радикал с 5 звеньями, содержащий гетероатом, выбираемый из атома серы, атома кислорода или атома азота, и в случае необходимости содержащий второй атом азота, причем указанный гетероарил в случае необходимости замещен одной или несколькими группами, выбираемыми из атомов галогена, алкильных радикалов с 1-5 атомами углерода, алкоксильных радикалов с 1-5 атомами углерода и радикалов -COCR6; или
гетероарильный радикал с 6 звеньями, содержащий 1 или 2 атома азота и в случае необходимости замещенный одной или несколькими группами, выбираемыми из атомов галогена, алкильных радикалов с 1-5 атомами углерода, алкоксильных радикалов с 1-5 атомами углерода и радикалов -COCR6,
в которых Alk, Ph, R4, R5и R6 имеют указанные выше значения;
R2 и R3независимо друг от друга обозначают гидроксильный радикал, алкоксильный радикал с 1-5 атомами углерода, аминорадикал, радикал -COOR6, нитрогруппу или радикал формул

в которых Alk, Ph, R4, R5и R6 имеют указанные выше значения; или
R2 и R3вместе с атомами углерода фенильного кольца, с которым они соединены, образуют 6-членный углеродный цикл, содержащий атом азота и второй гетероатом, такой как кислород, в форме основания или соли, а также в форме гидрата или сольвата.
2. Соединение формулы (I), в которой
R, находящийся в положениях 6, 7 или 8 имидазо[1,5-а]пиридина, обозначает атом водорода, алкильный радикал с 1-5 атомами углерода, алкоксильный радикал с 1-5 атомами углерода, гидроксильный радикал, радикал -COOR6или радикал формул

в которых Alk, Ph, R4, R5, R6, R7и m имеют значения, указанные в п.1;
R1 обозначает атом водорода, атом галогена, цианорадикал, радикал -COOR6или радикал формул

фенил, в случае необходимости замещенный одной или двумя группами, выбираемыми из атомов галогена, алкоксильных радикалов с 1-5 атомами углерода и радикалов -COOR6;
гетероарильный радикал с 5 звеньями, содержащий гетероатом, выбираемый из атома серы, атома кислорода или атома азота, и в случае необходимости содержащий второй атом азота, причем указанный гетероарил в случае необходимости замещен одной или двумя группами, выбираемыми из атомов галогена, алкильных радикалов с 1-5 атомами углерода, алкоксильных радикалов с 1-5 атомами углерода и радикалов -COOR6; или
гетероарильный радикал с 6 звеньями, содержащий 1 или 2 атома азота и в случае необходимости замещенный одной или двумя группами, выбираемыми из атомов галогена, алкильных радикалов с 1-5 атомами углерода, алкоксильных радикалов с 1-5 атомами углерода и радикалов -COOR6,
где Alk, Ph и R6 имеют значения, указанные в п.1;
R2 и R3независимо друг от друга обозначают алкоксильный радикал с 1-5 атомами углерода, радикал
-COOR6, аминогруппу, нитрогруппу или радикал формул

в которых Alk, Ph, R4, R5и R6 имеют значения, указанные в п.1;
в форме основания или соли, а также в форме гидрата или сольвата.
3. Соединение формулы (I) по п.1 или 2, в которой
R, находящийся в положениях 6, 7 или 8 имидазо[1,5-а]пиридина, обозначает атом водорода, алкоксильный радикал с 1-5 атомами углерода, гидроксильный радикал, радикал -COOR6 или радикал формул
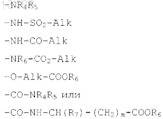
в которых m обозначает 0 или 1, R7 обозначает атом водорода, алкильный радикал с 1-5 атомами углерода или радикал формулы -Alk-OR6или -CH2-Ph, a Alk, R4, R5 и R6 имеют значения, указанные в п.1;
R1 обозначает атом водорода, атом галогена, цианогруппу, радикал -COOR6или радикал формул
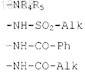
фенил в случае необходимости замещенный одной или двумя группами, выбираемыми из атомов галогена, алкоксильных радикалов с 1-5 атомами углерода и радикалов -COOR6,
гетероарильный радикал, выбираемый из тиенила, фурила и пирролила, причем указанный гетероарил в случае необходимости замещен одной или двумя группами, выбираемыми из алкоксильных радикалов с 1-5 атомами углерода и радикалов -COOR6, или пиридинил, в случае необходимости замещенный одной или двумя группами, выбираемыми из алкоксильных радикалов с 1-5 атомами углерода и радикалов -COOR6, где Alk, Ph и R6имеют значения, указанные в п.1;
R2 и R3независимо друг от друга обозначают алкоксильный радикал с 1-5 атомами углерода, радикал
-COOR6, нитрорадикал, аминорадикал или радикал формулы -NH-CO-Alk, -NH-CO-Ph или -NH-SO2Alk;
где Alk, Ph и R6 имеют значения, указанные в п.1;
в форме основания или соли, а также в форме гидрата или сольвата.
4. Соединение формулы (I) по любому из пп.1-3, в которой R2 обозначает алкоксильный радикал с 1-5 атомами углерода или радикал -COOR6, где R6 имеет значения, указанные в п.1, в форме основания или соли, а также в форме гидрата или сольвата.
5. Соединение формулы (I) по любому из пп.1-4, в которой R3 обозначает нитрорадикал, аминорадикал или радикал формул -NH-CO-Alk, -NH-CO-Ph или -NH-SO2Alk, где Alk и Ph имеют значения, указанные в п.1, в форме основания или соли, а также в форме гидрата или сольвата.
6. Соединение формулы (I) по любому из пп.1-5, в которой
R, находящийся в положениях 6, 7 или 8 имидазо[1,5-а]пиридина, обозначает атом водорода, гидроксильный радикал, радикал -COOR6или радикал формул
![]()
в которых R7 обозначает атом водорода, алкильный радикал с 1-5 атомами углерода или радикал формулы
-Alk-OR6, a Alk, R4, R5 и R6имеют значения, указанные в п.1;
R1 обозначает атом водорода, атом галогена, радикал -COOR6 или радикал формулы
![]()
фенил, в случае необходимости замещенный одной или двумя группами, выбираемыми из атомов галогена, алкоксильных радикалов с 1-5 атомами углерода и радикалов -COOR6, или
тиенильный радикал, в случае необходимости замещенный одной или двумя группами, выбираемыми из алкоксильных радикалов с 1-5 атомами углерода и радикалов -COOR6, в которых Ph и R6 имеют указанное в п.1 значение;
R2 обозначает алкоксильный радикал с 1-5 атомами углерода или радикал -COOR6, в котором R6 имеет указанное в п.1 значение; и
R3 обозначает аминорадикал;
в форме основания или соли, а также в форме гидрата или сольвата.
7. Способ получения соединений формулы (I), описанной в любом из предыдущих пунктов, отличающийся тем, что
конденсируют соединение формулы (II)
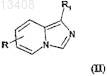
в которой R имеет значение, указанное для соединения формулы (I) по п.1, но R отличается от радикала, способного взаимодействовать с соединением формулы (III), такого как гидроксильный радикал, карбоксильный радикал или радикал -NR4R5, и R отличается от радикала -NH-CO2-Alk или от радикала
-CONR4R5, причем R1обозначает преимущественно атом водорода,
с соединением формулы (III)
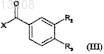
в которой X обозначает атом галогена, a R2 и R3независимо друг от друга обозначают алкоксильный радикал с 1-5 атомами углерода, нитрорадикал или радикал -COOR6, где R6 обозначает алкильный радикал с 1-5 атомами углерода, с получением:
соединений формулы (Ia), которые являются соединениями формулы (I), где R2 или R3 обозначают нитрорадикал, или
соединений формулы (Ib), которые являются соединениями формулы (I), где R2 или R3 обозначает радикал
-COOR6, где R6обозначает алкильный радикал с 1-5 атомами углерода,
затем:
а) соединения формулы (Ia) подвергают реакции восстановления для получения соединений формулы (Id)
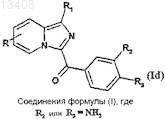
в которой R и R1 имеют значения, указанные для соединения формулы (Ia), a R2 или R3обозначает аминорадикал;
соединения формулы (Id) могут быть затем подвергнуты реакции алкилирования, ацилирования или сульфирования для получения соединений формулы (Ig)
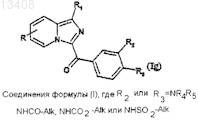
в которой R и R1 имеют значения, указанные для соединения формулы (Id), a R2 или R3обозначают радикал -NR4R5, радикал -NHCOAlk, радикал -NHCO2Alk или радикал -NHSO2Alk; или
б) соединения формулы (Ib) подвергают реакции омыления для получения соединений формулы (Ie)
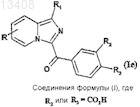
в которой R и R1 имеют значения, указанные для соединения формулы (Ib), а R2 или R3обозначает карбоксильный радикал,
затем соединения формулы (Ie) могут быть подвержены реакции сочетания после активирования карбоксильной группы, в присутствии основания, а затем добавления амина формулы HNR4R5или гидроксиламина с получением соединений формулы (Ih)
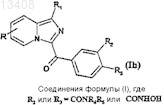
в которой R и R1 имеют значения, указанные для соединений формулы (Ie), a R2 или R3обозначает
-CONR4R5 или -CONHOH.
8. Способ получения соединений формулы (I), описанной в любом из предыдущих пунктов, отличающийся тем, что
соединение формулы (II), описанное в п.7, конденсируют с соединением формулы (III')
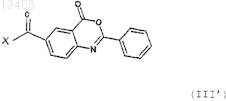
в которой X обозначает атом галогена,
для получения соединений формулы (Ic)
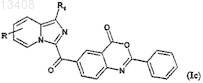
в которой R и R1 имеют значения, указанные для соединения формулы (II),
причем указанные соединения формулы (Ic) подвергают затем реакции алкоголиза с получением соединений формулы (If)
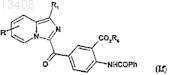
в которой R и R1 имеют значения, указанные для соединения формулы (II), a R6 имеет значение, указанное для соединения формулы (I),
затем соединения (If) могут быть подвергнуты омылению для получения соединений формул (Id) или (Ie), в которых R и R1имеют значения, указанные для соединения формулы (II), a R2обозначает радикал -COOH и R3 обозначает радикал -NH2.
9. Способ получения соединений формулы (I), описанной в любом из предыдущих пунктов, отличающийся тем, что
соединение формулы (I), в которой R1 обозначает атом водорода, полученное в п.7, подвергают реакции бромирования с целью получения соединений формулы (Ii)
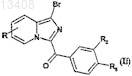
в которой R, R2 и R3имеют значения, указанные для соединения формулы (I) по п.1, если R2и R3 не образуют вместе гетероарил, и R1 обозначает атом брома,
соединения формулы (Ii), в которых R не является атомом брома или атомом йода, можно затем подвергнуть в присутствии палладиевого катализатора, лиганда и основания:
а) либо реакции иминирования с бензофенонимином с последующим кислым гидролизом для получения соединений формулы (Ij)

в которой R имеет значения, указанные для соединений формулы (Ii), R2и R3 имеют значения, указанные для соединений формулы (Ii), и R1 обозначает радикал -NH2,
b) либо реакции цианирования при помощи цианида цинка для получения соединений формулы (Ik)
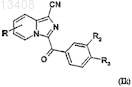
в которой R, R2 и R3имеют значения, указанные для соединений формулы (Ii), и R1обозначает радикал -CN,
а затем соединения формулы (Ik) можно подвергнуть щелочному гидролизу для получения соединений формулы (Im)
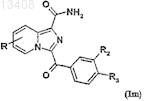
в которой R, R2 и R3имеют значения, указанные для соединений формулы (Ik), и R1обозначает радикал
-CONH2,
или же соединения формулы (Ik) подвергают реакции Pinner с первичным спиртом в присутствии хлористо-водородного газа для получения соответствующего имидоэфира, который после кислого гидролиза приводит к образованию соединений формулы (In)
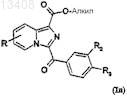
в которой R, R2 и R3имеют значения, указанные для соединений формулы (Ik), и R1обозначает радикал
-CO2Alk, где Alk имеет значения, указанные в п.1;
причем соединения формулы (In) сами могут быть подвергнуты реакции омыления с получением соединений формулы (Io)

в которой R, R2 и R3имеют значения, указанные для соединений формулы (Ik), и R1обозначает радикал
-CO2H;
с) либо реакции Сузуки при помощи фенилбороновых или гетероарилбороновых производных для получения соединений формулы (Is)
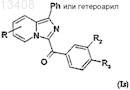
в которой R, R2 и R3имеют значения, указанные для соединений формулы (Ii), a R1представляет собой замещенный фенил или в случае необходимости замещенный гетероарил с 5 или 6 звеньями.
10. Способ получения соединений формулы (I), описанной в любом из предыдущих пунктов, отличающийся тем, что
соединения формулы (Ij), в которой R1 обозначает аминорадикал, подвергают реакции ацилирования или сульфирования для получения соединений формулы (Ip)

в которой R, R2 и R3имеют значения, указанные для соединений формулы (Ij), a R1представляет собой радикал -NHCOAlk, -NHCO2Alk, -NHSO2Alk, -NHCOPh или -NHCOCF3, в которых Alk и Ph имеют значения, указанные для соединения формулы (I) по п.1;
причем соединения формулы (Ip), в которой R1 обозначает радикал -NHCOCF3, сами можно подвергнуть реакции алкилирования с последующим снятием защиты и затем в случае необходимости подвергнуть второй реакции алкилирования для получения соединений формулы (Iq)
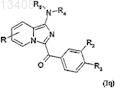
в которой R, R2 и R3имеют значения, указанные для соединения формулы (Ij), a R4и R5 имеют значения, указанные для соединения формулы (I).
11. Способ получения соединений формулы (I), описанной в любом из предыдущих пунктов, отличающийся тем, что
соединения формулы (Ir), в которых R обозначает радикал -CO2R6, где R6является радикалом Alk, полученные в п.7, подвергают кислому или щелочному гидролизу с получением соединений формулы (It)
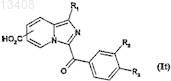
в которой R1, R2и R3 имеют значения, указанные для соединений формулы (Ir), a R обозначает радикал
-COOH;
соединения формулы (It) можно в дальнейшем подвергнуть:
а) либо реакции сочетания после активации карбоксильной группы в присутствии основания, а затем добавления амина формулы HNR4R5 или H2N-CH(R7)-(CH2)m-COOR6, где R6 обозначает радикал Alk, имеющий значения, указанные в п.1, для получения соединений формулы (Iu)
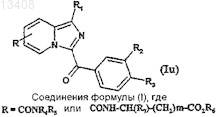
в которой R1, R2и R3 имеют значения, указанные для соединений формулы (It),
и если R обозначает радикал -CONH-CH(R7)-(CH2)m-COOR6, где R6 обозначает радикал Alk, имеющий значения, указанные в п.1, то эти соединения можно омылить для получения соединений формулы (Iu), где R обозначает радикал -CONH-CH(R7)-(CH2)m-COOR6, где R6обозначает атом водорода, a R1, R2 и R3имеют значения, указанные выше;
b) либо перегруппировке Куртиуса обработкой дифенилфосфорилазида в присутствии триэтиламина при кипячении с обратным холодильником в инертном растворителе, а затем добавлением спирта формулы Alk-OH для получения соединений формулы (Iv)
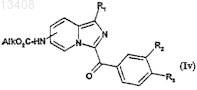
в которой R1, R2и R3 имеют значения, указанные для соединений формулы (It), a R обозначает радикал
-NHCO2Alk;
соединения формулы (Iv), в которой R обозначает радикал -NHCO2-Alk, где Alk обозначает радикал -tBu, могут затем привести к соединениям формулы (Iw), в которой R1, R2, R3, R4, R5 имеют значения, указанные для соединения формулы (I) по п.1
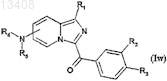
путем удаления защитных групп в кислой среде с получением соединений формулы (Iw), где R обозначает радикал -NH2,
путем алкилирования с последующим удалением защитных групп и необязательным вторым алкилированием для получения соединений формулы (Iw), где R обозначает радикал -NR4R5;
соединения формулы (Iw), где R обозначает радикал -NH2, можно затем подвергнуть либо ацилированию, либо сульфированию для получения соединений формулы (Ix)
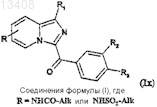
в которой R1, R2и R3 имеют значения, указанные для соединений формулы (Iw), a R обозначает радикал
-NHCOAlk или -NHSO2Alk.
12. Способ получения соединений формулы (I), описанной в любом из предыдущих пунктов, отличающийся тем, что
соединения формулы (Iy)
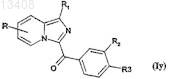
в которой R обозначает радикал -О-бензил, a R1, R2и R3 имеют значения, указанные для соединений формулы (I) по п.1,
подвергают реакции дебензилирования в протонном растворителе в присутствии палладия на угле для получения соединений формулы (Iz)
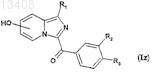
в которой R1, R2и R3 имеют значения, указанные для соединений формулы (Iy), a R обозначает гидроксильный радикал,
и если R2или R3 обозначает нитрорадикал, то получают соединения формулы (Id), в которой R2 или R3 обозначает NH2и R1 имеет значения, указанные для соединений формулы (I);
соединения формулы (Iz) можно затем подвергнуть реакции селективного О-алкилирования, воздействуя при комнатной температуре алкилгалогенидом в полярном растворителе в присутствии карбоната щелочного металла, с получением соединений формулы (Iz')

в которой R1, R2и R3 имеют значения, указанные для соединений формулы (Iz),
и если R обозначает радикал -O-Alk-COOR6, где R6 является радикалом Alk, имеющим значения, указанные для соединений формулы (I), то эти соединения можно подвергнуть омылению для получения соединений формулы (Iz'), в которой R обозначает радикал -O-Alk-COOR6, где R6 является атомом водорода, a R1, R2и R3 имеют значения, указанные выше.
13. Фармацевтическая композиция, отличающаяся тем, что она содержит соединение формулы (I) по любому из пп.1-6 или фармацевтически приемлемую соль, гидрат или сольват этого соединения, а также по меньшей мере один фармацевтически приемлемый эсципиент.
14. Применение соединения формулы (I) по любому из пп.1-6 для получения лекарственного средства, предназначенного для лечения заболеваний, при которых требуется модуляция рецепторов FGF.
15. Применение по п.14 для получения лекарственного средства, предназначенного для лечения злокачественных опухолей, в частности карцином, имеющих высокую степень васкуляризации, таких как карцинома легких, молочной железы, предстательной железы и пищевода, рака, индуцирующего метастазирование, такого как рак прямой кишки и рак желудка, меланом, глиом, лимфом и лейкемии.
16. Применение по п.15, отличающееся тем, что соединение формулы (I) ассоциировано с одним или несколькими противораковыми активными началами и/или с рентгенотерапией.
17. Применение по п.14 для получения лекарственного средства, предназначенного для лечения сердечно-сосудистых заболеваний, таких как атеросклероз, постангиопластический рестеноз, болезней, связанных с осложнениями после установки эндоваскулярных протезов и/или аортокоронарного шунтирования или других сосудистых трансплантатов, гипертрофии миокарда или сосудистых осложнений при диабете, таких как диабетическая ретинопатия.
18. Применение по п.14 для получения лекарственного средства, предназначенного для лечения хронических воспалительных заболеваний, таких как ревматоидный артрит или IBD.
19. Применение по п.14 для получения лекарственного средства, предназначенного для лечения остеоартроза, ахондроплазий (ACH), гипохондроплазий (HCH) и TD (танатофорическая дисплазия).
20. Применение по п.14 для получения лекарственного средства, предназначенного для лечения ожирения.
21. Применение по п.14 для получения лекарственного средства, предназначенного для лечения мышечной дегенерации, такой как мышечная дегенерация, связанная с возрастом (DMLA).
Текст
013408 Объектом настоящего изобретения являются новые производные имидазо[1,5-а]пиридинов, являющиеся ингибиторами FGF (Fibroblast Growth Factor), способ их получения и содержащие их фармацевтические композиции.FGF относятся к семейству полипептидов, синтезирующихся большим количеством клеток в процессе эмбрионального развития и клетками взрослых тканей в различных патологических условиях. Известны некоторые производные нафтиридиндиаминов и соответствующих карбамидов, которые являются селективными ингибиторами FGF-1 (Batley В. et al., Life Sciences (1998), vol. 62,2, p. 143150; Thompson A. et al., J. Med. Chem. (2000), vol. 43, p. 4200-4211). Производные индолизина, являющиеся антагонистами связывания FGF с их рецепторами, описаны в международных заявках на патент WO 03/084956 и WO 2005/028476. В настоящее время было обнаружено, что соединения, являющиеся производными имидазо[1,5 а]пиридинов, демонстрируют сильную антагонистическую активность в отношении связывания FGF с их рецепторами, а также очень хорошую активность в тесте in vivo. Так, тесты на моделях in vivo неожиданно показали, что уже при дозе 10 мг/кг можно достичь максимальной активности соединений. Такой эффект достигался раньше только при дозе 50 кг/кг с соединениями индолизинового ряда, как это описано в международных заявках на патент WO 03/084956 и WO 2005/028476. Таким образом, настоящее изобретение относится к новым производным имидазо[1,5-а]пиридинов формулы (I) в которых Alk обозначает алкильный или алкиленовый радикал с 1-5 атомами углерода,n обозначает целое число от 1 до 5,m обозначает целое число от 0 до 4,R4 и R5 независимо друг от друга обозначают атом водорода, алкильный радикал с 1-5 атомами водорода или бензильный радикал;R6 обозначает атом водорода или алкильный радикал с 1-5 атомами углерода,R7 обозначает атом водорода, алкильный радикал с 1-5 атомами углерода или радикал формулPh обозначает фенильный радикал, в случае необходимости замещенный одной или несколькими группами, выбранными из атомов галогена, алкоксильных радикалов с 1-5 атомами углерода и радикалов фенильный радикал, в случае необходимости замещенный одной или несколькими группами, выби-1 013408 раемыми из атомов галогена, алкильных радикалов с 1-5 атомами углерода, алкоксильных радикалов с 15 атомами углерода и радикалов -COOR6,гетероарильный радикал с 5 звеньями, содержащий гетероатом, выбираемый из атома серы, атома кислорода или атома азота, и в случае необходимости содержащий второй атом азота, причем указанный гетероарил в случае необходимости замещен одной или несколькими группами, выбираемыми из атомов галогена, алкильных радикалов с 1-5 атомами углерода, алкоксильных радикалов с 1-5 атомами углерода и радикалов -COOR6, или гетероарильный радикал с 6 звеньями, содержащий 1 или 2 атома азота и в случае необходимости замещенный одной или несколькими группами, выбираемыми из атомов галогена, алкильных радикалов с 1-5 атомами углерода, алкоксильных радикалов с 1-5 атомами углерода и радикалов -COOR6,в которых Alk, Ph, R4, R5 и R6 имеют указанное выше значение;R2 и R3 независимо друг от друга обозначают гидроксильный радикал, алкоксильный радикал с 1-5 атомами углерода, аминорадикал, радикал -COOR6, нитрогруппу или радикал формул в которых Alk, Ph, R4, R5 и R6 имеют указанное выше значение; илиR2 и R3 вместе с атомами углерода фенильного кольца, с которым они соединены, образуют 6-членный углеродный цикл, содержащий атом азота и второй гетероатом, такой как кислород. Соединения формулы (I) могут существовать в форме оснований или солей, образованных кислотами или основаниями, в частности фармацевтически приемлемыми кислотами или основаниями. Эти аддитивные соли составляют часть изобретения. Соединения согласно изобретению могут также находиться в форме гидратов или сольватов, в частности в форме ассоциаций или комбинаций с одной или несколькими молекулами воды или с растворителем. Такие гидраты и сольваты также составляют часть изобретения. В рамках настоящего изобретения подразумевают следующее: под алкильным радикалом: насыщенный линейный или разветвленный алифатический радикал, который может содержать 1-5 атомов углерода. В качестве примера можно назвать метильный, этильный,н-пропильный, изопропильный, н-6 утильный, изобутильный, трет-бутильный, 2,2-диметилпропильный радикалы; под алкиленовым радикалом: алкильный радикал, описанный выше, насыщенный линейный или разветвленный, который является двухвалентным радикалом. В качестве примера можно назвать метиленовый, этиленовый и пропиленовый радикалы; под алкоксильным радикалом: радикал О-алкил, где алкильной группой является радикал, описанный выше и содержащий 1-5 атомов углерода. В качестве примера можно назвать метоксильный, этоксильный и пропоксильный радикалы; под атомом галогена: фтор, хлор, кислород или йод; под гетероатомом: атом азота, кислорода или серы; под 5-членным гетероарильным радикалом: ароматический циклический радикал, содержащий 5 звеньев и содержащий гетероатом, такой как описан выше, и в случае необходимости второй гетероатом,которым является атом азота, причем указанный ароматический радикал в случае необходимости замещен. В качестве примера можно назвать тиенильный, фурильный и пирролильный радикалы; и под 6-членным гетероарильным радикалом: ароматический циклический радикал, содержащий 6 звеньев и содержащий 1 или 2 атома азота, в случае необходимости замещенный. В качестве примера можно назвать пиридинильный радикал. Из соединений согласно изобретению можно выделить вторую группу соединений формулы (I), в которой в которых Alk, Ph, R4, R5, R6, R7 и m имеют указанное выше значение; Фенил, в случае необходимости замещенный одной или двумя группами, выбираемыми из атомов галогена, алкоксильных радикалов с 1-5 атомами углерода и радикалов -COOR6,гетероарильный радикал с 5 звеньями, содержащий гетероатом, выбираемый из атома серы, атома кислорода или атома азота, и содержащий в случае необходимости второй атом азота,причем указанный гетероарил в случае необходимости замещен одной или двумя группами, выбираемыми из атомов галогена, алкильных радикалов с 1-5 атомами углерода, алкоксильных радикалов с 15 атомами углерода и радикалов -COOR6, или гетероарильный радикал с 6 звеньями, содержащий 1 или 2 атома азота и в случае необходимости замещенный одной или двумя группами, выбираемыми из атомов галогена, алкильных радикалов с 1-5 атомами углерода, алкоксильных радикалов с 1-5 атомами углерода и радикалов -COOR6,где Alk, Ph и R6 имеют значения, указанные выше;R2 и R3 независимо друг от друга обозначают алкоксильный радикал с 1-5 атомами углерода, радикал -COOR6, аминогруппу, нитрогруппу или радикал формул в которых Alk, Ph, R4, R5 и R6 имеют указанное выше значение. Из указанной второй группы соединений согласно изобретению можно, в частности, назвать соединения, в которых R7 обозначает атом водорода, алкильный радикал с 1-5 атомами углерода или радикал формулы -Alk-OR6 или -CH2-Ph. Из указанной второй группы соединений согласно изобретению можно также назвать соединения, в которых m=0 или 1. Из соединений согласно изобретению можно выделить третью группу соединений формулы (I), в которойR7 обозначает атом водорода, алкильный радикал с 1-5 атомами углерода или радикал формулы-3 013408 фенил, в случае необходимости замещенный одной или двумя группами, выбираемыми из атомов галогена, алкоксильных радикалов с 1-5 атомами углерода и радикалов -COOR6,гетероарильный радикал, выбираемый из тиенила, фурила и пирролила, причем указанный гетероарил в случае необходимости замещен одной или двумя группами, выбираемыми из алкоксильных радикалов с 1-5 атомами углерода и радикалов -COOR6, или пиридинил, в случае необходимости замещенный одной или двумя группами, выбираемыми из алкоксильных радикалов с 1-5 атомами углерода и радикалов -COOR6,где Alk, Ph и R6 имеют значения, указанные выше;R2 и R3 независимо друг от друга обозначают алкоксильный радикал с 1-5 атомами углерода, радикал -COOR6, аминогруппу, нитрогруппу или радикал формулы -NH-CO-Alk, -NH-CO-Ph, -NH-SO2Alk; где Alk, Ph и R6 имеют значения, указанные выше. Из совокупности соединений формулы (I) согласно изобретению, описанных выше, можно назвать,в частности, соединения, в которых R2 обозначает алкоксильный радикал с 1-5 атомами углерода или радикал -COOR6, в котором R6 имеет указанное выше значение. Из совокупности соединений формулы (I) согласно изобретению, описанных выше, можно назвать,в частности, соединения, в которых R3 обозначает нитрорадикал, аминорадикал или радикал формул-NH-CO-Alk, -NH-CO-Ph или -NH-SO2Alk, в которых Alk, Ph R6 имеют указанное выше значение. Преимущественно R3 обозначает аминорадикал. Из соединений согласно изобретению можно выделить четвертую группу соединений формулы (I),в которой в которых R7 обозначает атом водорода, алкильный радикал с 1-5 атомами углерода или радикал формулы -Alk-OR6 , a Alk, R4, R5 и R6 имеют значения, указанные выше;R1 обозначает атом водорода, атом галогена, радикал -COOR6 или радикал формулы фенил, в случае необходимости замещенный одной или двумя группами, выбираемыми из атомов галогена, алкоксильных радикалов с 1-5 атомами углерода и радикалов -COOR6, или тиенильный радикал, в случае необходимости замещенный одной или двумя группами, выбираемыми из алкоксильных радикалов с 1-5 атомами углерода и радикалов -COOR6,в которых Ph и R6 имеют указанное выше значение;R2 обозначает алкоксильный радикал с 1-5 атомами углерода или радикал -COOR6, в котором R6 имеет указанное выше значение; иR3 обозначает аминорадикал. Из соединений согласно изобретению можно назвать, в частности, следующие соединения: 2-амино-5-(имидазо[1,5-а]пиридин-3-ил)карбонилбензойная кислота; 2-амино-5-[1-(4-метоксифенил)имидазо[1,5-а]пиридин-3-ил]карбонилбензойная кислота; 2-амино-5-[1-(3-метоксифенил)имидазо[1,5-а]пиридин-3-ил]карбонилбензойная кислота;N-[3-(4-амино-3-метоксибензоил)имидазо[1,5-а]пиридин-6-ил]карбонил-L-серин. В дальнейшем описании соединения формулы (I), в зависимости от значений R, R1, R2 и R3, обозначаются как (Ia), (Ib), (Ic), (Id), (Ie), (If), (Ig), (Ih), (Ii), (Ij), (Ik), (Im), (In), (Io), (Ip), (Iq), (Ir), (Is), (It), (Iu),(Iv), (Iw), (Ix), (Iy), (Iz) и (Iz').-4 013408 Настоящее изобретение относится также к способу получения соединений формулы (I, отличающемуся тем, что: А) конденсируют соединение формулы (II) в которой R имеет значение, указанное для соединения формулы (I), но R отличается от радикала,способного взаимодействовать с соединением формулы (III), такого как гидроксильный радикал, карбоксильный радикал или радикал -NR4R5, и R отличается от радикала -NH-CO2R6 или от радикала-CONR4R5, причем R1 обозначает преимущественно атом водорода,с соединением формулы (III) в которой X обозначает атом галогена, a R2 и R3 независимо друг от друга обозначают алкоксильный радикал с 1-5 атомами углерода, нитрорадикал, радикал -COOR6, где R6 обозначает алкильный радикал с 1-5 атомами углерода,с получением соединений формулы (Ia), которые являются соединениями формулы (I), в которой R2 или R3 обозначают нитрорадикал, или соединений формулы (Ib), которые являются соединениями формулы (I), в которой R2 или R3 обозначает радикал -COOR6, где R6 обозначает алкильный радикал с 1-5 атомами углерода,затем а) соединения формулы (Ia) подвергают реакции восстановления для получения соединений формулы (Id) в которой R и R1 имеют значения, указанные для соединения формулы (Ia), a R2 или R3 обозначает аминорадикал; соединения формулы (Id) могут быть затем подвергнуты реакции алкилирования, ацилирования или сульфирования для получения соединений формулы (Ig) в которой R и R1 имеют значения, указанные для соединения формулы (Id), a R2 или R3 обозначают радикал -NR4R5, радикал -NHCOAlk, радикал -NHCO2Alk или радикал -NHSO2Alk; или б) соединения формулы (Ib) подвергают реакции омыления для получения соединении формулы (Ie) в которой R и R1 имеют значения, указанные для соединения формулы (Ib), a R2 или R3 обозначает карбоксильный радикал,-5 013408 затем соединения формулы (Ie) могут быть подвержены реакции сочетания после активирования карбоксильной группы, например, при помощи реактива ВОР [гексафторфосфат бензотриазол-1-илокситрис-(диметиламино)фосфония] в присутствии основания, такого как триэтиламин, в соответствии с методикой, описанной в Tetrahedron Letters; (1975), 14, 1219-1222, а затем добавления амина формулыHNR4R5 или гидроксиламина с получением соединений формулы (Ih) в которой R и R1 имеют значения, указанные для соединения формулы (Ie), a R2 или R3 обозначает в которой X обозначает атом галогена и R2' и R3' вместе с атомами углерода фенильного цикла, с которым они связаны, образуют углеродный цикл с 6 звеньями, содержащий атом азота и другой гетероатом, такой как кислород,для получения соединений формулы (Ic) в которой R и R1 имеют значения, указанные для соединения формулы (II),причем указанные соединения формулы (Ic) подвергают затем реакции алкоголиза с получением соединений формулы (If) в которой R и R1 имеют значения, указанные для соединения формулы (II), a R6 имеет значение,указанное для соединения формулы (I),затем соединения If могут быть подвергнуты омылению для получения соединений формул (Id) или(Ie), в которых R и R1 имеют значения, указанные для соединения формулы (II), a R2 обозначает радикал-COOH и R3 обозначает радикал -NH2; или С) соединение формулы (I), в котором R1 обозначает атом водорода, в том виде, как оно получено выше в п.А), подвергают реакции бромирования с целью получения соединений формулы (Ii) в которой R, R2 и R3 имеют значения, указанные для соединения формулы (I) (если R2 и R3 не образуют вместе гетероарил) и R1 обозначает атом брома,соединения формулы (Ii), в которых R не является атомом брома или атомом йода, можно затем подвергнуть в присутствии палладиевого катализатора, лиганда и основания: а) либо реакции иминирования с бензофенонимином в условиях реакции, описанной в Tetrehedron.;(2003), 59 (22), 3925-3936, с последующим кислым гидролизом для получения соединений формулы (Ij) в которой R имеет значения, указанные для соединения формулы (Ii), R2 и R3 имеют значения, указанные для соединения формулы (Ii), и R1 обозначает радикал -NH2,b) либо реакции цианирования при помощи цианида цинка в условиях реакции, описанной в J. Med.Chem.; (2003), 46, 265-283, для получения соединений формулы (Ik) в которой R, R2 и R3 имеют значения, указанные для соединений формулы (Ii), и R1 обозначает радикал -CN,соединения формулы (Ik) можно затем подвергнуть щелочному гидролизу для получения соединений формулы (Im) в которой R, R2 и R3 имеют значения, указанные для соединений формулы (Ik), и R1 обозначает радикал -CONH2, или соединения формулы (Ik) подвергают реакции Pinner [The Chemistry of Amidines and Imidates; Patai,S., Ed.; J.Wiley and Sons: New York (1975); 385-489] с первичным спиртом, таким как метанол или этанол,в присутствии хлористо-водородного газа для получения соответствующего имидоэфира, который после кислого гидролиза приводит к образованию соединений формулы (In) в которой R, R2 и R3 имеют значения, указанные для соединений формулы (Ik), и R1 обозначает радикал -CO2Alk; причем соединения формулы (In) сами могут быть подвергнуты реакции омыления с получением соединений формулы (Io) в которой R, R2 и R3 имеют значения, указанные для соединений формулы (Ik), и R1 обозначает радикал -CO2H; с) либо реакции Сузуки в условиях, описанных в Synth. Commun.; (1981), vol. 11, р. 513, при помощи фенилбороновых или гетероарилбороновых производных для получения соединений формулы (Is) в которой R, R2 и R3 имеют значения, указанные для соединения формулы (Ii), a R1 представляет собой замещенный фенил или в случае необходимости замещенный гетероарил с 5 или 6 звеньями; илиD) соединения формулы (Ij), в которой R1 обозначает аминорадикал, подвергают реакции ацилирования или сульфирования для получения соединений формулы (Ip) в которой R, R2 и R3 имеют значения, указанные для соединений формулы (Ij), a R1 представляет собой радикал -NHCOAlk, -NHCO2Alk, -NHSO2Alk, -NHCOPh или -NHCOCF3, в которых Alk и Ph имеют значения, указанные для соединения формулы (I); причем соединения формулы (Ip), в которой R1 обозначает радикал -NHCOCF3, сами можно подвергнуть реакции алкилирования с последующим снятием защиты и затем в случае необходимости подвергнуть второй реакции алкилирования для получения соединений формулы (Iq) в которой R, R2 и R3 имеют значения, указанные для соединений формулы (Ij), a R4 и R5 имеют значения, указанные для соединения формулы (I); или Е) соединения формулы (Ir), в которой R обозначает радикал -CO2R6, где R6 является радикаломAlk, полученные выше в п.А) (а именно: путем ацилирования соединений формулы (II), где R=-COOAlk,соединениями формулы (III, подвергают кислому или щелочному гидролизу с получением соединений формулы (It) в которой R1, R2 и R3 имеют значения, указанные для соединений формулы (Ir), a R обозначает радикал -COOH; соединения формулы (It) можно в дальнейшем подвергнуть: а) либо реакции сочетания после активации карбоксильной группы, например, при помощи реактива ВОР [гексафторфосфат бензотриазол-1-илокси-трис-(диметиламино)фосфония] в присутствии основания, такого как триэтиламин, в соответствии с методикой, описанной в Tetrahedron Letters; (1975), 14,1219-1222, а затем добавления амина формулы HNR4R5 или H2N-CH(R7)-(CH2)m-COOR6, где R6 обозначает радикал Alk, для получения соединений формулы (Iu) в которой R1, R2 и R3 имеют значения, указанные для соединений формулы (It),и если R обозначает радикал -CONH-CH(R7)-(CH2)m-COOR6, где R6 обозначает радикал Alk, имеющий значения, описанные для соединений формулы (I), то эти соединения можно подвергнуть омылениию для получения соединений формулы (Iu), где R обозначает радикал -CONH-CH(R7)-(CH2)m-COOR6, R6 обозначает атом водорода, a R1, R2 и R3 имеют значения, указанные выше;b) либо подвергают перегруппировке Куртиуса согласно методике, описанной в Synthesis (1990),295-299, обработкой дифенилфосфорилазида в присутствии триэтиламина при кипячении с обратным холодильником в инертном растворителе, таком как толуол, а затем добавлением спирта формулыAlk-OH для получения соединений формулы (Iv) в которой R1, R2 и R3 имеют значения, указанные для соединений формулы (It), a R обозначает радикал -NHCO2Alk,соединения формулы (Iv), в которой R обозначает радикал -NHCO2-Alk, где Alk обозначает радикал-tBu, могут привести к соединениям формулы (Iw), в которой R1, R2, R3, R4, R5 имеют значения, указанные для соединения формулы (I) путем удаления защитных групп в кислой среде с получением соединений формулы (Iw), где R обозначает радикал -NH2,путем алкилирования с последующим удалением защитных групп и необязательным вторым алкилированием для получения соединений формулы (Iw), где R обозначает радикал -NR4R5,соединения формулы (Iw), где R обозначает радикал -NH2, можно затем подвергнуть либо ацилированию, либо сульфированию для получения соединений формулы (Ix): в которой R1, R2 и R3 имеют значения, указанные для соединений формулы (w I), a R обозначает радикал -NHCOAlk или -NHSO2Alk; или в которой R обозначает радикал -О-бензил, a R1, R2 и R3 имеют значения, указанные для соединений формулы (I),-9 013408 подвергают реакции дебензилирования, например взаимодействием с гидразингидратом в протонном растворителе, таком как метанол, в присутствии палладия на угле для получения соединений формулы (Iz) в которой R1, R2 и R3 имеют значения, указанные для соединений формулы (Iy), a R обозначает гидроксильный радикал, если R2 или R3 обозначает нитрорадикал, то получают соединения формулы (Id), в которой R2 или R3 обозначают NH2, и R1 имеет значения, указанные для соединений формулы (I),соединения формулы (Iz) можно затем подвергнуть реакции селективного О-алкилирования, воздействуя при комнатной температуре алкилгалогенидом в полярном растворителе, таком как диметилформамид, в присутствии карбоната щелочного металла с получением соединений формулы (Iz') в которой R1, R2 и R3 имеют значения, указанные для соединений формулы (Iz),и если R обозначает радикал -O-Alk-COOR6, где R6 является радикалом Alk, имеющим значения,указанные для соединений формулы (I), то эти соединения можно подвергнуть омылению для получения соединений формулы (Iz'), в которой R обозначает радикал -O-Alk-COOR6, где R6 является атомом водорода, a R1, R2 и R3 имеют значения, указанные выше. Специалист сможет использовать различные реакции, описанные выше и иллюстрированные на схемах 1-6, для получения соединений формулы (I) с различными реакционноспособными группами,находящимися на молекуле. На схемах 1-6 исходные соединения и реагенты, получение которых не описано, являются доступными в продаже, или они описаны в литературе, или же их можно получить в соответствии со способами, которые описаны в литературе или известны специалисту. Различные варианты А, В, С, D, Е или F, описанные выше, иллюстрированы соответственно на схемах 1-6, представленных ниже. Соединения формулы (II), в частности, когда R1=H, получают способами, описанными в литературе, из соответственно замещенных 2-аминометилпиридинов, следуя следующей реакционной схеме, описанной в J. Chem. Soc.; (1955), 2834-2836 Можно сослаться также на три заявки на патент, описывающие синтез имидазо[1,5-а]пиридинов:WO 03/070732, WO 04/064836 и WO 04/046133. Соединения формулы (III), в которой R2 и R3, одинаковые или различные, имеют такие же значения,указанные для соединений формулы (Ia) или (Ib), и X обозначает атом хлора, получают путем взаимодействия тионилхлорида с соответствующими бензойными кислотами и являются продуктами, доступными в продаже, или же они описаны в литературе. Соединения формулы (III'), в которой R'2 и R'3 вместе с атомами углерода фенильного цикла, с которым они связаны, образуют углеродный цикл из 6 звеньев, содержащий атом азота и другой гетероатом, такой как кислород, и X обозначает атом хлора, можно получить воздействием тионилхлорида на соответствующие кислоты, описанные в литературе. Можно назвать, например, 4-оксо-2-фенил-4 Н-3,1 бензоксазин-6-карбоновую кислоту, получаемую по способу, описанному в патенте ФранцииFR 2333511, которая после обработки тионилхлоридом приводит к образованию соответствующего хлорангидрида кислоты, который используют для ацилирования соединений формулы (II) с образованием соединений формулы (Ic). Соединения формулы (I) согласно изобретению являются мощными антагонистами FGF-1 и -2. Их способность одновременно ингибировать образование новых сосудов из дифференцированных эндотелиальных клеток и блокировать дифференцировку клеток костного мозга взрослого человека в CD34+CD133+ эндотелиальных клетках была доказана в тесте in vitro. Кроме того, способность ингибировать патологический ангиогенез была доказана in vivo. При этом было доказано, что соединения формулы (I) являются сильными антагонистами рецептора FGF-1. В целом, рецепторы FGF задействованы в значительной мере посредством аутокринной, паракринной или юкстакринной секреций при явлениях сбоя стимуляции роста раковых клеток. Кроме того, рецепторы FGF оказывают влияние на опухолевый ангиогенез, который играет решающую роль одновременно в росте опухоли, а также в явлениях метастазирования. Ангиогенез является процессом образования новых капиллярных сосудов на основе ранее существовавших сосудов или же путем мобилизации и дифференцировки клеток костного мозга. Таким образом, неконтролируемая пролиферация эндотелиальных клеток и одновременно протекающая мобилизация ангиобластов костного мозга наблюдаются при явлениях неоваскуляризации опухолей. В тестах invitro и in vivo было показано, что несколько факторов роста стимулируют эндотелиальную пролиферацию, в частности рецептор FGF-1 или a-FGF и рецептор FGF-2 или b-FGF. Эти два фактора участвуют в пролиферации, миграции и продуцировании протеаз культуральными эндотелиальными клетками и в неоваскулярицации in vivo. Рецепторы a-FGF и b-FGF взаимодействуют с эндотелиальными клетками посредством двух классов рецепторов: рецепторов с высоким сродством с активностью тиразинкиназы(FGF) и низкоафинных рецепторов типа гепарансульфата протеогликана (HSPG), находящихся на поверхности клеток и во внеклеточных матриксах. Поскольку паракринная роль этих двух факторов в отношении эндотелиальных клеток широко описана, то a-FGF и b-FGF, вероятно, могут воздействовать на эти клетки также и посредством аутокринного механизма. Таким образом, a-FGF и b-FGF и их рецепторы являются очень подходящими объектами для выработки методов терапии с целью ингибирования процессов ангиогенеза (Keshet E., Ben-Sasson S.A., J. Clin. Invest (1999), vol. 501, p. 104-1497; Presta M.,Rusnati M., Dell'Era P., Tanghetti E., Urbinati C., Giuliani R. et al., New York: Plenum Publishers (2000),p. 8128-8139). Кроме того, систематические исследования, направленные на определение экспрессии, обусловленной a-FGF и b-FGF и их рецепторами (FGF), в различные типы опухолевых клеток, показывают, что клеточный ответ на эти два фактора зависит в большинстве случаев от исследуемых линий опухолевых клеток человека. Эти результаты подтверждают гипотезу о том, что антагонист в отношении a-FGF и b-FGF,очевидно, может ингибировать также пролиферацию опухолевых клеток (Chandler L.A., Sosnowski B.A.,Greenless L., Aukerman S.L., Baird A., Pierce G.F., Int. J. Cancer (1999), vol. 58, p. 81-451). Факторы a-FGF и b-FGF играют значительную роль в росте и сохранении клеток простаты. Было показано одновременно на моделях животного и на человеке, что изменение ответа клеток на эти факторы играет решающую роль в развитии рака простаты. Так, при этих патологиях отмечено одновременно увеличение продуцирования a-FGF и b-FGF фибропластами и эндотелиальными клетками, находящимися на уровне опухоли, и увеличение экспрессии рецепторов FGF в опухолевые клетки. Таким образом,происходит паракринная стимуляция раковых клеток простаты и это явление, по-видимому, составляет главную составляющую этой патологии. Соединение, обладающее антагонистической активностью в отношении рецепторов FGF, такое как соединение согласно настоящему изобретению, может представлять собой терапию выбора при лечении таких патологий. (Giri D., Ropiquet F., Clin. Cancer Res. (1999),vol. 71, p. 5-1063; Doll J.A., Reiher F.K., Crawford S.E., Pins M.R., Campbell S.C., Bouck N.P., Prostate(2001), vol. 305, p. 49-293). Многочисленные работы указывают на наличие одновременно а-FGF и b-FGF и их FGF-рецепторов в линиях клеток опухоли молочной железы человека (в частности, MCF7) и в биопсиях, взятых из опухолей. Эти факторы, по-видимому, ответственны в этих патологиях за появление фенотипа очень агрессивного и индуцирующего быстрое метастазирование. Таким образом, соединение, обладающее антагонистической активностью к рецепторам FGF, такое как соединение формулы (I), может представлять собой терапию выбора при лечении этих патологий (Vercoutter-Edouart A.-S., Czeszak X., Crepin M., Lemoine J.,Boilly В., Le Bourhis X. et al., Exp. Cell. res. (2001), vol. 262, p. 59-68). Злокачественные меланомы представляют собой опухоли, очень часто вызывающие метастазы и очень стойкие к различным видам химиотерапии. Процессы ангиогенеза играют решающую роль в росте злокачественной меланомы. Кроме того, было показано, что вероятность появления метастаз значительно повышается с увеличением васкуляризации первичной опухоли. Клетки меланом продуцируют и секретируют различные ангиогенные факторы, в том числе a-FGF и b-FGF. При этом оказалось, что ингибирование воздействия на клетки этими двумя факторами при помощи растворимого рецептора FGF-1 блокирует in vitro пролиферацию и продолжительность жизни опухолевых клеток меланомы и блокирует invivo рост опухоли. Таким образом, соединение, обладающее антагонистической активностью в отношении рецепторов FGF, такое как соединение согласно настоящему изобретению, может представлять собой терапию выбора при лечении таких патологий (Rofstad E.K., Halsor E.F., Cancer Res. (2000);Yayon A., Ma Y.-S., Safran M., Klagsbrun M., Halaban R., Oncogene (1997), vol. 14, p. 2999-3009). Клетки глиомы продуцируют in vitro и in vivo a-FGF и b-FGF и имеют на своей поверхности различные рецепторы FGF. Этот факт предполагает, что эти два фактора благодаря аутокринному и паракринному эффекту играют определяющую роль в росте этого типа опухоли. Более того, как и большин- 17013408 ство солидных опухолей, рост глиом и их способность индуцировать метастазирование значительно зависят от ангиогенных процессов, протекающих в первичной опухоли. Также было показано, что антисмысловые последовательности рецептора FGF-1 блокируют пролиферацию астроцитом человека. Более того, описаны производные нафталинсульфонатов для ингибирования клеточного воздействия со стороны a-FGF и b-FGF in vitro и ангиогенез, индуцированный этими факторами роста in vivo. Интрацеребральная инъекция этих соединений приводит к весьма значительному увеличению апоптоза и значительному уменьшению ангиогенеза, проявляющихся в значительной регрессии глиомы у крысы. Таким образом, соединение, обладающее антагонистической активностью в отношении a-FGF, и/или b-FGF, и/или рецепторов FGF, такое как соединение согласно настоящему изобретению, может представлять собой терапию выбора для лечения этих патологий (Yamada S.M., Yamaguchi F., Brown R., Berger M.S.,Morrison R.S., Glia (1999), vol. 76, p. 28-66; Auguste P., Gursel D.B., Lemiere S., Reimers D., Cuevas P.,Carceller F. et al., Cancer Res. (2001), vol. 26, p. 61-1717). В последних публикациях освещалась потенциальная роль проангиогенных агентов в лейкемиях и лимфомах. В целом было показано, что клеточные клоны в этих патологиях могут быть либо разрушены естественным путем иммунной системой, либо конвертированы в ангиогенный фенотип, который благоприятствует их выживаемости и затем их пролиферации. Это изменение фенотипа индуцировано экспрессированием ангиогенных факторов, в частности макрофагами и/или мобилизацией этих факторов из внеклеточного матрикса (Thomas D.A., Giles F.J., Albitar M., Kantarjian H.M., Acta Haematol (2001),vol. 207, p. 106-190). Из числа ангиогенных факторов обнаружен b-FGF в линиях клеток лимфобластических и гематопоэтических опухолей. В большинстве этих линий находились также и рецепторы FGF, что предполагает возможный аутокринный клеточный эффект a-FGF и b-FGF, вызывающий пролиферацию этих клеток. При этом сообщалось, что ангиогенез костного мозга под влиянием паракринных эффектов коррелирует с развитием некоторых из этих патологий. В частности, было показано на клетках CLL (устойчивые лейкемические миеломоноциты) (chroniclimphocytic leukemia), что фактор b-FGF увеличивает экспрессирование антиапоптического белка (Вс 12),что ведет к увеличению продолжительности жизни этих клеток и к их масштабному участию в распространении рака. Кроме того, доля b-FGF, определяемая в этих клетках, очень хорошо коррелирует со стадией клинического развития этого заболевания и с его устойчивостью к химиотерапевтическим средствам, применяемым при данной патологии (флударабин). Таким образом, соединение, обладающее антагонистической активностью в отношении рецепторов FGF, такое как соединение согласно настоящему изобретению, может представлять собой терапию выбора как индивидуально, так и в комбинации с флударабином или другими активными продуктами для лечения данной патологии (Thomas D.A., Giles F.J.,Albitar M., Kantarjian H.M., Acta Haematol, (2001), vol. 207, p. 106-190; Gabrilove J.L., Oncologist (2001),vol. 6, p. 4-7). Существует связь между процессом ангиогенеза костного мозга и "заболеванием костного мозга",прослеженная на клетках CML (устойчивые лейкемические миеломоноциты). Различные исследования подтверждают, что ингибирование ангиогенеза, в частности, при помощи соединения, обладающего антагонистической активностью в отношении рецепторов FGF, могло бы представлять собой терапевтический метод выбора для лечения этой патологии. Пролиферация и миграция клеток гладкой мышцы способствуют интимальной гипертрофии артерий и таким образом играют существенную роль в атеросклерозе и в рестенозе после ангиопластики и эндоартериэктомии. Исследования in vivo показывают, что после повреждения сонной артерии в результате "применения баллонной ангиопластики" наблюдается местное продуцирование a-FGF и b-FGF. На этой же модели было продемонстрировано, что антитело, нейтрализующее FGF2, ингибирует пролиферацию клеток сосудов гладкой мышцы и уменьшает таким образом интимальную гипертрофию. Химерный белок FGF2, связанный с молекулой, такой как сапорин, ингибирует пролиферацию клеток сосудов гладкой мышцы в тесте in vitro и интимальную гипертрофию in vivo (Epstein C.E.,Siegall C.B., Biro S., Fu Y.M., FitzGerald D., Circulation (1991), vol. 87, p. 84-778; Waltenberger J.,Circulation (1997), p. 96-4083). Таким образом, антагонисты рецепторов FGF, такие как соединения согласно настоящему изобретению, представляют собой терапию выбора как индивидуально взятые, так и в комбинации с антагонистами к другим факторам роста, задействованных в этих патологиях, такими как PDGF, при лечении патологий, связанных с пролиферацией клеток сосудов гладкой мышцы, таких как атеросклероз, постангиопластический рестеноз, или состояний после установки эндоваскулярных протезов (стенов) или аортокоронарного шунтирования. Гипертрофия миокарда возникает в качестве ответной реакции на стресс стенки желудочка, возникающий в результате перегрузки, связанной с давлением или увеличением объема. Эта перегрузка может являться следствием многочисленных физико-патологических состояний, таких как гипертония, АС (коарктация аорты), инфаркт миокарда и других сосудистых заболеваний. Последствиями этой патологии являются морфологические, молекулярные и функциональные изменения, такие как гипертрофия миоцитов миокарда, аккумуляция матриксных белков и реэксперессирование фетальных генов. В этой патоло- 18013408 гии задействован фактор b-FGF. Так, добавление b-FGF в культуру кардиомиоцитов новорожденной крысы изменяет профиль генов, соответствующих контрактильным белкам, приводящим к профилю генов фетального типа. Дополнительно отмечается, что миоциты взрослой крысы дают гипертрофический ответ под действием b-FGF, причем этот ответ блокируется антителами, нейтрализующими b-FGF. Опыты, проведенные in vivo, на трансгенных мышах с нокаутом в отношении b-FGF, показали, что b-FGF является главным стимулирующим фактором в отношении гипертрофии миоцитов миокарда в данной патологии (Schultz Jej, Witt S.A., Nieman M.L., Reiser P.J., Engle S.J., Zhou M. et al., J. Ckin. Invest. (1999),vol. 19, p. 104-709). Таким образом, соединение, такое как соединение согласно настоящему изобретению, обладающее антагонистической активностью в отношении рецепторов FGF, представляет собой терапию выбора при лечении сердечной недостаточности и любой другой патологии, ассоциированной с дегенерацией сердечной ткани. Это лечение могло бы быть осуществлено как само по себе, так и в сочетании с традиционным лечением (бета-блокаторы, диуретики, антагонисты ангиотензина, антиаритмические средства,противокальциевые препараты, противотромботические препараты и т.д.) Сосудистые нарушения, вызванные диабетом, характеризуются изменением реактивности сосудов и кровотока, гиперпроницаемостью, усилением пролиферативного ответа и увеличением отложений матриксных белков. Более конкретно, a-FGF и b-FGF присутствуют в преретинальных мембранах пациентов, страдающих диабетической ретинопатией, в мембранах нижележащих капилляров и в стекловидном теле больных, страдающих пролиферативной ретинопатией. Увеличивается участие растворимого рецептора FGF, способного связывать одновременно a-FGF и b-FGF, в сосудистых нарушениях, вызванных диабетом (Tilton R.G., Dixon Raf, Brock Т.А., Ехр. Opin: Invest. Drugs (1997), vol. 84, р. 6-1671). Таким образом, соединение, такое как соединение согласно настоящему изобретению, обладающее антагонистической активностью в отношении рецепторов FGF, представляет собой терапию выбора как индивидуально взятое, так и в комбинации с антагонистами других факторов роста, применяемыми в случае указанных патологий, такими как VEGF. Ревматоидный артрит (RA) представляет собой хроническое заболевание неизвестной этиологии. Несмотря на то что болезнь поражает многие органы, наиболее тяжелой формой RA является прогрессирующее синовиальное воспаление суставов, приводящее к их разрушению. Ангиогенез, по-видимому,влияет существенным образом на развитие этой патологии. Так, a-FGF и b-FGF были обнаружены в синовиальной ткани и в суставной жидкости пациента, больного RA, что указывает на то, что этот фактор роста задействован в инициации и/или развитии этой патологии. На крысиных моделях AIA (модель адъювантно-индуцированного артрита) было показано, что сверхэкспрессирование b-FGF увеличивает тяжесть заболевания, в то время как антитело, нейтрализующее b-FGF, блокирует развитие RA(Yamashita A., Yonoemitsu Y., Okano S., Nakagawa K., Nakashima Y., Irisa N., et al., J. Immunol. (2002),vol. 57, p. 168-450; Manabe N., Oda H., Nakamura K., Kuga Y., Uchida S., Kawaguchi H., Rheumatol. (1999),vol. 20, p. 38-714). Таким образом, соединения согласно изобретению представляют собой терапию выбора для этой патологии. Было также обнаружено, что содержание факторов роста, обладающих проангиогенной активностью, таких как FGF1 и 2, было очень высоким в синовиальной жидкости пациента, больного остеоартритом. В этом типе патологии отмечается сильное изменение баланса между про- и антиангиогенными факторами, задействованными в формировании новых сосудов. И, следовательно, происходит васкуляризация неваскуляризированных структур, таких как суставные хрящи или межпозвоночные диски. Таким образом, ангиогенез является ключевым фактором в костном формировании (остеофитов), что способствует развитию заболевания. Дополнительно следует отметить, что иннервация новых сосудов может также способствовать возникновению хронических болей, сопровождающих данную патологию(Walsh D.A., Curr. Opin. Rheumatol. 2004 Sep.; 16 (5) 609-15). Таким образом, соединения согласно изобретению представляют собой терапию выбора для данной патологии. Болезни IBD (воспалительное заболевание кишечника) включают две формы хронического воспалительного заболевания кишечника: UC (язвенный колит) и болезнь Крона (CD). Болезни IBD характеризуются дисфункцией иммунной системы, выражающейся патологической продукцией воспалительных цитокинов, сопровождающейся возникновением местной микрососудистой системы. Последствием этого ангиогенеза воспалительного происхождения является интестинальная ишемия, вызванная сужением кровеносных сосудов. У пациентов, имеющих эту патологию, были выявлены значительные содержания циркуляторных и местных b-FGF (Kanazawa S., Tsunoda T., Onuma E., Majima T., Kagiyama M., Kkuchi K.,American Journal of Gastroenterology (2001), vol. 28, p. 96-822; Thorn M., Raab Y., Larsson A., Gerdin B.,Hallgren R., Scandinavian Gastroenterology (2000), vol. 12, p. 35-408). Соединения согласно изобретению,обладающие значительной антиангиогенной активностью, показанной на модели воспалительного ангиогенеза, представляют собой терапию выбора для лечения этих патологий. Рецепторы FGF-1, -2 и -3 участвуют в процессах хроногенеза и остеогенеза. Мутации, приводящие к экспрессии всегда активированных FGF, связаны со многими генетическими заболеваниями человека и проявляются в неправильном развитии скелета человека, такими как синдромы Пфейфера, Крузона,Апера, Джексона-Вейса и cutis gyrate Бир-Стивенсона. Некоторые из этих мутаций, затрагивающих, в- 19013408 частности, рецептор FGF-3, приводят, в частности, к ахондроплазиям (ACH), гипохондроплазиям (HCH) и TD (танатофорическая дисплазия) (Thanatophoric dysplasia); причем ACH является наиболее распространенной формой нанизма. С биохимической точки зрения сохраняющаяся активация этих рецепторов осуществляется путем димеризации рецептора в отсутствии лиганда (Chen L., Adar R., Yang X.Monsonego E.O., Li C., Hauschka P.V, Yagon A. and Deng C.X. (1999), The Journ. Of Clin. Invest., vol.11,p. 1517-1525). Таким образом, соединения согласно изобретению, обладающие антагонистической активностью к связыванию b-FGF с рецептором FGF и в этой связи ингибирующие димеризацию рецептора, представляют собой терапию выбора для этих патологий. Кроме того, известно, что жировая ткань является одной из немногих тканей, которая у взрослого человека может разрастаться или регрессировать. Эта ткань является высоковаскуляризированной и каждый адипоцит окружен очень плотной сеткой из микрососудов. Эти наблюдения привели к необходимости проведения теста для оценки воздействия антиангиогенного агента на разрастание жировой ткани у взрослого человека. Таким образом, оказалось, что на фармакологических моделях у мыши ob/ob ингибирование ангиогенеза выразилось в значительной потере веса мыши (Rupnick M.A. et al. (2002), PNAS,vol. 99,16, p. 10730-10735). Таким образом, соединение, являющееся антагонистом к рецепторам FGF,обладающее сильной антиангиогенной активностью, может представлять собой терапию выбора для патологий, связанных с ожирением. Благодаря своей низкой токсичности и биологическим и фармакологическим свойствам соединения согласно настоящему изобретению могут найти применение при лечении любой карциномы, имеющей высокую степень васкуляризации (легкие, молочная железа, простата, пищевод), или индуцирующей метастазирование (прямая кишка, желудок, меланома), или чувствительной аутокринным образом кa-FGF или b-FGF, или же при патологиях типа лимфом и лейкемий. Эти соединения представляют собой терапию выбора как отдельно взятую, так и в комбинации с выбранным видом химиотерапии. Соединения согласно изобретению могут также найти применение при лечении сердечно-сосудистых заболеваний, таких как атеросклероз, постангиопластический рестеноз, при лечении заболеваний, связанных с осложнениями после установки эндоваскулярных протезов и/или аортокоронарного шунтирования или других сосудистых трансплантатов, и гипертрофии миокарда или сосудистых осложнений при диабете,таких как диабетическая ретинопатия. Соединения согласно изобретению могут найти применение при лечении хронических воспалительных заболеваний, таких как ревматоидный артрит или IBD. Наконец,соединения согласно изобретению можно использовать при лечении ахондроплазий (ACH), гипохондроплазий (HCH) и TD (танатофорическая дисплазия), а также при лечении ожирения. Соединения согласно изобретению могут также использоваться при лечении мышечной дегенерации, в частности мышечной дегенерации, связанной с возрастом (или DMLA). Главной причиной потери зрения у взрослых является неоваскуляризация и последующие кровоизлияния, которые приводят к значительным функциональным нарушениям на уровне глаза и проявляются в ранней слепоте. В последнее время изучение механизмов, участвующих в явлениях глазной неоваскуляризации, позволили выявить участие проангиогенного фактора в подобных патологиях. Используя модель хориоидального неоангиогенеза, наведенного лазером, удалось подтвердить, что продукты согласно изобретению позволяют также модулировать неоваскуляризацию хориоидеи. Кроме того, продукты согласно изобретению можно использовать для лечения или предупреждения тромбопении, вызванной, в частности, противораковой химиотерапией. Так, было продемонстрировано,что продукты согласно изобретению могут повысить содержание циркуляторных тромбоцитов при химиотерапии. Таким образом, согласно другому аспекту изобретение относится к лекарственным средствам, которые содержат соединение формулы (I) или аддитивную соль этого соединения с фармацевтически приемлемой кислотой или с фармацевтически приемлемым основанием или же гидрат или сольват соединения формулы (I). Согласно другому аспекту изобретение относится к фармацевтическим композициям, содержащим в качестве активного начала соединение формулы (I) согласно изобретению. Эти фармацевтические композиции содержат эффективную дозу по меньшей мере одного соединения согласно изобретению или фармацевтически приемлемой соли, гидрата или сольвата указанного соединения, а также по меньшей мере один фармацевтически приемлемый эксципиент. Указанные эксципиенты выбирают с учетом фармацевтической формы и желаемого способа введения (например, пероральным путем, путем приема под язык, подкожным путем, внутримышечным, внутривенным, чрескожным путем, через слизистую, локально или ректальным путем) из числа обычных эксципиентов, известных специалисту. Фармацевтические композиции согласно настоящему изобретению предпочтительно вводят пероральным путем. В фармацевтических композициях согласно изобретению для перорального введения активное начало может находиться в разовой форме для введения в смеси с классическими фармацевтическими носителями. Соответствующие разовые формы для введения включают, например, таблетки, в случае необходимости делимые, желатиновые капсулы, порошки, гранулы и растворы или суспензии для перораль- 20013408 ного введения. Например, разовая форма для введения соединения согласно изобретению, представленная в виде таблетки, может содержать следующие компоненты: Настоящее изобретение относится также к фармацевтической композиции, описанной выше, в качестве лекарственного средства. Настоящее изобретение относится также к применению соединения формулы (I), описанного выше,для получения лекарственного средства, пригодного для лечения заболеваний, требующих модуляциюFGF. Настоящее изобретение относится также к применению соединения формулы (I), описанному выше,для получения лекарственного средства, пригодного для лечения злокачественных опухолей, в частности карцином, имеющих высокую степень васкуляризации, таких как карцинома легких, молочной железы,простаты и пищевода, рака, индуцирующего метастазирование, такого как рак прямой кишки и рак желудка, меланом, глиом, лимфом и лейкемии. Соединение формулы (I) согласно изобретению может вводиться индивидуально, или в комбинации с одним или несколькими соединениями, обладающими антиангиогенной активностью, или с одним или несколькими цитотоксичными соединениями (химиотерапия), или в сочетании с лечением путем облучения. Таким образом, настоящее изобретение относится также к применению соединения формулы (I),описанного выше, в сочетании с одним или несколькими противораковыми активными началами и/или с рентгенотерапией. Настоящее изобретение относится также к применению соединения формулы (I), описанного выше,для получения лекарственного средства, пригодного для лечения сердечно-сосудистых заболеваний, таких как атеросклероз, постангиопластический рестеноз, заболевания, связанные с осложнениями после установки эндоваскулярных протезов и/или аортокоронарного шунтирования или других сосудистых трансплантатов, гипертрофия миокарда, или сосудистые осложнения при диабете, такие как диабетическая ретинопатия. Настоящее изобретение относится также к применению соединения формулы (I), описанного выше,для получения лекарственного средства, пригодного для лечения хронических воспалительных заболеваний, таких как ревматоидный артрит или IBD. Настоящее изобретение относится также к применению соединения формулы (I), описанного выше,для получения лекарственного средства, пригодного для лечения остеоартрита, ахондроплазий (ACH),гипохондроплазий (HCH) и TD (танатофорической дисплазии) (Thanatophoric dysplasia). Настоящее изобретение относится также к применению соединения формулы (I), описанного выше,для получения лекарственного средства, пригодного для лечения ожирения. Настоящее изобретение относится также к применению соединения формулы (I), описанного выше,для получения лекарственного средства, пригодного для лечения мышечной дегенерации, такой как мышечная дегенерация, связанная с возрастом (DMLA). Композиции согласно изобретению, предназначенные для перорального введения, содержат рекомендуемые дозы в диапазоне от 0,01 до 700 мг. Может случиться, что в конкретных случаях следует использовать более высокие или более низкие дозы; эти дозы входят в объем изобретения. Согласно обычной практике приемлемая доза для каждого пациента определяется врачом в зависимости от способа введения, возраста, массы тела и реакции пациента, а также от степени развития болезни. Настоящее изобретение согласно другому аспекту относится к способу лечения указанных выше патологий, который включает введение пациенту эффективной дозы соединения согласно изобретению или одной из его фармацевтически приемлемых солей или одного из гидратов или сольватов. Следующие примеры описывают получение некоторых соединений согласно изобретению. Эти примеры не ограничивают, а лишь иллюстрируют изобретение. Продукты и промежуточные соединения, если их получение не описано, являются известными из литературы или доступны в продаже. Некоторые промежуточные соединения, пригодные для получения соединений формулы (I), могут быть одновременно конечными продуктами формулы (I), как это представлено в приведенных ниже примерах. Аналогично, некоторые соединения формулы (I) согласно изобретению могут быть одновременно промежуточными продуктами для получения других соединений формулы (I) согласно изобретению.- 21013408 В описании приняты следующие условны обозначения: ВОС: трет-бутоксикарбонил; ВОР: гексафторфосфат бензотриазол-1-илокси-трис-(диметиламино)фосфония; ДМСО: диметилсульфоксид; спектр ЯМР измерялся на приборах BRUKER Avance 250, 300 и 400 МГц; температуры плавления измерялись на приборе BUCHI, тип В-540; МС: масс-спектрометрия, измеренная на приборе AGILENT MSD1; Получение промежуточных соединений Получение I. Синтез трет-бутилимидазо[1,5-а]пиридин-6-карбоксилата. К 570 мг (3,53 ммоль) имидазо[1,5-а]пиридин-6-карбоновой кислоты [описана в Bioorg. Med. Chem.Lett. (2002), 12 (3), 465-470] в смеси 5 мл диметилформамида и 5 мл толуола добавляют 3,37 мл(14,06 ммоль) ди-трет-бутилацетат-N,N-диметилформамида и нагревают при 90 С в течение 6 ч. Снова добавляют в реакционную среду 3,37 мл (14,06 ммоль) ди-трет-бутилацетат-N,N-диметилформамида и нагревают при 90 С в течение не более 4 ч. Реакционную среду выливают в воду и экстрагируют этилацетатом. Органическую фазу декантируют, промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют при пониженном давлении. Продукт очищают фильтрацией через слой кремнезема, элюируя смесью дихлорметана и метанола (98-2). После выпаривания получают 580 мг порошка бежевого цвета. Температура плавления: 77 С; 1 Н ЯМР (ДМСО-d6) 1,59 (9 Н, с); 7,71 (1 Н, д); 7,36 (1 Н, с); 7,58 (1 Н, д); 8,56 (1 Н, с); 9,03 (1 Н, с). Получение II. Синтез 7-(бензилокси)имидазо[1,5-а]пиридина. Стадия А. 4-(Бензилокси)-2-(хлорметил)пиридин. К 2 г (9,29 ммоль) [4-(бензилокси)пиридин-2-ил]метанола [описанного в J. Org. Chem. (1996), 61 (8),2624] в 46 мл дихлорметана добавляют 1,76 мл (24,16 ммоль) тионилхлорида. Реакционную среду перемешивают при комнатной температуре в течение 18 ч, затем концентрируют при пониженном давлении. Полученный остаток поглощают насыщенным водным раствором карбоната натрия, затем экстрагируют дихлорметаном. Органическую фазу сушат над сульфатом натрия, затем концентрируют при пониженном давлении. Получают 2,1 г масла коричневого цвета. Масс-спектрометрия (метод ES+) МН+=234. Стадия В. 1-[4-(Бензилокси)пиридин-2-ил]метанамин. К 2,1 г (8,99 ммоль) 4-(бензилокси)-2-(хлорметил)пиридина (описанного на стадии А) в 60 мл дихлорметана добавляют 1,5 г (10,78 ммоль) гексаметилентетрамина, затем 1,3 г йодида натрия. Реакционную среду кипятят с обратным холодильником в течение 12 ч, затем концентрируют при пониженном давлении. Полученный остаток поглощают 45 мл метанола. Добавляют 7,5 мл (89,90 ммоль) 12 н. раствора хлористо-водородной кислоты. Реакционную среду кипятят с обратным холодильником в течение 16 ч. После добавления этилового эфира образовавшийся осадок фильтруют, затем поглощают насыщенным водным раствором карбоната натрия. Водную фазу экстрагируют этилацетатом, сушат над сульфатом натрия, затем концентрируют при пониженном давлении. Получают 1,1 г масла бежевого цвета. Масс-спектрометрия (метод ES+) МН+=215 Стадия С. 0,7 г (3,27 ммоль) 1-[4-(бензилокси)пиридин-2-ил]метанамина (описанного на стадии В) в 16 мл муравьиной кислоты кипятят с обратным холодильником в течение 5 ч. Реакционную среду концентрируют при пониженном давлении. Полученный остаток поглощают 7 мл 1,2-дихлорэтана. Добавляют 0,6 мл(6,54 ммоль) фосфорилхлорида, растворенного в 7 мл 1,2-дихлорэтана. После кипячения с обратным холодильником в течение 4 ч реакционную среду концентрируют при пониженном давлении, затем поглощают дихлорметаном. Органическую фазу промывают насыщенным водным раствором гидрокарбоната натрия, сушат над сульфатом натрия и концентрируют при пониженном давлении. Получают 0,97 г масла коричневого цвета. Масс-спектрометрия (метод ES+) МН+=225; 1 Н ЯМР (ДМСО-d6) 5,092 (2 Н, с); 6,44-6,47 (1 Н, м); 7,07 (1 Н, м); 7,08 (1 Н, с); 7,37-7,49 (5 Н, м); 8,17(1 Н, с); 8,23-8,27 (1 Н, м) Получение III. Синтез 8-(бензилокси)имидазо[1,5-а]пиридина. Это соединение получают согласно методу, описанному в получении II (стадия С), исходя из 2,8 г(13,25 ммоль) 1-[3-(бензилокси)пиридин-2-ил]метанамина [описанного в Inorg. Chem. (2003), 42 (14),4401], которое подвергают формилированию муравьиной кислотой, затем циклизуют путем взаимодействия с фосфорилхлоридом. Получают 1,74 г масла коричневого цвета. Масс-спектрометрия (метод ES+) МН+=225; 1H ЯМР (ДМСО-d6) 5,26 (2 Н, с); 6,21-6,28 (1 Н, м); 6,55-6,60 (1 Н, м); 7,28-7,52 (6 Н, м); 7,96-7,99 (1 Н,- 22013408 м); 8,35 (1 Н, с) Примеры Пример 1. (Имидазо[1,5-а]пиридин-3-ил)(3-метокси-4-нитрофенил)метанон. К 3 г (0,025 моль) имидазо[1,5-а]пиридина [описанного в J. Chem. Soc; (1955), 2834-2836], растворенного в 100 мл 1,2-дихлорэтана, добавляют 11,5 г (0,053 моль) 3-метокси-4-нитробензоилхлорида и 7,8 мл (0,056 моль) триэтиламина. Перемешивают при комнатной температуре в течение 2 ч. Реакционную среду концентрируют при пониженном давлении, затем поглощают дихлорметаном и насыщенным водным раствором бикарбоната натрия. Органическую фазу декантируют, промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток поглощают дихлорметаном и очищают путем фильтрации через слой силикагеля. После выпаривания получают 7,1 г твердого вещества желтого цвета. Температура плавления: 183 С. 1 Н ЯМР (ДМСО-d6) 4,01 (3 Н, с); 7,35-7,40 (1 Н, м); 7,47-7,54 (1 Н, м); 7,97 (1 Н, с); 8,06-8,11 (3 Н, м); 8,15 (1 Н, с); 9,77 (1 Н, д). Примеры 2-4. Работая согласно процедуре, описанной в примере 1, получают соединения формулы (Ia),описанные в табл. I, путем ацилирования соответственно замещенных имидазо[1,5-а]пиридинов(описанных в международных заявках на патент WO 04/046133 и WO 03/070732) при помощи 3-метокси-4-нитробензоилхлорида. Таблица I Спектры ЯМР соединений примеров 2-8 (табл. I) описаны в табл. I'. Таблица I' Пример 9. Метил-5-[(имидазо[1,5-а]пиридин-3-ил)карбонил]-2-нитробензоат. К 1,3 г (0,011 моль) имидазо[1,5-а]пиридина [описанного в J. Chem.Soc. (1955), 2834-2836], растворенного в 100 мл 1,2-дихлорэтана, добавляют 5,6 г (0,023 моль) метил-5-(хлоркарбонил)-2-нитробензоата и 3,4 мл (0,024 моль) триэтиламина. Перемешивают при комнатной температуре в течение 4 ч. Реакционную среду концентрируют при пониженном давлении, затем поглощают дихлорметаном и насыщенным водным раствором бикарбоната натрия. Органическую фазу декантируют, промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют при пониженном давлении. Продукт очищают путем колоночной хроматографии с силикагелем, элюируя дихлорметаном.- 23013408 После выпаривания получают 3,1 г твердого вещества желтого цвета. Температура плавления: 151 С. 1(1 Н, д); 8,69 (1 Н, д); 8,76 (1 Н, с); 9,78 (1 Н, д). Пример 10. Трет-бутил-3-[3-(метоксикарбонил)-4-нитробензоил]имидазо[1,5-а]пиридин-6-карбоксилат. Это соединение получают согласно способу, описанному в примере 9, путем бензоилирования третбутилимидазо[1,5-а]пиридин-6-карбоксилта при помощи метил-5-(хлоркарбонил)-2-нитробензоата в присутствии триэтиламина. Получают твердое вещество желтого цвета. Температура плавления: 170 С. 1(1 Н, д); 8,77 (1 Н, с); 10,25 (1 Н, с). Пример 11. 3-[3-(Метоксикарбонил)-4-нитробензоил]имидазо[1,5-а]пиридин-6-карбоновая кислота. К 610 мг (1,43 ммоль) трет-бутил-3-[3-(метоксикарбонил)-4-нитробензоил]имидазо[1,5-а]пиридин 6-карбоксилата в 2 мл дихлорметана добавляют 2,13 мл (28,68 ммоль) трифторуксусной кислоты и перемешивают при комнатной температуре в течение 5 ч. Реакционную среду концентрируют при пониженном давлении, затем полученный остаток поглощают ацетоном. Образовавшийся осадок фильтруют,промывают ацетоном и сушат. Получают 450 мг порошка желтого цвета. Температура плавления: 290 С. 1 Н ЯМР (ДМСО-d6) 3,90 (3 Н, с); 7,78 (1 Н, д); 8,04 (1 Н, с); 8,12 (1 Н, д); 8,26 (1 Н, д); 8,68 (1 Н, д); 8,75(1 Н, с); 10,26 (1 Н, с). Пример 12. Метил-5-(6-[(трет-бутоксикарбонил)амино]имидазо[1,5-а]пиридин-3-илкарбонил)-2 нитробензоат. К 430 мг (1,16 ммоль) 3-[3-(метоксикарбонил)-4-нитробензоил]имидазо[1,5-а]пиридин-6 карбоновой кислоты в 20 мл толуола добавляют 0,55 мл (3,96 ммоль) триэтиламина и 1,07 мл третбутанола, затем 0,31 мл (1,40 ммоль) дифенилфосфорилазида. Реакционную среду нагревают при 110 С в течение 3 ч, затем охлаждают до комнатной температуры. Добавляют воду и насыщенный водный раствор бикарбоната натрия, затем экстрагируют этилацетатом. Органическую фазу декантируют, промывают насыщенным водным раствором хлорида натрия, затем сушат над сульфатом натрия и концентрируют при пониженном давлении. Продукт очищают колоночной хроматографией с силикагелем, элюируя смесью дихлорметана и метанола (98-2). Получают 480 мг твердого вещества оранжевого цвета. Температура плавления: 182 С. 1 Н ЯМР (ДМСО-d6) 1,55 (9 Н, с); 3,92 (3 Н, с); 7,45 (1 Н, д); 7,90 (1 Н, с); 7,99 (1 Н, д); 8,24 (1 Н, д); 8,67[6-(трет-Бутоксикарбониламино)имидазо[1,5-а]пиридин-3-ил](3-метокси-4-нитрофенил)метанон. Это соединение получают согласно способу, описанному в предыдущем примере 12, путем перегруппировки Куртиуса, исходя из 3-(3-метокси-4-нитробензоил]имидазо[1,5-а]пиридин-6-карбоновой кислоты при помощи дифенилфосфорилазида в присутствии трет-бутанола. Получают твердое вещество желтого цвета. Температура плавления: 200 С. 1 Н ЯМР (ДМСО-d6) 1,54 (9 Н, с); 4,02 (3 Н, с); 7,42 (1 Н, д); 7,87 (1 Н, с); 8,11-7,87 (3 Н, м); 8,15 (1 Н, с); 9,87 (1 Н, с). Пример 14. Метил-5-(6-[(трет-бутоксикарбонил)(метил)амино]имидазо[1,5-а]пиридин-3-илкарбонил)-2-нитробензоат. К 53,9 мг (1,35 ммоль) гидрида натрия (60%-ная дисперсия в масле) в 2 мл диметилформамида добавляют 540 мг (1,23 ммоль) метил-5-(6-[(трет-бутоксикарбонил)амино]имидазо[1,5-а]пиридин-3 илкарбонил)-2-нитробензоата в 10 мл диметилформамида и перемешивают 30 мин при комнатной температуре, затем добавляют 84 мкл (1,35 ммоль) метилйодида и оставляют на ночь для перемешивания при комнатной температуре. Подкисляют до pH 4 с помощью водного раствора гидросульфата калия и экстрагируют этилацетатом. Органическую фазу промывают насыщенным водным раствором хлорида натрия, затем сушат над сульфатом натрия и концентрируют при пониженном давлении. Продукт очищают путем фильтрации через кремниевый слой, элюируя дихлорметаном. Получают 475 мг порошка оранжевого цвета. Температура плавления: 55 С. 1 Н ЯМР (ДМСО-d6) 1,46 (9H, c); 3,33 (3 Н, с); 3,92 (3 Н, с); 7,57 (1 Н, д); 7,98 (1 Н, с); 8,06 (1 Н, д); 8,25- 24013408 Пример 15. Метил-5-[6-(метиламино)имидазо[1,5-а]пиридин-3-ил]карбонил-2-нитробензоат. К 460 мг (1/01 ммоль) метил-5-(6-[(трет-бутоксикарбонил)(метил)амино]имидазо[1,5-а]пиридин-3 илкарбонил)-2-нитробензоата в 5 мл дихлорметана добавляют 1,3 мл трифторуксусной кислоты и перемешивают при комнатной температуре в течение ночи. Реакционную среду концентрируют при пониженном давлении. Остаток поглощают водой и подщелачивают насыщенным водным раствором бикарбоната натрия, затем экстрагируют дихлорметаном. Органическую фазу промывают насыщенным водным раствором хлорида натрия, затем сушат над сульфатом натрия и концентрируют при пониженном давлении. Получают 350 мг порошка красного цвета. Температура плавления: 183 С. 1 Н ЯМР (ДМСО-d6) 2,79 (3 Н, д); 3,90 (3 Н, с); 7,11 (1 Н, д); 7,77 (1 Н, с); 7,82 (1 Н, д); 8,31 (1 Н, д); 8,66(1 Н, д); 8,75 (1 Н, с); 9,01 (1 Н, с). Пример 16. (6-Аминоимидазо[1,5-а]пиридин-3-ил)(3-метокси-4-нитрофенил)метанон. Это соединение получают согласно способу, описанному в предыдущем примере 15, путем снятия защитных групп с аминофункции соединения [6-(трет-бутоксикарбониламино)имидазо[1,5-а]пиридин-3 ил](3-метокси-4-нитрофенил)метанона при помощи трифторуксусной кислоты. Получают твердое вещество желтого цвета, которое переводят в соль с образованием соли гидрохлорида. Температура плавления: 252 С. 1 Н ЯМР (ДМСО-d6) 4,01 (3 Н, с); 7,14 (1 Н, д); 7,79 (1 Н, с); 7,87 (1 Н, д); 7,97-8,01 (2 Н, м); 8,13 (1 Н, с); 9,41 (1 Н, с). Пример 17. N-[3-(3-Метокси-4-нитробензоил)имидазо[1,5-а]пиридин-6-ил]метансульфонамид. К 0,40 г (1,15 ммоль) гидрохлорида (6-аминоимидазо[1,5-а]пиридин-3-ил)(3-метокси-4 нитрофенил)метанона в 10 мл пиридина, охлажденного до 5 С, добавляют 0,107 мл (1,38 ммоль) мезилхлорида, затем доводят температуру до комнатной и перемешивают 18 ч. Среду обрабатывают 130 мл 1 н. хлористо-водородной кислоты и экстрагируют этилацетатом. Органическую фазу промывают насыщенным водным раствором хлорида натрия, затем сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток поглощают изопропиловым эфиром, фильтруют, промывают изопропиловым эфиром, затем сушат. Получают 411 мг твердого вещества желтого цвета. Температура плавления: 249 С. 1 Н ЯМР (ДМСО-d6) 3,14 (3 Н, с); 4,02 (3 Н, с); 7,39 (1 Н, д); 7,94 (1 Н, с); 8,02-8,11 (3 Н, м); 8,13 (1 Н, с); 9,88 (1 Н, с). Пример 18. N-[3-(3-Метокси-4-нитробензоил)имидазо[1,5-а]пиридин-6-ил] ацетамид. К 0,50 г (1,43 моль) гидрохлорида (6-аминоимидазо[1,5-а]пиридин-3-ил)(3-метокси-4-нитрофенил)метанона в 25 мл 1,2-дихлорэтана, охлажденного до 5 С, добавляют 1,29 мл (9,29 ммоль) триэтиламина, затем 0,51 мл (7,15 ммоль) ацетилхлорида, затем температуру доводят до комнатной и перемешивают 18 ч. Среду обрабатывают водой, подщелачивают раствором бикарбоната натрия и экстрагируют дихлорметаном. Органическую фазу промывают насыщенным водным раствором хлорида натрия, затем сушат над сульфатом натрия и концентрируют при пониженном давлении. Продукт очищают колоночной хроматографией на силикагеле, элюируя смесью дихлорметана и ацетона (90-10). Получают 316 мг твердого вещества желтого цвета. Температура плавления: 257 С. 1 Н ЯМР (ДМСО-d6) 2,15 (3 Н, с); 4,01 (3 Н, с); 7,45 (1 Н, д); 7,92 (1 Н, с); 8,00-8,06 (3 Н, м); 8,13 (1 Н, с); 10,62 (1 Н, с). Пример 19. Метил-2-(бензоиламино)-5-[(имидазо[1,5-а]пиридин-3-ил)карбонил]бензоат. К 1,97 г (0,017 моль) имидазо[1,5-а]пиридина [описанного в J. Chem. Soc; (1955), 2834-2836] в 100 мл ацетонитрила добавляют 5,2 мл (0,037 моль) триэтиламина, затем в атмосфере азота при 0 С вводят 10 г (0,035 моль) 4-оксо-2-фенил-4 Н-3,1-бензоксазин-6-карбонилхлорида. После 22 ч перемешивания при комнатной температуре реакционную среду фильтруют. Полученный остаток промывают этилацетатом, водой, ацетоном, затем сушат. К 9,75 г (0,026 моль) полученного твердого желтого вещества в 50 мл метанола и 50 мл N,N-диметилформамида добавляют 0,32 г (2,65 ммоль) N,N-диметилпиридин-4-амина. После 22 ч кипячения с обратным холодильником реакционную среду фильтруют. Остаток промывают водой, затем сушат. Продукт очищают колоночной хроматографией на силикагеле, элюируя смесью дихлорметана с метанолом (99,9-0,1). Получают 3,67 г твердого вещества желтого цвета. Температура плавления: 218 С. 1 Н ЯМР (CDCl3) 4,05 (3 Н, с); 7,08-7,09 (1 Н, м); 7,27-7,29 (1 Н, м); 7,57-7,60 (3 Н, м); 7,76-7,81 (2 Н, м); 8,12 (2 Н, д); 8,78 (1 Н, д); 9,1 5 (1 Н, д); 9,28 (1 Н, с); 9,88 (1 Н, д).- 25013408 Пример 20. (1-бромимидазо[1,5-а]пиридин-3-ил)(3-метокси-4-нитрофенил)метанон. К 9,8 г (0,033 моль) (имидазо[1,5-а]пиридин-3-ил)(3-метокси-4-нитрофенил)метанона, полученного в примере 1, в 170 мл хлороформа добавляют 3,51 г (0,043 моль) ацетата натрия, затем прибавляют по каплям раствор 1,85 мл (0,036 моль) брома в 15 мл хлороформа, поддерживая комнатную температуру реакционной среды. После окончания введения перемешивают еще 1 ч при той же температуре. Реакционную среду выливают в насыщенный водный раствор бикарбоната натрия и экстрагируют дихлорметаном. Органическую фазу декантируют, промывают водным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток поглощают смесью толуолдихлорметан, затем очищают фильтрацией через силикагель, элюируя толуолом. После выпаривания получают 7,71 г твердого вещества желтого цвета. Температура плавления: 189 С. 1 Н ЯМР (CDCl3) 4,10 (3 Н, с); 7,23-7,29 (1 Н, м); 7,41-7,46 (1 Н, м); 7,78 (1 Н, д); 7,96 (1 Н, д); 8,14-8,20(2 Н, м); 9,90 (1 Н, д). Примеры 21-24. Работают так, как описано в примере 20, и получают соединения формулы (Ii), описанные в табл. II,путем бромирования соединения формулы (I) (при R1=H) в присутствии брома и ацетата натрия. Таблица II Спектры ЯМР соединений примеров 21-24 табл. II представлены в табл. II'. Таблица II' Пример 25. (3-Метокси-4-нитрофенил)[1-(4-метоксифенил)имидазо[1,5-а]пиридин-3-ил]метанон. К 0,850 г (0,023 моль) (1-бромимидазо[1,5-а]пиридин-3-ил) (3-метокси-4-нитрофенил)метанона, полученного в примере 20, в 30 мл диоксана в атмосфере аргона добавляют 0,447 г (0,003 моль) 4-метоксифенилбороновой кислоты, 2,24 г (0,009 моль) K3PO4 Н 2 О, затем 0,131 г (0,011 моль) тетра-кис(трифенилфосфин)палладия(0). Кипятят с обратным холодильником в течение 1 ч. Реакционную среду выливают в воду и экстрагируют этилацетатом. Органическую фазу декантируют, промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют при пониженном давлении. Продукт очищают фильтрацией через силикагель, элюируя смесью дихлорметан-циклогексан(2-1), затем дихлорметаном. После выпаривания получают 0,850 г твердого вещества оранжевого цвета. Температура плавления: 185 С. 1 Н ЯМР (ДМСО-d6) 3,85 (3 Н, с); 4,06 (3 Н, с); 7,12 (2 Н, д); 7,41-7,44 (1 Н, м); 7,54-7,58 (1 Н, м); 7,95(2 Н, д); 8,08-8,10 (2 Н, м); 8,34 (1 Н, д); 8,36 (1 Н, с); 9,81 (1 Н, д). Примеры 26-58. Работая согласно способу, описанному в примере 25, получают соединения формул Is, описанные в табл. III, представленной ниже, путем сочетания по Сузуки бромсодержащих соединений общей формулы (Ii) с фенилбороновыми или гетероарилбороновыми производными, изменяя условия проведения эксперимента (катализатор, лиганды, основания) в зависимости от получаемого соединения. Используют пинаколборонатные производные вместо соответствующих бороновых кислот. ВОС=трет-бутоксикарбонил.- 27013408 Спектры ЯМР соединений примеров 26-58 табл. III представлены в табл. III'. Таблица III' Пример 59. 3-(3-Метокси-4-нитробензоил)имидазо[1,5-а]пиридин-6-карбоксамид. К 0,346 г (1,01 ммоль) 3-(3-метокси-4-нитробензоил)имидазо[1,5-а]пиридин-6-карбоновой кислоты,полученной в примере 182, в 10 мл N,N-диметилформамида добавляют 0,16 мл (1,12 ммоль) триэтиламина, затем 0,49 г (1,12 ммоль) ВОР. Реакционную среду перемешивают в течение 30 мин при комнатной температуре, затем добавляют 1,35 мл 1 н. аммиачного раствора в тетрагидрофуран и перемешивают при комнатной температуре в течение 18 ч. Образовавшийся осадок фильтруют, затем промывают водой. Получают 0,25 г твердого вещества желтого цвета. Температура плавления: 289 С. 1 Н ЯМР (ДМСО-d6) 4,02 (3 Н, с); 7,82 (1 Н, д); 7,98 (1 Н, с); 8,06-8,10 (3 Н, м); 8,15 (1 Н, с); 10,21 (1 Н, с). Примеры 60-69. Работая согласно способу, описанному в примере 59, получают соединения общей формулы (Iu),приведенные в табл. IV, путем сочетания пептидного типа 3-(3-метокси-4-нитробензоил)имидазо[1,5 а]пиридин-6-карбоновой кислоты,полученной в примере 182,или 3-(3-метокси-4 нитробензоил)имидазо[1,5-а]пиридин-7-карбоновой кислоты, полученной в примере 184, с аминами или со сложными эфирами аминокислот в присутствии ВОР в качестве агента сочетания. Спектры ЯМР соединений примеров 60-69 табл. IV представлены в табл. IV. Таблица IV Пример 70. 3-(3-Метокси-4-нитробензоил)-N,N-диметилимидазо[1,5-а]пиридин-8-карбоксамид. К 0,318 г (0,88 ммоль) 3-(3-метокси-4-нитробензоил)имидазо[1,5-а]пиридин-8-карбоновой кислоты,полученной в примере 183, в 10 мл дихлорметана добавляют 0,17 мл (2,36 ммоль) тионилхлорида, затем 30 мкл N,N-диметилформамида. Кипятят с обратным холодильником в течение 2 ч. Реакционную среду концентрируют при пониженном давлении. К полученному остатку прибавляют 5 мл 2 н. раствора диметиламина в тетрагидрофуране. После перемешивания в течение 18 ч при комнатной температуре реакционную среду концентрируют при пониженном давлении. Остаток поглощают дихлорметаном. Органическую фазу промывают 1 н. водным раствором хлористо-водородной кислоты, затем насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией с силикагелем, элюируя дихлорметаном, затем смесью дихлорметан-метанол (99-1).
МПК / Метки
МПК: C07D 471/04, A61K 31/437, A61P 9/00, A61P 19/02, A61P 3/04, A61P 29/00, A61P 35/00, A61P 27/02
Метки: содержащие, производные, способ, имидазо[1,5-а]пиридинов, получения, фармацевтические, композиции
Код ссылки
<a href="https://eas.patents.su/30-13408-proizvodnye-imidazo15-apiridinov-sposob-ih-polucheniya-i-soderzhashhie-ih-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Производные имидазо[1,5-а]пиридинов, способ их получения и содержащие их фармацевтические композиции</a>
Предыдущий патент: Отделение загрязнений от полиэфирных материалов
Следующий патент: Фунгицидные водные композиции для протравливания семян
Случайный патент: Кристаллизированный полиэтилентерефталат, содержащий кремний, способ его получения, его применение и способ получения аморфного полиэтилентерефталата












