(аза)индольное производное, замещенное по положению 5, содержащая его фармацевтическая композиция, промежуточные соединения и способ их получения
Номер патента: 20373
Опубликовано: 30.10.2014
Авторы: Драгоне Патриция, Гарофало Барбара, Колетта Изабелла, Фурлотти Гвидо, Мауджери Катерина, Ализи Мария Алессандра, Гарроне Беатриче, Каццолла Никола, Мангано Джорджина
Формула / Реферат
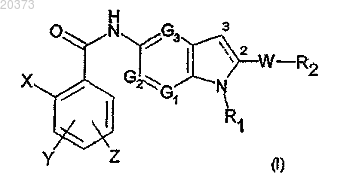
1. (Аза)индольное производное, замещенное по положению 5, формулы (I)
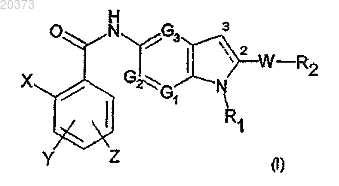
в которой X представляет собой атом галогена или метил, трифторметильную, амино-, циано-, гидроксигруппу;
Y и Z, которые могут быть одинаковыми или различными, представляют собой атом водорода или галогена либо (C1-C3)алкил, трифторметил, нитро, амино, гидрокси, (C1-C3)алкокси;
G1 представляет собой атом азота или группу CH;
G2 представляет собой группу CH;
G3 представляет собой группу CH;
R1 является (C1-C6)алкильной, (C3-C7)циклоалкильной, (C1-C6)алкил-ORI, (CH2)nNRIIRIII, (CH2)nCONRIIRIII, (CH2)nCORI, (CH2)nCOORII, (CH2)nOCORI, SO2RI, (CH2)nNRIISO2RI, (CH2)nSO2RI группой, необязательно замещенной 1-3 гидроксигруппами, где n равно целому числу от 1 до 6, RI является (C1-C3)алкильной или (C1-C3)алкил-OH группой и RII и RIII, которые могут быть одинаковыми или различными, являются атомом водорода или метилом;
W является s-связью или (C1-C6)алкильной, O(C1-C6)алкильной, C(O)NH, (CH2)pCO(CH2)q или (CH2)pC(OH)(CH2)q группой, где р и q, которые могут быть одинаковыми или различными, являются целым числом от 0 до 3;
R2 является фенильной, пиридиновой или (С3-С7)циклоалкильной группой, необязательно замещенной 1-3 заместителями, которые могут быть одинаковыми или различными, представленными группой L-M, где L является s-связью или (C1-C6)алкильной, O(C1-C6)алкильной группой и М является атомом водорода или галогена либо ОН, CF3, NO2, CN, COORII, SO2NHRII, NRIIRIII, SO2RIV, NHSO2RIV группой, где RII и RIII, которые могут быть одинаковыми или различными, определены выше и RIV и RV, которые могут быть одинаковыми или различными, являются (C1-С3)алкильной группой,
при условии, что, когда G1, G2 и G3 все являются группой CH, R1 является (C1-C6)алкильной или (C3-C7)циклоалкильной группой, необязательно замещенной 1-3 гидроксигруппами, W является s-связью и связь между атомами углерода в положении 2 и 3 является двойной связью, R2 не является фенильной или пиридиновой группой, необязательно замещенной 1-3 заместителями, которые могут быть одинаковыми или различными, выбранными из галогена, (C1-C6)алкила, необязательно замещенного гидроксигруппой, трифторметила, нитро, амино, ди(C1-C3)алкиламино, гидрокси, (C1-С3)алкокси, COOH, COORII, SO2CH3, SO2NHCH3, NHSO2CH3 и (Cl-C6)алкил-COOH, и
при условии, что, когда G1 представляет собой N и G2 и G3 являются группой CH, R2 не является двухвалентной ароматической группой, замещенной одной группой L-M, представленной O(C1-C6)алкильной группой;
и его физиологически приемлемые соли присоединения, стереоизомеры, энантиомеры, сольваты.
2. (Аза)индольное производное по п.1 в форме сольвата, которое представляет собой гидрат.
3. (Аза)индольное производное по п.1, где X выбирают из брома, хлора, фтора, метила, трифторметила и циано.
4. (Аза)индольное производное по п.1, где X выбирают из брома, хлора и трифторметила.
5. (Аза)индольное производное по п.1, где Y и Z, которые могут быть одинаковыми или различными, выбирают из водорода, брома, хлора, фтора, нитро, (C1-C3)алкила, трифторметила и (C1-С3)алкокси.
6. (Аза)индольное производное по п.1, где Y и Z, которые могут быть одинаковыми или различными, выбирают из водорода, брома, хлора, трифторметила, нитро, метила, этила, метокси и этокси.
7. (Аза)индольное производное по п.1, где R1 выбирают из (С1-С3)алкильной, (C1-C6)алкил-ORI, (CH2)nNRIIRIII, (CH2)nCONRIIRIII, (CH2)nCORI, (CH2)nCOORII, (CH2)nOCORI, SO2RI, (CH2)nNRIISO2RI, (CH2)nSO2RI группы, необязательно замещенной 1-3 гидроксигруппами, где n равно целому числу от 1 до 4, RI является (C1-C3)алкильной или (C1-C3)алкил-OH группой и RII и RIII, которые могут быть одинаковыми или различными, являются атомом водорода или метилом.
8. (Аза)индольное производное по п.1, где R1 выбирают из (C1-C3)алкильной, (C1-C6)алкил-ORI, (CH2)nCONRIIRIII, (CH2)nCORI, (CH2)nCOORII, (CH2)nOCORI, SO2RI, (CH2)nNRIISO2RI, (CH2)nSO2RI группы, необязательно замещенной 1-3 гидроксигруппами, где n равно целому числу от 1 до 3, RI является СН3, С2Н5, СН2ОН, С2Н4ОН группой и RII и RIII, которые могут быть одинаковыми или различными, являются атомом водорода или СН3 группой.
9. (Аза)индольное производное по п.1, где W выбирают из s-связи или (C1-C3)алкильной, O(C1-C3)алкильной, C(O)NH, (CH2)pCO(CH2)q или (CH2)pC(OH)(CH2)q группы, где р и q, которые могут быть одинаковыми или различными, являются целым числом от 1 до 3.
10. (Аза)индольное производное по п.1, где W выбирают из s-связи или СН2, С2Н4, ОСН2, ОС2Н4, C(O)NH, (CH2)pCO(CH2)q или (CH2)pC(OH)(CH2)q группы, где р и q, которые могут быть одинаковыми или различными, являются целым числом от 1 до 2.
11. (Аза)индольное производное по п.1, где R2 выбирают из фенильной, пиридиновой или (C3-C7)циклоалкильной группы, необязательно замещенной 1-2 заместителями, которые могут быть одинаковыми или различными, представленными группой L-M, где L является s-связью или (C1-C3)алкильной, O(C1-C3)алкильной группой и М является атомом водорода или галогена либо CF3, CN, COORII, SO2NHRII, NRIIRIII, SO2RIV или NHSO2RIV группой, где RII и RIII, которые могут быть одинаковыми или различными, являются атомом водорода или (C1-C3)алкильной группой и RIV и RV, которые могут быть одинаковыми или различными, являются (C1-C3)алкильной группой.
12. (Аза)индольное производное по п.1, где R2 выбирают из фенильной, пиридиновой или (C3-C7)циклоалкильной группы, необязательно замещенной 1 заместителем, представленным группой L-M, где L является s-связью или СН2, С2Н4, ОСН2, ОС2Н4 группой и М является атомом водорода или галогена либо CF3, CN, COORII, SO2NHRII, NRIIRIII, SO2RIV, NHSO2RIV группой, где RII и RIII, которые могут быть одинаковыми или различными, являются атомом водорода или СН3, С2Н5 группой и RIV и RV, которые могут быть одинаковыми или различными, являются СН3 или С2Н5 группой.
13. (Аза)индольное производное по п.1, где W является s-связью или СН2 или С2Н4 группой и R2 представляет собой фенильную группу, необязательно замещенную 1-3 заместителями, которые могут быть одинаковыми или различными, выбранными из атома Br, Cl и F, CH3, C2H5, OCH3, OC2H5, CN и CH2CN группы.
14. (Аза)индольное производное по п.1, где W является s-связью или СН2 или С2Н4 группой и R2 является пиридиновой группой, необязательно замещенной 1-3 заместителями, которые могут быть одинаковыми или различными, выбранными из атома Br, Cl и F, СН3, С2Н5, ОСН3, ОС2Н5, CN и CH2CN группы.
15. (Аза)индольное производное по п.1, где W является s-связью или СН2 или С2Н4 группой и R2 является циклогексильной группой, необязательно замещенной 1-3 заместителями, которые могут быть одинаковыми или различными, выбранными из атома Br, Cl и F, СН3, С2Н5, ОСН3, ОС2Н5, CN и CH2CN группы.
16. Способ получения (аза)индольного производного, замещенного по положению 5, формулы (I)
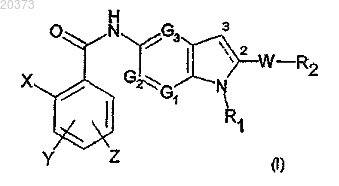
в которой X представляет собой атом галогена или метил, трифторметильную, амино-, циано-, гидроксигруппу;
Y и Z, которые могут быть одинаковыми или различными, представляют собой атом водорода или галогена либо (C1-C3)алкил, трифторметил, нитро, амино, гидрокси, (C1-C3)алкокси;
G1 представляет собой атом азота или группу CH;
G2 представляет собой группу CH;
G3 представляет собой группу СН;
R1 является (C1-C6)алкильной, (C3-C7)циклоалкильной, (C1-C6)алкил-ORI, (CH2)nNRIIRIII, (CH2)nCONRIIRIII, (CH2)nCORI, (CH2)nCOORII, (CH2)nOCORI, SO2RI, (CH2)nNRIISO2RI, (CH2)nSO2RI группой, необязательно замещенной 1-3 гидроксигруппами, где n равно целому числу от 1 до 6, RI является (C1-C3)алкильной или (C1-С3)алкил-OH группой и RII и RIII, которые могут быть одинаковыми или различными, являются атомом водорода или (C1-C3)алкильной группой;
W является s-связью или (C1-C6)алкильной, O(C1-C6)алкильной, C(O)NH, (CH2)pCO(CH2)q или (CH2)pC(OH)(CH2)q группой, где р и q, которые могут быть одинаковыми или различными, являются целым числом от 0 до 3;
R2 является фенильной, пиридиновой или (С3-С7)циклоалкильной группой, необязательно замещенной 1-3 заместителями, которые могут быть одинаковыми или различными, представленными группой L-M, где L является s-связью или (C1-C6)алкильной, O(C1-C6)алкильной группой и М является атомом водорода или галогена или ОН, CF3, NO2, CN, COORII, SO2NHRII, NRIIRIII, SO2RIV, NHSO2RIV группой, где RII и RIII, которые могут быть одинаковыми или различными, определены выше и RIV и RV, которые могут быть одинаковыми или различными, являются (C1-С3)алкильной группой,
при условии, что, когда G1, G2 и G3 все являются группой CH, R1 является (C1-C6)алкильной или (C3-C7)циклоалкильной группой, необязательно замещенной 1-3 гидроксигруппами, W является s-связью и связь между атомами углерода в положении 2 и 3 является двойной связью, R2 не является фенильной или пиридиновой группой, необязательно замещенной 1-3 заместителями, которые могут быть одинаковыми или различными, выбранными из галогена, (C1-C6)алкила, необязательно замещенного гидроксигруппой, трифторметила, нитро, амино, ди(C1-C3)алкиламино, гидрокси, (C1-С3)алкокси, COOH, COORII, SO2CH3, SO2NHCH3, NHSO2CH3 и (Cl-C6)алкил-COOH, и
при условии, что, когда G1 представляет собой N и G2 и G3 являются группой CH, R2 не является двухвалентной ароматической группой, замещенной одной группой L-M, представленной O(C1-C6)алкильной группой;
и его физиологически приемлемых солей присоединения, стереоизомеров, энантиомеров, сольватов,
характеризующийся:
а) взаимодействием соединения формулы (II)
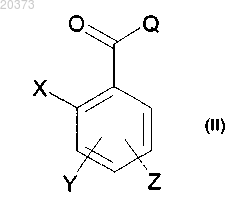
в которой X, Y и Z определены выше и
Q представляет собой атом галогена или гидроксигруппу,
с соединением формулы (III)
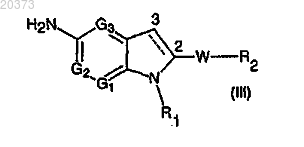
в которой G1, G2, G3, R1, W и R2 определены выше,
с получением соединения формулы (I)
в которой X, Y, Z, G1, G2, G3, R1, R2 и W определены выше; и
b) формированием, в случае необходимости, физиологически приемлемой соли соединения формулы (I) со стадии а).
17. Способ получения (аза)индольного производного по п.16, в котором (аза)индольное производное, замещенное по положению 5, формулы (I) в форме сольвата представляет собой гидрат.
18. Способ по п.16, отличающийся тем, что стадию а) осуществляют путем взаимодействия соединения формулы (II), в которой Q представляет собой Cl, с амином формулы (III) в присутствии подходящего связывающего кислоту соединения.
19. Способ по п.16, отличающийся тем, что стадию а) осуществляют путем взаимодействия соединения формулы (II), в которой Q представляет собой ОН, с амином формулы (III) в присутствии подходящего конденсирующего агента.
20. Способ по п.16, отличающийся тем, что стадию а) осуществляют в твердой фазе, содержащей соединение формулы (III), связанное с препаративной смолой.
21. Способ по п.20, отличающийся тем, что препаративная смола является альдегидной смолой.
22. Способ по любому из пп.20 и 21, отличающийся тем, что способ дополнительно включает стадию расщепления для удаления соединения формулы (I) с указанной смолы.
23. Способ по п.22, отличающийся тем, что стадию расщепления осуществляют путем обработки трифторуксусной кислотой.
24. Способ по п.16, отличающийся тем, что способ дополнительно включает стадию восстановления для превращения двойной связи между положением 2 и 3 в одинарную связь.
25. Способ по п.24, отличающийся тем, что стадию восстановления осуществляют путем обработки восстанавливающим агентом в присутствии сильной кислоты.
26. Способ по п.16, отличающийся тем, что, когда группа R1 представляет собой (CH2)nCOORII группу, где RII является алкильной группой, способ дополнительно включает стадию гидролиза с получением соответствующей кислоты.
27. Способ по п.26, отличающийся тем, что стадию гидролиза осуществляют в присутствии сильной кислоты.
28. Промежуточное соединение формулы (III)

где G1 представляет собой атом азота или группу CH;
G2 представляет собой группу СН;
G3 представляет собой группу СН;
R1 является (C1-C6)алкильной, (C3-C7)циклоалкильной, (C1-C6)алкил-ORI, (CH2)nCONRIIRIII, (CH2)nCORI, (CH2)nCOORII, (CH2)nOCORI, SO2RI, (CH2)nNRIISO2RI, (CH2)nSO2RI группой, необязательно замещенной 1-3 гидроксигруппами, где n равно целому числу от 1 до 6, RI является (C1-C3)алкильной или (C1-C3)алкил-OH группой и RII и RIII, которые могут быть одинаковыми или различными, являются атомом водорода или метильной группой;
W является s-связью или (C1-C6)алкильной, O(C1-C6)алкильной, C(O)NH, (CH2)pCO(CH2)q или (CH2)pC(OH)(CH2)q группой, где р и q, которые могут быть одинаковыми или различными, являются целым числом от 0 до 3;
R2 является фенильной, пиридиновой или циклогексильной группой, необязательно замещенной 1-3 заместителями, которые могут быть одинаковыми или различными, представленными группой L-M, где L является s-связью или (C1-C6)алкильной, O(C1-C6)алкильной группой и М является атомом водорода или галогена либо ОН, CF3, NO2, CN, COORII, SO2NHRII, NRIIRIII, SO2RIV, NHSO2RIV группой, где RII и RIII, которые могут быть одинаковыми или различными, определены выше и RIV и RV, которые могут быть одинаковыми или различными, являются (C1-C3)алкильной группой,
при условии, что, когда G1, G2 и G3 все являются группой CH, R1 является (C1-C6)алкильной или (C3-C7)циклоалкильной группой, необязательно замещенной 1-3 гидроксигруппами, W является s-связью и связь между атомами углерода в положении 2 и 3 является двойной связью, R2 не является фенильной или пиридиновой группой, необязательно замещенной 1-3 заместителями, которые могут быть одинаковыми или различными, выбранными из галогена, (C1-C6)алкила, необязательно замещенного гидроксигруппой, трифторметила, нитро, амино, ди(C1-C3)алкиламино, гидрокси, (C1-С3)алкокси, COOH, COORII, SO2CH3, SO2NHCH3, NHSO2CH3, (C1-C6)алкил-COOH, и
при условии, что, когда G1 представляет собой N и G2 и G3 являются группой CH, R2 не является двухвалентной ароматической группой, замещенной одной группой L-M, представленной O(C1-C6)алкильной группой.
29. Промежуточное соединение по п.28, отличающееся тем, что R1 имеет значения, определенные в любом из пп.7 или 8.
30. Промежуточное соединение по п.28, отличающееся тем, что W имеет значения, определенные в любом из пп.9 или 10.
31. Промежуточное соединение по п.28, отличающееся тем, что R2 выбран из фенильной, пиридиновой или циклогексильной группы, необязательно замещенной 1-2 заместителями, которые могут быть одинаковыми или различными, представленными группой L-M, где L является s-связью или (C1-C3)алкильной, O(C1-C3)алкильной группой и М является атомом водорода или галогена либо CF3, CN, COORII, SO2NHRII, NRIIRIII, SO2RIV, NHSO2RIV группой, где RII и RIII, которые могут быть одинаковыми или различными, представляют собой атом водорода или метил и RIV и RV, которые могут быть одинаковыми или различными, являются (C1-C3)алкильной группой.
32. Промежуточное соединение по п.28, отличающееся тем, что R2 выбран из фенильной, пиридиновой или циклогексильной группы, необязательно замещенной 1 заместителем, представленным группой L-M, где L является s-связью или СН2, С2Н4, ОСН2, ОС2Н4 группой и М является атомом водорода или галогена или CF3, CN, COORII, SO2NHRII, NRIIRIII, SO2RIV, NHSO2RIV группой, где RII и RIII, которые могут быть одинаковыми или различными, представляют собой атом водорода или СН3 группу и RIV и RV, которые могут быть одинаковыми или различными, представляют собой СН3 или С2Н5 группу.
33. Промежуточное соединение по п.28, отличающееся тем, что W и R2 имеют значения, определенные в любом из пп.13-15.
34. Фармацевтическая композиция, предназначенная для лечения или предотвращения расстройств, связанных с продуцированием простагландина Е2 (PGE2), выбранных из воспалительных процессов, боли, опухолей, нейродегенеративных расстройств и атеросклероза, содержащая эффективное количество (аза)индольного производного, замещенного по положению 5, формулы (I)

в которой X представляет собой атом галогена или метил, трифторметильную, амино-, циано-, гидроксигруппу;
Y и Z, которые могут быть одинаковыми или различными, представляют собой атом водорода или галогена либо (C1-C3)алкил, трифторметил, нитро, амино, гидрокси, (C1-C3)алкокси;
G1 представляет собой атом азота или группу CH;
G2 представляет собой группу CH;
G3 представляет собой группу СН;
R1 является (C1-C6)алкильной, (C3-C7)циклоалкильной, (C1-C6)алкил-ORI, (CH2)nNRIIRIII, (CH2)nCONRIIRIII, (CH2)nCORI, (CH2)nCOORII, (CH2)nOCORI, SO2RI, (CH2)nNRIISO2RI, (CH2)nSO2RI группой, необязательно замещенной 1-3 гидроксигруппами, где n равно целому числу от 1 до 6, RI является (C1-C3)алкильной или (C1-С3)алкил-OH группой и RII и RIII, которые могут быть одинаковыми или различными, являются атомом водорода или метилом;
W является s-связью или (C1-C6)алкильной, O(C1-C6)алкильной, C(O)NH, (CH2)pCO(CH2)q или (CH2)pC(OH)(CH2)q группой, где р и q, которые могут быть одинаковыми или различными, являются целым числом от 0 до 3;
R2 является фенильной, пиридиновой или (С3-С7)циклоалкильной группой, необязательно замещенной 1-3 заместителями, которые могут быть одинаковыми или различными, представленными группой L-M, где L является s-связью или (C1-C6)алкильной, O(C1-C6)алкильной группой и М является атомом водорода или галогена либо ОН, CF3, NO2, CN, COORII, SO2NHRII, NRIIRIII, SO2RIV, NHSO2RIV группой, где RII и RIII, которые могут быть одинаковыми или различными, определены выше и RIV и RV, которые могут быть одинаковыми или различными, являются (C1-С3)алкильной группой,
при условии, что, когда G1, G2 и G3 все являются группой CH, R1 является (C1-C6)алкильной или (C3-C7)циклоалкильной группой, необязательно замещенной 1-3 гидроксигруппами, W является s-связью и связь между атомами углерода в положении 2 и 3 является двойной связью, R2 не является фенильной или пиридиновой группой, необязательно замещенной 1-3 заместителями, которые могут быть одинаковыми или различными, выбранными из галогена, (C1-C6)алкила, необязательно замещенного гидроксигруппой, трифторметила, нитро, амино, ди(C1-C3)алкиламино, гидрокси, (C1-С3)алкокси, COOH, COORII, SO2CH3, SO2NHCH3, NHSO2CH3 и (Cl-C6)алкил-COOH, и
при условии, что, когда G1 представляет собой N и G2 и G3 являются группой CH, R2 не является двухвалентной ароматической группой, замещенной одной группой L-M, представленной O(C1-C6)алкильной группой;
и его физиологически приемлемой соли присоединения, стереоизомеров, энантиомеров, сольватов;
и по меньшей мере один фармацевтически приемлемый инертный компонент.
35. Фармацевтическая композиция по п.34, в которой (аза)индольное производное, замещенное по положению 5, формулы (I) в форме сольвата представляет собой гидрат.
Текст
(АЗА)ИНДОЛЬНОЕ ПРОИЗВОДНОЕ, ЗАМЕЩЕННОЕ ПО ПОЛОЖЕНИЮ 5,СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ И СПОСОБ ИХ ПОЛУЧЕНИЯ(Аза)индольное производное, замещенное по положению 5, формулы (I), в которой X, Y, Z, G1,G2, G3, R1, W и R2 имеют значение, указанное в описании, содержащая его фармацевтическая композиция, а также промежуточные соединения и способ их получения.(71)(73) Заявитель и патентовладелец: АЦЬЕНДЕ КИМИКЕ РЬЮНИТЕ АНДЖЕЛИНИ ФРАНЧЕСКО А.К.P.A.Ф. С.П.А. (IT) 020373 Настоящее изобретение относится к (аза)индольному производному, замещенному по положению 5, содержащей его фармацевтической композиции, промежуточным соединениям и способу их получения. Более конкретно, настоящее изобретение относится к (аза)индольному производному, замещенному по положению 5, которое обладает ингибирующей активностью в отношении mPGES-1. Известно, что простагландины (PG) синтезируются в результате окисления жирных кислот и выделяются во внеклеточное пространство и затем в плазму, мочу и другие биологические жидкости. Они являются важными биорегуляторами, а также медиаторами воспаления, которые модулируют внутриклеточные реакции и коммуникацию между клетками. Простагландины Е 2 (PGE2) выполняют важную физиологическую роль в регулировании почечной функции, сосудистого гомеостаза, ремоделирования кости, развития лихорадки, функции желудочнокишечного тракта и беременности. Помимо данных физиологических функций простагландины PGE2 ведут себя как сильные медиаторы острого воспаления (индуцируя гипералгезию, расширение сосудов и выход жидкости из сосудов: Vane J.R. and Botting R.M. 1997 "Anti-inflammatory drugs and their mechanismof action", Inflamm. Res., 47 (2): p. 78) и хронического воспаления. В частности, простагландины PGE2 образуются в особенно большом количестве при патологиях воспаления суставов. Простагландины PGE2 также играют определенную роль при боли и являются сильными гипертермическими агентами (AyoubR1104-R1117). Ферментом, ответственным за синтез простагландинов PGE2, является простагландин Е-синтаза(PGES), который превращает эндопероксид PGH2, образованный из арахидоновой кислоты при действии циклооксигеназ, в PGE2. Активность PGES обнаружена как в цитозольной фракции, так и в мембраносвязанной у различных типов клеток. Было идентифицировано три формы фермента (Kudo I. et al. 2005 "Prostaglandin E synthase, a terminal enzyme for prostaglandin E2 biosynthesis", Journal of Biochemistry and Molecular Biology, 38, 633-638); среди них микросомальная PGES-1 (mPGES-1) представляет собой мембраносвязанный фермент, который нуждается в глутатионе в качестве необходимого кофактора для его активности. Экспрессия mPGES-1 индуцируется провоспалительным стимулом, таким как IL-1 или LPS (Proc.Natl. Acad. Sci., 96: 7220, 1999). Она вместе с СОХ-2 располагается в эндоплазматическом ретикулуме и на ядерной оболочке (Lazarus M. et al. 2002 "Biochemical characterization of mouse microsomal prostaglandin E synthase-1 and its colocalization with cyclooxygenase-2 in peritoneal macrophages", Arch. Biochem. Biophys., 397: 336; Murakami M. et al. 2000 "Regulation of prostaglandin E2 biosynthesis by induciblecyclooxygenase-2 in brain endothelial cells of rats during endotoxin-induced fever", J. Neurosci. 15; 21 (8): 2669-77). Хотя два фермента (СОХ-2 и mPGES-1) функционально связаны и совместно экспрессируются,скорость их активации различна в нескольких клеточных системах, указывая на различие в регуляторных механизмах индукции (J. Immunol., 167: 469, 2001). Было показано, что лекарственные средства, которые ингибируют фермент СОХ-2, являются эффективными при уменьшении воспаления и боли при хронических болевых патологиях, таких как артрит, но их длительное применение может индуцировать повреждение тканей, вызванное избыточной продукцией цитокинов, например TNF- и IL-1 (Stichtenoth D.O. 2001 "Microsomal prostaglandin E synthase is regulated by proinflammatory cytokines and glucocorticoids in primary rheumatoid synovial cells", J.Immunol., 167: 469). Кроме того, длительному применению данных лекарственных средств сопутствуют побочные действия на сердечно-сосудистую систему. Это привело к изъятию из продажи ряда селективных ингибиторов СОХ-2 и пересмотру показаний для всего класса данных лекарственных средств. Последние исследования направлены на преодоление побочных эффектов ингибиторов СОХ-2 посредством исследования ингибиторов mPGES-1 с целью разработки лекарственных средств, которые являются эффективными при лечении воспаления и боли (В. Samuelsson et al. "Membrane Prostaglandin ESynthase-1: A Novel Therapeutic Target", Pharmacol. Rev., 59:207-224, 2007). Кроме того, многочисленные исследования демонстрируют, что простагландины PGE2 являются факторами, стимулирующими образование опухолей (L.R. Howe, "Inflammation and breast cancer. Cyclooxygenase/prostaglandin signaling and breast cancer", Breast cancer research, 2007, 9: 210, Castellone M.D.glioma cells", J. Neurosurgery, 104(4), 574-582), которые вовлечены в функции ангиогенеза, пролиферации клеток и миграции клеток. Также было обнаружено, что селективные ингибиторы FANS и СОХ-2 ингибируют различные типы опухолей, включая опухоли прямой кишки, пищевода, молочной железы, легко-1 020373 го и мочевого пузыря, посредством ингибирования PGE2. Простагландины PGE2, получаемые с помощью СОХ-2, индуцируют рост опухоли посредством связывания с существующими рецепторами и инициирования сигналов, касающихся контролирования клеточной пролиферации, миграции, апоптоза и ангиогенеза (Wang D. et al. 2006 "Prostaglandin and cancer", Gut. 55(1): 115-22; Han С. et al. 2006 "Prostaglandin E2receptor EP1 transactivates EGFR/MET receptor tyrosine kinases and enhances invasiveness in human hepatocellular carcinoma cells", Journal of Cellular Physiology, 207: 261-270). Были обнаружены (аза)индольные производные, замещенные по положению 5, которые обладают селективной ингибирующей активностью в отношении mPGES-1. Формулировка "(аза)индольное производное" предназначена для определения соединения формулы (I) здесь далее, где в исходной центральной части, представленной индольным кольцом, один или несколько атомов углерода в положении 4, 6 и 7 могут быть заменены на атом азота и может быть одинарная или двойная связь между атомами углерода в положении 2 и 3. В одном аспекте настоящее изобретение относится к (аза)индольным производным, замещенным по положению 5, формулы (I) в которой X представляет собой атом галогена или метил, трифторметильную, амино-, циано-, гидроксигруппу;Y и Z, которые могут быть одинаковыми или различными, представляют собой атом водорода или галогена либо (C1-C3)алкил, трифторметил, нитро, амино, гидрокси, (C1-C3)алкокси;G1 представляет собой атом азота или группу CH;G2 представляет собой группу CH;G3 представляет собой группу CH;R1 является (C1-C6)алкильной, (C3-C7)циклоалкильной, (C1-C6)алкил-ORI, (CH2)nNRIIRIII,(СН 2)nCONRIIRIII, (CH2)nCORI, (CH2)nCOORII, (CH2)nOCORI, SO2RI, (CH2)nNRIISO2RI, (CH2)nSO2RI группой, необязательно замещенной 1-3 гидроксигруппами, где n равно целому числу от 1 до 6, RI является(C1-C3)алкильной или (C1-C3)алкил-ОН группой и RII и RIII, которые могут быть одинаковыми или различными, являются атомом водорода или метилом;(CH2)pC(OH)(CH2)q группой, где р и q, которые могут быть одинаковыми или различными, являются целым числом от 0 до 3;R2 является фенильной, пиридиновой или (C3-C7)циклоалкильной группой, необязательно замещенной 1-3 заместителями, которые могут быть одинаковыми или различными, представленными группой LM, где L является -связью или (C1-C6)алкильной, O(C1-C6)алкильной группой и М является атомом водорода или галогена или ОН, CF3, NO2, CN, COORII, SO2NHRII, NRIIRIII, SO2RIV, NHSO2RIV группой, гдеRII и RIII, которые могут быть одинаковыми или различными, определены выше и RIV и RV, которые могут быть одинаковыми или различными, являются (C1-С 3)алкильной группой,при условии, что, когда G1, G2 и G3 все являются группой CH, R1 является (C1-C6)алкильной или(C3-C7)циклоалкильной группой, необязательно замещенной 1-3 гидроксигруппами, W является -связью и связь между атомами углерода в положении 2 и 3 является двойной связью, R2 не является фенильной или пиридиновой группой, необязательно замещенной 1-3 заместителями, которые могут быть одинаковыми или различными, выбранными из галогена, (C1-C6)алкила, необязательно замещенного гидроксигруппой, трифторметила, нитро, амино, ди(C1-C3)алкиламино, гидрокси, (C1-C3)алкокси, COOH, COORII,SO2CH3, SO2NHCH3, NHSO2CH3 и (C1-C6)алкил-COOH, и при условии, что, когда G1 представляет собой N и G2 и G3 являются группой CH, R2 не является двухвалентной ароматической группой, замещенной одной группой L-M, представленной O(C1C6)алкильной группой; и их физиологически приемлемым солям присоединения, стереоизомерам, энантиомерам, сольватам. Предпочтительно указанное выше (аза)индольное производное формулы (I) представлено в форме сольвата, который представляет собой гидрат. В предпочтительном аспекте настоящее изобретение относится к (аза)индольному производному формулы (I), где X выбирают из брома, хлора, фтора, метила, трифторметила и циано, наиболее предпочтительно из брома, хлора и трифторметила. В предпочтительном аспекте настоящее изобретение относится к (аза)индольному производному-2 020373 формулы (I), где Y и Z, которые могут быть одинаковыми или различными, выбирают из водорода, брома, хлора, фтора, нитро, (C1-C3)алкила, трифторметила и (C1-С 3)алкокси. В предпочтительном аспекте настоящее изобретение относится к (аза)индольному производному формулы (I), где Y и Z, которые могут быть одинаковыми или различными, выбирают из водорода, брома, хлора, трифторметила, нитро, метила, этила, метокси и этокси. В предпочтительном аспекте настоящее изобретение относится к (аза)индольному производному формулы (I), где R1 выбирают из (C1-C3)алкильной, (C1-C6)алкил-ORI, (CH2)nNRIIRIII, (CH2)nCONRIIRIII,(CH2)nCORI, (CH2)nCOORII, (CH2)nOCORI, SO2RI, (CH2)nNRIISO2RI, (CH2)nSO2RI группы, необязательно замещенной 1-3 гидроксигруппами, где n равно целому числу от 1 до 4, RI является (C1-C3)алкильной или(C1-C3)алкил-OH группой и RII и RIII, которые могут быть одинаковыми или различными, являются атомом водорода или метилом. В предпочтительном аспекте настоящее изобретение относится к (аза)индольному производному формулы (I), где R1 выбирают из (C1-C3)алкильной, (C1-C6)алкил-ORI, (CH2)nCONRIIRIII, (CH2)nCORI,(CH2)nCOORII, (CH2)nOCORI, SO2RI, (CH2)nNRIISO2RI, (CH2)nSO2RI группы, необязательно замещенной 1-3 гидроксигруппами, где n равно целому числу от 1 до 3, R1 является СН 3, С 2 Н 5, СН 2 ОН, С 2 Н 4 ОН группой и RII и RIII, которые могут быть одинаковыми или различными, являются атомом водорода или СН 3 группой. В предпочтительном аспекте настоящее изобретение относится к (аза)индольному производному формулы (I), где W выбирают из -связи или (C1-C3)алкильной, O(C1-C3)алкильной, C(O)NH,(CH2)pCO(CH2)q или (CH2)pC(OH)(CH2)q группы, где р и q, которые могут быть одинаковыми или различными, являются целым числом от 1 до 3. В предпочтительном аспекте настоящее изобретение относится к (аза)индольному производному формулы (I), где W выбирают из -связи или СН 2, С 2 Н 4, ОСН 2, ОС 2 Н 4, C(O)NH, (CH2)pCO(CH2)q или(CH2)pC(OH)(CH2)q группы, где р и q, которые могут быть одинаковыми или различными, являются целым числом от 1 до 2. В предпочтительном аспекте настоящее изобретение относится к (аза)индольному производному формулы (I), где R2 выбирают из фенильной, пиридиновой или (C3-C7)циклоалкильной группы, необязательно замещенной 1-2 заместителями, которые могут быть одинаковыми или различными, представленными группой L-M, где L является -связью или (C1-C3)алкильной, O(C1-C3)алкильной группой и М является атомом водорода или галогена или CF3, CN, COORII, SO2NHRII, NRIIRIII, SO2RIV или NHSO2RIV группой, где RII и RIII, которые могут быть одинаковыми или различными, являются атомом водорода или (C1-C3)алкильной группой и RIV и RV, которые могут быть одинаковыми или различными, являются(C1-C3)алкильной группой. В предпочтительном аспекте настоящее изобретение относится к (аза)индольному производному формулы (I), где R2 выбирают из фенильной, пиридиновой или (C3-C7)циклоалкильной группы, необязательно замещенной 1 заместителем, представленным группой L-M, где L является -связью или СН 2,С 2 Н 4, ОСН 2, ОС 2 Н 4 группой и М является атомом водорода или галогена или CF3, CN, COORII, SO2NHRII,NRIIRIII, SO2RIV, NHSO2RIV группой, где RII и RIII, которые могут быть одинаковыми или различными,являются атомом водорода или СН 3, С 2 Н 5 группой и RIV и RV, которые могут быть одинаковыми или различными, являются СН 3 или С 2 Н 5 группой. В предпочтительном аспекте настоящее изобретение относится к (аза)индольному производному формулы (I), где W является -связью или СН 2 или С 2 Н 4 группой и R2 представляет собой фенильную группу, необязательно замещенную 1-3 заместителями, которые могут быть одинаковыми или различными, выбранными из атома Br, Cl и F, CH3, C2H5, OCH3, OC2H5, CN и CH2CN группы. В предпочтительном аспекте настоящее изобретение относится к (аза)индольному производному формулы (I), где W является -связью или СН 2 или С 2 Н 4 группой и R2 является пиридиновой группой,необязательно замещенной 1-3 заместителями, которые могут быть одинаковыми или различными, выбранными из атома Br, Cl и F, СН 3, С 2 Н 5, ОСН 3, ОС 2 Н 5, CN и CH2CN группы. В предпочтительном аспекте настоящее изобретение относится к (аза)индольному производному формулы (I), где W является -связью или СН 2 или С 2 Н 4 группой и R2 является циклогексильной группой, необязательно замещенной 1-3 заместителями, которые могут быть одинаковыми или различными,выбранными из атома Br, Cl и F, СН 3, С 2 Н 5, ОСН 3, ОС 2 Н 5, CN и CH2CN группы. В другом аспекте настоящее изобретение относится к способу получения (аза)индольного производного, замещенного по положению 5, формулы (I), охарактеризованной выше, где указанный способ включает:-3 020373 а) взаимодействие соединения формулы (II)Q представляет собой атом галогена или гидроксигруппу,с соединением формулы (III) в которой G1, G2, G3, R1, W и R2 определены выше,с получением соединения формулы (I)b) формированием, в случае необходимости, физиологически приемлемой соли соединения формулы (I) со стадии а). В предпочтительном аспекте настоящее изобретение относится к способу получения(аза)индольного производного, в котором (аза)индольное производное, замещенное по положению 5,формулы (I) получают в форме сольвата, который представляет собой гидрат. В предпочтительном аспекте настоящее изобретение относится к способу получения(аза)индольного производного, в котором стадию (а) осуществляют путем взаимодействия соединения формулы (II), в которой Q представляет собой Cl, с амином формулы (III) в присутствии подходящего связывающего кислоту соединения. В предпочтительном аспекте настоящее изобретение относится к способу получения(аза)индольного производного, в котором стадию (а) осуществляют путем взаимодействия соединения формулы (II), в которой Q представляет собой ОН, с амином формулы (III) в присутствии подходящего конденсирующего агента. В предпочтительном аспекте настоящее изобретение относится к способу получения(аза)индольного производного, в котором стадию (а) осуществляют в твердой фазе, содержащей соединение формулы (III), связанное с препаративной смолой. В предпочтительном варианте настоящего способа препаративная смола является альдегидной смолой. В ещ одном предпочтительном варианте способ дополнительно включает стадию расщепления для удаления соединения формулы (I) с указанной смолы. Предпочтительно стадию расщепления осуществляют путем обработки трифторуксусной кислотой. В предпочтительном аспекте настоящее изобретение относится к способу получения(аза)индольного производного, который дополнительно включает стадию восстановления для превращения двойной связи между положением 2 и 3 в одинарную связь. Предпочтительно стадию восстановления осуществляют путем обработки восстанавливающим агентом в присутствии сильной кислоты. В предпочтительном аспекте настоящее изобретение относится к способу получения(аза)индольного производного, согласно которому, когда группа R1 представляет собой (CH2)nCOORII группу, где RII является алкильной группой, способ дополнительно включает стадию гидролиза с получением соответствующей кислоты. Предпочтительно стадию гидролиза осуществляют в присутствии сильной кислоты.-4 020373 Промежуточные соединения формулы (III) являются новыми. Таким образом, ещ одним аспектом настоящего изобретения является промежуточное соединение формулы (III) где G1 представляет собой атом азота или группу CH;G2 представляет собой группу CH;G3 представляет собой группу CH;R1 является (C1-C6)алкильной, (C3-C7)циклоалкильной, (C1-C6)алкил-ORI, (CH2)nCONRIIRIII,(CH2)nCORI, (CH2)nCOORII, (CH2)nOCORI, SO2RI, (CH2)nNRIISO2RI, (CH2)nSO2RI группой, необязательно замещенной 1-3 гидроксигруппами, где n равно целому числу от 1 до 6, RI является (C1-C3)алкильной или(C1-C3)алкилОН группой и RII и RIII, которые могут быть одинаковыми или различными, являются атомом водорода или метильной группой;(CH2)pC(OH)(CH2)q группой, где р и q, которые могут быть одинаковыми или различными, являются целым числом от 0 до 3;R2 является фенильной, пиридиновой или циклогексильной группой, необязательно замещенной 1-3 заместителями, которые могут быть одинаковыми или различными, представленными группой L-M, гдеL является -связью или (C1-C6)алкильной, O(C1-C6)алкильной группой и М является атомом водорода или галогена либо ОН, CF3, NO2, CN, COORII, SO2NHRII, NRIIRIII, SO2RIV, NHSO2RIV группой, где RII иRIII, которые могут быть одинаковыми или различными, определены выше и RIV и RV, которые могут быть одинаковыми или различными, являются (C1-C3)алкильной группой,при условии, что, когда G1, G2 и G3 все являются группой CH, R1 является (C1-C6)алкильной или(C3-C7)циклоалкильной группой, необязательно замещенной 1-3 гидроксигруппами, W является -связью и связь между атомами углерода в положении 2 и 3 является двойной связью, R2 не является фенильной или пиридиновой группой, необязательно замещенной 1-3 заместителями, которые могут быть одинаковыми или различными, выбранными из галогена, (C1-C6)алкила, необязательно замещенного гидроксигруппой, трифторметила, нитро, амино, ди(C1-C3)алкиламино, гидрокси, (C1-С 3)алкокси, COOH, COORII,SO2CH3, SO2NHCH3, NHSO2CH3, (C1-C6)алкил-COOH, и при условии, что, когда G1 представляет собой N и G2 и G3 являются группой CH, R2 не является двухвалентной ароматической группой, замещенной одной группой L-M, представленной O(C1C6)алкильной группой. В предпочтительном варианте настоящее изобретение относится к промежуточному соединению формулы (III), где R1 выбирают из (C1-C3)алкильной, (C1-C6)алкил-ORI, (CH2)nNRIIRIII, (CH2)nCONRIIRIII,(CH2)nCORI, (CH2)nCOORII, (CH2)nOCORI, SO2RI, (CH2)nNRIISO2RI, (CH2)nSO2RI группы, необязательно замещенной 1-3 гидроксигруппами, где n равно целому числу от 1 до 4, RI является (C1-C3)алкильной или(C1-C3)алкил-ОН группой и RII и RIII, которые могут быть одинаковыми или различными, являются атомом водорода или метилом; или где R1 выбирают из (C1-C3)алкильной, (C1-C6)алкил-ORI,(CH2)nCONRIIRIII, (CH2)nCORI, (CH2)nCOORII, (CH2)nOCORI, SO2RI, (CH2)nNRIISO2RI, (CH2)nSO2RI группы,необязательно замещенной 1-3 гидроксигруппами, где n равно целому числу от 1 до 3, RI является СН 3,С 2 Н 5, СН 2 ОН, С 2 Н 4 ОН группой и RII и RIII, которые могут быть одинаковыми или различными, являются атомом водорода или СН 3 группой. В предпочтительном варианте настоящее изобретение относится к промежуточному соединению формулы (III), где W выбирают из -связи или (C1-C3)алкильной, O(C1-C3)алкильной, C(O)NH,(CH2)pCO(CH2)q или (CH2)pC(OH)(CH2)q группы, где р и q, которые могут быть одинаковыми или различными, являются целым числом от 1 до 3; или W выбирают из -связи или СН 2, С 2 Н 4, ОСН 2, ОС 2 Н 4,C(O)NH, (CH2)pCO(CH2)q или (CH2)pC(OH)(CH2)q группы, где р и q, которые могут быть одинаковыми или различными, являются целым числом от 1 до 2. В предпочтительном варианте настоящее изобретение относится к промежуточному соединению формулы (III), где R2 выбран из фенильной, пиридиновой или циклогексильной группы, необязательно замещенной 1-2 заместителями, которые могут быть одинаковыми или различными, представленными группой L-M, где L является -связью или (C1-C3)алкильной, O(C1-C6)алкильной группой и М является атомом водорода или галогена или CF3, CN, COORII, SO2NHRII, NRIIRIII, SO2RIV, NHSO2RIV группой, гдеRII и RIII, которые могут быть одинаковыми или различными, представляют собой атом водорода или метил и RIV и RV, которые могут быть одинаковыми или различными, являются (C1-C3)алкильной группой. В предпочтительном варианте настоящее изобретение относится к промежуточному соединению-5 020373 формулы (III), где R2 выбран из фенильной, пиридиновой или циклогексильной группы, необязательно замещенной 1 заместителем, представленным группой L-M, где L является -связью или СН 2, С 2 Н 4,ОСН 2, ОС 2 Н 4 группой и М является атомом водорода или галогена либо CF3, CN, COORII, SO2NHRII,NRIIRIII, SO2RIV, NHSO2RIV группой, где RII и RIII, которые могут быть одинаковыми или различными,представляют собой атом водорода или СН 3 группу и RIV и RV, которые могут быть одинаковыми или различными, представляют собой СН 3 или С 2 Н 5 группу. В предпочтительном варианте настоящее изобретение относится к промежуточному соединению формулы (III), где W является -связью или СН 2 или С 2 Н 4 группой и R2 представляет собой фенильную группу, необязательно замещенную 1-3 заместителями, которые могут быть одинаковыми или различными, выбранными из атома Br, Cl и F, CH3, C2H5, OCH3, OC2H5, CN и CH2CN группы; или где W является -связью или СН 2 или С 2 Н 4 группой и R2 является пиридиновой группой, необязательно замещенной 1-3 заместителями, которые могут быть одинаковыми или различными, выбранными из атома Br, Cl и F, CH3, C2H5, OCH3, OC2H5, CN и CH2CN группы; или где W является -связью или СН 2 или С 2 Н 4 группой и R2 является циклогексильной группой, необязательно замещенной 1-3 заместителями, которые могут быть одинаковыми или различными, выбранными из атома Br, Cl и F, CH3, C2H5, OCH3, OC2H5, CN и CH2CN группы. Исследования биологических свойств соединения формулы (I) по настоящему изобретению демонстрировали, что оно имеет неожиданное свойство селективно ингибировать mPGES-1 и четко выраженную антиноцицептивную активность в воспалительной боли. Таким образом, ещ одним аспектом настоящего изобретения является фармацевтическая композиция, предназначенная для лечения или предотвращения расстройств, связанных с продуцированием простагландина Е 2 (PGE2), выбранных из воспалительных процессов, боли, опухолей, нейродегенеративных расстройств и атеросклероза, содержащая эффективное количество (аза)индольного производного, замещенного по положению 5, формулы (I), охарактеризованной выше. В предпочтительном варианте (аза)индольное производное, замещенное по положению 5, формулы(I) используют в форме сольвата, который представляет собой гидрат. В данном описании и формуле изобретения термин "эффективное количество" относится к количеству, которое приводит к заметному улучшению по меньшей мере одного симптома или параметра конкретного расстройства. Предпочтительно фармацевтические композиции по настоящему изобретению составляют в виде подходящих лекарственных форм, содержащих эффективную дозу по меньшей мере одного соединения формулы (I) или его физиологически приемлемой соли присоединения, стереоизомера, энантиомера,гидрата, сольвата или полиморфной формы и по меньшей мере один фармацевтически приемлемый инертный ингредиент. Примерами подходящих лекарственных форм являются таблетки, капсулы, покрытые оболочкой таблетки, гранулы, растворы и сиропы для перорального введения; кремы, мази и антисептические пластыри для местного введения; суппозитории для ректального введения и стерильные растворы для введения путем инъекции или в виде аэрозоля или введения через глаз. Лекарственные формы могут также содержать другие традиционные компоненты, например консерванты, стабилизаторы, поверхностно-активные вещества, буферы, соли для регулирования осмотического давления, эмульгаторы, подсластители, красители, ароматические добавки и т.п. Если необходимо для конкретной терапии, фармацевтическая композиция по настоящему изобретению может содержать другие фармакологически активные компоненты, одновременное введение с которыми является полезным. Количество соединения формулы (I) или его физиологически приемлемой соли присоединения,стереоизомера, энантиомера, гидрата, сольвата или полиморфной формы и по меньшей мере одного фармацевтически приемлемого инертного компонента в фармацевтической композиции по настоящему изобретению может варьировать в широком диапазоне в зависимости от известных условий, например типа заболевания, подвергаемого лечению, тяжести заболевания, массы тела пациента, лекарственной формы, выбранного пути введения, количества введений в день и эффективности выбранного соединения формулы (I). Однако оптимальное количество может быть легко и обычным путем определено специалистом в данной области техники. Как правило, количество соединения формулы (I) или его физиологически приемлемой соли присоединения, стереоизомера, энантиомера, гидрата, сольвата или полиморфной формы и по меньшей мере одного фармацевтически приемлемого инертного компонента в фармацевтической композиции по настоящему изобретению будет таким, что оно обеспечит уровень введения между 0,0001 и 100 мг/кг/день и даже более предпочтительно между 0,01 и 10 мг/кг/день. Очевидно нет необходимости, чтобы фармацевтические составы по настоящему изобретению обязательно содержали все количество соединения формулы (I), позднее указанное количество может быть добавлено путем введения некоторого количества доз фармацевтической композиции по настоящему изобретению.-6 020373 Фармацевтические композиции по настоящему изобретению могут быть получены способами, хорошо известными фармацевтам, включая смешивание, гранулирование, прессование, растворение, стерилизацию и тому подобное. Примеры далее служат дополнительной иллюстрацией изобретения, тем не менее без его ограничения. Пример 1. Получение промежуточных соединений. а) 1-Этил-2-(4-метилфенил-1H-пирроло[2,3-b]пиридин-5-амин. К раствору 2-амино-3-бром-5-нитропиридина (1,2 г, 5,5 ммоль) в безводном ТГФ (23 мл) добавляли при перемешивании PdCl2 (52 мг, 0,29 ммоль), 1,1'-бис-(ди-трет-бутилфосфино)ферроцен (D-tBPF, 0,17 г,0,39 ммоль), диизопропиламин (0,81 г, 8,0 ммоль) и CuI (22 мг, 0,11 ммоль). К этой смеси добавляли по каплям в течение 2,25 ч 4-этинилтолуол (1,0 мл, 7,9 ммоль). Полученную таким образом смесь фильтровали в вакууме через Целит, осадок промывали несколько раз с помощью EtOAc. После упаривания растворителя остаток очищали колоночной хроматографией на силикагеле(Et2O/н-гексан, Et2O 3060%) с получением 5-нитро-3-(фенилэтинил)пиридин-2-амина в виде желтого твердого вещества. 1(ВВ' системы АА'ВВ', 2H); 5,85 (ушир.с, 2H), 2,39 (с, 3H). К суспензии трет-бутилата калия (0,41 г, 3,7 ммоль) в безводном ДМФА (5 мл) добавляли по каплям при перемешивании при комнатной температуре раствор 5-нитро-3-(фенилэтинил)пиридин-2-амина (0,70 г, 2,8 ммоль) в ДМФА (25 мл). Через 1,5 дня добавляли йодэтан (0,38 мл, 4,7 ммоль) и все перемешивали дополнительно в течение 1,5 дней. К реакции затем добавляли Н 2 О (50 мл) и EtOAc (100 мл). Смесь выливали в делительную воронку, органический слой отделяли, водный слой тщательно экстрагировали с помощью EtOAc (50 мл) и объединенные органические слои промывали насыщенным раствором соли(2100 мл). Органический растворитель удаляли упариванием при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (Et2O/н-гексан, Et2O 1020%) с получением 1-этил-2(4-метилфенил)-5-нитро-1H-пирроло[2,3-b]пиридин. 1EtOAc/EtOH (абсолютный) = 4:7 (110 мл) гидрировали в атмосфере Н 2 в присутствии 10% Pd(C) (110 мг) в течение 2 ч. Остаток фильтровали в вакууме через Целит для удаления катализатора и растворитель упаривали с получением сырого 1-этил-2-(4-метилфенил)-1H-пирроло[2,3-b]пиридин-5-амина, который использовали без какой-либо дополнительной очистки. 1b) 1-Изопропил-2-(4-метилфенил)-1H-пирроло[2,3-b]пиридин-5-амин. Использовали способ, описанный выше в примере 1 а), за исключением того, что применяли изопропилбромид вместо йодэтана. 1-Изопропил-2-(4-метилфенил)-5-нитро-1H-пирроло[2,3-b]пиридин. 1(1,5 г, 6,3 ммоль) в CH3CN (50 мл) добавляли K2CO3 (1,7 г, 12,6 ммоль). К полученной таким образом смеси затем добавляли по каплям этил-4-бромбутаноат (3,3 г, 16 ммоль) и полученную смесь нагревали до 120C при перемешивании в течение 18 ч. После охлаждения смесь выливали в воду (500 мл) и сырой продукт фильтровали, сушили в вакууме с получением этил-4-(5-нитро-2-фенил-1H-индол-1 ил)бутаноата, который применяли в последующей реакции без какой-либо дополнительной очистки. 1(кв., J=7,02 Гц, 2H); 4,34 (т, J=7,31 Гц, 2H); 6,84 (с, 1H); 7,47-7,62 (м, 5H); 7,80 (д, J=9,06 Гц, 1 Н); 8,08 (дд,J=9,21, 2,19 Гц, 1H); 8,59 (д, J=2,34 Гц, 1H). К суспензии 10% Pd/C (67 мг, 0,06 ммоль) в 95% этаноле (50 мл) добавляли (0,1 г, 0,1 ммоль) раствор 4-(5-нитро-2-фенил-1 Н-индол-1-ил)бутаноата (2,2 г, 6 ммоль) в 95 этаноле (100 мл) и смесь гидрировали в автоклаве Парра (Н 2, 30 фунт/кв.дюйм (2,1105 Па в течение 4 ч. Остаток фильтровали в вакууме через Целит для удаления катализатора и растворитель упаривали с получением сырого этил-4-(5-амино-2-фенил-1H-индол-1-ил)бутаноата, который использовали без какой-либо дополнительной очистки. 1m) 2-(4-Фторфенил)-1-(2-метоксиэтил)-1H-индол-5-амин. К раствору 5-нитроиндола (3,5 г, 21,6 ммоль) в ДМФА (100 мл) добавляли Cs2CO3 (13,9 г, 42,6 ммоль). Полученную таким образом смесь перемешивали 1 ч при комнатной температуре, затем добавляли по каплям 1-бром-2-метоксиэтан (5,9 г, 42,6 ммоль). Полученную смесь нагревали до 120C при перемешивании в течение 4 ч. После охлаждения смесь выливали в воду (500 мл) и сырой продукт фильтровали, сушили в вакууме с получением 1-(2-метоксиэтил)-5-нитро-1H-индола, который применяли в последующей реакции без какой-либо дополнительной очистки. 1H ЯМР (ДМСО-d6): 3,21 (с, 3H); 3,68 (т, J=5,26 Гц, 2 Н); 4,43 (т, J=5,26 Гц, 2 Н); 6,75 (дд, J=3,22, 0,58 Гц, 1 Н); 7,62 (д, J=3,22 Гц, 1H); 7,70 (д, J=9,35 Гц, 1H); 8,02 (дд, J=9,06, 2,34 Гц, 1H); 8,56 (д, J=2,34 Гц,1H). К суспензии, содержащей высушенный в вакууме в течение ночи при 140C ацетат цезия (7,3 г, 38 ммоль) в N,N-диметилацетамиде (ДМА, 10 мл), под инертной атмосферой добавляли ацетат палладия(0,22 г, 0,98 ммоль), трифенилфосфин (1 г, 3,8 ммоль), 1-(2-метоксиэтил)-5-нитро-1H-индол (4,2 г, 19,1 ммоль) и 1-йод-4-фторбензол (4,7 г, 21 ммоль). Реакционную смесь оставляли перемешиваться при 140C в инертной атмосфере в течение 18 ч. Смесь затем охлаждали до комнатной температуры, добавляли дихлорметан (100 мл) и полученную таким образом смесь фильтровали в вакууме через Целит. Органический раствор переносили в делительную воронку, промывали Н 2 О (2100 мл) и сушили над Na2SO4. Органический растворитель удаляли упариванием при пониженном давлении и остаток очищали флэш-хроматографией на силикагеле (н-гексан/EtOAc, н-гексан 10060%) с получением 2-(4 фторфенил)-1-(2-метоксиэтил)-5-нитро-1H-индола (0,9 г), который использовали без какой-либо дополнительной очистки. 1H ЯМР (ДМСО-d6): 3,05 (с, 3H); 3,53 (т, J=5,33 Гц, 2 Н); 4,41 (т, J=5,41 Гц, 2H); 6,83 (с, 1H); 7,327,44 (м, 2H); 7,62-7,73 (м, 2 Н); 7,79 (д, J=9,21 Гц, 1 Н); 8,06 (дд, J=9,06, 2,34 Гц, 1H); 8,57 (д, J=2,34 Гц,1H). К суспензии, содержащей 2-(4-фторфенил)-1-(2-метоксиэтил)-5-нитро-1H-индол (0,9 г, 2,9 ммоль) в абсолютном этаноле (100 мл), добавляли хлорида олова дигидрат (3,3 г, 14,6 ммоль). Реакционную смесь оставляли перемешиваться при 75C в течение 48 ч. Смесь затем охлаждали до комнатной температуры,растворитель частично упаривали при пониженном давлении и выливали в воду (100 мл) и лед. Добавляли NaHCO3 (насыщенный раствор) до рН 8 и смесь оставляли перемешиваться в течение 20 мин. Раствор переносили в делительную воронку и экстрагировали этилацетатом (250 мл). Органические фазы объединяли и полученную органическую фазу промывали H2O (2100 мл) и сушили над Na2SO4. Органический растворитель удаляли упариванием при пониженном давлении и остаток очищали флэш-хроматографией на силикагеле (н-гексан/EtOAc, н-гексан 10060%) с получением 2-(4 фторфенил)-1-(2-метоксиэтил)-1H-индол-5-амина (0,7 г), который использовали без какой-либо дополнительной очистки. 1n) 3-(5-Амино-2-фенил-1H-индол-1-ил)пропилацетат. К раствору, содержащему этил-3-(5-нитро-2-фенил-1H-индол-1-ил)пропаноат (полученный, как описано в примере 1g (2,1 г, 6,2 ммоль) в ТГФ (20 мл), добавляли натрия боргидрид (0,98 г, 24,8 ммоль) и абсолютный EtOH (25 мл); реакционную смесь оставляли перемешиваться при комнатной температуре в течение 18 ч. Затем добавляли воду (5 мл) и 2 н. HCl до рН 6. Раствор переносили в делительную воронку и экстрагировали этилацетатом (250 мл). Органические фазы объединяли и сушили над Na2SO4. Растворитель удаляли упариванием при пониженном давлении и остаток очищали флэш-хроматографией на силикагеле (н-гексан/EtOAc, н-гексан 10070%) с получением 3-(5-нитро-2-фенил-1H-индол-1 ил)пропан-1-ола (1,5 г), который использовали без какой-либо дополнительной очистки. 1H ЯМР (CDCl3): 1,81-1,93 (м, J=6,58, 6,58, 6,43, 6,14 Гц, 2H); 3,36 (т, J=5,70 Гц, 2 Н); 3,50 (ушир.с,1 Н); 4,38 (т, J=7,02 Гц, 2 Н); 6,69 (с, 1 Н); 7,28-7,61 (м, 6 Н); 8,06 (дд, J=9,06, 2,34 Гц, 1H); 8,55 (д, J=2,05 Гц, 1H). К раствору, содержащему этил-3-(5-нитро-2-фенил-1H-индол-1-ил)пропан-1-ол (2,2 г, 7,4 ммоль) и триэтиламин (1,24 мл, 8,9 ммоль) в CH2Cl2 (20 мл), добавляли по каплям ацетилхлорид (0,6 мл, 8,9 ммоль), реакционную смесь оставляли перемешиваться при комнатной температуре в течение 2 ч. Затем добавляли воду (20 мл) и NaHCO3 (насыщенный раствор) до рН 7. Двухфазный раствор переносили в делительную воронку, экстрагировали CH2Cl2 (250 мл). Органические фазы объединяли, промывали насыщенным раствором соли (2100 мл) и сушили над Na2SO4. Растворитель удаляли упариванием при пониженном давлении с получением 3-(5-нитро-2-фенил-1H-индол-1-ил)пропилацетата (1,5 г), который использовали без какой-либо дополнительной очистки. 1(д, J=2,05 Гц, 1H). К суспензии 10% Pd/C (87 мг, 0,08 ммоль) в 95% этаноле (100 мл) добавляли раствор 3-(5-нитро-2 фенил-1H-индол-1-ил)пропилацетата (2,76 г, 8 ммоль) в 95% этаноле (200 мл) и смесь гидрировали в автоклаве Парра (Н 2, 30 фунт/кв.дюйм (2,1l05 Па в течение 4 ч. Остаток фильтровали в вакууме через Целит для удаления катализатора и растворитель упаривали с получением сырого 3-(5-амино-2-фенил-1H-индол-1-ил)пропилацетата, который использовали без какойлибо дополнительной очистки. о) 2-(5-Амино-2-фенил-1H-индол-1-ил)этилацетат. Использовали способ, описанный выше в примере 1n), за исключением того, что применяли этил(5 нитро-2-фенил-1H-индол-1-ил)ацетат (полученный, как описано в примере 1h вместо 3-(5-нитро-2 фенил-1H-индол-1-ил)пропаноата. 2-(5-Нитро-2-фенил-1H-индол-1-ил)этанол. 1CH2Cl2 (250 мл), добавляли по каплям раствор, содержащий метансульфонилхлорид (36 г, 312 ммоль). Реакционную смесь оставляли перемешиваться при комнатной температуре в течение 18 ч, затем добавляли NH4Cl (насыщенный раствор) (250 мл). Двухфазный раствор переносили в делительную воронку,органическую фазу отделяли, сушили над Na2SO4 и растворитель удаляли упариванием при пониженном давлении. Остаток суспендировали в EtOH (200 мл) и нагревали при перемешивании до выпадения желтого осадка. Сырой продукт фильтровали, промывали EtOH (750 мл) и сушили в вакууме с получениемN-(2-йод-4-нитрофенил)-N-(метилсульфонил)метансульфонамида (32 г), который применяли в последующей реакции без какой-либо дополнительной очистки. 1H ЯМР (ДМСО-d6): 3,68 (с, 6 Н); 7,93 (д, J=8,77 Гц, 1 Н); 8,29 (дд, J=8,48, 2,34 Гц, 1H); 8,73 (д,J=2,63 Гц, 1H). К смеси, содержащей N-(2-йод-4-нитрофенил)-N-(метилсульфонил)метансульфонамид (31 г, 75 ммоль) в EtOH (230 мл), добавляли воду (115 мл) и LiOH (9 г, 375 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 2 ч, затем охлаждали до комнатной температуры, растворитель упаривали при пониженном давлении. Добавляли NH4Cl (насыщенный раствор, 250 мл) и смесь перемешивали до выпадения желтого осадка. Сырой продукт фильтровали и сушили в вакууме с получением N(2-йод-4-нитрофенил)метансульфонамида (24 г), который применяли в последующей реакции без какойлибо дополнительной очистки. 1(17,9 мл, 129 ммоль), этинилциклогексан (8,55 г, 79 ммоль) в ДМФА (60 мл), добавляли CuI (1,5 г, 7,9 ммоль) и дихлор-бис-(трифенилфосфин)палладий(II) [Cl2(PPh3)2Pd] (2,77 г, 3,95 ммоль). Реакционную смесь оставляли перемешиваться при 70C в течение 18 ч. После охлаждения до комнатной температуры добавляли EtOAc (100 мл), неорганический осадок отфильтровывали, раствор переносили в делительную воронку и промывали NaHCO3 (насыщенный раствор, 3200 мл) и водой (2150 мл). Органическую фазу сушили над Na2SO4, растворитель удаляли упариванием при пониженном давлении. Полученный таким образом сырой продукт кристаллизовали (изопропиловый эфир) с получением 2-циклогексил-1(метилсульфонил)-5-нитро-1H-индола (11,7 г). 1H ЯМР (ДМСО-d6): 1,14-1,53 (м, 5 Н); 1,62-1,93 (м, 3H); 2,02-2,20 (м, 2 Н); 3,08-3,27 (м, 1 Н); 3,46 (с,3H); 6,87 (с, 1 Н); 8,09 (д, J=9,10 Гц, 1H); 8,17 (дд, J=9,10, 2,05 Гц, 1 Н); 8,52 (д, J=2,05 Гц, 1H). К раствору, содержащему 2-циклогексил-1-(метилсульфонил)-5-нитро-1H-индол (5,8 г, 18 ммоль) в ТГФ (50 мл), добавляли по каплям тетрабутиламмония фторид (1 М раствор в ТГФ, 18 мл, 18 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 18 ч, затем охлаждали до комнатной температуры. Добавляли воду (50 мл) и EtOAc (50 мл), двухфазный раствор переносили в делительную воронку, органический слой отделяли и сушили над Na2SO4 и растворитель удаляли упариванием при пониженном давлении. Остаток очищали флэш-хроматографией на силикагеле (н-гексан/EtOAc, н-гексан 10080%) с получением 2-циклогексил-5-нитро-1H-индола (3,2 г), который использовали без какойлибо дополнительной очистки. 1(ушир.с, 1H). К раствору 2-циклогексил-5-нитро-1H-индола (5 г, 20,5 ммоль) в ДМФА (100 мл) добавляли гидрид натрия (50% суспензия) (1 г, 20,5 ммоль), смесь оставляли перемешиваться в течение 30 мин, затем добавляли по каплям этилйодид (2,5 мл, 30,8 ммоль) в ДМФА (10 мл) и полученную смесь оставляли перемешиваться при комнатной температуре в течение 18 ч. Реакционную смесь выливали в NaHCO3 (насыщенный раствор, 100 мл) и перемешивали в течение 30 мин. Твердое вещество фильтровали в вакууме с получением 2-циклогексил-1-этил-5-нитро-1H-индола (4,8 г), который использовали без какой-либо дополнительной очистки. 1H ЯМР (ДМСО-d6): 1,16-1,56 (м, 5 Н); 1,29 (т, J=7,09 Гц, 3H); 1,67-1,89 (м, 3H); 1,90-2,05 (м, 2 Н); 2,69-2,86 (м, 1 Н); 4,28 (кв., J=7,16 Гц, 2 Н); 6,52 (с, 1 Н); 7,62 (д, J=9,06 Гц, 1H); 7,96 (дд, J=9,06, 2,34 Гц,1H); 8,45 (д, J=2,34 Гц, 1H). К суспензии 10% Pd/C (380 мг, 0,36 ммоль) в 95% этаноле (50 мл) добавляли раствор 2 циклогексил-1-этил-5-нитро-1H-индола (4,8 г, 18 ммоль) в 95% этаноле (100 мл) и смесь гидрировали в автоклаве Парра (Н 2, 30 фунт/кв.дюйм (2,1l05 Па в течение 4 ч. Остаток фильтровали в вакууме через Целит для удаления катализатора и растворитель упаривали с получением сырого 2-циклогексил-1-этил 1H-индол-5-амина (4 г), который использовали без какой-либо дополнительной очистки. Моноизотопная масса = 242,18; ГХ/МС (М)+ m/z = 242.q) 2-Фенетил-1-этил-1H-индол-5-амин. К раствору 2-йод-4-нитроанилина (1,02 г, 3,86 ммоль) в дихлорметане (10 мл) добавили при перемешивании триэтиламин (1,77 мл, 12,7 ммоль). К этой смеси очень медленно и на ледяной бане добавляли по каплям раствор метансульфонилхлорида (0,98 мл, 12,7 ммоль) в дихлорметане (2 мл). Полученную таким образом смесь оставляли перемешиваться при комнатной температуре в течение ночи. День спустя реакционную смесь нейтрализовали насыщенным водным раствором NH4Cl. Органическую фазу отделяли и после упаривания растворителя остаток промывали этанолом и фильтровали с получением N-(2 йод-4-нитрофенил)-N-(метилсульфонил)метансульфонамида в виде желтого твердого вещества.H-ЯМР (ДМСО-d6): 8,73 (д, J=2,6 Гц, 1H); 8,29 (дд, J=8,8, 2,6 Гц, 1H); 7,93 (д, J=8,8 Гц, 1H); 3,68 (с,6H). Добавляли LiOH (0,21 мг, 8,9 ммоль) в смеси этанол/вода 2/1 (18 мл) к раствору N-(2-йод-4 нитрофенил)-N-(метилсульфонил)метансульфонамида (0,75 г, 1,78 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры реакционную смесь нейтрализовали H2O, NH4Cl и 2 н. HCl, затем удаляли этанол и водную фазу экстрагировали этилацетатом (320 мл). Органический растворитель удаляли, упаривая при пониженном давлении, с полученим N-(2-йод-4-нитрофенил)метансульфонамида без дополнительной очистки.H-ЯМР (ДМСО-d6): 9,53 (ушир.с, 1H); 8,59 (д, J=2,2 Гц, 1H); 8,19 (дд, J=8,8, 2,7 Гц, 1H); 7,55 (д,J=8,8 Гц, 1H); 3,14 (с, 3H). Предварительно выдержанный в течение 48 ч в термостате CuI (0,06 г, 0,34 ммоль), бис(трифенилфосфино)палладия дихлорид (0,2 г, 0,17 ммоль), триэтиламин (1,1 мл, 7,82 ммоль) и 4-фенил 1-бутин (0,44 г, 3,4 ммоль) добавляли к раствору N-(2-йод-4-нитрофенил)метансульфонамида (0,6 г, 1,7 ммоль) в безводном ДМФА (20 мл), находящемуся в атмосфере азота. Реакционную смесь оставляли пе- 11020373 ремешиваться в течение ночи. На следующее утро, после охлаждения, реакционную смесь выливали вH2O и лед (200 мл), оставляя перемешиваться в течение нескольких часов. После фильтрования извлекали коричневое твердое вещество, перекристаллизовывали из этилацетата/гексана 1:1 и затем из(с, 1H); 3,52 (с, 3H); 3,29 (м, 2H); 3,05 (м, 2H). Тетрабутиламмония фторид (ТБАФ, 0,37 мл, 1,29 ммоль) добавляли к раствору 1(метилсульфонил)-5-нитро-2-(2-фенетил)-1 Н-индола (0,25 г, 0,95 ммоль) в ТГФ (5 мл). Реакционную смесь кипятили с обратным холодильником в течение ночи при перемешивании. На следующее утро,после охлаждения, реакционную смесь выливали в Н 2 О и оставляли перемешиваться в течение ночи. После фильтрования твердое вещество очищали флэш-хроматографией на силикагеле (н-гексан/EtOAc,н-гексан 9080%) с получением 2-фенетил-5-нитро-1H-индола. 2-Фенетил-5-нитро-1H-индол. 1(0,16 г, 0,6 ммоль) в ДМФА (30 мл). Реакционную смесь оставляли перемешиваться в течение 30 мин. Затем добавляли этилйодид (0,15 мл, 1,9 ммоль) и смесь оставляли перемешиваться в течение ночи при комнатной температуре. На следующее утро смесь выливали в H2O, оставляли перемешиваться в течение ночи, получая осадок, который фильтровали с получением 2-фенетил-1-этил-5-нитро-1H-индола. 2-Фенетил-1-этил-5-нитро-1H-индол. 1SnCl2 (1,2 г, 6,3 ммоль) добавляли к раствору 2-фенетил-1-этил-5-нитро-1H-индола (0,17 г, 0,57 ммоль) в ТГФ (50 мл). Смесь оставляли перемешиваться при 70C в течение ночи. После охлаждения смесь выливали в Н 2 О, нейтрализовали NaHCO3 и экстрагировали этилацетатом (350 мл). После упаривания растворителя при пониженном давлении остаток очищали на хроматографической колонке, используя CHCl3 в качестве элюента, с получением 2-фенетил-1-этил-1H-индол-5-амина. 2-Фенетил-1-этил-1H-индол-5-амин. 1 Н ЯМР (300 МГц, ДМСО-d6):7,25-7,37 (м, 4H); 7,15-7,25 (м, 1H); 7,11 (д, J=8,48 Гц, 1H); 6,72 (д,J=2,05 Гц, 1H); 6,53 (дд, J=2,19, 8,62 Гц, 1H); 6,02 (с, 1H); 5,46 (ушир.с, 2H); 4,05 (кв., J=7,11 Гц, 2H); 2,81-3,15 (м, 4H); 1,18 (т, J=7,16 Гц, 3H).r) 2-Бензил-1-этил-lH-индол-5-амин. Промежуточное соединение r) получали способом, аналогичным способу, описанному для промежуточного соединения q), используя 3-фенил-1-пропин (0,16 г, 1,4 ммоль) вместо 4-фенил-1-бутина. 2-Бензил-1-(метансульфонил)-5-нитро-1H-индол. 1N2H4H2O (25 мл) добавляли по каплям к раствору 1-фтор-4-нитробензола. Смесь оставляли перемешиваться сначала при комнатной температуре в течение 3 ч, а затем при кипении с обратным холодильником в течение 1 ч. После охлаждения полученный осадок фильтровали и промывали Н 2 О с получением 4-нитрофенилгидразина, который использовали в следующей реакции без какой-либо дополнительной очистки. 4-Нитрофенилгидразин: m/z (APCI+) 154 (МН+). Суспензию в воде (150 мл) 4-нитрофенилгидразина (15 г, 23 ммоль) и этилового эфира 2 оксопропионовой кислоты (12 г, 100 ммоль) оставляли перемешиваться при комнатной температуре в течение 6 ч. Полученный осадок фильтровали и промывали с получением этилового эфира 2-[(4 нитрофенил)гидразоно]пропионовой кислоты. 1- 12020373 1,36-1,22 (м, 3H). Полифосфорную кислоту (ПФК, 50 г) добавляли к раствору этилового эфира 2-[(4 нитрофенил)гидразоно]пропионовой кислоты (6 г, 23 ммоль) в толуоле (70 мл). Смесь кипятили с обратным холодильником в течение 3 ч, затем охлаждали до 0-10C и добавляли NH4Cl до рН 8-9. Смесь экстрагировали этилацетатом (EtOAc) и затем растворитель удаляли упариванием при пониженном давлении. Остаток очищали флэш-хроматографией на силикагеле (н-гексан/EtOAc, 80/20) и кристаллизовали сCH2Cl2 с получением этилового эфира 5-нитро-1H-индол-2-карбоновой кислоты. Этиловый эфир 5-нитро-1H-индол-2-карбоновой кислоты. 1 Н-ЯМР (ДМСО-d6): 12,55 (с, 1H); 8,73 (с, 1H); 8,14 (д, 1H); 7,62 (д, 1H); 7,45 (с, 1H); 4,45-4,32 (м,2H); 1,43-1,30 (м, 3H). Безводный K2CO3 (2,36 г, 17,1 ммоль), 18-краун-6 (1,14 г, 4,28 ммоль) и 3 триизопропилсиланилоксипропил бромид (3,78 г, 12,82 ммоль) добавляли к раствору этилового эфира 5 нитро-1H-индол-2-карбоновой кислоты (2 г, 8,85 ммоль) в безводном ацетонитриле (50 мл). Смесь нагревали при 80C в течение 4 ч. После упаривания растворителя при пониженном давлении добавляли воду и полученную смесь экстрагировали дихлорметаном. После упаривания растворителя при пониженном давлении твердое вещество очищали флэш-хроматографией на силикагеле (н-гексан/EtOAc, 50/10) с получением этилового эфира 5-нитро-1-(триизопропилсиланилоксипропил)-1H-индол-2-карбоновой кислоты.(2,76 г, 6,2 ммоль) растворяли в 5%-м растворе KOH в EtOH/H2O 1/1 (80 мл) и оставляли перемешиваться при комнатной температуре в течение 16 ч. Этанол затем упаривали и добавляли 1 н. HCl к раствору доpH 5. Раствор затем экстрагировали EtOAc. После упаривания растворителя при пониженном давлении твердое вещество промывали н-гексаном/дихлорметаном 10/1 и фильтровали с получением 5-нитро-1(триизопропилсиланилоксипропил)-1H-индол-2-карбоновой кислоты. 5-Нитро-1-(триизопропилсиланилоксипропил)-1H-индол-2-карбоновая кислота.m/z (APCI+) 421 (МН+). Смесь 5-нитро-1-(триизопропилсиланилоксипропил)-1H-индол-2-карбоновой кислоты (0,448 г,1,065 ммоль), О-бензотриазол-1-ил-N,N,N',N'-тетраметилуроний тетрафторбората (TBTU) (0,478 г, 1,49 ммоль) и триэтиламина (0,22 мл, 1,59 ммоль) в безводном акрилонитриле (14 мл) оставляли перемешиваться при комнатной температуре в течение 30 мин. Добавляли анилин (0,109 г, 1,175 ммоль) к этой смеси. Смесь выдерживали при 50-55C в течение приблизительно 3 ч, затем разбавляли H2O и экстрагировали этилацетатом (EtOAc). После упаривания растворителя при пониженном давлении полученное твердое вещество очищали флэш-хроматографией на силикагеле (н-гексан/EtOAc, 50/10) с получением фениламида 5-нитро-1-(триизопропилсиланилоксипропил)-1H-индол-2-карбоновой кислоты.m/z (APCI+) 496 (МН+). Каталитическое количество 10% Pd/C добавляли к раствору фениламида 5-нитро-1(триизопропилсиланилоксипропил)-1H-индол-2-карбоновой кислоты (0,323 г, 0,65 ммоль) в МеОН (100 мл) и смесь гидрировали при 29 фунт/кв.дюйм (2105 Па) в течение 12 ч. Раствор фильтровали через Целит и фильтрат упаривали при пониженном давлении с получением твердого вещества, используемого без какой-либо дополнительной очистки. Фениламид 5-амино-1-(триизопропилсиланилоксипропил)-1H-индол-2-карбоновой кислоты.m/z (APCI+) 466 (МН+). Пример 2. Получение соединения по изобретению. а) Пример первого варианта способа получения К раствору 5-амино(аза)индола (III) (2 ммоль) в дихлорметане (10 мл) добавляли триэтиламин (2,2 ммоль), затем по каплям добавляли ацилхлорид (II) (2,2 ммоль), растворенный в дихлорметане (10 мл). После того как закончили добавление, смесь оставляли перемешиваться при комнатной температуре в течение 20 ч. Затем добавляли воду (50 мл) и органическую фазу отделяли и сушили над Na2SO4. Раствор упаривали при пониженном давлении. Полученный сырой продукт очищали с получением соединения формулы (I), в котором X, Y, Z, G1, G2, G3, R1, W и R2 определены выше.b) Пример второго варианта способа получения К суспензии 5-амино(аза)индола (III) (0,9 ммоль) добавляли смолу Amberlyst A21 (0,9 г) в дихлорметане (3 мл) и ацилхлорид (II) (0,28 ммоль) в дихлорметане (3 мл). Смесь оставляли перемешиваться в течение 20 ч. Смолу Amberlyst A21 затем отделяли путем фильтрования и промывали дихлорметаном (5 мл). Органические фазы объединяли, разбавляли диметилформамидом (1 мл) и перемешивали со смолойAmberlyst 15 (0,9 г) в течение 5 ч. Данную обработку повторяли дважды. Смолу Amberlyst 15 удаляли путем фильтрования и раствор упаривали при центрифугировании с получением соединения формулы(I), в котором X, Y, Z, G1, G2, G3, R1, W и R2 определены выше. с) Пример третьего варианта способа получения В условиях инертной атмосферы растворяли бензойную кислоту (II) (0,67 ммоль) и 5 аминоазаиндол (III) (0,45 ммоль) в дихлорметане (8 мл) и диметилформамиде (0,8 мл). После перемешивания смеси при комнатной температуре в течение 10 мин добавляли PS-карбодиимидную смолу (0,73 г). После перемешивания реакционной смеси в течение 20 ч смолу удаляли фильтрованием и промывали дихлорметаном (25 мл). Раствор упаривали при центрифугировании с получением соединения формулы (I), в котором X, Y, Z, G1, G2, G3, R1, W и R2 определены выше.d) Пример четвертого варианта способа получения К раствору бензойной кислоты (II) (10 ммоль) в диметилформамиде (40 мл) с перемешиванием при 0C добавляли 1-гидроксибензотриазол (HOBt) (10 ммоль) и дициклогексилкарбодиимид (DCC) (10 ммоль). Смесь оставляли перемешиваться при 0C в течение 30 мин и добавляли 5-аминоазаиндол (III) (9 ммоль), растворенный в диметилформамиде (20 мл). Смесь оставляли перемешиваться при 0C в течение дополнительных 30 мин и затем при комнатной температуре в течение 18 ч. Смесь фильтровали, добавляли 2 н. хлористо-водородную кислоту до pH 2 и образующийся таким образом осадок отфильтровывали и очищали с получением соединения формулы(I), в котором X, Y, Z, G1, G2, G3, R1, W и R2 определены выше. е) Пример пятого варианта способа получения К суспензии высушенного в вакууме в течение ночи при 140C ацетата цезия (6,02 ммоль) в N,Nдиметилацетамиде (ДМА) (3 мл) в инертной атмосфере добавляли ацетат палладия (0,017 ммоль), трифенилфосфин (0,067 ммоль), 5-амино(аза)индол (IV)' (3,35 ммоль) и арилйодид (V) (3,68 ммоль). Реакционную смесь оставляли перемешиваться при 140C в инертной атмосфере в течение 18 ч. Реакционную смесь охлаждали до комнатной температуры, добавляли дихлорметан (50 мл) и полученную смесь фильтровали в вакууме через Целит. Отфильтрованный органический раствор переносили в делительную воронку. Органическую фазу промывали H2O (250 мл), сушили над Na2SO4 и упаривали при пониженном давлении. Остаток очищали с получением соединения формулы (I), в котором X, Y, Z, G1, G2, G3, R1, W и R2 определены выше.f) Пример твердофазного синтеза с применением смолы PL-FMP. Следующий пример твердофазного синтеза с применением препаративной смолы представлен со ссылкой на конкретные соединения по настоящему изобретению, где упомянутые выше группы G1, G2,- 14020373G3 представляют собой СН, R1 представляет собой SO2RI и X, Y, Z, W, R2 и R1 определены выше. Кроме того, следующий пример содержит стадии 1 и 2 для получения исходного соединения В 1 способа по настоящему изобретению, поскольку промежуточное соединение А 1 сначала получается in situ без отделения от препаративной смолы. Стадия (1). 15 г смолы PL-FMP (0,9 ммоль/г) в растворе 1% АсОН в ДМФА (300 мл) перемешивали при комнатной температуре в течение 2 ч. Затем добавляли N-(4-амино-2-йодфенил)алкилсульфонамидLaboratories, CK) является альдегидной смолой, подходящей для присоединения аминов посредством восстановительного аминирования. Смесь перемешивали при комнатной температуре в течение 24 ч,затем смолу отфильтровывали и промывали ДМФА (3150 мл), ДМФА/MeOH с объемным соотношением 1/1 (3150 мл), MeOH (3150 мл), CH2Cl2/MeOH с объемным соотношением 1/1 (3100 мл) и CH2Cl2(3100 мл). Смолу сушили в вакууме при комнатной температуре с получением 18,3 г смолы (А 1), которую использовали без какой-либо дополнительной очистки. Стадия (2). 1,172 г смолы (А 1) (0,8 ммоль, теоретическое) добавляли к смеси ДМФА (10 мл), алкина В 2 (5 ммоль), CuI (32 мг, 0,17 ммоль), 58 мг дихлор-бис-(трифенилфосфин)палладия (II) [Cl2(PPh3)2Pd](0,8 ммоль) и 2 мл триэтиламина (22 ммоль). Смесь нагревали при 70C и перемешивали в течение 48 ч. Реакцию останавливали охлаждением до комнатной температуры. Смолу отфильтровывали и промывали ДМФА (310 мл), ДМФА/Н 2 О с объемным соотношением 95/5 (310 мл), ДМФА/Н 2 О с объемным соотношением 90/10 (310 мл), ДМФА/Н 2 О с объемным соотношением 80/20 (310 мл), ДМФА/H2O с объемным соотношением 50/50 (310 мл), ДМФА (310 мл), ДМФА/MeOH с объемным соотношением 50/50 (310 мл), MeOH (310 мл), MeOH/CH2Cl2 с объемным соотношением 50/50 (310 мл) и CH2Cl2(310 мл). Полученную смолу В 1 использовали без какой-либо дополнительной очистки. Стадия (3). 1,38 мл N,N-диизопропилэтиламина (ДИЭА (DIEA), 8,0 ммоль) и ацилхлорид (6,5 ммоль) (С 2) добавляли к суспензии смолы (В 1) в CH2Cl2 (10 мл). Смесь перемешивали при комнатной температуре в течение 18 ч, затем смолу отфильтровывали и промывали CH2Cl2 (310 мл), CH2Cl2/ДМФА с объемным соотношением 1/1 (310 мл), ДМФА (310 мл), ДМФА/Н 2 О с объемным соотношением 9/1(310 мл), ДМФА (310 мл), ДМФА/MeOH с объемным соотношением 1/1 (310 мл), MeOH (310 мл),CH2Cl2/MeOH с объемным соотношением 1/1 (310 мл), CH2Cl2 (310 мл). Полученную смолу (С 1) использовали без какой-либо дополнительной очистки. Стадия (4). Смолу (С 1) добавляли к раствору триэтилсилана (0,15 мл) в ТФУ/ДХМ с объемным соотношением 1/1 (15 мл) и перемешивали при комнатной температуре в течение 15 мин. Смолу отфильтровывали и промывали раствором триэтилсилана (0,15 мл) в ТФУ/ДХМ с объемным соотношением 1/1 (5 мл). Раствор упаривали в вакууме с получением сырого продукта, который очищали препаративной ВЭЖХ с получением соединения (I), в котором X, Y, Z, W, R2 и R1 определены выше.g) Пример восстановления двойной связи в положении 2-3. 5-Амино(аза)индольное производное (1 ммоль) растворяли в растворе EtOH (3 мл) и концентрированной HCl (1,5 мл). Затем добавляли олово (5 ммоль) и смесь кипятили с обратным холодильником в течение 6 ч. Смесь фильтровали, раствор выливали в 20% раствор KOH (5 мл) и экстрагировали Et2O(310 мл). Органическую фазу фильтровали на Целите и сушили над Na2SO4. Раствор упаривали при пониженном давлении. Полученный сырой продукт очищали с получением соединения формулы (I'), в котором X, Y, Z, G1, G2, G3, R1, W и R2 определены выше.h) Пример получения кислоты из соответствующего сложного эфира Сложноэфирное производное азаиндола (0,32 ммоль) растворяли в раствор ТГФ/EtOH с объемным соотношением 1/1 (3 мл), затем добавляли раствор 1 н. NaOH (1,2 мл) и смесь перемешивали при комнатной температуре в течение 3 ч. Органические растворители удаляли в вакууме и добавляли 1 н. раствор HCl до тех пор, пока не выпадет кислота. Продукт отфильтровывали, промывали водой и сушили в вакууме с получением соединения формулы (I), в котором X, Y, Z, G1, G2, G3, n, W и R2 определены выше.i) Пример шестого варианта способа получения В условиях инертной атмосферы растворяли бензойную кислоту (II) (0,74 ммоль), TBTU (0,86 ммоль) и триэтиламин (0,98 ммоль) в безводном ацетонитриле (3 мл). После оставления смеси для перемешивания при комнатной температуре в течение 30 мин добавляли раствор соединения (V) (0,61 ммоль) в безводном ацетонитриле (3 мл). Смесь оставляли перемешиваться при комнатной температуре в течение 3 ч, затем разбавляли Н 2 О и экстрагировали этилацетатом (EtOAc). После упаривания растворителя при пониженном давлении полученное твердое вещество (0,16 ммоль) растворяли в MeOH (15 мл). Добавляли к раствору 2 н. HCl (2,5 мл) и смесь оставляли при комнатной температуре на 3 ч. Растворитель затем упаривали при пониженном давлении, остаток растворяли в ДХМ и промывали насыщенным раствором NaHCO3. После упаривания органического растворителя остаток очищали с получением соединения (I), где Y, Z, G1, G2 и G3 определены выше, W является амидной связью и R2 является фенильной группой. Соединения по настоящему изобретению, представленные в табл. 1 ниже, были получены таким образом. В табл. 1 используется следующая аббревиатура со следующим значением: очистка А = кристаллизация,очистка В = флэш-хроматография на силикагеле,очистка С = препаративная ВЭЖХ (X Bridge prep. C18; 5 мкм, 30150 мм),EtOAc = этилацетат,Hex = гексан,MeOH = метанол,EtOH = этанол,CH3CN = ацетонитрил,Н 2 О = вода,HCOOH = муравьиная кислота,iPrOH = изопропанол,Pr2O = пропиловый эфир. Таблица 1 Пример 3. Биологическая активность in vitro. Используемый тест позволяет оценить ингибиторную активность тестируемых соединений в отношении продукции PGE2 и селективность в отношении продукции PGF2. Использовали линию клеток аценокарциномы легкого человека А 549, которые являются особенно чувствительными к стимуляции провоспалительными цитокинами, например IL-1, и в ответ на эту стимуляцию особенно активно продуцируют и высвобождают два простаноида: PGE2 и PGF2 (Thoren S. Jakobsson P-J, 2000). Клетки стимулировали с помощью IL-1 (10 нг/мл) и одновременно обрабатывали тестируемым соединением в течение 22 ч в подходящей культуральной среде (DMEM - модифицированная по способу Дульбекко среда Игла), обогащенной 5% фетальной телячьей сывороткой и L-глутамином (4 мМ конечная), в термостате при 37C и с концентрацией СО 2 5%. В конце инкубации анализировали количество продуцированного и высвобожденного в культурального среду PGE2 и PGF2, используя тест-систему для ИФА (производимую и продаваемую CaymanChemicals, Анн Арбор, Мичиган, США). Используемым для сравнения соединением являлся индометацин с концентрацией 10 нМ (SigmaAldrich), который является нестероидным противовоспалительным лекарственным средством, которое ингибирует в равной степени PGE2 и PGF2.- 20020373 Результаты, выраженные в виде процента ингибирования продуцирования PGE2 и PGF2 при концентрации 10 мкМ, представлены в табл. 2, в которой "на" (не активен) обозначает инибирующую активность менее 20%. Таблица 2 Для иллюстративных целей в табл. 3 сравниваются значения pIC50 ряда соединений по изобретению, где pIC50 представляет собой отрицательный логарифм IC50, которая, в свою очередь, отражает концентрацию соединения, которая ингибирует продуцирование PGE2 и PGF2 на 50%, относительно клеток,которые стимулируются, но не обрабатываются, тем же самым соединением. В табл. 3 "но" означает не поддающийся определению. Таблица 3 Пример 4. Биологическая активность in vivo. Тестируемые соединения оценивались в модели вытяжения у мышей, индуцированных уксусной кислотой (Stock J.L. et al., J. Clin. Inv. 2001, 107: 325-331). Данный тест позволяет оценить антиноцицептивную активность соединений по изобретению в модели воспалительной боли. Для теста использовали самок мышей CD-1 весом 25-30 г. Животным вводили внутрибрюшинно тестируемое соединение (0,1-10 мг/кг), суспендируемое в метилцеллюлозе (МТС). Контрольным животным вводили только наполнитель (МТС) тем же самым способом. Через 30 мин после лечения животные получали внутрибрюшинную инъекцию уксусной кислоты(0,7 об./об. в физиологическом растворе, 16 мкл/г массы тела) для индуцирования воспалительной боли и проверки эффектов тестируемого соединения на ноцицептивную реакцию. Тотчас же после введения уксусной кислоты и в течение последующих 20 мин определяли число растяжений, которые представляют параметр для оценки ноцицептивной реакции. Как представлено в табл. 4, соединение по изобретению индуцирует дозозависимым образом уменьшение в вытяжении в течение 20 мин после введения уксусной кислоты по сравнению с животными, обработанными только МТС. Пример 5. Селективность в отношении изоформ PGES. Используемый тест позволяет оценить способность соединений по изобретению ингибировать продуцирование PGE2 клеточной линией лимфомы человека U-937, которая преимущественно экспрессирует изоформу фермента (cPGES), ответственную за продуцирование PGE2 в базальных условиях в отсутствие провоспалительных стимулов. Данная форма фермента отличается от преимущественно экспрессируемой клетками А 549 (mPGES-1) после провоспалительного стимула. Отсутствие ингибирующей активности в отношении PGE2 в данной клеточной модели позволяет удостовериться в селективности соединения по сравнению с формой фермента, ответственной за продукцию PGE2 в присутствии воспалительных стимулов. Результаты, выраженные в виде процента ингибирования продуцирования PGE2, представлены в табл. 5, в которой "на" (не активен) обозначает инибирующую активность менее 20%. В качестве контрольного соединения использовали индометацин при концентрации 10 нМ. Было обнаружено, что соединения по изобретению незначительно ингибируют продуцированиеPGE2, главным образом благодаря действию cPGES. Таблица 5 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. (Аза)индольное производное, замещенное по положению 5, формулы (I) в которой X представляет собой атом галогена или метил, трифторметильную, амино-, циано-, гидроксигруппу;Y и Z, которые могут быть одинаковыми или различными, представляют собой атом водорода или галогена либо (C1-C3)алкил, трифторметил, нитро, амино, гидрокси, (C1-C3)алкокси;G1 представляет собой атом азота или группу CH;G2 представляет собой группу CH;G3 представляет собой группу CH;R1 является (C1-C6)алкильной, (C3-C7)циклоалкильной, (C1-C6)алкил-ORI, (CH2)nNRIIRIII,(CH2)nCONRIIRIII, (CH2)nCORI, (CH2)nCOORII, (CH2)nOCORI, SO2RI, (CH2)nNRIISO2RI, (CH2)nSO2RI группой, необязательно замещенной 1-3 гидроксигруппами, где n равно целому числу от 1 до 6, RI является(C1-C3)алкильной или (C1-C3)алкил-OH группой и RII и RIII, которые могут быть одинаковыми или различными, являются атомом водорода или метилом;(CH2)pC(OH)(CH2)q группой, где р и q, которые могут быть одинаковыми или различными, являются целым числом от 0 до 3;R2 является фенильной, пиридиновой или (С 3-С 7)циклоалкильной группой, необязательно замещенной 1-3 заместителями, которые могут быть одинаковыми или различными, представленными группойL-M, где L является -связью или (C1-C6)алкильной, O(C1-C6)алкильной группой и М является атомом водорода или галогена либо ОН, CF3, NO2, CN, COORII, SO2NHRII, NRIIRIII, SO2RIV, NHSO2RIV группой,- 22020373 где RII и RIII, которые могут быть одинаковыми или различными, определены выше и RIV и RV, которые могут быть одинаковыми или различными, являются (C1-С 3)алкильной группой,при условии, что, когда G1, G2 и G3 все являются группой CH, R1 является (C1-C6)алкильной или(C3-C7)циклоалкильной группой, необязательно замещенной 1-3 гидроксигруппами, W является -связью и связь между атомами углерода в положении 2 и 3 является двойной связью, R2 не является фенильной или пиридиновой группой, необязательно замещенной 1-3 заместителями, которые могут быть одинаковыми или различными, выбранными из галогена, (C1-C6)алкила, необязательно замещенного гидроксигруппой, трифторметила, нитро, амино, ди(C1-C3)алкиламино, гидрокси, (C1-С 3)алкокси, COOH, COORII,SO2CH3, SO2NHCH3, NHSO2CH3 и (Cl-C6)алкил-COOH, и при условии, что, когда G1 представляет собой N и G2 и G3 являются группой CH, R2 не является двухвалентной ароматической группой, замещенной одной группой L-M, представленнойO(C1-C6)алкильной группой; и его физиологически приемлемые соли присоединения, стереоизомеры, энантиомеры, сольваты. 2. (Аза)индольное производное по п.1 в форме сольвата, которое представляет собой гидрат. 3. (Аза)индольное производное по п.1, где X выбирают из брома, хлора, фтора, метила, трифторметила и циано. 4. (Аза)индольное производное по п.1, где X выбирают из брома, хлора и трифторметила. 5. (Аза)индольное производное по п.1, где Y и Z, которые могут быть одинаковыми или различными, выбирают из водорода, брома, хлора, фтора, нитро, (C1-C3)алкила, трифторметила и (C1-С 3)алкокси. 6. (Аза)индольное производное по п.1, где Y и Z, которые могут быть одинаковыми или различными, выбирают из водорода, брома, хлора, трифторметила, нитро, метила, этила, метокси и этокси. 7. (Аза)индольное производное по п.1, где R1 выбирают из (С 1-С 3)алкильной, (C1-C6)алкил-ORI,(CH2)nNRIIRIII, (CH2)nCONRIIRIII, (CH2)nCORI, (CH2)nCOORII, (CH2)nOCORI, SO2RI, (CH2)nNRIISO2RI,(CH2)nSO2RI группы, необязательно замещенной 1-3 гидроксигруппами, где n равно целому числу от 1 до 4, RI является (C1-C3)алкильной или (C1-C3)алкил-OH группой и RII и RIII, которые могут быть одинаковыми или различными, являются атомом водорода или метилом. 8. (Аза)индольное производное по п.1, где R1 выбирают из (C1-C3)алкильной, (C1-C6)алкил-ORI,(CH2)nCONRIIRIII, (CH2)nCORI, (CH2)nCOORII, (CH2)nOCORI, SO2RI, (CH2)nNRIISO2RI, (CH2)nSO2RI группы,необязательно замещенной 1-3 гидроксигруппами, где n равно целому числу от 1 до 3, RI является СН 3,С 2 Н 5, СН 2 ОН, С 2 Н 4 ОН группой и RII и RIII, которые могут быть одинаковыми или различными, являются атомом водорода или СН 3 группой. 9. (Аза)индольное производное по п.1, где W выбирают из -связи или (C1-C3)алкильной,O(C1-C3)алкильной, C(O)NH, (CH2)pCO(CH2)q или (CH2)pC(OH)(CH2)q группы, где р и q, которые могут быть одинаковыми или различными, являются целым числом от 1 до 3. 10. (Аза)индольное производное по п.1, где W выбирают из -связи или СН 2, С 2 Н 4, ОСН 2, ОС 2 Н 4,C(O)NH, (CH2)pCO(CH2)q или (CH2)pC(OH)(CH2)q группы, где р и q, которые могут быть одинаковыми или различными, являются целым числом от 1 до 2. 11. (Аза)индольное производное по п.1, где R2 выбирают из фенильной, пиридиновой или(C3-C7)циклоалкильной группы, необязательно замещенной 1-2 заместителями, которые могут быть одинаковыми или различными, представленными группой L-M, где L является -связью или (C1C3)алкильной, O(C1-C3)алкильной группой и М является атомом водорода или галогена либо CF3, CN,COORII, SO2NHRII, NRIIRIII, SO2RIV или NHSO2RIV группой, где RII и RIII, которые могут быть одинаковыми или различными, являются атомом водорода или (C1-C3)алкильной группой и RIV и RV, которые могут быть одинаковыми или различными, являются (C1-C3)алкильной группой. 12. (Аза)индольное производное по п.1, где R2 выбирают из фенильной, пиридиновой илиL-M, где L является -связью или СН 2, С 2 Н 4, ОСН 2, ОС 2 Н 4 группой и М является атомом водорода или галогена либо CF3, CN, COORII, SO2NHRII, NRIIRIII, SO2RIV, NHSO2RIV группой, где RII и RIII, которые могут быть одинаковыми или различными, являются атомом водорода или СН 3, С 2 Н 5 группой и RIV и RV,которые могут быть одинаковыми или различными, являются СН 3 или С 2 Н 5 группой. 13. (Аза)индольное производное по п.1, где W является -связью или СН 2 или С 2 Н 4 группой и R2 представляет собой фенильную группу, необязательно замещенную 1-3 заместителями, которые могут быть одинаковыми или различными, выбранными из атома Br, Cl и F, CH3, C2H5, OCH3, OC2H5, CN иCH2CN группы. 14. (Аза)индольное производное по п.1, где W является -связью или СН 2 или С 2 Н 4 группой и R2 является пиридиновой группой, необязательно замещенной 1-3 заместителями, которые могут быть одинаковыми или различными, выбранными из атома Br, Cl и F, СН 3, С 2 Н 5, ОСН 3, ОС 2 Н 5, CN и CH2CN группы. 15. (Аза)индольное производное по п.1, где W является -связью или СН 2 или С 2 Н 4 группой и R2 является циклогексильной группой, необязательно замещенной 1-3 заместителями, которые могут быть одинаковыми или различными, выбранными из атома Br, Cl и F, СН 3, С 2 Н 5, ОСН 3, ОС 2 Н 5, CN и CH2CN- 23020373 группы. 16. Способ получения (аза)индольного производного, замещенного по положению 5, формулы (I) в которой X представляет собой атом галогена или метил, трифторметильную, амино-, циано-, гидроксигруппу;Y и Z, которые могут быть одинаковыми или различными, представляют собой атом водорода или галогена либо (C1-C3)алкил, трифторметил, нитро, амино, гидрокси, (C1-C3)алкокси;G1 представляет собой атом азота или группу CH;G2 представляет собой группу CH;G3 представляет собой группу СН;R1 является (C1-C6)алкильной, (C3-C7)циклоалкильной, (C1-C6)алкил-ORI, (CH2)nNRIIRIII,(CH2)nCONRIIRIII, (CH2)nCORI, (CH2)nCOORII, (CH2)nOCORI, SO2RI, (CH2)nNRIISO2RI, (CH2)nSO2RI группой, необязательно замещенной 1-3 гидроксигруппами, где n равно целому числу от 1 до 6, RI является(C1-C3)алкильной или (C1-С 3)алкил-OH группой и RII и RIII, которые могут быть одинаковыми или различными, являются атомом водорода или (C1-C3)алкильной группой;(CH2)pC(OH)(CH2)q группой, где р и q, которые могут быть одинаковыми или различными, являются целым числом от 0 до 3;R2 является фенильной, пиридиновой или (С 3-С 7)циклоалкильной группой, необязательно замещенной 1-3 заместителями, которые могут быть одинаковыми или различными, представленными группойL-M, где L является -связью или (C1-C6)алкильной, O(C1-C6)алкильной группой и М является атомом водорода или галогена или ОН, CF3, NO2, CN, COORII, SO2NHRII, NRIIRIII, SO2RIV, NHSO2RIV группой,где RII и RIII, которые могут быть одинаковыми или различными, определены выше и RIV и RV, которые могут быть одинаковыми или различными, являются (C1-С 3)алкильной группой,при условии, что, когда G1, G2 и G3 все являются группой CH, R1 является (C1-C6)алкильной или(C3-C7)циклоалкильной группой, необязательно замещенной 1-3 гидроксигруппами, W является -связью и связь между атомами углерода в положении 2 и 3 является двойной связью, R2 не является фенильной или пиридиновой группой, необязательно замещенной 1-3 заместителями, которые могут быть одинаковыми или различными, выбранными из галогена, (C1-C6)алкила, необязательно замещенного гидроксигруппой, трифторметила, нитро, амино, ди(C1-C3)алкиламино, гидрокси, (C1-С 3)алкокси, COOH, COORII,SO2CH3, SO2NHCH3, NHSO2CH3 и (Cl-C6)алкил-COOH, и при условии, что, когда G1 представляет собой N и G2 и G3 являются группой CH, R2 не является двухвалентной ароматической группой, замещенной одной группой L-M, представленнойO(C1-C6)алкильной группой; и его физиологически приемлемых солей присоединения, стереоизомеров, энантиомеров, сольватов,характеризующийся: а) взаимодействием соединения формулы (II)Q представляет собой атом галогена или гидроксигруппу,с соединением формулы (III) в которой G1, G2, G3, R1, W и R2 определены выше,- 24020373 с получением соединения формулы (I)b) формированием, в случае необходимости, физиологически приемлемой соли соединения формулы (I) со стадии а). 17. Способ получения (аза)индольного производного по п.16, в котором (аза)индольное производное, замещенное по положению 5, формулы (I) в форме сольвата представляет собой гидрат. 18. Способ по п.16, отличающийся тем, что стадию а) осуществляют путем взаимодействия соединения формулы (II), в которой Q представляет собой Cl, с амином формулы (III) в присутствии подходящего связывающего кислоту соединения. 19. Способ по п.16, отличающийся тем, что стадию а) осуществляют путем взаимодействия соединения формулы (II), в которой Q представляет собой ОН, с амином формулы (III) в присутствии подходящего конденсирующего агента. 20. Способ по п.16, отличающийся тем, что стадию а) осуществляют в твердой фазе, содержащей соединение формулы (III), связанное с препаративной смолой. 21. Способ по п.20, отличающийся тем, что препаративная смола является альдегидной смолой. 22. Способ по любому из пп.20 и 21, отличающийся тем, что способ дополнительно включает стадию расщепления для удаления соединения формулы (I) с указанной смолы. 23. Способ по п.22, отличающийся тем, что стадию расщепления осуществляют путем обработки трифторуксусной кислотой. 24. Способ по п.16, отличающийся тем, что способ дополнительно включает стадию восстановления для превращения двойной связи между положением 2 и 3 в одинарную связь. 25. Способ по п.24, отличающийся тем, что стадию восстановления осуществляют путем обработки восстанавливающим агентом в присутствии сильной кислоты. 26. Способ по п.16, отличающийся тем, что, когда группа R1 представляет собой (CH2)nCOORII группу, где RII является алкильной группой, способ дополнительно включает стадию гидролиза с получением соответствующей кислоты. 27. Способ по п.26, отличающийся тем, что стадию гидролиза осуществляют в присутствии сильной кислоты. 28. Промежуточное соединение формулы (III) где G1 представляет собой атом азота или группу CH;G2 представляет собой группу СН;G3 представляет собой группу СН;R1 является (C1-C6)алкильной, (C3-C7)циклоалкильной, (C1-C6)алкил-ORI, (CH2)nCONRIIRIII,(CH2)nCORI, (CH2)nCOORII, (CH2)nOCORI, SO2RI, (CH2)nNRIISO2RI, (CH2)nSO2RI группой, необязательно замещенной 1-3 гидроксигруппами, где n равно целому числу от 1 до 6, RI является (C1-C3)алкильной или(C1-C3)алкил-OH группой и RII и RIII, которые могут быть одинаковыми или различными, являются атомом водорода или метильной группой;(CH2)pC(OH)(CH2)q группой, где р и q, которые могут быть одинаковыми или различными, являются целым числом от 0 до 3;R2 является фенильной, пиридиновой или циклогексильной группой, необязательно замещенной 1-3 заместителями, которые могут быть одинаковыми или различными, представленными группой L-M, гдеL является -связью или (C1-C6)алкильной, O(C1-C6)алкильной группой и М является атомом водорода или галогена либо ОН, CF3, NO2, CN, COORII, SO2NHRII, NRIIRIII, SO2RIV, NHSO2RIV группой, где RII иRIII, которые могут быть одинаковыми или различными, определены выше и RIV и RV, которые могут быть одинаковыми или различными, являются (C1-C3)алкильной группой,при условии, что, когда G1, G2 и G3 все являются группой CH, R1 является (C1-C6)алкильной или(C3-C7)циклоалкильной группой, необязательно замещенной 1-3 гидроксигруппами, W является -связью и связь между атомами углерода в положении 2 и 3 является двойной связью, R2 не является фенильной или пиридиновой группой, необязательно замещенной 1-3 заместителями, которые могут быть одинаковыми или различными, выбранными из галогена, (C1-C6)алкила, необязательно замещенного гидроксигруппой, трифторметила, нитро, амино, ди(C1-C3)алкиламино, гидрокси, (C1-С 3)алкокси, COOH, COORII,SO2CH3, SO2NHCH3, NHSO2CH3, (C1-C6)алкил-COOH, и при условии, что, когда G1 представляет собой N и G2 и G3 являются группой CH, R2 не является двухвалентной ароматической группой, замещенной одной группой L-M, представленнойO(C1-C6)алкильной группой. 29. Промежуточное соединение по п.28, отличающееся тем, что R1 имеет значения, определенные в любом из пп.7 или 8. 30. Промежуточное соединение по п.28, отличающееся тем, что W имеет значения, определенные в любом из пп.9 или 10. 31. Промежуточное соединение по п.28, отличающееся тем, что R2 выбран из фенильной, пиридиновой или циклогексильной группы, необязательно замещенной 1-2 заместителями, которые могут быть одинаковыми или различными, представленными группой L-M, где L является -связью или(C1-C3)алкильной, O(C1-C3)алкильной группой и М является атомом водорода или галогена либо CF3, CN,COORII, SO2NHRII, NRIIRIII, SO2RIV, NHSO2RIV группой, где RII и RIII, которые могут быть одинаковыми или различными, представляют собой атом водорода или метил и RIV и RV, которые могут быть одинаковыми или различными, являются (C1-C3)алкильной группой. 32. Промежуточное соединение по п.28, отличающееся тем, что R2 выбран из фенильной, пиридиновой или циклогексильной группы, необязательно замещенной 1 заместителем, представленным группой L-M, где L является -связью или СН 2, С 2 Н 4, ОСН 2, ОС 2 Н 4 группой и М является атомом водорода или галогена или CF3, CN, COORII, SO2NHRII, NRIIRIII, SO2RIV, NHSO2RIV группой, где RII и RIII, которые могут быть одинаковыми или различными, представляют собой атом водорода или СН 3 группу и RIV иRV, которые могут быть одинаковыми или различными, представляют собой СН 3 или С 2 Н 5 группу. 33. Промежуточное соединение по п.28, отличающееся тем, что W и R2 имеют значения, определенные в любом из пп.13-15. 34. Фармацевтическая композиция, предназначенная для лечения или предотвращения расстройств,связанных с продуцированием простагландина Е 2 (PGE2), выбранных из воспалительных процессов, боли, опухолей, нейродегенеративных расстройств и атеросклероза, содержащая эффективное количество(аза)индольного производного, замещенного по положению 5, формулы (I) в которой X представляет собой атом галогена или метил, трифторметильную, амино-, циано-, гидроксигруппу;Y и Z, которые могут быть одинаковыми или различными, представляют собой атом водорода или галогена либо (C1-C3)алкил, трифторметил, нитро, амино, гидрокси, (C1-C3)алкокси;G1 представляет собой атом азота или группу CH;G2 представляет собой группу CH;G3 представляет собой группу СН;R1 является (C1-C6)алкильной, (C3-C7)циклоалкильной, (C1-C6)алкил-ORI, (CH2)nNRIIRIII,(CH2)nCONRIIRIII, (CH2)nCORI, (CH2)nCOORII, (CH2)nOCORI, SO2RI, (CH2)nNRIISO2RI, (CH2)nSO2RI группой, необязательно замещенной 1-3 гидроксигруппами, где n равно целому числу от 1 до 6, RI является(C1-C3)алкильной или (C1-С 3)алкил-OH группой и RII и RIII, которые могут быть одинаковыми или различными, являются атомом водорода или метилом;(CH2)pC(OH)(CH2)q группой, где р и q, которые могут быть одинаковыми или различными, являются целым числом от 0 до 3;R2 является фенильной, пиридиновой или (С 3-С 7)циклоалкильной группой, необязательно замещенной 1-3 заместителями, которые могут быть одинаковыми или различными, представленными группойL-M, где L является -связью или (C1-C6)алкильной, O(C1-C6)алкильной группой и М является атомом водорода или галогена либо ОН, CF3, NO2, CN, COORII, SO2NHRII, NRIIRIII, SO2RIV, NHSO2RIV группой,где RII и RIII, которые могут быть одинаковыми или различными, определены выше и RIV и RV, которые могут быть одинаковыми или различными, являются (C1-С 3)алкильной группой,- 26020373 при условии, что, когда G1, G2 и G3 все являются группой CH, R1 является (C1-C6)алкильной или(C3-C7)циклоалкильной группой, необязательно замещенной 1-3 гидроксигруппами, W является -связью и связь между атомами углерода в положении 2 и 3 является двойной связью, R2 не является фенильной или пиридиновой группой, необязательно замещенной 1-3 заместителями, которые могут быть одинаковыми или различными, выбранными из галогена, (C1-C6)алкила, необязательно замещенного гидроксигруппой, трифторметила, нитро, амино, ди(C1-C3)алкиламино, гидрокси, (C1-С 3)алкокси, COOH, COORII,SO2CH3, SO2NHCH3, NHSO2CH3 и (Cl-C6)алкил-COOH, и при условии, что, когда G1 представляет собой N и G2 и G3 являются группой CH, R2 не является двухвалентной ароматической группой, замещенной одной группой L-M, представленнойO(C1-C6)алкильной группой; и его физиологически приемлемой соли присоединения, стереоизомеров, энантиомеров, сольватов; и по меньшей мере один фармацевтически приемлемый инертный компонент. 35. Фармацевтическая композиция по п.34, в которой (аза)индольное производное, замещенное по положению 5, формулы (I) в форме сольвата представляет собой гидрат.
МПК / Метки
МПК: C07D 209/18, C07D 209/12, C07D 209/08, C07D 471/04, A61P 29/00, A61K 31/437, A61K 31/404, C07D 401/04
Метки: соединения, аза)индольное, производное, композиция, положению, содержащая, фармацевтическая, способ, промежуточные, замещенное, получения
Код ссылки
<a href="https://eas.patents.su/28-20373-azaindolnoe-proizvodnoe-zameshhennoe-po-polozheniyu-5-soderzhashhaya-ego-farmacevticheskaya-kompoziciya-promezhutochnye-soedineniya-i-sposob-ih-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">(аза)индольное производное, замещенное по положению 5, содержащая его фармацевтическая композиция, промежуточные соединения и способ их получения</a>
Предыдущий патент: Стимуляторы секреции инсулина – производные пиридопиразинонов, способы их получения и их применение для лечения диабета
Следующий патент: Производные бензолсульфонамида, фармацевтические композиции на их основе и применение
Случайный патент: Способ установления соединений между станциями, подключенными к сети связи












