Конъюгат, включающий белок и полимер или его производное (варианты), способ его получения, применение конъюгата и содержащая его фармацевтическая композиция
Номер патента: 14103
Опубликовано: 29.10.2010
Авторы: Лангер Клаус, Орландо Микеле, Цандер Норберт, Зоммермейер Клаус, Конрадт Харальд, Шиммел Мартин, Краус Эльмар, Франк Рональд, Хаккет Франк, Айхнер Вольфрам
Формула / Реферат
1. Способ получения конъюгата, содержащего белок и полимер или его производное, в котором полимер представляет собой гидроксиалкилкрахмал (HAS), предпочтительно гидроксиэтилкрахмал, предпочтительно гидроксиэтилкрахмал, имеющий молекулярную массу от 2 до 200 кДа, предпочтительно от 4 до 130 кДа, более предпочтительно от 4 до 70 кДа, причем способ включает введение в реакцию по меньшей мере одной функциональной группы А полимера или его производного по меньшей мере с одной функциональной группой Z белка с образованием ковалентной связи, причем Z выбирают из группы, состоящей из альдегидной группы и кетогруппы, и А включает аминогруппу, образующую связь с Z, и белок выбирают из группы, состоящей из бета IFN, GM-CSF, АРС, tPA, A1AT, AT III, фактора VII, фактора VIII и фактора IX, причем производное полимера получено введением функциональной группы А в полимер путем реакции полимера на его возможно окисленном восстанавливающем конце, по меньшей мере, с бифункциональным соединением, причем одна функциональная группа, по меньшей мере, бифункционального соединения содержит химическую структуру -NH- и вступает в реакцию с возможно окисленным восстанавливающим концом полимера, а по меньшей мере одна другая функциональная группа, по меньшей мере, бифункционального соединения представляет собой функциональную группу А или химически модифицирована с образованием функциональной группы А.
2. Способ по п.1, в котором альдегидная группа или кетогруппа расположены в боковой углеводной цепи белка и/или в N-концевой группе белка и в котором А обозначает аминооксигруппу или гидразидную группу.
3. Способ по п.2, дополнительно включающий окисление боковой углеводной цепи белка и/или окисление N-концевой группы белка, с получением альдегидной группы или кетогруппы, в котором реакцию окисления предпочтительно осуществляют ферментативно или с использованием перйодата, в случае необходимости, после удаления концевой сиаловой кислоты.
4. Способ по п.2 или 3, дополнительно включающий введение в реакцию полимера на его неокисленном восстанавливающем конце, по меньшей мере, с бифункциональным связывающим соединением, включающим функциональную группу, способную вступать в реакцию с неокисленным восстанавливающим концом полимера и группой А, до реакции производного полимера, включающего А, с белком, включающим Z, причем, по меньшей мере, бифункциональное соединение представляет собой гомобифункциональное соединение, предпочтительно гомобифункциональное соединение, включающее две аминооксигруппы, более предпочтительно гомобифункциональное соединение, представляющее собой О-[2-(2-аминооксиэтокси)этил]гидроксиламин.
5. Способ по п.4, в котором реакцию полимера, по меньшей мере, с бифункциональным связывающим соединением осуществляют в водной среде, причем реакция предпочтительно приводит к образованию оксимной связи и/или оксиаминной связи.
6. Конъюгат, полученный способом по одному из пп.1-5.
7. Конъюгат, включающий белок и полимер или его производное, в котором полимер представляет собой гидроксиалкилкрахмал (HAS) и белок выбран из группы, состоящей из бета IFN, GM-CSF, АРС, tPA, A1AT, AT III, фактора VII, фактора VIII и фактора IX, причем конъюгат имеет структуру формулы
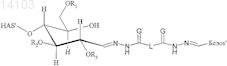
и/или
где R1, R2 и R3независимо обозначают водород или гидроксиалкильную группу, гидроксиарильную группу, гидроксиаралкильную группу или гидроксиалкарильную группу, содержащую от 2 до 10 атомов углерода, предпочтительно водород или гидроксиалкильную группу, более предпочтительно водород или гидроксиэтильную группу,
причем G выбран из группы, состоящей из О и S, предпочтительно О, и
причем L обозначает алкил, арил, аралкил, гетероарил или гетероаралкил, содержащий от 2 до 60 атомов углерода,
причем -L- предпочтительно обозначает -(СН2)n-, где n=2, 3, 4, 5, 6, 7, 8, 9, 10, предпочтительно 2, 3, 4, 5, 6, более предпочтительно 2, 3, 4, и особенно предпочтительно 4.
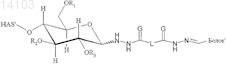
8. Конъюгат, включающий белок и полимер или его производное, в котором полимер представляет собой гидроксиалкилкрахмал (HAS), и белок выбран из группы, состоящей из бета IFN, GM-CSF, АРС, tPA, A1AT, AT III, фактора VII, фактора VIII и фактора IX, причем конъюгат имеет структуру формулы
и/или
в которой R1, R2и R3 независимо обозначают водород или гидроксиалкильную группу, гидроксиарильную группу, гидроксиаралкильную группу или гидроксиалкарильную группу, содержащую от 2 до 10 атомов углерода, предпочтительно водород или гидроксиалкильную группу, более предпочтительно водород или гидроксиэтильную группу, и
в которой G выбран из группы, состоящей из О и S, предпочтительно О.
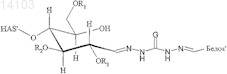
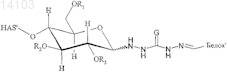
9. Конъюгат, включающий белок и полимер или его производное, в котором полимер представляет собой гидроксиалкилкрахмал (HAS), и белок выбран из группы, состоящей из бета IFN, GM-CSF, АРС, tPA, A1AT, AT III, фактора VII, фактора VIII и фактора IX, причем конъюгат имеет структуру формулы
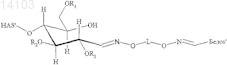
и/или
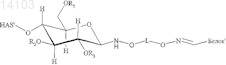
в которой R1, R2и R3 независимо обозначают водород или гидроксиалкильную группу, гидроксиарильную группу, гидроксиаралкильную группу или гидроксиалкарильную группу, содержащую от 2 до 10 атомов углерода, предпочтительно водород или гидроксиалкильную группу, более предпочтительно водород или гидроксиэтильную группу, и
в которой L обозначает алкил, арил, аралкил, гетероарил или гетероаралкил, содержащий от 2 до 60 атомов углерода, причем -L- предпочтительно обозначает -[(CRaRb)mG]n[CRcRd]o-, где Ra, Rb, Rc, Rd независимо обозначают водород, алкил, арил, предпочтительно водород,
где G выбран из группы, состоящей из О и S, предпочтительно О, и где
m = 1, 2, 3 или 4, причем остатки Ra и Rb могут быть одинаковыми или разными в группах CRaRb;
n = от 0 до 20, предпочтительно от 0 до 10, более предпочтительно 1, 2, 3, 4, 5, наиболее предпочтительно 1 или 2;
о = от 0 до 20, предпочтительно от 0 до 10, более предпочтительно 1, 2, 3, 4, 5, наиболее предпочтительно 1 или 2, причем остатки Rc и Rd могут быть одинаковыми или разными в группах CRcRd;
причем целые числа для n и о выбраны таким образом, чтобы в приведенной выше формуле не образовывалось пероксидных звеньев, например n и о не могут быть одновременно равны 0,
и более предпочтительно, в котором Ra, Rb, Rc, Rd обозначают водород, m=2, n=1 и о=2.
10. Конъюгат по одному из пп.7-9, в котором гидроксиалкилкрахмал представляет собой гидроксиэтилкрахмал, предпочтительно гидроксиэтилкрахмал, имеющий молекулярную массу от 2 до 200 кДа, предпочтительно от 4 до 130 кДа, более предпочтительно от 4 до 70 кДа.
11. Конъюгат по п.6 для применения в способе лечения организма человека или животных.
12. Фармацевтическая композиция, включающая в терапевтически эффективном количестве конъюгат по п.6, в случае необходимости дополнительно включающая по меньшей мере один фармацевтически приемлемый разбавитель, адъювант или носитель.
13. Применение конъюгата HAS-белок по одному из пп.6-10, предпочтительно конъюгата HES-белок, в котором белок представляет собой бета IFN, для получения лекарственного средства для лечения рассеянного склероза, предпочтительно рецидивирующих форм рассеянного склероза.
14. Применение конъюгата HAS-белок по одному из пп.6-10, предпочтительно конъюгата HES-белок, в котором белок представляет собой GM-CSF, для получения лекарственного средства для восстановления спинного мозга после трансплантации костного мозга или индукционной химиотерапии у лиц старшего возраста с острым миелогенным лейкозом, неудачей или задержкой приживления трансплантата костного мозга, мобилизацией и после трансплантации аутогенных клеток-предшественников периферической крови.
15. Применение конъюгата HAS-белок по одному из пп.6-10, предпочтительно конъюгата HES-белок, в котором белок представляет собой АРС, для получения лекарственного средства для лечения тяжелого сепсиса, тромбоза, тромбоэмболии или окклюзионных заболеваний, особенно окклюзионных заболеваний артерий.
16. Применение конъюгата HAS-белок по одному из пп.6-10, предпочтительно конъюгата HES-белок, в котором белок представляет собой tPA, для получения лекарственного средства для лечения инфарктов миокарда (сердечные приступы), тромбоза, тромбоэмболии или окклюзионных заболеваний, особенно окклюзионных заболеваний артерий.
17. Применение конъюгата HAS-белок по одному из пп.6-10, предпочтительно конъюгата HES-белок, в котором белок представляет собой А1АТ, для получения лекарственного средства для лечения эмфиземы, муковисцидоза, аллергического дерматита и/или бронхита.
18. Применение конъюгата HAS-белок по одному из пп.6-10, предпочтительно конъюгата HES-белок, в котором белок представляет собой AT III, для получения лекарственного средства для лечения наследственного дефицита, окклюзионного заболевания вен, ожогов и резистентности к гепарину при аортокоронарном шунтировании (CABG), предупреждения образования микросгустков, связанного с вентиляционной терапией, лечения перфорации кишечника в результате травмы или желудочно-кишечной хирургии; диссеминированного внутрисосудистого свертывания (ДВС) и/или сепсиса.
19. Применение конъюгата HAS-белок по одному из пп.6-10, предпочтительно конъюгата HES-белок, в котором белок представляет собой фактор VII, для получения лекарственного средства для лечения эпизодов у пациентов, страдающих гемофилией А или В, с ингибиторами фактора VIII или фактора IX.
20. Применение конъюгата HAS-белок по одному из пп.6-10, предпочтительно конъюгата HES-белок, в котором белок представляет собой фактор VIII, для получения лекарственного средства для лечения гемофилии.
21. Применение конъюгата HAS-белок по одному из пп.6-10, предпочтительно конъюгата HES-белок, в котором белок представляет собой фактор IX, для получения лекарственного средства для борьбы и профилактики геморрагических эпизодов у пациентов с гемофилией В, предпочтительно с врожденным дефицитом фактора IX или Рождественским заболеванием, включая борьбу и профилактику кровотечений в хирургии.
Текст
КОНЪЮГАТ, ВКЛЮЧАЮЩИЙ БЕЛОК И ПОЛИМЕР ИЛИ ЕГО ПРОИЗВОДНОЕ (ВАРИАНТЫ), СПОСОБ ЕГО ПОЛУЧЕНИЯ, ПРИМЕНЕНИЕ КОНЪЮГАТА И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ Изобретение относится к конъюгатам гидроксиалкилкрахмала и белка, причем эти конъюгаты образованы ковалентной связью между гидроксиалкилкрахмалом или производным гидроксиалкилкрахмала и белком. Настоящее изобретение также относится к способу получения этих конъюгатов, содержащей их фармацевтической композиции и к применению этих конъюгатов.(71)(73) Заявитель и патентовладелец: ФРЕЗЕНИУС КАБИ ДОЙЧЛАНД ГМБХ 014103 Настоящее изобретение относится к конъюгатам гидроксиалкилкрахмала и белка, причем эти конъюгаты образованы ковалентной связью между гидроксиалкилкрахмалом или производным гидроксиалкилкрахмала и белком. Настоящее изобретение также относится к способу получения этих конъюгатов и к применению этих конъюгатов. Общепринято считать, что стабильность белков может быть улучшена, и иммунный ответ против этих белков уменьшен, когда эти белки присоединены к полимерным молекулам. В WO 94/28024 раскрыто, что физиологически активные белки, модифицированные полиэтиленгликолем (ПЭГ), демонстрируют сниженную иммуногенность и антигенность и циркулируют в кровотке значительно дольше, чем неконъюгированные белки, то есть имеют сниженную скорость выведения. В WO 02/09766 раскрыты, среди прочих, биологически совместимые соединения белок-полимер,которые получают конъюгацией биологически активного белка с биологически совместимым полимерным производным. Используемые биологически совместимые полимеры представляют собой высоко реакционноспособные разветвленные полимеры, и полученные конъюгаты содержат длинный линкер между полимерным производным и белком. Как биологически совместимые полимеры, описаны полимеры формулы (P-OCH2CO-NH-CHR-CO-)n-L-Qk-A, в которых Р и Q обозначают полимерные остатки, и к может быть равен 1 или 0. Для Р и Q указаны полиэтиленгликоль, полипропиленгликоль, полиоксиэтилен, политриметиленгликоль, полимолочная кислота и ее производные, полиакриловая кислота и ее производные, полиаминокислота, поливиниловый спирт, полиуретан, полифосфазен, поли(L-лизин), полиалкиленоксид, полиакриламид и водорастворимые полимеры, такие как декстран или полисахарид. Как белки, среди прочих, указаны альфа, бета и гамма интерфероны, факторы крови, цитокины, такие как интерлейкины, G-CSF, GM-CSF. В примерах WO 02/09766 раскрыты только производные моно-, ди- и триполиэтиленгликоля, которые присоединяются исключительно к интерферону и эпидермальному фактору роста, и человеческому гормону роста. В WO 94/01483 раскрыты биологически совместимые полимерные конъюгаты, которые образованы ковалентным связыванием биологически неактивного полимера или производного полимера с фармацевтически чистым, синтетическим гидрофильным полимером через определенные типы химических связей. Как встречающиеся в природе полимеры и их производные указаны полисахариды, такие как гиалуроновая кислота, протеогликаны, такие как хондроитинсульфаты А, В и С, хитин, гепарин, сульфат гепарина, декстраны, такие как циклодекстран, гидроксиэтилцеллюлоза, простой эфир целлюлозы и крахмал,липиды, такие как триглицериды и фосфолипиды. Как синтетические полимеры описаны, среди прочих,полиэтилен и его производные, имеющие среднюю молекулярную массу от приблизительно 100 до приблизительно 100 000. Как белки, связанные с полимером или полимерным производным, описаны цитокины и факторы роста, включая интерфероны, факторы некроза опухоли, интерлейкины, колониестимулирующие факторы, факторы роста, такие как экстракт остеогенного фактора, эпидермальный фактор роста, трансформирующий фактор роста, происходящий из тромбоцитов фактор роста, кислый фактор роста фибробластов и другие. Во всех рабочих примерах WO 94/01483, в качестве полимера используются производные полиэтиленгликолей. В WO 96/11953 раскрыты химически модифицированные на N-конце белковые соединения и способы их получения. В частности, описаны композиции G-CSF, которые образуются в результате соединения водорастворимого полимера к N-концу G-CSF. В контексте WO 96/11953 также раскрыты консенсусные соединения интерферона, связанного по N-концу с водорастворимыми полимерами. Хотя в WO 96/11953 перечислен широкий ряд водорастворимых полимеров (например сополимеры этиленгликоля и пропиленгликоля, карбоксилметилцеллюлоза, декстран, поливиниловый спирт, поливинилпирролидон,поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этилена/малеинового ангидрида, полиаминокислоты (как гомополимеры, так и статистические сополимеры), поли(п-винил пирролидон)полиэтиленгликоль, гомополимеры полипропиленгликоля, сополимеры, полипропиленоксид/этиленоксид или полиоксиэтилированные многоатомные спирты), только ПЭГилированный G-CSF или композиции консенсусного IFN описаны в рабочих примерах WO 96/11953.WO 97/30148 относится к конъюгатам полипептида со сниженной аллергенностью, включающим полимерную молекулу носителя, соединенную с двумя или больше полипептидными молекулами. Эти конъюгаты являются предпочтительно частью композиций, используемых на рынке средств персонального ухода. Указанные конъюгаты получают, активируя полимерную молекулу носителя, вводя в реакцию две или более молекул полипептида с активированной полимерной молекулой носителя и блокируя остаточные активные группы на конъюгате. В качестве полимерной молекулы носителя в WO 97/30148 перечислен широкий ряд соединений, включая такие различные группы соединений, как природные или синтетические гомополимеры, такие как многоатомные спирты, полиамины, многоосновные карбоновые кислоты и гетерополимеры, включающие по меньшей мере две различные присоединенные группы. Приведенные примеры включают звездообразные ПЭГ, разветвленные ПЭГ, поливиниловые спирты,поликарбоксилаты, поливинилпирролидоны и поли-D,L-аминокислоты. Среди прочих также раскрыты декстраны, такие как карбоксиметилдекстран, целлюлозы, такие как гидроксиэтилцеллюлоза или гидроксипропилцеллюлоза, продукты гидролиза хитозана, крахмалы, такие как гидроксиэтилкрахмалы или гидроксипропилкрахмалы, гликоген, агароза, гуаровая смола, инулин, пуллулан, ксантановая смола, кар-1 014103 рагенин, пектин, альгиновая кислота и т.д. Как полипептиды, явно раскрыты только некоторые ферменты.Baldwin, J. E. et al., Tetrahedron, vol. 27 (1981), pp. 1723-1726 описывает химическую модификацию декстрана и гидроксиэтилкрахмала с получением альдегидзамещенных полимеров, которым позволяют реагировать с гемоглобином, с получением растворимых полимерсвязанных гемоглобинов. Показано, что они способны связывать кислород, но эксперименты по перфузии сердца ясно показали, что полимерсвязанные гемоглобины не подходят для использования в качестве заменителей крови. В WO 99/49897 описаны конъюгаты гемоглобина, образованные путем реакции полисахаридов, таких как декстран или гидроксиэтилкрахмал, с аминогруппами гемоглобина. Как функциональные группы полисахарида используются альдегидные группы, полученные окислительным размыканием сахаридного кольца. В качестве предпочтительного используемого восстановителя раскрыт борандиметиламин. Кроме того, WO 99/49897 ограничен исключительно гемоглобином.WO 03/074087 относится к способу соединения белков с модифицированным полисахаридом, являющимся производным крахмала. Связывание между белком и полисахаридом, гидроксиалкилкрахмалом, является ковалентной связью, которая формируется между концевой альдегидной группой или функциональной группой, полученной в результате химической модификации указанной концевой альдегидной группы молекулы гидроксиалкилкрахмала, и функциональной группой белка. Как реакционноспособная группа белка, раскрыты аминогруппы, тиогруппы и карбоксильные группы, а альдегидные группы белка не упомянуты. Кроме того, хотя указан широкий ряд возможностей различных связей в форме многих списков, включая различные функциональные группы, теоретически подходящие различные линкерные молекулы и различные химические процедуры, рабочие примеры описывают только две альтернативы: сначала используется окисленный гидроксиэтилкрахмал, который непосредственно присоединяют к белкам, используя этилдиметиламинопропил карбодиимидную (EDC) активацию, или используется неокисленный гидроксиэтилкрахмал, который непосредственно присоединяют к белку, образуя основание Schiff, которое затем восстанавливают до соответствующего амина. Таким образом, рабочие примеры WO 03/074087 не раскрывают отдельный конъюгат, соединенный через тиогруппу или карбоксильную группу белка, а также не описывают конъюгат, включающий гидроксиэтилкрахмал, белок и одну или более линкерных молекул. Почти вся литература относительно способов соединения полимера с белком описывает способы ПЭГилирования и ПЭГилированные белки (например, альфа интерфероны, бета интерфероны). Несмотря на прогресс способов соединения и использование монофункциональных молекул ПЭГ, общий недостаток ПЭГилированных лекарственных средств состоит в том, что пути метаболизма ПЭГ как неприродного полимера детально не известны. Некоторые из патентов описывают модификацию интерферона замещением аминокислот, повышением гликозилирования или формированием мультимеров. Эти способы требуют высоко технологических усилий (рекомбинантные методики) и могут привести к новым соединениям, которые заметно отличаются от природных белков (например, интерферона) и могут показывать другие свойства. Кроме того, в уровне техники описано получение, например, комплексных соединений между IFNбета и полисахаридами через получение комплексного соединения с металлом. Однако комплексные соединения не настолько же стабильны как ковалентные конъюгаты и содержат металлические ионы (например, Zn2+), что может иметь нежелательные побочные эффекты. Таким образом, цель настоящего изобретения состоит в том, чтобы преодолеть указанные недостатки этих методик конъюгации и получить конъюгаты бета-интерферона, основанные на хорошо определенном, биоразлагаемом, водорастворимом полимере, который ковалентно соединен с белком. Другая цель настоящего изобретения состоит в том, чтобы преодолеть указанные недостатки этих методик конъюгации и получить конъюгаты альфа-интерферона, основанные на хорошо определенном,биоразлагаемом, водорастворимом полимере, который ковалентно соединен с белком. Другая цель настоящего изобретения состоит в том, чтобы преодолеть указанные недостатки этих методик конъюгации и получить AT III конъюгаты, основанные на хорошо определенном, биоразлагаемом, водорастворимом полимере, который ковалентно соединен с белком. Другая цель настоящего изобретения состоит в том, чтобы преодолеть указанные недостатки этих методик конъюгации и получить конъюгаты GM-CSF, основанные на хорошо определенном, биоразлагаемом, водорастворимом полимере, который ковалентно соединен с белком. Другая цель настоящего изобретения состоит в том, чтобы преодолеть указанные недостатки этих методик конъюгации и получить конъюгаты А 1 АТ, и/или tPA, и/или АРС, и/или фактора VII, и/или фактора VIII, и/или фактора IX, основанные на хорошо определенном, биоразлагаемом, водорастворимом полимере, который ковалентно соединен с белком. Другая цель настоящего изобретения состоит в том, чтобы разработать способы получения этих конъюгатов. Поэтому, настоящее изобретение относится к способу получения конъюгата, содержащего белок и полимер или его производное, в котором полимер представляет собой гидроксиалкилкрахмал (HAS),предпочтительно гидроксиэтилкрахмал, предпочтительно гидроксиэтилкрахмал, имеющий молекуляр-2 014103 ную массу от 2 до 200 кДа, предпочтительно от 4 до 130 кДа, более предпочтительно от 4 до 70 кДа, причем способ включает введение в реакцию по меньшей мере одной функциональной группы А полимера или его производного по меньшей мере с одной функциональной группой Z белка, и таким образом образование ковалентной связи, причем Z выбирают из группы, состоящей из альдегидной группы и кетогруппы, и причем А включает аминогруппу, образующую указанную связь с Z, и белок выбирают из группы, состоящей из бета IFN, GM-CSF, АРС, tPA, A1AT, AT III, фактора VII, фактора VIII и фактораIX. Соответственно, настоящее изобретение также относится к конъюгату, который может быть получен согласно способу, описанному выше. Белки, которые могут быть конъюгированы согласно изобретению, могут быть охарактеризованы следующим образом. Интерфероны-цитокины, которые опосредуют противовирусные, антипролиферативные и иммуномодулирующие активности в ответ на вирусную инфекцию и другие биологические возбудители. В отличие от альфа IFN, бета IFN является очень видоспецифичным. Есть два подтипа бета IFN, бета 1a IFN и бета 1b IFN. В отношении промышленного получения, главное различие между бета 1a IFN и бета 1bIFN заключается в соответствующих клеточных системах, используемых для их получения, с последствиями в отношении гликозилирования и количества аминокислот. Бета 1a IFN продуцируется клетками млекопитающих и получает обозначение 1 а, потому что его аминокислотная последовательность идентична аминокислотной последовательности природного бета-интерферона. Бета 1b IFN продуцируется бактериями. Интерфероны, как большинство других белков млекопитающих, претерпевает посттрансляционную модификацию путем гликозилирования. Бактерии, однако, не обладают способностью к гликозилированию белков, и, таким образом, бета 1b IFN не включает боковые углеводные цепи, обнаруживаемые в природном материале. Бета 1a IFN имеет 166 аминокислот и молекулярную массу приблизительно 22 500 Д, бета 1b IFN имеет 165 аминокислот и молекулярную массу приблизительно 18 500 Д,потому что в бета 1b IFN вследствие бактериального способа получения отсутствует N-концевой метионин, а также и гликозилирование. Аминокислотная последовательность человеческого бета-интерферона приведена, например, в ЕР 0218825 А 1. О кристаллической структуре бета-интерферона сообщали в:Proc. Natl. Acad. Sci. USA 94 (1997) pp. 11813-11818, Biochemistry, Karpusas M., Nolte M., Benton C.B.,Meier W., Lipscomb W.N., Goelz S. Коммерческие препараты бета-интерферона - Betaseron (бета 1b IFN),Avonex и Rebif (бета 1a IFN). Бета-интерферон 1b получают бактериальным брожением штамма Е. coli,который несет генно-инженерную плазмиду, содержащую ген человеческого интерферона бета ser17. Нативный ген, был получен из человеческих фибробластов и изменен путем замены серином остатка цистеина в положении 17. Бета 1 а интерферон получают технологией рекомбинантной ДНК генноинженерных клеток Яичника Китайского хомячка (СНО), в которые был введен человеческий ген бетаинтерферона. Аминокислотная последовательность бета 1a IFN идентична аминокислотной последовательности природного человеческого бета-интерферона, полученного из фибробластов. Природный бетаинтерферон и бета 1 а интерферон гликозилированы и каждый содержит единственную углеводную часть комплексного соединения, N-связанного по Asn80. Препараты бета-интерферона показаны для лечения рассеянного склероза рецидивирующего/ремитирующего течения. Однако существует множество серьезных побочных эффектов, связанных с введением лекарственных продуктов на основе бетаинтерферона. Кроме того, они вводятся инъекцией (внутримышечный или подкожной), приводя к дополнительным рискам. Уменьшение побочных эффектов и облегчение (например, снижение частоты) введения являются целью многочисленных работ, проводимых с целью улучшения свойств бета IFN. Полимерная модификация белков представляет собой методику, которую используют, чтобы улучшить свойства белков. Основной используемой методикой является модификация интерферона с помощью полиэтиленгликоля, известная как ПЭГилирование. Формы альфа IFN естественным образом продуцируются бимоноцитами/макрофагами, лимфобластными клетками, фибробластами и множеством других типов клеток после индукции вирусами, нуклеиновыми кислотами, глюкокортикоидными гормонами и другими индукторами. Известно по меньшей мере 23 различных варианта альфа IFN. Индивидуальные белки имеют молекулярные массы 19-26 кДа и состоят из белков с длинами 156-166 или 172 аминокислот. Все подтипы альфа IFN обладают общей консервативной областью последовательности между положениями аминокислот 115-151, в то время как амино-концевые концы являются изменчивыми. Многие подтипы альфа IFN отличаются по их последовательностям только в одном или двух положениях. Дисульфидные связи образуются между цистеинами в положениях 1/98 и 29/138. Дисульфидная связь 29/138 является существенной для биологической активности, в то время как связь 1/98 может быть восстановлена без влияния на биологическую активность. Все формы альфа IFN содержат потенциальный сайт гликозилирования, но большинство подтипов не гликозилированы. В отличие от гамма IFN, белки альфа IFN стабильны при рН 2. Промышленное получение альфа IFN осуществляют, используя генетически модифицированную Е. coli. Поскольку бактерии не обладают способностью к гликозилированию белков, оба варианта альфа IFN (альфа 2 а IFN и альфа 2b IFN), которые используются в одобренных лекарственных продуктах, являются негликозилированными. Главный недостаток обычного альфа IFN - побочные эффекты. Много работы было проведено-3 014103 по улучшению препаратов альфа-интерферона, которые показаны для лечения Гепатита С. Полимерная модификация белков представляет собой методику, которую используют, чтобы улучшить свойства белков. Основной используемой методикой является модификация интерферона с помощью полиэтиленгликоля, известная как ПЭГилирование. Два коммерчески доступных варианта ПЭГилированного IFN-альфа- PEGIntron (SP) и Pegasys (Roche). Антитромбин III (AT III) - ингибитор серинпротеазы, который ингибирует тромбин и фактор Ха(Travis, Annu. Rev. Biochem. 52: 655, 1983). В меньшей степени, также ингибируются фактор IXa, XIa,XIIa, tPA, урокиназа, трипсин, плазмин и калликреин (Menache, Semin. Hematol. 28: 1, 1991; Menache,Transfusion 32:580, 1992; Lahiri, Arch. Biochem. Biophys. 175: 737, 1976). Человеческий AT III синтезируется в печени как одноцепочечный гликопротеид из 432 аминокислот с молекулярной массой (ММ) приблизительно 58000 Д. Его нормальная плазменная концентрация находится в пределах диапазона 14-20 мг/дл (Rosenberg, Rev. Hematol. 2 : 351, 1986; Murano, Thromb. Res.18: 259, 1980). Белок несет три дисульфидных связи (Cys 8-128, Cys 21-95, Cys 247-430) и четыре N-связанных углеводных цепи (Asn 96,-135, -155, -192), которые составляют 15% полной массы (Franzen, J. Biol. Chem. 255: 5090, 1980; Peterson, The Physiological Inhibitions of Blood Coagulation and Fibrinolysis, Elsevier/ North-Holland BiomedicalPress 1979, p 43). Антитромбин представляет собой ингибитор серинпротеиназы серпинового типа, который имеет главное значение в контроле коагуляции крови. AT III представляет собой самое массовое эндогенное противокоагулирующее средство, циркулирующее в человеческой плазме, и участвует в регулировании свертывания и в физиологических и в патологических состояниях (Opal, Crit. Care Med. 2002, 30:325). Он циркулирует в двух формах с низкой тромбин-ингибирующей способностью (Pike, J.Biol. Chem. 272: 19562, 1997; Ersdal-Badju, Fed. Proc. 44: 404, 1985) (85-95% альфа изоформы с 4 биантеннальными, моно- и дисиалилированными олигосахаридными цепями, 5-15% - бета-изоформа с высоким сродством к гепарину, негликозилированная по Asn 135, 2-6 концевых сиаловых связей). Небольшая фракция циркулирующего AT III обычно связывается с протеогликанами на поверхности клеток эндотелия сосудов. Эти протеогликаны являются в основном гепарансульфатами, молекулами, структурно подобными гепарину, которые в состоянии катализировать ингибирование тромбина таким же образом, как гепарин. AT III, связывающийся с хорошо определенными пентасахаридными звеньями гепарина, вызывает конформационное изменение белка (Choay, Ann. NY Acad. Sci. 370: 644, 1981; Choay, Biochem. Biophys. Res. Commun. 116: 492,1983; Olson, J. Biol. Chem. 266:6353, 1991; Bauer, Semin. Hematol. 28: 10,1991; Carell, Thromb. Haemost. 78:516, 1997). Это связывание катализирует 1000-кратное усиление ингибирующей активности AT по отношению к тромбину и Фактору Ха (Rosenberg, Fed. Proc. 44: 404, 1985;Olson, J. Biol. Chem. 267: 12528, 1992). Эта локализация фракции AT на эндотелиальной поверхности, где обычно производятся ферменты внутреннего каскада коагуляции, позволяет AT III быстро нейтрализовывать эти гемостатические ферменты и защищать естественные поверхности против формирования тромба. Таким образом, ключевые свойства AT III в предотвращении событий, связанных с образованием тромбов, заключаются в его способности связываться с гепариновым катализатором, претерпевать конформационное изменение, которое изменяет его ингибирующие свойства, и необратимо связываться тромбин или Фактор Ха, таким образом ингибируя их активность.AT III также имеет противовоспалительные свойства, несколько из которых следуют из его действий на каскад коагуляции (Roemisch, Blood Coagul Fibrinolysis. 2002,13: 657). Активированные коагуляционные протеазы, такие как активированный фактор X и тромбин, способствуют воспалению, например путем высвобождения провоспалительных медиаторов. Ингибирование этих протеаз AT III предотвращает их определенное взаимодействие с клетками и последующие реакции (Roemisch, Blood Coagul Fibrinolysis. 2002, 13:657). Противовоспалительные свойства AT III независимого от коагуляции включают прямые взаимодействия с клетками, приводящие к высвобождению, например, простациклина. Связывание AT III с недавно идентифицированным клеточным рецептором, syndecan-4, приводит к интерференции с внутриклеточным сигналом, индуцируемым медиаторами, такими как липополисахариды и, таким образом, к даун-модуляции воспалительного ответа (Roemisch, Blood Coagul Fibrinolysis. 2002,13 : 657). Помимо анализа структуры свободного AT III, было проведено много исследований сайтов комплексообразования с олигосахаридными звеньями гепарина вследствие важности комплексного соединения гепарин-АТ III для физиологической функции AT III (Choay, Ann. NY Acad. Sci. 370: 644, 1981; Choay,Biochem. Biophys. Res.Co.M. Mnun. 116:492, 1983; Olson, J. Biol. Chem. 266:6353, 1991; Bauer, Semin. Hematol. 28:10, 1991; Carell, Thromb. Haemost. 78:516, 1997). AT III может быть получен с помощью обычной методики фракционирования человеческой плазмы. Афинная хроматография (гепарин-сефароза) с использованием высокого сродства гепарина к AT III, с последующей термической обработкой для вирусной инактивации, используется для отделения от плазмы. Более свежими альтернативами, пригодными для получения AT III, являются рекомбинантные технологии получения, которые обеспечивают более безопасный доступ к этому терапевтическому Белку (Levi, Semin Thromb Hemost 27:405, 2001). ATryn рекомбинантный человеческий AT III (rh AT III), получаемый Genzyme Transgenics Corp. (GTC) от трансгенных коз. Были проведены детализированные исследования по сравнению структурных и функцио-4 014103 нальных свойств полученного из плазмы AT III (ph AT III) и rh AT III (Edmunds, Blood, 91:4561, 1998). Основанный на этих экспериментах rh AT III структурно идентичен ph AT III за исключением гликозилирования. Структуры олигоманнозы были обнаружены на Asn 155 трансгенного материала, тогда как комплексные структуры обнаружены в случае белка, полученного из плазмы. Некоторые из звеньев галактозы pd AT III замещены звеньями GalNac в rh AT III. Более высокая степень фукозилирования в rhAT III представляет собой другое отличие. Наконец, структура сиалилирования обоих белков отличается двумя признаками: rh AT III является менее сиалилированным и содержит как N-ацетил-, так и Nгликолилнейраминокислоты. Это структурное различие между двумя углеводными частями обеих молекул также приводит к различным биохимическим свойствам. Следующие препараты AT III доступны на европейском больничном рынке. (Источник: IMS-АТС group 2001):Kybernin (Aventis Behring), AT III(Baxter, Grifols), Atenativ (Pharmacia), Aclotine (LFB), Grifols (Anbin). Фактор VII участвует во внутреннем каскаде коагуляции крови протеиназ и поддерживает гемостаз,активируя внешний путь каскада коагуляции. F VII преобразуется в фактор VIIa фактором Ха, факторомXIIa, фактором IXa или тромбином за счет незначительного протеолиза. В присутствии тканевого фактора и ионов кальция фактор VIIa затем преобразовывает фактор X в фактор Ха ограниченным протеолизом. Фактор VIIa также преобразует фактор IX в фактор IXa в присутствии тканевого фактора и кальция. Фактор VII представляет собой витамин К-зависимый гликопротеин, состоящий из 406 аминокислотных остатков (MW 50 кДальтон). Фактор VII получают или обычной экстракцией из донорской человеческой плазмы или, совсем недавно, используя рекомбинантные системы. Novo Nordisk использует клетки почки детеныша хомяка (ВНК) для получения NovoSeven. Экспрессируемый в форме одноцепочечного белка из 406 аминокислот с номинальной молекулярной массой 55 кДа (Thim, L. et al., Biochemistry 27: 77857793 (1988). Молекула несет четыре боковых углеводных цепи. Две О-связанные боковые углеводные цепи на Ser 52,60 и две N-связанные боковые углеводные цепи на Asn 145, 322 (Thim, L. et al., Biochemistry 27: 7785-7793 (1988. Фактор VIII участвует во внутреннем каскаде коагуляции крови протеиназ и служит ко-фактором в реакции фактора IXa преобразования фактора X в активную форму, фактор Ха, который в конечном счете приводит к формированию сгустка фибрина. Нехватка или неустойчивость фактора VIII приводят к гемофилии А, общему рецессивному х-сцепленному нарушению коагуляции. Частота гемофилии А составляет 1-2 на 10000 рождений младенцев мужского пола во всех этнических группах. Пациенты или действительно экспрессируют уровни фактора VIII значительно ниже нормального, или принадлежат к так называемой группе crm (cross-reacting material) положительных пациентов (приблизительно 5% пациентов), которые имеют значительное количество фактора VIII в плазме (по меньшей мере 30% от нормы), но белок является нефункциональным. Приблизительно 50% всех пациентов имеют тяжелую гемофилию с активностью фактора VIII менее 1% от нормы; у них часто возникают спонтанные кровотечения в суставы, мышцы и внутренние органы. Умеренная гемофилия А, которая встречается у 30-40% пациентов, связана с активностью 5-30% от нормы. Кровотечения наблюдаются только после значительной травмы или хирургического вмешательства. Умеренно тяжелая гемофилия встречается приблизительно у 10% пациентов; здесь активность фактора VIII составляет 2-5% от нормы, и кровотечения наблюдаются уже после незначительной травмы. У человека период полураспада фактора VIII in vivo обычно составляет 10-15 ч, но должно быть отмечено, что высвобождение, стабильность и кинетика разложения находятся также под влиянием другого фактора - фактора van Willebrand. Фактор VIII получают или обычной экстракцией из донорской человеческой плазмы или, совсем недавно, используя рекомбинантные системы. Bayer использует клетки почки детеныша хомяка (ВНК) для продукции Kogenate, тогда как Baxter использует клетки Яичника Китайского хомячка (СНО) для продукта Recombinate, представляющего собой полноразмерный одноцепочечный белок из 2351 аминокислот с номинальной молекулярной массой 267 кДа (Toole et al., 1984, Nature 312:342) или в других версиях, где полный В-домен или его части делетированы для того, чтобы получить продукт, который более стабилен и дает более высокий выход продукции (Bhattacharyya et al. 2003, CRIPS 4/3: 2-8). Продуктпредшественник процессируется в две цепи полипептида 200 и 80 кДа в аппарате Гольджи и эти две цепи, соединенные ионом(ами) металла, экспрессируются в крови (Kaufman et al., 1988, J. Biol. Chem., 263: 6352). Прокоагулянтная активность требует дальнейшего расщепления тромбина для получения фрагментов 54 и 44 кДа тяжелой цепи плюс фрагмента 72 кДа легкой цепи (Aly et al., 1992, Proc. Natl. Acad. Sci.USA: 4933). В концентратах фактора VIII, полученных из человеческой плазмы, были таким образом описаны несколько фрагментированных полностью активных форм фактора VIII (Anderson et al., 1986,Proc. Natl. Acad, Sci. 83: 2979). Общий побочный эффект введения плазматического или рекомбинантного фактора VIII - иммунологические реакции у весьма большого числа пациентов (до 30%), что снижает терапевтическое значение. В прошлом были предприняты различные попытки обеспечить толерантность пациентов пероральной индукцией толерантности, но результаты были не слишком обнадеживающими. Новые генетические средства стимулирования толерантности были предложены, но еще не нашли широкого применения.-5 014103 Предполагается, что гезилированный белок будет иметь более низкую степень иммуногенности и может,таким образом, уменьшить это осложнение. Фактор VIII очень богат остатками лизина (более чем 220 из 2350 аминокислот; см. приложение 1),что может использоваться для подхода восстановительного аминирования. Фактор IX представляет собой витамин К-зависимый белок плазмы, который участвует во внутреннем пути коагуляции крови, преобразовывая фактор X в его активную форму в присутствии ионов Са(2+), фосфолипидов и фактора VIIIa. Фактор IX представляет собой гликопротеид с приблизительной молекулярной массой 55 000 Да, состоящий из 415 аминокислот в одиночной цепи (Yoshitake S. et al.,Biochemistry 24: 3736-3750 (1985. Фактор IX получают или обычной экстракцией из донорской человеческой плазмы, или, совсем недавно, используя рекомбинантные системы. Wyeth использует клетки яичника Китайского хомячка (СНО) для продукции BeneFIX. Он имеет первичную аминокислотную последовательность, которая является идентичной аллельной форме Ala148 фактора IX, полученного из плазмы, и имеет структурные и функциональные характеристики, подобные таковым эндогенного фактора IX. Белок несет восемь боковых углеводных цепей. Шесть боковых углеводных цепей О-связаны сSer 53,61 и с Треонином 159, 169, 172, 179, и две боковых углеводных цепи N-связаны с Asn 157, 167(Yoshitake S. et al., Biochemistry 24:3736-3750 (1985); Balland A. et al., Eur J Biochem. 1988; 172 (3): 56572). Человеческий гранулоцит-макрофаг колониестимулирующий фактор (hGM-CSF) - ранний действующий фактор, существенный для регуляции и дифференцировки предшественников гематопоэтических клеток, а также для того, чтобы стимулировать функциональную активацию популяций зрелых клеток. Он был клонирован и экспрессирован в клетках дрожжей, бактерий, насекомых, растений и млекопитающих, приводя к белку, варьирующем по структуре, составу, периоде полураспада в сыворотке и функциониям in vivo (Donahue, R. E.; Wang, E. A.; Kaufman, R. J.; Foutch, L.; Leary; Witek-Giannetti, J. S.;Metzeger, M.; Hewick, R. M.; Steinbrink, D. R.; Shaw, G.; Kamen, R.; Clark, S. CA. С Effects of N-linked carbohydrates on the in vivo properties of human GM-CSF.Cold Spring Harbor Symp. Quant. Biol. 1986, 51, стр. 685-692). Природный и полученный из клеток млекопитающих hGM-CSF представляет собой белок из 127 аминокислот и содержит как О-, так и N-гликаны. Он является очень гетерогенным вследствие различных состояний заполнения одного или двух сайтов N-гликозилирования и сайта О-гликозилированияof recombinant human granulocyte-macrophage colony-stimulating factor. Blood 1998, 92, стр. 4491-4508). Этот лимфокин представляет клинический интерес благодаря его потенциалу в лечении миелолейкоза и его способности стимулировать продукцию гранулоцитов и макрофагов у пациентов, страдающих иммуннодефицитом или с иммунитетом, подавленным заболеванием или радиацией и/или химиотерапиейyeast or animal cells. Proc. Natl. Acad. Sci. US 1987, 84, pp. 4428-4431). Некоторые исследования позволили предложить, что hGM-CSF, не содержащий N-связанного углевода, имеет значительно более высокую удельную активность in vitro по сравнению с нативным рекомбинантным цитокином (Armitage, J.О.;Colony-Stimulating Factor Purification and characterization of three forms of differently. Arch. Biochem. Biophys. 1991, 286, стр. 562-568; Hovgaard, D.; Mortensen, В. Т.; Schifter, S.; Nissen, N.I. Clinical pharmacokinetic studies of a human haemopoietic growth factor, GM-CSF. Eur. J. Clin. Inv. 1992, 22, pp. 45-49). Однако,есть многочисленные доказательства, подтверждающие ключевую роль углеводных цепей в функцияхhGM-CSF, такие как фармакокинетика (Cebon, J.; Nicola, N.; Ward, M.; Gardner, I.; Dempsey, P.; Layton, J.;sites on recombinant GM-CSF. Lancet 1990, 335, pp. 434-437). Ввиду антигенности, о которой часто сообщали в отношении клинических продуктов GM-CSF от Е. coli и от дрожжей, предложенная стратегия химической модификации представляет собой многообещающий подход для этого продукта, включая полученный от немлекопитающих систем экспрессии. Препараты GM-CSF доступны под названиямиLeukine (Immunex) и Leucomax (Novartis). GM-CSF используется в восстановлении спинного мозга после трансплантации костного мозга, неудачи или задержки приживления трансплантата костного мозга, мобилизации и после трансплантации аутогенных клеток-предшественников периферической крови, и после индукционной химиотерапии у взрослых старшего возраста с острым миелогенным лейкозом. Альфа 1-антитрипсин (А 1 АТ, также называемый ингибитором альфа 1-протеиназы) представляет собой ингибитор протеиназы, который, как показано, ингибирует фактически все сывороточные протеиназы млекопитающих (Travis Ann. Rev. Biochem. 52 (1983) p. 655), включая нейтрофилэластазу, тромбин,факторы Ха и XIa. А 1 АТ - одноцепочечный гликопротеид, синтезируемый в печени, с 394 аминокислотами и молекулярной массой 53 кДа. Плазменная концентрация - в пределах диапазона 1-1,3 г/л. Наличие только одного цистеина в целом белке не позволяет формирование внутримолекулярных дисульфидных связей. Молекула несет три боковых углеводных цепи (Asn 46, 83, 247) (Mega J. Biol. Chem. 255 (1980) p. 4057; Mega J. Biol. Chem. 255 (1980) p.4053; Carell FEBS Letters 135 (1981), p. 301; Hodges Biochemistry 21(1982) p. 2805), что составляет 12% молекулярной массы. Были открыты два типа углеводных цепей,имеющих, соответственно, би- или триантеннальную структуру (Hodges J. Biol. Chem. 254 (1979) p. 8208). Человеческий А 1 АТ встречается в по меньшей мере двенадцати различных формах в общей популяции. Эта микрогетерогенность является результатом различных количеств обоих типов углеводных цепей. Ключевой функцией является активность по контролю над нейтрофилэластазой (Travis Ann. Rev.Biochem. 52 (1983) p. 655). Неконтролируемая активность эластазы приводит к атакам тканей эпителия с необратимыми повреждениями в результате. В ходе инактивации А 1 АТ действует как субстрат для эластазы, связываясь с активным центром протеазы, которая, в результате образования этого комплекса,дезактивируется. Дефицит А 1 АТ вызывает, например, эмфизему легких, которая связана с повреждением легочного эпителия. Распределение обоих типов боковых углеводных цепей А 1 АТ по трем сайтам Nгликозилирования А 1 АТ разное для каждого изотипа А 1 АТ. Обычно получение А 1 АТ осуществляют путем фракционирования человеческой плазмы с использованием различных стадий афинной хроматографии. Однако, более свежий путь получения А 1 АТ заключается в использовании рекомбинантных методик. PPL Therapeutics разработал способ, позволяющий восстановить рекомбинантный человеческий А 1 АТ (rHA1AT) из молока трансгенной овцы (Olman Biochem. Soc. Symp. 63 (1998) p. 141; Tebbutt Curr.Opin. Mol. Ther. 2 (2000), p. 199; Carver Cytotechnology 9 (1992) p. 77; Wright Biotechnology (NY) 9 (1991),p. 830). В отношении белковой части молекулы rhA1AT показывает идентичность структуры с pdA1AT. Однако, как и в случае других полученных рекомбинантных челевеческих белков, имеются отличия в боковых углеводных цепях, особенно в отношении количества остатков сиаловой кислоты. Активатор плазминогена тканевого типа (tPA) представляет собой трипсиноподобную серинпротеазу, играющую важную роль в лизисе сгустков. В присутствии сгустка фибрина tPA превращает плазминоген в плазмин, который разлагает фибрин. tPA проявляет повышенную активность в присутствии фибрина и, как следствие, вызывает фибрин-специфическую активацию плазминогена (M.W. Spellman, L.J.Basa, С.K. Leonard, J.A. Chakel, J.V. O'Connor, The Journal of Biological Chemistry 264 (1989), p. 14100). Плазмин солюбилизирует фибрин, приводя к образованию продуктов распада фибрина. Через механизм положительной обратной связи фибрин усиливает свой собственный распад путем стимуляции опосредуемой tPA активации плазминогена (R.J. Stewart et al. The Journal of Biological Chemistry 275 (2000), pp. 10112-10120). htPA является физиологическим активатором фибринолиза, присутствующим в различных типах тканей. Он представляет собой гликопротеин с молекулярной массой приблизительно 68 кДа. В нативной форме tPA существует в одноцепочечной форме (single-chain tissue-type plasminogen activator,sctPA), которая путем расщепления плазмина по пептидному мостику Arg 275-Ile 276 может быть превращена в двухцепочечную структуру (two-chain tissue-type plasminogen activator, tctPA). Для терапии фибринолиза его получают рекомбинантным путем в виде rtPA (recombinant tissue-type plasminogen activator). Существуют различные типы tPA, демонстрирующие структурные различия в строении углеводов. Тип I tPA имеет N-связанные олигосахариды на аминокислотах Asn117, Asn184 и Asn448. Тип II tPA гликозилирован по Asn117 и Asn448. Оба типа содержат О-связанный остаток фукозы на Thr61 (K. Moriet al. The Journal of Biological Chemistry 270 (1995), pp. 3261-3267). Структура углеводов tPA, экспрессируемого в СНО-клетках, была исследована и показала широкую разновидность ди-, три- и тетраантеннальных структур цепей сахаров (М. W. Spellman, L. J. Basa, С. K. Leonard, J. A. Chakel, J. V. O'Connor,The Journal of Biological Chemistry 264 (1989) p. 14100). Первичная структура tPA содержит несколько цистеинов, которые, как полагают, являются поперечно сшитыми, плюс свободный остаток цистеина в сайте 83, который может взаимодействовать с другим tPA, образуя димер. Несколько результатов указывают, что выведение in vivo tPA зависит от структуры углеводов, особенно от олигосахарида с высоким содержанием маннозы, присоединенного в сайте Asn117. Другой предложенный механизм выведения включает распознавание О-связанного остатка фукозы в Thr61 высокоафинным рецептором на гепатоцитах. Этот остаток расположен близко к Cys83. Был разработан получаемый биоинженерным путем tPA(TNK-tPA), чтобы увеличить период полураспада. Сайт гликозилирования в положении 117 был перемещен в положение 103 путем замены Аспарагина в сайте 117 Глутамином и Треонина в сайте 103 - Аспарагином. TNK-tPA устойчив к инактивации ингибитором активатора плазмогена 1 из-за замещения тетрааланина в протеазном домене (The Journal of Biological Chemistry R. J. Stewart et al. 275 (2000), pp. 10112-10120). TNK-tpA встречается на рынке как Tenecteplase (Boehringer Ingelheim) и может вводиться в качестве единственного внутривенного болюса, в то время как tPA должен вводиться в качестве болюса, сопровождаемого инфузией. Активированный БелокС (АРС) представляет собой модулятор коагуляции и воспаления, связанного с тяжелым сепсисом. Активированный Белок С преобразуется из своего неактивного предшественника (белок С) тромбином, спаренным с тромбомодулином. Этот комплекс отщепляет короткую Nконцевую форму пептида активации от тяжелой цепи белка С, приводя к активированному белку С. Дротрекогин альфа (активированный) представляет собой активированный рекомбинантный белок С человека (rhAPC) с аминокислотной последовательностью, идентичной полученному активированному белку плазмы C и c похожими свойствами. Активированный белок С продается Eli Lilly как Xigris. Его получают на человеческой линии клеток (НЕК 293), в которую вводят векторы экспрессии белка С. Эта особая линия клеток использовалась благодаря способности выполнить правильный ряд сложных посттрансляционных модификаций, которые требуются для функциональной активности. Рекомбинантный активированный человеческий белокС представляет собой гликопротеин с 2 цепями, содержащий 4 сайта N-гликозилирования и 12 дисульфидных мостиков. Тяжелая цепь содержит 250 аминокислот, из которых семь остатков являются цистеинами, и имеет три сайта N-гликозилирования (Asn-248, Asn-313 иAsn-329). Семь остатков цистеина образуют три дисульфидных мостика в составе тяжелой цепи и один дисульфидный мостик между цепями. Легкая цепь содержит один N-связанный сайт гликозилирования(Asn-97) и 17 остатков цистеина, которые образуют восемь дисульфидных мостиков в составе легкой цепи и один дисульфидный мостик с тяжелой цепью. Первые девять остатков глутаминовой кислоты в легкой цепи гамма-карбоксилированы (Gla), а аспарагиновая кислота 71 бета-гидроксилирована. rhAPC имеет аминокислотную последовательность, идентичную полученному из плазмы человеческому активированному белку С, но отличается от последнего по структуре гликозилирования. Активированный белокС представляет собой протеазу, принадлежащую семейству серинпротеаз и играет главную роль в регулировании коагуляции. Основанием для антитромботической функции активированного белка С служит его способность ингибировать функцию тромбина. Кроме того, активированный белок С является важным модулятором воспаления, связанного с тяжелым сепсисом. Эндогенные ингибиторы серинпротеазы являются естественными ингибиторами для активированного белка С, из-за которых активированный белок С имеет очень короткий циркулирующий период полураспада активности (менее 30 мин)in vivo. Выведение активированного белка С из кровообращения опосредуется комбинацией по меньшей мере трех процессов, включая ингибирование ферментативной активности активированного белка С эндогенными протеазными ингибиторами, выведение активированного белка С и/или комплексов активированный белок С-ингибиторы серинпротеазы такими органами как печень и почки, и разложение активированного белка С и/или комплексов активированный белок С-ингибиторы серинпротеазы циркулирующими или тканевыми протеазами. Результаты, показанные в Фазе I клинических исследований с 24 часовой инфузией со скоростью 24 мкг/кг/ч, обнаруживают концентрацию динамического равновесия в плазме 70 нг/мл. Период полураспада rhAPC, измеренный в конце инфузии, составлял 0,5-1,9 ч. Концентрации rhAPC в плазме упали ниже порога чувствительности 10 нг/мл в течение 2 ч после завершения инфузии. Вследствие его короткого физиологического и фармакокинетического периода полураспада,активированный белок С вводится непрерывно инфузией в определенных количествах для поддержания желаемой концентрации в плазме в клиническом использовании в терапии сепсиса. Некоторые усилия были предприняты, чтобы улучшить фармакокинетический профиль активированного белка С. Например, D. Т. Berg et al. Proc. Natl. Acad. Sci. USA 100 (2003), pp. 4423-4428, описывают инженерный вариант активированного белка С с длительным плазменным периодом полураспада. В контексте настоящего изобретения, термин "гидроксиалкилкрахмал" (HAS), относится к производному крахмала, которое было замещено по меньшей мере одной гидроксиалкильной группой. Предпочтительный гидроксиалкилкрахмал согласно настоящему изобретению имеет строение согласно формуле (I) в которой восстановительный конец молекулы крахмала показан в неокисленной форме, и концевое сахаридное звено показано в ацетальной форме, которая, в зависимости от, например, растворителя, может быть в равновесии с альдегидной формой. Термин гидроксиалкилкрахмал в настоящем изобретении не ограничен соединениями, где концевая углеводная часть включает гидроксиалкильные группы R1, R2 и/или R3, как изображено, для краткости, в формуле (I), но также относится к соединениям, в которых по меньшей мере одна гидроксильная группа,имеющаяся в концевой углеводной части и/или в остальной части молекулы крахмала, HAS', замещена гидроксиалкильной группой R1, R2 или R3. Гидроксиалкилкрахмал, включающий две или более различных гидроксиалкильных групп, также может использоваться. По меньшей мере одна гидроксиалкильная группа в составе HAS может содержать две или более гидроксильных групп. Согласно предпочтительному варианту осуществления по меньшей мере одна гидроксиалкильная группа в составе HAS содержит одну гидроксильную группу. Выражение "гидроксиалкилкрахмал" также включает производные, в которых алкильная группа является моно- или полизамещенной. В этом контексте предпочтительно алкильная группа замещена галогеном, особенно фтором или арильной группой. Кроме того, концевая гидроксильная группа гидроксиалкильной группы может быть эстерифицирована или этерифицирована. Кроме того, вместо алкила также могут использоваться прямые или разветвленные замещенные или незамещенные алкеновые группы. Гидроксиалкилкрахмал представляет собой эфирное производное крахмала. Кроме указанных эфирных производных также в контексте настоящего изобретения могут использоваться другие производные крахмала. Например, пригодны производные, которые включают этерифицированные гидроксильные группы. Эти производные могут быть, например, производными незамещенных моно- или дикарбоновых кислот с 2-12 атомами углерода или их замещенных производных. Особенно пригодны производные незамещенных одноосновных карбоновых кислот с 2-6 атомами углерода, особенно производные уксусной кислоты. В этом контексте предпочтительны ацетилкрахмал, бутирилкрахмал и пропиноилкрахмал. Кроме того, предпочтительны производные незамещенных дикарбоновых кислот с 2-6 атомами углерода. В случае производных дикарбоновых кислот, предпочтительно вторая карбоксильная группа дикарбоновой кислоты также этерифицирована. Кроме того, производные сложных моноалкиловых эфиров дикарбоновых кислот являются также подходящими в контексте настоящего изобретения. Для замещенных моно- или дикарбоновых кислот, группы заместителя могут быть предпочтительно теми же самыми, как указано выше для замещенных алкильных остатков. Методики эстерификации крахмала известны в уровне техники (см., например, Klemm D. et al,Comprehensive Cellulose Chemistry, Vol. 2,1998, Whiley-VCH, Weinheim, New York, особенно глава 4,4,Esterification of Cellulose (ISBN 3-527-29489-9. Согласно предпочтительному варианту осуществления настоящего изобретения, используется гидроксиалкилкрахмал согласно формуле (I). В формуле (I) сахаридное кольцо, описанное подробно, и остаток, обозначенный HAS' вместе представляют предпочтительную молекулу гидроксиалкилкрахмала. Другие сахаридные кольцевые структуры, включенные в HAS', могут быть теми же самыми или отличными от подробно описанного сахаридного кольца. Что касается остатков R1, R2 и R3 согласно формуле (I), нет никаких определенных ограничений. Согласно предпочтительному варианту осуществления R1, R2 и R3 обозначают независимо водород или гидроксиалкильную группу, гидроксиарильную группу, гидроксиаралкильную группу или гидроксиалкарильную группу, имеющие от 2 до 10 атомов углерода в соответствующем алкильном остатке, или группу (CH2CH2O)n-Н, в которой n обозначает целое число, предпочтительно 1, 2, 3, 4, 5 или 6. Водород и гидроксиалкильная группа, содержащая от 2 до 10, являются предпочтительными. Более предпочтительно, гидроксиалкильная группа имеет от 2 до 6 атомов углерода, более предпочтительно от 2 до 4 атомов углерода и еще более предпочтительно от 2 до 4 атомов углерода. "Гидроксиалкилкрахмал" поэтому предпочтительно включает гидроксиэтилкрахмал, гидроксипропилкрахмал и гидроксибутилкрахмал, причем гидроксиэтилкрахмал и гидроксипропилкрахмал являются особенно предпочтительными, и гидроксиэтилкрахмал является наиболее предпочтительным. Алкил, арил, аралкил и/или алкарил может быть прямым или разветвленным и, в случае необходимости, соответствующим образом замещенным.-9 014103 Поэтому, настоящее изобретение также относится к способу, как описано выше, где R1, R2 и R3 обозначают независимо водород или прямую или разветвленную гидроксиалкильную группу с от 1 до 6 атомов углерода. Таким образом, R1, R2 и R3 предпочтительно могут представлять собой гидроксигексил, гидроксипентил, гидроксибутил, гидроксипропил, такой как 2-гидроксипропил, 3-гидроксипропил, 2-гидроксиизопропил, гидроксиэтил, такой как 2-гидроксиэтил, и особенно предпочтительны водород и 2 гидроксиэтил. Поэтому, настоящее изобретение также относится к способу и конъюгату, как описано выше, гдеR1, R2 и R3 обозначают независимо водород или 2-гидроксиэтил, причем особенно предпочтителен вариант осуществления, в котором по меньшей мере один остаток R1, R2 и R3 представляет собой 2 гидроксиэтил. Гидроксиэтилкрахмал (HES) является наиболее предпочтительным для всех вариантов осуществления настоящего изобретения. Поэтому, настоящее изобретение относится к способу и конъюгату, как описано выше, в которых полимер представляет собой гидроксиэтилкрахмал, и производное полимера - производное гидроксиэтилкрахмала. Гидроксиэтилкрахмал (HES) представляет собой производное природного амилопектина и разлагается альфа-амилазой в организме. HES представляет собой замещенное производное углеводного полимера амилопектина, который присутствует в кукурузном крахмале в концентрации до 95 вес.%. HES показывает выгодные биологические свойства и используется как средство восполнения объема крови и в терапии гемодилюции в клиниках (Sommermeyer et al., 1987, Krankenhauspharmazie, 8 (8), 271-278; иWeidler и др., 1991, Arzneim.-Forschung/Drug Res., 41, 494-498). Амилопектин состоит из частей глюкозы, в которой в главной цепи присутствуют альфа-1,4 гликозидные связи, а в местах разветвлений находятся альфа-1,6-гликозидные связи. Физико-химические свойства этой молекулы главным образом определяются типом гликозидных связей. Вследствие разрезания альфа-1,4-гликозидной связи образуются спиральные структуры приблизительно с шестью мономерами глюкозы на виток. Физико-химические, а также биохимические свойства полимера могут быть изменены путем замещения. Введение группы оксиэтила может быть осуществлено с помощью щелочного гидроксиэтилирования. Адаптацией условий реакции возможно задействовать другую реакционную способность соответствующей гидроксильной группы в незамещенном мономере глюкозы относительно гидроксиэтилирования. Вследствие этого факта, специалист может ограниченно влиять на структуру замещения.HES главным образом характеризуется распределением молекулярной массы и степенью замещения. Есть две возможности описания степени замещения: 1. Степень замещения может быть описана относительно части замещенных мономеров глюкозы по отношению ко всем частям глюкозы. 2. Степень замещения может быть описана как молярное замещение, в котором описано число оксиэтильных групп на часть глюкозы. В контексте настоящего изобретения, степень замещения, обозначенная DS, относится к молярному замещению, как описано выше (см. также Sommermeyer et al., 1987, Krankenhauspharmazie, 8 (8), 271-278,как процитировано выше, в особенности р. 273). Растворы HES присутствуют, как полидисперсные композиции, в которых каждая молекула отличается от другой в отношении степени полимеризации, количества и структуры участков разветвления и структуры замещения. HES поэтому представляет собой смесь соединений с различной молекулярной массой. Следовательно, конкретный раствор HES определяется средней молекулярной массой с помощью статистических средств. В этом контексте, Mn вычисляют как среднее арифметическое в зависимости от количества молекул. Альтернативно, Mw (или MW), средний вес, представляет собой единицу,которая зависит от массы HES. В контексте настоящего изобретения, гидроксиэтилкрахмал может предпочтительно иметь в среднем молекулярную массу (средний вес) от 1 до 300 кДа. Гидроксиэтилкрахмал может также демонстрировать предпочтительную молярную степень замещения от 0,1 до 3, предпочтительно от 0,1 до 2, более предпочтительно от 0,1 до 0,9, предпочтительно, от 0,1 до 0,8 и предпочтительное отношение между замещениями C2:C6 в диапазоне от 2 до 20 относительно гидроксиэтильных групп. Термин "средняя молекулярная масса", используемая в контексте настоящего изобретения, относится к массе, определяемой согласно способу LALLS-(лазерное рассеяние света под малым углом)-GPC как описано в Sommermeyer et al., 1987, Krankenhauspharmazie, 8 (8), 271-278; и Weidler et al., 1991,Arzneim.-Forschung/Drug Res., 41,494-498. Для средних молекулярных масс 10 кДа и менее дополнительно выполняли калибровку со стандартом, который был предварительно квалифицирован LALLS-GPC. Согласно предпочтительному варианту осуществления настоящего изобретения, средняя молекулярная масса используемого гидроксиэтилкрахмала составляет от 1 до 300 кДа, предпочтительно от 2 до 200 кДа, более предпочтительно от 3 до 100 кДа, более предпочтительно от 4 до 70 кДа. Примером HES, имеющего в среднем молекулярную массу приблизительно 130 кДа, является HES- 10014103 со степенью замещения от 0,2 до 0,8, такой как 0,2, 0,3, 0,4, 0,5, 0,6, 0,7 или 0,8, предпочтительно от 0,4 до 0,7, такой как 0,4, 0,5, 0,6 или 0,7. Примером HES со средней молекулярной массой приблизительно 130 кДа является Voluven отFresenius. Voluven - искусственный коллоид, используемый, например, для заполнения объема, применяемым в терапевтических целях для терапии и профилактики гиповолемии. ХарактеристикамиVoluven являются средняя молекулярная масса 130000 +/-20000 Д, молярное замещение 0,4 и отношение С 2:С 6 приблизительно 9:1. Поэтому, настоящее изобретение также относится к способу и конъюгатам, как описано выше, в которых гидроксиалкилкрахмал является гидроксиэтилкрахмалом, имеющим среднюю молекулярную массу от 4 до 100 кДа, предпочтительно 4-70 кДа. Предпочтительные диапазоны средней молекулярной массы составляют, например, 4-70 кДа или 10-70 кДа, или 12-70 кДа, или 18-70 кДа, или 50-70 кДа, или 4-50 кДа, или 10-50 кДа, или 12-50 кДа, или 18-50 кДа, или 4-18 кДа, или 10-18 кДа, или 12-18 кДа, или 4-12 кДа, или 10-12 кДа, или 4-10 кДа. Согласно особенно предпочтительным вариантам осуществления настоящего изобретения, средняя молекулярная масса используемого гидроксиэтилкрахмала находится в диапазоне от более 4 кДа и менее 70 кДа, например, приблизительно 10 кДа, или в диапазоне от 9 до 10 кДа, или от 10 до 11 кДа, или от 9 до 11 кДа, или приблизительно 12 кДа, или в диапазоне от 11 до 12 кДа, или от 12 до 13 кДа, или от 11 до 13 кДа, или приблизительно 18 кДа, или в диапазоне от 17 до 18 кДа, или от 18 до 19 кДа, или от 17 до 19 кДа, или около 30 кДа, или в диапазоне от 29 до 30, или от 30 до 31 кДа, или около 50 кДа, или в диапазоне от 49 до 50 кДа, или от 50 до 51 кДа, или от 49 до 51 кДа. Относительно верхнего предела молярной степени замещения (DS), также возможны значения до 3,0, такие как 0,9, 1,0, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9 или 2,0, предпочтительны значения ниже 2,0,более предпочтительны значения ниже 1,5, еще более предпочтительны значения ниже 1,0, такие как 0,7,0,8 или 0,9. Поэтому, предпочтительные диапазоны молярной степени замещения составляют от 0,1 до 2 или от 0,1 до 1,5, или от 0,1 до 1,0, или от 0,1 до 0,9, или от 0,1 до 0,8. Более предпочтительные диапазоны молярной степени замещения составляют от 0,2 до 2 или от 0,2 до 1,5, или от 0,2 до 1,0, или от 0,2 до 0,9,или от 0,2 до 0,8. Еще более предпочтительные диапазоны молярной степени замещения составляют от 0,3 до 2 или от 0,3 до 1,5, или от 0,3 до 1,0, или от 0,3 до 0,9, или от 0,3 до 0,8. Еще более предпочтительные диапазоны молярной степени замещения составляют от 0,4 до 2, или от 0,4 до 1,5, или от 0,4 до 1,0,или от 0,4 до 0,9, или от 0,4 до 0,8. Что касается степени замещения (DS), DS составляет предпочтительно по меньшей мере 0,1, более предпочтительно по меньшей мере 0,2 и более предпочтительно по меньшей мере 0,4. Предпочтительны диапазоны DS от 0,1 до 0,8, более предпочтительно от 0,2 до 0,8, более предпочтительно от 0,3 до 0,8 и еще более предпочтительно от 0,4 до 0,8, еще более предпочтительно от 0,1 до 0,7, более предпочтительно от 0,2 до 0,7, более предпочтительно от 0,3 до 0,7 и более предпочтительно от 0,4 до 0,7. Особенно предпочтительные значения DS составляют, например, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7 или 0,8, причем наиболее предпочтительно 0,2, 0,3, 0,4, 0,5, 0,6, 0,7 или 0,8, еще более предпочтительно 0,3, 0,4, 0,5, 0,6, 0,7 или 0,8, еще более предпочтительно 0,4, 0,5, 0,6, 0,7 или 0,8 и например 0,4 и 0,7 являются особенно предпочтительными. В контексте настоящего изобретения данное значение молярной степени замещения, такое как 0,8,может быть точным значением или может быть понято как находящееся в диапазоне от 0,75 до 0,84. Поэтому, например, данное значение 0,1 может быть точным значением 0,1 или может находиться в диапазоне от 0,05 до 0,14, данное значение 0,4 может быть точным значением 0,4 или составлять от 0,35 до 0,44, или данное значение 0,7 может быть точным значением 0,7 или находиться в диапазоне от 0,65 до 0,74. Особенно предпочтительными комбинациями молекулярной массы гидроксиалкилкрахмала, предпочтительно гидроксиэтилкрахмала, и его степени замещения DS являются, например, 10 кДа и 0,4 или 10 кДа и 0,7, или 12 кДа и 0,4, или 12 кДа и 0,7, или 18 кДа и 0,4, или 18 кДа и 0,7, или 30 кДа и 0,4, или 30 кДа и 0,7, или 50 кДа и 0,4, или 50 кДа и 0,7, или 100 кДа и 0,7. Что касается отношения замещения C2:C6, указанное замещение находится предпочтительно в диапазоне от 2 до 20, более предпочтительно в диапазоне от 2 до 15 и еще более предпочтительно в диапазоне от 3 до 12. Согласно следующему варианту осуществления настоящего изобретения также могут использоваться смеси гидроксиэтилкрахмалов, имеющих разные средние молекулярные массы и/или разные степени замещения и/или разные отношения замещения C2:С 6. Поэтому, могут использоваться смеси гидроксиэтилкрахмалов, имеющих разные средние молекулярные массы и разные степени замещения и разные отношения замещения C2:C6, или имеющие разные средние молекулярные массы и разные степени замещения и одинаковое или почти одинаковое отношение замещения С 2:C6, или имеющие разные средние молекулярные массы и одинаковую или почти одинаковую степень замещения и разные отношения замещения С 2:C6, или имеющие одинаковую или почти одинаковую среднюю молекулярную массу и раз- 11014103 ные степени замещения и разные отношения замещения C2:C6, или имеющие разные средние молекулярные массы и одинаковую или почти одинаковую степень замещения и одинаковое или почти одинаковое отношение замещения С 2:C6, или имеющие одинаковую или почти одинаковую среднюю молекулярную массу и разные степени замещения и одинаковое или почти одинаковое отношение замещения С 2:C6, или имеющие одинаковую или почти одинаковую среднюю молекулярную массу и одинаковую или почти одинаковую степень замещения и разные отношения замещения С 2:C6, или имеющие почти одинаковую среднюю молекулярную массу и почти одинаковую степень замещения и почти одинаковое отношение замещения С 2:C6. В различных конъюгатах и/или различных способах согласно настоящему изобретению могут использоваться различные гидроксиалкилкрахмалы, предпочтительно различные гидроксиэтилкрахмалы и/или различные смеси гидроксиалкилкрахмалов, предпочтительно различные смеси гидроксиэтилкрахмалов. Согласно одному варианту осуществления настоящего изобретения функциональная группа Z белка является альдегидной группой или кетогруппой. Поэтому, настоящее изобретение относится к способу и конъюгатам, как описано выше, в которых функциональная группа Z белка является альдегидной группой или кетогруппой. Хотя нет никаких общих ограничений относительно местоположения альдегидной группы или кетогруппы в пределах белка, альдегидная группа или кетогруппа, согласно предпочтительному варианту осуществления настоящего изобретения, расположены в боковой углеводной цепи белка. Поэтому, в контексте этого варианта осуществления, используется гликозилированный белок. В качестве гликозилированного белка предпочтительны гликозилированные формы бета IFN, такие как природный человеческий бета IFN или бета 1a IFN, природный или полученный из эукариотической клетки hGM-CSF, содержащий как N-, так и О-гликаны, рекомбинантный человеческий активированный белок C(rhAPC), представляющий собой гликопротеин с 2 цепями, содержащий 4 сайта N-гликозилирования, человеческий tPA (htPA) или рекомбинантный человеческий tPA (rhtPA) такой как тип I tPA,имеющий олигосахариды, N-связанные с аминокислотами Asn117, Asn184 и Asn448 или тип II tPA, являющийся гликозилированным по Asn117 и Asn448, плазменный А 1 АТ или рекомбинантный человеческий А 1 ат (pdAlAT или rhAlAT), рекомбинантный человеческий AT III (rhAT), фактор VII, фактор VIII и фактор IX. Гликозилированные формы бета IFN, AT III и GM-CSF являются особенно предпочтительными. В контексте настоящего изобретения, термин "гликозилированный белок", то есть белок, имеющий"боковую углеводную цепь", относится к белкам, включающим углеводные части, такие как гидроксиальдегиды или гидроксикетоны, а также к их химическим модификациям (см. Rmpp Chemielexikon;Thieme Verlag Stuttgart, Germany, 9th edition 1990, Volume 9, 2281-2285 и процитированную там литературу). Кроме того, он также относится к производным природных углеводных частей, таких как галактозы, N-ацетилнейраминокислоты и N-ацетилгалактозамин и т.п. В еще более предпочтительном варианте осуществления альдегидная группа или кетогруппа составляют часть остатка галактозы боковой углеводной цепи. Этот остаток галактозы может быть сделан доступным для реакции с функциональной группой А в составе полимера или производного полимера путем удаления концевых сиаловых кислот с последующим окислением, как описано далее. В другом предпочтительном варианте осуществления полимер или производное полимера, включающее функциональную группу А, связано с остатком сиаловой кислоты боковых углеводных цепей,предпочтительно с остатком сиаловой кислоты боковой углеводной цепи. Окисление концевых углеводных частей может быть выполнено химическим или ферментативным путем. Способы химического окисления углеводных частей полипептидов известны в уровне техники и включают обработку перйодатом (Chamow et al., 1992, J. Biol. Chem., 267, 15916-15922). Химическим окислением, в принципе, возможно окислить любую углеводную часть, концевую или нет. Однако, выбирая умеренные условия реакции, возможно предпочтительно окислить концевую сиаловую кислоту боковой углеводной цепи, с получением альдегидной группы или кетогруппы. Согласно одному варианту осуществления настоящего изобретения указанные умеренные условия реакции касаются реакции белка с подходящим водным раствором перйодата, имеющим предпочтительную концентрацию перйодата в диапазоне от 1 до 50 мМ, более предпочтительно от 1 до 25 мМ и особенно предпочтительно от 1 до 10 мМ, например, приблизительно 1 мМ, и при предпочтительной температуре реакции от 0 до 40 С и особенно предпочтительно от 0 до 21 С, например приблизительно 0 С, и с предпочтительным временем реакции от 5 мин до 5 ч, более предпочтительно от 10 мин до 2 ч и особенно предпочтительно от 10 мин до 1 ч, например приблизительно 1 ч. Предпочтительное молярное отношение перйодат:белок составляет от 1:200 до 1:1 и более предпочтительно от 1:50 до 1:5, например,приблизительно 15:1. Поэтому настоящее изобретение также относится к способу и конъюгату, как описано выше, в которых, до реакции белка и полимера или производного полимера, гликозилированный белок вводят в реакцию с раствором перйодата, чтобы получить белок, имеющий альдегидную группу или кетогруппу,- 12014103 расположенную в окисленной боковой углеводной цепи, причем указанную реакцию предпочтительно проводят в умеренных условиях реакции окисления. Термин "умеренные условия реакции", как используется в этом контексте, относится к, например, 1 мМ раствору перйодата и температуре реакции 0 С, в отличие от жестких условий, таких как 10 мМ раствор перйодата и температура реакции 20-25 С. Альтернативно боковая углеводная цепь может быть окислена ферментативно. Ферменты для окисления отдельной боковой углеводной цепи известны в уровне техники, например, в случае галактозы фермент является галактозоксидазой. Если требуется окислить концевые части галактозы, то будет в конечном счете необходимо удалить концевые сиаловые кислоты (частично или полностью), если полипептид был получен в клетках, способных к присоединению сиаловых кислот к углеводным цепям, например, в клетках млекопитающих или в клетках, которые были генетически модифицированы, чтобы быть способными к присоединению сиаловых кислот к углеводным цепям. Химические или ферментативные способы удаления сиаловых кислот известны в уровне техники (Chaplin and Kennedy (eds.), 1996,Carbohydrate Analysis: a practical approach, особенно Chapter 5 Montreuill, Glycoproteins, pp. 175-177; IRLPress Practical approach series (ISBN 0-947946-44-3 . Согласно другому предпочтительному варианту осуществления настоящего изобретения, альдегидная группа или кетогруппа могут быть расположены на N-конце белка и доступны для окисления. Особенно в случае, когда содержащая гидроксигруппу, аминокислота, такая как треонин или серин, расположена на N-конце белка в положении 1, может быть выполнено окисление указанной N-концевой аминокислоты, приводя к указанной кетогруппе или альдегидной группе, предпочтительно, альдегидной группе. В качестве способа химического окисления соответствующей N-концевой аминокислоты, может быть использован любой подходящий способ, причем предпочтительно окисление с перйодатом, в мягких условиях окисления. Согласно другому предпочтительному варианту осуществления настоящего изобретения указанные умеренные условия реакции касаются реакции белка с подходящим водным раствором перйодата,имеющим предпочтительную концентрацию перйодата в диапазоне от 1 до 50 мМ, более предпочтительно от 1 до 25 мМ и особенно предпочтительно от 1 до 10 мМ, например, приблизительно 1 мМ и при предпочтительной температуре реакции от 0 до 40 С и особенно предпочтительно от 0 до 21 С, например приблизительно 0 С, и при предпочтительном времени реакции от 5 мин до 5 ч, более предпочтительно от 10 мин до 2 ч и особенно предпочтительно от 10 мин до 1 ч, например приблизительно 1 ч. Предпочтительное молярное отношение перйодат:белок составляет от 1:200 до 1:1 и более предпочтительно от 1:50 до 1:5, например приблизительно 15:1. Поэтому, настоящее изобретение также относится к способу и конъюгату, как описано выше, в которых альдегидная группа или кетогруппа расположены в боковой углеводной цепи белка и/или в Nконцевой-группе белка. Структура олигосахаридов белков, продуцируемых в эукариотических клетках и, таким образом,гликозилированных пост-трансляционно, не идентична белкам, полученным от человека. Кроме того,многие гликозилированные белки не имеют желательного количества концевых остатков сиаловых кислот, маскирующих дальнейшую углеводную часть, такую как остаток галактозы. Эти дальнейшие углеводные части, такие как остаток галактозы, однако, если не замаскированы, являются возможно ответственными за недостатки, такие как более короткий плазменный период полураспада белка при возможных использованиях белка в качестве лекарственного средства. Неожиданно было обнаружено, что, путем получения конъюгата белка, сформированного полимером гидроксиалкилкрахмала, предпочтительно полимером гидроксиэтилкрахмала, который ковалентно связан, например, оксимной связью, как раскрыто ниже, с углеводной частью боковой углеводной цепи белка, или непосредственно или посредством по меньшей мере одного линкерного соединения, такого как одно или два линкерных соединения, возможно преодолеть, по меньшей мере, указанный недостаток. Следовательно, предполагается, что, соединяя полимер гидроксиалкилкрахмала или его производного, предпочтительно полимер гидроксиэтилкрахмала или его производного, по меньшей мере с одной боковой углеводной цепью гликозилированного белка,можно компенсировать недостаток подходящих концевых остатков углевода, расположенных в боковой углеводной цепи. Согласно другому аспекту изобретения, получая соответствующий конъюгат полимера гидроксиалкилкрахмала или его производного, предпочтительно полимера гидроксиэтилкрахмала или его производного, соединенный с оксиленной углеводной частью, как описано выше, не только компенсируют указанный недостаток, но получают конъюгат белка, имеющий лучшие характеристики в желаемой области применения, чем соответствующий природный белок. Поэтому соответствующие конъюгаты согласно изобретению имеют компенсационный и даже синергический эффект на белок. Также возможно, что даже белки, которые являются идентичными человеческим белкам или которые являются человеческими белками, не имеют желаемого количества подходящих маскирующих концевых углеводных остатков, таких как остатки сиаловой кислоты, в природных углеводных частях. В таких случаях,получая соответствующие конъюгаты полимера гидроксиалкилкрахмала или его производного, предпочтительно полимера гидроксиэтилкрахмала или его производного, соединенного с оксиленной углеводной частью, как описано выше, не только преодолевают и компенсируют этот недостаток искусственно полученного белка, но улучшают характеристики природного белка. Что касается функциональной группы- 13014103 гидроксиалкилкрахмала, предпочтительно гидроксиэтилкрахмала или его производного, которая присоединяется к альдегидной группе или кетогруппе окисленной углеводной части белка, можно обратиться к описанию функциональных групп А, как раскрыто ниже. Эта общая концепция не только применима к гликозилированному G-CSF, но и в принципе ко всем гликозилированным белкам, имеющим указанную нехватку концевых остатков углевода. Среди прочих, может быть упомянут эритропоэтин (ЕРО), интерферон бета 1 а (бета IFN 1a), ATIII, фактор VIII, альфа 1-антитрипсин (А 1 АТ), htPA или GM-CSF. Кроме того, настоящее изобретение также относится к конъюгату, образованному ковалентным присоединением гидроксиалкилкрахмала, предпочтительно гидроксиэтилкрахмала или его производного, к одной окисленной углеводной части белка, причем указанный белок или выделяют из естественных источников, или получают экспрессией в эукариотических клетках, таких как клетки млекопитающих,насекомых или в дрожжевых клетках, причем указанная углеводная часть имеет по меньшей мере одну кетогруппу или альдегидную группу, причем конъюгат имеет в желаемой области применения, предпочтительно, в применении в качестве лекарственного средства, такие же или лучшие характеристики по сравнению с соответствующим немодифицированным белком. В случае, если функциональная группа Z белка представляет собой альдегидную группу или кетогруппу, функциональная группа полимера или его производного включает аминогруппу согласно структуре -NH-. Поэтому, настоящее изобретение также относится к способу и конъюгату, как описано выше, в которых функциональная группа А, способная вступать в реакцию в случае необходимости с окисленным восстанавливающим концом полимера, включает аминогруппу согласно структуре -HN-. Согласно одному предпочтительному варианту осуществления настоящего изобретения эта функциональная группа А представляет собой группу, имеющую структуру R'-NH-, где R' обозначает водород или алкил, циклоалкил, арил, аралкил, арилциклоалкил, алкарил или циклоалкиларил, где циклоалкил,арил, аралкил, арилциклоалкил, алкарил или циклоалкиларил может быть связан непосредственно с группой NH или, согласно другому варианту осуществления, может быть связан кислородным мостиком с группой NH. Алкил, циклоалкил, арил, аралкил, арилциклоалкил, алкарил или циклоалкиларил может быть соответствующим образом замещен. В качестве предпочтительных заместителей могут быть указаны галогены, такие как F, Cl или Br. Особенно предпочтительным остатком R' является водород, алкильная и алкоксигруппы и еще более предпочтительным - водород и незамещенные алкильная и алкоксигруппы. Среди алкила и алкокси предпочтительны группы с 1, 2, 3, 4, 5 или 6 атомами С. Более предпочтительны метил, этил, пропил, изопропил, метокси, этокси, пропокси и изопропокси. Особенно предпочтительны метил, этил, метокси, этокси и особое предпочтение отдается метилу или метокси. Поэтому, настоящее изобретение также относится к способу и конъюгату, как описано выше, в которых R' обозначает водород или метил или метоксигруппу. Согласно другому предпочтительному варианту осуществления настоящего изобретения, функциональная группа А имеет структуру R'-NH-R"-, где R" предпочтительно включает структурную единицу-NH- и/или структурную единицу -(C=G)-, где G обозначает О или S, и/или структурную единицу -SO2-. Согласно более предпочтительным вариантам осуществления, функциональная группа R" выбрана из группы, состоящей из где, если G присутствует дважды, она обозначает независимо О или S. Поэтому, предпочтительными функциональными группами А, включающими аминогруппу -NH2,являются, например, где G обозначает О или S и, если присутствует дважды, независимо О или S, и R' является метилом. Особенно предпочтительными функциональными группами А, включающими аминогруппы, являются аминооксигруппы причем наиболее предпочтительна группа H2N-О-, и гидразидная группа где G предпочтительно обозначает О. Поэтому, настоящее изобретение также относится к способу, как описано выше, в котором функциональная группа Z белка представляет собой альдегидную группу или кетогруппу, и функциональная группа А представляет собой аминооксигруппу или гидразидную группу. Согласно особенно предпочтительному варианту осуществления настоящего изобретения, А представляет собой аминооксигруппу. Таким образом, настоящее изобретение также относится к конъюгату, как описано выше, в котором функциональная группа Z белка представляет собой альдегидную группу или кетогруппу, и функциональная группа А представляет собой аминооксигруппу или гидразидную группу. Согласно особенно предпочтительному варианту осуществления настоящего изобретения, А представляет собой аминооксигруппу. В результате реакции аминооксигруппы полимера или производного полимера с альдегидной группой или кетогруппой белка, образуется оксимная связь. Поэтому, настоящее изобретение также относится к конъюгату, как описано выше, в котором ковалентная связь между белком и полимером или полимерным производным представляет собой оксимную связь, которая образуется в результате реакции функциональной группы Z белка, причем указанная функциональная группа Z является альдегидной группой или кетогруппой, и функциональной группой А полимера или производного полимера, причем указанная функциональная групп А представляет собой аминооксигруппу. В результате реакции гидразидной группы полимера или производного полимера с альдегидной группой или кетогруппой белка образуется гидразиновая связь. Поэтому, настоящее изобретение также относится к конъюгату, как описано выше, в котором ковалентная связь между белком и полимером или полимерным производным представляет собой гидразиновую связь, которая образуется в результате реакции функциональной группы Z белка, причем указанная функциональная группа Z является альдегидной группой или кетогруппой, и функциональной группой А полимера или производного полимера, причем указанная функциональная группа А представляет собой гидразидную группу. Чтобы вводить функциональную группу А в полимер, не существует никаких определенных ограничений, при условии, что полученное производное полимера включает функциональную группу А. Согласно предпочтительному варианту осуществления настоящего изобретения, функциональную группу А вводят в полимер, вводя полимер в реакцию, по меньшей мере, с бифункциональным соединением, одна функциональная группа которого способна реагировать по меньшей мере с одной функциональной группой полимера, и по меньшей мере одна другая функциональная группа указанного, по меньшей мере, бифункционального соединения является функциональной группой А или способна к тому, чтобы быть химически модифицированной с получением функциональной группы А. Согласно еще одному предпочтительному варианту осуществления, полимер вводят в реакцию, по меньшей мере, с бифункциональным соединением на его в случае необходимости окисленном восстанавливающем конце. В случае, если полимер вводят в реакцию с его неокисленным восстанавливающим концом, полимер предпочтительно имеет строение причем в формуле (I) включена альдегидная форма неокисленного восстанавливающего конца. В случае, если полимер вводят в реакцию с его окисленным восстанавливающим концом, полимер предпочтительно имеет строение согласно формуле (IIa) Окисление восстанавливающего конца полимера, предпочтительно гидроксиэтилкрахмала, может быть выполнено согласно любому способу или комбинации способов, которые приводят к соединениям,имеющим указанные структуры (IIa) и/или (IIb). Хотя окисление может быть выполнено согласно любому подходящему способу или способам,приводящим к окисленному восстанавливающему концу гидроксиалкилкрахмала, его предпочтительно осуществляют, используя щелочной раствор йода как описано, например, в DE 19628705 А 1, соответствующее содержание которых (пример А, столбец 9, строки 6-24) включено в настоящее описание путем ссылки. В качестве функциональной группы, по меньшей мере, бифункционального соединения, которая является способной вступать в реакцию в случае необходимости с окисленным восстанавливающим концом полимера, может использоваться любая функциональная группа, которая является способной к образованию химической связи в случае необходимости с окисленным восстанавливающим концом гидроксиалкилкрахмала. Согласно предпочтительному варианту осуществления настоящего изобретения эта функциональная группа включает химическую структуру -NH-. Поэтому, настоящее изобретение также относится к способу и конъюгату, как описано выше, в которых функциональная группа, по меньшей мере, бифункционального соединения, причем указанная функциональная группа, являющаяся способной вступать в реакцию в случае необходимости с окисленным восстанавливающим концом полимера, включает структуру -NH-. Согласно одному предпочтительному варианту осуществления настоящего изобретения эта функциональная группа, по меньшей мере, бифункционального соединения представляет собой группу,имеющую структуру R'-NH-, где R' обозначает водород или алкил, циклоалкил, арил, аралкил, арилциклоалкил, алкарил или циклоалкиларил, где циклоалкил, арил, аралкил, арилциклоалкил, алкарил или циклоалкиларил может быть связан непосредственно с группой NH или, согласно другому варианту осуществления, может быть связан с группой NH кислородным мостиком. Алкил, циклоалкил, арил,аралкил, арилциклоалкил, алкарил или циклоалкиларил может быть соответствующим образом замещен. В качестве предпочтительных заместителей могут быть указаны галогены, такие как F, Cl или Br. Особенно предпочтительные остатки R' представляют собой водород, алкил и алкокси, и еще более предпочтительный - водород и незамещенный алкил и алкокси. Среди алкила и алкокси предпочтительны группы с 1, 2, 3, 4, 5 или 6 атомами С. Более предпочтительны метил, этил, пропил, изопропил, метокси, этокси, пропокси и изопропокси. Особенно предпочтительны метил, этил, метокси, этокси и особое предпочтение отдается метилу или метокси. Поэтому, настоящее изобретение также относится к способу и конъюгату, как описано выше, в которых R' обозначает водород или метил или метоксигруппу. Согласно другому предпочтительному варианту осуществления настоящего изобретения, функциональная группа, по меньшей мере, бифункционального соединения имеет структуру R'-NH-R"-, где R" предпочтительно включает структурную единицу -NH- и/или структурную единицу -(C=G)-, где G обозначает О или S, и/или структурную единицу -SO2-. Согласно более предпочтительным вариантам осуществления, функциональная группа R" выбрана из группы, состоящей из где, если G присутствует дважды, она независимо обозначает О или S. Поэтому, настоящее изобретение также относится к способу и конъюгату, как описано выше, в которых функциональная группа по меньшей мере бифункционального соединения, причем указанная функциональная группа является способной вступать в реакцию в случае необходимости с окисленным восстанавливающим концом полимера, выбрана из группы, состоящей из где G обозначает О или S и, если пристутствует дважды, обозначает независимо О или S и R' является метилом. Согласно еще более предпочтительному варианту осуществления настоящего изобретения функциональная группа, по меньшей мере, бифункционального соединения, причем указанная функциональная группа является способной вступать в реакцию в случае необходимости с окисленным восстанавливающим концом полимера и включает аминогруппу, является аминооксигруппами причем особенно предпочтительна группа H2N-О-, или гидразидной группой где G предпочтительно обозначает О. Поэтому настоящее изобретение также относится к способу и конъюгату, как описано выше, в которых функциональная группа Z белка представляет собой альдегидную группу или кетогруппу, и функциональная группа, по меньшей мере, бифункционального соединения, причем указанная функциональная группа является способной вступать в реакцию в случае необходимости с окисленным восстанавливающим концом полимера, является аминооксигруппой или гидразидной группой, предпочтительно аминооксигруппой. Таким образом, настоящее изобретение также относится к конъюгату, как описано выше, в котором функциональная группа Z белка представляет собой альдегидную группу или кетогруппу, и функциональная группа, по меньшей мере, бифункционального соединения, причем указанная функциональная группа является способной вступать в реакцию в случае необходимости с окисленным восстанавливающим концом полимера, является аминооксигруппой или гидразидной группой, предпочтительно аминооксигруппой. Согласно еще одному предпочтительному варианту осуществления настоящего изобретения, по меньшей мере, бифункциональное соединение вводят в реакцию с полимером на его неокисленном восстанавливающем конце. Согласно еще одному предпочтительному варианту осуществления настоящего изобретения, по меньшей мере, бифункциональное соединение, которое вступает в реакцию окисленным восстанавливающим концом полимера, включает функциональную группу А. По меньшей мере бифункциональное соединение может быть введено в реакцию сначала с полимером с получением производного полимера, которое затем вводят в реакцию с белком через функциональную группу А. Также возможно вводить в реакцию, по меньшей мере, бифункциональное соединение через функциональную группу А сначала с белком, с получением производного белка, которое затем вводят в реакцию с полимером по меньшей мере через одну функциональную группу остатка по меньшей мере бифункционального соединения, включенного в производное белка. Согласно предпочтительному варианту осуществления настоящего изобретения, по меньшей мере,бифункциональное соединение сначала вводят в реакцию с полимером. Поэтому настоящее изобретение относится к способу и конъюгату, как описано выше, причем указанный способ дополнительно включает введение в реакцию полимера на его неокисленном восстанавливающем конце, по меньшей мере, с бифункциональным связывающим соединением, содержащим функциональную группу, способную вступать в реакцию с неокисленным восстанавливающим концом полимера, и группу А, до реакции производного полимера, содержащего А, и белка, содержащего Z. Термин "полимер (или HAS) вступает в реакцию через восстанавливающий конец" или "полимер(или HAS), вступает в реакцию через селективно окисленный восстанавливающий конец" в контексте настоящего изобретения относится к способу, согласно которому полимер (или HAS) вступает в реакцию преимущественно через (селективно окисленный) восстанавливающий конец. Этот термин "преимущественно через (селективно окисленный) восстанавливающий конец" относится к способам, согласно которым статистически более 50%, предпочтительно по меньшей мере 55%,более предпочтительно по меньшей мере 60%, более предпочтительно по меньшей мере 65%, более предпочтительно по меньшей мере 70%, более предпочтительно по меньшей мере 75%, более предпоч- 17014103 тительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, более предпочтительно по меньшей мере 90% и еще более предпочтительно по меньшей мере 95%, например 95%, 96%, 97%,98% или 99% молекул гидроксиалкилкрахмала, используемых для данных реакций, вступают в реакцию через по меньшей мере один (селективно окисленный) восстанавливающий конец на молекулу полимера(или HAS), где данная молекула полимера (или HAS), которая вступает в реакцию по меньшей мере через один восстанавливающий конец, может быть введена в реакцию в той же самой данной реакции по меньшей мере через одну другую подходящую функциональную группу, которая содержится в указанной молекуле полимера (или HAS) и которая не является восстанавливающим концом. Если одна или более молекул полимера (или HAS) вступает в реакцию по меньшей мере через один восстанавливающий конец одновременно по меньшей мере через одну другую подходящую функциональную группу,которая содержится в этой (этих) молекуле(ах) полимера (или HAS) и которая не является восстанавливающим концом, статистически предпочтительно более 50%, предпочтительно по меньшей мере 55%,более предпочтительно по меньшей мере 60%, более предпочтительно по меньшей мере 65%, более предпочтительно по меньшей мере 70%, более предпочтительно по меньшей мере 75%, более предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, более предпочтительно по меньшей мере 90% и еще более предпочтительно по меньшей мере 95%, например 85, 96, 97, 98 или 99% всех реагирующих функциональных групп этих молекул полимера (или HAS), причем указанные функциональные группы включают восстанавливающие концы, являются восстанавливающими концами. Термин "восстанавливающий конец", используемый в контексте настоящего изобретения, относится к концевой альдегидной группе молекулы полимера (или HAS), которая может присутствовать в виде альдегидной группы и/или в форме соответствующего ацеталя. В случае, когда восстанавливающий конец является окисленным, альдегидная или ацетальная группа находится в форме карбоксильной группы и/или соответствующего лактона. Функциональная группа по меньшей мере бифункционального связывающего соединения, которая вступает в реакцию с полимером, и функциональная группа А, по меньшей мере, бифункционального связывающего соединения, которая вступает в реакцию с функциональной группой Z белка, могут быть разделены любым подходящим спейсером. Среди прочих, спейсер может быть в случае необходимости замещенным, линейным, разветвленным и/или циклическим углеводородным остатком. Обычно углеводородный остаток имеет до 60, предпочтительно до 40, более предпочтительно до 20, более предпочтительно до 10, более предпочтительно до 6 и особенно предпочтительно до 4 атомов углерода. Если присутствуют гетероатомы, разделяющая группа включает обычно от 1 до 20, предпочтительно от 1 до 8,более предпочтительно 1-6, более предпочтительно 1-4 и особенно предпочтительно от 1 до 2 гетероатомов. В качестве гетероатома предпочтителен О. Углеводородный остаток может включать в случае необходимости разветвленную алкильную цепь или арильную группу, или циклоалкильную группу, содержащую, например, от 5 до 7 атомов углерода, или аралкильную группу, алкарильную группу, где алкильная часть может быть прямой и/или циклической алкильной группой. Согласно еще более предпочтительному варианту осуществления настоящего изобретения, функциональные группы отделены линейной углеводородной цепью, имеющей 4 атома углерода. Согласно другому предпочтительному варианту осуществления настоящего изобретения функциональные группы отделены линейной углеводородной цепью, имеющей 4 атома углерода и по меньшей мере один, предпочтительно один гетероатом, особенно предпочтительно атом кислорода. Согласно другому предпочтительному варианту осуществления, по меньшей мере, бифункциональное связывающее соединение представляет собой гомобифункциональной связывающее соединение. Поэтому настоящее изобретение также относится к способу получения конъюгата, как описано выше, в котором по меньшей мере бифункциональное связывающее соединение представляет собой гомобифункциональное соединение. Таким образом, относительно указанных предпочтительных функциональных групп связывающего соединения, указанное гомобифункциональное связывающее соединение предпочтительно включает либо две аминооксигруппы H2N-О-, либо две аминооксигруппы R'-O-NH-, или две гидразидные группыH2N-NH-(C=G)-, причем предпочтительны аминооксигруппы H2N-О- и гидразидные группы H2N-NH(C=O) и особенно предпочтительны аминооксигруппы H2N-О-. Среди всех возможных гомобифункциональных соединений, содержащих две гидразидные группыH2N-NH-(С=O)-, предпочтительны гидразиды, где две гидразидные группы разделены углеводородным остатком, имеющим до 60, предпочтительно до 40, более предпочтительно до 20, более предпочтительно до 10, более предпочтительно до 6 и особенно предпочтительно до 4 атомов углерода. Более предпочтительно углеводородный остаток имеет 1-4 атома углерода, например 1, 2, 3 или 4 атома углерода. Наиболее предпочтительно, углеводородный остаток имеет 4 атома углерода. Поэтому предпочтительно гомобифункциональное соединение согласно формуле В вышеописанном варианте осуществления, где альдегидная группа или кетогруппа белка вступают в реакцию с соединением, включающим две гидразидные группы H2N-NH-(С=O)-, особенно предпочтительными гидроксиэтилкрахмалами являются, например, гидроксиэтилкрахмалы, имеющие в среднем молекулярную массу приблизительно 10 кДа и DS приблизительно 0,4. Также возможны, например, гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 10 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 18 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 50 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 50 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 12 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 12 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 18 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 30 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 30 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 50 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу около 50 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу около 100 кДа и DS приблизительно 0,7. Относительно каждой из этих комбинаций средней молекулярной массы и DS, также предпочтительна величина DS приблизительно 0,8. Согласно еще более предпочтительному варианту осуществления настоящего изобретения бифункциональное связывающее соединение представляет собой карбогидразид В вышеописанном варианте осуществления, где альдегидная группа или кетогруппа белка вступают в реакцию с карбогидразидом, особенно предпочтительные гидроксиэтилкрахмалы представляют собой,например, гидроксиэтилкрахмалы, имеющие в среднем молекулярную массу около 10 кДа и DS приблизительно 0,4. Также возможны, например, гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 10 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 18 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 50 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 50 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 12 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 12 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 18 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 30 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 30 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 50 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 50 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 100 кДа и DS приблизительно 0,7. Относительно каждой из этих комбинаций средней молекулярной массы и DS, также предпочтительна величина DS приблизительно 0,8. Как описано выше, настоящее изобретение также относится к способу и конъюгату, как описано выше, в которых, по меньшей мере, бифункциональное связывающее соединение представляет собой гомобифункциональное соединение и включает две аминооксигруппы. Следовательно, настоящее изобретение также относится к способу и конъюгату, как описано выше, в которых, по меньшей мере, бифункциональное связывающее соединение представляет собой гомобифункциональное соединение и включает две аминооксигруппы H2N-О-. Как описано выше, полимер предпочтительно вступает в реакцию на его восстанавливающем конце, который не является окисленным до реакции с бифункциональным связывающим соединением. Поэтому, реакция предпочтительного гомобифункционального соединения, включающего две аминооксигруппы H2N-О-, с полимером приводит к производному полимера, включающему оксимную связь. Поэтому, в случае, если функциональной группой Z белка является альдегидная группа или кетогруппа, которая предпочтительно вступает в реакцию с аминооксигруппой производного полимера, на- 19014103 стоящее изобретение также относится к конъюгату, как описано выше, причем указанный конъюгат включает полимер и белок, причем каждый присоединен ковалентной связью к связавшемуся соединению посредством оксимной или циклической аминной связью. Среди всех возможных гомобифункциональных соединений, содержащих две аминооксигруппыH2NO-, предпочтительны бифункциональные соединения, где две аминооксигруппы разделены углеводородным остатком, содержащим от 1 до 60, предпочтительно от 1 до 40, более предпочтительно от 1 до 20, более предпочтительно от 1 до 10, более предпочтительно от 1 до 6 и особенно предпочтительно 1-4 атомами углерода. Более предпочтительно углеводородный остаток имеет 1-4 атома углерода, например,1, 2, 3 или 4 атома углерода. Наиболее предпочтительно,углеводородный остаток имеет 4 атома углерода. Еще более предпочтительно углеводородный остаток имеет по меньшей мере один гетероатом, более предпочтительно один гетероатом и наиболее предпочтительно один атом кислорода. Особенно предпочтительно соединение О-[2-(2-аминооксиэтокси)этил]гидроксиламин согласно формуле Поэтому, настоящее изобретение относится к конъюгату, как описано выше, причем указанный конъюгат имеет строение согласно формуле причем HAS' предпочтительно является HES'. Особенно предпочтительные гидроксиэтилкрахмалы представляют собой, например, гидроксиэтилкрахмалы, имеющие в среднем молекулярную массу приблизительно 10 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 10 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 12 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 12 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 18 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 18 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 30 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 30 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 50 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмал,имеющий в среднем молекулярную массу приблизительно 50 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 100 кДа и DS приблизительно 0,7. Относительно каждой из этих комбинаций средней молекулярной массы и DS, также предпочтительна величина DS приблизительно 0,8. В описанном выше варианте осуществления, где альдегидная группа или кетогруппа белка вступают в реакцию с гидроксиамино-группой полимера или производного полимера, особенно предпочтительные гидроксиэтилкрахмалы представляют собой, например, гидроксиэтилкрахмалы, имеющие в среднем молекулярную массу приблизительно 10 кДа и DS приблизительно 0,4, и гидроксиэтилкрахмал,имеющий в среднем молекулярную массу приблизительно 10 кДа и DS приблизительно 0,7, и гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 18 кДа и DS приблизительно 0,4, и гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 50 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 50 кДа и DS приблизительно 0,7. Также возможны, например, гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 12 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 12 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 18 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 30 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 30 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 50 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмал, имеющий в среднем моле- 20014103 кулярную массу приблизительно 50 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 100 кДа и DS приблизительно 0,7. В качестве белков наиболее предпочтительны гликозилированный бета IFN, гликозилированныйAT III и гликозилированный GM-CSF. Поэтому, в случае, если гидроксиалкилкрахмал является предпочтительно гидроксиэтилкрахмалом, настоящее изобретение также относится к конъюгатуHES' наиболее предпочтительно происходит независимо для каждого белка от гидроксиэтилкрахмала, имеющего в среднем молекулярную массу приблизительно 10 кДа и DS приблизительно 0,4 и/или гидроксиэтилкрахмала, имеющего в среднем молекулярную массу приблизительно 10 кДа и/или DS приблизительно 0,7 и/или гидроксиэтилкрахмала, имеющего в среднем молекулярную массу приблизительно 18 кДа и DS приблизительно 0,4, и/или гидроксиэтилкрахмала, имеющего в среднем молекулярную массу приблизительно 50 кДа и DS приблизительно 0,4, и/или гидроксиэтилкрахмала, имеющего в среднем молекулярную массу приблизительно 50 кДа и DS приблизительно 0,7, и/или гидроксиэтилкрахмала,имеющего в среднем молекулярную массу приблизительно 100 кДа и DS приблизительно 0,7. Реакцию полимера на его неокисленном восстанавливающем конце со связавшим соединением,особенно в случае, когда указанное связывающее соединение представляет собой гомобифункциональное связывающее соединение, включающее две аминооксигруппы H2N-O-, предпочтительно осуществляют в водной системе. Термин "водная система" в контексте настоящего изобретения относится к растворителю или смеси растворителей, включающих воду в диапазоне по меньшей мере от 10 вес.%, предпочтительно по меньшей мере 50 вес.%, более предпочтительно по меньшей мере 80 вес.%, еще более предпочтительно по меньшей мере 90 вес.% или до 100 вес.%, в расчете на массу используемых растворителей. Предпочтительной реакционной средой является вода. Согласно другому варианту осуществления, может использоваться по меньшей мере один другой растворитель, в котором HAS, предпочтительно HES, растворим. Примерами этих растворителей явля- 21014103 ются, например, DMF, диметилацетамид или диметилсульфоксид. Что касается температур, используемых в ходе реакции, никаких определенных ограничений не существует, при условии, что реакция приводит к желаемому производному полимера. В случае, если полимер вступает в реакцию с гомобифункциональным связывающим соединением,включающим две аминооксигруппы H2N-О-, предпочтительно О-[2-(2-аминооксиэтокси)этил]гидроксиламином, температура находится предпочтительно в диапазоне от 5 до 45 С, более предпочтительно,в диапазоне от 10 до 30 С и особенно предпочтительно в диапазоне от 15 до 25 С. Время реакции для реакции полимера с гомобифункциональным связывающим соединением, включающим две аминооксигруппы H2N-O-, предпочтительно О-[2-(2-аминооксиэтокси)этил]гидроксиламином, может быть адаптировано к определенным потребностям и находится обычно в диапазоне от 1 ч до 7 дней, предпочтительно в диапазоне от 1 ч до 3 дней и более предпочтительно от 2 до 48 ч. Значение рН для реакции полимера с гомобифункциональным связывающим соединением, включающим две аминооксигруппы H2N-O-, предпочтительно О-[2-(2-аминооксиэтокси)этил]гидроксиламином, может быть адаптировано к определенным потребностям, таким как химическая природа реагентов. Значение рН находится предпочтительно в диапазоне от 4,5 до 6,5. Частными примерами указанных условий реакции являются, например, температура реакции приблизительно 25 С и рН приблизительно 5,5. Подходящее значение рН реакционной смеси может быть отрегулировано путем добавления по меньшей мере одного подходящего буфера. Среди предпочтительных буферов могут быть указаны ацетат натрия, фосфатные или боратные буферы. Как только производное полимера, включающее полимер и связанное с ним бифункциональное связывающее соединение, сформировалось, оно может быть выделено из реакционной смеси по меньшей мере одним подходящим способом. В случае необходимости, производное полимера может быть осаждено до выделения по меньшей мере одним подходящим способом. Если производное полимера сначала осаждают, возможно, например, ввести реакционную смесь в контакт по меньшей мере с одним растворителем или смесью растворителей, отличным от растворителя или смеси растворителей, присутствующего в реакционной смеси, при подходящих температурах, например, со смесью ацетон/этанол в подходящих объемных отношениях, например 1/1 об./об., или с изопропанолом, при подходящих температурах, например, от -20 до 50 С или от 0 до 25 С. Согласно особенно предпочтительному варианту осуществления настоящего изобретения, если в качестве растворителя используется водная среда, предпочтительно вода, реакционную смесь вводят в контакт со смесью 2-пропанола при температуре предпочтительно в диапазоне от - 20 до +50 С и особенно предпочтительно в диапазоне от 0 до 25 С. Выделение производного полимера может быть осуществлено подходящим способом, который может включать одну или более стадий. Согласно предпочтительному варианту осуществления настоящего изобретения производное полимера сначала отделяют от реакционной смеси или смеси реакционной смеси, например, с водной смесью 2-пропанола, подходящим способом, таким как центрифугирование или фильтрация. На второй стадии, отделенное производное полимера может быть подвергнуто дальнейшей обработке, такой как последующая обработка, например диализ, центробежная фильтрация или фильтрация под давлением, ионообменная хроматография, хроматография с обратной фазой, ВЭЖХ,MPLC, гель-фильтрация и/или лиофилизация. Согласно еще более предпочтительному варианту осуществления отделенное производное полимера сначала диализируют, предпочтительно против воды, и затем лиофилизируют, пока содержание растворителя в продукте реакции не станет достаточно низким согласно желаемым спецификациям продукта. Лиофилизация может быть осуществлена при температуре от 20 до 35 С, предпочтительно от 20 до 30 С. Таким образом выделенное производное полимера затем вводят в реакцию через функциональную группу А, с функциональной группой Z белка, причем Z является альдегидной группой или кетогруппой. В особенно предпочтительном случае, когда А обозначает аминооксигруппу H2N-O- для получения оксимной связи между полимерным производным и белком, реакцию предпочтительно осуществляют в водной среде, предпочтительно воде, при предпочтительной температуре в диапазоне от 0 до 40 С, более предпочтительно от 4 до 25 С и особенно предпочтительно от 15 до 25 С. Значение рН реакционной среды находится предпочтительно в диапазоне от 4 до 10, более предпочтительно в диапазоне от 5 до 9 и особенно предпочтительно в диапазоне от 5 до 7. Время реакции находится предпочтительно в диапазоне от 1 до 72 ч, более предпочтительно в диапазоне от 1 до 48 ч и особенно предпочтительно в диапазоне от 4 до 24 ч. Конъюгат может быть подвергнут дальнейшей обработке, такой как последующая обработка, например диализ, центробежная фильтрация или фильтрация под давлением, ионообменная хроматография, хроматография с обратной фазой, ВЭЖХ, MPLC, гель-фильтрация и/или лиофилизация. Согласно другому варианту осуществления настоящего изобретения функциональная группа Z белка представляет собой аминогруппу, и белок выбирают из группы, состоящей из альфа IFN, бета IFN,GM-CSF, APC, tPA, A1AT, AT III, фактора VII, фактора VIII и фактора IX. Поэтому, настоящее изобретение относится к способу и конъюгату, как описано выше, в которых функциональная группа Z белка- 22014103 представляет собой аминогруппу, и белок выбирают из группы, состоящей из альфа IFN, бета IFN, GMCSF, APC, tPA, A1AT, AT III, фактора VII, фактора VIII и фактора IX. Согласно особенно предпочтительному варианту осуществления настоящего изобретения функциональная группа А, реагирующая с функциональной группой Z, являющейся аминогруппой, представляет собой реакционноспособную карбоксильную группу. Поэтому настоящее изобретение также относится к способу и конъюгату, как описано выше, в которых функциональная группа Z представляет собой аминогруппу, и функциональная группа А полимера или производного полимера представляет собой реакционноспособную карбоксильную группу. Согласно первому предпочтительному варианту осуществления настоящего изобретения, реакционноспособная карбоксильная группа введена в полимер путем селективного окисления полимера на его восстанавливающем конце. Поэтому полимер, в который введена реакционноспособная карбоксильная группа, предпочтительно имеет строение согласно формуле (IIa) Окисление восстанавливающего конца полимера согласно формуле (I) предпочтительно гидроксиэтилкрахмала, может быть осуществлено согласно любому способу или комбинации способов, которые приводят к соединениям, имеющим указанные структуры (IIa) и/или(IIb). Хотя окисление может быть выполнено согласно любому подходящему способу или способам,приводящим к окисленному восстанавливающему концу гидроксиалкилкрахмала, его предпочтительно осуществляют, используя щелочной раствор йода, как описано, например, в DE 19628705 А 1, соответствующее содержание которой (пример А, столбец 9, строки 6-24) включено в настоящее описание путем ссылки. Введение реакционноспособной карбоксильной группы в полимер, который является селективно окисленным на его восстанавливающем конце, может быть выполнено любыми возможными способами. Окисленный полимер может использоваться как таковой или в форме соли, такой как соль щелочного металла, предпочтительно натриевая и/или калиевая соль. Согласно предпочтительному способу согласно настоящему изобретению, полимер, который является селективно окисленным на его восстанавливающем конце, вводят в реакцию на окисленном восстанавливающем конце по меньшей мере с одним спиртом, предпочтительно по меньшей мере с одним кислым спиртом. Более предпочтительными являются кислые спирты, имеющие величину pKA в диапазоне от 6 до 12, более предпочтительно от 7 до 11 при 25 С. Молекулярная масса кислого спирта находится предпочтительно в диапазоне от 80 до 500 г/моль, более предпочтительно от 90 до 300 г/моль и особенно предпочтительно от 100 до 200 г/моль. Подходящими кислыми спиртами являются все спирты H-О-RA, имеющие кислотный протон и способные вступать в реакцию с окисленным полимером, с получением соответствующего реакционноспособного сложного эфира полимера, предпочтительно согласно формуле еще более предпочтительно согласно формуле Предпочтительными спиртами являются N-гидроксисукцинимиды, такие как N-гидроксисукцинимид или сульфо-N-гидроксисукцинимид, соответствующим образом замещенные фенолы, такие как пнитрофенол, о,п-динитрофенол, о,о'-динитрофенол, трихлорфенол, такой как 2,4,6-трихлорфенол или 2,4,5-трихлорфенол, трифторфенол, такой как 2,4,6-трифторфенол или 2,4,5-трифторфенол, пентахлорфенол, пентафторфенол или гидроксиазолы, такие как гидроксибензотриазол. Особенно предпочтительны N-гидроксисукцинимиды, причем наиболее предпочтительны N-гидроксисукцинимид и сульфо-Nгидроксисукцинимид. Все спирты могут использоваться индивидуально или в виде подходящей комбинации двух или более спиртов. В контексте настоящего изобретения также возможно использовать соединение, которое высвобождает соответствующий спирт, например, путем добавления диэфиров угольных кислот. Поэтому настоящее изобретение также относится к способу и конъюгату, как описано выше, в которых полимер, который селективно окислен на его восстанавливающем конце, активирован путем введения в реакцию окисленного полимера с кислым спиртом, предпочтительно с N-гидроксисукцинимидом и/или сульфо-N-гидроксисукцинимидом. Согласно еще более предпочтительному варианту осуществления настоящего изобретения, полимер, который является селективно окисленным на его восстанавливающем конце, вступает в реакцию на окисленном восстанавливающем конце по меньшей мере с одним диэфиром угольной кислоты RB-О(C=O)-O-RC, где RB и RC могут быть одинаковыми или разными. Предпочтительно, этот способ дает реакционноспособные полимеры соответственно формуле где HAS' предпочтительно представляет собой HES'. В качестве подходящего соединения диэфира угольной кислоты могут использоваться соединения,чьи спиртовые компоненты представляют собой независимо N-гидроксисукцинимиды, такие как Nгидроксисукцинимид или сульфо-N-гидроксисукцинимид, соответствующим образом замещенные фенолы, такие как п-нитрофенол, о,п-динитрофенол, о,о'-динитрофенол, трихлорфенол, такой как 2,4,6 трихлорфенол или 2,4,5-трихлорфенол, трифторфенол, такой как 2,4,6-трифторфенол или 2,4,5 трифторфенол, пентахлорфенол, пентафторфенол или гидроксиазолы, такие как гидроксибензотриазол. Особенно предпочтительны N,N'-дисукцинимидилкарбонат и сульфо-N,N'-дисукцинимидилкарбонат,причем наиболее предпочтителен N,N'-дисукцинимидилкарбонат. Поэтому настоящее изобретение также относится к способу и конъюгату, как описано выше, в которых полимер, который селективно окислен на его восстанавливающем конце, активирован путем реакции окисленного полимера с N,N'-дисукцинимидилкарбонатом. Кислый спирт вступает в реакцию с окисленным полимером или солью окисленного полимера в молярном отношении кислый спирт:полимер предпочтительно от 5:1 до 50:1, более предпочтительно от 8:1 до 20:1, при предпочтительной температуре реакции от 2 до 40 С, более предпочтительно от 10 до 30 С и особенно предпочтительно от 15 до 25 С. Время реакции находится предпочтительно в диапазоне от 1 до 10 ч, более предпочтительно от 2 до 5 ч, более предпочтительно от 2 до 4 ч и особенно от 2 до 3 ч. Соединение диэфира угольной кислоты вступает в реакцию с окисленным полимером или солью окисленного полимера в молярном отношении соединение диэфира:полимер предпочтительно от 1:1 до 3:1, более предпочтительно от 1:1 до 1,5:1. Время реакции находится предпочтительно в диапазоне от 0,1 до 12 ч, более предпочтительно от 0,2 до 6 ч, более предпочтительно от 0,5 до 2 ч и особенно от 0,75 до 1,25 ч. Согласно предпочтительному варианту осуществления настоящего изобретения, реакцию окисленного полимера с кислым спиртом и/или диэфиром угольной кислоты осуществляют по меньшей мере в- 24014103 одном апротонном растворителе, особенно предпочтительно в безводном апротонном растворителе,имеющем содержание воды не более 0,5 вес.%, предпочтительно не более 0,1 вес.%. Подходящими растворителями являются, среди прочих, диметилсульфоксид (ДМСО), N-метилпирролидон, диметилацетамид (ДМА), диметилформамид (ДМФ) и смеси двух или более этих соединений. Температуры реакции находятся предпочтительно в диапазоне от 2 до 40 С, более предпочтительно от 10 до 30 С. Для осуществления реакции окисленного полимера по меньшей мере с одним кислым спиртом используют по меньшей мере один дополнительный активатор. Подходящими активаторами являются, среди прочих, карбонилдиимидазол, карбодиимиды, такие как диизопропилкарбодиимид(ДЦК),1-этил-3-(3 диметиламинопропил)карбодиимид (ЭДК), причем наиболее предпочтительны дициклогексилкарбодиимид (ДЦК) и 1-этил-3-(3-диметиламинопропил)карбодиимид (ЭДК). Поэтому, настоящее изобретение также относится к способу и конъюгату, как описано выше, где полимер, который является окисленным на его восстанавливающем конце, вступает в реакцию с кислым спиртом в присутствии дополнительного активатора, с получением реакционноспособного полимера сложного эфира. Согласно особенно предпочтительному варианту осуществления настоящего изобретения реакцию окисленного полимера с диэфиром угольной кислоты и/или кислым спиртом осуществляют при низкой активности основания, которая может быть определена путем добавления реакционной смеси к воде при объемном отношении воды к реакционной смеси 10:1. До добавления вода, которая не включает по существу буфера, имеет значение рН 7 при 25 С. После добавления реакционной смеси и измеряя значение рН, получают активность основания реакционной смеси, имеющую величину предпочтительно не более 9,0, более предпочтительно не более 8,0 и особенно предпочтительно не более 7,5. Согласно предпочтительному варианту осуществления настоящего изобретения, окисленный полимер вступает в реакцию с N-гидрокси сукцинимидом в сухом ДМА в отсутствие воды с ЭДК, с селективным получением полимера сложного эфира N-гидроксисукцинимида согласно формуле где более предпочтительно HAS' представляет собой HES'. Неожиданным образом эта реакция не дает побочных продуктов, происходящих из реакций ЭДК с группами ОН HES, и реакция перегруппировки О-ацилизомочевины, образованной ЭДК и окисленным полимером, в соответствующую N-ацилмочевину неожиданно оказывается подавленной. Согласно другому предпочтительному варианту осуществления настоящего изобретения окисленный полимер вступает в реакцию с N,N'-дисукцинимидилкарбонатом в безводном ДМФ и в отсутствие активатора, с селективным получением полимера сложного эфира N-гидроксисукцинимида согласно формуле где более предпочтительно HAS' представляет собой HES'. Реакционноспособный полимер, как описано выше, предпочтительно далее вступает в реакцию по меньшей мере с одной аминогруппой белка, с получением амидной связи. Согласно предпочтительному варианту осуществления настоящего изобретения, реакционноспособный полимер вступает в реакцию с одной аминогруппой белка. Аминогруппа белка может быть аминогруппой подходящего аминокислотного остатка белка, такого как остаток лизина или гистидина, или аминогруппой, расположенной на N-конце белка. Поэтому, настоящее изобретение относится к конъюгату, предпочтительно имеющему строение согласно формуле в которой атом N амидной связи происходит из аминогруппы белка, причем HAS' предпочтительно представляет собой HES', причем гидроксиэтилкрахмал предпочтительно является гидроксиэтилкрахма- 25014103 лом, имеющим в среднем молекулярную массу приблизительно 10 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмалом, имеющим в среднем молекулярную массу приблизительно 10 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмалом, имеющим в среднем молекулярную массу приблизительно 12 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмалом, имеющим в среднем молекулярную массу приблизительно 12 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмалом, имеющим в среднем молекулярную массу приблизительно 18 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмалом, имеющим в среднем молекулярную массу приблизительно 18 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмалом, имеющим в среднем молекулярную массу приблизительно 30 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмалом, имеющим в среднем молекулярную массу приблизительно 30 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмалом, имеющим в среднем молекулярную массу приблизительно 50 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмалом, имеющим в среднем молекулярную массу приблизительно 50 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмалом, имеющим в среднем молекулярную массу приблизительно 100 кДа и DS приблизительно 0,7. Относительно каждой из этих комбинаций средней молекулярной массы и DS также предпочтительна величина DS приблизительно 0,8. Особенно предпочтительный белок, присоединенный через указанную амидную связь к гидроксиалкилкрахмалу, предпочтительно гидроксиэтилкрахмалу, представляет собой AT III. Поэтому настоящее изобретение также относится к конъюгату в котором атом N амидной связи происходит из аминогруппы AT III и где HAS' предпочтительно представляет собой HES' и еще более предпочтительно, гидроксиэтилкрахмал, имеющий молекулярную массу приблизительно 10 кДа и величину DS приблизительно 0,4. В описанном выше варианте осуществления, где аминогруппа белка вступает в реакцию с реакционноспособной карбоксильной группой полимера или производного полимера, особенно предпочтительными гидроксиэтилкрахмалами являются, например, гидроксиэтилкрахмалы, имеющие в среднем молекулярную массу приблизительно 10 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмалы, имеющие в среднем молекулярную массу приблизительно 18 кДа и DS приблизительно 0,8. Также возможны гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 10 кДа и DS приблизительно 0,7 и гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 18 кДа иDS приблизительно 0,4, и гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 50 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 50 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 12 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмал,имеющий в среднем молекулярную массу приблизительно 12 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 18 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 30 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 30 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 50 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 50 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 100 кДа и DS приблизительно 0,7. Относительно каждой из этих комбинаций средней молекулярной массы и DS, также предпочтительна величина DS приблизительно 0,8. Реакцию реакционноспособного полимера с белком можно осуществить, комбинируя реакционную смесь получения реакционноспособного полимера, то есть без выделения реакционноспособного полимера, включающую по меньшей мере 10, более предпочтительно по меньшей мере 30 и еще более предпочтительно по меньшей мере 50 вес.% реакционноспособного полимера, с водным раствором белка. Предпочтительные водные растворы белка включают от 0,05 до 10, более предпочтительно от 0,5 до 5 и особенно предпочтительно от 0,5 до 2 вес.% белка при предпочтительном рН от 5,0 до 9,0, более предпочтительно от 6,0 до 9,0 и особенно предпочтительно от 7,5 до 8,5. Согласно настоящему изобретению, также возможно очистить реакционноспособный полимер по меньшей мере однократным, предпочтительно многократным осаждением по меньшей мере с одним подходящим осаждающим агентом, таким как безводный этиловый спирт, изопропанол и/или ацетон, с получением твердого вещества, включающего по меньшей мере 10, более предпочтительно по меньшей мере 30 и еще более предпочтительно по меньшей мере 50 вес.% реакционноспособного полимера. Очищенный реакционноспособный полимер может быть добавлен к водному раствору белка. Также- 26014103 возможно добавить раствор очищенного реакционноспособного полимера к водному раствору белка. Согласно предпочтительному варианту осуществления настоящего изобретения, реакцию реакционноспособного полимера с белком, с получением амидной связи осуществляют при температуре от 2 до 40 С, более предпочтительно от 5 до 35 С и особенно от 10 до 30 С и при предпочтительном рН от 7,0 до 9,0, предпочтительно от 7,5 до 9,0 и особенно предпочтительно от 7,5 до 8,5, при предпочтительном времени реакции от 0,1 до 12 ч, более предпочтительно от 0,5 до 5 ч, более предпочтительно от 0,5 до 3 ч, еще более предпочтительно от 0,5 до 2 ч и особенно предпочтительно от 0,5 до 1 ч, при этом молярное отношение реакционноспособный полимер сложного эфира:белок составляет предпочтительно от 1:1 до 70:1, более предпочтительно от 5:1 до 50:1 и особенно предпочтительно от 10:1 до 50:1. Согласно другому варианту осуществления настоящего изобретения, полимер, который является селективно окисленным на его восстанавливающем конце, вступает в реакцию на окисленном восстанавливающем конце с азолидом, таким как карбонилдиимидазол или карбонилдибензимидазол, с получением полимера, имеющего реакционноспособную карбоксильную группу. В случае карбонилдиимидазола,получают реакционноспособное производное полимера согласно формуле в которой HAS' предпочтительно представляет собой HES'. Имидазолид, происходящий из реакции полимера с азолидом, может избирательно вступать в реакцию с аминогруппой белка, с получением амидной связи. Также возможна реакция с гидроксильной группой белка, в случае присутствия последней, с получением сложноэфирной связи, или с тиогруппой белка, с получением тиоэфирной связи, или с карбоксильной группой белка, в случае пристутствия последней, с получением связи -(С=O)-О-(С=O)-. В указанном описанном варианте осуществления, где азолид используется, чтобы ввести реакционноспособную карбоксильную группу в полимер или полимерное производное, особенно предпочтительными гидроксиэтилкрахмалами являются, например, гидроксиэтилкрахмалы, имеющие в среднем молекулярную массу приблизительно 10 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 10 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 18 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 30 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 30 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 50 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 50 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 12 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмал,имеющий в среднем молекулярную массу приблизительно 12 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 18 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 50 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 50 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 100 кДа и DS приблизительно 0,7. Относительно каждой из этих комбинаций средней молекулярной массы и DS, также предпочтительна величина DS приблизительно 0,8. Согласно другому варианту осуществления настоящего изобретения, полимер, имеющий реакционноспособную карбоксильную группу А, происходящую из реакции селективно окисленного восстанавливающего конца полимера с одним из указанных соединений, предпочтительно по меньшей мере с одним из кислых спиртов и/или по меньшей мере одним из соединений диэфира угольной кислоты, может быть связан с функциональной группой Z белка по меньшей мере через одно линкерное соединение. В случае, если используется линкерное соединение, указанное соединение представляет собой, по меньшей мере, бифункциональное соединение, имеющее по меньшей мере одну функциональную группу F1, способную вступать в реакцию с функциональной группой А производного полимера, и по меньшей мере одну функциональную группу F2, способную вступать в реакцию с функциональной группой Z белка,или функциональную группу F2, способную быть химически модифицированной для обеспечения возможности вступать в реакцию с функциональной группой Z белка. Химическая модификация может быть осуществлена, например, реакцией функциональной группы F2 с функциональной группой F3 дополнительного линкерного соединения или окислением или восстановлением подходящей функциональной группы F2. В случае, если используется по меньшей мере одно линкерное соединение, реакция не ограничена аминогруппой белка, но, в зависимости от химической природы функциональных групп линкерного соединения или линкерных соединений, может использоваться, чтобы образовать связь с каждой подходящей функциональной группой белка, такой как карбоксильная группа, реакционноспособная- 27014103 карбоксильная группа, альдегидная группа, кетогруппа, тиогруппа, аминогруппа или гидроксильная группа. В случае, если используются два линкерных соединения, первое линкерное соединение имеет по меньшей мере одну функциональную группу F1, способную вступать в реакцию с реакционноспособной карбоксильной группой А полимера, такой как аминогруппа, тиогруппа, гидроксильная группа или карбоксильная группа. Кроме того, первое линкерное соединение имеет по меньшей мере одну другую функциональную группу F2, которая является способной вступать в реакцию по меньшей мере с одной функциональной группой F3 второго линкерного соединения. Относительно функциональной группы F2,должны быть упомянуты, среди прочих, следующие функциональные группы: С-С-двойные связи, или С-С-тройные связи, или ароматические С-С-связи; тиогруппа или гидроксильные группы; гидразид алкилсульфокислоты, гидразид арилсульфокислоты; 1,2-диолы; 1,2-аминоспирты; 1,2-аминотиоспирты; азиды; аминогруппа -NH2 или производные аминогрупп, включающие структурное звено -NH-, такие как аминоалкильные группы, аминоарильная группа, аминоаралкильные группы или алкариламиногруппы; гидроксиламиногруппа -O-NH2, или производные гидроксиламиногруппы, включающие структурное звено -О-NH-, такие как гидроксилалкиламиногруппы, гидроксилариламиногруппы, гидроксиларалкиламиногруппы или гидроксиалкариламиногруппы; алкоксиаминогруппы, арилоксиаминогруппы, аралкилоксиаминогруппы или алкарилоксиаминогруппы, каждая из которых включает структурное звено -NH-О-; остатки, имеющие карбонильную группу, -Q-C(=G)-M, в которой G обозначает О или S, и М обозначает, например,-ОН или -SH; алкоксигруппу, арилоксигруппу, аралкилоксигруппу или алкарилоксигруппу; алкилтиогруппу, арилтиогруппу, аралкилтиогруппу или алкарилтиогруппу; алкилкарбонилоксигруппу, арилкарбонилоксигруппу,аралкилкарбонилоксигруппу, алкарилкарбонилоксигруппу; активированные сложные эфиры, такие как сложные эфиры гидроксиламинов, имеющих имидную структуру, такие как N-гидроксисукцинимид или имеющие структурное звено O-N, где N является частью гетероарильного соединения или, когда G=O и Q отсутствует, такие как соединения арилокси с замещенным остатком арила, такие как пентафторфенил, паранитрофенил или трихлорфенил; где Q отсутствует или обозначает NH или гетероатом, такой как S или О;-NO2; нитрильная группа; карбонильные группы, такие как альдегидная группа или кетогруппа; карбоксильная группа; группа -N=C=O или группа -N=C=S; винилгалидные группы, такие как винилйодид или винилбромид или трифлат; группа где F3 обозначает группу, способную к образованию химической связи с одной из указанных групп и предпочтительно выбрана из указанных групп. Кроме того, второе линкерное соединение имеет по меньшей мере одну функциональную группу, которая является способной вступать в реакцию с функциональной группой Z белка, которая представляет собой, например, аминогруппу, тиогруппу, карбоксильную группу, реакционноспособную карбоксильную группу, альдегидную группу, кетогруппу или гидроксильную группу. В случае, если одно линкерное соединение используется для ковалентного связывания полимера и белка, полимер может вступать в реакцию с линкерным соединением, и полученное- 28014103 производное полимера вступает в реакцию с белком, или белок может вступать в реакцию с линкерным соединением, и полученное производное белка вступает в реакцию с полимером. В случае, если используются два линкерных соединения, L1 и L2, возможно осуществлять реакцию полимера с L1, реакцию полученного производного полимера с L2 и реакцию полученного производного полимера с белком, или реакцию белка с L2, реакцию полученного производного белка с L1 и реакцию полученного производного белка с полимером. Также возможно осуществлять реакцию полимера с L1 и реакцию белка с L2 и реакцию производного полимера с производным белка. Кроме того, возможно осуществлять реакцию L1 с L2, реакцию полученного соединения с полимером и полученного производного полимера - с белком. Кроме того, возможно осуществлять реакцию L1 с L2, реакцию полученного соединения с белком и полученного производного белка - с полимером. В указанном описанном варианте осуществления, где линкерное соединение используется в комбинации с кислым спиртом и/или диэфиркарбонатом и/или азолидом, особенно предпочтительными гидроксиэтилкрахмалами являются, например, гидроксиэтилкрахмалы, имеющие в среднем молекулярную массу приблизительно 10 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 10 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 18 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 50 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 50 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 12 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 12 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 18 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 30 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 30 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 50 кДа и DS приблизительно 0,4, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 50 кДа и DS приблизительно 0,7, или гидроксиэтилкрахмал, имеющий в среднем молекулярную массу приблизительно 100 кДа и DS приблизительно 0,7. Относительно каждой из этих комбинаций средней молекулярной массы и DS, также предпочтительна величина DS приблизительно 0,8. В соответствии со вторым предпочтительным вариантом осуществления настоящего изобретения относительно введения реакционноспособной карбоксильной группы в полимер, реакционноспособную карбоксильную группу вводят в полимер, восстанавливающий конец которого не является окисленным,путем реакции по меньшей мере одной гидроксильной группы полимера с диэфиром угольной кислоты. Поэтому, настоящее изобретение также относится к способу и конъюгату, как описано выше, в которых А представляет собой реакционноспособную карбоксильную группу, и где А вводят в полимер,восстанавливающий конец которого не является окисленным, путем реакции по меньшей мере одной гидроксильной группы полимера по меньшей мере с одним диэфиром угольной кислоты RB-О-(C=O)-ORC, в котором RB и RC могут быть одинаковыми или разными. Согласно другому варианту осуществления настоящего изобретения, полимер, восстанавливающий конец которого не является окисленным, вступает в реакцию по меньшей мере по одной гидроксильной группе с азолидом, таким как карбонилдиимидазол, карбонил-ди-(1,2,4-триазол) или карбонилдибензимидазол, с получением полимера, имеющего реакционноспособную карбоксильную группу. В качестве подходящих соединений диэфира угольной кислоты могут использоваться соединения,спиртовые компоненты которых представляют собой независимо N-гидроксисукцинимиды, такие как Nгидроксисукцинимид или сульфо-N-гидроксисукцинимид, соответствующим образом замещенные фенолы, такие как п-нитрофенол, о,п-динитрофенол, о,о'-динитрофенол, трихлорфенол, такой как 2,4,6 трихлорфенол или 2,4,5-трихлорфенол, трифторфенол, такой как 2,4,6-трифторфенол или 2,4,5 трифторфенол, пентахлорфенол, пентафторфенол или гидроксиазолы, такие как гидроксибензотриазол. Особенно предпочтительны симметрические соединения диэфира угольной кислоты, где RB и RC таким образом являются одинаковыми. Спиртовой компонент диэфира угольной кислоты предпочтительно выбирают из группы, состоящей из N-гидроксисукцинимида, N-гидрокси сукцинимид сульфоната, N-гидроксибензотриазола и нитро- и галогензамещенных фенолов. Среди прочих, предпочтительны нитрофенол, динитрофенол, трихлорфенол, трифторфенол, пентахлорфенол и пентафторфенол. Особенно предпочтительны N,N'-дисукцинимидил карбонат и сульфо-N,N'-дисукцинимидилкарбонат, и наиболее предпочтительным является N,N'-дисукцинимидилкарбонат. Неожиданно было обнаружено, что было возможно, особенно в предпочтительных диапазонах рН,приведенных выше, особенно при рН ниже 7 и большем или равном 4, осуществлять реакцию производного полимера преимущественно с аминогруппой, расположенной на N-конце белка. Термин "преимущественно" в контексте настоящего изобретения относится к варианту осуществления, где по меньшей мере 80%, предпочтительно по меньшей мере 85% доступных N-концевых аминогрупп вступают в реакцию через восстановительное аминирование. Также возможно вводить в реакцию по меньшей мере 90%,- 29
МПК / Метки
МПК: A61K 47/48
Метки: производное, конъюгата, варианты, полимер, композиция, содержащая, применение, конъюгат, включающий, белок, фармацевтическая, способ, получения
Код ссылки
<a href="https://eas.patents.su/30-14103-konyugat-vklyuchayushhijj-belok-i-polimer-ili-ego-proizvodnoe-varianty-sposob-ego-polucheniya-primenenie-konyugata-i-soderzhashhaya-ego-farmacevticheskaya-kompoziciya.html" rel="bookmark" title="База патентов Евразийского Союза">Конъюгат, включающий белок и полимер или его производное (варианты), способ его получения, применение конъюгата и содержащая его фармацевтическая композиция</a>
Предыдущий патент: Узел ветровоздушного двигателя и механическое транспортное средство с этим узлом
Следующий патент: Новые тетрациклические производные тетрагидрофурана, содержащие боковую цепь циклического амина
Случайный патент: Имидазольные соединения, арил или гетероарил конденсированные, в качестве противовоспалительных и анальгетических средств












