Производные тиенопиридина как ингибиторы мек
Номер патента: 16128
Опубликовано: 28.02.2012
Авторы: Арчибалд Сара Кэтрин, Ньюсс Джуди Шарлотт, Дейвис Джереми Мартин, Джонсон Джеймс Эндрью, Хатчингс Мартин Клайв, Брукингс Даниел Кристофер, Лэнгхем Барри Джон
Формула / Реферат
1. Соединение формулы (I) или его фармацевтически приемлемая соль, сольват или N-оксид
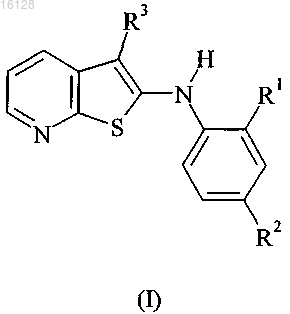
в которой
R1 обозначает водород, галоген или С1-С6алкил;
R2 обозначает галоген или С1-С6алкил;
R3 обозначает -CONRbRc и
Rb и Rc вместе с атомом азота, к которому они оба присоединены, обозначают азетидин-1-ил, пирролидин-1-ил, пиперидин-1-ил, морфолин-4-ил, тиоморфолин-4-ил, пиперазин-1-ил, гомопиперидин-1-ил, гомоморфолин-4-ил или гомопиперазин-1-ил, любая из этих групп необязательно может содержать один или большее количество заместителей, выбранных из группы, включающей С1-С6алкил, C1-С6алкоксигруппу, гидроксигруппу, гидрокси(C1-C6)алкил, амино(C1-C6)алкил, аминогидрокси(C1-C6)алкил, галоген, оксогруппу, C2-С6алкилкарбонил, карбоксигруппу, C2-С6алкоксикарбонил, ди(C1-C6)алкилгидразинилкарбонил, аминогруппу, (C1-C6)алкиламиногруппу, ди(C1-C6)алкиламиногруппу, (C2-C6)алкилкарбониламиногруппу, аминокарбониламиногруппу, аминокарбонил, C1-С6алкиламинокарбонил, ди(C1-C6)алкиламинокарбонил, аминосульфонил, (C1-C6)алкилсульфонил, C1-С6алкиламинокарбонил(C1-C6)алкил, С1-С6алкокси(C1-C6)алкил, карбокси(C1-C6)алкил, C2-C6алкоксикарбонил(C1-C6)алкил, (C2-C6)алкоксикарбониламиногруппу и C2-С6алкоксикарбониламино(C1-C6)алкил.
2. Соединение по п.1, в котором циклический фрагмент -NRbRc обозначает азетидин-1-ил, пирролидин-1-ил, пиперидин-1-ил, морфолин-4-ил, пиперазин-1-ил или гомопиперазин-1-ил, любая из этих групп необязательно может содержать один или большее количество заместителей, как определено в п.1.
3. Соединение по п.1 или 2, в котором циклический фрагмент -NRbRc является незамещенным или замещен одним или большим количеством заместителей, как определено в п.1.
4. Соединение по любому из предыдущих пунктов, в котором заместители на циклическом фрагменте
-NRbRc выбраны из группы, включающей C1-С6алкил, C1-С6алкокси(С1-C6)алкил, гидроксигруппу, гидрокси(C1-C6)алкил, аминогруппу, амино(C1-C6)алкил, карбоксиметил, C2-С6алкоксикарбонил, C2-С6алкоксикарбонил(С1-C6)алкил, ди(C1-C6)алкиламиногруппу, C2-С6алкоксикарбониламиногруппу и C2-С6алкоксикарбониламино(С1-C6)алкил.
5. Соединение по п.4, в котором заместители на циклическом фрагменте -NRbRc выбраны из группы, включающей метил, метоксиметил, гидроксигруппу, гидроксиметил, 2-гидроксиэтил, аминогруппу, аминометил, карбоксиметил, трет-бутоксикарбонил, этоксикарбонилметил, диметиламиногруппу, трет.бутоксикарбониламиногруппу и трет-бутоксикарбониламинометил.
6. Соединение по п.1, в котором циклический фрагмент -NRbRc представляет собой 3-гидроксиазетидин-1-ил, 3-аминоазетидин-1-ил, 3-(аминометил)азетидин-1-ил, 3-(трет-бутоксикарбониламино)азетидин-1-ил, 3-(трет-бутоксикарбониламинометил)азетидин-1-ил, пирролидин-1-ил, 2-(метоксиметил)пирролидин-1-ил, 3-гидроксипирролидин-1-ил, 3-аминопирролидин-1-ил, 3-(трет-бутоксикарбониламино)пирролидин-1-ил, 2-(гидроксиметил)пиперидин-1-ил, 4-аминопиперидин-1-ил, 4-(трет-бутоксикарбониламино)пиперидин-1-ил, морфолин-4-ил, 2-(гидроксиметил)морфолин-4-ил, пиперазин-1-ил, 4-метилпиперазин-1-ил, 2-(гидроксиметил)пиперазин-1-ил, 4-(2-гидроксиэтил)пиперазин-1-ил, 4-(карбоксиметил)пиперазин-1-ил, 4-(трет-бутоксикарбонил)-2-(гидроксиметил)пиперазин-1-ил, 4-(этоксикарбонилметил)пиперазин-1-ил или гомопиперазин-1-ил.
7. Соединение по п.1, представленное формулой (II), и его фармацевтически приемлемые соли, сольваты и N-оксиды
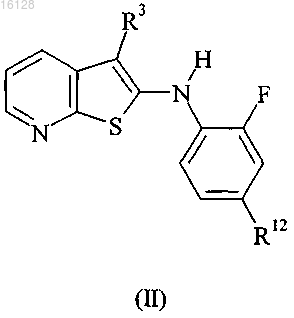
в которой
R12 обозначает галоген; и
R3 является таким, как определено в п.1.
8. Соединение по п.7, в котором R12 обозначает бром или йод.
9. Соединение по п.8, в котором R12 обозначает йод.
10. Соединение по п.1, выбранное из следующих соединений:
N-(2-фтор-4-йодфенил)-3-(морфолин-4-илкарбонил)тиено[2,3-b]пиридин-2-амин,
N-(2-фтор-4-йодфенил)-3-[(4-метилпиперазин-1-ил)карбонил]тиено[2,3-b]пиридин-2-амин,
[2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-ил](пирролидин-1-ил)метанон,
трет-бутиловый эфир (1-{2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-карбонил}пиперидин-4-ил)карбаминовой кислоты,
(4-аминопиперидин-1-ил)амид 2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-карбоновой кислоты, дигидрохлорид,
трет-бутиловый эфир (1-{2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-карбонил}азетидин-3-илметил)карбаминовой кислоты,
[3-(аминометил)азетидин-1-ил]-{2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-ил}метанон,
трет-бутиловый эфир (1-{2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-карбонил}-(3R)-пирролидин-3-ил)карбаминовой кислоты,
трет-бутиловый эфир (1-{2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-карбонил}-(3S)-пирролидин-3-ил)карбаминовой кислоты,
трет-бутиловый эфир (1-{2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-карбонил}азетидин-3-ил)карбаминовой кислоты,
[(3R)-3-аминопирролидин-1-ил]-{2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-ил}метанон,
[(3S)-3-аминопирролидин-1-ил]-{2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-ил}метанон,
(3-аминоазетидин-1-ил)-{2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-ил}метанон,
{2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-ил}-(3-гидроксиазетидин-1-ил)метанон,
{2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-ил}-[(3R)-3-гидроксипирролидин-1-ил]метанон,
{2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-ил}-[(3S)-3-гидроксипирролидин-1-ил]метанон,
{2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-ил}-[2-(гидроксиметил)пиперидин-1-ил]метанон,
{2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-ил}-[(3S)-3-(гидроксиметил)морфолин-4-ил]метанон,
трет-бутиловый эфир 4-{2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-карбонил}-(3R)-3-(гидроксиметил)пиперазин-1-карбоновой кислоты,
2-[4-({2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-ил}карбонил)пиперазин-1-ил]этанол,
3-(1,4-диазепан-1-илкарбонил)-N-(2-фтор-4-йодфенил)тиено[2,3-b]пиридин-2-амин,
N-(2-фтор-4-йодфенил)-3-(пиперазин-1-илкарбонил)тиено[2,3-b]пиридин-2-амин,
этил [4-({2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-ил}карбонил)пиперазин-1-ил]ацетат,
[4-({2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-ил}карбонил)пиперазин-1-ил]уксусная кислота,
{2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-ил}-[(2R)-2-(метоксиметил)пирролидин-1-ил]метанон,
{2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-ил}-[(2R)-2-(гидроксиметил)пиперазин-1-ил]метанон.
11. Фармацевтическая композиция, включающая соединение формулы (I) по п.1 или его фармацевтически приемлемую соль, сольват или N-оксид совместно с фармацевтически приемлемым носителем.
12. Применение соединения формулы (I) по п.1 или его фармацевтически приемлемой соли, сольвата или N-оксида для приготовления лекарственного средства, предназначенного для лечения и/или предупреждения патологических состояний, для которых показано введение селективного ингибитора МЕК.
13. Применение по п.12 соединения формулы (I), определенного в п.1, или его фармацевтически приемлемой соли, сольвата или N-оксида для приготовления лекарственного средства, предназначенного для лечения и/или предупреждения воспалительных, аутоимунных, сердечно-сосудистых, пролиферативных и ноцицептивных состояний.
14. Применение по п.12 соединения формулы (I), определенного в п.1, или его фармацевтически приемлемой соли, сольвата или N-оксида для приготовления лекарственного средства, предназначенного для лечения и/или предупреждения онкологических состояний.
Текст
ПРОИЗВОДНЫЕ ТИЕНОПИРИДИНА КАК ИНГИБИТОРЫ МЕК Описана группа производных тиено[2,3-b]пиридина, которые в положении 2 замещены замещенным анилиновым фрагментом формулы (I) которые являются селективными ингибиторами ферментов МЕK (МАРKK) человека и поэтому полезны для применения в медицине, например, для лечения воспалительных, аутоиммунных,сердечно-сосудистых, пролиферативных (включая онкологические) и ноцицептивных патологических состояний. 016128 Настоящее изобретение относится к классу производных тиенопиридина и к их применению в терапии. Точнее, настоящее изобретение относится к производным тиено[2,3-b]пиридина, которые в положении 2 замещены замещенным анилиновым фрагментом. Эти соединения являются селективными ингибиторами ферментов МЕК (МАРКК) (активированные митогеном протеинкиназы) и поэтому полезны для применения в качестве фармацевтических средств, в особенности для лечения неблагоприятных воспалительных, аутоиммунных, сердечно-сосудистых, пролиферативных (включая онкологические) и ноцицептивных патологических состояний. Ферменты МЕК вовлечены в различные физиологические и патологические функции, которые предположительно проявляются при целом ряде заболеваний людей. Эти функции описаны в абзацах[0004] и [0005] в US 2005/0049276 А 1. Поэтому соединения, применяющиеся в настоящем изобретении, являющиеся активными и селективными ингибиторами МЕК, полезны для лечения и/или предупреждения различных заболеваний человека. Они включают аутоиммунные и воспалительные нарушения, такие как ревматоидный артрит, остеоартрит, рассеянный склероз, астму, воспалительную болезнь кишечника, псориаз и отторжение трансплантата; сердечно-сосудистые нарушения, включая тромбоз, гипертрофию сердца, гипертензию и нерегулярные сердечные сокращения (например, при сердечной недостаточности); пролиферативные нарушения, такие как рестеноз, и онкологические патологические состояния, включая лейкоз, глиобластому, лимфому, меланому и раковые заболевания печени, костей, кожи, головного мозга, поджелудочной железы, легких, молочной железы, желудка, ободочной кишки, прямой кишки, предстательной железы, яичников и шейки матки человека; и боли и ноцицептивные нарушения, включая хроническую боль и невропатическую боль. Кроме того, соединения, применяющиеся в настоящем изобретении могут быть полезны для использования в качестве фармакологических стандартов при разработке новых биологических тестов и при поиске новых фармакологических средств. Так, соединения, применяющиеся в настоящем изобретении, можно использовать в качестве радиолигандов при анализах, предназначенных для обнаружения соединений, способных ингибировать ферменты МЕК человека. Ингибиторы МЕК на основе конденсированных ароматических кольцевых систем, присоединенных к замещенному анилиновому фрагменту, известны в данной области техники. Примеры соответствующих публикаций включают WO 2005/051906, WO 2005/023251, US-A-2005/0049276, WO 2005/009975,WO 03/077914 и WO 03/077855. В WO 2005/023818 описан широкий класс соединений на основе конденсированных бициклических ароматических кольцевых систем, которые в общем случае включают производные тиенопиридина, присоединенные к замещенному анилиновому фрагменту, но специально не раскрыто какое-либо конкретное соединение этого типа. Соединениям, описанным в этой публикации, не приписана какая-либо определенная фармакологическая активность с точки зрения конкретного фармакологического механизма, но тем не менее, утверждается, что они применимы, в частности, для лечения пролиферативных клеточных заболеваний, таких как рак. К этой области относится и US-A-2003/0220365. Однако в предшествующем уровне техники отсутствует явное раскрытие класса производных тиено[2,3-b]пиридина, присоединенных в положении 2 к замещенному анилиновому фрагменту. Согласно изобретению было установлено, что такие соединения являются особенно ценными в качестве селективных ингибиторов ферментов МЕК. Соединения, предлагаемые в настоящем изобретении, являются активными и селективными ингибиторами MEK, обладающими сродством связывания (IC50) с ферментом MEK1 и/или MEK2 человека,равным 50 мкМ или менее, в общем случае - 20 мкМ или менее, обычно - 5 мкМ или менее, в типичном случае - 1 мкМ или менее, предпочтительно - 500 нМ или менее, в идеальном случае - 100 нМ или менее,и более предпочтительно - 20 нМ или менее (специалист в данной области техники должен понимать,что меньшее значение IC50 означает более активное соединение). Соединения, предлагаемые в настоящем изобретении, могут обладать по меньшей мере 10-кратным селективным сродством, обычно - по меньшей мере 20-кратным селективным сродством, предпочтительно по меньшей мере 50-кратным селективным сродством, и в идеальном случае - по меньшей мере 100-кратным селективным сродством к ферменту MEK1 и/или MEK2 человека по сравнению с другими киназами человека. Настоящее изобретение относится к соединению формулы (I) или к его фармацевтически приемлемой соли, сольвату или N-оксиду:R2 обозначает галоген или С 1-С 6 алкил;Rb и Rc вместе с атомом азота, к которому они оба присоединены, обозначают азетидин-1-ил, пирролидин-1-ил, пиперидин-1-ил, морфолин-4-ил, тиоморфолин-4-ил, пиперазин-1-ил, гомопиперидин-1 ил, гомоморфолин-4-ил или гомопиперазин-1-ил, любая из этих групп необязательно может содержать один или большее количество заместителей, выбранных из группы, включающей С 1-С 6 алкил, C1 С 6 алкоксигруппу, гидроксигруппу, гидрокси(C1-C6)алкил, амино(C1-C6)алкил, аминогидрокси(C1C6)алкил, галоген, оксогруппу, С 2-С 6 алкилкарбонил, карбоксигруппу, С 2-С 6 алкоксикарбонил, ди(C1C6)алкилгидразинилкарбонил, аминогруппу, (C1-C6)алкиламиногруппу, ди(C1-C6)алкиламиногруппу, (C2C6)алкилкарбониламиногруппу, аминокарбониламиногруппу, аминокарбонил, С 1-С 6 алкиламинокарбонил, ди(C1-C6)алкиламинокарбонил, аминосульфонил, (C1-C6)алкилсульфонил, С 1-С 6 алкиламинокарбонил(C1-C6)алкил,С 1-С 6 алкокси(C1-C6)алкил,карбокси(C1-C6)алкил,С 2-С 6 алкоксикарбонил(C1-C6)алкил, (C2-C6)алкоксикарбониламиногруппу и С 2-С 6 алкоксикарбониламино(C1-C6)алкил. Настоящее изобретение также относится к соединению формулы (I), приведенной выше, или к его фармацевтически приемлемой соли, сольвату или N-оксиду, в которойRb и Rc вместе с атомом азота, к которому они оба присоединены, обозначают азетидинил, пирролидинил, пиперидинил, морфолинил, тиоморфолинил, пиперазинил, гомопиперидинил или гомоморфолинил, любая из этих групп необязательно может содержать один или большее количество заместителей. Для применения в медицине соли соединений формулы (I) должны быть фармацевтически приемлемыми солями. Однако для получения соединения, предлагаемые в настоящем изобретении, или их фармацевтически приемлемых солей можно использовать другие соли. Подходящие фармацевтически приемлемые соли соединений, предлагаемых в настоящем изобретении, включают соли присоединения с кислотами, которые, например, можно приготовить путем смешивания раствора соединения, предлагаемого в настоящем изобретении, с раствором фармацевтически приемлемой кислоты, такой как хлористоводородная кислота, серная кислота, метансульфоновая кислота, фумаровая кислота, малеиновая кислота, янтарная кислота, уксусная кислота, бензойная кислота, лимонная кислота, винная кислота или фосфорная кислота. Кроме того, если соединения, предлагаемые в настоящем изобретении, содержат кислотный фрагмент, например карбоксигруппу, то их подходящие фармацевтически приемлемые соли могут включать соли щелочных металлов, например соли натрия или калия, соли щелочно-земельных металлов, например соли кальция или магния, и соли, образованные с подходящими органическими лигандами, например четвертичные аммониевые соли. В объем настоящего изобретения входят сольваты соединений формулы (I), приведенной выше. Такие сольваты можно получить с обычными органическими растворителями, например, углеводородными растворителями, такими как бензол или толуол; хлорированными растворителями, такими как хлороформ или дихлорметан; спиртовыми растворителями, такими как метанол, этанол или изопропанол; простыми эфирными растворителями, такими как диэтиловый эфир или тетрагидрофуран; или сложноэфирными растворителями, такими как этилацетат. Альтернативно, сольваты соединений формулы (I) можно получить с водой и в этом случае они будут являться гидратами. Подходящие алкильные группы, которые могут содержаться в соединениях, предлагаемых в настоящем изобретении, включают обладающие линейной и разветвленной цепью С 1-С 6 алкильные группы,например, С 1-С 4 алкильные группы. Типичные примеры включают метильную и этильную группы и обладающие линейной или разветвленной цепью пропильную, бутильную и пентильную группы. Предпочтительные алкильные группы включают метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил и 2,2-диметилпропил. Являющиеся производными выражения, такие как "C1 С 6 алкоксигруппа", "С 1-С 6 алкилтиогруппа", "С 1-С 6 алкилсульфонил" и "С 1-С 6 алкиламиногруппа", образуются соответствующим образом. Предпочтительными C3-С 7 циклоалкильными группами являются циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Подходящие арильные группы включают фенил и нафтил, предпочтительно - фенил. Подходящие арил(C1-C6)алкильные группы включают бензил, фенилэтил, фенилпропил и нафтилметил. Подходящие гетероциклоалкильные группы, которые могут содержать их конденсированные с бензолом аналоги, включают азетидинил, тетрагидрофуранил, диоксоланил, пирролидинил, индолинил,имидазолидинил,тетрагидропиранил,пиперидинил,1,2,3,4-тетрагидрохинолинил,1,2,3,4 тетрагидроизохинолинил, пиперазинил, морфолинил и тиоморфолинил. Подходящие гетероарил группы включают фурильную, бензофурильную, дибензофурильную, тиенильную, бензотиенильную, пирролильную, индолильную, пиразолильную, индазолильную, оксазолильную, изоксазолильную, тиазолильную, изотиазолильную, имидазолильную, бензимидазолильную, оксадиазолильную, тиадиазолильную, триазолильную, тетразолильную, пиридинильную, хинолинильную,-2 016128 изохинолинильную, пиридазинильную, пиримидинильную и пиразинильную группы. Термин "галоген" при использовании в настоящем изобретении включает атомы фтора, хлора, брома и йода. Если соединения формулы (I) содержат один или большее количество асимметрических центров, то они могут существовать в виде соответствующих энантиомеров. Если соединения, предлагаемые в настоящем изобретении, содержат два или большее количество асимметрических центров, то они также могут существовать в виде диастереоизомеров. Следует понимать, что настоящее изобретение включает все такие энантиомеры и диастереоизомеры и их смеси в любом соотношении, включая рацематы. Формула (I) и формулы, приведенные ниже в настоящем изобретении включают все отдельные стереоизомеры и все их возможные смеси, если не указано или не представлено иное. Кроме того, соединения формулы (I) могут существовать в виде таутомеров, например, кето-(СН 2 С=О)енольных-(СН=СНОН) таутомеров. Формула (I) и формулы, приведенные ниже в настоящем изобретении, включают все отдельные таутомеры и все их возможные смеси, если не указано или не представлено иное. В одном варианте осуществления R1 обозначает водород. В другом варианте осуществления R1 обозначает галоген, предпочтительно фтор или хлор, более предпочтительно фтор. В другом варианте осуществления R1 обозначает C1-С 6 алкил, предпочтительно метил. Обычно R1 обозначает фтор. В одном варианте осуществления R2 обозначает галоген, предпочтительно бром или йод. В другом варианте осуществления R2 обозначает C1-С 6 алкил, предпочтительно метил. В одном предпочтительном варианте осуществления R2 обозначает бром. В другом предпочтительном варианте осуществления R2 обозначает йод. Предпочтительно, если Ra обозначает метил или этил, предпочтительно этил. Предпочтительно, если Rb обозначает водород или С 1-С 6 алкил, С 3-С 7 циклоалкил(C1-C6)алкил, C3 С 7 гетероциклоалкил или С 3-С 7 гетероциклоалкил(C1-C6)алкил, любая из этих групп необязательно может содержать один или большее количество заместителей. Более предпочтительно, если Rb обозначает водород или С 1-С 6 алкил, арил, арил(C1-C6)алкил, C3 С 7 гетероциклоалкил, С 3-С 7 гетероциклоалкил(C1-C6)алкил, гетероарил или гетероарил(C1-C6)алкил, любая из этих групп необязательно может содержать один или большее количество заместителей. Более предпочтительно, если Rb или циклический фрагмент -NRbRc может быть незамещенным или содержать один или большее количество заместителей, обычно 1 или 2 заместителя. В одном варианте осуществления группа Rb или циклический фрагмент -NRbRc является незамещенным. В другом варианте осуществления группа Rb или циклический фрагмент -NRbRc является монозамещенным. В другом варианте осуществления группа Rb или циклический фрагмент -NRbRc является дизамещенным. Примеры типичных заместителей Rb или циклического фрагмента -NRbRc включают C1-С 6 алкил, С 1 С 6 алкоксигруппу, гидроксигруппу, гидрокси(C1-C6)алкил, амино(C1-C6)алкил, (амино)(гидрокси)-(C1C6)алкил, галоген, оксогруппу, C2-С 6 алкилкарбонил, карбоксигруппу, C2-С 6 алкоксикарбонил, ди(C1C6)алкилгидразинилкарбонил, аминогруппу, C1-С 6 алкиламиногруппу, ди(C1-C6)алкиламиногруппу, C2 С 6 алкилкарбониламиногруппу, аминокарбониламиногруппу, аминокарбонил, С 1-С 6 алкиламинокарбонил,ди(C1-C6)алкиламинокарбонил, аминосульфонил, C1-С 6 алкилсульфонил и C1-С 6 алкиламинокарбонил(C1C6)алкил. Другие примеры включают С 1-С 6 алкокси(C1-C6)алкил, карбокси(C1-C6)алкил, C2 С 6 алкоксикарбонил(C1-C6)алкил, С 2-С 6 алкоксикарбониламиногруппу и C2-С 6 алкоксикарбониламино(С 1C6)алкил. Примеры предпочтительных заместителей Rb или циклического фрагмента -NRbRc включают метил,метоксигруппу,гидроксигруппу,гидроксиметил,2-гидроксиэтил,аминометил,2-амино-3 гидроксипропил, фтор, оксогруппу, ацетил, карбоксигруппу, метоксикарбонил, этоксикарбонил, третбутоксикарбонил,диметилгидразинилкарбонил,аминогруппу,метиламиногруппу,1,3 диметилбутиламиногруппу, диметиламиногруппу, ацетиламиногруппу, аминокарбониламиногруппу,аминокарбонил, этиламинокарбонил, диэтиламинокарбонил, аминосульфонил, метилсульфонил и метиламинокарбонилметил. Другие примеры включают метоксиметил, карбоксиметил, этоксикарбонилметил,трет-бутоксикарбониламиногруппу и трет-бутоксикарбониламинометил. Примеры более предпочтительных заместителей Rb или циклического фрагмента -NRbRc включаютC1-С 6 алкил, C1-С 6 алкокси(C1-C6)алкил, гидроксигруппу, гидрокси(C1-C6)алкил, аминогруппу, амино(C1C6)алкил,карбоксиметил,С 2-С 6 алкоксикарбонил,С 2-С 6 алкоксикарбонил(C1-C6)алкил,ди(C1C6)алкиламиногруппу, C2-С 6 алкоксикарбониламиногруппу и C2-С 6 алкоксикарбониламино(C1-C6)алкил. Примеры еще более предпочтительных заместителей Rb или циклического фрагмента -NRbRc, включают метил, метоксиметил, гидроксигруппу, гидроксиметил, 2-гидроксиэтил, аминогруппу, аминометил,карбоксиметил,трет-бутоксикарбонил,этоксикарбонилметил,диметиламиногруппу,третбутоксикарбониламиногруппу и трет-бутоксикарбониламинометил. Предпочтительные значения Rb включают водород, метил, этил, пропил, циклопропилметил, азетидинил, пирролидинил, пиперидинил, азетидинилметил, диоксоланилметил, пирролидинилметил, морфолинилэтил и морфолинилпропил, любая из этих групп необязательно может содержать один или большее количество заместителей. В этом контексте предпочтительные заместители включают C1-С 6 алкил (пред-3 016128 почтительно - метил), гидроксигруппу, аминогруппу, С 2-С 6 алкоксикарбонил (предпочтительно - третбутоксикарбонил) и ди(C1-C6)алкиламиногруппу (предпочтительно - диметиламиногруппу). Предпочтительные значения Rb включают водород, метил, 2-гидроксиэтил, 3-гидроксипропил, 1 гидроксипроп-2-ил,2,3-дигидроксипропил,2-амино-2-метилпропил,2,2-диметил-3-(диметиламино)пропил, циклопропилметил, 1-трет-бутоксикарбонилазетидин-3-ил, пирролидин-3-ил, 1-третбутоксикарбонилпирролидин-3-ил, пиперидин-3-ил, пиперидин-4-ил, 1-метилпиперидин-4-ил, 1-третбутоксикарбонилпиперидин-3-ил,1-трет-бутоксикарбонилпиперидин-4-ил,1-трет-бутоксикарбонилазетидин-3-илметил, 2,2-диметил-[1,3]диоксолан-4-илметил, пирролидин-2-илметил, 2-(морфолин 4-ил)этил и 3-(морфолин-4-ил)пропил. Обычно Rb обозначает водород или C1-С 6 алкил, необязательно замещенный одной или большим количеством, предпочтительно - одной или двумя гидроксигруппами. Типичные значения Rb включают водород, метил, гидроксипропил и дигидроксипропил. В одном варианте осуществления Rb обозначает водород. В другом варианте осуществления Rb обозначает метил. В другом варианте осуществления Rb обозначает гидроксипропил, предпочтительно 3-гидроксипропил. В дополнительном варианте осуществления Rb обозначает дигидроксипропил, предпочтительно 2,3 дигидроксипропил. В одном варианте осуществления Rc обозначает водород. В другом варианте осуществления Rc обозначает C1-С 6 алкил, предпочтительно метил. В другом варианте осуществления Rc обозначает гидрокси(C1-C6)алкил, например гидроксиэтил (предпочтительно 2-гидроксиэтил). Альтернативно, фрагмент -NRbRc предпочтительно может представлять собой азетидин-1-ил, пирролидин-1-ил, пиперидин-1-ил, морфолин-4-ил, тиоморфолин-4-ил, пиперазин-1-ил, гомопиперидин-1-ил или гомоморфолин-4-ил, любая из этих групп необязательно может содержать один или большее количество заместителей. Фрагмент -NRbRc также может представлять собой необязательно замещенный гомопиперазин-1-ил. Предпочтительные значения циклического фрагмента -NRbRc включают азетидин-1-ил, пирролидин-1-ил, пиперидин-1-ил, морфолин-4-ил, пиперазин-1-ил и гомопиперазин-1-ил, любая из этих групп необязательно может содержать один или большее количество заместителей. Более предпочтительные значения циклического фрагмента -NRbRc включают 3-гидроксиазетидин 1-ил, 3-аминоазетидин-1-ил, 3-(аминометил)азетидин-1-ил, 3-(трет-бутоксикарбониламино)азетидин-1 ил, 3-(трет-бутоксикарбониламинометил)азетидин-1-ил, пирролидин-1-ил, 2-(метоксиметил)пирролидин 1-ил, 3-гидроксипирролидин-1-ил, 3-аминопирролидин-1-ил, 3-(трет-бутоксикарбониламино)пирролидин-1-ил,2-(гидроксиметил)пиперидин-1-ил,4-аминопиперидин-1-ил,4-(трет-бутоксикарбониламино)пиперидин-1-ил, морфолин-4-ил, 2-(гидроксиметил)морфолин-4-ил, пиперазин-1-ил, 4 метилпиперазин-1-ил,2-(гидроксиметил)пиперазин-1-ил,4-(2-гидроксиэтил)пиперазин-1-ил,4(карбоксиметил)пиперазин-1-ил,4-(трет-бутоксикарбонил)-2-(гидроксиметил)пиперазин-1-ил,4(этоксикарбонилметил)пиперазин-1-ил и гомопиперазин-1-ил. Предпочтительно, если циклический фрагмент -NRbRc может быть замещен C1-С 6 алкилом, предпочтительно метилом. Предпочтительные значения -NRbRc включают пирролидин-1-ил, морфолин-4-ил и 4-метилпиперазин-1-ил. Обычно R3 обозначает цианогруппу, -CO2Ra, -CONRbRc, или -CON(ORb)Rc, где Ra, Rb и Rc являются такими, как определено выше. Предпочтительно, если R3 обозначает цианогруппу, -CO2R или -CONRbRc,более предпочтительно цианогруппу или -CONRbRc, где Ra, Rb и Rc являются такими, как определено выше. Предпочтительно, если R3 обозначает -CON(ORb)Rc, где Rb и Rc являются такими, как определено выше. В одном варианте осуществления R3 обозначает цианогруппу. В другом варианте осуществления R3 обозначает -CO2Ra, где Ra является таким, как определено выше. В другом варианте осуществления R3 обозначает -CONRbRc, где Rb и Rc являются такими, как определено выше. В дополнительном варианте осуществления R3 обозначает -CON(ORb)Rc, где Rb и Rc являются такими, как определено выше. В еще одном варианте осуществления R3 обозначает водород. Предпочтительная подгруппа соединений, предлагаемых в настоящем изобретении, характеризуется соединениями формулы (II), и его фармацевтически приемлемыми солями, сольватами и N-оксидами:-4 016128 В одном предпочтительном варианте осуществления R12 обозначает бром. В другом предпочтительном варианте осуществления R12 обозначает йод. Предпочтительные новые соединения, предлагаемые в настоящем изобретении, включают все соединения, получение которых описано в прилагающихся примерах, и их фармацевтически приемлемые соли и сольваты. Настоящее изобретение также относится фармацевтической композиции, которая включает соединение формулы (I), определенное выше, или его фармацевтически приемлемую соль, сольват или Nоксид, совместно с одним или большим количеством фармацевтически приемлемых носителей. Фармацевтические композиции, предлагаемые в настоящем изобретении, могут находиться в форме, пригодной для перорального, трансбуккального, парентерального, назального, местного, глазного или ректального введения, или в форме, пригодной для введения путем ингаляции или вдувания. Фармацевтические композиции, предназначенные для перорального введения, могут находиться,например, в форме таблеток, лепешек или капсул, приготовленных по обычным методикам с использованием фармацевтически приемлемых инертных наполнителей, таких как связующие (например, предварительно желатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или гидрофосфат кальция); смазывающие вещества (например, стеарат магния, тальк или диоксид кремния); вещества, обеспечивающие распадаемость (например, картофельный крахмал или гликолят натрия); или смачивающие агенты (например, лаурилсульфат натрия). На таблетки можно нанести покрытия по методикам, хорошо известным в данной области техники. Жидкие препараты, предназначенные для перорального введения,могут находиться, например, в форме растворов, сиропов или суспензий или они могут выпускаться в виде твердых продуктов, предназначенных для проводимого перед применением восстановления водой или другим подходящим растворителем. Такие жидкие препараты можно приготовить по обычным методикам с использованием фармацевтически приемлемых добавок, таких как суспендирующие агенты,эмульгирующие агенты, неводные растворители или консерванты. Эти препараты также могут содержать буферные соли, вкусовые добавки, окрашивающие агенты или подсластители, если это является целесообразным. Препараты, предназначенные для перорального введения, можно готовить в таком виде, чтобы обеспечить регулируемое высвобождение активного соединения. Композиции, предназначенные для трансбуккального введения, могут находиться, например, в форме таблеток или лепешек, приготовленных обычным образом. Соединения формулы (I) можно приготовить для парентерального введения путем инъекции, например болюсной инъекции, или путем вливания. Препараты для инъекции могут поставляться в разовой дозированной форме, например в стеклянных ампулах или содержащих множество доз контейнерах, например в стеклянных флаконах. Композиции для инъекции могут находиться в таких формах, как суспензии, растворы или эмульсии в масле или водных растворителях и могут содержать применяющиеся для приготовления препаратов агенты, такие как суспендирующие, стабилизирующие, консервирующие и/или диспергирующие агенты. Альтернативно, активный ингредиент может находиться в порошкообразной форме для восстановления с помощью подходящего растворителя, например стерильной апирогенной воды. В дополнение к препаратам, описанным выше, соединения формулы (I) также можно приготовить в виде препаратов-депо. Такие препараты пролонгированного действия можно вводить путем имплантации или внутримышечной инъекции. В случае назального введения или введения путем ингаляции соединения, предлагаемые в настоящем изобретении, можно приготовить в виде материалов для распыления с использованием в упаковках под давлением с применением подходящего пропеллента, например дихлордифторметана, фтортрихлорметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа или смеси газов. При необходимости композиции модно использовать в упаковке или дозирующем устройстве, которое может включать одну или большее количество разовых дозированных форм, содержащих активный ингредиент. К упаковке или дозирующему устройству могут прилагаться инструкции по введению. В случае местного введения соединения, предлагаемые в настоящем изобретении, можно приготовить в виде подходящей мази, содержащей активный компонент, суспендированный или растворенный в одном или большем количестве фармацевтически приемлемых носителей. Предпочтительные носители включают, например, минеральное масло, жидкие нефтепродукты, пропиленгликоль, полиоксиэтилен,полиоксипропилен, эмульгирующийся воск и воду. Альтернативно, соединения, предлагаемые в настоящем изобретении, можно приготовить в виде подходящего лосьона, содержащего активный компонент,суспендированный или растворенный в одном или большем количестве фармацевтически приемлемых носителей. Предпочтительные носители включают, например, минеральное масло, сорбитанмоностеарат,полисорбат 60, воск на основе цетиловых эфиров, цетеариловый спирт, бензиловый спирт, 2 октилдодеканол и воду. В случае введения в глаза соединения, предлагаемые в настоящем изобретении, можно приготовить в виде тонкоизмельченных суспензий в изотоническом, обладающем необходимым значением рН сте-5 016128 рильном солевом растворе, без прибавления или с прибавлением консерванта, такого как бактерицидный или фунгицидный агент, например, фенилмеркурнитрат, бензилалконийхлорид или хлоргексидинацетат. Альтернативно, в случае введения в глаза соединения можно приготовить в виде мази, такой как на основе вазелинового масла. В случае ректального введения соединения, предлагаемые в настоящем изобретении, можно приготовить в виде суппозиториев. Их можно приготовить путем смешивания активного компонента с подходящим, не оказывающим раздражающего воздействия инертным наполнителем, который является твердым при комнатной температуре, но жидким при ректальной температуре и поэтому плавится в прямой кишке с высвобождением активного компонента. Такие вещества включают, например, масло какао,пчелиный воск и полиэтиленгликоли. Количество соединения, предлагаемого в настоящем изобретении, необходимое для профилактики или лечения конкретного патологического состояния, будет меняться в зависимости от выбранного соединения и состояния подвергающегося лечению пациента. Однако обычно суточные дозы могут составлять примерно от 10 нг/кг до 1000 мг/кг, обычно от 100 нг/кг до 100 мг/кг, например, примерно от 0,01 до 40 мг/(кг массы тела) при пероральном или трансбуккальном введении, от примерно 10 нг/кг до 50 мг/(кг массы тела) при парентеральном введении, и от примерно 0,05 до примерно 1000 мг, например, от примерно 0,5 до примерно 1000 мг, при назальном введении или введении путем ингаляции или вдувания. Соединения формулы (I), приведенной выше, и их N-оксиды, можно получить по методике, которая включает реакцию соединения формулы (III) или его N-оксида с соединением формулы (IV) в которой R1, R2 и R3 являются такими, как определено выше, и L1 обозначает подходящую отщепляющуюся группу. Отщепляющаяся группа L1 обычно является атомом галогена, например хлора. Реакцию удобно проводить при повышенной температуре, если это необходимо, то в подходящем растворителе, например диметилсульфоксиде, обычно в щелочной среде, например, в присутствии неорганического основания, такого как гидрид натрия. Промежуточные продукты формулы (IV), приведенной выше, можно получить по реакции соединения формулы (V) в которой R1 и R2 являются такими, как определено выше, с тиофосгеном. Реакцию удобно проводить в подходящем растворителе, обычно в смеси хлороформа и воды. При использовании другой процедуры соединения формулы (I), приведенной выше, в которой R3 обозначает -CONRbRc или -CON(ORb)Rc и их N-оксиды, можно получить по методике, которая включает реакцию соединения формулы H-NRbRc или H-N(ORb)Rc с соединением формулы (VI) или его Nоксидом: в которой R1, R2, Rb и Rc являются такими, как определено выше; в присутствии конденсирующего реагента. Подходящим конденсирующим реагентом является 1-(3-диметиламинопропил)-3 карбодиимидгидрохлорид (EDC) и в этом случае реакцию удобно проводить в присутствии 1-6 016128 гидроксибензотриазола (ГОБТ) и N-метилморфолина (NMM). Соединения формулы (VI), приведенной выше, можно получить по реакции соединения формулы с соединением формулы (V), определенным выше. Реакцию с удобством можно проводить путем обработки соединения (V) основанием, например,бис(триметилсилил)амидом лития, в подходящем растворителе, например тетрагидрофуране, с последующим прибавлением соединения (VII). Промежуточный продукт формулы (VII), приведенной выше, можно получить из соединения формулы (VIII) в которой Ra является таким, как определено выше; путем омыления сложноэфирного фрагмента с последующим окислением метилсульфанильной группы. Омыление сложноэфирного фрагмента -CO2Ra в соединении (VIII) можно провести путем обработки основанием щелочного металла, например гидроксидом натрия, в подходящем растворителе, например, смеси воды с низшим алаканолом, таким как метанол, или циклическим простым эфиром, таким как тетрагидрофуран. Окисление метилсульфанильной группы в полученном соединении после этого можно провести путем обработки подходящим окислительным реагентом, например оксоном (пероксимоносульфат калия), в подходящем растворителе, например водном растворе метанола. Промежуточные продукты формулы (VIII), приведенной выше, можно получить по реакции соединения формулы (III), в которой R3 обозначает -CO2Ra, как определено выше, с дисульфидом углерода, с последующей обработкой метилгалогенидом, таким как йодметан. Реакцию удобно проводить в подходящем растворителе, например диметилсульфоксиде, в присутствии основания, такого как гидрид натрия. Если исходные вещества формулы (III) и (V) не имеются в продаже, то их можно получить по методикам, аналогичным приведенным в прилагающихся примерах, или по стандартным методикам, хорошо известным в данной области техники. Следует понимать, что любое соединение формулы (I), полученное по любой из указанных выше методик, затем при необходимости можно превратить в другое соединение формулы (I) по методикам,известным в данной области техники. Например, соединение формулы (I), в которой R3 обозначает-CO2Ra можно превратить в соответствующее соединение, в котором R3 обозначает -CONH2, путем обработки аммиаком, обычно в низшем алканоле в качестве растворителя, например этаноле, при повышенных температуре и давлении. Альтернативно, соединение формулы (I), в которой R3 обозначает -CO2Ra, можно превратить в соответствующее соединение, в котором R3 обозначает -CONRbRc, путем обработки соответствующим амином формулы H-NRbRc в присутствии триметилалюминия. Соединение формулы (I), в которой R3 обозначает -CO2Ra, можно превратить в соответствующее соединение, в котором R3 обозначает водород,путем обработки щелочным реагентом, таким как гидроксид лития, при жестких условиях, например,путем кипячения с обратным холодильником в смеси этанола и воды. Соединение формулы (I), в которой R3 содержит 2,2-диметил-[1,3]диоксолан-4-илметильный фрагмент, можно превратить в соответствующее соединение, в котором R3 содержит 2,3-дигидроксипропильный фрагмент, путем обработки неорганической кислотой, такой как хлористо-водородная кислота. Соединение формулы (I), в которой R3 содержит атом азота, к которому присоединена трет-бутоксикарбонильная (ВОС) группа, можно превратить в соответствующее соединение, в котором R3 содержит группу N-H, путем обработки кислотой, например неорганической кислотой, такой как хлористо-водородная кислота, или органической кислотой,такой как трифторуксусная кислота. Соединение формулы (I) в которой R3 обозначает группу N-H, можно превратить в соответствующее соединение, в котором R3 содержит атом азота, к которому присоединена этоксикарбонилметильная группа, путем обработки этилхлорацетатом, обычно в присутствии триэтиламина; полученное соединение затем можно превратить в соответствующее соединение, в которомR3 содержит атом азота, к которому присоединена карбоксиметильная группа, путем обработки щелочным реагентом, таким как гидроксид натрия, обычно в водном растворе низшего алканола, такого как этанол. Пиридин-N-оксидное производное соединения формулы (I) можно превратить в соответствующее соединение формулы (I) путем обработки трифенилфосфином и трихлоридом фосфора. Если при использовании любой из описанных выше методик получения соединений, предлагаемых в настоящем изобретении, образуется смесь продуктов, то искомый продукт можно из нее выделить на подходящей стадии с помощью обычных методик, таких как препаративная ВЭЖХ (высокоэффективная жидкостная хроматография) или колоночная хроматография с использованием, например, диоксида кремния и/или оксида алюминия вместе с подходящей системой растворителей. Если при использовании описанных выше методик получения соединений, предлагаемых в настоящем изобретении, образуется смесь стереоизомеров, то эти изомеры можно разделить по обычным методикам. В частности, когда необходимо получить конкретный энантиомер соединения формулы (I), то его можно получить из соответствующей смеси энантиомеров по любой обычной методике разделения энантиомеров. Так, например, диастереоизомерные производные, например, соли можно получить по реакции смеси энантиомеров формулы (I), например, рацемата с соответствующим хиральным соединением,например, хиральным основанием. Затем диастереоизомеры можно разделить по любым обычным методикам, например, путем кристаллизации и выделить необходимый энантиомер, например, путем обработки кислотой, если диастереоизомер является солью. В другой методике разделения рацемат формулы(I) можно разделить с помощью хиральной ВЭЖХ. Кроме того, при необходимости конкретный энантиомер можно получить путем использования подходящего хирального промежуточного продукта в одной из методик, описанных выше. Альтернативно, конкретный энантиомер можно получить путем проведения энантиомерно специфического биологического превращения, например, гидролиза сложного эфира с использованием эстеразы с последующей очисткой только энантиомерно чистой образовавшейся вследствие гидролиза кислоты от непрореагировавшего антипода - сложного эфира. Если необходимо получить конкретный геометрический изомер, предлагаемый в настоящем изобретении, то промежуточные продукты или конечные продукты можно использовать как хроматографию, перекристаллизацию и другие обычные методики разделения. Во время любой из указанных выше последовательностей синтеза может оказаться необходимой и/или желательной защита чувствительных или реакционноспособных групп в любой из участвующих в реакциях молекул. Это можно выполнить с помощью обычных защитных групп, таких как описанные в публикациях Protective Groups in Organic Chemistry, ed. J.F.W. McOmie, Plenum Press, 1973; и T.W. GreeneP.G.M. Wuts, Protective Groups in Organic Synthesis, John WileySons, 3rd edition, 1999. Защитные группы можно удалить на любой подходящей последующей стадии по методикам, известным в данной области техники. Приведенные ниже примеры иллюстрируют получение соединений, предлагаемых в настоящем изобретении. Соединения, предлагаемые в настоящем изобретении, эффективно ингибируют активность фермента МЕК человека. Исследование MEK in vitro Активность MEK1 исследовали с помощью каскадной методики при инициировании с помощью активного Raf путем активации MEK, Erk2 и последующего фосфорилирования меченого флуоресцеином субстрата Erk-tide при исследовании, основанном на поляризации флуоресценции (IMAP). Исследование проводили в 20 мМ Tris [трис(гидроксиметиламинометан)]+5 мМ MgCh+2 мМ DL-дитиотреитола + 0,01% Tween 20 рН 7,2, содержащем 1,5 нМ неактивированного МЕК, 100 нМ неактивированного Erk и 200 нМ Erk-tide (все концентрации являются конечными). Соединения или ДМСО в качестве контроля исследованы при конечной концентрации 2% ДМСО и исследование инициировали в присутствии 5 мкМ АТР (аденозинтрифосфат) путем прибавления 1,25 нМ активного Raf в буфере для проведения анализа. Через 20 мин при КТ прибавляли останавливающий раствор, а затем связывающие гранулы IMAP, затем исследуемую смесь инкубировали в течение 90 мин при КТ (при встряхивании) и после этого считывали с помощью считывающего устройства Molecular Devices LJL HT. При исследовании по описанной выше методике установлено, что все соединения, приведенные в прилагающихся примерах, ингибируют фермент МЕК человека и характеризуются значениями IC50, равными 10 мкМ или менее. Все спектры ЯМР снимали при 300 или 400 МГц. Названия соединений получены с помощью программного обеспечения ACD Labs Name (v. 7.0),выпускающегося формой Advanced Chemical Development, Toronto, Canada. Стандартная методика ЖХМС Использовали систему ЖХМС (жидкостная хроматография - масс-спектроскопия) Waters Alliance 2795 НТ quaternary HPLC с детектором на фотодиодной матрице (ДФМ) Waters 996 и масс-спектрометр с одной квадрупольной линзой Waters ZQ 4000. ZQ может накапливать данные одновременно в режимах положительной и отрицательной ионизации электрораспылением. Масс-спектрометр ZQ Данные получали в режиме полного сканирования от 100 до 1000 m/z. ВЭЖХ Аналитическое разделение с обращенной фазой проводили на приборе Gemini С 18, выпускающемся фирмой Phenomenex 504,6 мм с использованием диоксида кремния 5 мкм. Растворитель А: 90% 10 мМ NH4CO2 в воде/0,1% муравьиной кислоты/10% CH3CN Растворитель В: 90% CH3CN/0,l% муравьиной кислоты/10% 10 мМ NH4CO2 в воде Растворитель С: 90% 10 мМ NH4CO2 в воде/0,1% аммиака/10% CH3CN Растворитель D: 90% CH3CN/10% 10 мМ NH4CO2 в воде/0,1% аммиака Программа градиентного режима Для методики 595 рН=3 Препаративная УФ ВЭЖХ Система ЖХ включает четверной насос Waters 2525, детектор на фотодиодной матрице (ДФМ) Waters 996, систему отбора проба Waters 2700, систему подачи жидкости в колонки Column Fluidics Organiser и устройство сбора фракций Waters, работающие в режиме обращенной фазы с одной из двух систем рН. Система с низким рН (рН примерно 3,2) Разделение с обращенной фазой проводили на приборе Luna С 18, выпускающемся фирмой Phenomenex 10021,2 мм с использованием диоксида кремния 5 мкм. Растворитель А: 90% воды/10% CH3CN/0,1% муравьиной кислоты Растворитель В: 90% CH3CN/10% воды/0,1% муравьиной кислоты Система с высоким рН (рН примерно 9,5) Разделение с обращенной фазой проводили на приборе Gemini С 18, выпускающемся фирмой Phenomenex 15021,2 мм с использованием диоксида кремния 10 мкм. Растворитель С: 90% 10 мМ NH4HCO2 в воде/0,1% аммиака/10% CH3CN Растворитель D: 90% CH3CN/10% 10 мМ NH4HCO2 в воде/0,1% аммиака Типичные градиентные режимы описаны ниже: Программа градиентного режима для методики с низким рН Программа градиентного режима для методики с высоким рН Промежуточный продукт 1. 2-Фтор-4-йод-1-изотиоцианатобензол Тиофосген (3,55 мл, 46,4 ммоль) при энергичном перемешивании прибавляли к смеси 2-фтор-4 йоданилина (10,0 г, 42,2 ммоль) в CHCl3 (200 мл) и воды (100 мл). Смесь перемешивали при КТ в течение 16 ч. Органическую фазу сушили (Na2SO4) и концентрировали в вакууме и получали искомое соединение в виде почти белого кристаллического твердого вещества (11,8 г, количественный выход). Н (ДМСО-d6) 7,87 (1 Н, dd, J 1,8, 9,5 Гц), 7,63 (1 Н, ddd, J 1,0, 1,8, 8,4 Гц), 7,25 (1H, dd, J 8,2, 8,4 Гц). Промежуточный продукт 2. Этил-2-[(4-бром-2-фторфенил)амино]тиено[2,3-b]пиридин-3 карбоксилат Получали из этил-(2-хлорпиридин-3-ил)ацетата (D. H. Bremner et al., Synthesis, 1997, 949) (500 мг,2,5 ммоль) и 4-бром-2-фторфенилизотиоцианата (580 мг, 2,5 ммоль) по методике примера 1. Искомое соединение получали в виде почти белого твердого вещества (390 мг, 40%).(ЭР+) ВУ 4,66 мин, 395 (М(79Br)+Н)+. Промежуточный продукт 3. 3-(трет-Бутилдиметилсиланилокси)пропиламин К раствору N-(3-гидроксипропил)фталимида (5,25 г, 24,36 ммоль) в ДМФ (20 мл) прибавляли имидазол (16,6 г, 240 ммоля) и трет-бутилдиметилсилилхлорид (19 г, 120 ммоль). Реакционную смесь пере- 10016128 мешивали при комнатной температуре в течение 18 ч, затем летучие вещества удаляли в вакууме и порцию неочищенного продукта обрабатывали с помощью колоночной хроматографии (SiO2, 1:1 ДХМ/гексаны) и получали 2-[3-(трет-бутилдиметилсиланилокси)пропил]изоиндол-1,3-дион в виде прозрачного масла (5 г). 2-[3-(Трет-бутилдиметилсиланилокси)пропил]изоиндол-1,3-дион (5 г, 26,4 ммоль) растворяли в этаноле (50 мл) и прибавляли метилгидразин (2,94 мл, 55,4 ммоль). Реакционную смесь нагревали при 75 С в течение 8 ч, затем концентрировали в вакууме. Неочищенный остаток растирали со смесью диэтилового эфира (150 мл) и гексанов (50 мл) и полученное твердое вещество отделяли фильтрованием. Растворители удаляли в вакууме и получали искомое соединение в виде бледно-желтого маслаH (ДМСО-d6) 4,58 (2 Н, br s), 3,63-3,58 (2 Н, m), 2,67-2,62 (2 Н, m), 1,60-1,55 (2 Н, m), 0,83 (9 Н, d, J 1,1 Гц), 0,00 (6 Н, d, J 1,2 Гц). ЖХМС (ЭР+) ВУ 1,77 мин, 190 (М+Н)+. Промежуточный продукт 4. Этиловый эфир 2-метансульфанилтиено[2,3-b]пиридин-3-карбоновой кислоты К раствору этил-(2-хлорпиридин-3-ил)ацетата (D. H. Bremner et al., Synthesis, 1997, 949) (8,0 г, 40,0 ммоля) и дисульфида углерода (3,18 г, 42,0 ммоля) в ДМСО (100 мл) порциями прибавляли гидрид натрия (2,4 г, 60,0 ммоль). После 60 мин перемешивания при комнатной температуре смесь нагревали при 80 С в течение 2 ч. После этого реакционной смеси давали охладиться до комнатной температуры и прибавляли метилйодид (7,6 г, 54,0 ммоль). Через 18 ч прибавляли лед (50 мл) и образовывался желтый осадок, который выделяли фильтрованием и получали искомое соединение в виде серого твердого вещества(7,95 г, 78%). Н (ДМСО-d6) 8,60 (1H, dd, J 1,6, 8,2 Гц), 8,46, (1H, dd, J 1,6, 4,6 Гц), 7,35 (1 Н, dd, J 4,6, 8,2 Гц), 4,48 (2 Н, q, J 7,1 Гц), 2,71, (3 Н, s), 1,49 (3 Н, t, J 7,1 Гц). Промежуточный продукт 5. 2-Метансульфанилтиено[2,3-b]пиридин-3-карбоновая кислота Смесь промежуточного продукта 4 (12,5 г, 50,0 ммоля) с ТГФ (200 мл) и МеОН (50 мл) обрабатывали раствором гидроксида натрия (10% водный раствор, 50 мл) и перемешивали при комнатной температуре в течение 18 ч. После этого реакционную смесь упаривали в вакууме до одной трети ее объема. Затем прибавляли воду (50 мл), а после этого прибавляли 10% HCl, пока не образовывался белый осадок. Его отфильтровывали и получали искомое соединение в виде белого кристаллического твердого вещества (10,6 г, 95%). H (ДМСО-d6) 13,50-13,20 (1 Н br s), 8,55 (1H, dd, J 1,2, 8,2 Гц), 8,48 (1H, dd, J 1,3, 4,5 Гц),7,49 (1H, dd, J 4,6, 8,2 Гц), 3,25 (3 Н, s). Промежуточный продукт 6. 2-Метансульфинилтиено[2,3-b]пиридин-3-карбоновая кислота Оксон (14,5 г, 24,0 ммоля), растворенный в воде (25 мл), при энергичном перемешивании прибавляли к смеси промежуточного продукта 5 (10,6 г, 47 ммоля) с МеОН (250 мл). Смесь перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь подвергали распределению между ДХМ (300 мл) и водой (200 мл). Органический слой сушили (Na2SO4) и концентрировали в вакууме и получали искомое соединение в виде белого кристаллического твердого вещества (10,0 г, 88%). Н (ДМСО-d6) 14,20-13,80 (1H, br s), 8,73 (1H, dd, J 1,7, 8,3 Гц), 8,69 (1 Н, J 1,7, 4,6 Гц), 7,61 (1H, dd, J 4,6, 8,3 Гц), 3,05 (3 Н, s). Промежуточный продукт 7. 2-[(2-Фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-карбоновая кислота При перемешивании к раствору 2-фтор-4-йоданилина (6,0 г, 25 ммоля) в ТГФ (100 мл) при 0 С (баня со льдом) медленно прибавляли LiHMDS (1,0 М раствор в ТГФ, 20,0 мл, 20,0 ммоля). Смесь перемешивали при комнатной температуре в течение 30 мин, затем охлаждали до 0 С и порциями прибавляли промежуточный продукт 6 (2,0 г, 8,3 ммоля). Смесь перемешивали при комнатной температуре в течение 1 ч. После этого реакционную смесь выливали на лед и после установления температуры окружающей среды прибавляли лимонную кислоту, пока не образовывался осадок. Смесь фильтровали и получали искомое соединение в виде бледно-коричневого кристаллического твердого вещества (2,9 г, 84%). Н (ДМСО-d6) 14,00-13,00 (1H, br s), 10,80 (1H, s), 8,36 (1H, dd, J 1,3, 8,1 Гц), 8,32 (1 Н, dd, J, 1,3, 4,8 Гц), 7,84 (1H, dd, J 1,8, 10,1 Гц), 7,69 (1 Н, d, J 8,3 Гц), 7,54 (1H, m), 7,42 (1H, dd, J 8,3, 4,8 Гц). Промежуточный продукт 8. 4-Йод-1-изотиоцианато-2-метилбензол При перемешивании к раствору 4-йод-2-метиланилина (1,0 г, 4,2 ммоля) в ДХМ (50 мл) прибавляли воду (20 мл), а затем тиофосген (490 мг, 4,2 ммоля). Реакционную смесь перемешивали в течение ночи,затем слои разделяли и органический слой сушили (Na2SO4) и выпаривали в вакууме и получали искомый продукт в виде коричневого твердого вещества (1,05 г, 89%). H (CDCl3) 7,75 (1 Н, d, J 1,2 Гц), 7,62(1 Н, dd, J 1,2, 8,3 Гц), 7,15 (1H, d, J 8,3 Гц), 2,20 (3 Н, s). Промежуточный продукт 9. 2-Хлор-4-йод-1-изотиоцианатобензол При перемешивании к раствору 2-хлор-4-йоданилина (1,0 г, 3,9 ммоля) в ДХМ (50 мл) прибавляли воду (20 мл), а затем тиофосген (476 мг, 4,1 ммоля). Реакционную смесь перемешивали в течение ночи,затем слои разделяли и органический слой сушили (Na2SO4) и выпаривали в вакууме и получали искомый продукт в виде коричневого твердого вещества (1,0 г, 86%). H (CDCl3) 7,79 (1 Н, d, J 1,9 Гц), 7,58(2R)-2-[(2-[(2-фтор-4 йодфенил)амино]тиено[2,3-b]пиридин-3-карбониламино)метил]пирролидин-1-карбоновой кислоты 1-(3-Диметиламинопропил)-3-карбодиимидгидрохлорид (139 мг, 0,72 ммоль) прибавляли к раствору промежуточного продукта 7 (150 мг, 0,36 ммоль), 1-гидроксибензотриазола (98 мг, 0,72 ммоль), Nметилморфолина (0,11 мл, 0,99 ммоль) и (R)-2-(аминометил)-1-ВОС-пирролидина (144 мг, 0,72 ммоль) вN,N-диметилформамиде (5 мл). Реакционную смесь перемешивали при КТ в течение 20 ч, затем выливали в EtOAc (25 мл). Раствор органических веществ промывали насыщенным рассолом (3 25 мл), сушили(Na2SO4), фильтровали и концентрировали в вакууме и получали коричневое твердое вещество. Неочищенный продукт обрабатывали с помощью колоночной хроматографии (SiO2, 4:1 гексаны/EtOAc) и получали искомое соединение, которое выпаривали из эфира и получали твердое вспененное вещество (135 мг, 63%). H (CDCl3) 11,67 (1 Н, s), 8,35-8,33 (2 Н, m), 8,04 (1 Н, br s), 7,54-7,43 (3 Н,m), 7,32-7,30 (1 Н, m), 4,19 (1H, m), 3,82-3,78 (1H, m), 3,53-3,35 (3 Н, m), 2,18-1,86 (3 Н, m), 1,78 (1 Н, m),1,45 (9 Н, s). Промежуточный продукт 11. Трет-бутиловый эфир(2S)-2-[(2-[(2-фтор-4 йодфенил)амино]тиено[2,3-b]пиридин-3-карбониламино)метил]пирролидин-1-карбоновой кислоты Получали из промежуточного продукта 7 (150 мг, 0,36 ммоль), 1-гидроксибензотриазола (98 мг,0,72 ммоль), N-метилморфолина(0,11 мл,0,99 ммоль), 1-(3-диметиламинопропил)-3 карбодиимидгидрохлорида (139 мг, 0,72 ммоль) и (S)-2-(аминометил)-1-ВОС-пирролидина (144 мг, 0,72 ммоля) по методике получения промежуточного продукта 10. Искомое соединение выпаривали из эфира и получали бесцветное твердое вспененное вещество (139 мг, 64%). Н (CDCl3) 11,67 (1H, s), 8,35-8,33(2 Н, m), 8,04 (1H, br s), 7,54-7,43 (3 Н, m), 7,32-7,30 (1H, m), 4,19 (1 Н, m), 3,82-3,78 (1H, m), 3,53-3,35 (3 Н,m), 2,18-1,86 (3 Н, m), 1,78 (1H, m), 1,45 (9 Н, s). Промежуточный продукт 12. (2-Хлорпиридин-3-ил)уксусная кислота 2-Хлор-3-(цианометил)пиридин (D. H. Bremner et al., Synthesis, 1997, 949) (10,3 г, 67,1 ммоля) в концентрированной HCl (100 мл) кипятили с обратным холодильником в течение 3 ч. Реакционную смесь концентрировали в вакууме и остаток суспендировали в воде. Белое твердое вещество собирали фильтрованием и промывали водой, затем сушили в вакууме и получали искомый продукт (11,15 г). Н (ДМСО-d6) 12,60 (1 Н, br s), 8,32 (1H, dd, J 4,7, 1,9 Гц), 7,86 (1H, dd, J 7,5, 1,9 Гц), 7,40 (1H, dd, J 7,5, 4,7 Гц), 3,75 (2 Н, s). ЖХМС (ЭР+) ВУ 1,85 мин, 174 (М+Н)+. Промежуточный продукт 13. Метиловый эфир (2-хлорпиридин-3-ил)уксусной кислоты К суспензии промежуточного продукта 12 (3,83 г, 22,6 ммоль) в метаноле прибавляли ацетилхлорид(1,8 мл, 24,9 ммоль) и смесь нагревали при 70 С в течение 18 ч. Растворители удаляли в вакууме и получали искомое соединение в виде бледно-коричневого масла (4,63 г, количественный выход).(2 Н, s), 3,65 (3 Н, s). ЖХМС (ЭР+) ВУ 2,40 мин, 186 (М+Н)+. Промежуточный продукт 14. Метиловый эфир 2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин 3-карбоновой кислоты К раствору промежуточного продукта 13 (4,1 г, 22,1 ммоль) и промежуточного продукта 1 (6,16 г,22,1 ммоль) в сухом ДМСО в атмосфере азота прибавляли гидрид натрия (1,05 г, 24,3 ммоль, 60 мас.% дисперсия в минеральном масле). Смесь перемешивали при комнатной температуре в течение 15 мин,затем нагревали при 90 С в течение 3 ч. Реакционную смесь охлаждали, затем выливали в воду со льдом(200 мл). Водную фазу экстрагировали с помощью EtOAc (3200 мл), объединенные органические экстракты промывали рассолом, сушили (MgSO4), фильтровали и растворители удаляли в вакууме. Липкое желтое твердое вещество растирали с этанолом и получали тонкоизмельченное желтое твердое вещество которое собирали фильтрованием, промывали диэтиловым эфиром и сушили с отсасыванием и получали искомое соединение в виде бледно-желтого твердого вещества (1,73 г).(1 Н, t, J 8,5 Гц), 7,42 (1H, dd, J 5,7, 8,1 Гц), 3,94 (3 Н, s). ЖХМС (ЭР+) ВУ 4,00 мин, 429 (М+Н)+. Промежуточный продукт 15. 2-(2-Хлорпиридин-3-ил)-N-метокси-N-метилацетамид Промежуточный продукт 12 (500 мг, 2,9 ммоля) в дихлорметане (20 мл) с N,Одиметилгидроксиламином (300 мг, 3,04 ммоль), EDC (583 мг, 3,04 ммоль) и N-метилморфолином (0,98 мл, 8,70 ммоль) перемешивали при КТ в течение 18 ч. Реакционную смесь промывали с помощью 2 МHCl и органическую фазу сушили (сульфат магния) и концентрировали в вакууме. Хроматография (SiO2; 1:1 этилацетат:ДХМ) давала искомое соединение (320 мг) в виде белого твердого вещества. Н (ДМСО-d6) 8,31 (1H, dd, J 4,7, 1,9 Гц), 7,81 (1 Н, dd, J 7,5, 1,9 Гц), 7,40 (1 Н, dd, J 7,5, 4,7 Гц), 3,93(2 Н, s), 3,76 (3 Н, s), 3,15 (3 Н, s). ЖХМС (ЭР+) ВУ 2,22 мин, 215/217 (М+Н)+. Промежуточный продукт 16. 2-(2-Хлор-1-оксипиридин-3-ил)-N-метокси-N-метилацетамид Промежуточный продукт 15 (270 мг, 1,25 ммоль) растворяли в ДХМ (5 мл) и обрабатывали с помощью МХПБК (324 мг, 1,88 ммоль). После перемешивания при КТ в течение 3 дней реакционную смесь выливали непосредственно во флэш-колонку и хроматографировали (SiO2; этилацетат 5% метанол в этилацетате), и получали искомый продукт (265 мг) в виде белого твердого вещества.- 12016128 Н (ДМСО-d6) 8,39 (1 Н, dd, J 5,4, 2,5 Гц), 7,37-7,35 (2 Н, m), 3,98 (2 Н, s), 3,76 (3 Н, s), 3,15 (3 Н, s). ЖХМС(ЭР+) ВУ 1,81 мин, 231/233 (М+Н)+. Пример 1. Этил-2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-карбоксилат Гидрид натрия (650 мг 60% дисперсии в минеральном масле, 16,2 ммоль) в течение 10 мин порциями прибавляли к смеси промежуточного продукта 1 (3,75 г, 13,5 ммоль) и этил-(2-хлорпиридин-3 ил)ацетата (D. H. Bremner et al., Synthesis, 1997, 949) (2,7 г, 13,5 ммоль) в ДМСО (25 мл). Когда замедлилось выделение газа, смесь нагревали при 70 С в течение 3 ч затем выдерживали при КТ в течение ночи. Прибавляли воду (150 мл) и жидкость сливали с полученного твердого вещества. Твердую массу обрабатывали этанолом (40 мл) и получали мелкозернистую белую суспензию которую фильтровали, промывали этанолом (10 мл) и эфиром (215 мл) и сушили в вакууме при 40 С и получали искомое соединение в виде белого твердого вещества (2,90 г, 48%).(1,5 мл 2 М раствора в ТГФ, 3,0 ммоль) в толуоле (5 мл). Через 5 мин прибавляли соединение примера 1(250 мг, 0,60 ммоль) и смесь нагревали при 100 С в течение 4 ч. После охлаждения реакцию останавливали насыщенным раствором хлорида аммония (75 мл) и HCl (10 мл, 2 М) затем экстрагировали с помощью EtOAc (80 мл). Органическую фазу сушили (Na2SO4) и концентрировали в вакууме и получали твердое вещество. Растирание с эфиром (30 мл) и фильтрование давало искомое соединение в виде почти белого твердого вещества (138 мг, 57%). Н (CDCl3) 11,13 (1 Н, br s), 8,25 (1H, dd, J 1,4, 4,7 Гц), 7,80 (1 Н, dd, J 1,4, 8,2 Гц), 7,46-7,42 (2 Н, m),7,33 (1H, dd, J 8,3, 8,3 Гц), 7,21 (1H, dd, J 4,7, 8,2 Гц), 5,82 (1H, br s), 3,00 (3 Н, d, J 4,8 Гц). ЖХМС (ЭР-) ВУ 3,63 мин, 426 (М-Н)-. Пример 3. 2-[(2-Фтор-4-йодфенил)амино]-N,N-диметилтиено[2,3-b]пиридин-3-карбоксамид Получали из соединения примера 1 (100 мг, 0,23 ммоль) и диметиламина (0,35 мл 2,0 М раствора в ТГФ, 0,7 ммоль) по методике примера 2. Искомое соединение получали в виде белого твердого вещества(ЭР+) ВУ 3,29 мин, 442 (М+Н)+. Пример 4. N-(2-Фтор-4-йодфенил)-3-(морфолин-4-илкарбонил)тиено[2,3-b]пиридин-2-амин Получали из соединения примера 1 (250 мг, 0,60 ммоль) и морфолина (0,26 мл, 3 ммоль) по методике примера 2. Искомое соединение получали в виде белого твердого вещества (215 мг, 78%). Н (ДМСО-d6) 9,22 (1 Н, br s), 8,34 (1H, dd, J 1,4, 4,6 Гц), 7,81 (1H, dd, J 1,4, 8,0 Гц), 7,68 (1H, dd, J 1,9, 10,5 Гц), 7,50-7,46 (1 Н, m), 7,35 (1H, dd, J 4,6, 8,0 Гц), 7,13 (1 Н, dd, J 8,6, 8,6 Гц), 3,54-3,48 (4 Н, m),3,43-3,39 (4 Н, m). ЖХМС (ЭР+) ВУ 3,17 мин, 484 (М+Н)+. Пример 5. N-(2-Фтор-4-йодфенил)-3-[(4-метилпиперазин-1-ил)карбонил]тиено[2,3-b]пиридин-2 амин Триметилалюминий (1,5 мл 2 М раствора в гексане, 3,0 ммоль) прибавляли к раствору 1 метилпиперазина (0,333 мл, 3,0 ммоль) в толуоле (5 мл). Через 10 мин прибавляли соединение примера 1(250 мг, 0,60 ммоль) и толуол (2 мл) и смесь нагревали при 90 С в течение 6 ч. После охлаждения смесь нейтрализовывали с помощью NaOH (50 мл, 1 М) и экстрагировали с помощью EtOAc (50 мл + 25 мл). Объединенные органические экстракты промывали насыщенным рассолом (50 мл), сушили (Na2SO4) и концентрировали в вакууме и получали желтое твердое вещество. Растирание со смесью гексан/эфир(10:1, 30 мл) и фильтрование давало искомое соединение в виде бледно-желтого твердого вещества (245 мг, 87%). Н (ДМСО-d6) 9,13 (1 Н, br s), 8,37 (1H, br d, J 4,4 Гц), 7,79 (1H, br d, J 7,8 Гц), 7,67 (1H, br d, J 10,4 Гц), 7,47 (1H, br d, J 8,4 Гц), 7,37 (1H, dd, J4,7, 8,1 Гц), 7,10 (1H, m), 3,30 (4H, br s), 2,21 (4H, br s), 2,14(3H, s). ЖХМС (ЭР+) ВУ 2,09 мин, 497 (M+H)+. Пример 6. 2-[(4-Бром-2-фторфенил)амино]-N-(2,3-дигидроксипропил)тиено[2,3-b]пиридин-3 карбоксамид Триметилалюминий (0,95 мл 2 М раствора в гексане, 1,90 ммоль) прибавляли к раствору 2,2 диметил-1,3-диоксолан-4-метанамина (249 мг, 1,9 ммоль) в толуоле (4 мл). Через 2 мин прибавляли промежуточный продукт 2 (150 мг, 0,38 ммоль) и смесь нагревали при 90 С в течение 4 ч. После охлаждения реакцию останавливали насыщенным раствором хлорида аммония (5 мл) и HCl (5 мл, 2 М), перемешивали, затем экстрагировали с помощью EtOAc (225 мл) и ДХМ (25 мл). Органическую фазу сушили(Na2SO4) и концентрировали в вакууме и получали твердое вещество. Растирание со смесью эфир/гексан(1:3, 10 мл) и фильтрование давало искомое соединение в виде белого твердого вещества (95 мг, 57%). Н (ДМСО-d6) 10,64 (1H, br s), 8,36 (1H, dd, J 1,4, 4,7 Гц), 8,20 (1H, dd, J 1,4, 8,2 Гц), 7,89 (1 Н, dd, J- 13016128 8,8, 8,8 Гц), 7,69 (1 Н, dd, J 2,1, 10,6 Гц), 7,58 (1H, dd, J 8,8, 8,8 Гц), 7,48-7,41 (2 Н, m), 4,86 (1 Н, d, J 5,0 Гц),4,64 (1H, t, J 5,7 Гц), 3,72-3,66 (1H, m), 3,52-3,36 (3 Н, m), 3,31-3,22 (1 Н, m). ЖХМС (ЭР+) ВУ 2,80 мин,440 (М(79Br)+Н)+. Пример 7. 2-[(2-Фтор-4-йодфенил)амино]-N-(2,3-дигидроксипропил)тиено[2,3-b]пиридин-3 карбоксамид Получали из соединения примера 1 (150 мг, 0,34 ммоль) и 2,2-диметил-1,3-диоксолан-4-метанамина(0,14 мл, 1,0 ммоль) по методике примера 6. Искомое соединение получали в виде белого твердого вещества (94 мг, 57%).(1H, m), 3,51-3,41 (3 Н, m), 3,40-3,34 (1 Н, m). ЖХМС (ЭР+) ВУ 2,91 мин, 488 (М+Н)+. Пример 8. Этил-2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-карбоксилат 7-оксид Получали из промежуточного продукта 1 (2,38 г, 8,58 ммоль) и этил-(2-хлор-1-оксидопиридин-3 ил)ацетата (D. H. Bremner et al., Synthesis, 1997, 949) (1,85 г, 8,58 ммоль) по методике примера 1. Искомое соединение получали в виде бледно-желтого твердого вещества (3,10 г, 79%).N-(2,3-Дигидроксипропил)-2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3 карбоксамид 7-оксид Получали из соединения примера 8 (200 мг, 0,43 ммоля) и 2,2-диметил-1,3-диоксолан-4-метанамина(0,18 мл, 1,3 ммоля) по методике примера 6. Искомое соединение получали в виде белого твердого вещества (32 мг, 15%).(2 Н, m), 4,78 (1H, d, J 4,9 Гц), 4,64 (1 Н, t, J 5,6 Гц), 3,70-3,60 (1 Н, m), 3,50-3,15 (4 Н, m). ЖХМС (ЭР-) ВУ 2,37 мин, 502 (М-Н)-. Пример 10. 2-[(2-Фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-карбонитрил К раствору (2-хлорпиридин-3-ил)ацетонитрила (D. H. Bremner et al., Synthesis, 1997, 949) (700 мг,4,59 ммоль) и промежуточного продукта 1 (1,28 г, 4,60 ммоль) в сухом ДМСО (15 мл) прибавляли гидрид натрия (202 мг, 60% в минеральном масле, 5,06 ммоль). Смесь перемешивали при комнатной температуре в течение 15 мин, затем нагревали при 90 С в течение 4 ч. Реакционную смесь выливали в воду (80 мл) и твердый осадок отфильтровывали и промывали смесью вода/этанол (2:1 смесь, 50 мл), а затем диэтиловый эфир/гексан (смесь 1:1, 20 мл). Твердое вещество сушили в вакуумном сушильном шкафу и перекристаллизовывали из смеси этанол/вода и получали искомое соединение в виде бледнокоричневого твердого вещества (800 мг, 45%). Н (ДМСО-d6) 10,40 (1 Н, s), 8,37 (1H, dd, J 1,3, 4,6 Гц), 7,83-7,81 (2 Н, m), 7,64 (1H, d, J 8,3 Гц), 7,44(1H, dd, J 4,7, 8,0 Гц), 7,33 (1 Н, dd, J 8,3, 8,3 Гц). ЖХМС ВУ 3,08 мин, (ЭР-) 394 (М-Н)-, (ЭР+) 396 (М+Н)+. Пример 11. Амид 2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-карбоновой кислоты Раствор соединения примера 1 (250 мг, 0,56 ммоль) в этаноле (5 мл) прибавляли к жидкому аммиаку (15 мл) и смесь нагревали в аппарате Парра при 95 С и давлении 800 фунт-сила/дюйм в течение 18 ч. Летучие вещества удаляли в вакууме и получали коричневый маслообразный остаток. Повторное растирание с этанолом и ДХМ давало искомое соединение в виде белого твердого вещества (18 мг). Н (ДМСО-d6) 11,20 (1 Н, bs), 8,34 (1H, d, J 3,4 Гц), 8,20 (1H, dd, J 8,2, 1,3 Гц), 7,76 (1 Н, dd, J 10,4, 1,8 Гц), 7,62 (1H, d, J 8,2 Гц), 7,57 (2 Н, br s), 7,49-7,39 (2 Н, m). ЖХМС (ЭР+) ВУ 3,11 мин, 412 (М+Н)+. Пример 12. [2-[(2-Фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-ил](пирролидин-1-ил)метанон Получали из соединения примера 1 (250 мг, 0,60 ммоль) и пирролидина (0,25 мл, 3 ммоль) по методике примера 2. Искомое соединение получали в виде бледно-желтого твердого вещества (136 мг, 51%).(3-Гидроксипропил)амид 2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3 карбоновой кислоты Соединение примера 1 (500 мг, 1,13 ммоль) растворяли в сухом толуоле (6 мл) в атмосфере азота. К этому раствору в течение 5 мин прибавляли триметилалюминий (2,83 мл 2 М раствора в гексане, 5,66 ммоль). Через 10 мин прибавляли раствор промежуточного продукта 3 (1,07 г, 5,66 ммоль) в сухом толуоле (5 мл) и реакционную смесь нагревали при 100 С в течение 6 ч. Реакционной смеси давали охладиться до комнатной температуры и обрабатывали с помощью 2 М HCl (10 мл) и воды (30 мл). Смесь экстрагировали этилацетатом (350 мл), затем органические фазы сушили над Na2SO4 и фильтровали и растворители удаляли в вакууме. Неочищенный остаток растворяли в метаноле (30 мл), обрабатывали с помощью 2 М HCl (20 мл) и перемешивали при температуре окружающей среды в течение 18 ч. Смесь концентрировали в вакууме, обрабатывали с помощью 2 М NaOH (20 мл) и экстрагировали этилацетатом(3 50 мл). Органические фазы сушили над Na2SO4, фильтровали, и летучие вещества удаляли в вакууме. Оставшееся твердое вещество растирали с диэтиловым эфиром (10 мл) и сушили в вакуумном сушильном шкафу и получали искомое соединение в виде бледно-желтого твердого вещества (100 мг, 19%).H (ДМСО-d6) 10,75 (1H, br s), 8,35 (1 Н, m), 8,17 (1H, d, J 7,9 Гц), 8,01 (1H, br s), 7,75 (1H, d, J 10,1 Гц), 7,59 (1H, d, J 8,1 Гц), 7,44-7,41 (2H, m), 4,55 (1H, t, J 5,1 Гц), 3,54-3,48 (2H, m), 3,41-3,34 (2H, m), 1,751,67 (2H, m). ЖХМС (ЭР+) ВУ 3,22 мин, 472 (M+H)+. Пример 14. (2(S),3-Дигидроксипропил)амид 2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3 карбоновой кислоты Получали из соединения примера 1 (1,0 г, 2,26 ммоль) и (S)-(2,2-диметил-1,3-диоксолан-4 ил)метиламина (1,48 г, 11,3 ммоль) по методике примера 6. Искомое соединение получали в виде белого твердого вещества (425 мг, 39%). Н (ДМСО-d6) 10,67 (1H, bs), 8,36 (1 Н, d, J 3,8 Гц), 8,20 (1H, d, J 8,5 Гц), 7,88 (1 Н, bs), 7,76 (1H, d, J 10,5 Гц), 7,61 (1 Н, d, J 8,5 Гц), 7,46-7,40 (2 Н, m), 4,86 (1 Н, d, J 5,0 Гц), 4,64 (1 Н, t, J 5,7 Гц), 3,72-3,67 (1 Н,m), 3,52-3,38 (3 Н, m), 3,30-3,22 (1 Н, m). ЖХМС (ЭР+) ВУ 2,91 мин, 488 (М+Н)+. Пример 15. (2(R),3-Дигидроксипропил)амид 2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3 карбоновой кислоты Получали из соединения примера 1 (500 мг, 1,13 ммоль) и (R)-(2,2-диметил-1,3-диоксолан-4 ил)метиламина (655 г, 4,52 ммоль) по методике примера 6. Искомое соединение получали в виде белого твердого вещества (100 мг, 18%).H (ДМСО-d6) 10,67 (1H, bs), 8,36 (1 Н, d, J 3,8 Гц), 8,20 (1H, d, J 8,5 Гц), 7,88 (1H, bs), 7,76 (1H, d, J 10,5 Гц), 7,61 (1H, d, J 8,5 Гц), 7,46-7,40 (2 Н, m), 4,86 (1H, d, J 5,0 Гц), 4,64 (1 Н, t, J 5,7 Гц), 3,72-3,67 (1H,m), 3,52-3,38 (3 Н, m), 3,30-3,22 (1H, m). ЖХМС (ЭР+) ВУ 2,91 мин, 488 (М+Н)+. Пример 16. Метиламид 2-[(4-бром-2-фторфенил)амино]тиено[2,3-b]пиридин-3-карбоновой кислоты Получали из промежуточного продукта 2 (150 мг, 0,38 ммоль) и 2 М раствора метиламина в ТГФ(0,95 мл, 1,9 ммоль) по методике примера 2. Искомое соединение получали в виде белого твердого вещества (125 мг, 87%). Н (ДМСО-d6) 10,83 (1H, bs), 8,35 (1H, dd, J 1,4, 4,6 Гц), 8,18 (1H, dd, J 1,4, 8,2 Гц),7,92 (1H, bs), 7,69 (1 Н, dd, J 2,1, 10,6 Гц), 7,59 (1H, dd, J 8,8, 8,8 Гц), 7,48-7,43 (1 Н, m), 7,42 (1H, dd, J 8,2,4,6 Гц), 2,83 (3H, d, 74,5 Гц). ЖХМС (ЭР+) ВУ 3,45 мин, 380/382 [Br79/Br81] (M+H)+. Пример 17. Этиловый эфир 2-[(4-йодфенил)амино]тиено[2,3-b]пиридин-3-карбоновой кислоты Получали из этил-(2-хлорпиридин-3-ил)ацетата (D. H. Bremner et al., Synthesis, 1997, 949) (750 мг,3,8 ммоля) и 4-йодфенилизотиоцианата (1,0 г, 3,8 ммоль) по методике примера 1. Искомое соединение получали в виде почти белого твердого вещества (800 мг, 50%). Н (ДМСО-d6) 10,34 (1 Н, br s), 8,33-8,30(ЭР+) ВУ 4,31 мин, 425 (М+Н)+. Пример 18. 2-[(4-Йод-2-метилфенил)амино]тиено[2,3-b]пиридин-3-карбонитрил При перемешивании к раствору промежуточного продукта 8 (429 мг, 3,28 ммоль) и (2 хлорпиридин-3-ил)ацетонитрила (D. H. Bremner et al., Synthesis, 1997, 949) (500 мг, 3,28 ммоль) в ДМСО(20 мл) прибавляли гидрид натрия (164 мг, 4,1 ммоль). После завершения выделения газов реакционную смесь нагревали в течение 3 ч при 80 С. После этого реакционную смесь выливали на лед и экстрагировали с помощью ДХМ (250 мл). Органические вещества сушили (Na2SO4) и затем выпаривали в вакууме и получали коричневый остаток. Колоночная хроматография (SiO2, 5:1 гексан:EtOAc) давала искомое соединение в виде желтого порошкообразного вещества (198 мг, 15%).H. Bremner et al., Synthesis, 1997, 949) (165 мг, 1,08 ммоль) перемешивали в ДМСО (20 мл) и порциями прибавляли гидрид натрия (52 мг, 1,3 ммоль). После завершения выделения газов реакционную смесь нагревали в течение 4 ч при 80 С. После этого реакционную смесь прибавляли ко льду (50 мл) и образовывался осадок. Его отфильтровывали и очищали с помощью препаративной ВЭЖХ (рН 10, 2-3 мин) и получали искомое соединение в виде белого порошкообразного вещества (30 мг, 9%).et al., Synthesis, 1997, 949) (165 мг, 1,01 ммоль) перемешивали вместе с ДМСО (20 мл) и порциями прибавляли гидрид натрия (48 мг, 1,21 ммоль). После завершения выделения газов реакционную смесь нагревали в течение 4 ч при 80 С. После этого реакционную смесь прибавляли ко льду (50 мл) и затем экстрагировали с помощью ДХМ (250 мл), затем сушили (Na2SO4) и выпаривали в вакууме и получали желтый остаток. Этот остаток обрабатывали с помощью колоночной хроматографии (SiO2, 1:4EtOAc:гексан) и получали искомое соединение в виде желтого порошкообразного вещества (118 мг,28%). Н (ДМСО-d6) 10,38 (1 Н, s), 8,35 (1 Н, dd, J 1,5, 4,8 Гц), 8,00 (1H, d, J 1,9 Гц), 7,80 (2 Н, m), 7,42 (1 Н,dd, J 8,0, 4,8 Гц), 7,35 (1H, d, J 8,3 Гц). ЖХМС (ЭР+) ВУ 3,70 мин, 412 (М+Н)+. Пример 21. (2-Амино-2-метилпропил)амид 2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3 карбоновой кислоты Триметилалюминий (2,85 мл 2 М раствора в гексане, 5,7 ммоль) прибавляли к раствору 1,2 диамино-2-метилпропана (498 мг, 5,7 ммоль) в толуоле (5 мл). Через 10 мин прибавляли соединение примера 1 (500 мг, 1,13 ммоля) и смесь нагревали при 100 С в течение 4 ч. После охлаждения реакцию останавливали 10% раствором гидроксида натрия (75 мл) и экстрагировали с помощью EtOAc (100 мл). Органическую фазу сушили (Na2SO4) и концентрировали в вакууме и получали твердое вещество. Растирание с гексанами (30 мл) и фильтрование давало искомое соединение в виде желтого твердого веществаH (ДМСО-d6) 10,72 (1H, m), 8,43 (1H, dd, J 1,7, 8,0 Гц), 7,84 (1 Н, dd, J 1,7, 4,7 Гц), 7,80-7,40 (2 Н, s),7,46-7,35 (2 Н, m), 7,21 (1H, m), 7,00 (1H, dd, J 4,7, 8,0 Гц), 3,40 (2H, d, J 5,7 Гц), 1,25 (6H, s). ЖХМС (ЭР+) ВУ 2,23 мин, 501 (М+Н)+. Пример 22. [(4R)-2,2-Диметил-[1,3]диоксолан-4-илметокси]амид 2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-карбоновой кислоты 1-(3-Диметиламинопропил)-3-карбодиимидгидрохлорид (131 мг, 0,68 ммоль) прибавляли к раствору промежуточного продукта 7 (142 мг, 0,34 ммоль), 1-гидроксибензотриазола (93 мг, 0,68 ммоля), Nметилморфолина (0,10 мл, 0,94 ммоль) и (4R)-2,2-диметил-[1,3]диоксолан-4-илметоксиламина (WO 02/006213) (101 мг, 0,68 ммоль) в N,N-диметилформамиде (5 мл). Реакционную смесь перемешивали при КТ в течение 20 ч, затем выливали в EtOAc (25 мл). Раствор органических веществ промывали насыщенным рассолом (225 мл), затем сушили (Na2SO4), фильтровали и концентрировали в вакууме и получали коричневое твердое вещество. Неочищенный продукт обрабатывали с помощью колоночной хроматографии (SiO2, 2:1 гексаны/EtOAc) и получали искомое соединение в виде бледно-желтого порошкообразного вещества (135 мг, 95%). Н (ДМСО-d6) 10,98 (1H, s), 8,74 (1 Н, s), 8,28-8,26 (1H, m), 7,94-7,91 (1H, m), 7,48-7,46 (2 Н, m), 7,377,32 (1 Н, m), 7,23 (1H, dd, J 4,8, 8,2 Гц), 4,46-4,40 (1H, m), 4,17 (1H, dd, J 3,8, 11,7 Гц), 4,11-4,01 (2 Н, m),3,79 (1H, dd, J 7,0, 8,3 Гц), 1,15 (3 Н, s), 1,10 (3 Н, s). ЖХМС ВУ 3,38 мин, (ЭР-) 542 (М-Н)-, (ЭР+) 544[(2R)-2,3-Дигидроксипропокси]амид 2-[(2-фтор-4-йодфенил)амино]тиено[2,3b]пиридин-3-карбоновой кислоты Раствор соединения примера 22 (125 мг, 0,23 ммоль) в метаноле (5 мл) и ТГФ (5 мл) обрабатывали с помощью 10% водного раствора HCl (5 мл). Реакционную смесь перемешивали в течение 3,5 ч при КТ,затем разбавляли с помощью EtOAc (25 мл). Раствор органических веществ промывали насыщенным рассолом (2 25 мл), затем сушили (Na2SO4), фильтровали и концентрировали в вакууме и получали искомое соединение в виде белого порошкообразного вещества, которое промывали с помощью EtOAc,затем гексанами и сушили с отсасыванием (76 мг, 66%).H (ДМСО-d6) 11,31 (1 Н, s), 10,33 (1H, s), 8,34-8,33 (1 Н, m), 8,12-8,09 (1 Н, m), 7,79-7,76 (1H, m),7,63-7,60 (1 Н, m), 7,45-7,40 (2H, m), 4,89-4,88 (1H, m), 4,62-4,59 (1H, m), 3,99-3,97 (1H, m), 3,85-3,80 (2H,m), 3,43 (2H, m). ЖХМС ВУ 3,38 мин, (ЭР-) 502 (M-H)-, (ЭР+) 504 (М+Н)+. Пример 24. Трет-бутиловый эфир (1-2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3 карбонилпиперидин-4-ил)-карбаминовой кислоты Получали из промежуточного продукта 7 (150 мг, 0,36 ммоль), 1-гидроксибензотриазола (98 мг,0,72 ммоль), N-метилморфолина(0,11 мл,0,99 ммоль), 1-(3-диметиламинопропил)-3 карбодиимидгидрохлорида (139 мг, 0,72 ммоль) и 4-(ВОС-амино)пиперидина (145 мг, 0,72 ммоля) по методике примера 22. Искомое соединение выпаривали из эфира и получали бесцветное твердое вспененное вещество (111 мг, 51%).(М+Н)+. Пример 25. (4-Аминопиперидин-1-ил)амиддигидрохлорид 2-[(2-фтор-4-йодфенил)амино]тиено[2,3b]пиридин-3-карбоновой кислоты Раствор соединения примера 24 (99 мг, 0,17 ммоль) в метаноле (2 мл) обрабатывали с помощью 4 МHCl в 1,4-диоксане (5 мл) и перемешивали при КТ в течение 3 ч. Реакционную смесь концентрировали в вакууме и получали желтую смолу, которую растворяли в воде (25 мл). Водный раствор промывали эфиром (2 25 мл) и затем выпаривали в вакууме. Полученную смолу растирали с эфиром и получали искомое соединение в виде желтого порошкообразного вещества (89 мг, 94%).(3 Н, br s), 7,82-7,75 (1 Н, m), 7,72-7,66 (1 Н, m), 7,55-7,47 (1H, m), 7,38 (1 Н, dd, J4,7, 8,1 Гц), 7,23-7,10 (1 Н,m), 4,02 (2 Н, br m), 3,25 (1 Н, br m), 3,06-2,98 (1 Н, m), 2,88-2,81 (1 Н, m), 1,93-1,89 (2 Н, m), 1,43 (2 Н, br m). ЖХМС ВУ 2,86 мин, (ЭР+) 497 (М+Н)+. Пример 26. (2-Гидрокси-1-метилэтил)амид 2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3 карбоновой кислоты Получали из промежуточного продукта 7 (150 мг, 0,36 ммоль), 1-гидроксибензотриазола (98 мг,0,72 ммоль), N-метилморфолина(0,11 мл,0,99 ммоль), 1-(3-диметиламинопропил)-3 карбодиимидгидрохлорида (139 мг, 0,72 ммоль) и 2-аминопропанола (0,06 мл, 0,72 ммоль) по методике примера 22. Неочищенный продукт обрабатывали с помощью колоночной хроматографии (SiO2, 1:1 гексаны/EtOAc) и получали искомое соединение, которое перекристаллизовывали из смеси EtOAc/гексаны и получали бежевое порошкообразное вещество (56 мг, 33%). Н (ДМСО-d6) 10,45 (1 Н, s), 8,37-8,36 (1H, ), 8,16-8,13 (1H, m), 7,76-7,71 (2 Н, m), 7,60-7,57 (1H, m),7,46-7,36 (2 Н, m), 4,78 (1 Н, t, J 5,6 Гц), 4,10-4,03 (1 Н, m), 3,52-3,35 (2 Н, m), 1,13 (3 Н, d, J 6,7 Гц). ЖХМС ВУ 3,46 мин, (ЭР+) 472 (М+Н)+. Пример 27. Трет-бутиловый эфир 3-[(2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3 карбониламино)метил]азетидин-1-карбоновой кислоты Получали из промежуточного продукта 7 (150 мг, 0,36 ммоль), 1-гидроксибензотриазола (98 мг,0,72 ммоль), N-метилморфолина(0,11 мл,0,99 ммоль), 1-(3-диметиламинопропил)-3 карбодиимидгидрохлорида (139 мг, 0,72 ммоль) и 1-ВОС-3-(аминометил)азетидина (135 мг, 0,72 ммоль) по методике примера 22. Неочищенный продукт обрабатывали с помощью колоночной хроматографии(SiO2, 3:2 гексаны/EtOAc) и получали искомое соединение, которое перекристаллизовывали из смеси эфир/гексаны и получали порошкообразное вещество кремового цвета (116 мг, 55%).H (CDCl3) 8,37 (1H, dd, J 1,3, 4,7 Гц), 7,84 (1H, dd, J 1,3, 8,2 Гц), 7,56-7,53 (2 Н, m), 7,46-7,41 (1 Н, m),7,32 (1 Н, dd, J 4,7, 8,2 Гц), 6,08 (1 Н, m), 4,14-4,09 (2 Н, m), 3,77-3,73 (4 Н, m), 2,94-2,92 (1H, m), 1,46 (9 Н, s). ЖХМС ВУ 3,68 мин, (ЭР-) 581 (М-Н)-, (ЭР+) 583 (М+Н)+. Пример 28. Трет-бутиловый эфир (1-2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3 карбонилазетидин-3-илметил)карбаминовой кислоты Получали из промежуточного продукта 7 (150 мг, 0,36 ммоль), 1-гидроксибензотриазола (98 мг,0,72 ммоль), N-метилморфолина(0,11 мл,0,99 ммоль), 1-(3-диметиламинопропил)-3 карбодиимидгидрохлорида (139 мг, 0,72 ммоль) и 3-(ВОС-аминометил)азетидина (135 мг, 0,72 ммоль) по методике примера 22. Искомое соединение выпаривали из эфира и получали бесцветное твердое вспененное вещество (75 мг, 36%).H (CDCl3) 8,25 (1 Н, dd, J 1,5, 4,7 Гц), 7,67 (1H, dd, J 1,5, 8,1 Гц), 7,46-7,41 (2 Н, m), 7,38-7,33 (1H, m),7,22 (1 Н, dd, J 4,7, 8,1 Гц), 4,59 (1H, br s), 4,15-4,09 (2 Н, m), 3,80-3,75 (2 Н, m), 3,32 (2 Н, m), 2,78-2,74 (1H,m), 1,35 (9 Н, s). ЖХМС ВУ 3,41 мин, (ЭР-) 581 (М-Н)-, (ЭР+) 583 (М+Н)+. Пример 29. Трет-бутиловый эфир 3-(2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3 карбониламино)азетидин-1-карболовой кислоты Получали из промежуточного продукта 7 (150 мг, 0,36 ммоль), 1-гидроксибензотриазола (98 мг,0,72 ммоль), N-метилморфолина(0,11 мл,0,99 ммоль), 1-(3-диметиламинопропил)-3 карбодиимидгидрохлорида (139 мг, 0,72 ммоль) и 1-ВОС-3-аминоазетидина (125 мг, 0,72 ммоля) по методике примера 22. Искомое соединение перекристаллизовывали из смеси эфир/гексаны и получали порошкообразное вещество кремового цвета (116 мг, 57%).H (CDCl3) 8,38 (1 Н, dd, J 1,2, 4,7 Гц), 7,90 (1H, dd, J 1,2, 8,1 Гц), 7,56-7,53 (2 Н, m), 7,45-7,40 (1H, m),7,35 (1H, dd, J 4,7, 8,1 Гц), 6,19 (1H, d, J 6,9 Гц), 4,89-4,84 (1 Н, m), 4,44-4,38 (2 Н, m), 3,93-3,88 (2 Н, m),1,48 (9 Н, s). ЖХМС ВУ 3,66 мин, (ЭР-) 567 (М-Н)-, (ЭР+) 569 (М+Н)+. Пример 30. [3-(Аминометил)азетидин-1-ил]-2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3 илметанон Раствор соединения примера 28 (65 мг, 0,11 ммоль) в ДХМ (7 мл) обрабатывали трифторуксусной кислотой (3 мл) и перемешивали в течение 1 ч при КТ. Реакционную смесь концентрировали в вакууме и получали желтую смолу, которую растворяли в воде (25 мл) и подщелачивали до рН 10 карбонатом натрия. Водный раствор экстрагировали 5% метанолом в ДХМ (425 мл) и экстракты объединяли, затем сушили (Na2SO4), фильтровали и концентрировали в вакууме. Неочищенный продукт обрабатывали с помощью колоночной хроматографии (SiO2, 4:1 ДХМ/метанол) и получали искомое соединение в виде смолообразного твердого вещества, которое растирали с эфиром и получали порошкообразное вещество кремового цвета (34 мг, 63%).- 17016128 Пример 31. [(2R)-Пирролидин-2-илметил]амид 2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин 3-карбоновой кислоты Раствор промежуточного продукта 10 (135 мг, 0,23 ммоль) в метаноле (2 мл) обрабатывали с помощью 4 М HCl в 1,4-диоксане (5 мл) и перемешивали при КТ в течение 30 мин. Реакционную смесь концентрировали в вакууме и получали желтую смолу, которую растворяли в воде (25 мл). Водный раствор промывали эфиром (225 мл), затем подщелачивали до рН 11 25% водным раствором гидроксида аммония. Водный раствор экстрагировали с помощью ДХМ (225 мл) и органические экстракты объединяли,сушили (Na2SO4), фильтровали и концентрировали в вакууме. Неочищенный продукт обрабатывали с помощью колоночной хроматографии (SiO2, 91:8:1 ДХМ/метанол/25% водный раствор гидроксида аммония) и получали искомое соединение, которое в течение ночи сушили вымораживанием из смеси ацетонитрил/вода, и получали порошкообразное вещество кремового цвета (73 мг, 65%). Н (ДМСО-d6) 10,63 (1H, s), 9,12 (1H, br s), 8,37 (1 Н, dd, J 1,7, 8,0 Гц), 7,84 (1H, dd, J 1,7, 4,7 Гц), 7,47(М+Н)+. Пример 32. [(2S)-Пирролидин-2-илметил]амид 2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин 3-карбоновой кислоты Получали из промежуточного продукта 11 (139 мг, 0,23 ммоль) по методике примера 31. Искомое соединение получали в виде кремового порошкообразного вещества (81 мг, 70%). Н (ДМСО-d6) 10,63 (1 Н, s), 9,12 (1 Н, br s), 8,37 (1H, dd, J 1,7, 8,0 Гц), 7,84 (1 Н, dd, J 1,7, 4,7 Гц), 7,47(М+Н)+. Пример 33. Трет-бутиловый эфир (3S)-3-(2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3 карбониламино)пиперидин-1-карбоновой кислоты Получали из промежуточного продукта 7 (150 мг, 0,36 ммоль), 1-гидроксибензотриазола (98 мг,0,72 ммоль), N-метилморфолина(0,11 мл,0,99 ммоль), 1-(3-диметиламинопропил)-3 карбодиимидгидрохлорида (139 мг, 0,72 ммоль) и (S)-1-ВОС-3-аминопиперидина (145 мг, 0,72 ммоль) по методике примера 22. Искомое соединение получали в виде желтого смолообразного твердого вещества(3R)-3-(2-[(2-Фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-карбониламино)пиперидин-1-карбоновой кислоты трет-бутиловый эфир Получали из промежуточного продукта 7 (150 мг, 0,36 ммоль), 1-гидроксибензотриазола (98 мг,0,72 ммоль), N-метилморфолина(0,11 мл,0,99 ммоль), 1-(3-диметиламинопропил)-3 карбодиимидгидрохлорида (139 мг, 0,72 ммоль) и (R)-1-ВОС-3-аминопиперидина (145 мг, 0,72 ммолья) по методике примера 22. Искомое соединение получали в виде бледно-розового смолообразного твердого вещества (136 мг, 63%).(2 Н, m), 1,67 (2 Н, m), 1,47 (9 Н, s). ЖХМС ВУ 4,03 мин, (ЭР+) 597 (М+Н)+. Присмер 35. [(3S)-Пиперидин-3-ил]амиддигидрохлорид 2-[(2-фтор-4-йодфенил)амино]тиено[2,3b]пиридин-3-карбоновой кислоты Раствор соединения примера 33 (120 мг, 0,20 ммоль) в метаноле (2 мл) обрабатывали с помощью 4 М HCl в 1,4-диоксане (5 мл) и перемешивали при КТ в течение 3 ч. Реакционную смесь выпаривали в вакууме и получали искомое соединение в виде желтого смолообразного твердого вещества, которое растирали с эфиром и получали желтое порошкообразное вещество (112 мг, 98%). Н (ДМСО-d6) 10,38 (1H, s), 9,04-8,92 (2 Н, m), 8,38 (1 Н, dd, J 1,3, 4,6 Гц), 8,17-8,14 (2 Н, m), 7,75 (1H,dd, J 1,8, 10,4 Гц), 7,61-7,58 (1H, m), 7,44 (1 Н, dd, J 4,6, 8,2 Гц), 7,42-7,36 (1H, m), 4,09 (1H, m), 3,34-3,31(1H, m), 3,21-3,17 (1H, m), 2,94-2,79 (2 Н, m), 1,91 (2 Н, m), 1,74-1,61 (2 Н, m). ЖХМС ВУ 2,38 мин, (ЭР+) 497 (М+Н)+. Пример 36. [(3R)-Пиперидин-3-ил]амиддигидрохлорид 2-[(2-фтор-4-йодфенил)амино]тиено[2,3b]пиридин-3-карбоновой кислоты Получали из соединения примера 34 (126 мг, 0,21 ммоль) по методике примера 35. Искомое соединение получали в виде желтого порошкообразного вещества (115 мг, 96%). Н (ДМСО-d6) 10,38 (1 Н, s), 9,04-8,92 (2 Н, m), 8,38 (1H, dd, J 1,3, 4,6 Гц), 8,17-8,14 (2 Н, m), 7,75 (1H,dd, J 1,8, 10,4 Гц), 7,61-7,58 (1H, m), 7,44 (1 Н, dd, J 4,6, 8,2 Гц), 7,42-7,36 (1H, m), 4,09 (1H, m), 3,34-3,31- 18016128 Пример 37. Трет-бутиловый эфир (1-2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3 карбонил-(3R)-пирролидин-3-ил)карбаминовой кислоты Получали из промежуточного продукта 7 (150 мг, 0,36 ммоль), 1-гидроксибензотриазола (98 мг,0,72 ммоль), N-метилморфолина(0,11 мл,0,99 ммоль), 1-(3-диметиламинопропил)-3 карбодиимидгидрохлорида (139 мг, 0,72 ммоля) и (R)-3-(ВОС-амино)пирролидина (186 мг, 0,72 ммоль) по методике примера 22. Неочищенный продукт обрабатывали с помощью колоночной хроматографии(SiO2, 3:2 гексаны/EtOAc) и получали искомое соединение, которое выпаривали из эфира и получали бесцветное твердое вспененное вещество (110 мг, 52%). Н (CDCl3) 9,03 (1 Н, s), 8,28 (1 Н, dd, J 1,5, 4,7 Гц), 7,56 (1 Н, dd, J 1,5, 8,1 Гц), 7,43-7,39 (2 Н, m), 7,34-7,29(1H, dd, J 5,1, 11,8 Гц), 2,19-2,12 (1 Н, m), 1,86-1,77 (1 Н, m), 1,35 (9 Н, s). ЖХМС ВУ 3,33 мин, (ЭР-) 581 (МН)-, (ЭР+) 583 (М+Н)+. Пример 38. Трет-бутиловый эфир (1-2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3 карбонил-(3S)пирролидин-3-ил)карбаминовой кислоты Получали из промежуточного продукта 7 (150 мг, 0,36 ммоль), 1-гидроксибензотриазола (98 мг,0,72 ммоль), N-метилморфолина(0,11 мл,0,99 ммоль), 1-(3-диметиламинопропил)-3 карбодиимидгидрохлорида (139 мг, 0,72 ммоля) и (S)-3-(ВОС-амино)пирролидина (186 мг, 0,72 ммоля) по методике примера 37. Искомое соединение получали в виде бесцветного твердого вспененного вещества (125 мг, 59%). Н (CDCl3) 9,03 (1 Н, s), 8,28 (1 Н, dd, J 1,5, 4,7 Гц), 7,56 (1 Н, dd, J 1,5, 8,1 Гц), 7,43-7,39 (2 Н, m), 7,34-7,29(1 Н, dd, J 5,1, 11,8 Гц), 2,19-2,12 (1H, m), 1,86-1,77 (1H, m), 1,35 (9 Н, s). ЖХМС ВУ 3,33 мин, (ЭР-) 581 (М-Н)-,(ЭР+) 583 (М+Н)+. Пример 39. Трет-бутиловый эфир (1-2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3 карбонилазетидин-3-ил)-карбаминовой кислоты Получали из промежуточного продукта 7 (150 мг, 0,36 ммоль), 1-гидроксибензотриазола (98 мг,0,72 ммоль), N-метилморфолина(0,11 мл,0,99 ммоль), 1-(3-диметиламинопропил)-3 карбодиимидгидрохлорида (139 мг, 0,72 ммоль) и 3-(ВОС-амино)азетидина (125 мг, 0,72 ммоль) по методике примера 22. Неочищенный продукт обрабатывали с помощью колоночной хроматографии (SiO2,3:1 гексаны/EtOAc) и получали искомое соединение, которое выпаривали из эфира и получали порошкообразное вещество кремового цвета (100 мг, 49%). Н (CDCl3) 10,11 (1H, s), 8,35 (1 Н, dd, J 1,5, 4,7 Гц), 7,76 (1H, dd, J 1,5, 8,1 Гц), 7,55-7,51 (2 Н, m),7,47-7,41 (1 Н, m), 7,31 (1H, dd, J 4,7, 8,1 Гц), 4,95 (1 Н, br s), 4,52 (1 Н, br s), 4,46-4,40 (2H, m), 4,01-3,96(2H, m), 1,45 (9H, s). ЖХМС ВУ 3,47 мин, (ЭР-) 567 (M-H)-, (ЭР+) 569 (М+Н)+. Пример 40. Трет-бутиловый эфир 4-(2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3 карбониламино)пиперидин-1-карбоновой кислоты Получали из промежуточного продукта 7 (150 мг, 0,36 ммоль), 1-гидроксибензотриазола (98 мг,0,72 ммоль), N-метилморфолина(0,11 мл,0,99 ммоль), 1-(3-диметиламинопропил)-3 карбодиимидгидрохлорида (139 мг, 0,72 ммоль) и 4-амино-1-ВОС-пиперидина (145 мг, 0,72 ммоль) по методике примера 22. Неочищенный продукт адсорбировали на SiO2 и обрабатывали с помощью колоночной хроматографии (SiO2, 2:1 гексаны/EtOAc) и получали искомое соединение, которое выпаривали из эфира и получали чешуйки кремового цвета (97 мг, 45%).H (CDCl3) 11,18 (1H, s), 8,36 (1H, dd, J 1,4, 4,7 Гц), 7,81 (1H, dd, J 1,4, 8,2 Гц), 7,55-7,53 (2 Н, m),7,46-7,41 (1H, m), 7,32 (1H, dd, J 4,7, 8,2 Гц), 5,74 (1H, d, J 7,6 Гц), 4,27-4,20 (1 Н, m), 4,15-4,11 (2 Н, m),3,03-2,96 (2 Н, m), 2,15-2,10 (2 Н, m), 1,50 (9 Н, s), 1,45 (2 Н, m). ЖХМС ВУ 3,95 мин, (ЭР-) 567 (М-Н)-,(ЭР+) 569 (М+Н)+. Пример 41. [(3R)-3-Аминопирролидин-1-ил]-2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3 илметанон Получали из соединения примера 37 (100 мг, 0,17 ммоль) по методике примера 35. Искомое соединение получали в виде желтого порошкообразного вещества (100 мг, количественный выход).(2 Н, m), 3,51-3,38 (2 Н, m), 2,20-2,13 (1 Н, m), 2,01-1,97 (1H, m). ЖХМС ВУ 2,24 мин, (ЭР-) 481 (М-Н)-,(ЭР+) 483 (М+Н)+. Пример 42. [(3S)-3-Аминопирролидин-1-ил]-2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3 илметанон Получали из соединения примера 38 (115 мг, 0,20 ммоль) по методике примера 35. Искомое соединение получали в виде желтого порошкообразного вещества (109 мг, 99%). Н (ДМСО-d6) 9,29 (1H, s), 8,36 (1H, dd, J 1,5, 4,7 Гц), 8,29 (3 Н, s), 7,91-7,89 (1H, m), 7,72 (1H, dd, J 1,8, 10,4 Гц), 7,55-7,52 (1H, m), 7,37 (1H, dd, J 4,7, 8,1 Гц), 7,24-7,19 (1H, m), 3,79-3,72 (1 Н, m), 3,70-3,58(Пиперидин-4-ил)амид 2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3 карбоновой кислоты Получали из соединения примера 40 (87 мг, 0,15 ммоль) по методике примера 35. Искомое соединение получали в виде желтого порошкообразного вещества (80 мг, 96%). Н (ДМСО-d6) 10,31 (1H, s), 8,84 (1 Н, m), 8,68 (1H, m), 8,38 (1H, dd, J 1,3, 4,6 Гц), 8,24 (1 Н, d, J 7,5 Гц), 8,09 (1H, dd, J 1,3, 8,2 Гц), 7,74 (1 Н,dd J 1,8, 10,5 Гц), 7,59-7,57 (1H, m), 7,44 (1 Н, dd, J 4,7, 8,2 Гц),7,39-7,34 (1 Н, m), 4,05-3,97 (1H, m), 3,32-3,27 (2 Н, m), 3,03-2,87 (2 Н, m), 2,00-1,97 (2 Н, m), 1,82-1,71 (2 Н,m). ЖХМС ВУ 2,40 мин, (ЭР-) 495 (М-Н)-, (ЭР+) 497 (М+Н)+. Пример 44.(3-Аминоазетидин-1-ил)-2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3 ил]метанон Получали из соединения примера 39 (90 мг, 0,16 ммоля) по методике примера 30. Реакционную смесь концентрировали в вакууме и получали желтую смолу, которую растворяли в метаноле (5 мл) и воде (5 мл) и подщелачивали до рН 10 25% водным раствором гидроксида аммония. Водный раствор концентрировали в вакууме над SiO2, и неочищенный продукт обрабатывали с помощью колоночной хроматографии (SiO2, 95:4:1 ДХМ/ метанол/25% водный раствор гидроксида аммония). Искомое соединение в течение ночи сушили вымораживанием из смеси ацетонитрил/метанол/вода и получали порошкообразное вещество кремового цвета (31 мг, 42%).(1H, ddd, J 0,9, 0,9, 8,4 Гц), 7,38 (1 Н, dd, J 4,7, 8,1 Гц), 7,31-7,26 (1 Н, m), 4,23-4,11 (2 Н, m), 3,72-3,59 (3 Н,m). ЖХМС ВУ 3,00 мин, (ЭР-) 467 (М-Н)-, (ЭР+) 469 (М+Н)+. Пример 45. Бис(2-гидроксиэтил)амид 2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3 карбоновой кислоты Получали из промежуточного продукта 7 (150 мг, 0,36 ммоль), 1-гидроксибензотриазола (98 мг,0,72 ммоль), N-метилморфолина(0,11 мл,0,99 ммоль), 1-(3-диметиламинопропил)-3 карбодиимидгидрохлорида (139 мг, 0,72 ммоль) и диэтаноламина (76 мг, 0,72 ммоль) по методике примера 22. Неочищенный продукт обрабатывали с помощью колоночной хроматографии (SiO2, EtOAc,дважды) и получали искомое соединение, которое в течение ночи сушили вымораживанием из смеси ацетонитрил/вода и получали порошкообразное вещество кремового цвета (62 мг, 34%).H (ДМСО-d6) 8,79 (1 Н, br s), 8,38 (1 Н, dd, J 1,5, 4,7 Гц), 7,77 (1 Н, dd, J1,5, 8,1 Гц), 7,67 (1H, dd, J 1,9,10,5 Гц), 7,69-7,46 (1H, m), 7,38 (1H, dd, J 4,7, 8,1 Гц), 7,18-7,12 (1H,m), 4,83 (2 Н, br s), 3,30 (8 Н, s). ЖХМС ВУ 3,01 мин, (ЭР+) 502 (М+Н)+. Пример 46. 2-[(2-Фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-ил-(3-гидроксиазетидин-1-ил)метанон Получали из промежуточного продукта 7 (225 мг, 0,54 ммоль), 1-гидроксибензотриазола (147 мг,1,08 ммоль), N-метилморфолина(0,16 мл,1,48 ммоль), 1-(3-диметиламинопропил)-3 карбодиимидгидрохлорида (208 мг, 1,08 ммоль) и 3-гидроксиазетидингидрохлорида (120 мг, 1,08 ммоль) по методике примера 22. После хроматографии, искомое соединение перекристаллизовывали из смеси метанол/эфир и получали белое порошкообразное вещество (125 мг, 49%). Н (ДМСО-d6) 9,60 (1 Н, s), 8,35-8,34 (1 Н, m), 7,94 (1 Н, dd, J 1,4, 8,1 Гц), 7,75-7,71 (1H, m), 7,57-7,54(1 Н, m), 7,41-7,37 (1H, m), 7,31-7,25 (1 Н, m), 5,68 (1H, d, J6,0 Гц), 4,47-4,44 (1 Н, m), 4,21-4,16 (2 Н, m),3,79-3,74 (2 Н, m). ЖХМС ВУ 3,31 мин, (ЭР+) 470 (М+Н)+. Пример 47. 2-[(2-Фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-ил-[(3R)-3-гидроксипирролидин-1-ил]метанон Получали из промежуточного продукта 7 (150 мг, 0,36 ммоль), 1-гидроксибензотриазола (98 мг,0,72 ммоль), N-метилморфолина(0,11 мл,0,99 ммоль), 1-(3-диметиламинопропил)-3 карбодиимидгидрохлорида (139 мг, 0,72 ммоль) и (R)-3-гидроксипирролидина (63 мг, 0,72 ммоль) по методике примера 22. После хроматографии, искомое соединение в течение ночи сушили вымораживанием из смеси ацетонитрил/вода и получали порошкообразное вещество кремового цвета (116 мг, 66%). Н (ДМСО-d6) 9,20 (1 Н, s), 8,35 (1 Н, dd, J 1,5, 4,7 Гц), 7,81 (1H, dd, J 1,5, 8,1 Гц), 7,67 (1 Н, dd, J 1,9,10,5 Гц), 7,50-7,47 (1 Н, m), 7,36 (1H, dd, J4,7, 8,1 Гц), 7,17-7,11 (1 Н, m), 4,91 (1H, s), 4,22 (1 Н, s), 3,54-3,30(3 Н, m), 3,21-3,17 (1 Н, m), 1,90-1,74 (2 Н, m). ЖХМС ВУ 3,18 мин, (ЭР+) 484 (М+Н)+. Пример 48. 2-[(2-Фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-ил-[(3S)-3-гидроксипирролидин-1-ил]метанон Получали из промежуточного продукта 7 (150 мг, 0,36 ммоль), 1-гидроксибензотриазола (98 мг,0,72 ммоль), N-метилморфолина(0,11 мл,0,99 ммоль), 1-(3-диметиламинопропил)-3 карбодиимидгидрохлорида (139 мг, 0,72 ммоль) и (S)-3-гидроксипирролидина (63 мг, 0,72 ммоль) по методике примера 47. Искомое соединение получали в виде кремового порошкообразного вещества (105 мг, 60%). Н (ДМСО-d6) 9,20 (1H, s), 8,35 (1H, dd, J 1,5, 4,7 Гц), 7,81 (1H, dd, J 1,5, 8,1 Гц), 7,67 (1H, dd, J 1,9,10,5 Гц), 7,50-7,47 (1 Н, m), 7,36 (1H, dd, J 4,7, 8,1 Гц), 7,17-7,11 (1H, m), 4,91 (1H, s), 4,22 (1H, s), 3,54-3,30(3 Н, m), 3,21-3,17 (1H, m), 1,90-1,74 (2 Н, m). ЖХМС ВУ 3,17 мин, (ЭР+) 484 (М+Н)+. Пример 49. 2-[(2-Фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-ил-[2-(гидроксиметил)пиперидин-1-ил]метанон Получали из промежуточного продукта 7 (150 мг, 0,36 ммоль), 1-гидроксибензотриазола (98 мг,0,72 ммоль), N-метилморфолина(0,11 мл,0,99 ммоль), 1-(3-диметиламинопропил)-3 карбодиимидгидрохлорида (139 мг, 0,72 ммоль) и 2-пиперидинметанола (83 мг, 0,72 ммоль) по методике примера 22. После хроматографии, искомое соединение перекристаллизовывали из смеси EtOAc/гексаны и получали бледно-желтое порошкообразное вещество (44 мг, 24%). Н (ДМСО-d6, 130 С) 8,38 (1H, dd, J 1,5, 4,7 Гц), 7,83 (1H, dd, J 1,5, 8,0 Гц), 7,59 (1H, dd, J 1,9, 10,5 Гц), 7,47 (1H, d, J8,5 Гц), 7,35 (1H, dd, J 4,7, 8,0 Гц), 7,16 (1 Н, dd, J 8,8, 8,8 Гц), 4,30 (1H, br s), 4,21 (1H,m), 3,89 (1H, m), 3,65-3,60 (1H, m), 3,51-3,47 (1H, m), 3,03-2,97 (1H, m), 1,74-1,72 (1H, m), 1,65-1,56 (4H,m), 1,37 (1H, m). ЖХМС ВУ 2,86 мин, (ЭР-) 510 (M-H)-, (ЭР+) 512 (М+Н)+. Пример 50. 2-[(2-Фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-ил-[(3S)-3-(гидроксиметил)морфолин-4-ил]метанон Получали из промежуточного продукта 7 (150 мг, 0,36 ммоль), 1-гидроксибензотриазола (98 мг,0,72 ммоль), N-метилморфолина(0,11 мл,0,99 ммоль), 1-(3-диметиламинопропил)-3 карбодиимидгидрохлорида (139 мг, 0,72 ммоль) и (3S)-3-(гидроксиметил)морфолина (85 мг, 0,72 ммоль) по методике примера 22. После хроматографии, искомое соединение в течение ночи сушили вымораживанием из смеси ацетонитрил/вода и получали порошкообразное вещество кремового цвета (81 мг, 44%).(1H, m), 3,70-3,67 (1H, m), 3,65-3,56 (2 Н, m), 3,48-3,45 (1H, m), 3,34 (1H, m), 3,27-3,21 (1H, m). ЖХМС ВУ 2,60 мин, (ЭР-) 512 (М-Н)-, (ЭР+) 514 (М+Н)+. Пример 51. Трет-бутиловый эфир 4-2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3 карбонил-(3R)-3-(гидроксиметил)пиперазин-1-карбоновой кислоты Получали из промежуточного продукта 7 (150 мг, 0,36 ммоль), 1-гидроксибензотриазола (98 мг,0,72 ммоль), N-метилморфолина(0,11 мл,0,99 ммоль), 1-(3-диметиламинопропил)-3 карбодиимидгидрохлорида (139 мг, 0,72 ммоль) и (2R)-4-ВОС-2-(гидроксиметил)пиперазина (157 мг,0,72 ммоль) по методике примера 22. Неочищенный продукт обрабатывали с помощью колоночной хроматографии (SiO2, 1:1 гексаны/EtOAc) и получали искомое соединение, которое выпаривали из эфира и получали бледно-розовое твердое вспененное вещество (95 мг, 43%). Н (ДМСО-d6, 120 С) 8,53 (1 Н, br s), 8,38-8,37 (1 Н, m), 7,86-7,84 (1H, m), 7,60 (1H, dd, J 1,7, 10,5 Гц),7,49 (1H, d, J 8,5 Гц), 7,36 (1H, dd, J 4,7, 8,0 Гц), 7,19-7,15 (1H, dd, J 8,5, 8,7 Гц), 4,52 (1H, br s), 4,16 (1 Н,m), 3,95 (1H, d, J 13,5 Гц), 3,88-3,81 (2H, m), 3,49-3,43 (2H, m), 3,14-3,10 (1H, m), 3,02-2,95 (1H, m), 1,43(9H, s). ЖХМС ВУ 2,98 мин, (ЭР+) 613 (M+H)+. Пример 52. 2-[(2-Фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-7-оксид Соединение примера 8 (250 мг, 0,55 ммоль) суспендировали в смеси этанола (20 мл) и воды (10 мл). Прибавляли гидрат гидроксида лития (24,0 мг, 0,57 ммоль) и смесь кипятили с обратным холодильником в течение 24 ч. После концентрирования и сушки вымораживанием смесь очищали с помощью хроматографии (диоксид кремния, дихлорметан, затем 2% МеОН в дихлорметане). Искомое соединение получали в виде почти белого твердого вещества (50 мг, 24%). Н (ДМСО-d6) 9,42 (1H, br s), 8,13 (1H, dd, J 0,7, 6,2 Гц), 7,69 (1 Н, dd, J 1,9, 10,7 Гц), 7,54-7,51 (2 Н,m), 7,39-7,32 (2 Н, m), 6,73 (1H, s). ЖХМС (ЭР+) ВУ 2,84 мин, 387 (М+H)+. Пример 53. 2-[(2-Фтор-4-йодфенил)амино]-N-[2-(морфолин-4-ил)этил]тиено[2,3-b]пиридин-3 карбоксамид Получали из соединения примера 1 (250 мг, 0,56 ммоль) и 4-(2-аминоэтил)морфолина (292 мг, 2,24 ммоля) по методике примера 5. После хроматографии (5% метанола, 95% дихлорметана) искомое соединение получали в виде почти белого твердого вещества (140 мг, 47%).H (CDCl3) 11,43 (1 Н, br s), 8,36 (1H, dd, J 1,4, 4,7 Гц), 8,03 (1H, dd, J 1,4, 8,2 Гц), 7,55-7,51 (2H, m),7,44 (1 Н, dd, J 8,2, 8,2 Гц), 7,32 (1H, dd, J 4,7, 8,2 Гц), 6,84 (1H, br s), 3,80-3,77 (4H, m), 3,67-3,62 (2H, m),2,73-2,69 (2H, m), 2,62-2,59 (4H, m). ЖХМС (ЭР+) ВУ 2,37 мин, 527 (М+Н)+. Пример 54. 2-[4-(2-[(2-Фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-илкарбонил)пиперазин-1 ил]этанол Получали из соединения примера 1 (250 мг, 0,56 ммоль) и N-(2-гидроксиэтил)пиперазина (292 мг,2,24 ммоля) по методике примера 5. После хроматографии (5% метанола, 95% дихлорметана) искомое соединение получали в виде белого твердого вещества (86 мг, 29%).H (ДМСО-d6) 9,13 (1 Н, br s), 8,36 (1 Н, dd, J 1,5, 4,7 Гц), 7,80 (1 Н, dd, J 1,5, 8,1 Гц), 7,68 (1 Н, dd, J 1,9, 10,5 Гц), 7,49-7,45 (1 Н, m), 7,37 (1H, dd, J4,7, 8,1 Гц), 7,10 (1H, dd, J 8,7, 8,7 Гц), 4,37 (1H, t, J 5,4 Гц),3,50-3,40 (6H, m), 2,37-2,33 (6H, m). ЖХМС (ЭР+) ВУ 2,16 мин, 527 (M+H)+. Пример 55. 3-(1,4-Диазепан-1-илкарбонил)-N-(2-фтор-4-йодфенил)тиено [2,3-b]пиридин-2-амин Получали из соединения примера 1 (250 мг, 0,56 ммоль) и гомопиперазина (224 мг, 2,24 ммоль) по- 21016128 методике примера 5. После хроматографии (10-15% метанола в дихлорметане) искомое соединение получали в виде бледно-желтого твердого вещества (180 мг, 64%). Н (CDCl3) 8,99 (1 Н, br s), 8,34 (1 Н, dd, J 1,6, 4,7 Гц), 7,74 (1 Н, dd, J ,6, 8,1 Гц), 7,47-7,43 (2 Н, m), 7,35(1 Н, dd, J 8,5, 8,5 Гц), 7,28-7,22 (1 Н, m), 4,30-4,10 (1 Н, br m), 3,95-3,80 (1 Н, br m), 3,39-2,86 (6 Н, br m),2,17-1,77 (3 Н, br m). ЖХМС (ЭР+) ВУ 2,17 мин, 497 (М+Н)+. Пример 56. N-[3-(Диметиламино)-2,2-диметилпропил]-2-[(2-фтор-4-йодфенил)амино]тиено[2,3b]пиридин-3-карбоксамид Получали из соединения примера 1 (250 мг, 0,56 ммоля) и N,N,2,2-тетраметил-1,3-пропандиамина(292 мг, 2,24 ммоля) по методике примера 5. После хроматографии (5% метанола, 95% дихлорметана) искомое соединение получали в виде бледно-желтого твердого вещества (60 мг, 20%). H (ДМСО-d6) 10,81 (1H, br s), 9,10 (1H, br s), 8,24-8,21 (2H, m), 7,69-7,65 (1H, m), 7,55-7,52 (1H, m), 7,37-7,31 (2H, m),3,29-3,27 (2H, m), 2,50-2,37 (8H, br m), 0,96 (6H, s). ЖХМС (ЭР+) ВУ 2,39 мин, 527 (М+Н)+. Пример 57. 2-[(2-Фтор-4-йодфенил)амино]-N-[3-(морфолин-4-ил)пропил]тиено[2,3-b]пиридин-3 карбоксамид Получали из соединения примера 1 (250 мг, 0,56 ммоля) и 4-(3-аминопропил)морфолина (323 мг,2,24 ммоля) по методике примера 5. После хроматографии (5% метанола, 95% дихлорметана) искомое соединение получали в виде бледно-желтого твердого вещества (115 мг, 38%).H (CDCl3) 11,29 (1H, br s), 8,36 (1 Н, dd, J 1,4, 4,7 Гц), 7,99 (1H, dd, J 1,4, 8,2 Гц), 7,63-7,51 (2H, m),7,47-7,41 (1H, m), 7,33-7,29 (1H, m), 7,12 (1H, br s), 3,70-3,64 (2H, m), 3,60-3,56 (4H, m), 2,58-2,54 (2H, m),2,49-2,46 (4H, m), 1,90-1,82 (2H, m). ЖХМС (ЭР+) ВУ 2,34 мин, 541 (М+Н)+. Пример 58. N-(2-Фтор-4-йодфенил)-3-(пиперазин-1-илкарбонил)тиено[2,3-b]пиридин-2-амин Пиперазин (3,90 г, 45,2 ммоля) растворяли в сухом толуоле (100 мл) в атмосфере азота. Смесь помещали на водяную баню при 20 С и медленно прибавляли триметилалюминий (2,0 М в толуоле, 22,6 мл,45,2 ммоля). Через 10 мин прибавляли соединение примера 1 (4,00 г, 0,56 ммоля). Смесь нагревали при 100 С в атмосфере азота в течение 6 ч. После охлаждения до комнатной температуры смесь выливали во взвесь диоксида кремния (100 г) в хлороформе (400 мл) и метаноле (200 мл). После перемешивания в течение 10 мин смесь выдерживали в течение ночи. Фильтрование и удаление органического растворителя в вакууме давало неочищенное вещество, которое очищали путем растирания с диэтиловым эфиром(50 мл), фильтрования и промывки диэтиловым эфиром (20 мл). Искомое соединение выделяли в виде желтого твердого вещества (3,56 г, 82%), которое можно было использовать в последующих реакциях. Дигидрохлорид искомого соединения получали растворением свободного основания (1,60 г, 3,32 ммоля) в дихлорметане (30 мл) и метаноле (5 мл). Прибавляли HCl в эфире (2,0 М, 3,34 мл, 6,70 ммоля) и смесь концентрировали в вакууме. Растирание с диэтиловым эфиром (40 мл) и фильтрование давало дигидрохлорид искомого соединения (1,80 г, 98%).[4-(2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-илкарбонил)пиперазин-1-ил]ацетат Соединение примера 58 (300 мг, 0,62 ммоля) растворяли в дихлорметане (10 мл) и прибавляли триэтиламин (94 мкл, 0,65 ммоля) и этилхлорацетат (56 мкл, 0,65 ммоля). Смесь кипятили с обратным холодильником в течение 12 ч. После охлаждения и распределения между дихлорметаном и водой (по 25 мл каждого) органический слой сушили (Na2SO4) и концентрировали в вакууме. Очистка с помощью хроматографии (диоксид кремния, 3% метанола, 97% дихлорметана) давала продукт в виде масла, которое растворяли в диэтиловом эфире (5 мл) и концентрировали в высоком вакууме и получали искомое соединение в виде белого твердого вещества (240 мг, 68%).(4 Н, m), 1,29 (3 Н, t, J 7,1 Гц). ЖХМС (ЭР+) ВУ 3,26 мин, 569 (М+Н)+. Пример 60. [4-(2-[(2-Фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-илкарбонил)пиперазин-1 ил]уксусная кислота Соединение примера 59 (213 мг, 0,375 ммоля) растворяли в этаноле (7 мл) и воде (7 мл). Прибавляли гидроксид натрия (15,0 мг, 0,375 ммоля) и смесь перемешивали при комнатной температуре в течение 18 ч. Сушка вымораживанием давала искомое соединение в виде его натриевой соли (200 мг, 99%). Н (ДМСО-d6) 9,29 (1 Н, br s), 8,22-8,17 (1H, br m), 7,68 (1H, br d, J 8,0 Гц), 7,56 (1H, br d, J 10,4 Гц),7,40 (1H, br d, J 8,6 Гц), 7,28-7,20 (1H, br m), 7,07 (1H, dd, J 8,6, 8,6 Гц), 3,42-3,38 (4H, m), 2,65 (2H, s),2,37-2,35 (4H, m). ЖХМС (ЭР+) ВУ 2,64 мин, 541 (M+H)+. Пример 61. Трет-бутил-(3R)-3-[(2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-илкарбонил)амино]пирролидин-1-карбоксилат Получали из соединения примера 1 (250 мг, 0,56 ммоль) и (R)-3-амино-1-трет- 22016128 бутоксикарбонилпирролидина (417 мг, 2,24 ммоль) по методике примера 5. После хроматографии (25% этилацетата, 75% дихлорметана) искомое соединение получали в виде почти белого твердого веществаH (ДМСО-d6) 10,27 (1 Н, br s), 8,35 (1 Н, dd, J 1,4, 4,7 Гц), 8,23 (1H, br d, J 6,5 Гц), 8,06 (1H, dd, J 1,4,8,2 Гц), 7,74 (1H, dd, J 1,9, 10,5 Гц), 7,57 (1H, d, J 8,5 Гц), 7,43 (1H, dd, J 4,7, 8,2 Гц), 7,36 (1H, dd, J 8,6, 8,6 Гц), 4,46-4,40 (1H, br m), 3,57-3,54 (1 Н, m), 3,52-3,30 (3H, m), 2,15-2,05 (1H, br m), 1,95-1,85 (1H, br m),1,41 (9H, s). ЖХМС (ЭР+) ВУ 3,70 мин, 583 (M+H)+. Пример 62. Трет-бутил-(3S)-3-[(2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-илкарбонил)амино]пирролидин-1-карбоксилат Получали из соединения примера 1 (250 мг, 0,56 ммоль) и (S)-3-амино-1-третбутоксикарбонилпирролидина (417 мг, 2,24 ммоль) по методике примера 5. После хроматографии (25% этилацетата, 75% дихлорметана) искомое соединение получали в виде почти белого твердого веществаH (ДМСО-d6) 10,27 (1 Н, br s), 8,35 (1H, dd, J 1,4, 4,7 Гц), 8,23 (1H, br d, J 6,5 Гц), 8,06 (1H, dd, J 1,4,8,2 Гц), 7,74 (1H, dd, J 1,9, 10,5 Гц), 7,57 (1H, d, J 8,5 Гц), 7,43 (1H, dd, J 4,7, 8,2 Гц), 7,36 (1H, dd, J 8,6, 8,6 Гц), 4,46-4,40 (1H, br m), 3,57-3,54 (1H, m) 3,52-3,30 (3H, m), 2,15-2,05 (1H, br m), 1,94-1,85 (1H, br m),1,44 (9H, s). ЖХМС (ЭР+) ВУ 3,70 мин, 583 (M+H)+. Пример 63. 2-[(2-Фтор-4-йодфенил)амино]-N-[(3R)-пирролидин-3-ил]тиено[2,3-b]пиридин-3 карбоксамид Соединение примера 61 (40 мг, 0,069 ммоль) растворяли в дихлорметане (3 мл) и прибавляли HCl в диоксане (4,0 М, 1,0 мл, 4,0 ммоль). Смесь перемешивали при комнатной температуре в течение 18 ч. Полученное твердое вещество отфильтровывали и сушили в вакууме при 40 С и получали дигидрохлорид искомого соединения (28 мг, 73%). Н (ДМСО-d6) 10,44 (1 Н, br s), 9,25 (2 Н, br m), 8,37-8,31 (2 Н, m), 8,21 (1H, dd, J 1,3, 8,2 Гц), 7,76 (1H,dd, J 1,8, 10,4 Гц), 7,61 (1H, d, J 8,5 Гц), 7,45-7,39 (2H, m), 4,61-4,57 (1H, m), 3,45-3,23 (4H, m), 2,27-2,15(1H, m), 2,09-1,98 (1H, m). ЖХМС (ЭР+) ВУ 2,30 мин, 483 (М+Н)+. Пример 64. 2-[(2-Фтор-4-йодфенил)амино]-N-[(3S)-пирролидин-3-ил]тиено[2,3-b]пиридин-3 карбоксамид Соединение примера 62 (170 мг, 0,069 ммоль) растворяли в дихлорметане (4 мл) и прибавляли HCl в диоксане (4,0 М, 4,0 мл, 16,0 ммоль). Смесь перемешивали при комнатной температуре в течение 18 ч. Полученное твердое вещество отфильтровывали и сушили в вакууме при 40 С и получали дигидрохлорид искомого соединения (150 мг, 92%).(1H, m), 2,09-1,98 (1H, m). ЖХМС (ЭР+) ВУ 2,30 мин, 483 (M+H)+. Пример 65. 2-[(2-Фтор-4-йодфенил)амино]-N-(1-метилпиперидин-4-ил)тиено[2,3-b]пиридин-3 карбоксамид Получали из соединения примера 1 (250 мг, 0,56 ммоль) и 4-амино-1-метилпиперидина (255 мг, 2,24 ммоль) по методике примера 5. После хроматографии (10% метанола, 90% дихлорметана) неочищенное вещество растворяли в дихлорметане (2 мл) и прибавляли 2,0 М HCl в диэтиловом эфире (2 мл). Полученное твердое вещество отфильтровывали и получали дигидрохлорид искомого соединения в виде желтого твердого вещества (145 мг, 44%).(2H, m), 4,05 (1H, br m), 3,45-3,05 (5H, m), 2,70 (3H, d, J 6,0 Гц), 2,03-1,85 (4H, m). ЖХМС (ЭР+) ВУ 2,34 мин, 511 (M+H)+. Пример 66. 2-[(2-Фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-ил-[(2R)-2-(метоксиметил)пирролидин-1-ил]метанон Из промежуточного продукта 14 (285 мг, 0,66 ммоль), 2 М триметилалюминий в гексане (1,6 мл,3,30 ммоль) и (R)-2-(метоксиметил)пирролидина (383 мг, 3,30 ммоль) по методике примера 5 получали искомое соединение (17 мг). Н (ДМСО-d6) 9,17 (1 Н, br s), 8,37 (1 Н, dd, J 4,6, 1,3 Гц), 7,78 (1H, d, J 7,7 Гц), 7,76 (1H, dd, J 10,6, 1,8 Гц), 7,46 (1H, d, J 8,5 Гц), 7,37 (1H, d, J 8,0, 4,6 Гц), 7,05 (1H, t, J 8,5 Гц), 4,10-4,00 (1H, br m), 3,33-3,01(7H, br m), 1,90-1,64 (4H, br m). ЖХМС (ЭР+) ВУ 3,27 мин, 215 (М+Н)+. Пример 67. (Циклопропилметил)амид 2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3 карбоновой кислоты Из промежуточного продукта 14 (450 мг, 1,05 ммоля), 2 М триметилалюминия в гексане (2,6 мл,5,26 ммоля) и (аминометил)циклопропана (374 мг, 5,26 ммоля) по методике примера 5 получали искомое соединение (250 мг). Н (ДМСО-d6) 10,68 (1 Н, br s), 8,36 (1H, d, J 3,8 Гц), 8,17 (1H, d, J 8,1 Гц), 8,15-8,00 (1 Н, br m), 7,75(1 Н, d, J 10,4 Гц), 7,60 (1H, d, J 7,6 Гц), 7,47-7,38 (2H, br m), 3,18 (2H, t, J 6,2 Гц), 1,10-1,03 (1H, br m),- 23016128 0,47-0,41 (2H, br m), 0,28-0,23 (2H, br m). ЖХМС (ЭР+) ВУ 3,54 мин, 468 (M+H)+. Пример 68. (N-Метокси-N-метил)амид 2-[(2-фтор-4-йодфенил)амино]-7-окситиено[2,3-b]пиридин 3-карбоновой кислоты К раствору промежуточного продукта 16 (260 мг, 1,12 ммоль) в ДМСО прибавляли гидрид натрия(50 мг, 1,23 ммоль) и реакционную смесь перемешивали в течение 10 мин. Прибавляли промежуточный продукт 1 (328 мг, 1,18 ммоль) и реакционную смесь перемешивали в течение еще 1 ч при температуре окружающей среды. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Органическую фазу промывали рассолом, сушили (сульфат магния) и концентрировали в вакууме. Неочищенный продукт очищали с помощью хроматографии (SiO2; 10% метанол в этилацетате) и получали искомый продукт в виде бледно-желтого твердого вещества (64 мг).H (ДМСО-d6) 9,41 (1H, s), 8,20 (1 Н, dd, J 5,9, 1,0 Гц), 7,74 (1H, dd, J 10,3, 1,9 Гц), 7,57-7,54 (1H, m),7,48-7,38 (2 Н, m), 7,22 (1H, t, J 8,6 Гц), 3,47 (3 Н, s), 3,17 (3 Н, s). ЖХМС (ЭР+) ВУ 2,70 мин, 474 (М+Н)+. Пример 69. (N-Метокси-N-метил)амид 2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3 карбоновой кислоты Соединение примера 68 (64 мг, 0,13 ммоль) и трифенилфосфин (177 мг, 0,68 ммоль) в ТГФ (1 мл) нагревали при 65 С в течение ночи. Прибавляли трихлорид фосфора (34 мг, 0,39 ммоль) и реакционную смесь перемешивали при температуре окружающей среды в течение 90 мин. Реакцию останавливали раствором гидрокарбоната натрия и продукт экстрагировали с помощью ДХМ, сушили (сульфат магния) и концентрировали в вакууме. После обработки с помощью препаративной ВЭЖХ, искомый продукт (10 мг) получали в виде почти белого твердого вещества.H (ДМСО-d6) 9,23 (1 Н, s), 8,35 (1H, dd, J 4,7, 1,6 Гц), 7,84 (1 Н, dd, J 8,1, 1,6 Гц), 7,70 (1H, dd, J 10,3,1,9 Гц), 7,53 (1 Н, d, J 8,4 Гц), 7,37 (1 Н, dd, J 8,1, 4,7 Гц), 7,22 (1H, t, J 8,6 Гц), 3,47 (3 Н, s), 3,20 (3 Н, s). ЖХМС (ЭР+) ВУ 3,23 мин, 458 (М+Н)+. Пример 70. 2-[(2-Фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-ил-[(2R)-2-(гидроксиметил)пиперазин-1-ил]метанон Раствор соединения примера 51 (80 мг, 0,13 ммоль) в метаноле (2 мл) обрабатывали с помощью 4 МHCl в 1,4-диоксане (5 мл) и перемешивали при КТ в течение 3 ч. Реакционную смесь концентрировали в вакууме и получали желтую смолу, которую растворяли в метаноле (20 мл) и воде (5 мл), затем подщелачивали до рН 11 25% водным раствором гидроксида аммония. Водный раствор экстрагировали с помощью ДХМ (325 мл) и органические экстракты объединяли, сушили (Na2SO4), фильтровали и концентрировали в вакууме. Неочищенный продукт обрабатывали с помощью колоночной хроматографии(SiO2, 95:4:1 ДХМ/метанол/25% водный раствор гидроксида аммония) и получали искомое соединение в виде смеси 2 поворотных изомеров, которую в течение ночи сушили вымораживанием из смеси ацетонитрил/вода и получали порошкообразное вещество кремового цвета (63 мг, 94%).(М+Н)+. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) или его фармацевтически приемлемая соль, сольват или N-оксидR2 обозначает галоген или С 1-С 6 алкил;Rb и Rc вместе с атомом азота, к которому они оба присоединены, обозначают азетидин-1-ил, пирролидин-1-ил, пиперидин-1-ил, морфолин-4-ил, тиоморфолин-4-ил, пиперазин-1-ил, гомопиперидин-1 ил, гомоморфолин-4-ил или гомопиперазин-1-ил, любая из этих групп необязательно может содержать один или большее количество заместителей, выбранных из группы, включающей С 1-С 6 алкил, C1 С 6 алкоксигруппу, гидроксигруппу, гидрокси(C1-C6)алкил, амино(C1-C6)алкил, аминогидрокси(C1C6)алкил, галоген, оксогруппу, C2-С 6 алкилкарбонил, карбоксигруппу, C2-С 6 алкоксикарбонил, ди(C1C6)алкилгидразинилкарбонил, аминогруппу, (C1-C6)алкиламиногруппу, ди(C1-C6)алкиламиногруппу, (C2- 24016128 аминокарбониламиногруппу,аминокарбонил,C1C6)алкилкарбониламиногруппу,С 6 алкиламинокарбонил, ди(C1-C6)алкиламинокарбонил, аминосульфонил, (C1-C6)алкилсульфонил, C1 С 6 алкиламинокарбонил(C1-C6)алкил,С 1-С 6 алкокси(C1-C6)алкил,карбокси(C1-C6)алкил,С 2 С 6 алкоксикарбонил(C1-C6)алкил,(C2-C6)алкоксикарбониламиногруппу иC2 С 6 алкоксикарбониламино(C1-C6)алкил. 2. Соединение по п.1, в котором циклический фрагмент -NRbRc обозначает азетидин-1-ил, пирролидин-1-ил, пиперидин-1-ил, морфолин-4-ил, пиперазин-1-ил или гомопиперазин-1-ил, любая из этих групп необязательно может содержать один или большее количество заместителей, как определено в п.1. 3. Соединение по п.1 или 2, в котором циклический фрагмент -NRbRc является незамещенным или замещен одним или большим количеством заместителей, как определено в п.1. 4. Соединение по любому из предыдущих пунктов, в котором заместители на циклическом фрагменте -NRbRc выбраны из группы, включающей C1-С 6 алкил, C1-С 6 алкокси(С 1-C6)алкил, гидроксигруппу,гидрокси(C1-C6)алкил, аминогруппу, амино(C1-C6)алкил, карбоксиметил, C2-С 6 алкоксикарбонил, C2 С 6 алкоксикарбонил(С 1-C6)алкил, ди(C1-C6)алкиламиногруппу, C2-С 6 алкоксикарбониламиногруппу и C2 С 6 алкоксикарбониламино(С 1-C6)алкил. 5. Соединение по п.4, в котором заместители на циклическом фрагменте -NRbRc выбраны из группы, включающей метил, метоксиметил, гидроксигруппу, гидроксиметил, 2-гидроксиэтил, аминогруппу,аминометил, карбоксиметил, трет-бутоксикарбонил, этоксикарбонилметил, диметиламиногруппу, третбутоксикарбониламиногруппу и трет-бутоксикарбониламинометил. 6. Соединение по п.1, в котором циклический фрагмент -NRbRc представляет собой 3 гидроксиазетидин-1-ил,3-аминоазетидин-1-ил,3-(аминометил)азетидин-1-ил,3-(третбутоксикарбониламино)азетидин-1-ил, 3-(трет-бутоксикарбониламинометил)азетидин-1-ил, пирролидин 1-ил, 2-(метоксиметил)пирролидин-1-ил, 3-гидроксипирролидин-1-ил, 3-аминопирролидин-1-ил, 3-(третбутоксикарбониламино)пирролидин-1-ил, 2-(гидроксиметил)пиперидин-1-ил, 4-аминопиперидин-1-ил, 4(трет-бутоксикарбониламино)пиперидин-1-ил, морфолин-4-ил, 2-(гидроксиметил)морфолин-4-ил, пиперазин-1-ил, 4-метилпиперазин-1-ил, 2-(гидроксиметил)пиперазин-1-ил, 4-(2-гидроксиэтил)пиперазин-1 ил, 4-(карбоксиметил)пиперазин-1-ил, 4-(трет-бутоксикарбонил)-2-(гидроксиметил)пиперазин-1-ил, 4(этоксикарбонилметил)пиперазин-1-ил или гомопиперазин-1-ил. 7. Соединение по п.1, представленное формулой (II), и его фармацевтически приемлемые соли,сольваты и N-оксидыR3 является таким, как определено в п.1. 8. Соединение по п.7, в котором R12 обозначает бром или йод. 9. Соединение по п.8, в котором R12 обозначает йод. 10. Соединение по п.1, выбранное из следующих соединений:[4-(2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-илкарбонил)пиперазин-1 ил]ацетат,[4-(2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-илкарбонил)пиперазин-1-ил]уксусная кислота,2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-ил-[(2R)-2-(метоксиметил)пирролидин-1 ил]метанон,2-[(2-фтор-4-йодфенил)амино]тиено[2,3-b]пиридин-3-ил-[(2R)-2-(гидроксиметил)пиперазин-1 ил]метанон. 11. Фармацевтическая композиция, включающая соединение формулы (I) по п.1 или его фармацевтически приемлемую соль, сольват или N-оксид совместно с фармацевтически приемлемым носителем. 12. Применение соединения формулы (I) по п.1 или его фармацевтически приемлемой соли, сольвата или N-оксида для приготовления лекарственного средства, предназначенного для лечения и/или предупреждения патологических состояний, для которых показано введение селективного ингибитора МЕК. 13. Применение по п.12 соединения формулы (I), определенного в п.1, или его фармацевтически приемлемой соли, сольвата или N-оксида для приготовления лекарственного средства, предназначенного для лечения и/или предупреждения воспалительных, аутоимунных, сердечно-сосудистых, пролиферативных и ноцицептивных состояний. 14. Применение по п.12 соединения формулы (I), определенного в п.1, или его фармацевтически приемлемой соли, сольвата или N-оксида для приготовления лекарственного средства, предназначенного для лечения и/или предупреждения онкологических состояний.
МПК / Метки
МПК: A61K 31/4365, C07D 495/04
Метки: тиенопиридина, мек, ингибиторы, производные
Код ссылки
<a href="https://eas.patents.su/27-16128-proizvodnye-tienopiridina-kak-ingibitory-mek.html" rel="bookmark" title="База патентов Евразийского Союза">Производные тиенопиридина как ингибиторы мек</a>
Предыдущий патент: Применение производных триазина для производства лекарственного средства, обладающего заживляющим или ангиогенным эффектом
Следующий патент: Замещенные бифенилкарбоновые кислоты и их производные
Случайный патент: Способ сжигания топлива (варианты) и установка для его осуществления (варианты)































