Производные мутилина и их применение в качестве фармацевтических препаратов
Номер патента: 19579
Опубликовано: 30.04.2014
Авторы: Ашер Герд, Новак Родгер, Паукнер Зузанне, Тирринг Клаус, Хайльмайер Вернер
Формула / Реферат
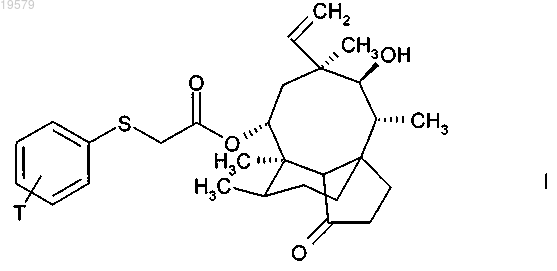
1. Соединение формулы (I)
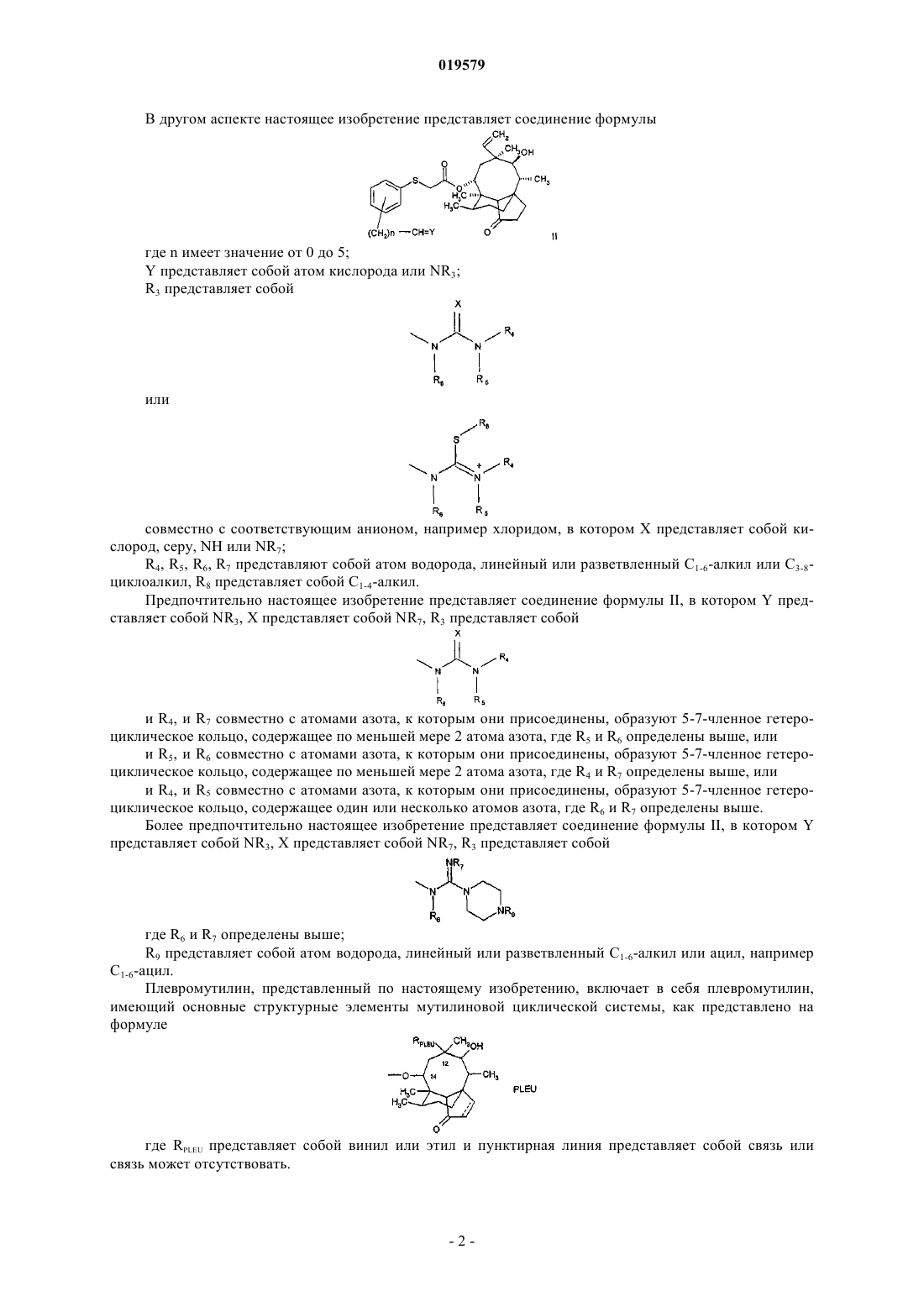
где Т представляет собой (C1-6)моно- или диалкиламинометил, (C1-6)ациламинометил, (C1-6)ацилоксиметил, бензоилоксиметил или гуанидиноиминометил либо
Т представляет собой (СН2)n-XR1,
где n равно 1;
X представляет собой кислород или NR2, где R2 представляет собой атом водорода или линейный или разветвленный (С1-6)алкил либо гидрокси(C1-6)алкил или (C1-6)алкокси(C1-6)алкил;
R1 представляет собой атом водорода, линейный или разветвленный (C1-6)алкил, моно- или дигалогенированный (C1-6)алкил, амино(C1-6)алкил, гидрокси(C1-6)алкил, фенил(C1-6)алкил, (C1-6)алкенил, фуранил(C1-6)алкил, (С3-6)циклоалкил или
XR1 представляет собой пиперазинил или морфолинил.
2. Соединение по п.1, где Т представляет собой (C1-6)моно- или диалкиламино(C1-6)алкил либо гуанидиноимино(C1-6)алкил.
3. Соединение по любому из пп.1 и 2, где Т представляет собой (СН2)n-XR1, в котором упомянутая (СН2)n-группа находится в мета-положении по отношению к атому серы, присоединенному к фенильному кольцу.
4. Соединение по п.3, которое представляет собой 14-O-[(3-гидроксиметилфенилсульфанил)ацетил]мутилин формулы
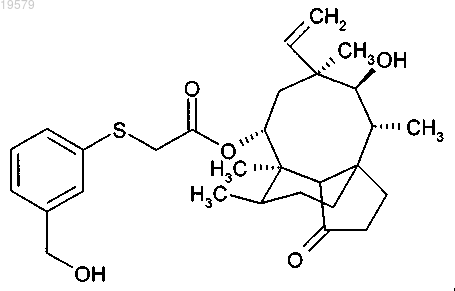
5. Соединение формулы
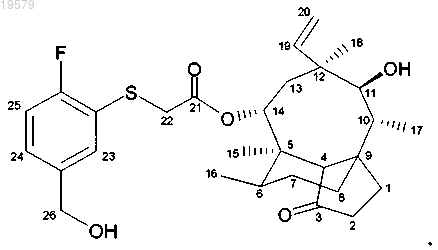
6. Соединение формулы
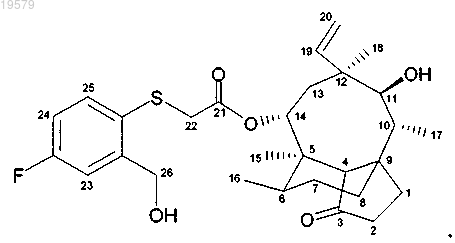
7. Соединение формулы
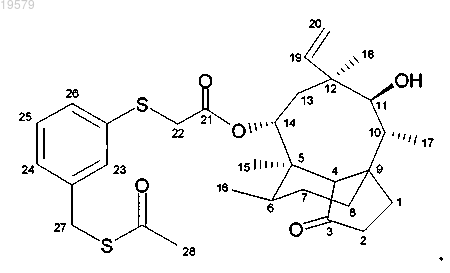
8. Соединение формулы
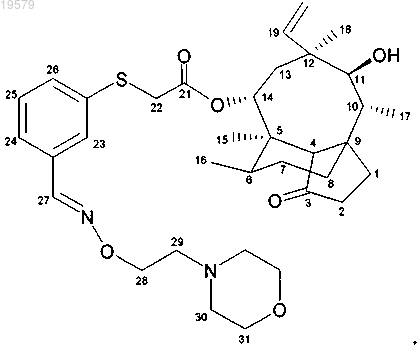
9. Соединение формулы
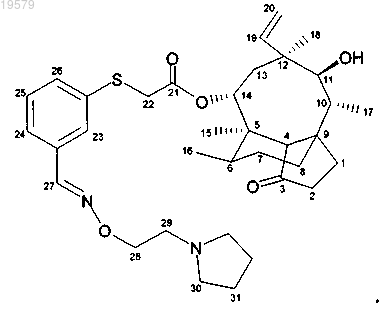
10. Соединение формулы
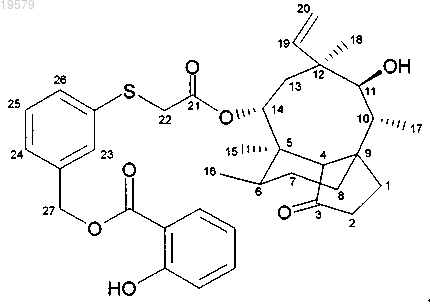
11. Соединение формулы
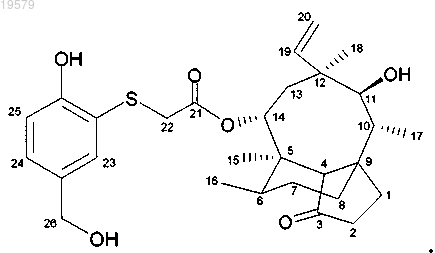
12. Соединение по любому из пп.1-3, выбранное из следующих соединений:
14-O-[(3-гидроксиметилфенилсульфанил)ацетил]мутилин,
14-O-[(5-гидроксиметил-2-фторфенилсульфанил)ацетил]мутилин,
14-O-[(2-гидроксиметил-4-фторфенилсульфанил)ацетил]мутилин,
14-O-[(4-гидроксиметилфенилсульфанил)ацетил]мутилин,
14-O-[(2-гидроксиметилфенилсульфанил)ацетил]мутилин,
14-O-[(2-гидрокси-5-гидроксиметилфенилсульфанил)ацетил]мутилин,
14-O-{[3-(аминоиминометил)гидразонометилфенилсульфанил]ацетил}мутилин, необязательно в форме гидрохлорида,
14-O-[{3-[((1-пиперазиноиминометил)метилгидразоно)метил]фенилсульфанил}ацетил]мутилин, необязательно в форме гидрохлорида,
14-O-[{3-[(3-этил-(2-этилимино)имидазолидин-1-илимино)метил]фенилсульфанил}ацетил]мутилин, необязательно в форме гидрохлорида,
14-O-[{3-[(1-пиперазиноиминометил)гидразонометил]фенилсульфанил}ацетил]мутилин, необязательно в форме гидрохлорида,
14-O-[{3-[(2-морфолин-4-илэтоксиимино)метил]фенилсульфанил}ацетил]мутилин, необязательно в форме гидрохлорида,
14-O-[3-{[(2-пирролидин-1-илэтоксиимино)метил]фенилсульфанил}ацетил]мутилин, необязательно в форме гидрохлорида,
14-O-[{4-[(1-пиперазиноиминометил)гидразонометил}фенилсульфанил}ацетил]мутилин, необязательно в форме гидрохлорида,
14-O-[{2-[(аминоиминометил)гидразонометил]фенилсульфанил}ацетил]мутилин, необязательно в форме гидрохлорида,
14-O-[{4-[(аминоиминометил)гидразонометил]фенилсульфанил}ацетил]мутилин, необязательно в форме гидрохлорида,
14-O-[{4-[(1-пиперазиноиминометил)гидразонометил]фенилсульфанил}ацетил]мутилин, необязательно в форме гидрохлорида,
14-O-[{4-[(1-пиперазиноиминометил)метилгидразонометил]фенилсульфанил}ацетил]мутилин в форме гидрохлорида,
14-O-[{3-[(1-ацетилпиперазиноиминометил)гидразонометил]фенилсульфанил}ацетил]мутилин, необязательно в форме гидрохлорида,
14-O-[(3-ацетоксиметилфенилсульфанил)ацетил]мутилин,
14-O-{[3-(2-гидроксифенилкарбонил)гидроксиметилфенилсульфанил]ацетил}мутилин,
14-O-[(3-меркаптометилфенилсульфанил)ацетил}мутилин,
14-O-[(3-ацетилтиометилфенилсульфанил)ацетил]мутилин,
14-O-[(3-аминометилфенилсульфанил)ацетил]мутилин, необязательно в форме гидрохлорида,
14-O-[(3-ацетиламинометилфенилсульфанил)ацетил]мутилин,
14-O-[(3-формиламинометилфенилсульфанил)ацетил]мутилин,
14-O-[{3-[(2-гидроксиэтиламино)метил]фенилсульфанил}ацетил]мутилин, необязательно в форме гидрохлорида,
14-O-[{3-[(3-аминопропиламино)метил]фенилсульфанил}ацетил]мутилин, необязательно в форме гидрохлорида,
14-O-[(3-{[3-(3-аминопропиламино)пропиламино]метил}фенилсульфанил)ацетил]мутилин, необязательно в форме гидрохлорида,
14-O-[{3-[(2,2-дифторэтиламино)метил]фенилсульфанил}ацетил]мутилин, необязательно в форме гидрохлорида,
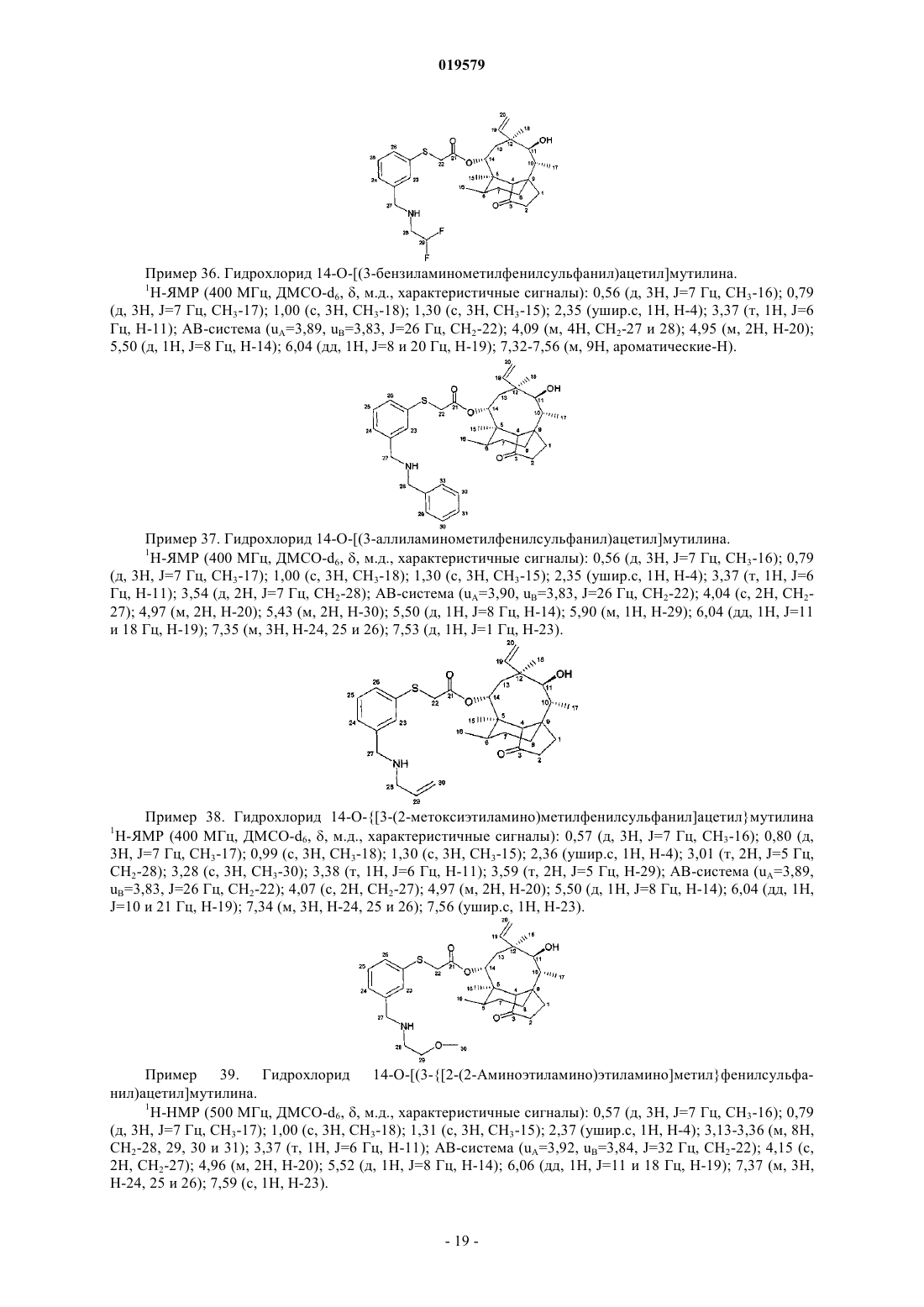
14-O-[(3-бензиламинометилфенилсульфанил)ацетил]мутилин, необязательно в форме гидрохлорида,
14-O-[(3-аллиламинометилфенилсульфанил)ацетил]мутилин, необязательно в форме гидрохлорида,
14-O-{[3-(2-метоксиэтиламино)метилфенилсульфанил]ацетил}мутилин, необязательно в форме гидрохлорида,
14-O-[(3-{[2-(2-аминоэтиламино)этиламино]метил}фенилсульфанил)ацетил]мутилин, необязательно в форме гидрохлорида,
14-O-[3-{[(фуран-2-илметил)амино]метил}фенилсульфанилацетил]мутилина, необязательно в форме гидрохлорида,
14-O-[(3-метиламинометилфенилсульфанил)ацетил]мутилин, необязательно в форме гидрохлорида,
14-O-[(3-циклопропиламинометилфенилсульфанил)ацетил]мутилин, необязательно в форме гидрохлорида,
14-O-[(3-морфолин-4-илметилфенилсульфанил)ацетил]мутилин, необязательно в форме гидрохлорида,
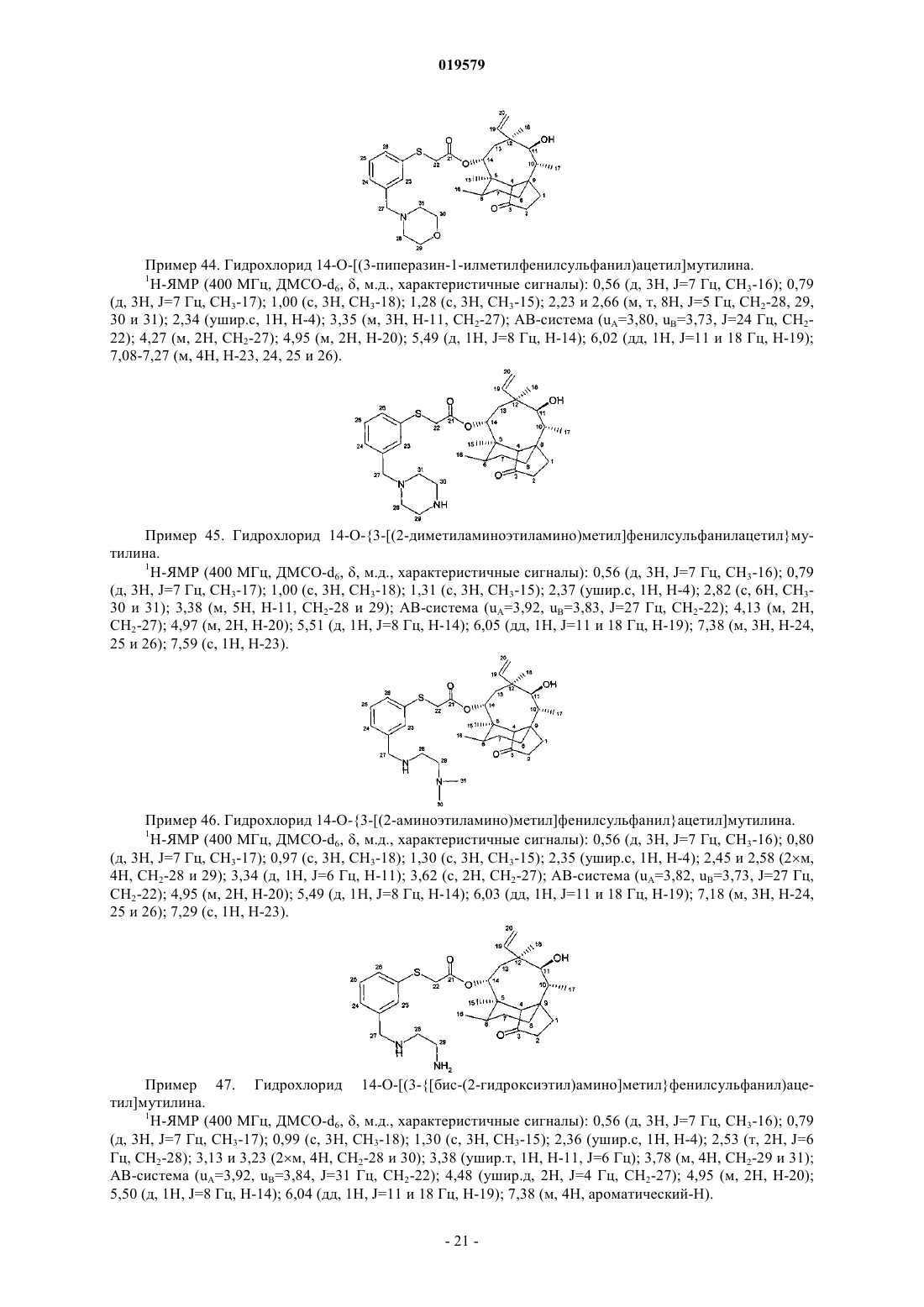
14-O-[(3-пиперазин-1-илметилфенилсульфанил)ацетил]мутилин, необязательно в форме гидрохлорида,
14-О-{3-[(2-диметиламиноэтиламино)метил]фенилсульфанилацетил}мутилин, необязательно в форме гидрохлорида,
14-О-{3-[(2-аминоэтиламино)метил]фенилсульфанил}ацетил]мутилин, необязательно в форме гидрохлорида,
14-O-[(3-{[бис-(2-гидроксиэтил)амино]метил}фенилсульфанил)ацетил]мутилин,
14-O-[(3-диметиламинометилфенилсульфанил)ацетил]мутилин, необязательно в форме гидрохлорида.
13. Соединение по любому из пп.1-12 в форме соли.
14. Применение соединения по любому из пп.1-13 в качестве фармацевтического препарата.
15. Способ лечения заболеваний, опосредованных бактериями, который включает в себя введение нуждающемуся в таком лечении эффективного количества соединения по любому из пп.1-13.
16. Применение соединения по любому из пп.1-13 для лечения заболеваний, опосредованных бактериями.
17. Применение соединения по любому из пп.1-13 для производства медикамента для лечения заболеваний, опосредованных бактериями.
18. Фармацевтическая композиция, включающая соединение по любому из пп.1-13 и включающая по меньшей мере один фармацевтический наполнитель.
19. Фармацевтическая композиция по п.18, дополнительно включающая другой фармацевтически активный агент.
20. Применение соединения по любому из пп.1-13 в производстве медикамента для лечения прыщей.
Текст
где Т представляет собой (C1-6)моно- или диалкиламинометил,(C1-6)ациламинометил, (C1-6)ацилоксиметил, бензилоксиметил илигуанидиноиминометил или Т представляет собой(СН 2)n-XR1 и остальные радикалы имеют различные значения: 14-O-[(5-гидроксиметил-2-фторфенилсульфанил)ацетил]мутилин,14-O-[(2-гидроксиметил-4-фторфенилсульфанил)ацетил]мутилин,14-O-[3-[(2-морфолин-4-илэтоксиимино)метил]фенилсульфанилацетил]мутилин, 14-O-[3-[(2 пирролидин-1-илэтоксиимино)метил]фенилсульфанилацетил]мутилин, 14-O-[(3-ацетилтиометилфенилсульфанил)ацетил]мутилин, 14-O-[(2-гидрокси-5-гидроксиметилфенилсульфанил)ацетил]мутилин, 14-O-[3-(2-гидроксифенилкарбонил)гидроксиметилфенилсульфанил]ацетилмутилин, необязательно в форме соли и их применение для лечения заболеваний, опосредованных бактериями.(71)(73) Заявитель и патентовладелец: НАБРИВА ТЕРАПЬЮТИКС АГ (AT) Настоящее изобретение относится к органическим соединениям, таким как плевромутилины. Плевромутилин, соединение формулы представляет собой природный антибиотик, продуцируемый, например, базидиальными грибамиPleurotus mutilus и Р. passeckerianus; см., например, Merck Index, 12-е изд., п.7694. Ряд других плевромутилинов, например, содержащих каркас циклической структуры плевромутилина и являющихся замещенными по гидроксигруппе, были исследованы, например, на антимикробную активность. Авторы обнаружили плевромутилины с интересной активностью. В одном аспекте настоящее изобретение относится к соединению, например плевромутилину, выбранному из группы, состоящей из 14-O-[C1-6)алкокси(C1-6)алкил)фенилсульфанил)ацетил]мутилинов,14-O-[C1-6)моно- или диалкиламино(C1-6)алкил)фенилсульфанил)ацетил]мутилинов,14-O-[гидрокси(C1-6)алкил)фенилсульфанил)ацетил]мутилинов,14-O-[формил(C0-5)алкил)фенилсульфанил)ацетил]мутилинов,14-O-[гуанидиноимино(C1-6)алкил)фенилсульфанил)ацетил]мутилинов,14-O-[уреидоимино(C1-6)алкил)фенилсульфанил)ацетил]мутилинов,14-O-[тиоуреидоимино(C1-6)алкил)фенилсульфанил)ацетил]мутилинов,14-O-[изотиоуреидоимино(C1-6)алкил)фенилсульфанил)ацетил]мутилинов,14-O-[циано(С 0-5)алкил)фенилсульфанил)ацетил]мутилинов,14-O-[азидо(С 0-5)алкил)фенилсульфанил)ацетил]мутилинов,14-O-[C1-6)ацилокси(C1-6)алкил)фенилсульфанил)ацетил]мутилинов,14-O-[бензоилокси(C1-6)алкил)фенилсульфанил)ацетил]мутилинов,в которых фенильный или 5- или 6-членный гетероарильный цикл необязательно дополнительно содержит в качестве заместителей до четырех групп, независимо выбранных из галогена, (C1-6)алкила,арила, арил(C1-6)алкила, (C1-6)алкокси, (C1-6)алкокси(C1-6)алкила, галоген(C1-6)алкила, арил(C1-6)алкокси,гидрокси, нитро, циано, азидо, ацилокси, карбомоила, моно- или ди-N-(C1-6)алкилкарбомоила,(C1-6)алкоксикарбонила, арилоксикарбонила, уреидо, гуанидино, (C1-6)алкилгуанидино, амидино,(C1-6)алкиламидино, сульфониламино, аминосульфонила, (C1-6)алкилтио, (C1-6)алкилсульфинила,(C1-6)алкилсульфонила, гетероциклила, гетероарила, гетероциклил(C1-6)алкила и гетероарил(C1-6)алкила,или два соседних кольцевых атома углерода могут быть связаны (С 3-5)алкиленовой цепью с образованием карбоциклического кольца. Предпочтительно изобретение относится к 14-O-[C1-6)алкокси(C1-6)алкил)фенилсульфанил)ацетил]мутилинам,14-O-[C1-6)моно- или диалкиламино(C1-6)алкил)фенилсульфанил)ацетил]мутилинам,14-O-[C1-6)ациламино(C1-6)алкил)фенилсульфанил)ацетил]мутилинам,14-O-[гидрокси(C1-6)алкил)фенилсульфанил)ацетил]мутилинам,14-O-[формил(С 0-5)алкил)фенилсульфанил)ацетил]мутилинам,14-O-[гуанидиноимино(C1-6)алкил)фенилсульфанил)ацетил]мутилинам. Более предпочтительно настоящее изобретение представляет соединение формулы где n имеет значение от 1 до 6;X представляет собой кислород или NR2, где R2 представляет собой атом водорода или линейный либо разветвленный (C1-6)алкил или гидрокси(C1-6)алкил либо (C1-6)алкокси(C1-6)алкил;R1 представляет собой атом водорода, линейный или разветвленный (C1-6)алкил, моно- или дигалогенированный (C1-6)алкил, амино(C1-6)алкил, гидрокси(C1-6)алкил, фенил(C1-6)алкил, (C1-6)алкилен, фуранил(C1-6)алкил, (С 3-6)циклоалкил и соответствующие аммониевые соли, например хлориды; илиR1 и R2 совместно с атомом азота, к которому они присоединены, образуют 5-7-членный гетероцикл, содержащий по меньшей мере один атом азота; илиXR1 представляет собой пиперазинил или морфолинил. В другом аспекте настоящее изобретение представляет соединение формулы где n имеет значение от 0 до 5;Y представляет собой атом кислорода или NR3;R4, R5, R6, R7 представляют собой атом водорода, линейный или разветвленный C1-6-алкил или С 3-8 циклоалкил, R8 представляет собой C1-4-алкил. Предпочтительно настоящее изобретение представляет соединение формулы II, в котором Y представляет собой NR3, X представляет собой NR7, R3 представляет собой и R4, и R7 совместно с атомами азота, к которым они присоединены, образуют 5-7-членное гетероциклическое кольцо, содержащее по меньшей мере 2 атома азота, где R5 и R6 определены выше, или и R5, и R6 совместно с атомами азота, к которым они присоединены, образуют 5-7-членное гетероциклическое кольцо, содержащее по меньшей мере 2 атома азота, где R4 и R7 определены выше, или и R4, и R5 совместно с атомами азота, к которым они присоединены, образуют 5-7-членное гетероциклическое кольцо, содержащее один или несколько атомов азота, где R6 и R7 определены выше. Более предпочтительно настоящее изобретение представляет соединение формулы II, в котором Y представляет собой NR3, X представляет собой NR7, R3 представляет собойR9 представляет собой атом водорода, линейный или разветвленный C1-6-алкил или ацил, напримерC1-6-ацил. Плевромутилин, представленный по настоящему изобретению, включает в себя плевромутилин,имеющий основные структурные элементы мутилиновой циклической системы, как представлено на формуле где RPLEU представляет собой винил или этил и пунктирная линия представляет собой связь или связь может отсутствовать. В настоящей заявке применяется следующая система нумерации: Пунктирная линия между положениями 19 и 20 (и между положениями 1 и 2) представляет собой связь или связь может отсутствовать. В соединении формулы А или формулы PLEU атом водорода в положениях 4, 7 и/или 8 циклической системы может быть замещен на дейтерий и, если пунктирная линия между положениями 1 и 2 обозначает отсутствие связи (одинарная связь между положениями 1 и 2),циклическая система может быть далее замещена в положениях 1 и/или 2, например, на галоген, дейтерий или гидроксигруппу. Далее, группа -О- в положении 14 замещена предпочтительно замещенной карбонильной группой. Можно отметить, что антимикробная активность упомянутых производных плевромутилина в отношении клинически значимых бактериальных патогенов (Staphylococcus aureus, Enterococcus faecalis,Streptococcus pneumoniae, Moraxella catarrhalis и Escherichia coli, см. таблицу ниже) особенно усиливается, когда фенильное кольцо несет а) насыщенный или ненасыщенный атом углерода в мета-положении по отношению к атому серы, присоединенному к фенильному кольцу, или b) насыщенный или ненасыщенный атом углерода в орто-положении по отношению к атому серы, присоединенному к фенильному кольцу, при условии, что фенильное кольцо дополнительно содержит в качестве заместителей до четырех групп, как описано в п.1. Следовательно, соединения являются предпочтительными, если упомянутая (СН 2)n-группа находится в мета-положении по отношению к атому серы, присоединенному к фенильному кольцу. Также предпочтительными являются соединения, в которых упомянутая (СН 2)n-группа находится в орто-положении по отношению к атому серы, присоединенному к фенильному кольцу, с условием, что фенильное кольцо дополнительно содержит в качестве заместителей до четырех групп, независимо выбранных из галогена,(C1-6)алкила, арила, арил(C1-6)алкила, (C1-6)алкокси, (C1-6)алкокси (C1-6)алкила, галоген(C1-6)алкила,арил(C1-6)алкокси, гидрокси, нитро, циано, азидо, ацилокси, карбомоила, моно- или ди-N-(C1-6)алкилкарбомоила, (C1-6)алкоксикарбонила, арилоксикарбонила, уреидо, гуанидино, (C1-6)алкилгуанидино, амидино, (C1-6)алкиламидино, сульфониламино, аминосульфонила, (C1-6)алкилтио, (C1-6)алкилсульфинила,(C1-6)алкилсульфонила, гетероциклила, гетероарила, гетероциклил(C1-6)алкила и гетероарил(C1-6)алкила,или два соседних кольцевых атома углерода могут быть связаны (С 3-5)алкиленовой цепью с образованием карбоциклического кольца. В другом аспекте настоящее изобретение представляет соединение, выбранное из группы, состоящей из 14-O-[(3-гидроксиметилфенилсульфанил)ацетил]мутилина,14-O-[(3-формилфенилсульфанил)ацетил]мутилина,14-O-[(3-[(аминоиминометил)гидразоно]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[2-(имино-N-пиперазинилметил)-2-метилгидразоно]метилфенилсульфанил)ацетил]мутилина,14-O-[(3-[(3-этил-2-метилиминоимидазолидин-1-илимино)метил]фенилсульфанил)ацетил]мутилина,14-O-[(3-[(имино-N-пиперазинилметил)гидразоно]метилфенилсульфанил)ацетил]мутилина, например, в форме соли, такой как гидрохлорид. В следующем аспекте настоящее изобретение представляет соединение, выбранное из группы, состоящей из 14-O-[(3-гидроксиметилфенилсульфанил)ацетил]мутилина,14-O-[3-(аминоиминометил)гидразонометилфенилсульфанил]ацетилмутилина,14-О-[3-[1-пиперазиноиминометил)метилгидразоно)метил]фенилсульфанилацетил]мутилина,14-O-[3-[(3-этил-(2-этилимино)имидазолидин-1-илимино)метил]фенилсульфанилацетил]мутилина,14-О-[3-[(1-пиперазиноиминометил)гидразонометил]фенилсульфанилацетил]мутилина,14-O-[3-[(2-морфолин-4-илэтоксиимино)метил]фенилсульфанилацетил]мутилина,14-O-[3-[(2-пирролидин-1-илэтоксиимино)метил]фенилсульфанилацетил]мутилина,4-O-[(3-аминометилфенилсульфанил)ацетил]мутилина,14-O-[(3-аллиламинометилфенилсульфанил)ацетил]мутилина,14-O-[3-[(фуран-2-илметил)амино]метилфенилсульфанилацетилмутилина,14-O-[(3-циклопропиламинометилфенилсульфанил)ацетил]мутилина, например, в форме соли, такой как гидрохлорид. Соединение, представленное настоящим изобретением, здесь также обозначается как "соедине-3 019579 ние(я) по настоящему изобретению". Соединение по настоящему изобретению включает в себя эфиры мутилин-14-илуксусной кислоты, например, как явно описано выше, и соединение формулы I или II. Соединение по настоящему изобретению включает в себя соединение в любой форме, например в свободном виде, в форме соли, в форме сольвата и в форме соли и сольвата. Соединения по настоящему изобретению могут находиться в кристаллической или некристаллической форме и в случае кристаллической формы могут необязательно представлять собой гидрат или сольват. Когда некоторым из соединений по этому изобретению позволяли кристаллизоваться или перекристаллизовываться из органических растворителей, растворитель для кристаллизации может присутствовать в кристаллическом продукте. Это изобретение включает в себя, в пределах его объема, такие сольваты. Аналогично, некоторые из соединений по этому изобретению могут быть кристаллизованы или перекристаллизованы из растворителей, содержащих воду. В таких случаях в кристаллическом продукте может присутствовать гидратационная вода. Это изобретение включает в себя, в пределах его объема, стехиометрические гидраты, а также соединения, содержащие переменные количества воды, которые могут быть получены способами,такими как лиофильная сушка. В другом аспекте настоящее изобретение представляет соединение по настоящему изобретению в форме соли. Такие соли включают в себя предпочтительно фармацевтически приемлемые соли, хотя фармацевтически неприемлемые соли являются включенными, например, для целей получения/выделения/очистки. Соль соединения по настоящему изобретению включает в себя соль металла или кислотно-аддитивные соли. Соли металла включают в себя, например, щелочные или щелочноземельные соли; кислотно-аддитивные соли кислоты включают в себя соли соединения по настоящему изобретению с кислотой, например гидрогенфумаровой кислоты, фумаровой кислоты, нафталин-1,5 сульфоновой кислоты, соляной кислоты, хлордейтериевой кислоты; предпочтительно соляной кислоты. Соединение по настоящему изобретению в свободном виде может быть конвертировано в соответствующее соединение в форме соли и vice versa. Соединение по настоящему изобретению в свободном виде или в форме соли и в форме сольвата может быть конвертировано в соответствующее соединение в свободном виде или в форме соли в несольватированной форме и vice versa. Соединение по настоящему изобретению, если замещено соответствующим образом, может существовать в форме изомеров и их смесей; например оптических изомеров, диастереоизомеров, цис-/трансконформеров. Соединение по настоящему изобретению может, например, содержать асимметрические атомы углерода и может, таким образом, существовать в форме энантимеров или диастереоизомеров и их смесей, например рацематов. Заместители при любом асимметрическом атоме углерода могут присутствовать в (R)-, (S)- или (R,S)-конфигурации, предпочтительно в (R)- или (S)-конфигурации. Например,если в соединении формулы I R1 является замещенным алкилом и указанный заместитель присоединен к атому углерода боковой цепи такого алкила, атом углерода, к которому присоединен такой заместитель,является асимметрическим атомом углерода и такой заместитель может находиться в (R)- и (S)конфигурации, включая их смеси. Конфигурация заместителей, присоединенных к асимметрическим атомам углерода мутилинового цикла, предпочтительно является теми же, как в природном плевромутилине. Изомерные смеси могут быть разделены, если необходимо, например, согласно способу получения чистых изомеров, например, в соответствии с традиционным способом. Настоящее изобретение включает в себя соединение по настоящему изобретению в любой изомерной форме и в любой изомерной смеси. Настоящее изобретение также включает в себя таутомеры соединения по настоящему изобретению,если таутомеры могут существовать. Любое описанное здесь соединение, например соединение по настоящему изобретению и интермедиаты при их получении, могут быть получены, если необходимо, например, аналогично традиционным способом или как определено здесь. В другом аспекте настоящее изобретение представляет способ получения 14-O-[C1-6)алкокси(С 1-6)алкил)фенилсульфанил)ацетил]мутилинов,14-O-[C1-6)моно- или диалкиламино(C6-1)алкил)фенилсульфанил)ацетил]мутилинов,14-O-[гидрокси(C1-6)алкил)фенилсульфанил)ацетил]мутилинов,14-O-[формил(С 0-5)алкил)фенилсульфанил)ацетил]мутилинов,14-O-[гуанидиноимино(C1-6)алкил)фенилсульфанил)ацетил]мутилинов,14-O-[уреидоимино(C1-6)алкил)фенилсульфанил)ацетил]мутилинов,14-O-[тиоуреидоимино(C1-6)алкил)фенилсульфанил)ацетил]мутилинов,14-O-[изотиоуреидоимино(C1-6)алкил)фенилсульфанил)ацетил]мутилинов,14-O-[C1-6)алкокси(C1-6)алкил)-5- или 6-членных гетероарилсульфанил)ацетил]мутилинов,14-O-[гидрокси(C1-6)алкил)-5- или 6-членных гетероарилсульфанил)ацетил]мутилинов,14-O-[формил(С 0-5)алкил)-5- или 6-членных гетероарилсульфанил)ацетил]мутилинов,14-O-[гуанидиноимино(C1-6)алкил)-5- или 6-членных гетероарилсульфанил)ацетил]мутилинов,14-O-[C1-6)алкилгуанидиноимино(C1-6)алкил)-5 или 6-членных гетероарилсульфанил)ацетил]мутилинов,-4 019579 14-O-[уреидоимино(C1-6)алкил)-5- или 6-членных гетероарилсульфанил)ацетил]мутилинов,14-O-[тиоуреидоимино(C1-6)алкил)-5- или 6-членных гетероарилсульфанил)ацетил]мутилинов,14-O-[изотиоуреидоимино-(C1-6)алкил)-5- или 6-членных гетероарилсульфанил)ацетил]мутилинов,включающий в себя реакцию: а) тозилата 14-O-плевромутилина с гидрокси(C1-6)алкилтиофенолом или 5- или 6-членным гидрокси(C1-6)алкилтиогетероарильным соединением в присутствии основания (если нет необходимости в дальнейшем превращении, конечные соединения выделяли и очищали соответствующим образом);b1) селективного окисления гидроксигруппы в формильную группу с применением соответствующего окисляющего агента (если нет необходимости в дальнейшем превращении, конечные соединения выделяли и очищали приемлемым образом);b2) трансформирования гидроксильной группы в соответствующий мезилат;c1) конденсации соединения, несущего формильную группу с соединением, имеющим свободную аминогруппу; с 2) замещение мезилата на азид; с 2 а) замещение мезилата на замещенные первичные или вторичные амины;d2) восстановление азидов до аминов; е 2) ацилирование амина. Соединения, имеющие заместители, которые не предназначены для участия в стадиях реакции, могут быть использованы в защищенной форме. Защитные группы могут быть удалены затем без разрушения остатка молекулы. Соединение, полученное способом, представленное по настоящему изобретению, может быть конвертировано в соответствующую соль, согласно, например аналогично, способу, который является традиционным, например путем обработки кислотой, или основанием металла соответственно для получения кислотно-аддитивные соли, или соответственно соли с металлом и vice versa, соединение, полученное способом, представленным настоящим изобретением, в форме соли, может быть конвертировано в соответствующее соединение в форме свободного основания, согласно, например аналогично, способу,который является традиционным, например, путем обработки кислотой, если была получена соль с металлом, и путем обработки основанием металла, например гидроксидом металла, если была получена кислотно-аддитивная соль. Соединения по настоящему изобретению, например, включая фенилсульфанил- или 5-6-членный гетероарилсульфанилмутилин, представленный по настоящему изобретению, который определен выше,и соединение формулы I или II проявляют фармакологическую активность и, следовательно, могут быть применены в качестве фармацевтических препаратов. Например, соединения по настоящему изобретению проявляют антимикробную, например антибактериальную, активность в отношении грамм-положительных бактерий, таких как коагулазаположительных и коагулаза-отрицательных Staphylococci, например Staphylococcus aureus, Styphylococcus epidermis, Staphylococcus haemolyticus, Streptococci, например Streptococcus pyogenes, Streptococcuspneumoniae, Streptococcus agalacticae, Enterococci, например Enterococcus faecium и Moraxellaceae, например Moraxella catarrhalis, Pastaurellaceae, например Haemophilus influenzae, также как в отношении Mycoplasmactaceae, Chlamydiaceae, например Chlamydia trachomatis, Chlamydia pneumoniae и облигатными анаэробами, например Bacteroides fragilis, Clostridium difficile; in vitro в тесте на разбавление в агаре или тесте на микроразбавление согласно Институту химических и лабораторных стандартов (CLSI, ранее Национальный Комитет для Клинических Лабораторных Стандартов (NCCLS) 2006, документ М 7-А 7,vol. 26,2 "Methods for dilution Antimicrobial Susceptibility Tests for Bacteria that Grow Aerobically - Seventh Edition, Approved Standard"; и в измерение in vitro антибактериальной активности в отношении анаэробных бактерий согласно Национальному Комитету для Клинических Лабораторных Стандартов(NCCLS), vol. 24,2, М 11-А 5, Methods for Antimicrobal Susceptibility Testing of Anaerobic Bacteria; Approved Standard; Sixth Edition (2004) и in vivo в модели сепсиса на мышах в отношении Staphylococcusaureus. Соединения по настоящему изобретению являются, следовательно, пригодными для лечения и профилактики заболеваний, которые опосредованы микроорганизмами, например бактериями. Болезни, которые также могут излечиваться, включают в себя, например, болезни, опосредованные Helicobacter, такой как Helicobacter pylori, и болезни, опосредованные Mycobacteria tuberculosis, болезни, опосредованные Legionella pneumophila или Neisseriaceae, болезни, которые также могут излечиваться, включают в себя общие воспалительные заболевания, в которых микроорганизмы опосредуют упомянутое воспаление, например, включая прыщи. Соединения по настоящему изобретению предпочтительно могут быть применены для излечения инфекций кожи и мягких тканей, например кожных инфекций, подобных импетиго, буллезного импетиго или эктимы, кожных инфекций, подобных рожистому воспалению, целлюлитов, эритразмы или некротизирующего фасцита, фолликулярных инфекций, аналогичных фолликулиту, фурункулезу или карбункулезу, других инфекций, подобных перионихии, дактилиту, ботриомикозу, маститу, вторичных повреждений инфицированной кожи, вторичного инфицированного дерматоза, для разрушения колоний бактери-5 019579 альных возбудителей, например разрушения колоний назального возбудителя Staphylococcus aureus и прыщей, путем местного применения. Согласно этому в следующем аспекте настоящее изобретение представляет применение соединения по изобретению или его фармацевтически приемлемой соли или производного либо сольвата для получения медикамента, адаптированного для местного введения для применения при лечении инфекций кожи и мягких тканей и также при лечении прыщей у людей. Изобретение также представляет применение соединения по изобретению или его фармацевтического приемлемого производного при производстве медикамента для применения в лечении инфекции кожи или мягкой ткани. В другом аспекте настоящее изобретение представляет соединение по настоящему изобретению для применения в качестве фармацевтического препарата, предпочтительно в качестве антимикробного препарата, такого как, например, антибиотик и антианаэробный препарат. В другом аспекте настоящее изобретение представляет соединение по настоящему изобретению для применения при лечении прыщей. В следующем аспекте настоящее изобретение представляет соединение по настоящему изобретению для применения при производстве медикамента для лечения заболеваний, опосредованных микроорганизмами, такими как бактерии, например: заболеваний, опосредованных бактериями, например, выбранными из Staphylococci, Streptococci,Enterococci; заболеваний, опосредованных Helicobacter; заболеваний,опосредованныхLegionella,Neisseriaceae,Moraxellaceae,Pasteurellaceae,Corynebacteria; заболеваний, опосредованных Mycobacteria tuberculosis; например, заболеваний, опосредованных Mycoplasmataceae, Chlamydiaceae и облигатными анаэробами,для лечения прыщей и для разрушения колоний у индивидуумов, пораженных бактериями. В следующем аспекте настоящее изобретение представляет способ лечения заболеваний, опосредованных микроорганизмами, который включает в себя введение индивидууму, нуждающемуся в таком лечении, эффективного количества соединения по настоящему изобретению, например, в форме фармацевтической композиции. В следующем аспекте настоящее изобретение представляет способ лечения прыщей, который включает в себя введение индивидууму, имеющему необходимость в таком лечении, эффективного количества соединения по настоящему изобретению, например, в форме фармацевтической композиции. Лечение включает в себя лечение и профилактику. Для антимикробного лечения и лечения прыщей соответствующая дозировка, конечно, будет варьироваться в зависимости от, например, химической природы и фармакокинетических данных применяемого соединения по настоящему изобретению, особенностей реципиента, режима введения и природы и тяжести состояний, которые излечиваются. Однако, в общем, для удовлетворительных результатов у больших млекопитающих, например людей, показана дневная дозировка в диапазоне от около 0,01 до 3 г соединения по настоящему изобретению, легко вводимая, например, в раздельных дозах до четырех раз в день. Соединение по настоящему изобретению может быть введено любым традиционным путем, например через желудочно-кишечный тракт, например, включая назальное, защечное, ректальное, пероральное введение; парентерально, например, включая внутривенное, внутримышечное, подкожное введение; или местно, например, включая чрескожное, интраназальное, внутритрахеальное введение, например, в форме покрытых или непокрытых таблеток, капсул, инъецируемых растворов или суспензий, например, в форме ампул, пузырьков, в форме полутвердых рецептур, например мазей, кремов, гелей, паст, в форме ингалируемого порошка, пен, настоек, пластырей, карандашей-корректоров, капель, спреев или в форме суппозиториев, например, аналогично макролидам, таким как эритромицины, например кларитромицин или азитромицин. Соединение по настоящему изобретению может быть введено в форме фармацевтически приемлемой соли, например кислотно-аддитивной соли или соли металла; или в свободном виде; необязательно в форме сольвата. Соединение по настоящему изобретению в форме соли проявляют тот же порядок активности, как соединение в свободном виде, необязательно в форме сольвата. Соединение по настоящему изобретению может быть применено для медикаментозного лечения по настоящему изобретение отдельно или в комбинации с одним или несколькими другими фармацевтически активными препаратами. Такие другие фармацевтически активные препараты включают в себя, например, другие антибиотики и антивоспалительные агенты и, если соединение по настоящему изобретению применяется для лечения прыщей, другие фармацевтические агенты включают в себя, помимо этого, препараты, которые являются активными против прыщей или применяются для разрушения колоний/уничтожения бактериальных возбудителей. Комбинации включают в себя фиксированные комбинации, в которых два или более фармацевтически активных препарата присутствуют в той же рецептуре; комплекты, в которых два или более фармацевтически активных препарата в раздельных рецептурах продаются в одной упаковке, например, с указаниями для совместного введения; и свободных комбинациях, в которых фармацевтически активные препараты упакованы отдельно, но дана инструкция для одновременного или последовательного введения. В другом аспекте настоящее изобретение представляет фармацевтическую композицию, включающую в себя соединение по настоящему изобретению, например включающую соединение формулы I, в свободном виде или в форме фармацевтически приемлемой соли и/или, например, в форме сольвата; в смеси по меньшей мере с одним фармацевтическим препаратом, наполнителем, например носителем или разбавителем, например, включая наполнители, связующие, дезинтегрирующие агенты, стабилизаторы потока, смазки, сахара и подсластители, ароматизирующие вещества, консерванты, стабилизаторы, смачивающие агенты и/или эмульгаторы, агенты, повышающие растворимость, соли для регуляции осмотического давления и/или буферы. В другом аспекте настоящее изобретение представляет фармацевтическуюкомпозицию по настоящему изобретению, дополнительно включающую в себя другой фармацевтически активный препарат. Такие фармацевтические композиции могут производиться согласно, например аналогично, способу, который является традиционным, например способами смешения, гранулирования, покрытия, растворения или лиофилизации. Форма дозировки со стандартным элементом может содержать, например, от около 0,01 до приблизительно 3000 мг, например от 1 до приблизительно 100 мг. Кроме того, соединения по настоящему изобретению являются приемлемыми в качестве ветеринарных препаратов, например ветеринарных активных соединений, например, при профилактике и при лечении микробных, например бактериальных, заболеваний у животных, например, таких как домашняя птица, свиньи и телята; для разбавления жидкостей для искусственного осеменения и для методик окунания яиц. В другом аспекте настоящее изобретение представляет соединение по настоящему изобретению для применения в качестве ветеринарного препарата. В следующем аспекте настоящее изобретение представляет соединение по настоящему изобретению для приготовления ветеринарной композиции, которая может быть применена в качестве ветеринарного препарата. В другом аспекте настоящее изобретение представляет способ профилактики и лечения микробных,например бактериальных, заболеваний в ветеринарии, который включает в себя введение индивидууму,имеющему необходимость в таком лечении, эффективного количества соединения по настоящему изобретению, например, в форме ветеринарной композиции. Для применения активных соединений по настоящему изобретению в качестве ветеринарного препарата дозировка будет, конечно, варьировать в зависимости от размера и возраста животного и желаемого эффекта; например, для профилактической обработки относительно низкие дозы должны вводиться в течение продолжительного периода времени, например от 1 до 4 недель. Предпочтительные дозы в воде для питья составляют от 0,0125 до 0,05 единиц массы по объему, особенно от 0,0125 до 0,025; и в кормах от 20 до 400 г/метрическая тонна, предпочтительно от 20 до 200 г/метрическая тонна. Предпочтительно вводить активные соединения по настоящему изобретению в качестве ветеринарного препарата курицам в воде для питья, свиньям в корме и телятам перорально или парентерально, например, в форме оральных или парентеральных препаратов. Далее изобретение описано со ссылкой на следующие примеры. Эти примеры представлены только с целями иллюстрации и не предназначены ограничивать любым способом настоящее изобретение. Примеры Пример 1. 14-O-[(3-Гидроксиметилфенилсульфанил)ацетил]мутилин. Стадия 1. Тозилат плевромутилина. К раствору 18,63 г (49,2 ммоль) плевромутилина и 9,39 г (49,2 ммоль) толуолсульфонилхлорида в 1400 мл раствора в метилэтилкетоне медленно добавляли 4,98 г (49,2 ммоль) триэтиламина в 300 мл метилэтилкетона при температуре окружающей среды. Реакционную смесь перемешивали в течение 24 ч при температуре окружающей среды, образующийся осадок отфильтровывали и к раствору добавляли 2800 мл воды. Раствор экстрагировали три раза этилацетатом, органическую фазу высушивали надNa2SO4 и упаривали досуха при пониженном давлении. Неочищенный продукт применяли на следующей стадии без дополнительной очистки. 1 Н-ЯМР (400 МГц, ДМСО-d6, , м.д., характеристичные сигналы): 0,49 (д, 3 Н, J=7 Гц, СН 3-16); 0,8 Стадия 2. 14-O-[(3-Гидроксиметилфенилсульфанил)ацетил]мутилин. К 1,96 г (14 ммоль) (3-меркаптофенил)метанола [полученного из 3-меркаптобензойной кислоты согласно Chemistry Express, vol. 7,11, p. 865-868 (1992)] в 90 мл абсолютного этанола добавляли 322 мг(14 ммоль) натрия. После перемешивания реакционной смеси в течение 30 мин при температуре окружающей среды добавляли раствор 7,45 г (14 ммоль) тозилата плевромутилина в 130 мл метилэтилкетона и реакционную смесь перемешивали при температуре окружающей среды в течение 16 ч. Реакционную смесь упаривали досуха при пониженном давлении, растворяли в этилацетате и экстрагировали три раза водой. Органическую фазу высушивали над Na2SO4, упаривали досуха при пониженном давлении и остаток хроматографировали на силикагеле с применением смеси дихлорметан/метанол 100:1,5 в качестве подвижной фазы. Полученное вещество являлось кристаллическим (т.пл. 139-141 С). 1 Н-ЯМР (500 МГц, CDCl3, ,м.д., характеристичые сигналы): 0,68 (д, 3 Н, J=7 Гц, СН 3-16); 0,88 (д, 3 Н, J=7 Гц, СН 3-17); 1,12 (с, 3 Н,СН 3-18); 1,42 (с, 3 Н, СН 3-15); 2,06 (ушир.с, 1 Н, Н-4); 3,32 (т, 1 Н, J=6 Гц, Н-11); 3,59 (с, 2 Н, СН 2-22); 4,66 Следующие соединения получали аналогичным способом. Пример 2 (сравнительный). 14-O-[(4-Метилфенилсульфанил)ацетил]мутилин. 1 Н-ЯМР (400 МГц, ДМСО-d6, , м.д., характеристичные сигналы): 0,55 (д, 3 Н, J=7 Гц, СН 3-16); 0,79 Пример 3. 14-O-[(5-Гидроксиметил-2-фторфенилсульфанил)ацетил]мутилин. Н-ЯМР (400 МГц, CD3OD, , м.д., характеристичные сигналы): 0,67 (д, 3 Н, J=7 Гц, СН 3-16); 0,89 (д,3 Н, J=7 Гц, СН 3-17); 1,18 (с, 3 Н, СН 3-18); 1,35 (с, 3 Н, СН 3-15); 2,29 (ушир.с, 1 Н, Н-4); 3,42 (д, 1 Н, J=7 Гц,Н-11); АВ-система (uA=3,70, uB=3,60, J=39 Гц, СН 2-22); 4,53 (с, 2 Н, СН 2-26); 5,07 (м, 2 Н, Н-20); 5,64 (д,1 Н, J=8 Гц, Н-14); 6,19 (дд, 1 Н, J=7 и 19 Гц, Н-19); 7,08, 7,27 и 7,44 (3 м, 3 Н, Н-23, 24 и 25). Требующийся (4-фтор-3-меркаптофенил)метанол получали в две стадии из 3-хлорсульфонил-4 фторбензойной кислоты, следуя методике получения (3-меркаптофенил)метанола, описанной в Chemistry(д, 3 Н, J=7 Гц, СН 3-17); 0,97 (с, 3 Н, СН 3-18); 1,27 (с, 3 Н, СН 3-15); 2,34 (ушир.с, 1 Н, Н-4); 3,37 (д, 1 Н, J=7 Гц, Н-11); АВ-система (uA=3,78, uB=3,70, J=29 Гц, СН 2-22); 4,56 (д, 2 Н, J=5 Гц, СН 2-26); 4,92 (м, 2 Н, Н 20); 5,45 (д, 1 Н, J=8 Гц, Н-14); 6,19 (дд, 1 Н, J=11 и 18 Гц, Н-19); 7,02 и 7,44 (2 м, 2 Н, Н-24 и 25); 7,20 (м,1 Н, Н-23). Требующийся (5-фтор-2-меркаптофенил)метанол получали из 5-фтор-2-меркаптобензойной кислоты, следуя методике получения (3-меркаптофенил)метанола, описанной в Chemistry Express, vol. 7,11,p. 865-868). 1(д, 3 Н, J=7 Гц, СН 3-17); 0,97 (с, 3 Н, СН 3-18); 1,28 (с, 3 Н, СН 3-15); 2,35 (ушир.с, 1 Н, Н-4); 3,36 (т, 1 Н, J=6 Гц, Н-11); АВ-система (uA=4,00, uB=3,93, J=31 Гц, СН 2-22); 4,97 (м, 2 Н, Н-20); 5,48 (д, 1 Н, J=8 Гц, Н-14); 6,01 (дд, 1 Н, J=11 и 18 Гц, Н-19); 7,45-7,86 (3 м, 4 Н, Н-23, 24, 25 и 26). Требующийся 3-меркаптобензонитрил получали из 3-цианобензолсульфонилхлорида, следуя методике получения 3-меркаптобензойной кислоты, описанной в Journal of Heterocyclic Chemistry (1982),19(4), 961-5. 1H-ЯМР (400 МГц, CDCl3, , м.д., характеристичные сигналы): 0,68 (д, 3 Н, J=7 Гц, СН 3-16); 0,86 (д,3 Н, J=7 Гц, СН 3-17); 1,12 (с, 3 Н, СН 3-18); 1,40 (с, 3 Н, СН 3-15); 2,06 (ушир.с, 1 Н, Н-4); 3,32 (дд, 1 Н, J=7 и 11 Гц, Н-11); 3,56 (с, 2 Н, СН 2-22); 4,66 (д, 2 Н, J=4 Гц, СН 2-25); 5,16 и 5,30 (2 м, 2 Н, Н-20); 5,73 (д, 1 Н,J=8 Гц, Н-14); 6,41 (дд, 1 Н, J=11 и 17 Гц, Н-19); 7,28 и 7,38 (2 д, 4 Н, J=8 Гц, Н-23 и 24); 9,91 (с, 1 Н, Н 25). Требующийся (4-меркаптофенил)метанол получали из 4-меркаптобензойной кислоты, следуя методике получения (3-меркаптофенил)метанола, описанной в Chemistry Express, vol. 7,11, p. 865-868). 1 Пример 7. 14-O-[(2-Гидроксиметилфенилсульфанил)ацетил]мутилин. Н-ЯМР (500 МГц, CDCl3, , м.д., характеристичные сигналы): 0,60 (д, 3 Н, J=7 Гц, СН 3-16); 0,85 (д,3 Н, J=7 Гц, СН 3-17); 1,09 (с, 3 Н, СН 3-18); 1,39 (с, 3 Н, СН 3-15); 2,04 (ушир.с, 1 Н, Н-4); 3,30 (т, 1 Н, J=7 Гц,Н-11); АВ-система (uA=3,62, uB=3,58, J=21 Гц, СН 2-22); АВ-система (uA=4,82, UB=4,78, J=19 Гц, СН 2-27); 5,12 и 5,28 (2 м, 2 Н, Н-20); 5,67 (д, 1 Н, J=8 Гц, Н-14); 6,35 (дд, 1 Н, J=11 и 18 Гц, Н-19); 7,24 и 7,42 (2 м,4 Н, arom-H). Требующийся (2-меркаптофенил)метанол получали из 2-меркаптобензойной кислоты, следуя методике получения (3-меркаптофенил)метанола, описанной в Chemistry Express, vol. 7,11, p. 865-868). 1(д, 3 Н, J=7 Гц, СН 3-17); 0,99 (с, 3 Н, СН 3-18); 1,29 (с, 3 Н, СН 3-15); 2,34 (ушир.с, 1 Н, Н-4); 3,36 (т, 1 Н, J=6 Гц, Н-11); АВ-система (uA=3,70, uB=3,59, J=26 ГЦ, СН 2-22); 4,32 (д, 2 Н, J=5 Гц, СН 2-26); 4,95 (м, 2 Н, Н 20); 5,47 (д, 1 Н, J=8 Гц, Н-14); 6,03 (дд, 1 Н, J=11 и 18 Гц, Н-19); 6,75 (д, 1 Н, J=8 Гц, Н-25); 6,98 (дд, 1 Н,J=2 и 8 Гц, Н-24); 7,11 (д, 1 Н, J=2 Гц, Н-23). Требующийся 4-гидроксиметил-2-меркаптофенол получали из 3-хлорсульфонил-4 гидроксибензойной кислоты, следуя методике получения (3-меркаптофенил)метанола, описанной в Пример 9. 14-O-[(3-Формилфенилсульфанил)ацетил]мутилин. К 2,38 г (4,75 ммоль) 14-O-[(3-гидроксиметилфенилсульфанил)ацетил]мутилина в 70 мл дихлорметана добавляли 2,02 г (4,75 ммоль) реагента Десса-Мартина (Dess-Martin). После перемешивания реакционной смеси в течение 60 мин при температуре окружающей среды реакционную смесь фильтровали,упаривали досуха при пониженном давлении и хроматографировали на силикагеле с применением смеси хлористый метилен/метанол 100:1 в качестве подвижной фазы. 1 Н-ЯМР (400 МГц, CDCl3, , м.д., характеристичные сигналы): 0,68 (д, 3 Н, J=7 Гц, СН 3-16); 0,86 (д,3 Н, J=7 Гц, СН 3-17); 1,11 (с, 3 Н, СН 3-18); 1,39 (с, 3 Н, СН 3-15); 2,06 (ушир.с, 1 Н, Н-4); 3,32 (м, 1 Н, Н-11); 3,64 (с, 2 Н, СН 2-22); 5,12 и 5,26 (2 м, 2 Н, Н-20); 5,74 (д, 1 Н, J=8 Гц, Н-14); 6,36 и 6,40 (дд, 1 Н, J=11 и 17 Гц, Н-19); 7,45 (т, 1 Н, J=8 Гц, Н-25); 7,62 (м, 1 Н, Н-26); 7,71 (м, 1 Н, Н-24); 7,85 (м, 1 Н, Н-23); 9,97 (с, 1 Н,Н-27). Следующие соединения получали аналогичным способом. Пример 10. 14-O-[(2-Формилфенилсульфанил)ацетил]мутилин. 1 Н-ЯМР (400 МГц, ДМСО-d6, , м.д., характеристичные сигналы): 0,54 (д, 3 Н, J=7 Гц, СН 3-16); 0,79 Пример 12. Гидрохлорид 14-O-[3-(аминоиминометил)гидразонометилфенилсульфанил]ацетилмутилина. К 381 мг (0,61 ммоль) 14-O-[(3-формилфенилсульфанил)ацетил]мутилина в 4 мл N,Nдиметилацетамида добавляли 83 мг (0,61 ммоль) дигидрокарбоната аминогуанидина и 0,61 мл 2 н. HCl. После перемешивания реакционной смеси в течение 12 ч при температуре окружающей среды реакционную смесь упаривали досуха при пониженном давлении и хроматографировали на силикагеле с применением смеси дихлорметан/метанол/изопропиловый эфир 4:1:1, содержащей 1% уксусной кислоты в качестве подвижной фазы. 1 Н-ЯМР (400 МГц, ДМСО-d6, , м.д., характеристичные сигналы): 0,55 (д, 3 Н, J=7 Гц, СН 3-16); 0,78 Следующие соединения получали аналогичным способом. Пример 13. Гидрохлорид 14-O-[3-[1-пиперазиноиминометил)метилгидразоно)метил]фенилсульфанил]ацетил]мутилина. 1 Н-ЯМР (500 МГц, CD3OD, , м.д., характеристичные сигналы): 0,65 (д, 3 Н, J=7 Гц, СН 3-16); 0,89 (д,3 Н, J=7 Гц, СН 3-17); 1,03 (с, 3 Н, СН 3-18); 1,37 (с, 3 Н, СН 3-15); 3,34 (с, 3 Н, N-CH3); 3,41-3,58 (м, 8 Н, NCH2); АВ-система (uA=3,78, uB=3,73, J=24 Гц, СН 2-22); 5,01 (м, 2 Н, Н-20); 5,64 (д, 1 Н, J=8 Гц, Н-14); 6,15 Пример 23. Гидрохлорид 14-O-[3-[(1-ацетилпиперазиноиминометил)гидразонометил]фенилсульфанилацетил]мутилина. 1 Н-ЯМР (400 МГц, CD3OD, , м.д., характеристичные сигналы): 0,63 (д, 3 Н, J=7 Гц, СН 3-16); 0,87 (д,3 Н, J=7 Гц, СН 3-17); 1,04 (с, 3 Н, СН 3-18); 1,34 (с, 3 Н, СН 3-15); 2,13 (с, 3 Н, СН 3-30), АВ-система (uA=3,51,uB=3,33, J=67 Гц, СН 2-22); 3,50 (т, 1 Н, J=6 Гц, Н-11); 3,55-3,69 (м, 8 Н, СН 2-28 и 29); 5,01 и 5,12 (2 м, 2 Н,Н-20); 5,65 (д, 1 Н, J=8 Гц, Н-14); 6,21 (дд, 1 Н, J=11 и 17 Гц, Н-19); 7,28 (м, 1 Н, Н-25); 7,33 и 7,48 (2 м,2 Н, Н-24 и 26); 7,74 (м, 1 Н, Н-23); 8,18 (с, 1 Н, Н-27). Требующийся 1-ацетилпиперазиноиминометилгидразин получали аналогично описанному ранее 1 формилпиперазиноиминометилгидразину (WO 9635692). Пример 24. 14-O-[(3-Ацетоксиметилфенилсульфанил)ацетил]мутилин. К раствору 1 г (2 ммоль) 14-O-[(3-гидроксиметилфенилсульфанил)ацетил]мутилина в 10 мл CH2Cl2 добавляли 351 мкл (3,2 ммоль) N-метилморфолин и 302 мкл (3,2 ммоль) уксусного ангидрида совместно с каталитическим количеством 4-диметиламинопиридина. Реакционной смеси позволили стоять в течение 16 ч при температуре окружающей среды, концентрировали при пониженном давлении и хроматографировали на силикагеле с применением смеси CH2Cl2/Ме 0 Н 100:0,5100:1 в качестве подвижной фазы. 1 Н-ЯМР (400 МГц, ДМСО-d6, , м.д., характеристичные сигналы): 0,56 (д, 3 Н, J=7 Гц, СН 3-16); 0,79 Пример 25. 14-O-[3-(2-Гидроксифенилкарбонил)гидроксиметилфенилсульфанил]ацетилмутилин. К 276 мг (2 ммоль) салициловой кислоты, суспендированной в 15 мл CH2Cl2, добавляли 122 мг (1 ммоль) 4-диметиламинопиридина, 500 мг (1 ммоль) 14-O-[(3-гидроксиметилфенилсульфанил)ацетил]мутилина и 515 мг (2,5 ммоль) дициклогексилкарбодиимида. Реакционной смеси позволили стоять в течение 24 ч при температуре окружающей среды. После концентрирования при пониженном давлении добавляли воду и этилацетат и органическую фазу промывали несколько раз водой и насыщенным солевым раствором. После концентрирования при пониженном давлении остаток хроматографировали на оксиде кремния с применением смеси CH2Cl2/MeOH 100:1 в качестве подвижной фазы. 1 Н-ЯМР (400 МГц, ДМСО-d6, , м.д., характеристичные сигналы): 0,53 (д, 3 Н, J=7 Гц, СН 3-16); 0,77 Пример 26. 14-O-[(3-Меркаптометилфенилсульфанил)ацетилмутилин. Стадия 1. 14-O-[(3-Метансульфонилоксиметилфенилсульфанил)ацетил]мутилин. К 6 г (12 ммоль) 14-O-[(3-гидроксиметилфенилсульфанил)ацетил]мутилина в 250 мл сухого ТГФ добавляли 2,17 мл (20 ммоль) N-метилморфолина и 3,0 6 г (18 ммоль) метансульфонового ангидрида совместно с каталитическим количеством 4-диметиламинопиридина. Реакционной смеси позволили стоять в течение 2 ч при температуре окружающей среды. После добавление воды смесь экстрагировали этилацетатом и затем органическую фазы промывали несколько раз водой и насыщенным солевым раствором. Органическую фазу высушивали над безводным сульфатом натрия и концентрировали при пониженном давлении. Неочищенный продукт применяли на следующей стадии без дополнительной очистки. 1 Н-ЯМР (400 МГц, CDCl3, , м.д., характеристичные сигналы): 0,68 (д, 3 Н, J=7 Гц, СН 3-16); 0,87 (д, 3 Н,J=7 Гц, СН 3-17); 1,12 (с, 3 Н, СН 3-18); 1,40 (с, 3 Н, СН 3-15); 2,08 (ушир.с, 1 Н, Н-4); 2,96 (с, 3 Н, СН 3-28); 3,34 (д, 1 Н, J=6 Гц, Н-11); 3,59 (с, 2 Н, СН 2-22); 5,15 и 5,30 (2 м, 2 Н, Н-20); 5,72 (д, 1 Н, J=8 Гц, Н-14); 6,40 Стадия 2. 14-O-[(3-Тритилсульфанилметилфенилсульфанил)ацетил]мутилин. К 118 мг (1,73 ммоль) NaOEt в 5 мл абсолютного этанола добавляли 478 мг (1,73 ммоль) трифенилметантиола в 8 мл абсолютного этанола и полученный раствор перемешивали при температуре окружающей среды. Через 45 мин добавляли 1 г (1,73 ммоль) 14-O-[(3-метансульфонилоксиметилфенилсульфанил)ацетил]мутилина в 9 мл ацетона и реакцию выдерживали при температуре окружающей среды в течение 3 ч. После концентрирования при пониженном давлении добавляли воду и этилацетат, органическую фазу промывали несколько раз водой и насыщенным солевым раствором. После концентрирования при пониженном давлении неочищенный продукт применяли на следующей стадии без дополнительной очистки. 1 Н-ЯМР (400 МГц, CDCl3, , м.д., характеристичные сигналы): 0,66 (д, 3 Н, J=7 Гц, СН 3-16); 0,85 (д,3 Н, J=7 Гц, СН 3-17); 1,07 (с, 3 Н, СН 3-18); 1,38 (с, 3 Н, СН 3-15); 2,03 (ушир.с, 1 Н, Н-4); 3,26 (с, 2 Н, СН 227); 3,29 (д, 1 Н, Н-11, J=6 Гц); 3,54 (д, 2 Н, J=8 Гц, СН 2-22); 5,09 и 5,26 (2 м, 2 Н, Н-20); 5,68 (д, 1 Н, J=8 Гц, Н-14); 6,38 (дд, 1 Н, J=11 и 18 Гц, Н-19); 6,95 и 7,20 (2 м, 2 Н, Н-24 и 26); 7,10 (м, 1 Н, Н-23); 7,13 (т,1 Н, J=7 Гц, Н-25); 7,22-7,30 (м, 15 Н, тритил-Н). смеси позволили стоять при температуре окружающей среды в течение 2 ч. После концентрирования при пониженном давлении остаток хроматографировали на силикагеле с применением смеси циклогексан/этилацетат 7:3 в качестве подвижной фазы. 1 Пример 27. 14-O-[(3-Ацетилтиометилфенилсульфанил)ацетил]мутилин. К 579 мг (1 ммоль) 14-O-[(3-Метансульфонилоксиметилфенилсульфанил)ацетил]мутилина в 100 мл ТГФ добавляли 114 мг тиоацетата калия. После перемешивания в течение 24 ч при температуре окружающей среды реакционную смесь концентрировали при пониженном давлении. Добавляли этилацетат и воду и органическую фазу промывали несколько раз водой и насыщенным солевым раствором. После концентрирования при пониженном давлении остаток хроматографировали на силикагеле с применением смеси CH2Cl2/МеОН 100:1 в качестве подвижной фазы. 1 Н-ЯМР (400 МГц, ДМСО-d6, , м.д., характеристичные сигналы): 0,55 (д, 3 Н, J=7 Гц, СН 3-16); 0,79 Пример 28. 14-O-[(3-Азидометилфенилсульфанил)ацетил]мутилин. К 1 г (1,73 ммоль) 14-O-[(3-метансульфонилоксиметилфенилсульфанил)ацетил]мутилина добавляли в 10 мл ДМФА 449 мг NaN3. Полученную суспензию перемешивали в течение 4,5 ч при 50 С и оставляли на ночь при температуре окружающей среды. Добавляли воду и этилацетат, органическую фазу промывали несколько раз водой и насыщенным солевым раствором. После концентрирования при пониженном давлении остаток хроматографировали на силикагеле с применением смеси CH2Cl2/MeOH 100:1 в качестве подвижной фазы. 1 Н-ЯМР (400 МГц, ДМСО-d6, , м.д., характеристичные сигналы): 0,56 (д, 3 Н, J=7 Гц, СН 3-16); 0,79 Пример 29. Гидрохлорид 14-O-[(3-аминометилфенилсульфанил)ацетил]мутилина. 1 г (1,9 ммоль) 14-O-[(3-азидометил)фенилсульфанилацетил]мутилина растворяли в 30 мл ТГФ, добавляли 900 мг катализатора Линдлара и реакционную смесь гидрировали в течение 6 ч. Реакционную смесь фильтровали через целит, концентрировали при пониженном давлении и остаток хроматографировали на силикагеле с применением смеси CH2Cl2/MeOH 10:1 в качестве подвижной фазы. Гидрохлорид приготовляли путем растворения 125 мг 14-O-[(3-аминометил)фенилсульфанилацетил]мутилина в 3 млCH2Cl2 и добавления 2 мл Et2O, насыщенного HCl. Через 45 мин реакционную смесь упаривали досуха при пониженном давлении. 1 Н-ЯМР (400 МГц, ДМСО-d6, , м.д., характеристичные сигналы): 0,57 (д, 3 Н, J=7 Гц, СН 3-16); 0,79 Пример 30. 14-O-[(3-Ацетиламинометилфенилсульфанил)ацетил]мутилин. К 300 мг (0,6 ммоль) 14-O-[(3-аминометил)фенилсульфанилацетил]мутилина в 3 мл CH2Cl2 добавляли 106 мкл (0,96 ммоль) N-метилморфолина, 91 мкл (0,96 ммоль) уксусного ангидрида и каталитическое количество 4-диметиламинопиридина. Полученному раствору позволили стоять в течение 5 ч при температуре окружающей среды. После упаривания досуха при пониженном давлении остаток хроматографировали на силикагеле с применением смесей CH2Cl2/MeOH 100:1100:1,2 в качестве подвижной фазы. 1 Н-ЯМР (400 МГц, ДМСО-d6, , м.д., характеристичные сигналы): 0,56 (д, 3 Н, J=7 Гц, СН 3-16); 0,79 Следующий пример проводили аналогичным способом с использованием смешанного ангидрида уксусной и муравьиной кислот. Пример 31. 14-O-[(3-Формиламинометилфенилсульфанил)ацетил]мутилин. 1 Н-ЯМР (400 МГц, ДМС 0-d6, , м.д., характеристичные сигналы): 0,57 (д, 3 Н, J=7 Гц, СН 3-16); 0,80 Пример 32. Гидрохлорид 14-O-[3-[(2-Гидроксиэтиламино)метил]фенилсульфанилацетил]мутилина. К 579 мг (1 ммоль) 14-O-[(3-метансульфонилоксиметилфенилсульфанил)ацетил]мутилина в 20 мл ТГФ добавляли 112 мг (2 ммоль) 2-аминоэтанола и реакционную смесь перемешивали при температуре окружающей среды в течение 16 ч. После концентрирования при пониженном давлении добавляли этилацетат и воду и органическую фазу промывали несколько раз водой и насыщенным солевым раствором. Органическую фазу высушивали над безводным сульфатом натрия, упаривали при пониженном давлении и остаток хроматографировали на силикагеле с применением смеси CH2Cl2/MeOH/водн. NH3 100:5:0,05 в качестве подвижной фазы.- 17019579 Гидрохлорид получали, как описано для примера 29. 1 Н-ЯМР (400 МГц, ДМСО-d6, , м.д., характеристичные сигналы): 0,57 (д, 3 Н, J=7 Гц, СН 3-16); 0,79 (д, 3 Н, J=7 Гц, СН 3-17); 0,98 (с, 3 Н, СН 3-18); 1,30 Следующие соединения получали аналогичным способом. Пример 33. Гидрохлорид 14-O-[3-[(3-аминопропиламино)метил]фенилсульфанилацетил]мутилина. 1 Н-ЯМР (400 МГц, ДМСО-d6, , м.д., характеристичные сигналы): 0,56 (д, 3 Н, J=7 Гц, СН 3-16); 0,79 Антимикробная активность новых производных плевромутилина. Антибактериальную активность выражали в виде минимальной концентрации ингибирования(MIC), определенной согласно разрешенным стандартным рекомендациям CLSI (прежняя аббревиатураNCCLS). Соединение примера 1 и другие описанные в формуле изобретения соединения проявляли очень хорошую активность в отношении по меньшей мере одного из клинически значимых бактериальных патогенов Staphylococcus aureus, Enterococcus faecalis, Streptococcus pneumoniae, Moraxella catarrhalis и Escherichia coli (см. таблицу). Эта активность in vitro была значительно лучше, чем активность соединения сравнения 2, так как значения MIC примера 1 были меньше с коэффициентом по меньшей мере 2, чемMIC для примера 2 (см. таблицу), для по крайней мере одного из штаммов таблицы. Антимикробная активность соединения примера 1 и соединения примера сравнения 2 по отношению к выбранным бактериальным болезнетворным микроорганизмам,представленная в виде минимальной концентрации ингибирования (MIC [мкг/мл]) где Т представляет собой (C1-6)моно- или диалкиламинометил,(C1-6)ацилоксиметил, бензоилоксиметил или гуанидиноиминометил либо Т представляет собой (СН 2)n-XR1,где n равно 1;X представляет собой кислород или NR2, где R2 представляет собой атом водорода или линейный или разветвленный (С 1-6)алкил либо гидрокси(C1-6)алкил или (C1-6)алкокси(C1-6)алкил;R1 представляет собой атом водорода, линейный или разветвленный (C1-6)алкил, моно- или дигалогенированный (C1-6)алкил, амино(C1-6)алкил, гидрокси(C1-6)алкил, фенил(C1-6)алкил, (C1-6)алкенил, фуранил(C1-6)алкил, (С 3-6)циклоалкил илиXR1 представляет собой пиперазинил или морфолинил. 2. Соединение по п.1, где Т представляет собой (C1-6)моно- или диалкиламино(C1-6)алкил либо гуанидиноимино(C1-6)алкил. 3. Соединение по любому из пп.1 и 2, где Т представляет собой (СН 2)n-XR1, в котором упомянутая(СН 2)n-группа находится в мета-положении по отношению к атому серы, присоединенному к фенильному кольцу. 4. Соединение по п.3, которое представляет собой 14-O-[(3-гидроксиметилфенилсульфанил)ацетил]мутилин формулы 12. Соединение по любому из пп.1-3, выбранное из следующих соединений: 14-O-[(3-гидроксиметилфенилсульфанил)ацетил]мутилин,14-O-[(5-гидроксиметил-2-фторфенилсульфанил)ацетил]мутилин,14-O-[(2-гидроксиметил-4-фторфенилсульфанил)ацетил]мутилин,14-O-[(4-гидроксиметилфенилсульфанил)ацетил]мутилин,14-O-[(2-гидроксиметилфенилсульфанил)ацетил]мутилин,14-O-[(2-гидрокси-5-гидроксиметилфенилсульфанил)ацетил]мутилин,14-O-[3-(аминоиминометил)гидразонометилфенилсульфанил]ацетилмутилин, необязательно в форме гидрохлорида,14-O-[3-[1-пиперазиноиминометил)метилгидразоно)метил]фенилсульфанилацетил]мутилин,необязательно в форме гидрохлорида,14-O-[3-[(3-этил-(2-этилимино)имидазолидин-1-илимино)метил]фенилсульфанилацетил]мутилин,необязательно в форме гидрохлорида,14-O-[3-[(1-пиперазиноиминометил)гидразонометил]фенилсульфанилацетил]мутилин, необязательно в форме гидрохлорида,14-O-[3-[(2-морфолин-4-илэтоксиимино)метил]фенилсульфанилацетил]мутилин, необязательно в форме гидрохлорида,14-O-[3-[(2-пирролидин-1-илэтоксиимино)метил]фенилсульфанилацетил]мутилин, необязательно в форме гидрохлорида,14-O-[4-[(1-пиперазиноиминометил)гидразонометилфенилсульфанилацетил]мутилин, необязательно в форме гидрохлорида,14-O-[2-[(аминоиминометил)гидразонометил]фенилсульфанилацетил]мутилин, необязательно в форме гидрохлорида,14-O-[4-[(аминоиминометил)гидразонометил]фенилсульфанилацетил]мутилин, необязательно в форме гидрохлорида,14-O-[4-[(1-пиперазиноиминометил)гидразонометил]фенилсульфанилацетил]мутилин, необязательно в форме гидрохлорида,14-O-[4-[(1-пиперазиноиминометил)метилгидразонометил]фенилсульфанилацетил]мутилин в форме гидрохлорида,14-O-[3-[(1-ацетилпиперазиноиминометил)гидразонометил]фенилсульфанилацетил]мутилин, необязательно в форме гидрохлорида,14-O-[(3-ацетоксиметилфенилсульфанил)ацетил]мутилин,14-O-[3-(2-гидроксифенилкарбонил)гидроксиметилфенилсульфанил]ацетилмутилин,14-O-[(3-меркаптометилфенилсульфанил)ацетилмутилин,14-O-[(3-ацетилтиометилфенилсульфанил)ацетил]мутилин,14-O-[(3-аминометилфенилсульфанил)ацетил]мутилин, необязательно в форме гидрохлорида,14-O-[(3-ацетиламинометилфенилсульфанил)ацетил]мутилин,14-O-[(3-формиламинометилфенилсульфанил)ацетил]мутилин,14-O-[3-[(2-гидроксиэтиламино)метил]фенилсульфанилацетил]мутилин, необязательно в форме гидрохлорида,14-O-[3-[(3-аминопропиламино)метил]фенилсульфанилацетил]мутилин, необязательно в форме гидрохлорида,14-O-[(3-[3-(3-аминопропиламино)пропиламино]метилфенилсульфанил)ацетил]мутилин, необязательно в форме гидрохлорида,14-O-[3-[(2,2-дифторэтиламино)метил]фенилсульфанилацетил]мутилин, необязательно в форме гидрохлорида,14-O-[(3-бензиламинометилфенилсульфанил)ацетил]мутилин, необязательно в форме гидрохлори- 24019579 да,14-O-[(3-аллиламинометилфенилсульфанил)ацетил]мутилин, необязательно в форме гидрохлорида,14-O-[3-(2-метоксиэтиламино)метилфенилсульфанил]ацетилмутилин, необязательно в форме гидрохлорида,14-O-[(3-[2-(2-аминоэтиламино)этиламино]метилфенилсульфанил)ацетил]мутилин, необязательно в форме гидрохлорида,14-O-[3-[(фуран-2-илметил)амино]метилфенилсульфанилацетил]мутилина, необязательно в форме гидрохлорида,14-O-[(3-метиламинометилфенилсульфанил)ацетил]мутилин, необязательно в форме гидрохлорида,14-O-[(3-циклопропиламинометилфенилсульфанил)ацетил]мутилин, необязательно в форме гидрохлорида,14-O-[(3-морфолин-4-илметилфенилсульфанил)ацетил]мутилин, необязательно в форме гидрохлорида,14-O-[(3-пиперазин-1-илметилфенилсульфанил)ацетил]мутилин, необязательно в форме гидрохлорида,14-О-3-[(2-диметиламиноэтиламино)метил]фенилсульфанилацетилмутилин, необязательно в форме гидрохлорида,14-О-3-[(2-аминоэтиламино)метил]фенилсульфанилацетил]мутилин, необязательно в форме гидрохлорида,14-O-[(3-[бис-(2-гидроксиэтил)амино]метилфенилсульфанил)ацетил]мутилин,14-O-[(3-диметиламинометилфенилсульфанил)ацетил]мутилин, необязательно в форме гидрохлорида. 13. Соединение по любому из пп.1-12 в форме соли. 14. Применение соединения по любому из пп.1-13 в качестве фармацевтического препарата. 15. Способ лечения заболеваний, опосредованных бактериями, который включает в себя введение нуждающемуся в таком лечении эффективного количества соединения по любому из пп.1-13. 16. Применение соединения по любому из пп.1-13 для лечения заболеваний, опосредованных бактериями. 17. Применение соединения по любому из пп.1-13 для производства медикамента для лечения заболеваний, опосредованных бактериями. 18. Фармацевтическая композиция, включающая соединение по любому из пп.1-13 и включающая по меньшей мере один фармацевтический наполнитель. 19. Фармацевтическая композиция по п.18, дополнительно включающая другой фармацевтически активный агент. 20. Применение соединения по любому из пп.1-13 в производстве медикамента для лечения прыщей.
МПК / Метки
МПК: A61K 31/495, C07D 295/215, C07C 323/52, A61K 31/22, A61K 31/4168, C07D 295/20
Метки: препаратов, применение, производные, мутилина, фармацевтических, качестве
Код ссылки
<a href="https://eas.patents.su/26-19579-proizvodnye-mutilina-i-ih-primenenie-v-kachestve-farmacevticheskih-preparatov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные мутилина и их применение в качестве фармацевтических препаратов</a>
Предыдущий патент: Выделенная молекула нуклеиновой кислоты и ее применение
Следующий патент: Способ борьбы с сорняками в культурах полезных растений
Случайный патент: Электрические кабели