Оптически активные карбаматы, способ их получения и их применение в качестве фармацевтических промежуточных соединений
Номер патента: 15801
Опубликовано: 30.12.2011
Авторы: Симиг Дьюла, Лукач Дьюла, Надь Калман, Мезеи Тибор, Мольнар Эникё, Тринка Петер, Катона Зольтан, Эвингер Жужанна, Понго Ласло, Порч-Маккаи Марта, Барта Ференц, Верецкеине Донат Дьёрдьи
Формула / Реферат
1. Способ получения 1-[(4-хлорфенил)метилфенил]пиперазина формулы (I)
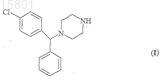
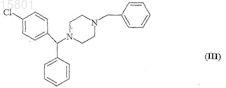
его энантиомеров и солей, при котором подвергают реакции 1-[(4-хлорфенил)фенилметил]-4-бензилпиперазин формулы (III)
или его энантиомер с 2,2,2-трихлорэтилхлорформиатом формулы (X)
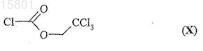
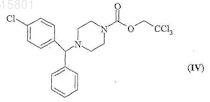
и превращают получающийся таким образом 1-[(4-хлорфенил)фенилметил]-4-(2,2,2-трихлорэтоксикарбонил)пиперазин формулы (IV)
в 1-[(4-хлорфенил)метилфенил]пиперазин формулы (I).
2. Способ получения 1-[(4-хлорфенил)фенилметил]-4-(2,2,2-трихлорэтоксикарбонил)пиперазина формулы (IV), его энантиомеров и солей, при котором подвергают реакции 1-[(4-хлорфенил)фенилметил]-4-бензилпиперазин формулы (III) или его энантиомер с 2,2,2-трихлорэтилхлорформиатом формулы (X) и необязательно превращают получающийся таким образом 1-[(4-хлорфенил)фенилметил]-4-(2,2,2-трихлорэтоксикарбонил)пиперазин формулы (IV) в его соль присоединения кислоты.
3. 1-[(4-Хлорфенил)фенилметил]-4-(2,2,2-трихлорэтоксикарбонил)пиперазин формулы (IV), его энантиомеры и соли присоединения кислоты.
4. Способ по любому из пп.1, 2, где 1-[(4-хлорфенил)фенилметил]-4-бензилпиперазин формулы (III) подвергают реакции с 1,0-1,2 мол.экв., предпочтительно 1,05 мол.экв. 2,2,2-трихлорэтилформиата формулы (X).
5. Способ по любому из пп.1, 2 или 4, где указанную реакцию 1-[(4-хлорфенил)фенилметил]-4-бензилпиперазина формулы (III) и 2,2,2-трихлорэтилхлорформиата формулы (X) осуществляют в присутствии неорганического или органического основания, представляющего собой реагент, связывающий кислоту.
6. Способ по п.5, где в качестве реагента, связывающего кислоту, используют гидрокарбонат или карбонат щелочного или щелочно-земельного металла, триэтиламин, трибутиламин или пиридин.
7. Способ по любому из пп.1, 2, 4-6, где реакцию 1-[(4-хлорфенил)фенилметил]-4-бензилпиперазина формулы (III) и 2,2,2-трихлорэтилхлорформиата формулы (X) осуществляют в растворителе, выбранном из ароматического, апротонного или простого эфирного растворителя.
8. Способ по п.7, где растворитель выбирают из бензола, толуола, N,N-диметилформамида, диметилсульфоксида, диизопропилового эфира, диэтилового эфира, диоксана или тетрагидрофурана.
9. Способ по любому из пп.1, 2 или 4-8, где реакцию осуществляют при температуре от -20 до 40°С, предпочтительно от 15 до 20°С.
10. Способ по п.1, где превращение 1-[(4-хлорфенил)фенилметил]-4-(2,2,2-трихлорэтоксикарбонил)пиперазина формулы (IV) в 1-[(4-хлорфенил)метилфенил]пиперазин формулы (I) осуществляют путем восстановления.
11. Способ по п.10, где восстановление осуществляют при помощи цинка в кислом растворе.
12. Способ по п.11, где используют от 1 до 5, предпочтительно от 1,5 до 2,5 мол.экв. цинка.
13. Способ по любому из пп.1, 10-12, где при превращении 1-[(4-хлорфенил)фенилметил]-4-(2,2,2-трихлорэтоксикарбонил)пиперазина формулы (IV) в 1-[(4-хлорфенил)метилфенил]пиперазин формулы (I) используют растворитель, выбранный из воды, водного раствора кислоты, предпочтительно раствора уксусной кислоты или соляной кислоты необязательно в смеси с ароматическим углеводородом, предпочтительно толуолом.
14. Способ по любому из пп.1, 10-13, где превращение 1-[(4-хлорфенил)фенилметил]-4-(2,2,2-трихлорэтоксикарбонил)пиперазина формулы (IV) в 1-[(4-хлорфенил)метилфенил]пиперазин формулы (I) осуществляют при температуре от 0 до 50°С, предпочтительно от 20 до 25°С.
15. Способ по п.1, при котором после превращения 1-[(4-хлорфенил)фенилметил]-4-(2,2,2-трихлорэтоксикарбонил)пиперазина формулы (IV) в 1-[(4-хлорфенил)метилфенил]пиперазин формулы (I) дополнительно добавляют фумаровую кислоту и соединение формулы (I) выделяют в виде соли фумарата формулы (XI).
16. Способ по п.1 или 2, где используют (R)-(+)-1-[(4-хлорфенил)фенилметил]-4-бензилпиперазин формулы (III).
17. Способ по п.10, где используют (R)-(+)-1-[(4-хлорфенил)фенилметил]-4-(2,2,2-трихлорэтоксикарбонил)пиперазин формулы (IV).
Текст
ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ЕВРАЗИЙСКОМУ ПАТЕНТУ Дата публикации и выдачи патента ОПТИЧЕСКИ АКТИВНЫЕ КАРБАМАТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ФАРМАЦЕВТИЧЕСКИХ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ Настоящее изобретение относится к 1-[(4-хлорфенил)фенилметил]-4-(2,2,2 трихлорэтоксикарбонил)пиперазину формулы(IV) при получении 1-(4-хлорфенил)фенилметилпиперазина и его оптических изомеров и солей. 1-(4-Хлорфенил)фенилметилпиперазин и его оптические изомеры представляют собой важные промежуточные соединения при получении неседативных активных фармацевтических ингредиентов антигистаминового типа.(71)(73) Заявитель и патентовладелец: ЭГИШ ДЬДЬСЕРДЬЯР НЬИЛЬВАНОШАН МЮКЕДЕ РЕСВЕНЬТАРШАШАГ (HU) 015801 Область изобретения Настоящее изобретение относится к 1-[(4-хлорфенил)фенилметил]-4-(2,2,2-трихлоркарбэтокси)пиперазину формулы (IV) и его оптическим изомерам, способам их получения и применению 1-[(4-хлорфенил)фенилметил]-4(2,2,2-трихлоркарбэтокси)пиперазина формулы (IV) при получении 1-(4-хлорфенил)фенилметилпиперазина формулы (I) и его оптических изомеров и солей. 1-(4-Хлорфенил)фенилметилпиперазин формулы (I) и его оптические изомеры представляют собой важные фармацевтические промежуточные соединения при получении неседативных активных фармацевтических ингредиентов антигистаминового типа. Предшествующий уровень техники 1-(4-Хлорфенил)фенилметилпиперазин формулы (I) представляет собой важное промежуточное соединение при получении активного фармацевтического ингредиента, известного под международным непатентованным названием цетиризин. Цетиризин,химически являющийся 2-[4-(4 хлорфенил)фенилметил-1-пиперазинил]этоксиуксусной кислотой, представляет собой неседативный активный ингредиент антигистаминового типа, подходящий для лечения аллергии. Действие цетиризина основано на его избирательном взаимодействии с гистаминовыми рецепторами Н 1, ингибирующими высвобождение гистамина. Цетиризин представляет собой рацемическое соединение, которое само по себе пригодно для терапии. Из уровня техники известно, что введение левовращающего энантиомера (-)-цетиризина является фармакологически благоприятным, поскольку при введении (-)-цетиризина обнаруживают меньше побочных действий. (-)-Цетиризин представляет собой индивидуальный активный фармацевтический ингредиент, известный под международным непатентованным названием левоцетиризин. Существует несколько подходов, известных в области техники, для синтеза оптически активных соединений. В соответствии с одним из этих подходов получают рацемический конечный продукт и оптически чистый энантиомер получают на конечной стадии путем расщепления рацемата. В соответствии со вторым подходом оптически активное промежуточное соединение получают на ранней стадии способа синтеза и затем разрабатывают путь синтеза, который обеспечивает сохранение конфигурации желаемого оптического центра и предотвращает его рацемизацию. Ввиду экономических причин желательно осуществлять разделение оптических изомеров на ранней стадии способа синтеза. Ценность веществ, используемых на ранней стадии синтеза, как правило, меньше, чем ценность промежуточных соединений, используемых на более поздних стадиях. Этот подход обычно приводит в результате также к преимуществам для окружающей среды, поскольку побочные продукты ранних стадий синтеза могут быть легче утилизированы или переработаны по сравнению с полученными на более поздних стадиях. В соответствии с общим приемлемым способом в области синтеза оптически активных химических соединений предпочтительны пути синтеза, которые дают возможность для применения ранее разделенного промежуточного соединения, известного в области техники, или, альтернативно, процесс разделения оптических изомеров обеспечивает хороший выход, или предполагаемое оптически активное промежуточное соединение имеется в продаже. В соответствии с уровнем техники известны три способа получения оптически активных форм 1-(4-хлорфенил)фенилметилпиперазина формулы (I). В соответствии со способом, раскрытым в патенте Великобритании 2225321, рацемический 1-(4-хлорфенил)фенилметилпиперазин расщепляли с использованием 2 мол.экв. (R)-винной кислоты и соль тартрат, обладающую неудовлетворительной оптической чистотой, полученную после трех перекристаллизаций, нейтрализовали. Полученное таким образом основание трижды перекристаллизовывали-1 015801 из гексана. Способ позволял получить (R)-(-)-1-(4-хлорфенил)фенилметилпиперазин с выходом 6,3%. Этот способ не подходит для применения в фармацевтической промышленности, поскольку ни чистота ни одного из продуктов, ни выход не являются удовлетворительными. Аналогично вышеописанному способу общий способ разделения оптических изомеров включает приготовление диастереоизомерных солей с использованием оптически активной кислоты, которая представляет собой так называемую разделяющую кислоту. Физические свойства полученных таким образом диастереоизомерных солей (т.е. температура плавления, растворимость и т.д.), полученных из двух оптических изомеров основного соединения, отличаются друг от друга. Как правило, различие в физических свойствах между двумя оптическими изомерами оптически активного основания является значимым, если оптический центр оптически активного основания стерически близко расположен к основному атому азота, который участвует в образовании соли. Разделение оптических изомеров 1-(4-хлорфенил)фенилметилпиперазина формулы (I) представляет собой сложную проблему, поскольку 1-(4-хлорфенил)фенилметилпиперазин формулы (I) содержит два основных атома азота. Хотя один из указанных атомов азота стерически близко расположен к оптическому центру, этот атом азота стерически блокирован, таким образом, образование соли в этом атоме азота затруднено. Атом азота, находящийся на расстоянии от оптического центра, в позиции 4 гораздо легче претерпевает образование соли. Кроме того, разделение такого соединения осложняется тем, что ввиду присутствия двух основных атомов азота для образования соли должны быть использованы 2 мол.экв. расщепляющей кислоты. Поскольку оптические изомеры рацемического 1-(4-хлорфенил)фенилметилпиперазина формулы (I) не могут быть разделены с хорошим выходом из-за двух основных атомов азота, разработали еще один способ. В Европейской заявке на патент 1236722 рацемический 1-(4-хлорфенил)фенилметилпиперазин формулы (I) ацилировали в позиции 4 и третичное бутоксикарбонилированное производное формулы (V) разделяли. Ацилирование в позиции 4 привело в результате к тому, что в молекуле присутствует один основный атом азота, поэтому количество расщепляющей кислоты может быть уменьшено до 1 мол.экв. Образование соли вслед за ацилированием осуществляется в позиции, стерически близкой оптическому центру, таким образом, эффективность разделения может быть увеличена. Бутоксикарбонильное производное формулы (V) расщепляли с использованием D-(+)-O,Oдибензоилвинной кислоты в качестве расщепляющей кислоты и первичный продукт получали с энантиомерной чистотой 78%. Затем защитную группу удаляли путем гидролиза и основание несколько раз перекристаллизовывали. Недостаток вышеупомянутого способа заключается в том, что введение и гидролитическое удаление защитной группы является дорогостоящим и выход составляет лишь приблизительно 30% из расчета на основе количества рацемического 1-(4-хлорфенил)фенилметилпиперазина формулы (I). Из уровня техники известно, что могут быть использованы только те защитные группы на атоме азота в позиции 4 пиперазинового кольца 1-(4-хлорфенил)фенилметилпиперазина формулы (I), которые могут быть удалены в мягких условиях при низкой температуре в неводном растворе без рацемизации оптического центра. В соответствии с опытом авторов изобретения оптически активный 1-(4-хлорфенил)фенилметилпиперазин формулы (I) медленно превращается в соответствующее рацемическое соединение в кислом или основном растворе даже при комнатной температуре. Рацемизация осуществляется быстро в водном растворе щелочи, поэтому защитные группы, которые удаляются щелочным гидролизом, т.е. ацетильная или этоксикарбонильная группа, не могут быть использованы без существенной рацемизации. В соответствии со способом, раскрытым в Европейском патенте 617028, оптический центр получают на ранней фазе синтеза. (R)-(-)-1-(4-Хлорфенил)фенилметиламин формулы (VI) используют в качестве исходного вещества. Указанное соединение формулы (VI) может быть получено в соответствии со способом Ингольда и Вилсона с использованием камфорсульфоновой кислоты (J. Chem. Soc. 1933, 1493) или с использованием способа Клемо и Гаднера в водном растворе с (+)-винной кислотой (J. Chem. Soc. 1939, 1958). Синтез пиперазинового кольца 1-(4-хлорфенил)фенилметилпиперазина формулы (I) осуществляют при помощи реакции циклизации. Для этой реакции используют N-замещенные производные поскольку использование N,N-бис-(2-хлорэтил)амина сопровождается побочными реакциями и образованием смолы. Во время синтеза получают оптически активный 1-[(4-хлорфенил)фенилметил]-4-[паратолуолсульфонил]пиперазин формулы (II) путем реакции оптически активного (4-хлорфенил)фенилметиламина формулы (VI) и N,N-бис-(2 хлорэтил)-4-метилбензолсульфонамида формулы (VII), которую осуществляют путем кипячения реагентов в N,N-диизопропилэтиламиновом растворителе при температуре 127 С в течение 4 ч. Продукт кристаллизуют и паратолуолсульфонильную группу удаляют с использованием 30% бромида водорода в растворителе уксусной кислоты путем перемешивания в течение 24 ч. В жестких условиях реакции для предотвращения рацемизации используют 4 мол.экв. 4-гидроксибензойной кислоты. Тем не менее, путем добавления 4-гидроксибензойной кислоты способ приводит в результате к продукту с примесями. Продукт получают с выходом приблизительно 85%. Неочищенный продукт дополнительно очищают путем перекристаллизации. В соответствии с различными авторами (Oplatka, C.J. et al., Synthesis, 1995, 766) с использованием вышеупомянутого способа оптически чистый 1-(4-хлорфенил)фенилметилпиперазин формулы (I) может быть получен с выходом 59%. Недостаток вышеупомянутого способа заключается в том, что для гидролиза толуолсульфонильной группы требуются жесткие условия реакции. При таких условиях происходит рацемизация, которой можно избежать с использованием только дополнительных добавок. Использование таких добавок составляет дополнительные затраты, и указанные добавки могут загрязнять продукт. В области органической химии для защиты атомов азота часто используют бензильную группу. Бензильная группа может быть удалена путем каталитического гидрирования с использованием катализатора палладий на углероде при температуре от 25 до 80 С или с использованием платинового катализатора или ренеевского никеля при более высокой температуре и при более высоком давлении водорода. Путем реакции N,N-(бис-хлорэтил)бензиламина формулы (VIII) с 1-(4-хлорметил)метилфениламином формулы Тем не менее, бензильная группа не может быть избирательно удалена из 1-[(4-хлорфенил)фенилметил]-4-бензилпиперазина формулы (III) путем каталитического гидрирования с использованием катализатора палладий на углероде, поскольку N-(4-хлорбензгидрильная) группировка элиминируется быстрее, чем бензильная группа. В соответствии с описанием патента США 2709169 удаление N-бензильной группы рацемического 1-[(4-хлорфенил)фенилметил]-4-бензилпиперазина формулы (III) может быть осуществлено с выходом 75% с использованием катализатора ренеевского никеля. Реакцию осуществляли при температуре 150 С и давлении 100 бар (100105 Па). Тем не менее, когда начинают с оптически активного бензилпиперазинового производного, общая рацемизация происходит при этой высокой температуре, таким образом, вышеупомянутый способ не подходит для получения 1-[(4-хлорфенил)фенилметил]пиперазина формулы (I) в оптически активной форме.-3 015801 В случае, когда соединение бис-(2-хлорэтил)амин, защищенный более легко удаляемой 2,2,2-трихлорэтоксигруппой в позиции 4, соответствующее формуле (IX) и 1-(4-хлорфенил)метилфениламин формулы (VI) непосредственно вступают в реакцию, выход желаемого замещенного пиперазинового производного формулы (IV) является низким, поскольку в условиях циклизации при температуре 100 С в присутствии реагента, связывающего кислоту, почти полностью удаляют 2,2,2-трихлорэтоксикарбонильную группу. Краткое изложение сущности изобретения Задача научно-исследовательской работы авторов настоящего изобретения заключалась в разработке способа для получения оптически активных форм 1-(4-хлорфенил)метилфенилпиперазина формулы(I) с хорошим выходом и с высокой оптической и химической чистотой экономичным образом. Вышеуказанную задачу решают при помощи способа по настоящему изобретению. Весьма неожиданно обнаружили,что 1-[(4-хлорфенил)фенилметил]-4-бензилпиперазин формулы (III) может вступать в реакцию в мягких условиях при комнатной температуре с 2,2,2-трихлорэтилхлорформиатом формулы (X) приводя в результате к образованию 1-[(4-хлорфенил)фенилметил]-4-(2,2,2-трихлорэтоксикарбонил)пиперазина формулы (IV) в течение нескольких часов. Хотя в области техники существует несколько примеров превращения N-бензильной группы алифатических аминов в соответствующий карбамат путем реакции указанных аминов со сложными эфирами хлоркарбоновой кислоты, химическая литература умалчивает о превращении замещенных пиперазиновых производных в карбаматы. Литература также умалчивает о замене бензильной группы на алкоксикарбонильную группу. Весьма неожиданно, что в этой реакции отщепление 4-хлорбензгидрильной группы происходит в гораздо меньшей степени и продукт побочной реакции осаждается из реакционной смеси и может быть легко удален. С использованием оптически активного 1-(4-хлорфенил)метилфениламина формулы (VI) в качестве исходного вещества не происходит рацемизация во время получения 1[(4-хлорфенил)фенилметил]-4-бензилпиперазина формулы (III) или во время получения 1-[(4-хлорфенил)фенилметил]-4-(2,2,2-трихлорэтоксикарбонил)пиперазина формулы (IV). Полученный таким образом продукт 1-[(4-хлорфенил)фенилметил]-4-(2,2,2-трихлорэтоксикарбонил)пиперазин формулы (IV) может быть превращен в 1-[(4-хлорфенил)фенилметил])пиперазин формулы (I) без опасности для рацемизации путем удаления защитной 2,2,2-трихлорэтоксикарбонильной группы, которое осуществляют путем обработки соединения формулы (IV) цинком и уксусной кислотой в безводной среде в толуольном растворителе. После удаления защиты 1-[(4-хлорфенил)фенилметил])пиперазин формулы (I) выделяют в форме соли фумарата формулы (XI) Фумарат 1-[(4-хлорфенил)фенилметил]пиперазина формулы (XI) является новым. Подробное описание изобретения В соответствии с первым аспектом настоящего изобретения предложен способ получения рацемической и оптически активных форм 1-(4-хлорфенил)фенилметилпиперазина формулы (I),включающий реакцию рацемической или соответствующей оптически активной формы 1-(4-хлорфенил)метилфениламина формулы (VI) с N,N-(бис-2-хлорэтил)бензиламином формулы (VIII) и превращение продукта рацемического или оптически активного 1-(4-хлорфенил)фенилметил-4 бензилпиперазина формулы (III) в 1-(4-хлорфенил)фенилметил-4-(2,2,2-трихлорэтоксикарбонил)пиперазин формулы (IV) путем обработки соединения формулы (III) 2,2,2-трихлорэтоксихлорформиатом, удаления защитной группы и выделения продукта 1-(4-хлорфенил)фенилметилпиперазина формулы (I) в форме его соли фумарата. Фумарат 1-(4-хлорфенил)фенилметилпиперазина(1:1) формулы (XI) является новым. В настоящем описании под выражением "соли присоединения кислоты" понимают соли интересующего соединения, образуемые с органическими или неорганическими кислотами. Кислоты, подходящие для образования соли, включают неорганические кислоты, такие как соляная кислота, бромид водорода, фосфорная кислота, азотная кислота и серная кислота; и органические кислоты, например муравьиная кислота, уксусная кислота, пропионовая кислота, малеиновая кислота, фумаровая кислота, янтарная кислота, молочная кислота, яблочная кислота, винная кислота, лимонная кислота, аскорбиновая кислота,-4 015801 малоновая кислота, щавелевая кислота, миндальная кислота, пикриновая кислота, гликолевая кислота,фталевая кислота, бензолсульфоновая кислота, паратолуолсульфоновая кислота, нафталинсульфоновая кислота или метансульфоновая кислота. Карбонаты, гидрокарбонаты, сульфиды, гидросульфиты и сульфиты также рассматривают как соли присоединения кислоты, образованные с неорганической кислотой. В соответствии с еще одним аспектом настоящего изобретения предложены оптически активные формы 1-[(4-хлорфенил)фенилметил]-4-бензилпиперазина формулы (III) и их соли присоединения кислоты. В соответствии с еще одним аспектом настоящего изобретения предложен способ получения оптически активных форм 1-[(4-хлорфенил)фенилметил]-4-бензилпиперазина формулы (III) и его солей присоединения кислоты. Энантиомеры соединения формулы (III) получают путем реакции оптически активной формы (4-хлорфенил)фенилметиламина формулы (VI) с N,N-бис-(2-хлорэтил)бензиламином формулы (VIII).(4-Хлорфенил)фенилметиламин формулы (VI) может быть использован в виде свободного основания или в виде гидрохлорида. N,N-бис-(2-Хлорэтил)бензиламин формулы (VIII) используют в 1,0-1,5 кратном, предпочтительно 1,1-кратном мольном количестве, рассчитанном на основе количества соединения формулы (VI). Агенты, связывающие кислоту, подходящие для применения в реакции, включают неорганические основания, например карбонаты или гидрокарбонаты щелочного металла или щелочно-земельного металла, или органические основания, например пиридин или трибутиламин. Агент, связывающий кислоту, используют в реакции в 3-5-кратном мольном количестве, рассчитанном на основе количестваN,N-бис-(2-хлорэтил)бензиламина формулы (VIII). В случае, когда (4-хлорфенил)фенилметиламин формулы (VI) используют в форме соли, количество агента, связывающего кислоту, увеличивается с количеством, необходимым для нейтрализации. Реакцию предпочтительно осуществляют в высококипящем инертном растворителе, например в метил- или этилцеллюлозе, этиленгликоле, 1-бутаноле, изобутаноле, циклогексаноле; или в биполярном апротонном растворителе, например в N,N-диметилформамиде, диметилсульфоксиде. Реакция также может быть осуществлена в высококипящем эфирном растворителе, например диизобутиловом эфире,диоксане или в ароматическом растворителе, например толуоле. Скорость реакции может быть увеличена с использованием катализаторов. Подходящий тип катализаторов включает галогениды щелочного металла и катализаторы фазового переноса. В качестве галогенида щелочного металла может быть использован йодид или бромид натрия или калия, в качестве катализатора фазового переноса могут быть использованы галогениды четвертичного бутиламмония. Реакцию осуществляют при температуре от 80 до 140 С, предпочтительно при температуре от 100 до 110 С. Время реакции в зависимости от температуры реакции приблизительно составляет от 1 до 8 ч,предпочтительно от 2 до 4 ч. В соответствии с еще одним аспектом настоящего изобретения предложен 1-[(4-хлорфенил)фенилметил]-4-[(2,2,2-трихлорэтил)оксикарбонил]пиперазин формулы (IV), его рацемическая и оптически активные формы и его соли присоединения кислоты. Еще один аспект настоящего изобретения относится к способу получения 1-[(4-хлорфенил)фенилметил]-4-[(2,2,2-трихлорэтил)оксикарбонил]пиперазина формулы (IV), включающему реакцию 1-[(4-хлорфенил)фенилметил]-4-бензилпиперазина формулы (III) с 2,2,2-трихлорэтилхлорформиатом формулы (V). Реакция может быть осуществлена, начиная с рацемической или оптически активной формы, по существу содержащей единичный энантиомер 1-[(4-хлорфенил)фенилметил]-4-бензилпиперазина формулы (III), где получают рацемический или оптически активный продукт. В реакции свободное основание 1-[(4-хлорфенил)фенилметил]-4-бензилпиперазина формулы (III) вступает в реакцию предпочтительно с 1,0-1,2 мольными эквивалентами 2,2,2-трихлорэтилхлорформиата формулы (V). Предпочтительно на каждый моль соединения формулы (III) используют 1,05 моль соединения формулы (V). Не обязательно во время реакции использовать агент, связывающий кислоту, поскольку продукт формулы (IV) образует соль с соляной кислотой, образующейся в реакции; тем не менее, если желательно, может быть использован агент, связывающий кислоту. Соединения, пригодные в качестве агентов,связывающих кислоту, могут быть выбраны из неорганических оснований, например карбоната натрия,карбоната калия, или из органических оснований, например пиридина, трибутиламина или триэтиламина. Реакцию осуществляют в инертном растворителе, предпочтительно ароматического типа, например толуола, бензола. Также могут быть использованы биполярные апротонные или эфирные растворители,например N,N-диметилформамид, диметилсульфоксид, диизобутиловый эфир, диэтиловый эфир, тетрагидрофуран или диоксан.-5 015801 В реакции 1-[(4-хлорфенил)фенилметил]-4-бензилпиперазина формулы (III) и 2,2,2-трихлорэтилхлорформиата формулы (V) образуется побочный продукт 1-бензил-4-(2,2,2-трихлорэтоксикарбонил)пиперазин формулы (XII) в реакции ацилирования 1-(4-хлорбензгидрильной) группы соединения формулы (IV) в количестве от 5 до 25 мас.%. Соль гидрохлорид соединения формулы (XII) кристаллизуется из ароматического растворителя во время реакции и может быть легко и полностью удалена Реакцию осуществляют при температуре от -20 до 40 С, предпочтительно при температуре от 15 до 20 С. Время реакции в зависимости от растворителя и температуры обычно составляет от 1 до 4 ч. В соответствии с еще одним аспектом настоящего изобретения предложен способ получения 1-[(4-хлорфенил)фенилметил]пиперазина формулы (I) и его соли фумарата, включающий удаление трихлорэтоксикарбонильной защитной группы у 1-[(4-хлорфенил)фенилметил]-4-[(2,2,2 трихлорэтил)оксикарбонил]пиперазина формулы (IV) путем восстановления, которое включает обработку указанного соединения цинком и кислотой. Цинк в реакции используют в количестве от 1 до 5 мол.экв., предпочтительно от 1,5 до 2,5 мол.экв.,рассчитанных на основе мольного количества соединения формулы (IV). 1-[(4-Хлорфенил)фенилметил]-4-[(2,2,2-трихлорэтил)оксикарбонил]пиперазин формулы (IV) может быть использован в виде свободного основания или в форме его соли гидрохлорида. Как правило, предпочтительно применение соли гидрохлорида соединения формулы (IV). Реакцию осуществляют в растворителе, выбранном из воды, водного раствора соляной кислоты или водного раствора уксусной кислоты, или из органических растворителей, т.е. простых эфиров, или ароматических растворителей, или смесей вышеуказанных. Температура реакции составляет от 0 до 50 С, предпочтительно температура составляет от 20 до 25 С. Время реакции составляет несколько часов. Во время любого из вышеупомянутых способов может быть использована рацемическая или оптически активные формы исходного вещества. Следовательно, в качестве продукта получают соответствующие рацемически или оптически активные промежуточные соединения. В соответствии с предпочтительным воплощением способа оптически активный 1-[(4-хлорфенил)фенилметил]-4-бензилпиперазин формулы (III) превращают в оптически активный 1-[(4-хлорфенил)фенилметил]пиперазин формулы (I) или его соль фумарат без выделения промежуточного соединения 1-[(4-хлорфенил)фенилметил]-4-(2,2,2-трихлорэтил)пиперазина формулы (IV) в так называемом "однореакторном" способе. Дополнительные детали изобретения раскрыты в следующих примерах без ограничения объема изобретения указанными примерами. Пример 1. Дигидрохлорид (R)-(+)-1-(4-хлорфенил)фенилметил-4-бензилпиперазина [соединение формулы(III)]. К 200 мл н-бутанола при перемешивании добавляют 21,8 г (0,10 моль) (R)-(-)-(4 хлорфенил)фенилметиламина, 33,6 г (0,40 моль) гидрокарбоната натрия, 25,6 г (0,11 моль) гидрохлоридаN,N-бис-(2-хлорэтил)бензиламина и 1,0 г йодида натрия. Смесь перемешивают при температуре 110 С в течение 2 ч, затем охлаждают и перемешивают при температуре 0 С в течение еще 2 ч и хлорид натрия,образующийся в реакции, фильтруют. Фильтрат упаривают в вакууме и остаток растворяют в трехкратном объеме изопропанола. Этот раствор по каплям добавляют к смеси 250 мл изопропанола и 30 мл концентрированного водного раствора соляной кислоты. Кристаллический продукт фильтруют при 0 С, промывают и сушат. Выход: 38,5 г (85,5%) не совсем белых кристаллов. Температура плавления: 245-246 С. Элементарный анализ рассчитанный на основе формулы C24H25ClN22HCl (449,9): рассчитано:С: 64,07, Н: 6,05, Cl: 23,65, N: 6,23; измерено: С: 63,85, H: 6,12, Cl: 23,44, N: 6,28. Оптическая чистота в соответствии с хиральной высокоэффективной жидкостной хроматографией 99,5%.(R)-(-)-1-(4-Хлорфенил)фенилметил-4-бензилпиперазин [соединение формулы (III)]. Следуют способу примера 1 с отличием, заключающимся в том, что после отфильтровывания неорганических солей фильтрат концентрируют в вакууме, остаток растворяют в 250 мл этилацетата, этилацетатный раствор промывают водой, сушат и растворитель упаривают. Желтый маслянистый остаток после упаривания растворяют в 150 мл метанола, продукт кристаллизуют при температуре -20 С в течение 24 ч, продукт основание отфильтровывают, промывают метанолом и сушат. Выход: 38,5 г (65,0%) не совсем белых кристаллов. Температура плавления: 76-78 С. Элементарный анализ рассчитанный на основе формулы C24H25ClN2 (376,9): рассчитано: С: 76,48, Н: 6,69, Cl: 9,41, N: 7,43; измерено: С: 76,12, Н: 6,82, Cl: 9,30, N: 7,51. Оптическая чистота (хиральная высокоэффективная жидкостная хроматография): 99,9%. Пример 3. Дигидрохлорид (S)-(-)-1-(4-хлорфенил)фенилметил-4-бензилпиперазина. Следуют способу, описанному в примере 1, с отличием, заключающимся в том, что вместо R-(-)-(4 хлорфенил)фенилметиламина используют 21,8 г (0,1 моль) (S)-(+)-(4-хлорфенил)фенилметиламина, вместо растворителя н-бутанола - то же самое количество метилцеллозольва (2-метоксиэтанола). Выход: 33,1 г (73,7%) не совсем белых кристаллов. Температура плавления: 245-246 С. Элементарный анализ рассчитанный на основе формулы C24H25ClN22HCl (449,9): рассчитано: С: 64,07, Н: 6,05, Cl: 23,65, N: 6,23; измерено: С: 64,04, Н:6,16, Cl: 23,74, N: 6,12. Оптическая чистота (хиральная высокоэффективная жидкостная хроматография): 99,4%. Пример 4. Дигидрохлорид (R)-(+)-1-(4-хлорфенил)фенилметил-4-бензилпиперазина [соединение формулы(III)]. Способ примера 1 осуществляют с отличием, заключающимся в том, что вместо гидрокарбоната натрия используют 27,4 г (0,20 моль) карбоната калия и вместо н-бутанольного растворителя метилцеллюлозу. Выход: 38,5 г (85,5%) не совсем белых кристаллов. Температура плавления: 245-246 С. Элементарный анализ рассчитанный на основе формулы C24H25ClN22HCl (449,9): рассчитано: С: 64,07, Н: 6,05, Cl: 23,65, N: 6,23; измерено: С: 63,72, Н: 6,22, Cl: 23,51, N: 6,32. Оптическая чистота (хиральная высокоэффективная жидкостная хроматография): 99,4%. Пример 5. Дигидрохлорид (R)-(+)-1-(4-хлорфенил)фенилметил-4-бензилпиперазина [соединение формулы(III)]. Способ примера 1 осуществляют с отличием, заключающимся в том, что вместо гидрокарбоната натрия используют 40,4 г (0,40 моль) триэтиламина, вместо н-бутанола - равный объем диоксанового растворителя. Выход: 35,4 г (75,6%) не совсем белых кристаллов. Температура плавления: 245-246 С. Элементарный анализ рассчитанный на основе формулы C24H25ClN22HCl (449,9): Рассчитано: С: 64,07, Н: 6,05, Cl: 23,65, N: 6,23; измерено: С: 63,94; Н:6,19; Cl: 23,85; N: 6,34. Оптическая чистота (хиральная высокоэффективная жидкостная хроматография): 98,9%. Пример 6. Гидрохлорид 2,2,2-трихлорэтилового эфира (R)-(+)-4-(4-хлорфенил)фенилметилпиперазин-1 карбоновой кислоты (1:1) [соединение формулы (IV)]. 37,7 г (0,1 моль) свободного основания (R)-(-)-1-[(4-хлорфенил)фенилметил]-4-бензилпиперазина растворяют в 300 мл толуола и к этому раствору по каплям добавляют раствор 23,3 г (0,11 моль) 2,2,2-трихлорэтилхлорформиата, полученного в 50 мл толуола. Мутную суспензию перемешивают при комнатной температуре в течение 2 ч, рН реакционной смеси доводят до рН 1,0-1,5 10 мас.%-ным раствором соляной кислоты, приготовленным в этилацетате, кристаллический побочный продукт(1-бензилпиперазин-4-(2,2,2-трихлорэтил)карбамат отфильтровывают, фильтрат промывают водным раствором гидрокарбоната натрия, толуольный слой сушат над карбонатом натрия и после фильтрации фильтрат упаривают.-7 015801 Желтый маслянистый остаток после упаривания, имеющий массу приблизительно 53,5 г, растворяют в 160 мл изопропилового спирта, и при температуре 40-55 С по каплям в течение 30 мин при перемешивании добавляют 37 мл 15 г/100 мл раствора соляной кислоты в изопропаноле (содержание соляной кислоты 5,5 г, 0,15 моль). После добавления соляной кислоты суспензию охлаждают до температуры-5 С в течение 1 ч, кристаллы фильтруют после перемешивания в течение 2 ч, фильтруют, промывают изопропанолом и сушат. Выход: 37,1 г (74,5%) белых кристаллов. Температура плавления: 244-246 С. Элементарный анализ рассчитанный на основе формулы C20H20Cl4N2O2HCl (498,7): рассчитано: С: 48,17, Н: 4,24, Cl: 35,55, N: 5,62; измерено: С: 48,05, Н: 4,32, Cl: 35,85, N: 5,71. Оптическая чистота (хиральная высокоэффективная жидкостная хроматография): 99,2%. Пример 7. 2,2,2-Трихлорэтиловый эфир (R)-(+)-4-(4-хлорфенил)фенилметилпиперазин-1-карбоновой кислоты[свободное основание соединения формулы (IV)]. 5,0 г (10 ммоль) гидрохлорида, полученного в соответствии с примером 6, добавляют к смеси 50 мл воды и 50 мл этилацетата и рН смеси доводят до рН 14 путем добавления 10 мас.% раствора гидроксида натрия при перемешивании. Два слоя разделяют, этилацетатный слой сушат над карбонатом калия,фильтруют и растворитель упаривают. Остаток после упаривания растворяют в 20 мл изопропанола и продукт кристаллизуют. Выход: 3,89 г (84,2%) белых кристаллов. Температура плавления: 96-97 С. Элементарный анализ рассчитанный на основе формулы C20H20Cl4N2O2 (462,2): рассчитано: С: 51,97, Н: 4,36, Cl: 30,68, N: 6,06; измерено: С: 51,84, Н:4,52, Cl: 30,85, N: 5,97. Оптическая чистота (хиральная высокоэффективная жидкостная хроматография): 99,8%. Пример 8. Гидрохлорид 2,2,2-трихлорэтилового эфира (S)-(-)-4-(4-хлорфенил)фенилметилпиперазин-1 карбоновой кислоты (1:1) [соединение формулы (IV)]. Способ примера 6 осуществляют с отличием, заключающимся в том, что в качестве исходного вещества используют дигидрохлорид (S)-(-)-1-(4-хлорфенил)фенилметил-4-бензилпиперазина (соединение примера 3). Выход: 33,1 г (66,4%) белых кристаллов. Температура плавления: 242-246 С. Элементарный анализ рассчитанный на основе формулы C20H20Cl4N2O2HCl (498,7): рассчитано: С: 48,17, Н:4,24, Cl: 35,55, N: 5,62; измерено: С: 48,22, Н: 4,38, Cl: 35,14, N: 5,79. Оптическая чистота (хиральная высокоэффективная жидкостная хроматография): 98,5%. Пример 9. 2,2,2-Трихлорэтиловый эфир (R)-(+)-4-(4-хлорфенил)фенилметилпиперазин-1-карбоновой кислоты[свободное основание соединения формулы (IV)]. Способ в соответствии с примером 6 осуществляют с отличием, заключающимся в том, что реакцию осуществляют в N,N-диметилформамидном растворителе вместо толуола при температуре 15 С, и в начале реакции к реакционной смеси добавляют 15,1 г (0,15 моль) триэтиламина. После реакции реакционную смесь выливают в 300 мл смеси лед-вода, продукт экстрагируют этилацетатом, органический слой сушат над сульфатом натрия и растворитель упаривают. Полученный таким образом маслянистый остаток растворяют в смеси растворителей 1:1 (об./об.) гексан-диэтиловый эфир, продукт кристаллизуют, фильтруют, сушат. Выход: 28,9 г (62,6%) белых кристаллов. Температура плавления: 96-97 С. Элементарный анализ рассчитанный на основе формулы C20H20Cl4N2O2 (462,2): рассчитано: 51,97, Н: 4,36, Cl: 30,68, N: 6,06; измерено: С: 51,89, Н: 4,42, Cl: 30,85, N: 5,96. Оптическая чистота (хиральная высокоэффективная жидкостная хроматография): 99,0%. Пример 10. Дигидрохлорид (R)-(-)-1-(4-хлорфенил)фенилметилпиперазина [соединение формулы (I)]. В сосуд загружают 250 мл тетрагидрофурана, 25 мл метанола и 5,0 мл (60 ммоль) концентрированной соляной кислоты (37 мас.%). Смесь охлаждают до температуры 15 С и при интенсивном перемешивании добавляют 5,5 г (84 ммоль) цинка из пульверизатора. Затем при температуре от 5 до 10 С несколькими порциями добавляют 12,5 г (25,1 ммоль) гидрохлорида 2,2,2-трихлорэтилового эфира (R)-(+)-4-(4 хлорфенил)фенилметилпиперазин-1-карбоновой кислоты (соединение примера 6). Суспензию переме-8 015801 шивают в течение 1 ч при комнатной температуре. В конце реакции не прореагировавший цинк отфильтровывают, фильтрат смешивают с 150 мл воды и 150 мл этилацетата, органический слой отделяют, промывают водным 5 мас.%-ным раствором гидрокарбоната натрия, сушат и растворитель упаривают. Остаток растворяют в 100 мл этилацетата и по каплям при перемешивании добавляют к 80 мл 10 г/100 мл раствора соляной кислоты, приготовленного в этилацетате. Суспензию, содержащую кристаллическую соль, которая начинает осаждаться почти сразу после добавления, охлаждают, продукт отфильтровывают, промывают диэтиловым эфиром и сушат. Выход: 7,7 г (85,4%) белых кристаллов. Температура плавления: 198-202 С. Элементарный анализ рассчитанный на основе формулы C17H19ClN22HCl (359,7): рассчитано: С: 56,76, Н: 5,88, Cl: 29,57, N: 7,79; измерено: С: 56,45, Н: 5,74, Cl: 29,25, N: 7,61. Оптическая чистота (хиральная высокоэффективная жидкостная хроматография): 98,7%. Пример 11. Фумарат (R)-(-)-1-(4-хлорфенил)фенилметилпиперазина (1:1) [соединение формулы (XI)]. 13,0 г (0,2 моль) цинка из пульверизатора при перемешивании добавляют к смеси 300 мл толуола, 30 мл (0,52 моль) ледяной уксусной кислоты (96 мас.%) и 30 мл метанола. Затем тремя равными порциями в течение 15 мин добавляют 50,0 г (0,10 моль) гидрохлорида (R)-(+)-4-(4 хлорфенил)фенилметилпиперазин-1-(2,2,2-трихлорэтилкарбамата) (соединение примера 6). Температура сероватой суспензии увеличивается приблизительно до 41-45 С в течение 10 мин и происходит интенсивное выделение диоксида углерода. Через 1 ч суспензию фильтруют, фильтрат смешивают с 40 мл воды и 38,5 мл 25 мас.%ного раствора гидроксида аммония. Слои разделяют, толуоловый слой сушат над карбонатом калия и растворитель упаривают. Полученный таким образом желтый маслянистый остаток после упаривания (приблизительно 42 г),имеющий содержание 75,5%, рассчитанное в виде свободного основания, растворяют в 500 мл ацетона и добавляют 12,8 г (0,11 моль) фумаровой кислоты. Продукт, который исходно выделяют в маслянистой форме, перемешивают в течение 3 ч при температуре 25 С. Кристаллический продукт фильтруют и сушат до постоянной массы. Выход: 31,3 г (77,8%) не совсем белых кристаллов. Температура плавления: 146-148 С. Элементарный анализ рассчитанный на основе формулы C21H23ClN2O4 (402,9): рассчитано: С: 62,61, Н: 5,75, Cl: 8,80, N: 6,95; измерено: С: 62,27, Н: 5,72, Cl: 8,79, N: 6,84. Оптическая чистота (хиральная высокоэффективная жидкостная хроматография): 99,8%. Пример 12. Фумарат (S)-(+)-1-(4-хлорфенил)фенилметилпиперазина (1:1) [соединение формулы (XI)]. Способ примера 11 осуществляют с отличием, заключающимся в том, что вместо использования соли гидрохлорида(R)-(+)-4-(4-хлорфенил)фенилметилпиперазин-1-(2,2,2-трихлорэтил)карбамата используют соль гидрохлорид (S)-(-)-4-(4-хлорфенил)фенилметилпиперазин-1-(2,2,2-трихлорэтил)карбамата (соединение примера 8). Выход: 24,2 г (60,0%) не совсем белых кристаллов. Температура плавления: 145-148 С. Оптическая чистота (хиральная высокоэффективная жидкостная хроматография): 99,2%. Температура плавления основания (S)-(+)-1-(4-хлорфенил)фенилметил пиперазина 94-96 С (гексан). Пример 13. Фумарат (R)-(-)-1-(4-хлорфенил)фенилметилпиперазина (1:1) [соединение формулы (XI)]. 45,0 г (0,10 моль) дигидрохлорида (R)-(+)-1-[(4-хлорфенил)фенилметил]-4-бензилпиперазина суспендируют в 300 мл толуола и при интенсивном перемешивании добавляют 50 г льда, 50 мл воды и 25 мл водного раствора гидроксида аммония. Слои разделяют, верхний толуоловый слой сушат над карбонатом калия при перемешивании и фильтрации. К фильтрату по каплям добавляют раствор 23,3 г(0,11 моль) 2,2,2-трихлорэтилхлорформиата, приготовленного в 50 мл толуола. Мутную суспензию перемешивают в течение 2 ч при комнатной температуре, кристаллический побочный продукт отфильтровывают. Фильтрат смешивают с 30 мл концентрированной уксусной кислоты (96 мас.%), добавляют 30 мл метанола и при интенсивном перемешивании 13,0 г (0,2 моль) цинка из пульверизатора. Во время реакции происходит интенсивное выделение диоксида углерода. Через 1 ч суспензию фильтруют, фильтрат смешивают с 40 мл воды и 38,5 мл 25 мас.% раствора гидроксида аммония. Два слоя разделяют, верхний толуоловый слой сушат над карбонатом калия и растворитель упаривают.-9 015801 Остаточное желтое масло (приблизительно 35,2 г) растворяют в 350 мл ацетона и при перемешивании добавляют 11,6 г (0,1 моль) фумаровой кислоты. Смесь кипятят до растворения. Продукт осаждается при охлаждении. Суспензию продукта перемешивают в течение 3 ч при комнатной температуре, кристаллы фильтруют, промывают диэтиловым эфиром и сушат. Выход: 27,9 г (65,8%) не совсем белых кристаллов. Температура плавления: 146-148 С. Оптическая чистота (хиральная высокоэффективная жидкостная хроматография): 99,6%. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения 1-[(4-хлорфенил)метилфенил]пиперазина формулы (I) его энантиомеров и солей, при котором подвергают реакции 1-[(4-хлорфенил)фенилметил]-4 бензилпиперазин формулы (III) или его энантиомер с 2,2,2-трихлорэтилхлорформиатом формулы (X) и превращают получающийся таким трихлорэтоксикарбонил)пиперазин формулы (IV) 1-[(4-хлорфенил)фенилметил]-4-(2,2,2 в 1-[(4-хлорфенил)метилфенил]пиперазин формулы (I). 2. Способ получения 1-[(4-хлорфенил)фенилметил]-4-(2,2,2-трихлорэтоксикарбонил)пиперазина формулы (IV), его энантиомеров и солей, при котором подвергают реакции 1-[(4-хлорфенил)фенилметил]-4-бензилпиперазин формулы (III) или его энантиомер с 2,2,2-трихлорэтилхлорформиатом формулы (X) и необязательно превращают получающийся таким образом 1-[(4-хлорфенил)фенилметил]4-(2,2,2-трихлорэтоксикарбонил)пиперазин формулы (IV) в его соль присоединения кислоты. 3. 1-[(4-Хлорфенил)фенилметил]-4-(2,2,2-трихлорэтоксикарбонил)пиперазин формулы (IV), его энантиомеры и соли присоединения кислоты. 4. Способ по любому из пп.1, 2, где 1-[(4-хлорфенил)фенилметил]-4-бензилпиперазин формулы (III) подвергают реакции с 1,0-1,2 мол.экв., предпочтительно 1,05 мол.экв. 2,2,2-трихлорэтилформиата формулы (X). 5. Способ по любому из пп.1, 2 или 4, где указанную реакцию 1-[(4-хлорфенил)фенилметил]-4 бензилпиперазина формулы (III) и 2,2,2-трихлорэтилхлорформиата формулы (X) осуществляют в присутствии неорганического или органического основания, представляющего собой реагент, связывающий кислоту. 6. Способ по п.5, где в качестве реагента, связывающего кислоту, используют гидрокарбонат или карбонат щелочного или щелочно-земельного металла, триэтиламин, трибутиламин или пиридин. 7. Способ по любому из пп.1, 2, 4-6, где реакцию 1-[(4-хлорфенил)фенилметил]-4-бензилпиперазина формулы (III) и 2,2,2-трихлорэтилхлорформиата формулы (X) осуществляют в растворителе, выбранном из ароматического, апротонного или простого эфирного растворителя. 8. Способ по п.7, где растворитель выбирают из бензола, толуола, N,N-диметилформамида, диметилсульфоксида, диизопропилового эфира, диэтилового эфира, диоксана или тетрагидрофурана. 9. Способ по любому из пп.1, 2 или 4-8, где реакцию осуществляют при температуре от -20 до 40 С,предпочтительно от 15 до 20 С. 10. Способ по п.1, где превращение 1-[(4-хлорфенил)фенилметил]-4-(2,2,2-трихлорэтокси- 10015801 карбонил)пиперазина формулы (IV) в 1-[(4-хлорфенил)метилфенил]пиперазин формулы (I) осуществляют путем восстановления. 11. Способ по п.10, где восстановление осуществляют при помощи цинка в кислом растворе. 12. Способ по п.11, где используют от 1 до 5, предпочтительно от 1,5 до 2,5 мол.экв. цинка. 13. Способ по любому из пп.1, 10-12, где при превращении 1-[(4-хлорфенил)фенилметил]-4-(2,2,2 трихлорэтоксикарбонил)пиперазина формулы (IV) в 1-[(4-хлорфенил)метилфенил]пиперазин формулы(I) используют растворитель, выбранный из воды, водного раствора кислоты, предпочтительно раствора уксусной кислоты или соляной кислоты необязательно в смеси с ароматическим углеводородом, предпочтительно толуолом. 14. Способ по любому из пп.1, 10-13, где превращение 1-[(4-хлорфенил)фенилметил]-4-(2,2,2 трихлорэтоксикарбонил)пиперазина формулы (IV) в 1-[(4-хлорфенил)метилфенил]пиперазин формулы(I) осуществляют при температуре от 0 до 50 С, предпочтительно от 20 до 25 С. 15. Способ по п.1, при котором после превращения 1-[(4-хлорфенил)фенилметил]-4-(2,2,2 трихлорэтоксикарбонил)пиперазина формулы (IV) в 1-[(4-хлорфенил)метилфенил]пиперазин формулы(I) дополнительно добавляют фумаровую кислоту и соединение формулы (I) выделяют в виде соли фумарата формулы (XI). 16. Способ по п.1 или 2, где используют (R)-(+)-1-[(4-хлорфенил)фенилметил]-4-бензилпиперазин формулы (III). 17. Способ по п.10, где используют (R)-(+)-1-[(4-хлорфенил)фенилметил]-4-(2,2,2-трихлорэтоксикарбонил)пиперазин формулы (IV).
МПК / Метки
МПК: C07D 295/06, C07D 295/18
Метки: промежуточных, получения, соединений, фармацевтических, способ, активные, карбаматы, качестве, применение, оптически
Код ссылки
<a href="https://eas.patents.su/12-15801-opticheski-aktivnye-karbamaty-sposob-ih-polucheniya-i-ih-primenenie-v-kachestve-farmacevticheskih-promezhutochnyh-soedinenijj.html" rel="bookmark" title="База патентов Евразийского Союза">Оптически активные карбаматы, способ их получения и их применение в качестве фармацевтических промежуточных соединений</a>
Предыдущий патент: Новые ферменты для ферментативного отбеливания пищевых продуктов
Следующий патент: Реконструированные сурфактанты, обладающие улучшенными свойствами












