Производные 6-алкенил-, 6-алкинил- и 6-эпокси-эпотилона, способ их получения и их применение в фармацевтических препаратах
Номер патента: 11502
Опубликовано: 28.04.2009
Авторы: Клар Ульрих, Хоффманн Йенс, Скубалла Вернер, Шведе Вольфганг, Бухманн Бернд, Лихтнер Роземари
Формула / Реферат
1. Эпотилоновое соединение формулы I
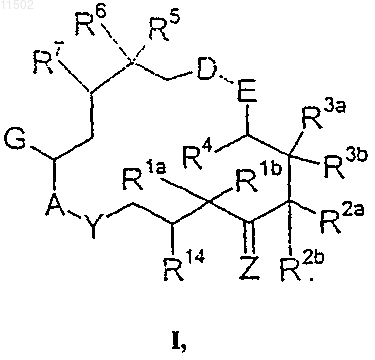
в которой
R1a, R1b одинаковы или различны и представляют собой атом водорода, C1-С10алкил, который может быть необязательно перфторирован или замещен 1-5 атомами галогена, гидроксильными группами, С1-С4алкоксигруппами или С6-С12арильными группами, которые могут быть необязательно замещены 1-3 атомами галогена, или вместе представляют собой группу -(СН2)m-, в которой m=1, 2, 3, 4 или 5, или группу -(СН2)-О-(СН2)-,
Ra представляет собой водород, C1-С10алкил, который может быть необязательно перфторирован или замещен 1-5 атомами галогена, гидроксильными группами, С1-С4алкоксигруппами или С6-С12арильными группами, которые могут быть необязательно замещены 1-3 атомами галогена, -(CH2)ra-OC-(CH2)pa-R26a, -(CH2)ra-C=C-(CH2)pa-R26a,
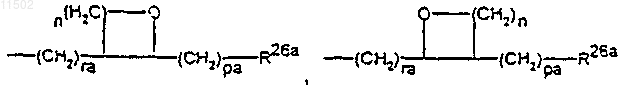
R2b представляет собой -(CH2)rb-CуC-(CH2)pb-R26b, -(CH2)rb-C=C-(CH2)pb-R26b,

n принимает значения от 0 до 5,
ra, rb имеют одинаковые или разные значения от 0 до 4,
pa, pb имеют одинаковые или разные значения от 0 до 3,
R3a представляет собой водород, C1-С10алкил, который может быть необязательно перфторирован или замещен 1-5 атомами галогена, гидроксильными группами, С1-С4алкоксигруппами или С6-C12арильными группами, которые могут быть необязательно замещены 1-3 атомами галогена;
R3b представляет собой ОН или группу OPG14, где PG14 означает защитную группу,
R14 представляет собой водород, OR14a или Hal, где R14a обозначает водород, SO2алкил, SO2арил или SO2аралкил,
R4 представляет собой водород, C1-С10алкил, который необязательно замещен; Hal, OR25 или CN,
R25 представляет собой водород или защитную группу PG5,
R26a, R26b одинаковы или различны и представляют собой водород, C1-С10алкил, который необязательно замещен, или, если pa или pb>0, дополнительно группу OR27,
R27 представляет собой водород или защитную группу PG6,
R5 представляет собой водород, C1-С10алкил,
R6, R7, каждый представляет собой атом водорода или вместе дополнительную связь или атом кислорода,
G представляет собой группу X=CR8- или би- или трициклическую арильную группу, содержащую от 5 до 12 атомов в цикле;
R8 представляет собой водород, галоген; CN; или С1-С20алкил, С6-С12арил, С7-С20аралкил, каждый из которых может быть замещен, X представляет собой атом кислорода, две алкоксигруппы OR23, С2-С10алкилен-a,w-диоксигруппу, которая может быть разветвленной или неразветвленной, H/OR9 или группу CR10R11, где
R23 обозначает С1-С20алкильный радикал,
R9 обозначает водород или защитную группу PGx,
R10, R11 различны или одинаковы и представляют собой водород, С1-С20алкил, С6-С12арил или С7-С20аралкил, каждый из которых необязательно замещен, или R10 и R11 вместе с атомом углерода метилена образуют 5-7-членное карбоциклическое кольцо,
D-E представляет собой группу -СН2-СН2-, -О-СН2-,
A-Y представляет собой группу О-С(=О), О-СН2, СН2С(=О) или NR29-C(=O),
R29 обозначает водород или С1-С10алкил,
Z представляет собой атом кислорода или H/OR12, где R12 является водородом или защитной группой PGz,
Hal обозначает галоген,
при том, что "арил" обозначает карбоциклическую арильную группу или гетероциклическую арильную группу, содержащую от 5 до 12 атомов, такую как, например, фенил или нафтил, или гетероциклил, содержащий 1 или более гетероатомов, выбранных из О, S, N, такой как, например, тиенил, пиридил, оксазолил, пиразолил, тиазолил, хинолил, а понятие "замещенный" для указанных случаев включает такие заместители для необязательных арильных заместителей, как, например, атом галогена, ОН, О-алкил, СО2Н, СО2алкил, -NH2, -NO2, N3, CN, C1-С20алкил, C1-С20ацил, С1-С20ацилокси, заместители для алкильных групп, если специально не оговорено, обозначают перфторзамещение или замещение 1-5 атомами галогена, гидроксильными группами, С1-С4алкоксигруппами или С6-С12арильными группами, которые могут быть необязательно замещены 1-3 атомами галогена; а все защитные группы PG, в том числе имеющие верхний индекс, обозначают общепринятые, такие как, например, алкил, алкил- или арилзамещенный силил, С4-С7циклоалкил, ацил, ароил, алкоксикарбонил.
2. Соединение формулы I по п.1, в котором R2a обозначает атом водорода.
3. Соединение формулы I по п.1, в котором R1a и R1b в каждом случае обозначают метильную группу или совместно образуют диметиленовую или триметиленовую группу.
4. Соединение формулы I по п.1, в котором G является группой X=CR8, где R8 представляет собой атом галогена или нитрильную группу.
5. Соединение по п.4, в котором R8 является атомом фтора.
6. Соединение формулы I по п.1, которое выбирают из группы, состоящей из следующего:
(4S,7R,8S,9S,13Z,16S(E))-4,8-дигидрокси-16-(1-метил-2-(2-пиридил)этенил)-1-окса-5,5,9,13-тетраметил-7-(бут-3-ин-1-ил)циклогексадец-13-ен-2,6-дион,
(4S,7R,8S,9S,13Z,16S(E))-4,8-дигидрокси-16-(1-метил-2-(2-пиридил)этенил)-1-окса-5,5,9,13-тетраметил-7-(бут-3-ен-1-ил)циклогексадец-13-ен-2,6-дион,
(4S,7R,8S,9S,13Е,16S(E))-4,8-дигидрокси-16-(1-метил-2-(2-пиридил)этенил)-1-окса-5,5,9,13-тетраметил-7-(бут-3-ин-1-ил)циклогексадец-13-ен-2,6-дион,
(1S,3S(E),7S,10R,11S,12S,16R)-7,11-дигидрокси-10-(бут-3-ин-1-ил)-3-(1-метил-2-(2-пиридил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион (А) и
(1R,3S(E),7S,10R,11S,12S,16S)-7,11-дигидрокси-10-(бут-3-ин-1-ил)-3-(1-метил-2-(2-пиридил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион (В),
(1S,3S(E),7S,10R,11S,12S,16R)-7,11-дигидрокси-10-(бут-3-ен-1-ил)-3-(1-метил-2-(2-пиридил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион (А) и
(1R,3S(E),7S,10R,11S,12S,16S)-7,11-дигидрокси-10-(бут-3-ен-1-ил)-3-(1-метил-2-(2-пиридил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион (В),
(1S,3S(E),7S,10R,11S,12S,16S)-7,11-дигидрокси-10-(бут-3-ин-1-ил)-3-(1-метил-2-(2-пиридил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион (А) и
(1R,3S(E),7S,10R,11S,12S,16R)-7,11-дигидрокси-10-(бут-3-ин-1-ил)-3-(1-метил-2-(2-пиридил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион (В),
(4S,7R,8S,9S,13Е,16S(E))-4,8-дигидрокси-16-(1-метил-2-(2-пиридил)этенил)-1-окса-5,5,9,13-тетраметил-7-(бут-3-ен-1-ил)-циклогексадец-13-ен-2,6-дион,
(1S,3S(E),7S,10R,11S,12S,16S)-7,11-дигидрокси-10-(бут-3-ен-1-ил)-3-(1-метил-(2-(2-пиридил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан -5,9-дион (А) и
(1R,3S(E),7S,10R,11S,12S,16R)-7,11-дигидрокси-10-(бут-3-ен-1-ил)-3-(1-метил-(2-(2-пиридил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион (В),
(4S,7R,8S,9S,13Z,16S(E))-4,8-дигидрокси-16-(1-метил-2-(2-метилтиазол-4-ил)этенил)-1-окса-5,5,9,13-тетраметил-7-(проп-2-ен-1-ил)циклогексадец-13-ен-2,6-дион,
(1S,3S(E),7S,10R,11S,12S,16R)-7,11-дигидрокси-10-(проп-2-ен-1-ил)-3-(1-метил-2-(2-метилтиазол-4-ил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион (А) и
(1R,3S(E),7S,10R,11S,12S,16S)-7,11-дигидрокси-10-(проп-2-ен-1-ил)-3-(1-метил-2-(2-метилтиазол-4-ил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион (В),
(4S,7R,8S,9S,13E,16S(E))-4,8-дигидрокси-16-(1-метил-2-(2-метилтиазол-4-ил)этенил)-1-окса-5,5,9,13-тетраметил-7-(проп-2-ен-1-ил)циклогексадец-13-ен-2,6-дион,
(1R,3S(E),7S,10R,11S,12S,16R)-7,11-дигидрокси-10-(проп-2-ен-1-ил)-3-(1-метил-2-(2-метилтиазол-4-ил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион (А) и
(1S,3S(E),7S,10R,11S,12S,16S)-7,11-дигидрокси-10-(проп-2-ен-1-ил)-3-(1-метил-2-(2-метилтиазол-4-ил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион (В),
(4S,7R,8S,9S,13Z,16S(E))-4,8-дигидрокси-16-(1-метил-2-(2-пиридил)этенил)-1-окса-5,5,9,13-тетраметил-7-(проп-2-ин-1-ил)-циклогексадец-13-ен-2,6-дион,
(4S,7R,8S,9S,13Е,16S(E))-4,8-дигидрокси-16-(1-метил-2-(2-пиридил)этенил)-1-окса-5,5,9,13-тетраметил-7-(проп-2-ин-1-ил)циклогексадец-13-ен-2,6-дион,
(4S,7R,8S,9S,13Z,16S(E))-4,8-дигидрокси-16-(1-метил-2-(2-пиридил)этенил)-1-окса-5,5,9,13-тетраметил-7-(проп-2-ен-1-ил)циклогексадец-13-ен-2,6-дион,
(4S,7R,8S,9S,13Е,16S(E))-4,8-дигидрокси-16-(1-метил-2-(2-пиридил)этенил)-1-окса-5,5,9,13-тетраметил-7-(проп-2-ен-1-ил)циклогексадец-13-ен-2,6-дион,
(1S/1R,3S(E),7S,10R(RS),11S,12S,16R/S)-7,11-дигидрокси-10-(2,3-эпоксипроп-1-ил)-3-(1-метил-2-(2-N-оксидопиридил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион,
(1S,3S(E),7S,10R(R или S),11S,12S,16R)-7,11-дигидрокси-10-(2,3-эпоксипроп-1-ил)-3-(1-метил-2-(2-N-оксидопиридил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион (А) и
(1R,3S(E),7S,10R(R или S),11S,12S,16S)-7,11-дигидрокси-10-(2,3-эпоксипроп-1-ил)-3-(1-метил-2-(2-N-оксидопиридил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион (В),
(1S/R,3S(E),7S,10R(S или R),11S,12S,16R/S)-7,11-дигидрокси-10-(2,3-эпоксипроп-1-ил)-3-(1-метил-2-(2-N-оксидопиридил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион,
(4S,7R,8S,9S,13Z,16S(R или S))-4,8-дигидрокси-16-(1-метил-2-(2-пиридил)этил)-1-окса-5,5,9,13-тетраметил-7-(проп-2-ен-1-ил)циклогексадец-13-ен-2,6-дион (А) и
(4S,7R,8S,9S,13Z,16S(S или R))-4,8-дигидрокси-16-(1-метил-2-(2-пиридил)этил)-1-окса-5,5,9,13-тетраметил-7-(проп-2-ен-1-ил)циклогексадец-13-ен-2,6-дион (В),
(4S,7R,8S,9S,13Z,16S)-4,8-дигидрокси-16-(2-метилбензоксазол-5-ил)-1-окса-5,5,9,13-тетраметил-7-(проп-2-ен-1-ил)циклогексадец-13-ен-2,6-дион,
(4S,7R,8S,9S,13Е,16S)-4,8-дигидрокси-16-(2-метилбензоксазол-5-ил)-1-окса-5,5,9,13-тетраметил-7-(проп-2-ен-1-ил)циклогексадец-13-ен-2,6-дион,
(4S,7R,8S,9S,13Z,16S(Z))-4,8-дигидрокси-16-(1-фтор-2-(2-метилтиазол-4-ил)этенил)-7-(проп-2-ин-1-ил)-1-окса-5,5,9,13-тетраметил)циклогексадец-13-ен-2,6-дион,
(4S,7R,8S,9S,13Е,16S(Z))-4,8-дигидрокси-16-(1-фтор-2-(2-метилтиазол-4-ил)этенил)-7-(проп-2-ин-1-ил)-1-окса-5,5,9,13-тетраметил)циклогексадец-13-ен-2,6-дион,
(1S,3S(Z),7S,10R,11S,12S,16R)-7,11-дигидрокси-3-(1-фтор-2-(2-метил-4-тиазолил)этенил)-10-(проп-2-ин-1-ил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион (А) и
(1R,3S(Z),7S,10R,11S,12S,16S)-7,11-дигидрокси-3-(1-фтор-2-(2-метил-4-тиазолил)этенил)-10-(проп-2-ин-1-ил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион (В),
(1S,3S(Z),7S,10R,11S,12S,16S)-7,11-дигидрокси-3-(1-фтор-2-(2-метил-4-тиазолил)этенил)-10-(проп-2-ин-1-ил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион (А) и
(1R,3S(Z),7S,10R,11S,12S,16R)-7,11-дигидрокси-3-(1-фтор-2-(2-метил-4-тиазолил)этенил)-10-(проп-2-ин-1-ил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион (В), и
(1SR,3S(Z),7S,10R,11S,12S,16SR)-7,11-дигидрокси-3-(1-фтор-2-(2-метил-4-тиазолил)этенил)-10-(проп-2-ин-1-ил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион (С),
(4S,7R,8S,9S,13Z,16S(Z))-4,8-дигидрокси-16-(1-фтор-2-(2-метилоксазол-4-ил)этенил)-7-(проп-2-ин-1-ил)-1-окса-5,5,9,13-тетраметилцклогексадец-13-ен-2,6-дион,
(4S,7R,8S,9S,13Е,16S(Z))-4,8-дигидрокси-16-(1-фтор-2-(2-метилоксазол-4-ил)этенил)-7-(проп-2-ин-1-ил)-1-окса-5,5,9,13-тетраметилцклогексадец-13-ен-2,6-дион,
(4S,7R,8S,9S,13Z,16S)-4,8-дигидрокси-16-(2-метилбензотиазол5-ил)этенил)-1-окса-5,5,9,13-тетраметил-7-(проп-2-ен-1-ил)цклогексадец-13-ен-2,6-дион,
(4S,7R,8S,9S,13Е,16S)-4,8-дигидрокси-16-(2-метилбензотиазол-5-ил)этенил)-1-окса-5,5,9,13-тетраметил-7-(проп-2-ен-1-ил)цклогексадец-13-ен-2,6-дион,
(1S,3S,7S,10R,11S,12S,16R)-7,11-дигидрокси-3-(2-метилбензотиазол-5-ил)-10-(проп-2-ен-1-ил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион (А) и
(1R,3S,7S,10R,11S,12S,16S)-7,11-дигидрокси-3-(2-метилбензотиазол-5-ил)-10-(проп-2-ен-1-ил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион (В),
(1S,3S,7S,10R,11S,12S,16R)-7,11-дигидрокси-3-(2-метилбензоксазол-5-ил)-10-(проп-2-ен-1-ил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион (А) и
(1R,3S,7S,10R,11S,12S,16R)-7,11-дигидрокси-3-(2-метилбензоксазол-5-ил)-10-(проп-2-ен-1-ил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион (В).
7. Соединение формулы I по п.1, в котором Z представляет собой кислород.
8. Соединение формулы I по п.1, в котором R1a и R1b совместно образуют триметиленовую группу.
9. Соединение формулы I по п.1, в котором R2a представляет собой водород.
10. Соединение формулы I по п.1, в котором R2a представляет собой водород, а R2b обозначает аллил, проп-2-инил, бут-3-инил или бут-3-енил.
11. Соединение формулы I по п.1, в котором R3a и R3b совместно представляют собой Н/ОН.
12. Соединение формулы I по п.1, в котором R4 представляет собой метил, этил, пропил, н-бутил, и-бутил, т-бутил или бензил.
13. Соединение формулы I по п.1, в котором R5 представляет собой Н, C1-5алкил.
14. Соединение формулы I по п.1, в котором G представляет собой бициклический гетероарильный радикал по меньшей мере с одним атомом азота в бициклическом кольце.
15. Соединение по п.14, в котором G представляет собой 2-метилбензоксазол-5-ильный или 2-метилбензотиазол-5-ильный радикал.
16. Соединение формулы I по п.1, в котором G представляет собой группу X=CR8-, где R8 является С1-С4алкилом, водородом, F, Cl или Br; а X обозначает CR10R11, где R10 либо R11 представляет собой водород, а другой обозначает гетероциклический арильный радикал.
17. Соединение по п.16, в котором гетероциклический арильный радикал представляет собой 2-метилтиазол-4-ил или 2-пиридил.
18. Соединение формулы I по п.1, в котором -A-Y представляет собой группу-О-С(=О) или -NR29-C(=O), где R29 обозначает водород или C1-С3алкил.
19. Фармацевтическая композиция, предназначенная для лечения злокачественных опухолей, содержащая соединение формулы I по п.1 и по меньшей мере один фармацевтически приемлемый адъювант или растворитель.
20. Композиция по п.19 в виде единицы дозирования, содержащей 0,1-100 мг соединения формулы I по п.1.
21. Способ получения соединения формулы I по п.1, который включает: циклизацию соединения формулы АВС-1
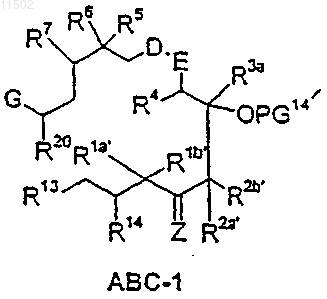
в которой
R14, Z, R3a, R4, D, E, R5, R6, R7 и G имеют значения, приведенные в п.1,
R1a', R1b', R2a' и R2b' имеют значения, приведенные для R1a, R1b, R2a и R2b в п.1,
PG представляет собой водород или защитную группу,
R13 обозначает CH2OR13a, CH2Hal, CHO, CO2R13b, COHal,
R20 обозначает галоген, N3, NHR29, гидроксигруппу, защищенную гидроксигруппу O-PG2, защищенную аминогруппу NR29PG2, необязательно перфторированную C1-С10алкилсульфонилоксигруппу, необязательно замещенную С1-С4алкилом, азотом, хлором или бромом бензоилоксигруппу, группу NR29SO2CH3, группу NR29C(=O)СН3, группу СН2-С(=О)-СН3, a R29 имеет значения алкила, арила, которое, в свою очередь, получают взаимодействием соединения АВ-1 формулы
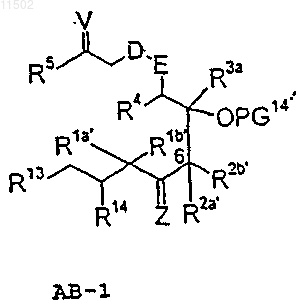
с соединением Cf
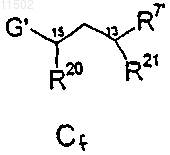
или реакцией промежуточного продукта ВС
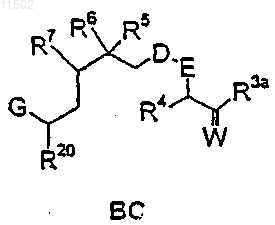
с соединением А-1
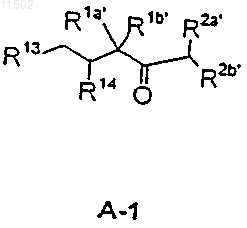
в которых
V представляет собой атом кислорода, две алкоксигруппы OR17, С2-С10алкилен-a,w-диоксигруппу, которая может быть разветвленной или неразветвленной или H/OR15,
W представляет собой атом кислорода, две алкоксигруппы OR19, С2-С10алкилен-a,w-диоксигруппу, которая может быть разветвленной или неразветвленной, или H/OR18,
G' представляет собой группу X=CR8', бицикло- или трициклоарильный радикал,
R8' имеет значение, ранее упомянутое в общей формуле I для R8, и
R7' представляет собой атом водорода,
R13a представляет собой водород, SO2-алкил, SO2-арил, SO2-аралкил или вместе образуют группу
-(СН2)o- или группу CR15aR15b,
R13b представляет собой водород, С1-С20алкил, С6-С12арил, С7-С20аралкил, каждый из которых необязательно замещен,
R15a, R15b одинаковы или различны и обозначают водород, C1-С10алкил, арил, С7-С20аралкил или совместно группу -(СН2)q,
X представляет собой атом кислорода, две алкоксигруппы OR23, С2-С10алкилен-a,w-диоксигруппу, которая может быть разветвленной или неразветвленной, H/OR9 или группу CR10R11,
где R23 обозначает C1-С20алкильный радикал,
R9 обозначает водород или защитную группу PG3,
R10, R11 различны или одинаковы и обозначают водород, С1-С20алкильный, С6-С12арильный или С7-С20аралкильный радикал, каждый из которых необязательно замещен, или R10 и R11 вместе с атомом углерода метилена совместно обозначают 5-7-членное карбоциклическое кольцо.
R21 представляет собой гидроксигруппу, галоген, защищенную гидроксигруппу OPG3, фосфонийгалидный радикал PPh3+Hal- (Ph=фенил; Hal=F, Cl, Br, I), фосфонатный радикал P(O)(OQ)2 (Q=C1-C10алкил или фенил) или фосфиноксидный радикал Р(О)Ph2 (Ph=фенил),
R14 представляет собой водород, OR14a, Hal, OSO2R14b,
R14a представляет собой водород, SO2-алкил, SO2-арил, SO2-аралкил или вместе образуют группу
-(СН2)o- или группу CR15aR15b,
R14b представляет собой водород, C1-С20алкил, С6-С12арил, С7-С20аралкил, каждый из которых необязательно замещен,
R17 обозначает необязательно замещенный алкил,
R18, R19 обозначает водород или защитную группу PG1,
о имеет значения от 2 до 4,
q имеет значения от 3 до 6,
при том, что соединение АВ-1 получают взаимодействием фрагмента А-1 с фрагментом Bf
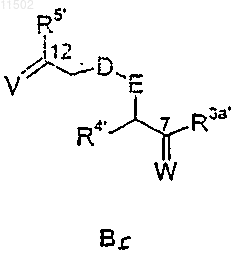
где R3a', R4' и R5' имеют значения, указанные для R3a, R4 и R5.
22. Способ по п.21, в котором получение соединений формулы АВС-1 осуществляют взаимодействием промежуточного соединения АВ-1 с соединением Cf, структурные формулы которых и значения соответствующих заместителей указаны в п.21.
23. Способ по п.21, в котором получение соединений формулы АВС-1 осуществляют взаимодействием промежуточного соединения ВС с соединением А-1, структурные формулы которых и значения соответствующих заместителей указаны в п.21.
24. Способ по п.21 или 22, в котором получение соединения формулы АВ-1 осуществляют взаимодействием соединения А-1 с соединением Bf, структурные формулы которых и значения соответствующих заместителей указаны в п.21.
25. Способ получения соединения формулы I по п.1, который включает
циклизацию соединения формулы АВС-2
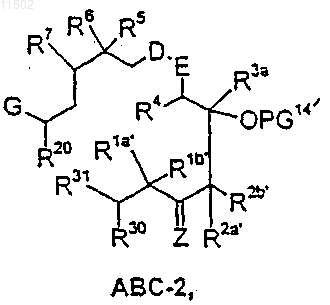
в которой
Z, R3a, R4, D, E, R5, R6, R7 и G имеют значения, приведенные в п.1,
R1a', R1b', R2a' и R2b' имеют значения, данные для Rla, Rlb, R2a и R2b в п.1,
PG14' представляет собой водород или защитную группу,
R20 обозначает галоген, N3, NHR29, гидроксигруппу, защищенную гидроксигруппу O-PG2, защищенную аминогруппу NR29PG2, необязательно перфторированную C1-С10 алкилсульфонилоксигруппу, необязательно замещенную С1-С4алкилом, азотом, хлором или бромом бензоилоксигруппу, группу NR29SO2CH3, группу NR29C(=O)СН3, группу СН2-С(=О)-СН3, a R29 имеет вышеуказанные значения,
R30 обозначает водород,
R31 обозначает гидроксил, или
R30, R31 вместе обозначают атом кислорода или С2-С10алкилен-a,w-диоксигруппу, которые могут быть разветвленными и неразветвленными, или R30, R31 независимо друг от друга обозначают C1-С10алкоксигруппу, которое, в свою очередь, получают взаимодействием соединения АВ-2 формулы
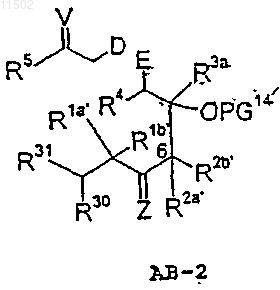
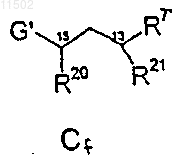
с фрагментом Cf
или реакцией промежуточного продукта ВС
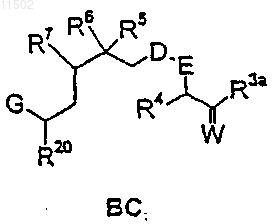
с фрагментом А-2
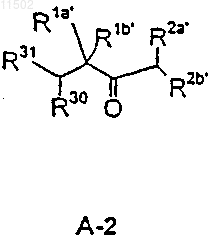
в которых
V представляет собой атом кислорода, две алкоксигруппы OR17, С2-С10алкилен-a,w-диоксигруппу, которая может быть разветвленной или неразветвленной или H/OR15,
W представляет собой атом кислорода, две алкоксигруппы OR19, С2-С10алкилен-a,w-диоксигруппу, которая может быть разветвленной или неразветвленной, или H/OR18,
G' представляет собой группу X=CR8', бицикло- или трициклоарильный радикал,
R8' имеет значение, ранее упомянутое в общей формуле I для R8, и
R7' представляет собой атом водорода,
X представляет собой атом кислорода, две алкоксигруппы OR23, С2-С10алкилен-a,w-диоксигруппу, которая может быть разветвленной или неразветвленной, H/OR9 или группу CR10R11,
где R23 обозначает С1-С20алкильный радикал,
R9 обозначает водород или защитную группу PG3,
R10, R11 различны или одинаковы и обозначают водород, С1-С20алкильный, С6-С12арильный или С7-С20аралкильный радикал, каждый из которых необязательно замещен, или R10 и R11 вместе с атомом углерода метилена совместно обозначают 5-7-членное карбоциклическое кольцо,
R21 представляет собой гидроксигруппу, галоген, защищенную гидроксигруппу OPG3, фосфонийгалидный радикал PPh3+Hal- (Ph=фенил; Hal=F, Cl, Br, I), фосфонатный радикал P(O)(OQ)2 (Q=C1-С10алкил или фенил) или фосфиноксидный радикал P(O)Ph2 (Ph=фенил),
R30 и R31 имеют вышеуказанные значения,
при том, что соединение АВ-2 получают взаимодействием соединения А-2 с соединением Bf формулы
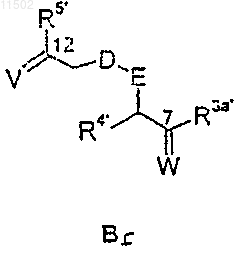
где R3a', R4' и R5' имеют значения, указанные для, соответственно, R3a, R4 и R5.
26. Способ по п.25, в котором получение соединения формулы АВС-2 осуществляют взаимодействием промежуточного соединения АВ-2 с фрагментом Cf, структурные формулы которых и значения соответствующих заместителей указаны в п.25.
27. Способ по п.25, в котором получение соединения формулы АВС-2 осуществляют взаимодействием промежуточного соединения ВС с фрагментом А-2, структурные формулы которых и значения соответствующих заместителей указаны в п.25.
28. Способ по п.25 или 26, в котором получение соединения формулы АВ-2 осуществляют взаимодействием соединения А-2 с соединением Bf, структурные формулы которых и значения соответствующих заместителей указаны в п.21.
29. Соединения формул А-1 и А-2
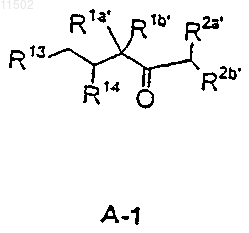
или
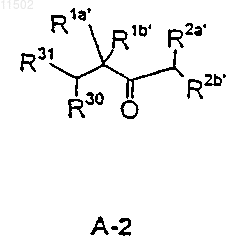
где все приведенные радикалы имеют значения, указанные в пп.21 и 25.
30. Соединения по п.29, в которых R14' или R31 обозначают ОН, R1a и R1b обозначают метил, а один из R2a' и R2b' обозначает водород, а другой группу проп-2-ен-1-ил.
31. Соединение по п.1, представляющее собой (1S,3S,7S,10R,11S,12S,16R)-7,11-дгидрокси-3-(2-метилбензотиазол-5-ил)-10-(проп-2-ен-1-ил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион.
32. Фармацевтическая композиция, предназначенная для лечения злокачественных опухолей, содержащая соединение по п.31 и по меньшей мере один фармацевтически приемлемый адъювант или носитель.
Текст
Hfle и др. описывают цитотоксическую активность природных веществ эпотилона A (R=водород) и эпотилона В (R=метил) следующей формулы: например, в Angew. Chem. (Applied Chem.), 1996, 108, 1571-1673. Благодаря своей селективности in vitro для культур клеток молочной железы и культур клеток кишечника и значительно большей активности против Р-гликопротеинобразующих мультирезистентных опухолевых культур по сравнению с таксолом,так же, как и физическим свойствам, которые превосходят аналогичные у таксола, например его растворимость в воде выше в 30 раз, этот новый структурный класс имеет особенные преимущества для разработки фармацевтического агента для лечения злокачественных опухолей. Природные вещества недостаточно стабильны как химически, так и метаболически для получения из них фармацевтических агентов. Чтобы избавиться от этих помех, необходимо внести модификации в природное вещество. Такие модификации становятся возможными только при подходе полного синтеза и требуют стратегий синтеза, которые позволяют широкую модификацию природного вещества. Целью структурных изменений также является расширение сферы терапевтического воздействия. Это можно сделать, только увеличивая селективность воздействия, и/или увеличивая активную силу, и/или снижая нежелательные токсические побочные эффекты, как описано в Proc. Natl. Acad. Sci. USA 1998, 95, 9542-9647. Полный синтез эпотилона А описан Schinzer и др. в Chem. Eur. J. 1996, 2, No. 11, 1477-1482 и вAngew. Chem. 1997, 109, No. 5, стр. 543-544. Производные эпотилона уже были описаны Hfle и др. вWO 97/19086. Эти производные получали исходя из природной формы эпотилона А или эпотилона В. В качестве возможных исходных продуктов для этой цели также описаны эпотилоны С и D (двойная связь между атомами углерода 12 и 13: эпотилон С=дезоксиэпотилон А; эпотилон D=дезоксиэпотилон В). Другой вариант синтеза эпотилона и производных эпотилона описан у Nicolaou и др. в Angew.Chem. 1997, 109, No. 1/2, стр. 170-172. Процесс синтеза эпотилонов А и В и некоторых аналогов эпотилона был описан в Nature, том 387, 1997, стр. 268-272; синтез эпотилона А и его производных описан в J.Am. Chem. Soc., том. 119, No. 34, 1997, стр. 7960-7973, а процесс синтеза эпотилонов А и В и нескольких аналогов эпотилона описан в J. Am. Chem. Soc. том. 119, No. 34, 1997, стр. 7974-7991 также у Nicolaou и др.Nicolaou и др. также описывают в Angew. Chem. 1997, 109, No. 19, стр. 2181-2187 производство аналогов эпотилона А с использованием комбинативного твердофазного синтеза. Там также описаны некоторые аналоги эпотилона В. Производные эпотилона, в некоторых случаях также и эпотилоны С и D, также описаны в патентных заявках WO 99/07592, WO 99/02514, WO 99/01124, WO 99/67252, WO 98/25929, WO 97/19086, WO 93/38192, WO 99/22461 и WO 99/58534. В производных эпотилона, известных ранее, у 6 атома углерода эпотилонового скелета не присутствовали алкенильный, алкинильный или эпокси-радикалы (см. формулу выше). Краткое описание изобретения Целью данного изобретения было сделать доступными новые производные эпотилона, которые достаточно стабильны как химически, так и метаболически для получения фармацевтических агентов,которые превосходят природные производные по своему терапевтическому воздействию, селективности действия и/или нежелательных токсических побочных эффектов и/или их активной силе. При дальнейшем изучении спецификации и приложенной формулы изобретения дальнейшие объекты и преимущества настоящего изобретения станут очевидны специалисту в данной области. В изобретение включены новые производные эпотилона и соединения общей формулы IR1a, R1b одинаковы или различны и представляют собой атом водорода, C1-С 10 алкил, который может быть необязательно перфторирован или замещен 1-5 атомами галогена, гидроксильными группами, C1-С 4 алкоксигруппами или С 6-С 12 арильными группами, которые могут быть необязательно замещены 1-3 атомами галогена,-1 011502 или вместе представляют собой группу -(СН 2)m-, в которой m=1, 2, 3, 4 или 5, или группу -(СН 2)-О-(СН 2)-,R2a представляет собой водород, C1-C10 алкил, который может быть необязательно перфторирован или замещен 1-5 атомами галогена, гидроксильными группами, С 1-С 4 алкоксигруппами или С 6-С 12 арильными группами, которые могут быть необязательно замещены 1-3 атомами галогена, -(CH2)ra-CC(CH2)pa-R26a, -(CH2)ra-C=C-(CH2)pa-R26a,n принимает значения от 0 до 5,ra, rb имеют одинаковые или разные значения от 0 до 4,pa, pb имеют одинаковые или разные значения от 0 до 3,R3a представляет собой водород, C1-С 10 алкил, который может быть необязательно перфторирован или замещен 1-5 атомами галогена, гидроксильными группами, C1-С 4 алкоксигруппами или С 6-С 12 арильными группами, которые могут быть необязательно замещены 1-3 атомами галогена,R3b представляет собой ОН или группу OPG14, где PG14 означает защитную группу,R14 представляет собой водород, OR14a или Hal, где R14a обозначает водород, SO2 алкил, SO2 арил илиSO2 аралкил,R4 представляет собой водород, C1-С 10 алкил, который необязательно замещен; Hal, OR25 или CN,R25 представляет собой водород или защитную группу PG5,R26a, R26b одинаковы или различны и представляют собой водород, С 1-С 10 алкил, который необязательно замещен, или, если pa или pb0, дополнительно группу OR27,R27 представляет собой водород или защитную группу PG6,R5 представляет собой водород, C1-С 10 алкил,R6, R7, каждый представляет собой атом водорода или вместе дополнительную связь или атом кислорода,G представляет собой группу X=CR8- или би- или трициклическую арильную группу, содержащую от 5 до 12 атомов в цикле,R8 представляет собой водород, галоген, CN или C1-С 20 алкил, С 6-С 12 арил, С 7-С 20 аралкил, каждый из которых может быть замещен,X представляет собой атом кислорода, две алкоксигруппы OR23, С 2-С 10 алкилен-,-диоксигруппу,которая может быть разветвленной или неразветвленной, H/OR9 или группу CR10R11, гдеR23 обозначает C1-С 20 алкильный радикал,R9 обозначает водород или защитную группу PGx,R10, R11 различны или одинаковы и представляют собой водород, C1-С 20 алкил, С 6-С 12 арил или С 7 С 20 аралкил, каждый из которых необязательно замещен, или R10 и R11 вместе с атомом углерода метилена образуют 5-7-членное карбоциклическое кольцо,D-E представляет собой группу -СН 2-СН 2-, -О-СН 2-,A-Y представляет собой группу О-С(=О), О-СН 2, СН 2 С(=О) или NR29-C(=O), гдеR29 обозначает водород или C1-С 10 алкил,Z представляет собой атом кислорода или H/OR12, гдеR12 является водородом или защитной группой PGz,Hal обозначает галоген,при том, что арил обозначает карбоциклическую арильную группу или гетероциклическую арильную группу, содержащую от 5 до 12 атомов, такую как, например, фенил или нафтил, или гетероциклил, содержащий 1 или более гетероатомов, выбранных из О, S, N, такой как, например, тиенил, пиридил, оксазолил, пиразолил, тиазолил, хинолил, а понятие замещенный для указанных случаев включает такие заместители для необязательных арильных заместителей, как, например, атом галогена, ОН,О-алкил, СО 2 Н, СО 2 алкил, -NH2, -NO2, N3, CN, C1-С 20 алкил, C1-С 20 ацил, С 1-С 20 ацилокси, заместители для алкильных групп, если специально не оговорено, обозначают перфторзамещение или замещение 1-5 атомами галогена, гидроксильными группами, С 1-С 4 алкоксигруппами или С 6-С 12 арильными группами, которые могут быть необязательно замещены 1-3 атомами галогена; а все защитные группы PG, в том числе имеющие верхний индекс, обозначают общепринятые, такие как, например, алкил, алкил- или арилзамещенный силил, С 4-С 7 циклоалкил, ацил, ароил, алкоксикарбонил. Получение новых производных и соединений эпотилона можно производить путем связывания трех фрагментов Af, Bf и Cf, этот способ описан далее в изобретении. Места соединения фрагментов показаны на общей формуле I' тремя линиями, перечеркивающими связи.R13 представляет собой CH2OR13a, CH2-Hal, CHO, CO2R13b, COHal,R14 представляет собой водород, OR14a, Hal, OSO2R14b,R13a, R14a представляют собой водород, SO2-алкил, SO2-арил, SO2-аралкил или вместе образуют группу -(СН 2)o- или группу CR15aR15b,R13b, R14b представляют собой водород, C1-С 20 алкил, С 6-С 12 арил, C7-С 20 аралкил, каждый из которых необязательно замещен,R15a, R15b различны или одинаковы и представляют собой водород, C1-С 10 алкил, арил, С 7-С 20 аралкил или вместе образуют группу -(CH2)q,о принимает значения от 2 до 4,q принимает значения от 3 до 6,R30 обозначает водород,R31 обозначает гидроксил, илиR30, R31 вместе обозначают атом кислорода или С 2-С 10 алкилен-,-диоксигруппу, которые могут быть разветвленными и неразветвленными, илиR30, R31 независимо друг от друга обозначают C1-С 10 алкоксигруппу,включая все стереоизомеры, так же, как и их смеси, и свободные гидроксильные группы в R13, R14 и R31 могут быть этерифицированы, эстерифицированы, свободные карбонильные группы могут быть кетализированы в А-1 или А-2 и R13, преобразованы в энольный эфир или восстановлены, а свободные кислотные группы в А-1 или А-2 могут быть преобразованы в их соли при помощи оснований.D, E, R3a', R4' and R5' имеют значения, ранее указанные для D, E, R3a, R4 и R5, иV представляет собой атом кислорода, две алкоксигруппы OR17, С 2-С 10 алкилен-,-диоксигруппу,которая может быть разветвленной или неразветвленной, или H/OR15,W представляет собой атом кислорода, две алкоксигруппы OR19, С 2-С 10 алкилен-,-диоксигруппу,которая может быть разветвленной или неразветвленной, или H/OR18,R19, R18 независимо один от другого обозначают водород или защитную группу PG1,R17, R15 независимо один от другого обозначают необязательно замещенный С 1-С 21 алкил,Cf обозначает С 13-С 16 фрагмент (система нумерации для эпотилонов) общей формулыG' представляет собой группу X=CR8', бицикло- или трициклоарильный радикал,R8' имеет значение, ранее упомянутое в общей формуле I для R8, иR7 представляет собой атом водорода,R20 представляет собой галоген, N3, NHR29, гидроксигруппу, защищенную гидроксигруппу O-PG2,защищенную аминогруппу NR29PG2, C1-С 10 алкилсульфонилоксигруппу, необязательно замещенную C1 С 4 алкилом, азотом, хлором или бромом бензоилоксигруппу, группу NR29SO2CH3, группу NR29C(=O)CH3,группу СН 2-С(=О)-СН 3,R21 представляет собой гидроксигруппу, галоген, защищенную гидроксигруппу OPG3, фосфонийгалидный радикал PPh3+Hal-(Ph=фенил; Hal=F, Cl, Br, I), фосфонатный радикал P(O)(OQ)2 (Q=C1-С 10 алкил или фенил) или фосфиноксидный радикал P(O)Ph2 (Ph=фенил),X представляет собой атом кислорода, две алкоксигруппы OR23, С 2-С 10 алкилен-,-диоксигруппу,которая может быть разветвленной или неразветвленной, H/OR9 или группу CR10R11, гдеR9 обозначает C1-С 20 алкильный радикал,R10 обозначает водород или защитную группу PG3,R10, R11 различны или одинаковы и обозначают водород, C1-С 20 алкильный, С 6-С 12 арильный или С 7 С 20 аралкильный радикал, каждый из которых необязательно замещен, илиR10 и R11 вместе с атомом углерода метилена совместно образуют 5-7-членное карбоциклическое кольцо. В качестве алкильных групп R1a, R1b, R2a, R2b, R3a, R4, R5, R8, R10, R11, R13a, R13b, R14a, R14b, R15a, R15b,17R , R19, R23, R26a, R26b, R28a, R28b и R29 могут служить разветвленные или неразветвленные алкильные группы с 1-20 атомами углерода, такие как, например, метил, этил, пропил, изопропил, бутил, изобутил,трет-бутил, пентил, изопентил, неопентил, гептил, гексил и децил. Алкильные группы R1a, R1b, R2a, R2b, R3a, R4, R5, R8, R10, R11, R13a, R13b, R14a, R14b, R15a, R17, R19, R23, R26a,26bR , R28a, R28b и R29 могут быть перфторированы или замещены 1-5 атомами галогена, гидроксигруппами,С 1-С 4 алкоксигруппами, С 6-С 12 арильными группами (которые могут быть замещены 1-3 атомами галогена). В качестве арильных радикалов, упомянутых выше и далее, в частности R1a, R1b, R2a, R2b, R3a, R4, R5,8 10R , R , R11, R13a, R13b, R14a, R14b, R15a, R17, R19, R23, R26a, R26b, R28a, R28b и R29, приемлемыми примерами могут быть замещенные или незамещенные карбоциклические или гетероциклические радикалы с 1 или более гетероатомами, такие как, например, фенил, нафтил, фурил, тиенил, пиридил, пиразолил, пиримидинил,оксазолил, пиридазинил, пиразинил, хинолил, тиазолил, бензотиазолил и бензоксазолил, которые могут быть замещены в одной или более позициях галогеном, ОН, О-алкильной, СО 2 Н, СО 2-алкильной, -NH2,-NO2, -N3, -CN, C1-С 20 алкильной, C1-С 20 ацильной, C1-С 20 алкоксигруппами. В качестве би- и трициклических арильных радикалов G или G' пригодны замещенные и незамещенные, карбоциклические или гетероциклические радикалы с 1 или более гетероатомами, такие как,например, нафтил, антрил, бензотиазолил, бензоксазолил, бензимидазолил, хинолил, изохинолил, бензоксазинил, бензофуранил, индолил, индазолил, хиноксалинил, тетрагидроизоквинолинил, тертрагидрохинолинил, тиенопиридинил, пиридориридинил, бензопиразолил, бензотриазолил, дигидроиндолил, которые могут быть замещены или незамещены в одной или более позициях галогеном, ОН, О-алкильной,СО 2 Н, СО 2-алкильной, -NH2, -NO2, -N3, -CN, С 1-С 20 алкильной, C1-С 20 ацильной, C1-С 20 алкоксигруппами. Аралкильные группы в R1a, R1b, R2a, R2b, R3a, R4, R5, R8, R10, R11, R13a, R13b, R14a, R14b, R15a, R15b, R17,19R , R23, R26a, R26b, R28a, R28b и R29 могут иметь в кольце(ах) до 14 С атомов, предпочтительно от 6 до 10, а в алкильной цепи от 1 до 8, предпочтительно от 1 до 4 атомов. В качестве аралкильных радикалов пригодны, например, бензил, фенилэтил, нафтилметил, нафтилэтил и пиридинилпропил. Кольца могут быть замещены в одной или более позициях галогеном, ОН, О-алкильной, СО 2 Н, СО 2-алкильной, -NH2, -NO2,-N3, -CN, С 1-С 20 алкильной, C1-С 20 ацильной, C1-С 20 алкоксигруппами. Алкоксигруппы, присутствовавшие в R30 R31 и X в общей формуле I, в каждом случае должны содержать от 1 до 20 атомов углерода, предпочтительными являются метокси, этокси, пропокси, изопропокси и т-бутоксигруппы. В качестве представителей всех защитных групп PG (т.е. каждой из защитных групп PG, включая имеющие верхний индекс) можно упомянуть алкил- и/или арилзамещенный силил, С 1-С 20 алкил, С 4-С 7 циклоалкил,который дополнительно может содержать атом кислорода в кольце, арил, С 7-С 20 аралкил, C1-С 20 ацил, ароил и С 1 С 20 алкоксикарбонил. Другие защитные группы известны в данной области и могут использоваться, как известно. В качестве алкильных, силильных и ацильных радикалов для защитных групп PG пригодны радикалы, известные специалисту в данной области техники. Предпочтительными являются алкильные или силильные радикалы, которые могут легко отщепляться от соответствующих алкиловых и силиловых эфиров, такие как, например, метоксиметил, метоксиэтил, этоксиэтил, тетрагидропиранил, тетрагидрофуранил, триметилсилил, триэтилсилил, трет-бутилдиметилсилил, трет-бутилдифенилсилил, трибензилсилил,триизопропилсилил, бензил, паранитробензил, параметоксибензил, а также алкилсульфонил и арилсуль-4 011502 фонил. В качестве ацильных радикалов пригодны, например, формил, ацетил, пропионил, изопропионил,пивалил, бутирил или бензоил, которые могут быть замещены амино- и/или гидроксигруппами. В качестве аминозащитных групп пригодны радикалы, известные специалисту в данной области техники. В качестве примера можно упомянуть Alloc-, Boc-, Z-, бензил, f-moc-, Troc, Stabase или Benzostabase группы. Ацильные группы PG могут содержать от 1 до 20 атомов углерода, предпочтительными являются формильная, ацетильная, пропионильная, изопропионильная и пивалильная группы. Индекс m в алкиленовой группе, образованной из R1a и R1b, предпочтительно обозначает 1, 2, 3 или 4. Соединения, перечисленные ниже, являются предпочтительными по изобретению:(1R,3S,7S,10R,11S,12S,16R)-7,11-дигидрокси-3-(2-метилбензоксазол-5-ил)-10-(проп-2-ен-1-ил)8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион (В). Получение частичных фрагментов Af Частичные фрагменты (компоненты синтеза) общей формулы А-1 можно получить исходя из предшественников, описанных в WO 99/07692, таких как, например, А-1. Процесс подробнее пояснен на примере по схеме 1. Схема 1 Стадия а (А-IA-II) Гидроксильную группу, защищенную PG7 в A-I, освобождают. В качестве защитной группы PG7 пригодны защитные группы, описанные выше и известные специалисту в данной области техники, такие как, например, метоксиметил, метоксиэтил, этоксиэтил, тетрагидропиранил, тетрагидрофуранил, триме-6 011502 тилсилил, триэтилсилил, трет-бутилдиметилсилил, трет-бутилдифенилсилил, трибензилисилил, триизопропилсилил, бензил, паранитробензил, параметоксибензил, формил, ацетил, пропионил, изопропионил,пивалил, бутирил или бензоил. Описание можно найти, например, в "Protective Groups in Organic Synthesis",Theodora W. Green, John Wiley and Sons. Предпочтительными являются группы, которые могут отщепляться под воздействием фторида, такие как, например, триметилсилильный, трет-бутилдиметилсилильный, трет-бутилдифенилсилильный,трибензилсилильный или триизопропильный радикалы. Особенно предпочтительными являются трет-бутилдиметилсилильный радикал, триизопропилсилильный радикал и трет-бутилдифенилсилильный радикал. В качестве защитных групп PG8a и PG8b применимы группы, ранее упомянутые для PG7, и группа -CR28aR28b, в которой R28a и R28b могут быть различны или одинаковы и обозначают водород, C1-С 10 алкил, арил, С 7-С 20 аралкил. Предпочтительными являются защитные группы -CR28aR28b, в которых R28a и R28b обозначают C1 С 8 алкил или R28a представляет собой водород, a R28b представляет собой арил. Особенно предпочтительной является группа -С(СН 3)2. Защитную группу PG7 отщепляют по способу, известному специалисту в данной области техники. Так как ею является силиловый эфир, то для отщепления используют реакцию с фторидами, такими как,например, фторид тетрабутиламмония, фтороводород-пиридиновый комплекс, фторид калия, или используют разведенные минеральные кислоты, используют каталитические количества кислот, таких как,например, паратолуолсульфоновая кислота, паратолуолсульфоновая соль пиридина, камфорсульфоновая кислота в спиртовых растворах, предпочтительно в этаноле или изопропаноле. Стадия b (A-IIA-III) Окисление первичного спирта A-II до альдегида А-III проводят по методам, известным специалисту в данной области техники. В качестве примера можно упомянуть окисление хлорохроматом пиридина,дихроматом пиридина, триоксид хрома-пиридиновым комплексом, окисление по методу Сверна и подобным, например с использованием хлорида оксалила и сульфоксида диметила, с использованием периодинана Десса-Мартина, с использование оксидов азота, таких как, например, N-метилморфолино-Nоксид в присутствии соответствующих катализаторов, таких как, например, перрутенат тетрапропиламмония в инертных растворителях. Предпочтительным является окисление по Сверну, а также N-метилморфолино-N-оксидом с использованием перрутената тетрапропиламмония. Стадия с (A-IIIA-IV) Реакцию альдегидов А-III с получением спиртов формулы A-IV проводят с органометаллическими соединениями теоретической формулы M-CHR2R2a', в которой М обозначает индий, щелочной металл,предпочтительно литий или двухвалентный металл MX, где X представляет собой галоген, а радикал R2a' имеет значения, упомянутые выше. В качестве двухвалентных металлов предпочтительными являются магний и цинк; в качестве галогена X предпочтительны хлор, бром и йод. Стадия d (A-IVA-V) Окисление вторичного спирта A-IV до кетона A-V проводят в условиях, указанных для стадии b). Предпочтительно окисление N-метилморфолино-N-оксидом с помощью перрутената тетрапропиламмония. Стадия е (A-VA-VI) Для необязательного присоединения радикала R2b, который может иметь указанные ранее значения,кроме водорода, кетон общей формулы А-V переводят в энолат с М в значении контркатиона при помощи сильных оснований, таких как предпочтительно диизопропиламид лития. Стадия f (A-VIA-VII) Энолат формулы A-VI подвергают реакции с соединением общей формулы X-R2b', в которой X представляет собой галоген или другую уходящую группу, такую как, например, алкилсульфонат или арилсульфонат. В качестве галогена X предпочтительны хлор, бром и йод. Частичные фрагменты (компоненты синтеза) общей формулы А-2 можно получить по методам,описанным в Angew. Chemie 1996, 108, 2976-2978. Еще один способ показан на схеме 2. Схема 2-7 011502 Стадия а (А-VIIIA-IX) Окисление первичного спирта А-VIII до альдегида A-IX проводят по методам, описанным для стадии b схемы 1. Предпочтительны окисление по Сверну и N-метилморфолино-N-оксидом при помощи перрутената тетрапропиламмония. Стадия b (A-IXА-Х) Карбонильную группу в A-IX можно необязательно перевести в кеталь с использованием методов,известных специалисту в данной области техники. Стадия с (А-ХA-XI) Гидроксильную группу, защищенную в А-Х защитной группой PG9, освобождают. В качестве защитной группы PG9 пригодны защитные группы, описанные для стадии схемы 1. Предпочтительны защитные группы, которые могут быть отщеплены воздействием фторида, такие как, например, триметилсилильный, трет-бутилдиметилсилильный, трет-бутилдифенилсилильный, трибензилсилильный или триизопропильный радикалы. Особенно предпочтительны трет-бутилдиметилсилильный радикал, триизопропилсилильный радикал и трет-бутилдифенилсилильный радикал. Стадия d (A-XIA-XII) Окисление первичного спирта A-XI до альдегида A-ХII проводят по методам, описанным для стадии b схемы 1. Предпочтительно окисление по Сверну и N-метилморфолино-N-оксидом при помощи перрутената тетрапропиламмония. Стадия е (А-XIIA-XIII) Присоединение радикалов R2a' и/или R2b' и получение кетона A-XIII проводят, как описано для стадий c-f схемы 1. Получение частичных фрагментов Bf Частичные фрагменты (компоненты синтеза) общей формулы Bf можно получить по методам, описанным в WO 59/07692. Получение частичных фрагментов Cf Частичные фрагменты (компоненты синтеза) общей формулы Cf можно получить по методам, описанным в DE 19751200.3, DE 19907480.1 и WO 99/07692, а также в РСТ/ЕР 00/01333 и примере 21. Получение частичных фрагментов Af, Bf и Cf, а также их циклизация в соединение формулы I также проводят аналогично описанному в WO 99/07692 для различных производных эпотилона, с той разницей, что в известных производных в 6 позиции не присутствует ненасыщенный радикал. WO 99/07692 уже подтверждает общую практичность принципа синтеза, описанного ниже для соединений по изобретению. Дополнительно в WO 99/07692 описаны многочисленные компоненты синтеза с общими формулами Af, Bf и Cf, из которых, необязательно в модифицированной форме в случае замещения по изобретению на 6 атоме углерода, можно получить другие соединения общей формулы I по настоящему изобретению. Компоненты синтеза общей формулы Cf, в которых в качестве R8 выступает атом галогена, в особенности атом фтора, хлора или йода, являются объектом DE 15907480.1, а также РСТ/ЕР 0/01333. Частичные фрагменты общей формулы АВPG представляет собой атом водорода или защитную группу PG, можно получить из вышеупомянутых фрагментов Af и Bf по способу, показанному на схеме 3. 14' Стадия aa (+BfАВ) Соединение Bf, в котором W обозначает атом кислорода и необязательно присутствующие карбонильные группы защищены, алкилируют энолятом карбонильного соединения общей формулы Af. Энолят получают воздействием сильных оснований, таких как, например, диизопропиламид лития, гексаметилдисилазан лития при низких температурах. Частичные фрагменты общей формулы ВС в которой R3a, R4, R5, R6, R7, R20, D, E, С и W имеют значения, упомянутые ранее, получают из ранее описанных фрагментов Bf и Cf по способу, показанному на схеме 4. Схема 4 Стадия ab (Bf+CfВС) Соединение С, в котором R21 обозначает соль Виттига и необязательно присутствующие дополнительные карбонильные группы защищены, депротонируют подходящим основанием, таким как, например, н-бутиллитий, диизопропиламид лития, трет-бутанолат калия, гексаметилдисилазид натрия или лития, и проводят реакцию с соединением Bf, в котором V обозначает кислород, a W обозначает две алкоксигруппы OR19, С 2-С 10 алкилен-,-диоксигруппу, которая может быть разветвленной или неразветвленной или содержать H/OR18. Частичные фрагменты общей формулы ABC (AB+Cf) в которой R1a', R1b', R2a', R2b', R3a, R4, R5, R6, R7, R13, R14, R30, R31, D, E, G и Z имеют уже упомянутые значения, a PG14' представляет собой атом водорода или защитную группу PG, получают из ранее описанных фрагментов АВ и С по способу, показанному на схеме 5 и схеме 6. Схема 5 Стадия ас (AB+CfABC) Соединение Cf, в котором R21 обозначает соль Виттига, а необязательно присутствующие дополнительные карбонильные группы необязательно защищены, депротонируют подходящим основанием, например н-бутиллитием, диизопропиламидом лития, трет-бутанолатом калия, гексаметилдисилазидом натрия или лития, и проводят реакцию с соединением АВ, в котором V обозначает атом кислорода. Схема 6 Стадия ad (Af+ВСABC) Соединение ВС, в котором W обозначает атом кислорода, а необязательно присутствующие карбонильные группы защищены, алкилируют энолятом карбонильного соединения формулы Af. Энолят получают действием сильных оснований, таких как, например, диизопропиламид лития, гексаметилдисила- 10011502 зан лития, при низких температурах. Стадия ае (АВС-1I) Соединения АВС-1, в которых R13 представляет собой карбоксильную кислоту СО 2 Н, a R20 представляет собой гидроксильную группу или аминогруппу, подвергают реакции по методам, известным специалисту в данной области техники, для образования больших макролидов или макролактамов соединений формулы I, в которых A-Y имеют значение О-(С=О) группы или NR29-C(=O) группы. Например,предпочтительным для образования лактона является метод, описанный в "Reagents for OrganicSynthesis", том 16, стр. 353, с применением 2,4,6-трихлорбензойной кислоты и подходящих оснований,таких как, например, триэтиламин, 4-диметиламинопиридин, гидрид натрия. Например, для образования лактама предпочтительна реакция аминокислоты (R13 обозначает карбоксильную кислоту СО 2 Н и R20 обозначает группу NHR29) с дифенилфосфорилазидом в присутствии основания. Стадия af (АВС-1I) Соединения АВС-1, в которых R13 представляет собой группу СН 2 ОН, a R20 представляет собой гидроксильную группу, можно подвергать реакции предпочтительно с применением трифенилфосфина и азодиэфиров, таких как, например, диэтиловый эфир азодикарбоксильной кислоты, для получения соединений формулы I, в которой A-Y обозначает О-СН 2 группу. Соединения ABC, в которых R13 представляет собой группу СН 2-Hal, или CH2OSO2-алкил, илиCH2OSO2-арил, или CH2OSO2-аралкил, a R20 представляет собой гидроксильную группу, можно циклизировать до получения соединений формулы I, в которой A-Y обозначают O-CH2 группу, после депротонации пригодными основаниями, такими как, например, гидрид натрия, н-бутиллитий, 4-диметиламинопиридин, основание Хнига, алкилгексаметилдизилазаны. Стадия ag (ABC-21) Соединения АВС-2, в которых R30 и R31 совместно представляют собой атом кислорода, a R20 представляет собой группу NR29SO2CH3, можно циклизировать при низких температурах до получения сульфонамида I, в котором A-Y обозначает группу NR29SO2, воздействием сильных оснований, таких как,например, диизопропиламид лития, гексаметилдисилазан лития. Стадия ah (АВС-21) Соединения АВС-2, в которых R30 и R31 совместно представляют собой атом кислорода, a R20 представляет собой группу О-С(=О)СН 3, можно циклизировать при низких температурах до лактона I, в котором A-Y обозначает группу О-С(=O), воздействием сильных оснований, таких как, например, диизопропиламид лития или щелочной гексаметилдисилизан. Стадия ah (ABC-2I) Соединения АВС-2, в которых R30 и R31 совместно представляют собой атом кислорода, a R20 представляет собой группу СН 2 С(=О)СН 3, можно циклизировать при низких температурах до получения лактона I, в котором A-Y обозначает группу СН 2 С(=О), воздействием сильных оснований, таких как, например, диизопропиламид лития, щелочной гексаметилдисилазан. Введение азотной группы R20 29 Аминогруппу NHR можно ввести на стадии Cf-фрагмента, ВС-фрагмента или ABC-фрагмента по методам, известным специалисту в данной области техники. Предпочтительным является получение из азида (R20=N3), который сначала переводят в фосфамин по методам, известным специалисту в данной области техники, предпочтительно с использованием фосфина, такого как, например, трифенилфосфин; фосфамин затем переводят в присутствии воды в амин (R20=NHR29), который должен быть необязательно защищен для последующей серии реакций. Внедрение азида можно проводить с использованием реакции Мицуноби в присутствии азидов металлов, предпочтительно азида натрия или олова, или замещением подходящей уходящей группы, такой как, например, атом хлора, брома или йода, алкилсульфонилоксигруппа, перфторированная алкилсульфонилоксигруппа, арилсульфонилоксигруппа или аралкилсульфонилоксигруппа, азидами. Гибкая функционализация описанных компонентов Af, Bf и Cf также позволяет получить последовательность связывания, которая является следствием вышеописанного способа и приводит к получению компонентов ABC. Эти способы перечислены в следующей таблице. По этим способам компоненты Af, Bf и Cf могут быть связаны, как показано на схеме 7. Свободные гидроксильные группы в I, Af, Bf, Cf, AB, ВС, ABC могут быть в дальнейшем функционально модифицированы этерификацией или эстерификацией, свободные карбонильные группы - кетализацией, образованием энольного эфира или восстановлением. Изобретение относится ко всем стереоизомерам этих соединений, а также к их смесям. Изобретение также относится ко всем пролекарственным формам этих соединений, т.е. всем соединениям, реализующим in vivo биоактивный активный ингредиент общей формулы I. Биологическое действие и применение новых производных Новые соединения формулы I являются ценными фармацевтическими агентами. Они взаимодействуют с тубулином, стабилизируя образующиеся микротубулы, и таким образом способны влиять на разрушение клеток фазово-специфическим образом. Следовательно, соединения применимы для лечения болезней или состояний, связанных с ростом, делением и/или пролиферацией клеток. Особенно они применимы с быстрорастущими клетками новообразований, рост которых не регулируется межклеточными регуляторными механизмами. Активные ингредиенты, включая соединения по изобретению,имеющие свойства этого типа, пригодны для лечения злокачественных опухолей. В качестве применения можно упомянуть, например, терапию карциномы яичников, желудка, толстой кишки, аденокарциномы,карциномы молочной железы, легкого, головы, шеи, злокачественной меланомы, острой лимфоцитной и миелоцитной лейкемии, в частности против связанных с ними опухолей. Соединения по изобретению благодаря своим свойствам также пригодны для терапии против ангиогенеза, а также лечения хронических воспалительных заболеваний, таких как, например, псориаз, рассеянный склероз или артрит. Соединения, описанные в изобретении, имеют свойства, аналогичные известным для производных эпотилона, описанным выше, но с преимуществами, описанными выше и далее. Как и известные эпотилоны,новые соединения можно назначать аналогично известным лекарствам, таким как таксол, но с некоторыми модификациями для того, чтобы в полной мере использовать их преимущества. В другом воплощении новые соединения или фармацевтические препараты, их содержащие, можно наносить или добавлять в полимерные материалы, используемые для медицинских имплантатов, для их лучшего приживления и/или избежания неконтролируемой пролиферации клеток. Соединения по изобретению можно использовать отдельно или в комбинации с другими элементами и классами веществ, которые могут использоваться в терапии новообразований, для аддитивного или синергического действия. В качестве примера можно упомянуть комбинацию с платиновыми комплексами, такими как, например, цис-платина, карбоплатина,интерполирующими веществами, например, принадлежащими к классу антрациклинов, такими как,например, доксорубицин, или принадлежащими к классу антрпиразолов, такими как, например, Cl-941,веществами, взаимодействующими с тубулином, например, принадлежащими к классу винка-алка- 13011502 лоидов, такими как, например, винкристин, винбластин, или принадлежащими к классу таксанов, такими как, например, таксол, таксотер, или принадлежащими к классу макролидов, такими как, например, ризоксин или другие соединения, такие как, например, колхицин, комбретастатин А-4, дискодермолид и его аналоги,ингибиторами ДНК-топоизомеразы, такими как, например, камптотецин, этопозид, топотецан, тенипозид,антиметаболитами фолата или пиримидина, такими как, например, лометрексол, гемцитубин,ДНК-алкилирующими соединениями, такими как, например, адозелезил, дистамицин А,ингибиторами факторов роста (например, PDGF, EGF, TGFb, EGF), такими как, например, антагонисты соматостатина, сурамина, бомбесина,ингибиторами протеинтирозинкиназ или протеинкиназ А или С, такими как, например, эрбстатин,генистеин, стауроспорин, илмофозин, 8-Cl-сАМР,антигормонами из класса антигестагенов, такими как, например, мифепристон, онапристон, или из класса антиэстрогенов, такими как, например, тамоксифен, или из класса антиандрогенов, такими как,например, ципротерон ацетат,соединениями, ингибирующими метастазы, например, из класса эйкозаноидов, такими как, например, PGL2, PGE1, 6-оксо-PGE1, а также их более стабильные производные (например, илопрост, цикапрост, мизопростол),ингибиторами онкогенных RAS протеинов, имеющих влияние на трансдукцию митотического сигнала, такими как, например, ингибиторы фарнесилпротеинтрансферазы,природными или синтетически изготовленными антителами, направленными против факторов, способствующих росту новообразований, или их рецепторов, такими как, например, антитело erbB2. Изобретение также относится к фармацевтическим агентам, основанным на фармацевтичевски совместимых соединениях, т.е. соединениях общей формулы I, которые не являются токсичными в используемых дозах, необязательно совместно с обычно используемыми адъювантами и растворителями. В других воплощениях соединения по изобретению могут быть инкапсулированы с липосомами или включены в -, - или -циклодекстриновый клатрат. По методам галенов, известным в данной области техники, из соединений по изобретению можно создавать фармацевтические препараты для внешнего, подкожного, парентерального или локального применения. Их можно применять, например, в форме таблеток, таблеток с покрытием, гелевых капсул,гранулятов, суппозиториев, имплант (капиллярных трубочек), впрыскиваемых, стерильных, водных или масляных растворов, суспензий или эмульсий, мазей, кремов и гелей. В этом случае активный компонент или компоненты могут быть смешаны с адъювантами, обычно используемыми в галенах, такими как, например, гуммиарабик, тальк, крахмал, маннитол, метилцеллюлоза, лактоза, ПАВ, такие как Tweens или Myrj, стеарат магния, водные и неводные растворители, производные парафина, детергенты, диспергаторы, эмульгаторы, консерванты и вкусовые добавки для коррекции вкуса (например, эфирные масла). Таким образом, изобретение также относится к фармацевтическим композициям, содержащим в качестве активного компонента по крайней мере одно соединение по изобретению. Единица дозирования предпочтительно будет содержать около 0,1-100 мг активного компонента(ов). Для человека дозировка соединений по изобретению предпочтительно составляет приблизительно 0,1-1000 мг в день. Примеры, приведенные ниже, служат для более детального пояснения изобретения, никоим образом его не ограничивая. Полное описание всех заявок, патентов и публикаций, упомянутых выше или далее, и соответствующих патентных заявок 19921086.1, поданной 30 апреля 1999, и 19954228.7, поданной 4 ноября 1999 (Германия), включены в данную заявку в качестве ссылки. Примеры Без дальнейших уточнений предполагается, что специалист в данной области техники может, используя предшествующее описание, использовать настоящее изобретение в полном объеме. Приведенные ниже предпочтительные конкретные воплощения, таким образом, должны рассматриваться только как иллюстративные и не ограничивающие остальную часть открытия никоим образом. В упомянутых выше и последующих примерах все температуры без исключения измеряются в градусах Цельсия; и, если не указано другое, все части и проценты исчисляются по массе. Пример 1. 4S,7R,8S,9S,13Z,16S(E)-4,8-Дигидрокси-16-(1-метил-2-(2-пиридил)этенил)-1-окса-5,5,9,13 тетраметил-7-(бут-3-ин-1-ил)циклогексадец-13-ен-2,6-дион. Получение (4S(4R,5S,6S,10E/Z,13S,14 Е-(13-гидрокси-5-(тетрагидро-2H-пиран-2-илокси)-2,6,10,14 тетраметил-3-оксо-15-(2-пиридил)-4-(бут-3-ин-1-ил)ундец-6-ин-2-ил)-2,2-диметил[1,3]диоксан; вариант I. Пример 1a. (3RS,4S)-4-(2-Метил-3-гидрокси-8-(триметилсилил)окт-7-ин-2-ил)-2,2-диметил[1,3]диоксан. Раствор 6,33 г (34 ммоля) (4S)-4-(2-метил-1-оксо-проп-2-ил)-2,2-диметил[1,3]диоксана, который получают аналогично способу, описанному в DE 19751200.3, в 10 мл безводного тетрагидрофурана смешивают по частям в атмосфере сухого аргона с 50 ммоль раствора бромида 5-триметилсилил-пент-4-ин-1 ил-магния в тетрагидрофуране, нагревают до 60 С и перемешивают на протяжении 1,5 ч. Выливают на- 14011502 воду и экстрагируют несколько раз этилацетатом. Соединенные органические экстракты промывают водой и концентрированным раствором хлорида натрия и сушат на сульфате натрия. Остаток, полученный после фильтрации и удаления растворителя, очищают тонкослойной хроматографией на силикагеле с разделительной системой, состоящей из н-гексана и этилацетата. Выделяют 6,22 г (19 ммоль, 56%) разделяемых хроматографией 3R- и 3S-эпимеров соединения, указанного в заголовке, и 1,35 г (4S)-4-(2-метил-1-гидрокси-проп-2-ил)-2,2-диметил[1,3]диоксана, в каждом случае имеющих вид бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3): =0,14 (9 Н), 0,73+0,88 (3 Н), 0,91 (3 Н), 1,28-1,93 (12 Н), 2,21-2,33 (2 Н), 3,40-3,72(2 Н), 3,80-4,03 (3 Н) ppm. Пример 1b. (4S)-4-(2-Метил-3-оксо-3-(триметилсилил)окт-7-ин-2-ил)-2,2-диметил[1,3]диоксан. Раствор 6,22 г (19 ммоль) смеси соединений, получаемых по примеру 1 а, в 200 мл безводного дихлорометана смешивают с молекулярным ситом (4 , около 20 дробинок), 4,01 г N-метилморфолино-Nоксида, 335 мг перрутената тетрапропиламмония и перемешивают на протяжении 16 ч при 23 С в атмосфере сухого аргона. Продукты реакции концентрируют выпариванием, полученный неочищенный продукт очищают тонкослойной хроматографией на силикагеле с градиентной системой, состоящей из нгексана и этилацетата. 5,17 г (15,9 ммоль, 84%) соединения, указанного в заглавии, изолируют в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3): =0,15 (9 Н), 1,07 (3 Н), 1,13 (3 Н), 1,28-1,36 (1H), 1,33 (3 Н), 1,41 (3 Н), 1,53-1,81(3 Н), 2,22 (2 Н), 2,62 (2 Н), 3,85 (1 Н), 3,97 (1 Н), 4,06 (1 Н) ppm. Пример 1 с. (4S(4R,5S,6S,10RS-4-(5-Гидрокси-2,6-диметил-3-оксо-4-(4-(триметилсилил)бут-3-ин-1-ил)-10 дифенил(1,1-диметилэтил)силил]окси]ундец-6-ин-2-ил)-2,2-диметил[1,3]диоксан (А) и (4S(4S,5R,6S,10RS4-(5-гидрокси-2,6-диметил-3-4-(4-(триметилсилил)бут-3-ин-1-ил)-10-дифенил(1,1-диметилэтил)силил] окси]ундец-6-ин-2-ил)-2,2-диметил[1,3]диоксан (В). Раствор 1,33 мл диизопропиламина в 35 мл безводного тетрагидрофурана охлаждают в атмосфере сухого аргона до -30 С, смешивают с 4,28 мл 2,4-молярного раствора н-бутиллития в н-гексане и перемешивают на протяжении 15 мин. При температуре -78 С по каплям добавляют раствор 2,87 г (8,84 моль) соединения, получаемого по примеру 1 с в 35 мл тетрагидрофуране, и дают прореагировать в течение 1 ч. Затем медленно смешивают с раствором 3,93 г (10,3 ммоль) (2S,6RS)-2-метил-6-(трет-бутилдифенилсилилокси)гептанала, который получают аналогично способу, описанному в DE 19751200.3, в 35 мл тетрагидрофурана и через 1 ч выливают на концентрированный раствор хлорида аммония. Разбавляют водой,экстрагируют несколько раз этилацетатом, объединенные органические экстракты промывают концентрированным раствором хлорида натрия, сушат на сульфате натрия и концентрируют выпариванием в вакууме. После колоночной хроматографии на силикагеле с разделительной системой, состоящей из нгексана и этилацетата, кроме исходного материала получают 2,40 г (3,39 ммоль, 38%) заглавного соединения A и 1,52 г (2,15 ммоль, 24%) диастереомера В. 1(6H), 7,67 (4H) ppm. Пример 1d. (4S(4R,5S,6S,10RS-4-(2,6-Диметил-3-оксо-4-(4-(триметилсилил)-5-(тетрагидро-2 Н-пиран 2-илокси)бут-3-ин-1-ил)-10-дифенил(1,1-диметилэтил)силил]окси]ундец-6-ин-2-ил)-2,2-диметил[1,3]диоксан. Раствор 2,35 г (3,32 ммоль) соединения А, полученного по примеру 1 с, в 55 мл безводного дихлорометана смешивают в атмосфере сухого аргона с 3,04 мл 3,4-дигидро-2H-пирана, 0,67 г п-толуолсульфоновой кислоты и перемешивают при 23 С на протяжении 48 ч. Выливают на концентрированный раствор бикарбоната натрия, органическую фазу отделяют и сушат на сульфате натрия. После фильтрации и удаления растворителя остаток хроматографируют на тонкослойном силикагеле со смесью, состоящей из нгексана и этилацетата. 2,29 г (2,89 ммоль, 87%) заглавного соединения изолируют в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3): =0,05 (9 Н), 0,88-2,15 (28 Н), 1,03 (9 Н), 1,41 (3 Н), 1,59 (3 Н), 2,21-2,48 (1 Н), 3,314,53 (9 Н), 7,30-7,45 (6 Н), 7,69 (4 Н) ppm. Пример 1 е. (4S(4R,5S,6S,RS-4-(2,6-Диметил-10-гидрокси-3-оксо-5-(тетрагидро-2 Н-пиран-2-илокси)-4-(бут-3-ин-1-ил)ундец-6-ин-2-ил)-2,2-диметил[1,3]диоксан. Раствор 2,48 г (3,13 ммоль) соединения, полученного по примеру 1d, в 25 мл безводного тетрагидрофурана смешивают в атмосфере сухого аргона с 12,5 мл 1-молярного раствора фторида тетрабутиламмония в тетрагидрофуране и смесь перемешивают при 23 С в течение 4 ч. Смешивают с концентрированным раствором бикарбоната натрия, несколько раз экстрагируют этилацетатом, промывают концентрированным раствором хлорида натрия и сушат на сульфате натрия. Остаток, полученный после фильтрации и удаления растворителя, очищают тонкослойной хроматографией на силикагеле (разделительная система состоит из н-гексана и этилацетата). 1,41 г (2,93 ммоль, 94%) заглавного соединения изолируют- 15011502 в виде бесцветного маслянистого вещества. Пример 1f. (4S(4R,5S,6S,10RS-4-(2,6-Диметил-3,10-диоксо-5-(тетрагидро-2H-пиран-2-илокси)-4(бут-3-ин-1-ил)ундец-6-ин-2-ил)-2,2-диметил[1,3]диоксан. Аналогично примеру 1b, 1,27 г (2,63 ммоль) соединения, получаемого по примеру 1 е, подвергают реакции и после обработки и очистки изолируют в виде бесцветного маслянистого вещества 1,14 г (2,38 ммоль,91%) заглавного соединения. 1 Н-ЯМР (CDCl3): =0,95-2,48 (29H), 0,98+1,01 (3 Н), 1,42 (3 Н), 2,13 (3 Н), 3,29-3,47 (2 Н), 3,64-4,04(4H), 4,20+4,32 (1H), 4,39+4,50 (1 Н) ppm. Пример 1g. (4S(4R,5S,6S,10E/Z,13S,14 Е-4-(13-Дифенил(1,1-диметилэтил)силил]окси]-5-(тетрагидро 2H-пиран-2-илокси)-2,6,10,14-тетраметил-3-оксо-15-(2-пиридил)-4-(бут-3-ин-1-ил)ундец-6-ин-2-ил)-2,2 диметил[1,3]диоксан. Суспензию 2,87 г (3,57 ммоль) йодида (5 Е,3S)-[3-(1,1-диметилэтил)дифенилсилил]окси]-4-метил-5-(2 пиридил)пент-4-ен-1-ил]трифенилфосфония, полученного аналогично способу, описанному в DE 19751200.3,в 11 мл безводного тетрагидрофурана смешивают при 0 С в атмосфере сухого аргона с 2,72 мл 1,6 М раствора н-бутиллития в н-гексане и нагревают до 23 С. К красному раствору медленно по каплям добавляют раствор 1,14 г (2,38 ммоль) соединения, полученного по примеру 1f, в 11 мл тетрагидрофурана, оставляют перемешиваться на 2 ч, выливают на концентрированный раствор хлорида аммония и экстрагируют несколько раз этилацетатом. Объединенные органические экстракты сушат на сульфате натрия и концентрируют выпариванием в вакууме. После колоночной хроматографии на силикагеле (разделительная система состоит из н-гексана и этилацетата) получают, кроме 20% исходного материала, 860 мг (0,98 ммоль, 41%) заглавного соединения. 1(3 Н), 4,92-5,24 (1 Н), 6,16-6,76 (1 Н), 6,92-7,08 (2 Н), 7,21-7,43 (6 Н), 7,49-7,72 (5 Н), 8,55 (1 Н) ppm. Пример 1h; вариант I. (4S(4R,5S,6S,10E/Z,13S,14 Е-4-(13-Гидрокси-5-(тетрагидро-2 Н-пиран-2-илокси)2,6,10,14-тетраметил-3-оксо-15-(2-пиридил)-4-(бут-3-ин-1-ил)ундец-6-ин-2-ил)-2,2-диметил[1,3]диоксан. 482 мг (550 моль) соединения, полученного по примеру 1g, подвергают реакции аналогично примеру 1g и после обработки и сушки изолируют в виде бесцветного маслянистого вещества 256 мг (401 моль,73%) заглавного соединения. 1 Н-ЯМР (CDCl3): =0,88-2,48 (35 Н), 1,42 (3 Н), 1,64+1,72 (3 Н), 2,08 (3 Н), 3,29-3,47 (2 Н), 3,64-4,04(4 Н), 4,12-4,35 (2 Н), 4,41+4,51 (1 Н), 5,20 (1H), 6,59 (1 Н), 7,09 (1 Н), 7,23 (1 Н), 7,63 (1 Н), 8,60 (1 Н) ppm. Получение (4S(4R,5S,6S,10E/Z,13S,14 Е-4-(13-гидрокси-5-(тетрагидро-2 Н-пиран-2-илокси)-2,6,10,14 тетраметил-3-оксо-15-(2-пиридил)-4-(бут-3-ин-1-ил)ундец-6-ин-2-ил)-2,2-диметил[1,3]диоксан; вариант II. Пример 1i. (4S(4R,5S,6S,10E/Z,13S,14 Е-4-(13-Дифенил(1,1-диметилэтил)силил]окси]-5-гидрокси 2,6,10,14-тетраметил-3-оксо-15-(2-пиридил)-4-(4-(триметилсилил)бут-3-ин-1-ил)ундец-6-ин-2-ил)-2,2-диметил-[1,3]диоксан (А) и (4S(4S,5R,6S,10E/Z,13S,14 Е-4-(13-дифенил(1,1-диметилэтил)силил]окси]-5 гидрокси-2,6,10,14-тетраметил-3-оксо-15-(2-пиридил)-4-(4-(триметилсилил)бут-3-ин-1-ил)ундец-6-ин-2 ил)-2,2-диметил[1,3]диоксан (В). 2,85 г (8,78 ммоль) соединения, полученного по примеру 1b, подвергают реакции аналогично примеру 1 с с 3,62 г (6,71 ммоль) (2S,6E/Z,9S,10S)-2,6,10-триметил-9-дифенил(1,1-диметилэтил)силил]окси]-1-оксо-11-(2-пиридил)ундека-6,10-диена, получаемого по способу, описанному в DE 19751200.3, и после обработки и очистки кроме исходного материала изолируют в каждом случае в виде бесцветного маслянистого вещества 1,28 г (1,48 ммоль, 22%) заглавного соединения А и 1,73 г (2,00 ммоль, 30%) заглавного соединения В. 1 Н-ЯМР (CDCl3) А: =0,13 (9 Н), 0,86-2,52 (36 Н), 1,08 (9 Н), 1,42-1,58 (3 Н), 2,01 (3 Н), 3,32-4,85 (9 Н),5,00 (1 Н), 6,23, (1 Н), 6,97-7,09 (2 Н), 7,21-7,45 (5 Н), 7,57 (1 Н), 7,61-7,75 (4 Н), 8,56 (1 Н) ppm. 1 Н-ЯМР (CDCl3) В: =0,12 (9 Н), 0,77-2,53 (36 Н), 1,08 (9 Н), 1,38+1,62 (3 Н), 2,00 (3 Н), 3,23-4,86 (9 Н),5,02 (1 Н), 6,23 (1H), 6,96-7,09 (2 Н), 7,19-7,47 (6 Н), 7,53-7,76 (5 Н), 8,57 (1 Н) ppm. Пример 1j. (4S(4R,5S,6S,10E/Z,13S,14 Е-4-(13-Дифенил(1,1-диметилэтил)силил]окси]-5-(тетрагидро-2 Н-пиран-2-илокси)-2,6,10,14-тетраметил-3-оксо-15-(2-пиридил)-4-(4-(триметилсилил)бут-3-ин-1 ил)ундец-6-ин-2-ил)-2,2-диметил[1,3]диоксан. 1,16 г (1,34 ммоль) соединения, полученного по примеру 1i, подвергают реакции аналогично примеру 1d и после обработки и очистки изолируют в виде бесцветного маслянистого вещества 1,12 г (1,18 ммоль,88%) заглавного соединения. 1 Н-ЯМР (CDCl3): =0,13 (9 Н), 0,86-2,52 (39 Н), 1,08 (9 Н), 2,01 (3 Н), 3,32-4,85 (9 Н), 5,00 (1 Н), 6,22(1H), 6,96-7,09 (2 Н), 7,21-7,44 (6 Н), 7,56 (1 Н), 7,61-7,75 (4 Н), 8,56 (1H) ppm. Пример 1h; вариант II. (4S(4R,5S,6S,10E/Z,13S,14 Е)-4-(13-Гидрокси-5-(тетрагидро-2 Н)пиран-2-илокси)2,6,10,14-тетраметил-3-оксо-15-(2-пиридил)-4-(бут-3-ин-1-ил)ундец-6-ин-2-ил)-2,2-диметил[1,3]диоксан. 1,12 г (1,18 ммоль) соединения, полученного по примеру 1j, подвергают реакции аналогично примеру 1 е и после обработки и очистки изолируют в виде бесцветного маслянистого вещества 654 мг (1,03 ммоль,87%) заглавного соединения. 1 Н-ЯМР спектр идентичен спектру для варианта I в примере 1h.- 16011502 Пример 1k. (3S,6R,7S,8S,12E/Z,15S,16 Е)-1,3,7,15-Тетрагидрокси-4,4,8,12,16-пентаметил-17-(2-пиридил)6-(бут-3-ин-1-ил)гептадека-12,16-диен-5-он. Раствор 654 мг (1,03 ммоль) соединения, полученного по примеру 1h, в 27 мл безводного этанола смешивают в атмосфере сухого аргона с 588 мг моногидрата п-толуолсульфоновой кислоты и смесь перемешивают при 23 С на протяжении 3 ч. После удаления растворителя остаток хроматографируют на тонкослойном силикагеле (смесь н-гексана и этилацетата). 484 мг (942 моль, 91%) заглавного соединения изолируют в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3): =0,90+0,92 (3 Н), 1,07 (3 Н), 1,11-2,16 (14 Н), 1,29 (3 Н), 1,63+1,42 (3 Н), 2,00+2,02(1 Н), 7,11 (1H), 7,30 (1H), 7,66 (1 Н), 8,58 (1H) ppm. Пример 1l. (3S,6R,7S,8S,12E/Z,15S,16 Е)-1,3,7,15-Тетракисдиметил(1,1-диметилэтил)силил]окси]4,4,8,12,16-пентаметил-17-(2-пиридил)-6-(бут-3-ин-1-ил)гептадека-12,16-диен-5-он. Раствор 937 мг (1,31 ммоль) соединения, полученного по примеру 1k, в 37 мл безводного дихлорометана охлаждают в атмосфере сухого аргона до -78 С, смешивают с 2,14 мл 2,60 лутидина, 2,41 мл третбутилдиметилсилилового эфира трифторометансульфоновой кислоты, подвергают нагреву до 0 С на протяжении 2 ч и перемешивают на протяжении еще 2 ч. Выливают в концентрированный раствор бикарбоната натрия и экстрагируют несколько раз дихлорометаном. Объединенные органические экстракты сушат на сульфате натрия и концентрируют выпариванием в вакууме. После колоночной хроматографии на силикагеле (разделительная система состоит из н-гексана и этилацетата) в виде бесцветного маслянистого вещества изолируют 1,11 г (1,29 ммоль, 99%) соединения, указанного в заголовке. 1 Н-ЯМР (CDCl3): =-0,01-0,12 (24H), 0,82-2,33 (55H), 1,08 (3 Н), 1,22 (3 Н), 1,60+1,68 (3 Н), 2,05 (3 Н),3,22 (1 Н), 3,51-3,73 (2 Н), 3,81 (1 Н), 3,92 (1 Н), 4,11 (1 Н), 5,18 (1 Н), 6,47 (1 Н), 7,08 (1 Н), 7,22 (1 Н), 7,61(1 Н), 8,59 (1H) ppm. Пример 1m. (3S,6R,7S,8S,12E/Z,15S,16 Е)-1-Гидрокси-3,7,15-трисдиметил(1,1-диметилэтил)силил] окси]-4,4,8,12,16-пентаметил-17-(2-пиридил)-6-(бут-3-ин-1-ил)гептадека-12,16-диен-5-он. Раствор 1,10 мг (1,13 ммоль) соединения, полученного по примеру 1l, в смеси из 14 мл дихлорометана и 14 мл метанола смешивают при 23 С в атмосфере сухого аргона с 312 мг камфор-10-сульфоновой кислоты и перемешивают на протяжении 2 ч. Выливают в концентрированный раствор бикарбоната натрия и экстрагируют насколько раз дихлорометаном. Объединенные органические экстракты сушат на сульфате натрия и концентрируют выпариванием в вакууме. После колоночной хроматографии на тонкослойном силикагеле (разделительная система состоит из н-гексана и этилацетата) выделяют в виде бесцветного маслянистого вещества 814 мг (950 моль, 84%) заглавного соединения. 1 Н-ЯМР (CDCl3): =0,01-0,13 (18 Н), 0,83-2,33 (47 Н), 1,12 (3 Н), 1,23 (3 Н), 1,61+1,63 (3 Н), 2,05 (3 Н),3,28 (1 Н), 3,68 (2 Н), 3,84 (1 Н), 4,02-4,18 (2 Н), 5,18 (1 Н), 6,48 (1 Н), 7,08 (1H), 7,22 (1 Н), 7,61 (1H), 8,60(1 Н) ppm. Пример 1n. (3S,6R,7S,8S,12E/Z,15S,16 Е)-3,7,15-Трисдиметил(1,1-диметилэтил)силил]окси]-4,4,8,12,16 пентаметил-5-оксо-17-(2-пиридил)-6-(бут-3-ин-1-ил)гептадека-12,16-диенал. Раствор 0,129 мл оксалилхлорида в 6,3 мл безводного дихлорометана охлаждают в атмосфере сухого аргона до -70 С, смешивают с 209 л диметилсульфоксида, раствором 814 мг (950 моль) соединения,полученного по примеру 1m, в 6,3 мл безводного дихлорометана, и смесь перемешивают на протяжении 0,5 ч. Затем ее смешивают с 646 л триэтиламина, дают прореагировать на протяжении 1 ч при -30 С и смешивают с н-гексаном и концентрированным раствором бикарбоната натрия. Органическую фазу отделяют, водную фазу экстрагируют еще несколько раз н-гексаном, объединенные органические экстракты промывают водой и сушат на сульфате магния. Остаток, полученный после фильтрации и удаления растворителя, подвергают дальнейшей реакции без очистки. Пример 1o. (3S,6R,7S,8S,12Z,15S,16 Е)-3,7,15-Трисдиметил(1,1-диметил)силил]окси]-4,4,8,12,16-пентаметил-5-оксо-17-(2-пиридил)-6-(бут-3-ин-1-ил)-гептадека-12,16-диеновая кислота (А) и (3S,6R,7S,8S,12 Е,15S,16 Е)3,7,15-трисдиметил(1,1-диметилэтил)силил]окси]-4,4,8,12,16-пентаметил-5-оксо-17-(2-пиридил)-6-(бут 3-ин-1-ил)гептадека-12,16-диеновая кислота (В). Раствор 852 мг (макс. 950 моль) соединения, полученного по примеру 1n, в 23 мл ацетона охлаждают до -30 С, смешивают с 1,19 мл нормализованного 8H раствора хромосерной кислоты и перемешивают на протяжении 1 ч. Выливают в смесь, состоящую из воды и диэтилового эфира, органическую фазу промывают концентрированным раствором хлорида натрия и сушат на сульфате натрия. После фильтрации и удаления растворителя остаток очищают тонкослойной хроматографией на силикагеле (разделительная система состоит из н-гексана и этилацетата). Выделяют 298 мг (342 моль, 36% относительно эдукта в примере 1l) заглавного соединения А, а также 234 мг (269 моль, 28% относительно эдукта в примере 1l) заглавного соединения В, в обоих случаях в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3) A: =-0,02-0,15 (18 Н), 0,81-0,99 (30 Н), 1,05-2,3 (15 Н), 1,12 (3 Н), 1,24 (3 Н), 1,71(1 Н), 7,71 (1 Н), 8,62 (1 Н) ppm. Пример 1p. (3S,6R,7S,8S,12Z,15S,16 Е)-15-Гидрокси-3,7-бисдиметил(1,1-диметилэтил)силил]окси]4,4,8,12,16-пентаметил-5-оксо-17-(2-пиридил)-6-(бут-3-ин-1-ил)гептадека-12,16-диеновая кислота. 298 мг (342 моль) соединения А, полученного по примеру 1o, подвергают реакции аналогично примеру 1 е и после обработки выделяют в виде неочищенного продукта 294 мг (макс. 342 моль) заглавного соединения, которое используют в последующих реакциях без очистки. Пример 1q. (4S,7R,8S,9S,13Z,16S(E-4,8-бис-Диметил(1,1-диметилэтил)силил]окси]-16-(1-метил 2-(2-пиридил)этенил)-1-окса-5,5,9,13-тетраметил-7-(бут-3-ин-1-ил)циклогексадец-13-ен-2,6-дион. Раствор 294 мг (макс. 342 моль) соединения, полученного по примеру 1 р, в смеси, состоящей из 2,6 мл безводного тетрагидрофурана и 30 мл толуола, смешивают в атмосфере сухого аргона с 284 л триэтиламина, 268 л хлорида 2,4,6-трихлоробензоила и перемешивают 20 мин. Этот раствор добавляют по каплям на протяжении 4,5 ч к раствору 434 мг 4-диметиламинопиридина в 132 мл толуола и перемешивают при 23 С еще 0,5 ч. Концентрируют выпариванием, помещают в небольшое количество дихлорометана и очищают тонкослойной хроматографией на силикагеле (разделительная система состоит из нгексана и этилацетата). Выделяют 136 мг (185) моль, 54%) заглавного соединения в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3): =-0,08 (3 Н), 0,13 (9 Н), 0,80-2,32 (12 Н), 0,85 (9 Н), 0,94 (9 Н), 0,99 (3 Н), 1,15 (3 Н),1,24 (3 Н), 1,68 (3 Н), 2,13 (3 Н), 2,47 (1 Н), 2,59-2,89 (3 Н), 3,11 (1H), 4,00 (1H), 4,06 (1 Н), 5,00 (1 Н), 5,18(1 Н), 6,57 (1 Н), 7,10 (1H), 7,26 (1 Н), 7,63 (1H), 8,60 (1H) ppm. Пример 1r. (4S,7R,8S,9S,13Z,16S(E-4,8-Дигидрокси-16-(1-метил-2-(2-пиридил)этенил)-1-окса-5,5,9,12 тетраметил-7-(бут-2-ин-1-ил)циклогексадец-12-ен-2,6-дион. Раствор 20 мг (27 моль) соединения, полученного по примеру 1 р, в 2 мл безводного тетрагидрофурана в атмосфере сухого аргона смешивают по частям с общим количеством 0,57 мл HF-пиридинового комплекса и перемешивают при 23 С на протяжении 24 ч. Выливают в концентрированный раствор бикарбоната натрия, несколько раз экстрагируют дихлорометаном и объединенные органические экстракты сушат на сульфате натрия. После фильтрации и удаления растворителя полученный остаток очищают тонкослойной хроматографией на силикагеле со смесью, состоящей из н-гексана и этилацетата. Выделяют 9,1 мг (17,9 моль, 66%) заглавного соединения в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3): =1,09 (6 Н), 1,19-2,12 (11 Н), 1,38 (3 Н), 6,9 (3 Н), 2,06 (3 Н), 2,21-2,41 (3 Н), 2,50(1 Н), 7,29 (1H), 7,68 (1H), 8,53 (1 Н) ppm. Пример 2. (4S,7R,8S,9S,13Z,16S(E-4,8-Дигидрокси-16-(1-метил-2-(2-пиридил)этенил)-1-окса-5,5,9,13 тетраметил-7-(бут-3-ен-1-ил)циклогексадец-13-ен-2,6-дион. Пример 2 а. (4S,7R,8S,9S,13Z,16S(E-4,8-бисДиметил(1,1-диметилэтил)силил]окси]-16-(1-метил-2(2-пиридил)этенил)-1-окса-5,5,9,13-тетраметил-7-(бут-3-ен-1-ил)циклогексадец-13-ен-2,6-дион. Раствор 25 мг (34 моль) соединения, полученного по примеру 1q, в 3 мл этанола смешивают с 25 л пиридина, каталитическим количеством сульфата палладия или бария (10%) и гидрогенизируют при 1 атм водорода. После фильтрации и удаления растворителя остаток очищают хроматографией на аналитической тонкослойной пластине. В качестве мобильного растворителя используют смесь н-гексана и этилацетата. Выделяют 13 мг (18 моль, 52%) заглавного соединения в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3): =-0,10 (3 Н), 0,06 (3 Н), 0,11 (6 Н), 0,80-2,20 (11H), 0,83 (9 Н), 0,92 (9 Н), 0,98 (3 Н),1,12 (3 Н), 1,19 (3 Н), 1,67 (3 Н), 2,12 (3 Н), 2,43 (1 Н), 2,55-2,82 (3 Н), 3,07 (1H), 4,00 (1H), 4,03 (1 Н), 4,905,03 (3 Н), 5,18 (1H), 5,72 (1H), 6,57 (1 Н), 7,09 (1H), 7,25 (1H), 7,62 (1 Н), 8,59 (1 Н) ppm. Пример 2b. (4S,7R,8S,9S,13Z,16S(E-4,8-Дигидрокси-16-(1-метил-2-(2-пиридил)этенил)-1-окса-5,5,9,13 тетраметил-7-(бут-3-ен-1-ил)циклогексадец-13-ен-2,6-дион. 10,3 мг (14 моль) соединения, полученного по примеру 2 а, подвергают реакции аналогично примеру 1 и после обработки и очистки выделяют 5,7 мг (11 моль, 80%) заглавного соединения в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3): =1,04 (3 Н), 1,09 (3 Н), 0,25-2,38 (13 Н), 1,36 (3 Н), 1,70 (3 Н), 2,07 (3 Н), 2,48 (1 Н),2,63 (1 Н), 2,74 (1 Н), 3,31 (1 Н), 3,69 (1H), 4,38 (1H), 4,61 (1 Н), 4,97 (1 Н), 5,02 (1 Н), 5,11 (1H), 5,19 (1 Н),5,77 (1H), 6,60 (1 Н), 7,13 (1H), 7,29 (1H), 7,68 (1 Н), 8,54 (1 Н) ppm. Пример 3. (4S,7R,8S,9S,13 Е,16S(E-4,8-Дигидрокси-16-(1-метил-2-(2-пиридил)этенил)-1-окса-5,5,9,13 тетраметил-7-(бут-3-ин-1-ил)циклогексадец-13-ен-2,6-дион. Пример 3 а. (3S,6R,7S,8S,12 Е,15S,16 Е)-15-Гидрокси-3,7-бисдиметил(1,1-диметилэтил)силил]окси]4,4,8,12,16-пентаметил-5-оксо-17-(2-пиридил)-6-(бут-3-ин-1-ил)гептадека-12,16-диеновая кислота. 234 мг (269 моль) соединения В, полученного в примере 1o, подвергают реакции аналогично примеру 1 е и после обработки выделяют в виде неочищенного продукта 229 мг (макс. 269 моль) заглавного соединения, которое подвергают дальнейшим реакциям без очистки.- 18011502 Пример 3b. (4S,7R,8S,9S,13 Е,16S(E-4,8-бисДиметил(1,1-диметилэтил)силил]окси]-16-(1-метил-2(2-пиридил)этенил)-1-окса-5,5,9,13-тетраметил-7-(бут-3-ин-1-ил)циклогексадец-13-ен-2,6-дион. 229 мг (макс. 269 моль) соединения, полученного по примеру 3 а, подвергают реакции аналогично примеру 1q и после обработки и очистки выделяют 112 мг (152 моль, 56%) заглавного соединения в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3): =0,05 (3 Н), 0,11 (6 Н), 0,15 (3 Н), 0,80-2,30 (33 Н), 1,13 (3 Н), 1,21 (3 Н), 1,62 (3 Н),2,61 (3 Н), 2,40-2,72 (4 Н), 3,10 (1 Н), 3,91 (1 Н), 4,46 (1 Н), 5,22 (1 Н), 5,30 (1 Н), 6,56 (1 Н), 7,09 (1 Н), 7,20(1 Н), 7,62 (1 Н), 8,60 (1 Н) ppm. Пример 3c. (4S,7R,8S,9S,13 Е,16S(E-4,8-Дигидрокси-16-(1-метил-2-(2-пиридил)этенил)-1-окса-5,5,9,13 тетраметил-7-(бут-3-ин-1-ил)циклогексадец-13-ен-2,6-дион. 72 мг (98 моль) соединения, полученного по примеру 3b, подвергают реакции аналогично примеру 1 и после обработки и очистки выделяют 32 мг (63 моль, 64%) заглавного соединения в виде бесцветной пены. 1 Н-ЯМР (CDCl3): =1,00 (3 Н), 1,04 (3 Н), 1,30-2,71 (16 Н), 1,32 (3 Н), 1,61 (3 Н), 2,10 (3 Н), 3,63 (1 Н),3,70 (1H), 3,86 (1 Н), 3,99 (1 Н), 4,48 (1 Н), 5,10 (1H), 5,41 (1 Н), 6,58 (1 Н), 7,13 (1H), 7,33 (1H), 7,58 (1 Н),8,54 (1 Н) ppm. Пример 4. (1S,3S(E),7S,10R,11S,12S,16R)-7,11-Дигидрокси-10-(бут-3-ин-1-ил)-3-(1-метил-2-(2-пиридил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион (А) и (1R,3S(E),7S,10R,11S,12S,16S)7,11-дигидрокси-10-(бут-3-ин-1-ил)-3-(1-метил-2-(2-пиридил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион (В). Раствор 5 мг (10 моль) соединения, полученного по примеру 1, в 1 мл дихлорометана смешивают в атмосфере сухого аргона при -20 С с 11,3 л 20% раствором трифторуксусной кислоты в дихлорометане и 5,6 мг м-хлоробензойной кислоты (60%). Перемешивают на протяжении 18 ч при -18 С, выливают на концентрированный раствор тиосульфата натрия, экстрагируют несколько раз дихлорометаном, объединенные органические экстракты промывают раствором бикарбоната натрия, концентрированным раствором хлорида натрия и сушат на сульфате магния. Остаток, полученный после фильтрации и удаления растворителя, очищают хроматографией на аналитической тонкослойной пластине. В качестве мобильного растворителя и элюанта используют смесь дихлорометана и этанола. Выделяют 1,3 мг (2,5 моль,25%) заглавного соединения А (или В) и 2,0 мг (3,8 моль, 39%) заглавного соединения В (или А), в обоих случаях в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3) А (или В): =1,01 (3 Н), 1,07 (3 Н), 1,23-2,20 (13 Н), 1,30 (3 Н), 1,46 (3 Н), 2,10 (3 Н),2,26 (1 Н), 2,40 (1 Н), 2,58 (1H), 2,82 (1 Н), 2,97 (1 Н), 3,63 (2 Н), 4,39 (1H), 5,22 (1H), 5,47 (1 Н), 6,61 (1 Н),7,15 (1H), 7,28 (1H), 7,69 (1H), 8,55 (1H) ppm. 1 Н-ЯМР (CDCl3) В (или А): =0,98 (3 Н), 1,08 (3 Н), 1,27-2,19 (13 Н), 1,32 (3 Н), 1,43 (3 Н), 2,12 (3 Н),2,30 (1H), 2,48 (1H), 2,70 (1H), 2,96 (1 Н), 3,15 (1H), 3,47 (1 Н), 3,57 (1H), 4,01 (1 Н), 4,49 (1 Н), 5,50 (1 Н),6,67 (1 Н), 7,12 (1 Н), 7,27 (1 Н), 7,66 (1 Н), 8,58 (1H) ppm. Пример 5. (1S,3S(E),7S,10R,11S,12S,16R)-7,11-Дигидрокси-10-(бут-3-ен-1-ил)-3-(1-метил-2-(2-пиридил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион (А) и (1R,3S(E),7S,10R,11S,12S,16S)7,11-дигидрокси-10-(бут-3-ен-1-ил-3-(1-метил-2-(2-пиридил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион (В). 6,6 мг (13 моль) соединения, полученного по примеру 2, подвергают реакции аналогично примеру 4 и после обработки и очистки выделяют 1,4 мг (2,7 моль, 20%) заглавного соединения А (или В) и 0,9 мг(1,7 моль, 13%) заглавного соединения В (или А), в обоих случаях в виде бесцветной пены. 1 Н-ЯМР (CDCl3) А (или В): =1,00 (3 Н), 1,07 (3 Н), 1,21-2,05 (12 Н), 1,30 (3 Н), 1,40 (3 Н), 2,10 (3 Н),2,16 (1 Н), 2,38 (1 Н), 2,57 (1 Н), 2,81 (1 Н), 2,97 (1 Н), 3,44 (1 Н), 3,63 (1 Н), 4,38 (1 Н), 4,98 (1 Н), 5,02 (1 Н),5,28 (1H), 5,45 (1 Н), 5,77 (1 Н), 6,62 (1 Н), 7,18 (1 Н), 7,31 (1 Н), 7,71 (1 Н), 8,56 (1 Н) ppm. 1 Н-ЯМР (CDCl3) В (или А): =0,94 (3 Н), 1,05 (3 Н), 1,18-2,17 (13 Н), 1,30 (3 Н), 1,38 (3 Н), 2,12 (3 Н),2,48 (1 Н), 2,62 (1 Н), 2,95 (1 Н), 3,28 (1 Н), 3,30 (1 Н), 3,50 (1H), 3,96 (1H), 4,41 (1H), 4,95 (1H), 5,00 (1 Н),5,52 (1 Н), 5,25 (1H), 6,73 (1 Н), 7,18 (1 Н), 7,33 (1H), 7,71 (1H), 8,58 (1 Н) ppm. Пример 6. (1S,3S(E),7S,10R,11S,12S,16S)-7,11-Дигидрокси-10-(бут-3-ин-1-ил)-3-(1-метил-2-(2-пиридил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион (А) и (1R,3S(E),7S,10R,11S,12S,16S)7,11-дигидрокси-10-(бут-3-ин-1-ил)-3-(1-метил-2-(2-пиридил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион (В). 14 мг (27 моль) соединения, полученного по примеру 3, подвергают реакции аналогично примеру 4 и после обработки и очистки выделяют 7,8 мг (15 моль, 55%) заглавного соединения А (или В) и 4,7 мг(1 Н), 7,12 (1 Н), 7,28 (1H), 7,67 (1 Н), 8,57 (1 Н) ppm. 1 Н-ЯМР (CDCl3) В (или А): =0,96 (3 Н), 1,10 (3 Н), 1,21-2,18 (13 Н), 1,26 (3 Н), 1,40 (3 Н), 2,10 (3 Н),- 19011502 2,29 (1 Н), 2,61 (2 Н), 2,86 (1 Н), 2,99 (1 Н), 3,58 (1 Н), 3,79 (2 Н), 4,37 (1 Н), 5,46 (1 Н), 6,61 (1 Н), 7,12 (1 Н),7,26 (1H), 7,66 (1 Н), 8,57 (1 Н) ppm. Пример 7. (4S,7R,8S,9S,13E,16S(E-4,8-Дигидрокси-16-(1-метил-2-(2-пиридил)этенил)-1-окса-5,5,9,13 тетраметил-7-(бут-3-ен-1-ил)циклогексадец-13-ен-2,6-дион. 14 мг (27 моль) соединения, полученного по примеру 3, подвергают реакции аналогично примеру 2 а и после обработки и очистки выделяют 4,1 мг (8 моль, 29%) заглавного соединения в иде бесцветной пены. 1 Н-ЯМР (CDCl3): =0,98 (3 Н), 1,02 (3 Н), 1,30 (3 Н), 1,36-2,68 (16 Н), 1,61 (3 Н), 2,09 (3 Н), 3,43 (1 Н),3,70 (1 Н), 4,17 (1 Н), 4,45 (1 Н), 4,94 (1H), 5,00 (1 Н), 5,09 (1H), 5,39 (1 Н), 5,72 (1 Н), 6,58 (1 Н), 7,12 (1H),7,35 (1 Н), 7,67 (1 Н), 8,52 (1 Н) ppm. Пример 8. (1S,3S(E),7S,10R,11S,12S,16S)-7,11-Дигидрокси-10-(бут-3-ен-1-ил)-3-(1-метил-2-(2-пиридил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион (А) и (1R,3S(E),7S,10R,11S,12S,16S)7,11-дигидрокси-10-(бут-3-ен-1-ил)-3-(1-метил-2-(2-пиридил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион (В). 4,1 мг (8 моль) соединения, полученного по примеру 7, подвергают реакции аналогично примеру 4 и после обработки и очистки выделяют 1,7 мг (3,2 моль, 40%) заглавного соединения А (или В) и 0,4 мг(1 Н), 6,60 (1 Н), 7,12 (1 Н), 7,26 (1H), 7,68 (1H), 8,57 (1 Н) ppm. Пример 9. (4S,7R,8S,9S,13Z,16S(E-4,8-Дигидрокси-16-(1-метил-2-(2-метилтиазол-4-ил)этенил)-1-окса 5,5,9,13-тетраметил-7-(проп-2-ен-1-ил)циклогексадец-13-ен-2,6-дион. Пример 9 а. (3RS,4S)-4-(2-Метил-3-гидрокси-гепт-6-ен-2-ил)-2,2-диметил[1,3]диоксан. 5,5 г (30 ммоль) (4S)-4-(2-метил-1-оксо-проп-2-ил)-2,2-диметил[1,3]диоксана, полученного аналогично способу, описанному в DE 19751200.3, подвергают реакции аналогично примеру 1 а с бромидом бут-3-ен-1-ил-магиня и после боработки и очистки выделяют 3,84 г (15,8 ммоль, 53%) заглавного соединения в виде бесцветного маслянистого вещества. Пример 9b. (4S)-4-(2-Метил-3-оксо-гепт-6-ен-2-ил)-1,2-диметил[1,3]диоксан. 3,84 г (15,8 ммоль) соединения, полученного по примеру 1 а, подвергают реакции аналогично примеру 1b и после обработки и очистки выделяют 3,0 г (12,5 ммоль, 79%) заглвного соединения в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3): =1,07 (3 Н), 1,14 (3 Н), 1,33 (4 Н), 1,41 (3 Н), 1,62 (1 Н), 2,29 (2 Н), 2,60 (2 Н), 3,86(1H), 3,97 (1 Н), 4,05 (1 Н), 4,96 (1 Н), 5,02 (1 Н), 5,81 (1 Н) ppm. Пример 9 с. (4S(4R,5S,6S,10E/Z,13S,14 Е-4-(13-Диметил(1,1-диметилэтил)силил]окси]-5-гидрокси 2,6,10,14-тетраметил-3-оксо-15-(2-метилтиазол-4-ил)-4-(проп-2-ен-1-ил)пентадек-2-ил)-2,2-диметил[1,3] диоксан (А) и (4S(4S,5R,6S,10E/Z,13S,14 Е-4-(13-диметил(1,1-диметилэтил)силил]окси]-5-гидрокси 2,6,10,14-тетраметил-3-оксо-15-(2-метилтиазол-4-ил)-4-(проп-2-ен-1-ил)пентадек-2-ил)-2,2-диметил[1,3] диоксан (В). 2,07 г (8,61 ммоль) соединения, полученного по примеру 9b, подвергают реакции аналогично примеру 1 с с 2,01 г (4,61 ммоль) (2S,6E/Z,9S,10 Е)-2,6,10-триметил-9-[диметил(1,1-диметилэтил)силил]окси]1-оксо-11-(2-метилтиазол-4-ил)ундека-6,10-диена, полученного аналогично способу, описанному в DE 19751200.3, и после обработки и очистки, кроме исходного материала, выделяют 995 мг (1,47 ммоль,32%) заглавного соединения А, а также 784 мг (1,16 ммоль, 25%) заглавного соединения В, в обоих случаях в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3) А: =0,01 (3 Н), 0,07 (3 Н), 0,85 (3 Н), 0,90 (9 Н), 0,98 (3 Н), 1,00-2,33 (12 Н), 1,23 (3 Н),1,33 (3 Н), 1,39 (3 Н), 1,60+1,67 (3 Н), 2,00 (3 Н), 2,46 (1H), 2,72 (3 Н), 2,99 (1H), 3,34 (1H), 3,49 (1 Н), 3,87(1 Н), 6,92 (1 Н) ppm. Пример 9d. (3S,6R,7S,8S,12E/Z,15S,16E)-15-Диметил(1,1-диметилэтил)силил]окси]-1,3,7-тригидрокси 4,4,8,12,16-пентаметил-17-(2-метилтиазол-4-ил)-6-(проп-2-ен-1-ил)гептадека-12,16-диен-5-он. 1,33 г (1,97 ммоль) соединения А, полученного по примеру 9 с, подвергают реакции аналогично примеру 1k и после обработки и очистки выделяют 1,02 г (1,60 ммоль, 81%) заглавного соединения в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3): =0,01 (3 Н), 0,07 (3 Н), 0,89 (12 Н), 1,00-2,38 (12 Н), 1,40+1,07 (3 Н), 1,23+1,25 (3 Н),1,60+1,68 (3 Н), 1,97+1,99 (3 Н), 2,52 (1 Н), 2,67-2,89 (1H), 2,73+2,77 (3 Н), 3,01 (1H), 3,33 (1 Н), 3,40-3,53 (1 Н),3,74-3,93 (3 Н), 4,03-4,19 (2 Н), 5,00 (1 Н), 5,06 (1H), 5,10+5,20 (1 Н), 5,71 (1 Н), 6,42 (1H), 6,93 (1 Н) ppm.- 20011502 Пример 9 е. (3S,6R,7S,8S,12E/Z,15S,16 Е)-1,3,7,15-Тетракисдиметил(1,1-диметилэтил)силил]окси]4,4,8,12,16-пентаметил-17-(2-метилтиазол-4-ил)-6-(проп-2-ен-1-ил)гептадека-12,16-диен-5-он. 1,02 г (1,60 ммоль) соединения, полученного по примеру 9d, подвергают реакции аналогично примеру 11 и после обработки и очистки выделяют 1,46 г (1,49 ммоль, 93%) заглавного соединения в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3) =0,00-0,11 (24 Н), 0,83-0,98 (39 Н), 1,01-1,62 (3 Н), 1,07 (3 Н), 1,20 (3 Н), 1,59+1,67(3 Н), 1,97 (1 Н), 2,00 (3 Н), 2,19-2,34 (3 Н), 2,48 (1 Н), 2,72 (3 Н), 3,13 (1 Н), 3,57 (1 Н), 3,67 (1 Н), 3,78 (1H),3,87 (1 Н), 4,09 (1 Н), 4,93 (1 Н), 4,99 (1H), 5,15 (1H), 5,77 (1 Н), 6,64 (1 Н), 6,91 (1 Н) ppm. Пример 9f. (3S,6R,7S,8S,12E/Z,15S,16 Е)-1-Гидрокси-3,7,15-трисдиметил(1,1-диметилэтил)силил] окси]-4,4,8,12,16-пентаметил-17-(2-метилтиазол-4-ил)-6-(проп-2-ен-1-ил)гептадека-12,16-диен-5-он. 1,45 г (1,48 ммоль) соединения, полученного по примеру 9 е, подвергают реакции аналогично примеру 1m, а после обработки и очистки выделяют 1,19 г (1,37 ммоль, 93%) заглавного соединения в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3): =0,01-0,14 (18 Н), 0,82-0,97 (30 Н), 1,04-1,70 (7 Н), 1,09 (3 Н), 1,19 (3 Н), 1,59+1,68(1H), 4,10 (1H), 4,96 (1 Н), 5,01 (1 Н), 5,14 (1H), 5,77 (1 Н), 6,46 (1 Н), 6,92 (1 Н) ppm. Пример 9g. (3S,6R,7S,8S,12E/Z,15S,16E)-3,7,15-Трисдиметил(1,1-диметилэтил)силил]окси]-4,4,8,12,16 пентаметил-17-(2-метилтиазол-4-ил)-5-оксо-6-(проп-2-ен-1-ил)гептадека-12,16-диенал. 1,18 г (1,37 ммоль) соединения, полученного по примеру 9f, подвергают реакции аналогично примеру 1n и после обработки выделяют 1,25 г (макс. 1,37 ммоль) заглавного соединения в виде желтого маслянистого вещества и без очистки подвергают дальнейшим реакциям. Пример 9h. (3S,6R,7S,8S,12Z,15S,16 Е)-3,7,15-Трисдиметил(1,1-диметилэтил)силил]окси]-4,4,8,12,16 пентаметил-17-(2-метилтиазол-4-ил)-5-оксо-6-(проп-2-ен-1-ил)гептадека-12,16-диеновая кислота (А) и(3S,6R,7S,8S,12 Е,15S,16 Е)-3,7,15-трисдиметил(1,1-диметилэтил)силил]окси]-4,4,8,12,16-пентаметил-17(2-метилтиазол-4-ил)-5-оксо-6-(проп-2-ен-1-ил)гептадека-12,16-диеновая кислота (В). 1,25 г (макс. 1,37 ммоль) соединения, полученного по примеру 9g, подвергают реакции аналогично примеру 1 о и после обработки и очистки выделяют 302 мг (0,34 ммоль, 25%) заглавного соединения А и 230 мг(0,26 ммоль, 19%) заглавного соединения В, в обоих случаях в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3) А: =-0,02-0,15 (18 Н), 0,82-0,97 (30 Н), 1,05-2,53 (14 Н), 1,12 (3 Н), 1,17 (3 Н), 1,70(1 Н), 5,74 (1 Н), 6,46 (1 Н), 6,93 (1 Н) ppm. Пример 9i. (3S,6R,7S,8S,12Z,15S,16 Е)-3,7-бисДиметил(1,1-диметилэтил)силил]окси]-15-гидрокси 4,4,8,12,16-пентаметил-17-(2-метилтиазол-4-ил)-5-оксо-6-(проп-2-ен-1-ил)гептадекан-12,16-диеновая кислота. 302 мг (0,34 ммоль) соединения А, полученного по примеру 9h, подвергают реакции аналогично примеру 1 е и после обработки выделяют 296 мг (макс. 0,34 ммоль) заглавного соединения в виде бледножелтого маслянистого вещества, которое подвергают дальнейшим реакциям без очистки. Пример 9j. (4S,7R,8S,9S,13Z,16S(E-4,8-бисДиметил(1,1-диметилэтил)силил]окси]-16-(1-метил-2(2-метилтиазол-4-ил)этенил)-1-окса-5,5,9,13-тетраметил-7-(проп-2-ен-1-ил)циклогексадец-13-ен-2,6-дион. 296 мг (макс. 0,34 ммоль) соединения, полученного по примеру 9i, подвергают реакции аналогично примеру 1q и после обработки и очистки выделяют 166 мг (0,22 ммоль, 65%) заглавного соединения в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3): =-0,10 (3 Н), 0,09 (3 Н), 0,11 (3 Н), 0,13 (3 Н), 0,86 (9 Н), 0,80-2,85 (13 Н), 0,94 (9 Н),1,00 (3 Н), 1,10 (3 Н), 12,0 (3 Н), 1,68 (3 Н), 2,10 (3 Н), 2,71 (3 Н), 3,11 (1 Н), 4,01 (2 Н), 4,85-5,03 (3 Н), 5,16(1H), 5,78 (1H), 6,57 (1H), 6,98 (1 Н) ppm. Пример 9k. (4S,7R,8S,9S,13Z,16S(E-4,8-Дигидрокси-16-(1-метил-2-(2-метилтиазол-4-ил)этенил)-1 окса-5,5,9,13-тетраметил-7-(проп-2-ен-1-ил)циклогексадец-13-ен-2,6-дион. 1,25 мг (34 моль) соединения, полученного по примеру 9j, подвергают реакции аналогично примеру 1 и после обработки и очистки выделяют 10 мг (19 моль, 57%) заглавного соединения в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3): =1,03 (3 Н), 1,05 (3 Н), 1,20-2,74 (14 Н), 1,30 (3 Н), 1,69 (3 Н), 2,07 (3 Н), 2,69 (3 Н),3,33 (1 Н), 3,69 (1H), 3,72 (1 Н), 4,23 (1 Н), 5,02 (1H), 5,07 (1 Н), 5,12 (1 Н), 5,21 (1H), 5,76 (1 Н), 6,57 (1 Н),6,96 (1 Н) ppm. Пример 10. (1S,3S(E),7S,10R,11S,12S,16R)-7,11-Дигидрокси-10-(проп-2-ен-1-ил)-3-(1-метил-2-(2-метилтиазол-4-ил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион (А) и (1R,3S(E),7S,10R,11S,12S,16R)-7,11-дигидрокси-10-(проп-2-ен-1-ил)-3-(1-метил-2-(2-метилтиазол-4-ил)этенил)8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион (В). Раствор 8,0 мг (15,5 моль) соединения, полученного по примеру 9, в 1 мл ацетонитрила смешивают с 89 л 1 М раствора тетраацетата этиленамида натрия, охлаждают до 0 С и смешивают с 148 л 1,1,1- 21011502 трифтороацетона, а также со смесью, состоящей из 22 мг оксона и 41 мг бикарбоната натрия. Дают прореагировать в течение 5 ч, выливают на раствор тиосульфата натрия и экстрагируют несколько раз этилацетатом. Объединенные органичестие экстракты промывают концентрированным раствором хлорида натрия и остаток, полученный после фильтрации и удаления растворителя, очищают хроматографией на аналитической тонкослойной пластине. В качестве мобильного растворителя используют смесь н-гексана и этилацетата. Выделяют 3,2 мг (6 моль, 39%) заглавного соединения A и 1,0 мг (2 моль, 12%) заглавного соединения В, в обоих случаях в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3) А: =1,00 (3 Н), 1,02 (3 Н), 1,21-1,82 (7 Н), 1,29 (3 Н), 1,36 (3 Н), 1,95-2,05 (2 Н), 2,11(1 Н), 5,01 (1 Н), 5,57 (1H), 5,74 (1H), 6,69 (1 Н), 7,01 (1 Н) ppm. Пример 11. (4S,7R,8S,9S,13 Е,16S(E-4,8-Дигидрокси-16-(1-метил-2-(2-метилтиазол-4-ил)этенил)-1 окса-5,5,9,13-тетраметил-7-(проп-2-ен-1-ил)циклогексадец-13-ен-2,6-дион. Пример 11 а. (3S,6R,7S,8S,12 Е,15S,16 Е)-3,7-бисдиметил(1,1-диметилэтил)силил]окси]-15-гидрокси 4,4,8,12,16-пентаметил-17-(2-метилтиазол-4-ил)-5-оксо-6-(проп-2-ен-1-ил)гептадека-12,16-диеновая кислота. 230 мг (0,26 ммоль) соединения В, полученного по примеру 9h, подвергают реакции аналогично примеру 1 е и после обработки выделяют 214 мг (макс. 0,26 ммоль) заглавного соединения в виде бледножелтого маслянистого вещества, которое подвергают дальнейшим реакциям без очистки. Пример 11b. (4S,7R,8S,9S,13 Е,16S(E-4,8-бисдиметил(1,1-диметилэтил)силил]окси]-16-(1-метил 2-(2-метилтиазол-4-ил)этенил)-1-окса-5,5,9,13-тетраметил-7-(проп-2-ен-1-ил)циклогексадец-13-ен-2,6-дион. 214 мг (макс. 0,26 ммоль) соединения, полученного по примеру 11 а, подвергают реакции аналогично примеру 1q и после обработки и очистки выделяют 114 мг (0,15 ммоль, 59%) заглавного соединения в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3): =0,05 (3 Н), 0,08 (3 Н), 0,10 (3 Н), 0,13 (3 Н), 0,82-0,94 (21 Н), 1,12 (3 Н), 1,15-2,62(1 Н), 5,28 (1 Н), 5,79 (1 Н), 6,51 (1 Н), 6,91 (1 Н) ppm. Пример 11e. (4S,7R,8S,9S,13E,16S(E-4,8-Дигидрокси-16-(1-метил-2-(2-метилтиазол-4-ил)этенил)1-окса-5,5,9,13-тетраметил-7-(проп-2-ен-1-ил)циклогексадец-13-ен-2,6-дион. 15 мг (20 моль) соединения, полученного по примеру 11b, подвергают реакции аналогично примеру 1 и после обработки и очистки выделяют 7,3 мг (14 моль, 71%) заглавного соединения в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3): =0,80-2,62 (13H), 0,99 (3 Н), 1,01 (3 Н), 1,26 (3 Н), 1,60 (3 Н), 2,04 (3 Н), 2,69 (3 Н),3,49 (1H), 3,73 (1 Н), 4,01 (1 Н), 4,12 (1 Н), 4,42 (1 Н), 4,95-5,10 (3 Н), 5,37 (1 Н), 5,71 (1 Н), 6,56 (1 Н), 5,99(1 Н) ppm. Пример 12. (1R,3S(E),7S,10R,11S,12S,16R)-7,11-Дигидрокси-10-(проп-2-ен-1-ил)-3-(1-метил-2-(2-метилтиазол-4-ил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион (А) и (1S,3S(E),7S,10R,11S,12S,16S)-7,11-дигидрокси-10-(проп-2-ен-1-ил)-3-(1-метил-2-(2-метилтиазол-4-ил)этенил)8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион (В). 7,3 мг (14 моль) соединения, полученного по примеру 11, подвергают реакции аналогично примеру 10 и после обработки и очистки выделяют 2,3 мг (4,3 моль, 31%) заглавного соединения А (или В) и 2,0 мг (3,7 моль, 27%) заглавного вещества В (или А), в обоих случаях в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3) А (или В): =0,90-2,34 (10 Н), 0,95 (3 Н), 1,01 (3 Н), 1,29 (3 Н), 1,38 (3 Н), 2,10 (3 Н),2,47-2,62 (3 Н), 2,72 (3 Н), 2,88 (2 Н), 3,48 (1 Н), 3,80 (1 Н), 4,19 (1 Н), 4,32 (1H), 5,02 (1H), 5,07 (1 Н), 5,48(1 Н), 5,06 (1H), 5,44 (1H), 5,72 (1H), 6,62 (1 Н), 6,99 (1 Н) ppm. Пример 13. (4S,7R,8S,9S,13Z,16S(E-4,8-Дигидрокси-16-(1-метил-2-(2-пиридил)этенил)-1-окса-5,5,9,13 тетраметил-7-(проп-2-ин-1-ил)циклогексадец-13-ен-2,6-дион. Пример 13 а. (3RS,4S)-4-(2-Метил-3-гидрокси-8-(триметилсилил)гепт-6-ин-2-ил)-2,2-диметил[1,3]диоксан. 7,0 г (37 ммоль) (4S)-4-(2-метил-1-оксо-проп-2-ил)-2,2-диметил[1,3]диоксана, полученного аналогично примеру 1a, подвергают реакции с бромидом 4-триметилсилил-бут-3-ин-1-ил-магния и после обработки и очистки выделяют 4,9 г (15,7 ммоль, 42%) заглавного соединения в виде бесцветного маслянистого вещества. Пример 13b. (4S)-4-(2-Метил-3-оксо-8-(триметилсилил)гепт-6-ин-2-ил)-2,2-диметил[1,3]диоксан. 4,87 г (15,6 ммоль) соединения, полученного по примеру 13 а, подвергают реакции аналогично примеру 1b и после обработки и очистки выделяют 4,10 г (13,2 ммоль, 86%) заглавного соединения в виде бесцветного маслянистого вещества.(2 Н), 2,73 (2 Н), 3,84 (1 Н), 3,96 (1 Н), 4,02 (1 Н) ppm. Пример 13 с. (4S(4R,5S,6S,10E/Z,13S,14 Е-4-(13-Диметил(1,1-диметилэтил)силил]окси]-5-гидрокси 2,6,10,14-тетраметил-3-оксо-15-(2-пиридил)-4-(4-(триметилсилил)проп-2-ин-1-ил)пентадек-2-ил)-2,2-диметил[1,3]диоксан (А) и (4S(4S,5R,6S,10E/Z,13S,14 Е-4-(13-диметил(1,1-диметилэтил)силил]окси]-5 гидрокси-2,6,10,14-тетраметил-3-оксо-15-(2-пиридил)-4-(4-(триметилсилил)проп-2-ин-1-ил)-пентадек-2 ил)-2,2-диметил[1,3]диоксан (В). 2,74 г (8,82 ммоль) соединения, полученного по примеру 13b, подвергают реакции аналогично примеру 1 с с 3,02 г (7,27 ммоль) (2S,6E/Z,9S,10 Е)-2,6,10-триметил-9-диметил(1,1-диметилэтил)силил]окси]-1-оксо-11-(2-пиридил)ундека-6,10-диеном, который получают аналогично способу, описанному в DE 19751200.3, и после обработки и очистки, кроме 50% исходного материала, выделяют 1,63 г (2,2 ммоль,31%) заглавного соединения А и 0,50 г (0,69 ммоль, 9%) заглавного соединения В, в обоих случаях в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3) А: =0,00-0,20 (15H), 0,83-0,95 (12 Н), 1,00-1,80 (20 Н), 1,60+1,68 (3 Н), 1,90-2,10(2 Н), 2,06 (3 Н), 2,29 (2 Н), 2,53 (2 Н), 3,04 (1H), 3,43 (1 Н), 3,61 (1H), 3,80-4,18 (4 Н), 5,18 (1 Н), 6,48 (1 Н),7,09 (1H), 7,23 (1 Н), 7,62 (1 Н), 8,59 (1H) ppm. Пример 13d. (3S,6R,7S,8S,12E/Z,15S,16E)-15-Диметил(1,1-диметилэтил)силил]окси]-1,3,7-тригидрокси-4,4,8,12,16-пентаметил-17-(2-пиридил)-6-(3-(триметилсилил)проп-2-ин-1-ил)гептадека-12,16-диен-5-он. 2,25 г (93,10 ммоль) соединения, полученного по примеру 13 с, подвергают реакции аналогично примеру 1k и после обработки и очистки, кроме исходного материала, выделяют 1,31 г (1,91 ммоль, 62%) заглавного соединения в иде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3): =0,00-0,19 (9 Н), 0,85-0,98 (12 Н), 1,03-2,43 (25 Н), 1,60+1,69 (3 Н), 2,00+2,02 (3 Н),2,69 (1H), 3,01+3,10 (1 Н), 3,31-3,60 (3 Н), 3,84 (2 Н), 4,02-4,26 (2 Н), 5,10+5,26 (1 Н), 6,41 (1 Н), 7,13 (1 Н),7,32 (1 Н), 7,68 (1 Н), 8,61 (1 Н) ppm. Пример 13 е. (3S,6R,7S,8S,12E/Z,15S,16 Е)-1,3,7,15-Тетракисдиметил(1,1-диметилэтил)силил]окси]4,4,8,12,16-пентаметил-17-(2-пиридил)-6-(3-(триметилсилил)проп-2-ин-1-ил)гептадека-12,16-диен-5-он. 1,49 г (2,17 ммоль) соединения, полученного по примеру 13d, подвергают реакции аналогично примеру 11 и после обработки и очистки выделяют 1,95 г (1,90 ммоль, 87%) заглавного соединения в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3): =0,00-0,18 (33 Н), 0,86-0,98 (35 Н), 1,01-1,73 (7 Н), 1,08 (3 Н), 1,26 (3 Н), 1,61+1,69(1 Н), 5,17 (1 Н), 6,48 (1H), 7,09 (1 Н), 7,23 (1 Н), 7,61 (1 Н), 8,60 (1 Н) ppm. Пример 13f. (3S,6R,7S,8S,12E/Z,15S,16 Е)-1-Гидрокси-3,7,15-трисдиметил(1,1-диметилэтил)силил]окси]-4,4,8,12,16-пентаметил-17-(2-пиридил)-6-(3-(триметилсилил)проп-2-ин-1-ил)гептадека-12,16-диен-5-он. 1,95 г (1,89 ммоль) соединения, полученного по примеру 13 е, подвергают реакции аналогично примеру 1m и после обработки и очистки выделяют 1,56 г (1,71 ммоль, 90%) заглавного соединения в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3): =0,00-0,17 (27 Н), 0,86-0,99 (30 Н), 1,07-1,78 (8 Н), 1,11 (3 Н), 1,26 (3 Н), 1,60+1,69(3 Н), 1,90-2,09 (2 Н), 2,04 (3 Н), 2,29 (2 Н), 2,48 (1H), 2,68 (1 Н), 3,27 (1 Н), 3,66 (2 Н), 3,80 (1 Н), 4,11 (2 Н),5,18 (1H), 6,49 (1H), 7,09 (1H), 7,22 (1 Н), 7,62 (1H), 8,60 (1 Н) ppm. Пример 13g. (3S,6R,7S,6S,12E/Z,15S,16E)-3,7,15-Трисдиметил(1,1-диметилэтил)силил]окси]-4,4,8,12,16 пентаметил-5-оксо-17-(2-пиридил)-6-(3-(триметилсилил)проп-2-ин-1-ил)гептадека-12,16-диенал. 1,56 г (1,71 ммоль) соединения, полученного по примеру 13f, подвергают реакции аналогично примеру 1n и после обработки выделяют 1,61 г (макс. 1,71 ммоль) заглавного соединения в виде желтого маслянистого вещества, которое подвергают дальнейшим реакциям без очистки. Пример 13h. (3S,6R,7S,8S,12Z,15S,16 Е)-3,7,15-Трисдиметил(1,1-диметилэтил)силил]окси]-4,4,8,12,16 пентаметил-5-оксо-17-(2-пиридил)-6-(3-(триметилсилил)проп-2-ин-1-ил)гептадека-12,16-диеновая кислота (А) и (3S,6R,7S,8S,12 Е,15S,16 Е)-3,7,15-Трисдиметил(1,1-диметилэтил)силил]окси]-4,4,8,12,16-пентаметил-5-оксо-17-(2-пиридил)-6-(3-(триметилсилил)проп-2-ин-1-ил)гептадека-12,16-диеновая кислота (В). Раствор 1,51 г (макс. 1,60 ммоль) соединения, полученного по примеру 13g, в 57 мл трет-бутанола смешивают с 47 мл 2-метил-2-бутена, охлаждают до 2 С, смешивают с 12,9 мл воды, 685 мг дигидрогенфосфата натрия, 1,16 г хлорита натрия, нагревают до 23 С и перемешивают на протяжении 3 ч. Выливают в концентрированный раствор тиосульфата натрия, разбавленного водой, и экстрагируют несколько раз этилацетатом. Объединенные органические экстракты сушат на сульфате натрия и остаток, полученный после фильтрации и удаления растворителя, очищают тонкослойной хроматографией на силикагеле(разделительная система состоит из н-гексана и этилацетата). Выделяют 749 мг (807 моль, 50%) заглавного соединения А и 579 мг (623 моль, 39%) заглавного соединения В, в обоих случаях в виде бесцветного маслянистого вещества.(1H), 7,62 (1 Н), 8,60 (1 Н) ppm. Пример 13i. (3S,6R,7S,8S,12Z,15S,16E)-15-Гидрокси-3,7-бисдиметил(1,1-диметилэтил)силил]окси]4,4,8,12,16-пентаметил-5-оксо-17-(2-пиридил)-6-(проп-2-ин-1-ил)гептадека-12,16-диеновая кислота. 726 мг (782 моль) соединения А, полученного по примеру 13h, подвергают реакции аналогично примеру 1 е и после обработки выделяют 657 мг (макс. 782 моль) заглавного соединения, которое подвергают дальнейшим реакциям без очистки. Пример 13j. (4S,7R,5S,9S,13Z,16S(E-4,8-бисДиметил(1,1-диметилэтил)силил]окси]-16-(1-метил 2-(2-пиридил)этенил)-1-окса-5,5,9,13-тетраметил-7-(проп-2-ин-1-ил)циклогексадец-13-ен-2,6-дион. 657 мг (макс. 782 моль) соединения, полученного по примеру 13i, подвергают реакции аналогично примеру 1q и после обработки и очистки выделяют 300 мг (414 моль, 53%) заглавного соединения в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3):=-0,08 (3 Н), 0,10 (3 Н), 0,15 (3 Н), 0,19 (3 Н), 0,81-2,20 (8 Н), 0,86 (9 Н), 0,95 (9 Н),1,02 (3 Н), 1,14 (3 Н), 1,23 (3 Н), 1,68 (3 Н), 2,14 (3 Н), 2,33-2,82 (6 Н), 3,12 (1H), 4,06 (1 Н), 4,11 (1H), 5,02(1 Н), 5,19 (1 Н), 6,58 (1 Н), 7,11 (1 Н), 7,26 (1H), 7,63 (1H), 8,59 (1 Н) ppm. Пример 13k. (4S,7R,8S,9S,13Z,16S(E-4,8-Дигидрокси-16-(1-метил-2-(2-пиридил)этенил)-1-окса 5,5,9,13-тетраметил-7-(проп-2-ин-1-ил)циклогексадец-13-ен-2,6-дион. 140 мг (193 моль) соединения, полученного по примеру 13j, подвергают реакции аналогично примеру 1 и после обработки и очистки выделяют 52 мг (105 моль, 54%) заглавного соединения в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3):=1,08 (3 Н), 1,10 (3 Н), 1,20-1,92 (6 Н), 1,42 (3 Н), 1,68 (3 Н), 2,02 (1H), 2,08 (3 Н),2,22-2,72 (7 Н), 2,86 (1 Н), 3,43 (1 Н), 3,78 (1 Н), 4,37 (1H), 4,54 (1 Н), 5,12 (1H), 5,20 (1 Н), 6,61 (1 Н), 7,13(1H), 7,30 (1 Н), 7,69 (1 Н), 8,55 (1 Н) ppm. Пример 14. (14S,7R,8S,9S,13 Е,16S(E-4,8-Дигидрокси-16-(1-метил-2-(2-пиридил)этенил)-1-окса-5,5,9,13 тетраметил-7-(проп-2-ин-1-ил)циклогексадец-13-ен-2,6-дион. Пример 14 а. (3S,6R,7S,8S,12 Е,15S,16 Е)-15-Гидрокси-3,7-бисдиметил(1,1-диметилэтил)силил]окси]4,4,8,12,16-пентаметил-5-оксо-17-(2-пиридил)-6-(проп-2-ин-1-ил)гептадека-12,16-диеновая кислота. 534 мг (575 моль) соединения В, полученного по примеру 13h, подвергают реакции аналогично примеру 1 е и после обработки выделяют 434 мг (макс. 585 моль) заглавного соединения, которое подвергают дальнейшим реакциям без очистки. Пример 14b. (4S,7R,8S,9S,13 Е,16S(E-4,8-бисДиметил(1,1-диметилэтил)силил]окси]-15-(1-метил 2-(2-пиридил)этенил)-1-окса-5,5,9,13-тетраметил-7-(проп-2-ин-1-ил)циклогексадец-13-ен-2,6-дион. 434 мг (макс. 585 моль) соединения, полученного по примеру 14 а, подвергают реакции аналогично примеру 1q и после обработки и очистки выделяют 382 мг (527 моль, 90%) заглавного соединения в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3): =0,04 (3 Н), 0,07-0,12 (9 Н), 0,85 (9 Н), 0,88 (9 Н), 0,93 (3 Н), 1,00-2,20 (8H), 1,14(3 Н), 1,22 (3 Н), 1,58 (3 Н), 2,00 (1 Н), 2,12 (3 Н), 2,44-2,62 (5 Н), 3,19 (1H), 3,91 (1H), 4,41 (1 Н), 5,19 (1 Н),5,29 (1 Н), 6,53 (1H), 7,09 (1H), 7,18 (1 Н), 7,62 (1 Н), 8,59 (1H) ppm. Пример 14 с. (4S,7R,8S,9S,13Z,16S(E-4,8-Дигидрокси-16-(1-метил-2-(2-пиридил)этенил)-1-окса-5,5,9,13 тетраметил-7-(проп-2-ин-1-ил)циклогексадец-13-ен-2,6-дион. 110 мг (152 моль) соединения, полученного по примеру 14b, подвергают реакции аналогично примеру 1 и после обработки и очистки выделяют 48 мг (97 моль, 64%) заглавного соединения в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3): =0,89-1,80 (5H), 1,01 (3 Н), 1,06 (3 Н), 1,35 (3 Н), 1,61 (3 Н), 1,93 (1 Н), 2,00 (1H),2,10 (3 Н), 2,17 (1 Н), 2,38-2,66 (6 Н), 3,58 (1 Н), 3,79 (2 Н), 3,88 (1 Н), 4,44 (1 Н), 5,10 (1H), 5,40 (1 Н), 6,59(4S,7R,8S,9S,13Z,16S(RS-4,8-бисдиметил(1,1-диметилэтил)силил]окси]-16-(1-метил-2-(2-пиридил)этенил)-1-окса-5,5,9,13-тетраметил-7-(проп-2-ен-1-ил) циклогексадец-13-ен-2,6-дион (В). Раствор 150 мг (207 моль) соединения, полученного по примеру 13j, в 16 мл этилацетата смешивают с каталитическим количеством бариевого сульфата палладия, 153 л пиридина и смесь гидрогенизируют при 23 С в атмосфере водорода. После фильтрации и удаления растворителя остаток очищают тонкослойной хроматографией на силикагеле (разделительная система состоит из н-гексана и этилацетата).- 24011502 Кроме исходного материала выделяют 66 мг (91 моль, 44%) заглавного соединения А и 64 мг (88 моль,42%) заглавного соединения В, в обоих случаях в виде изолированного маслянистого вещества. 1 Н-ЯМР (CDCl3) А: =-0,09 (3 Н), 0,07 (3 Н), 0,11 (6H), 0,78-1,82 (7H), 0,84 (9 Н), 0,92 (9 Н), 0,98 (3 Н),1,09 (3 Н), 1,18 (3 Н), 1,67 (3 Н), 2,06-2,82 (7 Н), 2,13 (3 Н), 3,11 (1 Н), 4,02 (1 Н), 4,85-5,03 (3 Н), 5,18 (1 Н),5,78 (1H), 6,57 (1 Н), 7,09 (1 Н), 7,25 (1H), 7,62 (1 Н), 8,59 (1 Н) ppm. Пример 15b. (4S,7R,8S,9S,13Z,16S(E-4,8-Дигидрокси-16-(1-метил-2-(2-пиридил)этенил)-1-окса-5,5,9,13 тетраметил-7-(проп-2-ен-1-ил)циклогексадец-13-ен-2,6-дион. 65,6 мг (90 ммоль) соединения А, полученного по примеру 15 а, подвергают реакции аналогично примеру 1 и после обработки и очистки выделяют 24,6 мг (59 моль, 55%) заглавного соединения в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3): =1,05 (6 Н), 1,19-1,89 (5 Н), 1,32 (3 Н), 1,69 (3 Н), 2,05 (3 Н), 2,13-2,57 (6 Н), 2,64(1 Н), 6,60 (1 Н), 7,12 (1 Н), 7,29 (1 Н), 7,68 (1H), 8,52 (1 Н) ppm. Пример 16. (4S,7R,8S,9S,13 Е,16S(Е-4,8-Дигидрокси-16-(1-метил-2-(2-пиридил)этенил)-1-окса-5,5,9,13 тетраметил-7-(проп-2-ен-1-ил)циклогексадец-13-ен-2,6-дион. Пример 16 а. (4S,7R,8S,9S,13 Е,16S(E-4,8-бисДиметил(1,1-диметилэтил)силил]окси]-16-(1-метил 2-(2-пиридил)этенил)-1-окса-5,5,9,13-тетраметил-7-(проп-2-ен-1-ил)циклогексадец-13-ен-2,6-дион. 114 г (157 моль) соединения, полученного по примеру 14b, подвергают реакции аналогично примеру 15 а и после обработки и очистки выделяют 68 мг (94 моль, 60%) заглавного соединения в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3): =0,04 (3 Н), 0,08 (3 Н), 0,10 (3 Н), 0,13 (3 Н), 0,83-0,98 (2 Н), 1,11 (3 Н), 1,15-1,96(6 Н), 1,20 (3 Н), 2,08-2,65 (7 Н), 2,14 (3 Н), 3,03 (1 Н), 3,88 (1 Н), 4,31 (1 Н), 4,98 (1 Н), 5,02 (1 Н), 5,22 (1H),5,29 (1 Н), 5,79 (1 Н), 6,54 (1 Н), 7,09 (1 Н), 7,20 (1H), 7,62 (1 Н), 8,60 (1 Н) ppm. Пример 16b. (4S,7R,8S,9S,13 Е,16S(E-4,8-Дигидрокси-15-(1-метил-2-(2-пиридил)этенил)-1-окса-5,5,9,13 тетраметил-7-(проп-2-ен-1-ил)циклогексадец-13-ен-2,6-дион. 67,7 мг (93 моль) соединения, полученного по примеру 16 а, подвергают реакции аналогично примеру 1 и после обработки и очистки выделяют 36,8 мг (74 моль) заглавного соединения в виде бесцветного масла. 1 Н-ЯМР (CDCl3): =0,96-2,66 (13 Н), 0,99 (6 Н), 1,28 (3 Н), 1,62 (3 Н), 2,10 (3 Н), 3,49 (1 Н), 3,72 (1 Н), 4,01(2 Н), 4,43 (1H), 4,91-5,13 (3 Н), 5,39 (1 Н), 5,71 (1H), 6,58 (1H), 7,12 (1H), 7,34 (1 Н), 7,66 (1H), 8,53 (1 Н) ppm. Пример 17. (1S/R,3S(E),7S,10R(RS),11S,12S,16R/S)-7,11-Дигидрокси-10-(2,3-эпоксипроп-1-ил)-3-(1 метил-2-(2-N-оксидопиридил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион. 36 мг (74 моль) соединения, полученного по примеру 16, подвергают реакции аналогично примеру 10 и после обработки и очистки выделяют 12 мг (22 моль, 30%) смеси двух диастереомеров А и В и 20 мг(37 моль, 50%) смеси двух диастереомеров С и D заглавного соединения, в каждом случае в виде бесцветного маслянистого вещества. Пример 18. (1S,3S(E),7S,10R(R или S),11S,12S,16R)-7,11-Дигидрокси-10-(2,3-эпоксипроп-1-ил)-3(1-метил-2-(2-N-оксидопиридил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9 дион (А) и (1R,3S(E),7S,10R(R или S),11S,12S,16S)-7,11-дигидрокси-10-(2,3-эпоксипроп-1-ил)-3-(1-метил-2(2-N-оксидопиридил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион (В). Раствор 20 мг (37 моль) смеси соединений С и D, полученных по примеру 17, в 3,1 мл безводного трихлорметана смешивают с молекулярным ситом (4 ), 789 мл изопропанола, 14,2 мг перрутената тетрапропиламмония и перемешивают на протяжении 5 ч при 55 С в атмосфере сухого аргона. Концентрируют выпариванием и полученный неочищенный продукт очищают хроматографией на аналитических тонкослойных пластинах. В качестве мобильного растворителя используется смесь этанола и этилацетата; в качестве элюанта используют смесь дихлорометана и этанола. Выделяют 4,6 мг (8,7 моль, 23%) заглавного соединения А или В и 3,3 мг (6,2 моль, 17%) заглавного соединения В или А, в обоих случаях в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3) А или В: =0,96 (3 Н), 1,06 (3 Н), 1,12-2,03 (11 Н), 1,22 (3 Н), 1,30 (3 Н), 2,11 (3 Н), 2,22(1 Н), 7,11 (1 Н), 7,23 (1 Н), 7,63 (1 Н), 8,59 (1 Н) ppm. 1 Н-ЯМР (CDCl3) В или А: =0,96 (3 Н), 1,05 (3 Н), 1,11-1,96 (9 Н), 1,23 (3 Н), 1,31 (3 Н), 2,12 (3 Н), 2,192,35 (3 Н), 2,50-2,66 (2 Н), 2,78 (1 Н), 3,50-3,69 (3 Н), 3,93 (1 Н), 4,16 (1H), 4,25 (1 Н), 4,41 (1H), 5,59 (1 Н),6,60 (1 Н), 7,12 (1 Н), 7,22 (1 Н), 7,64 (1 Н), 8,59 (1 Н) ppm. Пример 19. (1S/R,3S(E),7S,10R(S или R),11S,12S,16R/S)-7,11-Дигидрокси-10-(2,3-эпоксипроп-1-ил)-3-(1 метил-2-(2-N-оксидопиридил)этенил)-8,8,12,16-тетраметил-4,17-диоксабицикло[14,1,0]гептадекан-5,9-дион. 6,3 мг (12 моль) соединений А и В, полученных по примеру 17, подвергают реакции аналогично примеру 18 и после обработки и очистки выделяют 2,4 мг (4,5 моль, 38%) смеси заглавных соединений в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3): =0,95-2,22 (11 Н), 1,01 (3 Н), 1,10 (3 Н), 1,27 (3 Н), 1,31 (3 Н), 2,11 (3 Н), 2,34 (1 Н),- 25011502 2,45-2,57 (2 Н), 2,90 (1 Н), 3,39-3,87 (4 Н), 4,01-4,37 (3 Н), 5,49 (1 Н), 6,62 (1H), 7,13 (1H), 7,24 (1 Н) 7,66 (1 Н),8,58 (1 Н) ppm. Пример 20. (4S,7R,8S,9S,13Z,16S(R или S-4,8-Дигидрокси-16-(1-метил-2-(2-пиридил)этил)-1-окса 5,5,9,13-тетраметил-7-(проп-2-ен-1-ил)циклогексадец-13-ен-2,6-дион (А) и (4S,7R,8S,9S,13Z,16S(S или R4,8-дигидрокси-16-(1-метил-2-(2-пиридил)этил)-1-окса-5,5,9,13-тетраметил-7-(проп-2-ен-1-ил)циклогексадец-13-ен-2,6-дион (В). 7,0 мг (9,6 моль) соединения В, полученого по примеру 15 а, подвергают реакции аналогично примеру 1 и после обработки и очистки выделяют 1,4 мг (2,8 моль, 29%) заглавного соединения А и 1,7 мг(3,4 моль, 35%) заглавного соединения В, в обоих случаях в виде бесцветного масла. 1 Н-ЯМР (CDCl3) А: =0,88 (1H), 0,92 (3 Н), 1,04 (3 Н), 1,07 (3 Н), 1,18-2,57 (14 Н), 1,30 (3 Н), 1,68 (3 Н),2,91 (1H), 3,17 (1 Н), 3,28 (1H), 3,68 (1H), 4,47 (1H), 4,91-5,10 (4H), 5,70 (1H), 7,13-7,22 (2H), 7,68 (2H),8,46 (1H) ppm. 1 Н-ЯМР (CDCl3) B: =1,00 (6H), 1,05 (3H), 1,10-2,59 (15H), 1,33 (3H), 1,63 (3H), 2,93 (1H), 3,11 (1H),3,28 (1H), 3,63 (1H), 4,44 (1H), 4,91-5,12 (4H), 5,79 (1H), 6,39 (1H), 7,18 (2H), 7,67 (1H), 8,46 (1H) ppm. Пример 21. (4S,7R,8S,9S,13Z,16S)-4,8-Дигидрокси(2-метилбензоксазол-5-ил)-1-окса-5,5,9,13-тетраметил 7-(проп-2-ен-1-ил)циклогексадец-13-ен-2,6-дион. Пример 21 а. Этиловый эфир (2E/Z)-3-(2-метилбеноксазол-5-ил)-2-пропеновой кислоты. Суспензию 58 г (346 ммоль) 5-хлор-2-метилбанзоксазола, 200 мл диметилформамида, 57 г йодида натрия и 16,2 г бромида никеля(II) нагревают до 150 С в течение 4 ч. После охлаждения смешивают с 42 мл этилового эфира акриловой кислоты, 53 мл триэтиламина, 988 мг трис(дибензиленацетон)дипалладия(0),36,4 г трифенилфосфина и смесь нагревают до 150 С на протяжении 3 дней. Охлажденную смесь выливают в воду, подкисляют и экстрагируют несколько раз этилацетатом. Объединенные органические экстракты промывают концентрированным раствором хлорида натрия, сушат на сульфате натрия, остаток,полученный после фильтрации и удаления растворителя, очищают тонкослойной хроматографией на силикагеле (разделительная система состоит из н-гексана и этилацетата). Выделяют 6,4 г (28 ммоль, 8%) заглавного соединения в виде твердого кристаллического вещества. 1 Н-ЯМР (CDCl3): =1,33 (3 Н), 2,64 (3 Н), 4,28 (2 Н), 6,42 (1 Н), 7,47 (2 Н), 7,78 (1 Н), 7,81 (1 Н) ppm. Пример 21b. (2-Метилбензоксазол-5-ил)карбальдегид. Раствор 9,5 г (41 ммоль) соединения, полученного по примеру 21 а, в тетрагидрофуране смешивают с водой, 2,5% раствором тетроксида осмия в трет-бутаноле, периодатом натрия и смесь перемешивают 6 ч при 23 С. Выливают на концентрированный раствор тиосульфата натрия и несколько раз экстрагируют этилацетатом. Объединенные органические экстракты промывают концентрированным раствором хлорида натрия, сушат на сульфате натрия и полученный после фильтрации и удаления растворителя остаток очищают тонкослойной хроматографией на силикагеле (разделительная система состоит из нбутиллития и этилацетата). Выделяют 4,86 г (30 ммоль, 74%) заглавного соединения в виде твердого кристаллического вещества. 1 Н-ЯМР (CDCl3): =2,69 (3 Н), 7,60 (1H), 7,90 (1 Н), 8,16 (1H), 10,08 (1H) ppm. Пример 21c. (3RS)-3-(2-Метилбензоксазол-5-ил)-1-[(4S,5R)-4-метил-5-фенилоксазолидин-2-он-3-ил]3-гидроксипропил-1-он. 50 мл 2,4-молярного раствора н-бутиллития в н-гексане добавляют по каплям при -30 С в атмосфере сухого аргона к раствору 14,1 мл диизопропиламина в 67,0 мл безводного тетрагидрофурана, перемешивают на протяжении 20 мин, охлаждают до -70 С и смешивают на протяжении 4,5 ч с раствором 19,8 г(4S,5R)-3-ацетил-4-метил-5-фенилоксазолидин-2-она в 670 мл тетрагидрофурана. Через 1 ч по каплям добавляют в течение 1,5 ч раствор 4,86 г (30,1 ммоль) соединения, полученного по примеру 21b, в 175 мл тетрагидрофурана и смесь перемешивают на протяжении 1 ч при -70 С. Ее выливают на концентрированный раствор хлорида аммония, несколько раз экстрагируют этилацетатом, объединенные органические экстракты промывают концентрированным раствором хлорида натрия и сушат на сульфате натрия. Остаток, полученный после фильтрации и удаления растворителя, очищают тонкослойной хроматографией на силикагеле (разделительная система состоит из н-гексана и этилацетата). Выделяют 11,3 г (29,7 ммоль,98%) заглавного соединения в виде бесцветного маслянистого вещества. Пример 21d. (3S)-3-(2-Метилбензоксазол-5-ил)-1-[(4S,3R)-4-метил-5-фенилоксазолидин-2-он-3-ил]3-диметил(1,1-диметилэтил)силил]окси]пропил-1-он (А) и (3R)-3-(2-метилбензоксазол-5-ил)-1-[(4S,3R)4-метил-5-фенилоксазолидин-2-он-3-ил]-3-диметил(1,1-диметилэтил)силил]окси]пропил-1-он (В). Раствор 12,5 г (32,8 ммоль) соединения, полученного по примеру 21 с, в 110 мл безводного дихлорометана охлаждают в атмосфере сухого аргона до -70 С, смешивают с 7,8 мл 2,6-лутидина и 13,9 мл третбутилдиметилсилилового эфира трифторосульфоновой кислоты и смесь перемешивают в течение 1 ч. Выливают на концентрированный раствор бикарбоната натрия, экстрагируют несколько раз дихлорометаном,объединенные органические экстракты промывают концентрированным раствором хлорида натрия и сушат на сульфате натрия. Остаток, полученный после фильтрации и удаления растворителя, разделяют тонкослойной хроматографией на силикагеле (разделительная система состоит из н-гексана, этилацетата и этанола). Выделяют 8,9 г (18,0 ммоль, 55%) заглавного соединения А в виде кристаллического твердого- 26011502 вещества и 2,9 г (5,9 ммоль, 18%) заглавного соединения В в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3) А: =-0,19 (3 Н), 0,02 (3 Н), 0,82 (9 Н), 0,88 (3 Н), 2,61 (3 Н), 3,19 (1H), 3,51 (1 Н), 4,69(1H), 5,39 (1 Н), 5,63 (1H), 7,21-7,46 (7 Н), 7,67 (1 Н) ppm. Пример 21 е. Этиловый эфир (3S)-3-(2-метилбензоксазол-5-ил)-3-диметил(1,1-диметилэтил)силил] окси]пропионовой кислоты. Раствор 13,9 г (28,2 ммоль) соединения, полученного по примеру 21d, в 140 мл безводного этанола смешивают при 23 С в атмосфере сухого аргона с 7,1 мл тетраэтилата титана и нагревают до 85 С на протяжении 3 ч. Концентрируют выпариванием, остаток очищают тонкослойной хроматографией на силикагеле (разделительная система состоит из н-гексана и этилацетата). Выделяют 10,1 г (27,8 ммоль,99%) заглавного соединения в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3): =-0,20 (3 Н), 0,02 (3 Н), 0,82 (9 Н), 1,26 (3 Н), 2,55 (1 Н), 2,62 (3 Н), 2,76 (1 Н), 4,12(2 Н), 5,26 (1 Н), 7,29 (1 Н), 7,40 (1H), 7,62 (1 Н) ppm. Пример 21f. (3S)-3-(2-Метилбензоксазол-5-ил)-3-диметил(1,1-диметилэтил)силил]окси]пропап-1-ол. Раствор 10,1 г (27,8 ммоль) соединения, полученного по примеру 21 е, в безводном дихлорометане охлаждают в атмосфере сухого аргона до -78 С, смешивают с 58 мл 1,2-молярного раствора гидрида диизобутилалюминия в толуоле и перемешивают в течение еще 1 ч. Смешивают с 16 мл изопропанола,32 мл воды, нагревают до 23 С и перемешивают до образования тонкозернистого осадка. После фильтрации и удаления растворителя выделяют 7,2 г (22,4 ммоль, 81%) заглавного соединения в виде бесцветного маслянистого вещества. 1(1H), 7,28 (1H), 7,42 (1H), 7,60 (1 Н) ppm. Пример 21g. (3S)-3-(2-Метилбензоксазол-5-ил)-диметил(1,1-диметилэтил)силил]окси]-1-йодопропан. Раствор 2,83 г трифенилфосфина в 40 мл безводного дихлорометана смешивают при 23 С в атмосфере сухого аргона с 737 мг имидазола, 2,71 г йода, при охлаждении добавляют по каплям раствор 2,65 г(8,2 ммоль) соединения, полученного по примеру 21f, в 30 мл дихлорометана. Смесь перемешивают на протяжении 1 ч и очищают непосредственно тонкослойной хроматографией на силикагеле (разделительная система состоит из н-гексана и этилацетата). Выделяют 2,3 г (5,3 ммоль, 65%) заглавного соединения в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3): =-0,20 (3 Н), 0,06 (3 Н), 0,85 (9 Н), 2,10 (1 Н), 2,21 (1 Н), 2,61 (3 Н), 3,11 (1 Н), 3,23(1 Н), 4,82 (1H), 7,22 (1 Н), 7,39 (1 Н), 7,59 (1 Н) ppm. Пример 21h. Йодид (3S)-3-(2-метилбензоксазол-5-ил)-3-диметил(1,1-диметилэтил)силил]окси]пропан-1-трифенилфосфония. 2,3 г (5,3 ммоль) соединения, полученного по примеру 21g, смешивают с 2,9 мл этилдиизопропиламина, 17,5 г трифенилфосфина и нагревают до 85 С на протяжении 4 ч. Маслянистый остаток очищают тонкослойной хроматографией на силикагеле (разделительная система состоит из н-гексана и этилацетата). Выделяют 3,3 г (4,8 ммоль, 89%) заглавного соединения в виде кристаллического твердого вещества. 1 Н-ЯМР (CDCl3): =-0,19 (3 Н), 0,12 (3 Н), 0,84 (9 Н), 1,89 (1H), 2,09 (1H), 2,60 (3 Н), 3,41 (1 Н), 4,06(1 Н), 5,37 (1H), 7,38 (1 Н), 7,49 (1 Н), 7,59 (1 Н), 7,62-7,84 (15 Н) ppm. Пример 21i. (2S,6E/Z,9S)-9-Диметил(1,1-диметилэтил)силил]окси]-9-(2-метилбензоксазол-5-ил)-1(тетрагидропиранилокси)-2,8-диметил-нон-6-ен. Раствор 2,3 г (3,3 ммоль) соединения, полученного по примеру 21h, в 15 мл безводного тетрагидрофурана смешивают в атмосфере сухого аргона при 0 С с 5 мл 1,0-молярного раствора гексаметилдисилазана в тетрагидрофуране, по каплям добавляют раствор 513 мг (2,25 ммоль) (2S)-2-метил-6-оксогептан-1(тетрагидропиран-2-илокси), полученного аналогично способу, описанному в DE 19751200.3, в 15 мл тетрагидрофурана, нагревают до 23 С и дают прореагировать еще 3 ч. Реактивы выливаают на концентрированный раствор хлорида аммония, экстрагируют несколько раз этилацетатом, объединенные органические экстракты промывают концентрированным раствором хлорида натрия и сушат на сульфате натрия. Остаток, полученный после фильтрации и удаления растворителя, разделяют тонкослойной хроматографией на силикагеле (разделительная система состоит из н-гексана и этилацетата). Выделяют 506 мг(1,0 ммоль, 44%) заглавного соединения в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3): =-0,15 (3 Н), 0,01 (3 Н), 0,80-0,92 (12 Н), 1,02 (1 Н), 1,19-1,97 (12 Н), 1,46+1,62 (3 Н),2,21-2,48 (2 Н), 2,60 (3 Н), 3,10+3,19 (1 Н), 3,40-3,61 (2 Н), 3,82 (1 Н), 4,53 (1 Н), 4,69 (1H), 5,11 (1H), 7,22(1H), 7,37 (1H), 7,57 (1H) ppm. Пример 21j. (2S,6E/Z,9S)-9-Диметил(1,1-диметилэтил)силил]окси]-9-(2-метилбензоксазол-5-ил)-1 гидрокси-2,6-диметил-нон-6-ен. 447 мг (0,87 ммоль) соединения, полученного по примеру 21i, подвергают реакции аналогично примеру 1k и после обработки и очистки выделяют 298 мг (0,69 ммоль, 79%) заглавного соединения в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3): =-0,12 (3 Н), 0,01 (3 Н), 0,82-0,92 (12 Н), 1,01 (1H), 1,16-1,67 (4 Н), 1,44+1,63 (3 Н),- 27011502 1,83-1,98 (2 Н), 2,18 (1 Н), 2,33 (1 Н), 2,44 (1 Н), 2,62 (3 Н), 3,31-3,53 (2 Н), 4,71 (1H), 5,07+5,13 (1 Н),7,24+7,29 (1 Н), 7,39 (1H), 7,53+7,58 (1 Н) ppm. Пример 21k. (2S,6E/Z,9S)-9-Диметил(1,1-диметилэтил)силил]окси]-9-(2-метилбензоксазол-5-ил)-1 оксо-2,6-диметил-нон-6-ен. 272 мг (0,63 ммоль) соединения, полученного по примеру 21j, подвергают реакции аналогично примеру 1n и после обработки и очистки выделяют 236 мг (0,55 ммоль, 87%) заглавного соединения в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3): =-0,16 (3 Н), 0,01 (3 Н), 0,84 (9 Н), 1,02+1,05 (3 Н), 1,13-2,50 (5 Н), 1,44+1,61 (3 Н),2,61 (3 Н), 4,71 (1H), 5,13 (1 Н), 7,21 (1 Н), 7,37 (1 Н), 7,55 (1 Н), 9,54 (1 Н) ppm. Пример 21l. (4S(4R,5S,6S,10E/Z,13S-4-(13-(1,1-диметилэтал)диметилсилил]окси]-4-(проп-2-ен-1 ил)-13-(2-метилбензоксазол-5-ил)-3-оксо-5-гидрокси-2,6,10-триметил-тридек-10-ен-2-ил)-2,2-диметил-[1,3] диоксан (А) и (4S(4S,5R,6S,10E/Z,13S-4-(13-(1,1-диметилэтил)диметилсилил]окси]-4-(проп-2-ен-1-ил)13-(2-метилбензоксазол-5-ил)-3-оксо-5-гидрокси-2,6,10-триметил-тридек-10-ен-2-ил)-2,2-диметил-[1,3]диоксан (В). 236 мг (0,55 ммоль) соединения, полученного по примеру 21k, подвергают реакции аналогично примеру 1 с с 433 мг (1,80 ммоль) (4S)-4-(2-метил-3-оксо-гепт-6-ен-2-ил)-2,2-диметил[1,3]диоксана, получаемого аналогично способу, описанному в DE 19751200.3, и после обработки и очистки, кроме исходного материала, выделяют 221 мг (0,33 ммоль, 60%) заглавного соединения А и 72 мг (0,11 ммоль,20%) заглавного соединения В, в обоих случаях в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3) А: =-0,13 (3 Н), 0,01 (3 Н), 0,78-0,88 (12 Н), 0,96 (3 Н), 1,04 (1H), 1,11-2,52 (12 Н),1,23 (3 Н), 1,31 (3 Н), 1,39 (3 Н), 1,47+1,64 (3 Н), 2,62 (3 Н), 2,90+2,98 (1H), 3,32 (1 Н), 3,47 (1H), 3,87 (1H),3,97 (1H), 4,13 (1 Н), 4,70 (1H), 4,98 (1 Н), 5,03 (1 Н), 5,12 (1H), 5,71 (1 Н), 7,22, (1H), 7,38 (1 Н), 7,56 (1 Н) ppm. Пример 21m. (3S,6R,7S,8S,12E/Z,15S)-15-(1,1-Диметилэтил)диметилсилил]окси]-6-(проп-2-ен-1-ил)1,3,7-тригидрокси-4,4,8,12-тетраметил-15-(2-метилбензоксазол-5-ил)пентадек-12-ен-5-он. 221 мг (0,33 ммоль) соединения А, полученного по примеру 211, подвергают реакции аналогично примеру 1k и после обработки и очистки выделяют 163 мг (0,26 ммоль, 78%) заглавного соединения в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3): =-0,15 (3 Н), 0,01 (3 Н), 0,79-0,90 (12 Н), 1,05 (3 Н), 1,17-2,59 (13 Н), 1,20+1,24 (3 Н),1,43+1,62 (3 Н), 2,62+2,64 (3 Н), 2,81+3,07 (1 Н), 3,25-3,70 (3 Н), 3,86 (2 Н), 4,08 (2 Н), 4,68 (1 Н), 4,92-5,19(3 Н), 5,69 (1 Н), 7,25+7,29 (1H), 7,39 (1H), 7,48+7,52 (1 Н) ppm. Пример 21n. (3S,6R,7S,8S,12E/Z,15S)-6-(Проп-2-ен-1-ил)-1,3,7,15-тетракис-(1,1-диметилэтил)диметилсилил]окси]-4,4,8,12-тетраметил-15-(2-метилбензоксазол-5-ил)пентадек-12-ен-5-он. 163 мг (0,26 ммоль) соединения, полученного по примеру 21m, подвергают реакции аналогично примеру 1l и после обработки и очистки выделяют 236 мг (0,24 ммоль, 93%) заглавного соединения в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3): =-0,05 (3 Н), -0,04-0,08 (21 Н), 0,79-0,93 (33 Н), 0,96-1,66 (7H), 1,01 (3 Н), 1,17 (3 Н),1,47+1,62 (3 Н), 1,88 (2 Н), 2,18-2,52 (4 Н), 2,61 (3 Н), 3,11 (1H), 3,53 (1 Н), 3,63 (1 Н), 3,73 (1 Н), 3,84 (1 Н),4,68 (1 Н), 4,91 (1H), 4,97 (1H), 5,12 (1 Н), 5,72 (1 Н), 7,21 (1 Н), 7,36 (1 Н), 7,56 (1H) ppm. Пример 21 о. (3S,6R,7S,8S,12E/Z,15S)-1-Гидрокси-6-(проп-2-ен-1-ил)-3,7,15-трис(1,1-диметилэтил) диметилсилил]окси]-4,4,8,12-тетраметил-15-(2-метилбензоксазол-5-ил)пентадек-12-ен-5-он. 236 мг (0,24 ммоль) соединения, полученного по примеру 21n, подвергают реакции аналогично примеру 1m и после обработки и очистки выделяют 146 мг (0,17 ммоль, 71%) заглавного соединения в виде бесцветного маслянистого вещества. Пример 21 р. (3S,SR,7S,8S,12E/Z,15S)-5-Оксо-6-(проп-2-ен-1-ил)-3,7,15-трис(1,1-диметилэтил)диметилсилил]окси]-4,4,8,12-тетраметил-15-(2-метилбензоксазол-5-ил)пентадек-12-енал. 146 мг (0,17 ммоль) соединения, полученного по примеру 21 о, подвергают реакции аналогично примеру 1n и после обработки и очистки выделяют 143 мг (0,17 ммоль, 98%) заглавного соединения в виде бесцветного маслянистого вещества. Пример 21q. (3S,6R,7S,8S,12Z,15S)-5-Оксо-6-(проп-2-ен-1-ил)-3,7,15-трис-(1,1-диметилэтил)диметилсилил]окси]-4,4,8,12-тетраметил-5-(2-метил-бензоксазол-5-ил)пентадек-12-еновая кислота (А) и (3S,6R,7S,8S,12 Е,15S)-5-оксо-6-(проп-2-ен-1-ил)-3,7,15-трис(1,1-диметилэтил)диметилсилил]окси]-4,4,8,12 тетраметил-5-(2-метилбензоксазол-5-ил)пентадек-12-еновая кислота (В). Раствор 143 мг (0,17 ммоль) соединения, полученного по примеру 21p, в 5 мл трет-бутанола смешивают при 0 С с раствором 1,1 мл 2-метил-2-бутена в 3,6 мл тетрагидрофурана, 1,3 мл воды, 67 мг дигидрогенфосфата натрия и перемешивают на протяжении 2 ч. Смесь выливают на концентрированный раствор тиосульфата натрия, экстрагируют несколько раз этилацетатом, объединенные органические экстракты промывают концентрированным раствором хлорида натрия и сушат на сульфате натрия. Остаток,полученный после фильтрации и удаления растворителя, разделяют тонкослойной хроматографией на силикагеле (разделительная система состоит из н-гексана и этилацетата). Выделяют 58 мг (66 моль,39%) заглавного соединения А и 52 мг (60 моль, 35%) заглавного соединения В, в обоих случаях в виде бесцветного маслянистого вещества.(8 Н), 1,12 (3 Н), 1,19 (3 Н), 1,39 (3 Н), 2,23-2,60 (6 Н), 2,63 (3 Н), 3,21 (1 Н), 3,79 (1H), 4,36 (1 Н), 4,68 (1H),4,98 (1 Н), 5,01 (1H), 5,10 (1 Н), 5,77 (1 Н), 7,36 (1 Н), 7,41 (1 Н), 7,54 (1 Н) ppm. Пример 21r. (3S,6R,7S,8S,12Z,15S)-15-Гидрокси-5-оксо-6-(проп-2-ен-1-ил)-3,7-бис(1,1-диметилэтил)диметилсилил]окси]-4,4,8,12-тетраметил-15-(2-метилбензоксазол-5-ил)пентадек-12-еновая кислота. 58 мг (66 моль) соединения А, полученного по примеру 21q, подвергают реакции аналогично примеру 1 р и после обработки выделяют 52 мг (макс. 66 моль) заглавного соединения, которое подвергают дальнейшим реакциям без очистки. Пример 21s. (4S,7R,8S,9S,13Z,16S)-4,8-бисДиметил(1,1-диметилэтил)силил]окси]-16-(2-метилбензоксазол-5-ил)-7-(проп-2-ен-1-ил)-1-окса-5,5,9,13-тетраметилциклогексадец-13-ен-2,6-дион. 52 мг (макс. 66 моль) соединения, полученного по примеру 21 г, подвергают реакции аналогично примеру 1q и после обработки и очистки выделяют 42 мг (57 моль, 86%) заглавного соединения в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3): =-0,08 (3 Н), 0,09 (6 Н), 0,14 (3 Н), 0,77-1,88 (7H), 0,85 (9 Н), 0,93 (9 Н), 1,01 (3 Н),1,09 (3 Н), 1,15 (3 Н), 1,71 (3 Н), 2,10-2,75 (6 Н), 2,62 (3 Н), 2,91 (1H), 3,11 (1 Н), 4,00 (1H), 4,92 (1H), 4,99(1 Н), 5,19 (1H), 5,57 (1 Н), 5,79 (1H), 7,32 (1H), 7,44 (1H), 7,68 (1 Н) ppm. Пример 21t. (4S,7R,8S,9S,13Z,16S)-4,8-Дигидрокси-16-(2-метилбензоксазол-5-ил)-7-(проп-2-ен-1-ил)1-окса-5,5,9,13-тетраметилциклогексадец-13-ен-2,6-дион. 42 мг (75 моль) соединения, полученного по примеру 21s, подвергают реакции аналогично примеру 1 и после обработки и очистки выделяют 19 мг (37 моль, 65%) заглавного соединения в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3): =1,02 (3 Н), 1,08 (3 Н), 1,14-1,97 (6 Н), 1,22 (3 Н), 1,70 (3 Н), 2,22-2,60 (7 Н), 2,62(3 Н), 2,78-2,95 (2 Н), 3,36 (1 Н), 3,78 (1 Н), 4,10 (1 Н), 5,03 (1H), 5,09 (1 Н), 5,19 (1 Н), 5,76 (1 Н), 5,85 (1 Н),7,28 (1 Н), 7,43 (1 Н), 7,63 (1 Н) ppm. Пример 22. (4S,7R,8S,9S,13 Е,16S)-4,8-Дигидрокси-16-(2-метилбензоксазол-5-ил)-7-(проп-2-ен-1-ил)1-окса-5,5,9,13-тетраметилциклогексадец-13-ен-2,6-дион. Пример 22 а. (3S,6R,7S,8S,12 Е,15S)-15-Гидрокси-5-оксо-6-(проп-2-ен-1-ил)-3,7-бис(1,1-диметилэтил)диметилсилил]окси]-4,4,8,12-тетраметил-15-(2-метилбензоксазол-5-ил)пентадек-12-еновая кислота. 52 мг (60 моль) соединения В, полученного по примеру 21q, подвергают реакции аналогично примеру 1 р и после обработки выделяют 46 мг (макс. 60 моль) заглавного соединения, которое используют для дальнейших реакций без очистки. Пример 22b. (4S,7R,8S,9S,13E,16S)-4,8-бисДиметил(1,1-диметилэтил)силил]окси]-16-(2-метилбензоксазол-5-ил)-7-(проп-2-ен-1-ил)-1-окса-5,5,9,13-тетраметилциклогексадец-13-он-2,6-дион. 46 мг (макс. 60 моль) соединения, полученного по примеру 22 а, подвергают реакции аналогично примеру 1q и после обработки и очистки выделяют 32 мг (43 моль, 72%) заглавного соединения в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3): =0,03-0,11 (12 Н), 0,89 (9 Н), 0,91 (9 Н), 0,94-1,96 (6 Н), 0,98 (3 Н), 1,12 (3 Н), 1,21(3 Н), 1,59 (3 Н), 2,10-2,76 (7 Н), 2,63 (3 Н), 3,08 (1 Н), 3,91 (1H), 4,31 (1 Н), 5,02 (1H), 5,07 (1 Н), 5,29 (1H),5,79 (1 Н), 5,89 (1 Н), 7,30 (1 Н), 7,42 (1H), 7,62 (1 Н) ppm. Пример 22 с. (4S,7R,8S,9S,13 Е,16S)-4,8-Дигидрокси-16-(2-метилбензоксазол-5-ил)-7-(проп-2-ен-1-ил)1-окса-5,5,9,13-тетраметилциклогексадец-13-ен-2,6-дион. 32 мг (43 моль) соединения, полученного по примеру 22b, подвергают реакции аналогично примеру 1 и после обработки и очистки выделяют 15 мг (29 моль, 68%) заглавного соединения в виде бесцветного маслянистого вещества. 1(0,80 ммоль, 12%) заглавного соединения В, в обоих случаях в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3) А: =0,03-0,13 (15 Н), 0,82-0,92 (12 Н), 0,97-2,03 (12 Н), 1,06 (3 Н), 1,30 (6 Н), 1,38(3 Н), 1,58+1,65 (3 Н), 2,33-2,47 (3 Н), 2,55 (1H), 2,70 (3 Н), 3,44 (1H), 3,52 (1H), 3,80-4,28 (2 Н), 5,13 (1H),6,03 (1H), 7,32 (1H) ppm. 1 Н-ЯМР (CDCl3) В: =0,05-0,65 (15 Н), 0,88-0,99 (12 Н), 1,02-1,73 (8 Н), 1,18 (6 Н), 1,32 (3 Н), 1,41 (3 Н),1,60+1,69 (3 Н), 1,90-2,08 (2 Н), 2,33-2,58 (4 Н), 2,70 (3 Н), 3,43 (1H), 3,60 (1H), 3,79-4,26 (4 Н), 5,18 (1H),6,05 (1H), 7,33 (1H) ppm. Пример 23b. (3S,6R,7S,8S,12E/Z,15S,16Z)-15-(1,1-Диметилэтил)диметилсилил]окси]-6-(3-(триметилсилил)проп-2-ин-1-ил)-16-фтор-1,3,7-тригидрокси-4,4,8,12-тетраметил-17-(2-метилтиазол-4-ил)гептадека-12,16-диен-5-он. 3,26 г (4,35 ммоль) соединения А, полученного по примеру 23 а, подвергают реакции аналогично примеру 1k и после обработки и очистки, кроме исходного материала, выделяют 2,44 г (3,43 ммоль, 79%) заглавного соединения в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3): =0,03-0,15 (15 Н), 0,85-0,95 (12 Н), 0,98-2,08 (3 Н), 1,14 (3 Н), 1,26 (3 Н), 1,58+1,67(3 Н), 2,31-2,49 (3 Н), 2,59-2,76 (2 Н), 2,72 (3 Н), 2,89 (1H), 3,06 (1H), 3,42 (1H), 3,47-3,58 (2 Н), 3,88 (2 Н),4,08-4,22 (2 Н), 5,11+5,18 (1H), 5,98 (1H), 7,33 (1H) ppm. Пример 23 с. (3S,6R,7S,8S,12E/Z,15S,16Z)-16-Фтор-1,3,7,15-тетракис(1,1-диметилэтил)диметилсилил]окси]-6-(3-(триметилсилил)проп-2-ин-1-ил)-4,4,8,12-тетраметил-17-(2-метилтиазол-4-ил)гептадека 12,16-диен-5-он. 2,77 г (3,90 ммоль) соединения, полученного по примеру 23b, подвергают реакции аналогично примеру 1l и после обработки и очистки выделяют 3,48 г (3,31 ммоль, 85%) заглавного соединения в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3): =0,00-0,15 (33 Н), 0,83-0,97 (39 Н), 1,00-1,75 (7 Н), 1,07 (3 Н), 1,27 (3 Н), 1,60+1,68(3 Н), 1,88-2,03 (2 Н), 2,31-2,48 (2 Н), 2,51 (2 Н), 2,70 (3 Н), 3,29 (1H), 3,52-3,71 (2 Н), 3,29 (1H), 3,89 (1H),4,19 (1H), 5,15 (1H), 6,06 (1H), 7,33 (1H) ppm. Пример 23d. (3S,6R,7S,8S,12E/Z,15S,16Z)-16-Фтор-1-гидрокси-3,7,15-трис(1,1-диметилэтил)диметилсилил]окси]-6-(3-(триметилсилил)проп-2-ин-1-ил)-4,4,8,12-тетраметил-17-(2-метилтиазол-4-ил)гептадека-12,16-диен-5-он. 3,48 г (3,31 ммоль) соединения, полученного по примеру 23c, подвергают реакции аналогично примеру 1m и после обработки и очистки выделяют 2,36 г (2,5 ммоль, 76%) заглавного соединения в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3): =0,00-0,18 (27H), 0,83-0,99 (30 Н), 1,01-1,80 (7H), 1,12 (3 Н), 1,27 (3 Н), 1,60+1,68(1H), 5,16 (1H), 6,06 (1H), 7,32 (1H) ppm. Пример 23 е. (3S,6R,7S,8S,12E/Z,15S,16Z)-16-Фтор-5-оксо-3,7,15-трис(1,1-диметилэтил)диметилсилил]окси]-6-(3-(триметилсилил)проп-2-ин-1-ил)-4,4,8,12-тетраметил-17-(2-метилтиазол-4-ил)гептадека 12,16-диенал. 2,36 г (2,51 ммоль) соединения, полученного по примеру 23d, подвергают реакции аналогично примеру 1n и после обработки и очистки выделяют 2,25 г (2,40 ммоль, 96%) заглавного соединения в виде бесцветного маслянистого вещества. Пример 23f. (3S,6R,7S,8S,12Z,15S,16Z)-16-Фтор-5-оксо-3,7,15-трис(1,1-диметилэтил)диметилсилил]окси]-6-(3-(триметилсилил)проп-2-ин-1-ил)-4,4,8,12-тетраметил-17-(2-метилтиазол-4-ил)гептадека 12,16-диеновая кислота (А) и (3S,6R,7S,8S,12 Е,15S,16Z)-16-фтор-5-оксо-3,7,15-трис(1,1-диметилэтил) диметилсилил]окси]-6-(3-(триметилсилил)проп-2-ин-1-ил)-4,4,8,12-тетраметил-17-(2-метилтиазол-4-ил) гептадека-12,16 диеновая кислота (В). 2,25 г (2,40 ммоль) соединения, полученного по примеру 23 е, подвергают реакции аналогично примеру 22q и после обработки и очистки выделяют 960 мг (1,01 ммоль, 42%) заглавного соединения А, а также 937 мг (0,98 ммоль, 41%) заглавного соединения В в виде бесцветного маслянистого вещества. 1 Н-ЯМР (CDCl3) А: =-0,02-0,17 (27 Н), 0,89 (27 Н), 0,94 (3 Н), 1,08-1,67 (6H), 1,18 (3 Н), 1,22 (3 Н),1,70 (3 Н), 1,89 (1H), 2,12 (1H), 2,28-2,53 (5 Н), 2,61 (1H), 2,69 (3 Н), 3,31 (1H), 3,71 (1H), 4,20 (1H), 4,38(1H), 6,12 (1H), 7,38 (1H) ppm. Пример 23g. (3S,6R,7S,8S,12Z,15S,16Z)-16-Фтор-5-оксо-3,7-бис(1,1-диметилэтил)диметилсилил]окси]-15-гидрокси-6-(проп-2-ин-1-ил)-4,4,8,12-тетраметил-17-(2-метилтиазол-4-ил)гептадека-12,16-диеновая кислота. 960 мг (1,01 ммоль) соединения А, полученного по примеру 23f, подвергают реакции аналогично примеру 1 е и после обработки выделяют 898 мг (макс. 1,01 ммоль) заглавного соединения, которое ис- 30
МПК / Метки
МПК: C07D 405/06, C07D 493/04, C07D 413/06, C07D 417/06, A61P 35/00, A61K 31/335, C07D 405/14
Метки: фармацевтических, 6-алкинил, способ, препаратах, получения, 6-алкенил, 6-эпокси-эпотилона, применение, производные
Код ссылки
<a href="https://eas.patents.su/30-11502-proizvodnye-6-alkenil-6-alkinil-i-6-epoksi-epotilona-sposob-ih-polucheniya-i-ih-primenenie-v-farmacevticheskih-preparatah.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 6-алкенил-, 6-алкинил- и 6-эпокси-эпотилона, способ их получения и их применение в фармацевтических препаратах</a>
Предыдущий патент: Легкий многофункциональный самолет
Следующий патент: Гербицидные смеси с синергическим действием
Случайный патент: Способ получения олефинов












