Комбинация, содержащая производные тропана, полезные в терапии
Номер патента: 7580
Опубликовано: 29.12.2006
Авторы: Стаммен Бланда Люциа Криста, Вуд Энтони, Прайс Дэвид Энтони, Перрос Маноуссос
Формула / Реферат
1. Комбинация, включающая соединение формулы
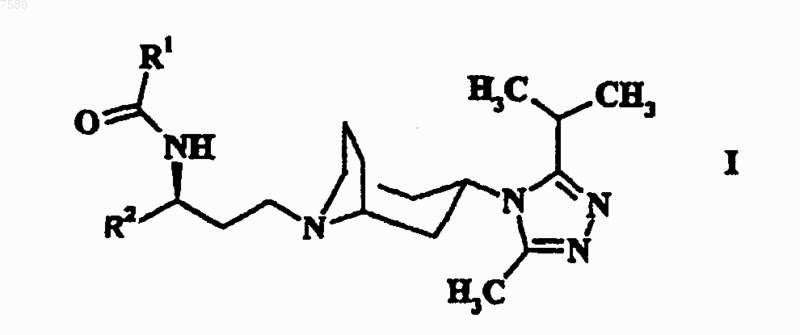
где R1 означает С3-6-циклоалкил, необязательно замещенный одним или более атомами фтора, или C1-6-алкил, необязательно замещенный одним или более атомами фтора, или С3-6-циклоалкилметил, необязательно замещенный по кольцу одним или более атомами фтора, и
R2 означает фенил, необязательно замещенный одним или более атомами фтора;
или его фармацевтически приемлемую соль или сольват и один или более дополнительный терапевтический агент.
2. Комбинация по п.1, где дополнительный терапевтический агент или терапевтические агенты выбирают из агентов, пригодных для лечения нарушения, при котором вовлекается модуляция CCR5 рецепторов.
3. Комбинация по п.1 или 2, где дополнительный терапевтический агент или терапевтические агенты выбирают из агентов, пригодных для лечения HIV.
4. Комбинация по любому из пп.1-3, где дополнительный терапевтический агент или терапевтические агенты включают один или более ингибитор HIV протеазы и/или HIV обратной транскриптазы.
5. Комбинация по п.4, где один или более ингибитор HIV протеазы и/или HIV обратной транскриптазы выбирают из класса ненуклеозидных ингибиторов обратной транскриптазы (NNTRI).
6. Комбинация по любому из пп.1-5, где дополнительный терапевтический агент или терапевтические агенты включают один или более компонент, выбранный из ингибиторов пролиферации, иммуномодуляторов, ингибиторов слияния, других агонистов/антагонистов рецепторов хемокина, модуляторов рецептора тахикинина, ингибиторов интегразы, ингибиторов RhaseH, ингибиторов вирусной транскриптазы, RNA репликации и других агентов, которые ингибируют вирусную инфекцию или улучшают состояние или последствия HIV-инфекции человека посредством других механизмов.
7. Комбинация по п.1 или 2, где дополнительный терапевтический агент или терапевтические агенты выбирают из агентов, пригодных для лечения воспалительного заболевания.
Текст
007580 Настоящее изобретение относится к комбинациям, содержащим производные тропана, полезные для лечения различных нарушений, включая те нарушения, при которых вовлекается модуляция CCR5 рецепторов. В частности, настоящее изобретение относится к комбинации на основе производных 3-(3 изопропил-5-метил-4 Н-1,2,4-триазол-4-ил)-экзо-8-азабицикло-[3.2.1]октана и их применению. Нарушения, которые можно лечить или предупреждать с помощью настоящих производных, включают HIV и генетически связанные ретровирусные инфекции (и приводящие к синдрому приобретенного иммунного дефицита - СПИДу) и воспалительные заболевания. Соединения, содержащиеся в комбинации по настоящему изобретению, являются модуляторами, в особенности, антагонистами, активности хемокин-CCR5 рецепторов. Модуляторы CCR5 рецепторов могут быть полезны при лечении различных воспалительных заболеваний и состояний и лечении инфекции, вызванной HIV-1 и генетически связанными ретровирусами. Название "хемокин" является сокращенным от "хемотактический цитокинез". Хемокины включают большое семейство белков, имеющих важные общие структурные признаки и обладающих способностью притягивать лейкоциты. Как лейкоцитарные хемотактические факторы, хемокины играют незаменимую роль в увлечении лейкоцитов в различные ткани тела, процессе, существенном как для воспалительного заболевания, так и при реакции организма на инфекцию. Поскольку хемокины и соответствующие рецепторы составляют основу патофизиологии воспалительных и инфекционных заболеваний, агенты, модулирующие, предпочтительно,антагонизирующие, активность хемокинов и соответствующих рецепторов, являются полезными при терапевтическом лечении указанных воспалительных и инфекционных заболеваний. Хемокин-рецептор CCR5 является особенно важным при лечении воспалительных и инфекционных заболеваний. CCR5 является рецептором для хемокинов, в особенности, для воспалительных белков макрофага (MIP), обозначаемых МIР-1 и МIР-1, и для белка, регулируемого под влиянием активации и экспрессируемого и секретируемого нормальными Т-клетками. Проведено обстоятельное исследование различных классов модуляторов активности хемокинрецепторов, в особенности CCR5 хемокин-рецепторов, например, WO 98/25617 касается замещенных арилпиперазинов в качестве модуляторов активности хемокин-рецепторов. Рассматриваемые соединения в общих чертах описаны в WO 00/38680, но не одно из них не подтверждено конкретными иллюстративными примерами. Настоящее изобретение относится к комбинации, включающей соединение формулы (I) где R1 означает С 3-6-циклоалкил, необязательно замещенный одним или более атомами фтора, илиC1-6-алкил, необязательно замещенный одним или более атомами фтора, или С 3-6-циклоалкилметил, необязательно замещенный по кольцу одним или более атомами фтора, иR2 означает фенил, необязательно замещенный одним или более атомами фтора; или его фармацевтически приемлемую соль или сольват и один или более дополнительный терапевтический агент."C1-6-алкил" в определении R1 включает линейные или разветвленные группы. Примеры алкила включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил и трет-бутил. "С 3-6 циклоалкил" означает циклопропил, циклобутил, циклопентил и циклогексил. Соединения формулы (I) содержат основной центр, и соответствующие кислотные аддитивные соли получают с кислотами, образующими нетоксичные соли. Примеры включают следующие соли: гидрохлорид, гидробромид, гидроиодид, сульфат, бисульфат, нитрат, фосфат, кислый фосфат, ацетат, малеат,фумарат, лактат, тартрат, цитрат, глюконат, камзилат, сукцинат, сахарат, бензоат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат. См. обзор подходящих солей: Berge et al. J.Pharm. Sci., 66, 1-19, 1977. Фармацевтически приемлемые сольваты соединений формулы (I) и их соли включают в себя гидраты. Кроме того, в объем соединений формулы (I), входящих в комбинацию, включены их полиморфные модификации. Соединение формулы (I), входящее в состав комбинации, содержит один или более асимметричных атомов углерода и поэтому существует в двух или более стереоизомерных формах. Комбинация по настоящему изобретению включает индивидуальные стереоизомеры соединений формулы (I) и, где это возможно, отдельные таутомерные формы, а также их смеси. Разделение диастереоизомеров может быть достигнуто общепринятыми способами, например,фракционированной кристаллизацией, хроматографией или ВЭЖХ стереоизомерной смеси соединения формулы (I), либо соответствующей соли или производного. Отдельный энантиомер соединения форму-1 007580 лы (I) может также быть получен из соответствующего оптически чистого промежуточного соединения или путем разделения, таким способом, как ВЭЖХ, соответствующего рацемата с применением подходящего хирального носителя, или путем фракционированной кристаллизации диастереоизомерных солей, полученных взаимодействием соответствующего рацемата с подходящими оптически активными кислотой или основанием, по обстоятельствам. Комбинация по изобретению включает также меченые изотопами соединения формулы (I). Предпочтительно R1 означает либо С 4-6-циклоалкил, необязательно замещенный одним или двумя атомами фтора, либо C1-4-алкил, необязательно замещенный одним-тремя атомами фтора. Предпочтительно R1 означает либо циклобутил, циклопентил, 4,4-дифторциклогексил, либо 3,3,3 трифторпропил. Предпочтительно R2 означает фенил, необязательно замещенный 1 или 2 атомами фтора. Предпочтительно R2 означает фенил или монофторфенил. Предпочтительно R2 означает фенил или 3-фторфенил. Предпочтительные соединения формулы (I) включают N-(1S)-3-[3-(3-изопропил-5-метил-4 Н-1,2,4 триазол-4-ил)-экзо-8-азабицикло[3.2.1]окт-8-ил]-1-фенилпропилциклобутанкарбоксамид;N-(1S)-3-[3-(3-изопропил-5-метил-4 Н-1,2,4-триазол-4-ил)экзо-8-азабицикло[3.2.1]окт-8-ил]-1-(3 фторфенил)пропил-4,4-дифторциклогексанкарбоксамид: или фармацевтически приемлемую соль или сольват любого из них. Соединения формулы (I) могут быть получены следующими общими способами, где каждый из R1 2 и R принимают значения, указанные выше для соединения формулы (I), если не оговорено особо. 1. Соединение формулы (I) может быть получено взаимодействием соединения формулы: с соединением формулы: в обычных условиях сочетания. Взаимодействие предпочтительно проводят в присутствии подходящего сочетающего агента, например, N-бензил-N'-циклогексилкарбодиимида, который может быть полимерносвязанным, или гидроксибензотриазолгидрата и 1-(3-диметиламинопропил)-3-этилкарбодиимидметиодида, при температуре порядка комнатной, в растворителе, не оказывающем отрицательного влияния на реакцию, например,дихлорметане. Дополнительные подходящие условия сочетания описаны в способе 2 ниже. Соединения формулы (III) являются либо известными, либо полученными на основании общепринятых методик. Соединения формулы (II) могут быть получены, как показано ниже на схеме 1. 2. Соединения формулы (I) могут быть получены, как показано на схеме 1. Схема 1-2 007580 где Р означает подходящую защитную группу, такую, как трет-бутилоксикарбонил, бензил или бензилоксикарбонил, и соединения формулы (II) и (VII) находятся в экзоформе. Согласно типичной методике, когда Р означает трет-бутилоксикарбонил, амин формулы (IV) взаимодействует с ди-трет-бутилдикарбонатом в присутствии основного акцептора, такого как водный гидроксид натрия, и в подходящем растворителе, таком как тетрагидрофуран. Защищенный амин формулы (V) может быть восстановлен до альдегида формулы (VI) с применением подходящего восстанавливающего агента, например, диизобутилалюмогидридом в дихлорметане при температуре ниже -70 С. Реакция гидроаминирования альдегида формулы (VI) амином формулы (в экзоформе): приводит к соединению формулы (VII). Взаимодействие может быть осуществлено в присутствии избытка восстанавливающего агента, например, натрийтриацетоксиборогидрида или натрийцианоборогидрида, в системе протонного растворителя, например, в уксусной кислоте либо в дихлорметане, либо в 1,1,1-трихлорметане, при комнатной температуре. Снятие защиты соединения формулы (VII) может быть выполнено в обычных условиях. Когда Р означает трет-бутилоксикарбонил, снятие защиты может быть достигнуто применением трифторуксусной кислоты или водной соляной кислоты в растворителе, таком как дихлорметан или метанол, при комнатной температуре. Полученное соединение формулы (II) может быть превращено в соединение формулы (I) взаимодействием с соединением формулы: где Z означает активирующую карбоновую кислоту группу, такую как хлор или 1 Н-имидазол-1-ил,с использованием общепринятых условий, например, применением N,N'-карбонилдиимидазола, триэтиламина и дихлорметана. Предпочтительно соединение формулы (VIB) получают in situ из соединения формулы (III), используя карбодиимид, такой как 3-(3-диметиламино-1-пропил)-1-этилкарбодиимид или полимерносвязанныйN-бензил-N'-циклогексилкарбодиимид, необязательно, в присутствии 1-гидроксибензотриазолгидрата, и подвергают взаимодействию с соединением формулы (II). Взаимодействие может быть выполнено в подходящем растворителе, таком как дихлорметан, тетрагидрофуран или этилацетат, необязательно, в присутствии основания, такого как третичный амин, например, триэтиламин или N-этилдиизопропиламин, при температуре порядка комнатной. Альтернативно, кислота формулы (III) может быть сначала активирована бензотриазол-1-илокситрис(диметиламино) фосфонийгексафторфосфатом (ВОР), бромотриспирролидинофосфонийгексафторфосфатом (PYBrOP) или 2-фтор-1-метилпиридиний-п-толуолсульфонатом (реагентом Mukaiyama'a) в присутствии избытка N-метилморфолина, триэтиламина или N-этилдиизопропиламина в подходящем растворителе, таком как тетрагидрофуран, дихлорметан или этилацетат, при комнатной температуре,получая соединение формулы (VIB), и указанное соединение подвергают взаимодействию с соединением формулы (II). Альтернативно, хлорангидрид формулы (VIB), где Z означает хлор, может быть подвергнут взаимодействию с соединением формулы (II), необязательно, в присутствии подходящего основания, например, триэтиламина, N-этилдиизопропиламина, карбоната натрия, карбоната калия или бикарбоната натрия, и в подходящем растворителе, таком как дихлорметан, этилацетат, ТГФ или толуол, при комнатной температуре. Удобно, что превращение соединения формулы (VII) в соединение формулы (I) через соединение формулы (II) может быть выполнено ранее описанными аналогичными способами путем снятия защиты/сочетания. Соединение формулы (VIA) может быть получено, как показано на схеме 2. где Р 1 означает подходящую защитную группу, такую как трет-бутилоксикарбонил или бензил, и соединения формул (X), (XI) и (XII) находятся в экзоформе. Оксим формулы (IX) может быть получен конденсацией кетона (VIII) с гидроксиламингидрохлоридом в присутствии основания, например, пиридина, и в подходящем растворителе, обычно этаноле. Взаимодействие, как правило, осуществляют при температуре кипения растворителя. Когда Р 1 означает трет-бутилоксикарбонил или бензил, восстановление оксима формулы (IX) может быть достигнуто применением натрия в присутствии спирта, обычно пентанола, или путем электрохимического восстановления, что дает амин формулы (X). Амид формулы (XI) может быть получен сочетанием защищенного амина формулы (X) с 2 метилпропановой кислотой или ее активированным производным. Сочетание может быть выполнено по общепринятой методике образования амидной связи, такой как описана выше в способах 1 и 2. Обычно кислота может быть сначала активирована карбодиимидом, таким как 1-(3-диметиламинопропил)-3 этилкарбодиимид, необязательно в присутствии 1-гидроксибензотриазола, в подходящем растворителе,таком как дихлорметан, и в присутствии основания, например, третичного амина, такого как триэтиламин или диизопропиламин, и затем взаимодействием с амином формулы (X). Альтернативно, взаимодействие может быть выполнено, используя 2-метилпропаноилхлорид в присутствии основания, такого как карбонат натрия, и подходящего растворителя, например, дихлорметана. Триазол формулы (XII) может быть получен в "одном реакторе", двухстадийным способом, первоначальным сочетанием амида формулы (XI) с уксусным гидразидом и последующей циклоконденсациейin situ. Обычно амид сначала активируют оксихлоридом трехвалентного фосфора в растворителе, таком как хлороформ, и в присутствии основания, например, пиридина, при 0 С, затем обрабатывают уксусным гидразидом в подходящем растворителе, например, хлороформе, и реакционную смесь нагревают до температуры кипения с обратным холодильником. Реакцию завершают в присутствии кислоты, например, п-толуолсульфокислоты, и в подходящем растворителе, таком как толуол, при повышенной температуре (например, 110 С). Снятие защиты соединения формулы (XII) по стандартной методике дает амин формулы (VIA). Обычно, когда Р 1 означает бензил, снятие защиты осуществляют путем каталитического гидрирования,при котором используют гидроксид палладия (II) в качестве катализатора в подходящем растворителе,например, этаноле, в присутствии формиата аммония при 70 С. Альтернативно, снятие защиты может быть выполнено каталитическим гидрированием с применением палладия-на-угле в качестве катализатора в подходящем растворителе, таком как метанол, необязательно, в присутствии подходящей кислоты, такой как п-толуолсульфокислота. 3. Соединения формулы (I) могут быть получены, как показано на схеме 3. Схема 3-4 007580 Амид формулы (XIV) может быть получен обычными способами образования амидной связи, такими как первоначальная активация кислоты формулы (XIII) (где R3 означает Н) либо переводом в форму хлорангидрида, либо другими способами, описанными выше в способах 1 и 2, и последующим взаимодействием с амином формулы (VIA). Альтернативно, сложный эфир формулы (XIII) (где R3 означает C1 С 6-алкил) может быть подвергнут прямому взаимодействию с амином или его солью с металлом. Так,взаимодействие хлорангидрида и амина или его соли можно проводить в присутствии избытка подходящего основания, например, Na2CO3, NaHCO3, K2 СО 3, триэтиламина или N,N-диизопропилэтиламина, и в подходящем растворителе, например, дихлорметане, этилацетате, ТГФ или толуоле, в присутствии или в отсутствие воды как сорастворителя. Альтернативно, кислота может быть активирована 1-[3-(диметиламино)пропил]-3-этилкарбодиимидгидрохлоридом (WCDI), CDI (1,1'-карбонилдиимидазол)ом или DCC(1,3-дициклогексилкарбодиимид) и НОАТ (1-гидрокси-7-азабензотриазол)ом, или НОВТ (1-гидроксибензотриазолгидрат)ом, и подвергнута взаимодействию с амином в присутствии основания, например,триэтиламина, в растворителе, таком как ТГФ, дихлорметан или толуол. Также сложный эфир и амин или его соль с металлом могут взаимодействовать в присутствии основания, например, триэтиламина, и необязательного катализатора, в растворителе, таком как дихлорметан, этилацетат, ТГФ или толуол, в присутствии или отсутствии воды как сорастворителя. Альтернативно, можно проводить взаимодействие сложного эфира, амина и фермента-катализатора в растворителе, таком как дихлорметан, этилацетат,ТГФ или толуол, в присутствии или в отсутствие воды как сорастворителя. Предпочтительно, хлорангидрид, амин и Na2CO3 подвергают совместному взаимодействию в дихлорметане и воде, либо кислоту обрабатывают N,N'-карбонилдиимидазолом, получая имидазолид, и затем осуществляют взаимодействие с амином в дихлорметане в присутствии триэтиламина. Амид формулы (XIV) может быть восстановлен с применением такого реагента, как нуклеофильный гидрид или электрофильный гидрид, либо путем каталитического гидрирования, либо использованием алкил- или арилсилана с подходящим катализатором, содержащим переходный металл, образуя соединение формулы (I). Характерные условия включают применение Red-Al (натрийбис(2-метоксиэтокси)алюмогидрида) в ТГФ или толуоле, или борана в ТГФ. 4. Соединения формулы (I) могут быть получены, как показано на схеме 4. Схема 4 где Y означает -CO2R4, -CN или -C(O)NHR4, где R4 означает Н или C1-С 6-алкил. Взаимодействие с получением альдегида формулы (XVI) может быть осуществлено восстановлением сложного эфира, нитрила, амида или кислоты (например, активированной подходящим реагентом) формулы (XV), с помощью такого восстанавливающего агента, как гидрид, в подходящем растворителе. Альтернативно, восстановление сложного эфира, нитрила или кислоты (активированной подходящим реагентом) формулы(XV) может быть достигнуто с помощью подходящего катализатора из переходного металла, источника водорода и в подходящем растворителе. Типичные условия включают восстановление сложного эфира,нитрила или амида алюмо- или боргидридом, таким как DIBAL (диизобутилалюмогидрид), Red-Al,LiAl(О(t-Bu3 или (Ме 2 СНСН(Me2 ВН, в растворителе, таком, как ТГФ, дихлорметан или толуол; или восстановление хлорангидрида катализатором, содержащим переходный металл, таким как Pd/C илиPd/BaSO4, в атмосфере водорода и с модификатором, таким как 2,4-диметилпиридин, и в растворителе,таком как ТГФ или толуол. Предпочтительные условия включают восстановление сложного эфира с DIBAL в дихлорметане или толуоле. Соединение формулы (I) может быть получено гидроаминированием с использованием альдегида формулы (XVI) и амина формулы (VIA) либо его соли. Характерное взаимодействие может быть осуществлено взаимодействием альдегида с 0,8-1,5 мол.экв. амина или его соли, необязательно, в присутствии 0,1-3 мол.экв. протонной кислоты, либо с восстанавливающим агентом, таким как натрийтриацетоксиборогидрид или натрийцианоборогидрид, либо использованием каталитических количеств катализатора,включающих переходный металл, такой как палладий, платина или родий, и источника водорода, такого как молекулярный водород или формиат аммония, в подходящем растворителе, таком как дихлорметан,ацетонитрил, толуол, этанол или 2-пропанол. Предпочтительно взаимодействие альдегида с тозилатной солью амина осуществляют в присутствии натрийтриацетоксиборогидрида и следов уксусной кислоты в дихлорметане при температуре окружающей среды. Альдегид формулы (XVI) может быть также получен из спирта формулы: Стандартными способами окисления, например, использованием окисляющего агента, такого как ДМСО/комплекс триоксид серы-пиридин, ДМСО с (СОСl)2, МnО 2 или СrО 3, в присутствии или отсутствии основания, такого как дихлорметан, толуол, ацетон или ацетонитрил; использованием катализатора,включающего переходный металл, такой, как Rh или Ru, в присутствии или в отсутствие основания и гидридного акцептора, такого, как кетон, в подходящем растворителе, таком, как дихлорметан, ацетон,толуол или ацетонитрил; или использованием каталитического оксиданта, такого, как ТРАР (тетрапропиламмонийперрутенат) или TEMPO (2,2,6,6-тетраметил-1-пиперидинилокси, свободный радикал), в присутствии или в отсутствие твердой подложки, со стехиометрическим количеством оксиданта для повторного окисления в качестве катализатора, такого, как NMO (4-метилморфолин-N-оксид), кислород или гипохлорит, или гипобромит натрия, и в подходящем растворителе, таком как дихлорметан, ацетон,толуол или ацетонитрил. Предпочтительные условия включают использование ДМСО, комплекса триоксид серы-пиридин и триэтиламина в дихлорметане, или TEMPO, KBr, NaOCl, воды и дихлорметана. 5. Соединения формулы (I) могут быть получены гидроаминированием соединения формулы (XV),где Y означает -CN, и амина формулы (VIA) или его соли. Восстановление может быть выполнено с использованием катализатора переходного металла, необязательно в присутствии кислоты, и источника водорода, в подходящем растворителе. Согласно обычной методике, используют палладий-на-угле или оксид платины (IV) и растворитель, такой как метанол, уксусная кислота или 2-пропанол. 6. Соединения формулы (I) могут быть получены алкилированием амина формулы (VIA) или его соли (кислотная аддитивная соль или соль металла) с применением соединения формулы: где Z1 означает уходящую группу, такую как галоген, С 1-С 4-алкансульфонилокси, бензолсульфонилокси или п-толуолсульфонилокси, необязательно, в присутствии основания и/или межфазного катализатора. Взаимодействие обычно осуществляют в присутствии основания, такого как триэтиламин или N,Nдиизопропилэтиламин; DBU - ДБУ(1,8-диазабицикло[5,4,0]ундец-7-ен; или неорганического основания,такого, как Nа 2 СО 3, NаНСО 3, K2 СО 3 или Cs2CO3: необязательно в присутствии межфазного катализатора,и в растворителе, таком как ацетонитрил, ДМФ (диметилформамид), ДМСО (диметилсульфоксид), 1,4 диоксан, ТГФ или толуол. Альтернативно, можно осуществлять взаимодействие соли металла и амина(т.е. депротонизированной формы) с соединением формулы (XVII) в подходящем растворителе, таком как ТГФ, ДМФ или 1,4-диоксан. Предпочтительно реакцию осуществляют путем взаимодействия амина и соединения формулы (XVII) либо с ДБУ в ацетонитриле, либо с K2CO3 и 18-кроун-6-(1,4,7,10,13,16 гексаоксациклооктадекан)ом в ТГФ. 7. Соединения формулы (I) могут быть получены, как показано на схеме 5. Схема 5 Соединение формулы (XVIII) может быть получено по реакции Манниха из соединения формулы: с соединением формулы (VIA), или его солью, формальдегидом или его эквивалентом, в присутствии или в отсутствие кислоты, в подходящем растворителе. Типичные условия включают взаимодействие амина и кетона с кислотой, такой как соляная кислота, серная кислота, п-толуолсульфокислота или-6 007580 уксусная кислота, и параформальдегидом в подходящем растворителе, таком как этанол, метанол, 2 пропанол или ДМФ: или взаимодействием соли амина (такой соли как гидрохлорид, сульфат или тозилат) с кетоном и параформальдегидом в подходящем растворителе, таком как этанол, метанол, 2 пропанол или ДМФ. Альтернативно, соединение формулы (XVIII) может быть получено взаимодействием соединения формулы (VIA), или его соли, с соединением формулы: где Z2 означает уходящую группу, такую как указана выше для Z1, в стандартных условиях алкилирования, таких как описаны выше для способа 6. Енамид формулы (XIX) может быть получен взаимодействием соединения формулы (XVIII) с амидом формулы: в условиях дегидратации, в присутствии или в отсутствие кислотного катализатора и в подходящем растворителе; или взаимодействием соединения формулы (XVIII) сначала с гидроксиламином, или его солью, и затем взаимодействием промежуточного продукта с ангидридом карбоновой кислоты формулы: катализатором переходного металла и кислотой в подходящем растворителе; либо взаимодействием соединения формулы (XVIII) сначала с аммиаком, или его солью, а затем взаимодействием промежуточного продукта с кислотой формулы (III), или ее активированным производным в стандартных условиях. Обычно осуществляют взаимодействие соединения формулы (XVIII) с амидом формулы (XXII) в присутствии каталитического количества кислоты при азеотропном удалении воды или удалении остаточной воды с применением дегидратирующего агента, такого как молекулярные сита. Соединение формулы (I) может быть получено путем асимметричного восстановления енамида формулы (XIX), осуществляемого при использовании 0,001-0,1 мол.экв. переходного металла, такого как[2,2,1]гептан), донора водорода, такого как молекулярный водород, фенилсилан, 2-пропанол или формиат аммония, и подходящего растворителя, такого как метанол, этанол, ацетонитрил, толуол, этилацетат,2-пропанол или ТГФ, при температуре от 0 С до температуры кипения с обратным холодильником и,необязательно, при повышенном давлении. 8. Соединение формулы (I) может быть получено, как показано на схеме 6. Схема 6 Кетон формулы (XVIII) может быть превращен в рацемический амин формулы (IIА) гидроаминированием в стандартных условиях, используя аммоний, или его эквивалент, и восстанавливающий агент в подходящем растворителе. Рацемический амин формулы (IIА) может быть разделен для получения амина формулы (II) стандартными способами, такими как классический, кинетический и динамический способы. Амин формулы (II) может быть превращен в соединение формулы (I) способами, описанными в способах 1 и 2. Альтернативно, рацемический амин формулы (IIA) может быть превращен в соединение формулы(I) использованием соединения формулы (III), или его подходящего активированного производного, хирального катализатора, необязательно, использованием катализатора для рацемизации присутствующего нежелательного изомера и подходящего растворителя. Амин формулы (II), или его соль с металлом (т.е. депротонированная форма), может также быть превращен в соединение формулы (I) взаимодействием со сложным эфиром формулы: где R5 означает образующую сложный эфир группу, такую как C1-С 6-алкил. Обычно реакцию осуществляют путем взаимодействия сложного эфира и амина, или его соли с металлом, с избытком основания, такого как триэтиламин, и необязательным катализатором в растворителе, таком как дихлорметан,этилацетат, ТГФ или толуол, в присутствии или в отсутствие воды в качестве сорастворителя: или взаимодействием сложного эфира и амина в присутствии фермента-катализатора в растворителе, таком как дихлорметан, этилацетат, ТГФ или толуол, в присутствии или в отсутствие воды в качестве сорастворителя. Все вышеуказанные взаимодействия и способы получения новых исходных материалов с использованием приведенных выше способов являются общепринятыми, и соответствующие реагенты и реакционные условия их выполнения или получения, равно как способы выделения целевых продуктов, хорошо известны квалифицированному специалисту в данной области, это касается материалов, приведенных в литературе, а также в примерах и препаративных примерах данного описания. Фармацевтически приемлемая соль соединения формулы (I) легко может быть получена смешиванием растворов соединения формулы (I) и требуемой кислоты. Соль может быть осаждена из раствора и собрана фильтрованием, или выделена упариванием растворителя. Комбинация на основе соединений формулы (I) и их фармацевтически приемлемых солей полезны,поскольку они обладают фармакологической активностью в отношении животных, включая людей. В частности, они полезны при лечении нарушения, при котором вовлекается модуляция CCR5 рецепторов. Заболевания, которые могут быть упомянуты, включают HIV, ретровирусную инфекцию, генетически связанную с HIV, СПИД или воспалительное заболевание. Комбинации по настоящему изобретению могут быть использованы для лечения респираторных нарушений, включающих респираторный дистресс-синдром у взрослых, бронхит, хронический бронхит,хроническое обструктивное заболевание легких, муковисцидоз, астму, эмфизему, ринит и хронический синусит. Другими состояниями, которые можно лечить, являются те, которые вызываются, затрагиваются или каким-либо другим образом регулируются перемещением Т-лимфоцитов в различные органы. Ожидается, что комбинации по изобретению могут быть полезны для лечения указанных состояний и, в частности, но не в порядке ограничения, следующих состояний, для которых установлена взаимосвязь сCCR5 или CCR5 хемокинами: воспалительного заболевания кишечника, включающего болезнь Крона и неспецифический язвенный колит, множественного склероза, ревматоидного артрита, отторжения трансплантата, в частности, но не как ограничение, аллотрансплантатов почек и легких, эндометриоза, диабета типа I, заболевания почек, хронического панкреатита, воспалительных состояний легких или хронической сердечной недостаточности. Последний обзор возможных применений блокаторов хемокинов и рецепторов хемокинов см. Cascieri, М.А., and Springer, M.S., "The chemokine/chemokine receptor family:potential and progress for therapeutic intervention", Curr. Opin. Chem. Biol., 4(4), 420-7 (August 2000). Применимость комбинаций на основе соединений формулы (I) и их фармацевтически приемлемых солей в качестве ингибиторов HIV инфекции может быть продемонстрирована любой одной или большим числом приемов, известных в данной области, таких как применение анализа на HIV микрокультуру, описанного в Dimitrov et al., J. Clin. Microbiol., 28, 734-737 (1990) и методики из отчета по испытанию на псевдотипичный HIV, описанной в Connor et al., Virology, 206 (2) 935-44 (1995). Способность комбинаций модулировать активность хемокин-рецепторов демонстрируется известным в данной области методологическим подходом, таким, как испытание на CCR5 связывание согласно методикам, описанным в Combadiere et al., J. Leukoc. Biol., 60, 147-52 (1996); и/или испытания в отношении мобилизации внутриклеточного кальция, описанных теми же авторами. Клеточные линии, экспрессирующие рассматриваемый рецептор, включают клетки, природно экспрессирующие рецептор, такие как РМ-1 или IL-2 стимулированные периферические лимфоциты крови (PBL), или созданные с помощью биоинженерии клетки для экспрессии рекомбинантного рецептора, такие как СНО, 300.19, L1.2 или НЕK-293. Комбинации, включающие соединения формулы (I) могут быть введены перорально, трансбуккально или подъязычно в форме таблеток, капсул, мультичастиц, гелей, пленок, овулей, эликсиров, растворов или суспензий, которые могут содержать корригенты или красители, для употребления посредством немедленного, задержанного, умеренного, замедленного, прерывистого или регулируемого высвобождения. Комбинации могут также быть введены в виде быстродиспергируемых или быстрорастворимых ле-8 007580 карственных форм, или в форме высококонцентрированной дисперсии, либо в виде покрытых оболочкой частиц. Подходящие составы соединений формулы (I) могут быть в оболочке, либо без оболочки, по желанию. Указанные твердые фармацевтические комбинации, например, таблетки, могут содержать наполнители, такие как микрокристаллическая целлюлоза, лактоза, цитрат натрия, карбонат кальция, вторичный кислый фосфат кальция, глицин и крахмал (предпочтительно, кукурузный, картофельный крахмал или тапиока), дезинтеграторы, такие как гликолят крахмала натрия, натрийкросскармелоза и некоторые комплексные силикаты, и гранулирующие связующие вещества, такие как поливинилпирролидон, гидроксипропилметилцеллюлоза (НРМС - ГПМЦ), гидроксипропилцеллюлоза (НРС - ГПЦ), сахароза, желатин и сок акации. Кроме того, могут быть включены смазывающие агенты, такие как стеарат магния, стеариновая кислота, глицерилбегенат и тальк. Общий пример Состав таблетки обычно может включать от 0,01 до 500 мг активного соединения, тогда как масса таблетки с наполнителем может быть в пределах от 50 до 1000 мг. Ниже иллюстрируется пример состава таблетки массой 10 мг: Количество, устанавливаемое в соответствии с активностью лекарственного средства. Таблетки изготавливают стандартным способом, например, прямым прессованием или способом мокрой или сухой грануляции. На сердцевины таблеток могут быть нанесены покрытия. Твердые комбинации подобного типа могут также использоваться как наполнители для желатиновых и ГПМЦ капсул. Предпочтительные в этом отношении наполнители включают лактозу, крахмал,целлюлозу, молочный сахар или высокомолекулярные полиэтиленгликоли. Для водных суспензий и/или эликсиров соединения формулы (I) могут быть объединены с различными подсластителями или корригентами, красящими веществами или красителями, с эмульгирующими и/или суспендирующими агентами и с разбавителями, такими как вода, этанол, пропиленгликоль и глицерин, и их комбинации. Соединения формулы (I) могут также быть введены парентерально, например, внутривенно, внутриартериально, внутрибрюшинно, подоболочечно, интравентрикулярно, интрауретрально, интрастернально, интракраниально, внутримышечно и подкожно, или они могут быть введены путем инфузии или безыгольной инъекции. Для такого парентерального введения указанные соединения лучше всего использовать в форме стерильного водного раствора, который может содержать другие вещества, например, соли или глюкозу в количестве, достаточном чтобы сделать раствор изотоническим в отношении крови. При необходимости в водные растворы следует добавлять соответствующий буферный раствор(предпочтительно до рН от 3 до 9). Получение соответствующих парентеральных составов в стерильных условиях легко осуществимо стандартными фармацевтическими методиками, хорошо известными специалисту в данной области. Для перорального и парентерального введения больным людям уровни суточных доз соединений формулы (I) и их фармацевтически приемлемых солей составляют от 0,01 до 30 мг/кг (в виде разовой или разделенной общей дозы), и, предпочтительно, находятся в пределах от 0,01 до 15 мг/кг. Так, таблетки содержат от 1 мг до 0,5 г соединения для разового приема, либо приема за два или более раз, по обстоятельствам. В любом случае врач определяет фактическую дозу, которая будет наиболее подходящей для каждого отдельного пациента, и эта доза меняется в зависимости от возраста,массы и реакции конкретного пациента. Вышеуказанные дозировки являются иллюстративными примерами усредненного случая. Конечно же, возможны частные случаи, при которых устанавливаются большие или меньшие пределы доз, и указанные случаи входят в объем изобретения и приложенных пунктов. Пероральное введение предпочтительно. Преимущественно прием осуществляют незадолго до ожидаемого момента возникновения потребности в лекарственном воздействии. Комбинации по настоящему изобретению могут также быть введены через нос или путем ингаляции и удобны для выпуска в форме ингалятора с сухим порошком или аэрозольного спрея, подаваемого из контейнера под давлением, контейнера с накачкой, пульверизатора, аэроионизатора или распылителя с либо без подходящего пропеллента, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, гидрофторалкана, такого как 1,1,1,2-тетрафторэтан (HFA 134A [торговая марка]) или 1,1,1,2,3,3,3-гептафторпропан (HFA 227EA [торговая марка]), двуокиси углерода или другого подходящего газа. В случае аэрозоля под давлением унифицированная доза может быть определена благодаря наличию клапана для доставки отмеренного количества. Контейнер под давлением, контейнер с накач-9 007580 кой, пульверизатор, аэроионизатор или распылитель могут содержать раствор или суспензию активного соединения, например, с применением смеси этанола и пропеллента в качестве растворителя, который может дополнительно содержать смазывающее вещество, например, сорбитантриолеат. Капсулы или картриджи (изготовленные, например, из желатина) для применения, например, в ингаляторе или инсуффляторе, могут быть формулированы так, что содержат порошковую смесь соединения формулы (I) и подходящую порошковую основу, такую как лактоза или крахмал. Аэрозольные или сухие порошковые составы предпочтительно компонованы так, что каждая отмеряемая доза или "пуф" (выброс при однократном нажатии) содержат от 1 мкг до 10 мг соединения формулы (I), доставляемого пациенту. Общая суточная доза с аэрозолем должна быть в пределах от 1 мкг до 20 мг, которые могут быть введены в виде разовой дозы или, обычно, в виде разделенных доз в течение дня. Альтернативно, комбинации на основе соединения формулы (I) могут быть введены в форме суппозитория или пессария, или они могут применяться местно (наружно) в форме геля, гидрогеля, лосьона,крема, мази или присыпки. Соединения формулы (I) могут также быть введены дермально или трансдермально, например, путем применения пластыря на кожу. Указанные комбинации могут быть также введены легочным или ректальным путем. Указанные комбинации могут также быть введены окулярным способом, в особенности для лечения воспалений или заболеваний глаз. Для глазного применения они могут быть формулированы в виде микронизированных суспензий в изотоническом, с доведенным до требуемой величины рН, стерильном растворе соли, или, предпочтительно, в виде растворов в изотоническом, с доведенным до требуемой величины рН, стерильном растворе соли, необязательно, с консервантом, таким как бензилалконийхлорид. Альтернативно, комбинации могут также быть формулированы в мазь, такую как вазелин. Для наружного применения на коже комбинации могут быть формулированы в виде подходящей мази, содержащей активное соединение, суспендированное или растворенное, например, в смеси с одним или более веществ, выбранных из группы, включающей следующее: минеральное масло, вазелиновое масло, белый вазелин, пропиленгликоль, смесь полиоксиэтиленполиоксипропилен, эмульгирующий воск и вода. Альтернативно, они могут быть формулированы в виде подходящего лосьона или крема, суспендированного или растворенного, например, в смеси с одним или более веществ, выбранных из группы,включающей следующее: минеральное масло, сорбитанмоностеарат, полиэтиленгликоль, вазелиновое масло, полисорбат 60, парафин из сложных эфиров цетилового спирта, цетеариловый спирт, 2 октилдодеканол, бензиловый спирт и вода. Соединения формулы (I), входящие в комбинацию изобретения, могут также применяться в сочетании с циклодекстрином. Известно, что циклодекстрины образуют комплексы включения или невключения с молекулами лекарственного средства. Образование комплекса лекарство-циклодекстрин может изменять растворимость, скорость растворения, биологическую доступность и/или характеристику стабильности молекулы лекарства. Комплексы лекарство-циклодекстрин обычно полезны для большинства лекарственных форм и способов ведения. В качестве альтернативы непосредственному образованию комплекса с лекарством циклодекстрин может быть использован как вспомогательная добавка, например, в качестве носителя, разбавителя или растворителя. Большей частью используются альфа-, бета- и гамма-циклодекстрины, и подходящие примеры описаны в WO-A-91/11172, WO-A-94/02518 и WO-A98/55148. Комбинации, включающие соединения формулы (I) и их фармацевтически приемлемые соли и один или более дополнительный терапевтический агент обладают тем преимуществом, что они являются более селективными, более быстро начинают действовать и являются более эффективными, более стабильными и более устойчивыми к метаболизму, либо обладают другими более желательными свойствами по сравнению с известным уровнем техники. Комбинации в соответствии с настоящим изобретением включают в качестве дополнительных терапевтических средств и активных ингредиентов один или более компонент, выбранный из ингибиторов пролиферации, иммуномодуляторов, ингибиторов слияния, других агонистов/антагонистов рецепторов хемокина, модуляторов рецептора тахикинина, ингибиторов интегразы, ингибиторов RhaseH, ингибиторов вирусной транскриптазы, RNA репликации и других агентов, которые ингибируют вирусную инфекцию или улучшают состояние или последствия HIV-инфекции человека посредством других механизмов. Такие схемы применения множества лекарственных средств, часто называемые комбинированной терапией, могут быть использованы при лечении и профилактике любого заболевания или состояния из числа опосредованных или связанных с модуляцией CCR5 хемокин-рецептора, в частности инфекции,вызванной вирусом иммунного дефицита человека, HIV. Применение указанных комбинаций терапевтических средств в особенности используется при лечении или предупреждении инфекции и многочисленных вирусов иммунного дефицита человека, HIV, и родственных патогенных ретровирусов у нуждающегося в лечении пациента или пациента групп риска. Из литературы общеизвестна способность таких ретровирусных патогенных микроорганизмов превращаться за сравнительно короткий период времени в штаммы, устойчивые к любой монотерапии, которая была назначена указанному пациенту. Кроме требования терапевтической эффективности лекарственного средства, которое может сде- 10007580 лать необходимым применение активных агентов в дополнение к модулирующим CCR5 хемокинрецептор соединениям формулы (I) и их фармацевтически приемлемым солям, может быть дополнительная необходимость применения комбинации лекарственных средств, включающих активные ингредиенты, представляющие вспомогательную терапию, т.е. завершающие и дополняющие функцию, выполняемую модулирующими CCR5 хемокин-рецептор соединениями, входящими в состав комбинации по настоящему изобретению. Указанные вспомогательные терапевтические агенты, используемые для дополнительного лечения, включают лекарства, которые вместо непосредственного лечения или предупреждения заболевания или состояния, опосредованного или связанного с модуляцией CCR5 хемокинрецептора, лечат болезни или состояния, прямо вызываемые или косвенно сопровождающие основное заболевание, или скрытые заболевания или состояния, связанные с модуляцией CCR5 хемокинрецептора. Например, когда основным заболеванием или состоянием, связанным с модуляцией CCR5 хемокин-рецептора, является HIV инфекция и ее распространение, может быть необходимо, или, по меньшей мере, желательно лечить условно-патогенные инфекции, опухоли и другие состояния, возникающие как результат иммунно-компромиссного состояния проходящего лечение пациента. Другие активные агенты могут быть использованы с соединениями формулы (I) и их фармацевтически приемлемыми солями, например, с целью обеспечения иммунной стимуляции или снятия боли и воспаления, которые сопровождают исходную и основную HIV инфекцию. Предпочтительные комбинации по настоящему изобретению включают одновременное или последовательное лечение соединением формулы (I) или его фармацевтически приемлемой солью и одним или более ингибиторами HIV протеазы и/или ингибиторов HIV обратной транскриптазы, предпочтительно выбранными из класса ингибиторов ненуклеозидной обратной транскриптазы (NNRTI), включающих, но не ограничивающих, невирапин, делавирдин и эфавиренз, из числа нуклеозидных/нуклеотидных ингибиторов, включающих, но не ограничивающих, зидовудин, диданозин, зальцитабин, ставудин, ламивудин,абакавир, адефовир и дипивоксил; и из числа ингибиторов протеазы, включающих, но не ограничивающих, индинавир, ритонавир, сахинавир, нелфинавир, лопинавир и ампренавир. Другие агенты, полезные для вышеуказанных предпочтительных вариантов осуществления комбинаций по настоящему изобретению включают современные и находящиеся в разработке лекарственные средства любого из указанных выше классов ингибиторов, включающих, но не ограничивающих, FTC, РMРА, фозивудинтидоксил, талвиралин, S-1153, МkС-442, MSC-204, MSH-372, DMMP450, PNU-140690, АВТ-378 и KNI-7 64. Также в объем предпочтительных вариантов выполнения настоящего изобретения входят комбинации соединения формулы (I) или его фармацевтически приемлемой соли и вспомогательного терапевтического средства, применяемого в целях дополнительного лечения, где указанное вспомогательное терапевтическое средство включает один или более препаратов, независимо выбранных из группы, включающей ингибиторы пролиферации, например, гидроксимочевину; иммунномодуляторы, например, сарграмостим и различные формы интерферона или производных интерферона; ингибиторы слияния, например, AMD3100,Т-20, PRO-542, AD-349, ВВ-10010 и другие агонисты/антагонисты хемокин-рецептора; модуляторы рецептора тахикинина, например, NK1 антагонисты; ингибиторы интегразы, например, AR177; RNaseH ингибиторы; ингибиторы вирусной транскрипции и RNA(PHK) репликации и другие агенты, ингибирующие вирусную инфекцию или улучшающие состояние или исход болезни HIV-инфицированных индивидуумов по различным механизмам. Предпочтительным применением комбинаций изобретения является их применение для предупреждения HIV-инфекции или лечения авиремных и асимптоматических субъектов, потенциально или фактически инфицированных HIV, включают, но не в порядке ограничения, введение компонентов по одному из пунктов, независимо выбранных из группы, включающей: (i) соединение в объеме формулы (I), как указано здесь; (ii) один NNRTI в дополнение к соединению по (i); (iii) два NRTI в дополнение к соединению по (i); (iv) один NRTI в дополнение к комбинации по (ii) и (v) соединение, выбранное из класса ингибиторов протеазы, используемое вместо NRTI в комбинациях (iii) и (iv). Комбинации по настоящему изобретению пригодны для терапии HIV-инфицированных индивидуумов с выявляемыми виремией или аномально низкими количествами CD4 дополнительно включают способы, выбранные из группы, включающей: (vi) лечение по вышеуказанному (i) в дополнение к стандартным рекомендованным исходным схемам терапевтического лечения выявленных HIV-инфекций,например, см. http://hivatis.org/trtgdlns.html. Указанные стандартные схемы лечения включают, но не в порядке ограничения, агент из класса ингибиторов протеазы в комбинации с двумя NRTIами; и (vii) стандартные рекомендованные исходные схемы терапевтического лечения выявленных HIV-инфекций,например, см. http://hivatis.org/trtgdlns.html, где либо компонент ингибитора протеазы, либо один или обаNRTIa заменены соединением в объеме формулы (I), как указано здесь. Для HIV-инфицированных индивидуумов, для которых антивирусная терапия оказалась неудачной,согласно настоящему изобретению, дополнительно включается способ, выбираемый из группы, включающей: (viii) лечение по вышеуказанному (i) в дополнение к стандартным рекомендованным схемам терапевтического лечения указанных пациентов, например, см. http://hivatis.org/trtgdlns.html; и (ix) стандартные рекомендованные исходные схемы терапевтического лечения пациентов, для которых антивирусная терапия оказалась неудачной, например, см. http://hivatis.org/trtgdlns.html, где либо один из ком- 11007580 понентов ингибитора протеазы, либо один или оба NRTIa заменены соединением в объеме формулы (I),как указано здесь. В вышеуказанных предпочтительных вариантах осуществления комбинаций по настоящему изобретению соединение формулы (I) и другие терапевтически активные агенты могут быть введены, в виде лекарственных форм, либо раздельно, либо совместно, и, либо серийно, либо одновременно. То есть,введение одного составляющего агента можно осуществлять перед, одновременно или после введения другого составляющего агента (агентов). Подразумевается, что все ссылки здесь на лечение включают лечебное, временно облегчающее и профилактическое лечение. Таким образом, настоящее изобретение включает: комбинацию, включающую соединение формулы (I) или его фармацевтически приемлемая соль,или сольват и один или более дополнительный терапевтический агент; комбинация для лечения нарушения, при котором вовлекается модуляция CCR5 рецепторов; комбинация для лечения HIV, генетически связанной с HIV ретровирусной инфекции, СПИДа или воспалительного заболевания; комбинация для лечения респираторного нарушения, включающего респираторный дистресссиндром у взрослых (ARDS), бронхит, хронический бронхит, хроническое обструктивное заболевание легких, муковисцидоз, астму, эмфизему, ринит и хронический синусит; комбинация для лечения воспалительного заболевания кишечника, включая болезнь Крона или неспецифический язвенный колит, множественного склероза, ревматоидного артрита, отторжения трансплантата, включая аллотрансплантат почек и легких, эндометриоза, диабета типа I, заболевания почек,хронического панкреатита, воспаления состояния легких или хронической сердечной недостаточности. Изобретение иллюстрируется нижеследующими примерами, в которых используются следующие обозначения: 0,88 аммиак = концентрированный раствор гидроокиси аммония, 0,88 SG ч = час мин = минута МС = масс-спектр ЯМР = ядерный магнитный резонанс Полимерно связанный N-бензил-N'-циклогексилкарбодиимид (1,15 г, 0,88 ммоль) добавляют к раствору указанного в заглавии соединения по препаративному примеру 11 (250 мг, 0,68 ммоль) и циклобутанкарбоновой кислоты (130 мкл, 1,37 ммоль) в дихлорметане (10 мл), и смесь перемешивают при комнатной температуре в течение 16 ч. Смесь фильтруют через Celite (ускоритель фильтрования) и упаривают при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем при градиенте элюирования дихлорметан:метанол:0,88 аммиак (1:0:0 - 95:5:0,5, по объему), что дает указанное в заглавии соединение в виде белой пены, 200 мг. Найдено С 69,98; Н 8,67; N 14,89%.- 12007580 Циклопентанкарбоновую кислоту (115 мкл, 1,06 ммоль) добавляют к раствору указанного в заглавии соединения по препаративному примеру 11 (300 мг, 0,82 ммоль), гидроксибензотриазолгидрата (10 мг, 74 мкмоль) и 1-(3-диметиламинопропил)-3-этилкарбодиимидметиодида (300 мг, 1,07 ммоль) в дихлорметане (10 мл) и смесь перемешивают при комнатной температуре в течение 3 ч. К смеси добавляют насыщенный водный раствор карбоната натрия (50 мл) и продукт экстрагируют дихлорметаном (2 х). Объединенные органические слои промывают насыщенным раствором соли, сушат (MgSO4), фильтруют и упаривают при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем при градиенте элюирования дихлорметан:метанол:0,88 аммиак (1:0:0 - 96:4:0,4, по объему), что дает указанное в заглавии соединение в виде белой пены, 330 мг. Найдено С 69,73; Н 9,00; N 14,09%. C28H41N5O; 0,25 СН 2 Сl2; рассчитано С 69,98; Н 8,63; N 14,44% 1 Полимерно связанный N-бензил-N'-циклогексилкарбодиимид (370 мг, 0,336 ммоль) добавляют к раствору указанного в заглавии соединения по препаративному примеру 11 (100 мг, 0,27 ммоль) и 4,4,4 трифторбутанкарбоновой кислоты (45 мг, 0,32 ммоль) в дихлорметане (4 мл), и смесь перемешивают при комнатной температуре в течение 1,5 ч. Смесь фильтруют через Celite и упаривают при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем при градиенте элюирования дихлорметан:метанол:0,88 аммиак (1:0:0 - 95:5:0,5, по объему), что дает указанное в заглавии соединение в виде белой пены, 75 мг. Найдено С, 61,55; Н, 7,46; N, 13,62%. Полимерно связанный N-бензил-NN'-циклогексилкарбодиимид (500 мг, 0,545 ммоль) добавляют к раствору указанного в заглавии соединения по препаративному примеру 11 (100 мг, 0,27 ммоль) и 4,4 дифторциклогексанкарбоновой кислоты (50 мг, 0,30 ммоль) в дихлорметане (4 мл), и смесь перемешивают при комнатной температуре в течение 1,5 ч. Смесь фильтруют через Celite и упаривают при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем при градиенте элюирования дихлорметан:метанол:0,88 аммиак (1:0:0 - 95:5:0,5, по объему), что дает указанное в заглавии соединение в виде белой пены, 67 мг. Найдено С, 64,68; Н, 7,88; N, 12,65%.PXRD - ПДРЛ анализ показывает, что продукт является смесью полиморфных форм, обозначенных"форма А" и "форма В". Отдельные кристаллы чистых формы А и формы В могут быть идентифицированы и выделены из смеси. ПДРЛ данные для формы А и формы В приведены в приложении 1. Указанное в заглавии соединение получают из соединения, указанного в заглавии препаративного примера 13 (200 мг, 0,52 ммоль) и 4,4-дифторциклогексанкарбоновой кислоты (128 мг, 0,79 ммоль), используя методику, описанную в примере 4, 160 мг. Найдено С 64,25; Н 7,67; N 12,53%. Соединение, указанное в заглавии препаративного примера 20 (176 г, 0,48 моль) растворяют в дихлорметане (1,76 л). Добавляют раствор насыщенного водного карбоната натрия (1,76 л) и воды (1,76 л). Наблюдается экзотермическая реакция, и смесь охлаждают до 15 С. К реакционной смеси добавляют раствор соединения, указанного в заглавии препаративного примера 14 (131,6 г, 0,72 моль) в толуоле(500 мл, наблюдается экзотермическая реакция. Полученную смесь перемешивают 12 ч при комнатной температуре. ВЭЖХ анализ реакционной смеси показывает, что взаимодействие завершено. Добавляют воду (1 л) и дихлорметан (1 л), что способствует разделению фаз. Фазы разделяют, рН водной фазы имеет значение рН=11. Водную фазу промывают дихлорметаном (1,76 л). Объединенные органические фазы промывают 0,5 М водным гидроксидом натрия (1,76 л) и затем водой (1,76 л). Органическую фазу концентрируют и добавляют этилацетат (700 мл). Смесь оставляют гранулироваться при температуре окружающей среды в течение ночи. Белое твердое вещество фильтруют и продукт промывают этилацетатом(60 мл) и сушат в вакуумном сушильном шкафу в течение 12 ч при 40 С, что дает указанное в заглавии соединение в виде белого твердого вещества 146 г (59%). 1 Н-ЯМР идентичен спектру соединения, указанного в заглавии примера 4. ПДРЛ анализ показывает, что продукт является отдельной полиморфной формой, обозначенной"форма В". ПДРЛ данные для формы В приведены в приложении 1. Температура плавления формы В, равная 197 С (температура пика), определена с применением Т.A. Instruments 2100 DSC. Сканирование осуществляют при 20 С/мин, (от температуры окружающей среды до 300 С) в токе азота. Пример 7. N-(1S)-3-[3-(3-Изопропил-5-метил-4 Н-1,2,4-триазол-4-ил)-экзо-8-азабицикло[3.2.1]окт 8-ил]-1-фенилпропил-4,4-дифторциклогексанкарбоксамид. Соединение, указанное в заглавии препаративного примера 9 суспендируют в дихлорметане (9 мл) и к реакционной смеси добавляют раствор соединения, указанного в заглавии препаративного примера 17 (1,58 г, 5,35 ммоль) в толуоле (3,2 мл) с последующим добавлением уксусной кислоты (0,3 мл). К по- 14007580 лученному раствору добавляют порциями натрийтриацетоксиборогидрид (1,36 г, 6,24 ммоль). Образовавшуюся суспензию перемешивают при комнатной температуре в течение 30 мин. Образец анализируют ВЭЖХ и ТСХ, реакция считается завершенной. Добавляют воду (10 мл) с последующим добавлением 2 М водного раствора гидроксида натрия (10 мл) и слои разделяют. Водную фазу промывают дихлорметаном (10 мл) и объединенные органические слои промывают 1 М водным раствором гидроксида натрия (10 мл). Органический слой концентрируют при пониженном давлении, получая слегка коричневатую пену, которую ресуспендируют в этилацетате (10 мл) в течение 12 ч при комнатной температуре. Белое твердое вещество фильтруют и сушат в вакуумном сушильном шкафу при пониженном давлении и 40 С в течение 4 ч, что дает указанное в заглавии соединение, которое идентично соединению,указанному в заглавии примера 4, 2,05 г, 75% выход. Следующие препаративные примеры иллюстрируют получение некоторых промежуточных соединений, используемых в приведенных выше примерах. Препаративный пример 1. Метил-(3S)-3-амино-3-фенилпропаноат. Раствор трет-бутил-(3S)-3-амино-3-фенилпропаноата (5,04 г, 22,9 ммоль) в 2,25 М метанольной соляной кислоты (100 мл) нагревают до температуры кипения с обратным холодильником в течение 24 ч. Смесь охлаждают до комнатной температуры, подщелачивают насыщенным водным раствором карбоната натрия до рН 8 и разделяют фазы. Водный слой экстрагируют дихлорметаном (4 х). Объединенные органические растворы промывают насыщенным раствором соли, сушат (MgSO4), фильтруют и упаривают при пониженном давлении, получая указанное в заглавии соединение, 3,97 г. 1 Н-ЯМР (400 МГц, CDCl3):[м.д.] 1,70 (2 Н, с), 2,66 (2 Н, д), 3,68 (3 Н, с), 4,43 (1 Н, т), 7,25-7,40 (5 Н,м). Смесь указанного в заглавии соединения препаративного примера 1 (5,38 г, 30 ммоль), ди-третбутилдикарбоната (8,72 г, 40 ммоль), тетрагидрофурана (50 мл) и 2 н. водного раствора гидроксида натрия (25 мл) перемешивают при комнатной температуре в течение 2 ч. Реакционную смесь разбавляют этилацетатом, слои разделяют и водную фазу экстрагируют этилацетатом (2 х). Объединенные органические растворы промывают водой, насыщенным раствором соли, сушат (МgSO4), фильтруют и упаривают при пониженном давлении, получая указанное в заглавии соединение в виде белого твердого вещества,8,39 г. 1 ЯМР (400 МГц, CDCl3):[м.д.] 1,41 (9 Н, с), 2,84 (2 Н, м), 3,61 (3 Н, с), 5,10 (1 Н, уш.с), 5,41 (1 Н,уш.с), 7,22-7,36 (5 Н, м). LRMS: m/z 279,7 (МН+) Препаративный пример 3. трет-Бутил-(1S)-3-оксо-1-фенилпропилкарбамат. Диизобутилалюмогидрид (1 М в дихлорметане, 60 мл, 60 ммоль) охлаждают до -78 С и добавляют по каплям к раствору указанного в заглавии соединения препаративного примера 2 (8,39 г, 30 ммоль) в дихлорметане (150 мл) при -78 С. Реакционную смесь перемешивают 90 мин, затем добавляют метанол(предварительно охлажденный до -78 С, 40 мл). Смеси дают нагреться до комнатной температуры и выливают в 2 М водную соляную кислоту (200 мл). Слои разделяют и водную фазу экстрагируют дихлорметаном (2 х). Объединенные органические слои сушат (MgSO4), фильтруют и упаривают при пониженном давлении, получая указанное в заглавии соединение в виде белого твердого вещества, 6,72 г. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 1,42 (9 Н, с), 2,86-3,00 (2 Н, м), 5,06 (1 Н, уш.с), 5,20 (1 Н, уш.с),7,22-7,38 (5 Н, м), 9,75 (1 Н, с). Раствор 2,5-диметокситетрагидрофурана (50 г, 378 ммоль) в 0,025 М водной соляной кислоте (160 мл) охлаждают до 0 С и перемешивают 16 ч. Добавляют бензиламингидрохлорид (65 г, 453 ммоль), кетомалоновую кислоту (55 г, 377 ммоль) и водный раствор ацетата натрия (300 мл, 0,69 М) и реакционную смесь перемешивают при комнатной температуре в течение 1 ч. Смесь нагревают до 50 С еще 90 мин,затем охлаждают на ледяной бане и подщелачивают до рН 12 с помощью 2 н. водного раствора гидроксида натрия. Слои разделяют и водную фазу экстрагируют этилацетатом (3 х). Объединенные органические растворы промывают водой, сушат (MgSO4), фильтруют и упаривают при пониженном давлении. Оставшееся коричневое масло перегоняют при пониженном давлении (126 С/0,4 кПа), получая указанное в заглавии соединение в виде не совсем белого твердого вещества, 37,81 г. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 1,64 (2 Н, м) , 2,06-2,14 (2 Н, м), 2,18 (1 Н, с), 2,23 (1 Н, с), 2,68 (1 Н,м), 2,72 (1 Н, м), 3,48 (2 Н, с), 3,73 (2 Н, с), 7,20-7,29 (1 Н, м), 7,32 (2 Н, м), 7,42 (2 Н, д). Смесь соединения, указанного в заглавии препаративного примера 4 (17,72 г, 82 ммоль), гидрохлорида гидроксиламина (5,72 г, 82 ммоль) и пиридина (7,2 мл, 89 ммоль) нагревают до температуры кипения с обратным холодильником в этаноле (500 мл) в течение 20 ч. Реакционной смеси дают охладиться до комнатной температуры и разбавляют насыщенным водным раствором карбоната натрия. Смесь фильтруют и фильтрат упаривают при пониженном давлении. Остаток распределяют между дихлорметаном и водой, слои разделяют и водный слой экстрагируют дихлорметаном (2 х). Объединенные органические экстракты промывают насыщенным раствором соли, сушат (MgSO4), фильтруют и упаривают при пониженном давлении, получая указанное в заглавии соединение в виде светло-коричневого твердого вещества, 18,10 г. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 1,45-1,56 (1 Н, м), 1,60-1,67 (1 Н, м), 1,96-2,07 (2 Н, уш.м), 2,12 Раствор соединения, указанного в заглавии препаративного примера 5 (18,10 г, 79 ммоль), в пентаноле (500 мл) нагревают до температуры кипения с обратным холодильником. Добавляют порциями, за 2,5 ч, натрий (22,0 г, 957 ммоль). Затем реакционную смесь нагревают до температуры кипения с обратным холодильником еще 2 ч и охлаждают до 0 С на ледяной бане. Добавляют воду до прекращения выделения газообразного водорода. Смесь подкисляют, используя 6 н. водную соляную кислоту, и разделяют фазы. Органический слой экстрагируют 6 н. водной соляной кислотой (3 х), объединенные водные экстракты подщелачивают до рН 12 с помощью таблеток гидроксида натрия (400 г) и водный раствор экстрагируют этилацетатом (3 х). Объединенные органические растворы сушат (MgSO4), фильтруют и упаривают при пониженном давлении, получая указанное в заглавии соединение, 15,65 г. 1 Н ЯМР (400 МГц, CDCl3):[м.д.] 1,20-1,40 (2 Н, уш.м), 1,48 (2 Н, м), 1,58 (2 Н, д), 1,64-1,76 (2 Н,уш.м), 2,00 (2 Н, уш.м), 2,95 (1 Н, м), 3,19 (2 Н, уш.с), 3,57 (2 Н, с), 7,18-7,26 (1 Н, м), 7,30 (2 Н, м), 7,37 (2 Н,д). Триэтиламин (9 мл, 66,8 ммоль) добавляют к раствору соединения, указанного в заглавии препаративного примера 6 (13 г, 60,1 ммоль), изомасляной кислоты (5,6 мл, 60,5 ммоль) и 1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорида (11,6 г, 60,4 ммоль) в дихлорметане (150 мл). Реакционную смесь перемешивают при комнатной температуре в течение 3 ч, и по прошествии этого времени добавляют изомасляную кислоту (1,4 мл, 15 ммоль) и 1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорид (2,9 г, 15,1 ммоль). Реакционную смесь перемешивают при комнатной температуре 2 дня,- 16007580 после чего добавляют изомасляную кислоту (2,6 мл, 28 ммоль), 1-(3-диметиламинопропил)-3 этилкарбодиимидгидрохлорид (5 г, 26 ммоль) и триэтиламин (3 мл, 22,3 ммоль). Реакционную смесь перемешивают 24 ч. К смеси добавляют насыщенный водный раствор карбоната натрия (300 мл) и продукт экстрагируют дихлорметаном (2 х). Объединенные органические слои промывают насыщенным раствором соли, сушат (MgSO4), фильтруют и упаривают при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем при градиенте элюирования дихлорметан:метанол:0,88 аммиак(1:0:0 - 97:3:0,3, по объему), что дает указанное в заглавии соединение в виде белого порошка, 9,2 г. Найдено С 75,43; Н 9,30; N 9,82%. C18H26N2O рассчитано С 75,48; Н 9,15; N 9,78% 1 Н-ЯМР (400 МГц, CDCl3):[м.д.] 1,10 (6 Н, д), 1,47 (2 Н, т), 1,60 (2 Н, с), 1,70 (2 Н, м), 1,80 (2 Н, м), 2,02 (2 Н, м), 2,27 Оксихлорид трехвалентного фосфора (9 мл, 96,9 ммоль) добавляют к раствору соединения, указанного в заглавии препаративного примера 7 (9,2 г, 32 ммоль), и пиридина (16 мл, 196 ммоль) в хлороформе (20 мл) при 0 С. Реакционной смеси дают нагреться до комнатной температуры и перемешивают в течение 5 ч. Смесь упаривают при пониженном давлении. Остаток растворяют в хлороформе (40 мл) и добавляют уксусный гидразид (3,6 г, 48,6 ммоль). Смесь нагревают до температуры кипения с обратным холодильником в течение 3 ч. Добавляют к смеси насыщенный водный раствор карбоната натрия (250 мл) и продукт экстрагируют дихлорметаном (2 х). Объединенные органические слои промывают насыщенным раствором соли, сушат (MgSО 4), фильтруют и упаривают при пониженном давлении. К остатку добавляют толуол (200 мл) и моногидрат п-толуолсульфокислоты (100 мг, 0,53 ммоль). Реакционную смесь нагревают до температуры кипения с обратным холодильником в течение 2 ч. Реакционную смесь упаривают при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем при градиенте элюирования дихлорметан:метанол:0,88 аммиак (1:0:0 - 95:5:0,5, по объему), что дает сырой продукт. Сырой материал суспендируют в 6 н. водной соляной кислоте (40 мл) и нагревают до температуры кипения с обратным холодильником в течение 12 ч, по прошествии этого времени добавляют 12 н. водную соляную кислоту (4 мл). Реакционную смесь нагревают до температуры кипения с обратным холодильником 2 ч. Смесь упаривают при пониженном давлении. Остаток подщелачивают, добавляя насыщенный водный раствор карбоната калия (200 мл), и продукт экстрагируют дихлорметаном (3 х). Объединенные органические слои промывают насыщенным раствором соли, сушат (MgSO4), фильтруют и упаривают при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем при градиенте элюирования дихлорметан:метанол:0,88 аммиак (1:0:0 - 96:4:0,4, по объему), что дает указанное в заглавии соединение в виде белого порошка, 3,12 г. 1 Н-ЯМР (300 МГц, CDCl3):[м.д.] 1,40 (6 Н, д), 1,70 (4 Н, м), 2,15-2,40 (4 Н, м), 2,60 (3 Н, с), 3,07 (1 Н,м), 3,37 (2 Н, с), 3,60 (2 Н, с), 4,30 (1 Н, м), 7,25-7,40 (5 Н, м). Формиат аммония (6 г, 92 ммоль) добавляют к раствору соединения, указанного в заглавии препаративного примера 8 (3,12 г, 9,6 ммоль), и гидроксида палладия (II) (500 мг) в этаноле (400 мл). Смесь нагревают до температуры кипения с обратным холодильником в течение 2 ч, после чего добавляют 0,88 раствор аммиака (2 мл). Смесь нагревают до температуры кипения с обратным холодильником в течение 1 ч, реакционной смеси дают охладиться до комнатной температуры и фильтруют через Arbocel (ускоритель фильтрования). Растворитель упаривают при пониженном давлении, получая указанное в заглавии соединение в виде белого твердого вещества, 1,91 г. 1 Н-ЯМР (300 МГц, CDCl3):[м.д.] 1,37 (6 Н, д), 1,70-2,25 (8 Н, м), 2,50 (3 Н, с), 3,05 (1 Н, м), 3,70 (2 Н,м), 4,32 (1 Н, м). Натрийтриацетоксиборогидрид (1,7 г, 8,02 ммоль) и ледяную уксусную кислоту (1 мл, 17,5 ммоль) добавляют к раствору соединения, указанного в заглавии препаративного примера 9 (1,6 г, 6,84 ммоль), и соединения, указанного в заглавии препаративного примера 3 (2 г, 8,03 ммоль), в дихлорметане (40 мл),и реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Смесь подщелачивают 10% м/м водным раствором карбоната калия и экстрагируют дихлорметаном (2 х). Объединенные органические экстракты промывают насыщенным раствором соли, сушат (MgSO4), фильтруют и упаривают при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем при градиенте элюирования дихлорметан:метанол:0,88 аммиак (1:0:0 - 97,5:2,5:0,25, по объему), что дает указанное в заглавии соединение в виде белой пены, 2,5 г. 1 Смесь соединения, указанного в заглавии препаративного примера 10 (2,5 г, 5,35 ммоль), 2,25 М водной соляной кислоты и метанола (70 мл) нагревают до температуры кипения с обратным холодильником в течение 5 мин и перемешивают при комнатной температуре в течение 1,5 ч. Реакционной смеси дают охладиться до комнатной температуры и упаривают при пониженном давлении. Остаток подщелачивают, добавляя насыщенный водный раствор карбоната натрия (150 мл) и экстрагируют дихлорметаном (2 х). Объединенные органические слои промывают насыщенным раствором соли, сушат (MgSO4),фильтруют и упаривают при пониженном давлении, получая указанное в заглавии соединение в виде белой пены, 1,80 г. 1 Н-ЯМР (400 МГц, CDCl3):[м.д.] 1,37 (6 Н, м), 1,42 (4 Н, м), 1,85 (2 Н, м), 2,05 (2 Н, м), 2,20 (2 Н, м),2,42 (5 Н, м), 3,00 (1 Н, м), 3,37 (2 Н, м), 4,10 (1 Н, м), 4,30 (1 Н, м), 7,30 (5 Н, м). Указанное в заглавии соединение получают из соединения, указанного в заглавии препаративного примера 9 (1,0 г, 4,27 ммоль), и трет-бутил-(1S)-3-оксо-1-(3-фторфенил) пропилкарбамата (ЕР-А 1013276) (2,2 г, 8,23 ммоль), используя методику, аналогичную описанной в препаративном примере 10,0,76 г. Указанное в заглавии соединение получают из соединения, указанного в заглавии препаративного примера 12 (7 60 мг, 1,57 ммоль), используя методику, аналогичную описанной в препаративном примере 11, 200 мг. 4,4-Дифторциклогексанкарбоновую кислоту (118,2 г, 0,72 моль) растворяют в толуоле (296 мл). К прозрачному раствору добавляют тионилхлорид (261 мл, 3,6 моль) и полученный раствор нагревают до температуры кипения с обратным холодильником в течение 1,5 ч. Отбирают пробу и концентрируют, 1 НЯМР подтверждает полноту завершения конверсии до указанного в заглавии соединения. Реакционную смесь охлаждают до комнатной температуры и тионилхлорид удаляют при пониженном давлении и заменяют толуолом, получая указанное в заглавии соединение в виде толуольного концентрата с общим объемом 591 мл. 1 Н-ЯМР (300 МГц, CDCl3):[м.д.] 2,29 (1 Н, м), 2,20-1,70 (8 Н, м). Препаративный пример 15. Этил-(3S)-3-[(4,4-дифторциклогексил)карбонил]амино-3-фенилпропаноат. Этил-(3S)-3-амино-3-фенилпропаноатгидрохлорид (10 г, 4 3,6 ммоль) суспендируют в дихлорметане (100 мл) и добавляют насыщенный водный раствор карбоната натрия (100 мл) и воду (100 мл). Смесь охлаждают до 0 С и к реакционной смеси добавляют раствор соединения, указанного в заглавии препаративного примера 14 (7,96 г, 43,6 ммоль), в толуоле (38 мл). Полученную смесь перемешивают в течение 1 ч при комнатной температуре. ВЭЖХ анализ реакционной смеси показывает, что реакция завершилась. Слои разделяют. Значение рН водной фазы равно рН=9. Водный слой промывают дихлорметаном(100 мл). Объединенные органические слои промывают водой (100 мл) и затем 1 М водной соляной кислотой (100 мл), после чего промывают водой (100 мл). Органический слой концентрируют до коричневого масла и масло гранулируют в смеси этилацетат: гептан 1:2, по объему (50 мл) в течение 4 ч. Белое твердое вещество отфильтровывают и сушат в сушильном шкафу при пониженном давлении в течение 12 ч при 40 С, получая указанное в заглавии соединение в виде белого твердого вещества, 10,9 г, 66% выход. 1(3S)-3-Амино-3-фенилпропанол (30,9 г, 0,20 моль) растворяют в дихлорметане (300 мл) и добавляют насыщенный водный раствор карбоната натрия (300 мл). Полученную двухфазную смесь охлаждают до 5 С и добавляют соединение, указанное в заглавии препаративного примера 14, в виде толуольного- 19007580 концентрата (37,3 г, 0,20 моль, 224 мл), поддерживая температуру ниже 10 С. Образовавшуюся суспензию перемешивают в течение 15 мин при 5 С. ВЭЖХ анализ образца показывает, что реакция завершилась. Добавляют воду (310 мл) и получают двухфазную смесь. Слои разделяют, водный слой промывают дихлорметаном (300 мл), и объединенные органические слои промывают 1 М водным раствором гидроксида натрия (300 мл). Объединенные органические слои концентрируют при пониженном давлении до твердого коричневого вещества. Твердое вещество суспендируют в толуоле (120 мл), что приводит к густой белой суспензии. Добавляют метил-трет-бутиловый эфир (240 мл), получают подвижную белую суспензию. Суспензию перемешивают при 0 С в течение 1 ч, и белое твердое вещество фильтруют. Твердый продукт сушат в сушильном шкафу при пониженном давлении в течение 12 ч при 40 С, получая указанное в заглавии соединение, 53,9 г, 89% выход. 1 Н-ЯМР (300 МГц, CDCl3):[м.д.] 7,30 (5 Н, м), 6,18 (1 Н, уш.д), 5,20 (1 Н, м), 3,75-3,50 (2 Н, м), 3,05 Комплекс триоксид серы-пиридин (80,3 г, 0,50 моль) суспендируют в дихлорметане (175 мл) в атмосфере азота. Добавляют диметилсульфоксид (175 мл) и полученный раствор охлаждают до 0 С. Раствор соединения по препаративному примеру 16, триэтиламина (70 мл, 0,50 моль) и диметилсульфоксида(88 мл) в дихлорметане (88 мл) медленно добавляют к реакционной смеси, поддерживая температуру ниже 10 С. Образовавшийся желтый раствор перемешивают при 0 С в течение 2 ч, пока образец ТСХ не покажет, что исходные материалы израсходованы. Добавляют воду (750 мл) и получают двухфазную смесь. Смесь разбавляют толуолом (750 мл) и слои разделяют. Органический слой промывают 0,5 М водной соляной кислотой (750 мл) и насыщенным раствором соли (750 мл). Органический слой концентрируют при пониженном давлении до твердого коричневого вещества, которое используют для примера 7 без дополнительной очистки. Образец твердого вещества очищают грануляцией в смеси этилацетат:метил-трет-бутиловый эфир (1:5, 4 мл/г). 1 Комплекс триоксид серы-пиридин (965 г, 6,1 моль) суспендируют в дихлорметане (2 л) в атмосфере азота. Добавляют диметилсульфоксид (2 л) и полученный раствор охлаждают до 0 С. Раствор бензил(1S)-3-гидрокси-1-фенилпропилкарбамата (577 г, 2,0 моль), триэтиламина (845 мл, 6,1 моль) и диметилсульфоксида (1 л) в дихлорметане (1 л) медленно добавляют к реакционной смеси, поддерживая температуру ниже 10 С. Образовавшийся желтый раствор перемешивают при 0 С в течение 2,5 ч. Образец анализируют ТСХ, который показывает, что исходные материалы израсходованы. Добавляют воду (8,6 л) и получают двухфазную смесь. Смесь разбавляют толуолом (8,6 л) и слои разделяют. Органический слой концентрируют при пониженном давлении, получая коричневую пену, которую используют для препаративного примера 19 без дополнительной очистки. 1- 20007580 Соединение, указанное в заглавии препаративного примера 9 (13,5 г, 32 ммоль), суспендируют в дихлорметане (27 мл) и к реакционной смеси добавляют раствор соединения по препаративному примеру 18 (9,93 г, 35 ммоль) в толуоле (50 мл) и дихлорметане (50 мл) с последующим добавлением уксусной кислоты (2,7 мл). К полученному раствору добавляют порциями натрийтриацетоксиборогидрид (8,1 г, 38 ммоль). Полученную суспензию перемешивают при температуре окружающей среды в течение 1,5 ч. Образец анализируют ВЭЖХ и ТСХ, подтверждающими завершение реакции. Добавляют воду (27 мл), с последующим добавлением 2 М водного раствора гидроксида натрия (27 мл). Водный слой подщелачивают до рН 11-12 добавлением 10 М водного гидроксида натрия и слои разделяют. Органический слой промывают 1 М водным гидроксидом натрия (27 мл) и насыщенным раствором соли (27 мл). Органический слой концентрируют при пониженном давлении, получая светло-коричневую пену 13,3 г, 76%. 1 Н-ЯМР (300 МГц, CDCl3):[м.д.] 1,39 (6 Н, д), 1,55-1,75 (4 Н, м), 1,84 (2 Н, м), 2,05 (2 Н, м), 2,15-2,45 Соединение, указанное в заглавии препаративного примера 19 (309 г, 0,62 моль), растворяют в метаноле (3,1 л). Гидроксид палладия (II) (31 г) добавляют к полученной суспензии при перемешивании и в атмосфере водорода при 345 кПа (50 фунт/кв.дюйм) в течение 12 ч. Отбирают образец для ТСХ и ВЭЖХ анализов, подтверждающих завершение реакции. Реакционную смесь фильтруют через Arbocel (ускоритель фильтрования) и плотный осадок на фильтре промывают метанолом (500 мл). Метанольный раствор концентрируют, получая указанное в заглавии соединение в виде белой пены, 176 г, 78%. 1 Н-ЯМР идентичен спектру соединения, указанного в заглавии препаративного примера 11. Препаративный пример 21. 8-Бензил-8-азабицикло[3.2.1]октан-3-оноксим. Смесь соединения, указанного в заглавии препаративного примера 4 (50 г, 0,23 моль), растворяют в промышленном метилированном спирте (250 мл). Добавляют раствор гидроксиламингидрохлорида (17,8 г, 0,26 моль) в воде (250 мл), что приводит к экзотермической реакции. Добавляют бикарбонат натрия(23,4 г, 0,28 моль), отмечается незначительная эндотермическая реакция и вспенивание. Полученный раствор перемешивают в течение 12 ч. Образуется белое твердое вещество, которое собирают фильтрованием и сушат в сушильном шкафу при пониженном давлении в течение 4 ч при 50 С, получают указанное в заглавии соединение в виде белого твердого вещества, 43,1 г, 81% выход. Препаративный пример 22. Бензил-8-азабицикло[3.2.1]октан-3-экзоамин. Очищенный металлический натрий (24,3 г, 1,06 моль) добавляют кусочками в толуол (300 мл) при комнатной температуре и смесь нагревают до температуры кипения с обратным холодильником. К кипящей реакционной смеси медленно добавляют за 15 мин раствор соединения, указанного в заглавии препаративного примера 5 (20,0 г, 87 ммоль), в толуоле (200 мл) и пентаноле (120 мл). В течение этого времени наблюдается выделение газа. Полученную смесь нагревают до температуры кипения с обратным холодильником в течение 2 ч, для уверенности в полном израсходовании натрия. Образуется густая белая суспензия. Реакционную смесь охлаждают до 80 С и добавляют изопропиловый спирт (200 мл). Реакционной смеси дают охладиться до комнатной температуры и добавляют воду (700 мл). Значение рН водного слоя доводят до рН 1 путем добавления концентрированной соляной кислоты (140 мл), (наблюдается экзотермическая реакция). Реакционную смесь перемешивают в течение 15 мин и слои разделяют. Этилацетат (700 мл) добавляют к водному слою, значение рН которого доводят до рН 12 путем добавления 10 М водного гидроксида натрия (40 мл). Слои разделяют и органический слой концентрируют при пониженном давлении, получая светло-желтое масло. Удержанный в масле пентанол удаляют азеотропной перегонкой с водой (200 мл) и остаток воды удаляют азеотропной перегонкой с толуолом (200 мл),получают указанное в заглавии соединение в виде светло-желтого масла, содержащего следы толуола,18,0 г, 95% выход. Стационарную установку на 20 л заполняют дихлорметаном (5 л), карбонатом натрия (900 г), водой(8,7 л) и соединением, указанным в заглавии препаративного примера 6 (1200 г, 5,56 моль). Полученную смесь охлаждают до 0 С. Изобутирилхлорид (700 мл, 6,67 моль) добавляют за 30 мин, поддерживая температуру ниже 10 С. Полученную смесь перемешивают в течение 2 ч при температуре от 0 С до комнатной. Согласно ВЭЖХ анализу взаимодействие завершается за 2 ч. Слои разделяют и водный слой промывают дихлорметаном (1,5 л). Водный слой имеет рН 8. Объединенные органические слои промывают 1 М водным раствором гидроксида натрия (1,5 л), дихлорметан отгоняют и добавляют этилацетат до конечного объема 3 л. Образовавшуюся смесь нагревают до температуры кипения с обратным холодильником, получая прозрачный коричневый раствор. Раствор охлаждают до 25 С за 1,5 ч и затем до 2 С за 1 ч и выдерживают при этой температуре 30 мин. Образовавшийся белый твердый продукт отделяют фильтрованием и фильтрат вносят в реактор, чтобы привести в движение прилипающее ко дну твердое вещество. Температуру выдерживают при 2 С. Образовавшуюся суспензию добавляют к плотному осадку на фильтре. В реактор добавляют этилацетат (0,6 л) для выделения оставшегося твердого вещества, и суспензию добавляют к плотному осадку на фильтре. Твердое вещество сушат в сушильной камере при пониженном давлении, получая указанное в заглавии соединение, 936 г, 59% выход. Жидкости упаривают при пониженном давлении до общего объема 1,5 л и образовавшийся коричневый раствор охлаждают до 10 С, получая суспензию. Белое твердое вещество фильтруют и сушат в сушильной камере при пониженном давлении, получая вторую порцию указанного в заглавии соединения, 144 г, 9%. Общий выход: 1080 г, 68%. Препаративный пример 24. 8-Бензил-3-(3-изопропил-5-метил-4 Н-1,2,4-триазол-4-ил)экзо-8-азабицикло[3.2.1]октан. Стационарную установку заполняют дихлорметаном (7 л) и PCl5 (719 г, 3,45 моль). Полученную суспензию охлаждают до 0 С. Раствор соединения, указанного в заглавии препаративного примера 7(760 г, 2,66 моль), в дихлорметане (2,5 л) добавляют за 30 мин, поддерживая температуру ниже 10 С. Полученный раствор перемешивают при температуре от 0 С до комнатной в течение 2 ч. Образовавшийся светло-желтый раствор охлаждают до 0 С. Раствор уксусного гидразида (315 г, 4,27 моль) в 2-метил-2 бутаноле (около 1,5 л) (полученный растворением уксусного гидразида в ацетонитриле (1 л) и 2-метил-2 бутаноле (2 л) и отгонкой ацетонитрила и 500 мл 2-метил-2-бутанола) медленно добавляют, поддерживая температуру ниже 10 С. Полученный раствор перемешивают при комнатной температуре 15 ч. Согласно ВЭЖХ анализу реакция завершается за 30 мин, но для гарантии выдерживают время. Смесь охлаждают до 0 С и добавляют 2 М водный раствор гидроксида натрия (7,5 л), поддерживая температуру ниже 20 С. Значение рН водного слоя доводят до рН 9 с помощью 10 М водного раствора гидроксида натрия (около 0,5 л). Слой разделяют, и водный слой промывают дихлорметаном (1 л). Объединенные органические слои упаривают при пониженном давлении, получая концентрат в 2-метил-2-бутаноле (ок. 2,5 л). Добавляют этилацетат (1,5 л) и уксусную кислоту (200 мл). Полученный раствор нагревают до 80 С в течение 30 мин. Раствор охлаждают до комнатной температуры в течение ночи. Раствор охлаждают до 0 С и смесь подщелачивают до рН 12 с помощью 2 М водного раствора гидроксида натрия (2 л). Слои разделяют и водный слой промывают этилацетатом (1 л). Объединенные органические слои концентрируют примерно до 2 л при пониженном давлении и добавляют гептан (2 л), смесь упаривают примерно до 3 л при пониженном давлении. Добавляют гептан (1,5 л) и этилацетат (300 мл) и смесь нагревают до температуры кипения с обратным холодильником. Раствор охлаждают до 20 С в течение 1 ч и до 0 С за 2 ч. Образуется белый твердый продукт, который фильтруют и сушат в сушильной камере при пониженном давлении и при 40 в течение ночи, что дает указанное в заглавии соединение, 622 г, 72% выход. Препаративный пример 25. Соль 3-(3-изопропил-5-метил-4 Н-1,2,4-триазол-4-ил)-экзо-8-азабицикло- 22007580 Соединение, указанное в заглавии препаративного примера 8 (600 г, 1,85 моль) и моногидрат паратолуолсульфокислоты (351 г, 1,85 моль) растворяют в метаноле (3 л). Добавляют 10% м/м палладий-наугле (60 г). Смесь перемешивают в атмосфере водорода при 345 кПа (50 фунт/кв.дюйм) и при комнатной температуре в течение 12 ч. Образец, отобранный на ВЭЖХ анализ показывает, что реакция завершилась. Реакционную смесь фильтруют через Arbocel (ускоритель фильтрования) и фильтровальную пробку промывают метанолом (500 мл). Метанол упаривают при пониженном давлении и полученное коричневое масло растворяют в горячем изопропиловом спирте (1,8 л), раствор оставляют гранулироваться при комнатной температуре на 12 ч и затем при 0 С на 2 ч. Белый твердый продукт отфильтровывают и сушат в вакуумной печи в течение 12 ч, получая указанное в заглавии соединение, 623 г, 83% выход. Биологическая активность Соединения по примерам 1-5 испытаны на CCR5 связывание согласно методикам, описанным вCombadiere et al., J. Leukoc. Biol., 60, 147-52 (1996) (упомянутым выше). Установлено, что все испытуемые соединения имеют значение IСм ниже 10 нМ. Приложение 1. ПДРЛ данные для полиморфных формы А и формы В, выделенных по примерам 4 и 6. Найдено, что N-(1S)-3-[3-(3-изопропил-5-метил-4 Н-1,2,4-триазол-4-ил)экзо-8-азабицикло [3.2.1] окт-8-ил]-1-фенилпропил-4,4-дифторциклогексанкарбоксамид, полученный по способам примеров 4 и 6, существует в 2 полиморфных формах, обозначенных как форма А и форма В. Моделирование ПДРЛ порошковой рентгенограммы, включающий d-межплоскостное расстояние и сравнительные интенсивности рассчитаны из отдельных кристаллических структур с применением Cerius2 Diffraction-Crystal Module. Параметры моделирования: Длина волны = 1,54178 ; Фактор поляризации = 0,5; Размер кристаллита = 500 х 500 х 500 ; Форма пика по Lorentzian'y. Основные пики (в градусах 2-тета) моделированных порошковых рентгенограмм приведены в следующих таблицах. Для квалифицированного специалиста очевидно, что хотя сравнительные интенсивности различных пиков в таблице могут меняться в зависимости от ряда факторов, включающих эффекты ориентации кристаллов в пучке рентгеновских лучей, чистоту исследуемого образца или степень кристалличности образца, положения пиков будут оставаться в основном такими, как указано в таблицах. Квалифицированному специалисту понятно также, что измерения, полученные с использованием различной длины волны пучка рентгеновских лучей будут приводить к различным сдвигам в положении пиков согласно уравнению Bragg'а. Считается, что такие порошковые рентгенограммы, полученные с применением различных длин волн служат альтернативными представлениями ПДРЛ порошковых рентгенограмм кристаллических материалов по настоящему изобретению, и поэтому входят в объем настоящего изобретения. Перечень пиков для формы А- 23007580 Перечень пиков для формы В где R1 означает С 3-6-циклоалкил, необязательно замещенный одним или более атомами фтора, илиC1-6-алкил, необязательно замещенный одним или более атомами фтора, или С 3-6-циклоалкилметил, необязательно замещенный по кольцу одним или более атомами фтора, иR2 означает фенил, необязательно замещенный одним или более атомами фтора; или его фармацевтически приемлемую соль или сольват и один или более дополнительный терапевтический агент. 2. Комбинация по п.1, где дополнительный терапевтический агент или терапевтические агенты выбирают из агентов, пригодных для лечения нарушения, при котором вовлекается модуляция CCR5 рецепторов. 3. Комбинация по п.1 или 2, где дополнительный терапевтический агент или терапевтические агенты выбирают из агентов, пригодных для лечения HIV. 4. Комбинация по любому из пп.1-3, где дополнительный терапевтический агент или терапевтические агенты включают один или более ингибитор HIV протеазы и/или HIV обратной транскриптазы. 5. Комбинация по п.4, где один или более ингибитор HIV протеазы и/или HIV обратной транскриптазы выбирают из класса ненуклеозидных ингибиторов обратной транскриптазы (NNTRI). 6. Комбинация по любому из пп.1-5, где дополнительный терапевтический агент или терапевтические агенты включают один или более компонент, выбранный из ингибиторов пролиферации, иммуномодуляторов, ингибиторов слияния, других агонистов/антагонистов рецепторов хемокина, модуляторов рецептора тахикинина, ингибиторов интегразы, ингибиторов RhaseH, ингибиторов вирусной транскриптазы, RNA репликации и других агентов, которые ингибируют вирусную инфекцию или улучшают состояние или последствия HIV-инфекции человека посредством других механизмов. 7. Комбинация по п.1 или 2, где дополнительный терапевтический агент или терапевтические агенты выбирают из агентов, пригодных для лечения воспалительного заболевания. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6
МПК / Метки
МПК: C07D 451/02, A61P 29/00, A61P 31/00, A61K 31/46
Метки: тропана, полезные, производные, содержащая, комбинация, терапии
Код ссылки
<a href="https://eas.patents.su/25-7580-kombinaciya-soderzhashhaya-proizvodnye-tropana-poleznye-v-terapii.html" rel="bookmark" title="База патентов Евразийского Союза">Комбинация, содержащая производные тропана, полезные в терапии</a>
Предыдущий патент: Ингибиторы фактора ха и других сериновых протеаз, вовлечённых в коагуляционный каскад
Следующий патент: Способ каталитического селективного окисления сернистых соединений
Случайный патент: Дансилгидразид 24-эпикастастерона в качестве меченого антигена для иммунохимического анализа (24r)-метилбрассиностероидов





























