Противоопухолевые производные эктейнасцидина
Номер патента: 6206
Опубликовано: 27.10.2005
Авторы: Гальего Пилар, Фернандес Каролина, Мансанарес Игнасио, Сарсуэло Мария, Франсесч Андрес, Флорес Мария, Чичарро Хосе Луис
Формула / Реферат
1. Соединение формулы

где группы заместителей, обозначенные как R1, R2, каждая независимо, выбраны из H, C(=O)R', замещенного или незамещенного C1-C18 алкила, замещенного или незамещенного C2-C18 алкенила, замещенного или незамещенного C2-C18 алкинила, замещенного или незамещенного арила;
каждая из R'-групп независимо выбрана из группы, состоящей из H, OH, NO2, NH2, SH, CN, галогена, =O, C(=O)H, C(=O)CH3, CO2H, замещенного или незамещенного C1-C18 алкила, замещенного или незамещенного C2-C18 алкенила, замещенного или незамещенного C2-C18 алкинила, замещенного или незамещенного арила;
X2 представляет OX1 или N(X1)2, где все или каждый X1 независимо представляет H, C(=O)R', где R' имеет вышеуказанные значения, замещенный или незамещенный C1-C18 алкил, замещенный или незамещенный C2-C18 алкенил, замещенный или незамещенный C2-C18 алкинил, замещенный или незамещенный арил, замещенный или незамещенный алкокси, замещенный или незамещенный гетероциклил, или две X1-группы вместе могут образовывать циклический заместитель на атоме азота, или X1 может быть SO2CH3, когда X2 представляет OX1;
X3 выбран из OR1, где R1 имеет вышеуказанные значения, CN, (=O) или H;
X4 представляет -H или C1-C18 алкил и
X5 выбран из H или R1, где R1 имеет вышеуказанные значения;
за исключением соединений следующих формул:
2. Соединение по п.1, где R1 представляет C(=O)R', где R' представляет H или замещенный или незамещенный алкил.
3. Соединение по п.2, где R1 представляет ацетил.
4. Соединение по п.1, 2 или 3, где R2 представляет H или метил.
5. Соединение по п.4, где R2 представляет метил.
6. Соединение по любому предшествующему пункту, где X3 представляет OH или CN.
7. Соединение по любому предшествующему пункту, где X4 представляет H или Me.
8. Соединение по любому предшествующему пункту, где X5 представляет H или C1-C18 алкил.
9. Соединение по п.8, где X5 представляет H.
10. Соединение по любому предшествующему пункту формулы
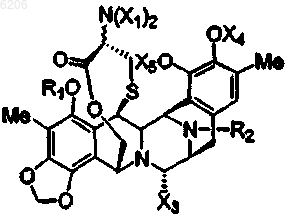
где группы заместителей R1, R2, X1, X3, X4 и X5 имеют вышеуказанные значения.
11. Соединение по п.10, где один X1 представляет водород.
12. Соединение по п.10 или 11, где N(X1)2 представляет -NHCOалкил и может быть галогензамещенным; -NHалкилCOOH; защищенный -NHCOCH(NH2)CH2SH, где NH2 и/или SH защищены; -NHбиотин; -NHарил; -NH(aa)y, где аа представляет аминокислотный ацил и у равен 1, 2 или 3, и где любая NH2 группа необязательно является превращенной в ее производное или защищенной; фталимидо группу, образованную из двух групп X1 с соседним азотом; -NHалкил; -NHCOарилалкенил, который может быть замещен, например, 3-трифторметилом.
13. Соединение по п.10, 11 или 12, где N(X1)2 представляет NHAc, NHCO(CH2)2COOH, NHCOCH(NHAlloc)CH2SFm, NHCO(CH2)14CH3, NHTFA, NHCO(CH2)2CH3, NHCOCH2CH(CH3)2, NHCO(CH2)6CH3, NHбиотин, NHBz, NHCOCinn, NHCO-(n-F3C)-Cinn, NHCOVal-NH2, NHCOVal-N-Ac, NHCOVal-N-COCinn, NHCOVal-Ala-NH2, NHCOVal-Ala-N-Ac, NHCOAla-NH2, NHCOCH(NH2)CH2SFm, NPhth, NH-(м-CO2Me)-Bz, NMe2, NHAlloc, NHTroc, NHCOVal-Ala-N-COCinn, NHCOAla-N-Ac, NHCOAla-N-COCinn.
14. Соединение по любому из пп.1-9 формулы
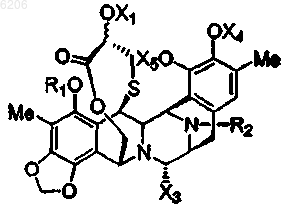
где группы заместителей R1, R2, X1, X3, X4 и X5 имеют вышеуказанные значения.
15. Соединение по п.14, где X1 представляет H.
16. Соединение по п.14 или 15, где OX1 представляет OH, OAc, OCOCF3, OCOCH2CH2CH3, OCO(CH2)6CH3, OCO(CH2)14CH3, OCOCH=CHPh, OSO2CH3.
17. Соединение формулы (XVIIb)
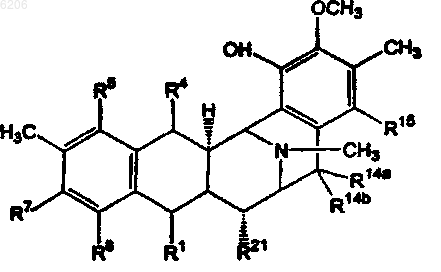
где R1 и R4 вместе образуют группу формулы (VIa) или (VIb)
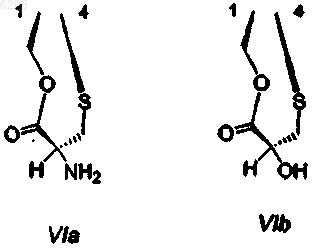
R5 представляет -H или -OH;
R7 представляет -OCH3 и R8 представляет -OH, или R7 и R8 вместе образуют группу -O-CH2-O-;
R14a и R14b оба представляют -H, или один представляет -H, а другой представляет -OH, -OCH3 или -OCH2CH3, или R14a и R14b вместе образуют кетогруппу; и
R15 представляет -H или -OH;
R21 представляет -H, -OH или -CN;
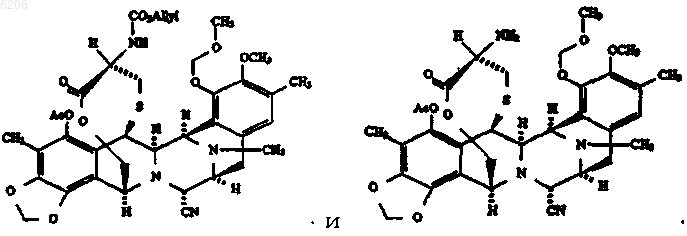
и производные, включая их ацилпроизводные; производные, где группа -NCH3- в 12 положении заменена группой -NH- или -NCH2CH3-; и производные, где группа -NH2 в соединении формулы (VIa) или группа -OH в соединении формулы (VIb) переведена в их производные, где группа -CHNH2 в VIa заменена группой -CHNHX1 или -CHN(X1)2, или где группа -CHOH в VIb заменена группой CHOX1, где X1 имеет значения, указанные в любом предшествующем пункте; за исключением эктейнасцидина 583, эктейнасцидина 597, N-ацетилэктейнасцидина 597, а также за исключением соединений следующих формул
18. Соединение по п.17, где R5 представляет ацилокси, содержащий вплоть до 4 атомов углерода.
19. Соединение по п.18, где R5 представляет ацетилокси.
20. Соединение по пп.17, 18 или 19, где R7 и R8 вместе образуют группу -O-CH2-O-.
21. Соединение по любому из пп.17-20, где ацилпроизводное представляет его N-ацил, или N-тиоацил, или циклический амид.
22. Соединение по п.21, где ацильная группа представляет алканоил, галогеналканоил, арилалканоил, алкеноил, гетероциклилацил, ароил, арилароил, галогенароил, нитроароил или другую ацильную группу.
23. Соединение по п.21 или 22, где ацильная группа имеет формулу -CO-Ra, где Ra представляет алкил, алкокси, алкилен, арилалкил, арилалкенил, аминокислоту, ароматический гетероциклил или частично или полностью насыщенный гетероциклил, каждый из которых необязательно замещен галогеном, циано, нитро, карбоксиалкилом, алкокси, арилом, арилокси, гетероциклилом, гетероциклилокси, алкилом, аминогруппой или замещенной аминогруппой.
24. Соединение по п.23, где Ra представляет алкил, галогеналкил, алкоксиалкил, галогеналкоксиалкил, арилалкилен, галогеналкиларилалкилен, ацил, галогенацил, арилалкил, алкенил или аминокислоту.
25. Соединение по п.23 или 24, где группа Ra-CO- представляет ацетил, трифторацетил, 2,2,2-трихлорэтоксикарбонил, изовалерилкарбонил, транс-3-(трифторметил)циннамоилкарбонил, гептафторбутирилкарбонил, деканоилкарбонил, транс-циннамоилкарбоэшы, бутирилкарбонил, 3-хлорпропионилкарбонил, циннамоилкарбонил, 4-метилциннамоилкарбонил, аланил, аргинил, аспартил, аспарагил, цистил, глутамил, глутаминил, глицил, гистидил, гидроксипролил, изолейцил, лейцил, лизил, метионил, фенилаланил, пролил, серил, треонил, тиронил, триптофил, тирозил, валил, фталимидо или другие циклические амиды.
26. Соединение по любому из пп.23-25, где группа -CO-Ra является производным аминокислоты и включает аминогруппу, которая сама образует ацильное производное.
27. Соединение по п.26, где N-ацильное соединение представляет дипептид, который, в свою очередь, может образовывать N-ацильные производные.
28. Соединение по любому из пп.17-20, где O-ацильное производное представляет алифатическое O-ацильное производное.
29. Соединение по любому из пп.17-28, где R14a и R14b представляют водород.
30. Соединение по любому из пп.17-29, где R15 представляет водород.
31. Соединение по любому из пп.17-30 формулы (XVIII)
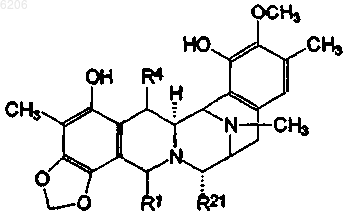
где R1 и R4 образуют группу формулы (VIa или VIb)
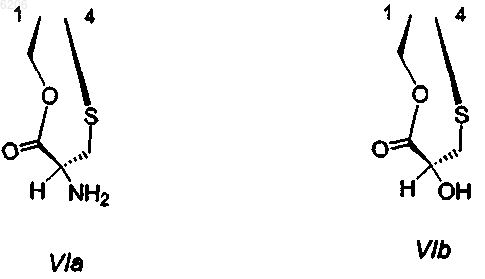
R21 представляет -H, -OH или -CN; и его ацильные производные.
32. Соединение по п.1, которое выбирают в соответствии со следующими определениями:



X5 представляет H и R2 представляет Me.
33. Соединение (4b) по п.1 формулы
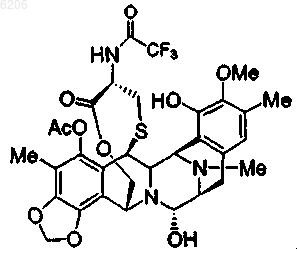
34. Соединение (4h) по п.1 формулы

35. Соединение (4p) по п.1 формулы
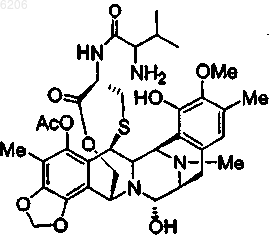
36. Фармацевтическая композиция, содержащая соединение по любому из предшествующих пунктов вместе с фармацевтически приемлемым носителем или разбавителем.
37. Применение соединения по любому из пп.1-35 при получении фармацевтической композиции для лечения опухолей.
38. Применение по п.37, где лечение опухолей осуществляют в комбинации с другим лекарством.
Текст
006206 Настоящее изобретение относится к противоопухолевым производным эктейнасцидина. Предпосылки изобретения Эктейнасцидины являются чрезвычайно сильными противоопухолевыми агентами, выделенными из морского оболочника Ecteinascidia turbinata. О нескольких эктейнасцидинах сообщалось раньше в патентной и научной литературе. В патенте США 5256663 описаны фармацевтические композиции, включающие вещество, выделенное из тропического морского беспозвоночного Ecteinascidia turbinata, и именуемые в нем как эктейнасцидины, а также использование таких композиций в качестве антибактериальных, антивирусных и/или противоопухолевых агентов для млекопитающих. В патенте США 5089273 описаны новые композиции вещества, выделенного из тропического морского беспозвоночного Ecteinascidia turbinata, и именуемые в нем как эктейнасцидины 729, 743, 745,759 А, 759 В и 770. Эти соединения оказались пригодными для млекопитающих в качестве антибактериальных и/или противоопухолевых агентов. В патенте США 5478932 описаны эктейнасцидины, выделенные из оболочника Ecteinascidia turbinata, обитающего в Карибском море, которые in vivo защищают от лимфомы Р 388, меланомы В 16, саркомы М 5076 яичника, Льюисовского рака легкого, а также от ксенотрансплантатов карциномы LX-1 легкого человека и карциномы МХ-1 молочной железы человека. В патенте США 5654426 описано несколько эктейнасцидинов, выделенных из оболочника Ecteinascidia turbinata, обитающего в Карибском море, которые in vivo защищают от лимфомы Р 388, меланомы В 16, саркомы М 5076 яичника, Льюисовского рака легкого, а также от ксенотрансплантатов карциномы LX-1 легкого человека и карциномы МХ-1 молочной железы человека. В патенте США 5721362 описан синтетический способ получения эктейнасцидиновых соединений и родственных структур.WO 00/69862, на основании которой настоящая заявка заявляет приоритет, описывает синтез эктейнасцидиновых соединений из цианосафрацина В. Интересующегося читателя отсылаем также к Corey, E.J., J. Am. Chem. Soc, 1996, 118 pp. 9202-9203;Sources" (Физиологически активные соединения из водных и наземных источников), vol. 53, pp. 771-792;Rinehart et al., Pure and Appl. Chem., 1990, "Biologically active natural products" (Биологически активные природные вещества), vol. 62, pp. 1277-1280; Rinehart, et al., J. Org. Chem., 1990, "Ecteinascidins 729, 743,745, 759A, 759 В и 770: Potent Antitumour Agents from the Caribbean Tunicate Ecteinascidia turbinata " (Эктейнасцидины 729, 743, 745, 759A, 759 В, и 770: Сильные противоопухолевые агенты из оболочника Ecteinascidia turbinata, обитающего в Карибском море), vol. 55, pp. 4513-4515; Wright et al., J. Org. Chem.,1990 " Antitumour Tetrahydroisoquinoline Alkaloids from the Colonial Ascidian Ecteinascidia turbinata" (Противоопухолевые тетрагидроизохинолиновые алкалоиды из образующих колонии асцидий Ecteinascidiaturbinata), vol. 55, pp. 4508-4512; Sakai et al., Proc. Natl. Acad. Sci. USA, 1992, "Additional antitumour ecteinascidins from a Caribbean tunicate: Crystal structures and activities in vivo" (Дополнительные противоопухолевые эктейнасцидины из оболочника, обитающего в Карибском море: Кристаллические структуры и активности in vivo), vol. 89, 11456-11460; Science 1994, "Chemical Prospectors Scour the Seas for PromisingDrugs" (Химические изыскания в морях перспективных лекарственных средств), vol. 266, pp. 1324; Koenig, K.E.," Asymmetric Synthesis" (Асимметрический синтез), ed. Morrison, Academic Press, Inc., Orlando,FL, vol. 5, 1985, p. 71; Barton, et al., J. Chem. Soc. Perkin Trans., 1, 1982, "Synthesis and Properties of a Seriesof Sterically Hindered Guanidine Bases" (Синтез и Свойства ряда стерически блокированных оснований гуанидина), pp. 2085; Fukuyama et al., J. Am. Chem. Soc, 1982, "Stereocontrolled Total Synthesis of (+)Saframycin B" (стереоконтролируемый полный синтез (+)-сафрамицина В), vol. 104, pp. 4957; FukuyamaLactam Intermediate to Saframycin А" (Синтез сафрамицинов. Получение ключевого трициклического лактамного промежуточного соединения сафрамицина A), vol. 54, 5391; Still, et al., J. Org. Chem., 1978,"Rapid Chromatographic Technique for Preparative Separations with . Moderate Resolution" (быстрый хроматографический метод препаративного разделения с удовлетворительным разрешением), vol. 43, р. 2923;(Масс-спектрометрия в биологии), 233-258 eds. Burlingame et al., Elsevier Amsterdam (1990); Guan et al.,Jour. Biomolec. StructDynam., vol. 10, pp. 793-817 (1993); Nakagawa et al., J. Amer. Chem. Soc, 111:27212722 (1989); Lichter et al., "Food and Drugs from the Sea Proceedings" (Продукты питания и лекарственные средства морского происхождения) (1972), Marine Technology Society, Washington, D.С.1973, 117-127;I.Manzanares et al., Org. Lett., 2000, 2(16), 2545-2548. Наиболее перспективным эктейнасцидином является эктейнасцидин 743, с помощью которого предпринимаются попытки клинического лечения злокачественных опухолей. Et 743 обладает сложной трис(тетрагидроизохинолинфенольной) структурой следующей формулы (I): В настоящее время его получают путем выделения из экстрактов морского оболочника Ecteinascidiaturbinata. Его выход низкий, поэтому пытаются найти альтернативные способы препаративного получения. Эктейнасцидины включают конденсированную систему из пяти циклов (А)-(Е), как показано в нижеследующей структурной формуле (XIV): У эктейнасцидина 743 1,4-мостик имеет следующую структурную формулу (IV); Другие известные эктейнасцидины включают соединения с различными мостиковыми циклическими кольцевыми системами, такими, которые встречаются у эктейнасцидина 722 и 736, где их мостик обладает следующей структурной формулой (V): У эктейнасцидинов 583 и 597, у которых данный мостик обладает следующей структурной формулой (VI):-2 006206 а также у эктейнасцидина 594 и 596, у которых данный мостик обладает следующей структурной формулой (VII): Соответствующая структура этих и родственных соединений полностью приведена в J. Am. Chem.Soc. (1996) 118, 9017-9023. Известны еще соединения в виде системы из пяти конденсированных колец. В большинстве случаев у них отсутствует мостиковая циклическая кольцевая система, которая присутствует у указанных эктейнасцидинов. Они включают бис(тетрагидроизохинолинхиноновые) противоопухолевыепротивомикробные антибиотики сафрацины и сафрамицины, а также морские природные вещества рениерамицины и ксестомицин, выделенные из культивируемых бактерий или губок. Все они обладают обычной димерной тетрагидроизохинолиновой углеродной структурой. Такие соединения можно разделить на четыре типа, типы I-IV, по характеру окисления ароматических колец. Тип I димерных изохинолинхинонов, представляющий собой систему формулы (VIII), чаще всего встречающийся в данном классе соединений, см. в нижеследующей табл. 1. Таблица 1. Структура антибиотиков сафрамицина типа I обозначения являются взаимозаменяемыми где данная группа Q представлена формулой (IX) Тип I ароматических колец наблюдается у сафрамицинов А, В и С; G и Н; и S, выделенном изYd2 получены с помощью S. lavendulae в результате направленного биосинтеза с соответствующими добавками в культуральную среду. Димеры сафрамицинов Y2b и Y2b-d, образующиеся путем связывания азота на С-25 одного фрагмента с азотом С-14 другого фрагмента, получают также в культуральной среде с добавками для S. lavendulae. Сафрамицины AR1 (=AH2) , бактериально восстановленный продукт по С-25 сафрамицина А, продуцируемого Rhodococcus amidophilus, получают также путем нестереоселективного химического восстановления сафрамицина А боргидридом натрия в виде смеси 1:1 эпимеров с последующим хроматографическим разделением (второй изомер AH1 является менее полярным). Следующий продукт восстановления, сафрамицин AR3, 21-дециано-25-дигидросафрамицин А (=25 дигидросафрамицин В), получают с помощью такого же бактериального превращения. Другой тип бактериального превращения сафрамицина А, с использованием видов Nocardia, дает сафрамицин В, а последующим восстановлением с помощью вида Mycobacterium получают сафрамицин АН 1Aс. Для биологических исследований химически получают также 25-O-ацетаты сафрамицина АН 2 и AH1. Из морских губок также выделяют соединения типа I формулы (X), см. табл. 2. Таблица 2. Структура соединений типа I из морских губок Рениерамицины A-D, вместе с биогенетически родственными мономерными изохинолинами рениерона и родственными соединениями, выделяют из противомикробных экстрактов губок вида Reniera,собранных в Мексике. Вначале структуру рениерамицина А определили с инвертированной стереохимией по С-3, С-11 и С-13. Однако тщательное исследование 1 Н-ЯМР данных новых, родственных соединений, рениерамицинов Е и F, выделенных из таких же губок, собранных на островах Палау, показало, что соединение колец рениерамицинов идентично таковому у сафрамицинов. Данный результат подвел к заключению о том, что ранее установленная стереохимия рениерамицинов A-D должна быть такой же,как и у сафрамицинов. Ксестомицин обнаружен в губках вида Xestospongia, собранных в водах Шри-Ланки. Соединения типа II формулы (XI) с восстановленным гидрохиноновым кольцом включают сафрамицины D и F, выделяемые из S. lavendulae, и сафрамицины Мх-1 и Мх-2, выделяемые из Myxococcus Скелет соединений тип III обнаруживается у антибиотиков сафрацинов А и В, выделяемых из культивируемого микроорганизма Pseudomonas fluorescens. Эти антибиотики формулы (XII) состоят из тетрагидроизохинолинхиноновой субъединицы и тетрагидроизохинолинфенольной субъединицы. где R21 представляет собой -Н у сафрацина А и -ОН у сафрацина В. Сафрамицин R, единственное соединение, отнесенное к скелету тип IV, было также выделено из S.lavendulae. Данное соединение формулы (XIII), состоящее из гидрохинонового кольца с гликолевой сложноэфирной боковой цепью по одному из фенольных кислородов, является предположительно пролекарством сафрамицина А из-за его умеренной токсичности. Данные известные соединения включают конденсированную систему из пяти колец формулы (XIV) В данном тексте представленную кольцевую структуру называют конденсированной системой эктейнасцидина из пяти колец, хотя следует иметь в виду, что кольца А и Е являются в данных эктейнасцидинах и некоторых других соединениях фенольными, хотя в других соединениях, особенно в указанных сафрамицинах, кольца А и Е являются хинольными. В данных соединениях кольца В и D являются тетрагидро, тогда как кольцо С является пергидро.-5 006206 Краткое изложение существа изобретения Настоящее изобретение предлагает соединения, имеющие конденсированную систему эктейнасцидина из пяти колец, и родственные эктейнасцидинам 583 и 597. У эктейнасцидинов 583 и 597 1,4-мостик имеет структуру формулы (VIa) Некоторые соединения настоящего изобретения имеют конденсированную систему из пяти колец эктейнасцидинов и мостик структуры формулы (VIa) с необязательными производными по -NH2-группе. Данные соединения могут ацилироваться по -CHNH2-группе, представленной в формуле (VI). К другим производным соединениям настоящего изобретения относят те, в которых данная -CHNH2-группа заменена группой -CHNHX1 или -С(Х 2)2-, в которой Х 1 или Х 2 определены как указано. Остальные заместители в данной конденсированной системе эктейнасцидина из пяти колец могут быть такими же, что и в природных соединениях, особенно в природных эктейнасцидинах, или отличаться. Другие соединения настоящего изобретения имеют конденсированную систему эктейнасцидина из пяти колец и мостик структуры формулы (VIb), в которой группа -NH2 мостика заменена группой -ОН,которая может быть необязательно превращена в ее производные. Данные соединения могут ацилироваться по группе -СНОН-, присутствующей в формуле (VIb). Другие производные соединения настоящего изобретения включают производные, в которых данная группа -СНОН- заменена группой -CHOX1 или-С(Х 2)2-, где X1 или Х 2 определены как указано. Остальные заместители в данной конденсированной системе эктейнасцидина из пяти колец могут быть такими же, что и в природных соединениях, особенно в природных эктейнасцидинах, или отличаться. В соединениях настоящего изобретения стереохимия основного мостикового углеродного атома,несущего группу -ОН или NH2 (или замещенные их производные), может быть такой же, как и в природных соединениях, особенно в природных эктейнасцидинах, или отличаться. В соединениях настоящего изобретения конденсированная система из пяти колец (А)-(Е) формулы(XIV) может быть такой же, как у эктейнасцидинов, или такой же, как у других родственных соединений. Так, кольца А и Е могут быть фенольными или хинольными; кольца В и D могут быть тетрагидро, а кольцо С может быть пергидро. Соединения настоящего изобретения проявляют противоопухолевую активность и настоящее изобретение предлагает фармацевтические композиции данных соединений наряду со способами получения данных композиций и способами лечения с использованием данных соединений или композиций. Настоящее изобретение предлагает также новые полусинтетические и синтетические способы получения соединений настоящего изобретения. Предпочтительные варианты осуществления настоящего изобретения Конденсированная система из пяти колец (А)-(Е) формулы (XIV) предпочтительно может быть такой же, как у эктейнасцидинов, и предпочтительно замещенной по другим положениям, отличным от 1,4,природными заместителями. В соответствии с первым аспектом настоящее изобретение предлагает новые соединения формулы в которой группы заместителей, обозначенные как R1, R2, каждая, независимо выбраны из Н, C(=O)R', замещенного или незамещенного C1-C18 алкила, замещенного или незамещенного С 2-C18 алкенила, замещенного или незамещенного С 2-С 18 алкинила, замещенного или незамещенного арила; каждая из R-групп независимо выбрана из группы, состоящей из Н, ОН, NO2, NH2, SH, CN, галогена, =O, C(=O)H,С(=О)СН 3, СО 2 Н, замещенного или незамещенного C1-C18 алкила, замещенного или незамещенного С 2 С 18 алкенила, замещенного или незамещенного С 2-С 18 алкинила, замещенного или незамещенного арила; Х 2 представляет OX1 или N(X1)2, где все или каждый X1 представляет Н, C(=O)R', замещенный или незамещенный C1-C18 алкил, замещенный или незамещенный С 2-С 18 алкенил, замещенный или незаме-6 006206 щенный С 2-С 18 алкинил, замещенный или незамещенный арил, или две X1-группы вместе могут образовывать циклический заместитель на атоме азота; Х 3 выбран из OR1, CN, (=O) или Н; Х 4 представляет -Н или C1-C18 алкил; а Х 5 выбран из Н, ОН, или -OR1 (в котором OR1 является таким, как определено выше). В соответствующем аспекте настоящее изобретение предлагает соединения формулы где группы заместителей, определенные как R1, R2, Х 3, Х 4 и Х 5, являются такими, как определено выше; a 1 независимо выбран из Н, C(=O)R', замещенного или незамещенного C1-C18 алкила, замещенного или незамещенного C2-C18 алкенила, замещенного или незамещенного С 2-С 18 алкинила, замещенного или незамещенного арила, или две X1-группы вместе, могут образовывать циклический заместитель на атоме азота. Алкильные группы содержат предпочтительно от примерно 1 до 12 углеродных атомов, более предпочтительно от 1 до примерно 8 углеродных атомов, еще более предпочтительно от 1 до примерно 6 углеродных атомов и наиболее предпочтительно 1, 2, 3 или 4 углеродных атома. Метил, этил и пропил, в том числе изопропил, в соединениях настоящего изобретения представляют собой особенно предпочтительные алкильные группы. Используемый в данном описании термин алкил, если не оговорено иначе,относится и к циклическим и нециклическим группам, хотя циклические группы должны включать по меньшей мере три углеродных атома кольца. Данные алкильные группы могут быть неразветвленными и разветвленными. Предпочтительные алкенильные и алкинильные группы в соединениях настоящего изобретения содержат одну или несколько ненасыщенных связей и от 2 до примерно 12 углеродных атомов, более предпочтительно от 2 до примерно 8 углеродных атомов, еще более предпочтительно от 2 до примерно 6 углеродных атомов и наиболее предпочтительно 2, 3 или 4 углеродных атома. Термины алкенил и алкинил, используемые в данном описании, относятся и к циклическим и нециклическим группам, хотя неразветвленные или разветвленные нециклические группы обычно являются более предпочтительными. Предпочтительные алкоксигруппы в соединениях настоящего изобретения включают группы, содержащие одну или несколько кислородных связей и от 1 до примерно 12 углеродных атомов, более предпочтительно от 1 до примерно 8 углеродных атомов, еще более предпочтительно от 1 до примерно 6 углеродных атомов, но наиболее предпочтительно 1, 2, 3 или 4 углеродных атома. Предпочтительные алкилтиогруппы в соединениях настоящего изобретения содержат одну или несколько простых тиоэфирных связей и от 1 до примерно 12 углеродных атомов, более предпочтительно от 1 до примерно 8 углеродных атомов, еще более предпочтительно от 1 до примерно 6 углеродных атомов. Алкилтиогруппы, содержащие 1, 2, 3 или 4 углеродных атома, являются особенно предпочтительными. Предпочтительные алкилсульфинильные группы в соединениях настоящего изобретения включают группы, содержащие одну или несколько сульфоксидных (SO) групп и от 1 до примерно 12 углеродных атомов, более предпочтительно от 1 до примерно 8 углеродных атомов, еще более предпочтительно от 1 до примерно 6 углеродных атомов. Алкилсульфинильные группы, содержащие 1, 2, 3 или 4 углеродных атома, представляются особенно предпочтительными. Предпочтительные алкилсульфонильные группы в соединениях настоящего изобретения включают группы, содержащие одну или несколько сульфонильных (SO2) групп и от 1 до примерно 12 углеродных атомов, более предпочтительно от 1 до примерно 8 углеродных атомов, еще более предпочтительно от 1 до примерно 6 углеродных атомов. Алкилсульфонильные группы, содержащие 1, 2, 3 или 4 углеродных атома, являются особенно предпочтительными. Предпочтительные аминоалкильные группы включают группы, содержащие одну или несколько первичных, вторичных и/или третичных аминогрупп и от 1 до примерно 12 углеродных атомов, более предпочтительно от 1 до примерно 8 углеродных атомов, еще более предпочтительно от 1 до примерно 6 углеродных атомов и наиболее предпочтительно 1, 2, 3 или 4 углеродных атома. Вторичная и третичная аминогруппы, как правило, более предпочтительны, чем первичные аминосоставляющие. Соответствующие гетероароматические группы в соединениях настоящего изобретения содержат один, два или три гетероатома, выбранных из атомов N, О или S, и включают, например, кумаринил, в том числе, 8-кумаринил, хинолинил, в том числе, 8-хинолинил, пиридил, пиразинил, пиримидил, фурил,пирролил, тиенил, тиазолил, оксазолил, имидазолил, индолил, бензофуранил и бензотиазолил. Соответствующие гетероалициклические группы в соединениях настоящего изобретения содержат один, два или-7 006206 три гетероатома, выбранных из атомов N, О или S, и включают, например, тетрагидрофуранильную, тетрагидропиранильную, пиперидинильную, морфолино- и пирролидинильную группы. Соответствующие карбоциклические арильные группы в соединениях настоящего изобретения включают соединения с одним и с несколькими кольцами, в том числе, соединения с несколькими кольцами, которые содержат отдельные и/или конденсированные арильные группы. Типичные карбоциклические арильные группы содержат 1-3 раздельных или конденсированных циклов и примерно 6-18 углеродных атомов кольца. Наиболее предпочтительные карбоциклические группы включают фенил, в том числе, замещенный фенил, такой как 2-замещенный фенил, 3-замещенный фенил, 2,3-замещенный фенил, 2,5-замещенный фенил, 2,3,5-замещенный и 2,4,5-замещенный фенил, в том числе и тогда, когда один или несколько фенильных заместителей представляют электроноакцепторную группу, такую как галоген, циано, нитро, алканоил, сульфинил, сульфонил и им подобные; нафтил, в том числе, 1-нафтил и 2-нафтил; бифенил; фенантрил; и антрацил. Группы заместителей, представленные R1, R2, X1, X4 и X5, каждая независимо, выбраны из группы,состоящей из Н, ОН, OR', SH, SR', SOR', SO2R' , NO2, NH2, NHR', N(R')2, NHC(O)R', CN, галогена, =O,замещенного или незамещенного C1-C18 алкила, замещенного или незамещенного С 2-С 18 алкенила, замещенного или незамещенного С 2-С 18 алкинила, замещенного или незамещенного арила, замещенной или незамещенной гетероароматической группы. Приведенные в данном описании ссылки на замещенные R'-группы в соединениях настоящего изобретения относятся к конкретному фрагменту, который можно заместить по одному или нескольким доступным положениям одной или несколькими подходящими группами, например галогеном, таким как фтор, хлор, бром и иод; циано; гидроксилом; нитро, азидо; алканоилом, таким как C1-6 алканоильная группа, такая как ацил и им подобные; карбоксамидо; алкильными группами, в том числе, группами, содержащими от 1 до примерно 12 углеродных атомов или от 1 до примерно 6 углеродных атомов, но более предпочтительно 1-3 углеродных атома; алкенильными и алкинильными группами, в том числе,группами, содержащими одну или несколько ненасыщенных связей и от 2 до примерно 12 углеродных атомов или от 2 до примерно 6 углеродных атомов; алкоксигруппами, содержащими одну или несколько кислородных связей и от 1 до примерно 12 углеродных атомов или от 1 до примерно 6 углеродных атомов; арилоксигруппами, такими как фенокси; алкилтиогруппами, в том числе, группами, содержащими одну или несколько простых тиоэфирных связей и от 1 до примерно 12 углеродных атомов или от 1 до примерно 6 углеродных атомов; алкилсульфинильными группами, в том числе, группами, содержащими одну или несколько сульфинильных связей и от 1 до примерно 12 углеродных атомов или от 1 до примерно 6 углеродных атомов; алкилсульфонильными группами, в том числе, группами, содержащими одну или несколько сульфонильных связей и от 1 до примерно 12 углеродных атомов или от 1 до примерно 6 углеродных атомов; аминоалкильными группами, такими как группы, содержащие один или несколько атомов N и от 1 до примерно 12 углеродных атомов или от 1 до примерно 6 углеродных атомов; карбоциклическими арильными группами, содержащими 6 и более углеродов, в частности, фенильной (например, R, представляющей замещенную или незамещенную бифенильную группу); и аралкильной группой,такой как бензильная.R1 предпочтительно представляет C(=O)R', где R' подходяще представляет Н или замещенный или незамещенный алкил, более предпочтительно ацетил.R2 предпочтительно представляет Н или метил, более предпочтительно метил. Обычно один из X1 или Х 2 представляет водород. Х 2, или же когда допускается X1, предпочтительно представляет Н; -NHCO-алкил, где предпочтительно алкил содержит вплоть до 16 углеродных атомов,например 1, 4, 7, 15 углеродных атомов, и может быть галогензамещенным, необязательно пергалогензамещенным; -NНалкилСООН, особенно в тех случаях, когда алкил содержит вплоть до 4 углеродных атомов; защищенный -NHCOCH(NH2)CH2SH, где NH2 и/или SH защищены; -NНбиотин; -NHарил; -NH(aa)y,где аа представляет аминокислотный ацил, а у равен, подходяще, 1, 2 или 3 и где любая NH2 группа необязательно является превращенной в ее производное или защищенной, например, амидной концевой группой или Вос-группой; фталимидо, образованной -NX2-; алкил, предпочтительно содержащий 1-4 углеродных атома; арилалкенил, особенно циннамоил, который может быть замещенным, например, 3 трифторметилом. Предпочтительные примеры группы Х 2 включаютCH2SFm, Npht, вместе с аналогичными группами, в которых изменено число углеродных атомов или заменена аминокислота, или осуществлено иное изменение подобного рода, что дает аналогичную группу.-8 006206 Другие предпочтительные примеры группы Х 2 включают ОН, ОАс, OCOCF3, ОСОСН 2 СН 2 СН 3,OСO(СН 2)6 СН 3, ОСО(СН 2)14 СН 3, ОСОСН=СНРh, ОSО 2 СН 3 вместе с аналогичными группами, в которых изменено число углеродных атомов или введены различные группы заместителей, или осуществлено иное изменение подобного рода, что дает аналогичную группу. Х 3 представляет предпочтительно ОН или CN. Х 4 представляет Н или Me, предпочтительно Me. Х 5 представляет Н или C1-18 алкил, предпочтительно Н. И еще, в более общем аспекте настоящего соединения данные соединения представлены обычно формулой (XVIIа) где R1 и R4 вместе образуют группу формулы (VIa) или (VIb)R7 представляет -ОСН 3, a R8 представляет -ОН, или же R7 и R8 вместе образуют группу -О-СН 2-О-;R14a и R14b оба представляют -Н или один представляет -Н, а другой представляет -ОН, -ОСН 3 илиR21 представляет -Н, -ОН или CN; и производные, включая их ацильные производные, особенно, в тех случаях, когда R5 представляет ацетилокси- или другую ацилоксигруппу, содержащую вплоть до 4 углеродных атомов, а также включая производные, где группа -NCH3- по положению 12 заменена на -NH- или -NCH2CH3-, и производные, где группа -NH2 в соединении формулы (VIa) и группа -ОН в соединении формулы (VIb) необязательно переводятся в их производные. Группа R1 с R4 могут быть ацилированы по группе -CHNH2- или -СНОН-, представленной в формулах(VIa и VIb). Другие производные соединения настоящего изобретения включают производные, в которых группа -CHNH2 в формуле VIa заменена на группу -CHNHX1 или -С(Х 2)2-, или в которых группа -СНОН в формуле VIb заменена на CHOX1 или на -С(Х 2)2-, в которых X1 или Х 2 определены как указано. Предпочтительные соединения представляют собой соединения формулы (XVIIb). Кроме того, в предпочтительных соединениях настоящего изобретения R7 и R8 вместе образуют группу -О-СН 2-О-. Ацильные производные могут представлять собой N-ацильные или N-тиоацильные производные, а также циклические амиды. Данные ацильные группы иллюстративно могут представлять собой алканоильную, галогеналканоильную, арилалканоильную, алкеноильную, гетероциклилацильную, ароильную,арилароильную, галогенароильную, нитроароильную или другие ацильные группы. Данные ацильные группы могут быть представлены формулой -CO-Ra, в которой Ra может представлять различные группы, такие как алкильная, алкокси, алкиленовая, арилалкильная, арилалкиленовая, аминокислотная-9 006206 ацильная или гетероциклильная, каждая из которых необязательно замещена галогеном, циано, нитро,карбоксиалкилом, алкокси, арилом, арилокси, гетероциклилом, гетероциклилокси, алкилом, аминогруппой или замещенной аминогруппой. Другие ацилирующие агенты включают изотиоцианаты, такие как арильные изотиоцианаты, в частности фенилизоцианат. Алкильная, алкокси или алкиленовая группы Ra,соответственно имеющие 1-6 или 12 углеродных атомов, могут быть неразветвленными, разветвленными или циклическими. Арильные группы обычно представлены фенилом, бифенилом или нафтилом. Гетероциклические группы могут быть ароматическими, частично или полностью ненасыщенными и соответственно имеющие 4-8 атомов в кольце, более предпочтительно 5 или 6 атомов в кольце, с одним или несколькими гетероатомами, выбранными из азота, серы и кислорода. Вообще, обычные Ra-группы включают алкил, галогеналкил, алкоксиалкил, галогеналкоксиалкил,арилалкилен, галогеналкиларилалкилен, ацил, галогенацил, арилалкил, алкенил и аминокислоту. Например, Ra-CO- может представлять собой ацетильную, трифторацетильную, 2,2,2-трихлорэтоксикарбонильную, изовалерилкарбонильную, транс-3-(трифторметил)циннамоилкарбонильную, гептафторбутирилкарбонильную, деканоилкарбонильную, транс-циннамоилкарбонильную, бутирилкарбонильную, 3-хлорпропионилкарбонильную, циннамоилкарбонильную, 4-метилциннамоилкарбонильную,гидроциннамоилкарбонильную или транс-гексеноилкарбонильную, или аланильную, аргинильную, аспартильную, аспарагильную, цистильную, глутамильную, глутаминильную, глицильную, гистидильную,гидроксипролильную, изолейцильную, лейцильную, лизильную, метионильную, фенилаланильную, пролильную, серильную, треонильную, тиронильную, триптофильную, тирозильную, валильную, а также иные менее обычные аминокислотные ацильные группы, а также фталимидо и другие циклические амиды. Другие примеры можно найти среди перечисленных защитных групп. Соединения, в которых -CO-Ra получена из аминокислоты и включает аминогруппу, могут сами образовать ацильные производные. Подходящие N-ацильные группы включают дипептиды, которые, в свою очередь, образуют N-ацильные производные.R1 предпочтительно представляет водород. О-ацильные производные соответственно представляют алифатические О-ацильные производные, особенно ацильные производные с 1-4 углеродными атомами,и обычно О-ацетильную группу, особенно в положении 5. Подходящие защитные группы для фенолов и гидроксигрупп включают простые эфиры и сложные эфиры, такие как алкиловый, алкоксиалкиловый, арилоксиалкиловый, алкоксиалкоксиалкиловый, алкилсилилалкоксиалкиловый, алкилтиоалкиловый, арилтиоалкиловый, азидоалкиловый, цианоалкиловый,хлоралкиловый, гетероциклиловый, арилациловый, галогенарилациловый, циклоалкилалкиловый, алкениловый, циклоалкиловый, алкиларилалкиловый, алкоксиарилалкиловый, нитроарилалкиловый, галогенарилалкиловый, алкиламинокарбониларилалкиловый, алкилсульфиниларилалкиловый, алкилсилиловый и другие простые эфиры, а также арилациловый, арилалкилкарбонатный, алифатический карбонатный,алкилсульфиниларилалкилкарбонатный, алкилкарбонатный, арилгалогеналкилкарбонатный, арилалкенилкарбонатный, арилкарбаминатный, алкилфосфиниловый, алкилфосфинотиоиловый, арилфосфинотиоиловый, арилалкилсульфонатный и другие сложные фиры. Такие группы могут быть необязательно замещены определенными выше группами в R1. Подходящие защитные группы для аминов включают карбаматы, амиды и другие защитные группы, такие как алкил, арилалкил, сульфо- или галогенарилалкил, галогеналкил, алкилсилилалкил, арилалкил, циклоалкилалкил, алкиларилалкил, гетероциклилалкил, нитроарилалкил, ациламиноалкил, нитроарилдитиоарилалкил, дициклоалкилкарбоксиамидоалкил, циклоалкил, алкенил, арилалкенил, нитроарилалкенил, гетероциклилалкенил, гетероциклил, гидроксигетероциклил, алкилтио, алкокси- или галогенили алкилсульфиниларилалкил, гетероциклилацил, и другие карбаматы, а также алканоил, галогеналканоил, арилалканоил, алкеноил, гетероциклилацил, ароил, арилароил, галогенароил, нитроароил и другие амиды, и кроме того, алкил, алкенил, алкилсилилалкоксиалкил, алкоксиалкил, цианоалкил, гетероциклил, алкоксиарилалкил, циклоалкил, нитроарил, арилалкил, алкокси- или гидроксиарилалкил, и многие другие группы. Такие группы могут быть необязательно замещены определенными выше группами в R1. Примеры таких защитных групп представлены в нижеследующих таблицах. Защита для группы ОН Простые эфиры Сокращение Метил МетоксиметилSEM Метилтиометил МТМ Фенилтиометил РТМ Азидометил Цианометил 2,2-дихлор-1,1-дифторэтил 2-хлорэтил 2-бромэтил- 10006206 Тетрагидропиранил 1-этоксиэтил Фенацил 4-бромфенацил Циклопропилметил Аллил Пропаргил Изопропил Циклогексил Трет-бутил Бензил 2,6-Диметилбензил 4-Метоксибензил о-Нитробензил 2,6-Дихлорбензил 3,4-Дихлорбензил 4-(диметиламино)карбонилбензил 4-Метилсульфинилбензил 9-Антрилметил 4-Пиколил Гептафтор-п-толил Тетрафтор-4-пиридил Триметилсилил трет-Бутилдиметилсилил трет-Бутилдифенилсилил Триизопропилсилил Сложные эфиры Арилформиат Арилацетат Ариллевулинат Арилпивалоат Арилбензоат Арил-9-фторкарбоксилат Арилметилкарбонат 1-адамантилкарбонат трет-Бутилкарбонат 4-Метилсульфинилбензилкарбонат 2,4-Диметилпент-3-илкарбонат Арил-2,2,2-трихлорэтилкарбонат Арилвинилкарбонат Арилбензилкарбонат Арилкарбамат Диметилфосфинил Диметилфосфинотиоил Дифенилфосфинотиоил Арилметансульфонат Арилтолуолсульфонат Арил-2-формилбензолсульфонат Защита для группы -NH2 Карбаматы Метил Этил 9-Флуоренилметил 9-(2-Сульфо)флуоренилметил 9-(2,7-Дибром)флуоренилметил 17-Тетрабензо[а,с,g,i]флуоренилметил 2-Хлор-3-инденилметил Бенз[f]инден-3-илметил 2,7-ди-трет-бутил[9-(10,10-диоксо-10,10,10,10 Тетрагидротиоксантил)]метил 2,2,2-ТрихлорэтилN-Фениламинотиокарбонил Амиды Формамид Ацетамид Хлорацетамид Трифторацетамид Фенилацетамид 3-Фенилпропанамид Пент-4-енамид Пиколинамид 3-Пиридилкарбоксамид Бензамид п-ФенилбензамидBSB Специальные защитные группы -NHTs Бензолсульфонамид Предпочтительный класс соединений настоящего изобретения включает соединения формулы(XVIIb), которые отвечают одному или нескольким, предпочтительно всем нижеследующим условиям: аминогруппа в группе формулы (VIa) превращена в производную группу; гидроксигруппа в группе формулы (VIb) превращена в производную группу;R7 и R8 вместе образуют группу -О-СН 2-О-;R21 представляет -ОН или -CN. Специфические эктейнасцидиновые продукты настоящего изобретения включают соединения формулы (XVIII) где R1 и R4 образуют группу формулы (VIa и VIb)R21 представляет -Н, -ОН или -CN, более предпочтительно -ОН или -CN; и его ацильные производные, точнее 5-ацильные производные, в том числе, 5-ацетильное производное, и в которых группа -NH2 в структуре формулы (VIa) и группа -ОН в структуре формулы (VIb) необязательно превращены в их производные. Соединения настоящего изобретения, особенно с одной из двух групп X1, могут быть получены синтезом из промежуточного соединения (47), описанного в патенте США 5721362, или из аналогичного соединения. Таким образом, настоящее изобретение предлагает способ, который включает превращение аминогруппы 1,4-мостика, в соответствии со следующей схемой реакции: где X1 является таким, как определено выше, а другие группы заместителей в данной молекуле могут быть защищены или превращены в их производные по желанию или соответствующим образом. Соединения настоящего изобретения, особенно с группами Х 2, представляющими -OХ 2, могут быть получены из промежуточного соединения (15), описанного в патенте США 5721362, или из аналогичного соединения. Таким образом, настоящее изобретение предлагает способ, который включает превращение 1,4-мостиковой оксогруппы в ее производное в соответствии со следующей схемой реакции: где X1 представляет группу, как указано выше, а другие группы заместителей в данной молекуле могут быть защищены или преобразованы в свои производные по желанию или соответствующим образом. Данная реакция может протекать с образованием заместителя -OX1, в котором X1 представляет водород,а затем с превращением в соединение, в котором X1 представляет другую группу. Очевидно, что соединения настоящего изобретения можно также получить путем модификации стадий синтеза, используемых в патенте США 5721362. Поэтому, например, различные реакционные группы могут быть введены по функциональным положениям, например, по положениям 5- или 18-. В настоящем изобретении разработан более общий способ получения соединений настоящего изобретения, и он был впервые раскрыт в WO 00/69862, включенной в данное описание во всей своей полноте путем ссылки и на основании которой испрашивается приоритет. Типичный процесс в указанной WO-заявке затрагивает способ получения соединения с конденсированной кольцевой структурой формулы (XIV) который включает одну или несколько реакций, исходя из 21-цианосоединения формулы (XVI) где R1 представляет амидометиленовую группу или ацилоксиметиленовую группу;R5 и R8 независимо выбраны из -Н, -ОН или ОСОСН 2 ОН, или же R5 и R8 оба представляют кетогруппу, а кольцо А представляет п-бензохиноновое кольцо;R14a и R14b оба представляют -Н или один представляет -Н, а другой представляет -ОН, -ОСН 3 или ОСН 2 СН 3, или же R14a и R14b вместе образуют кетогруппу; аR15 и R18 независимо выбраны из -Н или -ОН, или же R15 и R18 оба представляют кетогруппу, а кольцо А представляет п-бензохиноновое кольцо. В частности, такой способ может обеспечить способ получения исходных веществ для реакций Схем I и II, наряду с родственными соединениями. Противоопухолевая активность данных соединений охватывает лейкозы, рак легкого, рак толстой кишки, рак почек, рак предстательной железы, рак яичника, рак молочной железы, саркомы и меланомы. Другой особенно предпочтительный вариант осуществления настоящего изобретения представляет фармацевтические композиции, пригодные в качестве противоопухолевых агентов, которые содержат в качестве активного ингредиента соединение или соединения настоящего изобретения, а также способы их получения. Примеры фармацевтических композиций включают любые твердые (таблетки, пилюли, капсулы,гранулы и т.п.) или жидкие (растворы, суспензии или эмульсии) композиции соответствующего состава для перорального, местного или парентерального введения. Введение соединений или композиций настоящего изобретения можно осуществить любым подходящим способом, таким как внутривенная инфузия, пероральным способом, внутрибрюшинным или внутривенным способом. Во избежание сомнения, стереохимия, представленная в данном патентном описании, основывается на корректной стереохимии природных продуктов. По мере обнаружения ошибок в указанной стереохимии необходимо осуществлять соответствующие исправления в формулах, приведенных в данном описании. Кроме того, по мере модификации синтезов настоящее изобретение распространяется и на стереоизомеры. Подробное описание предпочтительных способов Соединения настоящего изобретения могут быть получены путем синтеза из промежуточных соединений 47 и 15, описанных в патенте США 5721362, соединения 36, описанного в WO 00/69862, и из вторичных продуктов (пронумерованных как 23 и 24), полученных на некоторых стадиях снятия защиты из соединения 33 из WO 00/69862 с использованием АlСl3. Соединение (1) соответствует синтезированному промежуточному соединению 47, описанному в патенте США 5721362. Соединения 27 и 28, включенные в табл. 4, описаны как 35 и 34 в WO 00/69862. Некоторые из предпочтительных способов получения соединения формулы I описаны в следующих реакционных схемах с примерами обычных групп заместителей. Указанные обычные заместители не ограничиваются настоящим изобретением, и следует иметь в виду, что данный способ представляет более общий случай, без особого учета тождества, указанного в буквенном коде.- 15006206 Многочисленные активные противоопухолевые соединения были получены из данных соединений и очевидно, что гораздо больше соединений может быть получено в соответствии с отличительными особенностями настоящего описания. Схема I Типы реакций следующие: Способы А, В, С, Е и М включают разные способы ацилирования с помощью хлорангидридов кислот, ангидридов, кислот или сульфонилхлоридов, для получения амидных или сложноэфирных связей. Способы D и Н включают реакции восстановительного алкилирования между альдегидом и 1 или между амином и 5, которые дают 2m или 3 о. Способ F трансформирует соединение 1 в 2n реакцией с BnBr и Cs2CO3. Способ G включает снятие защитных метоксиметильной группы (MOM) или МОМ/третбутилоксикарбонильных групп или МОМ/аллилоксикарбонильных групп с использованием триметилхлорсилана (TMSC1) и иодида натрия. Способы I (AgNO3) и J (CuBr) преобразуют CN в ОН в положении С-21. Способ К включает гидролиз карбаматной связи с использованием водной трифторуксусной кислоты. Способ L преобразует карбонильную группу в спирт путем восстановления с помощью NaCNBH3 в присутствии уксусной кислоты. С помощью данной реакции образуется новый хиральный центр. Принимая во внимание стерические эффекты и спектроскопические данные, очевидно, что основное соединение 11 имеет по данному центру R-конфигурацию, а вторичный продукт 12 имеет S-конфигурацию. На этом основании 13, 15, 17, 19, 21 должны иметь R-конфигурацию, а 14, 18 и 22 должны иметь Sконфигурацию. Такая интерпретация, осуществленная на основе имеющихся спектральных данных и, по- 18006206 существу, в отсутствие специальных исследований, которые бы подтверждали данную интерпретацию,должна рассматриваться исключительно в качестве предварительной. Модифицированные способы могут использоваться для получения других соединений настоящего изобретения. В частности, исходное вещество и/или реагенты и реакции могут меняться в соответствии с другими сочетаниями групп заместителей. В соответствии с другим аспектом настоящее изобретение касается применения в полусинтетическом синтезе известного соединения, сафрацина В, также называемого как хинонамин. Вообще, настоящее изобретение относится к полусинтетическому способу получения промежуточных соединений, производных и родственных эктейнасцидину структур или иных тетрагидроизохинолинфенольных соединений, исходя из природных бис(тетрагидроизохинолиновых) алкалоидов. Соответствующие предпочтительные исходные вещества для полусинтетического способа включают виды сафрамициновых и сафрациновых антибиотиков, доступных из различных культуральных сред,а также виды рейнерамициновых и ксестомициновых соединений, доступных из морских губок. Общая формула (XV) исходных соединений имеет следующий вид: где R1 представляет амидометиленовую группу, такую как -CH2-NH-CO-CR25aR25bR25c, где R25a и R25b образуют кетогруппу или один из них представляет -ОН, -NH2 или -ОСОСН 3, а другой представляет -СН 2 СОСН 3, -Н, -ОН или -ОСОСН 3, при условии, что когда R25a представляет -ОН или -NH2, то R25b не является -ОН, a R25c представляет -Н, -СН 3 или -СН 2 СН 3, или же R1 представляет ацилоксиметиленовую группу, такую как -CH2-O-CO-R, гдеR5 и R8 независимо выбраны из -Н, -ОН или -ОСОСН 2 ОН, или же R5 и R8, оба, представляют кетогруппу, а кольцо А представляет п-бензохиноновое кольцо;R14a и R14b, оба, представляют -Н или один из них представляет -Н, а другой представляет -ОН, -ОСН 3 или -ОСН 2 СН 3, или R14a и R14b вместе образуют кетогруппу;R15 и R18 независимо выбраны из -Н или -ОН, или же R15 и R18, оба, представляют кетогруппу, а кольцо А представляет п-бензохиноновое кольцо; иR21 представляет -ОН или CN. Более общая формула для данного класса соединений представлена ниже в которой группы заместителей, обозначенные R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, каждая, независимо,выбрана из группы, состоящей из Н, ОН, ОСН 3, CN, =O, СН 3; в которой X представляют различные амидные или сложноэфирные функциональности, содержащиеся в указанных природных продуктах; в которой каждый пунктирный цикл соответствует одной, двум или трем необязательным двойным связям. Так, в соответствии с настоящим изобретением, к настоящему времени предлагаются полусинтетические способы получения новых и уже известных соединений. Полусинтетические способы получения настоящего изобретения, каждый, включает ряд стадий превращения для получения требуемого продукта. Каждая стадия, сама по себе, представляет способ настоящего изобретения. Настоящее изобретение не ограничивается способами, которые рассматриваются в данном описании в качестве примеров, но возможны и альтернативные способы, например изменение по обстоятельствам порядка стадий превращения. В частности, настоящее изобретение предлагает 21-циано исходное вещество общей формулы где R1, R5, R8, R14a, R14b, R15 и R18 являются такими, как определено выше. Другие соединения формулы (XVI) с разными заместителями по положению 21 могут также представлять возможные исходные вещества. Вообще, им может стать любое производное, способное образовываться в результате нуклеофильного замещения 21-гидроксигруппы соединений формулы (XV), в которой R21 представляет гидроксигруппу. Примеры соответствующих 21-заместителей включают, но не ограничиваются ими меркаптогруппу; алкилтиогруппу (алкилгруппа, имеющая от 1 до 6 углеродных атомов); арилтиогруппу (арилгруппа, имеющая от 6 до 10 углеродных атомов и являющаяся незамещенной или замещенной 1-5 заместителями, выбранными, например, из алкилгруппы, имеющей от 1 до 6 углеродных атомов, алкоксигрупп, имеющих от 1 до 6 углеродных атомов, атомов галогена, меркаптогрупп и нитрогрупп); аминогруппу; моно- или диалкиламино (каждая или обе алкильные группы, имеющие от 1 до 6 углеродных атомов); моно- или диариламиногруппу (каждая или обе арильные группы являются такими, как определено выше в отношении арилтиогрупп);-карбонилалкильную группу формулы -C(Ra) (Rb)-C(=O)Rc, где Ra и Rb выбраны из атомов водорода, алкильных групп, имеющих от 1 до 20 углеродных атомов, арильных групп (как определено выше в отношении арилтиогрупп) и аралкильных групп (в которых алкильная группа, имеющая от 1 до 4 углеродных атома, замещена арильной группой, определенной выше в отношении арилтиогрупп), при условии, что один из Ra и Rb представляет атом водорода;Rc выбран из атома водорода, алкильной группы, имеющей от 1 до 20 углеродных атомов, арильных групп (как определено выше в отношении арилтиогрупп), аралкильной группы (в которой алкильная группа, имеющая от 1 до 4 углеродных атома замещена арильной группой, определенной выше в отношении арилтиогрупп), алкоксигруппы, имеющей от 1 до 6 углеродных атомов, аминогруппы или моноили диалкиламиногруппы, как они определены выше. Таким образом, в более общем аспекте, настоящее изобретение относится к способам, в которых на первой стадии образуется 21-производное с использованием нуклеофильного реагента. Такие соединения называются как 21-Nuc-соединения. Предпочтительные исходные вещества 21-Nuc-соединения обладают структурой формулы (XIV) где по меньшей мере одно кольцо А или Е является хинольным. Таким образом, кроме использования 21-цианосоединений, предусматриваются также способы с использованием других нуклеофилсодержащих соединений, которые образуют аналогичные соединения формулы (XVI), в которой положение 21 защищено другой нуклеофильной группой, 21-Nuc-группой. Например, 21-Nuc-соединение формулы (XVI) с алкиламинозаместителем по положению 21 можно получить путем взаимодействия соединения формулы (XV), в которой R21 представляет гидроксигруппу, с соответствующим алкиламином. 21-Nuc-соединение формулы (XVI) с алкилтиозаместителем по положению 21 можно также получить путем взаимодействия соединения формулы (XV), в которой R21 представляет гидроксигруппу, с соответствующим алкантиолом. Альтернативно, 21-Nuc-соединение формулы (XVI) с -карбонилалкильным заместителем по положению 21 можно получить путем взаимодействия соединения формулы (XV), в которой R21 представляет гидроксигруппу, с соответствующим карбонильным соединением, как правило, в присутствии основания. Для других 21-Nuc-соединений доступны другие способы. Наличие 21-цианогруппы необходимо для некоторых конечных продуктов, а именно, эктейнасцидина 770 и фталасцидина, в то время как для других конечных продуктов она действует в качестве за- 20006206 щитной группы, которую можно легко преобразовать в другой заместитель, такой как 21 гидроксигруппа. Использование 21-цианосоединения в качестве исходного вещества эффективно стабилизирует данную молекулу во время последующих стадий синтеза, пока эту группу не удалят (необязательно). Другие 21-Nuc-соединения могут обладать этим же и другими преимуществами. Предпочтительные исходные вещества включают соединения формулы (XV) или (XVI), где R14a и 14bR , оба, являются водородом. Предпочтительные исходные вещества включают также соединения формулы (XV) или (XVI), где R15 представляет водород. Кроме того, предпочтительные исходные вещества включают соединения формулы (XV) или (XVI), в которой кольцо Е представляет фенольное кольцо. Предпочтительные исходные вещества дополнительно включают соединения формулы (XV) или (XVI), в которой по меньшей мере один, но лучше по меньшей мере два или три из R , R8, R15 и R18 не являются водородом. Примеры соответствующих исходных веществ для настоящего изобретения включают сафрамицин А, сафрамицин В, сафрамицин С, сафрамицин G, сафрамицин Н, сафрамицин S, сафрамицин Y3, сафрамицин Yd1, сафрамицин Ad1, сафрамицин Yd2, сафрамицин АН 2, сафрамицин АН 2 Ас, сафрамицин AH1,сафрамицин AH1Ac, сафрамицин AR3, рениерамицин А, рениерамицин В, рениерамицин С, рениерамицин D, рениерамицин Е, рениерамицин F, ксестомицин, сафрамицин D, сафрамицин F, сафрамицин Мх 1, сафрамицин Мх-2, сафрацин А, сафрацин В и сафрамицин R. Предпочтительные исходные вещества имеют цианогруппу в положении 21, для группы R21. В особенно предпочтительном аспекте настоящее изобретение включает полусинтетический способ, в котором стадии преобразования применяются к сафрацину В Сафрацин В Сафрацин В представлен системой колец, весьма родственной эктейнасцидинам. Данное соединение имеет такую же структуру из пяти колец и такое же замещение в правостороннем ароматическом кольце, кольце Е. Более предпочтительные исходные вещества настоящего изобретения имеют 21-цианогруппу. В настоящее время наиболее предпочтительное соединение настоящего изобретения представляет собой соединение формулы 2. Данное соединение получают непосредственно из сафрацина В и его рассматривают в качестве ключевого промежуточного соединения в данном полусинтетическом способе. Соединение 2 Цианосафрацин В получают ферментацией продуцирующего сафрацин В штамма Pseudomonas fluorescens, а полученную культуральную среду обрабатывают с использованием ионов цианида. Предпочтительным штаммом Pseudomonas fluorescens является штамм А 2-2, FERM ВР-14, который используется в способе ЕР-А-0552 99. Подходящим источником ионов цианида является цианид калия. При обычной обработке культуральную среду фильтруют и добавляют избыток ионов цианида. После соответствующего периода встряхивания, например, в течение 1 ч, значение рН доводят до щелочного, например рН 9,5, и экстрагирование органическими растворителями дает неочищенный экстракт, который можно в дальнейшем очистить с получением цианосафрацина В.- 21006206 В целом, превращение исходного 21-цианосоединения в продукт настоящего изобретения включаетa) преобразование, при необходимости, хиноновой системы кольца Е в фенольную систему;b) преобразование, при необходимости, хиноновой системы кольца А в фенольную систему;c) преобразование фенольной системы кольца А в метилендиоксифенольное кольцо;d) образование мостиковой спироциклической системы формулы (IV), (VI) или (VII) по положению 1 и положению 4 в кольце В; иe) соответствующую дериватизацию (получение производных), такую как ацилирование. Стадия (а) преобразования, при необходимости, хиноновой системы кольца Е в фенольную систему может осуществляться с помощью процедур традиционного восстановления. Подходящей системой реагентов является водород с катализатором палладий на углероде, хотя можно использовать и другие восстановительные системы. Стадия (b) преобразования, при необходимости, хиноновой системы кольца А в фенольную систему аналогична стадии (а) и более подробного объяснения не требует. Стадию (с) преобразования фенольной системы кольца А в метилендиоксифенольное кольцо можно осуществить несколькими способами, в частности, вместе со стадией (b). Например, хиноновое кольцо А можно деметилировать по метоксизаместителю в положении 7 и восстановить до дигидрохинона, а кольцо замкнуть с помощью соответствующего электрофильного реагента, такого как СН 2 Вr2, ВrСН 2 Сl или аналогичный бивалентный реагент, непосредственно дающий метилендиоксициклическую систему,или с помощью бивалентного реагента, такого как тиокарбонилдиимидазол, который дает замещенную метилендиоксициклическую систему, которую можно преобразовать в требуемое кольцо. Стадия (d) обычно осуществляется путем соответствующего замещения по положению 1 с помощью мостикового реагента, который может содействовать образованию требуемого мостика, формируя эксэндохиноновый метид по положению 4 и давая возможность данному метиду взаимодействовать с 1 заместителем для создания мостиковой структуры. Предпочтительные мостиковые реагенты имеют формулу (XIX) где Fu обозначает защищенную функциональную группу, такую как группа -NHProt4a или Oprot4b, Prot3 представляет защитную группу, а пунктиром показана необязательная двойная связь. Соответственно, данное метидное соединение образуется путем первого введения гидроксигруппы по положению 10 в месте соединения колец А и В, что дает неполную структуру формулы (XX) или более предпочтительно неполную структуру формулы (XXI) где группа R" выбрана для требуемой группы формулы (IV), (V), (VI) или (VII). Что касается первых двух таких групп, группа R" обычно принимает вид -CHFu-CH2-Sprot3. Защитные группы впоследствии можно удалить и модифицировать соответствующим образом, что дает требуемое соединение. Типичная методика для стадии (d) раскрыта в патенте США 5721362, включенного путем ссылки. Конкретная ссылка сделана на раздел в столбце 8, стадия (1), и пример 33 данного патента США, а также соответствующие разделы. Дериватизация (получение производного) на стадии (е) может включать ацилирование, например, в случае группы Ra-CO-, а также преобразование группы 12-NCH3 в 12-NH или 12-NCH2CH3. Такое преобразование можно осуществить перед или после других стадий с использованием доступных способов. В качестве иллюстрации, можно трансформировать в промежуточное соединение 25 и, исходя из данного производного, представляется возможным ввести ряд цистеиновых производных,которые можно трансформировать в соединения настоящего изобретения. Предпочтительные цистеиновые производные иллюстрируются следующими двумя соединениями Один способ настоящего изобретения трансформирует цианосафрацин В в промежуточное соединение Int-25 при помощи последовательных реакций, которые включают, главным образом, (1) удаление метоксигруппы, находящейся в кольце А, (2) восстановление кольца А и образование метилендиоксигруппы в одну стадию (в одном сосуде), (3) гидролиз амидной функции, находящейся у углерода 1, (4) трансформацию полученной аминогруппы в гидроксильную группу, см. схему V. Схема V Данный способ исключает защиту и снятие защиты (блокирование и деблокирование) первичной спиртовой функции в положении 1 в кольце В соединения Int-25 с прямым использованием цистеинового остатка Int-29 для образования промежуточного соединения Int-27. Цистеиновое производное Int-29 защищают по аминогруппе -трихлорэтоксикарбонильной защитной группой для того, чтобы иметь возможность сочетания с присутствующими аллил- и МОМгруппами. Промежуточное соединение Int-27 окисляется и циклизуется напрямую. Данные обстоятельства, наряду с разными приемами снятия защиты на последних стадиях синтеза, делают данный способ новым и более приемлемым для промышленного применения, чем указанный способ патента США 5721362. Преобразование 2-цианосоединения в промежуточное соединение Int-25 обычно включает следующие стадии (см. схему V): образование защищенного соединения формулы Int-14 путем взаимодействия Int-2 с третбутоксикарбонильным ангидридом; преобразование Int-14 в двузащищенное соединение формулы Int-15 путем взаимодействия с бромметилметиловым простым эфиром и диизопропилэтиламином в ацетонитриле; избирательное удаление метоксигруппы из хиноновой системы Int-15 с получением соединения формулы Int-16 путем взаимодействия с метанольным раствором гидроксида натрия; трансформирование Int-16 в метилендиоксисоединение формулы Int-18 с использованием следующей предпочтительной последовательности операций: (1) восстанавливление хиноновой группы соединения Int-16 с помощью 10% Pd/C в атмосфере водорода; (2) преобразование полученного гидрохинонового промежуточного соединения в метилендиоксисоединение формулы Int-17 взаимодействием с бромхлорметаном и карбонатом цезия в атмосфере водорода; (3) трансформирование Int-17 в соединение формулы Int-18 в результате защиты свободной гидроксильной группы как OCH2R-группа; данную реакцию осуществляют с BrCH2R и карбоната цезия, где R может быть арилом, СН=СН 2, OR' и т.п.; удаление трет-бутоксикарбонильной и метоксиметильной защитных групп из Int-18 с получением соединения формулы Int-19 в результате взаимодействия с раствором НСl в диоксане; данную реакцию осуществляют также путем смешивания Int-18 с раствором трифторуксусной кислоты в дихлорметане; образование соединения тиомочевины формулы Int-20 путем взаимодействия Int-19 с фенилизотиоцианатом; преобразование соединения формулы Int-20 в аминосоединение формулы Int-21 путем взаимодействия с раствором хлористого водорода в диоксане; трансформирование соединения формулы Int-21 в N-Troc-производное Int-22 путем взаимодействия с трихлорэтилхлорформиатом и пиридином; образование защищенного гидроксисоединения формулы Int-23 путем взаимодействия Int-22 с бромметилметиловым эфиром и диизопропилэтиленамином; трансформирование соединения формулы Int-23 в N-H-производное Int-24 путем взаимодействия с уксусной кислотой и цинком; преобразование соединения формулы Int-24 в гидроксисоединение формулы Int-25 реакцией с нитритом натрия в уксусной кислоте. Альтернативно, можно использовать тетраоксид азота в смеси уксусная кислота-ацетонитрил с последующей обработкой гидроксидом натрия. Можно также использовать нитрит натрия в смеси уксусный ангидрид-уксусная кислота, с последующей обработкой гидроксидом натрия. Затем процесс превращения промежуточного соединения Int-25 в конечные промежуточные соединения Int-35 или Int-36 настоящего изобретения может протекать, как показано на схеме VI трансформирование соединения формулы Int-24 в производное Int-30 путем защиты первичной гидроксильной функции с помощью(S)-N-2,2,2-трихлорэтоксикарбонил-S-(9 Н-флуорен-9 илметил)цистеина Int-29; преобразование защищенного соединения формулы Int-30 в фенольное производное Int-31 путем расщепления аллилгруппы с помощью трибутилоловогидрида и дихлорпалладий-бис(трифенилфосфина); трансформирование фенольного соединения формулы Int-31 в соединение формулы Int-32 путем окисления с помощью бензолселенинового ангидрида при низкой температуре; трансформирование гидроксисоединения формулы Int-32 в лактон Int-33 с помощью следующей последовательности операций: (1) взаимодействие соединения формулы Int-32 с 2 экв. ангидрида трифторметансульфоновой кислоты и 5 экв. ДМСО, (2) последующее взаимодействие с 8 экв. диизопропилэтиламина, (3) последующее взаимодействие с 4 экв. трет-бутилового спирта, (4) последующее взаимодействие с 7 экв. 2-трет-бутил-1,1, 3, 3,тетраметилгуанидина, (5) последующее взаимодействие с 10 экв. уксусного ангидрида; трансформирование лактонового соединения Int-33 в гидроксильное соединение Int-34 путем удаления защитной группы MOM с помощью TMSI; отщепление N-трихлорэтоксикарбонильной группы соединения формулы Int-34 для получения соединения Int-35 путем взаимодействия с Zn/AcOH; трансформирование аминосоединения Int-35 в соответствующий -кетолактон Int-36 путем взаимодействия с N-метилпиридинийкарбоксальдегидхлоридом, с последующим взаимодействием с DBU. Преобразование промежуточного соединения Int-25 в ЕТ-743 с использованием цистеинового производного Int-37 можно осуществить аналогичным способом и с помощью тех же реагентов, что и с цистеиновым производным Int-29, исключая трансформации (f) и (g). Последовательность реакций иллюстрируется в следующей схеме VII Следует сразу иметь в виду, что данные способы синтеза можно легко модифицировать, в частности, путем соответствующего изменения исходного вещества и реагентов, для того, чтобы получить соединения настоящего изобретения с разными конденсированными кольцевыми системами или с разными заместителями. Новые активные соединения Изобретателями установлено, что соединения настоящего изобретения обладают активностью при лечении рака, такого как лейкозы, рак легких, рак толстой кишки, рак почек и меланомы. В соответствии с этим, настоящее изобретение предлагает способ лечения млекопитающего, в частности, человека, пораженного раком, который включает введение такому пораженному индивидууму терапевтически эффективного количества соединения настоящего изобретения или его фармацевтической композиции. Настоящее изобретение относится также к фармацевтическим композициям, которые содержат в качестве активного ингредиента соединение или соединения настоящего изобретения, а также к способам их получения. Примеры фармацевтических композиций включают твердые (таблетки, пилюли, капсулы, гранулы и т.п.) или жидкие (растворы, суспензии или эмульсии) составы, в зависимости от соответствующей композиции и композиции для перорального, местного или парентерального введения, и они могут содержать чисто данное соединение или в сочетании с каким-либо носителем или другими фармакологически активными соединениями. Данные композиции нуждаются в стерилизации при парентеральном введении. Введение соединений или композиций настоящего изобретения может осуществляться любым подходящим способом, в виде, например, внутривенной инфузии (вливания), пероральных препаратов,внутрибрюшинного или внутривенного введения. Предпочтительно используют время инфузии до 24 ч,более предпочтительно 2-12 ч, и наиболее предпочтительно 2-6 ч. Короткое инфузионное время, которое позволяет осуществлять лечение без ночевки в больнице, представляется особенно желательным. При необходимости, однако, инфузию можно осуществлять 12-24 ч или даже более длительно. Инфузию можно осуществлять с соответствующими интервалами, скажем, 2-4 недели. Фармацевтические композиции, содержащие соединения настоящего изобретения, могут доставляться с помощью липосом или инкапсулированием наносфер для замедленного высвобождения композиций или с помощью других стандартных средств доставки. Корректировка дозы соединений должна меняться в соответствии с конкретной композицией, способом применения и конкретным местом действия, пациентом и опухолью, подвергающихся лечению. Должны быть приняты во внимание и другие факторы, вроде возраста, веса тела, пола, питания, времени введения, скорости экскреции, состояния данного пациента, сочетания лекарственных средств, чувствительности к лекарственным средствам и тяжести заболевания. Введение можно осуществлять непрерывно или периодически в рамках предельно допустимой дозы. Соединения и композиции настоящего изобретения могут использоваться вместе с другими лекарственными средствами, что обеспечивает комбинированную терапию. Эти другие лекарственные средства могут входить в состав той же композиции или представлять собой отдельную композицию для вве- 26006206 дения в то же самое время или в иное время. Природа этого другого лекарственного средства особенно не ограничена, а подходящие кандидаты включаютa) лекарственные средства с антимитотическим действием, таким как таксановые лекарственные средства (например, таксол, паклитаксел, таксотер, доцетаксел), подофилотоксины или алкалоиды барвинка (винкристин, винбластин), особенно те из них, мишенью которых являются элементы цитоскелета,в том числе, модуляторы микротрубочек;c) алкилирующие агенты, такие как азотистые иприты (например, циклофосфамид или ифосфамид);d) лекарственные средства, которые действуют на ДНК, такие как антрациклиновые лекарственные средства адриамицин, доксорубицин, фарморубицин или эпирубицин;e) лекарственные средства, которые действуют на топоизомеразы, такие как этопозид;f) гормоны и гормональные агонисты или антагонисты, такие как эстрогены, антиэстрогены (тамоксифен и родственные соединения) и андрогены, флутамид, леупрорелин, госерелин, ципротрон или октреотид;g) лекарственные средства, которые действуют на сигнальную трансдукцию в опухолевых клетках,включая производные антител, такие как герцептин;h) алкилирующие лекарственные средства, такие как лекарственные средства на основе платиныi) лекарственные средства потенциально действующие на метастазы опухолей, такие как ингибиторы матричных металлопротеиназ;j) генную терапию и антисмысловые агенты; к) терапевтические агенты на основе антител;l) другие биологически активные соединения морского происхождения, а именно дидемнины, такие как аплидин;n) противовоспалительные лекарственные средства, в частности дексаметазон; и о) противорвотные средства, в частности дексаметазон. Кроме того, настоящее изобретение распространяется на соединения настоящего изобретения для их применения в способе лечения, а также для применения данных соединений для получения композиций для лечения рака. Цитотоксическая активность Клеточные культуры. Клетки поддерживают в логарифмической фазе роста в минимальной основной среде Игла, уравновешенной солями по Эрлу, с 2,0 мМ L-глутамина, с заменимыми аминокислотами,в отсутствие бикарбоната натрия (ЕМЕМ/neaa); с добавлением 10% сыворотки плода теленка (FCS), 10-2 М бикарбоната натрия и 0,1 г/л пенициллина G + сульфат стрептомицина. Применяют простую методику определения и сравнения противоопухолевой активности данных соединений с использованием адаптированной формы способа, описанного у Bergeron и соавт. (1984). Используемая линия опухолевых клеток представляет собой Р-388 (суспензионная культура лимфоидной опухоли мыши DBA/2), А-549 (монослойная культура карциномы легких человека), НТ-29 (монослойная культура карциномы толстой кишки человека) и MEL-28 (монослойная культура меланомы человека). Клетки Р-388 высевают в 16 мм лунки с плотностью 1 х 104 клеток на лунку в 1 мл аликвотах MEM 5FCS, содержащей указанную концентрацию лекарственного средства. Отдельные культуры без лекарственного средства высевают для контрольного выращивания, чтобы убедиться в том, что клетки остаются в экспоненциальной фазе роста. Все определения осуществляют в двойном повторе. Через три дня инкубации при 37 С, 10% СО 2 в атмосфере 98% влажности определяют примерную величину IC50 путем сравнения роста в лунках с лекарственным средством и в контрольных лунках. А-549, НТ-29 и MEL-28 высевают в 16 мм лунки с плотностью 2 х 104 клеток на лунку в 1 мл аликвотах MEM 10FCS, содержащей указанную концентрацию лекарственного средства. Отдельные культуры без лекарственного средства высевают для контрольного выращивания, чтобы убедиться в том, что клетки остаются в экспоненциальной фазе роста. Все определения осуществляют в двойном повторе. Через три дня инкубации при 37 С, 10% СО 2 в 98% атмосфере влажности определяют примерную величинуIC50 путем сравнения роста в лунках с лекарственным средством и в контрольных лунках. 1. Raymond J. Bergeron, Paul F. Cavanaugh, Jr., Steven J. Kline, Robert G. Hughes, Jr., Gary T. Elliot andCarl W. Porter. Antineoplastic and antiherpetic activity of spermidine catecholamine iron chelators (Противоопухолевая и антигерпесная активность хелатных соединений железа со спермидиновым катехоламидом). Biochem. Bioph. Res. Comm. 1984, 121(3), 848-854. 2. Alan С. Schroeder, Robert G. Hughes, Jr. and Alexander Bloch. Effects of Acyclic Pyrimidine Nucleoside Analoges (Действие ациклических пиримидиновых нуклеозидных аналогов). J.Med. Chem. 1981, 24 1078-1083. Примеры биологической активности соединений, описанных в настоящей заявке, представлены в табл. 4 (IC50 (нг/мл на следующих страницах.(0,08 М) в атмосфере аргона, добавляют 1,2 экв. ангидрида. Реакцию отслеживают с помощью TLC и гасят кислотой или основанием, экстрагируют CH2Cl2 и органические слои сушат Na2SO4. Флэшхроматография дает чистые соединения. Соединение 21 (с использованием ангидрида янтарной кислоты): 1H ЯМР (300 МГц, CDCl3):6,79ESI-MS m/z: Вычислено для C31H34N4O8S: 580,2. Найдено (М+Н+): 581,3. Пример 2. Способ В: К раствору 1 экв, 1 (2 р для 2t и 9, и 11 для 13 е-f) и 1,5 экв. кислоты, дважды упаренному с безводным толуолом в СН 2 Сl2 (0,05 М) в атмосфере аргона, добавляют 2 экв. DMAP и 2 экв. EDCHCl. Реакционную смесь перемешивают в течение 3 ч 30 мин. По истечении этого времени реакционную смесь разбавляют СН 2 Сl2, промывают насыщенным раствором соли и органические слои сушат Na2SO4. Флэш-хроматография дает чистые соединения.
МПК / Метки
МПК: C07D 515/22, A61K 35/00, A61P 35/00
Метки: противоопухолевые, эктейнасцидина, производные
Код ссылки
<a href="https://eas.patents.su/30-6206-protivoopuholevye-proizvodnye-ektejjnascidina.html" rel="bookmark" title="База патентов Евразийского Союза">Противоопухолевые производные эктейнасцидина</a>
Предыдущий патент: 1-арил-или 1-алкилсульфонилгетероциклилбензазолы в качестве лигандов 5-гидрокситриптамина-6
Следующий патент: Иммуногенные химерные частицы нвс, обладающие повышенной стабильностью
Случайный патент: Производные 6-(пирролопиридинил)пиримидин-2-иламина и их применение для лечения злокачественного новообразования












