Соли производных 3,3-дифенилпропиламинов
Формула / Реферат
1. Соединения общей формулы I
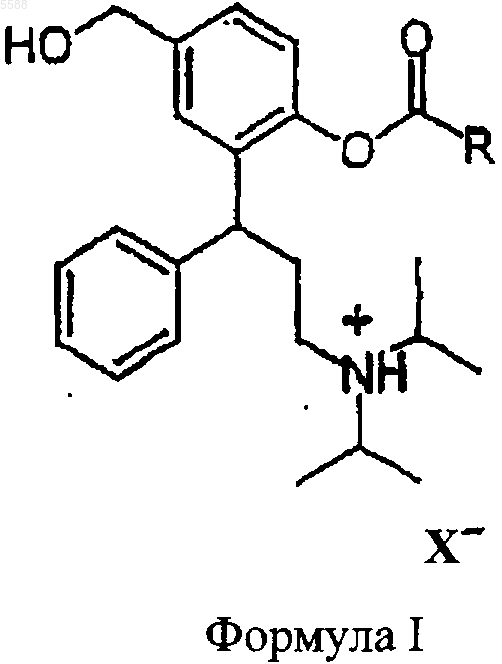
где R представляет собой C1-C6-алкил, C3-C10-циклоалкил, незамещенный фенил или фенил, замещенный этилкарбонилокси, изопропилкарбонилокси, m-бутилкарбонилокси, циклопропилкарбонилокси, циклобутилкарбонилокси и циклогексилкарбонилокси и X- является остатком физиологически приемлемой неорганической или органической кислоты.
2. Соединения по п.1, отличающиеся тем, что X- в каждом случае является кислотным остатком хлористо-водородной кислоты, бромисто-водородной кислоты, фосфорной кислоты, серной кислоты, азотной кислоты, уксусной кислоты, пропионовой кислоты, пальмитиновой кислоты, стеариновой кислоты, малеиновой кислоты, фумаровой кислоты, щавелевой кислоты, сукциновой кислоты, DL-яблочной кислоты, L-(-)-яблочной кислоты, D-(+)-яблочной кислоты, DL-винной кислоты, L-(+)-винной кислоты, D-(-)-винной кислоты, лимонной кислоты, L-аспартановой кислоты, L-(+)-аскорбиновой кислоты, D-(+)-глюкуроновой кислоты, 2-оксопропионовой кислоты (пировиноградной кислоты), фуран-2-карбоновой кислоты (слизовой кислоты), бензойной кислоты, 4-гидроксибензойной кислоты, салициловой кислоты, ванилиновой кислоты, 4-гидроксикоричной кислоты, галловой кислоты, гиппуровой кислоты (N-бензоилглицин), ацетилмочевой кислоты (N-ацетилглицин), флоретиновой кислоты (3-(4-гидроксифенил)пропионовой кислоты), фталевой кислоты, метансульфоновой кислоты или оротовой кислоты.
3. Соединения по п.1, отличающиеся тем, что они имеют общую формулу 2

где R представляет собой C1-C6-алкил, C3-C10-циклоалкил, незамещенный фенил или фенил, замещенный этилкарбонилокси, изопропилкарбонилокси, m-бутилкарбонилокси, циклопропилкарбонилокси, циклобутилкарбонилокси и циклогексилкарбонилокси и X- является остатком физиологически приемлемой неорганической или органической кислоты.
4. Соединения по п.3, отличающиеся тем, что X- в каждом случае является кислотным остатком хлористо-водородной кислоты, бромисто-водородной кислоты, фосфорной кислоты, серной кислоты, азотной кислоты, уксусной кислоты, пропионовой кислоты, пальмитиновой кислоты, стеариновой кислоты, малеиновой кислоты, фумаровой кислоты, щавелевой кислоты, сукциновой кислоты, DL-яблочной кислоты, L-(-)-яблочной кислоты, D-(+)-яблочной кислоты, DL-винной кислоты, L-(+)-винной кислоты, D-(-)-винной кислоты, лимонной кислоты, L-аспартановой кислоты, L-(+)-аскорбиновой кислоты, D-(+)-глюкуроновой кислоты, 2-оксопропионовой кислоты (пировиноградной кислоты), фуран-2-карбоновой кислоты (слизовой кислоты), бензойной кислоты, 4-гидроксибензойной кислоты, салициловой кислоты, ванилиновой кислоты, 4-гидроксикоричной кислоты, галловой кислоты, гиппуровой кислоты (N-бензоилглицин), ацетилмочевой кислоты (N-ацетилглицин), флоретиновой кислоты (3-(4-гидроксифенил)пропионовой кислоты), фталевой кислоты, метансульфоновой кислоты или оротовой кислоты.
5. Соединения по пп.3 и 4, отличающиеся тем, что они представляют собой R-(+)-2-(3-(диизопропиламино-1-фенилпропил)-4-гидроксиметилфенилизобутират - сложный эфир гидрофумарат, R-(+)-2-(3-(диизопропиламино-1-фенилпропил)-4-гидроксиметилфенилизобутират - сложный эфир гидрохлорид гидрат.
6. Соединения по пп.3 и 4, отличающиеся тем, R представляет собой циклопропил, циклобутил, циклопентил, циклогексил, 4-(1-циклопропилметаноилокси)фенил, 4-(1-циклобутилметаноилокси)фенил, 4-(1-циклогексилметаноилокси)фенил или 4-(2,2-диметилпропаноилокси)фенил и X- представляет собой хлорид.
7. Соединения по любому из пп.1-6, находящиеся в форме сыпучего продукта.
8. Способ получения соединений общей формулы I
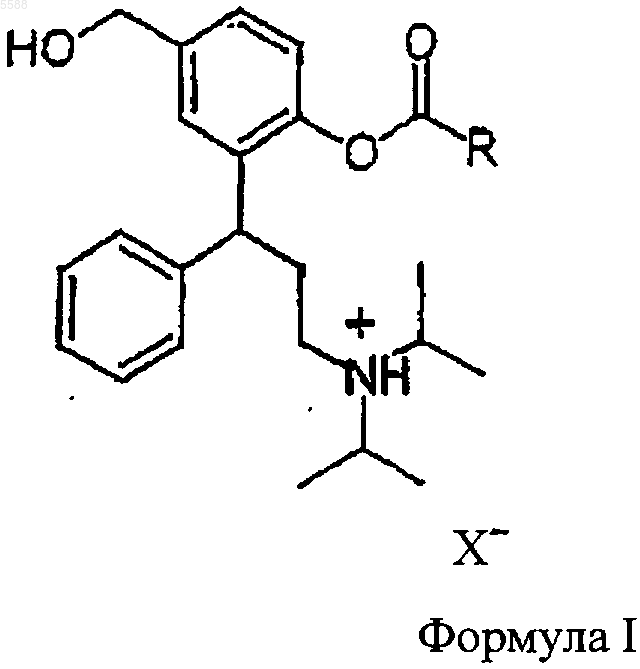
где R представляет собой C1-C6-алкил, C3-C10-циклоалкил, незамещенный фенил или фенил, замещенный этилкарбонилокси, изопропилкарбонилокси, m-бутилкарбонилокси, циклопропилкарбонилокси, циклобутилкарбонилокси и циклогексилкарбонилокси и X- представляет собой остаток кислоты физиологически приемлемой неорганической или органической кислоты, при котором
a) соединение формулы III
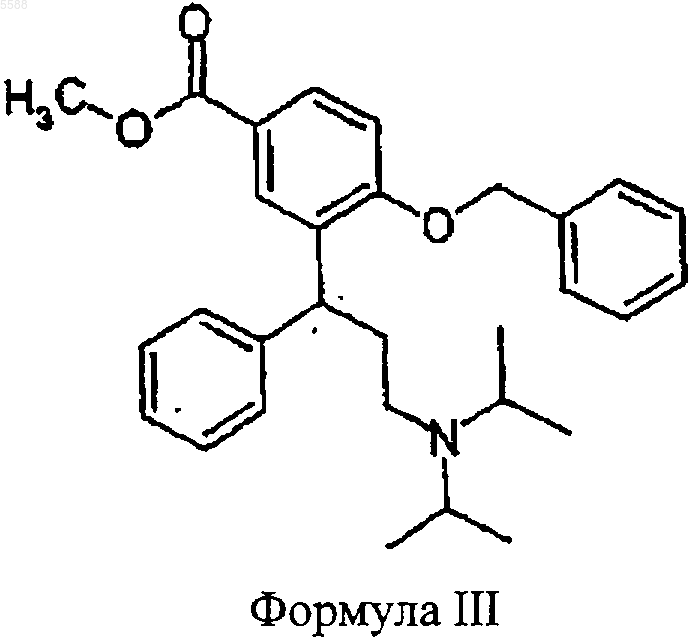
расщепляют с помощью агента гидрогенизации с образованием соединения формулы V
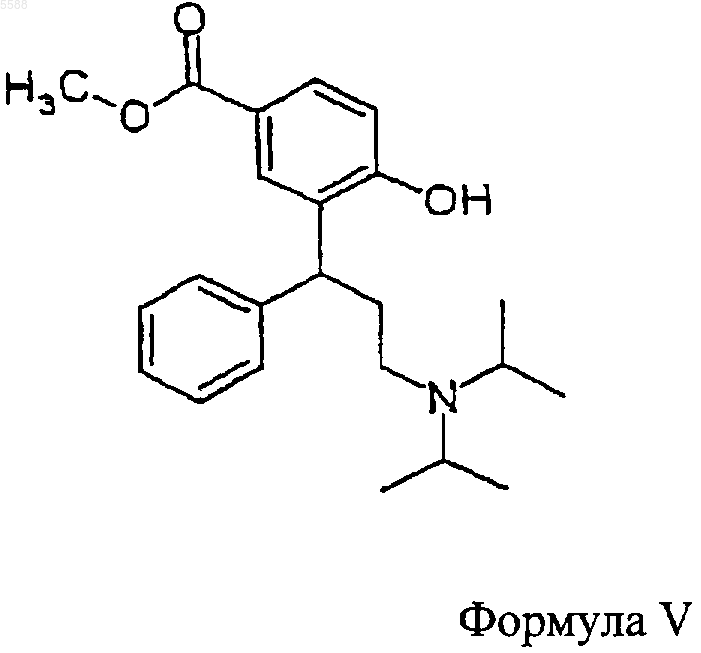
после чего
b) соединение формулы V, полученное указанным путем, обрабатывают восстанавливающим агентом, чтобы получить соединение формулы VI
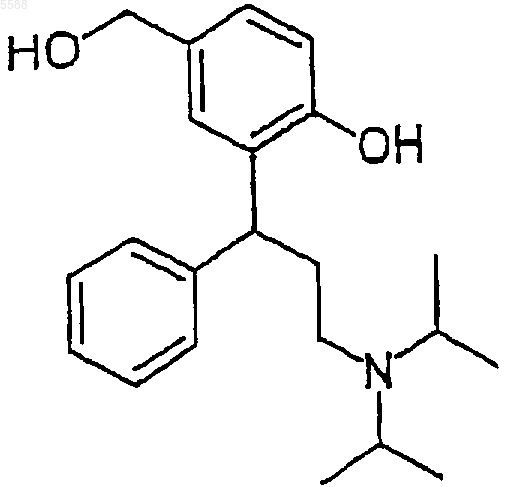
Формула VI
c) соединение формулы VI обрабатывают ацилирующим агентом, чтобы получить соединение формулы A
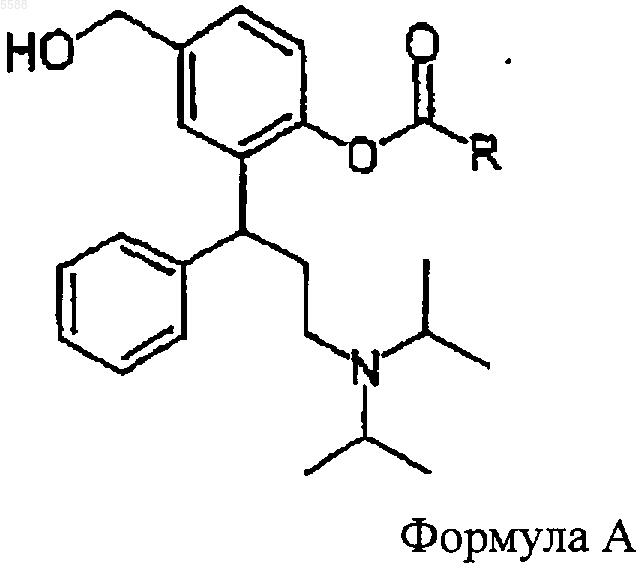
в которой R определен выше и которое
d) переводят с помощью физиологически приемлемой неорганической или органической кислоты в соединение формулы I
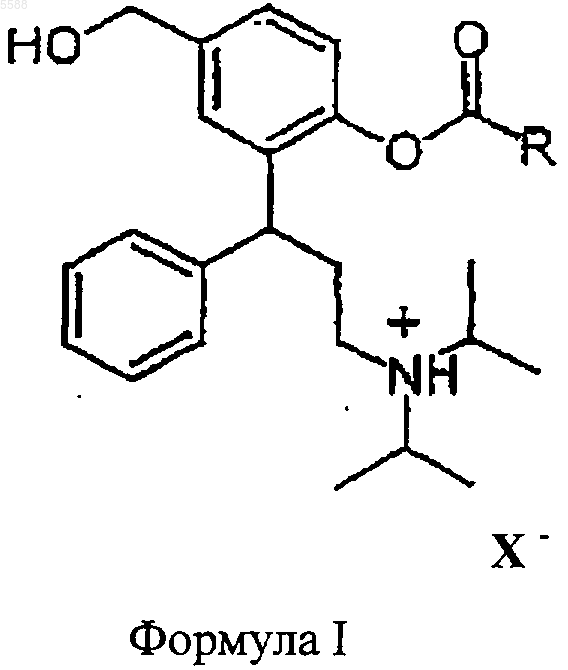
где R представляет собой C1-C6-алкил, C3-C10-циклоалкил, незамещенный или замещенный фенил и X- является кислотным остатком физиологически приемлемой неорганической или органической кислоты.
9. Способ по п.8, отличающийся тем, что для получения соединений общей формулы 1 используют хлористо-водородную кислоту, бромисто-водородную кислоту, фосфорную кислоту, серную кислоту, азотную кислоту, уксусную кислоту, пропионовую кислоту, пальмитиновую кислоту, стеариновую кислоту, малеиновую кислоту, фумаровую кислоту, щавелевую кислоту, сукциновую кислоту, DL-яблочную кислоту, L-(-)-яблочную кислоту, D-(+)-яблочную кислоту, DL-винную кислоту, L-(+)-винную кислоту, D-(-)-винную кислоту, лимонную кислоту, L-аспартановую кислоту, L-(+)-аскорбиновую кислоту, D-(+)-глюкуроновую кислоту, 2-оксопропионовую кислоту (пировиноградную кислоту), фуран-2-карбоновую кислоту (слизовую кислоту), бензойную кислоту, 4-гидроксибензойную кислоту, салициловую кислоту, ванилиновую кислоту, 4-гидроксикоричную кислоту, галловую кислоту, гиппуровую кислоту (N-бензоилглицин), ацетилмочевую кислоту (N-ацетилглицин), флоретиновую кислоту (3-(4-гидроксифенил)пропионовую кислоту), фталевую кислоту, метансульфоновую кислоту или оротовую кислоту.
10. Способ получения соединений общей формулы 2
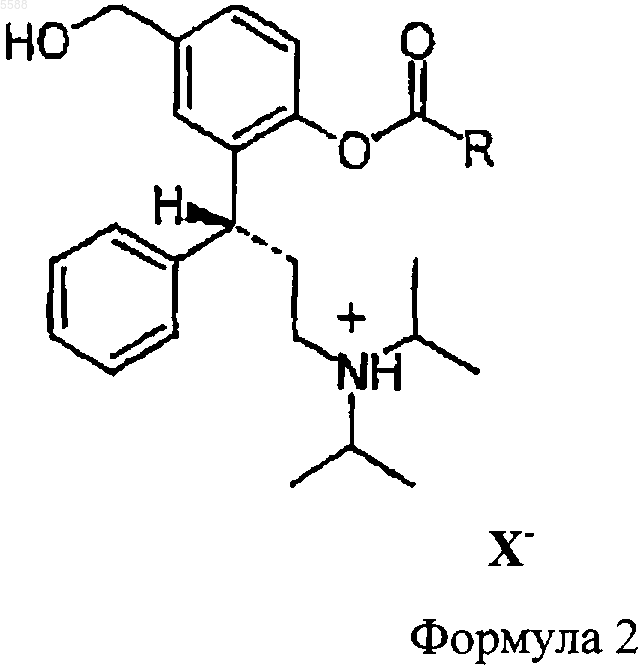
где R представляет собой C1-C6-алкил, C3-C10-циклоалкил, незамещенный фенил или фенил, замещенный этилкарбонилокси, изопропилкарбонилокси, m-бутилкарбонилокси, циклопропилкарбонилокси, циклобутилкарбонилокси и циклогексилкарбонилокси и X- является кислотным остатком физиологически приемлемой неорганической или органической кислоты, который заключается в том, что
a) соединение формулы 3

расщепляют с помощью агента гидрогенизации с образованием соединения формулы 5
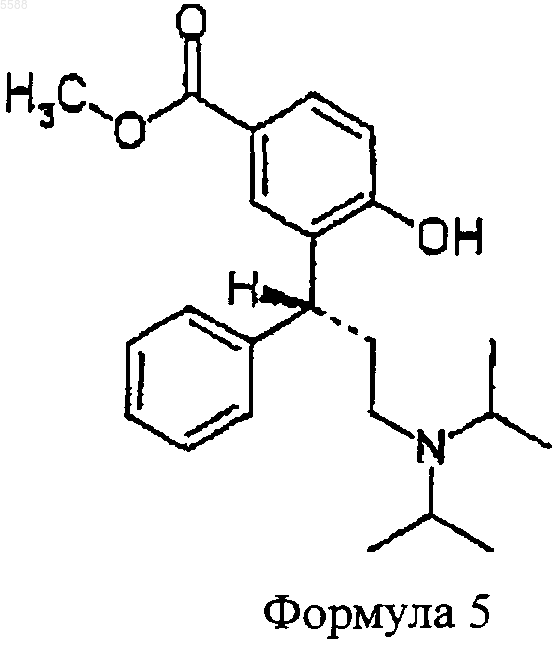
после чего
b) соединение формулы 5, полученное таким образом, обрабатывают восстанавливающим агентом, чтобы получить соединение формулы 6
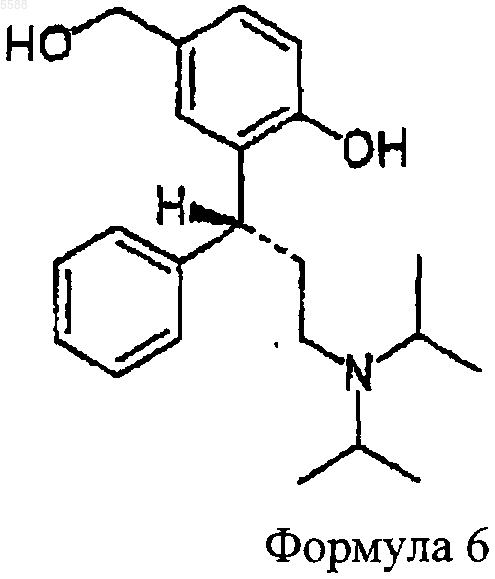
которое обрабатывают
c) ацилирующим агентом, чтобы получить соединение формулы 1
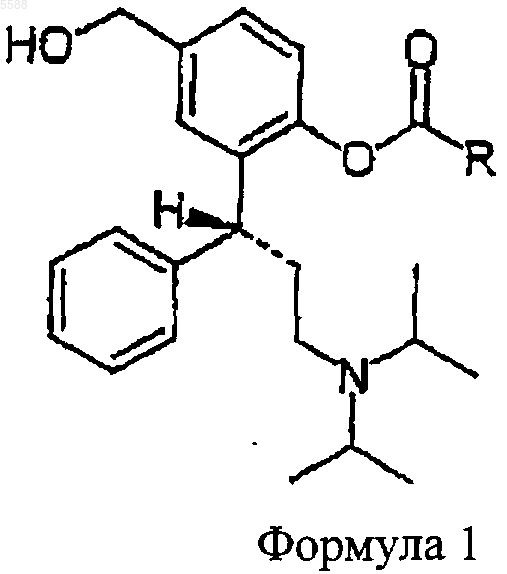
где R имеет значения, приведенные выше, которое
d) превращают с помощью физиологически приемлемой неорганической или органической кислоты в соединение формулы 2
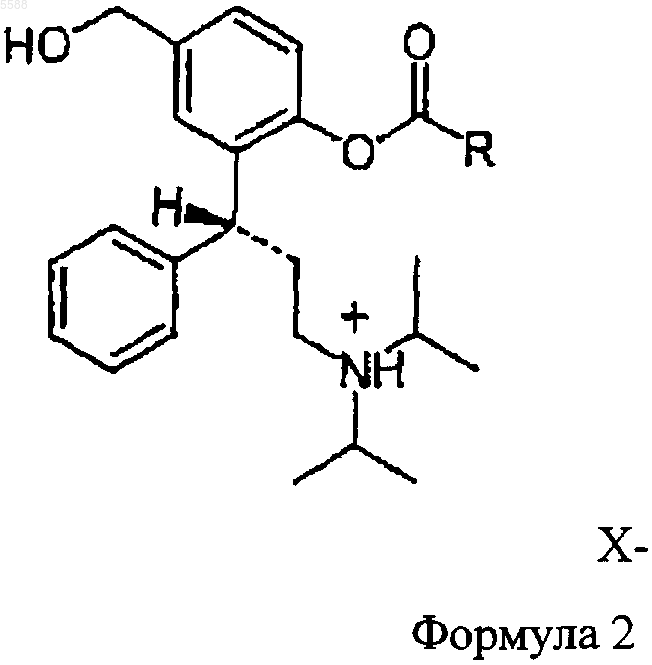
в которой R представляет собой C1-C6-алкшы, C3-C10-циклоалкил, незамещенный или замещенный фенил и X- является кислотным остатком физиологически приемлемой неорганической или органической кислоты.
11. Способ по п.10, отличающийся тем, что для получения соединений общей формулы 2, используют хлористо-водородную кислоту, бромисто-водородную кислоту, фосфорную кислоту, серную кислоту, азотную кислоту, уксусную кислоту, пропионовую кислоту, пальмитиновую кислоту, стеариновую кислоту, малеиновую кислоту, фумаровую кислоту, щавелевую кислоту, сукциновую кислоту, DL-яблочную кислоту, L-(-)-яблочную кислоту, D-(+)-яблочную кислоту, DL-винную кислоту, L-(+)-винную кислоту, D-(-)-винную кислоту, лимонную кислоту, L-аспартановую кислоту, L-(+)-аскорбиновую кислоту, D-(+)-глюкуроновую кислоту, 2-оксопропионовую кислоту (пировиноградную кислоту), фуран-2-карбоновую кислоту (слизевую кислоту), бензойную кислоту, 4-гидроксибензойную кислоту, салициловую кислоту, ванилиновую кислоту, 4-гидроксикоричную кислоту, галловую кислоту, гиппуровую кислоту (N-бензоилглицин), ацетилмочевую кислоту (N-ацетилглицин), флоретиновую кислоту (3-(4-гидроксифенил)пропионовую кислоту), фталевую кислоту, метансульфоновую кислоту или оротовую кислоту.
12. Способ по любому из пп.8-11, отличающийся тем, что в качестве агента гидрогенизации используют никель Ренея/H2 в метаноле, который является предпочтительным растворителем.
13. Способ по любому из пп.8-11, отличающийся тем, что в качестве восстанавливающего агента используют NaBH4/EtOH или предпочтительнo LiAlH4/ТГФ.
14. Способ по любому из пп.8-11, отличающийся тем, что в качестве ацилирующего агента используют изобутирилхлорид и в качестве основания используют триэтиламин.
15. Способ по любому из пп.10-14, отличающийся тем, что соединение формулы 6 превращают с помощью эквивалентного количества изобутирилхлорида в присутствии триэтиламина, используя один из соответствующих растворителей, таких как этилацетат, дихлорметан, тетрагидрофуран, ацетонитрил или толуол с направленной химической селективностью в R-(+)-2-(3-диизопропиламино-1-фенилпропил)-4-гидроксиметилфенилизобутират.
16. Способ по любому из пп.10-15, отличающийся тем, что R-(+)-2-(3-диизопропиламино-1-фенилпропил)-4-гидроксиметилфенилизобутират - сложный эфир и фумаровая кислота или хлористо-водородная кислота взаимодействуют с образованием соответствующей соли.
17. Способ по любому из пп.10-13, используемый для получения R-(+)-2-(3-диизопропиламино-1-фенилпропил)-4-гидроксиметилфенилизобутирата - сложного эфира гидрохлорида гидрата, заключающийся в том, что фенольную этерификацию R-(+)-2-(3-диизопропиламино-1-фенилпропил)-4-гидроксиметилфенола (6) осуществляют без прибавления основания из вне, при этом растворы (6) прикапывают в раствор хлорида изобутирата, который содержит по крайней мере 1 мольный эквивалент воды, чтобы непосредственно получить соответствующий устойчивый, гидратсодержащий гидрохлорид.
Текст
005588 Настоящее изобретение касается высокочистых, кристаллических, устойчивых соединений, представляющих собой новые производные 3,3-дифенилпропиламинов в форме их солей, способа их получения, а также высокочистых, устойчивых, промежуточных продуктов. Новые производные 3,3-дифенилпропиламинов известны из документа РСТ/ЕР 99/03212. Они являются ценными пролекарствами для лечения недержания мочи и других спазматических заболеваний, которые преодолевают недостатки активных соединений, применяемых в настоящее время, а именно неадекватное поглощение активного соединения биологическими мембранами или их неблагоприятный метаболизм. Кроме того, указанные новые пролекарства обладают улучшенными фармакокинетическими характеристиками, сравнимыми с характеристиками оксибутина и толтеродина. Предпочтительными соединениями из группы указанных новых производных 3,3-дифенилпропиламинов являются сложные эфиры алифатических или ароматических карбоновых кислот общей формулы А, представленной ниже где R представляет собой C1-С 6-алкил, С 3-С 10-циклоалкил или незамещенный или замещенный фенил. Они могут существовать в виде их оптических изомеров, образующих рацемические смеси и в форме индивидуальных энантиомеров. Соединения со структурной формулой А, однако, обладают низкой растворимостью в воде. Это ограничивает их оральную биопригодность. Наконец, моноэфиры структуры, как показано в формуле А, обладают тенденцией к внутримолекулярной трансэтерификации. Таким образом, в течение длительного периода хранения, по мере того как содержание соединений со структурой общей формулы А падает, наблюдается увеличение содержания диэфиров и свободного спирта. В основном соли соединений общей формулы А могут быть получены, если растворы соединений формулы А (основной компонент) обрабатывают с помощью растворов кислот в подходящих растворителях, но соли, полученные в твердом виде, могут оказаться или аморфными и/или гигроскопичными и не могут непосредственно кристаллизоваться из обычных растворителей. Такие соли имеют неадекватную химическую стабильность и не могут обрабатываться как галены ценных фармацевтически активных соединений. Удивительно, но было найдено, что упомянутые выше недостатки могут быть преодолены, если соединения структуры общей формулы А в случае, если они приготовлены в особом реакционном процесе,превращаются с помощью физиологически приемлемой неорганической или органической кислоты с общей формулой Н-Х-, в которой Х- представляет собой остаток соответствующей кислоты, в соответствующую соль общей формулы Таким образом, задачей настоящего изобретения является создание высокочистых, кристаллических, устойчивых соединений, которые представляют собой новые производные 3,3-дифенилпропиламинов в форме их солей, что позволяет избежать устойчивые недостатки этих производных, и которые с успехом пригодны для использования в фармацевтических составах и при этом могут быть в них введены. Дальнейшей задачей настоящего изобретения является создание способа получения указанных высокочистых, кристаллических, устойчивых соединений в форме их солей, а также высокочистых, устойчивых промежуточных продуктов.-1 005588 И, наконец, задачей изобретения является создание способа получения указанных выше соединений, который с учетом высокого выхода и соответствующих промежуточных продуктов может обладать высокой химической направленной селективностью. Указанные задачи решаются за счет высокочистых, кристаллических, устойчивых соединений, являющихся производными 3,3-дифенилпропиламинов в форме их солей с общей формулой I где R представляет собой C1-С 6-алкил, С 3-С 10-циклоалкил, замещенный или незамещенный фенил и Хпредставляет собой кислотный остаток физиологически приемлемой неорганической или органической кислоты. В соответствии с задачей изобретения соли общей формулы I могут содержать соответствующий кислотный остаток Х- таких кислот, как хлористо-водородной(соляной) кислоты, бромисто-водородной кислоты, фосфорной кислоты, серной кислоты, азотной кислоты, уксусной кислоты, пропионовой кислоты, пальмитиновой кислоты, стеариновой кислоты, малеиновой кислоты, фумаровой кислоты, щавелевой кислоты, сукциновой кислоты, DL-яблочной кислоты, L-(-)-яблочной кислоты, D-(+)-яблочной кислоты,DL-винной кислоты, L-(+)-винной кислоты, D-(-)-винной кислоты, лимонной кислоты, L-аспартановой кислоты, L-(+)-аскорбиновой кислоты, D-(+)-глюкуроновой кислоты, 2-оксопропионовой кислоты (пировиноградной кислоты), фуран-2-карбоновой кислоты (слизовой кислоты), бензойной кислоты, 4 гидроксибензойной кислоты, салициловой кислоты, ванилиновой кислоты, 4-гидроксикоричной кислоты, галловой кислоты, гиппуровой кислоты (N-бензоилглицин), ацетилмочевой кислоты (Nацетилглицин), флоретиновой кислоты (3-(4-гидроксифенил)пропионовой кислоты), фталевой кислоты,метансульфоновой кислоты или оротовой кислоты. В соответствии с другим воплощением изобретения обеспечиваются соединения общей формулы 2 с R-конфигурацией где R представляет собой C1-С 6-алкил, С 3-С 10-циклоалкил, замещенный или незамещенный фенил и Хявляется кислотным остатком физиологически приемлемой неорганической или органической кислоты. В соответствии с предпочтительным воплощением изобретения соединения в форме их солей общей формулы 2 могут содержать соответствующий кислотный остаток Х- кислот, приведенных ниже: хлористо-водородной (соляной) кислоты, бромисто-водородной кислоты, фосфорной кислоты, серной кислоты, азотной кислоты, уксусной кислоты, пропионовой кислоты, пальмитиновой кислоты, стеариновой кислоты, малеиновой кислоты, фумаровой кислоты, щавелевой кислоты, сукциновой кислоты,DL-яблочной кислоты, L-(-)-яблочной кислоты, D-(+)-яблочной кислоты, DL-винной кислоты, L-(+)винной кислоты, D-(-)-винной кислоты, лимонной кислоты, L-аспартановой кислоты, L-(+)аскорбиновой кислоты, D-(+)-глюкуроновой кислоты, 2-оксопропионовой кислоты (пировиноградной кислоты), фуран-2-карбоновой кислоты (слизовой кислоты), бензойной кислоты, 4-гидроксибензойной кислоты, салициловой кислоты, ванилиновой кислоты, 4-гидроксикоричной кислоты, галловой кислоты,гиппуровой кислоты (N-бензоилглицин), ацетилмочевой кислоты (N-ацетилглицин), флоретиновой кислоты (3-(4-гидроксифенил)пропионовой кислоты), фталевой кислоты, метансульфоновой кислоты или оротовой кислоты. Предпочтительными соединениями в соответствии с настоящим изобретением являются соли:R-(+)-2-(3-диизопропиламино-1-фенилпропил)-4-гидроксиметилфенилизобутират, сложный эфир гидрофумарат иR-(+)-2-(3-диизопропиламино-1-фенилпропил)-4-гидроксиметилфенилизобутират, сложный эфир гидрохлорид гидрат.-2 005588 Далее предпочтительными являются соединения, в которых R обозначает циклопропил, циклобутил, циклопентил, циклогексил, 4-(1-циклопропилметаноилокси)фенил, 4-(1-циклобутилметаноилокси) фенил, 4-(1-циклогексилметаноилокси)фенил или 4-(2,2-диметилпропаноилокси)фенил и Х- обозначает хлорид. Особенно предпочтительными являются [(R)-3-(2-1-[4-(1-циклопропилметаноилокси)фенил]метаноилокси-5-гидроксиметилфенил)-3-фенилпропил]диизопропиламмоний хлорид, [(R)-3-(2-1-[4-(1-циклобутилметаноилокси)фенил]метаноилокси-5-гидроксиметилфенил)-3-фенилпропил]диизопропиламмоний хлорид, [(R)-3-(2-1-[4-(1-циклогексилметаноилокси)фенил]метаноилокси-5-гидроксиметилфенил)3-фенилпропил]диизопропиламмоний хлорид, [(R)-3-(2-1-[4-(2,2-диметилпропаноилокси)фенил]метаноилокси-5-гидроксиметилфенил)-3-фенилпропил]диизопропиламмоний хлорид, (R)-3-[2-(1-циклопропилметаноилокси)-5-гидроксиметилфенил]-3-фенилпропилдиизопропиламмоний хлорид, (R)-3-[2-(1 циклобутилметаноилокси)-5-гидроксиметилфенил]-3-фенилпропилдиизопропиламмоний хлорид, (R)3-[2-(1-циклопентилметаноилокси)-5-гидроксиметилфенил]-3-фенилпропилдиизопропиламмоний хлорид и (R)-3-[2-(1-циклогексилметаноилокси)-5-гидроксиметилфенил]-3-фенилпропилдиизопропиламмоний хлорид. В соединениях по настоящему изобретению выражение "алкил" предпочтительно обозначает прямую или разветвленную углеводородную группу, содержащую от 1 до 6 С-атомов. Предпочтение отдается метилу, этилу, пропилу, изопропилу, бутилу, изобутилу, пентилу и гексилу. Выражение "циклоалкил" обозначает циклические углеводородные группы, имеющие от 3 до 10 атомов углерода, которые могут содержать пригодные заместители вместо атомов водорода. Выражение "фенил" обозначает -С 6 Н 5 группу, которая может быть замещенной или незамещенной. Пригодными заместителями могут быть,например, алкил, алкокси, галоген, нитро и амин. Выражение "алкокси" имеет со сноской на алкильный компонент то же значение, что дано для "алкила". Пригодные галогены включают атомы фтора, хлора,брома и йода. Настоящее изобретение также включает способы получения соединений в соответствии с изобретением общей формулы I, а также ценные промежуточные продукты. Способ характеризуется химической и направленной селективностью. Соединения общей формулы где R представляет собой C1-С 6-алкил, С 3-С 10-циклоалкил, замещенный или незамещенный фенил и Хпредставляет собой остаток кислоты физиологически приемлемой неорганической или органической кислоты, получают следующим образом: а) соединение формулы III расщепляют с помощью агента гидрогенизации с образованием соединения формулы Vb) соединение формулы V, полученное указанным путем, обрабатывают восстанавливающим агентом, чтобы получить соединение формулы VI Формула VI с) которое обрабатывают ацилирующим агентом, чтобы получить соединение формулы Аd) переводят с помощью физиологически приемлемой неорганической или органической кислоты в соединение формулы I где R представляет собой C1-С 6-алкил, С 3-С 10-циклоалкил, незамещенный или замещенный фенил и Хявляется кислотным остатком физиологически приемлемой неорганической или органической кислоты. В соответствии с изобретением для получения соединений общей формулы I используют хлористоводородную кислоту, бромисто-водородную кислоту, фосфорную кислоту, серную кислоту, азотную кислоту, уксусную кислоту, пропионовую кислоту, пальмитиновую кислоту, стеариновую кислоту, малеиновую кислоту, фумаровую кислоту, щавелевую кислоту, сукциновую кислоту, DL-яблочную кислоту,L-(-)-яблочную кислоту, D-(+)-яблочную кислоту, DL-винную кислоту, L-(+)-винную кислоту, D-(-)винную кислоту, лимонную кислоту, L-аспартановую кислоту, L-(+)-аскорбиновую кислоту, D-(+)глюкуроновую кислоту, 2-оксопропионовую кислоту (пировиноградную кислоту), фуран-2-карбоновую кислоту (слизевую кислоту), бензойную кислоту, 4-гидроксибензойную кислоту, салициловую кислоту,ванилиновую кислоту, 4-гидроксикоричную кислоту, галловую кислоту, гиппуровую кислоту (Nбензоилглицин), ацетилмочевую кислоту (N-ацетилглицин), флоретиновую кислоту (3-(4 гидроксифенил)пропионовую кислоту), фталевую кислоту, метансульфоновую кислоту или оротовую кислоту. В соответствии с еще одним воплощением изобретения описан способ получения соединений Rконфигурации общей формулы 2 где R представляет собой C1-С 6-алкил, С 3-С 10-циклоалкил, замещенный или незамещенный фенил и Хявляется кислотным остатком физиологически приемлемой неорганической или органической кислоты,который заключается в том, что а) соединение формулы 3 расщепляют с помощью агента гидрогенизации с образованием соединения формулы 5b) соединение формулы 5, полученное таким образом, обрабатывают восстанавливающим агентом,чтобы получить соединение формулы 6 которое обрабатывают с) ацилирующим агентом, чтобы получить соединение формулы 1d) превращают с помощью физиологически приемлемой неорганической или органической кислоты в соединении формулы 2 где R представляет собой C1-С 6-алкил, С 3-С 10-циклоалкил, незамещенный или замещенный фенил и Хявляется кислотным остатком физиологически приемлемой неорганической или органической кислоты. Преимущественно для того, чтобы получить соединения общей формулы 2, используют хлористоводородную кислоту, бромисто-водородную кислоту, фосфорную кислоту, серную кислоту, азотную кислоту,уксусную кислоту, пропионовую кислоту, пальмитиновую кислоту, стеариновую кислоту, малеиновую кислоту, фумаровую кислоту, щавелевую кислоту, сукциновую кислоту, DL-яблочную кислоту, L-(-)-яблочную-5 005588 кислоту, D-(+)-яблочную кислоту, DL-винную кислоту, L-(+)-винную кислоту, D-(-)-винную кислоту, лимонную кислоту, L-аспартановую кислоту, L-(+)-аскорбиновую кислоту, D-(+)-глюкуроновую кислоту, 2 оксопропионовую кислоту (пировиноградную кислоту), фуран-2-карбоновую кислоту (слизевую кислоту),бензойную кислоту, 4-гидроксибензойную кислоту, салициловую кислоту, ванилиновую кислоту, 4 гидроксикоричную кислоту, галловую кислоту, гиппуровую кислоту (N-бензоилглицин), ацетилмочевую кислоту (N-ацетилглицин), флоретиновую кислоту (3-(4-гидроксифенил)пропионовую кислоту), фталевую кислоту, метансульфоновую кислоту или оротовую кислоту. Особое преимущество имеется, когда на базе кристаллического R-(-)-4-бензилокси-3-(3 диизопропиламино-1-фенилпропил)бензойной кислоты сложного метилового эфира получают высокочистый,кристаллический промежуточный продукт R-(-)-3-(3-диизопропиламинофенилпропил)-4-гидроксибензойной кислоты сложный метиловый эфир, который восстанавливают до R-(+)-2-(3-диизопропиламино-1 фенилпропил)-4-гидроксиметилфенола, который наконец ацилируют по известной методике и затем превращают с помощью физиологически приемлемой неорганической или органической кислоты в условиях спонтанной кристаллизации в высокочистую, кристаллическую, устойчивую соль. Исходя из хлорангидрида кислоты, получают соединения общей формулы 1 где R представляет собой C1-С 6-алкил, особенно изопропил, С 3-С 10-циклоалкил или незамещенный или замещенный фенил. Чтобы получить соединения в соответствии с изобретением в форме их солей, решающим является проведение специального реакционного процесса через определенные промежуточные стадии и индивидуально подобранные промежуточные продукты. Это можно объяснить, используя реакционную схему 1, согласно которой происходят превращения соединений R-конфигурации, но этим объяснения не ограничиваются. Среди них 3 = метиловый эфир R-(-)-4-бензилокси-3-(3-диизопропиламино-1-фенилпропил)бензойной кислоты; 4 = R-(+)-[4-бензилокси-3-(3-диизопропиламино-1-фенилпропил)фенил]метанол; 5 = метиловый эфир R-(-)-3-(3-диизопропиламинофенилпропил)-4-гидроксибензойной кислоты; 6 = R-(+)-2-(3-диизопропиламино-1-фенилпропил)-4-гидроксиметилфенол; 1 = R-(+)-2-(3-диизопропиламино-1-фенилпропил)-4-гидроксиметил фенилизобутират, сложный эфир; 2 а = R-(+)-2-(3-диизопропиламино-1-фенилпропил)-4-гидроксиметилфенилизобутират, сложный эфир гидрофумарат; 2b=R-(+)-2-(3-диизопропиламино-1-фенилпропил)-4-гидроксиметилфенилизобутират,сложный эфир, гидрохлорид гидрат. В соответствии с реакционным процессом, описанным в данном воплощении изобретения, на предварительной стадии получают соединение 3 (метиловый эфир (R-(-)-4-бензилокси-3-(3-диизопропиламино-1 фенилпропил)бензойной кислоты в кристаллически чистой форме. Используя обычные реагенты - такие как ВВr3, АlСl3 - но предпочтительно газообразный водород в присутствии никеля Ренея в метаноле в качестве растворителя, при комнатной температуре (КТ), продукт 3 расщепляют до 5 (метилового эфира R-(-)-3-(3-диизопропиламинофенилпропил)-4-гидроксибензойной кислоты). Этот процесс приводит к высокочистой кристаллической форме (точка плавления 143,7 С). Наконец, используя пригодный восстанавливающий агент, такой как NaBH4/EtOH, предпочтительно LiAlH4, 5 восстанавливают в инертном растворителе при низкой температуре (от -78 до +10 С) и получают соединение 6 (R-(+)-2-(3-диизопропиламино-1-фенилпропил)-4-гидроксиметилфенол). Соединение 6 получают в высокочистом состоянии, и оно может быть перекристаллизовано из пригодного растворителя, такого как этилацетат. Получают бесцветный, компактный зернистый продукт, который имеет точку плавления 102,3 С. Это удивляет, поскольку соединение 6 в уровне техники описано, как аморфное вещество. Затем соединение 6 ацилируют с очень хорошим выходом, а также химической и направленной селективностью с получением фенольного сложного эфира. Указанную реакцию осуществляют при комнатной температуре или низкой температуре с эквивалентным количеством хлорангидрида кислоты в присутствии основания в пригодном растворителе. Пригодным растворителем является этилацетат, дихлорметан, тетрагидрофуран, ацетонитрил или толуол. Реакцию предпочтительно осуществляют с изобутирилхлоридом в качестве хлорангидрида кислоты и триэтиламином в качестве основания при температуре окружающей среды.-6 005588 1 - (R-(+)-2-(3-диизопропиламино-1-фенилпропил)-4-гидроксиметилфенилизобутират, сложный эфир) полученный затем, оказывается такой чистоты, что в присутствии растворов фумаровой кислоты в пригодных растворителях начинается спонтанная кристаллизация с образованием соли гидрофумарата 2 а. Полученная соль имеет высокую точку плавления 103 С, является устойчивой при комнатной температуре, не гигроскопична, не содержит кристаллозных агентов. Она может быть перекристаллизована так часто, как требуется. Если вместо фумаровой кислоты используют хлористый водород (безводную соляную кислоту),например в виде эфирного раствора, образование соли также имеет место с получением кристаллического продукта 2b (R-(+)-2-(3-диизопропиламино-1-фенилпропил)-4-гидроксиметилфенилизобутирата),эфира гидрохлорида гидрата. После дальнейшей перекристаллизации продукт 2b имеет точку плавления в интервале 97-106 С. Наконец, продукт 2b может быть преимущественно получен, следуя следующим вариантам реакционного процесса с инверсией, исходя из соединения 6 на реакционной схеме 1. Продукт 2b может быть таким образом получен без прибавления внешнего кислотнонейтрализующего основания, как описано далее. Раствор 6 (R-(+)-2-(3-диизопропиламино-1-фенилпропил)-4-гидроксиметил фенола) по каплям добавляют в раствор хлорида изобутирата, таким образом, что в условиях приемлемой полярности безводный продукт 2b быстро выкристаллизовывается. Соединение 2b является очень гигроскопичным. Если упомянутую выше реакцию осуществляют во влажном растворителе, который содержит по крайней мере 1 мольный эквивалент воды, получают устойчивый и кристаллический гидратсодержащий продукт 2b, который имеет приведенную выше точку плавления. Соединения по изобретению общих формул 1 и 2 соответствуют сыпучим продуктам. Особенно имеют преимущества высокочистые соединения общих формул III, V, VI, 3, 5, 6 и 7, которые могут быть получены. Соединение формулы III[(R)-3-(2-1-[4-(2,2-Диметилпропаноилокси)фенил]метаноилокси-5-1-[4-(2,2-диметилпропаноилокси)фенил]метаноилоксиметилфенил)-3-фенилпропил]диизопропиламмоний хлорид. Упомянутые выше соединения III, V, VI, 3, 5, 6 и 7 особенно пригодны для использования в каждом случае в виде высокочистого, кристаллического, устойчивого промежуточного продукта для получения фармацевтически приемлемых соединений. Особенно предпочтительны соединения для использования в качестве промежуточного продукта при получении R-(+)-2-(3-диизопропиламино-1-фенилпропил)-4-гидроксиметилфенилизобутирата сложного эфира гидрофумарата и R-(+)-2-(3-диизопропиламино-1-фенилпропил)-4-гидроксиметилфенилизобутирата - сложного эфира гидрохлорида гидрата. Наконец, способ может быть осуществлен особенно удачно путем взаимодействия соединения общей формулы 6 (см. схему реакции 1) с эквивалентным количеством изобутирилхлорида в присутствии триэтиламина, используя один из соответствующих растворителей, таких как этилацетат, дихлорметан,тетрагидрофуран, ацетонитрил или толуол, что позволяет с направленной химической селективностью получить R-(+)-2-(3-диизопропиламино-1-фенилпропил)-4-гидроксиметилфенилизобутират - сложный эфир. В соответствии с изобретением R-(+)-2-(3-диизопропиламино-1-фенилпропил)-4-гидроксиметилфенилизобутират - сложный эфир, особенно пригоден для взаимодействия с фумаровой кислотой или хлористо-водородной (соляной) кислотой с образованием соответствующей соли. Следующие воплощения раскрывают изобретение. Экспериментальная частьI. Общий процесс. Все соединения были полностью охарактеризованы с помощью 1 Н и 13 С ЯМР-спектров (Bruker DPX 200). Указанные химсдвиги в 13 С-ЯМР-спектре (50 мГц, определен в част. на млн) относятся к резонан-8 005588 сам растворителя СDСl3 (77,10 част. на млн). 1 Н ЯМР данные (CDCl3; 200 мГц, част. на млн) относятся к внутреннему стандарту (тетраметилсилану). Тонкослойную хроматографию (DC, Rf) осуществляют на 5 х 10 см Е. Merck силикагельной пленке(60F254) и пятна проявляют с помощью флуоресенции или опрыскиванием щелочным раствором перманганта калия. Системы поглощения: (1), н-гексан/ацетон/триэтиламин (70/20/10, об./об.-%); (2), толуол/ацетон/метанол/уксусная кислота (70/5/20/5, об./об.-%). Оптическое вращение измеряют при длине волны 589.3 нм (D-линия натрия) при комнатной температуре, используя этанол в качестве растворителя (прибор: Perkin Elmer Polarimeter Type 241), точки плавления (в С) неточны и их определяют на Mettler FP приборе или дифференциальным термоанализом(DSC) на Perkin Elmer аппарате Модели DSC7, используя "Pyris". УФ/VIS измерения проводят на спектрофотометре модели Lambda 7 (Perkin-Elmer) с толщиной слоя 1 см. Специфическую абсорбцию определяют для 1% раствора (A1%iсм). ИК спектр записывают на Perkin-Elmer FTIR спектрометре Series 1610 (гераствор 4 см-1). Газовую хроматографическую масс-спектрометрию (GC-MS, м/е) величины и относительную интенсивность по отношению к иону (%) определяют с помощью Finnigan TSQ 700 Triple Mass Спектрометра в позитивном (P-CI) или негативном (N-CI) химическом ионизационном измерительном аппарате с метаном или аммонием в качестве газовых реагентов или через процесс электронной ионизации. Гидроксисодержащие соединения измеряют в качестве производных триметилсилилэфиров. Связанную жидкостную хроматографию-масс-спектрометрию (ЖХ-МС): Waters' Integrity System,Thermabeam Mass Detector (El, 70 eV), м/е-величины и относительную интенсивность (%) измеряют в интервале сверх 50-500 а.т.и.II. Осуществление изобретения. Все арабские цифры в скобках (3), (4), (5), (6) соответствуют идентичным определениям на реакционной схеме 1. 1. Получение метилового эфира R-(-)-4-бензилокси-3-(3-диизопропиламино-1-фенилпропил)бензойной кислоты (3). Раствор гидрохлорида R-(-)-4-бензилокси-3-(3-диизопропиламино-1-фенилпропил)бензойной кислоты (2,30 кг, 4,77 моль) в 26,4 л метанола и 0,25 л концентрованной серной кислоты нагревают с рециклом в течение 16 ч. Затем треть растворителя отгоняют, охлаждают и при перемешивании смешивают с 5 кг льда и 2,5 л 25% водного раствора карбоната натрия. Осадок вначале экстрагируют 15 л и затем снова 5 л дихлорметана. Органические фазы очищают и концентрируют на роторном испарителе досуха. Получают 1,99 кг (90,7% от теории) темно-желтого масла с чистотой приблизительно 90% (DC, ЯМР). DC (1): 0.58. 13 С-ЯМР (CDCl3): 20.55, 20.65, 36.83, 41.84, 43.83, 51.82, 70.12, 111.09, 122.46, 125.28, 127.49,128.02, 128.35, 128.50, 129.22, 129.49, 133.20, 136.39, 144.51, 159.87, 167.09. Перекристаллизация. Растворяют 69,0 г маслянистого сырого продукта в 150 мл кипящего метанола. Затем прибавляют 15 мл дистиллированной воды и оставляют при 0 С, пока бесцветные кристаллы выпадают в осадок. Указанные кристаллы отфильтровывают, промывают с небольшим количеством метанола и сушат в вакууме. Выход: 41,8 г (60,6% от теории), бесцветные кристаллы, точка плавления 89,8 С; [I]D20=-30,7 Сырой продукт (3) (28 г), растворенный в 230 мл чистого диэтилового эфира, при перемешивании по каплям вводят в суспензию 1,8 г литийалюминий гидрида в диэтиловом эфире (140 мл). Через 18 ч-9 005588 перемешивания при комнатной температуре добавляют 4,7 мл воды. Органическую фазу отделяют, сушат над безводным сульфатом натрия, фильтруют и концентрируют на роторном испарителе досуха. Получают 26 г (98,9% от теории) R-(+)-[4-бензилокси-3-(3-диизопропиламино-1-фенилпропил)фенил]метанола (4) в виде бесцветного масла. DC (2): 0,32; [I]D20=+6,3 (с=1,0, этанол). 13 С-ЯМР (СDСl3): 20.53,20.61, 36.87, 41.65, 44.14, 48.82, 65.12, 70.09, 111.80, 125.77, 125.97, 126.94, 127.55, 128.08, 128.37, 128.44,133.27, 134.05, 134.27, 137.21, 144.84. 3. Получение метилового эфира R-(-)-3-(3-диизопропиламинофенилпропил)-4-гидроксибензойной кислоты (5). К перемешиваемой суспензии 5 г никеля Ренея (промытого водой, затем метанолом) в 200 мл метанола, добавляют 10 г (21,8 ммоль) метиловый эфир R-(-)-4-бензилокси-3-(3-диизопропиламино-1 фенилпропил)бензойной кислоты (3). Затем быстро нагревают, чтобы весь (3) полностью растворить, а затем установку помещают в атмосферу газообразного водорода. Через 3 ч перемешивания при обычном давлении и комнатной температуре, тонкослойная хроматография показывает полное завершение реакции превращения. Осадок продувают азотом, а затем добавляют некоторое количество активированного угля и фильтруют. Последующая концентрация метанольного раствора на роторном испарителе 6.0 г(75% от теории) приводит к метиловому эфиру R-(-)-3-(3-диизопропиламинофенилпропил)-4-гидроксибензойной кислоте (5) в форме бесцветных кристаллов с чистотой 99,6% (HPLC) (высокоэффективная жидкостная хроматография). Точка плавления 143,7 С; DSC 144,7 С [I]D20=-26,6 (с=0,93, этанол). 13 С-ЯМР (CDCl3): 18.74, 19.21,19.62, 33.12, 39.68, 42.36, 48.64, 51.42, 117.99, 120.32, 126.23, 127.81, 128.85, 129.39, 130.26, 132.21,144.06, 162.43, 167.35. 4. Получение R-(+)-2-(3-диизопропиламино-1-фенилпропил)-4-гидроксиметилфенола (6). а) Исходя из промежуточного продукта (4), R-(+)-[4-бензилокси-3-(3-диизопропиламино-1-фенилпропил)фенил]метанола.R-(+)-[4-бензилокси-3-(3-диизопропиламино-1-фенилпропил)фенил]метанол (19,7 г, 45,7 ммоль) растворяют в 220 мл метанола и никеля Ренея (5 г). Установку продувают водородом и осадок перемешивают в течение 2 дней при комнатной температуре. Затем прибавляют еще 5 г никеля Ренея и перемешивают дополнительно еще 2 дня при комнатной температуре в атмосфере водорода, с последующим отфильтровыванием катализатора и концентрированием досуха на роторном испарителе. Получают маслянистый бледно-желтый остаток, который растворяют в 100 мл диэтилового эфира, промывают дважды 100 мл воды, каждый раз сушат над сульфатом натрия, фильтруют и концентрируют досуха. Получают 14,1 г (90,4% от теории) R-(+)-2-(3-диизопропиламино-1-фенилпропил)-4-гидроксиметилфенол в форме окрашенного в кремовый цвет аморфного твердого вещества (перекристаллизация описана в с).b) Исходя из промежуточного соединенияR-(-)-3-(3 диизопропиламинофенилпропил)-4-гидроксибензойной кислоты. Раствор 370 мг (1,0 ммоль) метилового эфира R-(-)-3-(3-диизопропиламинофенилпропил)-4 гидроксибензойной кислоты в 20 мл безводного тетрагидрофурана медленно и при комнатной температуре прикапывают в перемешиваемую смесь сухого тетрагидрофурана (10 мл) и 1 М раствора литийалюминий гидрида в тетрагидрофуране (3 мл) (в защитной атмосфере азота). Избыток гидрида разрушают путем прикапывания насыщенного раствора карбоната натрия. Последующее отделение органической фазы и концентрирования на роторном испарителе, а затем сушка в высоком вакууме дает 274 мг (74% от теории) бледно-желтого масла, которое медленно затвердевает в аморфную массу.c) Перекристаллизация. Сырой продукт 6 (1,0 г) растворяют в этилацетате и снова концентрируют на роторном испарителе. К выделенному спирту из введенных таким образом растворителей (диэтилового эфира или тетрагидрофурана, см. выше) добавляют 1,5 мл этилацетата, слегка нагревая. Перемешивание проводят пока не об- 10005588 разуется прозрачный раствор, затем охлаждают при комнатной температуре и прибавляют насколько кристаллов затравки. Их получают путем очистки сырого 6 с помощью HPLC, собирают основную фракцию, концентрируют и остаток высушивают в течение нескольких часов в высоком вакууме. После того как проводят одну кристаллизацию до образования прозрачного раствора его оставляют при -10 С. Кристаллы отфильтровывают и держат на холоде, а затем сушат в вакууме. Получают бесцветные кристаллы с выходом 84%. Точка плавления 102,3 С, DC (1): 0,57 Раствор R-(+)-2-(3-диизопропиламино-1-фенилпропил)-4-гидроксиметилфенола (6) (65,0 г, 190.3 ммоль) и триэтиламина (20,4 г, 201,7 ммоль) добавляют в 750 мл дихлорметана, содержащего раствор хлорида изобутирата (23,4 г, 201,7 ммоль) в 250 мл дихлорметана, введенного при перемешивании и охлаждении. Проводят дополнительное перемешивание еще 15 мин при 0 С, затем 30 мин при комнатной температуре и затем последовательно промывают водой (250 мл) и 5% водным раствором карбоната натрия. Органическую фазу отделяют и концентрируют на роторном испарителе досуха. Сложный эфир R(+)-2-(3-диизопропиламино-1-фенилпропил)-4-гидроксиметилфенилизобутирата получают в виде бесцветного, вязкого масла; выход: 77,1 г (98,4% от теории). DC (1): 0,26; Раствор 41,87 г (102 ммоль) R-(+)-2-(3-диизопропиламино-1-фенилпропил)-4-гидроксиметилфенилизобутирата, сложного эфира в 90 мл 2-бутанона, содержащего фумаровую кислоту (11,81 г, 102 ммоль) добавляют при нагревании. После растворения кислоты, медленно добавляют циклогексан (20-30 мл) при перемешивании, пока не начнется помутнение. Бесцветный гомогенный остаток оставляют на 18 ч при комнатной температуре и затем на несколько часов при 0 С. Бесцветные кристаллы, выпавшие в осадок, отсасывают, промывают небольшим количеством циклогексана/2-бутанона (90:10, об.-%) и сушат в вакууме при 30 С. 44,6 г (83,1% от теории) гидрофумаровой соли R-(+)-2-(3-диизопропиламино-1 фенилпропил)-4-гидроксиметилфенилизобутирата, сложного эфира в форме бесцветных хлопьев. Точка плавления 98,8 С, вторая кристаллизация из той же смеси растворителей обеспечивает продукт с точкой плавления 103 С. [I]D20=+6,0 (c=1,0, этaнoл). Элементный анализ: Вычислено: C30H41NO7 (молекулярный вес 527.66) С 68,29%, Н 7,83%, N 2,65%, O 21,2%; найдено: С 68,29%, Н 7,90%, N 2,72%, O 21,0%. УФ/VIS прив нм (А 1% 1 cм): 191 (1306),193 (1305), 200 (1143), 220 (456). ИК: 3380, 2978, 2939, 2878, 2692, 2514, 1756, 1702, 1680, 1618, 1496,1468, 1226, 1040. 1019, 806, 1 Н ЯМР (СDСl3): 1.198, 1.285, 1.287 (СН 3); 2.541 (СНС=0); 3.589 (NCH); 4.585 Раствор R-(+)-2-(3-диизопропиламино-1-фенилпропил)-4-гидроксиметилфенилизобутирата, сложного эфира (8,54 г, 25,0 ммоль) в 50 мл дихлорметана медленно прикалывают при 0 С в перемешиваемый раствор хлорида изобутирата (2,66 г, 25,0 ммоль) в 100 мл дихлорметана. Через час охлаждение удаляют и вновь перемешивают еще 1 ч. После удаления летучих компонентов в вакууме на роторном испарителе остается бесцветная, аморфно-твердая пена. Этот остаток растворяют в ацетоне (17 мл), содержащем от 0,45 до 0,50 г воды и добавляют диэтиловый эфир (приблизительно 20-25 мл) пока не появится помутнение. После быстрой обработки ультразвуком начинается спонтанная кристаллизация, во время которой медленно вводят 80 мл диэтилового эфира. Выпавшие в осадок бесцветные кристаллы отсасывают и сушат в течение ночи в вакууме над пятиокисью фосфора. Получают 10,5 г (93,7% от теории) бесцветного кристаллического R-(+)-2-(3-диизопропиламино-1-фенилпропил)-4-гидроксиметилфенилизобутирата - сложного эфира гидрохлорида гидрата с чистотой 97,0% (HPLC). Точка плавления 97,1 С. с=+4.3 (с=1.03, этанол) 13 С-ЯМР (CDCl3): 16.94, 17.35, 18.24, 18.40, 18.87, 19.05, 31.20, 33.99, 41.64, 45.41, 54.18, 54.42,63.83, 122.25, 126.50, 126.70, 126.96, 127.34, 128.60, 133.80, 140.55, 142.17, 147.68, 175.79. 8. Фенольный моноэфир. Общая методика получения фенольных моноэфиров В раствор 120,3 мг (0.352 ммоль) R-(+)-2-(3-диизопропиламино-1-фенилпропил)-4-гидроксифенола(6) в 5 мл дихлорметане, при перемешивании при 0 С прикапывают раствор хлорангидрида кислоты(0,352 ммоль) в 2 мл дихлорметана. Затем добавляют триэтиламиндихлорметан (49,1 мкл/0,353 ммоль-2 мл). Через 18 ч при комнатной температуре тонкослойная хроматография показывает, что превращение завершено. Осадок промывают последовательно 5 мл воды, водной 0,1N-хлористо-водородной кислотой,5 мл 5% водного раствора гидрокарбоната натрия, 5 мл воды, сушат над сульфатом натрия, а затем фильтруют и концентрируют досуха. Затем сушат под высоким вакуумом, пока вес не станет постоянным. Следующие соединения получают, используя указанный способ:R-(+)-4-этилкарбонилоксибензойной кислоты-2-(3-диизопропиламино-1-фенилпропил)-4-гидроксиметилфенил - эфир гидрохлорид. Бесцветные кристаллы, точка плавления 195-8 С. 1 Н-ЯМР (DMSO-d6): 9,87 (с, 1 Н может быть замещен с D2O, NH), 8,19-8,12 (м, 2 Н, фенил-Н), 7,55 (д,J=1,0 Гц, 1 Н, фенил-Н 3), 7,41-7,13 (м, 9 Н, фенил-Н), 5,28 (расширенный синглет, 1 Н может быть замещен с D2O, ОН), 4,53 (с, 2 Н, CH2), 4,23 (т, J=7,6 Гц, 1 Н, СН), 3,61-3,50 (м, 2 Н, 2 хСН(СН 3)2), 2,97-2,74 (м,2 Н, СН 2), 2,67 (q, J=7,4 Гц, 2 Н, СН 2), 2,56-2,43 (м, 2 Н, СН 2), 1,23-1,13 (м, 15 Н, 2 хСН(СН 3)2, СН 3)R-(+)-4-(изопропилкарбонилокси)бензойной кислоты-2-(3-диизопропиламино-1-фенилпропил)-4 гидроксиметилфенил - сложный эфир гидрохлорид. Бесцветные кристаллы, точка плавления 202-4 С. 1 Н-ЯМР (DMSO-d6): 9,73 (с, 1 Н может быть замещен D2O, NH), 8,19-8,12 (м, 2 Н, фенил-Н), 7,55 (д,J=1,4 Гц, 1 Н, фенил-Н 3), 7,42-7,14 (м, 9 Н, фенил-Н), 5,27 (расширенный синглет, 1 Н может быть замещен D2O, ОН), 4,53 (с, 2 Н, CH2), 4,23 (т, J=7,5 Гц, 1 Н, СН), 3,61-3,50 (м, 2 Н, 2 хСН(СН 3)2), 2,99-2,78 (м,3 Н, СН 2, СН(СН 3)2), 2,54-2,47 (м, 2 Н, СН 2), 1,29-1,13 (м, 18 Н, 3 хСН(СН 3)2).R-(+)-4-(циклопропилкарбонилокси)бензойной кислоты-2-(3-диизопропиламино-1-фенилпропил)-4 гидроксиметилфенил - эфир гидрохлорид. Бесцветные кристаллы, точка плавления 208-213 С. 1 Н ЯМР (DMSO-d6): 9,04 (с, 1 Н может быть замещен D2O, NH), 8,15-8,09 (м, 2 Н, фенил-Н), 7,53 ('d',1H, фенил-Н 3), 7,42-7,13 (м, 9 Н, фенил-Н), 5,25 (расширенный синглет, 1H может быть замещен D2O,ОН), 4,52 (с, 2 Н, СН 2), 4,23 (т, J=7,5 Гц, 1H, СН), 3,62-3,53 (м, 2 Н, 2 хСН(СН 3)2), 3,05-2,70 (м, 2 Н, СН 2),2,51-2,37 (м, 2 Н, СН 2), 2,01-1,89 (м, 1H, циклопропил-СН), 1,20-1,05 (м, 16 Н, 2 хСН(СН 3)2, 2 х циклопропил-СН 2). 13 С-ЯМР (DMSO-d6=39,7 част. на млн): 172,71, 163.93, 154.92, 147.16, 142.69, 141.03, 134.97, 131.76,128.60, 127.86, 126.76, 126.56, 126.06, 125.94, 122.95, 122.65, 62.65, 54.00, 53.89, 45.33, 41.63, 31.49, 18.10,17.98, 16.69, 16.51, 12.86, 9.52.R-(+)-4-(циклобутилкарбонилокси)бензойной кислоты-2-(3-диизопропиламино-1-фенилпропил)-4 гидроксиметилфенил - эфир гидрохлорид. Бесцветные кристаллы, точка плавления 201-6 С. 1 Н-ЯМР (DMSO-d6): 9,50 (с, 1H может быть замещен D2O, NH), 8,17-8,12 (м, 2 Н, фенил-Н), 7,54 (д,J=1,4 Гц, 1H, фенил-Н 3), 7,42-7,14 (м, 9 Н, фенил-Н), 5,25 (расширенный синглет, 1H может быть замещен D2O, ОН), 4,52 (с, 2 Н, СН 2), 4,23 (т, J=7,5 Гц, 1H, СН), 3,62-3,47 (м, 3 Н, циклобутил-СН,2 хСН(СН 3)2), 3,00-2,70 (м, 2 Н, CH2), 2,51-2,26 (м, 6 Н, CH2, 2 х циклобутил-СН 2), 2,10-1,85 (м, 2 Н, циклобутил-CH2), 1,22-1,12 (м, 12 Н, 2 х СН(СН 3)2).R-(+)-4-(циклогексилкарбонилокси)бензойной кислоты-2-(3-диизопропиламино-1-фенилпропил)-4 гидроксиметилфенил - эфир гидрохлорид. Бесцветные кристаллы, точка плавления 212-217 С. 1 Н ЯMP (DMSO-d6): 9,34 (с, 1H, может быть замещен D2O, NH), 8,16-8,12 (м, 2 Н, фенил-Н), 7,54 (д,J=1,4 Гц, 1H, фенил-Н 3), 7,39-7,14 (м, 9 Н, фенил-Н), 5,26 (t1, 1H, может быть замещен D2O, ОН), 4,53 (д,J=4,2 Гц, 2 Н, СН 2), 4,22 (т, J=7,5 Гц, 1 Н, СН), 3,62-3,48 (м, 2 Н, 2 хСН(СН 3)2), 3,00-2,60 (м, 3 Н, циклогексил-СН, CH2), 2,51-2,40 (м, 2 Н, СН 2), 2,07-1,98 (м, 2 Н, циклогексил-СН 2), 1,80-1,11 (м, 20 Н, 4 х циклогексил-СН 2, 2 хСН(СН 3)2). 9. Симметричные диэфиры. Общая методика получения симметричных диэфиров В раствор 7,30 г (21,4 ммоль) R-(+)-2-(3-диизопропиламино-1-фенилпропил)-4-гидроксифенола (6) в 100 мл дихлорметана, при перемешивании при 0 С прикапывают раствор хлорангидрида кислоты (49,2 ммоль) в 50 мл дихлорметана. Затем добавляют триэтиламиндихлорметан (6,86 мл/49,2 ммоль-50 мл). Через 1-3 ч при комнатной температуре тонкослойная хроматография показывает, что превращение завершено. Остаток последовательно промывают соответственно 100 мл воды, водным раствором 0,1Nсоляной кислоты, 5 мл 5% водным раствором гидрокарбоната натрия, 5 мл воды, сушат над сульфатом натрия, затем фильтруют и концентрируют досуха. Затем проводят сушку в высоком вакууме, пока вес не станет постоянным. Используя указанный способ, получают следующие соединения:R' не является одинаковым с R" Общая методика получения смешанных диэфиров В раствор 5,30 ммоль фенольного моноэфира общей формулы А в 40 мл дихлорметана при перемешивании при 0 С прикапывают раствор хлорангидрида кислоты (5,83 ммоль) в 15 мл дихлорметана. Затем добавляют триэтиламиндихлорметан (0,589 г/5,82 ммоль-15 мл). Через 18 ч при комнатной температуре тонкослойная хроматография показывает, что превращение завершено. Осадок последовательно промывают соответственно 50 мл воды, 0,1N-соляной кислотой, 5 мл 5% водным раствором гидрокарбоната натрия, 5 мл воды, сушат над сульфатом натрия и затем фильтруют и концентрируют досуха. Затем проводят сушку в высоком вакууме, пока вес не станет постоянным. Следующий пример проводят, используя указанную методику:[]D20=+14.6 (c=1, CHCl3). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения общей формулы I где R представляет собой C1-С 6-алкил, С 3-С 10-циклоалкил, незамещенный фенил или фенил, замещенный этилкарбонилокси, изопропилкарбонилокси, m-бутилкарбонилокси, циклопропилкарбонилокси, циклобутилкарбонилокси и циклогексилкарбонилокси и Х- является остатком физиологически приемлемой неорганической или органической кислоты. 2. Соединения по п.1, отличающиеся тем, что X- в каждом случае является кислотным остатком хлористо-водородной кислоты, бромисто-водородной кислоты, фосфорной кислоты, серной кислоты,азотной кислоты, уксусной кислоты, пропионовой кислоты, пальмитиновой кислоты, стеариновой кислоты, малеиновой кислоты, фумаровой кислоты, щавелевой кислоты, сукциновой кислоты, DL-яблочной кислоты, L-(-)-яблочной кислоты, D-(+)-яблочной кислоты, DL-винной кислоты, L-(+)-винной кислоты,- 15005588D-(-)-винной кислоты, лимонной кислоты, L-аспартановой кислоты, L-(+)-аскорбиновой кислоты, D-(+)глюкуроновой кислоты, 2-оксопропионовой кислоты (пировиноградной кислоты), фуран-2-карбоновой кислоты (слизовой кислоты), бензойной кислоты, 4-гидроксибензойной кислоты, салициловой кислоты,ванилиновой кислоты, 4-гидроксикоричной кислоты, галловой кислоты, гиппуровой кислоты (Nбензоилглицин), ацетилмочевой кислоты (N-ацетилглицин), флоретиновой кислоты (3-(4 гидроксифенил)пропионовой кислоты), фталевой кислоты, метансульфоновой кислоты или оротовой кислоты. 3. Соединения по п.1, отличающиеся тем, что они имеют общую формулу 2 где R представляет собой C1-С 6-алкил, С 3-С 10-циклоалкил, незамещенный фенил или фенил, замещенный этилкарбонилокси, изопропилкарбонилокси, m-бутилкарбонилокси, циклопропилкарбонилокси, циклобутилкарбонилокси и циклогексилкарбонилокси и Х- является остатком физиологически приемлемой неорганической или органической кислоты. 4. Соединения по п.3, отличающиеся тем, что X- в каждом случае является кислотным остатком хлористо-водородной кислоты, бромисто-водородной кислоты, фосфорной кислоты, серной кислоты,азотной кислоты, уксусной кислоты, пропионовой кислоты, пальмитиновой кислоты, стеариновой кислоты, малеиновой кислоты, фумаровой кислоты, щавелевой кислоты, сукциновой кислоты, DL-яблочной кислоты, L-(-)-яблочной кислоты, D-(+)-яблочной кислоты, DL-винной кислоты, L-(+)-винной кислоты,D-(-)-винной кислоты, лимонной кислоты, L-аспартановой кислоты, L-(+)-аскорбиновой кислоты, D-(+)глюкуроновой кислоты, 2-оксопропионовой кислоты (пировиноградной кислоты), фуран-2-карбоновой кислоты (слизовой кислоты), бензойной кислоты, 4-гидроксибензойной кислоты, салициловой кислоты,ванилиновой кислоты, 4-гидроксикоричной кислоты, галловой кислоты, гиппуровой кислоты (Nбензоилглицин), ацетилмочевой кислоты (N-ацетилглицин), флоретиновой кислоты (3-(4 гидроксифенил)пропионовой кислоты), фталевой кислоты, метансульфоновой кислоты или оротовой кислоты. 5. Соединения по пп.3 и 4, отличающиеся тем, что они представляют собой R-(+)-2-(3(диизопропиламино-1-фенилпропил)-4-гидроксиметилфенилизобутират) - сложный эфир гидрофумарат,R-(+)-2-(3-(диизопропиламино-1-фенилпропил)-4-гидроксиметилфенилизобутират) - сложный эфир гидрохлорид гидрат. 6. Соединения по пп.3 и 4, отличающиеся тем, что R представляет собой циклопропил, циклобутил,циклопентил, циклогексил, 4-(1-циклопропилметаноилокси)фенил, 4-(1-циклобутилметаноилокси)фенил), 4-(1-циклогексилметаноилокси)фенил или 4-(2,2-диметилпропаноилокси)фенил и Х- представляет собой хлорид. 7. Соединения по любому из пп.1-6, находящиеся в форме сыпучего продукта. 8. Способ получения соединений общей формулы I где R представляет собой C1-С 6-алкил, С 3-С 10-циклоалкил, незамещенный фенил или фенил, замещенный этилкарбонилокси, изопропилкарбонилокси, m-бутилкарбонилокси, циклопропилкарбонилокси, циклобутилкарбонилокси и циклогексилкарбонилокси и X- представляет собой остаток кислоты физиологически приемлемой неорганической или органической кислоты, при котором а) соединение формулы III расщепляют с помощью агента гидрогенизации с образованием соединения формулы Vb) соединение формулы V, полученное указанным путем, обрабатывают восстанавливающим агентом, чтобы получить соединение формулы VI Формула VI с) соединение формулы VI обрабатывают ацилирующим агентом, чтобы получить соединение формулы Аd) переводят с помощью физиологически приемлемой неорганической или органической кислоты в соединение формулы I где R представляет собой C1-С 6-алкил, С 3-С 10-циклоалкил, незамещенный или замещенный фенил и Xявляется кислотным остатком физиологически приемлемой неорганической или органической кислоты. 9. Способ по п.8, отличающийся тем, что для получения соединений общей формулы 1 используют хлористо-водородную кислоту, бромисто-водородную кислоту, фосфорную кислоту, серную кислоту,азотную кислоту, уксусную кислоту, пропионовую кислоту, пальмитиновую кислоту, стеариновую ки- 17005588 слоту, малеиновую кислоту, фумаровую кислоту, щавелевую кислоту, сукциновую кислоту, DLяблочную кислоту, L-(-)-яблочную кислоту, D-(+)-яблочную кислоту, DL-винную кислоту, L-(+)-винную кислоту, D-(-)-винную кислоту, лимонную кислоту, L-аспартановую кислоту, L-(+)-аскорбиновую кислоту, D-(+)-глюкуроновую кислоту, 2-оксопропионовую кислоту (пировиноградную кислоту), фуран-2 карбоновую кислоту (слизовую кислоту), бензойную кислоту, 4-гидроксибензойную кислоту, салициловую кислоту, ванилиновую кислоту, 4-гидроксикоричную кислоту, галловую кислоту, гиппуровую кислоту (N-бензоилглицин), ацетилмочевую кислоту (N-ацетилглицин), флоретиновую кислоту (3-(4 гидроксифенил)пропионовую кислоту), фталевую кислоту, метансульфоновую кислоту или оротовую кислоту. 10. Способ получения соединений общей формулы 2 где R представляет собой C1-С 6-алкил, С 3-С 10-циклоалкил, незамещенный фенил или фенил, замещенный этилкарбонилокси, изопропилкарбонилокси, m-бутилкарбонилокси, циклопропилкарбонилокси, циклобутилкарбонилокси и циклогексилкарбонилокси и Х- является кислотным остатком физиологически приемлемой неорганической или органической кислоты, который заключается в том, что а) соединение формулы 3 расщепляют с помощью агента гидрогенизации с образованием соединения формулы 5b) соединение формулы 5, полученное таким образом, обрабатывают восстанавливающим агентом,чтобы получить соединение формулы 6 которое обрабатывают с) ацилирующим агентом, чтобы получить соединение формулы 1d) превращают с помощью физиологически приемлемой неорганической или органической кислоты в соединение формулы 2 в которой R представляет собой C1-С 6-алкил, С 3-С 10-циклоалкил, незамещенный или замещенный фенил и Х- является кислотным остатком физиологически приемлемой неорганической или органической кислоты. 11. Способ по п.10, отличающийся тем, что для получения соединений общей формулы 2 используют хлористо-водородную кислоту, бромисто-водородную кислоту, фосфорную кислоту, серную кислоту, азотную кислоту, уксусную кислоту, пропионовую кислоту, пальмитиновую кислоту, стеариновую кислоту, малеиновую кислоту, фумаровую кислоту, щавелевую кислоту, сукциновую кислоту, DLяблочную кислоту, L-(-)-яблочную кислоту, D-(+)-яблочную кислоту, DL-винную кислоту, L-(+)-винную кислоту, D-(-)-винную кислоту, лимонную кислоту, L-аспартановую кислоту, L-(+)-аскорбиновую кислоту, D-(+)-глюкуроновую кислоту, 2-оксопропионовую кислоту (пировиноградную кислоту), фуран-2 карбоновую кислоту (слизевую кислоту), бензойную кислоту, 4-гидроксибензойную кислоту, салициловую кислоту, ванилиновую кислоту, 4-гидроксикоричную кислоту, галловую кислоту, гиппуровую кислоту (N-бензоилглицин), ацетилмочевую кислоту (N-ацетилглицин), флоретиновую кислоту (3-(4 гидроксифенил)пропионовую кислоту), фталевую кислоту, метансульфоновую кислоту или оротовую кислоту. 12. Способ по любому из пп.8-11, отличающийся тем, что в качестве агента гидрогенизации используют никель Ренея/Н 2 в метаноле, который является предпочтительным растворителем. 13. Способ по любому из пп.8-11, отличающийся тем, что в качестве восстанавливающего агента используют NaBH4/EtOH или пpeдпочтительнo LiAlH4/TГФ. 14. Способ по любому из пп.8-11, отличающийся тем, что в качестве ацилирующего агента используют изобутирилхлорид и в качестве основания используют триэтиламин. 15. Способ по любому из пп.10-14, отличающийся тем, что соединение формулы 6 превращают с помощью эквивалентного количества изобутирилхлорида в присутствии триэтиламина, используя один из соответствующих растворителей, таких как этилацетат, дихлорметан, тетрагидрофуран, ацетонитрил или толуол с направленной химической селективностью, в R-(+)-2-(3-диизопропиламино-1-фенилпропил)-4-гидроксиметилфенилизобутират. 16. Способ по любому из пп.10-15, отличающийся тем, что R-(+)-2-(3-диизопропиламино-1 фенилпропил)-4-гидроксиметилфенилизобутират - сложный эфир и фумаровая кислота или хлористоводородная кислота взаимодействуют с образованием соответствующей соли. 17. Способ по любому из пп.10-13, используемый для получения R-(+)-2-(3-диизопропиламино-1 фенилпропил)-4-гидроксиметилфенилизобутирата - сложного эфира гидрохлорида гидрата, заключающийся в том, что фенольную этерификацию R-(+)-2-(3-диизопропиламино-1-фенилпропил)-4 гидроксиметилфенола (6) осуществляют без прибавления основания из вне, при этом растворы (6) прикапывают в раствор хлорида изобутирата, который содержит по крайней мере 1 мольный эквивалент воды, чтобы непосредственно получить соответствующий устойчивый, гидратсодержащий гидрохлорид.
МПК / Метки
МПК: C07C 215/54
Метки: соли, 3,3-дифенилпропиламинов, производных
Код ссылки
<a href="https://eas.patents.su/21-5588-soli-proizvodnyh-33-difenilpropilaminov.html" rel="bookmark" title="База патентов Евразийского Союза">Соли производных 3,3-дифенилпропиламинов</a>
Предыдущий патент: Биоразлагаемый смазочный состав и его применение, в частности, в буровом растворе
Следующий патент: Прозрачное водное анестезирующее средство
Случайный патент: Опорная цапфа












