Новые соединения бензолсульфонамида, способ их получения и фармацевтические композиции их содержащие
Номер патента: 5376
Опубликовано: 24.02.2005
Авторы: Вессетт-Курше Кристин, Симоне Серж, Лавиелль Жильбер, Дюбюффе Тьерри, Вербёрен Тони, Симитьер Бернар
Формула / Реферат
1. Соединения формулы (I)
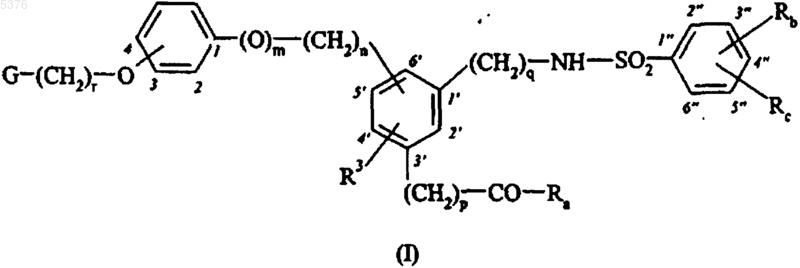
в которой G представляет собой группу, такую как
 ,
,
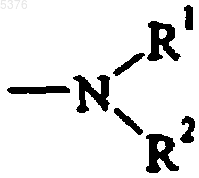
в которой R1 и R2 независимо представляют собой атом водорода или алкильную, циклоалкильную, необязательно замещенную арильную, необязательно замещенную арилалкильную, циклоалкильную, циклоалкилалкильную, необязательно замещенную гетероарильную или необязательно замещенную гетероарилалкильную группу, или
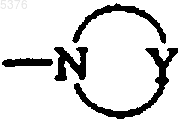
R1 и R2 совместно с атомом азота образуют гетероциклоалкильную группу формулы
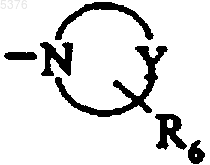 ,
,
которая имеет от 5 до 7 членов кольца, в которой Y представляет собой атом азота, атом кислорода или группу CH2 и R6 представляет собой атом водорода или алкильную, циклоалкильную, циклоалкилалкильную, необязательно замещенную арильную, необязательно замещенную арилалкильную, необязательно замещенную арилкарбонильную, необязательно замещенную арилкарбонилалкильную, необязательно замещенную диарилалкильную, необязательно замещенную диарилалкенильную, необязательно замещенную гетероарильную, необязательно замещенную гетероарилалкильную, необязательно замещенную гетероарилкарбонильную или необязательно замещенную гетероарилкарбонилалкильную группу,
R3 представляет собой атом водорода или алкильную или необязательно замещенную фенильную группу,
Ra представляет собой гидрокси, алкокси, необязательно замещенную арилокси, необязательно замещенную арилалкилокси, амино, алкиламино, диалкиламино, необязательно замещенную ариламино или необязательно замещенную арилалкиламиногруппу,
Rb и Rc, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода, атом галогена, алкильную группу, алкоксигруппу, гидроксигруппу или тригалоалкильную группу,
m представляет собой целое число от 0 до 1 включительно,
n и q представляют собой одинаковые или различные целые числа от 0 до 6 включительно,
p и r представляют собой одинаковые или различные целые числа от 1 до 6 включительно,
к их энантиомерам и диастереоизомерам, а также к их аддитивным солям с фармацевтически приемлемой кислотой или основанием,
причем
термин алкил обозначает линейную или разветвленную цепочку, имеющую от 1 до 6 атомов углерода,
термин алкокси обозначает линейную или разветвленную алкилоксигруппу, имеющую от 1 до 6 атомов углерода,
термин тригалоалкил обозначает углеродную цепочку, имеющую от 1 до 3 атомов углерода и от 1 до 3 одинаковых или различных атомов галогена,
термин алкенил обозначает цепочку, имеющую от 2 до 6 атомов углерода и содержащую от 1 до 3 двойных связей,
термин циклоалкил обозначает насыщенное циклическое кольцо, имеющее от 3 до 8 атомов углерода,
термин арил обозначает фенильную или нафтильную группу,
термин гетероарил обозначает ароматическую моноциклическую группу или бициклическую группу, у которой по меньшей одно из колец является ароматическим, имеющую от 5 до 11 членов кольца и от 1 до 5 гетероатомов, выбираемых из азота, кислорода и серы,
термины диарилалкил и диарилалкенил обозначают, соответственно, алкильную и алкенильную группы, как указано здесь ранее, замещенные двумя одинаковыми или различными арильными группами, как указано здесь ранее,
термин замещенный по отношению к фенилу, арилу, арилалкилу, арилкарбонилу, арилкарбонилалкилу, диарилалкилу, диарилалкенилу, гетероарилу, гетероарилалкилу, гетероарилкарбонилу, гетероарилкарбонилалкилу, ариламино и арилалкиламино обозначает, что группы, о которых идет речь, замещены в ароматической части одним или двумя одинаковыми или различными заместителями, выбираемыми из атомов галогенов алкильных групп, алкоксигрупп, гидроксигрупп, цианогрупп, нитрогрупп, аминогрупп (необязательно замещенных одной или двумя алкильными группами) и групп C(O)Rd, Rd представляет собой группу, выбираемую из гидрокси, алкокси и амино, в которой гетероарильные и гетероарилалкильные также могут быть замещены оксогруппой в неароматической части гетероарила.
2. Соединения формулы (I) по п.1, в которых p представляет собой 2, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
3. Соединения формулы (I) либо по п.1, либо по п.2, в которых q представляет собой 2, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
4. Соединения формулы (I) по любому из пп.1-3, в которых R3 представляет собой атом водорода, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
5. Соединения формулы (I) по любому из пп.1-4, в которых Ra представляет собой гидроксигруппу, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
6. Соединения формулы (I) по любому из пп.1-5, в которых Rb представляет собой атом галогена, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
7. Соединения формулы (I) по любому из пп.1-6, в которых Rc представляет собой атом водорода, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
8. Соединения формулы (I) по любому из пп.1-7, в которых p и q каждый представляет собой 2, Ra представляет собой гидроксигруппу, R3 и Rc каждый представляет собой атом водорода, Rb представляет собой атом галогена и G представляет собой амино, диалкиламино или арилалкиламиногруппу или гетероциклоалкильную группу формулы
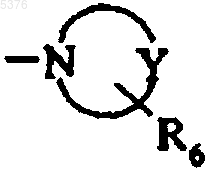
в которой Y представляет собой атом азота, атом кислорода или группу CH2 и R6 выбирают из атома водорода и групп: необязательно замещенного арила и необязательно замещенного гетероарила; их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
9. Соединения формулы (I) по любому из пп.1-8, в которых G представляет собой диалкиламиногруппу, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
10. Соединения формулы (I) по любому из пп.1-8, в которых G представляет собой замещенную гетероциклоалкильную группу
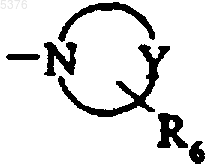 ,
,
в которой
представляет собой группу, имеющую 5 или 6 членов кольца, такую как пирролил, морфолино, пиперидил или пиперазинил, и
R6, замещенный на атоме углерода или азота гетероциклоалкила, представляет собой атом водорода, фениловый заместитель, необязательно замещенный атомом галогена, или гетероарильную группу, имеющую 9 членов кольца, которая содержит 1 или 2 гетероатома, выбираемых из азота, кислорода и серы, и необязательно замещен атомом галогена,
их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
11. Соединения формулы (I) по любому из пп.1-8 или 10, в которых необязательно замещенная гетероарильная группа представляет собой бензизоксазолильную группу, необязательно замещенную атомом галогена, или бензизотиазолильную группу, необязательно замещенную атомом галогена, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
12. Соединения формулы (I) по любому из пп.1-11, в которых заместитель G-(CH2)r-O- присоединен к 1 или 2 атомам углерода 2 или 4 фенильной группы, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
13. Соединения формулы (I) по любому из пп.1-12, в которых заместитель

присоединен к 5' атому углерода фенильной группы, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
14. Соединения формулы (I) по любому из пп.1-13, в которых Rb присоединен к 4" атому фенильной группы, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
15. Соединение формулы (I) по пп.1-9 и 12-14, которое представляет собой 3-[3-(2-{[(4-хлорофенил)сульфонил]амино}этил)-5-(2-{2-[3-(диметиламино)пропокси]фенил}этил)фенил]пропановую кислоту.
16. Соединения формулы (I) по пп.1-8, 10 и 12-14, которые представляют собой
3-[3-(2-{[(4-хлорофенил)сульфонил]амино)этил)-5-(2-{2-[2-(1-пирролидинил)этокси]фенил}этил)фенил]пропановую кислоту и
3-[3-(2-{[(4-хлорофенил)сульфонил]амино}этил)-5-(2-{2-[2-(4-морфолинил)этокси]фенил}этил)фенил]пропановую кислоту.
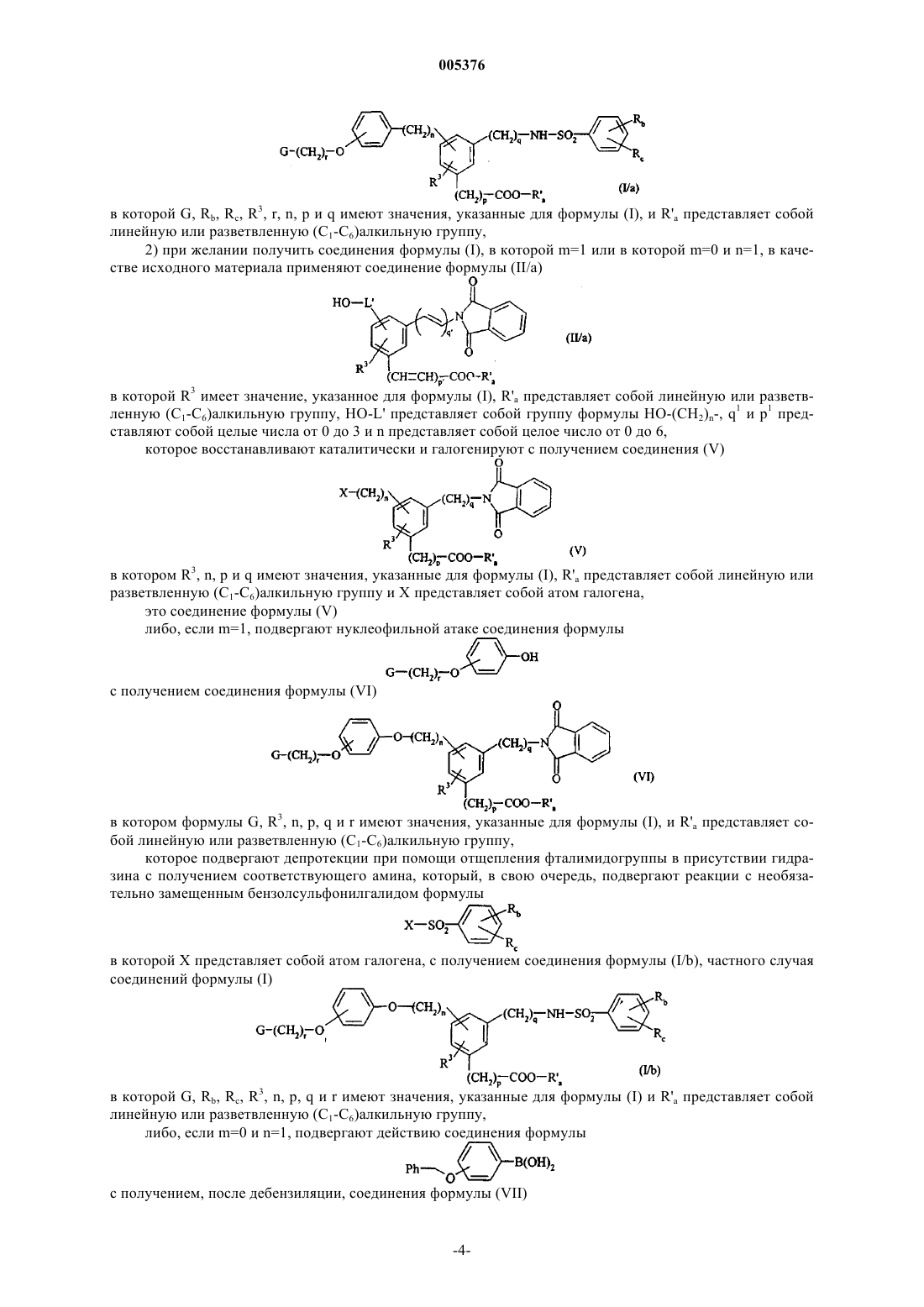
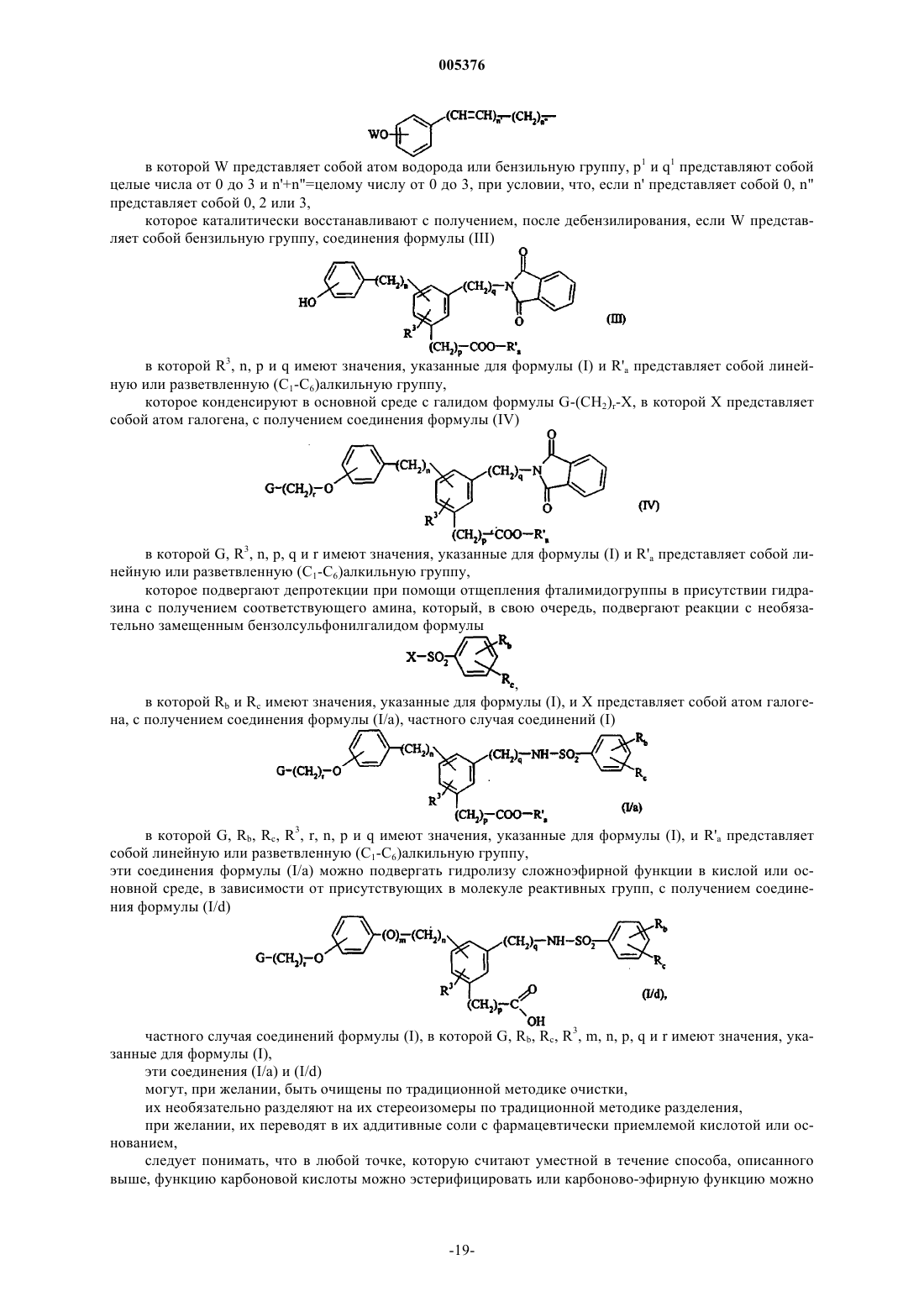
17. Способ получения соединений формулы (I) по п.1, отличающийся тем, что при желании получить соединения формулы (I), в которой m=0 и n отличен от 1, в качестве исходного материала применяют соединение формулы (II)
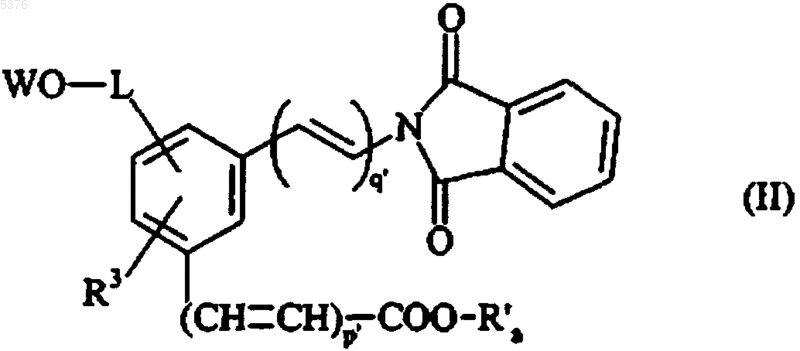
в которой R3 имеет значение, указанное для формулы (I), R'a представляет собой линейную или разветвленную (C1-C6)алкильную группу, WO-L представляет собой группу формулы
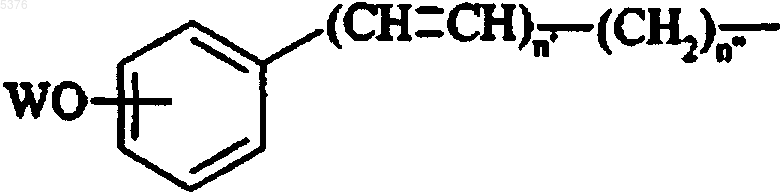
в которой W представляет собой атом водорода или бензильную группу, p1 и q1 представляют собой целые числа от 0 до 3 и n'+n"=целому числу от 0 до 3, при условии, что, если n' представляет собой 0, n" представляет собой 0, 2 или 3,
которое каталитически восстанавливают с получением, после дебензилирования, если W представляет собой бензильную группу, соединения формулы (III)
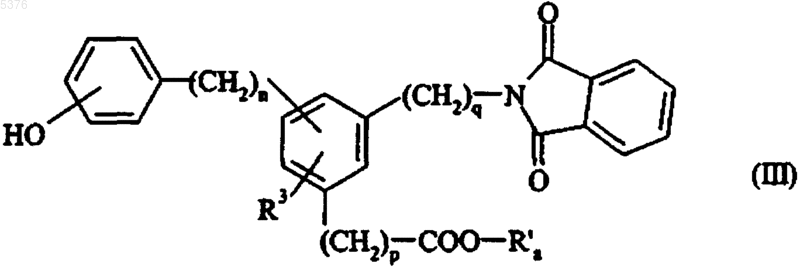
в которой R3, n, p и q имеют значения, указанные для формулы (I) и R'a представляет собой линейную или разветвленную (C1-C6)алкильную группу,
которое конденсируют в основной среде с галидом формулы G-(CH2)r-X, в которой X представляет собой атом галогена, с получением соединения формулы (IV)
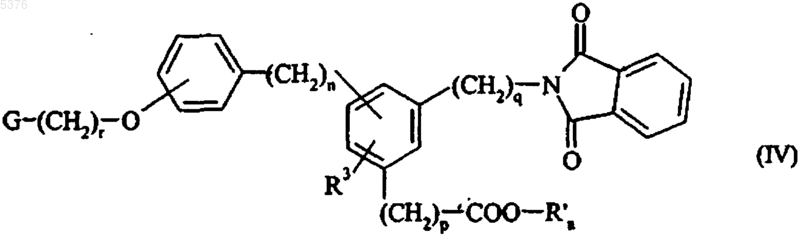
в которой G, R3, n, p, q и r имеют значения, указанные для формулы (I) и R'a представляет собой линейную или разветвленную (C1-C6)алкильную группу,
которое подвергают депротекции при помощи отщепления фталимидогруппы в присутствии гидразина с получением соответствующего амина, который, в свою очередь, подвергают реакции с необязательно замещенным бензолсульфонилгалидом формулы
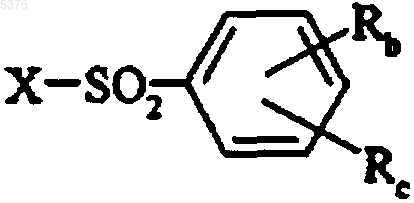 ,
,
в которой Rb и Rc имеют значения, указанные для формулы (I), и X представляет собой атом галогена, с получением соединения формулы (I/a), частного случая соединений (I)
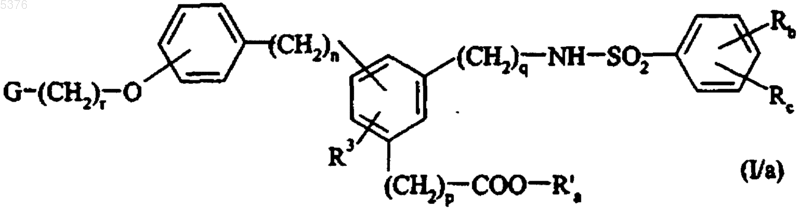
в которой G, Rb, Rc, R3, r, n, p и q имеют значения, указанные для формулы (I), и R'a представляет собой линейную или разветвленную (C1-C6)алкильную группу,
эти соединения формулы (I/a) можно подвергать гидролизу сложноэфирной функции в кислой или основной среде, в зависимости от присутствующих в молекуле реактивных групп, с получением соединения формулы (I/d)
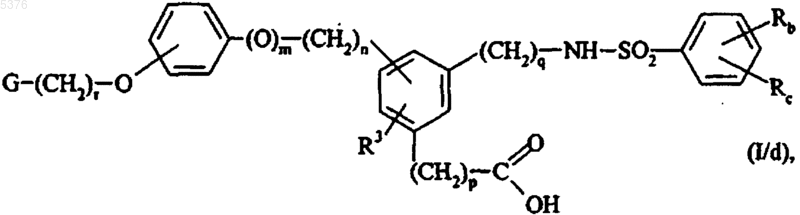
частного случая соединений формулы (I), в которой G, Rb, Rc, R3, m, n, p, q и r имеют значения, указанные для формулы (I),
эти соединения (I/a) и (I/d)
могут, при желании, быть очищены по традиционной методике очистки,
их необязательно разделяют на их стереоизомеры по традиционной методике разделения,
при желании, их переводят в их аддитивные соли с фармацевтически приемлемой кислотой или основанием,
следует понимать, что в любой точке, которую считают уместной в течение способа, описанного выше, функцию карбоновой кислоты можно эстерифицировать или карбоново-эфирную функцию можно гидролизировать до соответствующей кислоты, ее можно снова перевести в другой эфир, как это требуется для синтеза.
18. Фармацевтические композиции, включающие в качестве активного ингредиента по меньшей мере одно соединение по любому из пп.1-16, отдельно или в сочетании с одним или более фармацевтически приемлемыми, инертными, нетоксичными эксципиентами или носителями.
19. Фармацевтические композиции по п.18, содержащие по меньшей мере один активный ингредиент по любому из пп.1-16, для применения в производстве лекарственных препаратов, полезных в качестве антагонистов рецепторов TXA2 и рецепторов 5-HT2.
20. Фармацевтические композиции по п.18, содержащие по меньшей мере один активный ингредиент по любому из пп.1-16, для применения в производстве лекарственных препаратов, полезных при лечении атеротромботических сердечно-сосудистых заболеваний, таких как инфаркт миокарда, стенокардия, мозговые сосудистые травмы, болезнь Рейнауда (Raynaud), а также астмы и бронхоспазмов, так же как и мигрени и венозных заболеваний.
Текст
005376 Настоящее изобретение относится к новым соединениям бензолсульфонамида, к способу их получения и к фармацевтическим композициям, их содержащим. Соединения, имеющие бензолсульфонамидную цепочку, были описаны в заявке ЕР 864 561 в связи с их NO-дающим характером, а также с их антагонистическим характером по отношению к рецептору тромбоксана А 2 (ТХА 2), а также в заявках ЕР 648 741 или WO 9406761, исключительно в связи с их антагонистическими свойствами по отношению к рецептору ТХА 2. Соединения по настоящему изобретению имеют новую структуру, придающую им характер антагонистов по отношению к рецептору ТХА 2 и серотонинергическому рецептору 5 НТ 2. Скопления тромбоцитов и вазоплазмов играют существенную роль в этиологии и развитии атеротромботических сердечно-сосудистых заболеваний. ТХА 2, метаболит арахидоновой кислоты, и серотонин(5 НТ), нейротрансмиттер, оба являются сильными вазоконстрикторными агентами и способны индуцировать или усиливать активацию тромбоцитов, что ведет к их скоплению. На вазоконстрикторное и проагрегационное действие ТХА 2 оказывается влияние через промежуточные или мембранные рецепторы,которые называются ТР-рецепторы (Medicinal Research Reviews, 1991, 11, 5, стр. 503), в то время как на действие серотонина оказывается влияние через промежуточные рецепторы 5HT1 или 5 НТ 2 (T.I.P.S.,1991, 121, стр. 223). Стратегии исследования, разработанные с целью обнаружить агенты, которые блокируют продуцирование и/или активацию ТХА 2, привели к получению селективных антагонистов ТРрецептора, ингибиторов ТХА 2-синтазы либо смешанных агентов, которые проявляют оба эти свойства(Medicinal Research Reviews, там же., T.I.P.S., 1991, 121, 158). Подобно ТХА 2, серотонин действует, стимулируя тромбоциты и сжатие сосудов, и его активность, как было обнаружено, усиливается при атеротромботических заболеваниях. Идея о соединениях, которые противостоят как процессу, который вызывает активацию тромбоксана, так и процессу, который вызывает активацию серотонина, является чрезвычайно полезной для клинициста. Такие продукты имеют преимущество в том, что они предлагают более полную защиту как против активации тромбоцитов, так и против вазоплазмов. Таким образом, такие продукты будет возможно применять при лечении патологий, связанных и с повышенной активностью ТХА 2 и 5-НТ, особенно при лечении атеротромботических сердечно-сосудистых заболеваний, таких как инфаркт миокарда, стенокардия, мозговые сосудистые травмы, болезнь Рейнауда (Raynaud), а также астмы, и бронхоспазмов, так же как и мигрени и венозных заболеваний. Настоящее изобретение относится к соединениям формулы (I), в которой R1 и R2 независимо представляют собой атом водорода, или алкильную, циклоалкильную, необязательно замещенную арильную, необязательно замещенную арилалкильную, циклоалкильную, циклоалкилалкильную, необязательно замещенную гетероарильную или необязательно замещенную гетероарилалкильную группу, илиR1 и R2 совместно с атомом азота образуют гетероциклоалкильную группу формулы, которая имеет от 5 до 7 членов кольца, в которой Y представляет собой атом азота, атом кислорода или группу СН 2, и R6 представляет собой атом водорода или алкильную, циклоалкильную, циклоалкилалкильную,необязательно замещенную арильную, необязательно замещенную арилалкильную, необязательно замещенную арилкарбонильную, необязательно замещенную арилкарбонилалкильную, необязательно замещенную диарилалкильную, необязательно замещенную диарилалкенильную, необязательно замещенную гетероарильную, необязательно замещенную гетероарилалкильную, необязательно замещенную гетероарилкарбонильную или необязательно замещенную гетероарилкарбонилалкильную группу,R3 представляет собой атом водорода или алкильную или необязательно замещенную фенильную группу,Ra представляет собой гидрокси, алкокси, необязательно замещенную арилокси, необязательно замещенную арилалкилокси, амино, алкиламино, диалкиламино, необязательно замещенную ариламино или необязательно замещенную арилалкиламино группу,Rb и Rс, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода, атом галогена, алкильную группу, алкоксигруппу, гидроксигруппу или тригалоалкильную группу,m представляет собой целое число от 0 до 1 включительно,n и q представляют собой одинаковые или различные целые числа от 0 до 6 включительно,-1 005376 р и r представляют собой одинаковые или различные целые числа от 1 до 6 включительно,к их энантиомерам и диастереоизомерам, а также к их аддитивным солям с фармацевтически приемлемой кислотой или основанием,причем термин "алкил" обозначает линейную или разветвленную цепочку, имеющую от 1 до 6 атомов углерода,термин "алкокси" обозначает линейную или разветвленную алкилокси группу, имеющую от 1 до 6 атомов углерода,термин "тригалоалкил" обозначает углеродную цепочку, имеющую от 1 до 3 атомов углерода и от 1 до 3 одинаковых или различных атомов галогена,термин "алкенил" обозначает цепочку, имеющую от 2 до 6 атомов углерода и содержащую от 1 до 3 двойных связей,термин "циклоалкил" обозначает насыщенное циклическое кольцо, имеющее от 3 до 8 атомов углерода,термин "арил" обозначает фенильную или нафтильную группу,термин "гетероарил" обозначает ароматическую моноциклическую группу или бициклическую группу, у которой по меньшей мере одно из колец является ароматическим, имеющую от 5 до 11 членов кольца и от 1 до 5 гетероатомов, выбираемых из азота, кислорода и серы,термины "диарилалкил" и "диарилалкенил" обозначают, соответственно, алкильную и алкенильную группы, как указано здесь ранее, замещенные двумя одинаковыми или различными арильными группами, как указано здесь ранее, термин "замещенный" по отношению к фенилу, арилу, арилалкилу, арилкарбонилу, арилкарбонилалкилу, диарилалкилу, диарилалкенилу, гетероарилу, гетероарилалкилу, гетероарилкарбонилу, гетероарилкарбонилалкилу, ариламино и арилалкиламино обозначает, что группы, о которых идет речь, замещены в ароматической части одним или двумя одинаковыми или различными заместителями, выбираемыми из атомов галогенов и алкильных групп, алкоксигрупп, гидроксигрупп, цианогрупп, нитрогрупп, аминогрупп (необязательно замещенных одной или двумя алкильными группами) и групп C(O)Rd, Rd представляет собой группу, выбираемую из гидрокси, алкокси и амино, в которой гетероарильные и гетероарилалкильные также могут быть замещены оксогруппой в неароматическй части гетероарила. Среди фармацевтически приемлемых кислот можно упомянуть, без внесения ограничений, соляную, бромоводородную, серную, фосфоновую, уксусную, трифтороуксусную, молочную, пирувовую,малоновую, сукциновую, глутаровую, фумаровую, винно-каменную, малеиновую, лимонную, аскорбиновую, метансульфоновую, камфорную кислоту, др. Среди фармацевтически приемлемых оснований можно упомянуть, без привнесения каких-либо ограничений, гидроксид натрия, гидроксид калия, триэтиламин, трет-бутиламин и т.д. Предпочтительными соединениями формулы (I) являются такие, в которых, вместе или по отдельности, значением р является 2, значением q является 2, заместитель R3 представляет собой атом водорода, заместитель Ra представляет собой гидроксигруппу, заместитель Rb представляет собой атом галогена и заместитель Rc представляет собой атом водорода. Особенно преимущественное осуществление изобретения относится к соединениям формулы (I), в которой р и q, каждый представляет собой 2, Ra представляет собой гидроксигруппу, R3 и Rc, каждый представляет собой атом водорода, Rb представляет собой атом галогена и G представляет собой амино,диалкиламино или арилалкиламиногруппу или гетероциклоалкильную группу формулы в которой Y представляет собой атом азота, атом кислорода или группу CH2 и R6 выбирают из атома водорода и групп: необязательно замещенного арила и необязательно замещенного гетероарила. В предпочтительных соединениях формулы (I) G представляет собой диалкиламиногруппу. Другими предпочтительными соединениями формулы (I) являются те, в которых G представляет собой замещенную гетероциклоалкильную группу в которой представляет собой группу, имеющую 5 или 6 членов кольца, такую как пирролил,морфолино, пиперидил или пиперазинил, иR6, замещенный на атоме углерода или азота гетероциклоалкила, представляет собой атом водорода, фениловый заместитель, необязательно замещенный атомом галогена или гетероарильную группу,имеющую 9 членов кольца, которая содержит 1 или 2 гетероатома, выбираемых из азота, кислорода и серы, и необязательно замещен атомом галогена.-2 005376 Предпочтительными соединениями формулы (I) являются такие, в которых необязательно замещенная гетероарильная группа представляет собой бензизоксазолильную группу, необязательно замещенную атомом галогена, или бензизотиазолильную группу, необязательно замещенную атомом галогена. Преимущественно, изобретение относится к соединениям формулы (I) в которой, взятый вместе или по отдельности, заместитель G-(CH2)r-O- присоединен к 1 или 2 атомам углерода 2 или 4 фенильной группы, заместитель присоединен к 5' атому углерода фенильной группы и Rb присоединен к 4" атому фенильной группы. Среди предпочтительных соединений по изобретению можно упомянуть следующие: 3-[3-(2-[(4-хлорофенил)сульфонил]аминоэтил)-5-(2-2-[3-(диметиламино)пропокси]фенилэтил) фенил]пропановая кислота,3-[3-(2-[(4-хлорофенил)сульфонил]аминоэтил)-5-(2-2-[2-(1-пирролидинил)этокси]фенилэтил)фенил]пропановая кислота,3-[3-(2-[(4-хлорофенил)сульфонил]аминоэтил)-5-(2-2-[2-(4-морфолинил)этокси]фенилэтил)фенил]пропановая кислота. Настоящее изобретение относится также к способу получения соединений формулы (I), который отличается тем, что 1) при желании получить соединения формулы (I), в которой m=0 и n отличен от 1, в качестве исходного материала применяют соединение формулы (II) в которой R3 имеет значение, указанное для формулы (I), R'a представляет собой линейную или разветвленную (С 1-С 6)алкильную группу, WO-L представляет собой группу формулы в которой W представляет собой атом водорода или бензильную группу, р 1 и q1 представляют собой целые числа от 0 до 3 и n'+n"=целому числу от 0 до 3, при условии, что, если n' представляет собой 0, n" представляет собой 0, 2 или 3,которое каталитически восстанавливают с получением, после дебензилирования, если W представляет собой бензильную группу, соединения формулы (III) в которой R3, n, р и q имеют значения, указанные для формулы (I) и R'a представляет собой линейную или разветвленную (С 1-С 6)алкильную группу,которое конденсируют в основной среде с галидом формулы G-(CH2)r-X, в которой Х представляет собой атом галогена, с получением соединения формулы (IV) в которой G, R3, n, p, q и r имеют значения, указанные для формулы (I) и R'a представляет собой линейную или разветвленную (С 1-С 6)алкильную группу,которое подвергают депротекции при помощи отщепления фталимидогруппы в присутствии гидразина с получением соответствующего амина, который, в свою очередь, подвергают реакции с необязательно замещенным бензолсульфонилгалидом формулы в которой Rb и Rc имеют значения, указанные для формулы (I), и Х представляет собой атом галогена, с получением соединения формулы (I/a), частного случая соединений (I) в которой G, Rb, Rc, R3, r, n, р и q имеют значения, указанные для формулы (I), и R'a представляет собой линейную или разветвленную (С 1-С 6)алкильную группу,2) при желании получить соединения формулы (I), в которой m=1 или в которой m=0 и n=1, в качестве исходного материала применяют соединение формулы (II/а) в которой R3 имеет значение, указанное для формулы (I), R'a представляет собой линейную или разветвленную (С 1-С 6)алкильную группу, HO-L' представляет собой группу формулы НО-(CH2)n-, q1 и р 1 представляют собой целые числа от 0 до 3 и n представляет собой целое число от 0 до 6,которое восстанавливают каталитически и галогенируют с получением соединения (V) в котором R3, n, р и q имеют значения, указанные для формулы (I), R'a представляет собой линейную или разветвленную (С 1-С 6)алкильную группу и Х представляет собой атом галогена,это соединение формулы (V) либо, если m=1, подвергают нуклеофильной атаке соединения формулы с получением соединения формулы (VI) в котором формулы G, R3, n, р, q и r имеют значения, указанные для формулы (I), и R'a представляет собой линейную или разветвленную (С 1-С 6)алкильную группу,которое подвергают депротекции при помощи отщепления фталимидогруппы в присутствии гидразина с получением соответствующего амина, который, в свою очередь, подвергают реакции с необязательно замещенным бензолсульфонилгалидом формулы в которой Х представляет собой атом галогена, с получением соединения формулы (I/b), частного случая соединений формулы (I) в которой G, Rb, Rc, R3, n, p, q и r имеют значения, указанные для формулы (I) и R'a представляет собой линейную или разветвленную (С 1-С 6)алкильную группу,либо, если m=0 и n=1, подвергают действию соединения формулы в которой R3, р и q имеют значения, указанные для формулы (I) и R'a представляет собой линейную или разветвленную (С 1-С 6)алкильную группу,которое конденсируют в основной среде с галидом формулы G-(CH2)r-X, в которой Х представляет собой атом галогена, с получением соединения формулы (VIII) в которой G, R , р, q иr имеют значения, указанные для формулы (I) и R'a представляет собой линейную или разветвленную (С 1-С 6)алкильную группу,которое подвергают депротекции при помощи отщепления фталимидогруппы в присутствии гидразина с получением соответствующего амина, который, в свою очередь, подвергают реакции с необязательно замещенным бензолсульфонилгалидом формулы с получением соединения формулы (I/с), частного случая соединений (I) в которой G, Rb, Rc, R3, p, q и r имеют значения, указанные для формулы (I) и R'a представляет собой линейную или разветвленную (С 1-С 6)алкильную группу,эти соединения формулы (I/a), (I/b) или (I/с) можно подвергать гидролизу сложноэфирной функции в кислой или основной среде, в зависимости от присутствующих в молекуле реактивных групп, с получением соединения формулы (I/d) частного случая соединений формулы (I), в которой G, Rb, Rc, R3, m, n, p, q и r имеют значения, указанные для формулы (I),эти соединения (I/a), (I/b), (I/c) и (I/d) составляют совокупность соединений (I) и могут, при желании, быть очищены по традиционной методике очистки,их необязательно разделяют на их стереоизомеры по традиционной методике разделения,при желании, их переводят в их аддитивные соли с фармацевтически приемлемой кислотой или основанием,следует понимать, что в любой точке, которую считают уместной в течение способа, описанного выше, функцию карбоновой кислоты можно эстерифицировать или карбоново-эфирную функцию можно гидролизировать до соответствующей кислоты, ее можно снова перевести в другой эфир, как это требуется для синтеза. Настоящее изобретение также относится к фармацевтическим композициям, включающим в качестве активного ингредиента по меньшей мере одно соединение формулы (I), отдельно или в комбинации с одним или более фармацевтически приемлемыми, инертными, нетоксичными эксципиентами или носителями. Среди фармацевтических композиций по изобретению можно упомянуть более конкретно те, которые пригодны для орального, парентерального или назального применения, таблетки или драже, подъязычные таблетки, желатиновые капсулы, пастилки, суппозитории, кремы, мази, кожные гели, пр.-5 005376 Полезная дозировка может варьироваться в зависимости от возраста и веса пациента, природы и сложности расстройства, а также способа приема, который может быть оральным, назальным, ректальным или парентеральным. Обычно единичная доза варьируется от 0,1 до 500 мг при лечении за от 1 до 3 приемов в 24 ч. Нижеследующие примеры иллюстрируют изобретение, но не ограничивают его никоим образом. Структуры описанных соединений были подтверждены при помощи традиционных спектроскопических и спектрометрических методик. Применяемые исходные материалы представляют собой известные соединения или получаются по известными способами. Получение А. трет-Бутил (2 Е)-3-3-[(Е)-2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этенил]-5[(Е)-2-(2-гидроксифенил)этенил]фенил-2-пропеноат. Стадия а. 3,5-Дибромобензальдегид. 0,222 моль раствора н-бутиллития в гексане добавляют по каплям при -80 С к 0,222 моль 1,3,5-трибромобензола в 1,8 л этилового эфира. Реакционную смесь перемешивают при -80 С на протяжении 1 ч. Медленно добавляют раствор 0,222 моль N,N-диметилформамида в 50 мл этилового эфира. Температуру поддерживают при -80 С на протяжении 1 ч, перед доведением до температуры окружающей среды. Проводят перемешивание на протяжении одной ночи. Добавляют 450 мл 1 Н соляной кислоты. Реакционную смесь экстрагируют эфиром. Органические фазы собирают и сушат над сульфатом магния. После фильтрации и удаления растворителей при помощи выпаривания неочищенный продукт очищают при помощи хроматографии на кремнеземной колонке (элюант: циклогексан/этилацетат: 95/5). Стадия b. 2-[(Е)-2-(3,5-Дибромофенил)этeнил]фенол. 0,474 моль раствора н-бутиллития в гексане добавляют при +5 С к 0,237 моль бромида (2-гидроксибензил)(трифенил)фосфония в 1,2 л THF. Реакционную смесь выдерживают при +5 С на протяжении 1 ч и затем по каплям добавляют 0,21 моль соединения, полученного на предыдущей cтадии, растворенного в 360 мл THF. Реакционную смесь медленно доводят до температуры окружающей среды и затем гидролизируют и экстрагируют при помощи этилового эфира. Органические фазы собирают и сушат над сульфатом магния. После фильтрации и удаления растворителей при помощи выпаривания неочищенный продукт очищают при помощи хроматографии на кремнеземной колонке (элюант: циклогексан/этилацетат: 95/5). Стадия с. 3-Бромо-5-[(Е)-2-(2-гидроксифенил)этенил]бензальдегид. 0,378 моль раствора н-бутиллития в гексане медленно добавляют при -80 С к 0,172 моль соединения, полученного на предыдущей стадии, в 3 л этилового эфира. Реакционную смесь выдерживают при-80 С на протяжении 1 ч и затем медленно добавляют 0,172 моль N,N-диметилформамида, растворенного в 100 мл эфира. Реакционную смесь выдерживают при этой температуре на протяжении 1 ч и затем доводят до +10 С для гидролиза при помощи 1 Н раствора соляной кислоты. Смесь экстрагируют этиловым эфиром и органические фазы собирают и сушат над сульфатом магния. После фильтрации и удаления растворителей при помощи выпаривания неочищенный продукт очищают при помощи хроматографии на кремнеземе (элюант: циююгексан/этилацетат: 90/10). Стадия d. трет-Бутил (2 Е)-3-3-бромо-5-[(Е)-2-(2-гидроксифенил)этeнил]фенил-2-пропеноат. 0,3 моль трет-бутил(трифенилфосфоранилиден)ацетата добавляют к 0,15 моль соединения, полученного на предыдущей cтадии в 2 л толуола. Реакционную смесь нагревают с обратным холодильником на протяжении 2 ч. Растворители выпаривают и неочищенный продукт очищают при помощи хроматографии на кремнеземной колонке (элюант: циклогексан/этилацетат: 85/15). Стадия е. трет-Бутил (2 Е)-3-3-[(Е)-2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этeнил]-5-[(Е)-2(2-гидроксифенил)этенил]фенил-2-пропеноат. 0,1607 моль соединения, полученного на предыдущей стадии, 0,016 моль ацетата палладия, 0,032 моль трис(2-метилфенил)фосфина, 0,402 моль диизопропиламина и 0,1607 моль винилфталимида последовательно добавляют к 2,5 л N,N-диметилформамида и 10 мл воды. Реакционную смесь нагревают с обратным холодильником в течение 3 ч и затем доводят до температуры окружающей среды. После гидролиза смесь устанавливают на рН 4, используя разведенный раствор соляной кислоты, и затем экстрагируют при помощи дихлорометана. Органические фазы собирают и сушат над сульфатом магния. После фильтрации и удаления растворителей при помощи выпаривания неочищенный продукт очищают при помощи хроматографии на кремнеземе (элюант: циклогексан/этилацетат: 70/30). Получение В. трет-Бутил (2 Е)-3-[3-[(Е)-2-(1,3-диоксо-1,3-дигидро-2H-изоиндол-2-ил)этенил]-5(гидроксиметил)фенил]-2-пропеноат. Стадия а. 3,5-Дибромобензальдегид. Продукт получают согласно такому же способу, как и описанный в получении А, стадии а. Стадия b. (3,5-Дибромофенил)метанол. 0,506 моль борогидрида натрия добавляют порциями к 0,3 моль соединения, полученного на предыдущей стадии, в 650 мл метанола и 200 мл THF, поддерживая температуру на уровне +30 С. После перемешивания на протяжении 4 ч добавляют 300 мл концентрированного раствора NaHCO3. Растворители выпаривают. Полученное твердое вещество отфильтовывают, промывают водой и сушат.-6 005376 Стадия с. 3-Бромо-5-(гидроксиметил)бензальдегид. 0,628 моль н-бутиллития добавляют при -80 С к 0,285 моль соединения, полученного на предыдущей стадии в 2,3 л эфира. Реакционную смесь выдерживают при этой температуре на протяжении 4 ч 30 мин. Добавляют 22 мл DMF, растворенного в 100 мл эфира, при -80 С. Смесь выдерживают при -80 С на протяжении 1 ч перед тем, как позволить ей вернуться к температуре +10 С. Раствор 1 Н соляной кислоты добавляют до получения кислого рН. Смесь декантируют, экстрагируют при помощи этилового эфира и сушат над сульфатом магния. Неочищенный продукт очищают при помощи хроматографии (элюант: циклогексан/этилацетат: 80/20). Стадия d. трет-Бутил (2 Е)-3-[3-бромо-5-(гидроксиметил)фенил]-2-пропеноат. 0,35 моль трет-бутил(трифенилфосфоранилиден)ацетата добавляют к 0,175 моль соединения, полученного на предыдущей стадии, в 1,65 л толуола. Реакционную смесь нагревают с обратным холодильником на протяжении 3 ч. Растворители выпаривают. Неочищенный продукт отбирают в изопропиловый эфир и нагревают с обратным холодильником на протяжении 1 ч. После медленного охлаждения, осадок отфильтовывают. Фильтрат выпаривают и неочищенный продукт очищают при помощи хроматографии на кремнеземной колонке (элюант: циклогексан/этилацетат: 85/15). Стадия е. трет-Бутил (2 Е)-3-[3-[(Е)-2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этенил]-5-(гидроксиметил)фенил]-2-пропеноат. Способ идентичен таковому, применяемому в получении А, стадии е. Получение С. трет-Бутил (2 Е)-3-3-(2 Е)-3-2-(бензилокси)фенил]-2-пропенил-5-[(Е)-(1,3-диоксо 1,3-дигидро-2 Н-изоиндол-2-ил)этенил]фенил-2-пропеноат. Стадия а. Бромид (3,5-Дибромобензил)(трифенил)фосфония. 0,20 моль гидрробромида трифенилфосфина добавляют порциями к 0,20 моль соединения, полученного в получении А, стадии а, в 800 мл ацетонитрила. Смесь нагревают с обратным холодильником на протяжении 24 ч и затем охлаждают. Растворитель затем выпаривают и осадок отфильтовывают и затем сушат. Стадия b. [2-(Бензилокси)фенил]ацетальдегид. 0,104 моль гидрокси-1-оксо-бензо[d][1,2]йодоксол-3-она добавляют к 0,08 моль [2-(2-бензилокси) фенил]этанола в 500 мл тетрагидрофурана. Реакционную смесь нагревают с обратным холодильником на протяжении 2 ч и затем охлаждают. Осадок отфильтовывают и фильтрат выпаривают. Стадия с. 1-(2 Е)-3-[2-(Бензилокси)фенил]-2-пропенил-3,5-дибромобензол. 0,13 моль трет-бутоксида калия добавляют порциями к 0,13 моль соединения, полученного на стадии а в 800 мл тетрагидрофурана. Реакционную смесь перемешивают на протяжении 30 мин при комнатной температуре и затем добавляют 0,066 моль соединения, полученного на предыдущей стадии. После перемешивания на протяжении 12 ч добавляют 150 мл воды и затем проводят экстракцию дихлорометаном. Органические фазы собирают и сушат над сульфатом магния. Продукт очищают при помощи хломатографии на кремнеземе (элюант: циклогексан/дихлорометан: 80/20). Стадия d. трет-Бутил(2 Е)-3-(3-(2 Е)-3-[2-(бензилокси)фенил]-2-пропенил-5-бромофенил)-2-пропеноат. Способ идентичен таковому, применяемому в получении А, стадиях c и d. Стадия е. трет-Бутил (2 Е)-3-3-(2 Е)-3-[2-(бензилокси)фенил]-2-пропенил-5-[(Е)-2-(1,3-диоксо-1,3 дигидро-2 Н-изоиндол-2-ил)этенил]фенил-2-пропеноат. Способ идентичен таковому, применяемому в получении А, стадии е. Пример 1. 3-[3-(2-[(4-Хлорофенил)сульфонил]аминоэтил)-5-(2-2-[2-(диметиламино)этокси)фенилэтил)фенил]пропановая кислота. Стадия а. трет-Бутил 3-3-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]-5-[2-(2-гидроксифенил)этил]фенилпропаноат. 5 ммоль хлоротрис(трифенилфосфин)родия добавляют к 0,048 моль соединения, полученного в получении А, стадии е, растворенного в 720 мл этанола. Реакционную смесь нагревают при +50 С на протяжении 3 ч под давлением водорода 6 атм. После возвращения к температуре окружающей среды растворители выпаривают и неочищенный продукт очищают при помощи хроматографии на кремнеземной колонке (элюант: циклогексан/этилацетат: 80/20). Стадия b. трет-Бутил 3-3-(2-2-[2-(диметиламино)этокси]фенилэтил)-5-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]фенилпропаноат. 0,01 моль соединения, полученного на предыдущей стадии, растворенного в 100 мл толуола,медленно добавляют к 0,01 моль гидрида натрия, промытого заранее пентаном, суспендированным в 100 мл толуола. Реакционную смесь нагревают с обратным холодильником на протяжении 30 мин и затем медленно добавляют 0,013 моль 2-хлоро-N,N-диметилэтанамина, растворенного в 40 мл толуола. Осуществляют нагревание с обратным холодильником на протяжении 7 ч. После возвращения к температуре окружающей среды реакционную смесь гидролизируют и затем проводят экстракцию этиловым эфиром. Органические фазы собирают, промывают 1 Н раствором гидроксида натрия и сушат над сульфатом магния.-7 005376 Стадия с. трет-Бутил 3-[3-(2-аминоэтил)-5-(2-2-[2-(диметиламино)этокси]фенилэтил)фенил]пропаноат. 0,0115 моль моногидрата гидразина добавляют к 0,01 моль соединения, полученного на предыдущей стадии, в 27 мл метанола и 4,5 мл воды. Смесь нагревают с обратным холодильником на протяжении 2 ч 30 мин и затем охлаждают. После добавления 91 мл раствора карбоната калия и 75 мл дихлорометана проводят декантирование, сразу проводят экстрагирование дихлорометаном и растворители выпаривают. Неочищенный продукт очищают при помощи хроматографии на кремнеземной колонке (элюант: дихлорометан/метанол/гидроксид аммония: 95/5/0,5). Стадия d. трет-Бутил 3-[3-(2-[(4-хлорофенил)сульфонил]аминоэтил)-5-(2-2-[2-(диметиламино) этокси]фенилэтил)фенил]пропаноат. 0,005 моль триэтиламина добавляют к 0,005 моль соединения, полученного на предыдущей стадии в 50 мл дихлорметана. Реакционную смесь охлаждают до +5 С. Добавляют 0,005 моль 4-хлоробензолсульфонилхлорида. Реакционную смесь доводят до температуры окружающей среды и затем перемешивают на протяжении 45 мин перед гидролизом. После экстрагирования дихлорометаном и сушки над сульфатом магния растворители выпаривают. Неочищенный продукт используют на следующей стадии без дальнейшей очистки. Стадия е. 3-[3-(2-[(4-Хлорофенил)сульфонил]аминоэтил)-5-(2-2-[2-(диметиламино)этокси]фенилэтил)фенил]пропановая кислота. 0,004 моль соединения, полученного на предыдущей стадии, растворяют в 25 мл трифтороуксусной кислоты. Реакционную смесь перемешивают на протяжении 30 мин и затем трифтороуксусную кислоту выпаривают. Неочищенный продукт отбирают в 2 Н раствор гидроксида натрия. После экстрагирования этиловым эфиром водную фазу подкисляют уксусной кислотой до достижения рН 4-5. Продукт экстрагируют этилацетатом. Органические фазы собирают и сушат над сульфатом магния. Растворитель выпаривают. Элементарный микроанализ: С Н% обнаруженный 61,92 6,43 4,85 5,38 Пример 2. 3-[3-(2-[(4-Хлорофенил)сульфонил]аминоэтил)-5-(2-2-13-(диметиламино)пропокси] фенилэтил)фенил]пропановая кислота. Стадия а. трет-Бутил 3-3-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]-5-[2-(2-гидроксифенил)этил]фенилпропаноат. Процедура эксперимента идентична таковой примера 1, стадии а. Стадия b. трет-Бутил 3-3-(2-2-[3-(диметиламино)пропокси]фенилэтил)-5-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]фенилпропаноат. Ожидаемый продукт получают согласно способу, описанному в примере 1, стадии b, заменяя 2xлopo-N,N-димeтилэтaнaмин на N-(3-хлоропропил)-N,N-диметиламин. Стадия c. трет-Бутил 3-[3-(2-аминоэтил)-5-(2-2-[3-(диметиламино)пропокси]фeнилэтил)фенил] пропаноат. Экспериментальные условия получения продукта идентичны таковым, примененным в примере 1,стадии с. Стадия d. трет-Бутил 3-(3-(2-2-[3-(диметиламино)пропокси]фенилэтил)-5-2-[(фенилсулъфонил) амино]этилфенил)пропаноат. Экспериментальные условия получения продукта идентичны таковым, примененным в примере 1,стадии d. Стадия е. 3-[3-(2-[(4-Хлорофенил)сульфонил]аминоэтил)-5-(2-2-[3-(диметиламино)пропокси]фенилэтил)фенил]пропановая кислота. 0,004 моль соединения, полученного на вышеописанной стадии, растворяют в 25 мл трифтороуксусной кислоты. Реакционную смесь перемешивают на протяжении 30 мин и затем трифтороуксусную кислоту выпаривают. Неочищенный продукт отбирают в 2 Н раствор гидроксида натрия. После экстрагирования этиловым эфиром водную фазу подкисляют уксусной кислотой до достижения рН 4-5. Продукт очищают при помощи процедур осаждения, фильтрации и промывания водой и в конце сушат. Элементарный микроанализ: С Н% обнаруженный 62,76 6,58 6,30 4,81 5,51 Пример 3. 3-[3-(2-[(4-Хлорофенил)сульфонил]аминоэтил)-5-(2-2-[2-(1-пирролидинил)этокси]фенилэтил)фенил]пропановая кислота. Стадия а. трет-Бутил-3-3-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]-5-[2-(2-гидроксифенил)этил]фенилпропаноат. Процедура эксперимента идентична таковой примера 1, стадии а. Стадия b. трет-Бутил 3-[3-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]-5-(2-2-[2-(1-пирролидинил)этокси]фенилэтил)фенил]пропаноат.-8 005376 Ожидаемый продукт получают согласно способу, описанному в примере 1, стадии b, заменяя 2 хлоро-N,N-диметилэтанамин на 1-(2-хлороэтил)пирролидин. Стадия с. трет-Бутил 3-[3-(2-аминоэтил)-5-(2-2-[2-(1-пирролидинил)этокси]фенилэтил)фенил] пропаноат. Экспериментальные условия получения продукта идентичны таковым, примененным в примере 1,стадии с. Стадия d. трет-Бутил 3-[3-(2-[(4-хлорофенил)сульфонил]аминоэтил)-5-(2-2-[2-(1-пирролидинил) этокси]фенилэтил)фенил]пропаноат. Экспериментальные условия получения продукта идентичны таковым, примененным в примере 1,стадии d. Стадия е. 3-[3-(2-[(4-Хлорофенил)сулъфонил]аминоэтил)-5-(2-2-[2-(1-пирролидинил)этокси]фенилэтил)фенил]пропановая кислота. 0,004 моль соединения, полученного на вышеописанной стадии, растворяют в 25 мл трифтороуксусной кислоты. Реакционную смесь перемешивают на протяжении 30 мин и затем трифтороуксусную кислоту выпаривают. Неочищенный продукт отбирают в 2 Н растворе гидроксида натрия. После экстрагирования этиловым эфиром водную фазу подкисляют уксусной кислотой до достижения рН 4-5. Продукт экстрагируют этил ацетатом. Органические фазы собирают и сушат над сульфатом магния. Растворитель выпаривают. Продукт очищают при помощи хроматографии на кремнеземной колонке (элюант: дихлорометан/метанол/гидроксид аммония: 90/10/1). Элементарный микроанализ: С Н% обнаруженный 63,30 6,47 6,30 4,83 5,23 Пример 4. 3-[3-(2-[(4-Хлорофенил)сульфонил]аминоэтил)-5-(2-2-[2-(4-морфолинил)этокси]фенилэтил)фенил]пропановая кислота. Стадия а. трет-Бутил 3-3-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]-5-[2-(2-гидроксифенил)этил]фенилпропаноат. Процедура эксперимента идентична таковой примера 1, стадии а. Стадия b. трет-Бутил 3-[3-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]-5-(2-2-[2-(4-морфолинил)этокси]фенилэтил)фенил]пропаноат. Ожидаемый продукт получают согласно способу, описанному в примере 1, стадии b, заменяя 2 хлоро-N,N-диметилэтанамин на 4-(2-хлороэтил)морфолин. Стадия с. трет-Бутил 3-[3-(2-аминоэтил)-5-(2-2-[2-(4-морфолинил)этокси]фенилэтил)фенил]пропаноат. Экспериментальные условия получения продукта идентичны таковым, примененным в примере 1,стадии с. Стадия d. трет-Бутил 3-[3-(2-[(4-хлорофенил)сульфонил]аминоэтил)-5-(2-2-[2-(4-морфолинил) этокси]фенилэтил)фенил]пропаноат. Экспериментальные условия получения продукта идентичны таковым, примененным в примере 1,стадии d. Стадия е. 3-[3-(2-[(4-Хлорофенил)сульфонил]аминоэтил)-5-(2-2-[2-(4-морфолинил)этокси]фенилэтил)фенил]пропановая кислота. Ожидаемый продукт получают согласно тому же способу, что и описанный в примере 1, стадии е. Элементарный микроанализ: С Н% обнаруженный 61,82 6,26 6,21 4,70 5,10 Пример 5. 3-[3-(2-[(4-Хлорофенил)сульфонил]аминоэтил)-5-(2-4-[2-(диметиламино)этокси]фенил этил)фенил]пропановая кислота. Стадия а. трет-Бутил 3-3-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]-5-[2-(4-гидроксифенил)этил]фенилпропаноат. Процедура эксперимента идентична таковой примера 1, стадии а, с применением бромида (4 гидроксибензил)(трифенил)фосфония вместо бромида (2-гидроксибензил)(трифенил)фосфония в качестве реагента Виттига в получении А, стадии b. Стадия b. трет-Бутил 3-3-(2-4-[2-(диметиламино)этокси]фенилэтил)-5-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]фенилпропаноат. Ожидаемый продукт получают согласно способу, описанному в примере 1,стадии b. Стадия с. трет-Бутил 3-[3-(2-аминоэтил)-5-(2-4-[2-(диметнламино)этокси]фенилэтил)фенил]пропаноат. Экспериментальные условия получения продукта идентичны таковым, примененным в примере 1,стадии с.-9 005376 Стадия d. трет-Бутил 3-[3-(2-[(4-хлорофенил)сульфонил]аминоэтил)-5-(2-4-[2-(диметиламино) этокси]фенилэтил)фенил]пропаноат. Экспериментальные условия получения продукта идентичны таковым, примененным в примере 1,стадии d. Стадия е. 3-[3-(2-[(4-Хлорофенил)сульфонил]аминоэтил)-5-(2-4-[2-(диметиламино)этокси]фенилэтил)фенил]пропановая кислота. Ожидаемый продукт получают согласно тому же способу, что и описанный в примере 1, стадии е, и очищают при помощи хроматографии на кремнеземной колонке (дихлорометан/метанол/гидроксид аммония: 90/10/1). Элементарный микроанализ: С Н% обнаруженный 62,02 6,14 6,08 5,03 5,36 Пример 6. 3-3-(2-[(4-Хлорофенил)сульфонил]аминоэтил)-5-[2-(2-2-[4-(4-фторофенил)-1-пиперазинил]этоксифенил)этил]фенилпропановая кислота. Стадия а. трет-Бутил 3-3-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]-5-[2-(2-гидроксифенил)этил]фенилпропаноат. Процедура эксперимента идентична таковой примера 1, стадии а. Стадия b. трeт-Бутил 3-3-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]-5-[2-(2-2-[4-(4-фторофенил)-1-пиперазинил]этоксифенил)этил]фенилпропаноат. Ожидаемый продукт получают согласно способу, описанному в примере 1, стадии b, заменяя 2xлopo-N,N-димeтилэтaнaмин на 1-(2-хлороэтил)-4-(4-фторофенил)пиперазин. Стадия с. трет-Бутил 3-3-(2-аминоэтип)-5-[2-(2-2-[4-(4-фторофенил)-1-пиперазинил]этоксифенил)этил]фенилпропаноат. Экспериментальные условия получения продукта идентичны таковым, примененным в примере 1,стадии с. Стадия d. трет-Бутил 3-3-(2-[(4-хлорофенил)сульфонил]аминоэтил)-5-[2-(2-2-[4-(4-фторофенил)-1-пиперазинил]этоксифенил)этил]фенилпропаноат. Экспериментальные условия получения продукта идентичны таковым, примененным в примере 1,стадии d. Стадия е. 3-3-(2-[(4-Хлорофенил)сульфонил]аминоэтил)-5-[2-(2-2-[4'(4-фторофенил)-1-пиперазинил]этоксифенил)этил]фенилпропановая кислота. Ожидаемый продукт получают согласно тому же способу, что и описанный в примере 3, стадии е, и очищают при помощи хроматографии на кремнеземной колонке (дихлорометан/метанол/гидроксид аммония: 97/3/0.3). Элементарный микроанализ: С Н% обнаруженный 63,58 6,17 5,42 5,95 4,31 Пример 7. 3-3-(2-[(4-Хлорофенил)сульфонил]аминоэтил)-5-[2-(2-3-[4-(4-фторофенил)-1-пиперазинил]пропоксифенил)этил]фенилпропановая кислота. Стадия а. трет-Бутил 3-3-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]-5-[2-(2-гидроксифенил)этил]фенилпропаноат. Процедура эксперимента идентична таковой примера 1, стадии а. Стадия b. трет-Бутил 3-3-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]-5-[2-(2-3-[4-(4-фторофенил)-1-пиперазинил]пропоксифенил)этил]фенилпропаноат. Ожидаемый продукт получают согласно способу, описанному в примере 1, стадии b, заменяя 2 хлоро-N,N-диметилэтанамин на 1-(3-хлоропропил)-4-(4-фторофенил)пиперазин. Стадия с. трет-Бутил 3-3-(2-аминоэтил)-5-[2-(2-3-[4-(4-фторофенил)-1-пиперазинил]пропоксифенил)этил]фенилпропаноат. Экспериментальные условия получения продукта идентичны таковым, примененным в примере 1,стадии с. Стадия d. трет-Бутил 3-3-(2-[(4-хлорофенил)сульфонил]аминоэтил)-5-[2-(2-3-[4-(4-фторофенил)-1-пиперазинил]пропоксифенил)этил]фенилпропаноат. Экспериментальные условия получения продукта идентичны таковым, примененным в примере 1,стадии d. Стадия е. 3-3-(2-[(4-Хлорофенил)сульфонил]аминоэтил)-5-[2-(2-3-[4-(4-фторофенил)-1-пиперазинил]пропоксифенил)этил]фенилпропановая кислота. Ожидаемый продукт получают согласно тому же способу, что и описанный в примере 1, стадии е.% обнаруженный 63,49 6,00 5,09 5,84 4,13 Пример 8. 3-[3-(2-[(4-Хлорофенил)сульфонил]аминоэтил)-5-(2-2-[4-(диметиламино)бутокси]фенилэтил)фенил]пропановая кислота. Стадия а. трет-Бутил 3-3-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]-5-[2-(2-гидроксифенил)этил]фенилпропаноат. Процедура эксперимента идентична таковой примера 1, стадии а. Стадия b. трет-Бутил 3-3-(2-2-[4-(диметиламино)бутокси]фенилэтил)-5-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]фенилпропаноат. Ожидаемый продукт получают согласно способу, описанному в примере 1, стадии b, заменяя 2 хлоро-N,N-диметилэтанамин на N-(4-хлоробутил)-N,N-диметиламин. Стадия с. трет-Бутил 3-[3-(2-амииоэтил)-5-(2-2-[4-(диметиламино)бутокси]фенилэтил)фенил]пропаноат. Экспериментальные условия получения продукта идентичны таковым, примененным в примере 1,стадии с. Стадия d. трет-Бутил 3-[3-(2-[(4-хлорофенил)сульфонил]аминоэтил)-5-(2-2-[4-(диметиламино) бутокси]фенилэтил)фенил]пропаноат. Экспериментальные условия получения продукта идентичны таковым, примененным в примере 1,стадии d. Стадия е. 3-[3-(2-[(4-Хлорофенил)сульфонил]аминоэтил)-5-(2-2-[4-(диметиламино)бутокси]фенилэтил)фенил]пропановая кислота. Ожидаемый продукт получают согласно тому же способу, что и описанный в примере 3, стадии е,за исключением элюанта при очистке при помощи хроматографии на кремнеземной колонке (дихлорометан/метанол/гидроксид аммония: 97/3/0,3). Элементарный микроанализ: С Н% обнаруженный 63,38 6,96 6,12 4,74 5,21 Пример 9. 3-3-(2-[(4-Хлорофенил)сульфонил]аминоэтил)-5-[2-(2-2-[4-(6-фторо-1,2-бензизоксазол-3-ил)-1-пиперидил]этоксифенил)этил]фенилпропановая кислота. Стадия а. трет-Бутил 3-3-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]-5-[2-(2-гидроксифенил)этил]фенилпропаноат. Процедура эксперимента идентична таковой примера 1, стадии а. Стадия b. трет-Бутил 3-3-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]-5-[2-(2-2-[4-(6-фторо-1,2-бензизоксазол-3-ил)-1-пиперидил]этоксифенил)этил]фенилпропаноат. Ожидаемый продукт получают согласно способу, описанному в примере 1, стадии b, заменяя 2 хлopo-N,N-диметилэтaнaмин на 3-[1-(2-хлороэтил)-4-пиперидил]-6-фторо-1,2-бензизоксазол. Стадия с. трет-Бутил 3-3-(2-аминоэтил)-5-[2-(2-2-[4-(6-фторо-1,2-бензизоксазол-3-ил)-1-пиперидил]этоксифенил)этил]фенилпропаноат. Экспериментальные условия получения продукта идентичны таковым, примененным в примере 1,стадии с. Стадия d. трет-Бутил 3-3-(2-[(4-хлорофенил)сульфонил]аминоэтил)-5-[2-(2-2-[4-(6-фторо-1,2 бензизоксазол-3-ил)-1-пиперидил]этоксифенил)этил]фенилпропаноат. Экспериментальные условия получения продукта идентичны таковым, примененным в примере 1,стадии d. Стадия е. 3-3-(2-[(4-Хлорофенил)сульфонил]аминоэтил)-5-[2-(2-2-[4-(6-фторо-1,2-бензизоксазол-3-ил)-1-пиперидилэтоксифенилэтил]фенилпропановая кислота. 0,004 моль соединения, полученного на вышеописанной стадии, растворяют в 25 мл трифтороуксусной кислоты. Реакционную смесь перемешивают на протяжении 30 мин и затем трифтороуксусную кислоту выпаривают. Неочищенный продукт отбирают в 2 Н раствор гидроксида натрия. После экстрагирования этиловым эфиром водную фазу подкисляют уксусной кислотой до достижения рН 4-5. Неочищенный продукт экстрагируют этилацетат. Органические фазы собирают и сушат над сульфатом магния. Неочищенный продукт очищают при помощи хроматографии на кремнеземной колонке (элюант: дихлорометан/метанол: 95/5). Элементарный микроанализ: С Н-11 005376 Пример 10. Гидрохлорид 3-[3-[2-(2-2-[4-(1,2-бензизотиазол-3-ил)-1-пиперазинил]этоксифенил) этил)-5-(2-[(4-хлорофенил)сульфонил]аминоэтил)фенил]пропановой кислоты. Стадия а. трет-Бутил 3-3-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]-5-[2-(2-гидроксифенил)этил]фенилпропаноат. Процедура эксперимента идентична таковой примера 1, стадии а. Стадия b. трет-Бутил 3-3-[2-(2-2-[4-(1,2-бензизотиазол-3-ил)-1-пиперазинил]этоксифенил)этил]5-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]фенилпропаноат. Ожидаемый продукт получают согласно способу, описанному в примере 1, стадии b, заменяя 2 хлоро-N,N-диметилэтанамин на 3-[4-(2-хлороэтил)-4-пиперазинил]-1,2-бензизотиазол. Стадия с. трет-Бутил 3-3-(2-аминоэтил)-5-[2-(2-2-[4-(1,2-бензизотиазол-2-ил)-1-пиперазинил] этоксифенил)этил]фенилпропаноат. Экспериментальные условия получения продукта идентичны таковым, примененным в примере 1,стадии с. Стадия d. трет-Бутил 3-[3-[2-(2-2-[4-(1,2-бензизотиазол-2-ил)-1-пиперазинил]этоксифенил)этил]5-(2-[(4-хлорофенил)сульфонил]аминоэтил)фенил]пропаноат. Экспериментальные условия получения продукта идентичны таковым, примененным в примере 1,стадии d. Стадия е. Гидрохлорпд 3-[2-[2-(2-2-[4-(1,2-бензизотиазол-3-ил)-1-пиперазинил]этоксифенил) этил]-5-(2-[(4-хлорофенил)сульфонил]аминоэтил)фенил]пропановой кислоты. 0,004 моль соединения, полученного на вышеописанной стадии, растворяют в 25 мл трифтороуксусной кислоты. Реакционную смесь перемешивают на протяжении 30 мин и затем трифтороуксусную кислоту выпаривают. Неочищенный продукт отбирают в 2 Н раствор гидроксида натрия. После экстрагирования этиловым эфиром водную фазу подкисляют уксусной кислотой до достижения рН 4-5. Ожидаемый продукт отфильтовывают, промывают водой и затем отбирают в дихлорометан. После добавления 1 эквивалента 1 Н раствора соляной кислоты в этиловом эфире осажденный продукт отфильтовывают. Элементарный микроанализ: С Н% обнаруженный 59,06 5,57 4,70 7,13 7,97 Пример 11. 3-3-(2-[(4-Хлорофенил)сульфонил]аминоэтил)-5-[2-(2-2-[4-(6-фторо-1,2-бензизотиазол-3-ил)-1-пиперидил]этоксифенил)этил]фенилпропановая кислота. Стадия а. трет-Бутил 3-3-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]-5-[2-(2-гидроксифенил)этил]фенилпропаноат. Процедура эксперимента идентична таковой примера 1, стадии а. Стадия b. трет-Бутил 3-3-[2-(1,3-диоксо-1,3-дигидpо-2H-изoиндол-2-ил)этил]-5-[2-(2-2-[4-(6-фторо-1,2-бензизотиазол-3-ил)-1-пиперидил]этоксифенил)этил]фенилпропаноат. Ожидаемый продукт получают согласно способу, описанному в примере 1, стадии b, заменяя 2 хлоро-N,N-диметилэтанамин на 3-[1-(2-хлороэтил)-4-пиперидил]-6-фторо-1,2-бензизотиазол. Стадия с. трет-Бутил 3-3-(2-аминоэтил)-5-[2-(2-2-[4-(6-фторо-1,2-бензизотиазол-3-ил)-1-пиперидил]этоксифенил)этил]фенилпропаноат. Экспериментальные условия получения продукта идентичны таковым, примененным в примере 1,стадии с. Стадия d. трет-Бутил 3-3-(2-[(4-хлорофенил)сульфонил]аминоэтил)-5-[2-(2-2-[4-(6-фторо-1,2 бензизотиазол-3-ил)-1-пиперидил]этоксифенил)этил]фенилпропаноат. Экспериментальные условия получения продукта идентичны таковым, примененным в примере 1,стадии d. Стадия е. 3-3-(2-[(4-Хлорофенил)сульфонил]аминоэтил)-5-[2-(2-2-[4-(6-фторо-1,2-бензизотиазол-3-ил)-1-пиперидил]этоксифенил)этил]фенилпропановая кислота. 0,004 моль соединения, полученного на вышеописанной стадии, растворяют в 25 мл трифтороуксусной кислоты. Реакционную смесь перемешивают на протяжении 30 мин и затем трифтороуксусную кислоту выпаривают. Неочищенный продукт отбирают в 2 Н раствор гидроксида натрия. После экстрагирования этиловым эфиром водную фазу подкисляют уксусной кислотой до достижения рН 4-5. Неочищенный продукт очищают при помощи осаждения и затем после фильтрации промывают эфиром. Ожидаемый продукт очищают при помощи хроматографии на кремнеземной колонке (элюант: дихлорометан/метанол: 97/3). Элементарный микроанализ: С Н-12 005376 Пример 12. Гидрохлорид 3-[3-[2-(2-3-[4-(1,2-бензизотиазол-3-ил)-1-пиперазинил]пропоксифенил) этил]-5-(2-[(4-хлорофенил)сульфонил]аминоэтил)фенил]пропановой кислоты. Стадия а. трет-Бутил 3-3-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]-5-[2-(2-гидроксифенил)этил]фенилпропаноат. Процедура эксперимента идентична таковой примера 1, стадии а. Стадия b. трет-Бутил 3-3-[2-(2-3-[4-(1,2-бензизотиазол-3-ил)-1-пиперазинил]пропоксифенил) этил]-5-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]фенилпропаноат. Ожидаемый продукт получают согласно способу, описанному в примере 1, стадии b, заменяя 2 хлоро-N,N-диметилэтанамин на 3-[4-(3-хлоропропил)-1-пиперазинил]-1,2-бензизотиазол. Стадия с. трет-Бутил 3-3-(2-аминоэтил)-5-[2-(2-3-[4-(1,2-бензизотиазол-3-ил)-1-пиперазинил]пропоксифенил)этил]фенилпропаноат. Экспериментальные условия получения продукта идентичны таковым, примененным в примере 1,стадии с. Стадия d. трет-Бутил 3-[3-[2-(2-3-[4-(1,2-бензизотиазол-3-ил)-1-пиперазинил]пропоксифенил) этил]-5-(2-[(4-хлорофенил)сульфонил]аминоэтил)фенил]пропаноат. Экспериментальные условия получения продукта идентичны таковым, примененным в примере 1,стадии d. Стадия е. Гидрохлорид 3-[3-[2-(2-3-[4-(1,2-бензизотиазол-3-ил)-1-пиперазинил]пропоксифенил) этил]-5-(2-[(4-хлорофенил)сульфонил]аминоэтил)фенил]пропановой кислоты. 0,004 моль соединения, полученного на вышеописанной стадии, растворяют в 25 мл трифтороуксусной кислоты. Реакционную смесь перемешивают на протяжении 30 мин и затем трифтороуксусную кислоту выпаривают. Неочищенный продукт отбирают в 2 Н раствор гидроксида натрия. После экстрагирования этиловым эфиром водную фазу подкисляют уксусной кислотой до достижения рН 4-5. Неочищенный продукт очищают при помощи осаждения и затем после фильтрации промывают эфиром. Ожидаемый продукт очищают при помощи хроматографии на кремнеземной колонке (элюант: дихлорометан/метанол/гидроксид аммония: 95/5/0,5). Ожидаемый продукт отбирают в дихлорометан. После добавления 1 эквивалента 1 Н раствора соляной кислоты в эфире осажденный продукт отфильтровывают. Элементарный микроанализ: С Н% обнаруженный 59,76 5,67 9,05 6,97 7,54 Пример 13. 3-3-(2-[(4-Хлорофенил)сульфонил]аминоэтил)-5-[2-(2-3-[4-(6-фторо-1,2-бензизоксазол-3-ил)-1-пиперидил]пропоксифенил)этил]фенилпропановая кислота. Стадия а. трет-Бутил 3-3-[2-(1,3-диоксо-1,3 дигидро-2 Н-изоиндол-2-ил)этил]-5-[2-(2-гидроксифенил)этил]фенилпропаноат. Процедура эксперимента идентична таковой примера 1, стадии а. Стадия b. трет-Бутил 3-3-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]-5-[2-(2-3-[4-(6-(фтopо-1,2-бензизоксазол-3-ил)-1-пиперидил]пропоксифенил)этил]фенилпропаноат. Ожидаемый продукт получают согласно способу, описанному в примере 1, стадии b, заменяя 2 хлоро-N,N-диметилэтанамин на 3-[1-(3-хлоропропил)-4-пиперидил]-6-фторо-1,2-бензизоксазол. Стадия с. трет-Бутил 2-3-(2-аминоэтил)-5-[2-(2-3-[4-(6-фторо-1,2-бензизоксазол-3-ил)-1-пиперидил]пропоксифенил)этил]фенилпропаноат. Экспериментальные условия получения продукта идентичны таковым, примененным в примере 1,стадии с. Стадия d. трет-Бутил 3-3-(2-[(4-хлорофенил)сульфонил]аминоэтил)-5-[2-(2-2-[4-(6-фторо-1,2 бензизоксазол-3-ил)-1-пиперидил]пропоксифенил)этил]фенилпропаноат. Экспериментальные условия получения продукта идентичны таковым, примененным в примере 1,стадии d. Стадия е. 3-3-(2-[(4-Хлорофенил)сульфонил]аминоэтил)-5-[2-(2-3-[4-(6-фторо-1,2-бензизоксазол-3-ил)-1-пиперидил]пропоксифенил)этил]фенилпропановая кислота. Ожидаемый продукт получают согласно тому же способу, что и описанный в примере 8, стадии е,за исключением элюанта при хроматографической очистке на кремнеземной колонке (дихлорометан/метанол/гидроксид аммония: 95/5/0,5). Элементарный микроанализ: С-13 005376 Стадия а. трет-Бутил 3-[3-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]-5-(гидроксиметил)фенил]пропаноат. Каталитическую гидрогенацию продукта получения В, стадии е, проводят при условиях эксперимента, таких же, как и в примере 1, стадии а. Стадия b. трет-Бутил 3-3-(бромометил)-5-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]фенилпропаноат. К 0,052 моль соединения, полученного на вышеописанной стадии, растворенного в 320 мл дихлорметана, добавляют 0,063 моль трифенилфосфина и затем, медленно, раствор 0,063 моль тетрабромида углерода в 85 мл дихлорметана, поддерживая температуру ниже 30 С. Смесь перемешивают на протяжении 15 ч и затем концентрируют досуха. Неочищенный продукт очищают при помощи хроматографии(элюант: циклогексан/этилацетат: 80/20). Стадия с. трет-Бутил 3-3-(4-[2-(диметиламино)этокси]феноксиметил)-5-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]фенилпропаноат. 0,0083 моль 4-[2-(диметиламино)этокси]фенола, суспендированного в 15 мл толуола, добавляют к 0,0196 моль гидрида натрия, заранее промытого в пентане, в 90 мл толуола. Смесь нагревают с обратным холодильником на протяжении 1 ч, и затем вводят 0,0064 моль соединения, полученного на вышеописанной стадии, растворенного в 90 мл толуола. Проводят нагревание с обратным холодильником в течение 4 ч. После добавления воды и экстрагирования этиловым эфиром органические фазы промывают 1 Н раствором гидроксида натрия и сушат над сульфатом магния. После фильтрации неочищенный продукт используют без дальнейшей очистки. Стадия d. 3-[3-(2-[(4-Хлорофенил)сульфонил]аминоэтил)-5-(4-[2-(диметиламино)этокси]феноксиметил)фенил]пропановая кислота. Применение в качестве исходного материала продукта, синтезированного выше, экспериментальные условия для депротекции амина, добавление бензолсульфонилхлорида и, наконец, гидролиз сложного эфира идентичны таковым, примененным в примере 1, стадии с, стадии d и, наконец, стадии е, соответственно. Элементарный микроанализ: С Н% обнаруженный 59,95 6,04 6,94 4,97 5,43 Пример 15. 3-[3-(2-[(4-Хлорофенил)сульфонил]аминоэтил)-5-(2-[2-(диметиламино)этокси]феноксиметил)фенил]пропановая кислота. Стадия а. трет-Бутил 3-[3-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]-5-(гидроксиметил)фенил]пропаноат. Процедура эксперимента идентична таковой примера 14, стадии а. Стадия b. трет-Бутил 3-3-(бромометил)-5-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]фенилпропаноат. Процедура эксперимента идентична таковой примера 14, стадии b. Стадия с. трет-Бутил 3-3-(2-[2-(диметиламино)этокси]феноксиметил)-5-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]фенилпропаноат. Ожидаемый продукт получают согласно способу, описанному в примере 14, стадии с, заменяя 4-[2(диметиламино)этокси]фенол на 2-[2-(диметиламино)этокси]фенол. Стадия d. 3-[3-(2-[(4-Хлорофенил)сульфонил]аминоэтил)-5-(2-[2-(диметиламино)этокси]феноксиметил)фенил]пропановая кислота. Процедура эксперимента идентична таковой примера 14, стадии d. Элементарный микроанализ: С Н% обнаруженный 60,34 6,16 6,77 4,91 5,31 Пример 16. 3-[3-(2-[(4-Хлорофенил)сульфонил]аминоэтил)-5-(2-[3-(диметиламино)пропокси]феноксиметил)фенил]пропановая кислота. Стадия а. трет-Бутил 3-[3-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]-5-(гидроксиметил)фенил]пропаноат. Процедура эксперимента идентична таковой примера 14, стадии а. Стадия b. трет-Бутил 3-3-(бромометил)-5-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]фенилпропаноат. Процедура эксперимента идентична таковой примера 14, стадии b. Стадия с. трет-Бутил 3-3-(2-[3-(диметиламино)пропокси]феноксиметил)-5-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]фенилпропаноат. Ожидаемый продукт получают согласно способу, описанному в примере 14, стадии с, заменяя 4-[2(диметиламино)этокси]фенол на 2-[3-(диметиламино)пропокси]фенол.-14 005376 Стадия d. 3-[3-(2-[(4-Хлорофенил)сульфонил]аминоэтил)-5-(2-[3-(диметиламино)пропокси]феноксиметил)фенил]пропановая кислота. Процедура эксперимента идентична таковой примера 14, стадии d. Элементарный микроанализ: С Н% обнаруженный 61,57 6,59 6,09 4,62 5,52 Пример 17. Гидрохлорид 3-(3-(2-[(4-хлорофенил)сульфонил]аминоэтил)-5-2-[3-(диметиламино) пропокси]бензилфенил)пропановой кислоты. Стадия а. трет-Бутил 3-3-(бромометил)-5-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]фенилпропаноат. Процедура эксперимента идентична таковой примера 14, стадии b. Стадия b. трет-Бутил 3-3-[2-(бензилокси)бензил]-5-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил) этил]фенилпропаноат. 0,017 моль 2-бензилоксифенилборной кислоты, 34 мл 2 М раствора Na2CO3 и 0,85 моль тетракис(трифенилфосфин)палладия последовательно добавляют к 0,017 моль соединения, полученного на вышеописанной стадии, растворенного в 130 мл смеси 80/50 толуола/этанола. Реакционную смесь нагревают с обратным холодильником на протяжении 3 ч 30 мин и затем охлаждают. После добавления воды и толуола смесь декантируют и экстрагируют 3 раза толуолом. Органические фазы дважды промывают концентрированным раствором NaCl и затем сушат над сульфатом магния. После удаления растворителей при помощи выпаривания неочищенный продукт используют без дальнейшей очистки. Стадия с. трет-Бутил 3-[3-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]-5-(2-гидроксибензил) фенил]пропаноат. 1,4 г дигидроксида палладия добавляют к 0,0125 моль соединения, полученного на вышеописанной стадии, в 90 мл смеси 50/40 этанола/THF. Смесь помещают в водород при комнатной температуре на протяжении 2 ч. Смесь фильтруют и растворитель выпаривают. Продукт используют без дальнейшей очистки. Стадия d. трет-Бутил 3-3-2-[3-(диметиламино)пропокси]бензил-5-[2-(1,3-диоксо-1,3-дигидро-2 Низоиндол-2-ил)этил]фенилпропаноат. Процедура эксперимента идентична таковой примера 2, стадии b. Стадия е. Гидрохлорид 3-(3-(2-[(4-хлорофенил)сульфонил]аминоэтил)-5-2-[3-(диметиламино) пропокси]бензилфенил)пропановой кислоты. Депротекция амина, добавление бензолсульфонилхлорида и, наконец, гидролиз сложного эфира идентичны экспериментальным способам, примененным в примере 1, стадии с, стадии d и, наконец, стадии е, соответственно. Элементарный микроанализ: С Н% обнаруженный 59,31 6,34 8,88 4,57 5,61 Пример 18. 3-[3-(2-[(4-Хлорофенил)сульфонил]аминоэтил)-5-(3-2-[3-(диметиламино)пропокси] фенилпропил)фенил]пропановая кислота. Стадия а. трет-Бутил 3-3-3-[2-(бензилокси)фенил]пропил-5-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]фенилпропаноат. Процедура эксперимента идентична таковой примера 1, стадии а, с применением соединения по получению С, стадии е в качестве исходного материала вместо соединения по получению А, стадии е. Стадия b. трет-Бутил 3-3-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]-5-[3-(2-гидроксифенил)пропил]фенилпропаноат. 10% гидроксид палладия добавляют к 8,40 ммоль соединения, полученного на вышеописанной стадии, растворенного в 80 мл этанола. Смесь гидрогенизируют на протяжении 2,5 ч и растворитель выпаривают. Стадия с. трет-Бутил 3-3-(3-2-[3-(диметиламино)пропокси]фенилпропил)-5-[2-(1,3-диоксо-1,3 дигидро-2 Н-изоиндол-2-ил)этил]фенилпропаноат. Процедура эксперимента идентична таковой примера 2, стадии b, с применением соединения, полученного на предыдущей стадии, в качестве исходного материала. Стадия d. трет-Бутил 3-[3-(2-аминоэтил)-5-(3-2-[3-(диметиламино)пропокси]фенилпропил)фенил] пропаноат. Процедура эксперимента идентична таковой примера 1, стадии с, с применением соединения, полученного на предыдущей стадии, в качестве исходного материала.-15 005376 Стадия e. 3-[3-(2-[(4-Хлорофенил)сульфонил]аминоэтил)-5-(3-2-[3-(диметиламино)пропокси]фенилпропил)фенил]пропановая кислота. Депротекция амина, добавление бензолсульфонилхлорида и, наконец, гидролиз сложного эфира идентичны экспериментальным способам, примененным в примере 1, стадии с, стадии d и, наконец, стадии е, соответственно. Элементарный микроанализ: С% обнаруженный 62,93 6,69 6,60 4,70 5,35 Фармакологическое изучение Пример А. Агрегация тромбоцитов у человека. У людей-добровольцев, которые не принимали аспирин по меньшей мере на протяжении 14 дней,предшествовавших эксперименту, брали венозную кровь. Кровь пропускали над цитратом натрия (0,109 М)(1 об. цитрата на 9 об. крови). Плазму, богатую на тромбоциты (ПБТ), получали при помощи центрифугирования (20 С) при 200 об./с на протяжении 10 мин. Количество тромбоцитов в среднем составляло 250000 Пл/мм 3. ПБТ хранили при комнатной температуре до начала эксперимента и использовали в течение 2 ч с момента взятия. Применяли агонист ТХА 2 U46619 в концентрации 1 мкМ, а 5 гидрокситриптамин применяли в концентрации 10 мкМ, последний в присутствии 0,3 мкМ аденозина дифосфата и 1 мкМ адреналина. Соединения по изобретению ингибируют агрегацию тромбоцитов, индуцированную агонистом ТХА 2, а также таковую, вызванную 5-гидрокситриптамином. В качестве примера, значения IC50 соединения по примеру 2 в двух экспериментах составляли 3,3 мкМ и 0,96 мкМ, соответственно. Эти значения показывают, что соединения по изобретению являются сильными антиагрегантами тромбоцитов, которые действуют сбалансированным способом при двух путях активации, ТХА 2 и серотонина. Пример В. Фармацевтическая композиция. Формула для получения 1000 таблеток, каждая из которых содержит в 5 мг дозу, г: Соединение примера 4 5 Гидроксипропилметилцелюлоза 2 Пшеничный крахмал 10 Лактоза 100 Стеарат магния 3 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения формулы (I),в которой R1 и R2 независимо представляют собой атом водорода или алкильную, циклоалкильную,необязательно замещенную арильную, необязательно замещенную арилалкильную, циклоалкильную,циклоалкилалкильную, необязательно замещенную гетероарильную или необязательно замещенную гетероарилалкильную группу, илиR1 и R2 совместно с атомом азота образуют гетероциклоалкильную группу формулы,которая имеет от 5 до 7 членов кольца, в которой Y представляет собой атом азота, атом кислорода или группу СН 2 и R6 представляет собой атом водорода или алкильную, циклоалкильную, циклоалкилалкильную, необязательно замещенную арильную, необязательно замещенную арилалкильную, необязательно замещенную арилкарбонильную, необязательно замещенную арилкарбонилалкильную, необязательно замещенную диарилалкильную, необязательно замещенную диарилалкенильную, необязательно замещенную гетероарильную, необязательно замещенную гетероарилалкильную, необязательно заме-16 005376 щенную гетероарилкарбонильную или необязательно замещенную гетероарилкарбонилалкильную группу,R3 представляет собой атом водорода или алкильную или необязательно замещенную фенильную группу,Ra представляет собой гидрокси, алкокси, необязательно замещенную арилокси, необязательно замещенную арилалкилокси, амино, алкиламино, диалкиламино, необязательно замещенную ариламино или необязательно замещенную арилалкиламиногруппу,Rb и Rс, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода, атом галогена, алкильную группу, алкоксигруппу, гидроксигруппу или тригалоалкильную группу,m представляет собой целое число от 0 до 1 включительно,n и q представляют собой одинаковые или различные целые числа от 0 до 6 включительно,р и r представляют собой одинаковые или различные целые числа от 1 до 6 включительно,к их энантиомерам и диастереоизомерам, а также к их аддитивным солям с фармацевтически приемлемой кислотой или основанием,причем термин алкил обозначает линейную или разветвленную цепочку, имеющую от 1 до 6 атомов углерода,термин алкокси обозначает линейную или разветвленную алкилоксигруппу, имеющую от 1 до 6 атомов углерода,термин тригалоалкил обозначает углеродную цепочку, имеющую от 1 до 3 атомов углерода и от 1 до 3 одинаковых или различных атомов галогена,термин алкенил обозначает цепочку, имеющую от 2 до 6 атомов углерода и содержащую от 1 до 3 двойных связей,термин циклоалкил обозначает насыщенное циклическое кольцо, имеющее от 3 до 8 атомов углерода,термин арил обозначает фенильную или нафтильную группу,термин гетероарил обозначает ароматическую моноциклическую группу или бициклическую группу, у которой по меньшей мере одно из колец является ароматическим, имеющую от 5 до 11 членов кольца и от 1 до 5 гетероатомов, выбираемых из азота, кислорода и серы,термины диарилалкил и диарилалкенил обозначают, соответственно, алкильную и алкенильную группы, как указано здесь ранее, замещенные двумя одинаковыми или различными арильными группами, как указано здесь ранее,термин замещенный по отношению к фенилу, арилу, арилалкилу, арилкарбонилу, арилкарбонилалкилу, диарилалкилу, диарилалкенилу, гетероарилу, гетероарилалкилу, гетероарилкарбонилу, гетероарилкарбонилалкилу, ариламино и арилалкиламино обозначает, что группы, о которых идет речь, замещены в ароматической части одним или двумя одинаковыми или различными заместителями, выбираемыми из атомов галогенов алкильных групп, алкоксигрупп, гидроксигрупп, цианогрупп, нитрогрупп, аминогрупп(необязательно замещенных одной или двумя алкильными группами) и групп C(O)Rd, Rd представляет собой группу, выбираемую из гидрокси, алкокси и амино, в которой гетероарильные и гетероарилалкильные также могут быть замещены оксогруппой в неароматической части гетероарила. 2. Соединения формулы (I) по п.1, в которых р представляет собой 2, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 3. Соединения формулы (I) либо по п.1, либо по п.2, в которых q представляет собой 2, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 4. Соединения формулы (I) по любому из пп.1-3, в которых R3 представляет собой атом водорода,их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 5. Соединения формулы (I) по любому из пп.1-4, в которых Ra представляет собой гидроксигруппу,их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 6. Соединения формулы (I) по любому из пп.1-5, в которых Rb представляет собой атом галогена, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 7. Соединения формулы (I) по любому из пп.1-6, в которых Rc представляет собой атом водорода,их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 8. Соединения формулы (I) по любому из пп.1-7, в которых р и q каждый представляет собой 2, Ra представляет собой гидроксигруппу, R3 и Rc каждый представляет собой атом водорода, Rb представляет собой атом галогена и G представляет собой амино, диалкиламино или арилалкиламиногруппу или гетероциклоалкильную группу формулы в которой Y представляет собой атом азота, атом кислорода или группу CH2 и R6 выбирают из атома водорода и групп: необязательно замещенного арила и необязательно замещенного гетероарила; их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 9. Соединения формулы (I) по любому из пп.1-8, в которых G представляет собой диалкиламиногруппу, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 10. Соединения формулы (I) по любому из пп.1-8, в которых G представляет собой замещенную гетероциклоалкильную группуR6, замещенный на атоме углерода или азота гетероциклоалкила, представляет собой атом водорода, фениловый заместитель, необязательно замещенный атомом галогена, или гетероарильную группу,имеющую 9 членов кольца, которая содержит 1 или 2 гетероатома, выбираемых из азота, кислорода и серы, и необязательно замещен атомом галогена,их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 11. Соединения формулы (I) по любому из пп.1-8 или 10, в которых необязательно замещенная гетероарильная группа представляет собой бензизоксазолильную группу, необязательно замещенную атомом галогена, или бензизотиазолильную группу, необязательно замещенную атомом галогена, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 12. Соединения формулы (I) по любому из пп.1-11, в которых заместитель G-(СН 2)r-О- присоединен к 1 или 2 атомам углерода 2 или 4 фенильной группы, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 13. Соединения формулы (I) по любому из пп.1-12, в которых заместитель присоединен к 5' атому углерода фенильной группы, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 14. Соединения формулы (I) по любому из пп.1-13, в которых Rb присоединен к 4" атому фенильной группы, их энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 15. Соединение формулы (I) по пп.1-9 и 12-14, которое представляет собой 3-[3-(2-[(4 хлорофенил)сульфонил]аминоэтил)-5-(2-2-[3-(диметиламино)пропокси]фенилэтил)фенил]пропановую кислоту. 16. Соединения формулы (I) по пп.1-8, 10 и 12-14, которые представляют собой 3-[3-(2-[(4-хлорофенил)сульфонил]амино)этил)-5-(2-2-[2-(1 пирролидинил)этокси]фенилэтил)фенил]пропановую кислоту и 3-[3-(2-[(4-хлорофенил)сульфонил]аминоэтил)-5-(2-2-[2-(4 морфолинил)этокси]фенилэтил)фенил]пропановую кислоту. 17. Способ получения соединений формулы (I) по п.1, отличающийся тем, что при желании получить соединения формулы (I), в которой m=0 и n отличен от 1, в качестве исходного материала применяют соединение формулы (II) в которой R3 имеет значение, указанное для формулы (I), R'a представляет собой линейную или разветвленную (С 1-С 6)алкильную группу, WO-L представляет собой группу формулы в которой W представляет собой атом водорода или бензильную группу, р 1 и q1 представляют собой целые числа от 0 до 3 и n'+n"=целому числу от 0 до 3, при условии, что, если n' представляет собой 0, n" представляет собой 0, 2 или 3,которое каталитически восстанавливают с получением, после дебензилирования, если W представляет собой бензильную группу, соединения формулы (III) в которой R3, n, р и q имеют значения, указанные для формулы (I) и R'a представляет собой линейную или разветвленную (С 1-С 6)алкильную группу,которое конденсируют в основной среде с галидом формулы G-(СН 2)r-Х, в которой Х представляет собой атом галогена, с получением соединения формулы (IV) в которой G, R3, n, р, q и r имеют значения, указанные для формулы (I) и R'a представляет собой линейную или разветвленную (С 1-С 6)алкильную группу,которое подвергают депротекции при помощи отщепления фталимидогруппы в присутствии гидразина с получением соответствующего амина, который, в свою очередь, подвергают реакции с необязательно замещенным бензолсульфонилгалидом формулы,в которой Rb и Rc имеют значения, указанные для формулы (I), и Х представляет собой атом галогена, с получением соединения формулы (I/a), частного случая соединений (I) в которой G, Rb, Rc, R3, r, n, р и q имеют значения, указанные для формулы (I), и R'a представляет собой линейную или разветвленную (С 1-С 6)алкильную группу,эти соединения формулы (I/a) можно подвергать гидролизу сложноэфирной функции в кислой или основной среде, в зависимости от присутствующих в молекуле реактивных групп, с получением соединения формулы (I/d) частного случая соединений формулы (I), в которой G, Rb, Rc, R3, m, n, р, q и r имеют значения, указанные для формулы (I),эти соединения (I/a) и (I/d) могут, при желании, быть очищены по традиционной методике очистки,их необязательно разделяют на их стереоизомеры по традиционной методике разделения,при желании, их переводят в их аддитивные соли с фармацевтически приемлемой кислотой или основанием,следует понимать, что в любой точке, которую считают уместной в течение способа, описанного выше, функцию карбоновой кислоты можно эстерифицировать или карбоново-эфирную функцию можно-19 005376 гидролизировать до соответствующей кислоты, ее можно снова перевести в другой эфир, как это требуется для синтеза. 18. Фармацевтические композиции, включающие в качестве активного ингредиента по меньшей мере одно соединение по любому из пп.1-16, отдельно или в сочетании с одним или более фармацевтически приемлемыми, инертными, нетоксичными эксципиентами или носителями. 19. Фармацевтические композиции по п.18, содержащие по меньшей мере один активный ингредиент по любому из пп.1-16, для применения в производстве лекарственных препаратов, полезных в качестве антагонистов рецепторов ТХА 2 и рецепторов 5-НТ 2. 20. Фармацевтические композиции по п.18, содержащие по меньшей мере один активный ингредиент по любому из пп.1-16, для применения в производстве лекарственных препаратов, полезных при лечении атеротромботических сердечно-сосудистых заболеваний, таких как инфаркт миокарда, стенокардия, мозговые сосудистые травмы, болезнь Рейнауда (Raynaud), а также астмы и бронхоспазмов, так же как и мигрени и венозных заболеваний.
МПК / Метки
МПК: A61K 31/496, A61P 7/02, A61K 31/454, C07C 311/19, C07D 413/04, C07D 295/088, C07C 311/21, C07D 275/04, C07D 261/20, A61K 31/40, A61K 31/18
Метки: соединения, содержащие, способ, новые, бензолсульфонамида, получения, фармацевтические, композиции
Код ссылки
<a href="https://eas.patents.su/21-5376-novye-soedineniya-benzolsulfonamida-sposob-ih-polucheniya-i-farmacevticheskie-kompozicii-ih-soderzhashhie.html" rel="bookmark" title="База патентов Евразийского Союза">Новые соединения бензолсульфонамида, способ их получения и фармацевтические композиции их содержащие</a>
Предыдущий патент: Производные арилметилкарбониламинотиазола и их применение в качестве противоопухолевых средств
Следующий патент: Тетрагидроимидазо [1,2-h][1,7] нафтиридиновые соединения
Случайный патент: Анальгетическое средство "тетралгин" и способ его получения