Тетрагидроимидазо [1,2-h][1,7] нафтиридиновые соединения
Номер патента: 5377
Опубликовано: 24.02.2005
Авторы: Постиус Штефан, Грундлер Герхард, Штурм Эрнст, Кромер Вольфганг, Хубер Райнхард, Ханауэр Гуидо, Зимон Вольфганг-Александер
Формула / Реферат
1. Соединение формулы I
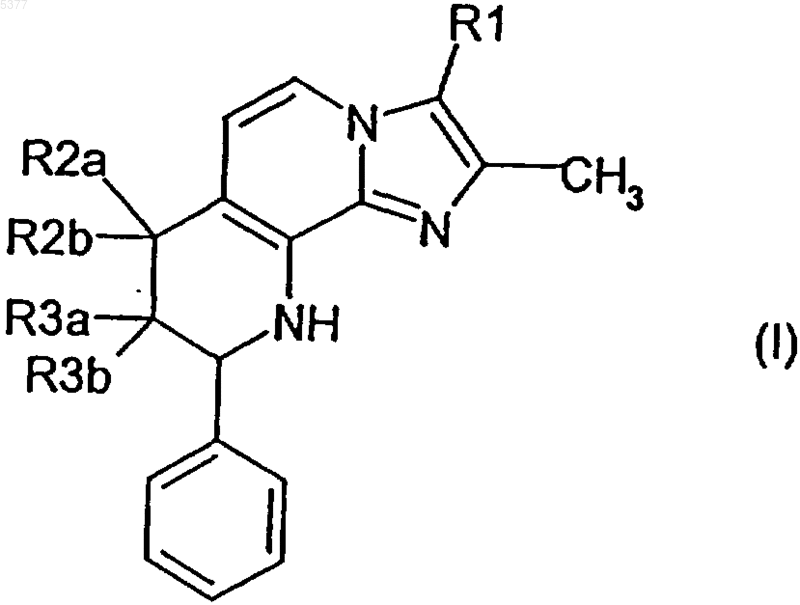
где R1 обозначает метил или гидроксиметил,
один из заместителей R2a и R2b обозначает водород, а другой обозначает гидрокси, метокси, этокси, изопропокси, метоксиэтокси или метоксипропокси,
один из заместителей R3a и R3b обозначает водород, а другой обозначает гидрокси, метокси, этокси, изопропокси, метоксиэтокси или метоксипропокси,
причем R2a или R2b, с одной стороны, и R3a или R3b, с другой стороны, не могут одновременно обозначать гидрокси,
и его соли.
2. Соединение по п.1, представленное формулой I*
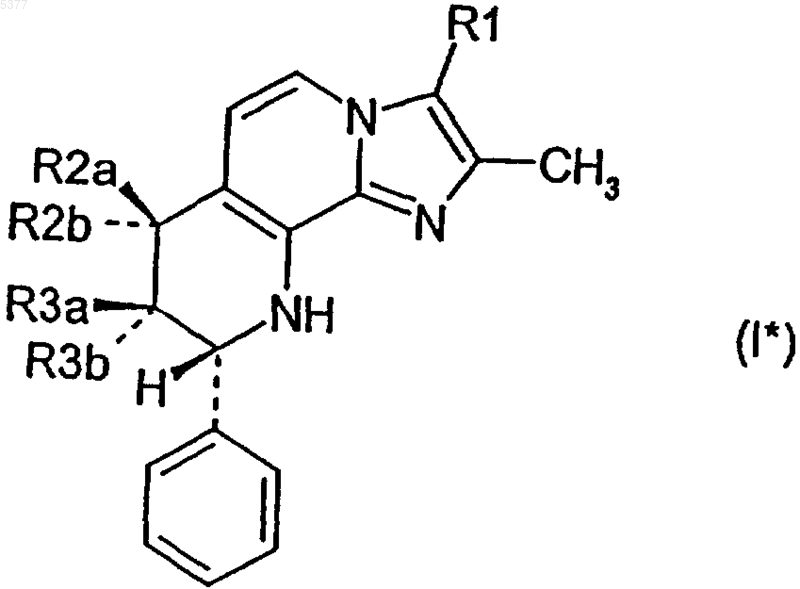
где R1 обозначает метил или гидроксиметил,
один из заместителей R2a и R2b обозначает водород, а другой обозначает гидрокси, метокси, этокси, изопропокси, метоксиэтокси или метоксипропокси,
один из заместителей R3a и R3b обозначает водород, а другой обозначает гидрокси, метокси, этокси, изопропокси, метоксиэтокси или метоксипропокси,
причем R2a или R2b, с одной стороны, и R3a или R3b, с другой стороны, не могут одновременно обозначать гидрокси,
и его соли.
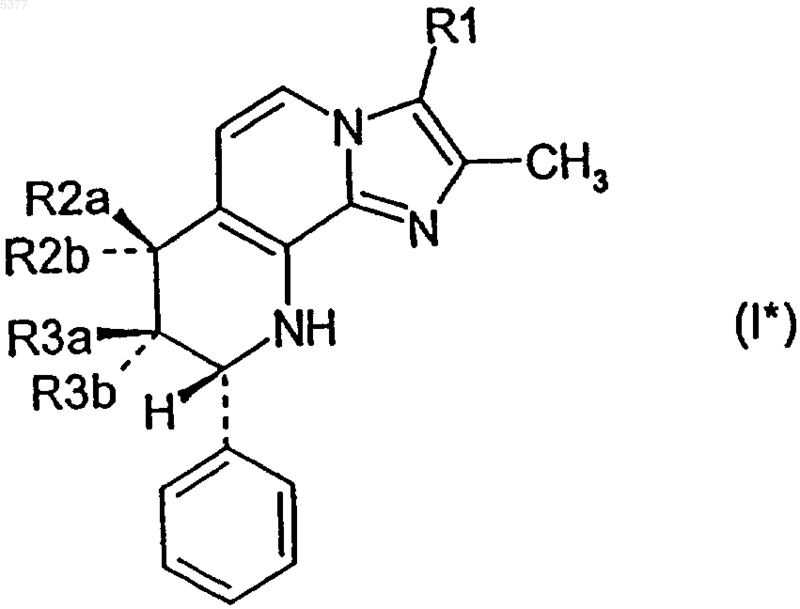
3. Соединение формулы I* по п.2, в котором
R1 обозначает метил,
один из заместителей R2a и R2b обозначает водород, а другой обозначает метокси, этокси, изопропокси, метоксиэтокси или метоксипропокси,
один из заместителей R3a и R3b обозначает водород, а другой обозначает гидрокси,
и его соли.
4. Соединение формулы I* по п.2, в котором
R1 обозначает метил,
один из заместителей R2a и R2b обозначает водород, а другой обозначает метокси, этокси, изопропокси, метоксиэтокси или метоксипропокси,
один из заместителей R3a и R3b обозначает водород, а другой обозначает метокси, этокси, изопропокси, метоксиэтокси или метоксипропокси,
и его соли.
5. Соединение формулы I* по пп.2, 3 или 4, в котором R3b обозначает водород.
6. Соединение формулы I* по пп.2, 3 или 4, в котором R2a и R3b обозначают водород.
7. Соединение по п.1, представленное формулой I**
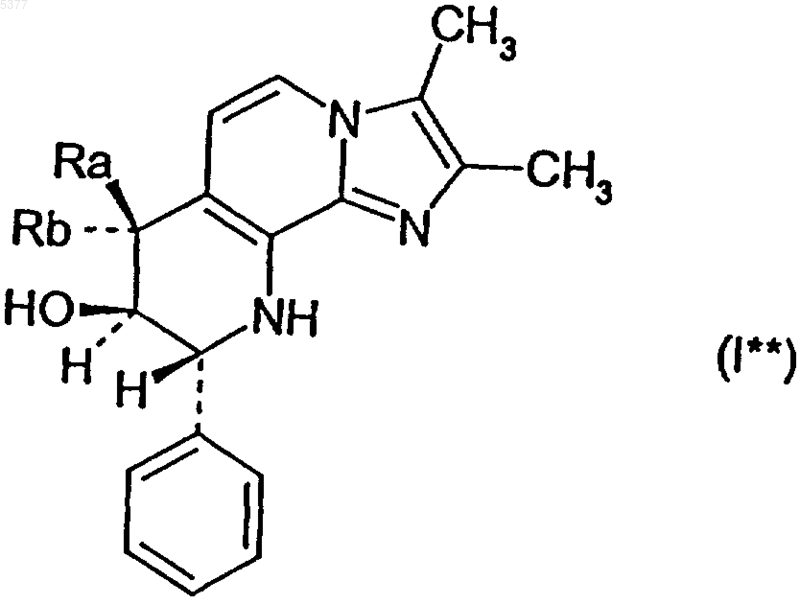
где один из заместителей Ra и Rb обозначает водород, а другой обозначает метокси, этокси, изопропокси, метоксиэтокси или метоксипропокси,
и его соли.
8. Соединение формулы I** по п.7, в котором Ra обозначает водород и Rb обозначает метокси, этокси, изопропокси, метоксиэтокси или метоксипропокси, и его соли.
9. Соединения общей формулы I*
где заместители R1, R2a, R2b, R3a и R3b имеют значения, приведенные в нижеследующей таблице:
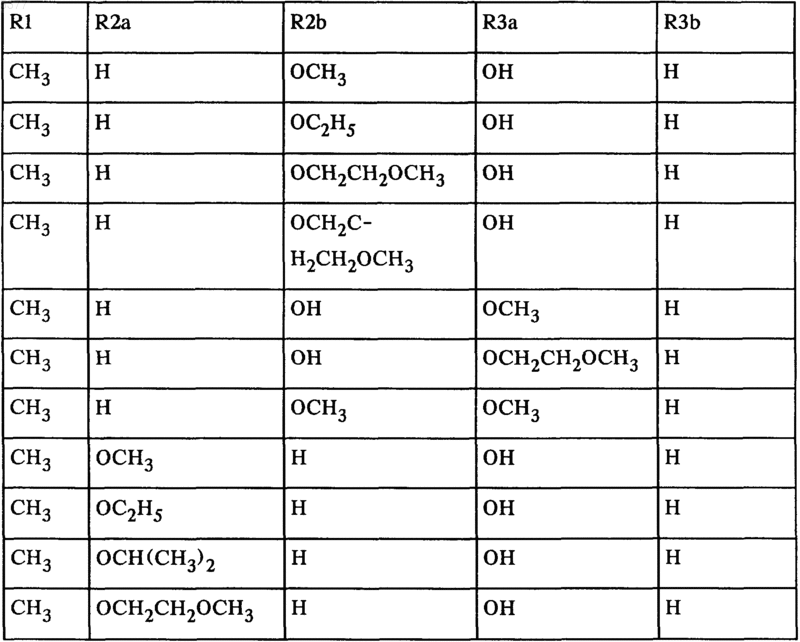

а также соли этих соединений.
10. Соединения по п.1, выбранные из группы, состоящей из
(7R,8R,9R)-2,3-диметил-8-гидрокси-7-метокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина,
(7S,8S,9S)-2,3-диметил-8-гидрокси-7-метокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина,
(7S,8R,9R)-2,3-диметил-8-гидрокси-7-метокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина,
(7R,8S,9S)-2,3-диметил-8-гидрокси-7-метокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина,
(7R,8R,9R)-2,3-диметил-7-этокси-8-гидрокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина,
(7S,8R,9R)-2,3-диметил-7-этокси-8-гидрокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина,
(7R,8R,9R)-2,3-диметил-8-гидрокси-7-(2-метоксиэтокси)-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина,
(7S,8S,9S)-2,3-диметил-8-гидрокси-7-(2-метоксиэтокси)-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина,
(7S,8R,9R)-2,3-диметил-8-гидрокси-7-(2-метоксиэтокси)-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина,
(7R,8S,9S)-2,3-диметил-8-гидрокси-7-(2-метоксиэтокси)-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина,
(7S,8R,9R)-2,3-диметил-8-гидрокси-9-фенил-7-(2-пропокси)-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина,
(7R,8R,9R)-2,3-диметил-7,8-диметокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина,
а также их солей.
11. Соединение по п.1, представляющее собой (7R,8R,9R-2,3)-диметил-8-гидрокси-7-(2-метоксиэтокси)-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин, и его соли.
12. Лекарственное средство, содержащее соединение по п.1 и/или его фармакологически переносимую соль вместе с обычными фармацевтическими вспомогательными веществами и/или эксципиентами.
13. Применение соединения по п.1 и его фармакологически переносимых солей для приготовления лекарственных средств, предназначенных для предупреждения и лечения желудочно-кишечных болезней.
Текст
005377 Область техники изобретения Изобретение относится к новым соединениям, которые могут применяться в фармацевтической промышленности в качестве действующих веществ для производства лекарственных средств. Предпосылки создания изобретения В патенте US 4468400 описаны трициклические имидазо[1,2-а]пиридины, имеющие различные кольцевые системы, сконденсированные с исходным имидазопиридиновым скелетом, которые могут применяться для лечения пептических язвенных болезней. Описание изобретения Изобретение относится к соединениям формулы IR1 обозначает метил или гидроксиметил,один из заместителей R2a и R2b обозначает водород, а другой обозначает гидрокси, метокси, этокси, изопропокси, метоксиэтокси или метоксипропокси,один из заместителей R3a и R3b обозначает водород, а другой обозначает гидрокси, метокси, этокси, изопропокси, метоксиэтокси или метоксипропокси,где R2a или R2b, с одной стороны, и R3a или R3b, с другой стороны, не могут одновременно обозначать гидрокси,и их солям. Приемлемые соли соединений формулы I, прежде всего, представляют собой кислотно-аддитивные соли. Особо следует отметить фармакологически переносимые соли неорганических и органических кислот, обычно применяемые в фармации. Такие приемлемые соли представляют собой водорастворимые и водонерастворимые кислотно-аддитивные соли таких кислот, как, например, соляная кислота, бромистоводородная кислота, фосфорная кислота, азотная кислота, серная кислота, уксусная кислота, лимонная кислота, D-глюконовая кислота, бензойная кислота, 2-(4-гидроксибензоил)бензойная кислота, масляная кислота, сульфосалициловая кислота, малеиновая кислота, лауриновая кислота, яблочная кислота, фумаровая кислота, янтарная кислота, щавелевая кислота, винная кислота, эмбоновая кислота, стеариновая кислота, толуолсульфоновая кислота, метансульфоновая кислота или 3-гидрокси-2-нафтойная кислота,причем при получении солей кислоты применяются в эквимолярном или в отличном от него количественном соотношении в зависимости от того, используется одно- или многоосновная кислота, и от того,какую соль требуется получить. Фармакологически непереносимые соли, которые могут быть сначала получены в качестве промежуточных продуктов способа, например при получении соединений по изобретению в промышленном масштабе,превращают в фармакологически переносимые соли способами, известными специалисту в данной области. Как очевидно специалисту в данной области, соединения по изобретению, а также их соли, например, когда их можно выделить в кристаллической форме, могут содержать различные количества растворителей. Поэтому под объем изобретения подпадают все сольваты, и в частности все гидраты соединений формулы I, а также все сольваты, и в частности все гидраты солей соединений формулы I. Соединения формулы I имеют три хиральных центра. Изобретение относится ко всем восьми возможным стереоизомерам в любом требуемом смесевом соотношении друг с другом, в том числе к чистым энантиомерам, которые представляют собой предпочтительный объект изобретения. Предпочтительным вариантом осуществления изобретения являются соединения формулы IR1 обозначает метил или гидроксиметил,один из заместителей R2a и R2b обозначает водород, а другой обозначает гидрокси, метокси, этокси, изопропокси, метоксиэтокси или метоксипропокси,один из заместителей R3a и R3b обозначает водород, а другой обозначает гидрокси, метокси, этокси, изопропокси, метоксиэтокси или метоксипропокси,-1 005377 причем R2a или R2b, с одной стороны, и R3a или R3b, с другой стороны, не могут одновременно обозначать гидрокси,и их соли. Вариантом осуществления (вариантом осуществления а) изобретения являются соединения формулы I, в которыхR1 обозначает метил,один из заместителей R2a и R2b обозначает водород, а другой обозначает метокси, этокси, изопропокси, метоксиэтокси или метоксипропокси,один из заместителей R3a и R3b обозначает водород, а другой обозначает гидрокси,и их соли. Еще одним вариантом осуществления (вариантом осуществления б) изобретения являются соединения формулы I, в которыхR1 обозначает метил,один из заместителей R2a и R2b обозначает водород, а другой обозначает гидрокси,один из заместителей R3a и R3b обозначает водород, а другой обозначает метокси, этокси, изопропокси, метоксиэтокси или метоксипропокси,и их соли. Следующим вариантом осуществления (вариантом осуществления в) изобретения являются соединения формулы I, в которыхR1 обозначает метил,один из заместителей R2a и R2b обозначает водород, а другой обозначает метокси, этокси, изопропокси, метоксиэтокси или метоксипропокси,один из заместителей R3a и R3b обозначает водород, а другой обозначает метокси, этокси, изопропокси, метоксиэтокси или метоксипропокси,и их соли. И еще одним вариантом осуществления (вариантом осуществления г) изобретения являются соединения формулы I, в которыхR1 обозначает гидроксиметил,один из заместителей R2a и R2b обозначает водород, а другой обозначает метокси, этокси, изопропокси, метоксиэтокси или метоксипропокси,один из заместителей R3a и R3b обозначает водород, а другой обозначает гидрокси,и их соли. Следующим вариантом осуществления (вариантом осуществления д) изобретения являются соединения формулы I, в которыхR1 обозначает гидроксиметил,один из заместителей R2a и R2b обозначает водород, а другой обозначает гидрокси,один из заместителей R3a и R3b обозначает водород, а другой обозначает метокси, этокси, изопропокси, метоксиэтокси или метоксипропокси,и их соли. Также вариантом осуществления (вариантом осуществления е) изобретения являются соединения формулы I, в которыхR1 обозначает гидроксиметил,один из заместителей R2a и R2b обозначает водород, а другой обозначает метокси, этокси, изопропокси, метоксиэтокси или метоксипропокси,один из заместителей R3a и R3b обозначает водород, а другой обозначает метокси, этокси, изопропокси, метоксиэтокси или метоксипропокси,и их соли. Предпочтительными соединениями согласно вариантам осуществления а-е являются соединения, в которых R3b обозначает водород. Особенно предпочтительными соединениями согласно вариантам осуществления а-е являются соединения, в которых R2a и R3b обозначают водород. Предпочтительными соединениями по изобретению являются соединения, представленные в варианте осуществления а, которые описываются формулой I-2 005377 где один из заместителей Ra и Rb обозначает водород, а другой обозначает метокси, этокси, изопропокси, метоксиэтокси или метоксипропокси,и их соли. Особенно предпочтительными соединениями согласно варианту осуществления а являются соединения формулы I, в которыхRb обозначает метокси, этокси, изопропокси, метоксиэтокси или метоксипропокси,и их соли. Среди соединений общей формулы I специально следует отметить следующие предпочтительные соединения по изобретению, в которых значения заместителей R1, R2a, R2b, R3a и R3b приведены ниже в табл. 1. Таблица 1 И соли этих соединений. Соединения по изобретению могут быть получены способом, который в качестве иллюстрации описан в приведенных ниже примерах, или с помощью аналогичных стадий способа с использованием соответствующих исходных соединений (см., например, ЕР-А-0299470 или у Kaminski и др., J. Med.Chem., 28, 876-892, 1985). Исходные соединения являются известными или могут быть получены аналогично известным соединениям. Соединения по изобретению могут быть получены, например, с использованием в качестве исходных продуктов N-защищенных 8-аминоимидазо[1,2-а]пиридинов согласно следующей реакционной схеме:-4 005377 Вышеприведенная схема представляет собой пример энантиоселективного синтеза. N-защищенный(Piv обозначает обычно применяемую защитную группу, предпочтительно пивалоильную группу) 8 аминоимидазо[1,2-а]пиридин, депротонированный в положении 7, подвергают взаимодействию с энантиомерно чистым диоксоланом. Это сначала приводит к получению продукта конденсации, который может быть подвергнут циклизации в сильно кислых условиях с удалением защитных групп. Последующее восстановление кетогруппы с использованием борогидрида натрия приводит к получению конечного указанного 7,8-транс-диола, содержащего более 90% требуемого энантиомера. Последующая этерификация, которую осуществляют согласно известным методам, например, как описано в примерах, приводит к получению конечных продуктов формулы I, в которых R2a и R3b обозначают водород. Соответствующее 7,8-цис-соединение получают из маточного раствора, который остается после отделения 7,8 транс-соединения, с помощью хроматографической очистки. Соединения по изобретению выделяют и очищают хорошо известным способом, например, отгоняя растворитель в вакууме и перекристаллизовывая полученный остаток из пригодного растворителя или подвергая его одному из общепринятых способов очистки, такому как, например, хроматография на колонках с использованием пригодного материала носителя. Соли получают путем растворения свободного соединения в пригодном растворителе, например в хлорированном углеводороде, таком как дихлорметан или хлороформ, или в алифатическом спирте с низкой молекулярной массой (этанол, изопропанол), который содержит требуемую кислоту или к которому затем добавляют требуемую кислоту. Соли получают путем фильтрации, повторного осаждения,осаждения с осадителем для кислотно-аддитивной соли или путем выпаривания растворителя. Полученные соли могут быть превращены с помощью подщелачивания или подкисления в свободные соединения, которые, в свою очередь, могут быть превращены в соли. Таким образом фармакологически непереносимые соли могут быть превращены в фармакологически переносимые соли. Чистые энантиомеры, в частности чистые энантиомеры формулы I, являющиеся предпочтительным объектом изобретения, могут быть получены способом, известным специалисту в данной области,например путем энантиоселективного синтеза (см., например, схему), путем хроматографического разделения на хиральных разделительных колонках, путем дериватизации с использованием хиральных вспомогательных реагентов, последующего разделения диастереомеров и удаления хиральной вспомогательной группы, путем получения солей с хиральными кислотами, последующего разделения солей и выделения требуемого соединения из соли или путем (фракционированной) кристаллизации из пригодного растворителя. Полученные транс-соединения (в которых R2a и R3b обозначают водород) могут быть превращены (по меньшей мере частично) в соответствующие цис-соединения (в которых R2b и R3b обозначают водород) путем выдерживания в кислых условиях (например, 2 эквивалента кислоты, такой как серная кислота) в соответствующем спирте R2a-ОН. Аналогично этому, полученные цис-соединения могут быть превращены в соответствующие транс-соединения. Цис- и транс-соединения разделяют, например, хроматографией или кристаллизацией. Следующие примеры служат для цели дальнейшей иллюстрации изобретения, но не ограничивают его объем. Более того, другие соединения формулы I, способ получения которых не описан явным образом, могут быть получены аналогичными методами, известными специалисту в данной области, с использованием общепринятых методов обработки. Сокращение мин обозначает минуту(ы), ч обозначает час(ы), эи обозначает избыток энантиомера. Примеры Конечные продукты 1 А. (7R,8R,9R)-2,3-Диметил-8-гидрокси-7-метокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7] нафтиридин. Вариант а способа. 20 г (65 ммолей) (7R,8R,9R)-2,3-диметил-7,8-дигидрокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2h][1,7]нафтиридина растворяют в метаноле (350 мл). Добавляют 13,5 г серной кислоты и раствор перемешивают в течение 48 ч при 50 С. После охлаждения реакционную смесь сливают на 250 мл воды. Значение рН доводят с помощью водного насыщенного раствора бикарбоната натрия до нейтрального. Осадок собирают и очищают на силикагеле (элюент: диэтиловый эфир). Получают 2,5 г указанного в заголовке соединения в виде бесцветных кристаллов, tпл 164-165 (2-пропанол). Вариант б способа. 10 г (32,5 ммоля) (7R,8R,9R)-2,3-диметил-7,8-дигидрокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2h][1,7]нафтиридина растворяют в 200 мл безводного диметилформамида. Добавляют при комнатной температуре небольшими порциями 1,9 г поступающего в продажу гидрида натрия в парафине (80%). Через 1 ч добавляют 9,1 г (65 ммолей) метилйодида, растворенного в 4 мл диметилформамида, и смесь перемешивают в течение еще 1 ч. Реакционную смесь сливают на холодную воду. Добавляют 20 мл водного насыщенного раствора хлорида аммония, собирают и отбрасывают осадок желтого цвета. Фильтрат экстрагируют несколько раз этилацетатом, объединенные органические фазы промывают несколько раз водой и растворитель упаривают в вакууме. Твердый остаток очищают на силикагеле (диэтиловый эфир).-5 005377 Получают 2 г указанного в заголовке соединения в виде бесцветных кристаллов, tпл 164-165 (2 пропанол). 1 Б. (7S,8S,9S)-2,3-Диметил-8-гидрокси-7-метокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7] нафтиридин. Указанное в заголовке соединение с tпл 161-162 получают аналогично описанному в примере 1 варианту а способа, используя в качестве исходного продукта (7S,8S,9S)-2,3-диметил-7,8-дигидрокси-9 фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. 2 А. (7S,8R,9R)-2,3-Диметил-8-гидрокси-7-метокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7] нафтиридин. 6 г указанного в заголовке соединения в виде бесцветного порошка с tпл 108-110 получают после очистки на силикагеле аналогично описанному в примере 1 А варианту а способа, используя в качестве исходного продукта (7S,8R,9R)-2,3-диметил-7,8-дигидрокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. 2 Б. (7R,8S,9S)-2,3-Диметил-8-гидрокси-7-метокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7] нафтиридин. Указанное в заголовке соединение с tпл 171-172 получают из маточного раствора, используемого в примере 1 Б, после очистки на силикагеле (диэтиловый эфир). 3. (7R,8R,9R)-2,3-Диметил-7-этокси-8-гидрокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. 500 мг указанного в заголовке соединения получают взаимодействием (7R,8R,9R)-2,3-диметил-7,8 дигидрокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина с этанолом и серной кислотой аналогично описанному в примере 1 варианту а способа, после очистки на силикагеле (диэтиловый эфир), tпл 188-190. 4. (7S,8R,9R)-2,3-Диметил-7-этокси-8-гидрокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. 800 мг указанного в заголовке соединения с tпл 135-137 получают в виде твердого вещества после дополнительной очистки на силикагеле маточного раствора, используемого в примере 3. 5 А. (7R,8R,9R)-2,3-Диметил-8-гидрокси-7-(2-метоксиэтокси)-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. Вариант а способа. 5 г указанного в заголовке соединения с tпл 130-131 получают взаимодействием 20 г (7R,8R,9R)2,3-диметил-7,8-дигидрокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина с 2-метоксиэтанолом аналогично описанному в примере 1 варианту а способа. Вариант б способа. К раствору, содержащему 100 г (7R,8R,9R)-2,3-диметил-7,8-дигидрокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина в 1 л 2-этоксиэтанола, медленно добавляют при комнатной температуре в атмосфере аргона 64 г концентрированной серной кислоты. Скорость добавления является такой,чтобы температура смеси не превышала 35 С. После перемешивания в течение еще 15 ч при комнатной температуре раствор зеленоватого цвета сливают на смесь, содержащую 1 кг ледяной крошки и 800 мл дихлорметана. Значение рН реакционной смеси доводят до 7,5, добавляя 10 М водный раствор гидроксида натрия, органический слой отделяют, водный слой экстрагируют трижды дихлорметаном (используя каждый раз по 200 мл), дихлорметановые слои вместе промывают 500 мл воды (шестикратно) и затем сушат над сульфатом натрия. После полного выпаривания растворителя при пониженном давлении оставшийся маслянистый остаток обрабатывают 450 мл ацетона, получая 75 г беловатых кристаллов, состоящих из смеси 1:1 указанного в заголовке соединения и его (7S,8R,9R)-эпимера. Смесь разделяют препаративной ЖХВР, используя метанол в качестве элюента. После перекристаллизации из этилацетата получают 28 г указанного в заголовке соединения с tпл 128-129. 5 Б.[1,2-h][1,7]нафтиридин. Указанное в заголовке соединение с tпл 130-131 получают аналогично описанному в примере 5 А варианту а способа, используя в качестве исходного продукта (7S,8S,9S)-2,3-диметил-7,8-дигидрокси-9 фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. 6 А. (7S,8R,9R)-2,3-Диметил-8-гидрокси-7-(2-метоксиэтокси)-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. 8 г указанного в заголовке соединения с tпл 131-132 в виде твердого вещества получают из маточного раствора, используемого в примере 5 А, после очистки на силикагеле (диэтиловый эфир). 6 Б.[1,2-h][1,7]нафтиридин. Указанное в заголовке соединение с tпл 131-132 получают из маточного раствора, используемого в примере 5 Б, после очистки на силикагеле (диэтиловый эфир). 7.-6 005377 1 г указанного в заголовке соединения с tпл 168-169 получают взаимодействием 3 г (7R,8R,9R)-2,3 диметил-7,8-дигидрокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина с 2-пропанолом аналогично описанному в примере 1 варианту а способа. 8. (7R,8R,9R)-2,3-Диметил-7,8-диметокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. 8 г указанного в заголовке соединения с tпл 155-156 получают взаимодействием 10 г (7R,8R,9R)2,3-диметил-7,8-дигидрокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина с 1,9 г гидрида натрия (80%) и 9,1 г метилйодида аналогично описанному в примере 1 варианту б способа. Исходные соединения А 1. 2,3-Диметил-7-[(2R,3S)-2,3-O-изопропилиден-3-фенилпропан-1-он-1-ил]-8-пивалоиламиноимидазо[1,2-а]пиридин. 60 г (0,245 моля) 2,3-диметил-8-пивалоиламиноимидазо[1,2-а]пиридина растворяют в 1,5 л безводного диэтилового эфира в атмосфере аргона без доступа влаги и охлаждают до -75 С. С помощью гибкой иглы в течение 30 мин по каплям добавляют 408 мл (0,612 моля) раствора трет-бутиллития (1,5 М в нпентане) таким образом, чтобы температура не превышала -65 С. Образуется суспензия красного цвета. После завершения добавления суспензию перемешивают при -75 С еще в течение 30 мин. Затем в течение 30 мин при -65 С медленно добавляют по каплям 1/3 раствора, содержащего 145 г метил-(2R,3S)-2,3O-изопропилиден-3-фенилпропионата (эи: 99,05%, ЖХВР с использованием сорбента типа Daicel Chiracel) в 150 мл абсолютного ТГФ. Затем быстро (5 мин) добавляют оставшееся количество, при этом происходит повышение температуры до -60 С. После завершения добавления удаляют охлаждающую баню. После того как внутренняя температура достигает -30 С, добавляют 20 мл метанола, а после того как внутренняя температура станет равной 0 С, добавляют 200 мл дистиллированной воды. Водную фазу отделяют с помощью делительной воронки, органическую фазу промывают 5 раз дистиллированной водой, используя каждый раз по 100 мл, затем органическую фазу трижды экстрагируют серной кислотой 10%-ной крепости (200 мл, 50 мл, 50 мл). Фазы, экстрагированные серной кислотой, объединяют, обрабатывают 200 мл дихлорметана и при охлаждении на льду и интенсивном перемешивании доводят значение рН до 2,3 с помощью 10 н. раствора гидроксида натрия. Отделяют органический слой. Водную фазу экстрагируют 30 мл дихлорметана. Объединенные дихлорметановые фазы дважды промывают небольшим количеством дистиллированной воды. Затем органический слой сушат над безводным сульфатом натрия и растворитель полностью отгоняют в вакууме. Образуется продукт в виде масла коричневого цвета, который обрабатывают 50 мл диэтилового эфира. После внесения затравки образуются кристаллы, которые отфильтровывают после выстаивания в течение ночи и промывают диэтиловым эфиром. После сушки в вакууме получают 57,7 г (выход 52,5%, эи 99%, ЖХВР, Daicel Chiracel) указанного в заголовке соединения в виде порошка светло-желтого цвета с tпл 76-80 С. А 2. 2,3-Диметил-7-[(2S,3R)-2,3-O-изопропилиден-3-фенилпропан-1-он-1-ил]-8-пивалоиламиноимидазо[1,2-а]пиридин. Указанное в заголовке соединение (эи: 89,3%, ЖХВР, Daicel Chiracel) получают аналогично примеру А 1, используя метил-(2S,3R)-2,3-O-изопропилиден-3-фенилпропионат (эи: 98%, ЖХВР, Daicel Chiracel) в качестве ацилирующего агента. Б 1. (8R,9R)-2,3-Диметил-8-гидрокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин-7-он. 10,8 г (24 ммоля) 2,3-диметил-7-[(2R,3S)-2,3-O-изопропилиден-3-фенилпропан-1-он-1-ил]-8-пивалоиламиноимидазо[1,2-а]пиридина (эи 95%, ЖХВР, Daicel Chiracel) добавляют в течение 4 мин при охлаждении на льду к 50 мл серной кислоты 70%-ной крепости. В процессе этого образуется суспензия, которая через 30 мин превращается в раствор оранжевого цвета. После завершения добавления ледяную баню удаляют и смесь перемешивают при комнатной температуре. Через 50 ч реакционный раствор добавляют к ледяной воде, добавляют дихлорметан, после чего значение рН смеси доводят до 8 с помощью 6 н. раствора гидроксида натрия и насыщенного раствора бикарбоната натрия. Отделяют органическую фазу. Водную фазу дважды экстрагируют дихлорметаном. Органические фазы объединяют и промывают небольшим количеством дистиллированной воды. Затем органический слой сушат над безводным сульфатом натрия, фильтруют и концентрируют в вакууме на роторном испарителе. Концентрированный остаток хроматографируют на силикагеле (элюент: дихлорметан/метанол, 100:1). Основную фракцию концентрируют и обрабатывают этилацетатом, в процессе этого кристаллизуется указанное в заголовке соединение в виде твердого вещества желтого цвета. Этот осадок отфильтровывают под вакуумом и сушат до постоянной массы в вакуумной сушильной печи при 50 С. В результате получают 4,22 г (57%,эи 95%, ЖХВР, Daicel Chiracel) указанного в заголовке соединения с tпл 231-234 С. Б 2. (8S,9S)-2,3-Диметил-8-гидрокси-9-фенил-7,8,9,10-тетрагидроимидазo[1,2-h][1,7]нафтиридин-7-он. Указанное в заголовке соединение (эи: 94%, ЖХВР, Daicel Chiracel) получают аналогично примеру Б 1, используя в качестве исходного продукта 2,3-диметил-7-[(2S,3R)-2,3-O-изопропилиден-3-фенилпропан-1-он-1-ил]-8-пивалоиламиноимидазо[1,2-а]пиридин. В 1. (7R,8R,9R)-2,3-Диметил-7,8-дигидрокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. 6 г (19,52 ммоля) (8R,9R)-2,3-диметил-8-гидрокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7] нафтиридин-7-она (эи 90%, ЖХВР, Daicel Chiracel) суспендируют в 60 мл метанола и охлаждают до тем-7 005377 пературы в диапазоне от -5 до 0 С в бане метанол-лед. При этой температуре шпателем в течение 0,5 ч добавляют борогидрид натрия (0,81 г, 21,47 ммоля) (выделяется газ). После завершения добавления смесь перемешивают еще в течение 10 мин и затем концентрируют в вакууме на роторном испарителе при температуре бани 40 С. Полученный маслянистый остаток растворяют в дистиллированной воде и трижды экстрагируют хлороформом. Органические фазы объединяют и промывают небольшим количеством воды, затем сушат с использованием безводного сульфата натрия и фильтруют. Фильтрат концентрируют в вакууме на роторном испарителе и совместно упаривают с ацетоном; в процессе этого кристаллизуется указанное в заголовке соединение. Осадок отфильтровывают, промывают ацетоном и сушат до постоянной массы при 50 С в вакуумной сушильной печи. Получают 5,15 г (85,3%, эи 90%, ЖХВР,Daicel Chiracel) указанного в заголовке соединения в виде бесцветного кристаллов с tпл 206-209 С. В 2. (7S,8S,9S)-2,3-Диметил-7,8-дигидрокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. Указанное в заголовке соединение, tпл 207-208 С (эи: 98,7%, ЖХВР, Daicel Chiracel), получают аналогично примеру В 1, используя в качестве исходного продукта (8S,9S)-2,3-диметил-8-гидрокси-9-фенил 7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин-7-он. Г. (7S,8R,9R)-2,3-Диметил-7,8-дигидрокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин. 2 г маточного раствора, используемого в примере В 1, хроматографируют на силикагеле (элюент: этилацетат/метанол, 19/1), получая 0,35 г указанного в заголовке соединения в виде масла, которое кристаллизуется при добавлении этилацетата. tпл 199-200 С (этилацетат). Практическое применение Соединения формулы I и их соли обладают ценными фармакологическими свойствами, которые обусловливают возможность их практического применения. В частности, они обладают выраженным ингибирующим действием в отношении секреции желудочных кислот и высокой защитной активностью в отношении желудка и кишечника теплокровных животных, в частности человека. В этом контексте соединения по настоящему изобретению отличаются высокой избирательностью действия, большой продолжительностью действия, очень хорошей активностью в отношении тонкого кишечника, отсутствием значительных побочных действий и широким спектром терапевтической активности. В контексте настоящего изобретения понятие "защита желудка и кишечника" означает предупреждение и лечение желудочно-кишечных болезней, в частности воспалительных болезней и повреждений желудочно-кишечного тракта (например, таких как язвы желудка, язвы двенадцатиперстной кишки, гастриты, функциональная гастропатия, вызванная повышенной кислотностью или лекарственными средствами), которые могут быть вызваны, например, микроорганизмами (например, Helicobacter pylory),бактериальными токсинами, лекарственными средствами (например, определенными противовоспалительными и противоревматическими средствами), химическими веществами (например, этанолом), желудочной кислотой или стрессовыми ситуациями. С использованием различных моделей, на которых определяли характеристики противоязвенного действия и ингибирования секреции, неожиданно было установлено, что благодаря своим очень хорошим характеристикам соединения по изобретению значительно превосходят известные в данной области соединения. Принимая во внимание эти характеристики, соединения формулы I и их фармакологически переносимые соли являются чрезвычайно ценными для применения в медицине человека и ветеринарии,где их применяют, в частности, для лечения и/или профилактики болезней желудка и/или кишечника. Поэтому изобретение также относится к соединениям по изобретению, предназначенным для применения для лечения и/или профилактики вышеуказанных болезней. Под объем изобретения также подпадает применение соединений по изобретению для приготовления лекарственных средств, которые применяют для лечения и/или профилактики вышеуказанных болезней. Кроме того, под объем изобретения подпадает применение соединений по изобретению для лечения и/или профилактики вышеуказанных болезней. Изобретение также относится к лекарственным средствам, которые содержат одно или несколько соединений формулы I и/или их фармакологически переносимых солей. Лекарственные средства получают хорошо известными способами, которые очевидны специалисту в данной области. В качестве лекарственных средств фармакологически активные соединения по изобретению (действующие вещества) применяют либо индивидуально, либо предпочтительно в сочетании с пригодными фармацевтическими вспомогательными веществами или эксципиентами в форме таблеток,филмтаблеток, капсул, суппозиториев, пластырей (например, в виде TTS (трансдермальной терапевтической проводящей системы, эмульсий, суспензий или растворов, в которых содержание действующего вещества предпочтительно находится в диапазоне от 0,1 до 95%, и при этом путем соответствующего выбора вспомогательных веществ и эксципиентов может быть достигнуто то, что фармацевтическая вводимая форма (например, форма с замедленным высвобождением или форма, предназначенная для кишечника) будет точно соответствовать характеристикам действующего вещества и/или требуемому началу действия.-8 005377 Специалисту в данной области на основе его практического опыта известны вспомогательные вещества или эксципиенты, которые пригодны для требуемой фармацевтической композиции. Помимо растворителей, гелеобразующих агентов, основ для суппозиториев, вспомогательных веществ для таблеток и других носителей для действующего вещества можно использовать, например, антиоксиданты,диспергаторы, эмульгаторы, пеногасители, корригенты, консерванты, солюбилизаторы, красители или, в частности, вещества, усиливающие проникающую способность, и комплексобразующие агенты (например, циклодекстрины). Действующие вещества могут вводиться перорально, парентерально или подкожно. В целом, в медицине человека для достижения требуемого результата в случае перорального введения предпочтительно вводить действующее(ие) вещество(а) в суточной дозе приблизительно от 0,01 до приблизительно 20, предпочтительно от 0,05 до 5, в частности от 0,1 до 1,5 мг/кг массы тела, при необходимости в виде нескольких, предпочтительно от 1 до 4 разделенных доз. В случае парентерального введения могут быть использованы аналогичные или (в частности, в случае внутривенного введения действующих веществ), как правило, меньшие дозы. Оптимальная доза и способ введения действующих веществ, требуемые в каждом случае, легко могут быть определены специалистом в данной области на основе его практического опыта. Если соединения по изобретению и/или их соли применяют для лечения вышеуказанных болезней,то фармацевтические композиции также могут содержать один или несколько фармакологически активных компонентов из других фармацевтических групп. Примерами, которые следует упомянуть, являются: транквилизаторы (например, из группы бензодиазапинов, например диазепам), спазмолитические средства (например, биетамиверин или камилофин), антихолинергетические средства (например, оксифенциклимин или фенкарбамид), местные анестетики (например, тетракаин или прокаин) и при необходимости также ферменты, витамины или аминокислоты. В этой связи, в частности, предпочтительной является комбинация соединений по изобретению с лекарственными средствами, которые ингибируют секрецию кислоты, такими как, например, Н 2 блокаторы (например, циметидин, ранитидин), ингибиторы H+/K+ - АТФазы (например, омепразол, пантопразол), или кроме того, с так называемыми периферическими антихолинергетическими средствами(такими как, например, пирензепин, телензепин), и с антагонистами гастрина с целью аддитивного или сверхаддитивного увеличения основного действия и/или устранения или уменьшения побочных действий, или, кроме того, комбинация с веществами, обладающими антибактериальной активностью (такими как, например, цефалоспорины, тетрациклины, пенициллины, макролиды, нитроимидазолы или в альтернативном варианте соли висмута) для борьбы с Helicobacter pylori. Компонентами комбинации, обладающими антибактериальной активностью, которые следует упомянуть, являются, например, мезлоциллин, ампициллин, амоксициллин, цефалотин, цефокситин, цефотаксим, имипенем, гентамицин, амикацин, эритромицин, ципрофлоксацин, метронидазол, кларитромицин, азитромицин и их комбинации (например, кларитромицин+метронидазол). Фармакология Чрезвычайно сильное защитное действие в отношении желудка и ингибирующее действие в отношении секреции желудочных кислот соединений по изобретению может быть показано в экспериментах на животных-моделях. Соединения по изобретению, изученные в приведенных ниже экспериментах,имеют номера, которые соответствуют номерам этих соединений в примерах. Тестирование ингибирующего секрецию действия с помощью перфузии желудка крысы В приведенной ниже табл. А представлены результаты действия in vivo после внутривенного введения соединений по изобретению в отношении стимулируемой пентагастрином секреции кислоты в подвергнутом перфузии желудке крысы. Таблица А Доза в.в., мкмоли/кг Ингибирование секреции кислоты, % 1 А 3 100 2 А 3 100 3 3 100 4 3 100 5 А 3 100 6 А 3 100 7 3 100 8 3 100 Методика Брюшную полость крыс, подвергнутых анестезии (крыса линии CD, самка, 200-250 г; уретан 1,5 г/кг в.м.), вскрывают после трахеотомии путем срединного разреза верхней части брюшной полости и трансорально вводят и фиксируют в пищеводе один катетер из ПВХ, а другой вводят через привратник-9 005377 так, чтобы концы трубки проходили в просвет желудка. Катетер, выходящий из привратника, выводят наружу через боковое отверстие в правой стенке брюшной полости. После тщательной промывки (приблизительно 50-100 мл) через желудок непрерывно пропускают теплый физиологический раствор NaCl при 37 С (0,5 мл/мин, рН 6,8-6,9; Braun-Unita I). Для вытекающей жидкости, которую в каждом случае собирают каждые 15 мин, определяют значение рН (рН-метр 632,стеклянный электрод ЕА 147; =5 мм, фирма Metrohm) и путем титрования свежеприготовленным 0,01 н. раствором NaCl до значения рН, равного 7 (Dosimat 665, Metrohm), определяют концентрацию НСl. Желудочную секрецию стимулируют путем непрерывной внутривенной инфузии 1 мкг/кг (т.е. 1,65 мл/ч) пентагастрина (левая бедренная вена) приблизительно через 30 мин после окончания операции (т.е. после анализа двух предварительных фракций). Тестируемые соединения вводят внутривенно в виде объемов жидкости 1 мл/кг через 60 мин после начала непрерывной инфузии пентагастрина. Температуру тела животных поддерживают на постоянном уровне 37-38 С с помощью инфракрасного облучения и обогревающих подушек (автоматический непрерывный контроль с помощью ректального датчика температуры). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы IR1 обозначает метил или гидроксиметил,один из заместителей R2a и R2b обозначает водород, а другой обозначает гидрокси, метокси, этокси, изопропокси, метоксиэтокси или метоксипропокси,один из заместителей R3a и R3b обозначает водород, а другой обозначает гидрокси, метокси, этокси, изопропокси, метоксиэтокси или метоксипропокси,причем R2a или R2b, с одной стороны, и R3a или R3b, с другой стороны, не могут одновременно обозначать гидрокси,и его соли. 2. Соединение по п.1, представленное формулой IR1 обозначает метил или гидроксиметил,один из заместителей R2a и R2b обозначает водород, а другой обозначает гидрокси, метокси, этокси, изопропокси, метоксиэтокси или метоксипропокси,один из заместителей R3a и R3b обозначает водород, а другой обозначает гидрокси, метокси, этокси, изопропокси, метоксиэтокси или метоксипропокси,причем R2a или R2b, с одной стороны, и R3a или R3b, с другой стороны, не могут одновременно обозначать гидрокси,и его соли. 3. Соединение формулы I по п.2, в которомR1 обозначает метил,один из заместителей R2a и R2b обозначает водород, а другой обозначает метокси, этокси, изопропокси, метоксиэтокси или метоксипропокси,-10 005377 один из заместителей R3a и R3b обозначает водород, а другой обозначает метокси, этокси, изопропокси, метоксиэтокси или метоксипропокси,и его соли. 5. Соединение формулы I по пп.2, 3 или 4, в котором R3b обозначает водород. 6. Соединение формулы I по пп.2, 3 или 4, в котором R2a и R3b обозначают водород. 7. Соединение по п.1, представленное формулой I где один из заместителей Ra и Rb обозначает водород, а другой обозначает метокси, этокси, изопропокси, метоксиэтокси или метоксипропокси,и его соли. 8. Соединение формулы I по п.7, в которомRb обозначает метокси, этокси, изопропокси, метоксиэтокси или метоксипропокси,и его соли. 9. Соединения общей формулы I а также соли этих соединений. 10. Соединения по п.1, выбранные из группы, состоящей из[1,7]нафтиридина,(7S,8R,9R)-2,3-диметил-8-гидрокси-9-фенил-7-(2-пропокси)-7,8,9,10-тетрагидроимидазо[1,2-h][1,7] нафтиридина,(7R,8R,9R)-2,3-диметил-7,8-диметокси-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридина,а также их солей. 11. Соединение по п.1, представляющее собой (7R,8R,9R)-2,3-диметил-8-гидрокси-7-(2 метоксиэтокси)-9-фенил-7,8,9,10-тетрагидроимидазо[1,2-h][1,7]нафтиридин, и его соли. 12. Лекарственное средство, содержащее соединение по п.1 и/или его фармакологически переносимую соль вместе с обычными фармацевтическими вспомогательными веществами и/или эксципиентами. 13. Применение соединения по п.1 и его фармакологически переносимых солей для приготовления лекарственных средств, предназначенных для предупреждения и лечения желудочно-кишечных болезней.
МПК / Метки
МПК: C07D 471/14, A61K 31/435
Метки: нафтиридиновые, 1,2-h][1,7, соединения, тетрагидроимидазо
Код ссылки
<a href="https://eas.patents.su/13-5377-tetragidroimidazo-12-h17-naftiridinovye-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Тетрагидроимидазо [1,2-h][1,7] нафтиридиновые соединения</a>
Предыдущий патент: Новые соединения бензолсульфонамида, способ их получения и фармацевтические композиции их содержащие
Следующий патент: Аминированные производные дигидро-1,3,5-триазина и их применение в терапии
Случайный патент: Соединение 2-морфолино-4-пиримидона












