Новые α-аминокислотные сульфонильные соединения, способ их получения и фармацевтические композиции, их содержащие
Номер патента: 4591
Опубликовано: 24.06.2004
Авторы: Левен Нижель, Юссон-Робер Бернадетта, Портвен Бернар, Ножан Оливье, Бенуа Ален, Де Нантей Гийом
Формула / Реферат
1. Соединение формулы (I)
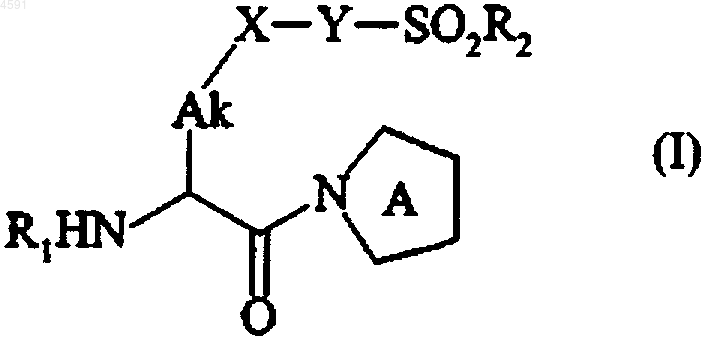
в которой

R1 представляет собой атом водорода или линейный или разветвленный (C1-C6)алкил, линейную или разветвленную (C1-C6)ацильную, пролильную, аланильную, гистидилпролильную или фенилаланилпролильную группу,
Ak представляет собой линейную или разветвленную (C1-C6)алкиленовую цепь или гетероалкиленовую цепь,
X представляет собой одинарную связь или фениленовую группу, необязательно замещенную одной или более одинаковыми или различными группами, выбираемыми из атомов галогенов и линейной или разветвленной (C1-C6)алкильной, гидрокси, линейной или разветвленной (C1-C6)алкокси и линейной или разветвленной (C1-C6)полигалоалкильной групп,
R2 представляет собой линейную или разветвленную (C1-C6)алкильную группу (необязательно замещенную одной или более одинаковыми или различными группами, выбираемыми из арильной, линейной или разветвленной (C1-C6)алкилсульфонильной, (C3-C7)циклоалкилсульфонильной, (C3-C7)циклоалкильной групп и атомов галогена), (C3-C10)циклоалкильную группу или -NR2aR2b, в которой R2a и R2b, которые могут быть одинаковыми или различными, каждая представляет собой атом водорода или линейную или разветвленную (C1-C6)алкильную группу или совместно с атомом азота несущим их, образуют азотсодержащий гетероцикл,
Y представляет собой группу -NR3-,
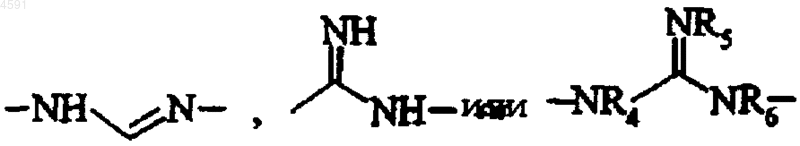
R3 представляет собой атом водорода или группу, выбираемую из линейной или разветвленной (C1-C6)алкильной группы, (C3-C7)циклоалкила и арила,
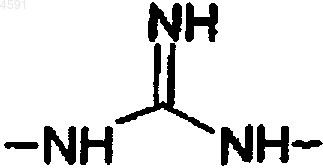
R4, R5 и R6, которые могут быть одинаковыми или различными, каждая представляет собой атом водорода или линейную или разветвленную (C1-C6)алкильную группу, или R4 и R6 или R5 и R6 совместно с атомами, их несущими, образуют имидазолидиновое или дигидробензимидазольное кольцо,
их оптические изомеры и их аддитивные соли с фармацевтически приемлемой кислотой,
азотосодержащий гетероцикл понимают как обозначающий насыщенную, моноциклическую, 5-7 членную группу, содержащую один, два или три гетероатомов, один из этих гетероатомов представляет собой атом азота и дополнительный гетероатом(ы), которые необязательно присутствуют, выбирают из атомов кислорода, азота и серы,
гетероалкиленовую цепь понимают как обозначающую линейную или разветвленную (C1-C6)алкиленовую цепь, в которой -CH2-член замещен атомом кислорода или серы.
2. Соединение формулы (I) по п.1, в которой  представляет собой 1-пирролидинильную группу, необязательно замещенную цианогруппой, или 1,3-тиазолидин-3-ильную группу, необязательно замещенную цианогруппой.
представляет собой 1-пирролидинильную группу, необязательно замещенную цианогруппой, или 1,3-тиазолидин-3-ильную группу, необязательно замещенную цианогруппой.
3. Соединения формулы (I) либо по п.1, либо 2, в которой X представляет собой одинарную связь.
4. Соединение формулы (I) по любому из пп.1-3, в которой конфигурация a для  амидной функции представляет собой (S).
амидной функции представляет собой (S).
5. Соединение формулы (I) по любому из пп.1-4, в которой R2 представляет собой линейную или разветвленную (C1-C6)алкильную группу и Y представляет собой группу
6. Соединение формулы (I) по любому из пп.1-4, в которой R2 представляет собой (C3-C10)циклоалкильную группу и Y представляет собой группу -NH-.
7. Соединение формулы (I) по п.1, которое представляет собой (S)-1-[N5-{(имино)(метилсульфониламино)метил}орнитил]пирролидин, его оптические изомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой.
8. Соединение формулы (I) по п.1, которое представляет собой (S)-N-[4-амино-5-оксо-5-(1-пирролидинил)пентил]циклогексансульфонамид, его оптические изомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой.
9. Соединение формулы (I) по п.1, которое представляет собой (2S)-2-циано-1-[N5-{(имино)(метилсульфониламино)метил}-(S)-орнитил]пирролидин, его оптические изомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой.
10. Соединение формулы (I) по п.1, которое представляет собой (2S)-2-циано-1-[N6-{(имино)(метилсульфониламино)метил}-(S)-лизил]пирролидин, его оптические изомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой.
11. Способ получения соединений формулы (I) по п.1, который отличается тем, что соединение формулы (II)
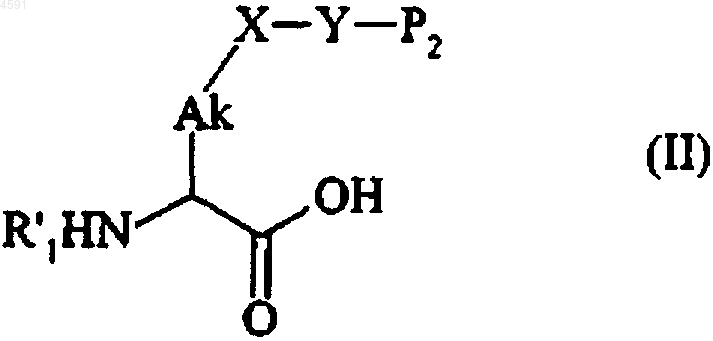
в которой Ak, X и Y имеют значения, указанные для формулы (I),
R'1 представляет собой защитную группу для аминофункции, или линейную или разветвленную (C1-C6)алкильную группу, линейную или разветвленную (C1-C6)ацильную группу, пролильную группу, необязательно защищенную аминофункционально-защитной группой, аланильную группу, необязательно защищенную аминофункционально-защитной группой, гистидилпролильную группу, необязательно защищенную аминофункционально-защитной группой, или фенилаланилпролильную группу, необязательно защищенную аминофункционально-защитной группой, и
P2 представляет собой атом водорода или защитную группу для аминофункции,
подвергают реакции с соединением формулы (III)

в которой  имеет значение, указанное для формулы (I),
имеет значение, указанное для формулы (I),
при обычных условиях пептидного связывания с получением после депротекции, где это необходимо, группы Y соединения формулы (IV)
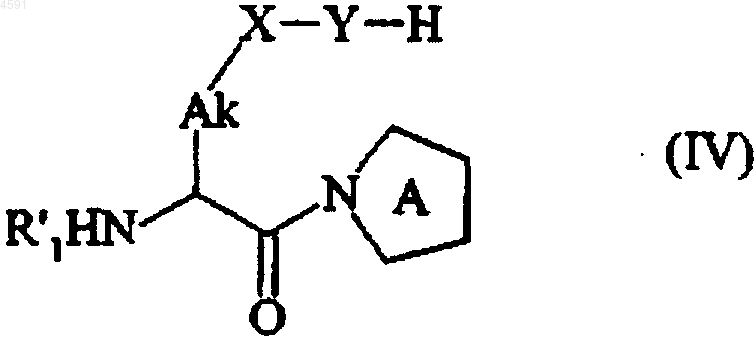
в которой  Ak, X, Y и R'1 имеют значения, указанные здесь ранее,
Ak, X, Y и R'1 имеют значения, указанные здесь ранее,
которое подвергают реакции с соединением формулы (V)
R2-SO2-Z1 (V),
в которой R2 имеет значение, указанное для формулы (I), и Z1 представляет собой уходящую группу, такую как, например, атом галогена,
с получением после депротекции, где это необходимо, соединения формулы (I),
которое очищают, где это необходимо, по традиционной методике очистки, которое разделяют при желании на оптические изомеры по традиционной методике разделения и которое переводят при желании в его аддитивные соли с фармацевтически приемлемой кислотой.
12. Фармацевтическая композиция, включающая как активный ингредиент соединение по любому из пп.1-10, в комбинации с одним или более инертным, нетоксичным и фармацевтически приемлемым носителем.
13. Фармацевтическая композиция по п.12 для применения в качестве лекарственного препарата как ингибитора дипептидилпептидазы IV для применения при лечении непереносимости глюкозы и расстройств, связанных с гипергликемией, таких как диабет типа II или ожирение, при предотвращении отторжения после трансплантации, при лечении рака и предотвращении раковых метастаз, при лечении СПИДа и периодонтита, а также при восстановлении кишечника после резекции.
14. Фармацевтическая композиция по п.12 для применения в качестве противодиабетного лекарственного препарата.
Текст
1 Данное изобретение относится к новым аминокислотным сульфонильным соединениям,к способу их получения, к фармацевтическим композициям их содержащим и к их применению в качестве ингибиторов дипептидилпептидазы IV (DPP IV). Ингибиторы DPP FV были описаны в литературе, в частности амидные соединения в патентной заявке ЕР 0 490 379 и в журнале Adv.Exp. Med. Biol. 1997, 421, 157-160, и карбаматные соединения в патентной заявке DE 19826972. Дипептидилпептидаза IV является мембранной серин протеазой, присутствующей в различных человеческих тканях и вовлечена в различные патологии:DPP IV оказался ответственным за дезактивацию GLP-1 (глюкагон-подобный пептид-1).GLP-1, будучи важным стимулятором секреции инсулина в поджелудочной железе, имеет прямой положительный эффект на уровень глюкозы в крови. Ингибирование DPP IV соответственно представляет собой очень обещающий подход при лечении непереносимости глюкозы и расстройств, связанных с гипергликемией, таких,как, например инсулин-независимый диабетDPP IV также играет роль в иммунном ответе. Экспрессируемый E-CD4+ лимфоцитами,там, где он синонимичен антигену CD26, он играет важную роль в механизме отторжения трансплантатов (Transplantation 1997, 63 (10),1495-500). Давая возможность более селективного подавления иммунного ответа, ингибированиеDPP IV соответственно представляет собой чрезвычайно обещающий подход в предотвращении отторжения трансплантатов у трансплантированных пациентов. Было также показано, что эндотелиальныйDPP IV легких, связывая фибронектин раковых клеток, содействует метастазу этих клеток(J. Biol. Chem. 1998, 273 (37), 24207-24215). Ингибиторы DPP IV соответственно полезны при лечении рака и предотвращении раковых метастаз.DPP IV также играет важную роль в инфицировании T-CD4+ лимфоцитов вирусом HIV-1(Res. Virol. 1997, 148 (4), 255-266). Предотвращая проникновение вируса в клетки, ингибиторы DPP IV соответственно являются особенно обещающими при предотвращении трансмиссии вируса HIV-1 DPP IV также оказался ответственным за инактивацию хемокинов, таких как факторы SDF-1 и SDF-1, которые известны по своей хемотактической антивирусной активностью (Proc. Natl. Acad. Sci. USA 1998, 95 (11),6331-6336).DPP IV таким образом упоминается, как играющий важную роль в патогенезе поджелу 004591 2 дочной железы (Infect. Immun. 2000, 68 (2), 716724). Наконец, DPP IV оказался ответственным за дезактивацию GLP-2, фактора, содействующего восстановлению кишечника после большой резекции (J. Surg. Res. 1999,87(1), 130-133). Ингибиторы DPP IV соответственно потенциально полезны при восстановлении кишечника. Более конкретно, данное изобретение относится к соединениям формулы (I) в которой представляет собой 5-членный, азотсодержащий гетероцикл, необязательно замещенный цианогруппой,R1 представляет собой атом водорода или линейный или разветвленный (C1-С 6)алкил, линейную или разветвленную (С 1-С 6)ацильную,пролильную, аланильную, гистидилпролильную или фенилаланилпролильную группу,Ak представляет собой линейную или разветвленную (С 1-С 6)алкиленовую цепь или гетероалкиленовую цепь,Х представляет собой одинарную связь или фениленовую группу необязательно замещенную одной или более одинаковых или различных групп, выбираемых из атомов галогенов и линейной или разветвленной (С 1-С 6)алкильной, гидрокси, линейной или разветвленной(С 1-С 6)полигалоалкильной групп,R2 представляет собой линейную или разветвленную (С 1-С 6)алкильную группу (необязательно замещенную одной или более одинаковых или различных групп, выбираемых из арильной, линейной или разветвленной (С 1-С 6) алкилсульфонильной, (С 3-С 7)циклоалкилсульфонильной, (С 3-С 7)циклоалкильной групп и атомов галогена),(С 3-С 10)циклоалкильную группу, или -NR2aR2b, в которой R2a и R2b, которые могут быть одинаковыми или различными,каждая представляет собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу или, совместно с атомом азота, несущим их, образуют азотсодержащий гетероцикл,Y представляет собой группу -NR3-,R3 представляет собой атом водорода или группу, выбираемую из линейной или разветвленной (С 1-С 6)алкильной группы, (С 3-С 7)циклоалкила и арила,R4, R5 и R6, которые могут быть одинаковыми или различными, каждая представляет собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу, или R4 иR5, или R5 и R6, совместно с атомами, их несущими, образуют имидазолидиновое или дигидробензимидазольное кольцо,к их оптическим изомерам и к их аддитивным солям с фармацевтически приемлемой кислотой. Среди фармацевтически приемлемых солей можно упомянуть, без внесения ограничений, соляную кислоту, бромоводородную кислоту, серную кислоту, фосфорную кислоту,уксусную кислоту, трифтороуксусную кислоту,молочную кислоту, пирувовую кислоту, малоновую кислоту, сукциновую кислоту, глутаровую кислоту, фумаровую кислоту, виннокаменную кислоту, малеиновую кислоту, лимонную кислоту, аскорбиновую кислоту, метансульфоновую кислоту, камфорную кислоту, оксалиловую кислоту, др. Азотосодержащий гетероцикл понимают как обозначающий насыщенную, моноциклическую, 5-7-членную группу, содержащую один,два или три гетероатомов, один из этих гетероатомов представляет собой атом азота и дополнительный гетероатом(ы), которые необязательно присутствуют, выбирают из атомов кислорода, азота и серы. Предпочтительными азотсодержащими гетероциклами являются пирролидинильная, тиазолидинильная, изоксазолидинильная, морфолинильная и пиразолидинильная группы. Гетероалкиленовую цепь понимают как обозначающую линейную или разветвленную(С 1-С 6)алкиленовую цепь, в которой -СН 2- член замещен атомом кислорода или серы. Предпочтительными соединениями форпредставмулы (I) являются те, в которых ляет собой 1-пирролидинильную группу, необязательно замещенную циано группой, или 1,3 тиазолидин-3-ильную группу, необязательно замещенную цианогруппой. Предпочтительными соединениями формулы (I) являются те, в которых Х представляет собой одинарную связь. Предпочтительными соединениями формулы (I) являются те, в которой конфигурацияамидамидной функции представлядля ет собой (S). Преимущественный аспект изобретения относится к соединениям формулы (I), в которой R2 представляет собой линейную или разветвленную (С 1-С 6)алкильную группу и Y представляет собой группу Другой преимущественный аспект изобретения относится к соединениям формулы (I), в которой R2 представляет собой (С 3-С 10)циклоалкильную группу и Y представляет собой группу -NH-. 4 Среди предпочтительных соединений по изобретению можно упомянуть более конкретно:(S)-1-[N5-(имино)(метилсульфониламино) метилорнитил]пирролидин, его оптические изомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой;(S)-N-[4-амино-5-оксо-5-(1-пирролидинил) пентил]циклогексансульфонамид, его оптические изомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой;(2S)-2-циано-1-[N5-(имино)(метилсульфониламино)метил-(S)-орнитил]пирролидин, его оптические изомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой; и (2S)-2-циано-1-[N6-(имино)(метилсульфониламино)метил-(S)-лизил]пирролидин, его оптические изомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой. Изобретение относится к способу получения соединений формулы (I), который отличается тем, что соединение формулы (II) в которой Ak, Х и Y имеют значения, указанные для формулы (I), R'1 представляет собой защитную группу для аминофункции, или линейную или разветвленную (С 1-С 6)алкильную группу,линейную или разветвленную (С 1-С 6)ацильную группу, пролильную группу, необязательно защищенную аминофункционально-защитной группой, аланильную группу, необязательно защищенную аминофункционально-защитной группой, гистидилпролильную группу, необязательно защищенную аминофункциональнозащитной группой, или фенилаланилпролильную группу, необязательно защищенную аминофункционально-защитной группой, и Р 2 представляет собой атом водорода или защитную группу для аминофункции,подвергают реакции с соединением формулы (III) в которой имеет значение, указанное для формулы (I),при обычных условиях пептидного связывания,с получением, после депротекции, где это необходимо, группы Y, соединения формулыAk, X, Y и R'1 имеют значения, указанные здесь ранее, 5 которое подвергают реакции с соединением формулы (V):R2-SO2-Z1 в которой R2 имеет значение, указанное для формулы (I) и Z1 представляет собой уходящую группу, такую как, например, атом галогена,с получением, после депротекции, где это необходимо, соединения формулы (I),которое очищают, где это необходимо, по традиционной методике очистки, которое разделяют при желании на оптические изомеры по традиционной методике разделения, и которое переводят при желании в его аддитивные соли с фармацевтически приемлемой кислотой. Соединение формулы (Iа), частный случай соединения формулы (I), R1, Ak, X, R2, R4 и R6 имеют значения, указанные для формулы (I),также можно получать реакцией соединения формулы (IIа), частного случая соединения формулы (II) в которой Ak, X, R4 и R6 имеют значения, указанные для формулы (I) и R'1 представляет собой защитную группу для аминофункции, или линейную или разветвленную (С 1-С 6)алкильную группу, линейную или разветвленную (С 1 С 6)ацильную группу, а пролильную группу, необязательно защищенную аминофункционально-защитной группой, аланильную группу, необязательно защищенную аминофункционально-защитной группой, гистидилпролильную группу, необязательно защищенную аминофункционально-защитной группой, или фенилаланилпролильную группу, необязательно защищенную аминофункционально-защитной группой,с соединением формулы (V)R2-SO2-Z1 в которой R2 имеет значение, указанное для формулы (I), и Z1 представляет собой уходящую группу, такую как, например, атом галогена,с получением соединения формулы (VII) в которой R'1, Ak, X, R2, R4 и R6 имеют значения, указанные здесь ранее, которое подвергают реакции с соединением формулы (III) в которой имеет значение, указанное для формулы (I),при обычных условиях пептидного связывания, с получением, после депротекции, где это необходимо, соединения формулы (Iа),которое очищают, где это необходимо, по традиционной методике очистки, которое разделяют при желании на оптические изомеры по традиционной методике разделения, и которое переводят при желании в его аддитивные соли с фармацевтически приемлемой кислотой. Соединение формулы (Ib), частный случай соединения формулы (I)R1, Ak, X и R2 имеют значения,указанные для формулы (I),также можно получать реакцией соединения формулы (VIII) в которой Ak и Х имеют значения, указанные для формулы (I), и R'1 представляет собой защитную группу для аминофункции, или линейную или разветвленную (С 1-С 6)алкильную группу, линейную или разветвленную (С 1 С 6)ацильную группу, пролильную группу, необязательно защищенную аминофункционально-защитной группой, аланильную группу, необязательно защищенную аминофункционально-защитной группой, гистидилпролильную группу, необязательно защищенную аминофункционально-защитной группой, или фенилаланилпролильную группу, необязательно защищенную аминофункционально-защитной группой,с соединением формулы (III) имеет значение, указанное в которой для формулы (I),при обычных условиях пептидного связывания,с получением соединения формулы (IX)R1, Ak, Х и R2 имеют значения,указанные для формулы (I),также можно получать реакцией соединения формулы (IVb), частного случая соединения формулы (IV)Ak и Х имеют значения, указанные здесь ранее, и R'1 представляет собой защитную группу для аминофункции, или линейную или разветвленную (С 1-С 6)алкильную группу, линейную или разветвленную (С 1 С 6)ацильную группу, пролильную группу, необязательно защищенную аминофункционально-защитной группой, аланильную группу,необязательно защищенную аминофункционально-защитной группой, гистидилпролильную группу, необязательно защищенную аминофункционально-защитной группой, или фенилаланилпролильную группу, необязательно защищенную аминофункционально-защитной группой,с соединением формулы (XI)Z2-CH=N-SO2R2 в которой R2 имеет значение, указанное для формулы (I), и Z2 представляет собой уходящую группу, такую как, например, линейную или разветвленную (С 1-С 6)алкоксигруппу,с получением, после депротекции, где это необходимо, соединения формулы (Iс),которое очищают, где это необходимо, по традиционной методике очистки, которое разделяют при желании на оптические изомеры по традиционной методике разделения, и которое переводят при желании в его аддитивные соли с фармацевтически приемлемой кислотой. Соединение формулы (Id), частный случай соединения формулы (I)R'1, Ak и Х имеют значения, указанные здесь ранее,которое затем восстанавливают до соединения формулы (IVa), частного случая соединения формулы (IV)(V) в которой R2 имеет значение, указанное для формулы (I), и Z1 представляет собой уходящую группу, такую как, например, атом галогена,с получением, после депротекции, где это необходимо, соединения формулы (Ib),которое очищают, где это необходимо, по традиционной методике очистки, которое разделяют при желании на оптические изомеры по традиционной методике разделения, и которое переводят при желании в его аддитивные соли с фармацевтически приемлемой кислотой. Соединение формулы (Iс), частный случай соединения формулы (I)R1, Ak, X и R2 имеют значения,указанные для формулы (I) и R'3 представляет собой группу, выбираемую из линейного или разветвленного (С 1-С 6)алкила, (С 3-С 7)циклоалкила и арила,также можно получать реакцией соединения формулы (IVb), частного случая соединения формулы (IV)Ak и Х имеют значения,указанные здесь ранее и R'1 представляет собой защитную группу для аминофункции, или линейную или разветвленную (С 1-С 6)алкильную группу, линейную или разветвленную (С 1 С 6)ацильную группу, пролильную группу, необязательно защищенную аминофункционально-защитной группой, аланильную группу,необязательно защищенную аминофункционально-защитной группой, гистидилпролильную группу, необязательно защищенную аминофункционально-защитной группой, или фенилаланилпролильную группу, необязательно защищенную аминофункционально-защитной группой,с 2-нитробензолсульфонилхлоридом с получением соединения формулы (XII)R'3-OH в которой R'3 имеет значение, указанное здесь ранее,в присутствии диэтил азодикарбоксилат и трифенилфосфин, с получением соединения формулы (XIV) 10 с получением, после депротекции, где это необходимо, соединения формулы (Id),которое очищают, где это необходимо, по традиционной методике очистки, которое разделяют при желании на оптические изомеры по традиционной методике разделения, и которое переводят при желании в его аддитивные соли с фармацевтически приемлемой кислотой. Соединение формулы (Ie), частный случай соединения формулы (I)R1, Ak, Х и R2 имеют значения, указанные для формулы (I),также можно получить реакцией соединения формулы (XVI) в которой Z1 представляет собой уходящую группу, такую как, например, линейную или разветвленную (С 1-С 6)алкилтиогруппу,с соединением формулы (V)R2-SO2-Z1 в которой R2 имеет значение, указанное для формулы (I), и Z1 представляет собой уходящую группу, такую как, например, атом водорода,с получением соединения формулы (XVII) в которой R2 и Z3 имеют значения, указанные здесь ранее, которое подвергают реакции с соединением формулы (IVb), частным случаем соединения формулы (IV) в которойR'1, Ak, X и R'3 имеют значения,указанные здесь ранее,которое подвергают реакции с бензолтиолом, в присутствии карбоната цезия, с получением соединения формулы (XV)R2-SO2-Z1 в которой R2 имеет значение, указанное для формулы (I), и Z1 представляет собой уходящую группу, такую как, например, атом галогена, в которойAk и Х имеют значения, указанные здесь ранее и R'1 представляет собой защитную группу для аминофункции, или линейную или разветвленную (С 1-С 6)алкильную группу, линейную или разветвленную (С 1-С 6)ацильную группу, пролильную группу, необязательно защищенную аминофункционально-защитной группой, аланильную группу, необязательно защищенную аминофункционально-защитной группой, гистидилпролильную группу, необязательно защищенную аминофункционально-защитной группой, или фенилаланилпролильную группу, необязательно защищенную аминофункционально-защитной группой, 11 с получением, после депротекции, где это необходимо, соединения формулы (Iе), которое очищают, где это необходимо, по традиционной методике очистки, которое разделяют при желании на оптические изомеры по традиционной методике разделения, и которое переводят при желании в его аддитивные соли с фармацевтически приемлемой кислотой. Кроме того факта, что они новы, соединения по настоящему изобретению имеют ценные фармакологические свойства. Они имеют дипептидилпептидазо IV-ингибирующие свойства,которые делают их полезными при лечении непереносимости глюкозы и расстройств, связанных с гипергликемией, таких как диабет типа II или ожирение, при предотвращении отторжения после трансплантации, при лечении рака и предотвращении раковых метастаз, при лечении СПИДа и периодонтита, а также при восстановлении кишечника после резекции. Изобретение также относится к фармацевтическим композициям, включающим в качестве активного ингредиента по меньшей мере одно соединение формулы (I) совместно с одним или более инертным, нетоксичным, подходящим эксципиентом. Среди фармацевтических композиций по изобретению можно упомянуть более конкретно те, которые пригодны для орального, парентерального (внутривенного,внутримышечного или подкожного) или назального применения, таблетки или драже,подъязычные таблетки, желатиновые капсулы,пастилки, суппозитории, кремы, мази, кожные гели, инъекционные препараты, питьевые суспензии, пр. Полезная дозировка может варьироваться в зависимости от природы и сложности расстройства, графика приема, а также возраста и веса пациента и каких-либо связанных лечений. Дозировка варьируется от 0,5 мг до 2 г на 24 ч за один или более приемов. Нижеследующие примеры иллюстрируют изобретение, но не ограничивают его никоим образом. Применяемые исходные материалы представляют собой известные соединения или получаются по известным методам получения. Структуры соединений, описанных в примерах, определяли согласно обычным спектрометрическим методикам (инфракрасный, ЯМР,масс-спектрометрия). Пример 1. (S)-1-[N5-(Иминo)(мeтилcyльфoнилaминo)мeтилopнитил]пирролидиндигидрохлорид. К 10 ммоль (S)-N2-(бензилоксикарбонил) аргинина, суспендированного в смеси ацетона/воды 80/20, добавляют при 0 С достаточное количество 4 Н раствора гидроксида натрия, устанавливая значение рН реакционной смеси на 11-11,5. После перемешивания на протяжении 2 ч затем добавляют раствор метансульфонилхлорида в ацетоне, а затем после перемешивания на протяжении последующих 3 ч смесь нейтрализуют, используя 1 Н раствор соляной кислоты; ацетон затем выпаривают и полученный остаток экстрагируют эфиром, а затем промывают, сушат, фильтруют и выпаривают. Полученное таким образом бледно-желтое масло очищают хроматографией на силикагеле (элюант: дихлорометан/метанол 7/3) с получением ожидаемого продукта в виде беловатого тягучего вещества. Стадия В. (S)-1-[N2-(Бeнзилoкcикapбoнил)N-(имино)(метилсульфониламино)метилорнитил]пирролидин. К 10 ммоль соединения, полученного на предыдущей стадии, растворенного в диметилформамиде, добавляют при 0 С 10 ммоль Nметилморфолина, а затем, через 10 мин, 10 ммоль изобутилхлороформата, и наконец, через 10 мин, 10 ммоль пирролидона, растворенного в диметилформамиде. После перемешивания на протяжении ночи при температуре окружающей среды, диметилформамид выпаривают и добавляют раствор гидрогенкарбоната натрия к полученному остатку, который затем экстрагируют дихлорометаном. Объединенные органические фазы затем промывают, сначала 10% раствором лимонной кислоты, а затем водой; затем их сушат, фильтруют и выпаривают. Желтое масло,полученное таким образом, очищают хроматографированием на силикагеле (элюант: дихлорометан/метанол 95/5) с получением ожидаемого продукта в виде беловатого тягучего вещества. Стадия С. (S)-1-[N5-(Иминo)(метилcyльфoнилaминo)мeтилopнитил]пирролидин. 10 ммоль соединения, полученного на предыдущей стадии, растворенного в этаноле, гидрогенируют в присутствии 10% палладия-науглероде, при комнатной температуре и давлении на протяжении 6 ч. Реакционную смесь затем фильтруют и выпаривают и затем, после добавления воды, ее лиофилизируют с получением ожидаемого продукта. Элементарный микроанализ: С% Н% Стадия D. (S)-1-[N5-(Иминo)(мeтилcyльфoнилaминo)мeтилopнитил]пирролидиндигидрохлорид. К 10 ммоль соединения, полученного на предыдущей cтадии, растворенного в диоксане,добавляют 4 Н раствор соляной кислоты в диоксане. После перемешивания на протяжении 24 ч 13 при комнатной температуре, растворитель выпаривают, добавляют воду и раствор лиофилизируют с получением ожидаемого продукта. Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 34,92 6,67 18,52 8,47 18,74 Обнаруженный 34,42 6,60 17,78 8,46 19,52 Пример 2. (R)-1-[N5-(Имино)(метилсульфониламино)метилорнитил]пирролидиндигидрохлорид. Ожидаемый продукт получают по способу,описанному в примере 1, заменяя (S)-N2(бензилоксикарбонил)аргинин (R)-N2-(бензилоксикарбонил)аргинином. Элементарный микроанализ : С% Н% N% S% Cl% Расчетный 34,92 6,66 18,51 8,48 18,74 Обнаруженный 34,46 6,52 17,70 8,61 19,43 Пример 3. (S)-N-[4-Амино-5-оксо-5-(1-пирролидинил)пентил]метансульфонамидгидрохлорид. Стадия А. (S)-N1-(Бeнзилoкcикapбoнил)4N -(тepт-бyтилoкcикapбoнил)opнитинa, растворенного в диметилформамиде, добавляют 10 ммоль пирролидина, 10 ммоль 1-гидроксибензотриазола и 10 ммоль дициклогексилкарбодиимида. После перемешивания на протяжении ночи при комнатной температуре, образованную дициклогексилмочевину отфильтровывают и затем диметилформамид выпаривают. Масло каштанового цвета, полученное таким образом,очищают хроматографированием на силикагеле(элюант: дихлорометан/этанол 95/5) с получением ожидаемого продукта в виде желтого масла. Стадия В. (S)-N4-(трет-Бутилоксикарбонил)5-оксо-5-(1-пирролидинил)-1,4-пентандиамин. Исходя из соединения, полученного на предыдущей cтадии, ожидаемый продукт получают по способу, описанному в cтадии С примера 1. Стадия С. (S)-N-[4-(трет-Бутилоксикарбониламино)-5-оксо-5-(1-пирролидинил)пентил]метансульфонамид. К 10 ммоль соединения, полученного на предыдущей cтадии, растворенного в пиридин,добавляют 10 ммоль метансульфонилхлорида,растворенного в дихлорометан. После перемешивания на протяжении ночи при комнатной температуре растворители выпаривают. Этил ацетат затем добавляют к полученному остатку,и раствор затем промывают, сушат, фильтруют и выпаривают. Полученное масло затем очищают хроматографией на силикагеле (элюант: дихлорометан/метанол 95/5) с получением ожидаемого продукта в виде масла. 14 Стадия D. (S)-N-[4-Амино-5-оксо-5-(1 пирролидинил)пентил]метансульфонамидгидрохлорид. Исходя из соединения, полученного на предыдущей cтадии, ожидаемый продукт получают по способу, описанному в cтадии D примера 1. Элементарный микроанализ : С% Н% N% S% Cl% Расчетный 40,06 7,40 14,02 10,69 11,82 Обнаруженный 39,99 7,75 13,95 9,81 13,15 Пример 4. (S)-1-[N6-(Имино)(метилсульфониламино)метиллизил]пирролидингидрохлорид. Стадия А. (S)-N5-(тepт-Бyтилoкcикapбoнил)-6-oкco-6-(1-пиppoлидинил)-1,5-гександиамин. Исходя из (S)-N6-(бензилоксикарбонил)2N -(трет-бутилоксикарбонил)лизина и пирролидина, ожидаемый продукт получают по способу,описанному в cтадиях А и В примера 3. Стадия В. (S)-1-N2-(тepт-Бyтилoкcикapбoнил)-N6-[(aминo)-(тepт-бутилоксикарбонилимино)метил]лизилпирролидин. Ожидаемый продукт получают по способу,описанному в Synthesis 1993, 579-582, связыванием соединения, полученного на предыдущей стадии, с 1-[(трет-бутилоксикарбониламино)(трет-бутилоксикарбонилимино)метил]-1H-пиразолом, после чего следует депротекция с применением уксусной кислоты. Стадия С. (S)-1-[N6-(Имино)(метилсульфониламино)метиллизил]пирролидингидрохлорид. Исходя из соединения, полученного на предыдущей стадии, ожидаемый продукт получают по способу, описанному в стадиях С и D примера 3. Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 40,50 7,36 19,68 9,01 9,96 Обнаруженный 40,75 7,50 19,05 8,63 10,1 Пример 5. (S)-N-[5-Амино-6-оксо-6-(1 пирролидинил)гексил]метансульфонамид. Исходя из (S)-N6-(бензилоксикарбонил)2N -(трет-бутилоксикарбонил)лизина, метансульфонилхлорида и пирролидина, ожидаемый продукт получают по методу, описанному на cтадиях А-С примера 3. Элементарный микроанализ: С% Н%S% Расчетный 47,63 8,36 15,15 11,56 Обнаруженный 47,54 8,32 14,21 11,19 Пример 6. (S)-N-5-[(S)-Фенилаланил-(S)пролиламино]-6-оксо-6-(1-пирролидинил)гексил метансульфонамидгидрохлорид. Исходя из [(S)-N2-(тepт-бyтилoкcикapбoнил)фeнилaлaнил]-[(S)-пpoлил]-(S)-N5-(бензилоксикарбонил)лизина, метансульфонилхлорида и пирролидина, ожидаемый продукт получают согласно методу, описанному в примере 3. Пример 7. (S)-N-5-[(S)-Гистидил-(S)-пролиламино]-6-оксо-6-(1-пирролидинил)гексил метансульфонамиддигидрохлорид. Исходя из [(S)-N2-(трет-бутилоксикарбонил)гистидил]-[(S)-пролил]-(S)-N5-(бензилоксикарбонил)лизина, метансульфонилхлорида и пирролидина, ожидаемый продукт получают по способу, описанному в примере 3. Пример 8. (S)-1-[4-[(Имино)(метилсульфониламино)метил]аминофенилаланил]пирролидингидрохлорид. Ожидаемый продукт получают по способу,описанному в примере 4, заменяя (S)-N6-(бензилоксикарбонил)-N2-(трет-бутилоксикарбонил) лизин на (S)-4-[(трет-бyтилoкcикapбoнил)aминo]-N2-(бeнзилoкcикapбoнил)фeнилaлaнин. Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 46,20 6,20 17,97 8,20 9,09 Обнаруженный 46,48 6,30 17,73 7,53 10,15 Пример 9. (S)-N-[2-Амино-3-оксо-3-(1-пирролидинил)пропил]метансульфонамидгидрохлорид. Исходя из (S)-3-[(бензилоксикарбонил) амино]-2-[(трет-бутилоксикарбонил)амино]пропанойной кислоты, метансульфонилхлорида и пирролидина, ожидаемый продукт получают согласно методу, описанному в примере 3. Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 35,35 6,69 15,47 11,80 13,04 Обнаруженный 34,66 6,56 14,60 11,84 14,45 Пример 10. (S)-N-4-[2-Амино-3-оксо-3-(1 пирролидинил)пропил]фенилметансульфонамидгидрохлорид. Исходя из (S)-4-(метилсульфониламино)N2-(бензилоксикарбонил)фенилаланина, метансульфонилхлорида и пирролидина, ожидаемый продукт получают согласно методу, описанному в примере 1. Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 48,34 6,37 12,08 9,22 10,19 Обнаруженный 48,36 6,42 11,66 9,08 10,06 Пример 11. (S)-N-[4-(2-Амино-3-оксо-3(1-пирролидинил)пропил)фенил](имино)метил метансульфонамидгидрохлорид. Стадия А. (S)-4-[2-(трет-Бутилоксикарбониламино)-3-оксо-3-(1-пирролидинил)пропил] бензнитрил. Исходя из (S)-N2-(тepт-бyтилoкcикapбoнил)-4-циaнoфeнилaлaнинa, метансульфонилхлорида и пирролидина, ожидаемый продукт получают по способу, описанному в cтадии А примера 3. 16 Стадия В. (S)-4-[2-[(трет-Бутилоксикарбонил)амино]-3-оксо-3-(1-пирролидинил)пропил]N-гидроксибензолкарбоксимидамид. К 10 ммоль соединения, полученного на предыдущей cтадии, растворенного в смеси этанола и воды, добавляют 36 ммоль гидроксиламина, а затем 22 ммоль карбоната натрия. Реакционную смесь затем нагревают с обратным холодильником на протяжении 7 ч, а затем, после возвращения к комнатной температуре, растворители выпаривают; добавляют дихлорометан и воду,водную фазу затем экстрагируют дихлорометаном, сушат, фильтруют и выпаривают с получением ожидаемого продукта в виде порошка. Точка плавления: 177 С. Стадия С. (S)-4-[2-[(трет-Бутилоксикарбонил)амино]-3-оксо-3-(1-пирролидинил)пропил] бензолкарбоксимидамидацетат. К 10 ммоль соединения, полученного на предыдущей стадии, растворенного в уксусной кислоте, добавляют 15 ммоль уксусного ангидрида, а затем 375 мг 10% Pd/C. Смесь затем гидрогенируют на протяжении ночи при комнатных температуре и давлении. После отфильтровывания катализатора добавляют толуол, а затем уксусную кислоту удаляют азеотропическим дистиллированнием. Полученный остаток затем растирают в порошок с получением ожидаемого продукта в виде белого порошка. Точка плавления: 182 С. Стадия D. (S)-N-[4-(2[(трет-Бутилоксикарбонил)амино]-3-оксо-3-(1-пирролидинил)пропил)фенил](имино)метилметансульфонамид. После осаждения ацетата, соединение, полученное в предыдущей стадии, растворяют в метилизобутилкетоне, а затем добавляют 30 ммоль карбоната калия и 10 ммоль метансульфонилхлорида. Реакционную смесь затем нагревают с обратным холодильником на протяжении 2 ч, а затем, после возвращения к комнатной температуре,растворитель выпаривают; добавляют дихлорометан и воду, водную фазу экстрагируют дихлорометаном и органическую фазу промывают, сушат,фильтруют и затем выпаривают. Полученный остаток очищают хроматографией на силикагеле(элюант: дихлорометан/метанол 97/3) с получением ожидаемого продукта. Стадия Е. (S)-N-[4-(2-Aмино-3-oксo-3-(1 пирролидинил)пропил)фенил](имино)метилметансульфонамидгидрохлорид. На протяжении 10 мин газообразный хлорид водорода пропускают через раствор соединения,полученного на предыдущей стадии, в этил ацетате и затем растворитель выпаривают. Полученный остаток промывают этилацетатом и затем сушат с получением ожидаемого продукта. Пример 12. (S)-1-[2-Амино-4-[(имино)(метилсульфониламино)метил]аминобутаноил] пирролидингидрохлорид. Ожидаемый продукт получают по способу,описанному в примере 4, заменяя (S)-N6-(бензилоксикарбонил)-N2-(трет-бутилоксикарбонил) 17 лизин на (S)-4-[(трет-бутилоксикарбонил)амино]-2-[(бензилоксикарбонил)амино]бутановую кислоту. Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 36,64 6,76 21,36 9,78 10,81 Обнаруженный 37,45 6,89 20,77 9,41 10,84 Пример 13. (S)-N-[3-Амино-4-оксо-4-(1 пирролидинил)бутил]метансульфонамидгидрохлорид. Исходя из (S)-4-[(бензилоксикарбонил) амино]-2-[(трет-бутилоксикарбонил)амино]бутановой кислоты, метансульфонилхлорида и пирролидина, ожидаемый продукт получают согласно методу, описанному в примере 3. Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 37,82 7,05 14,70 11,22 12,41 Обнаруженный 37,68 7,22 14,37 11,29 14,08 Пример 14. (S)-3-[N5-(Иминo)(мeтилcyльфoнилaминo)мeтилopнитил]-1,3-тиазолидингидрохлорид. Исходя из (S)-N2-(бензилоксикарбонил)аргинина, метансульфонилхлорида и 1,3-тиазолидина, ожидаемый продукт получают по способу, описанному в примере 1. Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 33,37 6,16 19,46 17,82 9,85 Обнаруженный 33,87 6,30 18,74 18,03 10,34 Пример 15. (S)-N-[4-Амино-5-оксо-5-(1,3 тиазолидин-3-ил)пентил]метансульфонамидгидрохлорид. Ожидаемый продукт получают по способу,описанному в примере 3, заменяя пирролидин на 1,3-тиазолидин. Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 34,01 6,34 13,22 20,18 11,15 Обнаруженный 34,22 6,71 12,52 20,03 11,34 Пример 16. (S)-3-[N6-(Имино)(метилсульфониламино)метиллизил]-1,3-тиазолидиндигидрохлорид. Ожидаемый продукт получают по способу,описанному в примере 4, заменяя пирролидин на 1,3-тиазолидин. Масс-спектрометрия: [M+H]+=338; [M-H]=336; [M+Cl]-=372 Пример 17. (S)-N-[5-Амино-6-оксо-6-(1,3 тиазолидин-3-ил)гексил]метансульфонамидгидрохлорид. Исходя из (S)-N6-(бeнзилoксикарбонил)2 метанN -(тepт-бyтилоксикарбонил)лизина,сульфонилхлорида и 1,3-тиазолидина, ожидаемый продукт получают согласно методу, описанному в примере 3. 18 Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 36,19 6,68 12,66 19,32 10,68 Обнаруженный 36,22 6,67 12,23 19,37 10,95 Пример 18. (S)-3-[2-Амино-3-[(имино)(метилсульфониламино)метил]аминопропаноил]1,3-тиазолидингидрохлорид. Ожидаемый продукт получают по способу,описанному в примере 4, заменяя (S)-N6-(бензилоксикарбонил)-N2-(трет-бутилоксикарбонил) лизин на (S)-3-[(трет-бутилоксикарбонил)амино]-2-[(бензилоксикарбонил)амино]пропановую кислоту и пирролидин на 1,3-тиазолидин. Пример 19. (S)-N-4-[2-Амино-3-оксо-3(1,3-тиазолидин-3-ил)]фенилметансульфонамидгидрохлорид. Исходя из (S)-3-[(бензилоксикарбонил) амино]-2-[(трет-бутилоксикарбонил)амино]пропановой кислоты, метансульфонилхлорида и 1,3-тиазолидина, ожидаемый продукт получают по способу, описанному в примере 3. Пример 20. (S)-3-[2-Амино-4-[(имино) (метилсульфониламино)метил]аминобутаноил]-1,3 тиазолидингидрохлорид. Ожидаемый продукт получают по способу,описанному в примере 4, заменяя (S)-N6(бензилоксикарбонил)-N2-(трет-бутилоксикарбонил)лизин на (S)-4-[(трет-бутилоксикарбонил)амино]-2-[(бензилоксикарбонил)амино]бутановую кислоту и пирролидин на 1,3-тиазолидин. Пример 21. (S)-N-[3-Амино-4-оксо-4-(1,3 тиазолидин-3-ил)бутил]метансульфонамидгидрохлорид. Исходя из (S)-4-[(бензилоксикарбонил) амино]-2-[(трет-бутилоксикарбонил)амино] бутановой кислоты, метансульфонилхлорида и 1,3-тиазолидина, ожидаемый продукт получают по способу, описанному в примере 3. Пример 22. (S)-1-[N5-(Иминo)(этилcyльфoнилaминo)мeтилopнитил]пирролидингидрохлорид. Исходя из (S)-N2-(бензилоксикарбонил)аргинина, этансульфонилхлорида и пирролидина,ожидаемый продукт получают по способу, описанному в примере 1. Пример 23. (S)-N-[4-Амино-5-оксо-5-(1 пирролидинил)пентил]этансульфонамидгидрохлорид. Исходя из (S)-N5-(бeнзилoкcикapбoнил)2N -(тepт-бyтилoкcикapбoнил)opнитинa,этансульфонилхлорида и пирролидина, ожидаемый продукт получают по способу, описанному в примере 3. Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 42,10 7,71 13,39 10,22 11,30 Обнаруженный 42,31 7,78 12,47 9,80 11,18 Пример 24. (S)-1-[N5-(Иминo)(пpoпилcyльфoнилaминo)мeтилopнитил]пирролидингидрохлорид. Исходя из (S)-N2-(бензилоксикарбонил) аргинина, пропансульфонилхлорида и пирролидина, ожидаемый продукт получают по способу,описанному в примере 1. Пример 25. (S)-N-[4-Амино-5-оксо-5-(1 пирролидинил)пентил]-1-пропансульфонамидгидрохлорид. Исходя из (S)-N5-(бeнзилoкcикapбoнил)2N -(тepт-бyтилoкcикapбoнил)opнитинa, 1-пропансульфонилхлорида и пирролидина, ожидаемый продукт получают согласно методу, описанному в примере 3. Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 43,96 7,99 12,82 9,78 10,81 Обнаруженный 43,91 7,97 12,44 9,66 11,64 Пример 30. (S)-1-[N5-(Имино)(циклобутилсульфониламино)метилорнитил]пирролидингидрохлорид. Исходя из (S)-N2-(бензилоксикарбонил)аргининa, циклобутансульфонилхлорида и пирролидина, ожидаемый продукт получают по способу, описанному в примере 1. Пример 31. (S)-N-[4-Амино-5-оксо-5-(1 пирролидинил)пентил]циклобутансульфонамидгидрохлорид. Исходя из (S)-N5-(бензилоксикарбонил)2N -(трет-бутилоксикарбонил)орнитина, циклобутансульфонилхлорида и пирролидина, ожидаемый продукт получают по способу, описанному в примере 3. Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 45,94 7,71 12,36 9,43 10,43 Обнаруженный 47,08 7,82 11,95 9,29 10,73 Пример 26. (S)-1-[N5-(Иминo)(бyтилcyльфoнилaминo)мeтилopнитил]пирролидингидрохлорид. Исходя из (S)-N2-(бензилоксикарбонил)аргинина, бутансульфонилхлорида и пирролидина, ожидаемый продукт получают по способу,описанному в примере 1. Пример 27. (S)-N-[4-Амино-5-оксо-5-(1 пирролидинил)пентил]бутансульфонамидгидрохлорид. Исходя из (S)-N5-(бензилоксикарбонил)2N -(трет-бутилоксикарбонил)орнитина, бутансульфонилхлорида и пирролидина, ожидаемый продукт получают согласно методу, описанному в примере 3. Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 45,67 8,25 12,29 9,38 10,37 Обнаруженный 45,75 8,17 12,00 9,04 10,68 Пример 32. (S)-1-[N5-(Имино)(циклопентилсульфониламино)метилорнитил]пирролидингидрохлорид. Исходя из (S)-N2-(бeнзилoкcикapбoнил)apгининa, циклопентансульфонилхлорида и пирролидина, ожидаемый продукт получают по способу, описанному в примере 1. Пример 33. (S)-N-[4-Амино-5-оксо-5-(1 пирролидинил)пентил]циклопентансульфонамидгидрохлорид. Исходя из (S)-N5-(бензилоксикарбонил)2N -(трет-бутилоксикарбонил)орнитина, циклопентансульфонилхлорида и пирролидина, ожидаемый продукт получают по способу, описанному в примере 3. Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 47,51 7,97 11,87 9,06 10,02 Обнаруженный 47,08 7,98 11,41 8,95 9,96 Пример 28. (S)-1-[N5-(Иминo)(циклoпpoпилcyльфoнилaминo)мeтилорнитил]пирролидингидрохлорид. Исходя из (S)-N2-(бензилоксикарбонил)аргинина, циклопропансульфонилхлорида и пирролидина, ожидаемый продукт получают по способу, описанному в примере 1. Пример 29. (S)-N5-[4-Амино-5-оксо-5-(1 пирролидинил)пентил]циклопропансульфонамидгидрохлорид. Исходя из (S)-N5-(бензилоксикарбонил)2N -(трет-бутилоксикарбонил)орнитина, циклопропансульфонилхлорида и пирролидина, ожидаемый продукт получают по способу, описанному в примере 3. Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 44,23 7,42 12,90 9,84 10,88 Обнаруженный 44,06 7,83 12,62 10,06 10,67 Пример 34. (S)-1-[N5-(Амино)(циклогексилсульфониламино)метилорнитил]пирролидингидрохлорид. Исходя из (S)-N2-(бензилоксикарбонил)аргинина, циклогексансульфонилхлорида и пирролидина, ожидаемый продукт получают по способу, описанному в примере 1. Пример 35. (S)-N-[4-Амино-5-оксо-5-(1 пирролидинил)пентил]циклогексансульфонамидгидрохлорид. Исходя из (S)-N5-(бензилоксикарбонил)2N -(трет-бутилоксикарбонил)орнитина, циклогексансульфонилхлорида и пирролидина, ожидаемый продукт получают по способу, описанному в примере 3. Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 48,97 8,22 11,42 8,71 9,64 Обнаруженный 48,68 8,26 11,20 8,34 9,44 21 Пример 36. (S)-1-[3-2-[Имино)(метилсульфониламино)метил)амино]этоксиаланил] пирролидингидрохлорид. Исходя из (S)-3-(2-[амино(имино)метил] аминоэтокси)-N-(бензилоксикарбонил)аланина, метансульфонилхлорида и пирролидина,ожидаемый продукт получают по способу, описанному в примере 1. Пример 37. (S)-N-2-[2-Амино-3-оксо-3-(1 пирролидинил)пропокси]этилметансульфонамидгидрохлорид. Стадия А. (S)-1-3-[2-Бензилоксикарбонил)амино)этокси]-N-(трет-бутилоксикарбонил) аланилпирролидин. Исходя из (S)-3-(2-[бензилоксикарбонил] аминоэтокси)-N-(трет-бутилоксикарбонил)аланина и пирролидина, ожидаемый продукт получают по способу, описанному в стадии А примера 3. Стадия В. (S)-1-3-[2-(Амино)этокси]-N(трет-бутилоксикарбонил)аланилпирролидин. 10 ммоль соединения, полученного на предыдущей стадии, обрабатывают 5 г формата аммония и 0,7 г 10% Pd/C в этаноле с обратным холодильником на протяжении 4 ч 30 мин; реакционную смесь затем доводят до комнатной температуры и фильтруют. Фильтрат выпаривают и остаток, полученный таким образом,очищают хроматографированием на силикагеле(элюант: дихлорометан/метанол/гидроксид аммиака 90/10/1) с получением ожидаемого продукта. Стадия С. (S)-N-2-[2-Амино-3-оксо-3-(1 пирролидинил)пропокси]этилметансульфонамидгидрохлорид. Исходя из соединения, полученного на предыдущей cтадии, и метансульфонилхлорида,ожидаемый продукт получают согласно стадиям С и D примера 3. Пример 38. (S)-1-[3-2-[Имино)(метилсульфониламино)метил)амино]этилтиоаланил] пирролидингидрохлорид. Исходя из (S)-3-(2-[амино(имино)метил] аминоэтилтио)-N-(бензилоксикарбонил)аланина, метансульфонилхлорида и пирролидина,ожидаемый продукт получают по способу, описанному в примере 1. Пример 39. (S)-N-2-[2-Амино-3-оксо-3-(1 пирролидинил)пропилтио]этилметансульфонамидгидрохлорид. Исходя из (S)-3-(2-[бензилоксикарбонил] аминоэтилтио)-N-(трет-бутилоксикарбонил) аланина, метансульфонилхлорида и пирролидина, ожидаемый продукт получают согласно способу, описанному в примере 37. Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 36,19 6,68 12,66 19,32 10,68 Обнаруженный 36,17 6,73 12,19 18,90 10,82 22 Пример 40. (S)-3-[3-2-[Имино)(метилсульфониламино)метил)амино]этоксиаланил]1,3-тиазолидингидрохлорид. Исходя из (S)-3-(2-[амино(имино)метил] аминоэтокси)-N-(бензилоксикарбонил)аланина, метансульфонилхлорида и 1,3-тиазолидина,ожидаемый продукт получают по способу, описанному в примере 36. Пример 41. (S)-N-2-[2-Амино-3-оксо-3(1,3-тиазолидин-3-ил)пропокси]этилметансульфонамидгидрохлорид. Исходя из (S)-3-(2-[бeнзилоксикapбонил]aминoэтокси)-N-(тepт-бутилоксикарбонил)аланина и 1,3-тиазолидина, ожидаемый продукт получают по способу, описанному в примере 37. Пример 42. (S)-3-[3-2-[Имино)(метилсульфониламидо)метил)амино]этилтиоаланил]1,3-тиазолидингидрохлорид. Исходя из (S)-3-(2-[амино(имино)метил] аминоэтилтио)-N-(бензилоксикарбонил)аланина, метансульфонилхлорида и 1,3-тиазолидина,ожидаемый продукт получают по способу, описанному в примере 36. Пример 43. (S)-N-2-[2-Амино-3-оксо-3(1,3-тиазолидин-3-ил)пропилтио]этилметансульфонамидгидрохлорид. Исходя из (S)-3-(2-[бензилоксикарбонил] аминоэтилтио)-N-(трет-бутилоксикарбонил) аланина, метансульфонилхлорида и 1,3-тиазолидина, ожидаемый продукт получают по способу,описанному в примере 37. Пример 44. (2S)-2-Циано-1-[N5-(имино)(метилсульфониламино)метил-(S)-орнитил] пирролидиндигидрохлорид. Исходя из (S)-N2-(бензилоксикарбонил) аргинина, метансульфонилхлорида и (S)-2 цианопирролидингидрохлорида,ожидаемый продукт получают по способу, описанному в примере 1. Пример 45. N-[(4S)-4-Амино-5-оксо-52S)-2-циано-1-пирролидинил)пентил]метансульфонамидгидрохлорид. Исходя из (S)-N5-(бензилоксикарбонил)2N -(трет-бутилоксикарбонил)орнитина, метансульфонилхлорида и (S)-2-цианопирролидингидрохлорида, ожидаемый продукт получают по способу, описанному в примере 3. Масс-спектрометрия: [M+H]+=289; [М-Н]=287; [M+Cl]-=322 Пример 46. (4R)-4-Циaнo-3-[N5-(иминo)(мeтилcyльфoнилaминo)мeтил-(S)-opнитил]1,3-тиaзoлидингидpoxлopид. Исходя из (S)-N2-(бензилоксикарбонил)аргинина, метансульфонилхлорида и (R)-4-циано 1,3-тиазолидина, ожидаемый продукт получают по способу, описанному в примере 1. Пример 47. N-[(4S)-4-Амино-5-оксо-54R)-4-циано-1,3-тиазолидин-3 ил)пентил]метансульфонамидгидрохлорид. Исходя из (S)-N5-(бензилоксикарбонил)2N -(трет-бутилоксикарбонил)орнитина, метансульфонилхлорида и (R)-4-циано-1,3-тиазоли 23 дина, ожидаемый продукт получают по способу,описанному в примере 3. Пример 48. (S)-N-([4-Амино-5-оксо-5-(1 пирролидинил)пентил]аминометилиден)метансульфонамидгидрохлорид. Стадия А. (S-N4-(Бeнзилoкcикapбoнил)1N -(трет-бутилоксикарбонил)орнитина и пирролидина, ожидаемый продукт получают по способу, описанному в стадии А примера 3. Стадия В. (S)-N4-(Бeнзилoкcикаpбoнил)-5oкco-5-(1-пирролидинил)-1,4-пентандиамингидрохлорид. Исходя из соединения, полученного на предыдущей стадии, ожидаемый продукт получают по способу, описанному в стадии D примера 3. Стадия С. (S)-N-[4-[(Бензилоксикарбонил)амино]-5-оксо-5-(1-пирролидинил)пентил] аминометилиденметансульфонамид. К 10 ммоль соединения, полученного на предыдущей стадии, растворенного в метаноле,добавляют 10 ммоль гидрохлорида калия, растворенного в метаноле. После перемешивания на протяжении 30 мин при комнатной температуре, образовавшийся осадок отфильтровывают,и затем к фильтрату добавляют 10 ммоль N(этоксиметилиден)метансульфонамида. После перемешивания на протяжении 15 мин при комнатной температуре, реакционную смесь выпаривают и полученный остаток очищают хроматографией на силикагеле (элюант: дихлорометан/метанол/гидроксид аммония 97/3/0,3) с получением ожидаемого продукта. Стадия D. (S)-N-([4-Амино-5-оксо-5-(1 пирролидинил)пентил]аминометилиден)метансульфонамидгидрохлорид. Исходя из соединения, полученного на предыдущей cтадии, ожидаемый продукт получают по способу, описанному в cтадиях С и D примера 1. Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 40,42 7,09 17,14 9,81 10,85 Обнаруженный 39,99 7,38 16,62 10,27 10,25 Пример 49. (S)-1-[N5-(Имино)-(мeтилсульфониламино)метил-N2-метилорнитил]пирролидингидрохлорид. Стадия А. (S)-1-[N5-(Иминo)-(мeтилcyльфoнилaминo)мeтил-N2-метилорнитил]пирролидин. Ожидаемый продукт получают по способу,описанному в стадиях А и В примера 1, заменяя 24 Исходя из соединения, полученного на предыдущей стадии, ожидаемый продукт получают по способу, описанному в стадии D примера 1. Пример 50. (S)-N-[5-Амино-1-имино-6-оксо-6-(1-пирролидинил)гексил]метансульфонамидгидрохлорид. Ожидаемый продукт получают по способу,описанному в примере 11, заменяя (S)-N2-(третбутилоксикарбонил)-4-цианофенилаланин наN -(трет-бутилоксикарбонил)орнитина, 2-пропансульфонилхлорида и пирролидина, ожидаемый продукт получают согласно способу, описанному в примере 3. Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 43,96 7,99 12,82 9,78 10,81 Обнаруженный 43,96 8,06 12,42 9,70 11,30 Пример 52. (S)-1-[2-Aминo-3-[(иминo)(мeтилcyльфoнилaминo)мeтил]аминопропаноил] пирролидингидрохлорид. Ожидаемый продукт получают по способу,описанному в примере 4, заменяя (S)-N6-(бензилоксикарбонил)-N2-(трет-бутилоксикарбонил) лизин на (S)-3-[(трет-бутилоксикарбонил)амино]-2-[(бензилоксикарбонил)амино]пропановую кислоту. Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 34,45 6,42 22,32 10,22 11,30 Обнаруженный 34,51 6,42 21,35 10,09 12,30 Пример 53. (S)-N-[4-Амино-5-оксо-5-(1 пирролидинил)пентил](циклогексил)метансульфонамидгидрохлорид. Исходя из (S)-N5-(бeнзилоксикарбонил)2N -(тepт-бутилоксикарбонил)орнитина, (циклогексил)метансульфонилхлорида и пирролидина,ожидаемый продукт получают согласно способу, описанному в примере 3. Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 50,31 8,44 11,00 8,39 9,28 Обнаруженный 50,70 8,44 10,67 8,20 9,60 Пример 54. N-[(5S)-5-Амино-6-оксо-6(2S)-2-циано-1-пирролидинилгексил]метансульфонамидгидрохлорид. Исходя из (S)-N6-(бензилоксикарбонил)2 метанN -(трет-бутилоксикарбонил)лизина,сульфонилхлорида и (S)-2-цианопирролидингидрохлорида, ожидаемый продукт получают согласно способу, описанному в примере 3.(мeтилcyльфoнилaминo)мeтил-(S)-лизил]пирролидингидрохлорид. Ожидаемый продукт получают по способу,описанному в примере 4, заменяя пирролидин на (S)-2-цианопирролидингидрохлорид. Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 40,99 6,62 22,06 8,42 9,31 Обнаруженный 40,70 6,71 20,91 8,49 10,30(циклoгeкcилcyльфoнилaминo)метил-(S)-лизил]пирролидингидрохлорид. Ожидаемый продукт получают по способу,описанному в примере 4, заменяя пирролидин на (S)-2-цианопирролидингидрохлорид и метансульфонилхлорид на циклогексансульфонилхлорид. Мaсс-спектрометрия: [M+H]+=413 Пример 62. N-(5S)-5-Амино-6-оксо-6[(4R)-4-циано-1,3-тиазолидин-3-ил]гексилциклогексансульфонамидгидрохлорид. Исходя из (S)-N6-(бензилоксикарбонил)2(R)-4-циано-1,3 тиазолидина, ожидаемый продукт получают по способу, описанному в примере 3. Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 45,22 6,88 13,18 15,09 8,34 Обнаруженный 45,41 6,75 12,94 15,09 8,75 Пример 56. (S)-1-[N6-(Иминo)(мeтилcyльфoнилaминo)мeтиллизил]пиразолидиндигидрохлорид. Ожидаемый продукт получают по способу,описанному в примере 4, заменяя пирролидин на 1-(бензилоксикарбонил)пиразолидин. Масс-спектрометрия:(мeтилcyльфoнилaминo)мeтил-(S)-лизил]-1,3 тиазолидингидрохлорид. Ожидаемый продукт получают по способу,описанному в примере 4, заменяя пирролидин на (R)-4-циано-1,3-тиазолидин. Масс-спектрометрия:N -(трет-бутилоксикарбонил)лизина, метансульфонилхлорида и (R)-4-циано-1,3-тиазолидина,ожидаемый продукт получают по способу, описанному в примере 3. Масс-спектрометрия: [M+H]+=321 Пример 59. (S)-N-[5-Амино-6-оксо-6-(1,3 тиазолидин-3-ил)гексил]циклогексансульфонамидгидрохлорид. Исходя из (S)-N6-(бeнзилoкcикapбoнил)2N -(тepт-бyтилoкcикapбoнил)лизинa, циклогексансульфонилхлорида и 1,3-тиазолидина, ожидаемый продукт получают согласно способу,описанному в примере 3. Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 45,04 7,56 10,50 16,03 8,86 Обнаруженный 45,36 7,37 10,22 16,69 9,39 Пример 60. (S)-3-[N6-(Имино)(циклогексилсульфониламино)метиллизил]-1,3-тиазолидиндигидрохлорид. Ожидаемый продукт получают по способу,описанному в примере 4, заменяя пирролидин на 1,3-тиазолидин и метансульфонилхлорид на циклогексансульфонилхлорид.(циклогексилсульфониламино)метил-(S)-лизил]-1,3-тиазолидиндигидрохлорид. Ожидаемый продукт получают по способу,описанному в примере 4, заменяя пирролидин на (R)-4-циано-1,3-тиазолидин и метансульфонилхлорид на циклогексансульфонилхлорид. Мaсс-cпектрометрия: [M+H]+=431 Пример 64. N-[(5S)-5-Амино-6-оксо-6(2S)-2-циано-1-пирролидинилгексил]циклогексансульфонамидгидрохлорид. Исходя из (S)-N6-(бензилоксикарбонил)2N -(трет-бутилоксикарбонил)лизина, циклогексансульфонилхлорида и (S)-2-цианопирролидингидрохлорида, ожидаемый продукт получают по способу, описанному в примере 3. Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 50,17 7,68 13,77 7,88 8,71 Обнаруженный 50,25 7,71 14,07 7,71 8,31 Пример 65. (S)-N-[5-Амино-6-оксо-6-(1 пирролидинил)гексил]циклогексансульфонамидгидрохлорид. Исходя из (S)-N6-(бензилоксикарбонил)2N -(трет-бутилоксикарбонил)лизина, циклогексансульфонилхлорида и пирролидина, ожидаемый продукт получают по способу, описанному в примере 3. Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 50,31 8,44 11,00 8,39 9,28 Обнаруженный 50,44 8,44 10,93 7,99 9,31 Пример 66. (S)-N-[4-Амино-5-оксо-5-(1,3 тиазолидин-3-ил)пентил]циклогексансульфонамидгидрохлорид. Ожидаемый продукт получают по способу,описанному в примере 3, заменяя пирролидин на 1,3-тиазолидин и метансульфонилхлорид на циклогексансульфонилхлорид. Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 43,57 7,31 10,89 16,62 9,19 Обнаруженный 43,40 7,30 10,52 16,64 9,34 Пример 67. (S)-N-[4-Амино-5-оксо-5-(1 пирролидинил)пентил]-4-морфолинсульфонамидгидрохлорид. Ожидаемый продукт получают по способу,описанному в примере 3, заменяя метансульфонилхлорид на 4-морфолинсульфонилхлорид. Элементарный микроанализ: С% Н% N% S% Расчетный 42,10 7,34 15,11 8,65 Обнаруженный 42,05 7,37 14,49 8,50N -(трет-бутилоксикарбонил)лизина, 2-нитробензолсульфонилхлорида и 1,3-тиазолидина,ожидаемый продукт получают по способу, описанному в cтадиях А по С примера 3. Стадия В. (S)-N-[5-трет-Бутилоксикарбониламино-6-оксо-6-(1,3-тиазолидин-3-ил)гексил]-N-метил-2-нитробензолсульфонамид. К 10 ммоль соединения, полученного наcтадии А, описанной выше, растворенного в тетрагидрофуране, добавляют 11,5 ммоль трифенилфосфина и 16,5 ммоль метанола. Реакционную смесь затем охлаждают до 0 С и добавляют 11,5 ммоль диэтилазодикарбоксилата. Смесь затем доводят до комнатной температуры. После перемешивания на протяжении 20 ч смесь гидролизируют и экстрагируют. Полученный продукт очищают хроматографией на силикагеле (элюант: дихлорометан/этил ацетат 80/20) с получением ожидаемого продукта. Стадия С. (S)-N1-Meтил-N5-тepт-бyтилoкcикapбoнил)-6-oкco-6-(1,3-тиазолидин-3-ил)1,5-гександиамин. Ожидаемый продукт получают реакцией сульфонамида, полученного на стадии В, описанной выше, с бензолтиолом в присутствии карбоната цезия, согласно способу, описанному в Tet. Lett. 1997, 38 (33), 5831-5834. Стадия D. (S)-N-[5-Амино-6-оксо-6-(1,3 тиазолидин-3-ил)гексил]-N-метилметансульфонамидгидрохлорид. 28 Исходя из соединения, полученного на предыдущей стадии, и метансульфонилхлорида,ожидаемый продукт получают по способу, описанному в стадиях С и D примера 3. Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 38,19 6,99 12,15 18,54 10,25 Обнаруженный 38,23 7,15 11,66 18,72 10,43 Пример 69. (S)-N-[4-Амино-5-оксо-5-(1 пирролидинил)пентил](метилсульфонил)метансульфонамидгидрохлорид. Ожидаемый продукт получают согласно способу примера 3, заменяя метансульфонилхлорид на (метилсульфонил)метансульфонилхлорид. Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 34,96 6,40 11,12 16,97 9,38 Обнаруженный 35,43 6,46 11,05 16,86 9,59 Пример 70. (S)-N-[4-Амино-5-оксо-5-(1 пирролидинил)пентил](фенил)метансульфонамидгидрохлорид. Ожидаемый продукт получают согласно способу примера 3, заменяя метансульфонилхлорид на (фенил)метансульфонилхлорид. Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 51,12 6,97 11,18 8,53 9,43 Обнаруженный 51,00 7,11 10,44 7,90 9,26 Пример 71. (S)-N-[4-Амино-5-оксо-5-(1 пирролидинил)пентил]-2,2,2-трифтороэтансульфонамидгидрохлорид. Ожидаемый продукт получают согласно способу примера 3, заменяя метансульфонилхлорид на 2,2,2-трифтороэтансульфонилхлорид. Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 35,92 5,75 11,42 8,72 9,64 Обнаруженный 35,43 6,07 11,09 8,70 9,37 Пример 72. (S)-N-[4-Амино-5-оксо-5-(1 пирролидинил)пентил]сульфамидгидрохлорид. Стадия А. (S)-N-[4-Амино-5-оксо-5-(1-пирролидинил)пентил]-N'-(бeнзилоксикарбонил) сульфамид. К 10 ммоль хлоросульфонилизоцианата,растворенного в дихлорометане при 0 С, добавляют по каплям при 0 С 10 ммоль бензилового спирта, растворяют в дихлорометане и затем,после перемешивания на протяжении 1 ч 30 мин при 0 С, 10 ммоль соединения, полученного наcтадии В примера 3, растворенного в смеси дихлорометана и триэтиламина 96/4. После возвращения к комнатной температуре, реакционную смесь перемешивают на протяжении ночи и затем разделяют. Органическую фазу промывают, сушат и выпаривают с получением ожидаемого продукта. 29 Стадия В. (S)-N-[4-Амино-5-оксо-5-(1-пирролидинил)пентил]сульфамидгидрохлорид. Исходя из соединения, полученного на предыдущей стадии, ожидаемый продукт получают по способу, описанному в стадиях С и D примера 1. Элементарный микроанализ: С% Н% N% S% Cl% Расчетный 35,94 7,04 18,63 10,66 11,79 Обнаруженный 35,92 6,95 18,18 11,05 12,35 Пример 73. (S)-N1-[-1-(Метилсульфонил)4,5-дигидро-1 Н-имидазол-2-ил]-5-оксо-5-(1 пирро-лидинил)-1,4-пентандиамингидрохлорид. Стадия А. 1-(Метилсульфонил)-2-(метилтио)-4,5-дигидро-1 Н-имидазол. Исходя из 2-(метилтио)-4,5-дигидро-1 Нимидазола и метансульфонилхлорида, ожидаемый продукт получают по способу, описанному в стадии С примера 3. Стадия В. (S)-N4-(тepт-Бyтилoкcикapбoнил)-N1-[1-(мeтилcyльфoнил)-4,5-дигидро 1 Н-имидазол-2-ил]-5-оксо-5-(1-пирролидинил)1,4-пентандиамин. К 10 ммоль соединения, полученного на стадии В примера 3, растворенного в изопропаноле, добавляют 14,6 ммоль соединения, полученного на стадии А, описанной выше. Реакционную смесь затем нагревают с обратным холодильником на протяжении 48 ч. После возвращения к комнатной температуре, гидролиза и экстракции, полученный продукт очищают хроматографией на силикагеле (элюант: дихлорометан/метанол 92,5/7,5) с получением ожидаемого продукта. Стадия С. (S)-N1-[1-(Meтилcyльфoнил)-4,5 дигидро-1 Н-имидазол-2-ил]-5-оксо-5-(1-пирролидинил)-1,4-пентандиамингидрохлорид. Исходя из соединения, полученного на предыдущей стадии, ожидаемый продукт получают по способу, описанному в стадии D примера 1. Масс-спектрометрия:N -(тepт-бyтилoкcикapбoнил)opнитинa, циклогексансульфонилхлорида и (S)-2-цианопирролидингидрохлорида, ожидаемый продукт получают по способу, описанному в примере 3. Пример 75. (S)-N-[4-Амино-5-оксо-5-(1 пирролидинил)пентил]-N-метилциклогексансульфонамидгидрохлорид. Исходя из (S)-N5-(бензилоксикарбонил)2N -(трет-бутилоксикарбонил)oрнитина, циклогексансульфонилхлорида и пирролидина, ожидаемый продукт получают по способу, описанному в примере 68.N -(трет-бутилоксикарбонил)орнитина, циклогексансульфонилхлорида и (S)-2-цианопирролидингидрохлорида, ожидаемый продукт получают по способу, описанному в примере 68. Фармакологическое изучение соединений по изобретению Пример 77. Ингибирование дипептидилпептидазы IV in vitro. Влияние соединений на энзиматическую активность DPP IV in vitro оценивают как описано ниже. Энзим, полученный из свиной почки, подвергают анализу при помощи хромогенного субстрата, глицил-пролил-n-нитроанилида 1,4 мМ, который гидролизируют, чтобы высвободить n-нитроанилин, который поглощает при 405 нм. Активность энзима определяли по поглощению, в присутствии различных концентраций оцениваемого соединения (в основном от 10-4 до 10-7 М). Полученные данные позволяют определить эффективную дозу для 50% ингибирования контрольной активности (IС 50). Соединения по изобретению имеют IС 50 от 1 нМ до 20 М. Пример 78. Фармацевтическая композиция. Формула для приготовления 1000 таблеток, каждая из которых содержит по 10 мг активного ингредиента: Соединение по примеру 1 10 г Гидроксипропилцеллюлоза 2 г Пшеничный крахмал 10 г Лактоза 100 г Стеарат магния 3 г Тальк 3 г ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) в которой представляет собой 5-членный, азотсодержащий гетероцикл, необязательно замещенный цианогруппой,R1 представляет собой атом водорода или линейный или разветвленный (С 1-С 6)алкил, линейную или разветвленную (С 1-С 6)ацильную,пролильную, аланильную, гистидилпролильную или фенилаланилпролильную группу,Ak представляет собой линейную или разветвленную (С 1-С 6)алкиленовую цепь или гетероалкиленовую цепь,Х представляет собой одинарную связь или фениленовую группу, необязательно замещенную одной или более одинаковыми или различ 31 ными группами, выбираемыми из атомов галогенов и линейной или разветвленной (С 1 С 6)алкильной, гидрокси, линейной или разветвленной (С 1-С 6)алкокси и линейной или разветвленной (С 1-С 6)полигалоалкильной групп,R2 представляет собой линейную или разветвленную (С 1-С 6)алкильную группу (необязательно замещенную одной или более одинаковыми или различными группами, выбираемыми из арильной, линейной или разветвленной (С 1(С 3-С 7)циклоалкилС 6)алкилсульфонильной,сульфонильной, (С 3-С 7)циклоалкильной групп и атомов галогена),(С 3-С 10)циклоалкильную группу или -NR2aR2b, в которой R2a и R2b, которые могут быть одинаковыми или различными,каждая представляет собой атом водорода или линейную или разветвленную (C1-С 6)алкильную группу или совместно с атомом азота несущим их, образуют азотсодержащий гетероцикл,Y представляет собой группу -NR3-,R3 представляет собой атом водорода или группу, выбираемую из линейной или разветвленной (С 1-С 6)алкильной группы, (С 3-С 7) циклоалкила и арила,R4, R5 и R6, которые могут быть одинаковыми или различными, каждая представляет собой атом водорода или линейную или разветвленную (С 1-С 6)алкильную группу, или R4 иR6 или R5 и R6 совместно с атомами, их несущими, образуют имидазолидиновое или дигидробензимидазольное кольцо,их оптические изомеры и их аддитивные соли с фармацевтически приемлемой кислотой,азотосодержащий гетероцикл понимают как обозначающий насыщенную, моноциклическую, 5-7 членную группу, содержащую один,два или три гетероатомов, один из этих гетероатомов представляет собой атом азота и дополнительный гетероатом(ы), которые необязательно присутствуют, выбирают из атомов кислорода, азота и серы,гетероалкиленовую цепь понимают как обозначающую линейную или разветвленную(С 1-С 6)алкиленовую цепь, в которой -СН 2-член замещен атомом кислорода или серы. 2. Соединение формулы (I) по п.1, в котопредставляет собой 1-пирролидирой нильную группу, необязательно замещенную цианогруппой, или 1,3-тиазолидин-3-ильную группу, необязательно замещенную цианогруппой. 3. Соединения формулы (I) либо по п.1,либо по п.2, в которой Х представляет собой одинарную связь. 4. Соединение формулы (I) по любому из пп.1-3, в которой конфигурациядля амидной функции представляет собой (S). 32 5. Соединение формулы (I) по любому из пп.1-4, в которой R2 представляет собой линейную или разветвленную (С 1-С 6)алкильную группу и Y представляет собой группу 6. Соединение формулы (I) по любому из пп.1-4, в которой R2 представляет собой (С 3 С 10)циклоалкильную группу и Y представляет собой группу -NH-. 7. Соединение формулы (I) по п.1, которое представляет собой (S)-1-[N5-(имино)(метилсульфониламино)метилорнитил]пирролидин,его оптические изомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой. 8. Соединение формулы (I) по п.1, которое представляет собой (S)-N-[4-амино-5-оксо-5-(1 пирролидинил)пентил]циклогексансульфонамид, его оптические изомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой. 9. Соединение формулы (I) по п.1, которое представляет собой (2S)-2-циано-1-[N5-(имино)(метилсульфониламино)метил-(S)-орнитил] пирролидин, его оптические изомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой. 10. Соединение формулы (I) по п.1, которое представляет собой (2S)-2-циано-1-[N6(имино)(метилсульфониламино)метил-(S)-лизил]пирролидин, его оптические изомеры, а также его аддитивные соли с фармацевтически приемлемой кислотой. 11. Способ получения соединений формулы (I) по п.1, который отличается тем, что соединение формулы (II) в которой Ak, X и Y имеют значения, указанные для формулы (I),R'1 представляет собой защитную группу для аминофункции, или линейную или разветвленную (С 1-С 6)алкильную группу, линейную или разветвленную (С 1-С 6)ацильную группу,пролильную группу, необязательно защищенную аминофункционально-защитной группой,аланильную группу, необязательно защищенную аминофункционально-защитной группой,гистидилпролильную группу, необязательно защищенную аминофункционально-защитной группой, или фенилаланилпролильную группу,необязательно защищенную аминофункционально-защитной группой, и Р 2 представляет собой атом водорода или защитную группу для аминофункции,подвергают реакции с соединением формулы (III) в которой имеет значение, указанное для формулы (I),при обычных условиях пептидного связывания с получением после депротекции, где это необходимо, группы Y соединения формулы(V),R2-SO2-Z1 в которой R2 имеет значение, указанное для формулы (I), и Z1 представляет собой уходящую группу, такую как, например, атом галогена,с получением после депротекции, где это необходимо, соединения формулы (I),которое очищают, где это необходимо, по традиционной методике очистки, которое раз 34 деляют при желании на оптические изомеры по традиционной методике разделения и которое переводят при желании в его аддитивные соли с фармацевтически приемлемой кислотой. 12. Фармацевтическая композиция, включающая как активный ингредиент соединение по любому из пп.1-10, в комбинации с одним или более инертным, нетоксичным и фармацевтически приемлемым носителем. 13. Фармацевтическая композиция по п.12 для применения в качестве лекарственного препарата как ингибитора дипептидилпептидазы IV для применения при лечении непереносимости глюкозы и расстройств, связанных с гипергликемией, таких как диабет типа II или ожирение,при предотвращении отторжения после трансплантации, при лечении рака и предотвращении раковых метастаз, при лечении СПИДа и периодонтита, а также при восстановлении кишечника после резекции. 14. Фармацевтическая композиция по п.12 для применения в качестве противодиабетного лекарственного препарата.
МПК / Метки
МПК: A61P 3/10, C07D 295/185, A61K 31/40
Метки: способ, содержащие, композиции, фармацевтические, новые, alpha;-аминокислотные, соединения, сульфонильные, получения
Код ссылки
<a href="https://eas.patents.su/18-4591-novye-alpha-aminokislotnye-sulfonilnye-soedineniya-sposob-ih-polucheniya-i-farmacevticheskie-kompozicii-ih-soderzhashhie.html" rel="bookmark" title="База патентов Евразийского Союза">Новые α-аминокислотные сульфонильные соединения, способ их получения и фармацевтические композиции, их содержащие</a>
Предыдущий патент: Способ блокировки развития, или снижения тяжести, или проявлений заболевания, “трасплантат против хозяина”
Следующий патент: Применение 2-метилтиазолидин-3,3-дикарбоновой кислоты (2-мтдк) и/или ее физиологически совместимых солей для лечения и/или предупреждения рака
Случайный патент: Тартратная соль производного тиазолидиндиона












