Тиофенпиразолопиримидиновые соединения
Номер патента: 16056
Опубликовано: 30.01.2012
Авторы: Цзя Шаоцзюань, Тот Джеймс Ли, Хембр Эрик Джеймс, Чэнь Чжаогэнь, Амдоучи Чафик Амдоучи, Хипскинд Филип Артур
Формула / Реферат
1. Соединение формулы I
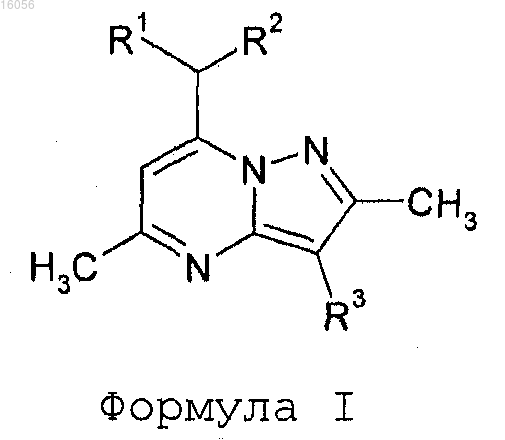
отличающееся тем, что
R1 и R2 независимо представляют собой водород или C1-С3алкил;
R3 представляет собой
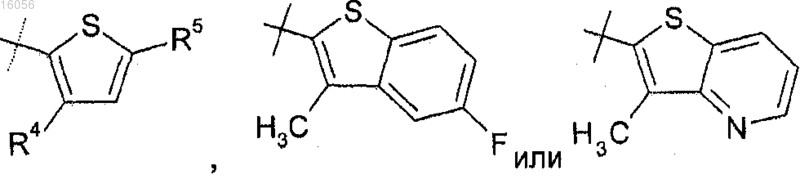
R4 представляет собой Cl или метил;
R5 представляет собой водород, Br, нитро, метокси, метоксиметил, диметиламино, этоксикарбонил, ацетамидо,
ацетокси,
или его фармацевтически приемлемая соль.
2. Соединение по п.1 или его фармацевтически приемлемая соль, отличающееся тем, что R1 и R2 независимо представляют собой этил или н-пропил.
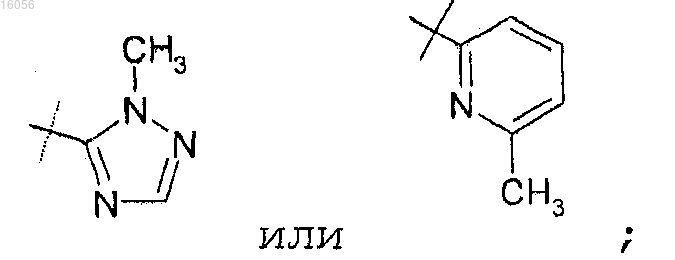
3. Соединение по п.1 или 2 или его фармацевтически приемлемая соль, отличающееся тем, что R3 представляет собой
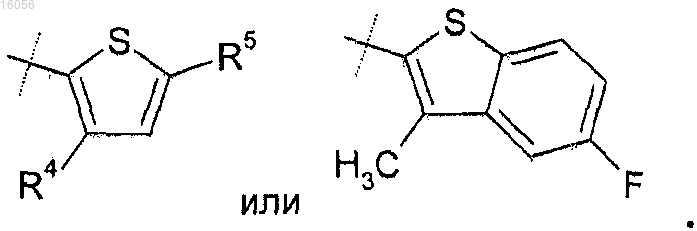
4. Соединение по любому из пп.1-3, отличающееся тем, что
R5 представляет собой метокси, метоксиметил, диметиламино или
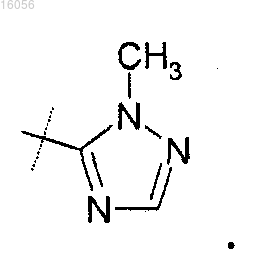
5. Фармацевтическая композиция, содержащая соединение по любому из пп.1-4, или его фармацевтически приемлемую соль, и фармацевтически приемлемый наполнитель.
6. Применение соединения по любому из пп.1-4 или его фармацевтически приемлемой соли для лечения алкоголизма или токсикомании.
7. Применение соединения по любому из пп.1-4 или его фармацевтически приемлемой соли для лечения депрессии или состояния тревоги.
8. Применение соединения по любому из пп.1-4 или его фармацевтически приемлемой соли для получения лекарственного средства для лечения состояния тревоги или депрессии.
9. Применение соединения по любому из пп.1-4 или его фармацевтически приемлемой соли для получения лекарственного средства для лечения алкоголизма или токсикомании.
Текст
ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ЕВРАЗИЙСКОМУ ПАТЕНТУ Дата публикации и выдачи патента В изобретении предлагают соединения формулы I Чэнь Чжаогэнь, Амдоучи Чафик Амдоучи, Хембр Эрик Джеймс,Хипскинд Филип Артур, Цзя Шаоцзюань, Тот Джеймс Ли (US) Медведев В.Н. (RU) их фармацевтические композиции и применение указанных соединений в качестве антагонистов рецептора кортикотропин-рилизинг фактора 1 (CRF1) при лечении психиатрических и нейроэндокринных расстройств, неврологических заболеваний и метаболического синдрома.(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) 016056 Область изобретения В настоящем изобретении предложены новые тиофенпиразолопиримидиновые соединения, их фармацевтические композиции и применение в качестве антагонистов CRF1 рецептора при лечении психиатрических и нейроэндокринных расстройств, неврологических заболеваний и метаболического синдрома. Предпосылки изобретения Кортикотропин-рилизинг фактор (CRF) представляет собой пептид, содержащий 41 аминокислоту,который является важнейшим физиологическим регулятором секреции пептидных производных проопиомеланокортинона (РОМС) из передней доли гипофиза. Помимо его эндокринной роли в гипофизе,иммуногистохимическая локализация CRF указывает на то, что этот гормон имеет широкое распространение в экстрагипоталамических участках центральной нервной системы и обладает широким спектром автономных, электрофизиологических и поведенческих эффектов, соответствующих роли нейромедиатора или нейромодулятора в головном мозге. Существуют также данные о том, что CRF играет существенную роль в интегрировании ответа иммунной системы на физиологические, психологические и иммунологические факторы стресса.CRF связывают с психиатрическими расстройствами и неврологическими заболеваниями, в том числе депрессией и состоянием тревоги, а также следующими состояниями: болезнью Альцгеймера, болезнью Хантингтона, прогрессирующим супрануклеарным параличом, боковым амиотрофическим склерозом, болезнью Паркинсона, эпилепсией, мигренью, алкоголизмом и токсикоманией и сопутствующими абстинентными синдромами, ожирением, метаболическим синдромом, врожденной гиперплазией надпочечников, болезнью Кушинга, гипертензией, нарушением мозгового кровообращения, синдромом раздраженной толстой кишки, индуцированной стрессом язвой желудка, предменструальным синдромом,сексуальной дисфункцией, преждевременными родами, воспалительными заболеваниями, аллергиями,рассеянным склерозом, висцеральной болью, нарушениями сна, опухолями гипофиза или эктопическими опухолями гипофизарного происхождения, синдромом хронической усталости и фибромиалгией. Были идентифицированы подтипы рецептора CRF, CRF1 и CRF2, неравномерно распределенные в пределах головного мозга, что позволяет сделать вывод о потенциальном разнообразии функций. Например, считают, широко распространенные рецепторы CRF1 головного мозга играют важную роль в эмоциональности, сопровождающей воздействие внешних факторов стресса. Существенно, что рецепторы CRF1, но не CRF2, очевидно, обусловливают выбор поведения, подобного тревожному. Более дискретное распространение в области перегородки/гипоталамуса и наличие альтернативных эндогенных лигандов указывают на другую функциональную роль CRF2 рецептора. Например, как сообщают, новое семейство нейропептидов CRF с предпочтительной аффинностью к рецепторам CRF2 относительно рецепторов CRF1, подавляет аппетит и при этом не создает профиля поведенческой активации, наблюдаемый при действии селективного агониста CRF1. В других случаях воздействие CRF2 агониста вызывает эффекты, сходные с эффектами, описанными для антагонистов CRF1 или делеции гена CRF1. Например, хотя было предложено использовать агонисты CRF2 в качестве препаратов против ожирения, антагонисты CRF1 также могут являться важным средством лечения ожирения. Некоторые пирроло[2,3-d]пиримидины, пирроло[3,2-d]пиримидины, пиразоло[1,5-а]пиримидины,1,2,3-триазоло [4,5-b]пиридины и пиразоло[1,5-а]-1,3,5-триазины, применяемые в качестве антагонистовCRF, описаны в WO 94/13676, WO 97/29109, WO 98/08847 и WO 98/03510. В настоящем изобретении предложены новые тиофенпиразолопиримидины, которые можно применять в качестве антагонистов рецептора CRF1. Ввиду вышеизложенного, желательно обеспечить новые эффективные и селективные антагонисты RF1 в качестве потенциально полезных терапевтических средств для лечения психиатрических и нейроэндокринных расстройств, неврологических заболеваний и метаболического синдрома. Кроме того, поскольку большинство коммерческих лекарственных препаратов для ЦНС и сердечно-сосудистой системы проявляет нежелательные характеристики биологической доступности, также желательно найти соединения с характеристиками биологической доступности, превосходящими характеристики известных антагонистов CRF, таких как СР 154526 и NBI30775. Краткое описание изобретения Согласно одному варианту реализации настоящее изобретение относится к соединению формулы I где R1 и R2 независимо представляют собой водород или C1-С 3 алкил;R5 представляет собой водород, Br, нитро, метокси, метоксиметил, диметиламино, этоксикарбонил,ацетамидо, ацетокси, или его фармацевтически приемлемой соли. Согласно другому варианту реализации настоящее изобретение относится к способу лечения депрессии или большого депрессивного расстройства, состояния тревоги, алкоголизма или токсикомании,ожирения, гипертензии, метаболического синдрома, синдрома раздраженной толстой кишки, эпилепсии,удара, нарушения сна, аллергии, мигрени, предменструального синдрома (PMS), бесплодия, сексуальной дисфункции, врожденной гиперплазии надпочечников, заболевания Кушинга, преждевременных родов,вызванной стрессом язвы желудка, воспалительных заболеваний, опухолей гипофиза или эктопических,вызванных гипофизом опухолей, синдрома хронической усталости, фибромиалгии, висцеральной боли или рассеянного склероза, включающему введение пациенту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли. Согласно другому варианту реализации настоящее изобретение обеспечивает применение соединения формулы I, или его фармацевтически приемлемой соли, для получения лекарственного средства для лечения депрессии или большого депрессивного расстройства, состояния тревоги, алкоголизма или токсикомании, ожирения, гипертензии, метаболического синдрома, синдрома раздраженной толстой кишки,эпилепсии, удара, нарушений сна, аллергии, мигрени, предменструального синдрома (PMS), бесплодия,сексуальной дисфункции, врожденной гиперплазии надпочечников, заболевания Кушинга, преждевременных родов, вызванной стрессом язвы желудка, воспалительных заболеваний, опухолей гипофиза или вызванных гипофизом эктопических опухолей, синдрома хронической усталости, фибромиалгии, висцеральной боли или рассеянного склероза. Согласно другому варианту реализации настоящее изобретение обеспечивает соединение формулыI, или его фармацевтически приемлемую соль, для применения в качестве фармацевтического препарата. Подробное описание изобретения Приведенные выше и в других местах описания настоящего изобретения нижеуказанные термины,если не указано иное, имеют следующие значения:"Алкил" означает насыщенную алифатическую углеводородную группу, которая может иметь прямую или разветвленную цепь, содержащую от 1 до 5 атомов углерода в цепи."Фармацевтически приемлемый наполнитель" обозначает фармацевтически приемлемый носитель,раствор или вспомогательное вещество, добавляемое для улучшения характеристик состава. Указанные наполнители должны быть совместимы с другими ингредиентами состава и не должны наносить вред принимающему их реципиенту, и они хорошо известны специалистам (см., например, Remingtons Pharmaceutical Sciences, 19th Edition, Mack Publishing Company, 1995)."Фармацевтически приемлемые соли" обозначают относительно нетоксичные, неорганические и органические соли присоединения кислоты и соли присоединения основания соединений согласно настоящему изобретению. Эти соли можно получить in situ в процессе конечного выделения и очистки соединений. В частности, соли присоединения кислоты можно получить по отдельности посредством реакции очищенного соединения в форме его свободного основания с подходящей органической или неорганической кислотой и выделения таким образом образовавшейся соли (см., например, Remingtons Pharmaceutical Sciences, 19th Edition, Mack Publishing Company, 1995)."Терапевтически эффективное количество" или "эффективное количество" означает количество соединения формулы I согласно настоящему изобретению или фармацевтической композиции, содержащей соединение формулы I согласно настоящему изобретению, которое будет вызывать либо биологическую или медицинскую реакцию, либо требуемый терапевтический эффект на ткань, систему, животное или человека, который добивается исследователь, ветеринар, лечащий врач или другой клиницист. Термины "лечение", "лечить", "лечащий" и т.п. включают как замедление, так и изменение в сторону улучшения развития заболевания. Указанные термины также включают облегчение, улучшение, ослабление, устранение или уменьшение одного или более симптомов заболевания или состояния, даже если заболевание или состояние фактически не устраняется и даже если развитие самого заболевания или состояния не замедляется или не изменяется в сторону улучшения. Термин "лечение" и аналогичные термины также включают превентивное (например, профилактическое) и паллиативное лечение. Предотвращение заболевания подтверждается пролонгированием или задержкой начала симптомов заболевания. Символ в молекулярной структуре указывает положение присоединения для данного конкретного заместителя. В случае, если в каком-либо компоненте или в формуле I какая-либо переменная встречается более одного раза, ее определение в каждом случае не зависит от ее определения в любом другом случае, если-2 016056 не указано иное. Кроме того, комбинации заместителей и/или группировок являются допустимыми,только если эти комбинации порождают стабильные соединения. При выборе соединений согласно настоящему изобретению обычный специалист в данной области понимает, что различные заместители,т.е. R1, R2 и т.п., следует выбирать в соответствии с хорошо известными принципами соединяемости химических структур. Согласно стандартной номенклатуре, применяемой при описании настоящего изобретения, сначала описывают концевую часть обозначенной боковой цепи, а затем соседнюю функциональность по направлению к месту присоединения. Например, арилкарбониламиноалкильный заместитель эквивалентен арил-С(О)-NH-алкилу-. В настоящем изобретении рассмотрены конкретные разделы изобретений, например следующие:(a) соединение формулы I или его фармацевтически приемлемая соль, где R1 и R2 независимо представляют собой этил или н-пропил;(b) соединение формулы I или его фармацевтически приемлемая соль, где R3 представляет собой(с) соединение формулы I или его фармацевтически приемлемая соль, где R5 представляет собой метокси, метоксиметил, диметиламино или(d) применение соединения формулы I, или его фармацевтически приемлемой соли, для лечения депрессии или состояния тревоги;(e) применение соединения формулы I, или его фармацевтически приемлемой соли, для лечения алкоголизма или токсикомании;(f) соединение формулы I, или его фармацевтически приемлемая соль, имеющее значение Ki для(g) соединение формулы I, или его фармацевтически приемлемая соль, имеющее значение Ki для(h) соединение формулы I, или его фармацевтически приемлемая соль, имеющее значение Ki для(i) соединение формулы I, или его фармацевтически приемлемая соль, имеющее значение Ki для(j) соединение формулы I, или его фармацевтически приемлемая соль, имеющее значение Ki для(k) соединение формулы I, или его фармацевтически приемлемая соль, имеющее значение Ki дляCRF1 связывания 5 нМ, и селективное связывание с CRF1 (т.е. более низкое Ki) относительно CRF2; Соединение формулы I, или его фармацевтически приемлемая соль, с лучшей характеристикой биологической совместимости, чем известные CRF антагонисты (например, СР 154526 и NBI30775). Соединения согласно настоящему изобретению предпочтительно формулируют в виде фармацевтических композиций, вводимых различными путями. Предпочтительно, если такие композиции предназначены для перорального введения. Указанные фармацевтические композиции и способы их получения хорошо известны в данной области (см., например, Remington: The Science и Practice of Pharmacy, A.Gennaro, et al., eds., 19th ed., Mack Publishing Co., 1995). Соединения формулы I, как правило, являются эффективными в широком диапазоне дозирования. Например, суточная дозировка обычно лежит в интервале от примерно 0,0001 до примерно 30 мг/кг массы тела. В некоторых случаях могут быть более адекватными уровни дозирования, лежащие ниже нижнего предела вышеуказанного диапазона, тогда как в других случаях можно применять еще большие дозы, не вызывая никакого вредного побочного эффекта, и, следовательно, вышеуказанный диапазон дозирования никоим образом не ограничивает объем настоящего изобретения. Очевидно, что количество фактически вводимого соединения будет определяться врачом, в свете соответствующих обстоятельств,в том числе состояния, подвергаемого лечению, выбранного способа введения, конкретного вводимого соединения или соединений, возраста, веса и реакции конкретного пациента и серьезности симптомов,наблюдаемых у пациента. Соединения формулы I являются CRF-1 антагонистами и, в качестве таковых, могут применяться-3 016056 для. лечения состояния, которое поддается лечению путем уменьшения стимуляции CRF1 рецептора. Кортикотропин-рилизинг фактор (CRF), пептид, содержащий 41 аминокислоту, который является важнейшим физиологическим регулятором секреции пептидов, вызванной проопиомеланокортиноном(РОМС) из передней доли гипофиза [J. Rivier et al., Proc. Natl. Acad. Sci (USA) 80:4851 (1983); W. Vale etal., Science 213:1394 (1981)], связывали со многими медицинскими состояниями. Например, помимо его эндокринной роли при гипофизе, иммуногистохимическая локализация CRF свидетельствует, что этот гормон имеет широкое экстрагипоталамическое распространение в центральной нервной системе и производит широкий спектр автономных, электрофизиологических и поведенческих эффектов, сопоставимых с ролью нейромедиатора или нейромодулятора в головном мозге [W. Vale et al., Rec. Prog. Horm.(1985)]. Существуют также данные, что CRF играет существенную роль в интегрировании отклика иммунной системы на физиологические, психологические и иммунологические стресс-факторы. [см., например, J. E. Blalock, Physiological Reviews 69:1 (1989); J. E. Morley, Life Sci. 41:527 (1987)].CRF связан с психиатрическими расстройствами и неврологическими заболеваниями, в том числе депрессией и чувством тревоги [D. M. Nielsen, Life Sci. 78:909-919; Н. Е. Kunzel et al. , J. Psychiatr. Res. 37:525-533; D. R. Gehlert et al., Eur. J. Pharmacol. 509:145-153]. Была постулирована роль CRF в этиологии и патофизиологии болезни Альцгеймера, болезни Гентингтона, прогрессирующего супрануклеарного паралича и бокового амиотрофического склероза, так как эти заболевания связаны с дисфункцией CRF нейронов в центральной нервной системе [см. обзор: Е. В. De Souze, Hosp. Practice 23:59 (1988)]. Как было показано, постоянное введение CRF вызывает повреждение допаминной системы, что предполагает роль в болезни Паркинсона [Е. Izzo et al., Pharmacol. Biochem. Behav. 81:701-708 (2005)]. Другие неврологические расстройства, с которыми связан CRF, включают эпилепсию [Т. Z. Baram et al., Brain Res. 770:89-95 (1997)] и мигрень [Т. С. Theoharides et al., Endocrinology 136:5745-5750 (1995)]. CRF связан с алкоголизмом и сопутствующими абстинентными синдромами [D. H. Overstreet et al., Pharmacol.Biochem. Behav. 77:405-413; У. Shaham et al., Psychopharmacology (Berl) 137:184-190]. Более того, имеются данные, что CRF играет роль в различных эндокринных расстройствах и сердечно-сосудистых заболеваниях, таких как ожирение [Е. Timofeeva и D. Richard, Neuroendocrinology 66:327-340 (1997)], метаболический синдром [А. М. Ward et al., Metabolism 53:720-726(2004)], врожденная гиперплазия надпочечников [D. P. Merke и G. В. Cutler Jr., Endocrinol. Metab. Clin. North Am. 30:121-135 (2001)], заболевание Кущинга [M. Labeur et al., Curr. Drug Targets Immune Endocr. Metabol. Di3ord. 4:335-342 (2004)], гипертензия[R. J. Briscoe, et al., Brain Res. 881:204-207 (2000)] и нарушение мозгового кровообращения [S. L. Stevenset al., J. Cereb. Blood Flow Metab. 23:1151-1159 (2003)]. Как было показано, желудочные расстройства,такие как синдром раздраженной толстой кишки [Y. Tache et al., Eur J. Surg. Suppl: 16-22 (2002)] и вызванная стрессом язва желудка [К. Е. Gabry et al., Mol. Psychiatry 7:474-483, 433 (2002)], связаны с CRF. Кроме того, имеются данные, что CRF играет роль в различных сферах женского здоровья, например предменструальном синдроме [F. Facchinetti et al., Psychosom. Med. 56:418-422 (1994)], бесплодии [L.Physiol. Regul. Integr. Сотр. Physiol. 283:R591-597 (2002) и преждевременных родов [P. D. Wadhwa et al.,Am. J. Obstet. Gynecol. 191:1063-1069 (2004)]. Также существуют свидетельства, что CRF играет существенную роль в иммунной системе, что указывает на терапевтический потенциал для лечения воспалительных заболеваний [A. Gravanis и А. N. Margioris, Curr. Med. Chem. 12:1503-1512 (2005)], аллергии [L. К. Singh et. Al., Brain Behav. Immun. 13:225-239 (1999)], рассеянного склероза и других аутоиммунных расстройств [С. Benou et al., J.Immunol. 174:5407-5413 (2005)]. Помимо вышесказанного, CRF связан с болью в животе [М. Nijsen et al., Neurogastroenterol. Motil. 17:423-432 (2005)], нарушениями сна [Т. М.Buckley и А. F. Schatzberg, J. Clin. Endocrinol. Metab. 90:3106-3114(2005)], опухолями гипофиза или эктопическими вызванными гипофизом опухолями [К. D. Dieterich et al., J. Clin. Endocrinol. Metab. 83:33273331 (1998)], синдром хронической усталости и фибромиалгией [G. Neeck и L. J. Crofford, Rheum. Dis.Clin. North Am. 26:989-1002 (2000)]. Были идентифицированы подтипы CRF рецептора, CRF1 и CRF2, которые неоднородно распределены в пределах головного мозга [D. Т. Chalmers et al., TIPS 17:166-72 (1996)], и тем самым, как полагают, могут проявлять потенциальное функциональное разнообразие [S. С. Heinrichs et al., Regul. Peptides 71:15 (1997)]. Например, широко рассредоточенные CRF1 рецепторы головного мозга сильно связаны с эмоциональностью, сопровождающей воздействие факторов стресса, обусловленных окружающей средой [G. Liebsch et al., Regul. Peptides 59: 229-39 (1995); D. W. Schulz, PNAS 93: 10477-82 (1996)]. Существенно, CRF1, но не CRF2, рецепторы, кажется, обуславливают избранное анксиогенно-подобное поведение [Heinrichs et al., 1997]. Более дискретное распределение в септальной/гипоталамической области [D. Т. Chalmers et al., J. Neurosci. 15(10): 6340-50 (1995)] и наличие альтернативных эндогенных лигандов [J.Vaughan et al., Nature 378: 287-92 (1995)] предполагает другую функциональную роль CRF2 рецептора[Heinrichs et al., 1997]. Например, как сообщают, новое семейство CRF нейропептидов с предпочтительным сродством к CRF2 относительно CRF1 рецепторов, подавляет аппетит, не создавая профиль поведенческой активации, наблюдаемый при действии селективного CRF1 агониста (Н. Tezval et al., PNAS 101(25): 9468-9473 (2004)]. В других случаях воздействие CRF2 агониста вызывает эффекты, сходные сPharmacological Sciences 20(8):311-5 (1999)]. Например, хотя агонисты CRF2 были предложены в качестве препаратов против ожирения, CRF1 антагонисты также могут являться важным средством для лечения ожирения [С. Contoreggi et al., Neuroendocrinology 80(2):111-23 (2004)]. Получение соединений согласно изобретению Все соединения согласно настоящему изобретению могут быть получены химическим способом,например, с помощью методов синтеза, представленных ниже на схемах. Однако последующее обсуждение никоим образом не предполагает ограничить объем настоящего изобретения. Например, конкретные стадии синтеза каждого из описанных способов можно комбинировать по-разному, или сочетать со стадиями из других схем для получения дополнительных соединений формулы (I). Продукты каждой стадии можно выделить обычными способами, в том числе, экстракцией, испарением, осаждением, хроматографией, фильтрацией, растиранием в порошок, кристаллизацией и т.п. На схемах, представленных ниже,все заместители, если не указано иное, определены ранее, а подходящие реактивы хорошо известны и применяются в данной области. Схема 1 Получение соединения формулы (I) можно осуществить согласно реакциям, как показано на схеме 1. Подходящим соединением формулы (I) является соединение, в котором R1 , R2 , R3, R4 и R5 определены при описании соединения формулы I. На стадии 1 этилацетоацетат и 5-метил-2 Н-пиразол-3-иламин конденсируют с образованием 2,5 диметил-4H-пиразоло[1,5-а]пиримидин-7-она (1) при температуре рефлюкса уксусной кислоты. Затем пиразоло[1,5-а]пиримидин-7-он формулы (1) превращают в 7-хлор-2,5-диметил- пиразоло[1,5-а]пиримидин на стадии 2, применяя оксихлорид фосфора и диметиланилин в инертном растворителе, таком как толуол, при температуре рефлюкса растворителя. На схеме 1, стадия 3, реактив Гриньяра формулы (3) (X = Cl или Br) реагирует с хлоридом формулы(2) в инертном растворителе, таком как толуол, при температуре рефлюкса с получением 7-алкилпиразолопиримидина формулы (4). В качестве альтернативы 7-алкилпиразолопиримидин формулы (4) получают конденсированием дикетона с 5-метил-2 Н-пиразол-3-иламином, как показано на стадии 4. Реакцию проводят в этаноле, применяя каталитическое количество пиперидина, при температуре от 60 до 80 С(Novinson, Т., et. Al. J. Med. Chem. 1975, 18, 460). Когда R1 = H, получают смесь региоизомеров, например, когда R2 = пропил, которые разделяют после йодирования на стадии 5. Пиразолопиримидин формулы (4) функционализируют с образованием йод-пиразолопиримидина формулы (5) на стадии 5, применяя избыток N-йодсукцинимида в ацетонитриле. На схеме 1, стадия 6, йод-пиразолопиримидин формулы (5) реагирует с гетероциклическим галогенидом цинка (R3ZnX) (X = Cl или Br) в реакции кросс-сочетания Негиши. Гетероциклический галогенид цинка можно получить способами, хорошо известными специалистам в данной области. Например, цинкорганический реактив получают с помощью реакции гетероциклического бромида с металлическим цинком или, в качестве альтернативы, путем применения не-галогенированного гетероцикла с образованием гетероциклического реактива лития с н-, втор- или трет-бутиллитием, с последующим обменом литий-цинк с ZnCl2. Цинкорганический реактив соединяют с йодпиразолопиримидином формулы (5) в присутствии палладиевого катализатора, например, дихлор[1,1'-бис(дифенилфосфино)ферроцен] палладий (II) дихлорметана, в инертном растворителе, таком как ТГФ, при температуре рефлюкса в течение примерно 12-36 ч с получением пиразолопиримидина формулы (I). В качестве альтернативы, на стадии 7, применяют гетероциклическую бороновую кислоту(R3B(OH)2) в реакции сочетания Сузуки с соединением йода формулы (5). Для проведения процедуры сочетания существуют многочисленные реакционные условия, доступные опытному технику. При пред-5 016056 почтительных условиях применяют смесь растворителей толуол/этанол/2 М карбонат натрия с палладиевым катализатором, например, бис(три-трет-бутилфосфин)палладием(0), при температуре от 60 С до температуры орошения, в течение примерно 12-36 ч. Как легко можно видеть, гетероарильные бороновые кислоты можно получить способами, аналогичными способам, описанным в настоящем документе, применяя процедуры, хорошо известные в данной области. Например, тиофены и бензотиофены можно бромировать посредством N-бромсукцинимида и затем конвертировать в бороновую кислоту путем обмена галоген металл с помощью алкиллитиевого реактива, с последующей обработкой триметилборатом и гидролизом после обработки. Специалисту в данной области очевидно, что тиенопиридин, например, как в соединении формулы(Ic), легко получают путем превращения коммерчески доступного тиено[3,2-b]пиридин-7-ола в бромид, с последующим обменом галоген - металл, и гашением источником протонов, таким как метанол/вода. Последующее бромирование бромом в положении 3 с последующей реакцией сочетания Сузуки с метилбороновой кислотой позволяет получить 3-метилтиено[3,2-b]пиридин, который соединяют с йодпиразолопиримидином формулы (5), применяя ZnCl2, как описано выше. Схема 2 Получение соединения формулы (7), (8) или (9) можно осуществить согласно реакциям, как показано на схеме 2. Подходящим соединением формулы (7), (8) или (9) является соединение, в котором R1, R2 и R4 определены при описании соединения формулы I, и "Het" определен, как показано. На схеме 2, стадия 1, тиофен формулы (6) бромируют N-бромсукцинимидом в инертном растворителе, таком как дихлорметан или хлороформ. На стадии 2 бромтиофен формулы (7) соединяют с гетероциклическим реактивом цинка с получением гетероцикла тиофена формулы (8). Гетероциклический реактив цинка получается из бромгетероцикла и металлического цинка и реагирует in situ с бромтиофеном формулы (7). Реакцию проводят в инертном растворителе, таком как ТГФ, при температуре рефлюкса растворителя. В качестве альтернативы, гетероциклический реактив лития можно получить, например, путем применения н-, втор- или трет-бутиллития с 1-метил-1,2,4-триазолом, с последующим обменом литий - цинк с ZnCl2 и получением гетероциклического реактива цинка. На схеме 2, стадия 3, тиофен формулы (6) подвергают нитрованию с получением нитротиофена формулы (9). При предпочтительных условиях применяют смесь растворителей дихлорметана и ТФК(трифторуксусной кислоты) с 70% азотной кислотой. Специалисту в данной области очевидно, что нитротиофен формулы (9) может служить в качестве промежуточного соединения для дальнейшей функционализации. Например, нитрогруппу можно восстановить и ацилировать с получением с получением ацетамида или алкилировать с получением диалкиламина. Таким образом, очевидно, что стадии, необходимые для получения соединения формулы (8), можно осуществить в любом порядке, так что 2-гетероцикл тиофена можно получить способами, известными в данной области, и затем функционализировать в виде бромтиофена или тиофенилбороновой кислоты, а затем соединить с йод-пиразолопиримидином формулы (5). Схема 3 Получение соединения формулы (10) можно осуществить согласно реакциям, как показано на схеме-6 016056 3, Подходящим соединением формулы (10) является соединение, в котором R1, R2 и R4 определены при описании соединения формулы I и R5a = -OCH3, -OC(O)CH3, -СН 2 ОСН 3 или -CO2CH2CH3. Как можно видеть, бромтиофен формулы (7) представляет собой полезное промежуточное соединение, которое специалист в данной области легко может превратить в разнообразные замещенные тиофены. Например, образование тиенильного реактива Гриньяра с последующей обработкой кислородом(Hurd, С. D. и Kreuz, К. JACS 1950, 72, 5543) позволяет получить 2-гидрокситиофен, который ацилируют с получением ацетоксипроизводного. Указанный реактив Гриньяра можно также обработать электрофилом, таким как этилцианоформат, с получением этоксикарбонил-замещенного тиофена. Путем обмена галоген литий с применением н-, втор- или трет-бутиллития можно получить тиениллитиевый реактив,который затем может реагировать с электрофилами, такими как галоидные алкилы, например, йодметилметиловый эфир. Кроме того, обработка оксидом меди, йодидом натрия и метоксидом натрия позволяет получить 2-метокситиофен. В настоящем документе "ТСХ" обозначает тонкослойную хроматографию; "ВЭЖХ" обозначает высокоэффективную жидкостную хроматографию; "5" обозначает часть на миллион сдвига слабого поля относительно тетраметилсилана; "ТГФ" обозначает тетрагидрофуран; "EtOAc" обозначает этилацетат;"НОАс" обозначает уксусную кислоту; "МеОН" обозначает метанол; "DME" обозначает диметоксиэтан. Пример Без дальнейшего уточнения полагают, что специалист в данной области может, применяя предшествующее описание, применить настоящее изобретение на практике в его наиболее полном объеме. Для более детального описания изобретения предложены нижеследующие способы получения и примеры. Они являются только иллюстративными и ни в коей мере не ограничивают изобретение. Реактивы и исходные вещества являются легко доступными для обычного специалиста в данной области или могут быть без труда им синтезированы. В примерах 1-27 представлены типичные соединения и проиллюстрированы способы их получения. В примерах А-С описаны различные биологические анализы, которые можно применять для определения биологических свойств соединений согласно изобретению. Для специалистов, опытных в данной области, сразу же будут очевидными подходящие вариации процедур,описанных в этих примерах. Названия соединений согласно настоящему изобретению соответствуютChemDraw Ultra version 7.0.1. Приготовление 1. 2,5-Диметил-4 Н-пиразоло[1,5-а]пиримидин-7-он. К уксуснокислому раствору (500 мл) 5-метил-2 Н-пиразол-3-иламина (100 г, 0,95 моль) по каплям добавляют этилацетоацетат (128 г, 0,98 моль), поддерживая температуру при 25-28 С. Смесь нагревают при температуре рефлюкса в течение 10 ч и затем охлаждают до комнатной температуры. Реакционную массу добавляют к трет-бутилметиловому эфиру (5 л), охлажденному до 5 С, поддерживая температуру ниже 10 С. Перемешивают в течение 1 ч при 5 С и фильтруют. Образовавшееся вещество высушивают в течение ночи в вакууме с получением белого твердого вещества (158 г, 96%). Приготовление 2. 7-Хлор-2,5-диметилпиразоло[1,5-а]пиримидин. К суспензии 2,5-диметил-4 Н-пиразоло[1,5-а]пиримидин-7-она (10,0 г, 61,3 ммоль) в толуоле (150 мл) добавляют N,N-диметиланилин (9,7 мл, 76,7 ммоль). По каплям к этой белой суспензии добавляют оксихлорид фосфора (11,2 мл, 122,6 ммоль). Нагревают при температуре рефлюкса в течение 3 ч в инертной атмосфере, охлаждают до комнатной температуры и концентрируют реакцию при пониженном давлении до получения коричневого масла. Масло растворяют в этилацетате (250 мл) и повышают основность посредством 1 N NaOH. Основную водную фазу отделяют и экстрагируют дополнительным количеством этилацетата (2x100 мл). Органические фазы объединяют, высушивают над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении с получением коричневого твердого вещества. Вещество очищают способом флэш-хроматографии, элюируя смесью 80% гексан/20% (30% ТГФ/гексан) - 0% гексан/100% (30% ТГФ/гексан) при ступенчатом градиенте с 20% приращениями с получением светло-зеленого твердого вещества (6,65 г, 59%). ЭС/МС m/z (35Cl) 182,3 (М+1)+. Приготовление 3. 7-(1-Этилпропил)-2,5-диметилпиразоло[1,5-а]пиримидин. Высушенную в сушильном шкафу колбу, оборудованную дефлегматором, заполняют каталитическим количеством йода и Rieke магнием (1,0 М в ТГФ, 52 мл, 52 ммоль) в инертной атмосфере. Нагревают до 45 С и к реакции добавляют 3-бромпентан (5,3 мл, 42,9 ммоль). Инициируют резкие скачки температуры в качестве реакции Гриньяра. Реакционную массу перемешивают еще 4 ч при 50 С и охлаждают до комнатной температуры. Оставляют осаждаться металлический магний и через канюлю помещают реактив Гриньяра при избыточном давлении аргона в колбу, содержащую 7-хлор-2,5-диметилпиразоло[1,5-а]пиримидин (5,19 г, 28,6 ммоль) в безводном толуоле (50 мл). Нагревают до температуры рефлюкса в инертной атмосфере в течение 48 ч. Реакционную массу охлаждают до комнатной температуры и гасят водой. Реакционную массу разбавляют этилацетатом (150 мл) и добавляют воду (50 мл). Водную фазу отделяют и экстрагируют этилацетатом (75 мл). Органические фазы объединяют, высушивают над без-7 016056 водным сульфатом магния и концентрируют при пониженном давлении. Очищают способом флэшхроматографии, элюируя смесью 80% пентан/20% (30% ТГФ/пентан) - 0% пентан/100% (30% ТГФ/пентан) при ступенчатом градиенте с 20% приращениями, с получением желтого масла (2,59 г,42%). ЭС/МС m/z 218,1 (М+1)+. Следующие соединения получают, по существу, как описано в способе получения 3, применяя коммерчески доступный реактив Гриньяра или получая реактив Гриньяра, как описано выше. Приготовление 6. 7-Бутил-2,5-диметилпиразоло[1,5-а]пиримидин. 5-Метил-2 Н-пиразол-3-иламин (217 мг, 2,17 ммоль), нонан-2,4-дион (339 мг, 2,39 ммоль) и пиперидин (1 капля) добавляют к этанолу (10 мл) и нагревают при 80 С в течение ночи. Охлаждают до комнатной температуры и концентрируют до сухости. Очищают способом колоночной хроматографии на силикагеле (0-20% этилацетат в гексане) с получением смеси из двух изомеров (2 г). Приготовление 7. 7-(1-Этилпропил)-3-йод-2,5-диметилпиразоло[1,5-а]пиримидин. 7-(1-Этилпропил)-2,5-диметилпиразоло[1,5-а]пиримидин (2,14 г, 9,84 ммоль) растворяют в безводном ацетонитриле (25 мл) и добавляют 6 частей (0,5 г каждая) N-йодсукцинимида (3,0 г, 13,3 ммоль) с 10-минутными интервалами. Реакционную массу перемешивают в течение 4 ч. Удаляют ацетонитрил и образовавшееся масло разбавляют дихлорметаном (100 мл). Оранжевый раствор промывают насыщенным раствором хлорида аммония (250 мл). Собирают органическую фазу, высушивают над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении с получением темнокрасного масла. Очищают способом флэш-хроматографии, элюируя смесью 100% пентан/0% (20% этилацетат/пентан) - 0% пентан/100% (20% этилацетат/пентан) при ступенчатом градиенте с 50% приращениями с получением оранжевого масла (3,28 г, 97%). 1 Н ЯМР (400 МГц, CDCl3): 6,44 (с, 1 Н), 3,59 (м, 1 Н),2,61 (с, 3 Н), 2,49 (с, 3 Н), 1,86-1,76 (м, 4 Н), 0,85 (т, J=7,5 Гц, 6 Н). Следующие соединения получают, по существу, как описано в способе получения 7. Обработка: органическую фазу промывают водным раствором Na2S2O3. Реакцию проводят на смеси изомеров способа получения 6. Два изомера разделяют на силикагеле (0-20% EtOAc/гексан). Пример 1. 3-(3-Хлортиофен-2-ил)-7-(1-этилпропил)-2,5-диметилпиразоло[1,5-а]пиримидин.Reike цинк (5 г/100 мл ТГФ, 20 мл, 15,0 ммоль) суспендируют в безводном ТГФ (10 мл) и добавляют 2-бром-3-хлортиофен (1,98 г, 10,0 ммоль). Смесь нагревают при температуре рефлюкса на масля-8 016056 ной бане (85 С) в инертной атмосфере в течение 3 ч. Реакционную массу охлаждают до комнатной температуры и центрифугируют оставшийся металлический цинк. Раствор реактивов через канюлю переносят в новый сосуд при избыточном давлении аргона и добавляют 7-(1-этилпропил)-3-йод-2,5-диметилпиразоло[1,5-а]пиримидин (1,72 г, 5,0 ммоль). Раствор дегазируют избыточным давлением аргона, в течение 10-15 мин и добавляют дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладий (II) дихлорметан(0,225 г, 0,275 ммоль). Перемешивают при температуре рефлюкса в инертной атмосфере в течение ночи. Реакционную массу охлаждают до комнатной температуры, гасят насыщенным хлоридом аммония и разбавляют этилацетатом (75 мл). Водную часть отделяют и экстрагируют этилацетатом (50 мл), органические фазы объединяют, высушивают над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Образовавшийся остаток очищают способом флэш-хроматографии, элюируя смесью 100% гексан/0% (15% этилацетат/гексан) - 0% гексан/100% (15% этилацетат/гексан) при ступенчатом градиенте с 10% приращениями с получением желтого твердого вещества (1,35 г, 40%). ЭС/МС m/z (35Cl) 334,4 Пример 4. 3-(3-Метилтиофен-2-ил)-7-(1-этилпропил)-2,5-диметилпиразоло[1,5-а]пиримидин. Высушенную в сушильном шкафу колбу заполняют бромидом 3-метил-2-тиенилцинка (11,0 мл, 5,5 ммоль), безводным ТГФ (6,0 мл) и 7-(1-этилпропил)-3-йод-2,5-диметилпиразоло[1,5-а]пиримидином(0,536 г, 1,56 ммоль). Дегазируют в течение 10-15 мин избыточным давлением аргона и добавляют дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладий(II) дихлорметан (0,12 г, 0,15 ммоль). Нагревают при температуре рефлюкса на масляной бане (100 С) в инертной атмосфере в течение ночи. Реакционную массу охлаждают до комнатной температуры, гасят насыщенным хлоридом аммония и разбавляют этилацетатом (75 мл). Водную часть отделяют и экстрагируют этилацетатом (50 мл). Органические фазы объединяют, высушивают над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Образовавшийся остаток очищают способом флэш-хроматографии, элюируя смесью 100% пентан/0% (25% этилацетат/пентан) - 0% пентан/100% (25% этилацетат/пентан) при ступенчатом градиенте с 10% приращениями с получением белой пены. Растирают в порошок с гексаном и фильтруют. 3-(3-Хлортиофен-2-ил)-7-(1-этилпропил)-2,5-диметилпиразоло[1,5-а]пиримидин (1,16 г, 3,5 ммоль) растворяют в дихлорметане (15 мл) и добавляют N-бромсукцинимид в одну аликвоту (0,69 г, 3,85 ммоль). Перемешивают 2 ч в инертной атмосфере и подтверждают завершение реакции способом ТСХ. Реакционную массу разбавляют дихлорметаном (50 мл), промывают водой (75 мл), соляным раствором(50 мл), высушивают над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении с получением желтого твердого вещества (1,56 г, количественный выход). 1 Н ЯМР (400 МГц,ДМСО): 7,39 (с, 1 Н), 6,88 (с, 1 Н), 3,48-3,44 (м, 1 Н), 2,45 (с, 3 Н), 2,39 (с, 3 Н), 1,80-1,73 (м, 4 Н), 0,76 (т,J=7,0 Гц, 6 Н). Следующие соединения получают, по существу, как описано в примере 5.-9 016056 Очищают способом колоночной хроматографии, элюируя смесью гексан/этилацетат. Пример 9. 3-[3-Хлор-5-(2-метил-2H-[1,2,4]триазол-3-ил)тиофен-2-ил]-7-(1-этилпропил)-2,5-диметилпиразоло[1,5-а]пиримидин.Reike цинк (5 г/100 мл ТГФ, 5,5 мл, 4,2 ммоль) суспендируют в безводном ТГФ (5 мл) и добавляют 1-метил-5-бром-1,2,4-триазол (0,4 г, 2,5 ммоль). Нагревают при температуре рефлюкса в инертной атмосфере на масляной бане (85 С) в течение 3 ч. Реакционную массу охлаждают до комнатной температуры и центрифугируют оставшийся металлический цинк. Раствор реагентов через канюлю переносят в новый сосуд при избыточном давлении аргона и добавляют 3-(5-бром-3-хлортиофен-2-ил)-7-(1 этилпропил)-2,5-диметилпиразоло[1, 5-а] пиримидин (0,64 г, 1,45 ммоль). Раствор дегазируют избыточным давлением аргона в течение 10-15 мин и добавляют дихлор[1,1-бис(дифенилфосфино)ферроцен] палладий (II) дихлорметан (0,136 г, 0,167 ммоль). Нагревают при температуре рефлюкса в инертной атмосфере в течение ночи. Реакционную массу охлаждают до комнатной температуры, гасят насыщенным хлоридом аммония и разбавляют этилацетатом (75 мл). Водную часть отделяют и экстрагируют этилацетатом (50 мл). Органические фазы объединяют, высушивают над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Образовавшийся остаток очищают способом флэш-хроматографии, элюируя смесью 100% гексан/0% (30% ТГФ/гексан) - 0% гексан/100% (30% ТГФ/гексан) при ступенчатом градиенте с 10% приращениями, с получением желтого твердого вещества (0,298 г, 50%). ЭС/МС m/z (35Cl) 415,0 (М+1)+. Следующее соединение получают, по существу, как описано в примере 9, применяя коммерчески доступный бромид 6-метил-2-пиридилцинка. Пример 11. 3-(3-Хлор-5-метокситиофен-2-ил)-7-(1-этилпропил)-2,5-диметилпиразоло[1,5-а]пиримидин. Высушенную в сушильном шкафу колбу заполняют 3-(5-бром-3-хлортиофен-2-ил)-7-(1-этилпропил)-2,5-диметилпиразоло[1,5-а]пиримидином (0,46 г, 1,1 ммоль), оксидом меди (0,045 г, 0,56 ммоль),йодидом натрия (0,020 г, 0,11 ммоль), 25% раствором метоксид натрия/метанол (10 мл) и безводным метанолом (10 мл). Реакционную массу нагревают при температуре рефлюкса в инертной атмосфере на масляной бане (90 С) в течение субботы и воскресенья. Реакционную массу гасят ледяной водой и экстрагируют эфиром (3100 мл). Органические фазы объединяют, высушивают над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Образовавшийся остаток очищают способом флэш-хроматографии, элюируя смесью 100% гексан/0% (35% этилацетат/гексан) - 0% гексан/100% (35% этилацетат/гексан) при ступенчатом градиенте с 10% приращениями, с получением белой пены (0,086 г, 21%). ЭС/МС m/z (35Cl) 363,7 (М+1)+. Пример 12. 4-Хлор-5-[7-(1-этилпропил)-2,5-диметилпиразоло[1,5-а]пиримидин-3-иловый] эфир уксусной кислоты. Изопропилбромид (0,25 мл, 2,7 ммоль) добавляют к суспензии 3-(5-бром-3-хлортиофен-2-ил)-7-(1 этил-пропил)-2,5-диметил-пиразоло [1, 5-а] пиримидина (0,74, 1,8 ммоль) в Reike магнии (1,0 М в ТГФ,2,7 мл, 2,7 ммоль) и безводном ТГФ (3 мл). Нагревают при температуре рефлюкса в инертной атмосфере в течение 1 ч и реакционную массу охлаждают до комнатной температуры. В экзотермическую реакцию при избыточном давлении при комнатной температуре барботируют кислород в течение 90 мин. Реакционную массу гасят насыщенным хлоридом аммония (30 мл), экстрагируют этилацетатом (2100 мл) и концентрируют при пониженном давлении. Масло растворяют в эфире (150 мл), промывают 0,1 N гидроксидом натрия (375 мл) и основную водную фазу повторно экстрагируют эфиром (50 мл). Водную фазу подкисляют насыщенным хлоридом аммония и экстрагируют дихлорметаном (475 мл). Порции дихлорметана объединяют, высушивают над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Неочищенное масло (0,138 г, 0,3 9 ммоль) растворяют в дихлорметане (2 мл) с триэтиламином (0,23 мл, 1,6 ммоль) и ацетилхлоридом (0,034 мл, 0,47 ммоль). Перемешивают в инертной атмосфере в течение 1 ч, разбавляют дихлорметаном (50 мл) и промывают водой (50 мл). Органическую фазу высушивают над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Образовавшийся остаток очищают способом флэш-хроматографии, элюируя смесью 100%- 10016056 гексан/0% (25% этилацетат/гексан) - 0% гексан/100% (25% этилацетат/гексан) при ступенчатом градиенте с 10% приращениями, с получением белой пены (0,084 г, 21%). ЭС/МС m/z (35Cl) 392,0 (М+1)+. Пример 13. 3-(3-Хлор-5-метоксиметилтиофен-2-ил)-7-(1-этилпропил)-2,5-диметилпиразоло [1,5 а]пиримидин. Высушенную в сушильном шкафу колбу заполняют 3-(5-бром-3-хлортиофен-2-ил)-7-(1-этилпропил)-2,5-диметилпиразоло[1,5-а]пиримидином ( 0,41, 1,0 ммоль) и безводным ТГФ (5 мл). Охлаждают до-70 С в инертной атмосфере и добавляют н-бутиллитий (2,5 М раствор гексана, 0,42 мл, 1,05 ммоль). Желтая реакция становится темно-красной. Добавляют йодметилметиловый эфир (0,09 мл, 1,10 ммоль) и оставляют реакционную массу нагреваться до комнатной температуры. Реакционную смесь разбавляют этилацетатом (100 мл), промывают водой (75 мл) и соляным раствором (75 мл). Органическую часть высушивают над безводным сульфатом магния и концентрируют при пониженном давлении до получения оранжевого масла. Образовавшийся остаток очищают способом флэш-хроматографии, элюируя смесью 100% гексан/0% (20% этилацетат/гексан) - 0% гексан/100% (20% этилацетат/гексан) при ступенчатом градиенте с 10% приращениями, с получением желтого твердого вещества (0,107 г, 28%). ЭС/МС m/z(0,62 г, 1,5 ммоль) в безводном ТГФ (5 мл) охлаждают до 0 С в инертной атмосфере и добавляют хлорид этилмагния (2 М раствор ТГФ, 0,83 мл, 1,65 ммоль). Реакционную массу перемешивают в течение 5 мин,нагревают до комнатной температуры и перемешивают еще 15 мин перед понижением температур реакции до 0 С. Добавляют этилцианоформат (0,16 мл, 1,58 ммоль), разбавленный в безводном ТГФ (1 мл). Реакционную массу нагревают до комнатной температуры и перемешивают 1 ч. Реакционную массу гасят насыщенным бикарбонатом натрия (20 мл) и экстрагируют эфиром (275 мл). Органические фазы объединяют, высушивают над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Очищают способом флэш-хроматографии, элюируя смесью 100% гексан/0% (20% этилацетат/гексан) - 0% гексан/100% (20% этилацетат/гексан) при ступенчатом градиенте с 10% приращениями. Образовавшееся вещество высушивают в вакууме с получением белого твердого вещества (0,114 г, 19%). ЭС/МС m/z (35Cl) 406,3 (М+1)+. Приготовление 11. 2-(5-Бром-4-метилтиофен-2-ил)-6-метилпиридин. 2,0 М Литий диизопропиламид (9,76 мл, 19,52 ммоль) добавляют к охлажденному до -78 С раствору 2-бром-3-метилтиофена (2,0 мл, 17,75 ммоль) и ТГФ (30 мл). Через 45 мин добавляют ZnCl2 (0,5 М в ТГФ, 39,0 мл, 19,50 ммоль) и перемешивают раствор в течение 30 мин. Добавляют 2-бром-6-метилпиридин (2,4 мл, 21,29 ммоль) и Pd(PPh3)4 (0,50 г, 0,44 ммоль). Раствор нагревают до температуры окружающей среды и перемешивают в течение 2 ч. Реакционную массу промывают насыщенным растворомNH4Cl (20 мл). Водную фазу промывают CH2Cl2 (30 мл). Органические фазы объединяют, промывают насыщенным раствором NH4Cl (20 мл), высушивают над Na2SO4, фильтруют и концентрируют. Образовавшийся остаток очищают способом колоночной хроматографии с силикагелем (градиент 10%-20%EtOAc/гексан) с получением вышеназванного соединения (2,34 г, 49%). ЖХ-ЭС/МС m/z (79Br/81Br) 267,7/269, 5 (М+Н)+. Приготовление 12. 3-Метил-5-(6-метилпиридин-2-ил)-тиофен-2-бороновая кислота. 2-(5-Бром-4-метилтиофен-2-ил)-6-метилпиридин (37,6 г, 0,14 моль) и триизопропилборат (34,2 г,0,182 моль, 42,3 мл) растворяют в толуоле (100 мл) и ТГФ (160 мл) в атмосфере азота. Раствор охлаждают до -40 С. Медленно через воронку в течение 40 мин добавляют н-бутиллитий (2,5 М в гексане, 70 мл,0,175 моль). Температура внутри раствора изменялась от -40 до -35 С. После завершения добавления смесь перемешивают при -40 С в течение 2 ч. Реакционную массу нагревают до 0 С и добавляют ТГФ(40 мл) и затем 2 N водный HCl (120 мл) с образованием белого твердого вещества. Добавляют 1 N NaOH до рН 7 и растворяют все соли. Органическую фазу отделяют, а водную фазу экстрагируют диэтиловым эфиром (3). Органические фазы объединяют, высушивают над MgSO4, фильтруют и концентрируют. К остатку добавляют ТГФ и затем гексан. Фильтруют образовавшийся желтый осадок и повторяют стадию осаждения несколько раз с получением вышеназванного соединения (19,7 г, 60%). 1 Н ЯМР (CD3OD):2,47 (ушир.с, 3 Н), 2,61 (с, 3 Н), 7,20 (д, J=7,7 Гц, 1 Н), 7,60 (ушир.с, 1 Н), 7,64 (ушир.д, J=7,7 Гц, 1 Н), 7,75- 11016056 Высушенную в сушильном шкафу колбу заполняют 2-(5-бороновая кислота-4-метилтиофен-2-ил)-6 метил-пиридином (0,29 г, 1,24 ммоль), безводным толуолом (4 мл), абсолютным этанолом (1 мл), 2 М карбонатом натрия (1,1 мл, 2,2 ммоль) и 7-(1-этилпропил)-3-йод-2,5-диметилпиразоло[1,5-а]пиримидином (0,25 г, 0,73 ммоль). Смесь дегазируют в течение 30 мин избыточным давлением аргона и добавляют бис(три-трет-бутилфосфин) палладий (0) (0,10 г, 0,086 ммоль). Реакционную массу нагревают при температуре рефлюкса в течение ночи на масляной бане (100 С) в инертной атмосфере. Реакционную массу охлаждают до комнатной температуры и разбавляют этилацетатом (75 мл) и водой (25 мл). Водную часть отделяют и экстрагируют этилацетатом (50 мл). Органические фазы объединяют, высушивают над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Образовавшийся остаток очищают способом флэш-хроматографии, элюируя смесью 100% гексан/0% (25% этилацетат/гексан) - 0% гексан/100% (25% этилацетат/гексан) при ступенчатом градиенте с 10% приращениями с получением грязно-белой пены (0,215 г, 73%). ЭС/МС m/z 405,4 (М+1)+. Приготовление 13. 7-Бром-тиено[3,2-b]пиридин. Тиено[3,2-b]пиридин-7-ол (5,00 г, 33 ммоль) и оксибромид фосфора (50 г, 174 ммоль) нагревают вместе при 110 С в течение 3 ч. Выливают горячую реакционную смесь в смесь льда и 5N NaOH и экстрагируют CH2Cl2. Органическую фазу высушивают над Na2SO4 и испаряют. Образовавшееся неочищенное вещество очищают, применяя хроматографическую колонку с силикагелем (гексан:EtOAC = 3:1), с получением вышеназванного соединения (4,19 г, 59%). ЭС/МС m/z (81Br) 215 (М+). Приготовление 14. Тиено[3,2-b]пиридин. 7-Бром-тиено[3,2-b]пиридин (3,69 г, 17 ммоль) растворяют в сухом ТГФ (20 мл) и охлаждают до-78 С. К смеси при -78 С медленно добавляют н-BuLi (1,6 М в гексане, 21,2 мл, 34 ммоль) и перемешивают при -78 С в течение 20 мин. Добавляют МеОН/H2O=1/1 (20 мл) и перемешивают при комнатной температуре в течение 1 ч. Реакционную смесь экстрагируют CH2Cl2. Органическую фазу промывают насыщенным раствором NaCl, высушивают над Na2SO4 и испаряют. Образовавшийся остаток очищают методом хроматографии на силикагеле, элюируя смесью 100% гексан гексан:этилацетат = 10:1, с получением вышеназванного соединения (1,44 г, 62%). ЭС/МС m/z 136 (М+1)+. Приготовление 15. 3-Бромтиено[3,2-b]пиридин. Смешивают тиено[3,2-b]пиридин (3,45 г, 25,6 ммоль), натрия бикарбонат (2,15 г, 25,6 ммоль),K2HPO4 (6,69 г, 38,4 ммоль) и MgSO4 (4,01 г, 33,3 ммоль) в CHCl3 (60 мл). Смесь перемешивают при температуре рефлюкса и медленно добавляют Br2 (1,57 мл, 30,7 ммоль). Реакционную массу перемешивают при температуре рефлюкса в течение ночи. Добавляют дополнительное количество брома (0,7 мл) и перемешивают реакционную массу при температуре рефлюкса в течение 4 ч. Охлаждают до комнатной температуры, добавляют воду и экстрагируют CHCl3. Органическую фазу промывают насыщенным раствором Na2S2O3 и насыщенным соляным раствором. Высушивают над Na2SO4 и испаряют. Вещество перекристаллизовывают из смеси гексан/CH2Cl2 с получением вышеназванного соединения (3,94 г, 72%). ЭС/МС m/z (81Br) 215 (М+). Приготовление 16. 3-Метилтиено[3,2-b]пиридин. Подготавливают три реакционные пробирки, которые можно применять в СВЧ-печи, содержащие 3-бром-тиено[3,2-b]пиридин (214 мг, 1,0 ммоль) и метилбороновую кислоту (180 мг, 3,0 ммоль) в смеси ДМЭ (диметоксиэтан)/вода/ EtOH = 7/3/1 (4 мл). Добавляют 2 М Na2CO3 (1,5 мл, 3,0 ммоль) и барботируют атмосфере азота в течение 15 мин. Добавляют Pd(PPh3)4 (58 мг, 0,05 ммоль) и запаивают пробирки. Пробирки нагревают при 130 С в течение 30 мин в СВЧ-печи. Объединяют все реакционные смеси, добавляют воду и CH2Cl2 и экстрагируют. ФазуCH2Cl2 отделяют, высушивают над Na2SO4, фильтруют и испаряют. Образовавшееся вещество очищают методом хроматографии на силикагеле, элюируя смесью гексан:этилацетат:2 М NH3 в МеОН = 20:4:1, с получением вышеназванного соединения (193 мг, 43%. ЭС/МС m/z 150 (М+1)+. Пример 16. 7-(1-Этилпропил)-2,5-диметил-3-(3-метилтиено[3,2-b]пиридин-2-ил)пиразоло[1,5-а]пиримидин. Высушенную в сушильном шкафу колбу Щренка заполняют 3-метилтиено[3,2-b]пиридином (0,213 г, 1,42 ммоль) и безводным ТГФ (5 мл) и охлаждают до -78 С в инертной атмосфере. Добавляют нбутиллитий (2,5 М гексан, 0,72 мл, 1,78 ммоль) и перемешивают при пониженной температуре в течение 30 мин. Добавляют безводный хлорид цинка в одну аликвоту (0,58 г, 4,26 ммоль) и перемешивают 15 мин при пониженной температуре. Реакционную массу оставляют нагреваться до комнатной температуры и перемешивают еще 30 мин. Реакционную массу разбавляют безводным ТГФ (5 мл) и добавляют 7(1-этилпропил)-3-йод-2,5-диметилпиразоло[1,5-а]пиримидин (0,406 г, 0,08 ммоль). Дегазируют 15 мин- 12016056 избыточным давлением аргона и добавляют дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладий(II) дихлорметан (0,093 г, 0,114 ммоль). Реакционную массу нагревают при температуре рефлюкса в течение ночи на масляной бане (90 С) в инертной атмосфере. Реакционную массу охлаждают до комнатной температуры, гасят насыщенным хлоридом аммония и разбавляют этилацетатом (75 мл). Водную часть отделяют и экстрагируют этилацетатом (50 мл). Органические фазы объединяют, высушивают над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Очищают способом флэш-хроматографии, элюируя смесью 100% гексан/0% (15% этилацетат/гексан) - 0% гексан/100% (15% этилацетат/гексан) при ступенчатом градиенте с 10% приращениями, с получением белой пены (0,059 г,14%). ЭС/МС m/z 365,0 (М+1)+. Пример 17. 3-[3-Метил-5-(2-метил-2H-[1,2,4]триазол-3-ил)тиофен-2-ил]-7-(1-этилпропил)-2,5-диметилпиразоло[1,5-а]пиримидин. Высушенную в сушильном шкафу колбу заполняют 1-метил-1,2,4-триазолом (0,320, 3,81 ммоль),безводным ТГФ (10 мл) и охлаждают до -78 С в инертной атмосфере. Добавляют н-бутиллитий (2,5 М гексан, 1,52 мл, 3,81 ммоль) и перемешивают при пониженной температуре в течение 30 мин. Добавляют безводный хлорид цинка (1,06 г, 7,75 ммоль) в одну аликвоту и перемешивают 15 мин при пониженной температуре. Реакционную массу оставляют нагреваться до комнатной температуры и перемешивают еще 30 мин. К реакции добавляют 3-(5-бром-3-метилтиофен-2-ил)-7-(1-этилпропил)-2,5-диметилпиразоло[1,5-а]пиримидин (0,50 г, 1,27 ммоль) в безводном ТГФ (5 мл). Дегазируют в течение 15 мин избыточным давлением аргона и добавляют дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладий (II) дихлорметан (0,147 г, 0,127 ммоль). Реакционную массу нагревают при температуре рефлюкса в течение ночи на масляной бане (90 С) в инертной атмосфере. Реакционную массу охлаждают до комнатной температуры, гасят насыщенным хлоридом аммония и разбавляют этилацетатом (75 мл). Водную часть отделяют и экстрагируют этилацетатом (50 мл). Органические фазы объединяют, высушивают над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Очищают способом флэш-хроматографии, элюируя смесью 100% гексан/0% (40% ТГФ/гексан) - 0% гексан/100% (40% ТГФ/гексан) при ступенчатом градиенте с 10% приращениями. Образовавшееся вещество растирают в порошок со смесью гексан/эфир (3:1) с получением белого твердого вещества (0,371 г, 74%). ЭС/МС m/z 395,0 (М+1)+. Пример 18. 3-(5-Нитро-3-метилтиофен-2-ил)-7-(1-этилпропил)-2,5-диметилпиразоло[1,5-а]пиримидин. 3-(3-Метилтиофен-2-ил)-7-(1-этилпропил)-2,5-диметилпиразоло[1,5-а]пиримидин (0,419 г, 1,33 ммоль) растворяют в дихлорметане (2,5 мл), перемешивают в инертной атмосфере, охлаждают на ледяной бане до 0 С и добавляют трифторуксусную кислоту (5 мл). К реакции по каплям добавляют концентрированную (70%) азотную кислоту (0,132 г, 1,47 ммоль). Цвет раствора изменяется от желтого до темно-зеленого. Перемешивают 1 ч в инертной атмосфере на ледяной бане и подтверждают завершение реакции способом ТСХ. Реакционную массу разбавляют дихлорметаном (80 мл) и гасят насыщенным бикарбонатом натрия. Водную основную фазу отделяют и экстрагируют дихлорметаном (50 мл). Органические фазы объединяют, высушивают над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Образовавшийся остаток очищают способом флэщ-хроматографии, элюируя смесью 100% гексан/0% (30% этилацетат/гексан) - 0% гексан/100% (30% этилацетат/гексан) при ступенчатом градиенте с 10% приращениями, с получением желтого твердого вещества (0,363 г, 76%). 1 Н ЯМР(400 МГц, CDCl3):7,81 (с, 1 Н), 6,51 (с,1 Н), 3,62-3,58 (м, 1 Н), 2,56 (с, 3 Н), 2,48 (с, 3 Н), 2,18 (с, 3 Н), 1,881,70 (м, 4 Н), 0,88 (т, J=7,5 Гц, 6 Н). Пример 19. N-5-[7-(1-Этилпропил)-2,5-диметилпиразоло[1,5-а]пиримидин-3-ил]-4-метилтиофен-2 илацетамид. 3-(5-Нитро-3-метилтиофен-2-ил)-7-(1-этилпропил)-2,5-диметилпиразоло[1,5-а]пиримидин (0,33 г,0,92 ммоль) растворяют в ТГФ (10 мл) с применением 10% палладия на углероде (0,10 г), дегазируют в вакууме/потоком водорода (3) и перемешивают в атмосфере водорода (55 psi) при комнатной температуре в течение 3 ч. Завершение реакции подтверждают способом ТСХ. Реакционную массу разбавляют ТГФ (50 мл) и фильтруют через слой диатомовой земли с последующим концентрированием до получения неочищенного оранжевого масла (0,328 г). Масло растворяют в дихлорметане (4 мл) и 1,0 М NaOH(1 мл). К реакции добавляют ацетилхлорид (0,038 мл, 0,52 ммоль) и перемешивают в запаянном реакционном сосуде при комнатной температуре в течение субботы и воскресенья. Реакционную массу разбавляют дихлорметаном (100 мл) и промывают водой. Органическую фазу собирают, высушивают над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении до получения красного масла. Масло очищают способом флэш-хроматографии, элюируя смесью 100% гексан/0% (15% этилацетат/10% 7 N аммонизированный метанол/75% гексан) - 0% гексан/100% (15% этилацетат/10% 7 N аммонизированный метанол/75% гексан) при ступенчатом градиенте с 10% приращениями, с получением коричневой пены (0,048 г, 26%). ЭС/МС m/z 371,0 (М+1)+. Пример 20. 3-[3-Хлор-5-(2-метил-2H-[1,2,4]триазол-3-ил)тиофен-2-ил]-7-(1-пропилбутил)-2,5 диметилпиразоло[1,5-а]пиримидин. Высушенную в сушильном шкафу колбу заполняют 1-метил-1,2,4-триазолом (0,120, 1,43 ммоль) и безводным ТГФ (5 мл) и охлаждают до -78 С в инертной атмосфере. Добавляют н-бутиллитий (2,5 М гексан, 0,60 мл, 1,43 ммоль) и перемешивают при пониженной температуре в течение 30 мин. Добавляют безводный хлорид цинка (0,400 г, 2,90 ммоль) в одну аликвоту и перемешивают 15 мин при пониженной температуре. Реакционную массу оставляют нагреваться до комнатной температуры и перемешивают еще 30 мин. К реакции добавляют 3-(5-бром-3-хлортиофен-2-ил)-7-(1-пропилбутил)-2,5-диметилпиразоло[1,5 а] пиримидин (0,500 г, 1,27 ммоль) в безводном ТГФ (5 мл). Дегазируют 15 мин избыточным давлением аргона и добавляют тетракис(трифенилфосфин) палладий(0) (0,060 г, 0,052 ммоль). Нагревают при температуре рефлюкса в течение ночи на масляной бане (90 С) в инертной атмосфере. Реакционную массу охлаждают до комнатной температуры, гасят насыщенным хлоридом аммония и разбавляют этилацетатом (75 мл). Водную фазу отделяют и экстрагируют этилацетатом (50 мл). Органические фазы объединяют, высушивают над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Образовавшийся остаток очищают способом флэш-хроматографии, элюируя смесью 100% гексан/0% (25% ТГФ/гексан) - 0% гексан/100% (25% ТГФ/гексан) при ступенчатом градиенте с 20% приращениями, с получением желтого твердого вещества (0,140 г, 66%). ЭС/МС m/z (35Cl) 441,7 (М+1)+. Следующее соединение получают по существу, как описано в примере 20. Приготовление 17. 2-Бром-5-фтор-3-метилбензо[b]тиофен. Раствор 5-фтор-3-метилбензо[b]тиофена (50,32 г, 0,303 моль) в ацетонитриле (350 мл) обрабатывают при механическом перемешивании N-бромсукцинимидом (56,32 г, 0,318 моль, 1,05 эк.). Начальный эндотерм понижает температуру реакции до 17 С. Затем последующий эндотерм увеличивает температуру реакции до 40 С в течение 10-минутного периода, во время которого реакционную массу охлаждают до 18-20 С путем применения водяной бани со льдом. Реакционную массу перемешивают при комнатной температуре в течение еще 35 мин и образовавшуюся суспензию медленно разбавляют водой(350 мл). Суспензию перемешивают в течение 10 мин. Продукт фильтруют, промывая смесью 50:50 ацетонитрил:вода (100 мл) и высушивают с образованием бесцветного кристаллического твердого вещества Высушенную в сушильном щкафу колбу заполняют 2-бром-5-фтор-3-метилбензо[b]тиофеном(0,490, 2,00 ммоль) и безводным ТГФ (5 мл) и охлаждают до -50 С в инертной атмосфере. Добавляют по каплям н-бутиллитий (2,5 М гексан, 0,80 мл, 2,0 ммоль) в одну аликвоту и перемешивают 30 мин. Добавляют безводный хлорид цинка (0,550 г, 4,00 ммоль) и перемешивают 30 мин при пониженной температуре. Реакционную массу оставляют нагреваться до комнатной температуры и перемешивают еще 30 мин. Добавляют 7-изопропил-3-йод-2,5-диметил-пиразоло[1,5 а] пиримидин (0,316 г, 1,00 ммоль) в безводном ТГФ (5 мл). Дегазируют 15 мин избыточным давлением аргона и добавляют дихлор[1,1'-бис(дифенилфосфино) ферроцен] палладий (II) дихлорметан (0,082 г, 0,1 ммоль). Нагревают при температуре рефлюкса в течение ночи на масляной бане (90 С) в инертной атмосфере. Реакционную массу охлаждают до комнатной температуры, гасят насыщенным хлоридом аммония и разбавляют этилацетатом (75 мл). Водную часть отделяют и экстрагируют этилацетатом (50 мл). Органические фазы объединяют, высушивают над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Образовавшийся остаток очищают способом флэш-хроматографии, элюируя смесью 100% гексан/0% (20%- 14016056 этилацетат/гексан) - 0% гексан/100% (20% этилацетат/гексан) при ступенчатом градиенте с 20% приращениями, с получением грязно-белой пены (0,206 г, 58%). ЭС/МС m/z 354,0 (М+1)+. Следующие соединения получают по существу, как описано в примере 22. Приготовление 18. Бороновая кислота, 5-фтор-3-метилбензо[b]тиофен-2-ил. В сухой колбе смешивают 5-фтор-3-метилбензо[b]тиофен (312 мг, 1,88 ммоль) с сухим ТГФ (4 мл). Охлаждают до -78 С и добавляют н-бутиллитий (1,6 N в гексане, 1,18 мл, 1,90 ммоль). Перемешивают 1,5 ч при -78 С и затем добавляют триметилборат (0,23 мл, 2,02 ммоль). Перемешивают 3 ч и оставляют баню нагреваться до -20 С. Добавляют 5N соляную кислоту до тех пор, пока реакция не станет кислой(рН = 4). Разбавляют водой и экстрагируют этилацетатом (3). Органические фазы смешивают, высушивают над сульфатом натрия, фильтруют и испаряют. Растирают в порошок в метиленхлориде с получением белого твердого вещества (258 мг, 65%). ЭС/МС m/z 209 (М-1)-. Пример 25. 7-Бутил-3-(5-фтор-3-метилбензо[b]тиофен-2-ил)-2,5-диметилпиразоло[1,5-а]пиримидин. Тетракис(трифенилфосфин)палладий (0) (31 мг, 0,03 ммоль) и 7-бутил-3-йод-2,5-диметилпиразоло[1,5-а]пиримидин (174 мг, 0,53 ммоль) добавляют к дегазированному безводному ТГФ (10 мл). Смесь перемешивают в течение 10 мин. Добавляют 2-бороновую кислоту-5-фтор-3-метил-бензо[b]тиофен (111 мг, 0,53 ммоль) и водный раствор карбоната натрия (112 мг, 1,06 ммоль в 5 мл воды). Смесь нагревают до 70 С в течение 24 ч. Охлаждают до комнатной температуры. Разбавляют эфиром, затем промывают водой и соляным раствором. Органическую фазу высушивают над сульфатом магния, фильтруют и концентрируют. Остаток очищают способом ВЭЖХ, элюируя смесью ацетонитрил/вода/ТФК с получением вышеназванного соединения (55 мг, 28%). ЭС/МС m/z 368 (М+1)+. Приготовление 19. 4-Хлор-тиофен-2-карбонитрил. 22-л реакционную колбу оборудуют охлаждающей ванной, воздушной мешалкой, газовой трубкой и температурным датчиком. Колбу очищают азотом, затем заполняют AlCl3 (1025 г, 7,69 молей) и CHCl3(6,6 л, 16,5 об.). Смесь охлаждают до 0-5 С и по каплям через воронку добавляют 2-тиофенкарбонитрил(400 г, 3,66 моля) в течение 10-15 мин, поддерживая температуру при 10 С. В нижний слой смеси вводят газообразный Cl2 (300 г, 4,23 моля, 1,16 эк.) при 10 С в течение 1,25 ч. Протекание реакции контролируют способом газовой хроматографии (ГХ). Аликвоту реакционной смеси гасят в 6N HCl, экстрагируют EtOAc, высушивают над Na2SO4, фильтруют и вводят фильтрат. Когда реакция согласно данным ГХ анализа завершается (считают, что реакция завершена, когда соотношение (исходное вещество:продукт:дихлорсодержащее вещество) составляет приблизительно(1:5,8:1) по площади, %, ГХ пиков), по каплям через воронку добавляют 6 N HCl (8,0 л) в течение 1,5 ч,поддерживая температуру при 20 С. Добавление HCl является чрезвычайно экзотермическим и вызывает выделение газа. Реакционную массу переносят в делительную воронку и фазы разделяют. Водную фазу экстрагируют CHCl3 (4,0 л), фазы с хлороформом объединяют и промывают водой (6,0 л). Органическую фазу высушивают над Na2SO4, фильтруют и концентрируют в вакууме с получением бледножелтого полутвердого вещества (575 г, 109%). ГХ (температурный градиент 60-280 С) Анализ площадей в % показывает приблизительно 68% продукта (tret =6,5 мин), при этом основными примесями являются непрореагировавшее исходное вещество (tret = 5,1 мин) и дихлорсодержащий продукт (tret = 7,4 мин). Способ ГХ: колонка: DB1; Тввода = 300 С ; Тнач. = 60 С, t = 2,0 мин; Ткон. = 280 С, скорость = 18 С /мин. Приготовление 20. 4-Хлор-2-тиофен карбоксамид. 22-л реакционную колбу оборудуют охлаждающей ванной, воздушной мешалкой и температурным датчиком и заполняют KOH (288,6 г, 5,143 молей) и водой (6,04 л) с образованием раствора, который проявляет экзотермический эффект до примерно 31 С. Раствор оставляют охлаждаться до примерно 28 С и добавляют в смесь 4-хлор-2-тиофен карбонитрил (671,3 г, 4,675 моля) (небольшое количество твердых веществ не растворяется). Добавляют EtOH (675 мл), во время добавления происходит постепенное экзотермическое выделение тепла, которое продолжается в течение 1-1,5 ч, при этом температура достигает примерно 38 С. Реакционную массу перемешивают при температуре окружающей среды в течение ночи. Реакционную смесь фильтруют в вакууме, промывают водой и высушивают с получением неочищенного продукта. Твердое вещество растворяют в EtOAc (10,0 л), обрабатывают Na2SO4 и активированным древесным углем в течение 1-2 ч, затем фильтруют и промывают EtOAc. Фильтрат концентрируют в роторном испарителе при 45 С до тех пор, пока твердое вещество не начнет осаждаться. Отключают вакуум и увеличивают температуру до 60-65 С для повторного растворения твердого вещества. При перемешивании при 60 С медленно добавляют гептан (3,5 л) для осаждения твердого вещества. Перемешивают в течение 15-20 мин при 60 С, затем смесь охлаждают до 30-40 С и фильтруют. Твердое- 15016056 вещество промывают гептаном (20,75 л) и высушивают с получением вышеназванного соединения в виде белого твердого вещества (235,4 г, 31%). Из фильтрата получают вторую порцию (67,8 г, 9%). Приготовление 21. 4-Хлор-N-диметиламинометилен-2-тиофен карбоксамид. 5-л реакционную колбу оборудуют колбонагревателем, воздушной мешалкой, аппаратом ДинСтарка и температурным датчиком. Заполняют 4-хлор-2-тиофенкарбоксамидом (300 г, 1,856 моль) и диметилформамид диметилацеталом (872 мл) для образования суспензии. Смесь постепенно нагревают до 96 С, собирая дистиллят (главным образом, МеОН). Удаляют колбонагреватель и охлаждают до 25 С. Через воронку добавляют воду (3,0 л) и поддерживают температуру при 35 С. Реакционную смесь экстрагируют EtOAc (3,0 л, 1,5 л). Органические фазы объединяют и промывают водой (1,5 л). Органическую фазу высушивают над Na2SO4, фильтруют и концентрируют в вакууме с получением неочищенного продукта (400 г). Вещество растворяют в EtOAc (320 мл, 0,8 об.) при 50-60 С. Медленно добавляют гептан (1700 мл,4,25 об.), постепенно увеличивая температуру до 70 С. К мутному раствору добавляют затравочный кристалл для инициации осаждения. Образовавшуюся смесь перемешивают при комнатной температуре в течение ночи, затем фильтруют и промывают гептаном. Твердое вещество высушивают с получением вышеназванного соединения в виде белого твердого вещества (329,8 г, 82%). Приготовление 22. 5-(4-Хлортиофен-2-ил)-1-метил-1H-[1,2,4] триазол. 3-л реакционную колбу оборудуют охлаждающей баней, воздушной мешалкой и температурным датчиком и заполняют 4-хлор-N-диметиламинометилен-2-тиофен-карбоксамидом (155 г, 0,715 моль) и НОАс (1500 мл) с образованием раствора. С помощью водяной охлаждающей бани со льдом поддерживают температуру при 30 С, по каплям через воронку добавляют метилгидразин (33,2 г, 0,721 моль) в течение 15-20 мин с образованием светло-желтой суспензии. Реакционную массу постепенно нагревают до 90 С и выдерживают при 90 С в течение 30 мин. Смесь анализируют способом ГХ, затем реакционную массу охлаждают до примерно 70 С и концентрируют до получения вязкого масла/суспензии. Медленно добавляют воду (1,67 л) для осаждения твердого вещества, смесь охлаждают до 30 С, фильтруют и промывают водой (1,67 л). Влажное твердое вещество (125,8 г) растворяют в теплом третбутилметиловом эфире (1,64 л), высушивают над Na2SO4, фильтруют и концентрируют до сухости с получением вышеназванного соединения в виде бледно-желтого твердого вещества (85,8 г, 60%). Приготовление 23. 5-(5-Бром-4-хлор-тиофен-2-ил)-1-метил-1 Н-[1,2,4]триазол. 3-л реакционную колбу оборудуют охлаждающей баней, воздушной мешалкой и температурным датчиком и заполняют 5-(4-хлор-тиофен-2-ил)-1-метил-1 Н-[1,2,4]триазолом (105,3 г, 0,527 моль), ацетонитрилом (1053 мл) и НОАс (105 мл) с образованием раствора. Порциями добавляют N-бромсукцинимид(103,2 г, 0,580 моль) в течение 30-60 мин, поддерживая температуру при 31 С. Перемешивают в течение 1 часа, во время которого ГХ анализ указывает на завершение реакции. Реакционную смесь выливают в воду (2,1 л, 20 об. ), перемешивают в течение 30 мин, фильтруют и промывают водой (21 л). Вещество высушивают в вакуумной печи при 45 С в течение ночи с получением вышеназванного соединения в виде бледно-желтого твердого вещества (123,0 г, 84%). Пример 26. 7-Бутил-3-[3-хлор-5-(2-метил-2 Н-[1,2,4]триазол-3-ил)-тиофен-2-ил]-2,5-диметилпиразоло[1,5-а]пиримидин. 5-(5-Бром-4-хлор-тиофен-2-ил)-1-метил-1 Н-[1,2,4]триазол (169 мг, 0,61 ммоль) добавляют к безводному ТГФ (5 мл). Охлаждают до -78 С Добавляют трет-бутиллитий (0,81 мл, 1,37 ммоль, 1,7 М в пентане). Перемешивают в течение 45 мин и затем медленно добавляют хлорид цинка (1,5 мл, 1,7 6 ммоль, 0,5 М в ТГФ). Перемешивают в течение 5 мин, затем нагревают до комнатной температуры и перемешивают в течение 15 мин. Добавляют бис(три-трет-бутилфосфин)палладий (0) (62 мг, 0,12 ммоль) и 7-бутил-3 йод-2,5-диметил-пиразоло[1,5-а]пиримидин (200 мг, 0,61 ммоль). Нагревают для орошения в течение ночи. Реакционную массу фильтруют через слой целита (Celite ) и концентрируют до сухости. Очищают способом колоночной хроматографии на силикагеле, элюируя смесью 0-50% этилацетата в гексане, с получением вышеназванного соединения (36 мг, 15 %). ЭС/МС m/z (35Cl) 401 (М+1)+. Пример 27. 5-[7-(1-Этилпропил)-2,5-диметилпиразоло[1,5-а]пиримидин-3-ил]-4-метилтиофен-2 илдиметиламин гидрохлорид 3-(5-Нитро-3-метилтиофен-2-ил)-7-(1-этилпропил)-2,5-диметилпиразоло(0,20 г), дегазируют в вакууме/потоком водорода (3) и перемешивают в атмосфере водорода (55 psi) при комнатной температуре в течение 3 ч. Завершение реакции подтверждают способом ТСХ. Реакционную массу разбавляют ТГФ (50 мл) и фильтруют через слой Celite. Добавляют гидрид натрия в виде 60%- 16016056 дисперсии в масле (0,10 г, 2,25 ммоль) и перемешивают 20 мин при комнатной температуре. К реакции добавляют йодметан (0,140 мл, 2,25 ммоль) и перемешивают в запаянном реакционном сосуде в течение ночи при 50 С. Реакционную массу гасят водой и разбавляют этилацетатом (100 мл). Органическую фазу промывают водой, насыщенным хлоридом аммония и соляным раствором. Высушивают над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении до получения масла. Образовавшийся остаток очищают способом флэш-хроматографии, элюируя смесью 100% гексан/0% (25% этилацетат/гексан) - 0% гексан/100% (25% этилацетат/гексан) при ступенчатом градиенте с 10% приращениями, с получением пены (0,145 г, 41%). Вещество растворяют (0,13 г, 0,365 ммоль) в метаноле (3 мл) и добавляют 4,0 М HCl-диоксан (3 мл). Реакционную массу перемешивают 30 мин и продувают избыточным давлением азота. Высушивают в вакуумной печи с получением белого твердого вещества(0,125 г). ЭС/МС m/z 357,2 (М+1)+. Пример А. Оценка эффективности in vivo с применением связывания ех Vivo. С целью оценки эффективности in vivo, соединение согласно настоящему изобретению исследуют методом связывания ex vivo. Следуя процедурам, описанным в D. R. Gehlert et al., EJP 509: 145-153(2005), соединение вводят крысам пероральным путем. Затем оценивают ex vivo связывание 125Iсаважина (sauvagine) с мозжечком, как описано в Gehlert et al. Например, соединение примера 20 обеспечивает 74% ингибирование в дозе 10 мг/кг. Пример В. Тест на связывание на CRF1 фильтрах. Ограничения экспрессии CRF1 человека на основе плазмид, относящиеся к получению линии рекомбинантных клеток с плотностью рецепторов, достаточной для проведения анализа связывания, обходят путем применения системы экспрессии Phoenix на основе ретровируса, по лицензии Стэндфордского университета. Для получения мембран используют стабильную клеточную линию HEK-hCRF1, и реакционную смесь для анализа связывания (200 мкл) готовят следующим образом: 50 мкл 125I-саважина (0,2 нМ конечн.), 50 мкл соединения и 100 мкл мембраны CRF1 (25 мкг/реакционную смесь). Реакционные смеси инкубируют при комнатной температуре в течение 2 ч и затем завершают путем фильтрации через предварительно обработанные стекловолоконные фильтровальные планшеты FB Millipore (96 лунок). Планшеты дважды промывают охлажденным льдом буфером для анализа (50 мМ ТРИС, 12,5 мМ NaCl,1 мМ EDTA, 10 мМ MgCl2, 0,05% BSA, рН 7,2), высушивают на воздухе в течение ночи и анализируют в счетчике MicroBeta, применяя 100 мкл Microscint 40. Неспецифическое связывание (NSB) определяют в присутствии 0,5 мкМ немеченого саважина. Как правило, проводят трехкратное измерение и с помощью программы Graph Pad Prism строят график по медианам экспериментальных точек. При применении указанного метода, приведенные в настоящем изобретении в качестве примера соединения (за исключением соединений примеров 2, 3, 6, 7 и 8, которые применяли в качестве промежуточных веществ для получения соединений других примеров и не исследовали) ингибируют связывание 125I-саважина (4 нМ) в клетках, культивируемых во флаконе/прикрепленных клетках с Ki (константа ингибирования)500 нМ. Например, соединение примера 20 имеет Ki 4,4 нМ. Пример С. Тест на связывание на CRF2 фильтрах. Ограничения экспрессии CRF1 человека на основе плазмид, относящиеся к получению линии рекомбинантных клеток с плотностью рецепторов, достаточной для проведения анализа связывания, обходят путем применения системы экспрессии Phoenix на основе ретровируса, по лицензии Стэндфордского университета. Для получения мембран используют стабильную клеточную линию HEK-hCRF1, и реакционную смесь для анализа связывания (200 мкл) готовят следующим образом: 50 мкл 125I-саважина (0,2 нМ-конечная концентрация.), 50 мкл соединения и 100 мкл мембраны CRF2 (25 мкг/реакционную смесь). Реакции инкубируют при комнатной температуре в течение 2 ч и затем завершают путем фильтрации через предварительно обработанные стекловолоконные фильтровальные планшеты FB Millipore (96 лунок). Планшеты дважды промывают охлажденным льдом буфером для анализа (50 мМ ТРИС, 12,5 мМNaCl, 1 мМ EDTA, 10 мМ MgCl2, 0,05% BSA, рН 7,2), высушивают на воздухе в течение ночи и считывают показания в счетчике MicroBeta с использованием 100 мкл Microscint 40. Неспецифическое связывание (NSB) определяют в присутствии 0,5 мкМ немеченого саважина. В качестве альтернативы соединения оценивают методом сцинтилляционного приближения (Scintillation Proximity assay). Этот метод реализуют следующим образом: 50 мкл 125I-саважина (конечная концентрация 0,2 нМ), 50 мкл соединения или немеченого саважина (NSB) и 100 мкл, содержащих 250 мкг гранул агглютинина из проростков пшеницы (WGA), частицы SPA и мембрану CRF2 (1,5 мкг/реакционную смесь). Планшеты инкубируют в течение 4-5 ч при комнатной температуре и затем центрифугируют при 200 X г в течение 10 мин. Связанную радиоактивность оценивают с применением сцинтилляционного счетчика Wallac Trilux. Как правило, связывание оценивают путем трехкратного измерения, и с помощью программы Graph Pad Prism строят график по медианам экспериментальных точек. Первоначально соединения подвергаются скринингу при фиксированной концентрации, и, если отмечается существенная активность, дополнительно получают кривые концентрация - отклик. Соединения согласно настоящему изобретению предпочтительно проявляют слабую аффинность кCRF2 рецептору (относительно CRF1). Например, соединения примера 20 демонстрируют 3 9% ингибирование при концентрации 50 мкМ.- 17016056 Пример D. Биодоступность и фармакокинетические свойства. Объем распределения (V расп.) связывает количество лекарственного препарата в организме с концентрацией этого препарата в крови или плазме. Объем распределения относится к объему жидкостей(организма), необходимому для того, чтобы вместить суммарное количество лекарственного препарата,чтобы при этом его концентрация была равна его концентрации в крови или плазме: V расп. = содержание лекарственного препарата в организме/концентрация лекарственного препарата в крови или плазме(Goodman и Gillman's). Для дозы 10 мг и концентрации в плазме 10 мг/л объем распределения составил бы 1 л. Объем распределения отражает степень присутствия лекарственного препарата в экстраваскулярной ткани. Большой объем распределения отражает склонность соединения связываться с компонентами ткани по сравнению со связыванием с белками плазмы. В клинических условиях V расп. можно применять для определения ударной дозы для достижения равновесной концентрации. Для изучения объема распределения самцам крыс Sprague Dawley (N=3) вводят однократно внутривенным путем дозу соединения, равную 1 мг/кг. Многократно отбирают пробы плазмы в моменты времени от 0,08 до 24 часов после введения дозы. Пробы плазмы анализируют методами ЖХ/МС/МС и определяют концентрацию соединения в плазме. Выполняют фармакокинетические расчеты с целью определения параметров фармакокинетики, в том числе V расп. и клиренса из плазмы (Clp). Соединения согласно настоящему изобретению предпочтительно имеют более благоприятные характеристики биологической доступности, чем другие антагонисты CRF, например, СР 154526 (Schulz etR1 и R2 независимо представляют собой водород или C1-С 3 алкил;R5 представляет собой водород, Br, нитро, метокси, метоксиметил, диметиламино, этоксикарбонил,ацетамидо, ацетокси,или его фармацевтически приемлемая соль. 2. Соединение по п.1 или его фармацевтически приемлемая соль, отличающееся тем, что R1 и R2 независимо представляют собой этил или н-пропил. 3. Соединение по п.1 или 2 или его фармацевтически приемлемая соль, отличающееся тем, что R3 представляет собой 4. Соединение по любому из пп.1-3, отличающееся тем, что 5. Фармацевтическая композиция, содержащая соединение по любому из пп.1-4, или его фармацевтически приемлемую соль, и фармацевтически приемлемый наполнитель.- 18016056 6. Применение соединения по любому из пп.1-4 или его фармацевтически приемлемой соли для лечения алкоголизма или токсикомании. 7. Применение соединения по любому из пп.1-4 или его фармацевтически приемлемой соли для лечения депрессии или состояния тревоги. 8. Применение соединения по любому из пп.1-4 или его фармацевтически приемлемой соли для получения лекарственного средства для лечения состояния тревоги или депрессии. 9. Применение соединения по любому из пп.1-4 или его фармацевтически приемлемой соли для получения лекарственного средства для лечения алкоголизма или токсикомании.
МПК / Метки
МПК: C07D 487/04, A61P 25/24, A61K 31/495
Метки: тиофенпиразолопиримидиновые, соединения
Код ссылки
<a href="https://eas.patents.su/20-16056-tiofenpirazolopirimidinovye-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Тиофенпиразолопиримидиновые соединения</a>
Предыдущий патент: Соединения, ингибирующие киназы, и фармацевтическая композиция на их основе
Следующий патент: Барабан машины для бережного ухода за бельем
Случайный патент: Способ получения соединений ряда пиперазина и их солянокислых солей
























