Применение 7-хлор-n,n,5-триметил-4-оксо-3-фенил-3,5-дигидро-4н-пиридазин[4,5-b]индол-1-ацетамида в качестве биомаркера уровней периферического бензодиазепинового рецептора
Номер патента: 20612
Опубликовано: 30.12.2014
Авторы: Марге Франк, Бенавидес Хесус, Тавитиан Бертран, Кастель Мари-Ноэлль, Бутен Эрве, Антрайе Филипп, Томинио Сирилль, Руни Томас, Дамон Аннелор, Долль Фредерик, Риврон Люк
Формула / Реферат
1. Применение меченного радиоактивным изотопом 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4H-пиридазин[4,5-b]индол-1-ацетамида в качестве биомаркера для определения уровней PBR у субъекта, связанных с нормальным и патологическим состояниями, где радиоактивная метка выбрана из углерода-11, радиогалогенов и радиометаллов.
2. Применение по п.1, где 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4H-пиридазин[4,5-b]индол-1-ацетамид представляет собой меченный радиоактивной меткой углеродом-11.
3. Применение по пп.1 и 2, где 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4H-пиридазин[4,5-b]индол-1-ацетамид представляет собой меченный радиоактивной меткой углеродом-11 по углероду метильной группы, расположенной в 5-положении индольного ядра.
4. Применение по п.1, где 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4H-пиридазин[4,5-b]индол-1-ацетамид представляет собой меченный радиоактивной меткой радиогалогенами.
5. Применение по п.1 или 4, где 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4H-пиридазин[4,5-b]индол-1-ацетамид представляет собой меченный радиоактивной меткой радиогалогеном фтор-18.
6. Применение по п.1 или 5, где 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4H-пиридазин[4,5-b]индол-1-ацетамид представляет собой меченный радиоактивной меткой фтор-18 в пара-положении 3-фенильного кольца.
7. Применение по пп.1-6, где патологические состояния, относящиеся к изменению уровней PBR, выбраны из повреждения головного мозга, инфекций головного мозга и неврологических заболеваний.
8. Применение по пп.1-6, где патологические состояния, относящиеся к изменению уровней PBR, выбраны из психиатрических заболеваний.
9. Применение по пп.1-6, где патологические состояния, относящиеся к изменению уровней PBR, выбраны из пролиферативных заболеваний.
10. Применение по пп.1-6, где патологические состояния, относящиеся к изменению уровней PBR, выбраны из периферических воспалительных процессов.
11. Применение по пп.1-6, где определение уровней PBR производят при исследовании заполнения.
12. Применение по пп.1-7, где определение уровней PBR производят для оценки эффективности терапевтического лечения.
13. Способ определения уровней PBR, связанных с нормальными состояниями и изменениями в уровнях PBR, связанными с патологическими состояниями, где определение производят при использовании меченной радиоактивным изотопом формы 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4H-пиридазин[4,5-b]индол-1-ацетамида, где радиоактивная метка выбрана из углерода-11, радиогалогенов и радиометаллов.
14. Способ по п.13, где меченный радиоактивной меткой 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4H-пиридазин[4,5-b]индол-1-ацетамид содержит углерод-11.
15. Способ по пп.13, 14, где 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4H-пиридазин[4,5-b]индол-1-ацетамид представляет собой меченный радиоактивной меткой углеродом-11 по углероду метильной группы, расположенной в 5-положении индольного ядра.
16. Способ по п.13, где 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4H-пиридазин[4,5-b]индол-1-ацетамид представляет собой меченный радиоактивной меткой фтором-18.
17. Способ по п.13, где 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4H-пиридазин[4,5-b]индол-1-ацетамид представляет собой меченный радиоактивной меткой фтором-18 в пара-положении 3-фенильного кольца.
18. Способ по пп.13-17, где патологические состояния, относящиеся к изменению уровней PBR, выбраны из повреждения головного мозга, инфекций головного мозга и неврологических заболеваний.
19. Способ по пп.13-17, где патологические состояния, относящиеся к изменению уровней PBR, выбраны из психиатрических заболеваний.
20. Способ по пп.13-17, где патологические состояния, относящиеся к изменению уровней PBR, выбраны из пролиферативных заболеваний.
21. Способ по пп.13-17, где патологические состояния, относящиеся к изменению уровней PBR, выбраны из периферических воспалительных процессов.
22. Способ по пп.13-17, где определение уровней PBR производят при исследовании заполнения.
23. Способ по пп.13-17, где определение уровней PBR производят для оценки эффективности терапевтического лечения.
24. Способ по пп.13-17, где определение уровней PBR и воспаления проводят при помощи получения изображений (PET) позитрон-эмиссионной томографии или получения изображений (SPECT) компьютерной томографии одиночных фотонов.
25. Способ по пп.13-17, где определение уровней PBR и воспаления производят при помощи получения изображений (PET) позитрон-эмиссионной томографии.
26. Диагностический набор для определения уровней PBR, связанных с нормальными состояниями и изменениями в уровнях PBR, связанными с патологическими состояниями, включающий форму 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4H-пиридазин[4,5-b]индол-1-ацетамида, меченную радиоактивным изотопом.
Текст
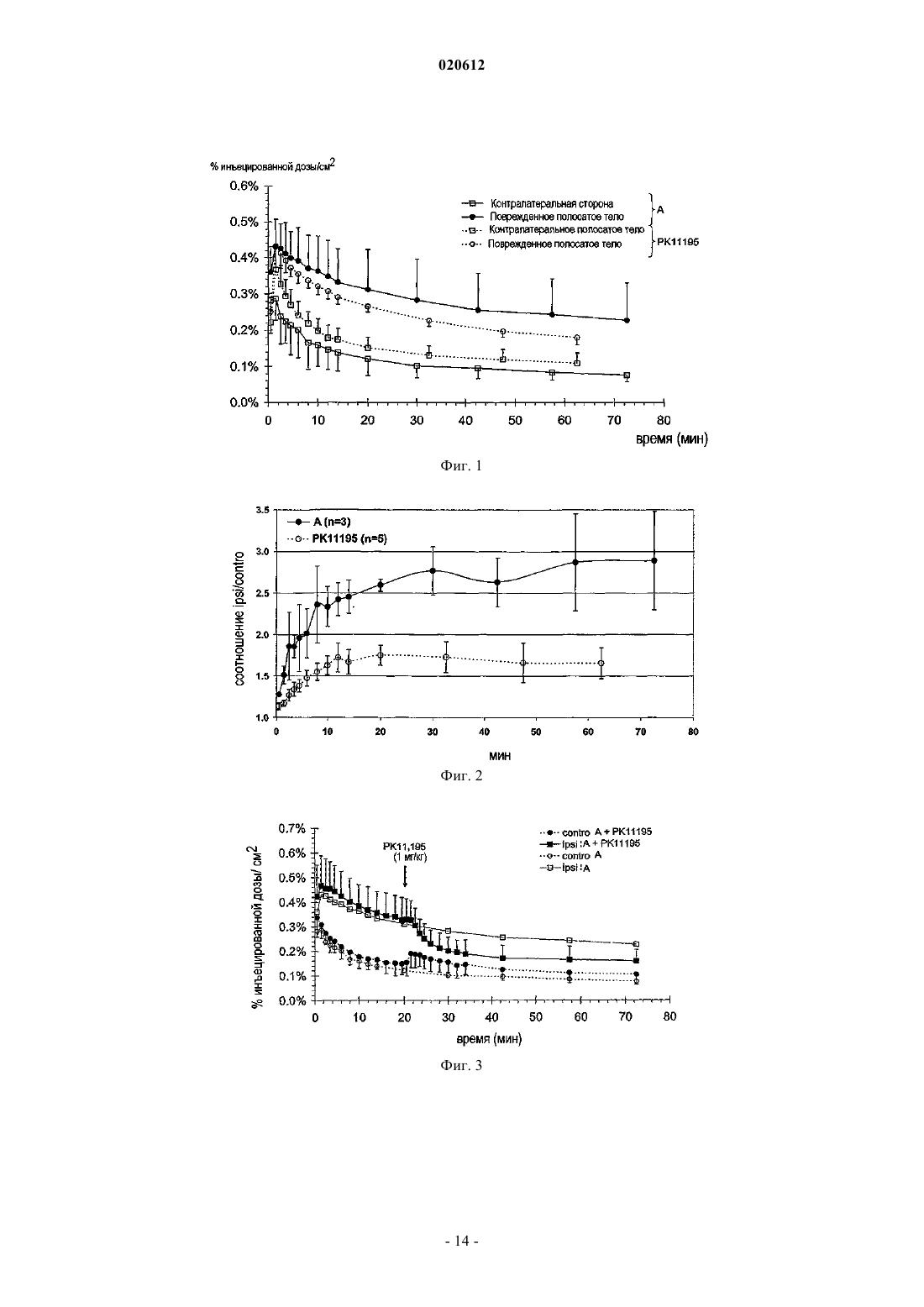
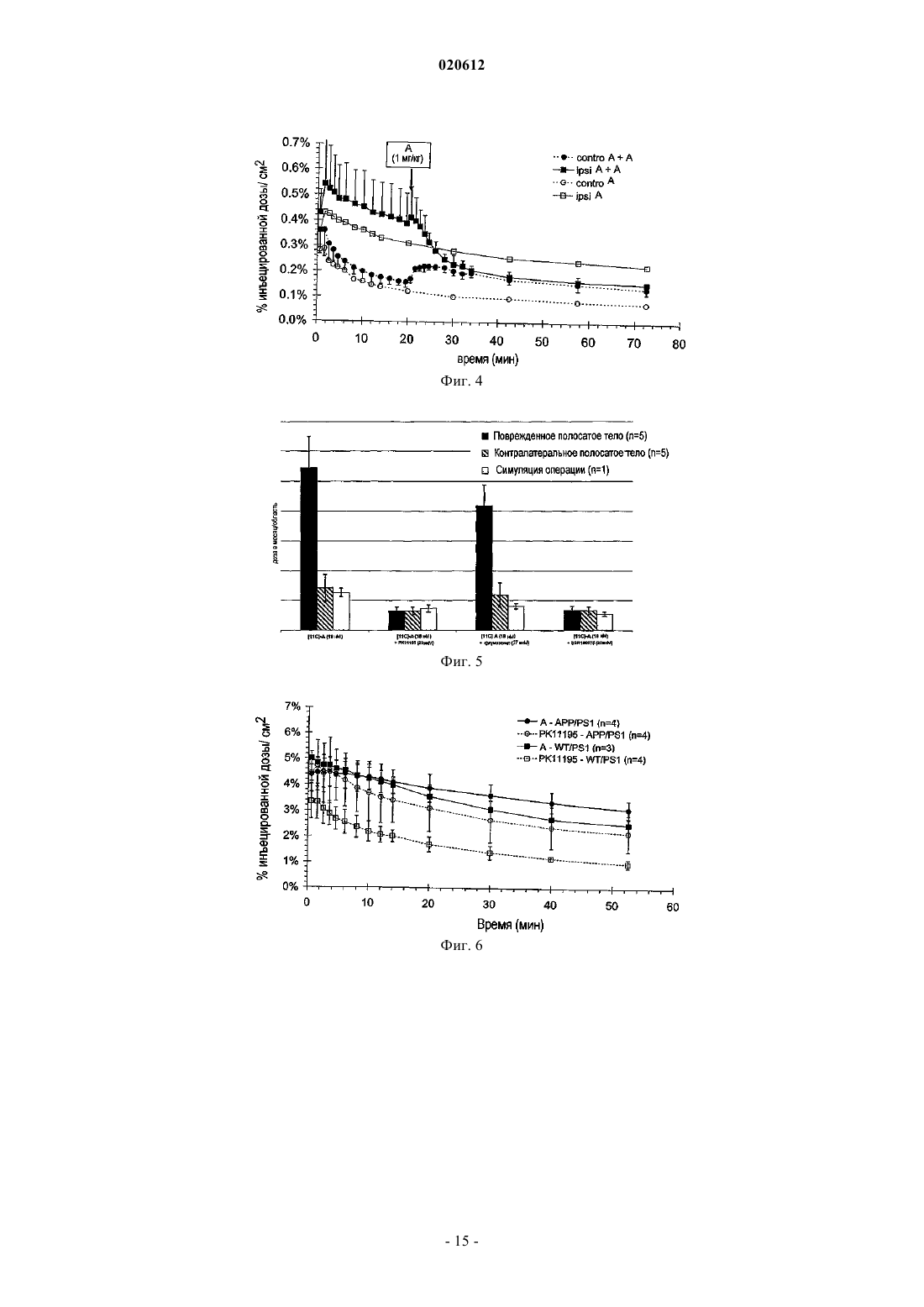
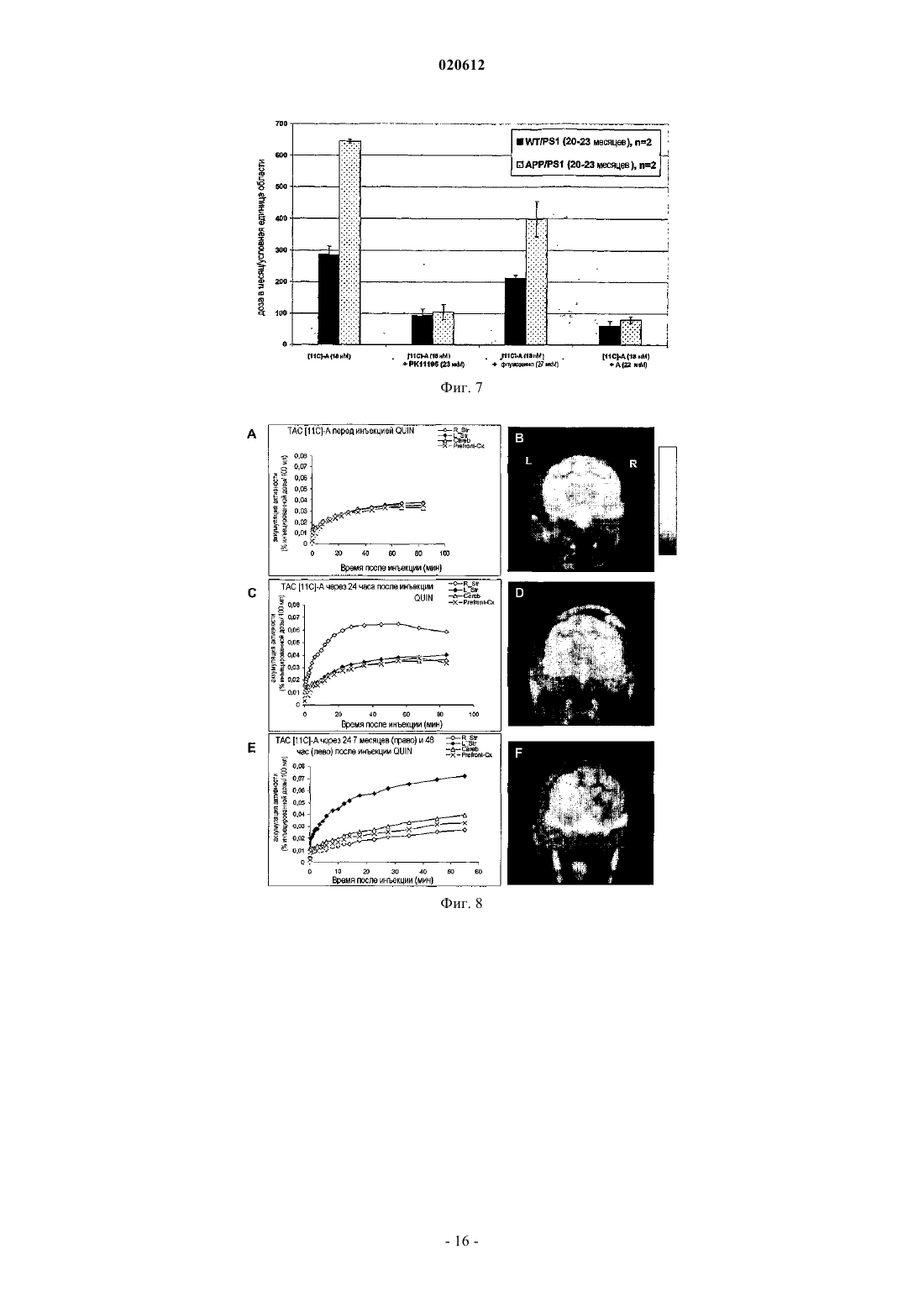
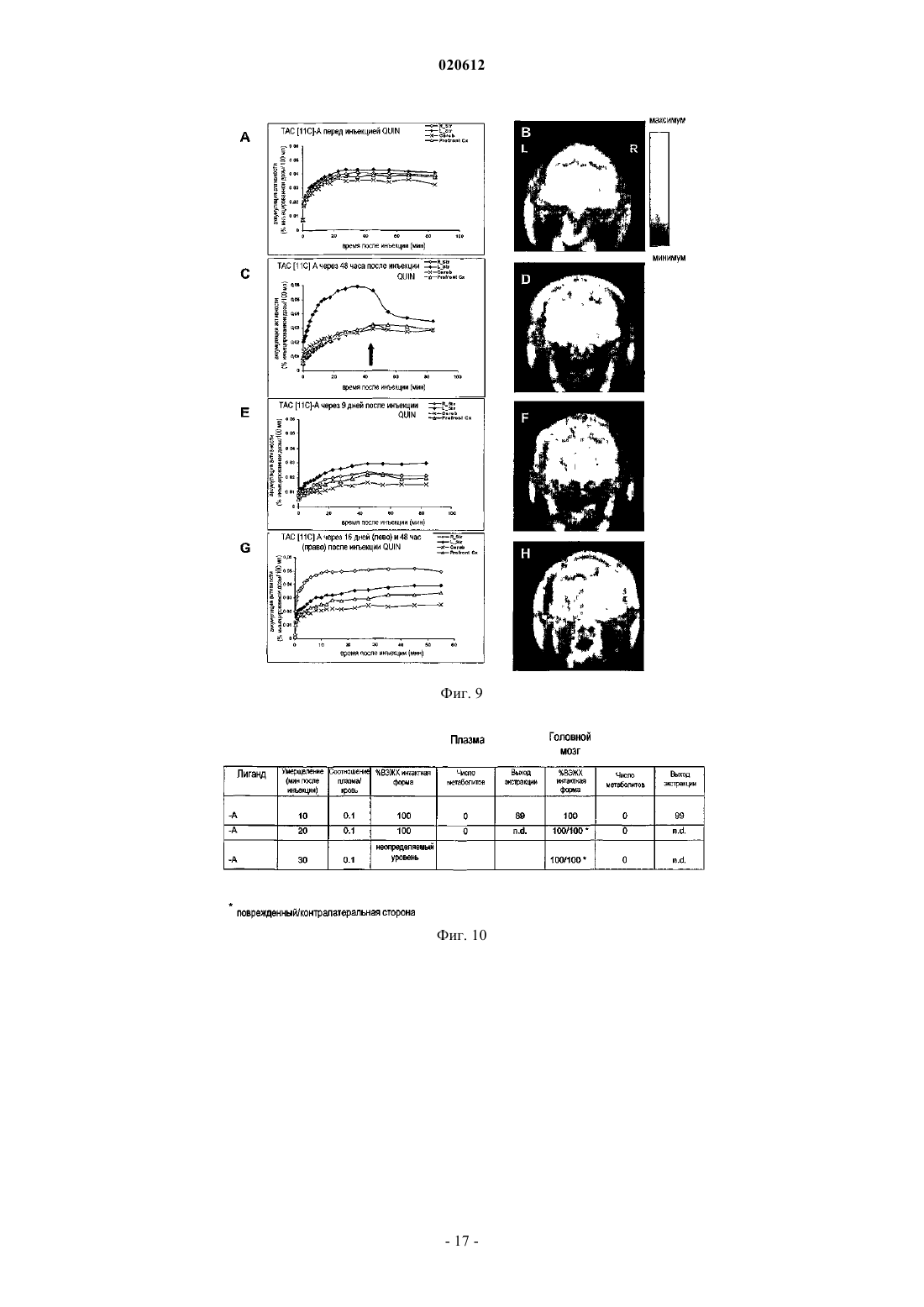
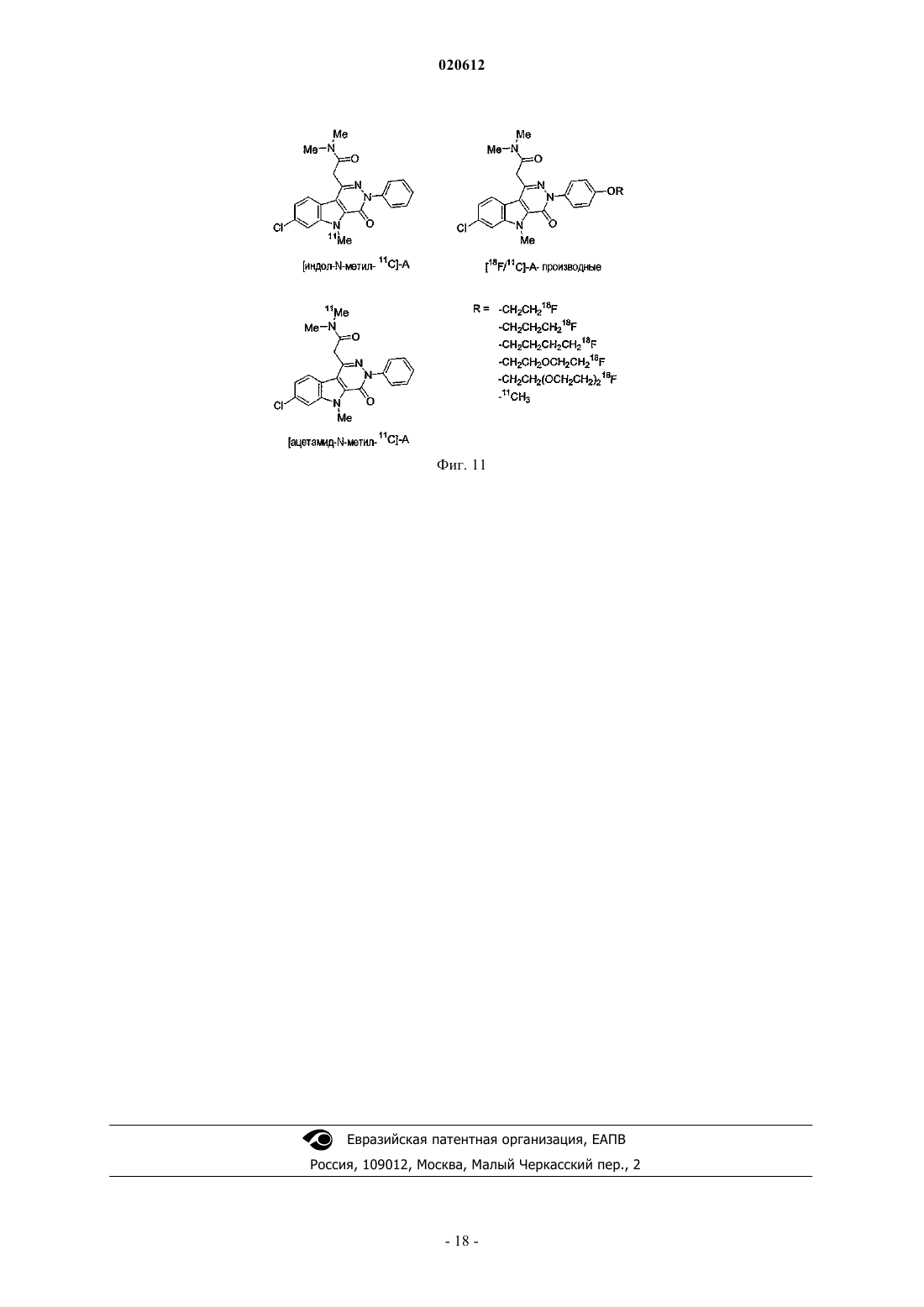
ПРИМЕНЕНИЕ 7-ХЛОР-N,N,5-ТРИМЕТИЛ-4-ОКСО-3-ФЕНИЛ-3,5-ДИГИДРО-4 НПИРИДАЗИН[4,5-b]ИНДОЛ-1-АЦЕТАМИДА В КАЧЕСТВЕ БИОМАРКЕРА УРОВНЕЙ ПЕРИФЕРИЧЕСКОГО БЕНЗОДИАЗЕПИНОВОГО РЕЦЕПТОРА Применение меченной радиоактивным изотопом формы 7-хлор-N,N,5-триметил-4-оксо-3 фенил-3,5-дигидро-4H-пиридазин[4,5-b]индол-1-ацетамида в качестве биомаркера для определения у пациента уровней PBR, связанных с нормальным и патологическим состояниями. Способ определения уровней PBR, связанных с нормальными и патологическими состояниями. Диагностический набор. Настоящее изобретение относится к применению 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5 дигидро-4H-пиридазин[4,5-b]индол-1-ацетамида в качестве биомаркера для определения у индивидуума уровней PBR (периферического бензодиазепинового рецептора), связанных с нормальным и патологическим состояниями. Настоящее изобретение также касается способа определения уровней PBR для указанных выше целей. При нормальных физиологических условиях PBR, также известный как транслокаторный белок 18 кДа (TSPO) (Papadopoulos В. et al. (2006) Trends Pharmac. Sci. 27: 402-409) экспрессируется в низких уровнях в мозге, главным образом, в микроглиацитах и экспрессируется в значительных концентрациях в многочисленных периферических тканях, таких как надпочечники, эпифиз, слюнные железы, половые железы, почка, легкое, сердечные и скелетные мышцы (Chen, M-K. and Guilarte, T. (2008) Pharmacologyand Therapeutics 118: 1-17; Venneti S. et al. (2006) Progress in Neurobiol. 80: 308-322). Исследования по субклеточной локализации с референтным PBR лигандом [3 Н]РК 11195 показали, что PBR локализуется на внешней мембране митохондрий (Anholt R.R. et al.(1986) J. Biol. Chem. 261: 576-583; AntkiewiczMichaluk L. et al. (1988) Mol. Pharmacol. 34: 272-278). Однако иммуно-гистохимические исследования также показали, что PBR экспрессируется в клетках крови (лишенных митохондрий) (Olson, J.M. et al.(1988) Eur. J. Pharmacol. 152: 47-53) и может локализоваться на плазматической мембране (O'Beirne, G. etal. (1990) Eur. J. Biochem. 188: 131-138; Woods M.J. et al. (1996) Boichem. Pharmacol. 51: 1283-1292). Ядерная или приядерная локализация PBR также наблюдалась при раке груди (Hardwick M. et al. (1999)Cancer Res. 59: 831-841), клетках глиомы человека (Brown R.C. et al. (2000) Cancer Lett. 156: 125-132),клетках опухоли печени (Corsi L. et al. (2005), Life Sci. 76: 2523-2533) и клетках глии (Kuhlmann, А.С. andGuilarte, T.R. (2000) J. Neurochem. 74: 1694-1704). Значительное повышение уровней PBR наблюдают после повреждения клеток, воспаления или деления и связано с большим числом острых и хронических патологических состояний (Chen M-K. andNeurobiology. 80: 308-322). Такие состояния включают повреждения мозга, такие как инсульт и ишемически-реперфузионное повреждение (Gerhard, A. et al. (2000) Neuroreport 11: 2957-2960; Gerhard A. et al.(2005) Neuroimage 24: 404-412), травматические повреждения мозга (Raghavendra R. et al. (2000) Exp.Neurol. 161: 102-114); инфекции мозга, такие как энцефалит (Banati R.B. et al. (1999) Neurology 53: 21992203; Cagin A. et al. (2001) Brain 124: 2014-2027); неврологические заболевания, такие как множественный склероз (Banati R. В. et al. (2000) Brain 123: 2321-2337), болезнь Альцгеймера и слабоумие (Cagnin A.et al. (2001) Lancet 358: 461-467; Versijpt, J.J. et al. (2003) Eur. Neurol. 50: 39-47), болезнь Паркинсона (Ouchi Y. et al. (2005) Ann. Neurol. 57: 168-175; Gerhard A. et al. (2006) Neurobiol. Dis. 21: 404-412), амиотрофический латеральный склероз (Turner M.R. et al. (2004) Neurobiol. Dis. 15: 601-609), кортикобазальная дегенерация (Gerhard A. et al. (2004) Mov. Disord. 19: 1221-1226; Henkel K. et al. (2004) Mov. Disord. 19: 817-821), синдром Хантингтона (Messmer К. and Reynolds, G.P. (1998) Neurosci. Lett. 241: 53-56; Pavese N.et al. (2006) Neurology 66: 1638-1643) и эпилепсия (Sauvageau A. et al. (2002) Metab. Brain Dis. 17: 3-11). Повышенные уровни PBR при патологиях ЦНС главным образом наблюдают в микроглиацитах (Chen,M-K. and Guilarte T. (2008) Pharmacology and Therapeutics 118: 1-17; Venneti S. et al. (2006) Progress inNeurobiology. 80: 308-322). Сильное повышение PBR также наблюдают при раке (Cornu P. et al. (1992) Acta Neurichir. 119: 146152; Hardwick M. et al. (1999) Cancer Res. 59: 831-841; Maaser K. et al. (2002) Cancer Res. 8: 3205-3209),воспалении легких (Audi S.H. et al. (2002) Lung. 180: 241-250; Hardwick M. J. et al. (2005) Mol. Imaging 4: 432-438), сердечной ишемии (Mazzone A. et al. (2000) J. Am. Coll. Cardiol. 36: 746-750), почечной ишемииRheumatology (Oxford) 43: 1224-1225), регенерации седалищного нерва (Mills, CD. et al. (2005) Mol. Cell.Mol. Imaging 36: 73-80). Напротив, повышение уровней PBR наблюдают в мозге пациентов, страдающих шизофренией (Kurumaji A. et al. (1997) J. Neural. Transm. 104: 1361-1370; Wodarz N. et al. (1998) Psychiatry Res. 14: 363-369) и при ревматоидном артрите (Bribes E. et al. (2002) Eur. J. Pharmacol. 452: 111-122) и остеоартрите (Bazzichi L. et al. (2003) Clin. Biochem. 36: 57-60). Возможность получать изображения уровней PBR in vivo в мозге и других тканях, таким образом,могла бы служить в качестве важного биомаркера прогрессии заболевания, для определения и оценки эффективности терапевтического лечения и оценки заполненности PBR рецептора in vivo. Для in vivo получения изображения уровней PBR при большом числе нейропатологических состояний широко использовался PET PBR лиганд [11C]PK11195 (Chen M-K. and Guilarte, T. (2008) Pharmacology and Therapeutics 118: 1-17; Venneti S. et al. (2006) Progress in Neurobiology. 80: 308-322). В то же время, [11 С]РК 11195 демонстрирует довольно низкое поглощение мозгом, высокую степень неспецифического связывания и довольно низкий сигнал по отношению к коэффициенту шума. Указанные свойства ограничивают чувствительность [11 С]РК 11195 для получения изображения PET уровней PBR и оценки заполненности в ЦНС. Разработка усовершенствованных PET PBR лигандов с более специфическим свя-1 020612 зыванием и большей чувствительностью по сравнению с [11C]PK11195 обеспечило бы, таким образом,значительный прорыв в получении изображения уровней PBR в мозге и других тканях. Среди соединений, описанных и заявленных в документах WO 99/06406 и WO 00/44384 производное пиридазин[4,5-b]индола, 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4H-пиридазин[4,5b]индол-1-ацетамид, было идентифицировано как в особенности интересное для использования в качестве PET (или SPECT) лиганда для PBR. Указанное соединение имеет высокое сродство к PBR in vitro и invivo (Ferzaz, B. et al. (2002) J. Pharm. Exp. Therap. 301: 1067-1078). Сущность изобретения Настоящее изобретение относится к применению 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5 дигидро-4H-пиридазин[4,5-b]индол-1-ацетамида в качестве биомаркера для определения уровней PBR,связанных с нормальным состоянием, и уровней PBR, связанных с патологическими состояниями. Настоящее изобретение также касается способа определения уровней PBR, связанных с нормальным состоянием, и уровней PBR, связанных с патологическими состояниями, при использовании меченной радиоактивным изотопом формы 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4Hпиридазин[4,5-b]индол-1-ацетамида. Настоящее изобретение также касается диагностического набора для определения уровней PBR. Определения Для удобства и облегчения чтения соединение 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро 4H-пиридазин[4,5-b]индол-1-ацетамида в некоторых главах настоящей заявки было переименовано в"А". Для настоящего изобретения последующие слова следует понимать таким образом. Биомаркер: характеристика, которая может быть объективно измерена (т.е. с приемлемой точностью и воспроизводимостью) и использована в качестве индикатора нормального физического или патологического процесса и для оценки действия медицинской терапии. Биомаркер может быть биологическим, анатомическим, физиологическим, биохимическим или молекулярным параметром, который может быть определен в ткани или биологической жидкости. Воспаление: ответ на повреждение или разрушение тканей. На периферии острое воспаление состоит из лейкоцитарных инфильтратов, характеризующихся полиморфно-ядерными клетками (нейтрофилы) и хроническое воспаление состоит из мононуклеарных клеток (макрофагов, лимфоцитов, плазматических клеток). В мозге воспаление объединяет широкий спектр клеточных ответов, которые включают активацию микроглии и астроцитов и участие в цитокинезе и хемокинезе, белках комплемента, белках острой фазы, окислительном повреждении и родственных молекулярных процессах. Указанные события могут оказывать вредное воздействие на нейронную функцию, приводя к повреждению нейронов и дальнейшей глиальной активации и в конечном итоге нейродегенерации. В ответ на воспаление мозга клетки глии (главным образом, микроглии) активируются и повышают экспрессию PBR. Уровни PBR в мозге представляют собой, таким образом, индикатор воспаления мозга и могут рассматриваться в качестве биомаркеров нейровоспаления по настоящему изобретению. Патологические состояния: такие состояния могут включать неврологические заболевания: любое повреждение, нарушение или заболевание, которое влияет на функцию центральной нервной системы. Такие состояния могут включать острые повреждения мозга, такие как инсульт, ишемическиреперфузионное повреждение и травматические повреждения мозга; мозговые инфекции, такие как энцефалит; неврологические заболевания, такие как множественный склероз, болезнь Альцгеймера, болезнь Паркинсона, амиотрофический латеральный склероз, слабоумие, кортикобазальную дегенерацию,синдром Хантингтона и эпилепсию; патологические состояния могут также включать психиатрические состояния, такие как шизофрения; периферические воспалительные процессы, такие как воспаление легких, атеросклероз, сердечная ишемия, почечная ишемия, ревматизм (фибромиалгия), псориазный артрит,ревматоидный артрит и остеоартрит; пролиферативные заболевания, такие как рак. Заполнение рецептора: показатель количества связывания с биохимической мишенью или рецептором. Уровень заполнения рецептора для лекарственного средства может быть измерен путем сравнения измерений времени-активности, полученных с меченным радиоактивным изотопом лигандом PET самим по себе и когда PET лиганд применяют после введения немеченого лекарственного средства. PET лиганд должен связываться с тем же рецептором, что и немеченое лекарственное средство. Количество меченного радиоактивным изотопом PET лиганда, связывающегося с рецептором, уменьшается в присутствии повышенных концентраций немеченого лекарственного средства. Величину этого уменьшения определяют как заполнение рецептора немеченым лекарственным средством.PET получение изображения: позитрон-эмиссионная томография представляет собой способ получения изображения, при помощи которого получают трехмерное изображение или карту функциональных процессов в организме. Система определяет пары гамма-лучей, испускаемых непосредственно испускающим позитроны радионуклидом (индикаторная добавка), который вводят в организм на биологически-активной молекуле. Изображения концентрации индикаторной добавки в 3-мерном пространстве в организме потом реконструируют при помощи компьютерного анализа. Материалы, используемые дляPET, представляют собой сцинтилляторы, такие как германат висмута, оксиортосиликат лютеция или ортосиликат гадолиния, в связи с их высокой способностью останавливать -лучи и скоростью превращения сигнала. Микро PET представляет собой применение PET для получения изображения у небольших животных.SPECT получение изображения компьютерной томографией одиночных фотонов представляет собой другой способ получения изображения, при помощи которого получают трехмерное изображение или карту функциональных процессов в организме. Система непосредственно отображает гамма-лучи,испускаемые радионуклидом, испускающим одиночные фотоны (индикаторная добавка), который вводят в организм на биологически-активной молекуле. Получение изображения концентрации индикаторной добавки в 3-мерном пространстве в организме потом реконструируют при помощи компьютерного анализа. Меченная радиоактивным изотопом форма: любая молекула, в которой один или несколько атомов были замещены на изотопы, позволяющие ее детектировать. Радиоизотопы, испускающие позитроны,наиболее часто использующиеся для PET получения изображения, представляют собой углерод-11 (или 11C, t1/2=20 мин), азот-13 (или 13N, t1/2=10 мин), кислород-15 (или 15O, t1/2=2 мин). Также можно рассматривать молекулы, в которых были добавлены дополнительные атомы для метки производных с другими испускающими позитрон изотопами для PET получения изображения, такие как фтор-18 (или 18F, t1/2=110 мин), а также галлий-68 (или 68Ga, t1/2=68 мин), медь-64 (или 64Cu, t1/2=12,7 ч), бром-76 (или 76Br, t1/2=16,1 ч) и йод-124 (или 124I, t1/2=4,2 дня). Наконец, также следует принять во внимание молекулы, в которые были введены другие дополнительные атомы для маркировки производных радиоизотопами, испускающими одиночные фотоны для SPECT получения изображения, такие как йод-123 (или 123I, t1/2=13,1 ч) или технеций-99m (или 99 Тс, t1/2=6,0 ч). Синтез меченных радиоактивным изотопом лигандов и замещение атома изотопом можно проводить несколькими способами, известными специалисту в данной области техники. Например, для замещения атома углерода на углерод-11, заявители использовали несколько производных, таких как[11C]метилиодид или [11C]метилтрифталат (Welch M.J. et al. (2003) In Handbook of Radiopharmaceuticals Radiochemistry and Applications (Welch MJ, Redvanly CS Eds.) New York-Chichester-Brisbane-Toronto,Wiley-Interscience Pub., 1-848). В случае А несколько метильных групп могут быть меченными углеродом-11, такие как N,N-диметилацетамид или N-метилиндольные функциональные группы. В случае метки фтором-18, радиоизотоп можно непосредственно присоединять к структуре остова(А) при помощи нуклеофильных алифатических или ароматических (включая гетероароматические(Dolle F. et al. (2005) Curr. Pharm. Design 11: 3221-3235 заместителей или электрофильных заместителей, или связанных через дополнительную спейсерную группу, оба способа известны специалисту в данной области техники (Kilbourn MR. (1990) In Fluoribe-18 Labeling of Radiopharmaceuticals, Nuclear ScienceElsvier: Amsterdam-Boston-Heidelberg-London-New York-Oxford-Paris-San Diego-San Francisco-SingaporeSydney-Tokyo, 3-65). В особенности интересным представляется использование алкильных, алкенильных или алкинильных линкеров для присоединения атома фтор-18 (Damont A. et al (2008) J. Label. CompdsLabel. Compds Radiopharm. 50: 716-732). В случае метки другим галогеном (таким как бром-76, иод-123 или иод-124) радиоизотоп можно также непосредственно присоединять при помощи нуклеофильных или электрофильных заместителей к структуре остова (А) или связывать путем добавления спейсерной группы, оба способа известны специалисту в данной области техники (Maziere В. et al. (2001) Curr. Pharm. Des. 7: 1931-1943; Coenen H.H. et al.H.H. Mertens J., Maziere B. (Eds), Springer Verlag, Berlin-Heidelberg, 1-101). В случае метки изотопами металлов (такими как галлий-68, медь-64 или технеций-99m) используемый предпочтительный подход, который будет приниматься во внимание специалистом в данной области техники, состоит в использовании бифункционального хелатирующего агента, на основе, например,открытоцепных полиаминокарбоксилатов этилендиамин тетрауксусной кислоты (ЭДТУ) и диэтилентриамин пентауксусной кислоты (DTPA), полиаминокарбоксильного макроцикла 1,4,7,10 тетраазациклододекан-1,4,7,10-тетрауксусной кислоты (DOTA), меркаптоацетилди- и триглицина(MAG2, MAG3), бис-(S-бензоилтиогликолоил)диаминопропаноата SBT)2DAP) и гидразиноникотиновой кислоты (HYNIC), облегчающих комплексообразование катионов радиометалла в одной функциональной группе и ковалентное присоединение к молекуле остова в другой (Brunner U.K. et al. (1995) Radiotracer production - Radiometals and their chelates in Principle of Nuclear Medecine, Wagner H.N. (Ed) Saunders: Philadelphia, 220-228; Weiner R.E. et al. (2003) Chemestry of gallium indium radiopharmaceuticals InInterscience Pub., 401-422; Mahmood A. et al. (2003) Technetium radiopharmaceuticals In Handbook of Radiopharmaceuticals - Radiochemistry and Applications (Welch MJ, Redvanly CS Eds.), New York-ChichesterBrisbane-Toronto, Wiley-Interscience Pub., 323-362). Может осуществляться непосредственное присоединение атома фтора-18 (или брома-76, йода-123 или йода-124), например, в 3-фенильных и/или пиридазин[4,5-b]индольных ароматических циклах, а также в любом другом химически приемлемом положении (таком, как ацетамидная функциональная группа). Непрямое присоединение указанных радиогалогенов (например, при использовании спейсерной группы) или добавление металлических радиоактивных изотопов, упомянутых выше (галлий-68, медь-64 или технеций-99m при использовании хелатирующего агента), можно также проводить в любое химически приемлемое положение остова N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4H-пиридазин[4,5b]индол-1-ацетамида (А) (см. ссылки выше). Введение: предпочтительно введение меченного радиоактивным изотопом биомаркера проводят путем внутривенного введения. Первый вариант осуществления представляет собой применение 7-хлор-N,N,5-триметил-4-оксо-3 фенил-3,5-дигидро-4H-пиридазин[4,5-b]индол-1-ацетамида в качестве биомаркера для определения у индивидуума, уровней PBR (периферического бензодиазепинового рецептора) и воспаления, ассоциированного с патологическими состояниями, где указанное соединение представляет собой меченное радиоактивным изотопом, где радиоактивный изотоп выбран из углерода-11, радиогалогенов или радиометаллов. Предпочтительно указанное соединение представляет собой меченное радиоактивным изотопом углерод-11 и более предпочтительно меченным углеродом-11 в положении углерода метильной группы,расположенной в 5 положении индольного ядра. В другом варианте осуществления 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4Hпиридазин[4,5-b]индол-1-ацетамид мечен радиоактивным изотопом радиометаллов, предпочтительно в 3-фенильном кольце в пара-положении в 7-положении пиридазин[4,5-b]индола, замещая атом хлора (с или без спейсерной группы, см. ниже), или в любом N-метильном положении (N,N-диметилацетамидной функциональной группы или метильной группы, располагающейся в 5-положении индольного ядра). В другом варианте осуществления 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4Hпиридазин[4,5-b]индол-1-ацетамид мечен радиоактивным изотопом радиогалогенидами, предпочтительно мечен радиоактивным изотопом радиогалогенида фтор-18, предпочтительно в 3-фенильном кольце пара-положении, в 7 положении пиридазин[4,5-b]индола, замещая атом хлора (с или без спейсерной группы, см. ниже), или в любом N-метильном положении (N,N-диметилацетамидной функциональной группы или метильной группы, располагающейся в 5-положении индольного ядра). В некоторых вариантах осуществления изобретения определение уровней PBR и воспаления осуществляют при применении PET получения изображения (позитрон-эмиссионная томография) илиSPECT получением изображения (компьютерная томография одиночных фотонов). В некоторых вариантах осуществления изобретения используют меченную радиоактивным изотопом форму 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4H-пиридазин[4,5-b]индол-1-ацетамида в качестве биомаркера для определения изменения уровней PBR или воспаления, связанных с патологическими состояниями, где указанные паталогические состояния выбирают из повреждений мозга, таких как инсульт, ишемически-реперфузионное повреждение и травматическое повреждение мозга; инфекций мозга, таких как энцефалит, неврологических заболеваний, таких как множественный склероз, болезнь Альцгеймера, болезнь Паркинсона, амиотрофический латеральный склероз, слабоумие, кортикобазальная дегенерация, синдром Хантингтона и эпилепсия; психиатрических состояний, таких как шизофрения; периферических воспалительных процессов, таких как воспаление легких, атеросклероз, сердечная ишемия, почечная ишемия, ревматизм (фибромиалгия), псориазный артрит, ревматоидный артрит и остеоартрит; пролиферативных заболеваний, таких как рак. В некоторых вариантах осуществления меченную радиоактивным изотопом форму 7-хлор-N,N,5 триметил-4-оксо-3-фенил-3,5-дигидро-4H-пиридазин[4,5-b]индол-1-ацетамида используют в качестве биомаркера уровней PBR и воспаления в том случае, когда воспаление представляет собой нейровоспаление. В некоторых вариантах осуществления изобретения меченную радиоактивным изотопом форму 7 хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4H-пиридазин[4,5-b]индол-1-ацетамида используют для оценки эффективности терапевтического лечения. Настоящее изобретение также касается способа определения PBR и воспаления, связанного с патологическими состояниями при применении меченной радиоактивным изотопом формы 7-хлор-N,N,5 триметил-4-оксо-3-фенил-3,5-дигидро-4H-пиридазин[4,5-b]индол-1-ацетамида. В некоторых вариантах осуществления меченная радиоактивным изотопом форма 7-хлор-N,N,5 триметил-4-оксо-3-фенил-3,5-дигидро-4H-пиридазин[4,5-b]индол-1-ацетамида содержит радиоактивную метку, выбранную из углерода-11, радиогалогенов и радиометаллов. В некоторых вариантах осуществления меченная радиоактивным изотопом форма 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро 4H-пиридазин[4,5-b]индол-1-ацетамида мечена углеродом-11. В некоторых вариантах осуществления меченная радиоактивным изотопом форма 7-хлор-N,N,5-4 020612 триметил-4-оксо-3-фенил-3,5-дигидро-4H-пиридазин[4,5-b]индол-1-ацетамида мечена радиоактивным изотопом по углероду метильной группы, расположенной в 5-положении индольного ядра. В некоторых вариантах осуществления 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4Hпиридазин[4,5-b]индол-1-ацетамид мечен радиометаллами, предпочтительно по 3-фенил кольцу в параположении, в 7-положении пиридазин[4,5-b]индола, замещая атом хлора (с или без спейсерной группы,см. ниже), или в любом N-метильном положении (N,N-диметилацетамидной функциональной группы или метильной группы, располагающейся в 5-положении индольного ядра). В некоторых вариантах осуществления 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4Hпиридазин[4,5-b]индол-1-ацетамид мечен радиогалогенидами, предпочтительно мечен радиоактивным изотопом радиогалогенида фтор-18, предпочтительно по 3-фенил кольцу в пара-положении, в 7 положении пиридазин[4,5-b]индола, замещая атом хлора (с или без спейсерной группы, см. ниже), или в любом N-метильном положении (N,N-диметилацетамидной функциональной группы или метильной группы, располагающейся в 5 положении индольного ядра). В некоторых вариантах осуществления изобретения патологические состояния выбраны из повреждений мозга, таких как инсульт, ишемически-реперфузионное повреждение, травматическое повреждение мозга; инфекций мозга, таких как энцефалит; неврологических заболеваний, таких как множественный склероз, болезнь Альцгеймера, болезнь Паркинсона, амиотрофический латеральный склероз, слабоумие, кортикобазальная дегенерация, синдром Хантингтона и эпилепсия; психиатрических состояний,таких как шизофрения; периферических воспалительных процессов, таких как воспаление легких, атеросклероз, сердечная ишемия, почечная ишемия, ревматизм (фибромиалгия), псориазный артрит, ревматоидный артрит и остеоартрит; пролиферативных заболеваний, таких как рак. Другой вариант осуществления согласно изобретению представляет собой способ определения PBR и воспаления, связанного с патологическими состояниями, где воспаление представляет собой нейровоспаление. Другой вариант осуществления соглавно изобретению представляет собой способ определения PBR и воспаления, связанного с патологическими состояниями, который проводят для исследования заполнения. Другой вариант осуществления представляет собой способ определения PBR и воспаления, связанного с патологическими состояниями, указанный способ, включает следующие стадии:a) Введение меченной радиоактивной меткой формы 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5 дигидро-4H-пиридазин[4,5-b]индол-1-ацетамида;b) Получение изображения интересующей области головного мозга или других периферических тканей при применении способа PET (или SPECT);c) Количественная оценка уровней PBR в интересующей области путем количественной оценкиPET сигнала, ассоциированного с меченной радиоактивной меткой формы 7-хлор-N,N,5-триметил-4 оксо-3-фенил-3,5-дигидро-4H-пиридазин[4,5-b]индол-1-ацетамида;e) Определение присутствия воспаления, связанного с патологическими состояниями. Настоящее изобретение также относится к диагностическому набору для определения уровней PBR,связанных с нормальными состояниями и изменениями уровней PBR, связанными с патологическими состояниями, включающему меченную радиоактивной меткой форму 7-хлор-N,N,5-триметил-4-оксо-3 фенил-3,5-дигидро-4 Н-пиридазин[4,5-b]индол-1-ацетамида. Последующие примеры допролнительно иллюстрируют настоящее изобретение и не предназначены для ограничения изобретения. С точки зрения облегчения чтения соединение 7-хлор-N,N,5-триметил-4 оксо-3-фенил-3,5-дигидро-4H-пиридазин[4,5-b]индол-1-ацетамид на чертежах и в результатах было переименовано как "А". Фиг. 1: Кривые активность-время [11C]-A и [11C]PK11195 в поврежденном и интактном полосатом теле крысы. Данные представлены как процент инъецированной дозы на кубический сантиметр как функция от времени после инъекции (мин). Фиг. 2: Соотношение поглощения [11C]-А и [11C]РK11195 в поврежденном и интактном полосатом теле крысы. Фиг. 3: Кривые активность-время [11C]-А в поврежденном (ipsi) и интактном (contro) полосатом теле крысы. Стрелка указывает добавление избытка 1 мг/кг РКП 195 через 20 мин после инъекции [11C]-A в поврежденное (ipsi+PK) и интактное контролатеральное (contro+PK) полосатое тело крысы. Данные выражены как процент инъецированной дозы на кубический сантиметр как функция времени после инъекции (мин). Фиг. 4: Кривые активность-время [11C]-A в поврежденном (ipsi А) и интактном (contro А) полосатом теле крысы. Стрелка указывает добавление избытка 1 мг/кг А через 20 мин после инъекции [11C]-A в поврежденное (ipsi A+A) и интактное контролатеральное (contro A + А) полосатое тело крысы. Данные выражены как процент инъецированной дозы на кубический сантиметр как функция времени после инъекции (мин).-5 020612 Фиг. 5: Авторадиография [11C]-A в срезе (20 мкм) головном мозге крысы через 7-8 дней после повреждения. Неспецифическое связывание достигали при использовании избытка немеченого[11C]PK11195 (23 мМ) или А (22 мМ). Специфичность PBR по отношению к бензодиазепиновых участков связывания оценивали при использовании избытка немеченого Флюмазенила (27 мкМ). Данные выражены как доза в месяц (dpm) на произвольную область.обозначает значительное различие по сравнению с [11C]-A (18 нМ) связыванием в поврежденном полосатом теле. Фиг. 6: Кривые активность-время [11C]-A и [11C]PK11195 в полном головном мозге (мозжечок исключен) 11-12 месячных APP/S1 и дикого типа PS1 трансгенных мышей. Данные представлены как процент инъецированной дозы на кубический сантиметр как функция от времени после инъекции (мин). Фиг. 7: Авторадиография [11C]-A (18 нМ) в срезе целого головного мозга 20-23 месячных APP/S1 и дикого типа PS1 трансгенных мышей. Неспецифическое связывание достигали при использовании избытка или немеченого [11 С]PK11195 (23 мкМ), или А (22 мкМ). Специфичность PBR по отношению к бензодиазепиновым участкам связывания оценивали при использовании избытка немеченого Флюмазенила (27 мкМ). Данные выражены как доза в месяц (dpm) на условную область. Фиг. 8: Кривые активность-время [11C]-A в четырех различных областях мозга у примата, отличного от человека (правое и левое полосатые тела, префронтальная кора, мозжечок) и соответствующие совокупности PET изображений избранных сечений коронального головного мозга в течение 120 мин при различных моментах времени исследования: исходный (А,В) и через 24 ч после повреждения правого полосатого тела (С, D). Панель (Е, F) показывает время активности [11C]-A через 48 ч после повреждения в левом полосатом теле и через 7 месяцев после повреждения в правом полосатом теле. Данные представлены как процент инъецированной дозы на 100 мл (%ID/100 мл) как функция от времени после инъекции (мин). Фиг. 9: Кривые активность-время [11C]-A в четырех различных областях мозга (правое и левое полосатые тела, префронтальная кора, мозжечок) и соответствующие совокупности PET изображений избранных сечений коронального головного мозга в течение 120 мин при различных моментах времени исследования: исходный (А,В) и через 48 ч после повреждения (С, D), на 9 день после повреждения (Е,F) и 16 день после повреждения в левом полосатом теле и 48 ч после повреждения в правом полосатом теле (G, Н). Стрелка указывает добавление избытка немеченого РК 11195 (1 мг/кг). Данные выражены как процент инъецированной дозы на 100 мл (%ID/100 мл) как функция от времени после инъекции (мин). Фиг. 10: Анализ [11C]-A метаболитов в плазме и мозге. Фиг. 11: выбранные меченные углеродом-11 и фтором-18 формы А. Способы Радиосинтез лигандов. Метка углеродом-11[11 С]PK11195 R)-N-[11 С]метил-N-(1-метилпропил)-1-(2-хлорфенил)изохинолин-3-карбоксамида,R-энантиомер). Получение [11C]PK11195 основывается на минимальных модификациях опубликованного способа(об./об.), 300 мкл), содержащего от 1,5 до 2,0 мг предшественника для мечения и 15-20 мг порошкообразного гидроксида (избыток); (2) нагревание при 110 С в течение 3 мин; (3) прием смеси в 0,5 мл мобильной фазы ВЭЖХ и (4) очистка полупрепаративной ВЭЖХ. Контроль качества, в особенности определения радиохимической и химической чистоты, проводили в аликвоте партии конечного продукта.[11C]-A мечение по N-метилиндольной функциональной группе: 7-хлор-N,N-диметил-5-[11C]метил 4-оксо-3-фенил-3,5-дигидро-4H-пиридазин[4,5-b]индол-1-ацетамида). Получение [11 С]-А включает следующие стадии: (1) поглощение при -10 С [11C]метилтрифталата в ДМФА (300 мкл), содержащего от 0,2 до 0,3 мг предшественника для мечения и 4 мг порошкообразного карбоната калия (избыток); (2) нагревание при 120 С в течение 3 мин; (3) прием смеси в 0,5 мл мобильной фазы ВЭЖХ и (4) очистка полупрепаративной ВЭЖХ. Контроль качества, в особенности определения радиохимической и химической чистоты, проводили в аликвоте партии конечного продукта.[11 С]-А (мечение по N,N-диметилацетамидной функциональной группе: 7-хлор-N-[11C]метил-N,5-диметил-4-оксо-3-фенил-3,5-дигидро-4H-пиридазин[4,5-b]индол-1-ацетамида) Получение [11C]-А также включает следующие стадии: (1) поглощение при -10 С [11C]метилиодида в 1/2 (об./об.) смеси ДМФА/ДМСО (100/200 мкл), содержащего от 0,5 до 1,0 мг предшественника для мечения и 5 мкл 1 М раствора тетрабутиламмоний гидрохлорида в метаноле; (2) нагревание при 120 С в течение 3 мин; (3) прием смеси в 0,5 мл мобильной фазы ВЭЖХ и (4) очистка полупрепаративной ВЭЖХ. Контроль качества, в особенности определения радиохимической и химической чистоты, проводили в аликвоте партии конечного продукта. Мечение фтором-18. Получение всех меченных фтором-18 производных А включало, по крайней мере, следующие ста-6 020612 дии: (1) фторирование при использовании источника [18F]фторида при от умеренной до высокой температуре в выбранном растворителе (от 300 до 900 мкл), содержащем от 1 до 10 мг пригодного предшественника для мечения и (2) очистки при применении, например, полупрепаративной ВЭЖХ. Как описано выше, контроль качества, в особенности определение радиохимической и химической чистоты, проводили в аликвоте партии конечного продукта. Нет особенного ограничения в отношении природы источника анионов [18F]фторида для применения в настоящей реакции, и любые источники аниона [18F]фторида, условно используемые в реакциях этого типа, могут быть в равной степени использованы здесь, обеспечивая, чтобы не оказывалось отрицательного влияния на другие части молекулы. Примеры пригодных источников анионов [18F]фторида включают [18F]фториды щелочного металла, такие как [18F]фторид натрия, [18F]фторид калия,[18F]фторид цезия, [18F]фторид аммония, [18F]фториды тетраалкиламмония, такие как [18F]фторид тетрабутиламмония. Из них [18F]фториды щелочного металла, особенно фторид калия, представляют собой предпочтительные. Источник анионов [18F]фторида может быть активирован присутствием лиганда, способного образовывать комплекс с противокатионной разновидностью источника анионов [18F]фторида. Лиганд может в особенности представлять собой циклический или полициклический мультидентатный лиганд. Примеры пригодных лигандов включают в особенности краун-эфиры, такие как 1,4,7,10,13 пентаоксациклооктадекан (18-С-6) или криптанды, такие как 4,7,13,16,21,24-гексаокса-1,10 диазабицикло-[8,8,8]гексакозан, продаваемый под названием К 222. Предпочтительно источник анионов [18F]фторида представляет собой криптатный комплекс щелочного металла [18F]фторида, особенно криптатный комплекс [18F]фторида калия, предпочтительно[18F]фторид 4,7,13,16,21,24-гексаокса-1,10-диазабицикло-[8,8,8]гексакозана калия (К[18F]/K222). Комплекс K[18F]/K222 может быть получен любыми традиционными способами (Dolle F. et al. (1999) J. Med.Chem. 42: 2251-2259 or Dolci L. et al. (1999) Bioorg. Med. Chem. 7: 467-479). Реакцию фторирования можно проводить в различных растворителях, и она может происходить в широком диапазоне температур. В общем, удобно проводить реакцию при температуре от 50 до примерно 200C и более часто используемые растворители представляют собой диметилсульфоксид (ДМСО),диметилформамид (ДМФА) и ацетонитрил. Время, необходимое для прохождения реакции может также широко варьировать (например, от 5 до 15 мин) в зависимости от многочисленных факторов, особенно температуры реакции, природы реакционных агентов и растворителей и количества используемого меченного предшественника (Kilbourn MR. (1990) In: Fluorine-18 Labeling of Radiopharmaceuticals, Nuclearal. (2008) Eur. J. Org. Chem. 17: 2853-2873: Dolle F. et al. (2008) in Flouorine and Health: Molecular Imaging,Biomedical Materials and Pharmaceuticals, Tressaud A, Haufe G (Eds). Elsevier: Amsterdam- BostonHeidelberg-London New York-Oxford-Paris-San Diego-San Francisco-Singapore-Sydney-Tokyo, 3-65). Меченные радиоактивным фтором соединения, полученные таким образом, обычно очищают ВЭЖХ, как описано для производных, меченных углеродом-11, но их можно также выделять или предварительно очищать из реакционной смеси путем применения других известных хроматографических технологических способов или простой фильтрацией на предварительно упакованной разделительной колонке.(1) поглощение К[18F]F-Kryptofix222 комплекса с раствором ДМСО (600 мкл), содержащим тозилокси предшественник для мечения (2,0-8,0 мг); (2) нагревание при 165C в течение 3-10 мин; (3) предварительная очистка при использовании С-8 или С-18 PrepSep картриджа и (4) очистка при использовании полупрепаративной ВЭЖХ. Контроль качества, в особенности определения радиохимической и химической чистоты, проводили в аликвоте партии конечного продукта. Мечение другими галогенами (бром-76, йод-123, йод-124) При получении всех прочих радиогалогенированных производных (бром-76, йод-123, йод-124) следуют стандартным технологическим способам и процедурам, известным специалисту в данной области техники (Maziere В. et al. (2001) Curr. Pharm. Des. 7: 1931-1943; Coenen H.H. et al. (2006) In Radioiodination reactions for Pharmaceuticals - Compendium for effective synthesis strategies, Coenen H.H., Mertens J.,Maziere B. (Eds.), Springer Verlag, Berlin-Heidelberg, 1-101). Мечение радиометаллами (галлий-68, медь-64 и технеций-99m) При получении производных, меченных радиометаллами (галлий-68, медь-64 и технеций-99m),также следуют стандартным технологическим способам и процедурам, известных специалисту в данной области техники (Brunner U.K. et al., (1995) Radiotracer production - Radiometals and their chelates in Principle of Nuclear Medicine, Wagner H.N. (Ed.) Saunders : Philadelphia, 220-228; Weiner R.E. et al. (2003) Chemistry of gallium and indium radiopharmaceuticals in Handbook of Radiopharmaceuticals - Radiochemistry andM.J., Redvanly CS Eds.), New York - Chichester - Brisbane -Toronto, Wiley-Interscience Pub., 323-362). Состав Состав [11C] PK11195, [11C]-A или любых других несущих радиоактивную метку производных А,как в растворе для внутривенных (i.v.) инъекций часто включают удаление ВЭЖХ растворителей на основе картриджа Waters SepPak и/или простое разбавление водным 0,9% раствором NaCl (физиологический раствор) до концентрации этанола ниже 10%. Экспериментальные модели на животных Все исследования проводили в соответствии с законодательством Франции или Европейскими указаниями. Экспериментальная модель нейровоспаления на крысе Крыс Wistar (средний размер тела 300 г, centre d'levage Rene Janvier, France) держали при условиях терморегуляции в условиях контроля влажности при цикле свет/темнота 12 ч/12 ч (свет включен в диапазоне от 7 утра до 7 вечера) и предоставляли свободный доступ к пище и воде. Нейровоспаление индуцировали стереотаксической инъекцией АМРА (альфаамино-3-гидрокси-5-метил-4-изоксазолпропионат)(15 мМ в PBS буфере, Sigma) при использовании 1 мкл микрошприца и микронасоса (скорость инъекции 0,5 мкл/мин, UltraMicroPump II и Micro4 Controller, WPI Inc., USA), как было описано ранее (Boutin et al., (2007) Glia 55: 1459-68; Boutin et al. (2007) J. Nucl. Med. 48: 573-581). AMPA (0,5 мкл) инъецировали в правое полосатое тело (+0,7 мм от брегмы, 2,7 мм от сагиттального шва, глубина от поверхности мозга 5,5 мм). Животных поддерживали при нормальной температуре тела (температура тела 36,70,5C,среднееSD) в ходе хирургической операции путем использования термоодеяла (Homeothermic BlanketControl Unit, Harvard Apparatus Limited, Edenbridge, Kent, UK). Экспериментальная модель нейровоспаления на приматах Макак-крабоедов (Масаса fascicularis) весом 4-5 кг поселяли в условиях с возможностью регуляции температуры и влажности при световом/темновом цикле 12 ч/12 ч (свет между 7 ч утра и 7 ч вечера) и им предоставляли свободный доступ к пище и воде. Нейровоспаление индуцировали стереотаксической инъекцией хинолиновой кислоты (хинолиновая кислота, Sigma, St Louis, МО; растворенная в 0,1 М PBSpH 7,2) в полосатое тело приматов (1 точка инъекции хвостатое ядро и 2 точка инъекции путамен) в ходе двух различных хирургических вмешательств, в ходе которых хинолиновую кислоту инъецировали в один день в одно полушарие и во второе полушарие 2 недели или 7 месяцев спустя (фиг. 8 и 9). В ходе каждого хирургического вмешательства животные получали 60 нмоль хинолиновой кислоты, распределенной в три различные точки полосатого тела, точка 5 мкл в хвостатое ядро и две точки 10 мкл в путамен при использовании 10 мкл шприца Гамильтона, присоединенного к игле 26. Стереотактические координаты, определенные согласно стереотактическому атласу Swabo and Cowan (1984), представляли собой следующее каудальная точка [АР: +19 мм, ML6 мм, DV -14 мм от синуса] ; путаминальная точка 1 [АР + 19 мм, ML12 MM, DV -17 мм от стереотаксического нуля] ; путаминальная точка 2 [АР: +17 мм,ML:13 мм, DV: -16 мм от синуса]. Эксайтотоксин инъецировали со скоростью 0,1 мкл/мин и инъекционный шприц оставляли на месте на дополнительные 5 мин для того, чтобы избежать обратного потока токсина. В ходе хирургического вмешательства поддерживали нормальной температуру тела примата(ректальная температура 36C0,6C, среднееSD). После извлечения иглы кожу зашивали и животных оставляли оправляться от анестезии и возвращали в их клетки, когда они были полностью бодрствующими. Трансгенные мыши Получение и характеристику мышей, трансгенных по одному PS1M146L (PS1) и двумAPP751SLPSlM146L (APPPS1) достигали, как описано ранее (Blanchard V. et al. (2003) Exp. Neurol 184: 247-263). У таких животных АРР экспрессировался на высоких уровнях во всех кортикальных нейронах под контролем промотора Thy-1. Человеческий PS1 с мутацией M146L экспрессировался под контролем промотора HMG-CoA редуктаза. Было обнаружено, что уровень амилоидной нагрузки был в достаточной степени воспроизводимым для заданного возраста. И одиночных PS1, и двойных APPPS1 мыши, обеспечиваемые Sanofi-Aventis, использовали для PET получения изображения в возрасте 11-12 месяцев и для авторадиографии в возрасте 20-23 месяца.MicroPET сканирования и получение данных Крысы и трансгенные мышиMicroPET получение изображения производили через 7 дней после инъекции АМРА крысам и трансгенным мышам в возрасте 11-12 месяцев. И крысам и мышам вводили для анастезии изофлуран 5% и после чего поддерживали на растворе 2-2,5% изофлурана в смеси 70%/30% NO2/O2. Для PET сканирований голову крысы помещали в стереотаксическую рамку собственного изготовления, совместимую с получением данных PET и у крыс поддерживали нормальную температуру (ректальная температура 36,7C0,5C, среднееSD). Мышей помещали на подложку, оснащенную маской для анастезии, позво-8 020612 ляющей нагревать поток воздуха, и отслеживали ректальную температуру при использовании Homeothermic Blanket Control Unit. Все протоколы получения изображений проводили при использовании Concorde Focus PET сканирования при использовании или [11C]PK11195, или [11 С]-А. У крыс меченные радиоактивными изотопами соединения и немеченные лиганды инъецировали в хвостовую вену при использовании катетера 24. Меченные радиоактивным изотопом соединения инъецировали в сочетании с началом получения данных PET и немеченые соединения инъецировали через 20 мин после инъекции радиоактивной метки. Данные PET получали в течение 80 мин. У мышей меченные радиоактивным изотопом соединения инъецировали в хвостовую вену при использовании иглы 28 непосредственно перед началом PET сканирования. Данные PET собирали в течение 60 мин. Приматы Сеансы получения изображений проводили перед и через различное время после инъекции хинолиновой кислоты (24, 48, 9 дней, 16 дней и 7 месяцев после повреждения). Инъецировали [11C]-А и исследовали кинетику головного мозга при помощи PET в течение 90 мин. За один час до PET получения изображения животных анастезировали внутримышечной инъекцией смеси кетамина/ксилазина (15/1,5 мг/кг) и интубировали. Затем ставили катетеры в подкожную вену ноги и бедренную артерию для отбора крови. Животных поддерживали в анастезированном состоянии путем внутривенной инъекции пропофола (Diprivan 1%; 0,05 мгкг-1 мин-1). Для обеспечения корректного положения животного в аппарате голову животного закрепляли в стереотаксической рамке собственного изготовления. PET сканирования проводили при использованииFocus Micro-Pet высокого разрешения (CTI-Siemens, Knoxville, TN), который собирает данные в 95 последовательных плоскостях одновременно. Для поправки на затухание сначала проводили трансмиссионное сканирование при использовании крутящегося стержня источника 68Ge. Макак инъецировали внутривенно 192,2933,67 МБк [11C]-А и проводили сбор данных в течение 90 мин. Весь сбор данныхPET проводили в режиме list mode (3D режим) и изображения реконструировали при использовании следующего временного интервала: (4 изображения в 25 с) + (4 изображения в 30 с) + (2 изображения в 1 мин) + (5 изображений в 2 мин) + (3 изображения в 5 мин) и (3 изображения в 10 мин), и (1 изображение в 15 мин), в течение общего времени 90 мин для [11C]-A. Анализ изображенийPET анализ изображений проводили при использовании ASIPro VM (CTI Concorde Microsystems'Analysis Tools and System Setup/Diagnostics Tool) и Brainvisa/Anatomist (http://brainvisa.info/). Анализ метаболитов в крови и головном мозге крыс Неподвергнутым воздействию или оперированным самцам Wistar крыс (вес тела 300-400 г) инъецировали внутривенно в хвостовую вену [11C]-A. Животных умерщвляли через 10, 20 или 30 мин. Отбирали образец крови и изолировали плазму центрифугированием (5 мин, 3000 об./мин). Белки плазмы осаждали из 400 мкл плазмы путем добавления 400 мкл ацетонитрила. После центрифугирования (5 мин, 3000 об./мин.) супернатант вкалывали в колонку ВЭЖХ. У крыс изолировали головной мозг и разделяли полушария. Гомогенизацию ультразвуком проводили в 1 мл ацетонитрила на полушарие. После быстрого центрифугирования отделяли супернатант от центрифугированного осадка и концентрировали при пониженном давлении перед вкалыванием в ВЭЖХ (см. радиохимическую часть для условий ВЭЖХ). Авторадиография[11C]-A авторадиографию проводили при использовании 20 мкм срезов головного мозга крыс (7-8 дней после повреждения) или мышей (20-23 месяца). Неспецифическое связывание оценивали при использовании избытка или немеченного PK11195, или А. Специфичность PBR по отношению к центральным сайтам связывания бензодиазепина оценивали при использовании избытка немеченного флюмазенила. Срезы инкубировали в течение 20 мин в Трис буфере (TRIZMA предварительно установленные кристаллы, Sigma, установленный при pH 7,4 при 4C, 50 мМ при использовании 120 мМ NaCl), затем промывали 2 раза в течение 2 мин холодным буфером с последующим быстрым промыванием холодной дистиллированной водой. Срезы затем помещали в непосредственный контакт с экраном PhosphorImager и оставляли на ночь. Авторадиограммы анализировали при использовании программного обеспечения ImageQuant. Пример 1. Радиосинтез [11C]PK11195 Конечную очистку ВЭЖХ [11C] PK11195 проводили при использовании полупрепаративной WatersSymmetry C-18 ВЭЖХ колонке (элюент:вода/ацетонитрил/ТФУ : 40/60/0,1 [об.:об.:об.]; скорость потока: 7 мл/мин) и собирали пик, соответствующий радиохимически чистому [11C]PK11195 (реальное время: 6,5-7,0 мин). Обычно, начиная с циклотронной партии продукции 55,5 ГБк [11C]CO2, примерно 4,5-5,0 ГБк [11C]PK11195 получали в течение 30 мин радиосинтеза (включая ВЭЖХ очистку и составление). Радиохимическая чистота (определенная аналитической ВЭЖХ на Waters Symmetry-M C-18 колонке) составляла более чем 95% и конкретные радиоактивности составляли в диапазоне от 50 до 90 ГБк/мкмоль (в конце радиосинтеза). Пример 2. Радиосинтез [11C]-A (меченного по N-метилиндольной функции Конечную очистку ВЭЖХ [11C]-А проводили при использовании полупрепаративной Zorbax SB-9 020612C-18 ВЭЖХ колонке (элюент: 0,9% водный NaCl/EtOH/lM водного фосфатного буфера (рН 2,3): 50/50/0,1[11 С]-А (реальное время : 8,0-8,5 мин). Обычно, начиная с циклотронной партии продукции 55,5 ГБк[11C]CO2, примерно 4,5-6,0 ГБк [11C]-А получали в течение 25 мин радиосинтеза (включая ВЭЖХ очистку и составление). Радиохимическая чистота (определенная аналитической ВЭЖХ на Waters SymmetryM C-18 колонке) составляла более чем 95% и конкретные радиоактивности составляли в диапазоне от 50 до 90 ГБк/мкмоль (в конце радиосинтеза). Пример 3. Радиосинтез [11C]-A (меченного по N,N-диметилацетамидной функции Конечную очистку ВЭЖХ [11 С]-А проводили при использовании полупрепаративной SymmetryPrep C-18 ВЭЖХ колонке (элюент: вода/ацетонитрил/ТФУ: 50/50/0,1 [об.:об.:об.]; скорость потока: 5 мл/мин) и собирали пик, соответствующий радиохимически чистому [11C]-А (реальное время: 8,08,5 мин). Обычно, начиная с циклотронной партии продукции 55,5 ГБк [11C]CO2, примерно 3,5-5,0 ГБк А получали в течение 25 мин радиосинтеза (включая ВЭЖХ очистку и составление). Радиохимическая чистота (определенная аналитической ВЭЖХ на Waters Symmetry-M C-18 колонке) составляла более чем 95% и конкретные радиоактивности составляли в диапазоне от 50 до 90 ГБк/мкмоль (в конце радиосинтеза). Пример 4.i) Синтез 4-гидрокси-А. 4-гидрокси-А можно повторно синтезировать согласно WO 00/44384. Rf:0,15 (SiO2-TLCii) Радиосинтез [11 С]метокси-А. Мечение углеродом-11 и конечную ВЭЖХ очистку можно производить, как описано для получения[11C]-A (пример 2/пример 3) при использовании 4-гидроксипроизводного А, синтезированного непосредственно выше (пример 4i). Пример 5. Общая процедура синтеза (фтор)алкокси-А и тозилоксиалкокси-А. К суспензии K2CO3 (101 мг, 0,7 3 ммоль) в безводном ДМФ (8-12 мл) добавляли 4 гидроксипроизводное А (150 мг, 0,36 ммоль, см. WO00/44384) в растворе в безводном ДМФ (2 мл). Реакционную смесь перемешивали в течение 30 мин при комнатной температуре, с последующим постепенным добавлением подходящего алкилирующего агента (2 экв.) в растворе в ДМФ (2 мл). Всю смесь затем перемешивали в течение 2 ч при 70C и перемешивали в течение дополнительного часа при комнатной температуре. Смесь затем гасили добавлением насыщенного водного раствора NH4Cl и экстрагировали CH2Cl2. Органические слои соединяли, промывали рассолом, сушили над сульфатом натрия, фильтровали и концентрировали досуха. Осадок очищали хроматографией на колонке с силикагелем(CH2Cl2/MeOH 98:2 до 95:5 об./об. в качестве элюента) для получения ожидаемого (фтор)алкокси-А в виде белого порошка или белого рыхлого твердого вещества. Пример 6. Синтез метокси-А. Общую процедуру, описанную выше (пример 5), использовали с метилиодидом с предоставлением целевого соединения с выходом 40%. Rf: 0,35 (SiO2-TLC (CH2Cl2/MeOH: 95/5 об.:об 1H-ЯМР (CDCl3)7,94 (д, 1 Н, J: 8,4 Гц), 7,53 (м, 3H), 7,33 (дд, 1 Н, J: 8,4, 1,6 Гц), 7,00 (д, 2 Н, J: 8,8 Гц), 4,32 (с, 3H), 4,18 (с,2 Н), 3,86 (с, 3H), 3,22 (с, 3H), 3,00 (с, 3H). 13 С NMR (CDCl3)168,4 [С], 158,9 [С], 155,3 [С], 141,6 [С],140,1 [С], 134,6 [С], 133,2 [С], 131,3 [С], 127,3 [2.СН], 123,3 [СН], 123,0 [СН], 119,0 [С], 117,4 [С], 113,9Radiopharm. 51: 28 6-2 92) с предоставлением целевого соединения с выходом 63%. Rf : 0,38 (SiO2-TLC(CH2Cl2/MeOH: 95/5 об.:об 1H-ЯМР (CD2Cl2)7,89 (д, 1 Н, J: 8,8 Гц), 7,58 (д, 1 Н, J: 1,6 Гц), 7,54 (д, 2 Н,J: 9,2 Гц), 7,34 (дд, 1 Н, J: 8,8, 1,6 Гц), 7,03 (д, 2 Н, J: 9,2 Гц), 4,78 (дт, 2 Н, J2H-F: 47,6, J3H-H: 4,0 Гц), 4,32 (с,3H), 4,27 (дт, 2 Н, J3H-F: 28,4 Гц, J3H-H: 4,0 Гц), 4,16 (с, 2 Н), 3,19 (с, 3H), 2,96 (с, 3H). 13 С-ЯМР (CD2Cl2)168,2 [С], 157,6 [С], 155,1 [С], 141,3 [С], 140,7 [С], 140,3 [С], 135,4 [С], 132,8 [С], 127,4 [2.СН], 123,2 [СН],122,6 [СН], 118,9 [С], 117,2 [С], 114,3 [2.СН], 110,7 [СН], 82,0 [д, J1C-F: 169 Гц, СН 2], 67,5 [д, J2C-F: 20 Гц,СН 2], 39,5 [СН 2], 37,4 [СН 3], 35,2 [СН 3] , 31,6 [СН 3]. Анализ, вычислено для C23H22ClFN4O3.0,15 Н 2 О: С,60,11, Н, 4,89, N, 12,19, найдено : С, 60,00, Н, 4,96, N, 12,18. Пример 8. Синтез фторпропокси-А. Общую процедуру, описанную выше (пример 5), использовали с 3-фторпропил-4 метилбензолсульфонатом с предоставлением целевого соединения с выходом 58%. Rf:0,39 (SiO2-TLC(CD2Cl2)168,2 [С], 158,0 [С], 155,1 [С], 141,3 [С], 140,3 [С], 135,0 [С], 132,8 [С], 131,3 [С], 127,3 [2.СН],123,2 [СН], 122,5 [СН], 119,0 [С], 117,2 [С], 114,2 [2.СН], 110,7 [СН], 80,8 [д, J1C-F: 163 Гц, СН 2], 63,9 [д,J3C-F: 6,0 Гц, СН 2], 39,5 [СН 2], 37,4 [СН 3], 35,2 [СН 3], 31,5 [СН 3], 30,3 [СН 2, J2C-F: 20,0 Гц]. Пример 9. Синтез фторбутокси-А. Общую процедуру, описанную выше (пример 5), использовали с 4-фторбутилбромидом с предоставлением целевого соединения с выходом 70%. Rf:0,40 (SiO2-TLC (CH2Cl2/MeOH: 95/5 об.:об 1[СН 3], 31,5 [СН 3], 27,1 [СН 2, J2C-F: 20,0 Гц], 25,1 [СН 2, J3C-F: 5,0 Гц]. Пример 10. Синтез 2-(фторэтокси)этокси-А. Общую процедуру, описанную выше (пример 5), использовали с 2-(2-фторэтокси)этил-4 метилбензолсульфонатом с предоставлением целевого соединения с выходом 69%. Rf: 0,45 (SiO2-TLC[СН 3], 31,6 [СН 3]. Пример 11. Синтез 2-(2-(фторэтокси)этокси)этокси-А. Общую процедуру, описанную выше (пример 5), использовали с 2-(2-(2-фторэтокси)этокси)этил-4 метилбензолсульфонатом с предоставлением целевого соединения с выходом 63%. Rf:0,32 (SiO2-TLC[СН 3], 31,6 [СН 3]. Пример 12. Синтез тозилэтокси-А. Общую процедуру, описанную выше(пример 5), использовали с этан-1,2-диил бис(4 метилбензолсульфонатом) (синтезированным согласно Damont A. et al. (2008) J. label. Compds Radiopharm. 51: 286-292) с предоставлением целевого соединения с выходом 45%. Rf: 0,72 (SiO2-TLC(CH2Cl2/MeOH: 95/5 об.: об.) ). 1H-ЯМР (CD2Cl2)7,89 (д, 1 Н, J: 8,8 Гц), 7,84 (д, 2 Н, J: 8,4 Гц), 7,60 (д,1 Н, J: 1,6 Гц), 7,53 (д, 2 Н, J: 8,8 Гц), 7,41 (д, 2 Н, J: 8,4 Гц), 7,36 (дд, 1 Н, J: 8,8, 1,6 Гц), 6,91 (д, 2 Н, J: 8,8 Гц), 4,40 (т, 2 Н, J: 4,4 Гц), 4,32 (с, 3H), 4,22 (т, 2 Н, J: 4,4 Гц), 4,17 (с, 2 Н), 3,21 (с, 3H), 2,98 (с, 3H), 2,48 (с,3H). 13 С-ЯМР (CD2Cl2)168,1 [С], 157,2 [С], 155,0 [С], 145,2 [С], 141,2 [С], 140,3 [С], 135,5 [С], 132,8 [С],132,7 [С], 131,3 [С], 129,9 [2.СН], 127,9 [2.СН], 127,4 [2.СН], 123,2 [СН], 122,6 [СН], 118,9 [С], 117.2 [С],114,4 [2,СН], 110,7 [СН], 68,3 [СН 2], 65,8 [СН 2], 39,5 [СН 2], 37,4 [СН 3], 35,2 [СН 3], 31,6 [СН 3], 21,3 [СН 3]. Тозилоксипропокси-А, тозилоксибутокси-А, 2-(тозилоксиэтокси)этокси-А и 2-(2-(тозилоксиэтокси)этокси)этокси-А в качестве предшественников для мечения фтором-18 описанных выше фторалкокси-А производных могут быть получены, как описано непосредственно выше при использовании подходящего алкилирующего реакционного агента. Пример 13. Радиосинтез [18F]фторэтокси-А: конечную ВЭЖХ очистку [18F]фторэтокси-А осуществляли при использовании полупрепаративной Symmetry С-18 ВЭЖХ колонке (элюент: вода/ацетонитрил/ТФУ: 60/40/0,1 [об.:об.:об.]; скорость потока: 5 мл/мин) и собирали пик, соответствующий радиохимически чистому [18F]фторэтокси-А (реальное время : 11,0-13,0 мин). Начиная с циклотронной партии продукции 37 ГБк [18F]фторид, примерно 3,7 ГБк [18F]фторэтокси-А получали в течение 90 мин радиосинтеза (включая ВЭЖХ очистку и составление). Радиохимическая чистота (определенная аналитической ВЭЖХ на Waters Symmetry-M С-18 колонке) составляла более чем 95% и конкретные радиоактивности составляли более чем 50 ГБк/мкмоль (в конце радиосинтеза).[18F]фторпропокси-А, [18F]фторбутокси-А, 2-([18F]фторэтокси)этокси-А и 2-(2-([18F]фторэтокси) этокси)этокси-А могут быть получены как описано непосредственно выше из соответствующих тозилалкокси-А производных (пример 12) в качестве предшественников для фтор-18 мечения. Пример 14. Поглощение [11 С]-А представляет собой значительно более высокое в поврежденном полосатом теле крыс, инъецированных АМРА (область, в которой индуцируется экспрессия PBR) по сравнению с интактным контралатеральным полосатым телом, которое, как ожидается, не экспрессирует или экспрессирует незначительные количества PBR (фиг. 1). Поглощение [11C]-A также представляет собой значительно более высокое по сравнению с поглощением, наблюдаемым с лигандом сравнения PBR PET,[11C]PK11195 в поврежденном полосатом теле (фиг. 1). Отношение поглощения в поврежденном по сравнению с интактным полосатым телом также представляет собой значительно более высокое для[11C]-A по сравнению с [11C]PK11195 (фиг. 2). Связывающий потенциал и R1 представляют собой значительно более высокие для [11C]-A по сравнению с [11C]PK11195 (ВР=1,650,36 по сравнению с 0,660,15;[11C]-A) значительно понижали поглощение мозгом [11C]-A в поврежденном полосатом теле. Оба немеченых компонента индуцируют слабое повышение связывания [11C]-A в контралатеральной стороне, что,по-видимому, обусловлено увеличением концентрации в крови [11 С]-А из-за высвобождения [11C]-A из экстра-церебральных связывающих сайтов. Анализ метаболитов, присутствующих в крови и плазме крыс через 10 и 20 мин после инъекции[11C]-A, и метаболитов, присутствующих в мозге крыс через 10, 20 и 30 мин после инъекции [11 С]-А, в значительной степени определял только исключительно исходное соединение (фиг. 10). Дополнительно, авторадиография связывания [11C]-A в срезах мозга отражала результаты полученных изображений с высоким отношением ипсилатеральным к контралатеральному (3,8), которое нивелировалось избытком немеченых PK11195 или А (фиг. 5). Небольшое, но значимое уменьшение [11C]-A связывания наблюдали с немеченым флумазенилом, антагонистом бензодиазепина (фиг. 5). Пример 15. У обоих APPPS1 и диком типе PS1 трансгенных мышей поглощение [11C]-A в целом головном мозге (исключая мозжечок) представляет собой боле высокое по сравнению с поглощением[11C]PK11195 (фиг. 6). Однако поглощение и [11C]-А, и [11C] PK11195 не представляло собой значительно более высокое у APPPS1 по сравнению с диким типом PS1. Напротив, специфическое [3 Н]-А связывание представляет собой примерно в 2 раза выше в срезах целого мозга у APPPS1 мышей по сравнению с диким типом мышей PS1 (фиг. 7). Указанные данные демонстрируют, что [11C]-А может специфическим образом детектировать увеличенное связывание PBR и воспаление в острой модели нейровоспаления крыс и мышиной модели болезни Альцгеймера. Получение изображение PET in vivo подтверждает, что [11C]-A может быть использовано для получения изображений повышенной экспрессии PBR рецептора и нейровоспаления у грызунов. Более того, связывание PBR рецептора, наблюдаемое при получении изображений PET с [11C]-А представляет собой большее, чем наблюдается с лигандом сравнения рецептора PET [11C]PK11195. Пример 16. Поглощение [11C]-A представляет собой значительно более высокое в поврежденном правом полосатом теле у приматов, инъецированных хинолиновой кислотой по сравнению с поглощением [11C]-A В контролатеральном неинъецированном полосатом теле и двух неинъецированных контрольных областях головного мозга (мозжечке, префронтальной коре головного мозга) через 24 ч после инъекции эксайтотоксина (фиг. 8). Поглощение [11C]-A в контралатеральном неинъецированном полосатом теле оставалось стабильным и на том же самом уровне, что и поглощение [11C]-A в областях головного мозга у неинъецированных приматов (фиг. 8). Увеличение поглощения [11C]-A может быть все еще визуализировано через 48 ч после инъекции эксайтотоксина (в левом полушарии), тогда как поглощение [11C]-A через 7 месяцев после инъекции эксайтотоксина (кинетики в правом полосатом теле поврежденном 7 месяцев ранее) не показал исходных уровней. Более подробная характеристика ранней фазы нейровоспаления демонстрирует, что увеличение поглощения [11C]-A может быть визуализировано в диапазоне от 24 ч до 16 дней (фиг. 9). Системное введение большого избытка немеченого PK11195 через 30 мин после введения радиометки приводит к специфическому замещению [11 С]-А связывания в поврежденном полосатом теле на незаметные изменения, наблюдаемые в неповрежденных контрольных областях головного мозга(фиг. 9). Применения Настоящее изобретение можно применять в качестве инструмента диагностики и в качестве инструмента для прослеживания эволюции и прогресса патологий, при которых изменяются уровни PBR и при которых присутствует воспаление. Изобретение можно также применять для изучения занятости рецепторов и оценки эффективности терапевтического лечения при патологических состояниях и в качестве трансляционного биомаркера для исследования от моделей на животных до человека. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение меченного радиоактивным изотопом 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5- 12020612 дигидро-4H-пиридазин[4,5-b]индол-1-ацетамида в качестве биомаркера для определения уровней PBR у субъекта, связанных с нормальным и патологическим состояниями, где радиоактивная метка выбрана из углерода-11, радиогалогенов и радиометаллов. 2. Применение по п.1, где 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4H-пиридазин[4,5b]индол-1-ацетамид представляет собой меченный радиоактивной меткой углеродом-11. 3. Применение по пп.1 и 2, где 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4Hпиридазин[4,5-b]индол-1-ацетамид представляет собой меченный радиоактивной меткой углеродом-11 по углероду метильной группы, расположенной в 5-положении индольного ядра. 4. Применение по п.1, где 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4H-пиридазин[4,5b]индол-1-ацетамид представляет собой меченный радиоактивной меткой радиогалогенами. 5. Применение по п.1 или 4, где 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4Hпиридазин[4,5-b]индол-1-ацетамид представляет собой меченный радиоактивной меткой радиогалогеном фтор-18. 6. Применение по п.1 или 5, где 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4Hпиридазин[4,5-b]индол-1-ацетамид представляет собой меченный радиоактивной меткой фтор-18 в параположении 3-фенильного кольца. 7. Применение по пп.1-6, где патологические состояния, относящиеся к изменению уровней PBR,выбраны из повреждения головного мозга, инфекций головного мозга и неврологических заболеваний. 8. Применение по пп.1-6, где патологические состояния, относящиеся к изменению уровней PBR,выбраны из психиатрических заболеваний. 9. Применение по пп.1-6, где патологические состояния, относящиеся к изменению уровней PBR,выбраны из пролиферативных заболеваний. 10. Применение по пп.1-6, где патологические состояния, относящиеся к изменению уровней PBR,выбраны из периферических воспалительных процессов. 11. Применение по пп.1-6, где определение уровней PBR производят при исследовании заполнения. 12. Применение по пп.1-7, где определение уровней PBR производят для оценки эффективности терапевтического лечения. 13. Способ определения уровней PBR, связанных с нормальными состояниями и изменениями в уровнях PBR, связанными с патологическими состояниями, где определение производят при использовании меченной радиоактивным изотопом формы 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4Hпиридазин[4,5-b]индол-1-ацетамида, где радиоактивная метка выбрана из углерода-11, радиогалогенов и радиометаллов. 14. Способ по п.13, где меченный радиоактивной меткой 7-хлор-N,N,5-триметил-4-оксо-3-фенил 3,5-дигидро-4H-пиридазин[4,5-b]индол-1-ацетамид содержит углерод-11. 15. Способ по пп.13, 14, где 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4H-пиридазин[4,5b]индол-1-ацетамид представляет собой меченный радиоактивной меткой углеродом-11 по углероду метильной группы, расположенной в 5-положении индольного ядра. 16. Способ по п.13, где 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4H-пиридазин[4,5b]индол-1-ацетамид представляет собой меченный радиоактивной меткой фтором-18. 17. Способ по п.13, где 7-хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4H-пиридазин[4,5b]индол-1-ацетамид представляет собой меченный радиоактивной меткой фтором-18 в пара-положении 3-фенильного кольца. 18. Способ по пп.13-17, где патологические состояния, относящиеся к изменению уровней PBR,выбраны из повреждения головного мозга, инфекций головного мозга и неврологических заболеваний. 19. Способ по пп.13-17, где патологические состояния, относящиеся к изменению уровней PBR,выбраны из психиатрических заболеваний. 20. Способ по пп.13-17, где патологические состояния, относящиеся к изменению уровней PBR,выбраны из пролиферативных заболеваний. 21. Способ по пп.13-17, где патологические состояния, относящиеся к изменению уровней PBR,выбраны из периферических воспалительных процессов. 22. Способ по пп.13-17, где определение уровней PBR производят при исследовании заполнения. 23. Способ по пп.13-17, где определение уровней PBR производят для оценки эффективности терапевтического лечения. 24. Способ по пп.13-17, где определение уровней PBR и воспаления проводят при помощи получения изображений (PET) позитрон-эмиссионной томографии или получения изображений (SPECT) компьютерной томографии одиночных фотонов. 25. Способ по пп.13-17, где определение уровней PBR и воспаления производят при помощи получения изображений (PET) позитрон-эмиссионной томографии. 26. Диагностический набор для определения уровней PBR, связанных с нормальными состояниями и изменениями в уровнях PBR, связанными с патологическими состояниями, включающий форму 7 хлор-N,N,5-триметил-4-оксо-3-фенил-3,5-дигидро-4H-пиридазин[4,5-b]индол-1-ацетамида,меченную радиоактивным изотопом.
МПК / Метки
МПК: G01N 33/60, A61K 51/04
Метки: применение, биомаркера, качестве, бензодиазепинового, рецептора, уровней, 7-хлор-n,n,5-триметил-4-оксо-3-фенил-3,5-дигидро-4н-пиридазин[4,5-b]индол-1-ацетамида, периферического
Код ссылки
<a href="https://eas.patents.su/19-20612-primenenie-7-hlor-nn5-trimetil-4-okso-3-fenil-35-digidro-4n-piridazin45-bindol-1-acetamida-v-kachestve-biomarkera-urovnejj-perifericheskogo-benzodiazepinovogo-receptora.html" rel="bookmark" title="База патентов Евразийского Союза">Применение 7-хлор-n,n,5-триметил-4-оксо-3-фенил-3,5-дигидро-4н-пиридазин[4,5-b]индол-1-ацетамида в качестве биомаркера уровней периферического бензодиазепинового рецептора</a>
Предыдущий патент: Способ получения чайного продукта, чайный продукт и оздоравливающая композиция
Следующий патент: Цитотоксические конъюгаты с соединением, связывающим рецептор нейропептида y
Случайный патент: Способ хранения газа и продукт хранения