Карбоксамиды в качестве агонистов 5-ht1f
Формула / Реферат
1. Соединение формулы I
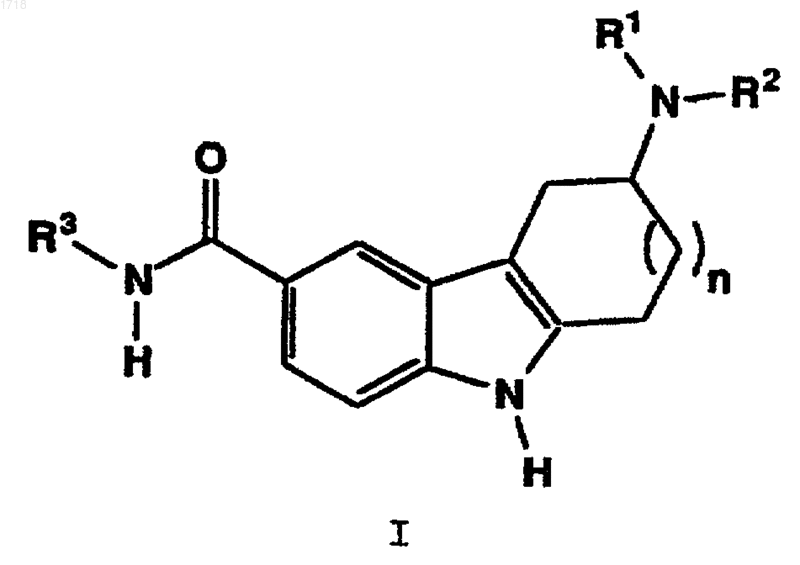
где R1 и R2 независимо представляют водород, C1-C4алкил или -СН2СН2-арил, где арил представляет фенил, фенил, монозамещенный галогеном, или 1-(C1-C6алкил)пиразол-4-ил;
R3 представляет C3-C6циклоалкил или гетероцикл;
n = 1 или 2;
и их фармацевтически приемлемые соли и гидраты.
2. Соединение по п.1, где n = 1.
3. Соединение по п.2, где R1 и R2 независимо представляют C1-C4алкил.
4. Фармацевтическая композиция, которая включает в сочетании с фармацевтически приемлемым носителем, разбавителем или эксципиентом, соединение по любому из пп.1-3.
5. Способ активации 5-HT1F рецепторов у млекопитающих, включающий введение нуждающемуся в такой активации млекопитающему эффективного количества соединения по любому из пп.1-3.
6. Способ ингибирования экстравазации нейронного протеина у млекопитающих, включающий введение нуждающемуся в таком ингибировании млекопитающему эффективного количества соединения по любому из пп.1-3.
7. Способ лечения мигрени, включающий введение нуждающемуся в таком лечении млекопитающему эффективного количества соединения по любому из пп.1-3.
8. Способ профилактики мигрени у млекопитающих, включающий введение подверженному мигрени млекопитающему эффективного количества соединения по любому из пп.1-3.
9. Способ по любому из пп.5-8, где млекопитающим является человек.
Текст
1 Различные теории, относящиеся к патофизиологии мигрени, доминировали с 1938 г., когда была опубликована работа Graham и Wolff(Arch. Neurol. Psychiatry, 39, 737-63 (1938. Эти авторы предположили, что причиной головной боли, связанной с мигренью, является вазодилатация экстрактраниальных сосудов. Эта точка зрения подтверждалась известным фактом, что алкалоиды спорыньи и суматриптан, гидрофильный 5-HT1 агонист, который не преодолевает гематоэнцефалический барьер, сокращают гладкую мускулатуру краниальных сосудов и эффективны при лечении мигрени. (Humphrey,et al., Ann. NY Acad. Sci., 600, 587-600 (1990. В недавней работе Moskowitz показал, однако, что случаи головной боли, связанной с мигренью,не зависят от изменений диаметра сосудовMoskowitz предположил, что до сих пор неизвестные триггеры боли стимулируют тригеминальные ганглии, которые возбуждают сосудистую сеть краниальной ткани, что приводит к выделению вазоактивных нейропептидов из аксонов на сосудистой сети. Затем эти выделенные нейропептиды активируют ряд актов, следствием которых является боль. Такое нейрогенное воспаление блокируется суматриптаном и алкалоидами спорыньи за счет механизмов, которые включат 5-НТ рецепторы, которые, как считают, тесно связаны с 5-НТ 1D подтипом, которые расположены на тригеминососудистых волокнах (Neurology, 43 (suppl.3), S16-S20(1993. Серотонин (5-НТ) демонстрирует различную физиологическую активность, опосредствованную, по крайней мере, четырьмя классами рецепторов, наиболее гетерогенным из которых является, по-видимому, 5-HT1. Ген человека,который экспрессирует пятый 5-HT1 подтип,названный 5-HT1F, был выделен Као с сотр.(Рrос. Natl. Acad. Sci. USA, 90, 408-412 (1993. Этот 5-НТ 1F рецептор демонстрирует фармакологический профиль, отличный от любого из до сих пор описанных серотонергичных рецепторов. Высокая степень сродства суматриптана с этим подтипом, Ki = 23 nМ, предполагает определенную роль 5-HT1F рецептора в мигрени. РядN-арил-3-амино-1,2,3,4-тетрагидро 9 Н-карбазол-6-карбоксамидов был описан Porter с сотр. (WO 94/14773, July 7, 1994) как 5-НТ 1 подобные агонисты, которые демонстрируют вазоактивные эффекты. Амиды настоящего изобретения являются 5-HT1F агонистами, которые ингибируют экстравазацию, связанную со стимуляцией тригеминальных ганглий, и поэтому пригодны для лечения мигрени и связанных с ней нарушений без сопутствующего сужения сосудов, что свойственно структурно схожим соединениям. В настоящем изобретении предложены новые 3-амино-1,2,3,4-тетрагидро-9 Н-карбазол-6 001718R1 и R2 независимо представляют водород,C1-C4 алкил или -СН 2 СН 2-Арил, где Арил представляет фенил, фенил, монозамещенный галогеном, или 1-(C1-C6 алкил)пиразол-4-ил;n = 1 или 2; и их фармацевтически приемлемые соли и гидраты. Настоящее изобретение относится также к способу усиления активации 5-HT1F рецептора путем введения соединения формулы I. Кроме того, настоящее изобретение относится к способу усиления активации 5-HT1F рецептора для лечения различных нарушений,которые были связаны с ослаблением нейротрансмиссии серотонина у млекопитающих. Такие нарушения включают депрессию, боль,связанную с мигренью, булемию, предменструальный синдром или синдром поздней лютеальной фазы, дисфорию, алкоголизм, зависимость от табака, панику, беспокойство, общую боль,посттравматический синдром, потерю памяти,старческое слабоумие, социальную фобию, дефицит внимания, гиперактивность, поведенческие нарушения, нарушения контроля импульсов, нарушение самоограничения, обсессивные навязчивые состояния, хронический синдром полноты, ускоренную эякуляцию, эректильные затруднения, нервно-психическую анорексию,нарушения сна, аутизм, мутизм, трихокриптоманию, тригеминальную невралгию, зубную боль или боль, связанную с дисфункцией височно-нижнечелюстного сустава. Соединения настоящего изобретения можно также использовать для профилактики мигрени. Любые из этих способов используют соединение формулыI. Кроме того, в настоящем изобретении предложены фармацевтические композиции,включающие эффективное для активации 5HT1F рецепторов количество соединения формулы I, в сочетании с подходящим фармацевтическим носителем, разбавителем или эксципиентом. Общие химические термины, используемые в вышеприведенной формуле, имеют свои обычные значения. Так, например, термин "алкил" включает такие группы, как метил, этил, нпропил, изопропил, н-бутил, изобутил, вторбутил, трет-бутил и т.п. Термин "циклоалкил" включает циклопропил, циклобутил, циклопентил и циклогексил. Термин "алкокси" включает такие группы, как метокси, этокси, изопропок 3 си, трет-бутокси и т.п. Термин "галоген" включает фтор, хлор, бром и йод. Термин "гетероцикл" включает фур-2-ил,фур-3-ил, тиен-2-ил, тиен-3-ил, пиридин-3-ил,пиридин-4-ил, пиррол-3-ил, N-метилпиррол-3 ил, оксазол-5-ил, изоксазол-4-ил, изоксазол-5 ил, пиразол-4-ил, пиримидин-5-ил или пиразин 4-ил. Эти гетероциклы содержат незамещенные атомы углерода. Вплоть до трех доступных атомов углерода в любой гетероциклической системе могут быть, необязательно, замещены заместителями, независимо выбранными из группы, состоящей из галогена, C1-C4 алкила, C1-C4 алкокси или C1-C4 алкоксикарбонила. Соединения настоящего изобретения содержат асимметричный атом углерода. Этот углерод помечен звездочкой в следующей формуле Как таковые, соединения настоящего изобретения существуют не только в виде рацемата, но и как индивидуальные R- и S-энантиомеры: Соединения настоящего изобретения включают не только рацематы, то также их соответствующие оптически активные R- и Sэнантиомеры и их смеси. Хотя все рацематы,смеси и индивидуальные энантиомеры можно использовать в качестве 5-HT1F агонистов,предпочтительно, чтобы соединение существовало в виде отдельного энантиомера. Хотя все соединения настоящего изобретения полезны в качестве 5-HT1F агонистов, некоторые классы являются предпочтительными. В следующем разделе описаны такие предпочтительные классы.al) R2 представляет -CH2CH2-Ar, где Аr представляет 1-(C1-С 6 алкил)пиразол-4-ил,am) R2 представляет -CH2CH2-Ar, где Аr представляет 1-метилпиразол-4-ил,an) R2 представляет -CH2CH2-Ar, где Аr представляет 1-изопропилпиразол-4-ил,ао) R3 гетероцикл,ар) R3 представляет пиридин-3-ил,aq) R3 представляет пиридин-4-ил,ar) R3 представляет пиридин-3-ил или пиридин-4-ил, монозамещенный галогеном,as) R3 представляет пиридин-3-ил или пиридин-4-ил, монозамещенный хлором,at) R3 представляет пиридин-3-ил или пиридин-4-ил, монозамещенный фтором,au) R3 представляет фур-2-ил или фур-3 ил,av) R3 представляет тиен-2-ил или тиен-3 ил,aw) R3 представляет пиррол-3-ил,ax) R3 представляет оксазол-5-ил,ау) R3 представляет изоксазол-4-ил или изоксазол-5-ил,az) R3 представляет пиразол-4-ил,ba) R3 представляет пиримидин-5-ил,bb) R3 представляет пиразин-4-ил,bc) R3 представляет фур-2-ил или фур-3 ил, необязательно, замещенный C1-C4 алкилом,C1-C4 алкокси или галогеном,bd) R3 представляет фур-2-ил,be) R3 представляет фур-3-ил,bf) R3 представляет тиен-2-ил или тиен-3 ил, необязательно, замещенный C1-C4 алкилом или C1-C4 алкокси,bg) R3 представляет тиен-2-ил,bh) R3 представляет тиен-3-ил,bi) R3 представляет пиридин-3-ил или пиридин-4-ил, необязательно, замещенный галогеном, C1-C4 алкилом или C1-C4 алкокси,bj) R3 представляет 6-галопиридин-3-ил,bk) R3 представляет C3-C6 циклоалкил,bl) R3 представляет циклопропил,bm) n = 1,bn) n = 2,bo) соединение является рацематом,bp) соединение является R-энантиомером,bq) соединение является S-энантиомером,br) соединение является свободным основанием,bs) соединение является солью,bt) соединение является солью хлористоводородной кислоты,bu) соединение является солью фумаровой кислоты,bv) Соединение является солью щавелевой кислоты. Следует учитывать, что вышеуказанные классы могут быть объединены и образовывать дополнительные предпочтительные классы. Соединения настоящего изобретения можно использовать в способе усиления активации 5-HT1F рецепторов для лечения различных на 5 рушений, связанных с ослаблением нейротрансмиссии серотонина у млекопитающих. Предпочтительно, чтобы млекопитающим, которое будут лечить введением соединений настоящего изобретения, был человек. Так как соединения настоящего изобретения являются аминами, они по своей природе являются основаниями и, соответственно, взаимодействуют с любой неорганической и органической кислотой с образованием фармацевтически приемлемых солей присоединения кислоты. Так как некоторые свободные амины соединений настоящего изобретения обычно являются маслами при комнатной температуре, предпочтительно, превращать эти свободные амины в их фармацевтически приемлемые соли присоединения кислоты для облегчения их обработки и введения, так как последние обычно являются твердыми при комнатной температуре. Кислоты, которые обычно используют для получения таких солей, являются неорганическими кислотами, такими как хлористоводородная кислота, бромисто-водородная кислота, йодисто-водородная кислота, серная кислота, фосфорная кислота и т.п., и органическими кислотами, такими как паратолуолсульфоновая кислота, метансульфоновая кислота,щавелевая кислота, парабромфенилсульфоновая кислота, карбоновая кислота, янтарная кислота,лимонная кислота, бензойная кислота, уксусная кислота и т.п. Примерами таких фармацевтически приемлемых солей служат сульфат, пиросульфат, бисульфат, сульфит, бисульфит, фосфат, моногидрофосфат, дигидрофосфат, метафосфат, пирофосфат, хлорид, бромид, йодид,ацетат, пропионат, деканоат, каприлат, акрилат,формиат, изобутират, капроат, гептаноат, пропиолат, оксалат, малонат, сукцинат, суберат,себакат, фумарат, малеат, бутин-1,4-диоат, гексин-1,6-диоат, бензоат, хлорбензоат, метилбензоат, динитробензоат, гидроксибензоат, метоксибензоат, фталат, сульфонат, ксилолсульфонат,фенилацетат, фенилпропионат, фенилбутират,цитрат, лактат, b-гидроксибутират, гликолят,тартрат, метансульфонат, пропансульфонат,нафталин-1-сульфонат, нафталин-2-сульфонат,манделат и т.п. Предпочтительными фармацевтически приемлемыми солями являются соли хлористоводородной кислоты, щавелевой кислоты или фумаровой кислоты. Приводимая далее группа соединений иллюстрирует соединения, входящие в объем настоящего изобретения:N-(циклогексил)-4-(диизопропил)амино 10 Н-циклогепта-[7,6-b]индол-7-карбоксамид. Соединения настоящего изобретения получают способами, хорошо известными специалистам. Соединения настоящего изобретения, в которых n = 1, являются членами класса, обычно известного, как 3-амино-1,2,3,4-тетрагидро 9 Н-карбазол-6-карбоксамиды. Соединения этого класса обычно получают с помощью индольного синтеза Фишера, как показано на схеме синтеза I, где R1' и R2' независимо представляютC1-C6 алкил, бензил или, вместе с атомом азота,к которому они присоединены, образуют фталимидогруппу, а R3 имеет указанные ранее значения. Схема синтеза I Фенилгидразин и 4-аминоциклогексанон конденсируют вместе в подходящем растворителе, обычно в низшем спирте, таком как этанол, в присутствии каталитического количества кислоты, такой как хлористо-водородная, до получения целевого фенилгидразона. Реакцию обычно проводят при температуре от около комнатной до температуры кипения с обратным холодильником в течение от около 1 до около 24 ч. После завершения реакции конденсации образовавшийся фенилгидразон можно при желании выделить из реакционной смеси, добавляя воду или водный раствор основания, такого как карбонат калия. Продукт выделяется из смеси в виде масла или твердого вещества. Продукт можно экстрагировать несмешивающимся с водой растворителем, обычно дихлорметаном, или отфильтровать, если этот метод приемлем. Продукт можно использовать на следующей стадии,как он есть, или после дополнительной очистки. Реакция индольной циклизации Фишера фенилгидразона протекает в присутствии избытка кислоты. Реакцию можно осуществить, растворяя фенилгидразон в чистой кислоте, например, в уксусной кислоте. В другом варианте фенилгидразон можно растворить в низшем спирте,который был обработан кислотой, например, в этанольном растворе хлористого водорода. Если полученный, как указано выше, фенилгидразон не требует дополнительной очистки, исходную реакционную смесь можно просто обработать соответствующей кислотой без выделения фе 001718 8 нилгидразона. Очень часто реакция индольной циклизации Фишера происходит после образования фенилгидразона, что приводит к получению продукта в одну стадию. Реакцию обычно ведут при температуре от около комнатной до температуры кипения с обратным холодильником в течение от около 1 до около 24 ч. Продукт реакции можно выделить непосредственно фильтрованием или экстрагированием после удаления растворителя и нейтрализации кислоты в результате добавления водного основания. Продукт можно очистить перекристаллизацией или хроматографически, если приемлемо. Хотя в схеме синтеза I использован амидофенилгидразин, специалистам должно быть ясно, что индолизацию Фишера можно осуществить с соответствующей карбоновой кислотой или сложным эфиром. Затем при желании или в случае необходимости можно ввести в синтез амидный фрагмент. Фенилгидразины, необходимые для получения соединений настоящего изобретения, либо являются коммерчески доступными, либо их можно получить хорошо известными специалистам способами из 4-нитробензойной кислоты,как показано на схеме синтеза II. R3 имеет указанные ранее значения. Схема синтеза II Карбоновую кислоту можно вначале превратить в соответствующий хлорангидрид или бромангидрид в стандартных условиях, например, обрабатывая тионилхлоридом или бромидом. Соответствующий галоид ангидрид, необязательно, в присутствии ацилирующего катализатора, такого как диметиламинопиридин, подвергают взаимодействию с соответствующим амином формулы R3-NH2, в присутствии подходящего основания. Подходящие основания включают амины, которые обычно используют в качестве акцепторов кислоты, такие как пиридин или триэтиламин, или коммерчески доступные полимерные основания, такие как поливинилпиридин. В другом варианте нужный амин подвергают взаимодействию с соответствующей карбоновой кислотой в присутствии типичных пептидных агентов сочетания, таких как N,N'карбонилдиимидазол (CDI), N,N'-дициклогексилкарбодиимид (DCC) и 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид(EDC). Нанесенная на полимер форма EDC была описана (Tetrahedron Letters, 34 (48), 7685(1993, и является очень полезной для получения соединений настоящего изобретения. Продукты этих реакций выделяют с помощью стандартных способов экстракции и очищают с помощью стандартных методов хроматографии и кристаллизации, в зависимости от необходимо 9 сти или желания, для получения соединений настоящего изобретения. Выделение продуктов из реакционной среды, в которой используют связанный на полимере реагент, существенно упрощается, так как требует лишь фильтрования реакционной смеси с последующим концентрированием фильтрата при пониженном давлении. Продукты, полученные в таких реакциях, можно затем очистить, как указано выше. Нитрокарбоксамиды гидрируют над катализаторами - благородными металлами, предпочтительно, над платиной-на-угле, при температуре около окружающей, при начальном давлении около 4,219 кг/см 2 (60 пси), в течение от 1 до 24 ч, в подходящем растворителе, таком как низший спирт или тетрагидрофуран, получая соответствующий анилин. Затем этот анилин растворяют в концентрированной кислоте, такой как фосфорная, хлористоводородная или бромистоводородная кислота, и обрабатывают нитритом натрия при температуре около 0 С или ниже. После перемешивания в течение примерно часа реакционную смесь добавляют к раствору хлорида олова(II) в концентрированной хлористоводородной кислоте, и эту смесь перемешивают при температуре около 0 С в течение примерно часа. Продукт выделяют, обрабатывая реакционную смесь водным основанием до тех пор, пока она не становится сильно щелочной, а затем экстрагируют не смешивающимся с водой растворителем, таким как этилацетат. Полученный гидразин можно при необходимости или при желании далее очистить хроматографически или путем кристаллизации перед введением в дальнейшую реакцию. Специалистам должно быть ясно, что, заменяя амин соответствующим спиртом в схеме синтеза II,можно получить сложные эфиры, пригодные для получения соединений настоящего изобретения. 4-замещенные циклогексаноны, необходимые для получения соединений настоящего изобретения, можно получить способами, хорошо известными специалистам, что продемонстрировано на схеме синтеза III. R1 и R2 независимо представляют водород, C1-C6 алкил или бензил. Схема синтеза III 1,4-циклогександион монокеталь подвергают восстановительному аминированию, используя соответствующий амин в стандартных условиях и получая соответствующий 4 аминоциклогексанон кеталь. Затем в водных кислотных условиях удаляют защитные группы полученного кеталя для получения соответствующего 4-аминоциклогексанона. 10 Соединения настоящего изобретения, в которых R1 = R2 = Н, получают из 4-(1 фталимидил)циклогексанона, который можно получить известными специалистам способами,например, King et al. (Journal of Medical Chemistry, 36, 1918 (1993. Короче, 4-аминоциклогексанол подвергают взаимодействию вначале сN-карбэтоксифталимидом и полученный 4-(1 фталимидил)циклогексанол обрабатывают пиридинийхлорхроматом, получая целевой кетон. Затем полученный 4-(1-фталимидил)циклогексанон подвергают взаимодействию с соответствующим фенилгидразином с последующей реакцией индольной циклизации Фишера, получая соответствующий 3-(1-фталимидил)карбазол. Затем фталимид удаляют в реакции с гидразином в удобный момент после индольного синтеза Фишера, получая соединения настоящего изобретения, в которых R1 = R2 = Н. Специалистам должно быть ясно, что манипуляции с заместителем в 6-положении можно осуществить до или после циклизации, представленной на схеме синтеза I. Например, соединения настоящего изобретения можно получить из соответствующих карбоновых кислот,сложных эфиров, галоидангидридов или смешанных ангидридов кислот, что представлено на схеме синтеза IV. R1' и R2' независимо представляют C1-C6 алкил, бензил или вместе с атомом азота, к которому они присоединены, образуют фталимидную группу; Z представляет водород или подходящую азотзащитную группу;Y представляет гидрокси, C1-C6 алкокси, хлор,бром или C1-C6 алкоксикарбонил; и R3 имеет указанные ранее значения. Схема синтеза IV Хлорид, бромид или ангидрид карбоновой кислоты, необязательно, в присутствии катализатора ацилирования, такого как диметиламинопиридин, подвергают взаимодействию с соответствующим амином формулы R3-NH2. В другом варианте нужный амин подвергают взаимодействию с соответствующей карбоновой кислотой в присутствии типичных реагентов сочетания пептидов. Сложный эфир вначале гидролизуют до карбоновой кислоты, а затем осуществляют реакцию сочетания с соответствующим амином. Каждый из этих способов представлен в схеме синтеза II. Соединения настоящего изобретения, в которых n = 2, являются 4-амино-10 Н-циклогепта[7,6-b]индол-7-карбоксамидами. Эти соединения получают практически, как указано для соответствующих 3-амино-1,2,3,4-тетрагидро-9 Нкарбазол-6-карбоксамидов, что проиллюстрировано на схеме синтеза I, за исключением того, 11 что 4-аминоциклогептанон заменяет 4-аминоциклогексанон в процессе синтеза. 4-Аминоциклогептаноны, необходимые для получения соединений настоящего изобретения, можно получить в соответствии со схемой синтеза V. Соответствующий 4-аминоциклогексанон в подходящем растворителе, например, диэтиловом эфире, обрабатывают соответствующей кислотой Льюиса, такой как трехфтористый бор, в течение от около 20 минут до около часа при комнатной температуре. Затем к этому раствору добавляют этилдиазоацетат, и полученную смесь перемешивают в течение от около 1 часа до около 24 ч при комнатной температуре. Полученный 2-этоксикарбонил-5-аминоциклогептанон выделяют, разбавляя реакционную смесь насыщенным водным раствором карбоната натрия, и экстрагируют несмешивающимся с водой растворителем, таким как диэтиловый эфир. Затем продукт реакции непосредственно растворяют в диметилсульфоксиде, который содержит хлорид натрия и воду. Затем реакционную смесь нагревают примерно до 170 С в течение от около 1 до около 24 ч для осуществления декарбоэтоксилирования. Целевой 4 аминоциклогептанон выделяют, разбавляя реакционную смесь водой и экстрагируя соответствующим растворителем, таким как диэтиловый эфир. Продукт реакции можно при желании очистить с помощью хроматографической колонки перед тем, как ввести в дальнейшую реакцию. После реакции с соответствующим фенилгидразином соответствующий 4-аминоциклогептанонфенилгидразон помещают в условия индольной циклизации Фишера, как указано выше. Однако присущая циклогептанону асимметрия приводит к получению следующих двух изомеров: Изомеры А и В можно разделить путем кристаллизации или с помощью хроматографии в любой удобный момент процесса синтеза соединений настоящего изобретения. Промежуточную карбоновую кислоту,пригодную для получения соединений настоя 001718 12 щего изобретения, можно либо синтезировать непосредственно из 4-карбоксифенилгидразина способом, представленным на схеме синтеза I,или их можно получить из соответствующего бромпроизводного. Однако перед манипуляциями с бромзаместителем, индольный азот нужно предварительно защитить, как представлено на схеме синтеза VI. R1" и R2" представляют C1-C6 алкил или бензил; LG представляет хлор, бром или трифторметансульфонил; и Аr представляет фенил или 2,4,6-три-изопропилфенил. Схема синтеза VI Раствор исходного материала в подходящем растворителе, таком как тетрагидрофуран или диэтиловый эфир, добавляют к суспензии гидрида щелочного металла, предпочтительно,гидрида калия в том же самом растворителе. Удаление защитных групп осуществляют при температуре от около -10 С до комнатной температуры в течение примерно часа. Затем к этому раствору добавляют соответствующий арилсульфонилхлорид, триизопропилсилилгалогенид или триизопропилсилилтрифлат, и реакцию проводят в течение от около 1 до 24 ч. Производное с защищенным индольным азотом выделяют, обрабатывая реакционную смесь льдом для разложения всего не прореагировавшего гидрида, разбавляя реакционную смесь водой, а затем экстрагируя продукт несмешивающимся с водой растворителем, таким как дихлорметан,диэтиловый эфир или этилацетат. Выделенный продукт можно использовать в дальнейших реакциях в том виде, как он выделен, или очистить путем кристаллизации или с помощью хроматографии. Защищенный таким образом бром-замещенный субстрат, можно затем использовать для получения нужной карбоновой кислоты, как представлено на схеме синтеза VII. 13 Раствор бром-соединения в подходящем растворителе, таком как тетрагидрофуран или диэтиловый эфир, обрабатывают алкиллитием,таким как н-бутил- или трет-бутиллитий, при температуре около -70 С в течение около часа для осуществления обмена галоген-металл. Полученный раствор анионов обрабатывают затем двуокисью углерода при температуре около-70 С. Затем реакционной смеси дают постепенно нагреться до комнатной температуры в течение от около 1 до около 24 ч. Полученный продукт выделяют, разбавляя реакционную смесь водным аммонийхлоридом и экстрагируя не смешивающимся с водой растворителем, таким как дихлорметан. Продукт можно далее очистить перекристаллизацией или с помощью хроматографии при необходимости. Конечная стадия в этой последовательности требует удаления защитных групп у индольного азота для получения соединений настоящего изобретения, как представлено на схеме синтеза VIII. R1", R2" и Z имеют указанные ранее значения. Схема синтеза VIII Если Z представляет арилсульфонил, защитную группу можно удалить щелочным гидролизом в низшем спирте, таком как метанол или этанол. Если Z представляет триизопропилсилил, удаление защитных групп обычно осуществляют, обрабатывая реагентом с фторидным анионом, предпочтительно, тетрабутиламмонийфторидом, в стандартных условиях. Соединения настоящего изобретения, в которых R1 и R2 независимо представляют водород, можно получить, осуществляя каталитическое гидрирование соответствующего 3 бензиламиносоединения над катализатором благородным металлом, таким как палладий или платина-на-угле, или никель Ренея. Эти реакции обычно осуществляют в низшем спирте или тетрагидрофуране при температуре от комнатной до около 60 С, в течение от около 1 ч до 24 ч, при давлении водорода около 4,219 кг/см 2(около 60 пси). Такой гидрогенолиз можно при желании осуществить до или после удаления защитных групп у индольного азота. Соединения, в которых любой или оба изR1 и R2 представляют водород, можно далее функционализировать для получения других соединений настоящего изобретения с помощью восстановительного алкилирования. В этих условиях первичный или вторичный амин подвергают взаимодействию с соответствующим альдегидом или кетоном для получения соответствующего имина или енамина. Затем имин или енамин восстанавливают до целевого соединения с помощью каталитического гидрирования, 001718 14 или востанавливая с помощью подходящего восстанавливающего гидрид-реагента в присутствии кислоты. Предпочтительно осуществлять преобразование прямым алкилированием, как представлено на схеме синтеза IX. R1 представляет водород или C1-C6 алкил; R2 представляет C1-C6 алкил или арилэтил; X представляет бром, -СООН или R3NHC(O)-, и арилэтил имеет указанные ранее значения. Схема синтеза IX Исходный амин и основание объединяют в реакционном растворителе с последующим добавлением алкилирующего агента. Реакционным растворителем может быть нереакционноспособный растворитель, который обычно используют для алкилирований такого типа, такой как ацетонитрил, диметилформамид или Nметил-2-пирролидинон, ограниченные растворимостью субстрата. Основание должно быть достаточно сильным, чтобы нейтрализовать кислоту, которая образуется в реакции, но не настолько сильным, чтобы депротонировать другие центры субстрата, приводя к получению других продуктов. Кроме того, основание не должно конкурировать в значительной степени с субстратом для алкилирующего агента. Основаниями, которые обычно используют для этих реакций, являются насыщенный карбонат натрия и карбонат калия. Реакционную смесь обычно перемешивают при температуре от комнатной до 80 С в течение от около 8 ч до 3 дней. Алкилированные продукты выделяют, концентрируя реакционную смесь при пониженном давлении с последующим разделением полученного остатка между водой и подходящим органическим растворителем, таким как этилацетат, диэтиловый эфир, дихлорметан, этиленхлорид, хлороформ или четыреххлористый углерод. Выделенный продукт можно очистить хроматографически, кристаллизацией из подходящего растворителя, с помощью образования соли или в результате сочетания этих методик. Отщепляемая группа (LG) алкилирующего агента может быть хлором, бромом, йодом, метансульфонилокси-,трифторметансульфонилокси-, 2,2,2-трифторэтансульфонилокси-, бензолсульфонилокси-, парабромбензолсульфонилокси-, паранитробензолсульфонилокси- или паратолуолсульфонилоксигруппами,причем каждая из них может быть использована для получения соединений настоящего изобретения. Конкретно используемый алкилирующий агент определяется своей коммерческой доступностью или удобством синтеза из коммерчески доступных исходных материалов. Предпочтительные алкилирующие агенты для получения соединений настоящего изобретения выбирают 15 из тех, в которых отщепляемой группой является хлор, бром, йод или метансульфонилоксигруппа. Алкилирующие агенты, в которых отщепляемой группой является хлор, получают из соответствующих спиртов стандартными способами, предпочтительно, обрабатывая спирт чистым тионилхлоридом при комнатной температуре. Алкилирующие агенты, в которых отщепляемой группой является метансульфонилоксигруппа, получают, обрабатывая соответствующий спирт метансульфонилхлоридом или метансульфоновым ангидридом. Исходными спиртами, необходимыми для получения соединений настоящего изобретения, являются либо коммерчески доступные, либо их можно получить,используя хорошо известные способы синтеза,как раскрыто в патенте США 5521196, включенном сюда в качестве ссылки. Соединения настоящего изобретения имеют хиральный центр, и как таковые существуют как в виде рацемической смеси, так и в виде индивидуальных энантиомеров. Как было указано выше, рацематы и индивидуальные энантиомеры все составляют часть настоящего изобретения. Индивидуальные энантиомеры можно разделить фракционной кристаллизацией солей рацемических оснований и энантиомерно чистых кислот, например, дитолилвиннокаменной кислоты. В другом варианте индивидуальные энантиомеры можно получить, используя хиральные вспомогательные агенты в процессе получения соединения, как представлено на следующей схеме синтеза X. Х представляет -Вr или -СO2 Н. Схема синтеза Х Проводят восстановительное аминирование 1,4-циклогександион моно-(2,2-диметилпропан-1,3-диол)кеталя в стандартных условиях, используя энантиомер -метил-(4-нитрофе 001718 16 нил)этиламин (на схеме синтеза Х проиллюстрировано использование R-(+)-энантиомера). Кеталь удаляют, как было указано ранее, и полученный аминоциклогексанон в условиях реакции, описанных для схемы синтеза I, дает диастереоизомерную смесь. Диастереоизомеры разделяют затем хроматографически или фракционной кристаллизацией. Амин можно затем обработать, при желании, соответствующим алкилирующим агентом, например, соответствующим алкилгалогенидом, получая соответствующую четвертичную соль перед расщеплением -метил-(4-нитрофенил)этильного фрагмента. Расщепление-метил-(4-нитрофенил) этильного фрагмента осуществляют путем восстановления 4-нитрогруппы с последующим катализируемым кислотой сольволизом полученного-метил-(4-аминофенил)этильного фрагмента. Восстановление нитрогруппы можно осуществить с помощью широкого круга восстанавливающих агентов, включая, например, тетрахлорид титана, литийалюминийгидрид или цинк/уксусную кислоту, или с помощью каталитического гидрирования. Сольволитическое расщепление имеет место, когда моногидрохлорид (или другую одноосновную соль) продукта восстановления обрабатывают водой или спиртом при комнатной температуре,или, в некоторых случаях, при повышенных температурах. Наиболее удобным условием для удаления-метил-(4-нитрофенил)этильного фрагмента является гидрирование моногидрохлорида амина в метаноле над сульфидированным платиновым катализатором. Реакции, представленные на схемах синтеза VI-X, являются реакциями для соединений настоящего изобретения, которые являются либо карбазолами, либо 10 Н-циклогепта[7,6-b] индолами. Однако специалистам должно быть ясно, что проиллюстрированные реакции применимы к любому классу соединений. Специалисты должны также понимать, что порядок осуществления стадий получения соединений настоящего изобретения во многих случаях не является важным. Пример получения I. 6-Бром-3-диметиламино-9-триизопропилсилил-1,2,3,4-тетрагидро 9 Н-карбазол. 4-Диметиламиноциклогексанон (2,2-диметилпропан-1,3-диол)кеталь К раствору 25,0 г (554,6 ммоль) диметиламина в 500 мл метанола добавляют 50,0 г (252,2 ммоль) 1,4-циклогександион моно-2,2-диметилпропан-1,3-диол кеталя, и реакционную смесь перемешивают при комнатной температуре в течение 2 ч. К этому раствору постепенно добавляют 31,69 г (504,3 ммоль) цианоборгидрида натрия. После завершения добавления, уксусная кислота для доведения рН до примерно рН = 6 прибавляется. Величину рН контролируют пе 17 риодически, продолжая добавлять уксусную кислоту, чтобы поддерживать величину рН около 6. Когда добавление уксусной кислоты больше не приводит к выделению газа, реакционную смесь перемешивают при комнатной температуре в течение 18 ч. Затем реакционную смесь концентрируют при пониженном давлении до объема около 100 мл и затем разделяют между 1 н. гидроксидом натрия и дихлорметаном. Оставшуюся водную фазу обрабатывают насыщенным водным раствором хлорида натрия и снова экстрагируют дихлорметаном. Органические фазы объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении, получая 40,15 г (70%) целевого соединения в виде масла желтого цвета. Масс-спектр(далее МС) (m/е): 228 (М+1). 4-Диметиламиноциклогексанон Раствор 18,4 г (81 ммоль) 4-диметиламиноциклогексанон (2,2-диметилпропан-1,3 диол)кеталя в 250 мл 90% муравьиной кислоты кипятят с обратным холодильником в течение 3 ч. Затем реакционную смесь перемешивают при комнатной температуре в течение 3 дней. Затем реакционную смесь разбавляют 250 мл воды и концентрируют до объема около 250 мл в роторном испарителе. Последовательность операций разбавление/концентрирование повторяют затем еще два раза. Остаток затем концентрируют далее до объема около 50 мл, подщелачивают 5 н. гидроксидом натрия и экстрагируют дихлорметаном. Органические фазы объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении, получая 11,8 г(100%) целевого соединения в виде масла желтого цвета. МС (m/е) : 141 (М+). ЯМР (CDCl3):2,50 (м, 2 Н), 2,28 (м, 2 Н),2,28 (м, 6 Н), 2,01 (м, 2 Н), 1,80 (м, 2 Н). 4-Диметиламиноциклогексанон 4 бромфенилгидразон К смеси 6,0 г (42,0 ммоль) 4-диметиламиноциклогексанона и 9,5 г (42,0 ммоль) 4 бромфенилгидразингидрохлорида в 100 мл этанола добавляют 3,4 мл (42 ммоль) пиридина. Затем полученную смесь нагревают с обратным холодильником в течение 2 ч, а затем перемешивают при комнатной температуре в течение 18 ч. Затем реакционную смесь обрабатывают водным раствором карбоната калия и тщательно экстрагируют дихлорметаном. Органические фазы объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток обрабатывают толуолом и снова концентрируют при пониженном давлении, получая 11,3 г (87%) целевого соединения. 6-Бром-3-(диметиламино)-1,2,3,4-тетрагидро 9 Н-карбазол гидрохлорид Раствор 11,3 г (36,4 ммоль) 4-диметиламиноциклогексанон 4-бромфенилгидразона в 250 мл 4 М этанольного хлористого водорода нагревают с обратным холодильником в атмосфере азота в течение 3 ч. Реакционной смеси 18 дают остыть до комнатной температуры, а затем концентрируют при пониженном давлении. Оставшуюся пасту растворяют в 200 мл воды, и к этому раствору добавляют 50 мл 6 М хлористоводородной кислоты. Полученную смесь охлаждают до 0 С в течение 18 ч. Закристаллизовавшийся целевой продукт фильтруют и сушат,получая 8,66 г (72%). Силилирование 8,66 г (26,2 ммоль) 6-бром-3-диметиламино-1,2,3,4-тетра-гидро-9 Н-карбазол гидрохлорида разделяют между 1 н. гидроксидом натрия и дихлорметаном. Органическую фазу сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток растворяют в 50 мл тетрагидрофурана, и полученный раствор добавляют к суспензии 8,0 г (40 ммоль) гидрида калия (20% в минеральном масле) в 100 мл тетрагидрофурана, охлажденного примерно до 0 С. Полученную смесь перемешивают в течение 1 ч при этой температуре, затем к ней добавляют 8,0 мл (30 ммоль) триизопропилсилилтрифтала, и смеси дают постепенно нагреться до комнатной температуры. Через 18 ч реакционную смесь обрабатывают льдом для разложения избытка гидрида калия. После разрушения всего гидрида реакционную смесь разбавляют 200 мл воды, а затем экстрагируют дихлорметаном. Органические фазы объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Оставшееся масло обрабатывают хроматографически на силикагеле, элюируя последовательно толуолом, смесью 9:1 толуол : этилацетат, 4:1 толуол:этилацетат, 1:1 толуол : этилацетат и этилацетатом. Этилацетатные фракции объединяют и концентрируют при пониженном давлении, получая 7,08 г (60%) указанного в заголовке соединения в виде твердого вещества. Т.плавления = 92-93 С. ЯМР (CDCl3):7,52 (д, 1 Н) , 7,39 (дд, 1 Н),7,13 (д, 1 Н), 3,04 (шир.дд, 1 Н), 2,88 (м, 2 Н), 2,70(м, 1 Н), 2,58 (дд, 1 Н), 2,41 (с, 6 Н), 2,20 (д, 1 Н),1,78 (м, 3 Н), 1,70 (м, 1 Н), 1,14 (м, 18 Н). Пример получения II. 6-Карбокси-3-диметиламино-9-триизопропилсилил-1,2,3,4-тетрагидро-9 Н-карбазол. К раствору 2,95 г (6,56 ммоль) 6-бром-3 диметиламино-9-триизопропилсилил-1,2,3,4 тетрагидро-9 Н-карбазола в 150 мл тетрагидрофурана при -78 С добавляют 16,4 мл (26,24 ммоль) трет-бутиллития (1,6 М в пентане). Темный раствор перемешивают при этой температуре в течение 1 ч, затем через раствор барботируют двуокись углерода до тех пор, пока темный цвет не превращается в светло-желтый. После того, как реакционной смеси дают в течение 1 ч нагреться до комнатной температуры, ее выливают в воду, затем рН смеси доводят до примерно 7, и полученную смесь экстрагируют дихлорметаном. Органические фазы объединяют, сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток тща 19 тельно растирают с гексаном, получая 2,31 г(85%) целевого соединения в виде пены желтокоричневого цвета. ИК: 3022, 2958, 2871, 1465, 1249 см-1 MC(m/e): 414 (М+). Пример получения III. 4-(1-Фталимидил) циклогептанон. К перемешиваемому раствору 5,00 г (20,55 ммоль) 4-(1-фталимидил)циклогексанона в 30 мл диэтилового эфира добавляют 3,79 мл (30,8 ммоль) эфирата трехфтористого бора. После перемешивания в течение 20 мин при комнатной температуре, по каплям добавляют 3,24 мл(30,8 ммоль) этилдиазоацетата. Полученный раствор перемешивают в течение 16 ч при комнатной температуре. Реакционную смесь разбавляют насыщенным водным раствором карбоната натрия, а затем экстрагируют диэтиловым эфиром. Объединенные органические экстракты сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток растворяют в 15 мл диметилсульфоксида. К этому раствору добавляют 1,3 мл воды и 1,5 г хлорида натрия. Полученную смесь нагревают при 170 С в течение 7 ч. Затем реакционную смесь охлаждают, выливают в 150 мл воды и тщательно экстрагируют диэтиловым эфиром. Объединенные органические фазы промывают последовательно водой и насыщенным водным хлоридом натрия, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток обрабатывают хроматографически на силикагеле, элюируя смесью 6:4 гексан : этилацетат. Фракции, содержащие продукт, объединяют и концентрируют при пониженном давлении, получая 4,17 г (79%) указанного в заголовке соединения. MC (m/e): 257 (М+). Пример получения IV. (R)- и (S)-3-(N-метил-4-нитробензил)амино-6-бром-2-амино 1,2,3,4-тетрагидро-9 Н-карбазол. Восстановительное аминирование К раствору 20,0 г (100,9 ммоль) 1,4 циклогександион моно(2,2-диметил)пропан-1,3 диол монокеталя в 250 мл метанола добавляют 35,0 г (172,7 ммоль) R-(+)метил-4-нитробензиламин гидрохлорида, 25 г (398 ммоль) цианоборгидрид а натрия и 10 мл уксусной кислоты. Реакционную смесь перемешивают в течение 18 ч при комнатной температуре. Затем к реакционной смеси добавляют дополнительную порцию 25,0 г (398 ммоль) цианоборгидрида натрия, и реакционную смесь перемешивают еще 18 ч при комнатной температуре. Затем реакционную смесь разбавляют водной виннокаменной кислотой, и тщательно экстрагируют дихлорметаном. Оставшуюся водную фазу подщелачивают водным гидроксидом натрия и тщательно экстрагируют дихлорметаном. Эти дихлорметановые экстракты объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении, получая 33,7 г (96%)(m/е): 348 (М+) Удаление защитных групп у кеталя Раствор 33,42 г (95,91 ммоль) (R)-4-(N-метил-4-нитробензил)аминоциклогексанон 2,2 диметилпропан-1,2-диол кеталя в 250 мл 98% муравьиной кислоты нагревают при 40 С в течение 66 ч. Реакционную смесь концентрируют при пониженном давлении до объема около 50 мл, а затем обрабатывают водным карбонатом калия. Щелочную водную смесь тщательно экстрагируют дихлорметаном. Эти органические фазы объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении,получая 22,36 г (89%) (R)-4-(Nметил-4 нитробензил)аминоциклогексанона в виде масла коричневого цвета. Получение фенилгидразона К раствору 22,3 г (85,01 ммоль) (R)-4-(N-метил-4-нитробензил)аминоциклогексанона в 375 мл этанола добавляют 19,0 г (85,0 ммоль) 4 бромфенилгидразин гидрохлорида и 6,73 г (85,1 ммоль) пиридина. Реакционную смесь нагревают до 80 С в течение 48 ч. Реакционную смесь охлаждают до комнатной температуры и концентрируют при пониженном давлении. Остаток растворяют в дихлорметане, и органический раствор промывают последовательно водным карбонатом калия и насыщенным водным хлоридом натрия. Оставшийся органический материал сушат над сульфатом натрия и концентрируют при пониженном давлении, получая 31,66 г (86%) (R)-4-(Nметил-4-нитробензил)аминоциклогексанон 4-бромфенилгидразона в виде твердого вещества коричневого цвета. Индольная реакция Фишера Раствор 31,66 г (73,4 ммоль) (R)-4-(N-метил-4-нитробензил)аминоциклогексанон 4 бромфенилгидразона в 500 мл 3,7 М этанольного хлористого водорода перемешивают при кипении с обратным холодильником в течение 18 ч. Реакционную смесь охлаждают до комнатной температуры, а затем концентрируют при пониженном давлении. Остаток разделяют между 1 н. гидроксидом натрия и дихлорметаном. Водную фазу тщательно экстрагируют дихлорметаном. Органические фазы объединяют, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток обрабатывают хроматографически на силикагеле, элюируя 5% метанолом в дихлорметане, который содержит 1% гидроксида аммония.[]D20 (с = 10, метанол): +337,9. Рассчитано для C20H20N3O2Br: С 57,78 H 4,87 N 10.14. Найдено: С 58,26 Н 5,03 N 9,93. Кристаллографические исследования с помощью рентгеновских лучей показали, что диастереоизомер, который элюируется медленнее,имеет указанную абсолютную конфигурацию. Пример получения V. (R)-(+)-6-бром-3 диметиламино-1,2,3,4-тетрагидро-9 Н-карбазол гидройодид. Кватернизация К раствору 5,00 г (12,1 ммоль) (3R)-(+)-3(N-R)метил-4-нитробензил)амино)-6-бром 1,2,3,4-тетрагидро-9 Н-карбазола в 150 мл ацетонитрила добавляют 10,0 мл йодометана, а затем 5,0 г карбоната калия. Эту смесь перемешивают в течение 2 дней при комнатной температуре, а затем 18 ч при кипении с обратным холодильником. Затем реакционную смесь охлаждают до комнатной температуры, и полученный желтый осадок отфильтровывают, промывают метанолом и сушат при пониженном давлении,получая 3,65 г (53%) (R)-(+)-3-(N,N-диметил-NR)-(+)метил-(4-нитробензил)амино)-6 бром-1,2,3,4-тетрагидро-9 Н-карбазолйодида в виде твердого вещества желтого цвета. Рассчитано для C25H25N3O2BrI: С 46,34 Н 4,42 N 7,37. Найдено: С 46,22 Н 4,41 N 7,30. Гидрогенолиз Смесь 0,70 г (1,23 ммоль) (R)-(+)-3-(N,Nдиметил-N-R)-(+)метил-(4-нитробензил) амино)-6-бром-1,2,3,4-тетрагидро-9 Н-карбазол йодида и 0,20 г сульфидированной платины-наугле в 150 мл метанола гидрируют при комнатной температуре в течение 18 ч при начальном давлении водорода 2,812 кг/см 2 (40 пси). Затем реакционную смесь дегазируют и нагревают для осуществления метанолиза. Реакционную смесь фильтруют и концентрируют при пониженном давлении, получая 0,471 г (91%) указанного в заголовке соединения в виде твердого вещества светло-желтого цвета. Т.плавления = 252 С. МС (m/е): 293 (М+).N 6,65. Найдено: С 39,87 Н 4,19 N 6,38. Пример получения VI. Разделение рацемического 6-бром-3-диметиламино-1,2,3,4-тетрагидро-9 Н-карбазола. К раствору 5,0 г (17,06 ммоль) 6-бром-3 диметиламино-1,2,3,4-тетрагидро-9 Н-карбазола в 200 мл теплого этилацетата добавляют раствор 6,59 г (17,06 ммоль) дипаратолуоил-D-виннокаменной кислоты в 100 мл этилацетата при перемешивании. После выстаивания в течение 4 ч выпавший осадок отфильтровывают и сушат,получая 12,0 г соли. Суспензию 1 г этого твердого вещества нагревают до кипения в 10 мл метанола. Эту смесь охлаждают затем до комнатной температуры и оставляют выстаиваться на 18 ч. Оставшийся твердый продукт отфильтровывают и сушат, получая 0,65 г. Этот твердый продукт снова суспендируют в 10 мл кипящего метанола, и оставляют охлаждаться и выстаиваться в течение 18 ч, получая 0,52 г твердого продукта после фильтрования и сушки в вакууме. Этот твердый продукт разделяют между дихлорметаном и разбавленным водным гидроксидом натрия. Фазы разделяют, и органическую промывают насыщенным водным хлоридом натрия, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток растворяют в 7 мл толуола и оставляют выстаиваться при комнатной температуре в течение 18 ч. Раствор фильтруют для удаления образовавшейся твердой части, и полученный фильтрат концентрируют при пониженном давлении, получая 0,133 г масла, которое постепенно кристаллизуется. Т.плавления = 131-133 С.[]D20 (с = 10, метанол): -83. Два метанольных фильтрата объединяют и концентрируют при пониженном давлении, получая 0,33 г стеклообразного материала. Его обрабатывают, как указано выше, получая 0,121 г масла, которое постепенно кристаллизуется. Т.плавления = 131-134 С []D20 (с = 10, метанол): +78. Пример 1. N-(Пиридин-4-ил)-3-диметиламино-1,2,3,4-тетрагидро-9 Н-карбазол-6-карбоксамид дигидрохлорид. Смесь 0,41 г (1,0 ммоль) 3-диметиламино 9-триизопропилсилил-1,2,3,4-тетрагидро-9 Нкарбазол-6-карбоновой кислоты, 0,77 г (4,0 ммоль) 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорида, 0,54 г (4,0 ммоль) 1 гидроксибензотриазола и 0,38 г (4,0 ммоль) 4 аминопиридина в 10 мл диметилформамида и 50 мл тетрагидрофурана перемешивают при комнатной температуре в течение 3 дней. К реакционной смеси добавляют полистирол-связанную изоцианатную смолу и перемешивают при 40 С 23 в течение 6 ч для удаления избытка 4-аминопиридина. Реакционную смесь фильтруют, концентрируют при пониженном давлении, а остаток обрабатывают с помощью препаративной центрифужной ТСХ (PCTLC), элюируя хлороформом, содержащим 5% метанола и 0,5% гидроксида аммония. Фракции, содержащие десилилированный продукт, объединяют и концентрируют при пониженном давлении, получая масло желтого цвета. Это масло растворяют в дихлорметане и обрабатывают этанольным хлористым водородом. Полученную смесь концентрируют при пониженном давлении, получая 0,22 г (54%) указанного в заголовке соединения в виде твердого вещества желто-коричневого цвета. МС (m/е): 293 (М+). Рассчитано для C20H22N4O2HCl: С 58,97 Н 5,94 N 13,75. Найдено: С 58,77 Н 5,91 N 13,79. Пример 2. Полугидрат (S)-(-)-N-(пиридин 4-ил)-3-диметиламино-1,2,3,4-тетрагидро-9 Нкарбазол-6-карбоксамид дигидрохлорида. Смесь 0,336 г (0,81 ммоль) (S)-(-)-3 диметиламино-9-три-метилсилил-1,2,3,4 тетрагидро-9 Н-карбазол-6-карбоновой кислоты,0,171 г (0,89 ммоль) 1-(3-диметиламинопропил)3-этилкарбодиимид гидрохлорида и 0,084 г (0,89 ммоль) 4-аминопиридина в 15 мл диметилформамида перемешивают при комнатной температуре в течение 3 дней. Реакционную смесь разбавляют дихлорметаном, а затем промывают водой. Органическую фазу сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток обрабатывают хроматографически на силикагеле, как указано в примере 1,получая 0,244 г частично десилилированного продукта. Процесс десилилирования завершают,смешивая с 5 мл тетрабутиламмонийфторида(1,0 М в тетрагидрофуране) в 25 мл тетрагидрофурана, содержащего 5 мл борной кислоты, и перемешивая при комнатной температуре в течение 18 ч. Реакционную смесь концентрируют при пониженном давлении, а затем растворяют в водной виннокаменной кислоте, и полученный раствор тщательно промывают дихлорметаном. Оставшийся водный раствор подщелачивают 5 н. гидроксидом натрия, а затем экстрагируют 10% изопропанолом в хлороформе. Органические фазы объединяют, сушат над карбонатом калия и концентрируют при пониженном давлении. Остаток обрабатывают с помощью препаративной центрифужной ТСХ, элюируя хлороформом, содержащим 5% метанола и 0,5% гидроксида аммония. Фракции, содержащие продукт, объединяют и концентрируют при пониженном давлении. Остаток растворяют в хлороформе, содержащем метанол, и раствор помещают в ионообменную колонку VARIAN BONDELUT SCX (Varian, Harbor City, CA, U.S.A.). Колонку промывают двумя объемами метанола,а затем колонку элюируют 2 н. аммиаком в метаноле. Фракции, содержащие продукт, объеди 001718 24 няют и концентрируют при пониженном давлении. Остаток растворяют в этанольном хлористом водороде, и раствор концентрируют при пониженном давлении, получая 0,044 г (18%) указанного в заголовке соединения в виде твердого вещества бежевого цвета. Рассчитано для C20H22N4O2HCl0,5H2O: С 57,70 Н 6,05 N 13,46. Найдено: С 57,75 Н 5,84 N 12,83. Общий способ присоединения аминов к 3 диметиламино-1,2,3,4-тетрагидро-9 Н-карбазол 6-карбоновым кислотам. К суспензии 4-5 эквивалентов связанного с полимером 1-этил-3-(3-диметиламинопропил) карбодиимида (Desai, et al Tetrahedron Letters,34 (48), 7685 (1993 в хлороформе добавляют 1 эквивалент 3-диметиламино-1,2,3,4-тетрагидро 9 Н-карбазол-6-карбоновой кислоты и 2-3 эквивалента соответствующего амина. Реакционную смесь перемешивают до завершения реакции,нагревая при необходимости. Смолу отфильтровывают, а продукт выделяют, выпаривая растворитель. Эта процедура проиллюстрирована в примерах 3-7. Пример 3. N-Циклопропил-3-(диметил) амино-1,2,3,4-тетрагидро-9 Н-карбазол-6-карбоксамид. Исходя из 7,4 мг (0,029 ммоль) 3 диметиламино-1,2,3,4-тетрагидро-9 Н-карбазол 6-карбоновой кислоты и циклопропиламина,выделяют 3,5 мг (41%) указанного в заголовке соединения. МС (m/е): 298 (М+) Пример 4. N-циклопентил-3-диметиламино-1,2,3,4-тетрагидро-9 Н-карбазол-6-карбоксамид. Исходя из 7,4 мг (0,029 ммоль) 3 диметиламино-1,2,3,4-тетрагидро-9 Н-карбазол 6-карбоновой кислоты и циклопентиламина,выделяют 4,1 мг (41%) указанного в заголовке соединения. 25 Исходя из 7,4 мг (0,029 ммоль) 3 диметиламино-1,2,3,4-тетрагидро-9 Н-карбазол 6-карбоновой кислоты и 6-метокси-3-аминопиридина, выделяют 1,8 мг (14%) указанного в заголовке соединения . MC (m/e): 365 (М+) Пример 8. N-(пиридин-3-ил)-3- и -4 диметиламино-10 Н-циклогепта[7,6-b]индол-7 карбоксамиды. 7-Карбокси-3- и 4-(диметиламино)циклогепта[7,6-b]индол гидрохлориды. Суспензию 1,40 г (7,33 ммоль) 4(диметиламино)циклогептанона и 1,115 г (7,33 ммоль) 4-карбоксифенилгидразина в 20,0 мл 5 н. хлористоводородной кислоты кипятят с обратным холодильником в течение 15 ч. Реакционную смесь концентрируют при пониженном давлении, получая указанное в заголовке соединения в виде твердого вещества черного цвета. МС (m/е): 272 (М+). К перемешиваемому раствору 0,541 г (1,75 ммоль) смеси 3- и 4-диметиламино-10 Нциклогепта[7,6-b]индол-7-карбоновой кислоты гидрохлорида в 10 мл диметилформамида добавляют 0,387 г (2,38 ммоль) карбонилдиимидазола. Реакционную смесь перемешивают в течение 15 мин при комнатной температуре, а затем добавляют 3,48 ммоль 3-аминопиридина. Реакционную смесь перемешивают при комнатной температуре в течение 20 ч, разбавляют водой и экстрагируют этилацетатом. Органические фазы объединяют, тщательно промывают водой, затем насыщенным водным хлоридом натрия, сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток обрабатывают хроматографически на силикагеле, элюируя хлороформом, содержащим 15% метанола и 1% гидроксида аммония. Фракции, содержащие изомерные амины, объединяют и концентрируют при пониженном давлении, получая указанные в заголовке соединения. Обнаружение того факта, что 5-HT1F является медиатором нейрогенной менингеальной экстравазации, вызывая тем самым боль, связанную с мигренью и связанными с ней расстройствами, раскрыто в патенте США 5521196, включенном сюда в качестве ссылки. Для демонстрации использования соединений настоящего изобретения для лечения мигрени, определяют их способность связываться с 5-HT1F рецепторным подтипом. Способность соединений настоящего изобретения связываться с 5-HT1F рецепторным подтипом определяют практически способом, раскрытым в N. Adham, et al., Proceedings of the NationalAcademy of Sciences (USA), 90, 408-412 (1993). Подготовка мембран: Мембраны приготавливают из трансфектированных Ltk-клеток,которые выращивают до 100% конфлюэнтности. Клетки дважды промывают буферированым фосфатом физиологическим раствором, соскребают с культуральных чашек в 5 мл охлажденного льдом буферированного фосфатом физио 001718 26 логического раствора и центрифугируют при 200 g в течение 5 мин при 4 С. Осадок снова суспендируют в 2,5 мл охлажденного Трис буфера (20 мМ Tris HCl, рН = 7,4 при 23 С, 5 мМEDTA) и гомогенизируют с помощью измельчителя тканей Weaton. Лизат затем центрифугируют при 200 g в течение 5 мин при 4 С для осаждения более крупных фрагментов, которые удаляют. Надосадочную жидкость собирают и центрифугируют при 40000 g в течение 20 мин при 4 С. Осадок, полученный в результате центрифугирования, промывают в охлажденном льдом Tris промывочном буфере и снова суспендируют в конечном буфере, содержащем 50 мМ Tris HCl и 0,5 мМ EDTA, рН = 7,4 при 23 С. Мембранные препараты хранят на льду и используют в течение двух часов для анализов связывания с радио-лигандами. Концентрации протеина определяют способом Bradford (Anal.Biochem., 72, 248-254 (1976. Связывание с радиолигандом: [3H-5-HT] связывание осуществляют, используя небольшие модификации условий 5-НТ 1D анализа, сообщавшиеся Herrick-Davis and Titeler (J. Neurochem., 50, 1624-1631 (1988, опуская маскирующие лиганды. Исследования связывания радиолигандов осуществляют при 37 С в полном объеме 250 мкл буфера (50 мМ Tris, 10 мМMgCl2, 0,2 мМ EDTA, 10 мМ паргилина, 0,1% аскорбата, рН = 7,4 при 37 С) в 96 ячеечных микротитровальных пластинах. Исследования насыщения осуществляют, используя [3H]5-HT при 12 различных концентрациях в интервале от 0,5 нМ до 100 нМ. Исследования замещения осуществляют, используя 4,5-5,5 нМ [3H]5-HT. Профиль связывания для лекарств в экспериментах конкурирования получают, используя 612 концентраций соединения. Времена инкубирования составляют 30 мин для исследований как насыщения, так и замещения на основании начальных исследований, в которых были определены равновесные условия связывания. Неспецифическое связывание определяют в присутствии 10 мкМ 5-НТ. Связывание инициируют, добавляя 50 мкл мембранных гомогенатов(10-20 мкг). Реакцию заканчивают быстрым фильтрованием через предварительно смоченные (0,5% полиэтиленимин) фильтры, используя сборник 48R Cell Brandel Harvester(Gaithersburg, MD). Затем фильтры промывают в течение 5 с ледяным буфером (50 мМ Tris HCl,рН = 7,4 при 4 С), сушат и помещают в ампулы,содержащие 2,5 мл Readi-Safe (Beckman,Fullerton, CA), и радиоактивность измеряют,используя жидкостной сцинтилляционный счетчик Beckman LS 5000TA. Эффективность подсчета [3 Н]5-НТ составляет в среднем 4550%. Данные по связыванию анализируют с помощью компьютерного нелинейного регрессионного анализа (Accufit and Accucomp, Lunden Software, Chagrin Falls, ОН). Величины ИК 50 превращают в значения Ki, используя уравнениеCheng-Prusoff (Biochem, Pharmacol., 22, 30993108 (1973. Все эксперименты повторяют трижды. Обнаружено, что соединения настоящего изобретения обладают сродством к 5-HT1F рецептору, о чем свидетельствуют проведенные,как указано выше, измерения. Как сообщалось R.L. Weinshank, et al., WО 93/14201, 5-HT1F рецептор функционально связан с G-протеином, как показали измерения способности меротонина и серотониновых лекарственных препаратов, ингибировать форсколином стимулируемое продуцирование сАМР вNIH3T3 клетках, трансфекцированных 5-HT1F рецептором. Активность аденилатциклазы определяют, используя стандартные методики. Максимальный эффект достигается серотонином. Емакс определяют, деля ингибирование испытываемого соединения на максимальный эффект, и определяя % ингибирования. (N. Adham,et al., supra; R.L. Weinshank, et al., Proceedings ofthe National Academy of Sciences (USA), 89,3630-3634 (1992 и указанные там ссылки. Измерения образования сАМР Трансфекцированные(оценка Вмакс из одной точки конкурентных исследований = 488 фмоль/мг протеина) инкубируют в DMEM, 5 мМ теофиллина, 10 мМ(4-[2-гидроксиэтил]-1-пиперазинэтансульфоновая кислота) и 10 мкМ паргилина в течение 20 мин при 37 С, 5% СО 2. Кривые доза лекарства-эффект получают, добавляя 6 различных конечных концентраций лекарства с последующим немедленным добавлением форсколина (10 мкМ). Затем клетки инкубируют в течение дополнительно 10 мин при 37 С, 5% СO2. Среду отсасывают и реакцию останавливают,добавляя 100 мМ НСl. Для демонстрации конкурентного антагонизма параллельно измеряют кривую доза-реакция для 5-НТ, используя фиксированную дозу метиотепина (0,32 мкМ). Пластины хранят при 4 С в течение 15 мин, а затем центрифугируют 5 мин при 500 g для осаждения клеточных осколков, отбирают аликвоты надосадочной жидкости и хранят при -20 С перед оценкой сАМР образования с помощью радиоиммунологического анализа (набор для радиоиммунологического анализа сАМР; Advanced Magnetics, Cambridge, MA). Радиоактивность определяют количественно, используя счетчик Packard COBRA Auto Gamma counter,снабженный программным обеспечением. Обнаружено, что протестированные представительные соединения настоящего изобретения являются агонистами 5-HT1F рецептора в сАМР анализе. Экстравазация протеина Крыс штамма Наrlan Sprague-Dawley (225325 г) или морских свинок из Charles RiverLaboratories (225-325 г) анестезируют внутривенно фенобарбиталом натрия (65 мг/кг или 45 мг/кг, соответственно), и помещают в стереотаксическую раму (David Kopf Instruments) с 28 резцом, расположенным на -3,5 мм для крыс или -4,0 мм для морских свинок. После сагитального рассечения по средней линии, просверливают две пары билатеральных отверстий через скулу (6 мм сзади, 2,0 и 4,0 мм сбоку у крыс; 4 мм сзади и 3,2 и 5,2 мм сбоку у морских свинок, причем все координаты со ссылкой наbregma). В отверстия погружают пары стимулирующих электродов из нержавеющей стали(Rhodes Medical Systems, Inc.) в обе полусферы на глубину 9 мм (для крыс) или 10,5 мм (для морских свинок) от твердой мозговой оболочки. Вскрывают бедренную вену и внутривенно вводят дозу испытываемого соединения (1 мл/кг). Примерно 7 мин спустя внутривенно вводят также (50 мг/кг) флуоресцентный краситель Evans Blue. Evans Blue образует комплекс с протеинами крови и функционирует как маркер для экстравазации протеина. Точно через 10 мин после инъекции испытываемого соединения левый тригеминальный ганглион стимулируют в течение 3 мин током силой 1,0 мА (5 Гц, 4 мсек длительность) с помощью прибора Model 273 потенциометр/гальванометр (EGG Princeton Applied Research). Через 15 мин после стимулирования животных умерщвляют и обескровливают 20 мл физиологического раствора. Верхнюю часть скулы удаляют для облегчения сбора мембран твердой мозговой оболочки. Образцы мембран удаляют с обеих полусфер, промывают водой и распластывают на стеклах для микроскопа. После того, как они высохнут, ткани покрывают раствором 70% глицерин/вода. Для количественного определения количества красителя Evans Blue в каждом образце,используют флуоресцентный микроскоп (Zeiss),снабженный дифракционным монохроматором и спектрофотометром. Используют возбуждающую длину волны примерно 535 нм и измеряют интенсивность испускания на 600 нм. Микроскоп снабжен предметным столиком с моторчиком и интерфейсом с компьютером. Это облегчает контролируемые компьютером передвижения столика при измерениях флуоресценции в 25 точках (с шагом 500 мкм) для каждого образца твердой мозговой оболочки. Среднее значение и стандартные отклонения измерений определяют с помощью компьютера. Экстравазация, индуцируемая электростимуляцией тригминального ганглиона, является ипсилатеральной (т.е. происходит только на стороне твердой мозговой оболочки, в которой стимулируют тригеминальный ганглион). Это позволяет использовать другую половину твердой оболочки мозга (не стимулированную) в качестве контроля. Рассчитывают отношение величины экстравазации в оболочке для стимулированной стороны к величине экстравазации для не стимулированной стороны оболочки. Контроль физиологического раствора дает отношение примерно 2,0 для крыс и 1,8 для мор 29 ских свинок. Напротив, соединения, которые эффективно предотвращают экстравазацию в оболочке со стимулированной стороны, должны иметь величину этого отношения примерно 1,0. Строят кривую доза-реакция и аппроксимируют дозу, которая ингибирует экстравазацию на 50%(ID50). Суматриптан, коммерчески доступное лекарство от мигрени, отличается низкой биодоступностью и относительно кратковременным действием. Его сродство с рядом подтипов серотониновых рецепторов приводит к нежелательным побочным эффектам, особенно к сужению сосудов, что серьезно ограничивает его применимость для лечения мигрени. Так как соединения настоящего изобретения являются эффективными агонистами 5-HT1F рецепторов,необходимы лишь чрезвычайно низкие их дозы для достижения терапевтического эффекта. Кроме того, так как соединения, которые селективны для 5-HT1F рецепторов, по сравнению с другими рецепторами не вызывают сужения сосудов, удается избежать осложнений, связанных с сужением сосудов. Кроме того, соединения настоящего изобретения ингибируют экстравазацию протеина, если их вводят до или после стимуляции тригеминальных ганглий, что предполагает возможность их применения перед наступающим приступом мигрени для предотвращения боли или во время приступа мигрени для ослабления боли. Хотя имеется возможность вводить соединения, используемые в способах настоящего изобретения, непосредственно без дополнительных ингредиентов, эти соединения обычно вводят в форме фармацевтических композиций,включающих фармацевтически приемлемый эксципиент и, по крайней мере, один активный ингредиент. Эти композиции можно вводить различными способами, включая пероральный,ректальный, чрескожный, подкожный, внутривенный, внутримышечный и через нос. Многие соединения, используемые в методиках настоящего изобретения, являются эффективными как в виде композиций для перорального введения, так и в виде композиций для инъекций. Такие композиции приготавливают способами, хорошо известными фармацевтам, и они включают, по крайней мере, одно активное соединение. См. например, REMINGTON'SPHARMACEUTICAL SCIENCES (16th ed. 1980). При приготовлении композиций, используемых в настоящем изобретении, активный ингредиент обычно смешивают с эксципиентом, разбавляют эксципиентом или заключают внутрь такого носителя, который может быть в форме капсул, саше, бумаги или в других формах контейнеров. Если эксципиент служит разбавителем, он может быть твердым, полутвердым или жидким материалом, который функционирует как средство доставки, носитель или среда для активного ингредиента. Так, компози 001718 30 ции могут быть в форме таблеток, пилюль, порошков, пастилок, саше, облаток, элексиров,суспензий, эмульсий, растворов, сиропов, аэрозолей (как твердых, так и в жидкой среде), мазей, содержащих, например, вплоть до 10 вес.% активного соединения, мягких и твердых желатиновых капсул, суппозиториев, стерильных растворов для инъекций и порошков в стерильной упаковке. При приготовлении композиций может оказаться необходимым измельчить активное соединение для достижения соответствующего размера частиц перед тем, как объединять его с другими ингредиентами. Если активное соединение практически нерастворимо, его обычно измельчают до частиц размером менее 200 меш. Если активное соединение хорошо растворяется в воде, размер частиц в результате размалывания обычно доводят до такого, который равномерно распределяется в композиции, например,до около 40 меш. Некоторые примеры подходящих эксципиентов включают лактозу, декстрозу, сахарозу,сорбит, маннит, крахмалы, смолу акации, фосфат кальция, альгинаты, трагакант, желатин,силикат кальция, микрокристаллическую целлюлозу, поливинилпирролидон, целлюлозу, воду, сироп и метилцеллюлозу. Композиции могут включать дополнительно: скользящие, такие как тальк, стеарат магния и минеральное масло; смачивающие агенты; эмульгаторы и суспендирующие агенты, консерванты, такие как метили пропилгидроксибензоаты; подслащивающие агенты и вкусовые агенты. Композиции настоящего изобретения можно приготовить так, чтобы обеспечить быстрое, замедленное или с задержкой выделение активного ингредиента после введения композиции пациенту, используя известные специалистам способы. Композиции, предпочтительно, приготавливают в виде единичных дозовых форм, причем каждая доза содержит от около 0,05 до около 100 мг, чаще от около 1,0 до около 30 мг активного ингредиента. Термин "единичная дозовая форма" относится к физически дискретной единице, которую можно использовать как стандартную дозу для людей и других млекопитающих, причем каждая единичная доза содержит определенное количество активного материала, рассчитанное так, чтобы обеспечить нужный терапевтический эффект, вместе с подходящим фармацевтическим эксципиентом. Активные соединения обычно эффективны в широком интервале доз. Так, например, дневная доза обычно попадает в интервал значений от около 0,01 до около 30 мг/кг веса тела. При лечении взрослых людей интервал от около 0,1 до около 15 мг/кг/день в виде единичной дозы или в виде нескольких доз наиболее предпочтителен. Однако следует учитывать, что количество соединения, которое вводят реально, должен определять врач с учетом сопутствующих об 31 стоятельств, включая подлежащее лечению состояние, выбранный способ введения, реальное соединение или соединения, которое предстоит ввести, возраст, вес и индивидуальную реакцию пациента, тяжесть симптомов заболевания, и поэтому вышеуказанные дозы не должны ограничивать ни коим образом объем изобретения. В некоторых случаях могут оказаться подходящими дозы ниже нижнего уровня, тогда как в других случаях можно использовать гораздо большие дозы без какого либо вредного эффекта при условии, что такие более крупные дозы вначале делят на несколько меньших доз для введения в течение дня. Пример композиции 1. Приготавливают твердые желатиновые капсулы, содержащие следующие ингредиенты: Ингредиент Количество(мг/капсулу) Соединение примера 1 30,0 Крахмал 305,0 Стеарат магния 5,0 Вышеуказанные ингредиенты смешивают и заполняют ими твердые желатиновые капсулы в количестве 340 мг в каждую. Пример композиции 2. Приготавливают таблетки, используя перечисленные ниже ингредиенты: Ингредиент Количество(мг/таблетку) Соединение примера 2 25,0 Микрокристаллическая целлюлоза 200,0 Коллоидная двуокись кремния 10,0 Стеариновая кислота 5,0 Компоненты смешивают и прессуют, получая таблетки весом 240 мг каждая. Пример композиции 3. Композицию сухого порошка для ингаляции приготавливают из следующих компонентов: Ингредиент Вес.% Соединение примера 3 5 Лактоза 95 Активное соединение смешивают с лактозой и эту смесь помещают в устройство для ингаляции сухим порошком. Пример композиции 4. Приготавливают таблетки, каждая из которых содержит 30 мг активного ингредиента,следующим образом: Ингредиент Количество 32 Натрий карбоксиметилкрахмал Стеарат магния Тальк Всего Активный ингредиент, крахмал и целлюлозу пропускают через сито 20 меш. США и тщательно перемешивают. Раствор поливинилпирролидона смешивают с полученными порошками, и все это затем пропускают через сито 16 меш. США. Полученные таким образом гранулы сушат при 50-60 С и пропускают через сито 16 меш. США. Натрий карбоксиметилкрахмал, стеарат магния и тальк, предварительно пропущенные через сито 30 меш. США, добавляют затем к гранулам, и, после перемешивания, прессуют в машине для изготовления таблеток, получая таблетки весом 120 мг каждая. Пример композиции 5. Приготавливают капсулы, каждая из которых содержит 40 мг лекарственного вещества: Ингредиент Количество(мг/капсулу) Соединение примера 6 40,0 Крахмал 109,0 Стеарат магния 1,0 Всего 150,0 Активный ингредиент, целлюлозу, крахмал и стеарат магния смешивают, пропускают через сито 20 меш. США, и заполняют этой смесью твердые желатиновые капсулы в количестве 150 мг в каждую. Пример композиции 6. Приготавливают суппозитории, каждый из которых содержит 25 мг активного ингредиента,следующим образом: Ингредиент Количество Соединение примера 7 25 мг Глицериды насыщенных жирных кислот до 2000 мг Активный ингредиент пропускают через сито 60 меш. США и суспендируют в глицеридах насыщенных жирных кислот, которые предварительно расплавляют, используя минимальный нагрев при необходимости. Затем полученную смесь выливают в форму для суппозиториев номинальной емкостью 2,0 г и оставляют остывать. Пример композиции 7. Приготавливают суспензии, каждая из которых содержит 50 мг лекарственного вещества на 5,0 мл дозу, следующим образом: Ингредиент Количество Соединение примера 1 50,0 мг Ксантановая смола 4,0 мг Натрийкарбоксиметилцеллюлоза (11%) Микрокристаллическая целлюлоза (89%) 50,0 мг Сахароза 1,75 г 33 Бензоат натрия Вкусовой агент и краситель Очищенная вода до Лекарственное вещество, сахарозу и ксантановую смолу смешивают, пропускают через сито 10 меш. США, а затем смешивают с приготовленным заранее раствором микрокристаллической целлюлозы и натрийкарбоксиметилцеллюлозы в воде. Бензоат натрия, вкусовой агент и краситель разбавляют небольшим количеством воды и добавляют при перемешивании. Затем добавляют достаточное количество воды до нужного объема. Пример композиции 8. Приготавливают капсулы, каждая из которых содержит 15 мг лекарственного вещества,следующим образом: Ингредиент Количество(мг/капсулу) Соединение примера 2 15,0 Крахмал 407,0 Стеарат магния 3,0 Всего 425,0 Активный ингредиент, целлюлозу, крахмал и стеарат магния смешивают, пропускают через сито 20 меш. США, и заполняют этим твердые желатиновые капсулы в количестве 425 мг. Пример композиции 9. Композицию для внутривенного введения можно приготовить следующим образом: Ингредиент Количество 250,0 мг Соединение примера 3 Изотонический физиологический раствор 1000 мл Пример композиции 10. Композицию для поверхностного нанесения можно приготовить следующим образом: Ингредиент Количество 1-10 г Соединение примера 4 30 г Эмульгирующий воск 20 г Жидкий парафин до 100 г Белый мягкий парафин Белый мягкий парафин нагревают до тех пор, пока он не расплавится. Добавляют жидкий парафин и эмульгирующий воск, и все это перемешивают до растворения. Добавляют активный ингредиент и перемешивание продолжают до получения однородной дисперсии. Затем смесь охлаждают до твердого состояния. Пример композиции 11. Таблетки для приема под язык или за щеку, каждая из которых содержит 10 мг активного ингредиента, можно приготовить следующим образом: Ингредиент Количество в таблетке Соединение примера 5 10,0 мг 34 Глицерин Вода Цитрат натрия Поливиниловый спирт Поливинилпирролидон Всего Глицерин, воду, цитрат натрия, поливиниловый спирт и поливинилпирролидон смешивают вместе при непрерывном перемешивании,поддерживая при этом температуру около 90 С. После того, как полимеры растворяются, этот раствор охлаждают до около 50-55 С, и медленно примешивают лекарственное вещество. Гомогенную смесь выливают в формы, изготовленные из инертного материала, для получения диффузной матрицы, содержащей лекарство,причем толщина матрицы составляет около 2-4 мм. Затем эту диффузную матрицу разрезают на отдельные таблетки соответствующего размера. Другой предпочтительной формой, используемой в способах настоящего изобретения,является устройство для чрескожной доставки лекарства ("пластыри"). Такие пластыри для чрезкожной доставки можно использовать для обеспечения непрерывного или порционного поступления соединений настоящего изобретения в регулируемых количествах. Получение и применение пластырей для чрескожной доставки фармацевтических агентов хорошо известно специалистам. См. например, патент США 5023252, выданный 11 июня 1991 г., и включенный сюда по ссылке. Такие пластыри могут быть созданы для обеспечения непрерывной, периодической или по требованию доставки фармацевтических агентов. Часто бывает желательным или необходимым ввести фармацевтическую композицию в мозг либо непосредственно, либо косвенно. Методика непосредственного введения обычно включает введение катетера для доставки лекарства в вентрикулярную систему пациента для преодоления гематоэнцефалического барьера. Одна такая имплантируемая система доставки,которую используют для транспорта биологических факторов в специфические анатомические участки тела, раскрыта в патенте США 5011472,выданном 30 апреля 1991 г., который включен сюда в качестве ссылки. Косвенные методики, которые вообще бывают предпочтительными, обычно включают создание композиций для обеспечения "скрытой" формы лекарства путем превращения гидрофильных лекарств в липидрастворимые лекарства или пролекарства. Такую "скрытую" форму обычно обеспечивают, блокируя гидроксильные, карбонильные, сульфатные группы и группы первичных аминов, присутствующие на молекулах лекарства, для того, чтобы сделать лекарство более растворимым в липидах и более подходящим для преодоления гематоэнцефалического барьера. В другом варианте доставку гидрофильных лекарств можно улучшить путем внутриартериальных вливаний гипертонических растворов, которые могут кратковременно открывать гематоэнцефалический барьер. Тип формы композиции, который используют для введения соединений, используемых в способах настоящего изобретения, может определяться конкретными используемыми соединениями, типом нужного фармакокинетического профиля, желательного в зависимости от способа введения, и соединения (соединений), а также состояния пациента. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы I где R1 и R2 независимо представляют водород,C1-C4 алкил или -СН 2 СН 2-арил, где арил представляет фенил, фенил, монозамещенный галогеном, или 1-(C1-C6 алкил)пиразол-4-ил; 36 и их фармацевтически приемлемые соли и гидраты. 2. Соединение по п.1, где n = 1. 3. Соединение по п.2, где R1 и R2 независимо представляют C1-C4 алкил. 4. Фармацевтическая композиция, которая включает в сочетании с фармацевтически приемлемым носителем, разбавителем или эксципиентом, соединение по любому из пп.1-3. 5. Способ активации 5-HT1F рецепторов у млекопитающих, включающий введение нуждающемуся в такой активации млекопитающему эффективного количества соединения по любому из пп.1-3. 6. Способ ингибирования экстравазации нейронного протеина у млекопитающих, включающий введение нуждающемуся в таком ингибировании млекопитающему эффективного количества соединения по любому из пп.1-3. 7. Способ лечения мигрени, включающий введение нуждающемуся в таком лечении млекопитающему эффективного количества соединения по любому из пп.1-3. 8. Способ профилактики мигрени у млекопитающих, включающий введение подверженному мигрени млекопитающему эффективного количества соединения по любому из пп.1-3. 9. Способ по любому из пп.5-8, где млекопитающим является человек.
МПК / Метки
МПК: A61K 31/40, C07D 209/88, A61P 25/06
Метки: агонистов, качестве, карбоксамиды, 5-ht1f
Код ссылки
<a href="https://eas.patents.su/19-1718-karboksamidy-v-kachestve-agonistov-5-ht1f.html" rel="bookmark" title="База патентов Евразийского Союза">Карбоксамиды в качестве агонистов 5-ht1f</a>
Предыдущий патент: Сейсморазведка
Следующий патент: Эфиры иодированных жирных кислот, иодированные жирные кислоты и их производные, способ их получения и применение в фармакологии.
Случайный патент: Монолитное кессонное перекрытие












