Производные хиназолиндиона в качестве ингибиторов parp
Номер патента: 11552
Опубликовано: 28.04.2009
Авторы: Ван Дюн Якобус Альфонсус Йозефус, Сомерс Мария Викторина Франциска, Кенни Людо Эдмон Жозефин, Ваутерс Вальтер Баудевейн Леопольд, Мертенс Йозефус Каролус
Формула / Реферат
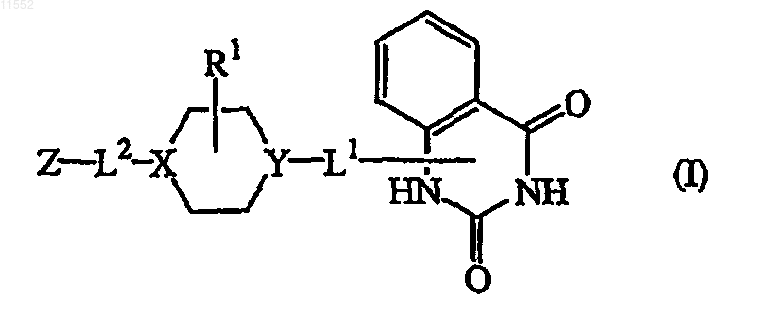
1. Соединение формулы (I)

его N-оксидные формы, его фармацевтически приемлемые аддитивные соли и его стереохимически изомерные формы, где
каждый X независимо обозначает 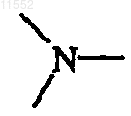 или
или 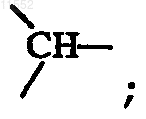
и когда X означает 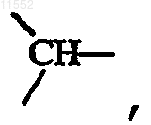 то
то
Y означает 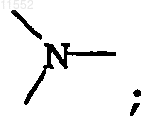
каждый Y независимо обозначает 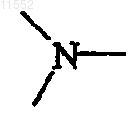 или
или 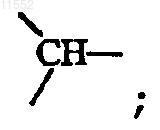
за исключением случая, когда X обозначает 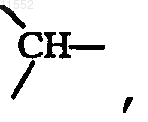
и тогда Y обозначает 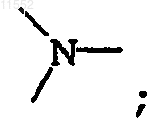
L1 означает прямую связь или двухвалентный радикал, выбранный из -C1-6алкандиила-,
L2 означает прямую связь или двухвалентный радикал, выбранный из карбонила, -С1-6алкандиила-,
-(гидрокси)C1-6алкандиила-, -C(O)-C1-6алкандиила- или -C1-6алкандиил-С(О)-;
R1 означает атом водорода или гидроксильную группу;
Z означает атом водорода или радикал, выбранный из
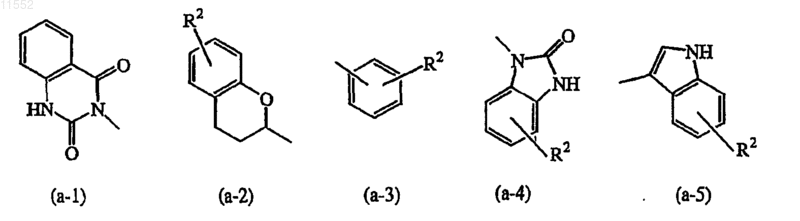
где каждый R2 независимо выбран из атома водорода, атома галогена или C1-6алкила,
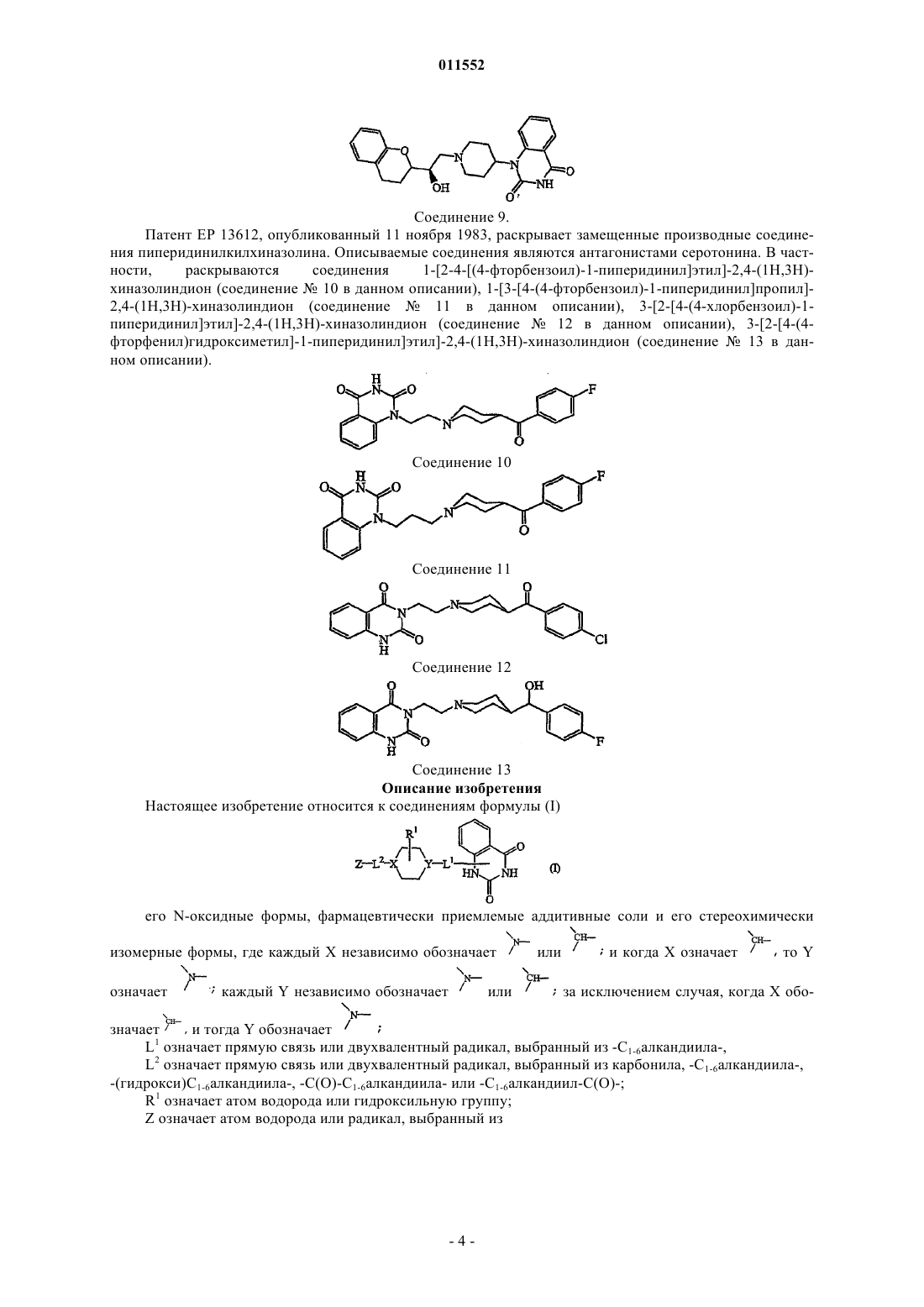
при условии, что хиназолиндионовый фрагмент присоединен к остальной части молекулы по -NH-фрагменту в положении 1, и в этом случае атом водорода замещен, и при условии, что соединения 1-[1-[(2S)-2-[(2R)-3,4-дигидро-2Н-1-бензопиран-2-ил]-2-гидроксиэтил]-4-пиперидинил]-2,4(1H,3H)-хиназолиндион, 1-[2-4-[(4-фторбензоил)-1-пиперидинил]этил]-2,4-(1H,3H)хиназолиндион и 1-[3-[4-(4-фторбензоил)-1-пиперидинил]пропил]-2,4-(1Н,3Н)хиназолиндион исключаются.
2. Соединение по п.1, где
каждый X независимо обозначает 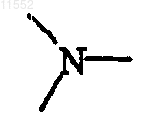 или
или 
каждый Y независимо обозначает 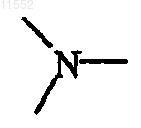 или
или 
L1 означает прямую связь или двухвалентный радикал, выбранный из -C1-6алкандиила-;
L2 означает прямую связь или двухвалентный радикал, выбранный из карбонила или -C1-6алкандиила-;
R1 означает атом водорода или гидроксильную группу;
Z означает атом водорода или радикал, выбранный из (а-1), (а-2), (а-3), (а-4) или (а-5); и
каждый R2 независимо выбран из атома водорода, атома галогена или С1-6алкила.
3. Соединение по п.1 и 2, где
каждый X обозначает 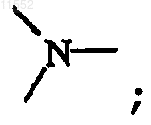
каждый Y обозначает 
L1 означает прямую связь;
L2 означает прямую связь;
R1 означает атом водорода и Z означает атом водорода.
4. Соединение по пп.1, 2 и 3, где соединением является соединение ь 1
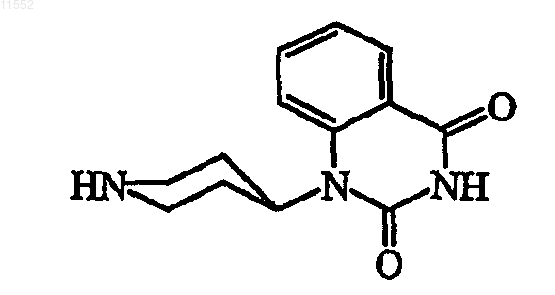
Соединение ь 1
5. Применение соединения по любому из пп.1-4 в качестве лекарственного средства.
6. Фармацевтическая композиция, содержащая фармацевтически приемлемые носители и терапевтически эффективное количество соединения по пп.1-4 в качестве активного ингредиента.
7. Способ получения фармацевтической композиции по п.6, где тщательно смешивают фармацевтически приемлемые носители и соединение по пп.1-4.
8. Применение соединения формулы (I)
его N-оксидных форм, его фармацевтически приемлемых аддитивных солей и его стереохимических изомерных форм, где
каждый X независимо обозначает 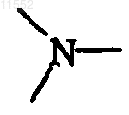 или
или 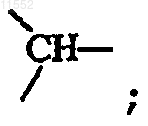
и когда X означает 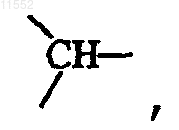 то
то
Y означает 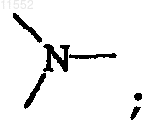
каждый Y независимо обозначает  или
или 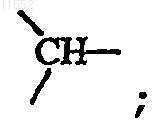
за исключением случая, когда X обозначает 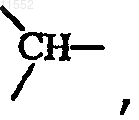
тогда Y обозначает 
L1 означает прямую связь или двухвалентный радикал, выбранный из -C1-6алкандиила-,
L2 означает прямую связь или двухвалентный радикал, выбранный из карбонила, -C1-6алкандиила-,
-(гидрокси)C1-6алкандиила-, -C(O)-C1-6алкандиила- или -C1-6алкандиил-С(О)-;
R1 означает атом водорода или гидроксильную группу;
Z означает атом водорода или радикал, выбранный из
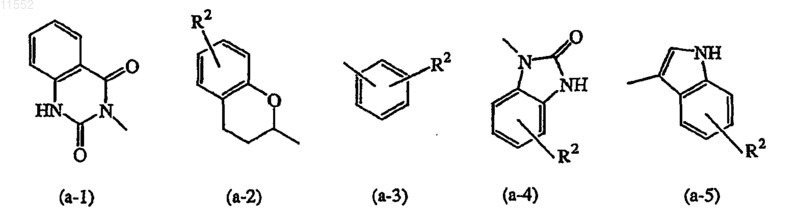
где каждый R2 независимо выбран из атома водорода, атома галогена или C1-6алкила; для приготовления лекарственного средства для лечения опосредованного PARP заболевания.
9. Применение по п.8, где опосредованное PARP заболевание представляет собой опосредованное PARP-1 заболевание.
10. Применение по пп.8 и 9, где лечение включает химиосенсибилизацию.
11. Применение по пп.8 и 9, где лечение включает радиосенсибилизацию.
12. Комбинация соединения формулы (I) по пп.1-4 с химиотерапевтическим средством.
13. Способ получения соединения по п.1, характеризующийся взаимодействием промежуточного соединения формулы (II) с промежуточным соединением формулы (III), где W обозначает подходящую уходящую группу, с образованием соединения формулы (I-а), где
X обозначает  в инертном для данной реакции растворителе и при добавлении подходящего основания,
в инертном для данной реакции растворителе и при добавлении подходящего основания,
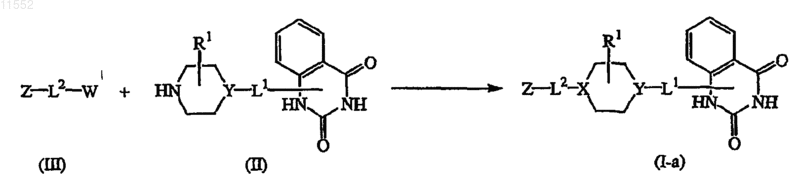
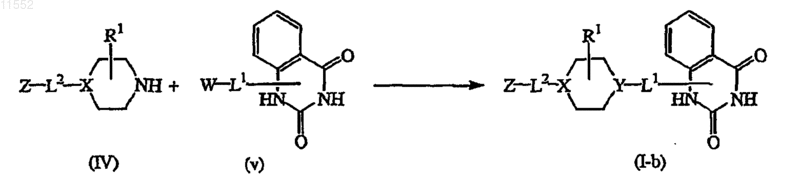
14. Способ получения соединения по п.1, характеризующийся взаимодействием промежуточного соединения формулы (IV) с промежуточным соединением формулы (V), где W обозначает подходящую уходящую группу, с образованием соединения формулы (I-b), где
Y обозначает  в инертном для данной реакции растворителе и при добавлении подходящего основания
в инертном для данной реакции растворителе и при добавлении подходящего основания
Текст
011552 Область техники, к которой относится изобретение Настоящее изобретение относится к ингибиторам PARP и предлагает соединения и композиции,содержащие эти соединения. Кроме того, в настоящем изобретении предлагаются способы применения описанных ингибиторов PARP, например, в качестве лекарственных средств. Уровень техники Нуклеарный фермент поли(ADP-рибоза)полимераза-1 (PARP-1) является членом семейства ферментов PARP. Указанное возрастающее семейство состоит из ферментов PARP, таких как, например,PARP-1, PARP-2, PARP-3 и Vault-PARP; и ферментов танкираз (TANK), таких как, например, TANK-1,TANK-2 и TANK-3. PARP называют также поли(аденозин-5'-дифосфорорибоза)полимеразой или PARS(поли(ADP-рибоза)синтетазой). Танкиразы (TANK) были идентифицированы как компоненты теломерного комплекса человека. Было также высказано предположение, что они играют определенную роль в выборе направления миграции везикул, а также могут служить в качестве клеточного каркаса для белков, которые принимают участие в различных других клеточных процессах. Теломеры, которые играют существенную роль в обеспечении жизнедеятельности и устойчивости хромосом, поддерживаются теломеразой, специализированной обратной транскриптазой. TANK представляют собой (ADP-рибоза)трансферазы, которые обладают общими свойствами как сигнальных, так и цитоскелетных белков. Они содержат домен PARP, который катализирует поли-ADP-рибозилирование белков-субстратов и представляет собой агенезический альфафрагмент, сходный с доменами некоторых сигнальных молекул, и домен ANK, который включает 24 анкириновых повторов, гомологичных цитоскелетному белку анкирину. Домен ANK взаимодействует с теломерным белком, фактором-1 связывания теломерного повтора (TRF-1). Поэтому указанные белки называют взаимодействующими с TRF1 анкирин-связывающими ADP-рибозаполимеразами (TANK). Одной из наиболее специфичных функций TANK является ADP-рибозилирование TRF-1. Функционирование теломеров человека требует наличия двух теломер-специфичных ДНК-связывающих белков TRF-1 и TRF-2. TRF-2 защищает концы хромосом, a TRF-1 регулирует длину теломера. ADPрибозилирование подавляет способность TRF-1 связываться с теломерной ДНК. Указанное поли-ADPрибозилирование TRF-1 высвобождает TRF-1 из теломеров, раскрывая теломерный комплекс, и открывает доступ к теломеразе. Таким образом, TANK функционирует в качестве положительного регулятора длины теломеров, позволяя осуществлять удлинение теломеров под действием теломеразы.PARP-1 является основным нуклеарным белком, имеющим размер 116 кДа, и включает три домена:N-концевой ДНК-связывающий домен, который содержит две цинкосодержащие пальцеообразные области, домен аутомодифицирования и С-концевой каталитический домен. Он имеется практически у всех эукариот. Указанный фермент синтезирует поли(ADP-рибозу) - разветвленный полимер, который содержит более 200 фрагментов ADP-рибозы. Белки-акцепторы поли(ADP-рибозы) прямо или опосредованно участвуют в поддержании целостности ДНК. Они включают гистоны, топоизомеразы, ДНК- и РНКполимеразы, ДНК-лигазы и Ca2+- и Mg2+-зависимые эндонуклеазы. Белок PARP экспрессируется с высоким уровнем во многих тканях и в основном в иммунной системе, сердце, мозге и линии половых клеток. В нормальных физиологических условиях PARP обладает минимальной активностью. Однако повреждение ДНК вызывает немедленное вплоть до 500-кратного увеличение активности PARP. Одной из многочисленных функций, которые относят к PARP, и в частности PARP-1, является важная роль, которую он играет в способствовании репарации ДНК путем ADP-рибозилирования и, таким образом, в координировании функций ряда белков, осуществляющих репарацию ДНК. В результате активирования PARP значительно понижаются уровни NAD+. Интенсивная активация PARP приводит к значительному элиминированию NAD+ из клеток, страдающих от массового повреждения ДНК. Короткий полупериод существования поли(ADP-рибозы) приводит к быстротечности функционального цикла. Как только поли(ADP-рибоза) образовалась, она быстро разлагается под действием конститутивно активной поли(ADP-рибоза)гликогидролазы (PARG) вместе с фосфодиэстеразой и (ADPрибоза)протеинлиазой. PARP и PARG составляют цикл, в котором большое количество NAD+ превращается в ADP-рибозу. Менее чем за час избыточное стимулирование PARP может вызвать падение уровняNAD+ и АТФ до значения, составляющего меньше, чем 20% от нормального уровня. Подобный сценарий особенно пагубен при ишемии, когда кислородная недостаточность уже подвергла значительному риску выработку энергии клетками. Полагают, что последующее производство свободных радикалов в процессе реперфузии является основной причиной поражения тканей. Частично падения концентрации АТФ,что типично для многих органов при ишемии и реперфузии, можно связать с элиминированием NAD+,вызванным метаболизмом поли(ADP-рибозы). Таким образом, ожидают, что ингибирование PARP илиPARG сохраняет уровень клеточной энергии и тем самым обеспечивает возможность ишемическим тканям выжить после инсульта. Поли(ADP-рибоза)синтаза принимает также участие в индуцированной экспрессии ряда генов, которые важны для формирования воспалительного ответа. Ингибиторы PARP подавляют продукцию индуцируемой синтазы оксида азота (iNOS) в макрофагах, селектина Р-типа и молекулы-1 межклеточной адгезии (ICAM-1) в клетках эндотелия. Подобная активность подчеркивает сильное противовоспалительное действие, которое оказывают ингибиторы PARP. Ингибиторы PARP способны также снижатьPARP активируется фрагментами поврежденной ДНК и сразу же после активации катализирует присоединение вплоть до 100 фрагментов ADP-рибозы к разнообразным нуклеарным белкам, включая гистоны и сам PARP. При серьезных клеточных стрессах экстенсивная активация PARP может быстро привести к повреждению или смерти клеток за счет истощения запасов энергии. Поскольку на каждую регенерированную молекулу NAD+ потребляются четыре молекулы АТФ, то массовая активация PARP приводит к элиминированию NAD+, а попытки вновь синтезировать NAD+ могут привести к истощению запасов АТФ. Сообщалось, что активация PARP играет ключевую роль как в NMDA-, так и NO-индуцированной нейротоксичности. Это было показано в кортикальных культурах и в срезах гиппокампа, в которых предотвращение токсичности прямо коррелирует с действенностью ингибирования PARP. Потенциальная роль ингибиторов PARP при лечении нейродегенеративных заболеваний и травм головы признана, несмотря на то, что точный механизм их действия пока еще не выявлен. Аналогично, было показано, что однократные инъекции ингибиторов PARP снижали размер инфаркта, вызываемого ишемией и реперфузией в сердце или скелетных мышцах кроликов. При проведении указанных исследований однократные инъекции 3-аминобензамида (10 мг/кг) как за одну минуту до окклюзии, так и за одну минуту до реперфузии вызывали аналогичные снижения размера инфаркта в сердце (32-42%), в то время как 1,5-дигидроксиизохинолин (1 мг/кг), другой ингибитор PARP, в сопоставимой степени (38-48%) снижал размер инфаркта. Указанные результаты заставляют предположить, что ингибиторы PARP способны защитить от ранее наблюдаемой ишемии сердца или вызываемого реперфузией повреждения тканей скелетных мышц. Активацию PARP можно также использовать как меру поражения в результате нейротоксических инсультов, являющихся результатом воздействия любого из следующих индуцирующих факторов, таких как глутамат (за счет стимулирования рецептора NMDA), реакционноспособные промежуточные соединения кислорода, амилоидный -белок, N-метил-4-фенил-1,2,3,6-тетрагидропиридин (MPTP) или его активный метаболит N-метил-4-фенилпиридин (MPP+), которые участвуют в таких патологических состояниях, как удар, болезнь Альцгеймера и болезнь Паркинсона. Продолжаются исследования, направленные на изучение in vitro роли активации PARP в мозжечковых тучных клетках и при MPTP нейротоксичности. Избыточное действие на нервные ткани глутамата, который является превалирующим нейротрансмиттером центральной нервной системы и воздействует на рецепторы N-метил-D-аспартата(NMDA) и другие типы рецепторов, наиболее часто возникает в результате удара или протекания другого нейродегенеративного процесса. В результате кислородной недостаточности нейроны в больших количествах высвобождают глутамат при ишемическом инсульте мозга, возникающем при ударе или при сердечном приступе. Указанное избыточное высвобождение глутамата, в свою очередь, вызывает избыточное стимулирование (экзитотоксичность) рецепторов N-метил-D-аспартата (NMDA), AMPA, каината и MGR, которые открывают ионные каналы и позволяют возникать неконтролируемому потоку ионов (в частности,Ca2+ и Na+ в клетки и K+ из клеток), что приводит к избыточному возбуждению нейронов. Избыточное возбуждение нейронов вызывает дополнительную секрецию глутамата, что создает петлевую обратную связь или вызывает эффект домино, который в конце концов приводит к поражению или смерти клеток за счет продуцирования протеаз, липаз и свободных радикалов. Избыточная активация рецепторов глутамата вовлекается в различные неврологические заболевания и состояния, включая эпилепсию, удар,болезнь Альцгеймера, болезнь Паркинсона, амиотрофический латеральный склероз (ALS), болезнь Хантингтона, шизофрению, хроническую боль, ишемию и потерю нейронов в результате гипоксии, гипогликемию, ишемию, травму и нервный инсульт. Воздействие глутамата и стимулирование составляет также основу компульсивных расстройств, в частности, зависимости от наркотиков. Для различных видов животных, а также в культурах коры головного мозга, обработанных глутаматом или с помощью NMDA,получены подтверждения того, что антагонисты рецептора глутамата (т.е. соединения, которые блокируют связывание глутамата или активирование его рецептора) блокируют повреждение нервных тканей после васкулярной травмы. Попытки предотвратить экзитотоксичность путем блокирования рецепторовNMDA, AMPA, каината и MGR оказались трудными, поскольку каждый рецептор обладает множеством участков, с которыми может связываться глутамат, т.е. оказалось трудно найти эффективную смесь антагонистов или универсальный антагонист, способный предотвратить связывание глутамата со всеми рецепторами, и проверить указанную теорию. Кроме того, многие композиции, которые эффективно блокируют рецепторы, одновременно токсичны для животных. Таким образом, эффективное лечение глутаматных аномалий в настоящее время не известно. Стимулирование рецепторов NMDA глутаматом, например, активирует фермент нейрональную синтазу оксида азота (nNOS), что приводит к образованию оксида азота (NO), который также опосредует нейротоксичность. Нейротоксичность NMDA можно также предотвратить путем обработки ингибиторами нейрональной синтазы оксида азота (NOS) или путем нацеленного генетического разрушения nNOSin vitro. Другое применение ингибиторы PARP находят при лечении поражений периферических нервов и-2 011552 возникающего вследствие этого патологического болевого синдрома, известного как невропатическая боль, который, в частности, вызывается поражением при хроническом защемлении (CCI) обычного седалищного нерва и при котором возникает транссинаптическое изменение заднего рога спинного мозга,характеризующееся гиперхроматозом цитоплазмы и нуклеоплазмы (появление так называемых "темных" нейронов). Получены данные, указывающие на то, что ингибиторы PARP применимы для лечения воспалительных заболеваний кишечника, таких как колит. В частности, колит вызывали у крыс путем внутрипросветного введения гаптена тринитробензолсульфоновой кислоты в 50%-ном этаноле. Подвергнутые обработке крысы получали 3-аминобензамид, являющийся специфичным ингибитором активностиPARP. Ингибирование активности PARP снижает воспалительный ответ и восстанавливает морфологию и энергетический статус дистальной ободочной кишки. Имеются также указания, что ингибиторы PARP применимы для лечения артрита. Кроме того, ингибиторы PARP, видимо, пригодны для лечения диабета. Было показано, что ингибиторы PARP применимы для лечения эндотоксического шока или септического шока. Ингибиторы PARP применяли также для продления времени жизни и увеличения пролиферативной способности клеток, в том числе при лечении таких заболеваний, как старение кожи, болезнь Альцгеймера, атеросклероз, остеоартрит, остеопороз, мышечная дистрофия, дегенеративные заболевания скелетных мышц, включая репликационное физиологическое старение, возрастная дегенерация мышц, физиологическое старение иммунной системы, СПИД и другие заболевания иммунной системы, вызванные физиологическим старением; и для изменения экспрессии генов стареющих клеток. Известно также, что ингибиторы PARP, такие как 3-аминобензамид, оказывают воздействие на общую репарацию ДНК в ответ, например, на действие пероксида водорода или ионизирующего излучения. Надежно установлена кардинальная роль PARP при репарации разрывов в цепи ДНК, особенно в тех случаях, которые вызваны непосредственно действием ионизирующего излучения или опосредовано проявляются после ферментативной репарации повреждений ДНК, вызываемых метилирующими агентами, ингибиторами топоизомеразы I типа и другими химиотерапевтическими средствами, такими как цисплатин и блеомицин. Различные исследования с использованием мышей-"нокаутов", моделей трансдоменного ингибирования (сверхэкспрессия ДНК-связывающего домена), антисмысловых ингибиторов и ингибиторов с небольшой молекулярной массой продемонстрировали роль PARP при репарации и выживании клеток после индуцирования повреждения ДНК. Ингибирование ферментативной активностиPARP должно приводить к повышенной чувствительности опухолевых клеток к обработкам, вызывающим повреждение ДНК. Сообщалось, что ингибиторы PARP эффективны при радиосенсибилизации (гипоксической) опухолевых клеток и эффективно препятствуют восстановлению опухолевых клеток при потенциально летальном и сублетальном поражении ДНК после радиотерапии, в первую очередь за счет способности ингибиторов препятствовать воссоединению разрывов нити ДНК и за счет воздействия на несколько путей передачи сигнала о повреждении ДНК. Ингибиторы PARP применяли при лечении рака. Кроме того, в патенте США 5177075 обсуждается несколько изохинолинов, которые применяли для усиления летального действия ионизирующего излучения или химиотерапевтических средств на опухолевые клетки. Weltin et al., "Effect of 6(5Phenanthridinone), an Inhibitor of Poly(ADP-ribose) Polymerase, on Cultured Tumor Cells", Oncol. Res., 6: 9,399-403 (1994) обсуждают ингибирование активности PARP, уменьшение пролиферации опухолевых клеток и выраженный синергический эффект в том случае, когда опухолевые клетки подвергают совместной обработке с алкилирующим лекарством. Обзоры по современному уровню техники опубликованы Li and Zhang, IDrugs 2001, 4(7): 804-812,Ame et al. , Bioassays 2004, 26: 882-883 и Nguewa et al., Progress in BiophysicMolecular Biology 2005, 88: 143-172. Сохраняется потребность в эффективных и действенных ингибиторах PARP и, в частности, ингибиторах PARP-1, которые вызывают минимальные побочные эффекты. В настоящем изобретении предлагаются соединения, композиции для ингибирования и способы ингибирования активности PARP при лечении рака и/или предотвращении поражения клеток, тканей и/или органов в результате повреждения или отмирания клеток, вызываемого, например, некрозом или апоптозом. Соединения и композиции по настоящему изобретению наиболее пригодны для повышения эффективности химиотерапии и радиотерапии, где основной эффект от воздействия заключается в повреждении ДНК клеток-мишеней. Описание предшествующего уровня техники Патент EP 2036073, опубликованный 17 июня 1999, раскрывает замещенные производные хиназолиндиона. Приведенные соединения обладают фундальными релаксирующими свойствами. В частности,раскрывается соединение 1-[1-[(2S)-2-[(2R)-3,4-дигидро-2 Н-1-бензопиран-2-ил]-2-гидроксиэтил]-4 пиперидинил]-2,4(1H,3H)хиназолиндион (соединение 9 в данном описании). Соединение 9. Патент EP 13612, опубликованный 11 ноября 1983, раскрывает замещенные производные соединения пиперидинилкилхиназолина. Описываемые соединения являются антагонистами серотонина. В частности,раскрываются соединения 1-[2-4-[(4-фторбензоил)-1-пиперидинил]этил]-2,4-(1H,3H)хиназолиндион (соединение 10 в данном описании), 1-[3-[4-(4-фторбензоил)-1-пиперидинил]пропил]2,4-(1H,3H)-хиназолиндион (соединение 11 в данном описании), 3-[2-[4-(4-хлорбензоил)-1 пиперидинил]этил]-2,4-(1H,3H)-хиназолиндион (соединение 12 в данном описании), 3-[2-[4-(4 фторфенил)гидроксиметил]-1-пиперидинил]этил]-2,4-(1H,3H)-хиназолиндион (соединение 13 в данном описании). Соединение 13 Описание изобретения Настоящее изобретение относится к соединениям формулы (I) его N-оксидные формы, фармацевтически приемлемые аддитивные соли и его стереохимически изомерные формы, где каждый X независимо обозначает означаетL1 означает прямую связь или двухвалентный радикал, выбранный из -C1-6 алкандиила-,L2 означает прямую связь или двухвалентный радикал, выбранный из карбонила, -C1-6 алкандиила-,-(гидрокси)C1-6 алкандиила-, -С(О)-C1-6 алкандиила- или -C1-6 алкандиил-С(О)-;R1 означает атом водорода или гидроксильную группу;Z означает атом водорода или радикал, выбранный из где каждый R2 независимо выбран из атома водорода, атома галогена или C1-6 алкила,при условии, что хиназолиндионовый фрагмент присоединен к остальной части молекулы по -NHфрагменту в положении 1, и в этом случае атом водорода замещен, и при условии что соединения 1-[1[(2S)-2-[(2R)-3,4-дигидро-2 Н-1-бензопиран-2-ил]-2-гидроксиэтил]-4-пиперидинил]-2,4(1H,3H)хиназолиндион, 1-[2-4-[(4-фторбензоил)-1-пиперидинил]этил]-2,4-(1H,3H)хиназолиндион, и 1-[3-[4-(4 фторбензоил)-1-пиперидинил]пропил]-2,4-(1H,3H)хиназолиндион исключаются. В том случае, когда Z обозначает гетероциклическую кольцевую систему, включающую фрагмент CH2-, -CH= или -NH-, то заместитель R2 и/или остальная часть молекулы может быть присоединена к атому углерода/или атому азота, и в этом случае замещены один или оба атома водорода. Соединения формулы (I) могут существовать в таутомерных формах. Несмотря на то, что подобные формы не полностью освещены в приведенной выше формуле, предполагается, что они также входят в объем настоящего изобретения. Ниже разъясняется ряд терминов, которые используются в приведенных далее определениях. Указанные термины иногда используются самостоятельно или же используются в составных терминах. В приведенных ниже определениях и далее по тексту галоген является общим термином для атома фтора, хлора, брома и иода; C1-6 алкил означает насыщенные углеводородные радикалы с прямой или разветвленной цепью, содержащие от 1 до 6 атомов углерода, такие как метильная, этильная, пропильная,бутильная, пентильная, гексильная, 1-метилэтильная, 2-метилпропильная, 2-метилбутильная, 2 метилпенильная группа и т.п.; C1-6 алкандиил означает двухвалентные углеводородные радикалы с прямой или разветвленной цепью, содержащие от 1 до 6 атомов углерода, такие как, например, метиленовая,1,2-этандиильная, 1,3-пропандиильная, 1,4-бутандиильная, 1,5-пентандиильная, 1,6-гександиильная группа и их разветвленные изомеры, такие как 2-метилпентандиильная, 3-метилпентандиильная, 2,2 диметилбутандиильная, 2,3-диметилбутандиильная группа и т.д. Термин "фармацевтически приемлемые соли" означает фармацевтически приемлемые кислотноаддитивные или основно-аддитивные соли. Подразумевается, что указанные выше фармацевтически приемлемые кислотно-аддитивные или основно-аддитивные соли включают терапевтически активные нетоксичные кислотно-аддитивные и нетоксичные основно-аддитивные солевые формы, которые способны образовывать соединения формулы (I). Соединения формулы (I), обладающие свойствами основания, могут быть превращены в их фармацевтически приемлемые кислотно-аддитивные соли обработкой указанного основания подходящей кислотой. Подходящие кислоты включают, например, неорганические кислоты, такие как галогеноводородные кислоты, в частности, хлористо-водородная или бромистоводородная кислота; серная кислота; фосфорная кислота и подобные кислоты; или органические кислоты, такие как, например, уксусная, пропановая, гидроксиуксусная, молочная, пировиноградная, щавелевая, малоновая, янтарная (т.е. бутандионовая кислота), малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая,салициловая, п-аминосалициловая, памовая и подобные кислоты. Соединения формулы (I), обладающие кислотными свойствами, могут быть превращены в их фармацевтически приемлемые основно-аддитивные соли обработкой указанной кислотной формы соответствующим органическим или неорганическим основанием. Подходящие солевые формы включают, например, аммониевые соли, соли щелочных и щелочно-земельных металлов, в частности, соли лития, натрия, калия, магния, кальция и т.п., соли с органическими основаниями, в частности, соли бензатина, Nметил-D-глюкамина, гидрабамина, и соли с аминокислотами, такими как, например, аргинин, лизин и т.п. Термины кислотно-аддитивные или основно-аддитивные соли включает также гидраты и формы,образованные присоединением растворителя, которые способны образовать соединения формулы (I). Примерами подобных форм являются, например, гидраты, алкоголяты и т.п. Термин стереохимически изомерные формы соединений формулы (I) в данном описании означает все возможные соединения, образованные теми же самыми атомами, соединенными той же самой последовательностью связей, однако имеющими различные трехмерные структуры, не являющиеся взаимно совмещаемыми, которые могут иметь соединения формулы (I). Если не отмечено или не указано иное,химическое обозначение соединения охватывает смесь всех возможных стереохимически изомерных форм, которые может иметь указанное соединения. Указанная смесь может содержать все диастереомеры и/или энантиомеры основной молекулярной структуры указанного соединения. Предполагается, что в объем настоящего изобретения входят все стереохимически изомерные формы соединений формулы (I),-5 011552 как в чистой форме, так и в смеси друг с другом. Предполагается, что N-оксидные формы соединений формулы (I) включают такие соединения формулы (I), в которых один или несколько атомов азота окислены с образованием так называемых Nоксидов, в частности, таких N-оксидов, в которых N-окислен один или несколько атомов азота пиперидина или пиперазина. Предполагается, что в контексте всего описания термин "соединения формулы (I)" включает такжеN-оксидные формы, фармацевтически приемлемые кислотно-аддитивные или основно-аддитивные соли и стереоизомерные формы. Соединения, приведенные в EP 1036073, обладают фундальными релаксирующими свойствами. 1[1-[(2S)-2-[(2R)-3,4-дигидро-2 Н-1-бензопиран-2-ил]-2-гидроксиэтил]-4-пиперидинил]-2,4(1H,3H)хиназолиндион (соединение 9 в данном описании) раскрывается в EP 1036073. Соединения, приведенные в EP 13612, являются антагонистами серотонина. Раскрываются соединения 1-[2-[4-(4 фторбензоил)-1-пиперидинил]этил]-2,4-(1H,3H)хиназолиндион (соединение 10 в данном описании), 1[3-[4-(4-фторбензоил)-1-пиперидинил]пропил]-2,4-(1H,3H)хиназолиндион (соединение 11 в данном описании), 3-[2-[4-(4-хлорбензоил)-1-пиперидинил]этил]-2,4-(1H,3H)хиназолиндион (соединение 12 в данном описании),3-[2-[4-(4-фторфенил)гидроксиметил]-1-пиперидинил]этил]-2,4-(1H,3H)хиназолиндион (соединение 13 в данном описании). Неожиданно было обнаружено, что соединения по настоящему изобретению показывают ингибирующую активность по отношению к PARP. Первую группу представляющих интерес соединений составляют такие соединения формулы (I), к которым может быть применено одно или несколько из следующих ограничений: а) каждый X независимо обозначаетc) L1 означает прямую связь или двухвалентный радикал, выбранный из -С 1-6 алкандиила- ;d) L2 означает прямую связь или двухвалентный радикал, выбранный из карбонила, -С 1-6 алкандиила-, -(гидрокси)С 1-6 алкандиила- или -С(О)-С 1-6 алкандиила- ;e) R1 означает атом водорода или гидроксильную группу;f) Z означает атом водорода или радикал, выбранный из (а-1), (а-2), (а-3), (а-4) или (а-5); д) каждый R2 независимо выбран из атома водорода, атома галогена или С 1-6 алкила. Вторую группу представляющих интерес соединений составляют такие соединения формулы (I), к которым может быть применено одно или несколько из следующих ограничений:a) L2 означает прямую связь или двухвалентный радикал, выбранный из -С 1-6 алкандиила- или -С(О)С 1-6 алкандиила- ;b) Z означает атом водорода или радикал, выбранный из (а-1), (а-4) или (а-5). Третью группу представляющих интерес соединений составляют такие соединения формулы (I), к которым может быть применено одно или несколько из следующих ограничений: а) каждый X обозначаетf) Z означает атом водорода. Группа предпочтительных соединений составлена из таких соединений формулы (I), где каждый X независимо обозначаетL1 означает прямую связь или двухвалентный радикал, выбранный из -С 1-6 алкандиила-; L2 означает прямую связь или двухвалентный радикал, выбранный из -С 1-6 алкандиила; R1 означает атом водорода или гидроксильную группу;Z означает атом водорода или радикал, выбранный из (а-1), (а-2), (а-3), (а-4) или (а-5); и каждый R2 независимо выбран из атома водорода, атома галогена или С 1-6 алкила. Группа более предпочтительных соединений составлена из таких соединений формулы (I), где каждый X обозначаетR1 означает атом водорода иZ означает атом водорода. Наиболее предпочтительным соединением является соединение 1. Соединение 1 Соединения формулы (I) могут быть получены в соответствии с общими способами, приведенными в EP 1036073 и EP 13612. Исходные соединения и некоторые из промежуточных соединений известны и коммерчески доступны или же могут быть получены по обычным реакциям, известным из области техники. Некоторые способы получения будут более детально описаны позднее. Другие способы получения конечных соединений формулы (I) приведены в примерах. Соединения формулы (I), где X обозначает которые в данном описании относят к соединениям формулы (I-а), могут быть получены взаимодействием промежуточного соединения формулы (II) с промежуточным соединением формулы (III), где W обозначает подходящую уходящую группу, такую как, например, атом галогена, в частности, атом фтора, хлора, брома или иода, или сульфонилоксирадикал, такой как метилсульфонилокси, 4-метилфенилсульфонилокси и т.п. Реакцию можно проводить в инертном для данной реакции растворителе, таком как, например, спирт, в частности, метанол, этанол,2-метоксиэтанол, пропанол, бутанол и т.п.; простой эфир, в частности, 4,4-диоксан, 1,1'-оксибиспропан и т.п.; или кетон, в частности, 4-метил-2-пентанон, N,N-диметилформамид, нитробензол и т.п. Для связывания кислоты, которая выделяется в результате протекания реакции, можно использовать добавление подходящего основания, такого как, например, карбонат или гидрокарбонат щелочного или щелочноземельного металла, в частности, добавление триэтиламина или карбоната натрия. Для ускорения реакции может быть добавлено небольшое количество соответствующего иодида металла, в частности, иодид натрия или калия. Скорость реакции можно ускорить перемешиванием. Реакцию обычно можно проводить в интервале от комнатной температуры и до температуры кипения реакционной смеси и, если необходимо, реакцию можно проводить при повышенном давлении. которые в данном описании относят Аналогично соединения формулы (I), где Y обозначает к соединениям формулы (I-b), могут быть получены взаимодействием промежуточного соединения формулы (IV) с промежуточным соединением формулы (V) , где значение W указано ранее. Соединения формулы (I) могут быть также превращены друг в друга посредством реакций, известных из области техники, или путем преобразования функциональных групп. Некоторые из подобных преобразований уже приведены выше в данном описании. Другими примерами являются гидролиз сложных эфиров с образованием соответствующей карбоновой кислоты или соответствующего спирта; гидролиз амидов с образованием соответствующей карбоновой кислоты или соответствующих аминов; гидролиз нитрилов с образованием соответствующих амидов; аминогруппы в имидазоле или фенильной группе могут быть замещены атомом водорода по известной из области техники реакции диазотирования с последующим замещением диазогруппы атомом водорода; спирты могут быть превращены в сложные эфиры или в простые эфиры; первичные амины могут быть превращены во вторичные или третичные амины; двойные связи могут быть гидрированы до соответствующей простой связи; радикал иода в фе-7 011552 нильной группе может быть превращен в сложноэфирную группу путем введения монооксида углерода в присутствии подходящего палладиевого катализатора. Настоящее изобретение относится также к соединениям формулы (I), определение которых дано выше, для использования в качестве лекарственного средства. Соединения по настоящему изобретению проявляют ингибирующие свойства по отношению кPARP, что подтверждается в приведенной далее экспериментальной части. Термин "PARP" в данном описании означает белок, который обладает активностью осуществлять поли-ADP-рибозилирование. В рамках указанного термина PARP охватывает все белки, кодируемые геном parp, их мутанты и альтернативные части указанных белков. Кроме того, в данном описании термин"PARP" включает аналоги PARP, гомологи и аналоги других животных. Термин "PARP" включает, однако этим не ограничиваясь, PARP-1. В понятие указанного термина могут входить PARP-2, PARP-3, Vault-PARP (PARP-4), PARP-7 (TiPARP), PARP-8, PARP-9 (Bal), PARP10, PARP-11, PARP-12, PARP-13, PARP-14, PARP-15, PARP-16, TANK-1, TANK-2 и TANK-3. Соединения, которые ингибируют как PARP-1, так и танкиразу-2, обладают тем преимуществом,что они проявляют повышенную активность по отношению к раковым клеткам. Настоящее изобретение предполагает также применение соединений для приготовления лекарственных препаратов для лечения любых приведенных в данном описании заболеваний и расстройств у животных, при этом указанными соединениями являются соединения формулы (I), их N-оксидные формы, их фармацевтически приемлемые аддитивные соли и их стереохимические изомерные формы, где каждый XL1 означает прямую связь или двухвалентный радикал, выбранный из -С 1-6 алкандиила-,L2 означает прямую связь или двухвалентный радикал, выбранный из карбонила, -С 1-6 алкандиила-, (гидрокси)С 1-6 алкандиила- , -С(О)-С 1-6 алкандиила- или -С 1-6 алкандиил-С(О)- ;R1 означает атом водорода или гидроксильную группу;Z означает атом водорода или радикал, выбранный из где каждый R2 независимо выбран из атома водорода, атома галогена или С 1-6 алкила. Поскольку они обладают способностью связывать PARP, то соединения по настоящему изобретению могут применяться в качестве соединений сравнения или соединений-меток, и в этом случае один из атомов в молекуле может быть замещен, например, радиоактивным изотопом. Для приготовления фармацевтических композиций по настоящему изобретению эффективное количество конкретного соединения в форме основания или кислотно-аддитивной соли, которое используют в качестве активного ингредиента, объединяют в виде однородной смеси с фармацевтически приемлемым носителем, при этом указанный носитель может принимать разнообразные формы в зависимости от формы предназначенного для введения препарата. Желательно, чтобы указанные фармацевтические композиции были приготовлены в виде стандартной дозировочной формы, предпочтительно пригодной для введения перорально, ректально, чрескожно и с помощью парентеральной инъекции. Например, при приготовлении композиции в виде пероральной дозировочной формы могут применяться любые обыч-8 011552 ные фармацевтические среды, такие как, например, вода, гликоли, масла, спирты и т.п. в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры или растворы; или твердые носители, такие как крахмалы, сахара, каолин, лубриканты, связующие, разрыхлители и т.п. в случае порошков,пилюль, капсул и таблеток. Благодаря легкости их введения, таблетки и капсулы являются наиболее удобными пероральными дозировочными формами, и в этом случае, очевидно, применяют твердые фармацевтические носители. Для парентеральных композиций носитель обычно представляет собой, по крайней мере, в большинстве случаев, стерильную воду, хотя могут включаться и другие ингредиенты,например вещества, способствующие повышению растворимости. Могут быть приготовлены, например,растворы для инъекций, в которых носителем является физиологический солевой раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Могут быть также приготовлены суспензии для инъекций, и в этом случае можно использовать подходящие жидкие носители, суспендирующие агенты и т.п. В композициях, пригодных для чрескожного введения, носитель необязательно содержит средство, усиливающее проникновение через кожу, и/или подходящее смачивающее средство, необязательно в сочетании с небольшими пропорциями подходящих добавок любого типа, при этом указанные добавки не оказывают значительного вредного воздействия на кожу. Указанные добавки могут облегчить нанесение на кожу и/или могут быть полезны для приготовления требуемых композиций. Указанные композиции могут вводиться различными путями, в частности, в виде чрескожного пластыря,наклейки, мази. Наиболее удобно составлять вышеуказанные фармацевтические композиции в виде стандартной дозировочной формы, с целью облегчения введения и обеспечения большей однородности дозы. Стандартная дозировочная форма по тексту настоящего описания и в формуле изобретения означает физически дискретные единицы, пригодные для однократного дозирования, при этом каждая единица содержит определенное количество активного ингредиента, рассчитанное для получения требуемого терапевтического эффекта, в сочетании с требуемым фармацевтическим носителем. Примерами подобных стандартных дозировочных форм являются таблетки (в том числе таблетки с насечками или таблетки с нанесенным покрытием), капсулы, пилюли, пакетики с порошком, облатки, растворы или суспензии для инъекций, количества лекарственного препарата, равные чайной ложке, количества лекарственного препарата, равные столовой ложке, и т.п. и их разделенные части. Соединения по настоящему изобретению способны лечить или предупреждать поражение тканей,вызванное повреждением или отмиранием клеток вследствие некроза или апоптоза; они способны уменьшать последствия поражения нервных тканей или сердечно-сосудистых тканей, включая поражение,возникающее после локальной ишемии, инфаркта миокарда, и поражение в результате реперфузии; они способны вылечивать различные заболевания и состояния, вызываемые обострением активности PARP; способны расширять или увеличивать время жизни или пролиферативную способность клеток; они могут изменять генную экспрессию стареющих клеток; способны повышать чувствительность клеток к действию радиотерапевтических и/или химиотерапевтических средств. В общемслучае, ингибирование активности PARP спасает клетки от потери энергии, предотвращая в случае нервных клеток необратимую деполяризацию нейронов, и, таким образом, осуществляет нейрозащиту. По указанным причинам настоящее изобретение относится также к способу введения терапевтически эффективного количества вышеуказанных соединений, которое достаточно для ингибирования активности PARP, для лечения или предупреждения поражения тканей, вызванного повреждением или отмиранием клеток вследствие некроза или апоптоза, к воздействию на активность нейронов, не опосредованную токсичностью NMDA, к воздействию на активность нейронов, опосредованную токсичностьюNMDA, к лечению повреждения нервных тканей вследствие ишемии и поражения в результате реперфузии, неврологических заболеваний и нейродегенеративных заболеваний; к предупреждению или лечению васкулярной травмы; к лечению или предупреждению сердечно-сосудистых заболеваний; к лечению других состояний и/или заболеваний, таких как возрастная мышечная дегенерация, СПИД и другие заболевания иммунной системы, вызванные физиологическим старением, воспаление, подагра, артрит, атеросклероз, общее истощение, рак, дегенеративные заболевания скелетных мышц, включая репликативное физиологическое старение, диабет, травма головы, воспалительные заболевания кишечника (такие как колит и болезнь Крона), мышечная дистрофия, остеоартрит, остеопороз, хроническая и/или острая боль (такая как невропатическая боль), почечная недостаточность, ретинальная ишемия, септический шок (такой как эндотоксический шок) и старение кожи, увеличение времени жизни и усиление пролиферативной способности клеток; к изменению генной экспрессии стареющих клеток; к повышению химиосенсибилизации и/или радиосенсибилизации (гипоксической) опухолевых клеток. Настоящее изобретение относится также к лечению заболеваний или состояний у животных, которое заключается во введении указанному животному терапевтически эффективного количества идентифицированных выше соединений. В частности, настоящее изобретение относится к способу лечения, предупреждения или подавления неврологического заболевания у животного, который включает введение указанному животному терапевтически эффективного количества вышеуказанных соединений. Неврологическое заболевание выбирают из группы, включающей периферическую нейропатию, вызванную физической травмой или болезненным состоянием, травматическое повреждение мозга, физическое повреждение спинного мозга, удар,-9 011552 вызванный повреждением мозга, локальную ишемию, общую ишемию, поражение, вызванное реперфузией, демиелинизирующее заболевание и неврологическое заболевание, связанное с нейродегенерацией. Настоящее изобретение включает также применение соединений формулы (I) для ингибирования активности PARP с целью лечения, предупреждения или подавления поражения тканей, вызываемого повреждением или отмиранием клеток вследствие некроза или апоптоза, с целью лечения, предупреждения или подавления неврологического заболевания у животного. Термин "предупреждение нейродегенерации" включает способность предупреждать нейродегенерацию у пациента, которому недавно поставлен диагноз наличия нейродегенеративного заболевания или который подвергается риску развития нового дегенеративного заболевания, а также способность предотвращать дальнейшую нейродегенерацию у пациентов, которые уже страдают от нейродегенеративного заболевания или у которых наблюдаются симптомы нейродегенеративного заболевания. Термин "лечение" по тексту настоящего описания охватывает любое лечение заболевания и/или состояния у животного, в частности человека, и включает (i) предупреждение возникновения заболевания и/или состояния у субъекта, который может быть предрасположен к заболеванию и/или состоянию, но у которого указанное заболевание и/или состояние еще не обнаружено; (ii) подавление заболевания и/или состояния, т.е. прекращение его развития; (iii) ослабление заболевания и/или состояния, т.е. регрессия заболевания и/или состояния. Термин "радиосенсибилизирующее средство" по тексту настоящего описания определяется как молекула, предпочтительно молекула с небольшой молекулярной массой, которую вводят животному в терапевтически эффективных количествах с целью повысить чувствительность клеток к ионизирующему излучению и/или ускорить лечение заболеваний, которые можно лечить с помощью ионизирующего излучения. Заболевания, которые можно лечить с помощью ионизирующего излучения, включают опухолевые заболевания, доброкачественные и злокачественные опухоли и раковые клетки. Настоящие изобретение также охватывает лечение с помощью ионизирующего излучения других заболеваний, которые не указаны выше. Термин "химиосенсибилизирующее средство" по тексту настоящего описания определяется как молекула, предпочтительно молекула с небольшой молекулярной массой, которую вводят животному в терапевтически эффективных количествах с целью повысить чувствительность клеток к химиотерапии и/или ускорить лечение заболеваний, которые можно лечить химиотерапевтическими методами. Заболевания, которые можно лечить химиотерапевтическими методами, включают опухолевые заболевания,доброкачественные и злокачественные опухоли и раковые клетки. Настоящие изобретение также охватывает лечение с помощью химиотерапевтических средств других заболеваний, которые не указаны выше. Соединения, композиции и способы по настоящему изобретению наиболее пригодны для лечения или предупреждения поражения тканей, вызываемого повреждением или отмиранием клеток вследствие некроза или апоптоза. Соединения по настоящему изобретению могут быть "противораковыми средствами", и этот термин охватывает также "средства, препятствующие росту опухолевых клеток" и "противоопухолевые средства". Например, способы по настоящему изобретению пригодны для лечения рака и для химиосенсибилизации и/или радиосенсибилизации опухолевых клеток при таких видах рака, как ACTH-продуцирующие опухоли, острый лимфолейкоз, лейкоз, отличный от лимфолейкоза, рак коркового вещества надпочечников, рак мочевого пузыря, рак мозга, рак груди, рак шейки, хронический лимфолейкоз, хронический миелолейкоз, колоректальный рак, лимфома Т-клеток кожи, рак эндометрия, рак пищевода, саркома Эвинга, рак желчного пузыря, лейкоз ворсинчатых клеток, рак головы и шеи, лимфома Ходжкина, саркома Капоши, рак почки, рак печени, рак легкого (мелкоклеточных и немелкоклеточный рак), злокачественный выпот в брюшную полость; злокачественный выпот в плевральную полость, меланома, мезотелиома, множественная миелома, нейробластома, лимфома, отличная от лимфомы Ходжкина, остеосаркома, яичниковый рак, рак яичников (половых клеток), рак предстательной железы, рак поджелудочной железы, рак полового члена, ретинобластома, рак кожи, саркома мягких тканей, карцинома сквамозных клеток, рак желудка, рак яичек, рак щитовидной железы, трофобластические опухоли, рак матки, вагинальный рак, рак вульвы и опухоль Вилма. Таким образом, соединения по настоящему изобретению могут применяться в качестве "радиосенсибилизирующего средства" и/или "химиосенсибилизирующего средства". Известно, что радиосенсибилизирующие средства повышают чувствительность раковых клеток к токсическому воздействию ионизирующего излучения. В литературе было предложено несколько механизмов воздействия радиосенсибилизирующих средств, включая: гипоксические клеточные радиосенсибилизирующие средства (в частности, 2-нитроимидазольные соединения и бензотриазиновые диоксиды) имитируют кислород или иначе ведут себя как биоредуцирующие средства при гипоксии; негипоксические клеточные радиосенсибилизирующие средства (в частности, галогензамещенные пиримидины) могут быть аналогами оснований ДНК и предпочтительно встраиваются в ДНК раковых клеток и тем самых ускоряют вызываемое радиацией разрушение молекул ДНК и/или препятствуют протеканию нормального механизма репарации ДНК; а также для радиосенсибилизирующих средств были предложены- 10011552 другие различные потенциальные механизмы действия при лечении заболеваний. Во многих современных методиках лечения рака радиосенсибилизирующие средства применяют вместе с облучением рентгеновскими лучами. Примеры радиосенсибилизирующих средств, активируемых рентгеновскими лучами, включают, однако этим не ограничиваясь, следующие соединения: метронидазол, мизонидазол, десметилмизонидазол, пимонидазол, этанидазол, ниморазол, митомицин С, RSU 1069, SR 4233, EO9, RB 6145, никотинамид, 5-бромдеоксиуридин (BUdR), 5-иододеоксиуридин (IUdR),бромдеоксицитидин, фтордеоксиуридин (FudR), гидроксимочевина, цисплатин и их терапевтически эффективные аналоги и их производные соединения. Фотодинамическая терапия (PDT) рака использует видимый свет в качестве радиационного активатора сенсибилизаторов. Примеры фотодинамических радиосенсибилизирующих средств включают, однако этим не ограничиваясь, следующие соединения: производные соединения гематопорфирина, фотофрин, производные соединения бензопорфирина, этиопорфирин олова, феоборбид-а, бактериохлорофилл-а, нафталоцианины, фталоцианины, фталоцианин цинка и их терапевтически эффективные аналоги и их производные соединения. Радиосенсибилизирующие средства могут вводиться в сочетании с терапевтически эффективным количеством одного или нескольких других соединений, включая, однако этим не ограничиваясь, соединения, которые ускоряют включение радиосенсибилизирующих средств в клетки-мишени; соединения,которые контролируют приток терапевтических средств, нутриентов и/или кислорода к клеткаммишеням; химиотерапевтические средства, которые действуют на опухоли без дополнительной радиации или вместе с дополнительной радиацией; или другие терапевтически эффективные соединения для лечения рака или другого заболевания. Примеры дополнительных терапевтических средств, которые могут применяться в сочетании с радиосенсибилизирующими средствами, включают, но этим не ограничиваясь, 5-фторурацил, лейковорин, 5'-амино-5'-деокситимидин, кислород, карбоген, вливания красных кровяных телец, перфторуглеводороды (в частности, Fluosol 10 DA), 2,3-DPG, BW12C, блокаторы кальциевых каналов, пентоксифиллин, соединения, препятствующие ангиогенезу, гидралазин и LBSO. Примеры химиотерапевтических средств включают, однако этим не ограничиваясь, адриамицин, камптотецин,карбоплатин, цисплатин, даунорубицин, доцетаксель, доксорубицин, интерферон (альфа, бета, гамма),интерлейкин 2, иринотекан, паклитаксель, топотекан и их терапевтически эффективные аналоги и их производные соединения. Химиосенсибилизирующие средства могут вводиться в сочетании с терапевтически эффективным количеством одного или нескольких других соединений, включая, однако этим не ограничиваясь, соединения, которые ускоряют включение химиосенсибилизирующих средств в клетки-мишени; соединения,которые контролируют приток терапевтических средств, нутриентов и/или кислорода к клеткаммишеням; химиотерапевтические средства, которые действуют на опухоли, или другие терапевтически эффективные соединения для лечения рака или другого заболевания. Примеры дополнительных терапевтических средств, которые могут применяться в сочетании с химиосенсибилизирующими средствами,включают, но этим не ограничиваясь, метилирующие средства, ингибиторы топоизомеразы I и другие химиотерапевтические средства, такие как цисплатин и блеомицин. Соединения формулы (I) могут применяться также для обнаружения и идентификации PARP и, в частности, рецептора PARP-1. С этой целью в соединения формулы (I) может также вводиться метка. Указанная метка может быть выбрана из группы, включающей радиоизотоп, спиновую метку, антигенную метку, ферментативную метку с флуоресцентной группой или хемилюминесцентной группой. Специалисты смогут легко определить эффективное количество лекарства по результатам испытаний, которые представлены ниже. В общем случае предполагается, что эффективное количество лекарства составит от 0,001 до 100 мг/кг массы тела и, в частности, от 0,005 до 10 мг/кг массы тела. Удобно вводить требуемую дозу в виде двух, трех, четырех или большего количества субдоз через определенные интервалы в течение всего дня. Указанные субдозы могут быть составлены в виде стандартных дозировочных форм, например, содержащих от 0,05 до 500 мг и, в частности, от 0,1 до 200 мг активного ингредиента на одну стандартную дозировочную форму. Следующие примеры поясняют настоящее изобретение. Экспериментальная часть Далее по тексту "DCM" означает дихлорметан, "DIPE" означает диизопропиловый эфир, "ДМФА" означает N,N-диметилформамид, "EtOH" означает этанол, "MeOH" означает метанол, "MEK" означает метилэтилкетон, "TEA" означает триэтиламин, "ТГФ" означает тетрагидрофуран. А. Получение промежуточных соединений Пример 1. Получение промежуточного соединения 1 Смесь 2-1-(фенилметил)-4-пиперидинил]амино]бензамида (0,03 моль) и 1,1'-карбонилбис-1 Н- 11011552 имидазола (0,033 моль) в диметилацетамиде (25 мл) кипятят с обратным холодильником при перемешивании в течение 5 ч, затем добавляют дополнительное количество 1,1'-карбонилбис-1 Н-имидазола (0,003 моль) и реакционную смесь оставляют на ночь при перемешивании и при кипячении с обратным холодильником. Смесь выливают в воду (300 мл), образовавшийся осадок отфильтровывают, промывают водой и DIPE и высушивают (выход 9,1 г, 91%). Часть продукта затем кристаллизуют из ДМФА и воды,выделяют конечный продукт, получая 0,8 г промежуточного соединения 1 с т.пл. 233,5C. В. Получение конечных продуктов Пример B1. Получение соединения 1 Смесь промежуточного соединения 1 (0,15 моль) в ТГФ (250 мл) и MeOH (250 мл) гидрируют в аппарате Пара над 10%-ным Pd/С (5 г) в качестве катализатора. После поглощения H2 (1 эквив.) катализатор отфильтровывают и получают фильтрат (I) и оставшийся осадок на фильтре. Полученный осадок перемешивают в кипящем гидроксиацетоне и смесь фильтруют в горячем виде. Полученный фильтрат объединяют с фильтратом (I) и смесь упаривают. Остаток перемешивают в воде, затем добавляют Соединение 1 (0,038 моль) в 2-метоксиэтаноле (150 мл) перемешивают при нагревании до полного растворения, затем по каплям при нагревании добавляют раствор 1-(4-фторфенил)-4-иод-1-бутанона(0,019 моль) в 2-метоксиэтаноле (10 мл), при этом образуется осадок. Реакционную смесь кипятят с обратным холодильником при перемешивании в течение 1,5 ч. Осадок отфильтровывают и фильтрат упаривают. Остаток очищают на силикагеле через воронку со стеклянным фильтрующим дном (элюент:CHCl3/МеОН 90/10). Собирают фракции с продуктом и растворитель отгоняют. Остаток кристаллизуют из 2-пропанола, полученный осадок собирают и сушат, получая 2,3 г (29%) соединения 2, т.пл. 195 С. Пример В 3. Получение соединения 3(0,015 моль) и карбоната натрия (0,030 моль) в 4-метил-2-пентаноне (150 мл) кипятят с обратным холодильником при перемешивании в течение 24 ч, затем реакционную смесь охлаждают и добавляют воду. Органический слой отделяют, сушат и растворитель отгоняют. Остаток очищают колоночной хроматографией на силикагеле (элюент: CHCl3/МеОН 95/5). Собирают фракции с продуктом и растворитель отгоняют. Остаток кристаллизуют из EtOH и полученный осадок собирают, получая 2 г (33%) соединения 3, т.пл. 216,8 С. В табл. 1 приведены соединения, которые получают в соответствии с одним из приведенных выше примеров.In vitro сцинтилляционный проксимальный анализ (SPA) ингибиторной активности для PARP-1 Соединения по настоящему изобретению испытывают in vitro по методу, основанному на технологии SPA (запатентован компанией Amersham Pharmacia Biotech). Принципиально анализ основывается на хорошо разработанной технологии SPA для обнаружения поли(ADP-рибозилирования) биотинилированных белков-мишеней, т.е. гистонов. Указанное рибозилирование индуцируют, используя фермент PARP-1, активированный с помощью ДНК, которая содержит разрывы в цепи, и динуклеотид [3H] -никотинамидаденин ([3H]-NAD+) в качестве донора ADP-рибозила. В качестве инициатора активности фермента PARP-1 готовят ДНК, содержащую однонитевой разрыв. Для этого 25 мг ДНК (поставщик: Sigma) растворяют в 25 мл буферного раствора для ДНКазы (10 мМ Tris-HCl, pH 7,4; 0,5 мг/мл бычьего сывороточного альбумина (BSA); 5 мМ MgCl26H2O и 1 мМ KCl),в который добавляют 50 мкл раствора ДНКазы (1 мг/мл в 0,15 М NaCl). После инкубирования при температуре 37C в течение 90 мин реакцию прерывают, добавив 1,45 г NaCl, а затем инкубируют при 58C еще в течение 15 мин. Реакционную смесь охлаждают льдом и подвергают диализу при температуре 4 С в течение, соответственно, 1,5 и 2 ч по отношению к 1,5 л 0,2 М раствора KCl и дважды по отношению к 1,5 л 0,01 М раствора KCl в течение 1,5 и 2 ч, соответственно. Берут аликвоту смеси и хранят ее при температуре -20C. Гистоны (1 мг/мл, тип II-A, поставщик: Sigma) биотинилируют, используя набор для биотинилирования компании Amersham, и аликвоту хранят при температуре -20C. Исходный раствор,содержащий 100 мг/мл шариков поли(винилтолуола) (PVT) для проведения SPA (поставщик: Amersham),готовят в забуференном фосфатом солевом растворе. Исходный раствор [3H]-NAD+ готовят, добавляя 120 мкл [3H]-NAD+ (0,1 мКи/мл, поставщик: NEN) к 6 мл буферного раствора для инкубирования (50 мМTris/HCl, pH 8; 0,2 мМ DTT; 4 мМ MgCl2). Раствор 4 мМ NAD+ (поставщик: Roche) готовят в буферном растворе для инкубирования (из 100 мМ исходного раствора в воде, который хранят при -20C). ФерментPARP-1 получают по известным из области техники методикам, т.е. клонированием и экспрессией белка,используя исходную кДНК печени человека. Информацию относительно используемой белковой последовательности фермента PARP-1, включая литературные ссылки, можно найти в базе данных Swiss-Prot- 13011552 под первичным регистрационным номером Р 09874. Биотинилированные гистоны и шарики PVT-SPA смешивают и предварительно инкубируют в течение 30 мин при комнатной температуре. ФерментPARP-1 (концентрация зависит от поставляемой партии вещества) смешивают с ДНК, содержащей разрывы в цепи, и смесь предварительно инкубируют в течение 30 мин при температуре 4 С. Смешивают равные части раствора гистоны/шарики PVT-SPA и раствора фермент PARP-1/ДНК и 75 мкл полученной смеси вместе с 1 мкл соединения в ДМСО и 25 мкл [3H]-NAD+ на лунку помещают на 96-луночный планшет для микротитрования. Конечная концентрация смеси для инкубирования составляет 2 мкг/мл для биотинилированных гистонов, 2 мг/мл для шариков PVT-SPA, 2 мкг/мл/мл для для ДНК, содержащей разрывы в цепи, и в диапазоне 5-10 мкг фермента PARP-1. После инкубирования смеси в течение 15 мин при комнатной температуре реакцию прерывают, добавляя 100 мкл 4 мМ раствора NAD+ в буфере для инкубирования (конечная концентрация 2 мМ), и планшеты смешивают. Дают шарикам осесть в течение по крайней мере 15 мин и планшеты переносят в TopCountNXT(Packard) для проведения сцинтилляции и количество отсчетов выражают в виде единиц в минуту (cpm). При каждом эксперименте параллельно проводят испытания контрольного образца (содержащего фермент PARP-1 и ДМСО без соединения), пустого раствора для инкубирования (содержащего ДМСО, но не содержащего фермент PARP-1 или соединение по настоящему изобретению) и испытуемых образцов(содержащих фермент PARP-1 и соединение по настоящему изобретению, растворенные в ДМСО). Все тестируемые соединения растворяют в ДМСО, а затем дополнительно разбавляют в ДМСО. Вначале соединения испытывают при концентрации 10-5M. В том случае, если соединения показывают активность при 10-5M, то строят кривую зависимости реакции от дозы, при этом соединения исследуют в диапазоне концентраций от 10-5 до 10-8M. При проведении каждого теста значения для пустого раствора вычитают из результатов как контрольного, так и испытуемого образцов. Контрольный образец характеризует максимальную активность фермента PARP-1. Для каждого образца величину отсчетов в минуту выражают в виде процента от среднего значения отсчетов в минуту для контрольных образцов. Там, где возможно,рассчитывают величины IC50 (концентрация лекарства, необходимая для 50%-ного снижения ферментативной активности PARP-1 по сравнению с контрольным образцом) методом линейной интерполяции между экспериментальными точками, расположенными непосредственно над и непосредственно под уровнем, составляющим 50%. В данном описании величину воздействия соединений выражают в видеpIC50 (отрицательный логарифм от значения IC50). Для оценки SPA анализа в качестве соединения для сравнения используют 4-амино-1, 8-нафталимид. Тестируемые соединения проявляют ингибиторную активность при начальной исследуемой концентрации, составляющей 10-5M (см. табл. 2).In vitro фильтрационный анализ ингибиторной активности поотношению к PARP-1 Соединения по настоящему изобретению тестируют по методу in vitro фильтрационного анализа активности PARP-1 (инициируется в присутствии ДНК, содержащей однонитевой разрыв) по его активности при поли(ADP-рибозилировании) гистона, используя [32P]-NAD в качестве донора ADP-рибозила. Радиоактивные рибозилированные гистоны осаждают трихлоруксусной кислотой (TCA) на 96 луночных фильтровальных пластинах и захваченное количество [32P] определяют с помощью сцинтиллятора. Готовят смесь гистонов (исходный раствор: 5 мг/мл в H2O), NAD+ (исходный раствор: 100 мМ вH2O) и [32P]-NAD+ в буферном растворе для инкубирования (50 мМ Tris/HCl, pH 8; 0,2 мМ DTT; 4 мМMgCl2) . Готовят также смесь фермента PARP-1 (5-10 мкг/мл) и ДНК, содержащей одноцепочечный разрыв. ДНК, содержащую одноцепочечный разрыв, готовят, как описано в in vitro SPA анализе ингибиторной активности для PARP-1. Добавляют по 75 мкл смеси фермент PARP-1/ДНК вместе с 1 мкл соединения по изобретению в ДМСО и 25 мкл смеси гистоны-NAD+/ [32P]-NAD+ на каждую лунку 96-луночной фильтровальной пластинки (0,45 мкм, поставщик: Millipore). Конечная концентрация в смеси для инкубирования составляет 2 мкг/мл для гистонов, 0,1 мМ для NAD+, 200 мкМ (0,5 мкКи) для [32P]-NAD+ и 2 мкг/мл для ДНК с одноцепочечным разрывом. Пластинки инкубируют в течение 15 мин при комнатной температуре и реакцию прерывают добавлением 10 мкл охлажденного льдом 100% TCA с последующим добавлением 10 мкл охлажденного льдом раствора BSA (1% в H2O). Дают в течение 10 мин фракции белка осесть при комнатной температуре и пластинки отфильтровывают в вакууме. Каждую лунку пластинок последовательно промывают с помощью 1 мл охлажденного льдом 10%-ного раствора TCA, 1 мл охлажденного льдом 5%-ного раствора TCA и 1 мл 5%-ного раствора TCA при комнатной температуре. Наконец, в каждую лунку добавляют 100 мкл сцинтилляционного раствора (Microscint 40, Packard) и пластинки помещают в TopCountNXT (поставщик: Packard) для проведения сцинтилляционного подсчета и полученные значения выражают в виде количества отсчетов в минуту (cpm). B каждом эксперименте параллельно проводят испытания контрольного образца (содержащего фермент PARP-1 и ДМСО без соединения), пустого раствора для инкубирования (содержащего ДМСО, но не содержащего ферментPARP-1 или соединение по настоящему изобретению) и испытуемых образцов (содержащих ферментPARP-1 и соединение по настоящему изобретению, растворенные в ДМСО). Все тестируемые соединения растворяют в ДМСО, а затем дополнительно разбавляют в ДМСО. Вначале тестируемые соединения испытывают при концентрации 10-5M. В том случае, если соединения показывают активность при 10-5M,то строят кривую зависимости реакции от дозы, при этом соединения исследуют в диапазоне концентра- 14011552 ций от 10-5 до 10-8M. При проведении каждого теста значения для пустого раствора вычитают из результатов как контрольного, так и испытуемого образцов. Контрольный образец характеризует максимальную активность фермента PARP-1. Для каждого образца величину отсчетов в минуту выражают в виде процента от среднего значения отсчетов в минуту для контрольных образцов. Там, где возможно, рассчитывают величины IC50 (концентрация лекарства, необходимая для 50%-ного снижения ферментативной активности PARP-1 по сравнению с контрольным образцом) методом линейной интерполяции между экспериментальными точками, расположенными непосредственно над и непосредственно под уровнем,составляющим 50%. В данном описании величину воздействия тестируемых соединений выражают в виде pIC50 (отрицательный логарифм от значения IC50). Для оценки фильтрационного анализа в качестве соединения для сравнения проводят испытания с 4-амино-1,8-нафталимидом. Тестируемые соединения проявляют ингибиторную активность при начальной исследуемой концентрации, составляющей 10-5MIn vitro сцинтилляционный проксимальный анализ (SPA) ингибиторной активности для TANK-2 Соединения по настоящему изобретению испытывают in vitro по методу, основанному на технологии SPA, используя планшеты Ni Flash (96 или 384 лунки). Принципиально анализ основывается на технологии SPA для обнаружения авто-поли(ADPрибозилирования) белка TANK-2, используя динуклеотид [3H]-никотинамидаденина ([3H]-NAD+) в качестве донора ADP-рибозила. Готовят исходный раствор [3H]-NAD+/NAD, добавляя 64,6 мкл [3H]-NAD+ (0,1 мКи/мл, поставщик:Perkin Elmer) и 46,7 мкл исходного раствора NAD (10,7 мМ, хранят -20 С, поставщик: Roche) к 1888,7 мкл буферного раствора для анализа (60 мМ Tris/HCl, рН 7,4; 0,9 мМ DTT; 6 мМ MgCl2). Фермент(Perkin Elmer) добавляют 60 мкл буферного раствора для анализа вместе с 1 мкл соединения по изобретению в ДМСО, 20 мкл раствора [3H] -NAD+/NAD и 20 мкл фермента TANK-2 (конечная концентрация 6 мкг/мл). После инкубирования смеси в течение 120 мин при комнатной температуре реакцию прерывают добавлением 60 мкл раствора для остановки процесса (42,6 мг NAD в 6 мл H2O). Планшеты покрывают герметиком для планшетов и помещают в TopCountNXT (Packard) для проведения сцинтилляционных подсчетов. Полученные значения выражают в виде количества отсчетов в минуту (cpm). В каждом эксперименте параллельно проводят испытания контрольного образца (содержащего фермент TANK-2 и ДМСО без соединения по изобретению), пустого раствора для инкубирования (содержащего ДМСО, но не содержащего фермент TANK-2 или соединение по настоящему изобретению) и испытуемых образцов(содержащих фермент TANK-2 и соединение по настоящему изобретению, растворенные в ДМСО). Все тестируемые соединения растворяют в ДМСО, а затем дополнительно разбавляют в ДМСО. Вначале тестируемые соединения испытывают при концентрации 10-5M. В том случае, если соединения показывают активность при 10-5M, то строят кривую зависимости реакции от дозы, при этом соединения исследуют в диапазоне концентраций от 10-5 до 10-8M. При проведении каждого теста значения для пустого раствора вычитают из результатов как контрольного, так и испытуемого образцов. Контрольный образец характеризует максимальную активность фермента TANK-2. Для каждого образца величину отсчетов в минуту выражают в виде процента от среднего значения отсчетов в минуту для контрольных образцов. Там, где возможно, рассчитывают величины IC50 (концентрация лекарства, необходимая для 50%-ного снижения ферментативной активности TANK-2, по сравнению с контрольным образцом) методом линейной интерполяции между экспериментальными точками, расположенными непосредственно над и непосредственно под уровнем, составляющим 50%. В данном описании величину воздействия тестируемых соединений выражают в виде pIC50 (отрицательный логарифм от значения IC50). Для оценки SPA анализа в качестве соединения для сравнения проводят испытания с 3-аминобензамидом и 4-амино-1,8-нафталимидом. Приведена методика проведения анализа для 96-луночных планшетов. В анализах, где используют 384 луночные планшеты, применяют те же самые конечные концентрации, а используемые объемы адаптируют. Если получают данные для 96-луночных планшетов, то эти результаты приведены в табл. 2, в противном случае представлены результаты для 384-луночных планшетов. Оценку соединений можно также провести с помощью анализов химио- и/или радиосенсибилизации клеток, анализа по определению ингибирования активности эндогенного PARP-1 в линиях раковых клеток и, наконец, в тесте по in vivo радиосенсибилизации. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) его N-оксидные формы, его фармацевтически приемлемые аддитивные соли и его стереохимически изомерные формы, где каждый X независимо обозначает и когда X означаетL1 означает прямую связь или двухвалентный радикал, выбранный из -C1-6 алкандиила-,L2 означает прямую связь или двухвалентный радикал, выбранный из карбонила, -С 1-6 алкандиила-,-(гидрокси)C1-6 алкандиила-, -C(O)-C1-6 алкандиила- или -C1-6 алкандиил-С(О)-;R1 означает атом водорода или гидроксильную группу;Z означает атом водорода или радикал, выбранный из где каждый R2 независимо выбран из атома водорода, атома галогена или C1-6 алкила,при условии, что хиназолиндионовый фрагмент присоединен к остальной части молекулы по -NHфрагменту в положении 1, и в этом случае атом водорода замещен, и при условии, что соединения 1-[1[(2S)-2-[(2R)-3,4-дигидро-2 Н-1-бензопиран-2-ил]-2-гидроксиэтил]-4-пиперидинил]-2,4(1H,3H)-хиназолиндион, 1-[2-4-[(4-фторбензоил)-1-пиперидинил]этил]-2,4-(1H,3H)хиназолиндион и 1-[3-[4-(4-фторбензоил)-1-пиперидинил]пропил]-2,4-(1 Н,3 Н)хиназолиндион исключаются. 2. Соединение по п.1, где каждый X независимо обозначаетL1 означает прямую связь или двухвалентный радикал, выбранный из -C1-6 алкандиила-;L2 означает прямую связь или двухвалентный радикал, выбранный из карбонила или -C1-6 алкандиила-;R1 означает атом водорода или гидроксильную группу;Z означает атом водорода или радикал, выбранный из (а-1), (а-2), (а-3), (а-4) или (а-5); и каждый R2 независимо выбран из атома водорода, атома галогена или С 1-6 алкила. 3. Соединение по п.1 и 2, где каждый X обозначает каждый Y обозначаетR1 означает атом водорода и Z означает атом водорода. 4. Соединение по пп.1, 2 и 3, где соединением является соединение 1 Соединение 1 5. Применение соединения по любому из пп.1-4 в качестве лекарственного средства. 6. Фармацевтическая композиция, содержащая фармацевтически приемлемые носители и терапевтически эффективное количество соединения по пп.1-4 в качестве активного ингредиента. 7. Способ получения фармацевтической композиции по п.6, где тщательно смешивают фармацевтически приемлемые носители и соединение по пп.1-4. 8. Применение соединения формулы (I) его N-оксидных форм, его фармацевтически приемлемых аддитивных солей и его стереохимических изомерных форм, где каждый X независимо обозначает и когда X означаетL1 означает прямую связь или двухвалентный радикал, выбранный из -C1-6 алкандиила-,L2 означает прямую связь или двухвалентный радикал, выбранный из карбонила, -C1-6 алкандиила-,-(гидрокси)C1-6 алкандиила-, -C(O)-C1-6 алкандиила- или -C1-6 алкандиил-С(О)-;R1 означает атом водорода или гидроксильную группу;Z означает атом водорода или радикал, выбранный из где каждый R2 независимо выбран из атома водорода, атома галогена или C1-6 алкила; для приготовления лекарственного средства для лечения опосредованного PARP заболевания. 9. Применение по п.8, где опосредованное PARP заболевание представляет собой опосредованноеPARP-1 заболевание. 10. Применение по пп.8 и 9, где лечение включает химиосенсибилизацию. 11. Применение по пп.8 и 9, где лечение включает радиосенсибилизацию. 12. Комбинация соединения формулы (I) по пп.1-4 с химиотерапевтическим средством. 13. Способ получения соединения по п.1, характеризующийся взаимодействием промежуточного соединения формулы (II) с промежуточным соединением формулы (III), где W обозначает подходящую уходящую группу, с образованием соединения формулы (I-а), гдеX обозначает основания, в инертном для данной реакции растворителе и при добавлении подходящего 14. Способ получения соединения по п.1, характеризующийся взаимодействием промежуточного соединения формулы (IV) с промежуточным соединением формулы (V), где W обозначает подходящую уходящую группу, с образованием соединения формулы (I-b), где в инертном для данной реакции растворителе и при добавлении подходящего
МПК / Метки
МПК: A61K 31/517, A61P 35/00, C07D 401/04, C07D 401/14
Метки: хиназолиндиона, качестве, производные, ингибиторов
Код ссылки
<a href="https://eas.patents.su/19-11552-proizvodnye-hinazolindiona-v-kachestve-ingibitorov-parp.html" rel="bookmark" title="База патентов Евразийского Союза">Производные хиназолиндиона в качестве ингибиторов parp</a>
Предыдущий патент: Изопентилкарбоксанилиды для борьбы с нежелательными микроорганизмами
Следующий патент: Гербицидные комбинации с особыми кетоенолами
Случайный патент: Система безопасности на железнодорожном транспорте