Пиперазинбензотиазолы, используемые в качестве средств для лечения церебральных ишемических расстройств или расстройств цнс
Номер патента: 9682
Опубликовано: 28.02.2008
Авторы: Готтелан Жан-Пьер, Витте Пьер-Ален, Гайяр Паскаль
Формула / Реферат
1. Пиперазинбензотиазоловые производные формулы
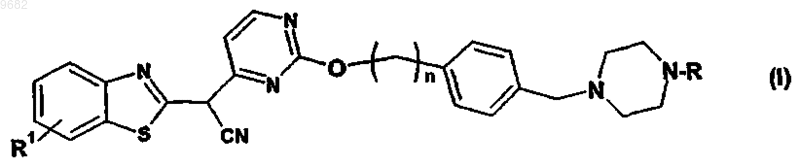
а также их таутомеры, геометрические изомеры, оптически активные формы в виде энантиомеров, диастереомеры и их рацематы, а также их фармацевтически приемлемые соли,
где R выбран из группы, включающей или состоящей из
Н;
C1-С6алкила;
C1-С6алкилa, замещеннoгo гидроксигруппой или C1-С6алкоксикарбонилом;
C1-С6алкильной группы, имeющей арильный заместитель, означающий ненасыщенную ароматическую карбоциклическую группу с 6-14 атомами углерода;
гетероарила, где гетероарил означает 5-6-членную моноциклическую гетероароматическую группу, содержащую до трех гетероатомов, выбранных из О или N;
ацила, включающего группу -С(О), в которой углерод карбонильной группы замещен
C1-С6алкилом;
С1-С5алкильной группы, имeющей алкоксизаместитель, включающий группу -O-, где в которой кислород замещен C1-С6алкильной группой;
aлкоксикарбонила, включая -С(О)О, в которой кислород, который не является кислородом карбонильной группы, замещен C1-С6алкильной группой;
aминоацетильной группы;
аминокарбонила, где аминокарбонил включает группу -C(O)N, где азот дважды замещен и каждое замещение независимо выбирают из
водорода или C1-С6алкила;
C1-С6алкильнoй группы, имeющей аминокарбонильный заместитель, где аминокарбонил включает группу -C(O)N, где азот дважды замещен и каждое замещение независимо выбирают из
водорода или C1-С6алкила;
формила;
R1 представляет собой Н и
n равно целому числу от 1 до 3.
2. Пиперазинбензотиазоловое производное по п.1, где R выбран из группы, состоящей из
Н,
C1-С3алкила,
аминокарбoнила, где аминокарбонильный азот дважды замещен C1-С6алкилом;
C1-С6алкилa, имеющего C1-6алкоксикарбонильный заместитель,
С1-С5алкила, имеющего C1-6алкоксизаместитель,
C1-С6алкоксикарбонила или
C1-С6алкила, имеющего aминокарбонильный заместитель.
3. Пиперазинбензотиазоловое производное по п.2, где R представляет собой Н, C1-С3алкил или
С1-С5алкил, имеющий C1-C6aлкоксизаместитeль.
4. Пиперазинбензотиазоловое производное по п.2, где R представляет собой метил или этил.
5. Пиперазинбензотиазоловое производное по любому из предыдущих пунктов, где n равно 1.
6. Пиперазинбензотиазоловое производное по любому из предыдущих пунктов, выбранное из группы, состоящей из
1,3-бензотиазол-2-ил[2-({4-[(4-метилпиперазин-1-ил)метил]бензил}окси)пиримидин-4-ил]ацетонитрила,
1,3-бензотиазол-2-ил[2-({4-[(4-бензилпиперазин-1-ил)метил]бензил}окси)пиримидин-4-ил]ацетонитрила,
1,3-бензотиазол-2-ил(2-{[4-(пиперазин-1-илметил)бензил]окси}пиримидин-4-ил)ацетонитрила,
1,3-бензотиазол-2-ил[2-({4-[(4-формилпиперазин-1-ил)метил]бензил}окси)пиримидин-4-ил]ацетонитрила,
[2-({4-[(4-ацетилпиперазин-1-ил)метил]бензил}окси)пиримидин-4-ил](1,3-бензотиазол-2-ил)ацетонитрила,
(3H-бензотиазол-2-илиден)-{2-[4-(4-[1,2,4]оксадиазол-3-илметилпиперазин-1-илметил)бензилокси]пиримидин-4-ил}ацетонитрила,
метилового эфира [4-(4-{4-[(3H-бензотиазол-2-илиден)цианометил]пиримидин-2-илоксиметил}бензил)пиперазин]-1-карбоновой кислоты,
2-[4-(4-{4-[(3H-бензотиазол-2-илиден)цианометил]пиримидин-2-илоксиметил}бензил)пиперазин-1-ил]ацетамида,
(2-{4-[4-(2-аминоацетил)пиперазин-1-илметил]бензилокси}пиримидин-4-ил)-(3H-бензотиазол-2-илиден)ацетонитрила,
метилового эфира [4-(4-{4-[(3H-бензотиазол-2-илиден)цианометил]пиримидин-2-илоксиметил}бензил)пиперазин-1-ил]уксусной кислоты,
(3H-бензотиазол-2-илиден)-(2-{4-[4-(2-метоксиэтил)пиперазин-1-илметил]бензилокси}пиримидин-4-ил)ацетонитрила,
диметиламида 4-(4-{4-[(3H-бензотиазол-2-илиден)цианометил]пиримидин-2-илоксиметил}бензил)пиперазин-1-карбоновой кислоты,
(3H-бензотиазол-2-илиден)-{2-[4-(4-этилпиперазин-1-илметил)бензилокси]пиримидин-4-ил}ацетонитрила и
(3H-бензотиазол-2-илиден)-(2-{4-[4-(2-гидроксиэтил)пиперазин-1-илметил]бензилокси}пиримидин-4-ил)ацетонитрила.
7. Применение пиперазинбензотиазолового производного по любому из пп.1-6 в получении лекарственного средства для лечения церебральных ишемических расстройств или расстройств ЦНС.
8. Способ получения пиперазинбензотиазолового производного по любому из пп.1-6 формулы (I)
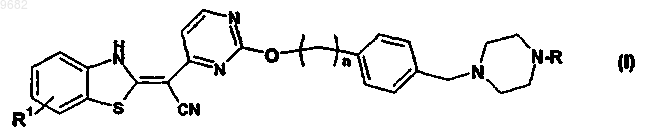
где R, R1 и n определены выше,
включающий взаимодействие соединения формулы (IV)

с соединением формулы (V)
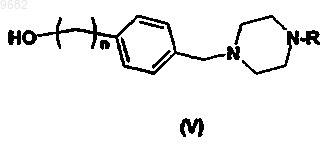
где R, R1 и n определены выше.
Текст
009682 Настоящее изобретение относится к пиперазинбензотиазоловым производным, а в частности, к их применению для лечения и/или профилактики церебральных ишемических расстройств или расстройств ЦНС, а также к способам получения указанных соединений. Клетки млекопитающих отвечают на некоторые внеклеточные стимулы путем активации каскадов сигнальных реакций, которые опосредуются различными активированными митогенами протеинкиназами (MAPK). Несмотря на различия в их ответе на предшествующие стимулы, каскады реакций MAPкиназы организованы аналогичным образом и состоят из реакций, в которых участвуют киназы киназMAP-киназы (MAPK). MAP-киназы принадлежат к широкому семейству киназ, которое включает Nконцевые киназы с-Jun (JNK), известные как "активированные стрессом протеинкиназы" (SAPK), а также как киназы, регулируемые внеклеточным сигналом (ERK), и MAP-киназы р 38. Каждое из этих трех подсемейств MAP-киназ участвует по крайней мере в трех различных, но параллельных путях, передающих определенную информацию, "запускаемую" внешними стимулами. Путь передачи сигнала JNK активируется стрессовым воздействием на клетки окружающих факторов, таких как химические токсины, радиация, гипоксия и осмотический шок, а также путем обработки клеток факторами роста или провоспалительными цитокинами, такими как фактор некроза опухоли альфа (TNF-) или интерлейкин-1 бетаMKK7, активируют JNK посредством двойного фосфорилирования специфических треониновых и тирозиновых остатков, расположенных в мотиве Thr-Pro-Tyr на активационной петле фермента, в ответ на действие цитокинов и стрессовых сигналов. Известно, что даже в еще более ранней реакции сигнального каскада, MKK4 также сама активируется киназой киназы MAP-киназ, MEKK1, посредством фосфорилирования по сериновым и треониновым остаткам. После активации JNK связывается с N-концевой областью мишеней фактора транскрипции и фосфорилирует домены активации транскрипции, что приводит к стимуляции экспрессии различных генных продуктов, которые могут вызывать апоптоз клеток, воспалительные ответы или онкогенные процессы (1). Известно, что некоторые факторы транскрипции, т.е. субстраты JNK, представляют собой белки Jun(c-Jun, JunB и JunD), родственные факторы транскрипции ATF2 и ATFa, факторы транскрипции ETs, такие как Elk-1 и Sap-1, опухолевый супрессор р 53 и домен белка клеточной гибели (DENN). Три различных фермента JNK были идентифицированы как продукты генов JNK1, JNK2, JNK3 и было идентифицировано десять различных изоформ JNK (2). JNK1 и JNK2 экспрессируются во всех тканях человека, тогда как JNK3 селективно экспрессируются в головном мозге, сердце и яичках (2). Каждая изоформа связывается с субстратами с различными аффинностями, что позволяет предположить, чтоin vivo субстрат-специфическая регуляция сигнальных путей осуществляется различными изоформамиJNK. Активация пути JNK наблюдалась в различных патологических процессах, и этот факт послужил основой для разработки лекарственных средств, нацеленных на этот путь активации. Кроме того, генетические методы молекулярной биологии подтвердили патогенную роль этого пути в некоторых заболеваниях. Так, например, аутоиммунные и воспалительные заболевания возникают в результате неадекватной активации иммунной системы. Активированные иммунные клетки экспрессируют многие гены, кодирующие воспалительные молекулы, включая цитокины, факторы роста, рецепторы клеточных поверхностей, молекулы клеточной адгезии и гидролизующие ферменты. Известно, что многие из этих генов регулируются путями JNK посредством активации факторов транскрипции c-Jun и ATF-2. Ингибирование активации JNK в стимулированных липополисахаридом бактериальных макрофагах эффективно модулирует продуцирование ключевого провоспалительного цитокина, TNF- (3). Ингибирование активации JNK приводит к снижению активации факторов транскрипции, ответственных за индуцибельную экспрессию металлопротеиназ матрикса (ММР) (4), которые, как известно,ответственны за стимуляцию эрозии хряща и кости при ревматоидном артрите, и за общую деструкцию тканей при других аутоиммунных заболеваниях. Каскад реакций с участием JNK также активируется в Т-клетках путем стимуляции антигеном и костимуляции рецептора CD28 (5) и регулирует продуцирование промотора IL-2 (6). Неадекватная активация Т-лимфоцитов инициирует и переводит в статус хронических заболеваний многие аутоиммунные заболевания, включая астму, синдром воспаления кишечника и рассеянный склероз. В нейронах, восприимчивых к разрушению, обусловленному болезнью Альцгеймера, и в нейронах СА 1 у пациентов с острой гипоксией (7), наблюдается высокий уровень экспрессии белка JNK3. Было также обнаружено, что ген JNK3 также экспрессируется в пораженных областях головного мозга у пациентов с болезнью Альцгеймера (8). Кроме того, было обнаружено, что в отличие от нейронов мышей дикого типа, нейроны мышей с JNK3 KO приобретают резистентность к апоптозу, индуцированному каиновой кислотой.-1 009682 На основании этих данных очевидно, что путь передачи сигнала JNK, в частности JNK2 и JNK3,играет определенную роль в ассоциированных с апоптозом нейродегенеративных заболеваниях,таких как болезнь Альцгеймера, болезнь Паркинсона, эпилепсия и эпилептические припадки, болезнь Гентингтона, расстройства ЦНС, травматические повреждения головного мозга, а также ишемические расстройства и геморрагический шок. Было высказано предположение, что модуляторами JNK-пути являются некоторые малые молекулы Общая проблема, с которой сталкиваются специалисты при лечении расстройств ЦНС, например церебральных расстройств, заключается в доставке терапевтических соединений в ЦНС, например, в головной мозг. Хорошо известно, что доставке лекарственных средств в ЦНС препятствует ГЭБ. Гематоэнцефалический барьер (ГЭБ) представляет собой барьер, образованный капиллярными стенками и окружающей нейроглией, который препятствует транспорту веществ между тканями крови и головного мозга. Этот гематоэнцефалический барьер (ГЭБ) поддерживает гомеостатическую среду центральной нервной системы (ЦНС). Капилляры, которые поставляют кровь в головной мозг, имеют плотные стыки,которые блокируют прохождение большинства молекул через капиллярные эндотелиальные мембраны. Эти мембраны пропускают липидные растворимые в липидах вещества, такие как героин и другие психотропные лекарственные средства, но водорастворимые материалы, такие как глюкоза, белки и аминокислоты не проходят через ГЭБ. Для транспорта глюкозы и незаменимых аминокислот через ГЭБ существуют механизмы опосредованного транспорта. Механизмы активного транспорта позволяют выводить из головного мозга молекулы, которые присутствуют в нем в избыточном количестве, например калий. Общий обзор см. в работе Goldstein and Betz, 1986 и Betz et al., 1994, которая во всей своей полноте вводится в настоящее описание посредством ссылки (14; 15). Краткое описание изобретения Настоящее изобретение относится к пиперазинбензотиазоловым производным, а в частности, к их применению для лечения и/или профилактики церебральных ишемических расстройств или расстройств ЦНС, а также к способам получения этих соединений. Описание изобретения В нижеследующих разделах приводятся определения различных химических молекул, которые образуют соединения настоящего изобретения, и такие определения необходимы для единообразия терминологии, используемой в описании и в формуле изобретения, если это не оговорено особо в случае необходимости придания данному термину более широкого смысла. Термин "C1-C6 алкил" означает моновалентные алкильные группы, имеющие 1-6 атомов углерода. Примерами таких групп являются метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил,н-гексил и т.п. Термин "арил" означает ненасыщенную ароматическую карбоциклическую группу с 6-14 атомами углерода, имеющую одинарное кольцо (например, фенил) или множество конденсированных колец (например, нафтил). Предпочтительным арилом является фенил, нафтил, фенантренил и т.п. Термин "C1-C6 алкиларил" означает C1-C6 алкильные группы, имеющие арильный заместитель,включая бензил, фенетил и т.п. Термин "гетероарил" означает моноциклическую гетероароматическую, либо бициклическую или трициклическую конденсированную гетероароматическую группу. Конкретными примерами гетероароматических групп являются необязательно замещенный пиридил, пирролил, фурил, тиенил,имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразолил, 1,2,3-триазолил, 1,2,4-триазолил,1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, 1,3,4-триазинил,1,2,3-триазинил, бензофурил, [2,3-дигидро]бензофурил, изобензофурил, бензотиенил, бензотриазолил,изобензотиенил, индолил, изоиндолил, 3H-индолил, бензимидазолил, имидазо[1,2-а]пиридил,бензотиазолил, бензоксазолил, хинолизинил, хиназолинил, фталазинил, хиноксалинил, циннолинил,нафтиридинил, пиридо[3,4-b]пиридил, пиридо[3,2-b]пиридил, пиридо[4,3-b]пиридил, хинолил,изохинолил,тетразолил,5,6,7,8-тетрагидрохинолил,5,6,7,8-тетрагидроизохинолил,пуринил,-2 009682 птеридинил, карбазолил, ксантенил или бензохинолил. Термин "C1-C6 алкилгетероарил" означает C1-C6 алкильные группы, имеющие гетероарильный заместитель, включая 2-фурилметил, 2-тиенилметил, 2-(1 Н-индол-3-ил)этил и т.п. Термин "C2-C6 алкенил" означает алкенильные группы, предпочтительно имеющие от 2 до 6 атомов углерода и содержащие двойные связи (ненасыщенность) по крайней мере в одном или в двух положениях. Предпочтительными алкенильными группами являются этенил (-CH=CH2), н-2-пропенил (аллил,-CH2CH=CH2) и т.п. Термин "C2-C6 алкениларил" означает C2-C6 алкенильные группы, имеющие арильный заместитель,включая 2-фенилвинил и т.п. Термин "C2-C6 алкенилгетероарил" означает C2-C6 алкенильные группы, имеющие гетероарильный заместитель, включая 2-(3-пиридинил)винил и т.п. Термин "C2-C6 алкинил" означает алкинильные группы, предпочтительно имеющие от 2 до 6 атомов углерода и содержащие тройные связи по крайней мере в 1-2 положениях, и предпочтительными алкинильными группами являются этинил (-CCH), пропаргил (-CH2CCH) и т.п. Термин "C2-C6 алкиниларил" означает C2-C6 алкинильные группы, имеющие арильный заместитель,включая фенилэтинил и т.п. Термин "C2-C6 алкинилгетероарил" означает C2-C6 алкинильные группы, имеющие гетероарильный заместитель, включая 2-тиенилэтинил и т.п. Термин "C3-C8 циклоалкил" означает насыщенную карбоциклическую группу с 3-8 атомами углерода, имеющую одинарное кольцо (например, циклогексил) или множество конденсированных колец (например, норборнил). Предпочтительными циклоалкилами являются циклопентил, циклогексил, норборнил и т.п. Термин "гетероциклоалкил" означает C3-C8 циклоалкильную группу, определенную выше, в которой от 1 до 3 атомов углерода заменены гетероатомами, выбранными из группы, состоящей из О, S, NR, гдеR представляет собой водород или метил. Предпочтительным гетероциклоалкилом являются пирролидин, пиперидин, пиперазин, 1-метилпиперазин, морфолин и т.п. Термин "C1-C6 алкилциклоалкил" означает C1-C6 алкильные группы, имеющие циклоалкильный заместитель, включая циклогексилметил, циклопентилпропил и т.п. ТерминC1-C6 алкильные группы,имеющие гетероциклоалкильный заместитель,включая 2-(1-пирролидинил)этил,4-морфолинилметил,(1-метил-4-пиперидинил)метил и т.п. Термин "карбокси" означает группу -C(O)OH. Термин "C1-C6 алкилкарбокси" означает C1-C5 алкильные группы, имеющие карбокси-заместитель,включая 2-карбоксиэтил и т.п. Термин "ацил" означает группу -C(O)R, где R представляет собой "C1-C6 алкил", "арил","гетероарил", "C1-C6 алкиларил" или "C1-C6 алкилгетероарил". Термин "C1-C6 алкилацил" означает C1-C6 алкильные группы, имеющие ацильный заместитель,включая 2-ацетилэтил и т.п. Термин "ацилокси" означает группу -OC(O)R, где R представляет собой "C1-C6 алкил", "арил","гетероарил", "C1-C6 алкиларил" или "C1-C6 алкилгетероарил". Термин "C1-C6 алкилацилокси" означает C1-C6 алкильные группы, имеющие ацилокси-заместитель,включая 2-(ацетилокси)этил и т.п. Термин "алкокси" означает группу -O-R, где R представляет собой "C1-C6 алкил", "арил", "гетероарил", "C1-C6 алкиларил" или "C1-C6 алкилгетероарил". Предпочтительными алкоксигруппами являются,например, метокси, этокси, фенокси и т.п. Термин "C1-C6 алкилалкокси" означает C1-C5 алкильные группы, имеющие алкоксизаместитель,включая 2-этоксиэтил и т.п. Термин "алкоксикарбонил" означает группу -С(О)OR, где R представляет собой Н, "C1-C6 алкил","арил", "гетероарил", "C1-C6 алкиларил" или "C1-C6 алкилгетероарил". Термин "C1-C6 алкилалкоксикарбонил" означает C1-C6 алкильные группы, имеющие алкоксикарбонильный заместитель, включая 2-(бензилоксикарбонил)этил и т.п. Термин "аминокарбонил" означает группу -C(O)NRR', где каждый из R и R' независимо представляет собой водород, C1-C6 алкил, арил, гетероарил, C1-C6 алкиларил или C1-C6 алкилгетероарил. Термин "C1-C6 алкиламинокарбонил" означает C1-C6 алкильные группы, имеющие аминокарбонильный заместитель, включая 2-(диметиламинокарбонил)этил и т.п. Термин "ациламино" означает группу -NRC(O)R', где каждый из R и R' независимо представляет собой водород, C1-C6 алкил, арил, гетероарил, C1-C6 алкиларил или C1-C6 алкилгетероарил. ТерминC1-C6 алкильные группы,имеющие ациламинозаместитель, включая 2-(пропиониламино)этил и т.п. Термин "уреидо" означает группу -NRC(О)NR'R", где каждый из R, R' и R" независимо представляет собой водород, "C1-C6 алкил", "арил", "гетероарил", "C1-C6 алкиларил", "C1-C6 алкилгетероарил","циклоалкил" или "гетероциклоалкил" и где R' и R", взятые вместе с атомом азота, с которым они связа-3 009682 ны, могут, но необязательно, образовывать 3-8-членное гетероциклоалкильное кольцо. Термин "C1-C6 алкилуреидо" означает C1-C5 алкильные группы, имеющие уреидозаместитель, включая 2-(N'-метилуреидо)этил и т.п. Термин "амино" означает группу -NRR', где каждый из R и R' независимо представляет собой водород, "C1-C6 алкил", "арил", "гетероарил", "C1-C6 алкиларил", "C1-C6 алкилгетероарил", "циклоалкил" или"гетероциклоалкил" и где R и R', взятые вместе с атомом азота, с которым они связаны, могут, но необязательно, образовывать 3-8-членное гетероциклоалкильное кольцо. Термин "C1-C6 алкиламино" означает C1-C5 алкильные группы, имеющие аминозаместитель, включая 2-(1-пирролидинил)этил и т.п. Термин "аммоний" означает положительно заряженную группу -N+RR'R", где каждый из R, R' и R" независимо представляет собой "C1-C6 алкил", "C1-C6 алкиларил", "C1-C6 алкилгетероарил", "циклоалкил" или "гетероциклоалкил", и где R и R', взятые вместе с атомом азота, с которым они связаны, могут, но необязательно, образовывать 3-8-членное гетероциклоалкильное кольцо. Термин "галоген" означает атомы фтора, хлора, брома и йода. Термин "сульфонилокси" означает группу OSO2-R, где R выбран из Н, "C1-C6 алкила","C1-C6 алкила", замещенного галогенами, например, группы -OSO2-CF3-, "арила", "гетероарила","C1-C6 алкиларила" или "C1-C6 алкилгетероарила". Термин "C1-C6 алкилсульфонилокси" означает C1-C6 алкильные группы, имеющие сульфонилоксизаместитель, включая 2-(метилсульфонилокси)этил и т.п. Термин "сульфонил" означает группу "-SO2-R", где R выбран из Н, "арила", "гетероарила","C1-C6 алкила", "C1-C6 алкила", замещенного галогенами, например, группы -SO2-CF3-, "C1-C6 алкиларила" или "C1-C6 алкилгетероарила". Термин "C1-C6 алкилсульфонил" означает C1-C6 алкильные группы, имеющие сульфонильный заместитель, включая 2-(метилсульфонил)этил и т.п. Термин "сульфинил" означает группу "-S(O)-R", где R выбран из Н, "C1-C6 алкила", "C1-C6 алкила",замещенного галогенами, например, группы -SO-CF3-, "арила", "гетероарила", "C1-C6 алкиларила" или"C1-C6 алкилгетероарила". Термин "C1-C6 алкилсульфинил" означает C1-C6 алкильные группы, имеющие сульфинильный заместитель, включая 2-(метилсульфинил)этил и т.п. Термин "сульфанил" означает группы -S-R, где R представляет собой "C1-C6 алкил", "арил","гетероарил", "C1-C6 алкиларил" или "C1-C6 алкилгетероарил". Предпочтительными сульфанильными группами являются метилсульфанил, этилсульфанил и т.п. Термин "C1-C6 алкилсульфанил" означает C1-C6 алкильные группы, имеющие сульфанильный заместитель, включая 2-(этилсульфанил)этил и т.п. Термин "сульфониламино" означает группу -NRSO2-R', где каждый из R и R' независимо представляет собой водород, "C1-C6 алкил", "арил", "гетероарил", "C1-C6 алкиларил" или "C1-C6 алкилгетероарил". Термин "C1-C6 алкилсульфониламино" означает C1-C6 алкильные группы, имеющие сульфониламино-заместитель, включая 2-(этилсульфониламино)этил и т.п. Термин "замещенный или незамещенный", если это не оговорено особо в определении отдельного заместителя, означает, что вышеуказанные группы, такие как "алкил", "алкенил", "алкинил", "арил","гетероарил" и т.п., могут быть, но необязательно, замещены 1-5 заместителями, выбранными из группы,состоящей из "C1-C6 алкила", "C2-C6 алкенила", "C2-C6 алкинила", "циклоалкила", "гетероциклоалкила","C1-C6 алкиларила", "C1-C6 алкилгетероарила", "C1-C6 алкилциклоалкила", "C1-C6 алкилгетероциклоалкила", "амино", "аммония", "ацила", "ацилокси", "ациламино", "аминокарбонила", "алкоксикарбонила","уреидо", "арила", "гетероарила", "сульфинила", "сульфонила", "алкокси", "сульфанила", "галогена","карбокси", "тригалогенметила", "циано", "гидрокси", "меркапто", "нитро" и т.п. Альтернативно, указанный термин "замещенный" может быть также использован в тех случаях, когда соседние заместители подвергаются реакции замыкания цикла, т.е. если в такой реакции участвуют соседние функциональные заместители, образуя, например, лактамы, лактоны, циклические ангидриды, а также ацетали, тиоацетали и аминали, образованные в результате реакции замыкания цикла, проводимой, например, в целях получения защитной группы. Термин "фармацевтически приемлемые соли или комплексы" означает соли или комплексы идентифицированных ниже соединений формул (I) и (II), сохраняющих нужную биологическую активность. Примерами таких солей являются, но не ограничиваются ими, кислотно-аддитивные соли, образованные неорганическими кислотами (например, хлористо-водородной кислотой, бромисто-водородной кислотой, серной кислотой, фосфорной кислотой, азотной кислотой и т.п.) и соли, образованные органическими кислотами, такими как уксусная кислота, щавелевая кислота, винная кислота, янтарная кислота,яблочная кислота, фумаровая кислота, малеиновая кислота, аскорбиновая кислота, бензойная кислота,дубильная кислота, памовая кислота, альгиновая кислота, полиглутаминовая кислота, нафталинсульфоновая кислота, нафталиндисульфоновая кислота и полигалактуроновая кислота. Указанные соединения могут быть также введены в виде фармацевтически приемлемых четвертичных солей, известных специалистам, которыми, в частности, являются соль четвертичного аммония формулы -NR,R',R"+Z-, где R, R' иR" независимо представляют собой водород, алкил, бензил, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил,C1-C6 алкиларил, C1-C6 алкилгетероарил, циклоалкил, гетероциклоалкил, a Z представляет собой противоион, включая хлорид, бромид, йодид, О-алкил, толуолсульфонат, метилсульфонат, сульфонат, фосфат или карбоксилат (такой как бензоат, сукцинат, ацетат, гликолят, малеат, малат, фумарат, цитрат, тартрат,аскорбат, циннамоат, манделоат или дифенилацетат). Термин "фармацевтически активное производное" означает любое соединение, которое после его введения реципиенту обладает прямой или опосредованной активностью, описанной в настоящем изобретении. Термин "энантиомерный избыток" (э.и.) означает продукты, полученные путем асимметрического синтеза, т.е. синтеза с использованием нерацемических исходных материалов и/или реагентов, или синтеза, предусматривающего проведение по крайней мере одной энантиоселективной стадии с получением избытка одного энантиомера (э.и.), составляющего по крайней мере примерно 52%. Указанные формулы соединений также относятся к их таутомерам, геометрическим изомерам, к их оптически активным формам в виде энантиомеров, к их диастереомерам и рацематам, а также к их фармацевтически приемлемым солям. Предпочтительными фармацевтически приемлемыми солями формулы (I) являются кислотно-аддитивные соли, образованные фармацевтически приемлемыми кислотами,такие как гидрохлорид, гидробромид, сульфат или бисульфат, фосфат или бифосфат, ацетат, бензоат,сукцинат, фумарат, малеат, лактат, цитрат, тартрат, глюконат, метансульфонат, бензолсульфонат и паратолуолсульфонат. Соединениями настоящего изобретения являются соединения формулы где R выбран из группы, включающей или состоящей из водорода, замещенного или незамещенногоC1-C6 алкила, замещенного или незамещенного C1-C6 алкиларила, замещенного или незамещенного гетероарила, замещенного или незамещенного C1-C6 алкилгетероарила, замещенного или незамещенногоC2-C6 алкенила, замещенного или незамещенного C2-C6 алкениларила, замещенного или незамещенногоC2-C6 алкенилгетероарила, замещенного или незамещенного C2-C6 алкинила, замещенного или незамещенного C2-C6 алкиниларила, замещенного или незамещенного C2-C6 алкинилгетероарила, замещенного или незамещенного C3-C8 циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенногоC1-C6 алкилгетероциклоалкила, замещенной или незамещенной C1-C6 алкилкарбоксигруппы, ацила, замещенного или незамещенного C1-C6 алкилацила, ацилоксигруппы, замещенной или незамещеннойC1-C6 алкилацилоксигруппы, замещенной или незамещенной C1-C6 алкилалкоксигруппы, алкоксикарбонила, замещенного или незамещенного C1-C6 алкилалкоксикарбонила, аминокарбонила, замещенного или незамещенного C1-C6 алкиламинокарбонила, ациламиногруппы, замещенной или незамещенной С 1-С 6 алкилациламиногруппы, уреидогруппы, замещенной или незамещенной C1-C6 алкилуреидогруппы,аминогруппы, замещенной или незамещенной C1-C6 алкиламиногруппы, сульфонилоксигруппы, замещенной или незамещенной C1-C6 алкилсульфонилоксигруппы, сульфонила, замещенного или незамещенного C1-C6 алкилсульфонила, сульфинила, замещенного или незамещенного C1-C6 алкилсульфинила,сульфанила, замещенного или незамещенного C1-C6 алкилсульфанила, сульфониламиногруппы, замещенной или незамещенной C1-C6 алкилсульфониламиногруппы;R1 выбран из группы, включающей или состоящей из Н, галогена, цианогруппы, нитрогруппы, аминогруппы, замещенного или незамещенного C1-C6 алкила, а в частности C1-C3 алкила, например метила,этила или -CF3, замещенного или незамещенного C2-C6 алкенила, замещенного или незамещенногоC2-C6 алкинила, замещенного или незамещенного C1-C6 алкиларила, замещенного или незамещенного арила или замещенного или незамещенного гетероарила, замещенного или незамещенногоC1-C6 алкилгетероарила, -С(О)-OR2, -C(O)-R2, -С(О)-NR2R2', -(SO2)R2, где R2 и R2' независимо выбраны из группы, включающей или состоящей из водорода, незамещенного или замещенного C1-C6 алкила, незамещенного или замещенного C2-C6 алкенила, незамещенного или замещенного C2-C6 алкинила, незамещенного или замещенного арила, незамещенного или замещенного гетероарила, незамещенного или замещенного C1-C6 алкиларила, незамещенного или замещенного C1-C6 алкилгетероарила. R1 предпочтительно представляет собой Н;n равно целому числу от 0 до 3, а более предпочтительно 1. В более предпочтительном варианте настоящего изобретения пиперазинбензотиазоловым производным являются соединения, где R представляет собой водород, C1-C3 алкил, аминокарбонил,C1-C6 алкилалкоксикарбонил, C1-C6 алкилалкоксигруппу, C1-C6 алкилацилоксигруппу, алкоксикарбонил,C1-C6 алкиламинокарбонил. Более конкретно, R представляет собой Н или C1-C3 алкил, а в частности метильную или этильную группу, или C1-C6 алкилалкоксигруппу.-5 009682 Настоящее изобретение также относится к соответствующим таутомерам, имеющим следующую формулу: Конкретные пиперазинбензотиазоловые производные настоящего изобретения выбраны из группы,состоящей из 1,3-бензотиазол-2-ил[2-(4-[(4-метилпиперазин-1-ил)метил]бензилокси)пиримидин-4-ил]ацетонитрила,1,3-бензотиазол-2-ил[2-(4-[(4-бензилпиперазин-1-ил)метил]бензилокси)пиримидин-4-ил]ацетонитрила,1,3-бензотиазол-2-ил(2-[4-(пиперазин-1-илметил)бензил]оксипиримидин-4-ил)ацетонитрила,1,3-бензотиазол-2-ил[2-(4-[(4-формилпиперазин-1-ил)метил]бензилокси)пиримидин-4-ил]ацетонитрила,[2-4-[(4-ацетилпиперазин-1-ил)метил]бензилоксипиримидин-4-ил](1,3-бензотиазол-2-ил)ацетонитрила,(3H-бензотиазол-2-илиден)-2-[4-(4-[1,2,4]оксадиазол-3-илметилпиперазин-1-илметил)бензилокси]пиримидин-4-илацетонитрила,метилового эфира 4-(4-4-[(3H-бензотиазол-2-илиден)цианометил]пиримидин-2-илоксиметилбензил)пиперазин-1-карбоновой кислоты,2-[4-(4-4-[(3H-бензотиазол-2-илиден)цианометил]пиримидин-2-илоксиметилбензил)пиперазин-1 ил]ацетамида,(2-4-[4-(2-аминоацетил)пиперазин-1-илметил]бензилоксипиримидин-4-ил)-(3H-бензотиазол-2 илиден)ацетонитрила,метилового эфира [4-(4-4-[(3H-бензотиазол-2-илиден)цианометил]пиримидин-2-илоксиметилбензил)пиперазин-1-ил]уксусной кислоты,(3H-бензотиазол-2-илиден)-(2-4-[4-(2-метоксиэтил)пиперазин-1-илметил]бензилоксипиримидин 4-ил)ацетонитрила,диметиламида 4-(4-4-[(3H-бензотиазол-2-илиден)цианометил]пиримидин-2-илоксиметилбензил)пиперазин-1-карбоновой кислоты,(3H-бензотиазол-2-илиден)-2-[4-(4-этилпиперазин-1-илметил)бензилокси]пиримидин-4-илацетонитрила,(3H-бензотиазол-2-илиден)-(2-4-[4-(2-гидроксиэтил)пиперазин-1-илметил]бензилоксипиримидин 4-ил)ацетонитрила. Настоящее изобретение также относится к геометрическим изомерам, оптически активным формам,энантиомерам и диастереомерам соединений формулы (I), к их рацематам и к их фармацевтически приемлемым солям, а также к фармацевтически активным пиперазинбензотиазоловым производным формулы (I). Соединения настоящего изобретения представляют собой ингибиторы JNK, а именно, JNK3, а поэтому они могут быть использованы для лечения расстройств, опосредуемых JNK. Неожиданно было обнаружено, что соединения настоящего изобретения обладают значительной способностью проходить через гематоэнцефалический барьер (ГЭБ), а поэтому они могут быть особенно подходящими для лечения церебральных ишемических расстройств или расстройств ЦНС. Следовательно, в другом своем аспекте, настоящее изобретение относится к применению пиперазинбензотиазоловых производных для лечения и/или профилактики церебральных ишемических расстройств или расстройств ЦНС. В другом своем аспекте, настоящее изобретение относится к применению пиперазинбензотиазоловых производных формулы (I) или (II) в получении фармацевтических композиций для лечения церебральных ишемических расстройств или расстройств ЦНС. Еще одной задачей настоящего изобретения является разработка способа получения новых бензотиазоловых производных формулы (I) или (II). Общий способ синтеза соединений формулы (I) представлен на схеме 1. Схема 1 Как показано выше на схеме 1, исходные соединения формулы (III) подвергают реакции взаимодействия с соответствующим образом замещенными (активированными) пиримидинами, такими как галогенпиримидины, например с 2,4-дихлорпиримидином формулы (VI), в результате чего получают-6 009682 пиримидинобензотиазоловые соединения IV. Такие реакции взаимодействия предпочтительно осуществляют в присутствии подходящих оснований, например гидрида натрия, гидрида калия и т.п., в безводной инертной атмосфере, предпочтительно в полярном растворителе, таком как ДМФ, ДМА, MeCN или ТГФ при температуре примерно от -78 до 100 С. Бензотиазолы формулы (III) либо являются коммерчески доступными, например поставляютсяMaybridge Cemical Co. LTD, либо они могут быть получены из коммерчески доступных соединений стандартными методами. Галогенированные пиримидины, например 2,4-дихлорпиримидин формулы (VI), также либо являются коммерчески доступными, например поставляются Aldrich, Fluka, Sigma и т.п., либо они могут быть получены стандартными методами. Для получения конечных пиперазинбензотиазолов формулы (I) промежуточные соединения формулы (IV) предпочтительно подвергают реакции взаимодействия с подходящими спиртами формулы (V),как показано на схеме 2 Схема 2 Эту реакцию предпочтительно осуществляют в присутствии растворителей, таких как ДМФ, ДМА,NMP, ДМСО или ACN, а наиболее предпочтительно в ДМА или MeCN в присутствии подходящего основания, такого как tBuOK, CS2CO3 (карбоната цезия) и в присутствии или в отсутствие CuI, NaH или т.п., а наиболее предпочтительно NaH при температуре примерно от 25 до 120 С. В предпочтительном способе исходные соединения нагревают при 25-100 С в растворе ДМА в присутствии NaH. Промежуточные соединения формулы (V) могут быть получены методами синтеза, проиллюстрированного на схеме 3. На указанной схеме для получения бензилового спирта исходной структурой является метил-п-толуат. В случае фенетилового спирта или фенилпропилового спирта формулы (V) метилп-толуат может быть заменен соответствующими исходными соединениями, либо коммерчески доступными, либо полученными стандартными методами. Схема 3 Используемый здесь термин "лечение" означает подавление или полное прекращение развития заболевания, расстройства или состояния и/или ослабление, ремиссию или устранение симптомов заболевания, расстройства или состояния. При этом следует отметить, что для определения степени развития заболевания, расстройства или состояния могут быть использованы различные методы и анализы, и аналогично, для определения степени ослабления, ремиссии или устранения симптомов заболевания, расстройства или состояния могут быть использованы различные методы или анализы. Пиперазинбензотиазоловые производные настоящего изобретения, при их использовании в качестве фармацевтических средств, обычно вводят в форме фармацевтической композиции. Поэтому в объем настоящего изобретения также входят фармацевтические композиции, содержащие соединение формулы(I) и фармацевтически приемлемый носитель, разбавитель или наполнитель. Специалистам известно большое число таких носителей, разбавителей или наполнителей, которые могут быть подходящими для приготовления фармацевтической композиции. Настоящее изобретение также относится к соединениям,используемым в качестве лекарственного препарата. Соединения настоящего изобретения вместе с обычно используемым адъювантом, носителем, разбавителем или наполнителем могут быть приготовлены в форме фармацевтических композиций и разо-7 009682 вых лекарственных форм, и в такой форме они могут быть использованы в виде твердых препаратов,таких как таблетки или заполненные капсулы, либо в виде жидких препаратов, таких как растворы, суспензии, эмульсии, эликсиры или заполненные капсулы для перорального введения, либо они могут быть изготовлены в форме стерильных растворов для инъекций при парентеральном введении (включая подкожное введение). Такие фармацевтические композиции и разовые лекарственные формы могут содержать ингредиенты в подходящих количествах в сочетании с дополнительными активными соединениями или действующими веществами, или без них, и такие разовые лекарственные формы могут содержать любое подходящее эффективное количество активного ингредиента, соответствующее нужной суточной дозе в определенном диапазоне. Фармацевтические композиции настоящего изобретения могут быть введены различными путями,включая пероральное, ректальное, чрескожное, подкожное, внутривенное, внутримышечное, интратекальное, внутрибрюшинное и интраназальное введение. В зависимости от выбранного способа доставки,указанное соединение предпочтительно готовят в виде композиций для инъекций и композиций для местного и перорального введения. Композиции для перорального введения могут быть приготовлены в виде нерасфасованных жидких растворов или суспензий, либо в виде насыпных порошков. Однако обычно для получения более точных доз такие композиции приготавливают в виде разовых лекарственных форм. Термин "разовые лекарственные формы" означает физически дискретные разовые формы,подходящие для введения человеку или другим млекопитающим унифицированных доз в сочетании с подходящим фармацевтическим наполнителем, где каждая разовая форма содержит предварительно вычисленное количество активного вещества, необходимое для продуцирования нужного терапевтического эффекта. Типичными разовыми лекарственными формами являются ампулы или шприцы, предварительно заполненные определенным количеством жидкой композиции, либо, в случае твердых композиций,драже, таблетки, капсулы или т.п. В таких композициях пиперазинбензотиазоловое соединение является компонентом, обычно присутствующим в малом количестве (примерно от 0,1 до примерно 50 мас.%, или предпочтительно примерно от 1 до примерно 40 мас.%), а остальную массу составляют различные наполнители или носители и технологические добавки, облегчающие приготовление нужной лекарственной формы. Жидкие формы, подходящие для перорального введения, могут включать подходящий водный или безводный носитель вместе с буферами, суспендирующими и диспергирующими агентами, красителями,ароматизаторами и т.п. Твердые формы могут включать, например, любой из нижеследующих ингредиентов или соединений аналогичной природы: связующий агент, такой как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; наполнитель, такой как крахмал или лактоза; дезинтегрирующий агент, такой как альгиновая кислота, примогель или кукурузный крахмал; замасливатель, такой как стеарат магния; вещество, улучшающее скольжение, такое как коллоидный диоксид кремния; подсластитель, такой как сахароза или сахарин; ароматизатор, такой как перечная мята, метилсалицилат или апельсиновая отдушка. Композиции для инъекций обычно приготавливают на основе стерильных физиологических растворов или забуференных фосфатом физиологических растворов для инъекций или других инъецируемых носителей, известных специалистам. Как было упомянуто выше, в таких композициях пиперазинбензотиазоловые производные формулы (I) представляют собой компонент, обычно присутствующий в небольшом количестве, часто в пределах от 0,05 до 10 мас.%, а остальную массу составляет носитель для инъекций и т.п. Вышеупомянутые компоненты для композиций, вводимых перорально или путем инъекции, приводятся как репрезентативные примеры. Другие материалы, а также способы получения композиций и т.п. описаны в части 8 руководства Remington's Pharmaceutical Sciences, 17th Edition, 1985, Marck Publishing.Company, Easton, Pennsylvania, которое вводится в настоящее описание посредством ссылки. Соединения настоящего изобретения могут быть также введены в формах для пролонгированного высвобождения лекарственного средства или в виде системы доставки лекарственного средства с пролонгированным высвобождением. Описание репрезентативных материалов для пролонгированного высвобождения можно также найти среди включенных материалов в руководстве Remington's Pharmaceutical Sciences. В нижеследующем описании настоящего изобретения представлены некоторые примеры, которые приводятся лишь в иллюстративных целях и не должны рассматриваться как ограничение изобретения. Данные ВЭЖХ, ЯМР и МС, представленные в описанных ниже примерах, были получены при следующих условиях: ВЭЖХ: колонка Waters Symmetry C8 504,6 см,условия:-8 009682 масс-спектр: PE-SCIEX API 150 EX (APCI и ESI),ЖХ/МС-спектры: Waters ZMD (ES); 1 Н-ЯМР: Bruker DPX-300 МГц. Очистку проводили при следующих условиях: препаративная ВЭЖХ на системе Waters Prep LC 4000, снабженной колонками Prep Nova-PakHRC186 мкм 60, 4030 мм (до 100 мг) или 40300 мм (до 1 г). Всю очистку проводили в градиенте MeCN/H2O, 0,09% TFA. Пример А. Получение промежуточного соединения (IV), см. схему 1. 1,3-Бензотиазол-2-ил-(2-хлор-4-пиримидинил)ацетонитрил. К перемешиваемой суспензии NaH (60% в масле, 9,2 г, 0,23 моль) в сухом ТГФ (200 мл) в инертной атмосфере по каплям добавляли раствор 1,3-бензотиазол-2-илацетонитрила (20 г, 0,15 моль) в сухом ТГФ(200 мл). После перемешивания при комнатной температуре в течение 1,5 ч по каплям добавляли раствор 2,4-дихлорпиримидина (17,1 г, 0,15 моль) в сухом ТГФ (200 мл). Реакционную смесь оставляли при перемешивании в инертной атмосфере при комнатной температуре до полного исчезновения исходного соединения. Реакцию гасили добавлением воды и ТГФ выпаривали. Затем добавляли воду и суспензию слегка подкисляли водной 1 М HCl. Полученный осадок отфильтровывали и тщательно промывали водой до тех пор, пока его pH не становился нейтральными, а затем промывали гексаном для удаления масла. Неочищенное твердое вещество сушили в вакууме при 40 С с получением 28 г (84%) указанного в заголовке соединения в виде светло-коричневого порошка: т.пл. 246 С, разл.; МС: 286,8 (М+1); ВЭЖХ (условия а, 268 нм) 97%, время выдержки 5,66 мин. 1 Н ЯМР (ДМСО-d6)13,25 (ушир.с, 1 Н, заменяемый), 8,09 (д, J=4,14 Гц, 1 Н), 7,90 (д, J=7,53 Гц,1 Н), 7,61 (д, J=7,92 Гц, 1 Н), 7,39-7,34 (м, 4 Н), 7,20-7,15 (м, 1 Н), 6,96 (ушир.д, 1 Н).CHN анализ: C13H7ClN4S; Вычислено: С 54,19%, Н 2,48%, N 19,45%; Найдено: С 53,35%, Н 2,77%, N 17,62%. Пример В. Получение промежуточного соединения (Va), см. схему 3. 4-(4-Метилпиперазин-1-илметилфенил)метанол. Стадия 1. Метил-п-толуат. К раствору п-толуоловой кислоты (175 г, 1,28 моль) в метаноле (2 л) по каплям, перемешивая при 5 С, добавляли тионилхлорид (612 г, 5,14 моль). Смесь кипятили с обратным холодильником в течение ночи, а затем растворитель выпаривали. Полученный остаток обрабатывали 10% водным растворомNaHCO3 (pH 8). Продукт экстрагировали этилацетатом, промывали водой и сушили. Растворитель удаляли и неочищенный продукт очищали колоночной хроматографией (петролейный эфир/этилацетат) с получением метил-п-толуата в виде бесцветной жидкости (180 г, 93%). Стадия 2. 4-Метоксикарбонилбензилбромид. К смеси метил-п-толуата (180 г, 1,2 моль) и N-бромсукцинимида (235 г, 1,32 моль) в CCl4 (2 л) порциями добавляли бензоилпероксид (18 г) при 50 С. Смесь кипятили с обратным холодильником в течение 5 ч. Затем смесь оставляли для охлаждения до 40 С и твердое вещество отфильтровывали. Фильтрат концентрировали и получали 4-метоксикарбонилбензилбромид (252 г, 91%) в виде светло-желтой жидкости. Стадия 3. N-Метил(4-метоксикарбонилбензил)пиперазин. К раствору N-метилпиперазина (80 г, 0,91 моль) и триэтиламина (232 г, 2,29 моль) в абсолютном спирте (1750 мл) по каплям при 0 С добавляли раствор 4-метоксикарбонилбензилбромида (252 г,1,1034 моль) в абсолютном спирте (250 мл). Смесь перемешивали в течение ночи при комнатной температуре. Затем смесь концентрировали, и полученный остаток растворяли в 1,5 н. HCl (3 л), а затем промывали диэтиловым эфиром (3 раза) и этилацетатом. Раствор нейтрализовали 10% водным растворомNaOH и подщелачивали 10% водным раствором NaHCO3 до pH 8. Продукт экстрагировали CHCl3,промывали водой и насыщенным раствором соли, а затем сушили над Na2SO4. Растворитель удаляли и неочищенный продукт очищали колоночной хроматографией (CHCl3/МеОН) с получениемN-метил(4-метоксикарбонилбензил)пиперазина (150 г, 70%) в виде коричневой жидкости. Стадия 4. 4-(4-Метилпиперазин-1-илметилфенил)метанол. К смеси LAH (36 г, 0,957 моль) в сухом ТГФ (1750 мл) в атмосфере N2 при 0 С по каплям добавляли N-(4-метоксикарбонилбензил)бромид (150 г, 0,638 моль) в сухом ТГФ (250 мл). Смесь перемешивали в течение ночи при комнатной температуре в атмосфере N2, а затем реакцию гасили 10% водным раствором NaOH. Твердое вещество отфильтровывали и фильтрат концентрировали. Остаток растворяли в ДХМ(1 л) и промывали водой. После выпаривания растворителя получалиN-метил(4-гидроксиметилбензил)пиперазин (96 г, 73%) в виде светло-желтой жидкости. М+(ЕС): 221,2; 1 Н ЯМР (ДМСО-d6)7,26-7,19 (м, 4 Н), 5,11 (т, J=5,65 Гц, 1 Н), 4,45 (д, J=5,65 Гц, 2 Н), 3,40 (с, 2 Н),-9 009682 3,39-2,20 (м, 8 Н), 2,12 (с, 3H). Аналогичным образом могут быть получены нижеследующие промежуточные соединения. 3-(4-Метилпиперазин-1-илметилфенил)метанол. 1 Н ЯМР (ДМСО-d6)7,27-7,11 (м, 4 Н), 5,17-5,13 (м, 1 Н), 4,48-4,46 (м, 2 Н), 3,41 (с, 2 Н), 2,41-2,21 (м,8 Н), 2,13 (с, 3H). трет-Бутиловый эфир 4-(4-гидроксиметилбензил)пиперазин-1-карбоновой кислоты. М+(ЕС): 307,2; 1 Н ЯМР (ДМСО-d6)7,27-7,21 (м, 4 Н), 5,12 (т, J=5,65 Гц, 1 Н), 4,46 (д, J=5,65 Гц, 2 Н), 3,43 (с, 2 Н),3,28 (ушир.т, 4 Н), 2,27 (т, J=4,9 Гц, 4 Н), 1,40 (с, 9 Н). 4-[(4-Этилпиперазин-1-ил)метил]фенилметанол.Y=78%, M+(EC): 297. Пример 1. Получение 1,3-бензотиазол-2-ил[2-(4-[(4-метилпиперазин-1-ил)метил]бензилокси)пиримидин-4-ил]ацетонитрила (тримезилатной соли), см. схему 2. К суспензии NaH (60% в масле, 1,68 г, 69,75 ммоль) в сухом ДМА (80 мл) добавляли раствор 4-(4-метилпиперазин-1-илметилфенил)метанола (соединение формулы (V) на схеме 2) (7,68 г,34,88 ммоль) в сухом ДМА (80 мл). Полученную суспензию перемешивали при комнатной температуре в течение 1 ч в инертной атмосфере. Затем по каплям добавляли раствор соединения IV (5 г, 17,44 ммоль) в ДМА (80 мл) и суспензию перемешивали при 100 С в инертной атмосфере. Через 4 ч реакционную смесь охлаждали и реакцию гасили добавлением воды. Растворители выпаривали и остаток растворяли в воде (100 мл). Затем для захвата остаточного масла из NaH добавляли 10 мл EtOAc и циклогексана и раствор хранили при 4 С в течение 1 дня. Образовавшийся осадок отфильтровывали и промывали водой до тех пор, пока его pH не становился нейтральным, а затем циклогексаном, в результате чего получали 6,17 г неочищенного основания. 3,5 г этого неочищенного основания растворяли в воде (125 мл) и добавляли 1,25 мл метансульфоновой кислоты. Раствор лиофилизировали и получали оранжево-желтое твердое вещество, которое промывали ACN и сушили в вакууме при 30 С с получением 4,99 г (выход = 66%) указанного в заголовке соединения в виде желтого порошка.M-(ESI): 469,1; M+(ESI): 471,16; ВЭЖХ (условия b, участок максимума)%, время выдержки 2,01 мин. 1 Н ЯМР (ДМСО-d6)10,30 (очень ушир.с, 1 Н), 8,06-8,03 (м, 2 Н), 7,82 (д, J=8,3 Гц, 1 Н), 7,76 (д,3=7,9 Гц, 2 Н), 7,69 (д, J=7,9 Гц, 2 Н), 7,56-7,51 (м, 1 Н), 7,40-7,35 (м, 1 Н), 6,88 (ушир.д, 1 Н), 5,82 (с, 2 Н),4,52 (с, 2 Н), 3,85-3,57 (м, 4 Н), 3,48-3,26 (м, 4 Н), 2,95 (с, 3H), 2,48 (с, 9 Н). Пример 2. Получение 1,3-бензотиазол-2-ил[2-(4-[(4-бензилпиперазин-1-ил)метил]бензилокси)пиримидин-4-ил]ацетонитрила (2Mes). Указанное в заголовке соединение получали в соответствии с процедурой, описанной выше в примере 1, за исключением того, что вместо 4-(4-метилпиперазин-1-илметилфенил)метанола использовали 4-(4-бензилпиперазин-1-илметилфенил)метанол.Y: 42%; М-(ESI): 545,7; М+(ESI): 547,2; ВЭЖХ (условия b, участок максимума) 99,8%, время выдержки 2,52 мин. 1 Н ЯМР (ДМСО-d6)7,95-7,93 (м, 2 Н), 7,73 (д, J=7,9 Гц, 1 Н), 7,67-7,64 (м, 2 Н), 7,56-7,40 (м, 8 Н),7,29-7,24 (м, 1 Н), 6,75 (ушир.д, 1 Н), 5,73 (с, 2 Н), 4,45-4,15 (м, 4 Н), 3,60-3,30 (м, 4 Н), 3,25, 2,90 (м, 4 Н). Пример 3. Получение (3H-бензотиазол-2-илиден)-2-[4-(4-этилпиперазин-1-илметил)бензилокси]пиримидин-4-илацетонитрила. Указанное в заголовке соединение получали в соответствии с процедурой, описанной выше в примере 1, за исключением того, что вместо 4-(4-метилпиперазин-1-илметилфенил)метанола использовали 4-[(4-этилпиперазин-1-ил)метил]фенилметанол.Y: 83%; М+(ES): 485,18; ВЭЖХ (условия b, участок максимума) 97,8%, время выдержки 2,06 мин. 1 Н ЯМР (ДМСО-d6)7,95 (д, J=7,9 Гц, 1 Н), 7,90 (ушир.д, 1 Н), 7,74 (д, J=7,9 Гц, 1 Н), 7,67 (д,J=7,9 Гц, 2 Н), 7,58 (д, J=7,9 Гц, 1 Н), 7,45-7,40 (м, 1 Н), 7,30-7,24 (м, 1 Н), 6,73 (ушир.д, 1H), 5,73 (с, 2H),4,32 (с, 2 Н), 4,42-4,23 (м, 2 Н), 3,76-3,38 (м, 4 Н), 3,32-2,89 (м, 4 Н), 1,21 (т, J=7,1 Гц, 3H). Пример 4. Получение (3H-бензотиазол-2-илиден)-(2-4-[4-(2-метоксиэтил)пиперазин-1-илметил]бензилоксипиримидин-4-ил)ацетонитрила (3TFA). Указанное в заголовке соединение получали в соответствии с процедурой, описанной выше в примере 1, за исключением того, что вместо 4-(4-метилпиперазин-1-илметилфенил)метанола использовалиY: 33%; М+(ES): 515,06; ВЭЖХ (условия b, участок максимума) 99,5%, время выдержки 2,10 мин. 1 Н ЯМР (ДМСО-d6)7,93 (д, J=7,9 Гц, 1 Н), 7,87 (ушир.д, 1 Н), 7,74 (д, J=8,3 Гц, 1 Н), 7,63 (д,J=7,9 Гц, 2 Н), 7,50 (д, J=7,9 Гц, 2 Н), 7,44-7,39 (м, 1 Н), 7,28-7,23 (м, 1 Н), 6,70 (ушир.д, 1 Н), 5,71 (с, 2 Н),4,10 (с, 2 Н), 3,63-3,60 (м, 2 Н), 3,50-2,90 (м, 13 Н). Пример 5. Получение 1,3-бензотиазол-2-ил(2-[4-(пиперазин-1-илметил)бензил]оксипиримидин-4 ил)ацетонитрила (3TFA). Указанное в заголовке соединение получали в соответствии с процедурой, описанной выше в примере 1, за исключением того, что вместо 4-(4-метилпиперазин-1-илметилфенил)метанола использовали 4-(4-Вос-пиперазин-1-илметилфенил)метанол. Таким образом было получено Boc-защищенное неочищeнное основание.Boc-защищенное неочищенное основание растворяли в смеси ДХМ/TFA (9:1) и перемешивали в течение 2 ч при комнатной температуре. ДХМ выпаривали при комнатной температуре. Остаток растирали с эфиром, а затем отфильтровывали и сушили в вакууме при комнатной температуре в течение ночи. После очистки препаративной ВЭЖХ чистые фракции собирали и лиофилизировали с получением 3,03 гY: 34%; М-(ES): 455,2; М+(ES): 457,4; ВЭЖХ (условия b, участок максимума) 99,7%, время выдержки 1,98 мин. 1 Н ЯМР (ДМСО-d6)9,00 (ушир.с, 1 Н), 7,93 (д, J=7,6 Гц, 1 Н), 7,87 (ушир.д, 1 Н), 7,74 (д, J=7,9 Гц,1 Н), 7,63 (д, J=7,9 Гц, 2 Н), 7,51 (д, J=7,9 Гц, 2 Н), 7,45-7,39 (м, 1 Н), 7,28-7,23 (м, 1 Н), 6,72 (д, 7=6,4 Гц,1 Н), 5,71 (с, 2 Н), 4,10 (с, 2 Н), 3,32-3,18 (м, 4 Н), 3,13-2,92 (м, 4 Н). Пример 6. Получение 1,3-бензотиазол-2-ил[2-(4-[(4-формилпиперазин-1-ил)метил]бензилокси)пиримидин-4-ил]ацетонитрила (2TFA). Неочищенное основание со снятой Вос-группой, полученнoe, как описано в примере 3 (0,6 г,1,31 ммоль), суспендировали в 15 мл метилформиата в герметично закрытом сосуде. Реакционную смесь перемешивали при 40 С в течение 15 дней, а затем охлаждали до комнатной температуры. Образовавшийся осадок отфильтровывали, а затем промывали водой и неочищенный продукт очищали препаративной ВЭЖХ. Чистые фракции собирали и лиофилизировали с получением 0,26 г указанного в заголовке соединения в виде желтого порошка.Y: 28%; М-(ES): 483,3; M+(ES): 485,5; ВЭЖХ (условия b, участок максимума) 99,7%, время выдержки 2,18 мин. 1 Н ЯМР (ДМСО-d6)9,95 (ушир.с, 1 Н), 8,03 (с, 1 Н), 7,93 (д, J=7,9 Гц, 1 Н), 7,96-7,84 (очень ушир.д,1 Н), 7,73 (д, J=7,9 Гц, 1 Н), 7,68 (д, J=7,9 Гц, 2 Н), 7,54 (д, J=7,9 Гц, 2 Н), 7,47-7,40 (м, 1 Н), 7,29-7,24 (м,1 Н), 6,73 (ушир.д, 1 Н), 5,73 (с, 2 Н), 4,36 (с, 2 Н), 4,05-2,80 (м, 8 Н). Пример 7. Получение (2-4-[4-(2-аминоацетил)пиперазин-1-илметил]бензилоксипиримидин-4-ил)(3H-бензотиазол-2-илиден)ацетонитрила (2Mes) (3TFA). К ДМА-раствору (40 мл) неочищенного продукта со снятой Вос-группой (2,9 г, 3,65 ммоль), полученного, как описано в примере 5, добавляли Amberlyst A21 (0,7 г, 3,76 ммоль) и раствор перемешивали при комнатной температуре в течение 20 мин. Затем смолу отфильтровывали и фильтрат добавляли к раствору Вос-глицина (0,74 г, 4 ммоль), HOBt (0,73 г, 5,47 ммоль), EDC (1,05 г, 5,47 ммоль) и DIPEA(1,9 г, 14,6 ммоль) в ДМА (30 мл). Полученный раствор перемешивали в течение ночи при комнатной температуре. После выпаривания растворителя при пониженном давлении полученный остаток суспендировали в смеси МеОН и EtOAc и оставляли на ночь при 4 С. Осадок отфильтровывали, промывалиEtOAc и сушили в вакууме при 40 С с получением 1,04 г указанного в заголовке соединения в виде желтого твердого вещества.(с, 2 Н), 3,73-3,10 (м, 8 Н). Пример 8. Получение [2-(4-[(4-ацетилпиперазин-1-ил)метил]бензилокси)пиримидин-4-ил](1,3 бензотиазол-2-ил)ацетонитрила (2TFA). К ДМА-раствору (6 мл) неочищенного продукта со снятой Вос-группой (0,3 г, 0,66 ммоль), полученного, как описано в примере 5, добавляли триэтиламин (0,09 мл, 0,66 ммоль) и ацетилхлорид (0,09 мл,1,31 ммоль), и раствор перемешивали при комнатной температуре в течение 5 мин. Реакционную смесь концентрировали почти досуха и полученный остаток очищали препаративной ВЭЖХ. Чистые фракции собирали и лиофилизировали с получением 0,1 г (21%) указанного в заголовке соединения в виде желтого порошка.(ушир.д, 1 Н), 5,73 (с, 2 Н), 4,36 (с, 2 Н), 4,02-3,87 (м, 1 Н), 3,42-2,75 (м, 7 Н), 2,01 (с, 3H). Пример 9. Получение диметиламида 4-(4-4-[(3H-бензотиазол-2-илиден)цианометил]пиримидин-2 илоксиметилбензил)пиперазин-1-карбоновой кислоты (2TFA). К ДМА-раствору (12 мл) неочищенного продукта со снятой Вос-группой (0,5 г, 0,63 ммоль), полученного, как описано в примере 5, добавляли Amberlyst A21 (1,12 г, 5,35 ммоль) и диметилкарбамоилхлорид (0,12 мл, 1,31 ммоль), и раствор перемешивали при 0 С в течение 1 ч. Поскольку продукт не образовывался, то раствор нагревали до комнатной температуры в течение 12 дней до полного исчезновения исходного соединения. Смолу Amberlyst отфильтровывали и к фильтрату добавляли воду. Поскольку осадок не образовывался, то растворители выпаривали при пониженном давлении и остаток растворяли в воде и лиофилизировали. Полученный остаток очищали препаративной ВЭЖХ. Чистые фракции собирали и лиофилизировали с получением 85 мг указанного в заголовке соединения в виде желтого твердого вещества.Y: 18%; М+(ES): 528,09; ВЭЖХ (условия b, участок максимума) 98,9%, время выдержки 2,32 мин. 1 Н ЯМР (ДМСО-d6)9,82 (очень ушир.с, 1 Н), 7,94-7,86 (м, 2 Н), 7,73 (д, J=7,9 Гц, 1 Н), 7,67 (д,J=7,9 Гц, 2 Н), 7,55 (д, J=7,9 Гц, 2 Н), 7,44-7,39 (м, 1 Н), 7,28-7,23 (м, 1 Н), 6,72 (ушир.д, 1 Н), 5,73 (с, 2 Н),4,37 (с, 2 Н), 3,65-3,48 (м, 2 Н), 3,32-3,18 (м, 2 Н), 3,11-2,90 (м, 4 Н), 2,74 (с, 6 Н). Аналогичным образом получали нижеследующее соединение. Метиловый эфир 4-(4-4-[(3H-бензотиазол-2-илиден)цианометил]пиримидин-2-илоксиметилбензил)пиперазин-1-карбоновой кислоты (2TFA).(с, 3H), 3,60-2,94 (м, 6 Н). Пример 10. Получение (3H-бензотиазол-2-илиден)-2-[4-(4-[1,2,4]оксадиазол-3-илметилпиперазин 1-илметил)бензилокси]пиримидин-4-илацетонитрила (2TFA). К ДМА-раствору (10 мл) неочищенного продукта со снятой Вос-группой (0,5 г, 0,63 ммоль), полученного, как описано в примере 5, добавляли Amberlyst A21 (0,7 г, 3,76 ммоль), и раствор перемешивали при комнатной температуре в течение 20 мин. Смолу отфильтровывали и к фильтрату добавляли 3-(хлорметил)-1,2,4-оксадиазол и карбонат калия. Полученную суспензию перемешивали при комнатной температуре в течение 48 ч. Полное исчезновение исходного соединения наблюдалось после проведения реакции в течение 3 дней при перемешивании при комнатной температуре и добавлении 2,4 экв. 3-(хлорметил)-1,2,4-оксадиазола. После фильтрации и удаления растворителя при пониженном давлении полученный остаток очищали препаративной ВЭЖХ. Чистые фракции собирали и лиофилизировали с получением 110 мг указанного в заголовке соединения в виде желтого твердого вещества.(д, J=7,9 Гц, 2 Н), 7,44-7,39 (м, 1 Н), 7,27-7,22 (м, 1 Н), 6,72 (ушир.д, 1 Н), 5,72 (с, 2 Н), 4,32 (с, 2 Н), 3,85 (с,2 Н), 3,34-3,17 (м, 2 Н), 3,12-2,88 (м, 4 Н), 2,58-2,41 (м, 2 Н). Аналогичным образом получали нижеследующее соединение.Y: 16%; М+(ES): 513,95; ВЭЖХ (условия b, участок максимума) 93%, время выдержки 2,08 мин. 1 Н ЯМР (ДМСО-d6)7,93 (д, J=7,9 Гц, 1 Н), 7,88 (ушир.д, 1 Н), 7,73 (д, J=7,9 Гц, 1 Н), 7,61 (д,J=7,9 Гц, 2 Н), 7,46 (ушир.д, 2 Н), 7,45-7,40 (м, 1 Н), 7,28-7,23 (м, 1 Н), 6,72 (ушир.д, 1 Н), 5,71 (с, 2 Н), 4,302,65 (м, 12 Н). Пример 11. Получение фармацевтической композиции. В приведенных ниже неограничивающих примерах проиллюстрировано получение репрезентативных фармацевтических композиций настоящего изобретения.- 12009682 Композиция 1. Таблетки. Пиперазинбензотиазоловое соединение формулы (I) в виде сухого порошка смешивают с сухим желатиновым связующим агентом в массовом отношении приблизительно 1:2. Затем добавляют небольшое количество стеарата магния в качестве замасливателя. Смесь формуют в таблетки весом 240-270 мг (содержащие 80-90 мг активного пиперазинбензотиазолового соединения на таблетку) в прессе для таблетирования. Композиция 2. Капсулы. Пиперазинбензотиазоловое соединение формулы (I) в виде сухого порошка смешивают с крахмалом, используемым в качестве разбавителя, в массовом отношении приблизительно 1:1. Затем этой смесью заполняют капсулы с получением капсул весом 250 мг (содержащих 125 мг активного пиперазинбензотиазолового соединения на капсулу). Композиция 3. Жидкость. Пиперазинбензотиазоловое соединение формулы (I), 1250 мг, сахарозу (1,75 г) и ксантановую камедь (4 мг) смешивают, пропускают через сито US10 меш, а затем перемешивают с предварительно полученным раствором микрокристаллической целлюлозы и натрийсодержащей карбоксиметилцеллюлозы (11:89, 50 мг) в воде. Бензоат натрия (10 мг), ароматизатор и краситель разбавляют водой и добавляют, перемешивая, к полученной смеси. Затем добавляют достаточное количество воды до полного объема 5 мл. Композиция 4. Таблетки. Пиперазинбензотиазоловое соединение формулы (I) в виде сухого порошка смешивают с сухим желатиновым связующим агентом в массовом отношении приблизительно 1:2. Затем добавляют небольшое количество стеарата магния в качестве замасливателя. Смесь формуют в таблетки весом 450-900 мг (содержащие 150-300 мг активного пиперазинбензотиазолового соединения) в прессе для таблетирования. Композиция 5. Инъекции. Пиперазинбензотиазоловое соединение формулы (I) растворяют в забуференной стерильной физиологической водной среде для инъекций до концентрации приблизительно 5 мг/мл. Пример 12. Биологические анализы. Анализы соединений настоящего изобретения описаны ниже.a. In vitro-анализ на JNK2 и JNK3. Соединения настоящего изобретения представляют собой ингибиторы JNK, а в частности JNK2 иJNK3. Фосфорилирование с-jun киназами JNK2 и JNK3 может быть определено путем мониторинга включения 33 Р в c-jun в соответствии с протоколом, описанным ниже. Ингибирующую активность соединения настоящего изобретения формулы (I), направленную на фосфорилирование c-jun киназой JNK,определяли путем вычисления фосфорилирующей активности в присутствии или в отсутствие соединений формулы (I). Анализы на JNK3 и/или JNK2 осуществляли в 96-луночных МТТ-планшетах: 0,5 мкг рекомбинантного предварительно активированного GST-JNK3 или GST-JNK2 инкубировали с 1 мкг рекомбинантного биотинилированного GST-c-Jun и 2 мкМ 33-АТР (2 нКи/мкл) в присутствии или в отсутствие соединений формулы (I) и в реакционном объеме 50 мкл, содержащем 50 мМ Трис-HCl, pH 8,0; 10 мМ MgCl2; 1 мМ дитиотреитола и 100 мкМ NaVO4. Инкубирование осуществляли в течение 120 мин при комнатной температуре и прекращали добавлением 200 мкл раствора, содержащего 250 мкг сфер SPA, покрытых стрептавидином (Amersham, Inc.), 5 мМ EDTA, 0,1% Тритона Х-100 и 50 мкМ АТР, в забуференном фосфатом физиологическом растворе. После инкубирования в течение 60 мин при комнатной температуре сферы осаждали путем центрифугирования при 1500 г в течение 5 мин, ресуспендировали в 200 мкл PBS, содержащего 5 мМEDTA, 0,1% Тритона Х-100 и 50 мкМ АТР, и после осаждения сфер, как описано выше, измеряли радиоактивность в сцинтилляционном -счетчике. Ингибирующая концентрация (IC50) тестируемых соeдинений формулы (I) по отношению к JNK3 составляет менее 10 мкМ, а предпочтительно менее 1 мкМ, а более предпочтительно менее 0,25 мкМ.b. Общая ишемия у песчанок. Способность ингибиторов JNK, описанных формулой (I), предотвращать гибель клеток при инсульте может быть оценена в соответствии со следующим протоколом. Билатеральная окклюзия сонной артерии у песчанки представляет собой хорошо известную модель острого ишемического приступа и предусматривает использование относительно простой хирургической техники. Дегенерация нейронов в гиппокампе развивается в течение нескольких дней и часто называется"медленной нейронной гибелью". Кроме того, нейродегенерация наблюдается в гистологических анализах и легко поддается количественной оценке (11). Кроме того, гистологический анализ у песчанок дает картину, аналогичную картине, наблюдаемой в области СА 1 гиппокампа головного мозга человека после остановки сердца. В случае использования песчанок может быть даже проведено наблюдение поведения,такое как тест на запоминание. Тесты такого типа, проводимые для оценки степени выздоровления, труд- 13009682 но осуществить на других моделях, например на крысах, которые обладают гораздо более низкой способностью к обучению (12). Нейропротективный эффект соединений формулы (I) может быть оценен на песчанке в качестве модели общей ишемии в соответствии с нижеописанным протоколом. 1. МетодХирургическая операция. Анестезия изофлураном (0,5-4%). Выделение общей сонной артерии (левой и правой) из ткани. Окклюзия артерий с использованием микрозажимов типа "бульдог" в течение 5 мин. Снятие зажимов (реперфузия) Помещение животных под нагревательной лампой до их просыпания от наркоза. Помещение животных в индивидуальные клетки для животных.Умерщвление животных. Через 7 дней после приступа ишемии (путем декапитации или введения избыточной дозы пентобарбитала). Взятие образцов головного мозга.Проведение гистологического анализа. Замораживание головного мозга в изопентане (-20 С). Приготовление срезов гиппокампа с использованием криомикротома (20 мкм). Окрашивание крезиловым фиолетовым. Оценка поражений (в субобластях СА 1/СА 2 в гиппокампе) с использованием модифицированной шкалы оценок по Герхарду и Боусту (13). 2. Обработка Введение (i.p.) соединения формулы (I) или носителя через 15 мин, 24 и 48 ч после реперфузии (через 5-10 мин после восстановления от наркоза). Стандартный протокол. Использовали всего 40 животных; указанных животных разделяли на 5 групп по 8 животных: группа А: контроль (физиологический раствор); группы B-D: тестируемое соединение вводили в 3 различных дозах (10 мг/кг; 20 мг/кг; 40 мг/кг); группа Е: известное соединение (оротовая кислота 3300 мг/кг, i.р.). Для тестируемого соединения, описанного в примере 1 (т.е. для 1,3-бензотиазол-2-ил[2-(4-[(4 метилпиперазин-1-ил)метил]бензилокси)пиримидин-4-ил]ацетонитрила) и используемого в вышеупомянутом анализе при концентрации 40 мг/кг, определяли уровень ингибирования гибели нервных клеток,который составлял примерно 60%.c. Оценка прохождения через ГЭБ: взятие проб головного мозга и плазмы Соединения настоящего изобретения могут быть использованы для лечения и/или профилактики церебральных ишемических расстройств или расстройств ЦНС. В частности, соединения настоящего изобретения обладают хорошей способностью проходить через гематоэнцефалический барьер (ГЭБ). Способность соединений формул (I) или (II) проходить через ГЭБ может быть оценена в соответствии с протоколом, описанным ниже. Целью этого анализа является количественная оценка тестируемых соединений формул (I) или (II) в головном мозге крыс после внутривенного (i.v.) введения. Шесть самцов крыс Crl:CD(SD)Br Sprague-Dawley (в возрасте примерно 8 недель и весом примерно 300 г) разделяли на три нижеследующие группы. Группа 1. 2 животных для i.v. введения (10 мг/кг тестируемого соединения формулы (I) в 0,9% NaCl для инъекций). Тестируемое соединение вводили в виде разовой дозы (схема введения лекарственного средства). Образцы брали через 0,25 ч после умерщвления животных.- 14009682 Группа 2. 2 животных для i.v. введения (10 мг/кг тестируемого соединения формулы (I) в 0,9% NaCl для инъекций). Тестируемое соединение вводили в виде разовой дозы (схема введения лекарственного средства). Образцы брали через 0,5 ч после умерщвления животных. Группа 3. 2 животных для i.v. введения (10 мг/кг тестируемого соединения формулы (I) в 0,9% NaCl для инъекций). Тестируемое соединение вводили в виде разовой дозы (схема введения лекарственного средства). Образцы брали через 1 ч после умерщвления животных. Перед каждым умерщвлением животных в соответствии с указанными схемами животных соответствующей группы подвергали глубокой анестезии диэтиловым эфиром. Кровь для соответствующих проб собирали в гепаринизированные пробирки и центрифугировали для удаления клеток крови с получением плазмы. Пробы плазмы, полученные в соответствии с каждой схемой отбора проб (т.е. t=0,25 ч,0,5 ч, 1 ч) от крыс каждой группы после введения им тестируемого соединения формулы (I), объединяли с получением 1 пула на данное время отбора проб для каждой группы. Затем крыс умерщвляли путем кровопускания. Для взятия образцов головного мозга у умерщвленных животных брали весь головной мозг (большой мозг и мозжечок). Головной мозг, полученный от двух животных в соответствии с каждой схемой взятия образцов (т.е. t=0,25 ч, 0,5 ч, 1 ч после введения соединения), объединяли для получения одного пула на данное время взятия образцов. Каждый пул гомогенизировали в смеси растворителей (ацетонитрил/метанол/диметилсульфоксид, 50:48:1 по объему), центрифугировали и супернатант анализировали на тестируемое соединение. Концентрацию в пробах плазмы и в гомогенатах головного мозга количественно оценивали аналитическим методом, проводимым с помощью ВЭЖХ-МС/МС, специально разработанным для данного соединения. Тестируемым соединением, используемым в данном анализе, является соединение, описанное в примере 1 (т.е. 1,3-бензотиазол-2-ил[2-4-[(4-метилпиперазин-1-ил)метил]бензилокси)пиримидин-4 ил]ацетонитрил). Концентрации тестируемого соединения в пробах плазмы и в образцах гомогената головного мозга,проанализированные с помощью ВЭЖХ-МС/МС, представлены в таблице. Концентрации тестируемого соединения в плазме и в головном мозге (в виде соли три-TFA), обнаруженные после внутривенного введения в дозе 10 мг/кг Как видно из таблицы, тестируемое соединение обладает способностью к прохождению в головной мозг в значительных концентрациях и в течение длительного времени. Библиография 1. Davis, Roger J. Signal Transduction by the JNK Group of MAP Kinases. Cell, 2000, 103: 239-252. 2. Gupta, S. et al. Selective interaction of JNK protein kinase isoforms with transcription factors. The а также их таутомеры, геометрические изомеры, оптически активные формы в виде энантиомеров, диастереомеры и их рацематы, а также их фармацевтически приемлемые соли,где R выбран из группы, включающей или состоящей из Н;C1-С 6 алкильной группы, имeющей арильный заместитель, означающий ненасыщенную ароматическую карбоциклическую группу с 6-14 атомами углерода; гетероарила, где гетероарил означает 5-6-членную моноциклическую гетероароматическую группу,содержащую до трех гетероатомов, выбранных из О или N; ацила, включающего группу -С(О), в которой углерод карбонильной группы замещенC1-С 6 алкилом; С 1-С 5 алкильной группы, имeющей алкоксизаместитель, включающий группу -O-, где в которой кислород замещен C1-С 6 алкильной группой;aлкоксикарбонила, включая -С(О)О, в которой кислород, который не является кислородом карбонильной группы, замещен C1-С 6 алкильной группой;aминоацетильной группы; аминокарбонила, где аминокарбонил включает группу -C(O)N, где азот дважды замещен и каждое замещение независимо выбирают из водорода или C1-С 6 алкила;C1-С 6 алкильнoй группы, имeющей аминокарбонильный заместитель, где аминокарбонил включает группу -C(O)N, где азот дважды замещен и каждое замещение независимо выбирают из водорода или C1-С 6 алкила; формила;n равно целому числу от 1 до 3. 2. Пиперазинбензотиазоловое производное по п.1, где R выбран из группы, состоящей из Н,C1-С 3 алкила,аминокарбoнила, где аминокарбонильный азот дважды замещен C1-С 6 алкилом;C1-С 6 алкила, имеющего aминокарбонильный заместитель. 3. Пиперазинбензотиазоловое производное по п.2, где R представляет собой Н, C1-С 3 алкил или С 1-С 5 алкил, имеющий C1-C6aлкоксизаместитeль. 4. Пиперазинбензотиазоловое производное по п.2, где R представляет собой метил или этил. 5. Пиперазинбензотиазоловое производное по любому из предыдущих пунктов, где n равно 1. 6. Пиперазинбензотиазоловое производное по любому из предыдущих пунктов, выбранное из группы, состоящей из 1,3-бензотиазол-2-ил[2-(4-[(4-метилпиперазин-1-ил)метил]бензилокси)пиримидин-4 ил]ацетонитрила,- 16009682 1,3-бензотиазол-2-ил[2-(4-[(4-бензилпиперазин-1-ил)метил]бензилокси)пиримидин-4-ил]ацетонитрила,1,3-бензотиазол-2-ил(2-[4-(пиперазин-1-илметил)бензил]оксипиримидин-4-ил)ацетонитрила,1,3-бензотиазол-2-ил[2-(4-[(4-формилпиперазин-1-ил)метил]бензилокси)пиримидин-4-ил]ацетонитрила,[2-(4-[(4-ацетилпиперазин-1-ил)метил]бензилокси)пиримидин-4-ил](1,3-бензотиазол-2-ил)ацетонитрила,(3H-бензотиазол-2-илиден)-2-[4-(4-[1,2,4]оксадиазол-3-илметилпиперазин-1-илметил)бензилокси]пиримидин-4-илацетонитрила,метилового эфира [4-(4-4-[(3H-бензотиазол-2-илиден)цианометил]пиримидин-2-илоксиметилбензил)пиперазин]-1-карбоновой кислоты,2-[4-(4-4-[(3H-бензотиазол-2-илиден)цианометил]пиримидин-2-илоксиметилбензил)пиперазин-1 ил]ацетамида,(2-4-[4-(2-аминоацетил)пиперазин-1-илметил]бензилоксипиримидин-4-ил)-(3H-бензотиазол-2 илиден)ацетонитрила,метилового эфира [4-(4-4-[(3H-бензотиазол-2-илиден)цианометил]пиримидин-2-илоксиметилбензил)пиперазин-1-ил]уксусной кислоты,(3H-бензотиазол-2-илиден)-(2-4-[4-(2-метоксиэтил)пиперазин-1-илметил]бензилоксипиримидин 4-ил)ацетонитрила,диметиламида 4-(4-4-[(3H-бензотиазол-2-илиден)цианометил]пиримидин-2-илоксиметилбензил)пиперазин-1-карбоновой кислоты,(3H-бензотиазол-2-илиден)-2-[4-(4-этилпиперазин-1-илметил)бензилокси]пиримидин-4-илацетонитрила и(3H-бензотиазол-2-илиден)-(2-4-[4-(2-гидроксиэтил)пиперазин-1-илметил]бензилоксипиримидин 4-ил)ацетонитрила. 7. Применение пиперазинбензотиазолового производного по любому из пп.1-6 в получении лекарственного средства для лечения церебральных ишемических расстройств или расстройств ЦНС. 8. Способ получения пиперазинбензотиазолового производного по любому из пп.1-6 формулы (I) где R, R1 и n определены выше,включающий взаимодействие соединения формулы (IV)
МПК / Метки
МПК: A61K 31/506, A61P 25/28, C07D 417/14, C07D 417/06
Метки: средств, качестве, расстройств, церебральных, лечения, используемые, ишемических, цнс, пиперазинбензотиазолы
Код ссылки
<a href="https://eas.patents.su/18-9682-piperazinbenzotiazoly-ispolzuemye-v-kachestve-sredstv-dlya-lecheniya-cerebralnyh-ishemicheskih-rasstrojjstv-ili-rasstrojjstv-cns.html" rel="bookmark" title="База патентов Евразийского Союза">Пиперазинбензотиазолы, используемые в качестве средств для лечения церебральных ишемических расстройств или расстройств цнс</a>
Предыдущий патент: Таблетка дерамцикланфумарата и способ её приготовления
Следующий патент: Состав для точечного (наружного) нанесения на пораженный участок на основе производного нодулиспориновой кислоты для защиты от паразитов
Случайный патент: Средство крепления выводов электрических резистивных элементов












