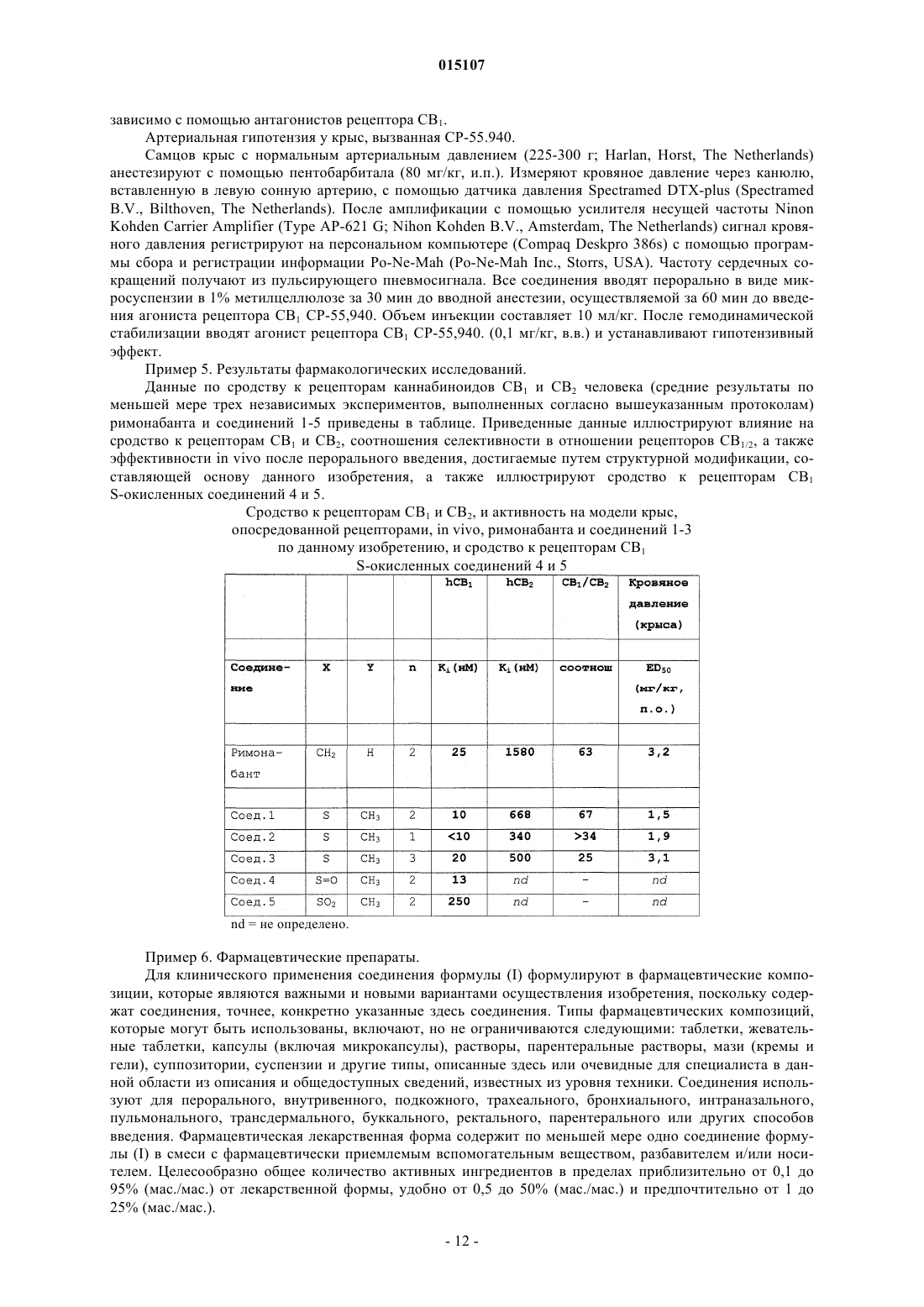
Серосодержащие производные пиразола в качестве избирательных антагонистов рецептора каннабиноидов св1
Номер патента: 15107
Опубликовано: 30.06.2011
Авторы: Ван Влиет Бернард Й., Крюсе Корнелис Г., Ланге Йозефус Х.М.
Формула / Реферат
1. Соединения общей формулы (I)
где R1означает Н, Cl или Br;
R2 означает Cl или Br;
X означает атом серы, сульфоксидную (S=O) или сульфоновую (SO2) группу;
Y означает метильную или этильную группу;
n может иметь значения 1, 2 или 3,
таутомеры, стереоизомеры указанных соединений и изотопно меченые соединения формулы (I), а также фармакологически приемлемые соли, гидраты и сольваты указанных соединений формулы (I) и их таутомеры, стереоизомеры или изотопно меченые аналоги.
2. Соединения по п.1 общей формулы (I), где R1 и R2означают Cl; Y означает метильную группу; n равно 1 или 2 и X имеет значения, указанные в п.1.
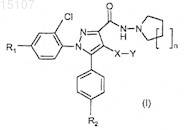
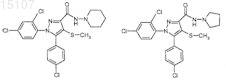
3. Соединения по п.1, представленные формулами:
4. Фармацевтическая композиция, проявляющая свойства избирательного антагониста рецептора каннабиоидов CB1, включающая в дополнение к фармацевтически приемлемому носителю и/или по меньшей мере одному фармацевтически приемлемому вспомогательному веществу фармакологически активное количество по меньшей мере одного соединения по п.1 или соли указанного соединения в качестве активного ингредиента.
5. Фармацевтическая композиция по п.4, включающая также по меньшей мере одно дополнительное терапевтическое средство.
6. Способ получения фармацевтических композиций по п.4 или 5, отличающийся тем, что соединение по п.1 переводят в удобную для введения форму.
7. Применение соединения по п.1 в качестве лекарственного средства для лечения нарушений, связанных с каннабиноидной нейропередачей.
8. Соединения общей формулы (IV)
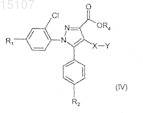
где R1, R2 и Y имеют указанные по п.1 значения;
R4 означает атом водорода, лития, калия или натрия и
X означает атом серы, сульфоксидную (S=O) группу или сульфоновую (SO2) группу.
9. Соединения общей формулы (V)
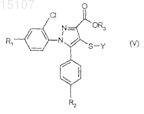
где R1, R2, X и Y имеют указанные по п.1 значения и
R3 означает метильную, этильную или н-пропильную группу.
10. Применение соединений по п.1 для получения фармацевтической композиции для лечения таких нарушений, как психоз, тревожность, депрессия, дефицит внимания, нарушения памяти, расстройства познавательной способности, нарушения аппетита, ожирение, в частности ювенильное ожирение и ожирение, вызванное приемом лекарственных средств, зависимость, влечение, лекарственная зависимость и неврологические нарушения, такие как нейродегенеративные расстройства, деменция, дистония, мышечная спастичность, тремор, эпилепсия, рассеянный склероз, травматическое повреждение мозга, болезнь Паркинсона, болезнь Альцгеймера, болезнь Гентингтона, синдром Туретта, церебральная ишемия, апоплексия мозга, черепно-мозговая травма, инсульт, повреждение спинного мозга, нейровоспалительные расстройства, склероз (уплотнение гемолитической бляшки), вирусный энцефалит, нарушения, вызванные демиелинизацией; а также для лечения болевых расстройств, включая невропатические болевые расстройства, и других заболеваний, связанных с каннабиноидной нейропередачей, включая лечение таких нарушений, как септический шок, глаукома, рак, диабет, рвота, тошнота, астма, респираторные заболевания, желудочно-кишечные расстройства, язвенные болезни желудка, диарея, сексуальные расстройства и сердечно-сосудистые расстройства.
11. Применение по п.10 соединения по п.1 для получения фармацевтической композиции для лечения нарушений аппетита, в частности ожирения, ювенильного ожирения и ожирения, вызванного приемом лекарственных средств.
12. Применение по п.11, где указанная фармацевтическая композиция также содержит по меньшей мере один ингибитор липазы.
13. Применение по п.12, отличающееся тем, что указанным ингибитором липазы является орлистат или липстатин.
14. Способ получения соединений по п.1, в котором производное 1-арил-2-алкилсульфанилэтанона формулы (VIII)
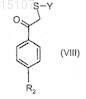
где R2и Y имеют значения, указанные в п.1,
последовательно подвергают
взаимодействию с производным эфира щавелевой кислоты общей формулы (IX)
![]()
где R3означает линейную C1-3-алкильную группу (метил, этил или н-пропил),
в присутствии основания, такого как алканоат натрия (NaOR3), в инертном безводном органическом растворителе, таком как метанол, этанол или пропанол, и
последующей реакции с производным арилгидразина общей формулы (X)
![]()
где R1имеет значение, указанное в п.1,
с получением сложного эфира общей формулы (V)
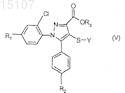
где R1, R2 и Y имеют значения, указанные в п.1; и
R3означает линейную C1-3-алкильную группу.
Текст
СЕРОСОДЕРЖАЩИЕ ПРОИЗВОДНЫЕ ПИРАЗОЛА В КАЧЕСТВЕ ИЗБИРАТЕЛЬНЫХ АНТАГОНИСТОВ РЕЦЕПТОРА КАННАБИНОИДОВ СВ 1 Данное изобретение касается серосодержащих производных пиразола и соответствующих Sокисленных активных метаболитов в качестве избирательных антагонистов рецептора каннабиноидов CB1, обладающих высокой селективностью в отношении субтипа рецептора CB1/СВ 2,способов получения указанных соединений, новых промежуточных соединений, полезных для синтеза указанных производных пиразола, фармацевтических композиций, включающих одно или более указанных производных пиразола в качестве активных ингредиентов, а также применения указанных фармацевтических композиций для лечения психических и неврологических расстройств. Соединения имеют общую формулу (I), где символы имеют значения, приведенные в описании изобретения. 015107 Область техники, к которой относится изобретение Данное изобретение касается серосодержащих производных пиразола и соответствующихS-окисленных активных метаболитов в качестве избирательных антагонистов рецептора каннабиноидовCB1, обладающих высокой селективностью в отношении субтипа рецептора CB1/CB2; способов получения указанных соединений; новых промежуточных соединений, полезных для синтеза указанных производных пиразола; фармацевтических композиций, включающих одно или более указанных производных пиразола в качестве активных ингредиентов, а также применения указанных фармацевтических композиций для лечения психических и неврологических расстройств. Соединения имеют общую формулу (I) где символы имеют значения, приведенные в описании изобретения. Обоснование изобретения Производные пиразола, обладающие сродством к рецептору СВ, известны из ряда патентных заявокMatthews, 1999). Антагонисты рецептора CB1, в частности SR141716A, известный в настоящее время как римонабант, и потенциальные терапевтические применения указанных антагонистов являются предметом ряда обзорных публикаций (Boyd, 2005; Sorbera, 2005; Carai, 2005; Lange, 2004, 2005; Hertzog, 2004;Smith, 2005; Thakur, 2005; Padgett, 2005; Muccioli, 2005, 2006; Reggio, 2003; Adam, 2006). Вышеупомянутые патентные заявки и статьи раскрывают ряд рецепторных антагонистов, избирательных в отношенииCB1/СВ 2 субтипа рецептора. Рецепторы каннабиноидов (СВ) являются частью эндоканнабиноидной системы, которая вовлечена в неврологические, психические, сердечно-сосудистые, желудочно-кишечные,репродуктивные расстройства и расстройства пищевого поведения, а также онкологические (DePetrocellis, 2004; Di Marzo, 2004; Lambert, 2005; Vandevoorde, 2005; Centonze, 2007). Модуляторы рецептора CB1 имеют несколько возможных терапевтических применений, например как лекарственные средства для лечения таких нарушений, как психоз, тревожность, депрессия, дефицит внимания, нарушения памяти, расстройства познавательной способности, нарушения аппетита, ожирение, зависимость, влечение, лекарственная зависимость, нейродегенеративные расстройства, деменция, дистония, мышечная спастичность, тремор, эпилепсия, рассеянный склероз, травматическое повреждение мозга, инсульт, болезнь Паркинсона, болезнь Альцгеймера, болезнь Гентингтона, синдром Туретта, церебральная ишемия,апоплексия мозга, черепно-мозговая травма, повреждение спинного мозга, нейровоспалительные расстройства, уплотнение гемолитической бляшки, вирусный энцефалит, нарушения, вызванные демиелинизацией, а также для лечения таких нарушений, как болевые расстройства, включая невропатические болевые расстройства, септический шок, глаукома, диабет, рак, рвота, тошнота, желудочно-кишечные расстройства, язвенные болезни желудка, диарея, сексуальные расстройства, расстройства контроля над побуждениями и сердечно-сосудистые расстройства. Рецепторы СВ 2 преимущественно наблюдаются в иммунной системе (в клетках селезенки, миндалин, в иммуноцитах), а также в микроглиальных клетках и астроцитах и недавно также были обнаружены в центральной нервной системе, стволе головного мозга и мозжечке (Van Sickle, 2005; Ashton, 2006). Эффективные модуляторы рецептора СВ 1, имеющие низкое сродство к рецептору СВ 2 (т.е. соединения, обладающие высокой селективностью в отношении субтипа рецептора CB1/CB2), являются предпочтительными соединениями по сравнению с неизбирательными или слабо избирательными модуляторами рецепторов каннабиноидов, поскольку лишены нежелательных побочных эффектов, связанных с рецептором СВ 2, таких как иммунологические побочные эффекты или связанные с воспалением побочные эффекты, или влияния на невропатическое восприятие боли. Подробное описание изобретения Цель данного изобретения состоит в дальнейшей разработке орально активных антагонистов рецептора CB1 с высокой селективностью в отношении субтипа рецептора CB1/CB2. Известно, что некоторые производные пиразола формулы (I), где X (см. ниже) означает СН 2-группу,являются антагонистами рецептора CB1. Неожиданно было обнаружено, что замена указанной СН 2-группы на атом серы приводит к соединениям, которые не только являются антагонистами рецептора CB1, избирательными в отношении субтипа рецептора CB1/СВ 2, но являются более эффективными,чем соответствующие несодержащие серу аналоги, исследуемые при пероральном введении в связанном с рецептором CB1 фармакологическом испытании in vivo. Соединения общей формулы (I), где X означает S=O или SO2-группу, могут считаться метаболитами соединений общей формулы (I), где X означает атом серы. Неожиданно было обнаружено, что такие соединения общей формулы (I), где X означает S=O(сульфоксидную) или SO2 (сульфоновую) группу, проявляют также существенное сродство к рецепторуCB1 и, в результате, могут считаться активными S-окисленными метаболитами соединений общей формулы (I), где X означает атом серы. В целом, известно, что образование активных метаболитов повышает эффективность терапевтических средств in vivo. Активные метаболиты общей формулы (I), где X означает S=O или SO2-группу, составляют часть данного изобретения. Цитохром Р 450 является важным эндогенным ферментом, вовлеченным в такие метаболические окисления алкилсульфидов до соответствующих сульфоксидов и сульфонов (Denisov, 2005; Nnane, 2001). Данное изобретение касается соединений общей формулы (I)Y означает метильную или этильную группу;n может иметь значения 1, 2 или 3,и таутомеров, стереоизомеров, пролекарств и N-оксидов указанных соединений и изотопно меченых соединений формулы (I), а также фармакологически приемлемых солей, гидратов и сольватов указанных соединений формулы (I) и их таутомеров, стереоизомеров, пролекарств и N-оксидов или изотопно меченых аналогов. Все сульфоксиды в рамках объема данного изобретения содержат центр хиральности. Изобретение касается рацематов, смесей диастереомеров, а также отдельных стереоизомеров соединений, имеющих формулу (I). Изобретение также касается Е-изомера, Z-изомера и E/Z смесей соединений, имеющих формулу (I). Изобретение, в частности, касается соединений общей формулы (I), в которой R1 и R2 означают Cl;Y означает метильную группу и X имеет вышеуказанные значения; n равно 1 или 2. Еще точнее, изобретение касается соединений, представленных формулами: Благодаря высокой антагонистической или обратной антагонистической активности в отношенииCB1, соединения по данному изобретению полезны для применения в лечении психических расстройств,таких как психоз, тревожность, депрессия, дефицит внимания, нарушения памяти, расстройства познавательной способности, нарушения аппетита, ожирение, в частности ювенильное ожирение и ожирение,вызванное приемом лекарственных средств, зависимость, влечение, лекарственная зависимость, и неврологические нарушения, такие как нейродегенеративные расстройства, деменция, дистония, мышечная спастичность, тремор, эпилепсия, рассеянный склероз, травматическое повреждение мозга, инсульт, болезнь Паркинсона, болезнь Альцгеймера, болезнь Гентингтона, синдром Туретта, церебральная ишемия,апоплексия мозга, черепно-мозговая травма, повреждение спинного мозга, нейровоспалительные расстройства, уплотнение гемолитической бляшки, вирусный энцефалит, нарушения, вызванные демиелинизацией, а также для лечения болевых расстройств, включая невропатические болевые расстройства,других заболеваний, с вовлечением каннабиноидной нейропередачи, включая лечение таких нарушений,как септический шок, глаукома, рак, диабет, рвота, тошнота, астма, респираторные заболевания, желудочно-кишечные расстройства, язвенные болезни желудка, диарея, сексуальные расстройства, расстройства контроля над побуждениями и сердечно-сосудистые расстройства. Модулирующая активность соединений по изобретению в отношении рецептора каннабиноидов делает указанные соединения, в частности, полезными для лечения ожирения, юношеского ожирения и ожирения, вызванного приемом лекарственных средств, в особенности при использовании в комбинации с ингибиторами липазы. Специфическими примерами соединений, которые могут быть использованы в таких комбинированных препаратах, являются (но не в порядке ограничения) ингибитор синтетической липазы орлистат, ингибиторы липазы, выделенные из микроорганизмов, такие как липстатин(из Streptomyces toxytricini), эбелактон В (из Streptomyces aburaviensis), синтетические производные таких соединений, а также экстракты из растений, которые как известно обладают ингибирующей активностью в отношении липазы, например, экстракты из Alpinia officinarum или соединения, выделенные из таких экстрактов, типа 3-метилэфиргалангина (из А.officinarum). Изобретение также включает в себя следующее: фармацевтическую композицию для лечения, например, нарушения или состояния, потенциально излечиваемого блокированием рецепторов каннабиноидов-CB1, где композиция включает соединение формулы (I), или фармацевтически приемлемую соль указанного соединения и фармацевтически приемлемый носитель; способ лечения нарушения или состояния, потенциально излечиваемого блокированием рецепторов каннабиноидов-СВ 1, где способ включает введение нуждающемуся в таком лечении млекопитающему соединения формулы (I) или фармацевтически приемлемой соли указанного соединения; фармацевтическую композицию для лечения, например, нарушения или состояния, выбираемого из группы, включающей перечисленные здесь нарушения; способ лечения нарушения или состояния, выбираемого из группы, включающей перечисленные здесь нарушения, где способ включает введение нуждающемуся в таком лечении млекопитающему соединения формулы (I) или фармацевтически приемлемой соли указанного соединения; фармацевтическую композицию для лечения перечисленных здесь нарушений, где композиция включает соединение формулы (I), или фармацевтически приемлемую соль указанного соединения, и фармацевтически приемлемый носитель; способ лечения перечисленных здесь нарушений, где способ включает введение нуждающемуся в таком лечении пациенту соединения формулы (I) или фармацевтически приемлемой соли указанного соединения; способ применения антагонистов рецептора каннабиноидов CB1, который включает введение нуждающемуся в таком лечении субъекту эффективного количества соединения формулы (I). Изобретение также касается применения соединения или соли, отвечающих формуле (I), для изготовления лекарственного средства. Кроме того, изобретение касается комбинированной терапии, где соединение по изобретению или фармацевтически приемлемую соль указанного соединения, или фармацевтическую композицию, или состав, включающий соединение по изобретению вводят одновременно или последовательно или в виде комбинированного препарата с другим терапевтическим средством или средствами для лечения одного или более перечисленных состояний. Указанные другие терапевтические средства (средство) могут быть введены перед, одновременно с или после введения соединений по изобретению. Изобретение также касается соединений, фармацевтических композиций, наборов и способов лечения перечисленных здесь нарушений, где способы включают введение нуждающемуся в таком лечении пациенту соединения формулы (I) или фармацевтически приемлемой соли указанного соединения. Соединения по изобретению обладают антагонистической активностью в отношении каннабиноидов-CB1. Антагонистические активности соединений по изобретению легко продемонстрировать, например, с применением одного или более испытаний, описанных здесь или известных из уровня техники. Изобретение также касается способов получения соединений по изобретению и промежуточных соединений, используемых в указанных способах. Соединения по данному изобретению могут содержать один или более асимметрических центров и могут, таким образом, существовать в виде рацематов и рацемических смесей, отдельных энантиомеров,диастереомерных смесей и отдельных диастереомеров. В зависимости от характера различных заместителей молекула может содержать дополнительные асимметрические центры. Каждый такой асимметрический центр независимо образует два оптических изомера. Все возможные оптические изомеры и диастереомеры в виде смесей или чистых или частично очищенных соединений входят в данное изобретение. Данное изобретение охватывает все такие изомерные формы указанных соединений. Формула (I) отображает структуру класса соединений, без указания стереохимии. Независимые синтезы таких диастереомеров или хроматографические разделения указанных диастереомеров могут быть выполнены, как известно из уровня техники, при соответствующей модификации описанной здесь методики. Абсолютная стереохимия диастереомеров может быть установлена рентгенокристаллографией кристаллических продуктов или кристаллических промежуточных соединений, полученных, при необходимости, с реагентом, содержащим асимметрический центр известной абсолютной конфигурации. Рацемические смеси соединений могут быть разделены на индивидуальные энантиомеры хорошо известными из уровня техники способами, такими как связывание рацемической смеси соединений энантиомерно чистым соединением с образованием диастереомерной смеси и последующее разделение индивидуальных диастереомеров стандартными способами, такими как фракционированная кристаллизация или хроматография. Связывание часто состоит в образовании солей с применением энантиомерно чистой кислоты или основания, например (-)-ди-п-толуоил-D-винной кислоты и/или(+)-ди-п-толуоил-L-винной кислоты. Диастереомерные производные могут быть затем превращены в чистые энантиомеры путем расщепления добавленного хирального остатка. Рацемическая смесь соеди-3 015107 нений может также быть разделена непосредственно хроматографическими способами с применением хиральных неподвижных фаз, которые хорошо известны из уровня техники. Альтернативно, любой энантиомер соединения может быть получен стереоизбирательным синтезом с применением оптически чистых исходных материалов или реагентов известной конфигурации хорошо известными из уровня техники способами. цис- и транс-Изомеры соединения формулы (I) или фармацевтически приемлемой соли указанного соединения также включены в изобретение, что также применимо к таутомерам соединений формулы (I) или фармацевтически приемлемой соли таутомера. Некоторые кристаллические формы соединений могут существовать как полиморфы: имеется в виду, что полиморфы, как таковые, входят в изобретение. Кроме того, некоторые соединения могут образовывать сольваты с водой (т.е, гидраты) или обычными химическими растворителями. Такие сольваты также входят в объем данного изобретения. Изотопно меченое соединение формулы (I) или фармацевтически приемлемые соли указанного соединения, включая соединения формулы (I), изотопно меченные в целях обнаружения методом PET илиSPECT, также входят в объем данного изобретения. То же самое применимо к соединениям формулы (I),меченным [13 С]-, [14 С]-, [3 Н]-, [18F]-, [125I]- или другими изотопно обогащенными атомами, пригодными для исследований на рецепторное связывание или метаболизм. Определение химических и других терминов Термин "алкил" означает линейные или разветвленные насыщенные углеводородные радикалы."Алкил(С 1-3)", например, означает метил, этил, н-пропил или изопропил, и " алкил (С 1-4) " означает метил, этил, н-пропил, изопропил, н-бутил, 2-бутил, изобутил или 2-метил-н-пропил. Термин "арил" охватывает моноциклические или конденсированные бициклические ароматические или гетероароматические группы, включающие, но не в порядке ограничения, фурил, тиенил, пирролил,оксазолил, тиазолил, имидазолил, имидазо[2,1-b][1,3]тиазолил, пиразолил, изоксазолил, изотиазолил,пиридил, пиридазинил, пиримидинил, пиразинил, 1,3,5-триазинил, фенил, индазолил, индолил, индолизинил, изоиндолил, бензо[b]фуранил, 1,2,3,4-тетрагидронафтил, 1,2,3,4-тетрагидроизохинолинил, инданил, инденил, бензо[b]тиенил, 2,3-дигидро-1,4-бензодиоксин-5-ил, бензимидазолил, бензотиазолил, бензо[1,2,5]тиадиазолил, пуринил, хинолинил, изохинолинил, фталазинил, хиназолинил, хиноксалинил, 1,8 нафтиридинил, нафтил, птеридинил или азуленил. Термин "гало" или "галоген" означает хлор, фтор, бром или йод; "гетеро", как в "гетероалкил, гетероароматический" и т.д., означает содержащий один или более атомов N, О или S. Гетероалкил" включает алкильные группы с гетероатомами в любом положении, таким образом,включает N-связанные, O-связанные или S-связанные алкильные группы. Термины "окси", "тио" и "карбо", как использованы здесь в качестве части другой группы, соответственно означают атом кислорода, атом серы и карбонильную (С=O)-группу, служат связующими между двумя группами, как, например, гидроксил, оксиалкил, тиоалкил, карбоксиалкил и т.д. Термин "амино", как использован здесь самостоятельно или в качестве части другой группы, означает атом азота, который может быть либо концевым, либо связующим между двумя другими группами,где группа может представлять собой первичный, вторичный или третичный (два атома водорода, связанных с атомом азота, один атом водорода, связанный с атомом азота, и отсутствуют атомы водорода,связанные с атомом азота, соответственно) амин. Термины "сульфинил" и "сульфонил", как использованы здесь в качестве части другой группы, соответственно означают -SO- или -SO2-группу. Как использовано здесь, если не оговорено иное, термин "уводящая группа" должен означать заряженный или незаряженный атом или группу, которая удаляется во время реакции замещения или вытеснения. Подходящие примеры включают, но не ограничиваются ими, Br, Cl, I, мезилат, тозилат и т.п.N-оксиды вышеупомянутых соединений входят в объем изобретения. Третичные амины могут приводить или не приводить к метаболитам N-оксида. Степень возможного N-окисления изменяется от следовых количеств до почти количественной конверсии. N-оксиды могут быть более активны, чем соответствующие третичные амины, или менее активны. Хотя N-оксиды легко могут быть восстановлены до соответствующих третичных аминов химическими способами, в организме человека такое восстановление происходит до различной степени. Некоторые N-оксиды подвергаются почти количественной восстановительной конверсии до соответствующих третичных аминов, в других случаях конверсия является лишь следовой реакцией или даже полностью отсутствует (Bickel, 1969). Для более краткого описания некоторые приведенные здесь количественные выражения не сопровождаются термином "около". Подразумевается, что независимо от того, используется термин "около" в явной форме или нет, каждое приведенное здесь количество означает фактически заданную величину, а также означает указание на приближение к такой заданной величине, которое разумно предполагать из знаний среднего специалиста в данной области, включая приближения, обусловленные экспериментальными условиями и/или условиями измерения такой заданной величины. Во всем описании и в формуле описания изобретения слово "включают" и разновидности слова, такие как "включающий" и "включает",не рассматриваются как исключающие другие добавки, компоненты, целые числа или стадии.-4 015107 Любое соединение, подвергнувшееся превращению в процессе обмена веществ in vivo с образованием биоактивного агента (т.е. соединения формулы (I, является пролекарством, охватываемым рамками объема и сущностью заявки. Пролекарства являются терапевтическими агентами, неактивными сами по себе, но превращающимися в один или более активных метаболитов. Таким образом, в способах лечения по данному изобретению термин "введение" охватывает лечение различных описанных здесь нарушений с помощью конкретно раскрытого соединения или с помощью соединения, которое не раскрыто конкретно, но может превращаться в указанное соединение in vivo после введения пациенту. Пролекарства являются биообратимыми производными лекарственных молекул, используемыми для преодоления некоторых препятствий к применимости молекулы исходного лекарственного вещества. Такие препятствия включают, но не в порядке ограничения, растворимость, проницаемость, устойчивость, пресистемный метаболизм и ограничения в обеспечении направленной доставки препарата (Bundgaard, 1985; King,1994; Stella, 2004; Ettmayer, 2004; Jarvinen, 2005). Пролекарства, т.е. соединения, которые при введении человеку любым известным способом подвергаются превращению в процессе обмена веществ до соединений формулы (I), принадлежат изобретению. В частности, сказанное относится к соединениям с первичными или вторичными амино- или гидроксигруппами. Такие соединения могут быть подвергнуты взаимодействию с органическими кислотами, что приводит к получению соединений формулы (I), где присутствует добавочная группа, которая легко удаляется после введения, как, например, но не ограничиваясь этим, такая как амидин, енамин, основание Манниха, гидроксилметиленовое производное, производное О-(ацилоксиметиленкарбамат)а, карбамат, сложный эфир, амид или енаминон. Термин "композиция", как использован здесь, охватывает продукт, включающий конкретно указанные ингредиенты в заданных количествах или пропорциях, а также любой продукт, который образуется,прямо или опосредованно, в результате комбинирования конкретно указанных ингредиентов в точно указанных количествах. В отношении фармацевтических композиций такой термин охватывает продукт,включающий один или более активных ингредиентов и необязательный носитель, включающий инертные ингредиенты, а также любой продукт, который образуется, прямо или опосредованно, в результате комбинирования, комплексообразования или агрегации любых двух или более ингредиентов, или в результате диссоциации одного или более ингредиентов, или в результате других типов реакций или взаимодействий одного или более ингредиентов. В целом, фармацевтические композиции получают путем однородного и тесного объединения активного ингредиента с жидким носителем или тонкоизмельченным твердым носителем или с тем и другим и затем, при необходимости, формования продукта в требуемую лекарственную форму. Фармацевтическая композиция включает достаточное количество активного целевого соединения, обеспечивающее получение требуемого воздействия на развитие или состояние заболевания. Следовательно, фармацевтические композиции по данному изобретению включают любую композицию, полученную смешением соединения по данному изобретению и фармацевтически приемлемого носителя. В контексте данного описания термин "комбинированный препарат" включает как истинные комбинации, подразумевающие, что соединения по изобретению и другие лекарственные средства физически объединены в препарат, такой как таблетка или жидкость для инъекции, так и "набор из частей",включающий соединения по изобретению и ингибитор липазы в отдельных лекарственных формах, вместе с инструкциями по применению, необязательно, с дополнительными средствами, облегчающими соблюдение приема комплектующих соединений, например, с ярлыком или схемами. В случае истинных комбинаций фармакотерапия по определению является одновременной. Содержимое "набора из частей" может быть введено либо одновременно, либо при различных временных интервалах. Будет ли терапия одновременной или последовательной, зависит от характеристик используемых других лекарственных средств, таких как начало и продолжительность действия, уровни в плазме, клиренс и пр., а также от заболевания, стадии заболевания и особенностей отдельного пациента."Фармацевтически приемлемый" означает, что носитель, разбавитель или наполнитель должен быть совместимым с другими ингредиентами лекарственной формы и безвредным для самого реципиента. Сродство соединений по изобретению к рецепторам каннабиноидов определяют, как описано ниже. Из сродства к связыванию, измеренного для данного соединения формулы (I), можно рассчитать теоретическую минимально эффективную дозу. При концентрации соединения, равной двойной измереннойK-величине, почти 100% рецепторов каннабиноидов-CB1, по-видимому, блокируется соединением. Пересчет указанной концентрации в мг соединения на 1 кг массы пациента дает теоретическую минимальную эффективную дозу при условии идеальной биологической доступности. Фармакокинетические,фармакодинамические и другие соображения могут изменять фактически вводимую дозу до большего или меньшего значения. Целесообразная для введения доза составляет 0,001-1000 мг/кг, предпочтительно 0,1-100 мг/кг массы тела пациента. Термин "терапевтически эффективное количество", как использован здесь, относится к количеству терапевтического средства для лечения или предупреждения состояния, излечиваемого путем введения композиции по изобретению.-5 015107 Указанное количество является количеством, достаточным для проявления поддающегося обнаружению терапевтического, профилактического или мелиоративного (благоприятного) отклика в системе тканей, организме животного или человека. Эффект может включать, например, лечение или профилактику перечисленных состояний. Точное эффективное количество для субъекта зависит от размера субъекта и состояния здоровья, характера и степени излечиваемого состояния, рекомендаций лечащего терапевта (научного сотрудника, ветеринара, врача или другого клинициста) и терапевтических средств или комбинации терапевтических средств, выбранных для введения. Таким образом, нет смысла заранее определять точное эффективное количество. Термин "фармацевтически приемлемая соль" означает те соли, которые в рамках здравого медицинского смысла приемлемы для применения в контакте с тканями человека и низших животных, не вызывая неспецифическую токсичность, раздражение, аллергическую реакцию и т.п. и соответствующие разумному соотношению польза/риск. Фармацевтически приемлемые соли хорошо известны из уровня техники. Такие соли могут быть получены in situ (на месте), во время конечного выделения и очистки соединений по изобретению или отдельно при взаимодействии соединений по изобретению с фармацевтически приемлемыми нетоксичными основаниями или кислотами, включая неорганические или органические основания и неорганические или органические кислоты. Термин "лечение", как использован здесь, означает любое лечение состояния или заболевания млекопитающего, предпочтительно человека, и включает:(1) предупреждение возникновения заболевания или состояния у субъекта, предрасположенного к заболеванию, но еще не диагностированного, как имеющего данное заболевание или состояние;(2) сдерживание заболевания или состояния, т.е. остановка развития;(3) ослабление заболевания или состояния, т.е. приведение состояния к регрессии; или(4) исключение симптомов заболевания. Как использовано здесь, подразумевается, что термин "лекарственная терапия" включает профилактическую, диагностическую и терапевтическую лечебные схемы, осуществляемые in vivo или ex vivo на человеке или другом млекопитающем. Термин "субъект", как использован здесь, означает животное, предпочтительно млекопитающее,преимущественно человека, являющегося объектом лечения, наблюдения или эксперимента. Примеры Пример 1. Аналитические методы. Спектры 1 Н-ЯМР регистрируют на приборе Bruker, 400 МГц или 300 МГц, используя CDCl3 в качестве растворителя, с тетраметилсиланом в качестве внутреннего стандарта. Спектры 13 С-ЯМР регистрируют на приборе Bruker (100 МГц), используя CDCl3 в качестве растворителя. Химические сдвиги даны в м.д. (шкала ) в сторону слабого поля относительно тетраметилсилана. Константы связи (J) выражены в герцах (Гц). Флэш-хроматографию осуществляют с применением силикагеля 60 (0,040-0,063 мм, Merck). Колоночную хроматографию выполняют, используя силикагель 60 (0,063-0,200 мм, Merck). Температуры плавления регистрируют на приборе для определения точки плавления Buchi B-545. Пример 2. Общие аспекты синтезов. Синтезы соединений, имеющих формулу (I), представлены схемой 1. Синтезы промежуточных соединений, имеющих формулу (II), осуществляют аналогично опубликованным методикам (Lan, 1999;Francisco, 2002; Katoch-Rouse 2003). Карбоновая кислота общей формулы (II), где R1 и R2 имеют вышеуказанное значение, может быть бромирована до соответствующего 4-бром-производного (III) с применением бромирующего агента, такого как бром, в инертном органическом растворителе, таком как дихлорметан. Указанное бром-производное (III), где R1 и R2 имеют вышеуказанное значение, может быть обработано сильным основанием, таким как н-бутиллитий, в инертном безводном органическом растворителе, таком как тетрагидрофуран, и впоследствии подвергнуто взаимодействию с серо-производным электрофилом YSSY, где Y означает метильную или этильную группу, что дает соединение общей формулы (IV), где R1, R2 и Y имеют вышеуказанное значение; R4 означает атом водорода и X означает атом серы. Указанное соединение общей формулы (IV) может быть превращено в соответствующий сложный эфир общей формулы (V), где R1, R2 и Y имеют вышеуказанное значение; R3 означает линейную C1-3-алкильную группу (метил, этил или н-пропил) и X означает атом серы. Такой сложный эфир общей формулы (V) может быть окислен одномолярным эквивалентом окисляющего реагента, такого как метахлорпербензойная кислота, что дает соответствующий сульфиниловый аналог. Альтернативно,взаимодействием соединения общей формулы (V) с двумя или более молярными эквивалентами метахлорпербензойной кислоты можно превратить сульфанилгруппу в соответствующую сульфонилгруппу. Сложный эфир общей формулы (V), где R1, R2 и Y имеют вышеуказанное значение и X означает сульфоксидную или сульфоновую группу, может быть гидролизован предпочтительно в кислотных условиях,что дает соответствующую карбоновую кислоту (VI). Полученное соединение общей формулы (VI) может быть связано (конденсировано) с амином в присутствии активирующего или связующего реагента,что дает соединение общей формулы (I), где R1, R2 и Y имеют вышеуказанное значение; n имеет вышеуказанное значение и X означает сульфоксидную (S=O) группу или сульфоновую (SO2) группу. Альтернативно, соединение общей формулы (IV), где R1, R2 и Y имеют вышеуказанное значение и X означает-6 015107 атом серы, может быть связано с амином в присутствии активирующего или связующего реагента, что дает соединение общей формулы (I), где R1, R2, Y и n имеют вышеуказанное значение и X означает атом серы. Альтернативно, сложноэфирное производное, имеющее формулу (V), может быть подвергнуто взаимодействию по так называемой реакции амидирования Weinreb'а с образованием соединения общей формулы (I), где R1, R2, Y и n имеют вышеуказанное значение и X означает атом серы или сульфоксидную (S=O) группу, или сульфоновую (SO2) группу. Такие реакции амидирования Weinreb'a могут быть промотированы применением триметилалюминия Al(СН 3)3 (Levin, 1982). Способы активации и связывания аминов с карбоновыми кислотами хорошо описаны (Bodanszky, 1994; Akaji, 1994; Albericio, 1997;(е) R3-OH, кислотный катализатор или тионилхлорид; Альтернативные синтезы соединений, имеющих формулу (I), представлены схемой 2. Производное бромацетофенона общей формулы (VII), где R2 имеет вышеуказанное значение, может быть подвергнуто взаимодействию с соединением общей формулы NaS-Y с образованием соответствующего производного 1-арил-2-(алкилсульфанил)этанона (VIII) в инертном растворителе, таком как метанол. Указанное производное 1-арил-2-(алкилсульфанил)этанона (VIII), где R2 имеет вышеуказанное значение, может быть подвергнуто взаимодействию с производным эфира щавелевой кислоты общей формулы (IX) в присутствии основания, такого как алканоат натрия, в инертном безводном органическом растворителе с последующим взаимодействием с арилгидразином (X) или солью указанного соединения, где R1 имеет вышеуказанное значение, что дает сложный эфир общей формулы (V), где R1, R2 и Y имеют вышеуказанное значение; R3 означает линейную C1-3-алкильную группу (метил, этил или н-пропил) и X означает атом серы. Такой сложный эфир общей формулы (V) может быть гидролизован в щелочных условиях, например, с помощью гидроксида лития с образованием соответствующей карбоновой кислоты общей формулы (IV) или соли указанной карбоновой кислоты и щелочного элемента (такого как литий, натрий или калий). Такая карбоновая кислота или соль карбоновой кислоты и щелочного элемента общей формулы(IV), где R1, R2 и Y имеют вышеуказанное значение и X означает атом серы, могут быть связаны с амином в присутствии активирующего или связующего реагента в инертном органическом растворителе,таком как диметилформамид, с образованием соединения общей формулы (I), где R1, R2, Y и n имеют вышеуказанное значение и X означает атом серы. Такое соединение общей формулы (I), где R1, R2, Y и n имеют вышеуказанное значение и X означает атом серы, может быть окислено одним молярным эквивалентом метахлорпербензойной кислоты, что дает соответствующий сульфинил-аналог (X означает S=O группу). Альтернативно, взаимодействием соединения общей формулы (I), где X означает атом серы, с двумя или более молярными эквивалентами метахлорпербензойной кислоты можно превратить сульфанилгруппу (I) в соответствующую сульфонилгруппу. Выбор конкретных синтетических методик зависит от факторов, известных специалисту в данной области, таких как совместимость функциональных групп с используемыми реагентами, возможность использования защитных групп, катализаторов активирующих и связующий реагентов и основных характерных особенностей структур, присутствующих в конечном получаемом соединении. Фармацевтически приемлемые соли могут быть получены с применением стандартных методик,хорошо известных из уровня техники, например смешением соединения по данному изобретению с подходящей кислотой, например неорганической кислотой, такой как хлористо-водородная кислота, или с органической кислотой. Гидраты могут быть получены с применением стандартных методик, хорошо известных из уровня техники, например кристаллизацией или выпариванием из водосодержащего (неводного) органического растворителя. Пример 3. Синтезы специфических соединений. Соединение 1. 5-(4-Хлорфенил)-1-(2,4-дихлорфенил)-1H-пиразол-3-карбоновая кислота. 5-(4-Хлорфенил)-1-(2,4-дихлорфенил)-1H-пиразол-3-карбоновую кислоту (т.пл. 185-187 С) получают из метил-5-(4-хлорфенил)-1-(2,4-дихлорфенил)-1H-пиразол-3-карбоксилата путем гидролиза сложного эфира в щелочных условиях (метанол, водный KOH). 4-Бром-5-(4-хлорфенил)-1-(2,4-дихлорфенил)-1H-пиразол-3-карбоновая кислота. К перемешиваемому магнитной мешалкой раствору 5-(4-хлорфенил)-1-(2,4-дихлорфенил)-1Hпиразол-3-карбоновой кислоте (20,0 г, 54,5 ммоль) в дихлорметане (400 мл) медленно добавляют бром(5,62 мл, 109 ммоль) и осуществляют взаимодействие полученной смеси в течение 16 ч при комнатной температуре. Последовательно добавляют диэтиловый эфир (400 мл) и избыток водного насыщенного раствора NaHCO3. Органический слой отделяют, дважды промывают водным насыщенным растворомNaHCO3 и затем промывают насыщенным раствором соли, сушат над MgSO4, фильтруют и концентрируют, получая 4-бром-5-(4-хлорфенил)-1-(2,4-дихлорфенил)-1H-пиразол-3-карбоновую кислоту (19,77 г,81% выход). Температура плавления: 222-224 С. 5-(4-Хлорфенил)-1-(2,4-дихлорфенил)-4-метилсульфанил-1H-пиразол-3-карбоновая кислота. К перемешиваемому магнитной мешалкой раствору 4-бром-5-(4-хлорфенил)-1-(2,4-дихлорфенил)1H-пиразол-3-карбоновой кислоты (5,00 г, 11,2 ммоль) в безводном тетрагидрофуране (ТГФ) (250 мл) добавляют н-бутиллитий (15,75 мл, 1,6 М раствор, 25,2 ммоль) и полученный раствор перемешивают в течение 15 мин в атмосфере N2 при -78 С. Добавляют шприцем раствор диметилдисульфида (CH3S)2(3,16 г, 33,6 ммоль) в безводном ТГФ (20 мл) и полученный раствор перемешивают при -78 С в течение ночи. Реакционную смесь гасят избытком воды и полученный раствор экстрагируют диэтиловым эфиром. Слой диэтилового эфира промывают водой, сушат над MgSO4, фильтруют и концентрируют, получая сырую 5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метилсульфанил-1H-пиразол-3-карбоновую кислоту,которую дополнительно очищают, используя флэш-хроматографию (элюент: смесь дихлорметан/метанол= 95/5 (об./об., с последующей другой очисткой флэш-хроматографией (элюент: смесь дихлорметан/этанол =95/5 (об./об., что дает 5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метилсульфанил-1Hпиразол-3-карбоновую кислоту (2,75 г), которую сразу же подвергают превращению на следующей реакционной стадии. К перемешиваемому магнитной мешалкой раствору 5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4 метилсульфанил-1 Н-пиразол-3-карбоновой кислоты (4,69 г, 11,3 ммоль) в дихлорметане (100 мл) последовательно добавляют 7-аза-1-гидроксибензотриазол (HOAt) (2,2 г, 16,0 ммоль), (1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорид (EDCI) (3,1 г, 16,1 ммоль) и 1-аминопиперидин (1,6 г,16,0 ммоль). После перемешивания в течение 16 ч полученную смесь впоследствии промывают водой(3), сушат над Na2SO4, фильтруют и концентрируют, получая сырой твердый продукт. Указанный сырой твердый продукт дополнительно очищают флэш-хроматографией (силикагель, смесьEtOAc/гептан=22/78 (об./об.) ) и порошкуют со смесью н-гептан/метанол, получая 5-(4-хлорфенил)-1(2,4-дихлорфенил)-4-метилсульфанил-N-(пиперидин-1-ил)-1H-пиразол-3-карбоксамид: соединение 1C-ЯМР (CDCl3, 100 МГц)20,03, 23,32, 25,29, 57,02, 113,66, 126,20, 127,99, 128,74, 130,36, 130,48,131,24, 132,85, 135,59, 135,64, 136,41, 147,08, 147,30, 158,62. Соединение 2. 1-(4-Хлорфенил)-2-(метилсульфанил)этанон. К перемешиваемому магнитной мешалкой раствору бром-4-хлор-ацетофенона (16,8 г, 72 ммоль) в метаноле (200 мл) добавляют NaSCH3 (5,23 г, 72 ммоль), что дает экзотермическую реакцию. Полученную смесь подвергают взаимодействию в течение 2 ч при комнатной температуре, концентрируют и суспендируют в дихлорметане (150 мл) и промывают водой, сушат над MgSO4, фильтруют и концентрируют, получая 1-(4-хлорфенил)-2-(метилсульфанил)этанон (5,1 г). 1 Н-ЯМР(CDCl3, 400 МГц)2,13 (с, 3 Н), 3,72 (с, 2 Н) 7,44(ушир.д, J=8 Гц, 2 Н), 7,92 ушир.д, J=8 Гц,2 Н). Этил-5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метилсульфанил-1H-пиразол-3-карбоксилат. Металлический натрий (2 г, 87 ммоль) растворяют в этаноле (80 мл). Полученный раствор добавляют к перемешиваемому магнитной мешалкой раствору диэтилоксалата (6 г, 41 ммоль) и 1-(4-хлорфенил)-2-(метилсульфанил)этанона (8,0 г, 40 ммоль). Полученную смесь подвергают взаимодействию в течение 20 ч при комнатной температуре, после чего выливают в водную хлористоводородную кислоту (200 мл, 1 н.). Полученную смесь дважды экстрагируют метилтретбутиловым эфиром (МТВЕ) (200 мл), сушат над MgSO4, фильтруют и концентрируют. Полученный остаток растворяют в уксусной кислоте (200 мл), добавляют 2,4-дихлорфенилгидразин. HCl (8,6 г, 40 ммоль) и полученную смесь нагревают при 60 С в течение 3 ч. Реакционной смеси дают достичь комнатной температуры, концентрируют приблизительно до 50 мл и выливают в воду (200 мл) с последующей экстракцией МТВЕ(3 порции по 150 мл). Объединенные органические слои промывают 5% водным NaHCO3, сушат надMgSO4, фильтруют и концентрируют. Дополнительная очистка с применением колоночной хроматографии (силикагель; элюент:смесь гептан/этилацетат = 90/10 (об./об. дает этил-5-(4-хлорфенил)-1-(2,4 дихлорфенил)-4-метилсульфанил-1H-пиразол-3-карбоксилат (4,9 г, 27% выход). Rf0,4 (смесь гептан/этилацетат = 90/10 (об./об 1H-ЯМР (CDCl3, 300 МГц)1,44 (т, J=7 Гц, 3 Н), 2,32 (с, 3 Н), 4,46 (кв, J=7 Гц, 2 Н), 7,10-7,45 (м, 7 Н). 5-(4-Хлорфенил)-1-(2,4-дихлорфенил)-4-метилсульфанил-1 Н-пиразол-3-карбоксилат лития. К перемешиваемому магнитной мешалкой раствору этил-5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4 метилсульфанил-1H-пиразол-3-карбоксилата (4,9 г, 11 ммоль) в тетрагидрофуране (100 мл) добавляютLiOHH2O (0,47 г, 11 ммоль) и полученную смесь подвергают взаимодействию в течение 20 ч при 35 С и впоследствии концентрируют в вакууме. Полученный сырой 5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4 метилсульфанил-1 Н-пиразол-3-карбоксилат лития используют на следующей стадии. К перемешиваемому магнитной мешалкой раствору 5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4 метилсульфанил-1H-пиразол-3-карбоксилата лития (максимально 1,2 г, 3 ммоль) в диметилформамиде(TBTU) (1,25 г, 3,9 ммоль), триэтиламин (1,3 мл) и 1-аминопирролидингидрохлорид (0,410 г,3,35 ммоль). После перемешивания в течение 18 ч при 50 С полученной смеси дают достичь комнатной температуры и концентрируют в вакууме. Полученный остаток порошкуют с водой и затем дополнительно очищают флэш-хроматографией (силикагель, смесь EtOAc/гептан = 20/80 (об./об., получая 5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метилсульфанил-N-(пирролидин-1-ил)-1H-пиразол-3 карбоксамид: соединение 2 (0,78 г, 54% выход). 1 Н-ЯМР (CDCl3, 400 МГц)1,88-1,96 (м, 4 Н), 2,39 (с, 3 Н), 3,02-3,08 (м, 4 Н), 7,15 (ушир.д, J=8 Гц,2 Н), 7, 29-7,33 (м, 4 Н), 7,42 (ушир.с, 1 Н), 7,98 (ушир.с, 1 Н). 5-(4-Хлорфенил)-1-(2,4-дихлорфенил)-4-метилсульфанил-N-(азепан-1-ил)-1H-пиразол-3 карбоксамид (соединение 3) Соединение 3 получают аналогично тому, как описано выше для соединения 2, из сырого 5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метилсульфанил-1 Н-пиразол-3-карбоксилата лития, азепан-1 иламина, TBTU и Et3N в ДМФА с 52% выходом. 1 Н-ЯМР (CDCl3, 400 МГц)1,64-1,68 (м, 4 Н), 1,72-1,79 (м, 4 Н), 2,38 (с, 3 Н), 3,18-3,22 (м, 4 Н),7,15(ушир.д, J=8 Гц, 2 Н), 7,29-7,33 (м, 4 Н), 7,42 (ушир.т, J=2 Гц, 1 Н), 8,43 (ушир.с, 1 Н). 13C-ЯМР (CDCl3, 100 МГц)20,17, 26,30, 26,99, 58,10, 113,31, 126,26, 127,96, 128,75, 130,36, 130,49,131,23, 132,86, 135,62, 135,65, 136,36, 147,26, 147,31, 158,87. 5-(4-Хлорфенил)-1-(2,4-дихлорфенил)-4-метилсульфонил-N-(пиперидин-1-ил)-1H-пиразол-3 карбоксамид (соединение 4). К перемешиваемому магнитной мешалкой раствору 5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4 метилсульфанил-N-(пиперидин-1-ил)-1H-пиразол-3-карбоксамида (0,70 г, 1,41 ммоль) добавляют м-СРВА (2,2 г 70% водного раствора, 9 ммоль). Полученную смесь подвергают взаимодействию в течение 70 ч при комнатной температуре и затем выливают в воду (25 мл). Полученную смесь экстрагируют дихлорметаном (25 мл). Органический слой отделяют и сушат над MgSO4, фильтруют и концентрируют. Колоночная хроматография (силикагель, смесь дихлорметан/метанол = 95/5 (об./об. дает 5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метилсульфонил-N-(пиперидин-1-ил)-1H-пиразол-3-карбоксамид К перемешиваемому магнитной мешалкой раствору 5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4 метилсульфанил-N-(пиперидин-1-ил)-1H-пиразол-3-карбоксамида (0,70 г, 1,41 ммоль) добавляют м-хлорпербензойную кислоту (м-СРВА) (0,50 г 70% водного раствора, 2,0 ммоль). Полученную смесь подвергают взаимодействию в течение 20 ч при комнатной температуре и затем выливают в воду (25 мл). Полученную смесь экстрагируют дихлорметаном (25 мл). Органический слой отделяют и сушат над MgSO4, фильтруют и концентрируют. Колоночная хроматография (силикагель, смесь дихлорметан/метанол = 95/5 (об./об. дает 5-(4-хлорфенил)-1-(2,4-дихлорфенил)-4-метилсульфинил-N(пиперидин-1-ил)-1H-пиразол-3-карбоксамид (150 мг, 21% выход) (соединение 5). 1(ушир.д, J=8 Гц, 2 Н), 7,27-7,32 (м, 4 Н), 7,43 (ушир.с, 1 Н), 8,70 (ушир.с, 1 Н). 13 С-ЯМР(CDCl3, 100 МГц)23,28, 25,22, 41,84, 56,97, 122,91, 124,67, 128,03, 128,66, 130,41, 130,63,131,60, 133,01, 134,54, 136,51, 136,98, 144,62, 144,85, 157,60. Пример 4. Фармакологические методики. Сродство к рецепторам каннабиноидов-CB1 человека in vitro. Сродство соединений по изобретению к рецепторам каннабиноидов CB1 может быть определено с применением мембранных препаратов клеток яичника китайского хомячка (СНО), в которых рецептор каннабиноидов CB1 человека устойчиво трансфицирован совместно с [3 Н] СР-55,940 в качестве радиолиганда. После инкубации свежеприготовленного препарата клеточной мембраны с [3 Н]-лигандом, с добавлением или без добавления соединений по изобретению, разделение связанного и свободного лиганда осуществляют путем фильтрования через фильтры из стекловолокна. Радиоактивность на фильтре измеряют путем подсчета импульсов в жидкой фазе. Сродство к рецепторам каннабиноидов-СВ 2 человека in vitro. Сродство соединений по изобретению к рецепторам каннабиноидов СВ 2 может быть определено с применением мембранных препаратов клеток яичника китайского хомячка (СНО), в которых рецептор каннабиноидов СВ 2 человека устойчиво трансфицирован совместно с [3 Н] СР-55,940 в качестве радиолиганда. После инкубации свежеприготовленного препарата клеточной мембраны с [3 Н]-лигандом, с добавлением или без добавления соединений по изобретению, разделение связанного и свободного лиганда осуществляют путем фильтрования через фильтры из стекловолокна. Радиоактивность на фильтре измеряют путем подсчета импульсов в жидкой фазе. Антагонизм в отношении рецепторов каннабиноидов-CB1 in vitro. Антагонизм в отношении рецепторов CB1 in vitro может быть оценен с помощью рецептора CB1,клонированного в клетках яичника китайского хомячка (СНО). СНО клетки выращивают в модифицированной по способу Дульбекко культуральной среде Игла (DMEM), пополненной 10% термоинактивированной сывороткой плода теленка. Среду отсасывают с помощью аспиратора и заменяют DMEM без фетальной телячьей сыворотки плода теленка, но содержащей [3 Н]-арахидоновую кислоту, и инкубируют в течение ночи в сушильной печи для клеточной культуры (5% CO2/95% воздух; 37 С; водонасыщенная атмосфера). За указанный период [3 Н]-арахидоновая кислота инкорпорируется фосфолипидами мембраны. В день испытания среду отсасывают с помощью аспиратора и клетки трижды промывают, используя 0,5 мл DMEM, содержащей 0,2% альбумин бычьей сыворотки (BSA). Стимуляция рецептора CB1 с помощью WIN 55.212-2 ведет к активации PLA2 с последующим высвобождением [3 Н]-арахидоновой кислоты в среду. Антагонизм такой индуцированной WIN 55.212-2 секреции вызывают концентрационно- 11015107 зависимо с помощью антагонистов рецептора CB1. Артериальная гипотензия у крыс, вызванная СР-55.940. Самцов крыс с нормальным артериальным давлением (225-300 г; Harlan, Horst, The Netherlands) анестезируют с помощью пентобарбитала (80 мг/кг, и.п.). Измеряют кровяное давление через канюлю,вставленную в левую сонную артерию, с помощью датчика давления Spectramed DTX-plus (SpectramedB.V., Bilthoven, The Netherlands). После амплификации с помощью усилителя несущей частоты NinonKohden Carrier Amplifier (Type AP-621 G; Nihon Kohden B.V., Amsterdam, The Netherlands) сигнал кровяного давления регистрируют на персональном компьютере (Compaq Deskpro 386s) с помощью программы сбора и регистрации информации Po-Ne-Mah (Po-Ne-Mah Inc., Storrs, USA). Частоту сердечных сокращений получают из пульсирующего пневмосигнала. Все соединения вводят перорально в виде микросуспензии в 1% метилцеллюлозе за 30 мин до вводной анестезии, осуществляемой за 60 мин до введения агониста рецептора СВ 1 СР-55,940. Объем инъекции составляет 10 мл/кг. После гемодинамической стабилизации вводят агонист рецептора CB1 СР-55,940. (0,1 мг/кг, в.в.) и устанавливают гипотензивный эффект. Пример 5. Результаты фармакологических исследований. Данные по сродству к рецепторам каннабиноидов CB1 и СВ 2 человека (средние результаты по меньшей мере трех независимых экспериментов, выполненных согласно вышеуказанным протоколам) римонабанта и соединений 1-5 приведены в таблице. Приведенные данные иллюстрируют влияние на сродство к рецепторам CB1 и СВ 2, соотношения селективности в отношении рецепторов CB1/2, а также эффективности in vivo после перорального введения, достигаемые путем структурной модификации, составляющей основу данного изобретения, а также иллюстрируют сродство к рецепторам СВ 1S-окисленных соединений 4 и 5. Сродство к рецепторам CB1 и СВ 2, и активность на модели крыс,опосредованной рецепторами, in vivo, римонабанта и соединений 1-3 по данному изобретению, и сродство к рецепторам CB1 Пример 6. Фармацевтические препараты. Для клинического применения соединения формулы (I) формулируют в фармацевтические композиции, которые являются важными и новыми вариантами осуществления изобретения, поскольку содержат соединения, точнее, конкретно указанные здесь соединения. Типы фармацевтических композиций,которые могут быть использованы, включают, но не ограничиваются следующими: таблетки, жевательные таблетки, капсулы (включая микрокапсулы), растворы, парентеральные растворы, мази (кремы и гели), суппозитории, суспензии и другие типы, описанные здесь или очевидные для специалиста в данной области из описания и общедоступных сведений, известных из уровня техники. Соединения используют для перорального, внутривенного, подкожного, трахеального, бронхиального, интраназального,пульмонального, трансдермального, буккального, ректального, парентерального или других способов введения. Фармацевтическая лекарственная форма содержит по меньшей мере одно соединение формулы (I) в смеси с фармацевтически приемлемым вспомогательным веществом, разбавителем и/или носителем. Целесообразно общее количество активных ингредиентов в пределах приблизительно от 0,1 до 95% (мас./мас.) от лекарственной формы, удобно от 0,5 до 50% (мас./мас.) и предпочтительно от 1 до 25% (мас./мас.).- 12015107 Соединения по изобретению могут быть введены в формы, удобные для введения, общепринятыми способами с применением вспомогательных веществ, таких как жидкие или твердые, порошкообразные ингредиенты, такие как фармацевтически приемлемые жидкие или твердые наполнители или расширители, растворители, эмульгаторы, смазывающие вещества, корригенты, красители и/или буферные вещества. Часто используемые вспомогательные вещества включают такие вещества, как карбонат магния, диоксид титана, лактоза, сахароза, сорбит, маннит и другие сахара или сахарные спирты, тальк, лактопротеин, желатин, крахмал, амилопектин, целлюлоза и производные целлюлозы, животные и растительные масла, такие как рыбий жир, подсолнечное, арахисовое или кунжутное масло, полиэтиленгликоль и растворители, такие как, например, стерильная вода, и одно- или многоатомные спирты, такие как глицерин,а также дезинтегрирующие средства и смазывающие вещества, такие как стеарат магния, стеарат кальция, стеарилфумарат натрия и полиэтиленгликолевые парафины. Смесь может быть затем переработана в гранулы или спрессована в таблетки. Активные ингредиенты могут быть отдельно примешаны к другим неактивным ингредиентам перед смешиванием с образованием лекарственной формы. Активные ингредиенты могут также быть смешаны друг с другом перед смешиванием с неактивными ингредиентами с образованием лекарственной формы. Мягкие желатиновые капсулы могут быть получены содержащими смесь активных ингредиентов по изобретению, растительное масло, жир или другие подходящие растворители для мягких желатиновых капсул. Твердые желатиновые капсулы могут содержать гранулы активных ингредиентов. Твердые желатиновые капсулы могут также содержать активные ингредиенты вместе с твердыми, порошкообразными ингредиентами, такими как лактоза, сахароза, сорбит, маннит, картофельный крахмал, кукурузный крахмал, амилопектин, производные целлюлозы или желатин. Единичные дозы для ректального введения могут быть получены (i) в форме суппозиториев, которые содержат активное вещество, смешанное с нейтральной жировой основой; (ii) в форме желатиновой ректальной капсулы, которая содержит активное вещество в смеси с растительным маслом, парафиновым маслом или другим подходящим растворителем для желатиновых ректальных капсул; (iii) в форме готовой микроклизмы или (iv) в форме сухого состава для микроклизмы, ресуспендируемого в подходящем растворителе перед введением. Жидкие препараты могут быть получены в форме сиропов, эликсиров, концентрированных капель или суспензий, например растворов или суспензий, содержащих активные ингредиенты и остаточные вещества, представляющие собой, например, сахар или сахарные спирты и смесь этанола, воды, глицерина, пропиленгликоля и полиэтиленгликоля. По желанию, такие жидкие препараты могут содержать красители, корригенты, консерванты, сахарин и карбоксиметилцеллюлозу или другие загустители. Жидкие препараты могут также быть получены в форме сухого порошка, ресуспендируемого в подходящем растворителе перед употреблением. Растворы для парентерального введения могут быть получены в виде раствора состава по изобретению в фармацевтически приемлемом растворителе. Такие растворы могут также содержать стабилизирующие ингредиенты, консерванты и/или буферные ингредиенты. Растворы для парентерального введения могут также быть получены в виде сухого препарата, ресуспендируемого в подходящем растворителе перед употреблением. Также согласно настоящему изобретению разработаны составы и "наборы из частей", включающие один или более контейнеров, наполненных одним или более ингредиентами фармацевтической композиции по изобретению, предназначенные для использования при лекарственном лечении. К такому контейнеру (контейнерам) могут быть приложены различные текстовые материалы, такие как инструкции по применению или уведомление в форме, предписанной государственным органом, регулирующим изготовление, употребление и продажу фармацевтической продукции, указанное уведомление отражает разрешение на изготовление, употребление и продажу в целях применения человеком или в ветеринарии. Применение составов по настоящему изобретению в изготовлении лекарственных препаратов для применения в лечении состояния, при котором требуется или желателен антагонизм рецепторов каннабиноидов-CB1, и способы лекарственного лечения, включающие введение терапевтически эффективного общего количества по меньшей мере одного соединения формулы (I) либо как такового, либо в случае пролекарств после приема пациенту, страдающему состоянием или подверженному состоянию, при котором требуется или желателен антагонизм рецепторов каннабиноидов-CB1. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения общей формулы (I)Y означает метильную или этильную группу;n может иметь значения 1, 2 или 3,таутомеры, стереоизомеры указанных соединений и изотопно меченые соединения формулы (I), а также фармакологически приемлемые соли, гидраты и сольваты указанных соединений формулы (I) и их таутомеры, стереоизомеры или изотопно меченые аналоги. 2. Соединения по п.1 общей формулы (I), где R1 и R2 означают Cl; Y означает метильную группу; n равно 1 или 2 и X имеет значения, указанные в п.1. 3. Соединения по п.1, представленные формулами:- 15015107 4. Фармацевтическая композиция, проявляющая свойства избирательного антагониста рецептора каннабиоидов CB1, включающая в дополнение к фармацевтически приемлемому носителю и/или по меньшей мере одному фармацевтически приемлемому вспомогательному веществу фармакологически активное количество по меньшей мере одного соединения по п.1 или соли указанного соединения в качестве активного ингредиента. 5. Фармацевтическая композиция по п.4, включающая также по меньшей мере одно дополнительное терапевтическое средство. 6. Способ получения фармацевтических композиций по п.4 или 5, отличающийся тем, что соединение по п.1 переводят в удобную для введения форму. 7. Применение соединения по п.1 в качестве лекарственного средства для лечения нарушений, связанных с каннабиноидной нейропередачей. 8. Соединения общей формулы (IV) где R1, R2 и Y имеют указанные по п.1 значения;R4 означает атом водорода, лития, калия или натрия иX означает атом серы, сульфоксидную (S=O) группу или сульфоновую (SO2) группу. 9. Соединения общей формулы (V) где R1, R2, X и Y имеют указанные по п.1 значения иR3 означает метильную, этильную или н-пропильную группу. 10. Применение соединений по п.1 для получения фармацевтической композиции для лечения таких нарушений, как психоз, тревожность, депрессия, дефицит внимания, нарушения памяти, расстройства познавательной способности, нарушения аппетита, ожирение, в частности ювенильное ожирение и ожирение, вызванное примом лекарственных средств, зависимость, влечение, лекарственная зависимость и неврологические нарушения, такие как нейродегенеративные расстройства, деменция, дистония,мышечная спастичность, тремор, эпилепсия, рассеянный склероз, травматическое повреждение мозга,болезнь Паркинсона, болезнь Альцгеймера, болезнь Гентингтона, синдром Туретта, церебральная ишемия, апоплексия мозга, черепно-мозговая травма, инсульт, повреждение спинного мозга, нейровоспалительные расстройства, склероз (уплотнение гемолитической бляшки), вирусный энцефалит, нарушения,вызванные демиелинизацией; а также для лечения болевых расстройств, включая невропатические болевые расстройства, и других заболеваний, связанных с каннабиноидной нейропередачей, включая лечение таких нарушений, как септический шок, глаукома, рак, диабет, рвота, тошнота, астма, респираторные заболевания, желудочно-кишечные расстройства, язвенные болезни желудка, диарея, сексуальные расстройства и сердечно-сосудистые расстройства. 11. Применение по п.10 соединения по п.1 для получения фармацевтической композиции для лечения нарушений аппетита, в частности ожирения, ювенильного ожирения и ожирения, вызванного приемом лекарственных средств. 12. Применение по п.11, где указанная фармацевтическая композиция также содержит по меньшей мере один ингибитор липазы. 13. Применение по п.12, отличающееся тем, что указанным ингибитором липазы является орлистат или липстатин. 14. Способ получения соединений по п.1, в котором производное 1-арил-2-алкилсульфанилэтанона формулы (VIII) где R2 и Y имеют значения, указанные в п.1,последовательно подвергают взаимодействию с производным эфира щавелевой кислоты общей формулы (IX) где R3 означает линейную C1-3-алкильную группу (метил, этил или н-пропил),в присутствии основания, такого как алканоат натрия (NaOR3), в инертном безводном органическом растворителе, таком как метанол, этанол или пропанол, и последующей реакции с производным арилгидразина общей формулы (X) где R1 имеет значение, указанное в п.1,с получением сложного эфира общей формулы (V)
МПК / Метки
МПК: C07D 231/18, A61P 25/30, A61K 31/4155
Метки: св1, серосодержащие, каннабиноидов, рецептора, пиразола, антагонистов, производные, качестве, избирательных
Код ссылки
<a href="https://eas.patents.su/18-15107-serosoderzhashhie-proizvodnye-pirazola-v-kachestve-izbiratelnyh-antagonistov-receptora-kannabinoidov-sv1.html" rel="bookmark" title="База патентов Евразийского Союза">Серосодержащие производные пиразола в качестве избирательных антагонистов рецептора каннабиноидов св1</a>
Предыдущий патент: Ингибиторы 11-бета-гидроксистероид дегидрогеназы 1
Следующий патент: Способ получения твердой фармацевтической композиции, содержащей валсартан
Случайный патент: Бумажный рулон с центральным отверстием и упрочненным элементом и способ изготовления такого рулона